Дуаклир Дженуэйр — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-003844
Торговое наименование:
Дуаклир Дженуэйр
Группировочное наименование:
аклидиния бромид + формотерол
Лекарственная форма:
порошок для ингаляций дозированный
СОСТАВ
Одна отмеренная доза содержит:
Активныевещества: аклидиния бромид микронизированный (в расчете на аклидиний) 0,400 мг (0,343 мг)* и формотерола фумарата дигидрат микронизированный 0,012 мг**.
Вспомогательное вещество: лактозы моногидрат 11,588 мг.
* доставленная доза аклидиния бромида – 396 мкг, что соответствует 340 мкг аклидиния.
** доставленная доза формотерола фумарата дигидрата – 11,8 мкг.
Описание
Ингалятор: Ингалятор белого цвета с оранжевым защитным колпачком, с оранжевой дозирующей кнопкой и закрепленной сдвигающейся крышкой с картриджем, содержащим 60 доз препарата и счетчиком доз.
Содержимое картриджа: Белый или почти белый мелкодисперсный, легкосыпучий порошок, не содержащий видимых конгломератов или посторонних частиц.
Фармакотерапевтическая группа:
бронходилатирующее средство комбинированное (β2-адреномиметик селективный+м-холиноблокатор)
Код АТХ: R03AL05
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
Механизм действия
Препарат Дуаклир Дженуэйр содержит два бронходилататора: аклидиний, антагонист мускариновых рецепторов длительного действия (также называемый антихолинергик), и формотерол, длительно действующий агонист β2-адренергических рецепторов. Комбинация этих веществ с разными механизмами действия обеспечивает аддитивный эффект по сравнению с применением отдельных компонентов. Вследствие различия плотности мускариновых и β2-адренорецепторов в центральных и периферических дыхательных путях, антагонисты мускариновых рецепторов более эффективны в расслаблении центральных дыхательных путей, а агонисты β2-адренергических рецепторов – периферических дыхательных путей; таким образом, применение комбинированной терапии может усиливать благоприятное воздействие на функцию легких.
Аклидиний является конкурентным, селективным антагонистом мускариновых рецепторов с более длительным временем связывания с M3-рецепторами, чем с M2-рецепторами. M3-рецепторы служат посредниками при сокращении гладкой мускулатуры дыхательных путей. Вдыхаемый аклидиния бромид действует местно
в легких в качестве антагониста M3-рецепторов гладкой мускулатуры дыхательных путей и вызывает бронходилатацию. Применение аклидиния у пациентов с хронической обструктивной болезнью легких (ХОБЛ) вызывает также снижение выраженности симптомов, улучшение связанного с заболеванием состояния
здоровья, снижение частоты обострений и улучшение переносимости физической нагрузки. Поскольку аклидиния бромид быстро разрушается в плазме крови, количество системных антихолинергических побочных эффектов является низким.
Формотерол является мощным селективным агонистом β2-адренорецепторов.
Бронходилатация достигается за счет расслабления гладкой мускулатуры дыхательных путей вследствие повышения уровня циклического аденозинмонофосфата после активации аденилатциклазы. Помимо улучшения функции легких, формотерол уменьшает выраженность симптомов и повышает качество жизни у пациентов с ХОБЛ.
Фармакодинамика
Клинические исследования показали, что препарат Дуаклир Дженуэйр обеспечивает клинически значимое улучшение функции легких (оцениваемое по объему форсированного выдоха за 1 секунду (ОФВ1)) в течение более 12 часов после приема.
Препарат Дуаклир Дженуэйр обладает быстрым началом действия – в течение 5 минут после первой ингаляции по сравнению с плацебо. Начало действия препарата Дуаклир Дженуэйр было сравнимо с эффектом быстродействующего агониста β2-адренорецепторов, формотерола, в дозе 12 мкг. Максимальная бронходилатация (максимальный ОФВ1) по сравнению с исходным уровнем достигалась с первого дня (304 мл) и поддерживалась в течение всего периода терапии длительностью более 6 месяцев (326 мл).
Электрофизиология сердца
Не было выявлено клинически значимого влияния препарата Дуаклир Дженуэйр на параметры электрокардиограммы (ЭКГ), включая интервал QT, по сравнению с аклидинием, формотеролом и плацебо, а также на сердечный ритм при проведении суточного мониторирования по Холтеру.
Клиническая эффективность
Программа клинических исследований III фазы с участием приблизительно 4000 пациентов с клиническим диагнозом ХОБЛ средней или тяжелой степени включала два 6-месячных рандомизированных исследования с плацебо и активным контролем (ACLIFORM-COPD и AUGMENT), 6-месячную продленную фазу исследования AUGMENT, а также дополнительное 12-месячное рандомизированное, контролируемое исследование.
В долгосрочных исследованиях безопасности препарат Дуаклир Дженуэйр показал стойкую эффективность при длительности применения более 1 года, без признаков тахифилаксии.
Влияние на функцию легких
Препарат Дуаклир Дженуэйр (340 мкг + 11,8 мкг/доза 2 раза в сутки) обеспечивал клинически значимое улучшение функции легких (оцениваемое по ОФВ1, форсированной жизненной емкости легких и емкости вдоха) по сравнению с плацебо. Клинически значимый бронходилатирующий эффект достигался в течение 5 минут после приема первой дозы препарата и поддерживался в течение всего междозового интервала.
В исследовании ACLIFORM-COPD препарат Дуаклир Дженуэйр обеспечивал улучшение ОФВ1 через 1 час после приема дозы по сравнению с плацебо и аклидинием, на 299 мл и 125 мл, соответственно (p<0,0001 в обоих сравнениях), и улучшение остаточного ОФВ1 по сравнению с плацебо и формотеролом, на 143 мл и 85 мл, соответственно (p<0,0001 в обоих сравнениях). В исследовании AUGMENT улучшение ОФВ1 через 1 час после приема дозы по сравнению с плацебо и аклидинием, составило 284 мл и 108 мл, соответственно (p<0,0001 в обоих сравнениях), а улучшение остаточного ОФВ1 по сравнению с плацебо и формотеролом составило 130 мл (p<0,0001) и 45 мл (p=0,01), соответственно.
Облегчениесимптомовиулучшениесостоянияздоровья, обусловленного заболеванием
Одышка и другие симптомы
Препарат Дуаклир Дженуэйр обеспечивал клинически значимое улучшение в отношении одышки (оценивалось с помощью транзиторного индекса одышки (TDI)), с повышением индекса TDI через 6 месяцев терапии по сравнению с плацебо на 1,29 единиц в исследовании ACLIFORM-COPD (p<0,0001) и на 1,44 единицы – в исследовании AUGMENT (p<0,0001).
Объединенный анализ этих двух исследований показал, что применение препарата Дуаклир Дженуэйр ассоциируется со статистически значимым большим улучшением индекса TDI по сравнению с аклидинием (на 0,4 единицы; p=0,016) или формотеролом (на 0,5 единиц; p=0,009).
Препарат Дуаклир Дженуэйр улучшал дневную симптоматику ХОБЛ, в частности одышку, симптомы со стороны грудной клетки, кашель и отделение мокроты (оценивалась с помощью общего индекса E-RS), а также общую выраженность ночных симптомов, ранних утренних симптомов и симптомов, ограничивающих активность в ранние утренние часы, по сравнению с плацебо, аклидинием и формотеролом, однако данное улучшение не всегда было статистически значимым. Комбинация аклидиния/формотерола не показала статистически значимого снижения среднего количества ночных пробуждений, обусловленных ХОБЛ, по сравнению с плацебо или формотеролом.
Качество жизни, обусловленное состоянием здоровья В исследовании AUGMENT препарат Дуаклир Дженуэйр обеспечивал статистически значимое улучшение состояния здоровья, обусловленного заболеванием (оценивалось с помощью Респираторного опросника больницы Святого Георгия (SGRQ)), с улучшением общего индекса SGRQ на -4,35 единицы по сравнению с плацебо (p<0,0001). В исследовании ACLIFORM-COPD наблюдалось лишь небольшое снижение общего индекса SGRQ по сравнению с плацебо вследствие неожиданно выраженного ответа на терапию плацебо (p=0,598), и процент пациентов, достигших клинически значимого улучшения относительно исходного уровня, составил 55,3% в группе препарата Дуаклир Дженуэйр и 53,2% – в группе плацебо (p=0,669).
Объединенный анализ данных этих двух исследований показал большее улучшение общего индекса SGRQ при применении препарата ДуаклирДженуэйр по сравнению с формотеролом (-1,7 единиц; p=0,018) или аклидинием (-0,79 единиц; p=0,273).
Снижение частоты обострений ХОБЛ
В рамках объединенного анализа эффективности двух исследований длительностью 6 месяцев было продемонстрировано статистически значимое снижение на 29% частоты обострений средней или тяжелой степени (требующих терапии антибиотиками или кортикостероидами, или приводящих к госпитализации) на фоне терапии препаратом Дуаклир Дженуэйр по сравнению с плацебо (частота на пациента в год: 0,29 против 0,42, соответственно; p=0,036), а также увеличение времени до первого обострения средней или тяжелой степени по сравнению с плацебо (соотношение рисков 0,70; p=0,027).
Применение препаратов экстренной терапии
Препарат Дуаклир Дженуэйр снижал потребность в препарате экстренной терапии на протяжении более 6 месяцев по сравнению с плацебо (на 0,9 ингаляций/сутки (p<0,0001)), аклидинием (на 0,4 ингаляции/сутки (p<0,001)) и формотеролом (на 0,2 ингаляции/сутки (p=0,062)).
Фармакокинетика
Параметры фармакокинетики аклидиния и формотерола при ингаляционном применении в комбинации существенно не отличались от наблюдаемых при применении отдельных компонентов. Абсорбция
После однократной ингаляции препарата Дуаклир Дженуэйр, аклидиний и формотерол быстро абсорбировались в плазму крови с достижением максимальной концентрации в течение 5 минут после ингаляции у здоровых добровольцев и в течение 24 минут после ингаляции у пациентов с ХОБЛ. Максимальные равновесные концентрации аклидиния и формотерола у пациентов с ХОБЛ, получавших препарат Дуаклир Дженуэйр 2 раза в сутки в течение 5 дней, достигались в течение 5 минут после ингаляции и составляли 128 пг/мл и 17 пг/мл, соответственно.
Распределение
Общее количество попадающего в легкие через ингалятор Дженуэйр аклидиния составило приблизительно 30% отмеренной дозы. Связывание аклидиния с белками плазмы in vitro вероятнее всего соответствует связыванию метаболитов с белками, вследствие быстрого гидролиза аклидиния в плазме крови. Связывание с белками плазмы крови составило 87% для метаболита карбоновой кислоты и 15% для спиртового метаболита. Основным белком плазмы крови, который связывает аклидиний, является альбумин.
Связывание формотерола с белками плазмы крови составляет 61% — 64% (34% – преимущественно с альбумином). Не отмечено насыщения центров связывания в диапазоне концентраций, достигающихся при применении препарата в терапевтических дозах.
Биотрансформация
Аклидиний быстро и интенсивно гидролизуется до фармакологически неактивных спиртового производного и производного карбоновой кислоты. Происходит химический (неферментативный) и ферментативный гидролиз под действием эстераз. Основной эстеразой, вовлеченной в гидролиз у человека, является бутирилхолинэстераза. Концентрация кислотного метаболита в плазме крови после ингаляции приблизительно в 100 раз выше, чем концентрация спиртового метаболита и неизмененного активного вещества.
Низкая абсолютная биодоступность аклидиния при ингаляционном введении (<5%) обусловлена его интенсивным системным и пресистемным гидролизом как при нахождении в легких, так и при приеме внутрь. Биотрансформация с участием изоферментов цитохрома P450 (CYP450) играет незначительную роль в общем метаболическом клиренсе аклидиния. Исследования invitroпоказали, что аклидиний в терапевтической дозе или его метаболиты не ингибируют или не индуцируют какие-либо изоферменты CYP450 и не ингибируют эстеразы (карбоксилэстеразу, ацетилхолинэстеразу и бутирилхолинэстеразу). Также in vitro установлено, что аклидиний или его метаболиты не являются субстратами или ингибиторами P-гликопротеина.
Формотерол выводится преимущественно посредством метаболизма. Основным путем является прямая глюкуронизация с O-деметилированием с последующей конъюгацией с глюкуронидом. В O-деметилировании формотерола участвуют изоферменты CYP2D6, CYP2C19, CYP2C9 и CYP2A6. В терапевтически значимых концентрациях формотерол не ингибирует изоферменты CYP450.
Выведение
После ингаляции препарата Дуаклир Дженуэйр 340 мкг + 11,8 мкг/доза конечный период полувыведения аклидиния и формотерола составляет приблизительно 5 ч и 8 ч, соответственно.
После внутривенного введения 400 мкг меченого радиоактивным изотопом аклидиния здоровым добровольцам около 1% введенной дозы выводилось в неизмененном виде с мочой. До 65% дозы препарата выводилось в виде метаболитов с мочой и до 33% – в виде метаболитов с фекалиями. После ингаляции 200 мкг и 400 мкг аклидиния здоровыми добровольцами и пациентами с ХОБЛ выведение неизмененного аклидиния с мочой было очень низким (приблизительно 0,1% введенной дозы), что свидетельствует о том, что почечный клиренс играет незначительную роль в общем клиренсе аклидиния из плазмы крови.
Основная часть введенной дозы формотерола подвергалась метаболизму в печени с последующим выведением почками. После ингаляции 6% — 9% доставленной дозы формотерола выводится с мочой в неизмененном виде или в виде конъюгатов формотерола.
Особые популяции пациентов
Пожилые пациенты
Исследования фармакокинетики комбинации аклидиния/формотерола у пациентов пожилого возраста не проводились. Поскольку пожилым пациентам не требуется коррекции дозы препаратов аклидиния или формотерола, при применении комбинации аклидиния/формотерола корректировать дозу также не требуется.
Пациенты с нарушением функции почек и печени
Данные об особенностях применения комбинации аклидиния/формотерола у пациентов с нарушением функции почек или печени отсутствуют. Поскольку у пациентов с нарушением функции почек или печени не требуется коррекции дозы препаратов аклидиния или формотерола, при применении комбинации аклидиния/формотерола корректировать дозу также не требуется.
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
Препарат Дуаклир Дженуэйр показан в качестве поддерживающей бронходилатирующей терапии с целью облегчения симптомов хронической обструктивной болезни легких у взрослых.
ПРОТИВОПОКАЗАНИЯ
- Повышенная чувствительность к аклидиния бромиду, формотеролу или лактозе.
- Детский возраст до 18 лет (эффективность и безопасность не установлены).
- Непереносимость галактозы, дефицит лактазы или глюкозо-галактозная мальабсорбция.
С ОСТОРОЖНОСТЬЮ
Инфаркт миокарда, перенесенный в течение предшествующих 6 месяцев,
нестабильная стенокардия, впервые выявленная аритмия в течение предшествующих 3 месяцев, госпитализация в течение предшествующих 12 месяцев по поводу сердечной недостаточности III и IV функциональных классов по классификации NYHA или другие тяжелые сердечно-сосудистые заболевания, интервал QTc (по методу Базетта) > 470 мс, сопутствующая терапия лекарственными препаратами, удлиняющими интервал QTc, судорожные расстройства, тиреотоксикоз, феохромоцитома, симптоматическая гиперплазия предстательной железы, задержка мочи, закрытоугольная глаукома, гипокалиемия.
ПРИМЕНЕНИЕ В ПЕРИОД БЕРЕМЕННОСТИ И ГРУДНОГО ВСКАРМЛИВАНИЯ
Беременность
Данные о применении препарата Дуаклир Дженуэйр у беременных женщин отсутствуют.
В исследованиях на животных отмечена фетотоксичность только в дозах, значительно превышающих максимальную дозу аклидиния у человека, и нежелательные эффекты в исследованиях репродуктивной токсичности только при очень высокой системной экспозиции формотерола.
Во время беременности препарат Дуаклир Дженуэйр следует применять только в тех случаях, когда ожидаемая польза превосходит потенциальные риски.
Период грудного вскармливания
Неизвестно, выделяется ли аклидиний (и/или его метаболиты) или формотерол с грудным молоком. Поскольку доклинические исследования показали, что небольшие количества аклидиния (и/или его метаболиты) и формотерола проникают в молоко, в период грудного вскармливания препарат Дуаклир Дженуэйр следует применять только в случаях, когда ожидаемая польза для женщины превосходит потенциальный риск для младенца.
Фертильность
Доклинические исследования выявили небольшое снижение фертильности только при применении в дозах, значительно превышающих максимальные дозы аклидиния и формотерола у человека. Считается маловероятным, что применение препарата Дуаклир Дженуэйр в рекомендуемой дозе будет влиять на фертильность у человека.
СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ
Для ингаляционного применения.
Рекомендуемая доза – одна ингаляция препарата Дуаклир Дженуэйр 340 мкг + 11,8 мкг/доза 2 раза в сутки.
В случае пропуска приема дозы пропущенную дозу необходимо принять как можно скорее, а следующую дозу принять в обычное время. Не следует принимать двойную дозу с целью компенсации пропущенной.
Пожилые пациенты
Коррекции дозы препарата у пожилых пациентов не требуется (см. раздел «Фармакокинетика»).
Нарушение функции почек
Коррекции дозы препарата у пациентов с нарушением функции почек не требуется (см. раздел «Фармакокинетика»).
Нарушение функции печени
Коррекции дозы препарата у пациентов с нарушением функции печени не требуется (см. раздел «Фармакокинетика»).
Дети
Препарат Дуаклир Дженуэйр не предназначен для применения у детей и подростков младше 18 лет при ХОБЛ.
Способ применения
Пациенты должны быть обучены принципам правильного применения препарата.
Инструкция для правильного применения препарата Дуаклир Дженуэйр
Перед первым применением вскройте запечатанный пакет по линии стрелок, извлеките ингалятор Дженуэйр и ознакомьтесь с его составными частями. Пакет и пакетик-саше с десикантом подлежат утилизации.
Защитный колпачок -Индикатор доз — Оранжевая кнопка — Окно цветового контроля — Мундштук

Перед применением ингалятора Дженуэйр внимательно прочитайте инструкцию.
Как использовать Дуаклир Дженуэйр Общие сведения
Для использования ингалятора Дженуэйр после снятия колпачка Вам необходимо сделать 2 шага:
Шаг 1: Нажать и ОТПУСТИТЬ оранжевую кнопку и полностью выдохнуть, но не в ингалятор.
Шаг 2: Плотно обхватить губами мундштук и СИЛЬНО и ГЛУБОКО вдохнуть через ингалятор.
После ингаляции не забудьте надеть защитный колпачок.
Начало применения
•Когда Вы собираетесь принять дозу лекарственного препарата, снимите защитный колпачок, слегка сжав стрелки на каждой стороне и потянув колпачок наружу (см. рисунок 1).

РИСУНОК 1
• Убедитесь в том, что мундштук ничто не блокирует.
• Держите ингалятор Дженуэйр горизонтально мундштуком по направлению к Вам, с оранжевой кнопкой, обращенной прямо вверх (см. рисунок 2).
Держите ингалятор оранжевой кнопкой, обращенной прямо вверх. НЕ НАКЛОНЯЙТЕ ЕГО.
РИСУНОК 2
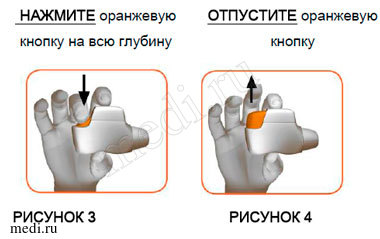
ШАГ 1: НАЖМИТЕ оранжевую кнопку на всю глубину и затем ОТПУСТИТЕ ее (см. рисунки 3 и 4).
НЕ УДЕРЖИВАЙТЕ ОРАНЖЕВУЮ КНОПКУ НАЖАТОЙ.
Остановитесь и проверьте: убедитесь, что доза готова для ингаляции
• Убедитесь, что окно цветового контроля стало зеленым (см. рисунок 5).
• Зеленый цвет окна контроля подтверждает, что лекарственный препарат готов для ингаляции.
Готов к применению
ЗЕЛЕНЫЙ
ЕСЛИ ОКНО ЦВЕТОВОГО КОНТРОЛЯ ОСТАЕТСЯ КРАСНЫМ, НАЖМИТЕ И ОТПУСТИТЕ ОРАНЖЕВУЮ КНОПКУ ЕЩЕ РАЗ (СМ. ШАГ 1).
•Перед тем, как поднести ингалятор ко рту, полностью выдохните. Не выдыхайте в ингалятор.
ШАГ 2:
•Плотно обхватите губами мундштук ингалятора Дженуэйр и СИЛЬНОи ГЛУБОКО вдохните через мундштук (см. рисунок 6).
— Такой сильный, глубокий вдох доставляет лекарственный препарат через ингалятор в легкие.
ВНИМАНИЕ! НЕ УДЕРЖИВАЙТЕ ОРАНЖЕВУЮ КНОПКУ НАЖАТОЙ ВО ВРЕМЯ ИНГАЛЯЦИИ.
ПРАВИЛЬНО / НЕПРАВИЛЬНО

РИСУНОК 6
•Во время вдоха Вы услышите «ЩЕЛЧОК», указывающий на правильное применение ингалятора Дженуэйр.
•Для того, чтобы принять всю дозу, продолжайте вдыхать даже после того, как
услышали «ЩЕЛЧОК» ингалятора.
•Выньте ингалятор Дженуэйр изо рта и задержите дыхание так долго, чтобы было комфортно, затем медленно выдохните через нос.
Примечание. Некоторые пациенты, в зависимости от индивидуальных особенностей, могут ощущать легкий сладковатый или горьковатый вкус при ингаляции препарата. Не принимайте дополнительную дозу, если Вы не почувствовали никакого вкуса после ингаляции.
Остановитесь и проверьте: убедитесь, что Вы правильно провели ингаляцию
•Убедитесь, что окно контроля стало красным (см. рисунок 7). Это подтверждает
то, что Вы правильно провели ингаляцию полной дозы.
Ингаляция проведена правильно
КРАСНЫЙ

РИСУНОК 7
ЕСЛИ ОКНО ЦВЕТОВОГО КОНТРОЛЯ ОСТАЕТСЯ ЗЕЛЕНЫМ, НЕОБХОДИМО ВНОВЬ СИЛЬНО И ГЛУБОКО ВДОХНУТЬ ЧЕРЕЗ МУНДШТУК (СМ. ШАГ 2).
•Если окно контроля все еще не изменяет цвет на красный, то возможно, Вы
забыли отпустить оранжевую кнопку перед ингаляцией или могли неправильно вдохнуть. Если это так, попробуйте вновь.
Убедитесь, что Вы ОТПУСТИЛИ оранжевую кнопку, исделайте СИЛЬНЫЙ глубокий вдох через мундштук.
Примечание. Если после нескольких попыток Вам так и не удалось правильно провести ингаляцию, обратитесь к лечащему врачу.
•Как только окно контроля стало красным, наденьте защитный колпачок на мундштук (см. рисунок 8).
РИСУНОК 8
Когда Вам необходим новый ингалятор Дженуэйр?
• Ингалятор Дженуэйр оборудован индикатором доз, показывающим, сколько примерно доз осталось в ингаляторе. Индикатор доз медленно опускается, отражая интервалы по 10 (60, 50, 40, 30, 20, 10, 0) (см. рисунок A). Каждый ингалятор Дженуэйр содержит по меньшей мере 60 доз препарата.
Когда на индикаторе доз появится лента с красными полосками (см. рисунок А), это означает, что препарат заканчивается и необходимо приобрести новый ингалятор Дженуэйр.
Индикатор доз снижается с интервалами по 10: 60, 50, 40, 30, 20, 10, 0.
Индикатор доз
Лента с красными полосками

РИСУНОК А
Примечание. Если Ваш ингалятор Дженуэйр окажется поврежден или потерян колпачок, необходимо заменить ингалятор. Ингалятор Дженуэйр чистить НЕ НУЖНО. Однако, в случае необходимости, это надо делать с помощью сухой ткани или бумажной салфетки снаружи мундштука.
НИКОГДА не используйте воду для чистки ингалятора Дженуэйр, поскольку это может повредить лекарственный препарат.
Как узнать, что Ваш ингалятор Дженуэйр пуст?
• Когда в середине индикатора доз появится цифра 0 (ноль), необходимо продолжить применение всех остающихся в ингаляторе Дженуэйр доз.
• Когда для ингаляции будет подготовлена последняя доза, оранжевая кнопка не вернется полностью в свое верхнее положение, а останется заблокирована в среднем положении (см. рисунок B).
Заблокирована
Даже когда оранжевая кнопка заблокирована, Вы, тем не менее, сможете принять последнюю дозу. После этого ингалятор Дженуэйр не может быть использован вновь, и Вам необходимо будет начать использовать новый ингалятор Дженуэйр.
ПОБОЧНОЕ ДЕЙСТВИЕ
Представленные ниже сведения по безопасности основаны на опыте применения препарата Дуаклир Дженуэйр (в рекомендуемой терапевтической дозе до 12 месяцев) и его отдельных компонентов.
Обзор профиля безопасности
Нежелательные реакции, связанные с применением препарата Дуаклир Дженуэйр, схожи с наблюдавшимися при применении его отдельных компонентов. Поскольку препарат Дуаклир Дженуэйр содержит аклидиний и формотерол, то на фоне его применения можно ожидать нежелательные реакции, описанные для этих компонентов.
Наиболее часто отмечавшимися нежелательными реакциями при применении препарата Дуаклир Дженуэйр являлись назофарингит (7,9%) и головная боль (6,8%).
Список нежелательных реакций в виде таблицы
Частота нежелательных реакций основана на оценке общих коэффициентов возникновения реакций, наблюдаемых при применении препарата Дуаклир
Дженуэйр 340 мкг + 11,8 мкг/доза в рамках объединенного анализа рандомизированных, плацебо-контролируемых клинических исследований III фазы длительностью не менее 6 месяцев.
Частота нежелательных реакций представлена с использованием следующих обозначений: очень часто (≥ 1/10); часто (≥ 1/100 до < 1/10); нечасто (≥ 1/1000 до < 1/100); редко (≥ 1/10000 до < 1/1000); очень редко (< 1/10000) и неуточненной частоты (невозможно оценить по доступным данным).
1 Нежелательные реакции, наблюдавшиеся при применении препарата Дуаклир
Дженуэйр, но не указанные в инструкциях на его отдель
ные компоненты.
2 Нежелательные реакции, наблюдавшиеся при применении препарата Дуаклир
Дженуэйр, и указанные в инструкции хотя бы одного из его отдельных компонентов.
3 Нежелательные реакции, указанные в инструкции хотя бы одного из отдельных
компонентов, но при применении препарата Дуаклир Дженуэйр 340 мкг + 11,8
мкг/доза наблюдавшиеся с более низкой или сопоставимой частотой, чем при
применении плацебо.
4 Нежелательные реакции, указанные в инструкции хотя бы одного из отдельных
компонентов, но не наблюдавшиеся при применении препарата Дуаклир Дженуэйр
340 мкг + 11,8 мкг/доза; категория частоты развития указана в соответствии с
разделом «Побочное действие» инструкции на отдельные компоненты.
ПЕРЕДОЗИРОВКА
Опыт лечения передозировки препарата Дуаклир Дженуэйр ограничен. Высокие дозы препарата Дуаклир Дженуэйр могут приводить к усилению симптомов и проявлений антихолинергического и/или β2-адренергического действия; наиболее частыми из которых являются: нечеткость зрения, сухость во рту, тошнота, мышечный спазм, тремор, головная боль, ощущение сердцебиения и артериальная гипертензия.
В случае передозировки следует прекратить применение препарата Дуаклир Дженуэйр. Показана поддерживающая и симптоматическая терапия.
ВЗАИМОДЕЙСТВИЕ С ДРУГИМИ ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ И ДРУГИЕ ВИДЫ ЛЕКАРСТВЕННОГО ВЗАИМОДЕЙСТВИЯ
Лекарственные средства для лечения ХОБЛ
Совместное применение препарата Дуаклир Дженуэйр с другими антихолинергическими средствами и/или агонистами β2-адренергических рецепторов длительного действия не изучалось и не рекомендуется.
Хотя формальных исследований лекарственных взаимодействий препарата Дуаклир Дженуэйр in vivo не проводилось, он применялся одновременно с другими лекарственными средствами для терапии ХОБЛ, включая агонисты β2-адренергических рецепторов короткого действия, метилксантины, а также пероральные и ингаляционные глюкокортикостероиды, без клинических признаков лекарственного взаимодействия.
Метаболические взаимодействия
В исследованиях in vitro было установлено, что не ожидается взаимодействия аклидиния в терапевтической дозе или его метаболитов с субстратами P-гликопротеина (P-gp) и лекарственными средствами, метаболизируемыми изоферментами цитохрома P450 (CYP450), и эстеразами. В терапевтически значимых концентрациях формотерол не ингибирует изоферменты CYP450 (см. раздел «Фармакокинетика»).
Препараты, вызывающие гипокалиемию
Сопутствующее применение производных метилксантина, стероидов или калийнесберегающих диуретиков, может усиливать возможный гипокалиемический эффект агонистов β2-адренорецепторов, поэтому следует соблюдать осторожность при совместном применении с этими препаратами (см. раздел «Особые указания»).
Блокаторы β-адренергических рецепторов
Блокаторы β-адренергических рецепторов могут ослаблять или нивелировать эффект агонистов β2-адренергических рецепторов. При необходимости применения блокаторов β-адренергических рецепторов (в том числе в виде глазных капель) предпочтительнее назначение кардиоселективных блокаторов β-адренергических рецепторов, хотя и они должны применяться с осторожностью.
Другие фармакодинамические взаимодействия
Следует с осторожностью применять препарат Дуаклир Дженуэйр у пациентов, получающих лекарственные препараты, удлиняющие интервал QTc, такие как ингибиторы моноаминоксидазы, трициклические антидепрессанты, антигистаминные средства или макролиды, поскольку они могут потенцировать влияние формотерола на сердечно-сосудистую систему. Лекарственные препараты, удлиняющие интервал QTc, повышают риск развития желудочковой аритмии.
ОСОБЫЕ УКАЗАНИЯ
Бронхиальная астма
Препарат Дуаклир Дженуэйр не должен применяться при бронхиальной астме; клинические исследования препарата Дуаклир Дженуэйр при бронхиальной астме не проводились.
Парадоксальный бронхоспазм
В клинических исследованиях не отмечены случаи парадоксального бронхоспазма на фоне применения препарата Дуаклир Дженуэйр в рекомендуемой дозе. Однако парадоксальный бронхоспазм наблюдали при проведении другой ингаляционной терапии. В случае его возникновения следует прекратить применение лекарственного препарата и рассмотреть возможность альтернативной терапии.
Препарат не предназначен для купирования острых приступов
Препарат Дуаклир Дженуэйр не показан для лечения острых приступов бронхоспазма.
Влияние на сердечно-сосудистую систему
Препарат Дуаклир Дженуэйр следует применять с осторожностью у пациентов, перенесших инфаркт миокарда в течение предшествующих 6 месяцев, у пациентов с нестабильной стенокардией, впервые выявленной аритмией в течение предшествующих 3 месяцев, с интервалом QTc (рассчитанного по методу Базетта) > 470 мс или госпитализировавшихся в течение предшествующих 12 месяцев по поводу сердечной недостаточности III и IV функциональных классов по классификации NYHA, поскольку эти пациенты не включались в клинические исследования.
У отдельных пациентов агонисты β2-адренорецепторов могут вызывать повышение частоты пульса и артериального давления, изменения на ЭКГ в виде уплощения зубца Т, депрессии сегмента ST и удлинения интервала QTc. В случае развития данных эффектов может потребоваться досрочное прекращение терапии. Агонисты β2-адренорецепторов длительного действия следует применять с осторожностью у пациентов с удлинением интервала QTc в настоящее время или в анамнезе, либо получающих лекарственные препараты, влияющие на длительность интервала QTc (см. раздел «Взаимодействие с другими лекарственными средствами и другие виды лекарственного взаимодействия»).
Системные эффекты
Препарат Дуаклир Дженуэйр следует применять с осторожностью у пациентов с тяжелыми нарушениями со стороны сердечно-сосудистой системы, судорожными расстройствами, тиреотоксикозом и феохромоцитомой.
При применении высоких доз агонистов β2-адренорецепторов возможно развитие метаболических эффектов в виде гипергликемии и гипокалиемии. В клинических исследованиях III фазы частота значимого повышения концентрации глюкозы в крови на фоне применения препарата Дуаклир Дженуэйр была низкой (0,1%) и схожей с группой плацебо. Гипокалиемия обычно транзиторная и не требует дополнительной терапии. У пациентов с тяжелой ХОБЛ гипокалиемия может потенцироваться гипоксией и сопутствующей терапией (см. раздел
«Взаимодействие с другими лекарственными средствами и другие виды лекарственного взаимодействия»). Гипокалиемия может увеличить риск развития аритмии.
Вследствие антихолинергической активности препарат Дуаклир Дженуэйр следует применять с осторожностью при симптоматической гиперплазии предстательной железы, задержке мочи или закрытоугольной глаукоме (несмотря на то, что непосредственный контакт препарата с глазами очень маловероятен). Сухость во рту, отмечавшаяся на фоне антихолинергической терапии, при сохранении в течение длительного времени может привести к кариесу зубов.
ВЛИЯНИЕ НА СПОСОБНОСТЬ УПРАВЛЯТЬ ТРАНСПОРТНЫМИ СРЕДСТВАМИ И ДРУГИМИ МЕХАНИЗМАМИ
Препарат Дуаклир Дженуэйр не влияет или в незначительной степени влияет на способность управлять транспортом и механизмами. Развитие нечеткости зрения или головокружения может оказать влияние на способность к управлению транспортными средствами или работе с механизмами.
ФОРМА ВЫПУСКА
Порошок для ингаляций дозированный, 340 мкг + 11,8 мкг/доза. По 60 доз порошка для ингаляций в ингалятор.
По 1 ингалятору в пакет из ламинированной алюминиевой фольги, содержащий пакетик-саше с десикантом. По 1 пакету с инструкцией по применению в картонную пачку с контролем первого вскрытия.
УСЛОВИЯ ХРАНЕНИЯ
При температуре не выше 30 °С. Хранить в недоступном для детей месте.
СРОК ГОДНОСТИ
2 года.
После первого вскрытия пакета – 60 дней.
Не применять по истечении срока годности, указанного на упаковке.
УСЛОВИЯ ОТПУСКА ИЗ АПТЕК
По рецепту.
НАИМЕНОВАНИЕ И АДРЕС ЮРИДИЧЕСКОГО ЛИЦА, НА ИМЯ КОТОРОГО ВЫДАНО РЕГИСТРАЦИОННОЕ УДОСТОВЕРЕНИЕ
АстраЗенека ЮК Лимитед, Великобритания
2 Кингдом Стрит, Лондон W2 6BD, Великобритания
AstraZeneca UK Limited, United Kingdom
2 Kingdom Street, London W2 6BD, United Kingdom
ПРОИЗВОДИТЕЛЬ,ФАСОВЩИК (ПЕРВИЧНАЯУПАКОВКА),УПАКОВЩИК (ВТОРИЧНАЯ (ПОТРЕБИТЕЛЬСКАЯ) УПАКОВКА), ВЫПУСКАЮЩИЙ КОНТРОЛЬ КАЧЕСТВА
Индустриас Фармасеутикас Альмиралль С.А., Испания
Ктра. Насьональ II, км 593
08740 Сант Андреу де ла Барка, Барселона, Испания
Industrias Farmaceuticas Almirall SA
Ctra. Nacional II, km 593
08740 Sant Andreu de la Barca, Barcelona, Spain
Дополнительная информация предоставляется по требованию:
Представительство АстраЗенека ЮК Лимитед, Великобритания, в г. Москве и ООО АстраЗенека Фармасьютикалз 125284 Москва, ул. Беговая д. 3, стр. 1
Купить Дуаклир Дженуэйр в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Фармакологическое действие
Механизм действия
Препарат содержит два бронходилататора: аклидиния бромид, антагонист мускариновых рецепторов длительного действия, и формотерол, длительно действующий агонист β2-адренорецепторов. Комбинация этих веществ с разными механизмами действия обеспечивает аддитивный эффект по сравнению с применением отдельных компонентов. Вследствие различия плотности мускариновых и β2-адренорецепторов в центральных и периферических дыхательных путях антагонисты мускариновых рецепторов более эффективны в расслаблении центральных дыхательных путей, а агонисты β2-адренорецепторов — периферических дыхательных путей; таким образом, применение комбинированной терапии может усиливать благоприятное воздействие на функцию легких.
Аклидиния бромид является конкурентным, селективным антагонистом мускариновых рецепторов с более длительным временем связывания с М3-рецепторами, чем с М2-рецепторами. М3-рецепторы служат посредниками при сокращении гладкой мускулатуры дыхательных путей. Вдыхаемый аклидиния бромид действует местно в легких в качестве антагониста М3-рецепторов гладкой мускулатуры дыхательных путей и вызывает бронходилатацию. Применение аклидиния бромида у пациентов с ХОБЛ вызывает также снижение выраженности симптомов, улучшение связанного с заболеванием состояния здоровья, снижение частоты обострений и улучшение переносимости физической нагрузки. Поскольку аклидиния бромид быстро разрушается в плазме крови, количество системных антихолинергических побочных эффектов является низким.
Формотерол является мощным селективным агонистом β2-адренорецепторов. Бронходилатация достигается за счет расслабления гладкой мускулатуры дыхательных путей вследствие повышения уровня циклического аденозинмонофосфата после активации аденилатциклазы. Помимо улучшения функции легких формотерол уменьшает выраженность симптомов и повышает качество жизни у пациентов с ХОБЛ.
Фармакодинамика
Клинические исследования показали, что препарат обеспечивает клинически значимое улучшение функции легких (оцениваемое по объему форсированного выдоха за 1 секунду (OФВ1)) в течение более 12 ч после приема.
Препарат обладает быстрым началом действия — в течение 5 мин после первой ингаляции по сравнению с плацебо. Начало действия препарата было сравнимо с эффектом быстродействующего агониста β2-адренорецепторов, формотерола, в дозе 12 мкг. Максимальная бронходилатация (максимальный ОФВ1) по сравнению с исходным уровнем достигалась с первого дня (304 мл) и поддерживалась в течение всего периода терапии длительностью более 6 месяцев (326 мл).
Электрофизиология сердца
Не было выявлено клинически значимого влияния препарата на параметры ЭКГ, включая интервал QT, по сравнению с аклидинием, формотеролом и плацебо, а также на сердечный ритм при проведении суточного мониторирования по Холтеру.
Клиническая эффективность
Программа клинических исследований III фазы с участием приблизительно 4000 пациентов с клиническим диагнозом ХОБЛ средней или тяжелой степени включала два 6-месячных рандомизированных исследования с плацебо и активным контролем (ACLIFORM-COPD и AUGMENT), 6-месячную продленную фазу исследования AUGMENT, а также дополнительное 12-месячное рандомизированное, контролируемое исследование.
В долгосрочных исследованиях безопасности препарат показал стойкую эффективность при длительности применения более 1 года, без признаков тахифилаксии.
Влияние на функцию легких
Препарат в дозе 340 мкг+11.8 мкг/доза 2 раза/сут обеспечивал клинически значимое улучшение функции легких (оцениваемое по ОФВ1, форсированной жизненной емкости легких и емкости вдоха) по сравнению с плацебо. Клинически значимый бронходилатирующий эффект достигался в течение 5 мин после приема первой дозы препарата и поддерживался в течение всего междозового интервала.
В исследовании ACLIFORM-COPD препарат обеспечивал улучшение OOB1 через 1 ч после приема дозы по сравнению с плацебо и аклидинием, на 299 мл и 125 мл, соответственно (р<0.0001 в обоих сравнениях), и улучшение остаточного ОФВ1 по сравнению с плацебо и формотеролом, на 143 мл и 85 мл. соответственно (р<0.0001 в обоих сравнениях). В исследовании AUGMENT улучшение ОФВ1 через 1 ч после приема дозы по сравнению с плацебо и аклидинием, составило 284 мл и 108 мл, соответственно (р<0.0001 в обоих сравнениях), а улучшение остаточного ОФВ1 по сравнению с плацебо и формотеролом составило 130 мл (р<0.0001) и 45 мл (р=0.01), соответственно.
Облегчение симптомов и улучшение состояния здоровья, обусловленного заболеванием
Одышка и другие симптомы. Препарат обеспечивал клинически значимое улучшение в отношении одышки (оценивалось с помощью транзиторного индекса одышки (TDI)), с повышением индекса TDI через 6 месяцев терапии по сравнению с плацебо на 1.29 единиц в исследовании ACLIFORM-COPD (р<0.0001) и на 1.44 единицы — в исследовании AUGMENT (р<0.0001).
Объединенный анализ этих двух исследований показал, что применение препарата ассоциируется со статистически значимым большим улучшением индекса TDI по сравнению с аклидинием (на 0.4 единицы; р=0,016) или формотеролом (на 0,5 единиц: р=0.009).
Препарат улучшал дневную симптоматику ХОБЛ, в частности одышку, симптомы со стороны грудной клетки, кашель и отделение мокроты (оценивалась с помощью общего индекса E-RS), а также общую выраженность ночных симптомов, ранних утренних симптомов и симптомов, ограничивающих активность в ранние утренние часы, по сравнению с плацебо, аклидинием и формотеролом, однако данное улучшение не всегда было статистически значимым. Комбинация аклидиния/формотерола не показала статистически значимого снижения среднего количества ночных пробуждений, обусловленных ХОБЛ, по сравнению с плацебо или формотеролом.
Качество жизни, обусловленное состоянием здоровья. В исследовании AUGMENT препарат обеспечивал статистически значимое улучшение состояния здоровья, обусловленного заболеванием (оценивалось с помощью Респираторного опросника больницы Святого Георгия (SGRQ)), с улучшением общего индекса SGRQ на -4.35 единицы по сравнению с плацебо (р<0.0001). В исследовании ACLIFORM-COPD наблюдалось лишь небольшое снижение общего индекса SGRQ по сравнению с плацебо вследствие неожиданно выраженного ответа на терапию плацебо (р=0.598), и процент пациентов, достигших клинически значимого улучшения относительно исходного уровня, составил 55.3% в группе комбинированного препарата и 53.2% — в группе плацебо (р=0.669).
Объединенный анализ данных этих двух исследований показал большее улучшение общего индекса SGRQ при применении препарата по сравнению с формотеролом (-1.7 единиц; р=0.018) или аклидинием (-0.79 единиц; р=0.273).
Снижение частоты обострении ХОБЛ
В рамках объединенного анализа эффективности двух исследований длительностью 6 месяцев было продемонстрировано статистически значимое снижение на 29% частоты обострений средней или тяжелой степени (требующих терапии антибиотиками или кортикостероидами, или приводящих к госпитализации) на фоне терапии препаратом по сравнению с плацебо (частота на пациента в год: 0.29 против 0.42, соответственно; р=0.036), а также увеличение времени до первого обострения средней или тяжелой степени по сравнению с плацебо (соотношение рисков 0.70; р=0.027).
Применение препаратов экстренной терапии
Препарат снижал потребность в препарате экстренной терапии на протяжении более 6 месяцев по сравнению с плацебо (на 0.9 ингаляций/сут (p<0.0001)), аклидинием (на 0.4 ингаляции/сут (р<0.001)) и формотеролом (на 0.2 ингаляции/сут (р=0.062)).
Фармакокинетика
Параметры фармакокинетики аклидиния и формотерола при ингаляционном применении в комбинации существенно не отличались от наблюдаемых при применении отдельных компонентов.
После однократной ингаляции препарата аклидиний и формотерол быстро абсорбировались в плазму крови с достижением Cmax в течение 5 мин после ингаляции у здоровых добровольцев и в течение 24 мин после ингаляции у пациентов с ХОБЛ. Cmax аклидиния и формотерола в равновесном состоянии у пациентов с ХОБЛ, получавших препарат 2 раза/сут в течение 5 дней, достигались в течение 5 мин после ингаляции и составляли 128 пг/мл и 17 пг/мл соответственно.
Общее количество попадающего в легкие через ингалятор аклидиния составило приблизительно 30% отмеренной дозы. Связывание аклидиния с белками плазмы in vitro вероятнее всего соответствует связыванию метаболитов с белками, вследствие быстрого гидролиза аклидиния в плазме крови. Связывание с белками плазмы крови составило 87% для метаболита карбоновой кислоты и 15% для спиртового метаболита. Основным белком плазмы крови, который связывает аклидиний, является альбумин.
Связывание формотерола с белками плазмы крови составляет 61-64% (34% — преимущественно с альбумином). Не отмечено насыщения центров связывания в диапазоне концентраций, достигающихся при применении препарата в терапевтических дозах.
Аклидиний быстро и интенсивно гидролизуется до фармакологически неактивных спиртового производного и производного карбоновой кислоты. Происходит химический (неферментативный) и ферментативный гидролиз под действием эстераз. Основной эстеразой, вовлеченной в гидролиз у человека, является бутирилхолинэстераза. Концентрация кислотного метаболита в плазме крови после ингаляции приблизительно в 100 раз выше, чем концентрация спиртового метаболита и неизмененного активного вещества.
Низкая абсолютная биодоступность аклидиния при ингаляционном введении (<5%) обусловлена его интенсивным системным и пресистемным гидролизом как при нахождении в легких, так и при приеме внутрь. Биотрансформация с участием изоферментов цитохрома Р450 (CYP450) играет незначительную роль в общем метаболическом клиренсе аклидиния. Исследования in vitro показали, что аклидиний в терапевтической дозе или его метаболиты не ингибируют или не индуцируют какие-либо изоферменты CYP450 и не ингибируют эстеразы (карбоксилэстеразу, ацетилхолинэстеразу и бутирилхолинэстеразу). Также in vitro установлено, что аклидиний или его метаболиты не являются субстратами или ингибиторами Р-гликопротеина.
Формотерол выводится преимущественно посредством метаболизма. Основным путем является прямая глюкуронизация с O-деметилированием с последующей конъюгацией с глюкуронидом. В O-деметилировании формотерола участвуют изоферменты CYP2D6, CYP2C19, CYP2C9 и CYP2A6. В терапевтически значимых концентрациях формотерол не ингибирует изоферменты CYP450.
После ингаляции препарата в дозе 340 мкг+11.8 мкг/доза конечный Т1/2 аклидиния и формотерола составляет приблизительно 5 ч и 8 ч соответственно. После в/в введения 400 мкг меченого радиоактивным изотопом аклидиния здоровым добровольцам около 1% введенной дозы выводилось в неизмененном виде с мочой. До 65% дозы препарата выводилось в виде метаболитов с мочой и до 33% — в виде метаболитов с фекалиями. После ингаляции 200 мкг и 400 мкг аклидиния здоровыми добровольцами и пациентами с ХОБЛ выведение неизмененного аклидиния с мочой было очень низким (приблизительно 0.1% введенной дозы), что свидетельствует о том, что почечный клиренс играет незначительную роль в общем клиренсе аклидиния из плазмы крови. Основная часть введенной дозы формотерола подвергалась метаболизму в печени с последующим выведением почками. После ингаляции 6-9% доставленной дозы формотерола выводится с мочой в неизмененном виде или в виде конъюгатов формотерола.
Показания активных веществ препарата
Дуаклир Дженуэйр
В качестве поддерживающей бронходилатирующей терапии с целью облегчения симптомов ХОБЛ у взрослых.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Для ингаляционного применения.
Рекомендуемая доза — 1 ингаляция препарата (340 мкг+11.8 мкг/доза) 2 раза/сут.
В случае пропуска приема дозы пропущенную дозу необходимо принять как можно скорее, а следующую дозу принять в обычное время. Не следует принимать двойную дозу с целью компенсации пропущенной.
Коррекции дозы препарата у пациентов пожилого возраста не требуется.
Коррекции дозы препарата у пациентов с нарушением функции почек и печени не требуется.
Препарат не предназначен для применения у детей и подростков в возрасте до 18 лет при ХОБЛ.
Побочное действие
Представленные ниже сведения по безопасности основаны на опыте применения препарата (в рекомендуемой терапевтической дозе до 12 месяцев) и его отдельных компонентов.
Нежелательные реакции, связанные с применением препарата, схожи с наблюдавшимися при применении его отдельных компонентов. Поскольку препарат содержит аклидиния бромид и формотерол, на фоне его применения можно ожидать нежелательные реакции, описанные для этих компонентов.
Наиболее часто отмечавшимися нежелательными реакциями при применении препарата являлись назофарингит (7.9%) и головная боль (6.8%).
Частота нежелательных реакций основана на оценке общих коэффициентов возникновения реакций, наблюдаемых при применении препарата 340 мкг+11.8 мкг/доза в рамках объединенного анализа рандомизированных, плацебо-контролируемых клинических исследований III фазы длительностью не менее 6 месяцев.
Частота нежелательных реакций представлена с использованием следующих обозначений: очень часто (≥1/10); часто (≥1/100 до <1/10); нечасто (≥1/1000 до <1/100); редко (≥1/10 000 до <1/1000); очень редко (<1/10 000) и неуточненной частоты (невозможно оценить по доступным данным).
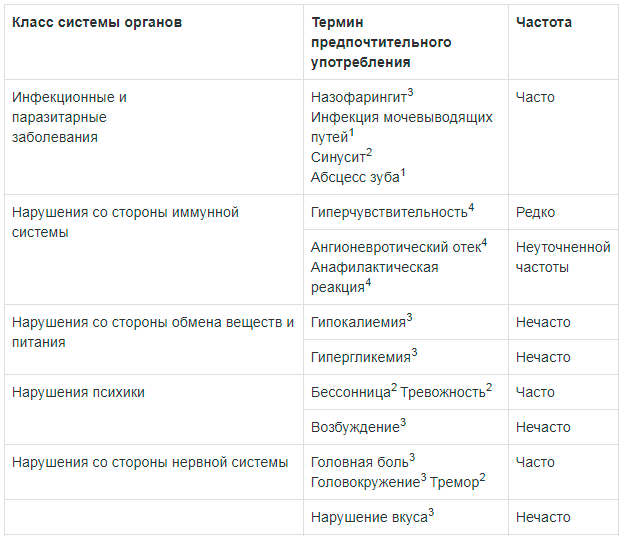
Инфекционные и паразитарные заболевания: часто — назофарингит3, инфекция мочевыводящих путей1, синусит2, абсцесс зуба1.
Со стороны иммунной системы: редко — гиперчувствительность4; неуточненной частоты — ангионевротический отек4, анафилактическая реакция4.
Со стороны обмена веществ и питания: нечасто — гипокалиемия3, гипергликемия3.
Нарушения психики: часто — бессонница2, тревожность2; нечасто — возбуждение3.
Со стороны нервной системы: часто — головная боль3, головокружение3, тремор2; нечасто — нарушение вкуса3.
Со стороны органа зрения: нечасто — нечеткость зрения2.
Со стороны сердечно-сосудистой системы: нечасто — повышение АД3, тахикардия2, удлинение интервала QTc на ЭКГ2, ощущение сердцебиения3; неуточненной частоты — стенокардия4.
Со стороны дыхательной системы: часто — кашель3; нечасто — дисфония2, раздражение глотки3; редко — бронхоспазм, в т.ч. парадоксальный4.
Со стороны пищеварительной системы: часто — диарея3, тошнота3, сухость во рту2; нечасто — стоматит3.
Со стороны кожи и подкожно-жировой клетчатки: нечасто — сыпь3, зуд3.
Со стороны костно-мышечной системы: часто — миалгия2, мышечные спазмы2.
Со стороны мочевыделительной системы: нечасто — задержка мочи3.
Прочие: часто — периферический отек3.
Лабораторные и инструментальные данные: часто — повышение активности КФК1.
1 Нежелательные реакции, наблюдавшиеся при применении препарата, но не указанные в инструкциях на его отдельные компоненты.
2 Нежелательные реакции, наблюдавшиеся при применении препарата, указанные в инструкции хотя бы одного из его отдельных компонентов.
3 Нежелательные реакции, указанные в инструкции хотя бы одного из отдельных компонентов, но при применении комбинированного препарата 340 мкг+11.8 мкг/доза наблюдавшиеся с более низкой или сопоставимой частотой, чем при применении плацебо.
4 Нежелательные реакции, указанные в инструкции хотя бы одного из отдельных компонентов, но не наблюдавшиеся при применении комбинированного препарата 340 мкг+11.8 мкг/доза; категория частоты развития указана в соответствии с разделом «Побочное действие» инструкции на отдельные компоненты.
Противопоказания к применению
Возраст до 18 лет (эффективность и безопасность не установлены); непереносимость галактозы, дефицит лактазы или глюкозо-галактозная мальабсорбция; повышенная чувствительность к аклидиния бромиду, формотеролу или лактозе.
С осторожностью: инфаркт миокарда, перенесенный в течение предшествующих 6 месяцев; нестабильная стенокардия, впервые выявленная аритмия в течение предшествующих 3 месяцев; госпитализация в течение предшествующих 12 месяцев по поводу сердечной недостаточности III и IV ФК по классификации NYHA или другие тяжелые сердечно-сосудистые заболевания; интервал QTc (по методу Базетта) >470 мс; сопутствующая терапия лекарственными препаратами, удлиняющими интервал QTc; судорожные расстройства; тиреотоксикоз; феохромоцитома; симптоматическая гиперплазия предстательной железы; задержка мочи; закрытоугольная глаукома; гипокалиемия.
Применение при беременности и кормлении грудью
Беременность
Данные о применении препарата у беременных женщин отсутствуют. В исследованиях на животных отмечена фетотоксичность только в дозах, значительно превышающих максимальную дозу аклидиния у человека, и нежелательные эффекты в исследованиях репродуктивной токсичности только при очень высокой системной экспозиции формотерола.
Во время беременности препарат следует применять только в тех случаях, когда ожидаемая польза превосходит потенциальные риск.
Период грудного вскармливания
Неизвестно, выделяется ли аклидиний (и/или его метаболиты) или формотерол с грудным молоком. Поскольку доклинические исследования показали, что небольшие количества аклидиния (и/или его метаболиты) и формотерола проникают в молоко, в период грудного вскармливания препарат следует применять только в случаях, когда ожидаемая польза для женщины превосходит потенциальный риск для младенца.
Фертильность
Доклинические исследования выявили небольшое снижение фертильности только при применении в дозах, значительно превышающих максимальные дозы аклидиния и формотерола у человека. Считается маловероятным, что применение препарата в рекомендуемой дозе будет влиять на фертильность у человека.
Применение при нарушениях функции печени
Коррекции дозы препарата у пациентов с нарушением функции печени не требуется.
Применение при нарушениях функции почек
Коррекции дозы препарата у пациентов с нарушением функции почек не требуется.
Применение у детей
Противопоказано применение препарата в возрасте до 18 лет (эффективность и безопасность не установлены).
Применение у пожилых пациентов
Коррекции дозы препарата у пациентов пожилого возраста не требуется.
Особые указания
Препарат не следует применять при бронхиальной астме; клинические исследования препарата при бронхиальной астме не проводились.
Препарат не показан для лечения острых приступов бронхоспазма.
Парадоксальный бронхоспазм
В клинических исследованиях не отмечены случаи парадоксального бронхоспазма на фоне применения препарата в рекомендуемой дозе. Однако парадоксальный бронхоспазм наблюдали при проведении другой ингаляционной терапии. В случае его возникновения следует прекратить применение лекарственного препарата и рассмотреть возможность альтернативной терапии.
Влияние на сердечно-сосудистую систему
У отдельных пациентов агонисты β2-адренорецепторов могут вызывать повышение частоты пульса и АД, изменения на ЭКГ в виде уплощения зубца Т, депрессии сегмента ST и удлинения интервала QTc. В случае развития данных эффектов может потребоваться досрочное прекращение терапии. Агонисты β2-адренорецепторов длительного действия следует применять с осторожностью у пациентов с удлинением интервала QTc в настоящее время или в анамнезе, либо получающих лекарственные препараты, влияющие на длительность интервала QTc.
Системные эффекты
При применении высоких доз агонистов β2-адренорецепторов возможно развитие метаболических эффектов в виде гипергликемии и гипокалиемии. В клинических исследованиях III фазы частота значимого повышения концентрации глюкозы в крови на фоне применения комбинированного препарата была низкой (0.1%) и схожей с группой плацебо. Гипокалиемия обычно транзиторная и не требует дополнительной терапии. У пациентов с тяжелой ХОБЛ гипокалиемия может потенцироваться гипоксией и сопутствующей терапией. Гипокалиемия может увеличить риск развития аритмии.
Вследствие антихолинергической активности препарат следует применять с осторожностью при симптоматической гиперплазии предстательной железы, задержке мочи или закрытоугольной глаукоме (несмотря на то, что непосредственный контакт препарата с глазами очень маловероятен). Сухость во рту, отмечавшаяся на фоне антихолинергической терапии, при сохранении в течение длительного времени может привести к кариесу зубов.
Влияние на способность к управлению транспортными средствами и механизмами
Препарат не влияет или в незначительной степени влияет на способность управлять транспортом и механизмами. Развитие нечеткости зрения или головокружения может оказать влияние на способность к управлению транспортными средствами или работе с механизмами.
Лекарственное взаимодействие
Совместное применение препарата с другими антихолинергическими средствами и/или агонистами β2-адренорецепторов длительного действия не рекомендуется.
Препарат применялся одновременно с другими лекарственными средствами для терапии ХОБЛ, включая агонисты β2-адренорецепторов короткого действия, метилксантины, а также пероральные и ингаляционные ГКС, без клинических признаков лекарственного взаимодействия.
В исследованиях in vitro было установлено, что не ожидается взаимодействия аклидиния бромида в терапевтической дозе или его метаболитов с субстратами Р-гликопротеина (P-gp) и лекарственными средствами, метаболизируемыми изоферментами цитохрома Р450 (CYP450), и эстеразами. В терапевтически значимых концентрациях формотерол не ингибирует изоферменты CYP450.
Сопутствующее применение производных метилксантина, стероидов или калийнесберегающих диуретиков может усиливать возможный гипокалиемический эффект агонистов β2-адренорецепторов, поэтому следует соблюдать осторожность при совместном применении с этими препаратами.
Блокаторы β2-адренорецепторов могут ослаблять или нивелировать эффект агонистов β2-адренорецепторов. При необходимости применения бета-адреноблокаторов (в т.ч. в виде глазных капель) предпочтительнее назначение кардиоселективных бета-адреноблокаторов, хотя и они должны применяться с осторожностью.
Следует с осторожностью применять препарат у пациентов, получающих лекарственные средства, удлиняющие интервал QTc, такие как ингибиторы МАО, трициклические антидепрессанты, антигистаминные средства или макролиды, поскольку они могут потенцировать влияние формотерола на сердечно-сосудистую систему. Лекарственные препараты, удлиняющие интервал QTc, повышают риск развития желудочковой аритмии.
Содержание
-
Русское название
-
Английское название
-
Латинское название
-
Фармакологическая группа вещества Аклидиния бромид + Формотерол
-
Нозологическая классификация
-
Фармакологическое действие
-
Характеристика
-
Фармакология
-
Применение вещества Аклидиния бромид + Формотерол
-
Противопоказания
-
Ограничения к применению
-
Применение при беременности и кормлении грудью
-
Побочные действия вещества Аклидиния бромид + Формотерол
-
Взаимодействие
-
Передозировка
-
Способ применения и дозы
-
Меры предосторожности
-
Источники информации
-
Торговые названия с действующим веществом Аклидиния бромид + Формотерол
Русское название
Аклидиния бромид + Формотерол
Английское название
Aclidinium bromide + Formoterol
Латинское название
Aclidinii bromidum + Formoterolum (род. Aclidinii bromidi + Formoteroli)
Фармакологическая группа вещества Аклидиния бромид + Формотерол
Нозологическая классификация
Фармакологическое действие
—
бронходилатирующее, м-холиноблокирующее, бета2-адреномиметическое.
Характеристика
Комбинация антагонист мускариновых рецепторов + агонист β2-адренергических рецепторов.
Фармакология
Механизм действия
Комбинация аклидиния бромид + формотерол содержит два бронходилататора: аклидиния бромид — антагонист мускариновых рецепторов длительного действия (также называемый антихолинергик) и формотерол — агонист β2-адренергических рецепторов длительного действия. Комбинация этих веществ с разными механизмами действия обеспечивает аддитивный эффект по сравнению с применением отдельных компонентов. Вследствие различия плотности мускариновых и β2-адренорецепторов в центральных и периферических дыхательных путях антагонисты мускариновых рецепторов более эффективны в расслаблении центральных дыхательных путей, а агонисты β2-адренергических рецепторов — периферических дыхательных путей, таким образом применение комбинированной терапии может усиливать благоприятное воздействие на функцию легких.
Аклидиния бромид является конкурентным, селективным антагонистом мускариновых рецепторов с более длительным временем связывания с М3-рецепторами, чем с М2-рецепторами. М3-рецепторы служат посредниками при сокращении гладкой мускулатуры дыхательных путей. Вдыхаемый аклидиния бромид действует местно в легких в качестве антагониста М3-рецепторов гладкой мускулатуры дыхательных путей и вызывает бронходилатацию. Применение аклидиния бромида у пациентов с ХОБЛ вызывает также снижение выраженности симптомов, улучшение связанного с заболеванием состояния здоровья, снижение частоты обострений и улучшение переносимости физической нагрузки. Поскольку аклидиния бромид быстро разрушается в плазме крови, количество системных антихолинергических побочных эффектов является низким.
Формотерол является мощным селективным агонистом β2-адренорецепторов. Бронходилатация достигается за счет расслабления гладкой мускулатуры дыхательных путей вследствие повышения уровня цАМФ после активации аденилатциклазы. Помимо улучшения функции легких, формотерол уменьшает выраженность симптомов и повышает качество жизни у пациентов с ХОБЛ.
Фармакодинамика
Клинические исследования показали, что комбинация аклидиния бромид + формотерол обеспечивает клинически значимое улучшение функции легких (оцениваемое по ОФВ за 1 с (OФВ1) в течение более 12 ч после применения.
Комбинация аклидиния бромид + формотерол обладает быстрым началом действия — в течение 5 мин после первой ингаляции по сравнению с плацебо. Начало действия комбинации аклидиния бромид + формотерол было сравнимо с эффектом быстродействующего агониста β2-адренорецепторов формотерола в дозе 12 мкг. Максимальная бронходилатация (максимальный ОФВ1) по сравнению с исходным уровнем достигалась с первого дня (304 мл) и поддерживалась в течение всего периода терапии длительностью более 6 мес (326 мл).
Электрофизиология сердца
Не было выявлено клинически значимое влияние комбинации аклидиния бромид + формотерол на параметры ЭКГ, включая интервал QT, по сравнению с аклидиния бромидом, формотеролом и плацебо, а также на сердечный ритм при проведении суточного мониторирования по Холтеру.
Клиническая эффективность
Программа клинических исследований III фазы с участием приблизительно 4000 пациентов с клиническим диагнозом ХОБЛ средней или тяжелой степени включала два 6-месячных рандомизированных исследования с плацебо и активным контролем (ACLIFORM-COPD и AUGMENT), 6-месячную продленную фазу исследования AUGMENT, а также дополнительное 12-месячное рандомизированное контролируемое исследование.
В долгосрочных исследованиях безопасности комбинация аклидиния бромид + формотерол показала стойкую эффективность без признаков тахифилаксии при длительности применения более 1 года.
Влияние на функцию легких
Комбинация аклидиния бромид + формотерол (340+11,8 мкг/доза 2 раза в сутки) обеспечивала клинически значимое улучшение функции легких (оценка по ОФВ1, форсированной жизненной емкости легких и емкости вдоха) по сравнению с плацебо. Клинически значимый бронходилатирующий эффект достигался в течение 5 мин после применения первой дозы и поддерживался в течение всего междозового интервала.
В исследовании ACLIFORM-COPD комбинация аклидиния бромид + формотерол обеспечивала улучшение OФВ1 через 1 ч после применения по сравнению с плацебо и аклидиния бромидом 299 и 125 мл соответственно (р<0,0001 в обоих сравнениях) и улучшение остаточного ОФВ1 по сравнению с плацебо и формотеролом 143 и 85 мл соответственно (р<0,0001 в обоих сравнениях). В исследовании AUGMENT улучшение ОФВ1 через 1 ч после применения по сравнению с плацебо и аклидиния бромидом составило 284 и 108 мл соответственно (р<0,0001 в обоих сравнениях), а улучшение остаточного ОФВ1 по сравнению с плацебо и формотеролом — 130 (р<0,0001) и 45 мл (р=0,01) соответственно.
Облегчение симптомов и улучшение состояния здоровья, обусловленного заболеванием
Одышка и другие симптомы. Комбинация аклидиния бромид + формотерол обеспечивала клинически значимое улучшение в отношении одышки (оценивалось с помощью транзиторного индекса одышки (TDI) с повышением индекса TDI через 6 мес терапии по сравнению с плацебо на 1,29 единицы в исследовании ACLIFORM-COPD (р<0,0001) и на 1,44 единицы — в исследовании AUGMENT (р<0,0001).
Объединенный анализ этих двух исследований показал, что применение комбинации аклидиния бромид + формотерол ассоциируется со статистически значимым бóльшим улучшением индекса TDI по сравнению с аклидиния бромидом (на 0,4 единицы; р=0,016) или формотеролом (на 0,5 единицы; р=0,009).
Комбинация аклидиния бромид + формотерол улучшала дневную симптоматику ХОБЛ, в частности одышку, симптомы со стороны грудной клетки, кашель и отделение мокроты (оценивалась с помощью общего индекса E-RS), а также общую выраженность ночных симптомов, ранних утренних симптомов и симптомов, ограничивающих активность в ранние утренние часы, по сравнению с плацебо, аклидиния бромидом и формотеролом, однако данное улучшение не всегда было статистически значимым. Комбинация аклидиния бромид + формотерол не показала статистически значимого снижения среднего количества ночных пробуждений, обусловленных ХОБЛ, по сравнению с плацебо или формотеролом.
Качество жизни, обусловленное состоянием здоровья
В исследовании AUGMENT комбинация аклидиния бромид + формотерол обеспечивала статистически значимое улучшение состояния здоровья, обусловленного заболеванием (оценивалось с помощью Респираторного опросника больницы Святого Георгия (SGRQ), с улучшением общего индекса SGRQ на −4,35 единицы по сравнению с плацебо (р<0,0001). В исследовании ACLIFORM-COPD наблюдалось лишь небольшое снижение общего индекса SGRQ по сравнению с плацебо вследствие неожиданно выраженного ответа на терапию плацебо (р=0,598), и процент пациентов, достигших клинически значимого улучшения относительно исходного уровня, составил 55,3% в группе комбинация аклидиния бромид + формотерол и 53,2% в группе плацебо (р=0,669).
Объединенный анализ данных этих двух исследований показал большее улучшение общего индекса SGRQ при применении комбинации аклидиния бромид + формотерол по сравнению с формотеролом (−1,7 единиц; р=0,018) или аклидиния бромидом (−0,79 единиц; р=0,273).
Снижение частоты обострений ХОБЛ
В рамках объединенного анализа эффективности двух исследований длительностью 6 мес было продемонстрировано статистически значимое снижение на 29% частоты обострений средней или тяжелой степени (требующие терапии антибиотиками или кортикостероидами или приводящие к госпитализации) на фоне терапии комбинацией аклидиния бромид + формотерол по сравнению с плацебо (частота на пациента в год — 0,29 против 0,42 соответственно; р=0,036), а также увеличение времени до первого обострения средней или тяжелой степени по сравнению с плацебо (соотношение рисков 0,7; р=0,027).
Применение средств экстренной терапии
Комбинация аклидиния бромид + формотерол снижала потребность в средстве экстренной терапии на протяжении более 6 мес по сравнению с плацебо (на 0,9 ингаляций/сутки (р<0,0001), аклидиния бромидом (на 0,4 ингалиции/сутки (p<0,001) и формотеролом (на 0,2 ингаляции/сутки (р=0,062).
Фармакокинетика
Параметры фармакокинетики аклидиния бромида и формотерола при ингаляционном применении в комбинации существенно не отличались от наблюдаемых при применении отдельных компонентов.
Абсорбция. После однократной ингаляции комбинации аклидиния бромид + формотерол аклидиния бромид и формотерол быстро абсорбировались в плазму крови с достижением Cmax в течение 5 мин у здоровых добровольцев и в течение 24 мин у пациентов с ХОБЛ. Максимальные Css аклидиния бромида и формотерола у пациентов с ХОБЛ, получавших комбинацию аклидиния бромид + формотерол 2 раза в сутки в течение 5 дней, достигались в течение 5 мин после ингаляции и составляли 128 и 17 пг/мл соответственно.
Распределение. Общее количество попадающего в легкие после ингаляции аклидиния бромида составило приблизительно 30% отмеренной дозы. Связывание аклидиния с белками плазмы in vitro вероятнее всего соответствует связыванию метаболитов с белками вследствие быстрого гидролиза аклидиния бромида в плазме крови. Связывание с белками плазмы крови составило 87% для производного карбоновой кислоты и 15% для спиртового производного. Основным белком плазмы крови, который связывает аклидиния бромид, является альбумин.
Связывание формотерола с белками плазмы крови составляет 61–64% (34% — преимущественно с альбумином). Не отмечено насыщение центров связывания в диапазоне концентраций, достигающихся при применении комбинации аклидиния бромид + формотерол в терапевтических дозах.
Биотрансформация. Аклидиния бромид быстро и интенсивно гидролизуется до фармакологически неактивных спиртового производного и производного карбоновой кислоты. Происходит химический (неферментативный) и ферментативный гидролиз под действием эстераз. Основной эстеразой, вовлеченной в гидролиз у человека, является бутирилхолинэстераза. Концентрация кислотного метаболита в плазме крови после ингаляции приблизительно в 100 раз выше, чем концентрация спиртового метаболита и неизмененного активного вещества.
Низкая абсолютная биодоступность аклидиния бромида при ингаляционном введении (<5%) обусловлена его интенсивным системным и пресистемным гидролизом как при нахождении в легких, так и при приеме внутрь. Биотрансформация с участием изоферментов цитохрома CYP450 играет незначительную роль в общем метаболическом клиренсе аклидиния бромида. Исследования in vitro показали, что аклидиний в терапевтической дозе или его метаболиты не ингибируют и не индуцируют какие-либо изоферменты CYP450 и не ингибируют эстеразы (карбоксилэстеразу, ацетилхолинэстеразу и бутирилхолинэстеразу). Также in vitro установлено, что аклидиния бромид или его метаболиты не являются субстратами или ингибиторами Р-gp.
Формотерол выводится преимущественно посредством метаболизма. Основным путем является прямая глюкуронизация с О-деметилированием и последующей конъюгацией с глюкуронидом. В О-деметилировании формотерола участвуют изоферменты CYP2D6, CYP2C19, CYP2C9 и CYP2A6. В терапевтически значимых концентрациях формотерол не ингибирует изоферменты CYP450.
Выведение. После ингаляции комбинации аклидиния бромид + формотерол в дозе 340+11,8 мкг конечный T1/2 аклидиния бромида и формотерола составляет приблизительно 5 и 8 ч соответственно.
После в/в введения 400 мкг меченого радиоактивным изотопом аклидиния здоровым добровольцам около 1% введенной дозы выводилось в неизмененном виде с мочой. До 65% дозы выводилось в виде метаболитов с мочой и до 33% — в виде метаболитов с фекалиями. После ингаляции 200 и 400 мкг аклидиния бромида здоровыми добровольцами и пациентами с ХОБЛ выведение неизмененного аклидиния с мочой было очень низким (приблизительно 0,1% введенной дозы), что свидетельствует о том, что почечный клиренс играет незначительную роль в общем клиренсе аклидиния бромида из плазмы крови.
Основная часть введенной дозы формотерола подвергалась метаболизму в печени с последующим выведением почками. После ингаляции 6–9% доставленной дозы формотерола выводилось с мочой в неизмененном виде или в виде конъюгатов формотерола.
Особые группы пациентов
Пожилой возраст. Исследования фармакокинетики комбинации аклидиния бромид + формотерол у пациентов пожилого возраста не проводились. Поскольку пожилым пациентам не требуется коррекция дозы аклидиния бромида или формотерола в режиме монотерапии, при применении комбинации аклидиния бромид + формотерол корректировать дозу также не требуется.
Нарушение функции почек и печени. Данные об особенностях применения комбинации аклидиния бромид + формотерол у пациентов с нарушением функции почек или печени отсутствуют. Поскольку у пациентов с нарушением функции ночек или печени не требуется коррекция дозы аклидиния бромида или формотерола в режиме монотерапии, при применении комбинации аклидиния/формотерола корректировать дозу также не требуется.
Применение вещества Аклидиния бромид + Формотерол
Поддерживающая бронходилатирующая терапия с целью облегчения симптомов хронической обструктивной болезни легких у взрослых.
Противопоказания
Повышенная чувствительность к компонентам комбинации; возраст до 18 лет.
Ограничения к применению
Инфаркт миокарда, перенесенный в течение предшествующих 6 мес; нестабильная стенокардия; впервые выявленная аритмия в течение предшествующих 3 мес; госпитализация в течение предшествующих 12 мес по поводу сердечной недостаточности III и IV функциональных классов по классификации NYHA или другие тяжелые сердечно-сосудистые заболевания; интервал QTc (по методу Базетта) >470 мс; сопутствующая терапия ЛС, удлиняющими интервал QTc; судорожные расстройства; тиреотоксикоз; феохромоцитома; симптоматическая гиперплазия предстательной железы; задержка мочи; закрытоугольная глаукома; гипокалиемия.
Применение при беременности и кормлении грудью
Данные о применении комбинации аклидиния бромид + формотерол у беременных женщин отсутствуют.
В исследованиях на животных отмечена фетотоксичность только в дозах, значительно превышающих максимальную дозу аклидиния бромида у человека и нежелательные эффекты в исследованиях репродуктивной токсичности только при очень высокой системной экспозиции формотерола.
Во время беременности комбинацию аклидиния бромид + формотерол следует применять только в тех случаях, когда ожидаемая польза превосходит потенциальные риски.
Неизвестно, выделяется ли аклидиния бромид (и/или его метаболиты) или формотерол с грудным молоком. Поскольку доклинические исследования показали, что небольшие количества аклидиния бромида (и/или его метаболиты) и формотерола проникают в молоко, в период грудного вскармливания комбинацию аклидиния бромид + формотерол следует применять только в случаях, когда ожидаемая польза для женщины превосходит потенциальный риск для младенца.
Фертильность. Доклинические исследования выявили небольшое снижение фертильности только при применении в дозах, значительно превышающих максимальные дозы аклидиния бромида и формотерола у человека. Считается маловероятным, что применение комбинации аклидиния бромид + формотерол в рекомендуемой дозе будет влиять на фертильность у человека.
Побочные действия вещества Аклидиния бромид + Формотерол
Представленные ниже сведения по безопасности основаны на опыте применения комбинации аклидиния бромид + формотерол (в рекомендуемой терапевтической дозе до 12 мес) и ее отдельных компонентов.
Обзор профиля безопасности
Нежелательные реакции, связанные с применением комбинации аклидиния бромид + формотерол, схожи с наблюдавшимися при применении его отдельных компонентов. Поскольку эта комбинация содержит аклидиния бромид и формотерол, то на фоне ее применения можно ожидать нежелательные реакции, описанные для этих компонентов.
Наиболее часто отмечавшимися нежелательными реакциями при применении комбинации аклидиния бромид + формотерол являлись назофарингит (7,9%) и головная боль (6,8%).
Частота нежелательных реакций основана на оценке общих коэффициентов возникновения реакций, наблюдаемых при применении комбинации аклидиния бромид + формотерол в дозе 340+11,8 мкг в рамках объединенного анализа рандомизированных плацебо-контролируемых клинических исследований III фазы длительностью не менее 6 мес.
Частота нежелательных реакций представлена с использованием следующих обозначений: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1 /100); редко (≥1/10000, <1/1000); очень редко (<1/10000) и частота неизвестна (невозможно оценить по доступным данным).
Инфекционные и паразитарные заболевания: часто — назофарингит1, инфекция мочевыводящих путей2, синусит3, абсцесс зуба2.
Со стороны иммунной системы: редко — гиперчувствительность4; частота неизвестна — ангионевротический отек4, анафилактическая реакция4.
Со стороны обмена веществ и питания: нечасто — гипокалиемия1, гипергликемия1.
Нарушения психики: часто — бессонница3, тревожность3; нечасто — возбуждение1.
Со стороны нервной системы: часто — головная боль1, головокружение1, тремор3; нечасто — нарушение вкуса1.
Со стороны органа зрения: нечасто — нечеткость зрения3.
Со стороны сердца: нечасто — тахикардия3, удлинение интервала QTc на ЭКГ3, ощущение сердцебиения1; частота неизвестна — стенокардия4.
Со стороны дыхательной системы, органов грудной клетки и средостения: часто — кашель1; нечасто — дисфония3, раздражение глотки1; редко — бронхоспазм, в т.ч. парадоксальный4.
Со стороны органов пищеварения: часто — диарея1, тошнота1, сухость во рту3; нечасто — стоматит1.
Со стороны кожи и подкожных тканей: нечасто — сыпь1, кожный зуд1.
Со стороны скелетно-мышечной системы и соединительной ткани: часто — миалгия3, мышечные спазмы3.
Со стороны почек и мочевыводящих путей: нечасто — задержка мочи1.
Общие расстройства и нарушения в месте введения: часто — периферический отек1.
Лабораторные и инструментальные данные: часто — повышение активности КФК в крови2; нечасто — повышение АД1.
1Нежелательные реакции, относящиеся хотя бы к одному из отдельных компонентов, но при применении комбинации аклидиния бромид + формотерол в дозе 340+1,8 мкг наблюдавшиеся с более низкой или сопоставимой частотой, чем при применении плацебо.
2Нежелательные реакции, наблюдавшиеся при применении комбинации аклидиния бромид + формотерол, но не указанные в инструкциях его отдельных компонентов.
3Нежелательные реакции, наблюдавшиеся при применении комбинации аклидиния бромид + формотерол и указанные в инструкции хотя на один из ее отдельных компонентов.
4Нежелательные реакции, относящиеся хотя бы к одному из отдельных компонентов, но не наблюдавшиеся при применении комбинации аклидиния бромид + формотерол в дозе 340+11,8 мкг; категория частоты развития указана в соответствии с разделом «Побочные действия» в инструкциях отдельных компонентов.
Взаимодействие
ЛС для лечения ХОБЛ
Совместное применение комбинации аклидиния бромид + формотерол с другими антихолинергическими средствами и/или агонистами β2-адренергических рецепторов длительного действия не изучалось и не рекомендуется.
Хотя формальных исследований лекарственных взаимодействий комбинации аклидиния бромид + формотерол in vivo не проводилось, она применялась одновременно с другими ЛС для терапии ХОБЛ, включая агонисты β2-адренергических рецепторов короткого действия, метилксантины, а также пероральные и ингаляционные ГКС, без клинических признаков лекарственного взаимодействия.
Метаболические взаимодействия
В исследованиях in vitro было установлено, что не ожидается взаимодействие аклидиния в терапевтической дозе или его метаболитов с субстратами P-gp и ЛС, метаболизируемыми изоферментами CYP450 и эстеразами. В терапевтически значимых концентрациях формотерол не ингибирует изоферменты CYP450.
ЛС, вызывающие гипокалиемию
Сопутствующее применение производных метилксантина, стероидов или калийнесберегающих диуретиков может усиливать возможный гипокалиемический эффект агонистов β2-адренорецепторов, поэтому следует соблюдать осторожность при их совместном применении (см. «Меры предосторожности»).
Блокаторы β2-адренергических рецепторов
Блокаторы β-адренергических рецепторов могут ослаблять или нивелировать эффект агонистов β2-адренергических рецепторов. При необходимости применения блокаторов β-адренергических рецепторов (в т.ч. в виде глазных капель) предпочтительнее назначение кардиоселективных блокаторов β-адренергических рецепторов, хотя и они должны применяться с осторожностью.
Другие фармакодинамические взаимодействия
Следует с осторожностью применять комбинацию аклидиния бромид + формотерол у пациентов, получающих ЛС, удлиняющие интервал QTc, такие как ингибиторы МАО, трициклические антидепрессанты, антигистаминные средства или макролиды, поскольку они могут потенцировать влияние формотерола на ССС. ЛС, удлиняющие интервал QTc, повышают риск развития желудочковой аритмии.
Передозировка
Опыт лечения передозировки комбинации аклидиния бромид + формотерол ограничен.
Симптомы: высокие дозы этой комбинации могут приводить к усилению симптомов и проявлений антихолинергического и/или β2-адренергического действия, наиболее частыми из которых являются нечеткость зрения, сухость во рту, тошнота, мышечный спазм, тремор, головная боль, ощущение сердцебиения и артериальная гипертензия.
Лечение: в случае передозировки следует прекратить применение комбинации аклидиния бромид + формотерол. Показана поддерживающая и симптоматическая терапия.
Способ применения и дозы
Ингаляционно, в дозе 340+11,8 мкг 2 раза в сутки.
Меры предосторожности
Бронхиальная астма
Комбинация аклидиния бромид + формотерол не должна применяться при бронхиальной астме, клинические исследования этой комбинации при бронхиальной астме не проводились.
Парадоксальный бронхоспазм
В клинических исследованиях не отмечены случаи парадоксального бронхоспазма на фоне применения комбинации аклидиния бромид + формотерол в рекомендуемой дозе. Однако парадоксальный бронхоспазм наблюдали при проведении другой ингаляционной терапии. В случае его возникновения следует прекратить применение и рассмотреть возможность альтернативной терапии.
Комбинация аклидиния бромид + формотерол не предназначена для купирования острых приступов бронхоспазма.
Влияние на ССС
Комбинацию аклидиния бромид + формотерол следует применять с осторожностью у пациентов, перенесших инфаркт миокарда в течение предшествующих 6 мес, с нестабильной стенокардией, впервые выявленной аритмией в течение предшествующих 3 мес, с интервалом QTc (рассчитанным по методу Базетта) >470 мс или госпитализировавшихся в течение предшествующих 12 мес по поводу сердечной недостаточности III и IV функциональных классов по классификации NYHA, поскольку эти пациенты не включались в клинические исследования.
У отдельных пациентов агонисты β2-адренорецепторов могут вызывать повышение частоты пульса и АД, изменения на ЭКГ в виде уплощения зубца Т, депрессии сегмента ST и удлинения интервала QTc. В случае развития данных эффектов может потребоваться досрочное прекращение терапии. Агонисты β2-адренорецепторов длительного действия следует применять с осторожностью у пациентов с удлинением интервала QTc в настоящее время или в анамнезе либо получающих ЛС, влияющие на длительность интервала QTc (см. «Взаимодействие»).
Системные эффекты
Комбинацию аклидиния бромид + формотерол следует применять с осторожностью у пациентов с тяжелыми нарушениями со стороны ССС, судорожными расстройствами, тиреотоксикозом и феохромоцитомой.
При применении высоких доз агонистов β2-адренорецепторов возможно развитие метаболических эффектов в виде гипергликемии и гипокалиемии. В клинических исследованиях III фазы частота значимого повышения концентрации глюкозы в крови на фоне применения комбинации аклидиния бромид + формотерол была низкой (0,1%) и схожей с группой плацебо. Гипокалиемия обычно транзиторная и не требует дополнительной терапии. У пациентов с тяжелой ХОБЛ гипокалиемия может потенцироваться гипоксией и сопутствующей терапией (см. «Взаимодействие»). Гипокалиемия может увеличить риск развития аритмии.
Вследствие антихолинергической активности комбинацию аклидиния бромид + формотерол следует применять с осторожностью при симптоматической гиперплазии предстательной железы, задержке мочи или закрытоугольной глаукоме (несмотря на то что непосредственный контакт с глазами очень маловероятен). Сухость во рту, отмечавшаяся на фоне антихолинергической терапии, при сохранении в течение длительного времени может привести к кариесу зубов.
Влияние на способность управлять транспортными средствами и работать с механизмами. Применение комбинации аклидиния бромид + формотерол не влияет или в незначительной степени влияет на способность управлять транспортом и работать с механизмами. Развитие нечеткости зрения или головокружения может оказать влияние на способность к управлению транспортными средствами или работе с механизмами.
Источники информации
Обобщенные материалы www.grls.rosminzdrav.ru, 2016.
Торговые названия с действующим веществом Аклидиния бромид + Формотерол
| Торговое название | Цена за упаковку, руб. |
|---|---|
| Дуаклир Дженуэйр |
от 2621.00 до 2621.00 |
Фармакокинетика
При совместном введении аклидиния и формотерола ингаляционным путем фармакокинетика каждого из веществ не показала значимых различий по сравнению с фармакокинетикой при введении лекарственных средств по отдельности.
Всасывание
После вдыхания однократной дозы препарата Бримика® Дженуэйр® 340 мкг/12 мкг аклидиний и формотерол быстро всасываются в плазму, достигая пиковой концентрации в плазме в течение 5 минут после ингаляции у здоровых субъектов и в течение 24 минут после ингаляции у пациентов, страдающих ХОБЛ. Пиковые концентрации в плазме аклидиния и формотерола в равновесном состоянии, наблюдаемые у пациентов, страдающих ХОБЛ и принимавших препарат Бримика® Дженуэйр® два раза в сутки в течение 5 дней, были достигнуты в течение 5 минут после ингаляции и составляли 128 пг/мл и 17 пг/мл соответственно.
Распределение
Общее количество попадающего в легкие аклидиния, вдыхаемого через ингалятор Дженуэйр®, составило, приблизительно, 30% отмеренной дозы. Связывание аклидиния с белками плазмы in vitro, соответствует, скорее всего, связыванию метаболитов с белками, в связи с быстрым гидролизом аклидиния в плазме, связывание с белками плазмы составило 87% для метаболита карбоновой кислоты и 15% для спиртового метаболита. Основным белком плазмы, который связывает аклидиния, является альбумин.
Связывание формотерола с белками плазмы составляет 61% – 64% (34% главным образом с альбумином). Насыщения связей не происходит при концентрациях, достигаемых при приеме в терапевтических дозах.
Биотрансформация
Аклидиний быстро и активно гидролизуется до своих фармакологически неактивных спиртовых дериватов и дериватов карбоновой кислоты. Уровень кислотного метаболита в плазме после ингаляции примерно в 100 раз выше, чем уровень спиртового метаболита и неизмененного действующего вещества. Происходит как химический гидролиз (неферментативный), так и ферментативный – с участием эстераз, и основной эстеразой, вовлеченной в гидролиз у человека, является бутирилхолинэстераза. Низкая абсолютная биодоступность аклидиния при ингаляционном введении (<5%) связана с тем, что аклидиний подвергается активному системному и пресистемному гидролизу как при нахождении в легких, так и при приеме внутрь. Биотрансформация при участии ферментов CYP450 играет незначительную роль в общем метаболическом клиренсе аклидиния. Испытания in vitro показали, что аклидиний в терапевтической дозе или его метаболиты не подавляют или не индуцируют какие-либо ферменты цитохрома P450 (CYP450) и не подавляют активность эстераз (карбоксилэстеразы, ацетилхолинэстеразы и бутирилхолинэстеразы). Исследования in vitro показали, что аклидиний или его метаболиты не являются субстратами или ингибиторами Р‑гликопротеина.
Формотерол выводится главным образом метаболическим путем. Наиболее важным путем является непосредственная глюкуронизация с о-деметилированием, затем следует конъюгация с глюкуронидом, являющаяся дальнейшим метаболическим путем. Изоферменты цитохрома P450 – CYP2D6, CYP2C19, CYP2C9 и CYP2A6 участвуют в о-деметилировании формотерола. Формотерол в терапевтических концентрациях не ингибирует ферменты CYP450.
Выведение
После ингаляции препарата Бримика® Дженуэйр® 340/12 мкг аклидиний и формотерол продемонстрировали конечное время полувыведения, прибл., 5 часов и 8 часов соответственно.
После внутривенного введения здоровым испытуемым меченого радиоактивной меткой аклидиния бромида, 400 мкг, около 1% введенного количества выводилось в неизмененном виде с мочой. До 65% дозы выводилось в виде метаболитов с мочой и до 33% в виде метаболитов с фекалиями. После ингаляционного введения здоровым испытуемым и пациентам, страдающим ХОБЛ, аклидиния бромида, 200 мкг и 400 мкг, очень малое количество, около 0,1% принятой дозы, выводилось в неизмененном виде с мочой, что указывает на то, что почечный клиренс играет незначительную роль в общем клиренсе аклидиния из плазмы.
Основная часть принятого формотерола преобразовывается за счет метаболизма печени, а затем выводится почками. После ингаляции 6–9% высвобожденной дозы формотерола выводится с мочой в неизмененном виде или в качестве непосредственных конъюгатов формотерола.
Особые группы пациентов
Пациенты пожилого возраста
Исследования фармакокинетики аклидиния/формотерола среди пациентов пожилого возраста не проводились. Поскольку у пациентов пожилого возраста ни при применении аклидиния, ни при применении формотерола, изменений дозы не требуется, в случае аклидиния/формотерола при применении его у пожилых пациентов изменение дозы не является обоснованным.
Пациенты с нарушением функции почек или печени
Данные по специальному применению аклидиния/формотерола у пациентов с нарушением функции почек или печени отсутствуют. Поскольку у пациентов с нарушением функции почек или печени изменений дозы ни при применении аклидиния, ни при применении формотерола не требуется, то в случае аклидиния/формотерола изменение дозы не является обоснованным.
Фармакодинамика
Механизм действия
В препарате Бримика® Дженуэйр® содержатся два бронходилататора: аклидиний является антагонистом мускариновых рецепторов пролонгированного действия (также известно, что он обладает антихолинергическим действием), а формотерол является β2-адреномиметиком пролонгированного действия. При помощи комбинации этих двух веществ с различными механизмами действия получают аддитивный эффект в отличие от применения каждого из компонентов по отдельности. Как следствие различной плотности мускариновых рецепторов и β2‑адренорецепторов в центральных и периферических дыхательных путях, мускариновые антагонисты должны быть более эффективными в расслаблении центральных дыхательных путей, в то время как β2-адреномиметики должны более эффективно расслаблять периферические дыхательные пути; расслабление и центральных и периферических дыхательных путей в комбинированной терапии должно оказывать благотворное воздействие на функцию легких. Дополнительная информация относительно этих двух веществ приведена ниже.
Аклидиний является конкурентным, селективным антагонистом мускариновых рецепторов, с более длительным временем размещения на M3-рецепторах, чем на M2-рецепторах. M3-Рецепторы опосредуют сокращение гладкой мускулатуры дыхательных путей. При вдыхании аклидиния бромид действует местно в легких, проявляя антагонизм к M3-рецепторам в гладких мышцах дыхательных путей и вызывая расширение бронхов. Также было доказано, что аклидиний оказывает благоприятное воздействие на пациентов, страдающих ХОБЛ, в отношении ослабления симптомов, улучшения состояния здоровья, являющегося специфичным для данного заболевания, снижение частоты обострений и повышение переносимости физических нагрузок. Поскольку аклидиний быстро разрушается в плазме, уровень системных антихолинергических побочных действий низок.
Формотерол – мощный селективный β2-адреномиметик. Бронходилатация вызывается непосредственным расслаблением гладкой мускулатуры дыхательных путей как следствие увеличения содержания циклического АМФ, обусловленного активацией аденилатциклазы. Кроме улучшения функции легких было также доказано, что формотерол ослабляет симптомы и повышает качество жизни пациентов, страдающих ХОБЛ.
Фармакодинамические эффекты
Клинические исследования эффективности показали, что препарат Бримика® Дженуэйр® обеспечивал клинически значимое улучшение в отношении функции легких (при измерении объема форсированного выдоха за первую секунду маневра форсированного выдоха [ОФВ1]) более чем через 12 часов после приема.
Препарат Бримика® Дженуэйр® продемонстрировал быстрое начало действия в течение 5 минут после первого вдыхания по сравнению с плацебо (p < 0,0001). Начало действия препарата Бримика® Дженуэйр® было сравнимо с эффектом формотерола, 12 мкг, быстродействующего β2-адреномиметика. Максимальное бронходилатационное действие (пик ОФВ1) относительно исходного значения проявлялось с первого дня (304 мл) и сохранялось в течение 6-месячного периода лечения (326 мл).
Электрофизиология сердца
Не было обнаружено клинически значимого эффекта препарата Бримика® Дженуэйр® на параметры ЭКГ (в том числе на интервал QT) по сравнению с аклидинием, формотеролом и плацебо в испытаниях фазы III длительностью 6-12 месяцев, в которых участвовало 4000 пациентов, страдающих ХОБЛ. Не было выявлено клинически значимого эффекта препарата Бримика® Дженуэйр® на сердечный ритм при проведении 24‑часового Холтеровского мониторинга в подгруппе из 551 пациентов (114 из которых получали препарат Бримика® Дженуэйр® два раза в сутки).
Клиническая эффективность и безопасность
В фазе III программы клинической разработки приняло участие 4000 пациентов с клиническим диагнозом ХОБЛ, в нее вошло два 6-месячных рандомизированных, контролируемых плацебо и активным препаратом сравнения исследования (ACLIFORM-COPD и AUGMENT), а также 6-месячное продолжение исследования AUGMENT и еще одно 12-месячное рандомизированное контролируемое исследование. В ходе этих исследований пациентам было разрешено продолжать свое неизменное лечение ингаляционными кортикостероидами, кортикостероидами для приема внутрь в низких дозах, лечение кислородом (если оно занимало менее 15 часов/сутки) или метилксантинами: также можно было использовать сальбутамол в качестве препарата экстренной помощи.
Эффективность оценивалась по результатам измерений функции легких, исходам симптоматики, по состоянию здоровья, являющемуся для данного заболевания специфическим, по применению препаратов для неотложной помощи и обострениям. При проведении долгосрочных исследований безопасности, препарат Бримика® Дженуэйр® продемонстрировал устойчивую эффективность при приеме в течение одного года, причем тахифилаксия не наблюдалась.
Влияние на функцию легких
Прием препарата Бримика® Дженуэйр® 340 мкг/12 мкг два раза в сутки стабильно обеспечивал клинически значимые улучшения функции легких (согласно оценкам по ОФВ1, форсированной жизненной емкости легких и объему максимального вдоха) по сравнению с плацебо. В исследованиях фазы III клинически значимое бронходилатационное действие наблюдалось в течение 5 минут после приема первой дозы и продолжалось в течение периода между приемами лекарственного средства. Устойчивый эффект наблюдался в течение 6-месячных и годовых исследований фазы III.
ОФВ1 через 1 час после приема препарата и наименьший ОФВ1 (по сравнению с 400 мкг аклидиния и 12 мкг формотерола, соответственно) были установлены как комбинированные первичные конечные точки в обоих 6-месячных опорных исследованиях фазы III с целью продемонстрировать бронходилататорное воздействие формотерола и аклидиния в препарате Бримика® Дженуэйр®, соответственно.
В исследовании ACLIFORM-COPD препарат Бримика® Дженуэйр® показал повышение ОФВ1 через 1 час после приема препарата по сравнению с плацебо и аклидинием, 299 мл и 125 мл соответственно (для обоих p < 0,0001), а также повышение наименьшего ОФВ1 по сравнению с плацебо и формотеролом, 143 мл и 85 мл соответственно (для обоих p < 0,0001). В исследовании AUGMENT препарат Бримика® Дженуэйр® показал повышение ОФВ1 через 1 час после приема препарата по сравнению с плацебо и аклидинием, 284 мл и 108 мл (для обоих p < 0,0001) соответственно, а также повышение наименьшего ОФВ1 по сравнению с плацебо и формотеролом, 130 мл (p < 0,0001) и 45 мл (p = 0,01) соответственно.
Благоприятное воздействие на ослабление симптомов и состояние здоровья, являющееся в случае данного заболевания специфическим
Одышка и другие исходы симптоматики:
Препарат Бримика® Дженуэйр® обеспечил клинически значимое улучшение при одышке (оценка по переходному индексу диспноэ [TDI]) с улучшением показателя фокусного индекса TDI через 6 месяцев по сравнению с плацебо на 1,29 единицы в исследовании ACLIFORM-COPD (p < 0,0001) и на 1,44 единицы в исследовании AUGMENT (p < 0,0001). Процент пациентов с клинически значимыми улучшениями показателя фокусного индекса TDI (определяется как увеличение на, минимум, 1 единицу) был у принимавших препарат Бримика® Дженуэйр® выше, чем у принимавших плацебо в ACLIFORM-COPD (64,8% против 45,5%; p < 0,001) и AUGMENT (58,1% против 36,6%; p < 0,0001).
Объединенный анализ этих двух исследований показал, что препарат Бримика® Дженуэйр® способствует статистически значимому улучшению показателя фокусного индекса TDI по сравнению с аклидинием (0,4 единицы, p = 0,016) или формотеролом (0,5 единицы, p = 0,009). Кроме того, более высокий процент пациентов, принимающих препарат Бримика® Дженуэйр®, реагировали клинически значимым улучшением показателя фокусного индекса TDI по сравнению с аклидинием или формотеролом (61,9% против 55,7% и 57,0% соответственно; p = 0,056 и p = 0,100 соответственно).
Препарат Бримика® Дженуэйр® ослаблял дневные симптомы ХОБЛ, например, одышку, «грудные симптомы» (симптомы патологии со стороны дыхательных путей), кашель и отделение мокроты (при оценке по общему баллу E-RS), а также общие ночные симптомы, общие утренние симптомы и симптомы, ограничивающие утреннюю активность, по сравнению с плацебо, аклидинием и формотеролом, однако улучшение не всегда было статистически значимым. Аклидиний/формотерол статистически значимо не снижал – по сравнению с плацебо или формотеролом – среднее число ночных пробуждений, вызванных проявлениями ХОБЛ.
Качество жизни, обусловленное состоянием здоровья:
Препарат Бримика® Дженуэйр® обеспечил клинически значимое улучшение качества жизни, связанное с состоянием здоровья (оценка с помощью Респираторного опросника госпиталя Св. Георгия [SGRQ]) в исследовании AUGMENT, где улучшение общего балла SGRQ по сравнению с плацебо составило -4,35 единиц (p < 0,0001). Процент пациентов в исследовании AUGMENT, у которых наблюдалось клинически значимое улучшение по сравнению с исходными значениями общего балла SGRQ (определяется как увеличение на, минимум, 4 единицы), был выше среди получавших препарат Бримика® Дженуэйр®, чем у получавших плацебо (58,2% против 38,7% соответственно; p < 0,0001). В исследовании ACLIFORM-COPD наблюдалось небольшое снижение общего балла SGRQ по сравнению с плацебо по причине неожиданно выраженной реакции на плацебо (p = 0,598), процент пациентов, достигших клинически значимого улучшения по сравнению с исходными значениями, составил 55,3% в отношении препарата Бримика® Дженуэйр® и 53,2% в отношении плацебо (p = 0,669).
В объединенном анализе этих двух исследований было продемонстрировано, что препарат Бримика® Дженуэйр® способствует значительному улучшению общего балла SGRQ по сравнению с формотеролом (‑1,7 единицы; p = 0,018) или аклидинием (-0,79 единицы; p = 0,273). Кроме того, у более высокого процента пациентов, принимающих препарат Бримика® Дженуэйр®, имело место клинически значимое улучшение общего балла SGRQ по сравнению с аклидинием и формотеролом (56,6% против 53,9% и 52,2% соответственно; p = 0,603 и p = 0,270 соответственно).
Снижение частоты обострений ХОБЛ
Пуловый анализ эффективности двух 6-месячных исследований фазы III продемонстрировал значительное (на 29%) снижение частоты умеренных или тяжелых обострений (требующих лечения антибиотиками или кортикостероидами, или заканчивающихся госпитализацией) при приеме препарата Бримика® Дженуэйр® по сравнению с плацебо (частота на пациента в год: 0,29 против 0,42 соответственно; p = 0,036).
Дополнительно препарат Бримика® Дженуэйр® способствовал отсрочке времени первого умеренного или тяжелого обострения по сравнению с плацебо (отношение рисков = 0,70; p = 0,027).
Необходимость в препарате для неотложной помощи
Препарат Бримика® Дженуэйр® в течение 6 месяцев снизил необходимость в препарате для неотложной помощи по сравнению с плацебо (на 0,9 вдыханий в сутки [p < 0,0001]), аклидинием (на 0,4 дыханий в сутки [p < 0,001]) и формотеролом (на 0,2 дыханий в сутки [p = 0,062]).
Пациенты педиатрического профиля
Европейское медицинское агентство отказалось от обязательства предоставлять результаты исследований лекарственного препарата Бримика® Дженуэйр® во всех подгруппах педиатрического профиля, страдающих ХОБЛ (см. раздел «Способ применения и дозы», информация применении в педиатрии).
Доклинические данные по безопасности
В неклинических данных по безопасности, основанных на традиционных фармакологических исследованиях безопасности, токсичности при многократном применении, генотоксичности, канцерогенного действия и токсичности в отношении органов репродукции какого-либо особого риска, связанного с применением аклидиния и формотерола, для человека не обнаружено.
Эффекты аклидиния в неклинических исследованиях токсичности в отношении органов репродукции (фетотоксические эффекты) и фертильности (небольшое снижение частоты зачатий, количества желтых тел, пре- и постимплантационные потери) наблюдали только при воздействии, существенно превышающем максимальную экспозицию для человека, что указывает на небольшую значимость этих эффектов для клинического применения.
В испытаниях с формотеролом, при высоких уровнях системной экспозиции веществу, была выявлена сниженная фертильность (постимплантационные потери) у крыс, а также пониженные постнатальная выживаемость и средняя масса при рождении. Незначительное повышение частоты развития лейомиомы матки наблюдалось у крыс и мышей; этот эффект считается эффектом, присущим этому классу грызунов при длительной экспозиции β2-адреномиметикам в высоких дозах.
Неклинические исследования, в которых изучалось воздействие аклидиния/формотерола на сердечно-сосудистые параметры, продемонстрировали повышенную частоту сердечных сокращений и аритмию при воздействии существенно превышающем максимальную экспозицию для человека, что указывает на небольшую значимость этих эффектов для клинического применения. Эти эффекты представляют собой известные чрезмерные фармакологические реакции на β2-адреномиметики.
Аклидиния бромид + Формотерол
Aclidinium bromide + Formoterol
Фармакологическое действие
Комбинация Аклидиния бромид + Формотерол содержит два бронходилататора: аклидиния бромид — антагонист мускариновых рецепторов длительного действия (также называемый антихолинергик) и формотерол — агонист β2-адренергических рецепторов длительного действия. Комбинация этих веществ с разными механизмами действия обеспечивает аддитивный эффект по сравнению с применением отдельных компонентов. Вследствие различия плотности мускариновых и β2-адренорецепторов в центральных и периферических дыхательных путях антагонисты мускариновых рецепторов более эффективны в расслаблении центральных дыхательных путей, а агонисты β2-адренергических рецепторов — периферических дыхательных путей, таким образом применение комбинированной терапии может усиливать благоприятное воздействие на функцию лёгких.
Аклидиния бромид является конкурентным, селективным антагонистом мускариновых рецепторов с более длительным временем связывания с М3-рецепторами, чем с М2-рецепторами. М3-рецепторы служат посредниками при сокращении гладкой мускулатуры дыхательных путей. Вдыхаемый аклидиния бромид действует местно в лёгких в качестве антагониста М3-рецепторов гладкой мускулатуры дыхательных путей и вызывает бронходилатацию. Применение аклидиния бромида у пациентов с хронической обструктивной болезнью лёгких вызывает также снижение выраженности симптомов, улучшение связанного с заболеванием состояния здоровья, снижение частоты обострений и улучшение переносимости физической нагрузки. Поскольку аклидиния бромид быстро разрушается в плазме крови, количество системных антихолинергических побочных эффектов является низким.
Формотерол является мощным селективным агонистом β2-адренорецепторов. Бронходилатация достигается за счёт расслабления гладкой мускулатуры дыхательных путей вследствие повышения уровня цАМФ после активации аденилатциклазы. Помимо улучшения функции лёгких, формотерол уменьшает выраженность симптомов и повышает качество жизни у пациентов с хронической обструктивной болезнью лёгких.
Фармакодинамика
Клинические исследования показали, что комбинация Аклидиния бромид + Формотерол обеспечивает клинически значимое улучшение функции лёгких (оцениваемое по ОФВ за 1 с (OФВ1) в течение более 12 часов после применения.
Комбинация Аклидиния бромид + Формотерол обладает быстрым началом действия — в течение 5 минут после первой ингаляции по сравнению с плацебо. Начало действия комбинации Аклидиния бромид + Формотерол было сравнимо с эффектом быстродействующего агониста β2-адренорецепторов формотерола в дозе 12 мкг. Максимальная бронходилатация (максимальный ОФВ1) по сравнению с исходным уровнем достигалась с первого дня (304 мл) и поддерживалась в течение всего периода терапии длительностью более 6 месяцев (326 мл).
Электрофизиология сердца
Не было выявлено клинически значимое влияние комбинации Аклидиния бромид + Формотерол на параметры ЭКГ, включая интервал QT, по сравнению с аклидиния бромидом, формотеролом и плацебо, а также на сердечный ритм при проведении суточного мониторирования по Холтеру.
Клиническая эффективность
Программа клинических исследований III фазы с участием приблизительно 4 000 пациентов с клиническим диагнозом хроническая обструктивная болезнь лёгких средней или тяжёлой степени включала два 6-месячных рандомизированных исследования с плацебо и активным контролем (ACLIFORM-COPD и AUGMENT), 6-месячную продлённую фазу исследования AUGMENT, а также дополнительное 12-месячное рандомизированное контролируемое исследование.
В долгосрочных исследованиях безопасности комбинация Аклидиния бромид + Формотерол показала стойкую эффективность без признаков тахифилаксии при длительности применения более 1 года.
Влияние на функцию лёгких
Комбинация Аклидиния бромид + Формотерол (340 + 11,8 мкг/доза 2 раза в сутки) обеспечивала клинически значимое улучшение функции лёгких (оценка по ОФВ1, форсированной жизненной ёмкости лёгких и ёмкости вдоха) по сравнению с плацебо. Клинически значимый бронходилатирующий эффект достигался в течение 5 минут после применения первой дозы и поддерживался в течение всего междозового интервала.
В исследовании ACLIFORM-COPD комбинация Аклидиния бромид + Формотерол обеспечивала улучшение OФВ1 через 1 час после применения по сравнению с плацебо и аклидиния бромидом 299 и 125 мл соответственно (р <0,0001 в обоих сравнениях) и улучшение остаточного ОФВ1 по сравнению с плацебо и формотеролом 143 и 85 мл соответственно (р <0,0001 в обоих сравнениях). В исследовании AUGMENT улучшение ОФВ1 через 1 час после применения по сравнению с плацебо и аклидиния бромидом составило 284 и 108 мл соответственно (р <0,0001 в обоих сравнениях), а улучшение остаточного ОФВ1 по сравнению с плацебо и формотеролом — 130 (р <0,0001) и 45 мл (р = 0,01) соответственно.
Облегчение симптомов и улучшение состояния здоровья, обусловленного заболеванием
Одышка и другие симптомы
Комбинация Аклидиния бромид + Формотерол обеспечивала клинически значимое улучшение в отношении одышки (оценивалось с помощью транзиторного индекса одышки (TDI) с повышением индекса TDI через 6 месяцев терапии по сравнению с плацебо на 1,29 единицы в исследовании ACLIFORM-COPD (р <0,0001) и на 1,44 единицы — в исследовании AUGMENT (р<0,0001).
Объединенный анализ этих двух исследований показал, что применение комбинации Аклидиния бромид + Формотерол ассоциируется со статистически значимым бóльшим улучшением индекса TDI по сравнению с аклидиния бромидом (на 0,4 единицы; р = 0,016) или формотеролом (на 0,5 единицы; р = 0,009).
Комбинация Аклидиния бромид + Формотерол улучшала дневную симптоматику хронической обструктивной болезни лёгких, в частности одышку, симптомы со стороны грудной клетки, кашель и отделение мокроты (оценивалась с помощью общего индекса E-RS), а также общую выраженность ночных симптомов, ранних утренних симптомов и симптомов, ограничивающих активность в ранние утренние часы, по сравнению с плацебо, аклидиния бромидом и формотеролом, однако данное улучшение не всегда было статистически значимым. Комбинация Аклидиния бромид + Формотерол не показала статистически значимого снижения среднего количества ночных пробуждений, обусловленных ХОБЛ, по сравнению с плацебо или формотеролом.
Качество жизни, обусловленное состоянием здоровья
В исследовании AUGMENT комбинация Аклидиния бромид + Формотерол обеспечивала статистически значимое улучшение состояния здоровья, обусловленного заболеванием (оценивалось с помощью Респираторного опросника больницы Святого Георгия (SGRQ), с улучшением общего индекса SGRQ на −4,35 единицы по сравнению с плацебо (р <0,0001). В исследовании ACLIFORM-COPD наблюдалось лишь небольшое снижение общего индекса SGRQ по сравнению с плацебо вследствие неожиданно выраженного ответа на терапию плацебо (р = 0,598), и процент пациентов, достигших клинически значимого улучшения относительно исходного уровня, составил 55,3 % в группе комбинация Аклидиния бромид + Формотерол и 53,2 % в группе плацебо (р = 0,669).
Объединённый анализ данных этих двух исследований показал большее улучшение общего индекса SGRQ при применении комбинации Аклидиния бромид + Формотерол по сравнению с формотеролом (−1,7 единиц; р = 0,018) или аклидиния бромидом (−0,79 единиц; р = 0,273).
Снижение частоты обострений хронической обструктивной болезни лёгких
В рамках объединённого анализа эффективности двух исследований длительностью 6 месяцев было продемонстрировано статистически значимое снижение на 29 % частоты обострений средней или тяжёлой степени (требующие терапии антибиотиками или кортикостероидами или приводящие к госпитализации) на фоне терапии комбинацией Аклидиния бромид + Формотерол по сравнению с плацебо (частота на пациента в год — 0,29 против 0,42 соответственно; р = 0,036), а также увеличение времени до первого обострения средней или тяжёлой степени по сравнению с плацебо (соотношение рисков 0,7; р = 0,027).
Применение средств экстренной терапии
Комбинация Аклидиния бромид + Формотерол снижала потребность в средстве экстренной терапии на протяжении более 6 месяцев по сравнению с плацебо (на 0,9 ингаляций/сутки (р<0,0001), аклидиния бромидом (на 0,4 ингалиции/сутки (p <0,001) и формотеролом (на 0,2 ингаляции/сутки (р = 0,062).
Фармакокинетика
Параметры фармакокинетики аклидиния бромида и формотерола при ингаляционном применении в комбинации существенно не отличались от наблюдаемых при применении отдельных компонентов.
Абсорбция
После однократной ингаляции комбинации Аклидиния бромид + Формотерол аклидиния бромид и формотерол быстро абсорбировались в плазму крови с достижением максимальной плазменной концентрации (Cmax) в течение 5 минут у здоровых добровольцев и в течение 24 минут у пациентов с хронической обструктивной болезнью лёгких. Максимальные Css аклидиния бромида и формотерола у пациентов с хронической обструктивной болезнью лёгких, получавших комбинацию Аклидиния бромид + Формотерол 2 раза в сутки в течение 5 дней, достигались в течение 5 минут после ингаляции и составляли 128 и 17 пг/мл соответственно.
Распределение
Общее количество попадающего в лёгкие после ингаляции аклидиния бромида составило приблизительно 30 % отмеренной дозы. Связывание аклидиния с белками плазмы in vitro вероятнее всего соответствует связыванию метаболитов с белками вследствие быстрого гидролиза аклидиния бромида в плазме крови. Связывание с белками плазмы крови составило 87 % для производного карбоновой кислоты и 15 % для спиртового производного. Основным белком плазмы крови, который связывает аклидиния бромид, является альбумин.
Связывание формотерола с белками плазмы крови составляет 61–64 % (34 % — преимущественно с альбумином). Не отмечено насыщение центров связывания в диапазоне концентраций, достигающихся при применении комбинации Аклидиния бромид + Формотерол в терапевтических дозах.
Биотрансформация
Аклидиния бромид быстро и интенсивно гидролизуется до фармакологически неактивных спиртового производного и производного карбоновой кислоты. Происходит химический (неферментативный) и ферментативный гидролиз под действием эстераз. Основной эстеразой, вовлечённой в гидролиз у человека, является бутирилхолинэстераза. Концентрация кислотного метаболита в плазме крови после ингаляции приблизительно в 100 раз выше, чем концентрация спиртового метаболита и неизменённого активного вещества.
Низкая абсолютная биодоступность аклидиния бромида при ингаляционном введении (<5 %) обусловлена его интенсивным системным и пресистемным гидролизом как при нахождении в лёгких, так и при приёме внутрь. Биотрансформация с участием изоферментов цитохрома CYP450 играет незначительную роль в общем метаболическом клиренсе аклидиния бромида. Исследования in vitro показали, что аклидиний в терапевтической дозе или его метаболиты не ингибируют и не индуцируют какие-либо изоферменты CYP450 и не ингибируют эстеразы (карбоксилэстеразу, ацетилхолинэстеразу и бутирилхолинэстеразу). Также in vitro установлено, что аклидиния бромид или его метаболиты не являются субстратами или ингибиторами Р-gp.
Формотерол выводится преимущественно посредством метаболизма. Основным путём является прямая глюкуронизация с О-деметилированием и последующей конъюгацией с глюкуронидом. В О-деметилировании формотерола участвуют изоферменты CYP2D6, CYP2C19, CYP2C9 и CYP2A6. В терапевтически значимых концентрациях формотерол не ингибирует изоферменты CYP450.
Выведение
После ингаляции комбинации Аклидиния бромид + Формотерол в дозе 340 + 11,8 мкг конечный период полувыведения (T½) аклидиния бромида и формотерола составляет приблизительно 5 и 8 часов соответственно.
После внутривенного введения 400 мкг меченого радиоактивным изотопом аклидиния здоровым добровольцам около 1 % введённой дозы выводилось в неизменённом виде с мочой. До 65 % дозы выводилось в виде метаболитов с мочой и до 33 % — в виде метаболитов с фекалиями. После ингаляции 200 и 400 мкг аклидиния бромида здоровыми добровольцами и пациентами с хронической обструктивной болезнью лёгких выведение неизменённого аклидиния с мочой было очень низким (приблизительно 0,1 % введённой дозы), что свидетельствует о том, что почечный клиренс играет незначительную роль в общем клиренсе аклидиния бромида из плазмы крови.
Основная часть введённой дозы формотерола подвергалась метаболизму в печени с последующим выведением почками. После ингаляции 6–9 % доставленной дозы формотерола выводилось с мочой в неизменённом виде или в виде конъюгатов формотерола.
Особые группы пациентов
Пожилой возраст
Исследования фармакокинетики комбинации Аклидиния бромид + Формотерол у пациентов пожилого возраста не проводились. Поскольку пожилым пациентам не требуется коррекция дозы аклидиния бромида или формотерола в режиме монотерапии, при применении комбинации Аклидиния бромид + Формотерол корректировать дозу также не требуется.
Нарушение функции почек и печени
Данные об особенностях применения комбинации Аклидиния бромид + Формотерол у пациентов с нарушением функции почек или печени отсутствуют. Поскольку у пациентов с нарушением функции ночек или печени не требуется коррекция дозы аклидиния бромида или формотерола в режиме монотерапии, при применении комбинации аклидиния/формотерола корректировать дозу также не требуется.
Показания
Поддерживающая бронходилатирующая терапия с целью облегчения симптомов хронической обструктивной болезни лёгких у взрослых.
Противопоказания
Повышенная чувствительность к компонентам комбинации; возраст до 18 лет.
С осторожностью
Инфаркт миокарда, перенесённый в течение предшествующих 6 месяцев; нестабильная стенокардия; впервые выявленная аритмия в течение предшествующих 3 месяцев; госпитализация в течение предшествующих 12 месяцев по поводу сердечной недостаточности III и IV функциональных классов по классификации NYHA или другие тяжёлые сердечно-сосудистые заболевания; интервал QTc (по методу Базетта) >470 мс; сопутствующая терапия препаратами, удлиняющими интервал QTc; судорожные расстройства; тиреотоксикоз; феохромоцитома; симптоматическая гиперплазия предстательной железы; задержка мочи; закрытоугольная глаукома; гипокалиемия.
Беременность и грудное вскармливание
Применение при беременности
Категория действия на плод по FDA — N (для аклидиния бромида — C, для формотерола — C).
Данные о применении комбинации Аклидиния бромид + Формотерол у беременных женщин отсутствуют.
В исследованиях на животных отмечена фетотоксичность только в дозах, значительно превышающих максимальную дозу аклидиния бромида у человека и нежелательные эффекты в исследованиях репродуктивной токсичности только при очень высокой системной экспозиции формотерола.
Во время беременности комбинацию Аклидиния бромид + Формотерол следует применять только в тех случаях, когда ожидаемая польза превосходит потенциальные риски.
Применение в период грудного вскармливания
Неизвестно, выделяется ли аклидиния бромид (и/или его метаболиты) или формотерол с грудным молоком. Поскольку доклинические исследования показали, что небольшие количества аклидиния бромида (и/или его метаболиты) и формотерола проникают в молоко, в период грудного вскармливания комбинацию Аклидиния бромид + Формотерол следует применять только в случаях, когда ожидаемая польза для женщины превосходит потенциальный риск для младенца.
Фертильность
Доклинические исследования выявили небольшое снижение фертильности только при применении в дозах, значительно превышающих максимальные дозы аклидиния бромида и формотерола у человека. Считается маловероятным, что применение комбинации Аклидиния бромид + Формотерол в рекомендуемой дозе будет влиять на фертильность у человека.
Способ применения и дозы
Ингаляционно.
Побочные действия
Представленные ниже сведения по безопасности основаны на опыте применения комбинации Аклидиния бромид + Формотерол (в рекомендуемой терапевтической дозе до 12 месяцев) и её отдельных компонентов.
Обзор профиля безопасности
Нежелательные реакции, связанные с применением комбинации Аклидиния бромид + Формотерол, схожи с наблюдавшимися при применении его отдельных компонентов. Поскольку эта комбинация содержит аклидиния бромид и формотерол, то на фоне её применения можно ожидать нежелательные реакции, описанные для этих компонентов.
Наиболее часто отмечавшимися нежелательными реакциями при применении комбинации Аклидиния бромид + Формотерол являлись назофарингит (7,9 %) и головная боль (6,8 %).
Частота нежелательных реакций основана на оценке общих коэффициентов возникновения реакций, наблюдаемых при применении комбинации Аклидиния бромид + Формотерол в дозе 340 + 11,8 мкг в рамках объединённого анализа рандомизированных плацебо-контролируемых клинических исследований III фазы длительностью не менее 6 месяцев.
Частота нежелательных реакций представлена с использованием следующих обозначений: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1 000, <1 /100); редко (≥1/10 000, <1/1 000); очень редко (<1/10 000) и частота неизвестна (невозможно оценить по доступным данным).
Инфекционные и паразитарные заболевания
Часто — назофарингит1, инфекция мочевыводящих путей2, синусит3, абсцесс зуба2.
Со стороны иммунной системы
Редко — гиперчувствительность4; частота неизвестна — ангионевротический отёк4, анафилактическая реакция4.
Со стороны обмена веществ и питания
Нечасто — гипокалиемия1, гипергликемия1.
Нарушения психики
Часто — бессонница3, тревожность3; нечасто — возбуждение1.
Со стороны нервной системы
Часто — головная боль1, головокружение1, тремор3; нечасто — нарушение вкуса1.
Со стороны органа зрения
Нечасто — нечёткость зрения3.
Со стороны сердца
Нечасто — тахикардия3, удлинение интервала QTc на ЭКГ3, ощущение сердцебиения1; частота неизвестна — стенокардия4.
Со стороны дыхательной системы, органов грудной клетки и средостения
Часто — кашель1; нечасто — дисфония3, раздражение глотки1; редко — бронхоспазм, в том числе парадоксальный4.
Со стороны органов пищеварения
Часто — диарея1, тошнота1, сухость во рту3; нечасто — стоматит1.
Со стороны кожи и подкожных тканей
Нечасто — сыпь1, кожный зуд1.
Со стороны скелетно-мышечной системы и соединительной ткани
Часто — миалгия3, мышечные спазмы3.
Со стороны почек и мочевыводящих путей
Нечасто — задержка мочи1.
Общие расстройства и нарушения в месте введения
Часто — периферический отёк1.
Лабораторные и инструментальные данные
Часто — повышение активности КФК в крови2; нечасто — повышение артериального давления1.
1 Нежелательные реакции, относящиеся хотя бы к одному из отдельных компонентов, но при применении комбинации Аклидиния бромид + Формотерол в дозе 340 + 1,8 мкг наблюдавшиеся с более низкой или сопоставимой частотой, чем при применении плацебо.
2 Нежелательные реакции, наблюдавшиеся при применении комбинации Аклидиния бромид + Формотерол, но не указанные в инструкциях его отдельных компонентов.
3 Нежелательные реакции, наблюдавшиеся при применении комбинации Аклидиния бромид + Формотерол и указанные в инструкции хотя на один из её отдельных компонентов.
4 Нежелательные реакции, относящиеся хотя бы к одному из отдельных компонентов, но не наблюдавшиеся при применении комбинации Аклидиния бромид + Формотерол в дозе 340 + 11,8 мкг; категория частоты развития указана в соответствии с разделом «Побочные действия» в инструкциях отдельных компонентов.
Передозировка
Опыт лечения передозировки комбинации Аклидиния бромид + Формотерол ограничен.
Симптомы
Высокие дозы этой комбинации могут приводить к усилению симптомов и проявлений антихолинергического и/или β2-адренергического действия, наиболее частыми из которых являются нечёткость зрения, сухость во рту, тошнота, мышечный спазм, тремор, головная боль, ощущение сердцебиения и артериальная гипертензия.
Лечение
В случае передозировки следует прекратить применение комбинации Аклидиния бромид + Формотерол. Показана поддерживающая и симптоматическая терапия.
Взаимодействие
Лекарственные средства для лечения хронической обструктивной болезни лёгких
Совместное применение комбинации Аклидиния бромид + Формотерол с другими антихолинергическими средствами и/или агонистами β2-адренергических рецепторов длительного действия не изучалось и не рекомендуется.
Хотя формальных исследований лекарственных взаимодействий комбинации Аклидиния бромид + Формотерол in vivo не проводилось, она применялась одновременно с другими препаратами для терапии хронической обструктивной болезни лёгких, включая агонисты β2-адренергических рецепторов короткого действия, метилксантины, а также пероральные и ингаляционные глюкокортикостероиды, без клинических признаков лекарственного взаимодействия.
Метаболические взаимодействия
В исследованиях in vitro было установлено, что не ожидается взаимодействие аклидиния в терапевтической дозе или его метаболитов с субстратами P-gp и Лекарственные средства, метаболизируемыми изоферментами CYP450 и эстеразами. В терапевтически значимых концентрациях формотерол не ингибирует изоферменты CYP450.
Лекарственные средства, вызывающие гипокалиемию
Сопутствующее применение производных метилксантина, стероидов или калийнесберегающих диуретиков может усиливать возможный гипокалиемический эффект агонистов β2-адренорецепторов, поэтому следует соблюдать осторожность при их совместном применении (см. раздел «Особые указания»).
Блокаторы β2-адренергических рецепторов
Блокаторы β-адренергических рецепторов могут ослаблять или нивелировать эффект агонистов β2-адренергических рецепторов. При необходимости применения блокаторов β-адренергических рецепторов (в том числе в виде глазных капель) предпочтительнее назначение кардиоселективных блокаторов β-адренергических рецепторов, хотя и они должны применяться с осторожностью.
Другие фармакодинамические взаимодействия
Следует с осторожностью применять комбинацию Аклидиния бромид + Формотерол у пациентов, получающих препараты, удлиняющие интервал QTc, такие как ингибиторы МАО, трициклические антидепрессанты, антигистаминные средства или макролиды, поскольку они могут потенцировать влияние формотерола на сердечно-сосудистую систему. Лекарственные средства, удлиняющие интервал QTc, повышают риск развития желудочковой аритмии.
Особые указания
Бронхиальная астма
Комбинация Аклидиния бромид + Формотерол не должна применяться при бронхиальной астме, клинические исследования этой комбинации при бронхиальной астме не проводились.
Парадоксальный бронхоспазм
В клинических исследованиях не отмечены случаи парадоксального бронхоспазма на фоне применения комбинации Аклидиния бромид + Формотерол в рекомендуемой дозе. Однако парадоксальный бронхоспазм наблюдали при проведении другой ингаляционной терапии. В случае его возникновения следует прекратить применение и рассмотреть возможность альтернативной терапии.
Комбинация Аклидиния бромид + Формотерол не предназначена для купирования острых приступов бронхоспазма.
Влияние на сердечно-сосудистую систему
Комбинацию Аклидиния бромид + Формотерол следует применять с осторожностью у пациентов, перенёсших инфаркт миокарда в течение предшествующих 6 месяцев, с нестабильной стенокардией, впервые выявленной аритмией в течение предшествующих 3 месяца, с интервалом QTc (рассчитанным по методу Базетта) >470 мс или госпитализировавшихся в течение предшествующих 12 месяцев по поводу сердечной недостаточности III и IV функциональных классов по классификации NYHA, поскольку эти пациенты не включались в клинические исследования.
У отдельных пациентов агонисты β2-адренорецепторов могут вызывать повышение частоты пульса и артериального давления, изменения на ЭКГ в виде уплощения зубца T, депрессии сегмента ST и удлинения интервала QTc. В случае развития данных эффектов может потребоваться досрочное прекращение терапии. Агонисты β2-адренорецепторов длительного действия следует применять с осторожностью у пациентов с удлинением интервала QTc в настоящее время или в анамнезе либо получающих препараты, влияющие на длительность интервала QTc (см. раздел «Взаимодействие»).
Системные эффекты
Комбинацию Аклидиния бромид + Формотерол следует применять с осторожностью у пациентов с тяжёлыми нарушениями со стороны сердечно-сосудистой системы, судорожными расстройствами, тиреотоксикозом и феохромоцитомой.
При применении высоких доз агонистов β2-адренорецепторов возможно развитие метаболических эффектов в виде гипергликемии и гипокалиемии. В клинических исследованиях III фазы частота значимого повышения концентрации глюкозы в крови на фоне применения комбинации Аклидиния бромид + Формотерол была низкой (0,1 %) и схожей с группой плацебо. Гипокалиемия обычно транзиторная и не требует дополнительной терапии. У пациентов с тяжёлой хронической обструктивной болезнью лёгких гипокалиемия может потенцироваться гипоксией и сопутствующей терапией (см. раздел «Взаимодействие»). Гипокалиемия может увеличить риск развития аритмии.
Вследствие антихолинергической активности комбинацию Аклидиния бромид + Формотерол следует применять с осторожностью при симптоматической гиперплазии предстательной железы, задержке мочи или закрытоугольной глаукоме (несмотря на то что непосредственный контакт с глазами очень маловероятен). Сухость во рту, отмечавшаяся на фоне антихолинергической терапии, при сохранении в течение длительного времени может привести к кариесу зубов.
Влияние на способность к вождению автотранспорта и управлению механизмами
Применение комбинации Аклидиния бромид + Формотерол не влияет или в незначительной степени влияет на способность управлять транспортом и работать с механизмами. Развитие нечёткости зрения или головокружения может оказать влияние на способность к управлению транспортными средствами или работе с механизмами.
Спортивная медицина
Формотерол, входящий в состав комбинации, может стать причиной нарушений антидопинговых правил и положительного результата при проведении допинг-контроля. За исключением ингаляций формотерола: максимальная доставляемая доза 54 мкг в течение 24 часов.
Формотерол относится к запрещённым WADA бета-2 агонистам.
Присутствие в моче формотерола в концентрации, превышающей 40 нг/мл не соответствует терапевтическому использованию и будет рассматриваться в качестве неблагоприятного результата анализа (AAF), если только спортсмен с помощью контролируемого фармакокинетического исследования не докажет, что не соответствующий норме результат явился следствием ингаляции терапевтических доз, не превышающих вышеуказанный максимум.
Глоссарий
| Термин | Описание |
|---|---|
| WADA | Всемирное антидопинговое агентство |
Классификация
-
Фармакологические группы
-
Коды МКБ 10
-
Категория при беременности по FDA
N
(не классифицировано FDA)
Информация о действующем веществе Аклидиния бромид + Формотерол предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Аклидиния бромид + Формотерол, содержатся в инструкции производителя, прилагаемой к упаковке.