«Амондис 45» (Amondys 45, касимерсен) — новый лекарственный препарат, предназначенный для лечения мышечной дистрофии Дюшенна у пациентов с подтвержденной мутацией гена дистрофина (DMD), подходящей для терапевтического пропуска экзона 45.
«Амондис 45», разработанный «Сарепта терапьютикс» (Sarepta Therapeutics), одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в условном порядке, то есть препарату еще предстоит подтвердить свою терапевтическую эффективность.
Цена «Амондиса 45» по прейскуранту для американских пациентов выставлена в 300 тыс. долларов в год (при массе тела 20 кг).
«Амондис 45» стал третьим лекарственным средством, подготовленным «Сарепта» для борьбы с мышечной дистрофией Дюшенна. Так, в сентябре 2016 года появился «Эксондис 51» (Exondys 51, этеплирсен), ориентирующийся на пациентов, заболевание которых пригодно для терапии путем пропуска экзона 51. В декабре 2019 года вышел «Виондис 53» (Vyondys 53, голодирсен), нацеленный на пропуск экзона 53.
В августе 2020 года свет увидел «Вилтепсо» (Viltepso, вилтоларсен) — прямой конкурент «Виондису 53», созданный «Эн-эс фарма» (NS Pharma) в составе японской «Ниппон Синяку» (Nippon Shinyaku).
Мышечная дистрофия Дюшенна является X-сцепленным рецессивным генетическим заболевание, приводящим к недостаточной активности дистрофина — белка, участвующего в связывании цитоскелета с внеклеточным матриксом.
Дистрофин расположен на цитоплазматической поверхности плазматической мембраны мышечных волокон и входит в состав крупного многокомпонентного гликопротеинового комплекса. Дистрофин обеспечивает механическое усиление сарколеммы и стабилизирует комплекс, защищая его от разрушения протеазами, чего патологически не происходит при отсутствии или сниженной экспрессии дистрофина. Потеря мембранных белков может привести к дегенерации мышечных волокон.
Итогом дистрофинопатии становятся прогрессирующая слабость проксимальных мышц, кардиомиопатия, дыхательная недостаточность. Болезнь проявляется обычно в возрасте 2–5 лет. Пациенты оказываются прикованными к инвалидному креслу до наступления, как правило, 13-летнего возраста. Мышечная дистрофия Дюшенна поражает только лиц мужского пола, распространенность составляет 1,7–4,2 случая на 100 тыс. Если миодистрофию Дюшенна оставлять без какого-либо лечения, смерть наступает к 20-летнему возрасту — по причине сердечной или дыхательной недостаточности.
Ген дистрофина (DMD), самый длинный ген в организме человека, представлен 79 экзонами и состоит из 2,4 млн пар нуклеотидов. Известно свыше 5 тыс. патогенных вариантов дистрофина, при этом 60–70% патогенных мутаций гена приходится на делеции экзонов и 5–10% — на дупликации экзонов.
Касимерсен (casimersen, SRP-4045), равно как этеплирсен (eteplirsen), голодирсен (golodirsen) и вилтоларсен (viltolarsen), представляет собой фосфородиамидатный морфолиновый антисмысловой олигонуклеотид.
Касимерсен, будучи структурным аналогом ДНК, связывается с экзоном 45 пре-мРНК дистрофина, реализуя его альтернативный сплайсинг за счет пропуска в ходе процессинга мРНК и тем самым (посредством восстановления рамки считывания) обеспечивая синтез внутренне усеченного, но функционального дистрофина. Выработка последнего восполняет критическую недостаточность этого белка при мышечной дистрофии Дюшенна. Заболевание переходит в менее тяжелую форму дистрофинопатии, фенотипически подобную на мышечную дистрофию Беккера.
Касимерсен способен изменить течение мышечной дистрофии Дюшенна в том случае, если заболевание поддается коррекции путем пропуска экзона 45. Речь идет о пациентах, ген дистрофина которых характеризуется делециями в экзонах 7–44, 12–44, 18–44, 44, 46, 46–47, 46–48, 46–49, 46–51, 46–53, 46–55, 46–57, 46–59, 46–60, 46–67, 46–69, 46–75, 46–78.
«Амондис 45» охватит приблизительно 8% больных с мышечной дистрофией Дюшенна. Если учитывать два предшествовавших лекарственных препарата «Сарепта» — «Эксондис 51» и «Виондис 53», терапия этого генетического заболевания уже может быть организована для 30% пациентов.
Подробно о механизме действия антисмысловых олигонуклеотидов рассказано в материале «„Эксондис 51“: лекарство против мышечной дистрофии Дюшенна».
«Амондис 45»: эффективность касимерсена в лечении мышечной дистрофии Дюшенна
Эффективность касимерсена была изучена в продолжающемся клиническом исследовании ESSENCE (NCT02500381) фазы III (рандомизированном, двойном слепом, плацебо-контролируемом, многоцентровом, международном) среди мальчиков в возрасте 7–13 лет с мышечной дистрофией Дюшенна с подтвержденной делецией гена дистрофина, подходящей для терапевтического пропуска экзона 45.
Среди основных критериев включения в исследование:
- стабильная доза пероральных кортикостероидов на протяжении минимум 6 месяцев;
- незатронутые болезнью правый и левый бицепсы либо две других мышечных группы пояса верхних конечностей;
- способность к прохождению дистанции 300–450 м в 6-минутном тесте (6MWT);
- стабильная легочная функция: форсированная жизненная емкость легких (FVC) не менее чем 50% от прогнозируемой.
Участники еженедельно получали внутривенные вливания плацебо или «Амондис 45» в дозе 30 мг/кг.
По прошествии 48 недель были сняты промежуточные результаты, охватившие 16 пациентов в группе плацебо и 27 пациентов в группе касимерсена.
Эффективность «Амондиса 45» определялась путем оценки изменения уровня белка дистрофина в процентах от такового у здоровых людей. Согласно вестерн-блоттингу мышечных биоптатов бицепсов, данный усредненный показатель в группе касимерсена вырос с исходных 0,93% до 1,74% (разница 0,81%; p<0,001) — против прибавки с 0,54% до 0,76% (разница 0,22%; p=0,09) в контрольной группе. Расхождение между группами составило усредненных 0,59% (p=0,004).
Среди пациентов группы касимерсена, биоптаты которых были протестированны полимеразной цепной реакцией с обратной транскрипцией (RT-PCR) на содержание мРНК с пропуском экзона 45 (n=22/27), у всех продемонстрирован соответствующий рост таковой, что позволяет говорить о 100-процентном ответе на лечение.
Отмечена статистически значимая положительная корреляция между пропуском экзона 45 и выработкой дистрофина: коэффициент ранговой корреляции Спирмена 0,635 (p<0,001).
«Амондис 45»: безопасность касимерсена в лечении мышечной дистрофии Дюшенна
Исследования на самцах мышей и крыс засвидетельствовали почечную токсичность касимерсена, проявившуюся дегенерацией почечных канальцев. И хотя испытания на людях не отметились ничем таким подобным, необходимо принимать во внимание, что в ходе изучения некоторых других антисмысловых олигонуклеотидов пациенты сталкивались с почечной токсичностью, включая потенциально летальный гломерулонефрит. Потому терапия «Амондисом 45» должна сопровождаться мониторингом функции почек.
Среди наиболее частых побочных реакций на назначение касимерсена: инфекции верхних дыхательных путей (у 65% пациентов — против 55% в группе плацебо), кашель (33% против 26%), лихорадочное состояние (33% против 23%), головная боль (32% против 19%), суставная боль (21% против 10%), боль в ротоглотке (21% против 7%).
Мышечная дистрофия Дюшенна: вопросы к терапии антисмысловыми олигонуклеотидами
«Амондис 45» — по аналогии с «Эксондисом 51», «Виондисом 53» и «Вилтепсо» — регуляторное одобрение получил условно: на базе суррогатной конечной точки. Четверка этих лекарственных средств обеспечила статистически значимый рост уровня белка дистрофина в скелетных мышцах, что с приемлемой вероятностью позволяет прогнозировать клиническую пользу для пациентов. FDA вынесло положительные вердикты ввиду жизнеугрожающей и инвалидизирующей природы мышечной дистрофии Дюшенна, надежной и высокоэффективной специфической терапии которой по-прежнему не предложено.
По мнению отраслевых экспертов, клинически значимой эффективностью любой терапии мышечной дистрофии Дюшенна является выход на синтез дистрофина de novo до не менее чем 10% от его нормального образования в здоровом организме. Даром что ли «Эксондис 51», обеспечивший подъем уровень дистрофина до всего лишь 0,44% после 48-недельного курса лечения, некоторые критики назвали «изящным с научной точки зрения плацебо».
К слову, Европейское агентство по лекарственным средствам (EMA) отказалось одобрять «Эксондис 51», ссылаясь на отсутствие должных клинических данных, которые бы подтвердили, что скромная прибавка уровня дистрофина, обеспечиваемая этеплирсеном, принесет пациентам долгосрочные положительные результаты. Возможно, регулятор поменяет свое решение, когда к 2026 году будут собраны результаты 144-недельного клинического исследования MIS51ON (NCT03992430) фазы III, проверяющего «Эксондис 51» в стандартной и повышенной вплоть до 6 раз дозе.
Продолжающееся клиническое испытание ESSENCE (NCT02500381), которое завершится к 2024 году, призвано подтвердить терапевтическую эффективность «Амондиса 45» и «Виондиса 53». По прошествии 96 и 144 недель лечения будет оценена мышечная функциональность пациентов: тестом 6MWT, способностью самостоятельно подниматься с пола, временем до потери амбулаторного статуса, амбулаторной оценкой состояния по шкале North Star (NSAA), показателем FVC. Кроме того, по истечении 96 недель терапии будет замерен уровень дистрофина в мышечных биоптатах (вестерн-блоттингом и иммуногистохимически).
Генная терапия мышечная дистрофия Дюшенна: долгая надежда
«Сарепта» продолжает разрабатывать генную терапию мышечной дистрофии Дюшенна, которая, похоже, подойдет всем больным без оглядки на мутационную подоплеку болезни. Есть надежда, что после однократной инъекции течение этого инвалидизирующего и фатального заболевания изменится кардинальным образом: пациенты не только избавятся от угрозы неминуемой смерти, но и получат шанс на более-менее полноценную самостоятельную жизнь.
Усилия «Сарепта» сосредоточены на вирус-векторной доставке в организм синтетического трансгена, кодирующего важнейшие домены белка дистрофина, критическая недостаточность которого является причиной миодистрофии Дюшенна. Поскольку аденовирусный вектор располагает ограниченной возможностью для переноса генетической информации (емкость составляет приблизительно 4,7 килобаз), он не способен транспортировать ген дистрофина, который слишком велик (2,4 мегабаз), потому вполне сойдет усеченный, но всё же функциональный вариант последнего — так называемый микродистрофин.
В начале января 2021 года «Сарепта» поделилась основными результатами продолжающегося клинического исследования NCT03769116 фазы II (рандомизированного, двойного слепого, плацебо-контролируемого, многоцентрового) генотерапевтической программы SRP-9001 (rAAVrh74.MHCK7.micro-dystrophin), охватывающего мальчиков (n=41) в возрасте 4–7 лет с мышечной дистрофией Дюшенна.
По прошествии 12 недель после однократной дозы деландистрогена моксепарвовека (delandistrogene moxeparvovec, SRP-9001) уровень экспрессии микродистрофина вышел к 28,1% (p<0,0001). Продемонстрированы также должные биологические показатели: число копий вирус-векторных геномов на ядро (1,56), пропорция (33,0%) и интенсивность окрашивания (63,7%) дистрофин-положительных мышечных волокон, снижение креатинкиназы.
По истечении 48 недель исходный общий балл NSAA в группе генной терапии увеличился на 1,7 пункта (p=0,0090) — против его роста на 0,9 пункта (p=0,1411) в группе контроля. Однако разница не оказалась статистически значимой (p=0,37).
17-компонентная оценочная шкала NSAA используется для определения функциональных моторных навыков детей с мышечной дистрофией Дюшенна и применяется для отслеживания прогрессирования заболевания и терапевтических эффектов. Шкала NSAA учитывает способности пациентов к тому, чтобы стоять, ходить, вставать со стула и пола, стоять на одной ноге, подниматься и спускаться по ступенькам, прыгать, бегать и т. п.
На фоне столь разочаровывающих известий биржевые котировки «Сарепта» потеряли сразу половину стоимости: минус 7 млрд долларов рыночной стоимости предприятия.
«Сарепта», впрочем, не расстраивается, объясняя формальный провал испытания следующим образом. Рандомизация участников была стратифицирована по возрастным группам: 4–5 и 6–7 лет. В первой группе общий балл NSAA среди прошедших генную терапию прибавил 4,3 пункта (p<0,0001) — против его роста на 1,9 пункта (p=0,0126) среди получивших плацебо. Разница в 2,5 пункта получилась статистически значимой (p=0,0172), что связано, как утверждается, с исходным функциональным статусом пациентов, который был хорошо сбалансирован между группой генной терапии и плацебо. При этом во второй группе таковой характеризовался явным расхождением: в группу плацебо фактически попали пациенты с менее тяжелой степенью выраженности миодистрофии Дюшенна, если сравнивать с больными в группе экспериментального лечения. Другими словами, терапевтический провал деландистрогена моксепарвовека среди всей популяции включенных в исследование пациентов объясняется не тем, что изучаемая генная терапия неэффективна, а ошибками с подбором испытуемых.
Как бы то ни было, клиническое испытание продолжается.
В конце декабря 2019 года «Сарепта» предоставила «Рош» (Roche) все коммерческие права на SRP-9001 за пределами США. Взамен были получены авансом 750 млн долларов наличными и 400 млн долларов акциями, обещаны дополнительные выплаты до 1,7 млрд долларов по мере прохождения регуляторных и сбытовых этапов, плюс роялти от реализации.
В генную терапию мышечной дистрофии Дюшенна также погружены «Пфайзер» (Pfizer) и «Солид байосайенсиз» (Solid Biosciences), тестирующие соответственно фордадистроген мовапарвовек (fordadistrogene movaparvovec, PF-06939926) и SGT-001.
Дополнительные материалы
Инструкция по медицинскому применению лекарственного препарата «Амондис 45» (Amondys 45, касимерсен) в США. [PDF]
Casimersen Treatment in Patients With Duchenne Muscular Dystrophy: Safety, Tolerability, and Pharmacokinetics Over 144 Weeks of Treatment (NCT02530905 Phase I/II). [PDF]
Duchenne Population Potentially Amenable to Exon Skipping. [PDF]
Micro-dystrophin SRP-9001-102. Top-line Clinical Data (Part One). [PDF]
Amondys 45 Prescribing Information
Package insert / product label
Generic name: casimersen
Dosage form: injection
Drug class: Miscellaneous uncategorized agents
J Code (medical billing code): J1426 (10 mg, injection)
Medically reviewed by Drugs.com. Last updated on Mar 1, 2023.
On This Page
- Indications and Usage
- Dosage and Administration
- Dosage Forms and Strengths
- Contraindications
- Warnings and Precautions
- Adverse Reactions/Side Effects
- Use In Specific Populations
- Description
- Clinical Pharmacology
- Nonclinical Toxicology
- Clinical Studies
- How Supplied/Storage and Handling
- Patient Counseling Information
Indications and Usage for Amondys 45
Amondys 45 is indicated for the treatment of Duchenne muscular dystrophy (DMD) in patients who have a confirmed mutation of the DMD gene that is amenable to exon 45 skipping. This indication is approved under accelerated approval based on an increase in dystrophin production in skeletal muscle observed in patients treated with Amondys 45 [see Clinical Studies (14)]. Continued approval for this indication may be contingent upon verification of a clinical benefit in confirmatory trials.
Amondys 45 Dosage and Administration
Monitoring to Assess Safety
Serum cystatin C, urine dipstick, and urine protein-to-creatinine ratio (UPCR) should be measured before starting Amondys 45. Consider measurement of glomerular filtration rate prior to initiation of Amondys 45. Monitoring for kidney toxicity during treatment is recommended. Obtain the urine sample prior to infusion of Amondys 45 or at least 48 hours after infusion [see Warnings and Precautions (5.2)].
Dosing Information
The recommended dosage of Amondys 45 is 30 milligrams per kilogram administered once weekly as a 35 to 60-minute intravenous infusion via an in-line 0.2 micron filter.
If a dose of Amondys 45 is missed, it may be administered as soon as possible after the scheduled dose.
Preparation Instructions
Amondys 45 is supplied in single-dose vials as a preservative-free concentrated solution that requires dilution prior to administration. Parenteral drug products should be inspected visually for particulate matter and discoloration prior to administration, whenever solution and container permit. Use aseptic technique.
- Calculate the total dose of Amondys 45 to be administered based on the patient’s weight and the recommended dose of 30 milligrams per kilogram. Determine the volume of Amondys 45 needed and the correct number of vials to supply the full calculated dose.
- Allow the vials to warm to room temperature. Mix the contents of each vial by gently inverting 2 or 3 times. Do not shake.
- Visually inspect each vial of Amondys 45. The solution is a clear to slightly opalescent, colorless liquid, and may contain trace amounts of small, white to off-white amorphous particles. Do not use if the solution in the vials is cloudy, discolored or contains extraneous particulate matter other than trace amounts of small, white to off-white amorphous particles.
- With a syringe fitted with a 21-gauge or smaller bore non-coring needle, withdraw the calculated volume of Amondys 45 from the appropriate number of vials. To avoid dulling the needle and fragmenting the stoppers, replace the needle periodically during preparation.
- Dilute the withdrawn Amondys 45 in 0.9% Sodium Chloride Injection, USP, to make a total volume of 100 to 150 mL. Gently invert 2 to 3 times to mix. Do not shake. Visually inspect the diluted solution. Do not use if the solution is cloudy, discolored or contains extraneous particulate matter other than trace amounts of small, white to off-white amorphous particles.
- Administer the diluted solution via an in-line 0.2 micron filter.
- Amondys 45 contains no preservatives and should be administered immediately after dilution. Complete infusion of diluted Amondys 45 within 4 hours of dilution. If immediate use is not possible the diluted product may be stored for up to 24 hours at 2 °C to 8 °C (36 °F to 46 °F). Do not freeze. Discard unused Amondys 45.
Administration Instructions
Application of a topical anesthetic cream to the infusion site prior to administration of Amondys 45 may be considered.
Amondys 45 is administered via intravenous infusion. Flush the intravenous access line with 0.9% Sodium Chloride Injection, USP, prior to and after infusion.
Infuse the diluted Amondys 45 over 35 to 60 minutes via an in-line 0.2 micron filter. Do not mix other medication with Amondys 45 or infuse other medications concomitantly via the same intravenous access with Amondys 45.
If a hypersensitivity reaction occurs, consider slowing the infusion, interrupting or discontinuing the Amondys 45 therapy [see Warning and Precautions (5.1) and Adverse Reactions (6.2)].
Dosage Forms and Strengths
Amondys 45 is a clear to slightly opalescent, colorless liquid and may contain trace amounts of small, white to off-white amorphous particles and is available as:
- Injection: 100 mg/2 mL (50 mg/ mL) solution in a single-dose vial
Contraindications
Amondys 45 is contraindicated in patients with known hypersensitivity to casimersen or to any of the inactive ingredients. Instances of hypersensitivity, including angioedema and anaphylaxis, have occurred in patients receiving Amondys 45 [see Warnings and Precautions (5.1)].
Warnings and Precautions
5.1 Hypersensitivity Reactions
Hypersensitivity reactions, including angioedema and anaphylaxis, have occurred in patients who were treated with Amondys 45. If a hypersensitivity reaction occurs, institute appropriate medical treatment, and consider slowing the infusion [see Dosage and Administration (2.4)], interrupting, or discontinuing the Amondys 45 infusion and monitor until the condition resolves [see Contraindications (4)].
Kidney Toxicity
Kidney toxicity was observed in animals who received casimersen [see Use in Specific Populations (8.4) and Nonclinical Toxicology (13.2)]. Although kidney toxicity was not observed in the clinical studies with Amondys 45, kidney toxicity, including potentially fatal glomerulonephritis, has been observed after administration of some antisense oligonucleotides. Kidney function should be monitored in patients taking Amondys 45. Because of the effect of reduced skeletal muscle mass on creatinine measurements, creatinine may not be a reliable measure of kidney function in DMD patients. Serum cystatin C, urine dipstick, and urine protein-to-creatinine ratio should be measured before starting Amondys 45. Consider also measuring glomerular filtration rate using an exogenous filtration marker before starting Amondys 45. During treatment, monitor urine dipstick every month, and serum cystatin C and urine protein-to-creatinine ratio (UPCR) every three months. Only urine expected to be free of excreted Amondys 45 should be used for monitoring of urine protein. Urine obtained on the day of Amondys 45 infusion prior to the infusion, or urine obtained at least 48 hours after the most recent infusion, may be used. Alternatively, use a laboratory test that does not use the reagent pyrogallol red, as this reagent has the potential to cross react with any Amondys 45 that is excreted in the urine and thus lead to a false positive result for urine protein.
If a persistent increase in serum cystatin C or proteinuria is detected, refer to a pediatric nephrologist for further evaluation.
Adverse Reactions
The following clinically significant adverse reactions are described elsewhere in the labeling:
- Hypersensitivity reactions [see Warnings and Precautions (5.1)]
- Kidney toxicity [see Warnings and Precautions (5.2)]
Clinical Trials Experience
Because clinical trials are conducted under widely varying conditions, adverse reaction rates observed in clinical trials of a drug cannot be directly compared to rates in the clinical trials of another drug and may not reflect the rates observed in practice.
In the Amondys 45 clinical development program, 76 patients received at least one intravenous dose of Amondys 45 (30 mg/kg). All patients were male and had genetically confirmed Duchenne muscular dystrophy. Age at study entry was 7 to 20 years (mean 9.9 years). Most (88%) patients were White, and 9% were Asian.
Amondys 45 was studied in a double-blind, placebo-controlled study (Study 1).
Patients in ongoing Study 1 received Amondys 45 (n=57) 30 mg/kg or placebo (n=31) intravenously once weekly for up to 96 weeks, after which all patients received or will receive Amondys 45 30 mg/kg for up to 48 weeks.
Adverse reactions observed in ≥20% of patients treated with Amondys 45 and 5% more frequently than in the placebo group in Study 1 are shown in Table 1.
|
*Includes upper respiratory infection, pharyngitis, nasopharyngitis, and rhinitis. |
||
| Adverse Reaction | Amondys 45 30 mg/kg Once Weekly (n = 57) % |
Placebo
(n = 31) |
| Upper Respiratory Tract Infections* | 65 | 55 |
| Cough | 33 | 26 |
| Pyrexia | 33 | 23 |
| Headache | 32 | 19 |
| Arthralgia | 21 | 10 |
| Oropharyngeal Pain | 21 | 7 |
Other adverse reactions that occurred in at least 10% of patients treated with Amondys 45, and that were reported at a rate at least 5% more frequently in the Amondys 45 group than in the placebo group, were: ear pain, nausea, ear infection, post-traumatic pain, and dizziness and light-headedness.
Postmarketing Experience
The following adverse reactions have been identified during postapproval use of Amondys 45. Because these reactions are reported voluntarily from a population of uncertain size, it is not always possible to reliably estimate their frequency or establish a causal relationship to drug exposure.
Hypersensitivity reactions, including angioedema and anaphylaxis, have occurred in patients treated with Amondys 45.
USE IN SPECIFIC POPULATIONS
Pregnancy
Risk Summary
There are no human or animal data available to assess the use of Amondys 45 during pregnancy. In the U.S. general population, major birth defects occur in 2% to 4% and miscarriage occurs in 15% to 20% of clinically recognized pregnancies.
Lactation
Risk Summary
There are no human or animal data to assess the effect of Amondys 45 on milk production, the presence of casimersen in milk, or the effects of Amondys 45 on the breastfed infant.
The developmental and health benefits of breastfeeding should be considered along with the mother’s clinical need for Amondys 45 and any potential adverse effects on the breastfed infant from Amondys 45 or from the underlying maternal condition.
Pediatric Use
Amondys 45 is indicated for the treatment of DMD in patients who have a confirmed mutation of the DMD gene that is amenable to exon 45 skipping, including pediatric patients [see Clinical Studies (14)].
Juvenile Animal Toxicity Data
Intravenous administration of casimersen (0, 100, 300, and 900 mg/kg) to juvenile male rats once weekly for 10 weeks (postnatal days 14 to 77) resulted in renal tubular degeneration/necrosis at the highest dose tested. No effects were observed on the male reproductive system, neurobehavioral development, or immune function. At the overall no-effect dose (300 mg/kg), plasma exposure (AUC) was 4 times that in humans at the recommended human dose of 30 mg/kg/week.
Geriatric Use
DMD is largely a disease of children and young adults; therefore, there is no experience with Amondys 45 in geriatric DMD patients.
Patients with Renal Impairment
Renal clearance of casimersen is decreased in non-DMD adults with renal impairment based on estimated glomerular filtration rate (calculated using the Modification of Diet and Renal Disease (MDRD) equation) [see Clinical Pharmacology (12.3)]. However, because of the effect of reduced skeletal muscle mass on creatinine measurements in DMD patients, no specific dosage adjustment can be recommended for DMD patients with renal impairment based on estimated glomerular filtration rate. Patients with known renal function impairment should be closely monitored during treatment with Amondys 45.
Amondys 45 Description
Amondys 45 (casimersen) injection is a sterile, aqueous, preservative-free, concentrated solution for dilution prior to intravenous administration. Amondys 45 is a clear to slightly opalescent, colorless liquid and may contain trace amounts of small, white to off-white amorphous particles. Amondys 45 is supplied in single-dose vials containing 100 mg casimersen (50 mg/mL). Amondys 45 is formulated as an isotonic phosphate buffered saline solution with an osmolality of 260 to 320 mOsm and a pH of 7.5. Each milliliter of Amondys 45 contains: 50 mg casimersen; 0.2 mg potassium chloride; 0.2 mg potassium phosphate monobasic; 8 mg sodium chloride; and 1.14 mg sodium phosphate dibasic, anhydrous, in water for injection. The product may contain hydrochloric acid or sodium hydroxide to adjust pH.
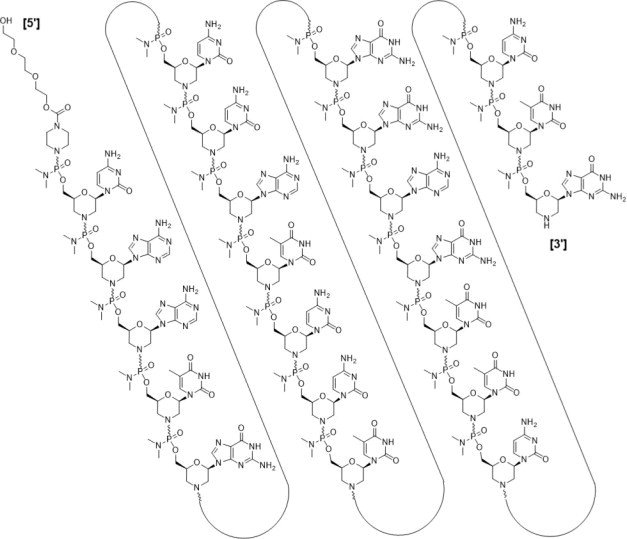
Casimersen is an antisense oligonucleotide of the phosphorodiamidate morpholino oligomer (PMO) subclass. PMOs are synthetic molecules in which the five-membered ribofuranosyl rings found in natural DNA and RNA are replaced by a six-membered morpholino ring. Each morpholino ring is linked through an uncharged phosphorodiamidate moiety rather than the negatively charged phosphate linkage that is present in natural DNA and RNA. Each phosphorodiamidate morpholino subunit contains one of the heterocyclic bases found in DNA (adenine, cytosine, guanine, or thymine). Casimersen contains 22 linked subunits. The sequence of bases from the 5′ end to 3′ end is CAATGCCATCCTGGAGTTCCTG. The molecular formula of casimersen is C268H424N124O95P22 and the molecular weight is 7584.5 daltons.
The structure of casimersen is:
Amondys 45 — Clinical Pharmacology
Mechanism of Action
Casimersen is designed to bind to exon 45 of dystrophin pre-mRNA resulting in exclusion of this exon during mRNA processing in patients with genetic mutations that are amenable to exon 45 skipping. Exon 45 skipping is intended to allow for production of an internally truncated dystrophin protein in patients with genetic mutations that are amenable to exon 45 skipping [see Clinical Studies (14)].
Pharmacodynamics
In the interim analysis of muscle biopsy tissue obtained at baseline and at Week 48 from patients in Study 1, patients who received Amondys 45 (n=27) demonstrated a significant increase in skipping of exon 45 (p<0.001) compared to baseline, demonstrated by reverse transcription digital droplet polymerase chain reaction (RT-ddPCR). Patients who received placebo (n=16) did not demonstrate a significant increase in exon 45 skipping (p=0.808). The level of exon skipping is positively correlated with dystrophin protein expression [see Clinical Studies (14)].
In Study 1 [see Clinical Studies (14)], dystrophin levels as assessed by the Sarepta Western blot assay increased from 0.93% (SD 1.67) of normal at baseline to 1.74% (SD 1.97) of normal after 48 weeks of treatment with Amondys 45. The mean change from baseline in dystrophin after 48 weeks of treatment with Amondys 45 was 0.81% (SD 0.70) of normal levels (p<0.001). This increase in dystrophin protein expression after treatment with Amondys 45 positively correlated with the level of exon skipping. The mean change from baseline in dystrophin after 48 weeks of treatment with placebo was 0.22% (SD 0.49). Patients who received Amondys 45 showed a significantly greater increase in dystrophin protein levels from baseline to Week 48 compared to those who received placebo (mean difference of 0.59%; p = 0.004). Dystrophin levels assessed by Western blot can be meaningfully influenced by differences in sample processing, analytical technique, reference materials, and quantitation methodologies. Therefore, comparing dystrophin results from different assay protocols will require a standardized reference material and additional bridging studies.
Correct localization of dystrophin to the sarcolemma in patients treated with Amondys 45 was demonstrated by immunofluorescence staining.
Pharmacokinetics
The pharmacokinetics of casimersen was evaluated in DMD patients following administration of intravenous (IV) doses ranging from 4 mg/kg/week to 30 mg/kg/week (i.e., recommended dosage). Following a single IV dose of casimersen, Cmax was reached at the end of infusion. Casimersen exposure increased in a proportional manner with dose increment. No accumulation of casimersen was observed in plasma following once weekly dosing. Inter-subject variability (as %CV) for casimersen Cmax and AUC ranged from 12% to 34% and 16% to 34%, respectively.
Distribution
Binding of casimersen to human plasma protein was not concentration-dependent and ranged from 8.4% to 31.6%. The mean apparent volume of distribution at steady state (Vss) was 367 mL/kg (%CV = 28.9) following a 30 mg/kg dose of casimersen administered intravenously.
Elimination
The plasma clearance (CL) of casimersen was 180 mL/hr/kg at the 30 mg/kg dose. The elimination half-life (t1/2) was 3.5 hours (SD 0.4 hours).
Metabolism
Casimersen is metabolically stable in human hepatic microsomal incubations. No metabolites were detected in plasma or urine.
Excretion
Casimersen is mostly excreted unchanged in the urine. In a clinical study with radiolabeled casimersen, more than 90% of the drug was excreted in urine, with negligible fecal excretion.
Specific Populations
Age, Sex & Race
The pharmacokinetics of Amondys 45 have been evaluated in male DMD patients 9 to 20 years of age. There is no experience with the use of Amondys 45 in DMD patients 65 years of age or older. Amondys 45 has not been studied in female patients. The potential impact of race on the pharmacokinetics of casimersen is unknown.
Patients with Renal Impairment
The effect of renal impairment on the pharmacokinetics of casimersen was evaluated in non-DMD subjects aged 35 to 65 years with Stage 2 chronic kidney disease (CKD) (n=8, estimated glomerular filtration rate [eGFR] ≥60 and <90 mL/min/1.73 m2) or Stage 3 CKD (n=8, eGFR ≥30 and <60 mL/min/1.73 m2) and matched healthy subjects (n=9, eGFR ≥90 mL/min/1.73 m2). Subjects received a single 30 mg/kg intravenous dose of casimersen.
In subjects with Stage 2 or Stage 3 CKD, exposure (AUC) increased approximately 1.2-fold and 1.8-fold, respectively, compared with subjects with normal renal function. The Cmax in subjects with Stage 2 CKD was similar to Cmax in subjects with normal renal function; in subjects with Stage 3 CKD, there was a 1.2-fold increase in Cmax compared with subjects with normal renal function. The effect of Stage 4 or Stage 5 CKD on casimersen pharmacokinetics and safety has not been studied.
Estimated GFR values derived from MDRD equations and the threshold definitions for various CKD stages in otherwise healthy adults would not be generalizable to pediatric patients with DMD. Therefore, no specific dosage adjustment can be recommended for patients with renal impairment [see Use in Specific Populations (8.6)].
Patients with Hepatic Impairment
Amondys 45 has not been studied in patients with hepatic impairment. However, casimersen does not undergo hepatic metabolism, and the systemic clearance of casimersen is not expected to be affected by hepatic impairment.
Drug Interaction Studies
Based on in vitro data, casimersen has a low potential for clinically relevant drug-drug interactions with major CYP enzymes and transporters.
Casimersen did not inhibit CYP1A2, CYP2B6, CYP2C8, or CYP2D6 in vitro. Casimersen was a potential inhibitor of CYP3A4/5, CYP2C9, and CYP2C19 in vitro; however, considering its short plasma half-life and lack of plasma accumulation with the weekly dosing regimen, clinical drug interaction with substrates for these enzymes is unlikely. Casimersen did not induce CYP1A2, CYP2B6, or CYP3A4 either at the mRNA or protein (activity) level. Casimersen was not metabolized by human hepatic microsomes and was not a substrate or strong inhibitor of the key human drug transporters tested (OAT1, OAT3, OCT2, OATP1B1, OATP1B3, MATE1, MATE2-K, P-gp, BCRP, and MRP2).
Nonclinical Toxicology
Carcinogenesis, Mutagenesis, Impairment of Fertility
Carcinogenesis
Carcinogenicity studies have not been conducted with casimersen.
Mutagenesis
Casimersen was negative in in vitro (bacterial reverse mutation assay and chromosomal aberration assay in CHO cells) and in vivo (mouse bone marrow micronucleus) assays.
Impairment of Fertility
Fertility studies in animals were not conducted with casimersen. No effects of casimersen were observed on the male reproductive system following weekly administration to male mice at subcutaneous doses up to 960 mg/kg for 26 weeks or to male monkeys at intravenous doses up to 640 mg/kg for 39 weeks. Plasma exposures at the highest doses tested in mouse and monkey were approximately 9 and 35 times, respectively, that in humans at the recommended human dose of 30 mg/kg/week.
Animal Toxicology and/or Pharmacology
Kidney toxicity was observed in studies in male mice and rats [see Warnings and Precautions (5.1)].
In male mice, casimersen was administered weekly for 12 weeks (0, 12, 120, or 960 mg/kg) or 22 weeks (0, 300, 960, or 2000 mg/kg) by intravenous injection or for 26 weeks by subcutaneous injection (0, 300, 600, or 960 mg/kg). In the 12-week study, microscopic findings in kidney (cytoplasmic basophilia and microvacuolation) were observed at the highest dose tested. In the 22- and 26-week studies, renal tubular degeneration was observed at all doses. A no-effect dose for adverse effects on kidney was not identified. Plasma exposure (AUC) at the lowest dose tested in the 26-week study (300 mg/kg) was approximately 2 times that in humans at the recommended human dose (RHD) of 30 mg/kg/week.
In male rats, intravenous administration of casimersen (0, 250, 500, 1000, or 2000 mg/kg) weekly for 13 weeks resulted in renal tubular degeneration at all doses tested; at the highest dose, the microscopic changes were accompanied by increases in blood urea nitrogen. A no-effect dose for adverse effects on kidney was not identified. Plasma exposure (AUC) at the lowest dose tested were approximately 4 times that in humans at the RHD.
Clinical Studies
The effect of Amondys 45 on dystrophin production was evaluated in one study in male DMD patients who have a confirmed mutation of the DMD gene that is amenable to exon 45 skipping (Study 1; NCT02500381).
Study 1 is an ongoing, double-blind, placebo-controlled, multicenter study designed to evaluate the safety and efficacy of Amondys 45 in ambulatory patients. The study is planned to enroll a total of 111 patients, age 7 to 13 years, randomized to Amondys 45 or placebo in a 2 to 1 ratio. Patients were required to have been on a stable dose of oral corticosteroids for at least 24 weeks prior to dosing with Amondys 45 or placebo. Following the 96-week double-blind period, all patients began or are to begin an additional 48 week open-label treatment period. Interim efficacy was assessed based on change from baseline in the dystrophin protein level (measured as % of the dystrophin level in healthy subjects, i.e., % of normal) at Week 48 of Study 1. Interim results from 43 evaluable patients (n = 27, Amondys 45; n = 16, placebo) who had a muscle biopsy at Week 48 of the double-blind period are presented in Table 2. Patients who provided muscle biopsy data had a median age of 9 years and were 86% White.
| Placebo | Amondys 45 30 mg/kg/week IV |
|
| Dystrophin by Sarepta Western blot | n=16 | n=27 |
| Baseline Mean (SD) | 0.54 (0.79) | 0.93 (1.67) |
| Week 48 Mean (SD) | 0.76 (1.15) | 1.74 (1.97) |
| Change from Baseline Mean (SD) | 0.22 (0.49) | 0.81 (0.70) |
| p-value Change from Baseline to Week 48 | 0.09 | <0.001 |
| Between group mean difference | 0.59 | |
| p-value between groups | p=0.004 |
How Supplied/Storage and Handling
How Supplied
Amondys 45 injection is supplied in single dose vials. The solution is a clear to slightly opalescent, colorless liquid, and may contain trace amounts of small, white to off-white amorphous particles.
• Single-dose vials containing 100 mg/2 mL (50 mg/mL) NDC 60923-227-02
Storage and Handling
Store Amondys 45 at 2°C to 8°C (36°F to 46°F). Do not freeze. Store in original carton until ready for use to protect from light.
Patient Counseling Information
Hypersensitivity Reactions
Advise patients and/or caregivers that hypersensitivity reactions, including angioedema and anaphylaxis, have occurred in patients who were treated with Amondys 45. Instruct them to seek immediate medical care should they experience signs and symptoms of hypersensitivity [see Warnings and Precautions (5.1)].
Kidney Toxicity
Inform patients nephrotoxicity has occurred with drugs similar to Amondys 45. Advise patients of the importance of monitoring for kidney toxicity by their healthcare providers during treatment with Amondys 45 [see Warnings and Precautions (5.2)].
Manufactured for:
Sarepta Therapeutics, Inc.
Cambridge, MA 02142 USA
Sarepta and Sarepta Therapeutics are trademarks of Sarepta Therapeutics, Inc. registered in the U.S. Patent and Trademark Office and may be registered in various other jurisdictions. Amondys 45 and the Amondys 45 logo are trademarks of Sarepta Therapeutics, Inc.
Principal Display Panel — 2 mL Carton Label
NDC: 60923-227-02
Rx Only
Amondys 45
(casimersen) Injection
100 mg/2 mL
(50 mg/mL)
For Intravenous Infusion
After Dilution
Use a 0.2 micron in-line
filter during infusion
Single Dose
1 vial
SAREPTA
THERAPEUTICS
Principal Display Panel — 2 mL Vial Label
Amondys 45
(casimersen) Injection
100 mg/2 mL
(50 mg/mL)
Rx Only
Single Dose.
Mfg for: Sarepta Therapeutics,
Inc., Cambridge, MA 02142
| Amondys 45 casimersen injection |
|||||||||||||||||
|
|||||||||||||||||
|
|||||||||||||||||
|
|||||||||||||||||
|
|||||||||||||||||
|
Labeler — Sarepta Therapeutics, Inc. (121653406)
Sarepta Therapeutics, Inc.
Frequently asked questions
- What are the new drugs for Duchenne muscular dystrophy?
Medical Disclaimer
Номидес — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-003504
Торговое наименование препарата:
Номидес
Международное непатентованное наименование:
Осельтамивир (Oseltamivir)
Лекарственная форма:
капсулы.
Состав:
активное вещество:
| Осельтамивира фосфата: | 39,40 мг | 59,10 мг | 98,50 мг |
| что соответствует содержанию Осельтамивира: |
30,00 мг | 45,00 мг | 75,00 мг |
вспомогательные вещества:
Кремния диоксид коллоидный (аэросил) — 6,00 мг/9,00 мг/15,00 мг; коповидон -3,60 мг/5,40 мг/9,00 мг; крахмал прежелатинизированный — 65,60 мг/98,40 мг/164,00 мг; кроскармеллоза натрия — 1,840 мг/2,760 мг/4,60 мг; натрия стеарилфумарат -0,920 мг/1,380 мг/2,30 мг; тальк — 2,640 мг/3,960 мг/6,60 мг.
Состав твердых желатиновых капсул:
Для дозировки 30мг:
корпус капсулы: вода очищенная — 14-15 мг, натрия лаурилсульфат — 0,12 мг, титана диоксид — 2,0500 мг, желатин — до 100 мг;
крышечка капсулы: вода очищенная — 14-15 мг, натрия лаурилсульфат — 0,12 мг, титана диоксид — 2,0500 мг, желатин — до 100 мг.
Для дозировки 45 мг:
корпус капсулы: вода очищенная — 14-15 мг, натрия лаурилсульфат — 0,08 мг, титана диоксид — 0,97524 мг, краситель бриллиантовый голубой — 0,2626 мг, желатин — до 100 мг;
крышечка капсулы: вода очищенная — 14-15 мг, натрия лаурилсульфат — 0,08 мг, титана диоксид — 0,97524 мг, краситель бриллиантовый голубой — 0,2626 мг, желатин — до 100 мг.
Для дозировки 75 мг:
корпус капсулы: вода очищенная — 14-15 мг, натрия лаурилсульфат — 0,12 мг, титана диоксид — 1,50038 мг, желатин — до 100 мг;
крышечка капсулы: вода очищенная — 14-15 мг, натрия лаурилсульфат — 0,12 мг, титана диоксид — 1,50038 мг; краситель солнечный закат желтый Е 110 — 1,2753 мг, краситель пунцовый [Понсо 4R] Е 124 — 0,2401 мг, желатин — до 100 мг.
Описание:
Для дозировки 30 мг: твердые желатиновые капсулы № «3», корпус белого цвета, крышечка белого цвета.
Для дозировки 45 мг: твердые желатиновые капсулы № «2», корпус голубого цвета, крышечка голубого цвета.
Для дозировки 75 мг: твердые желатиновые капсулы № «1», корпус белого цвета, крышечка оранжевого.
Содержимое капсул — белый или белый с желтоватым оттенком порошок.
Фармакотерапевтическая группа:
противовирусное средство.
Код АТХ:
J05AH02.
Фармакологические свойства
Фармакодинамика
Противовирусный препарат, осельтамивира фосфат является пролекарством, его активный метаболит (осельтамивира карбоксилат, ОК) — эффективный и селективный ингибитор нейраминидазы вирусов гриппа типа А и В — фермента, катализирующего процесс высвобождения вновь образованных вирусных частиц из инфицированных клеток, их проникновение в клетки эпителия дыхательных путей и дальнейшего распространения вируса в организме. Тормозит рост вируса гриппа in vitro и подавляет репликацию вируса и его патогенность in vivo, уменьшает выделение вирусов гриппа А и В из организма.
Исследования клинических изолятов вируса гриппа показали, что концентрация ОК, необходимая для ингибирования нейраминидазы на 50 % (IC50), составляет 0,1-1,3 нМ для вируса гриппа А и 2,6 нМ для вируса гриппа В. Согласно данным опубликованных исследований медиана значение IC50 для вируса гриппа В несколько выше и составляет 8,5 нМ.
Резистентность
Клинические исследования
Риск появления вирусов гриппа со сниженной чувствительностью или резистентностью к препарату изучался в клинических исследованиях. У всех пациентов-носителей ОК-резистентного вируса носительство имело временный характер, не влияло на элиминацию вируса и не вызывало ухудшения клинического состояния.
| Популяция пациентов | Пациенты с мутациями, приводящими к резистентности | |
| Фенотипирование* | Гено-и фенотипирование* | |
| Взрослые и подростки | 4/1245 (0,32 %) | 5/1245 (0,4 %) |
| Дети (1-12 лет) | 19/464 (4,1 %) | 25/464 (5,4 %) |
* Полное генотипирование не было проведено ни в одном из исследований.
При приеме осельтамивира с целью постконтактной профилактики (7 дней), профилактики контактировавших в семье (10 дней) и сезонной профилактики (42 дня) у лиц с нормальной функцией иммунной системы случаев резистентности к препарату не отмечено. В 12-недельном исследовании по сезонной профилактике у лиц с ослабленным иммунитетом случаев возникновения резистентности также не наблюдалось.Данные отдельных клинических случаев и наблюдательных исследований
У пациентов, не получавших осельтамивир, обнаружены возникающие в природных условиях мутации вирусов гриппа А и В, которые обладали сниженной чувствительностью к осельтамивиру. В 2008 году мутация по типу замены H275Y, приводящая к резистентности, была обнаружена более чем у 99 % штаммов вируса 2008 H1N1, циркулирующих в Европе. Вирус гриппа 2009 H1N1 («свиной грипп») в большинстве случаев был чувствителен к осельтамивиру. Устойчивые к осельтамивиру штаммы обнаружены у лиц с нормальной функцией иммунной системы и лиц с ослабленным иммунитетом, принимавших осельтамивир. Степень снижения чувствительности к осельтамивиру и частота встречаемости подобных вирусов может отличаться в зависимости от сезона и региона. Устойчивость к осельтамивиру обнаружена у пациентов с пандемическим гриппом H1N1, получавших препарат как для лечения, гак и для профилактики.
Частота встречаемости резистентности может быть выше у более молодых пациентов и пациентов с ослабленным иммунитетом. Устойчивые к осельтамивиру лабораторные штаммы вирусов гриппа и вирусы гриппа от пациентов, получавших терапию осельтамивиром, несут мутации нейраминидазы N1 и N2. Мутации, приводящие к устойчивости, часто являются специфическими для подтипа нейраминидазы. При принятии решения о применении осельтамивира следует учитывать сезонную чувствительность вируса гриппа к препарату (последнюю информацию можно найти на сайте ВОЗ).
Доклинические данные
Доклинические данные, полученные на основании стандартных исследований по изучению фармакологической безопасности, генотоксичности и хронической токсичности, не выявили особой опасности для человека.
Канцерогенность: результаты 3 исследований по выявлению канцерогенного потенциала (2-летних исследований на крысах и мышах для осельтамивира и одного 6-месячного исследования на трансгенных мышах Tg:AC для активного метаболита) были отрицательными.
Мутагенность: стандартные генотоксические тесты для осельтамивира и активного метаболита были отрицательными.
Влияние на фертильность: осельтамивир в дозе 1500 мг/кг/сут не влиял на репродуктивную функцию самцов и самок крыс.
Тератогенность: в исследованиях по изучению тератогенности осельтамивира в дозе до 1500 мг/кг/сут (на крысах) и до 500 мг/кг/сут (на кроликах) влияния на эмбриональное развитие не обнаружено. В исследованиях по изучению антенатального и постнатального периодов развития у крыс при введении осельтамивира в дозе 1500 мг/кг/сут наблюдалось увеличение периода родов: предел безопасности между экспозицией для человека и максимальной не оказывающей эффекта дозой у крыс (500 мг/кг/сут) для осельтамивира выше в 480 раз, а для его активного метаболита — в 44 раза. Экспозиция у плода I составляла 15-20 % от таковой у матери.
Прочее: осельтамивир и активный метаболит проникают в молоко лактирующих крыс. Согласно ограниченным данным осельтамивир и его активный метаболит проникают в грудное молоко человека. По результатам экстраполяции данных, полученных в исследованиях у животных, их количество в грудном молоке может составлять 0,01 мг/сут и 0,3 мг/сут, соответственно.
Примерно у 50 % протестированных морских свинок при введении максимальных доз активной субстанции осельтамивира наблюдалась сенсибилизация кожи в виде эритемы. Также выявлено обратимое раздражение глаз у кроликов.
В то время как очень высокие пероральные однократные дозы (657 мг/кг и выше) осельтамивира фосфата не оказывали влияния на взрослых крыс, данные дозы оказывали токсическое действие на незрелых 7-дневных детенышей крыс, в т.ч. приводили к гибели животных. Нежелательных эффектов не наблюдалось при хроническом введении в дозе 500 мг/кг/сут с 7 по 21 день постнатального периода.
Фармакокинетика.
Абсорбция
Осельтамивира фосфат легко всасывается в желудочно-кишечном тракте и в высокой степени превращается в активный метаболит под действием печеночных и кишечных эстераз. Концентрация активного метаболита в плазме определяется в пределах 30 мин, время достижения максимальной концентрации 2-3 ч, и более чем в 20 раз превышают концентрацию пролекарства. Не менее 75 % принятой внутрь дозы попадает в системный кроваток в виде активного метаболита, менее 5 % — в виде исходного препарата. Плазменные концентрации как пролекарства, так и активного метаболита пропорциональны дозе и не зависят от приема пищи.
Распределение
Объем распределения (Vss) активного метаболита — 23 л.
По данным исследований, проведенных на животных, после приема внутрь осельтамивира фосфата его активный метаболит обнаруживался во всех основных очагах инфекции (легких, промывных водах бронхов, слизистой оболочки полости носа, среднем ухе и трахее) в концентрациях, обеспечивающих противовирусный эффект.
Связь активного метаболита с белками плазмы — 3 %. Связь пролекарства с белками плазмы 42 %, что недостаточно, чтобы служить причиной существенных лекарственных взаимодействий.
Метаболизм
Осельтамивира фосфат в высокой степени превращается в активный метаболит под действием эстераз, находящихся преимущественно в печени. Ни осельтамивира фосфат, ни активный метаболит не являются субстратами или ингибиторами изоферментов системы цитохрома Р450.
Выведение
Выводится (>90 %) в виде активного метаболита преимущественно почками. Активный метаболит не подвергается дальнейшей трансформации и выводится почками (>99 %) путем клубочковой фильтрации и канальцевой секреции. Почечный клиренс (18,8 л/ч) превышает скорость клубочковой фильтрации (7,5 л/ч), что указывает на то, что препарат выводится еще и путем канальцевой секреции. Через кишечник выводится менее 20 % приятного препарата.Период полувыведения активного метаболита 6-10 ч.
Фармакокинетика в особых группах пациентов
Больные с поражением почек
При применение осельтамивира (100 мг два раза в сутки в течение 5 дней) у больных с различной степенью поражения почек площадь под кривой «концентрация активного метаболита в плазме — время» (AUC осельтамивира карбоксилата) обратно пропорциональна снижению функции почек.
Фармакокинетика осельтамивира у пациентов с терминальной стадией почечной недостаточности (с клиренсом креагинина <10 мл/мин), не находящихся на диализе, не изучалась. В связи с этим рекомендации по дозированию у данной группы пациентов отсутствуют.
Больные с поражением печени
Полученные in vitro и в исследованиях на животных данные об отсутствии значительного повышения AUC осельтамивира фосфата при нарушении функции печени легкой и средней степени тяжести были подтверждены и в клинических исследованиях. Безопасность и фармакокинетика осельтамивира фосфата у пациентов с тяжелым нарушением функции печени не изучалась.
Больные пожилого и старческого возраста
У больных пожилого и старческого возраста (65-78 лет) экспозиция метаболита в равновесном состоянии на 25-35 % выше, чем у более молодых пациентов при назначении аналогичных доз осельтамивира. Период полувыведения препарата у больных пожилого и старческого возраста существенно не отличался от такового у более молодых пациентов. С учетом данных по экспозиции препарата и его переносимости больными пожилого и старческого возраста коррекции дозы при лечении и профилактике гриппа не требуется.
Дети
У детей младшего возраста выведение пролекарства и активного метаболита происходит быстрее, чем у взрослых, что приводит к более низким AUC по отношение к конкретной дозе. Прием препарата в дозе 2 мг/кг обеспечивает такую же AUC осельтамивира карбоксилата, какая достигается у взрослых после однократного приема капсулы с 75 мг препарата (что эквивалентно примерно 1 мг/кг). Фармакокинетика осельтамивира у детей старше 12 лет такая же, как у взрослых.
Показания к применению
Лечение гриппа у взрослых и детей в возрасте старше 3 лет.
Профилактика гриппа у взрослых и подростков в возрасте старше 12 лет, находящихся в группах повышенного риска инфицирования вирусом (в больших коллективах, у ослабленных больных).
Профилактика гриппа у детей старше 3 лет.
Противопоказания
Повышенная чувствительность к осельтамивира фосфату или любому компоненту препарата, терминальная стадия почечной недостаточности (клиренс креатинина <10 мл/мин), тяжелая печеночная недостаточность, детский возраст до 3 лет.
С осторожностью:
Беременность, период грудного вскармливания.
Применение при беременности и в период грудного вскармливания
Контролируемых исследований у беременных женщин не проводилось. Однако результаты постмаркетинговых и наблюдательных исследований продемонстрировали пользу предлагаемого стандартного режима дозирования для данной популяции пациентов. Результаты фармакокинетического анализа показали более низкую экспозицию активного метаболита (приблизительно на 30 % в течение всех триместров беременности) у беременных женщин по сравнению с не беременными. Тем не менее, значение расчетной экспозиции остается выше ингибирующих концентраций (значение IC95) и терапевтических значений для многих штаммов вируса гриппа. Изменение режима дозирования у беременных женщин при проведении терапии или профилактики не рекомендуется. Не обнаружено прямого или опосредованного неблагоприятного влияния препарата на беременность, эмбрио-фетальное или постнатальное развитие (см. «Доклинические данные»). При назначении осельтамивира беременным женщинам следует учитывать как данные по безопасности, так и течение беременности и патогенность циркулирующего штамма вируса гриппа.
Во время доклинических исследований осельтамивир и активный метаболит проникали в молоко лактирующих крыс. Данные по экскреции осельтамивира с грудным молоком у человека и применению осельтамивира кормящими женщинами ограничены. Осельтамивир и его активный метаболит в небольших количествах проникают в грудное молоко (см. «Доклинические данные»), создавая субтерапевтические концентрации в крови грудного ребенка. При назначении осельтамивира кормящим женщинам следует также учитывать сопутствующее заболевание и патогенность циркулирующего штамма вируса гриппа.
При беременности и в период грудного вскармливания осельтамивир применяют только в случае, если предполагаемая польза для матери превышает потенциальный риск для плода и ребенка.
Способ применения и дозы
Препарат осельтамивир принимается внутрь, независимо от приема пищи или во время еды.
Лечение
Прием препарата необходимо начинать не позднее 2 суток с момента развития симптомов заболевания.
Взрослые и подростки в возрасте >12 лет
Рекомендуемая суточная доза составляет 150 мг. Препарат назначают в дозе 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 2 раза в сутки внутрь в течение 5 дней.
Дети с массой тела более 40 кг или в возрасте >8 лет
Дети, которые умеют проглатывать капсулы, также могут получать лечение, принимая по 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 2 раза в сутки в течение 5 дней.
Дети в возрасте >3 лет
Рекомендованный режим дозирования осельтамивира капсулы 30 и 45 мг.
| Масса тела | Рекомендованная доза в течение 5 дней |
| <15 кг | 30 мг два раза в сутки |
| >15-23 кг | 45 мг два раза в сутки |
| >23-40 кг | 60 мг два раза в сутки |
Профилактика
Прием препарата необходимо начинать не позднее 2 суток после контакта с больными.
Взрослые и подростки в возрасте >12 лет
По 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 1 раз в сутки внутрь в течение не менее 10 дней после контакта с больным. Во время сезонной эпидемии гриппа — по 75 мг 1 раз в сутки в течение 6 недель. Профилактическое действие продолжается столько, сколько длится прием препарата.
Дети с массой тела более 40 кг или в возрасте >8 лет
Дети, которые могут проглатывать капсулы, также могут получать профилактическую терапию, принимая по 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 1 раз в сутки в течение 10 дней.
Дети в возрасте >3 лет
Рекомендованный режим дозирования осельтамивира капсулы 30 и 45 мг.
| Масса тела | Рекомендованная доза в течение 10 дней |
| <15 кг | 30 мг 1 раз в сутки |
| >15-23 кг | 45 мг 1 раз в сутки |
| >23-40 кг | 60 мг 1 раз в сутки |
Дозирование в особых случаях
Пациенты с нарушением функции почек:
Лечение
Больным с клиренсом креатинина более 60 мл/мин коррекции дозы не требуется. У больных с клиренсом креатинина от 30 до 60 мл/мин дозу осельтамивира следует уменьшить до 30 мг два раза в сутки в течение 5 дней.
У больных с клиренсом креатинина от 10 до 30 мл/мин дозу осельтамивира следует уменьшить до 30 мг один раз в сутки в течение 5 дней. Пациентам, находящимся на постоянном гемодиализе, осельтамивир в первоначальной дозе 30 мг можно принять до начала диализа, если симптомы гриппа появились в течение 48 ч между сеансами диализа. Для поддержания плазменной концентрации на терапевтическом уровне осельтамивир следует принимать по 30 мг после каждого сеанса диализа. Пациентам, находящимся на перитонеальном диализе, осельтамивир следует принимать в первоначальной дозе 30 мг до начала проведения диализа, затем по 30 мг каждые 5 дней.
Фармакокинетика осельтамивира у пациентов с терминальной стадией хронической почечной недостаточности (с клиренсом креатинина <10 мл/мин), не находящихся на диализе, не изучалась. В связи с этим рекомендации по дозированию у данной группы пациентов отсутствуют.
Профилактика
Больным с клиренсом креатинина более 60 мл/мин коррекции дозы не требуется. У больных с клиренсом креатинина от 30 до 60 мл/мин дозу осельтамивира следует уменьшить до 30 мг один раз в сутки. У больных с клиренсом креатинина от 10 до 30 мл/мин рекомендуется уменьшить дозу осельтамивира до 30 мг через день. Пациентам, находящимся на постоянном гемодиализе, осельтамивир в первоначальной дозе 30 мг можно принять до начала диализа. Для поддержания плазменной концентрации на терапевтическом уровне осельтамивир следует принимать по 30 мг после каждого последующего нечетного сеанса диализа. Пациентам, находящимся на перитонеальном диализе, осельтамивир следует принимать в первоначальной дозе 30 мг до начала проведения диализа, затем по 30 мг каждые 7 дней. Фармакокинетика осельтамивира у пациентов с терминальной стадией хронической почечной недостаточности (с клиренсом креатинина менее 10 мл/мин), не находящихся на диализе, не изучалась. В связи с этим рекомендации по дозированию у данной группы пациентов отсутствуют.
Пациенты с нарушением функции печени
Коррекции дозы при лечении и профилактике гриппа у пациентов с нарушением функции печени легкой и средней степени тяжести не требуется. Безопасность и фармакокинетика осельтамивира у пациентов с тяжелыми нарушениями функции печени не изучалась. Больные пожилого и старческого возраста
Коррекции дозы для профилактики или лечения гриппа не требуется.
Больные с ослабленным иммунитетом (после трансплантации)
Для сезонной профилактики гриппа у больных с ослабленным иммунитетом в возрасте >3 лет — в течение 12 недель, коррекции дозы не требуется.
Побочное действие
В исследованиях по лечению гриппа у взрослых/пациентов подросткового возраста самыми частыми нежелательными реакциями (HP) были тошнота, рвота и головная боль. Большинство HP возникали в первый или второй день лечения и проходили самостоятельно в течение 1-2 дней. В исследованиях по профилактике гриппа у взрослых и подростков самыми частыми HP были тошнота, рвота, головная боль и боль. У детей наиболее часто встречалась рвота. Описанные HP в большинстве случаев не требовали отмены препарата.
Лечение и профилактика гриппа у взрослых и подростков
В таблице 1 представлены HP, возникавшие наиболее часто (>1 %) при приеме рекомендованной дозы осельтамивира в исследованиях по профилактике и лечению гриппа у взрослых и подростков (75 мг 2 раза в сутки в течение 5 дней для лечения и 75 мг 1 раз в сутки до 6 недель для профилактики), и частота которых как минимум на 1% выше по сравнению с плацебо. В исследования по лечению гриппа вошли взрослые/подростки без сопутствующей патологии и больные группы риска, т.е. пациенты с высоким риском развития осложнений гриппа (пациенты пожилого и старческого возраста, пациенты с хроническими заболеваниями сердца или органов дыхания). В целом профиль безопасности у пациентов группы риска соответствовал таковому у взрослых/пациентов подросткового возраста без сопутствующей патологии.
В исследованиях по профилактике гриппа профиль безопасности у пациентов, получавших рекомендованную дозу препарата (75 мг 1 раз в сутки до 6 недель), не отличался от такового в исследованиях по лечению гриппа, несмотря на более длительный прием препарата.
Таблица 1. Процент взрослых/подростков с HP, возникавшими с частотой >1% в группе осельтамивира в исследованиях по лечению и профилактике гриппозной инфекции (различие с плацебо >1 %).
| Системно-органный класс Нежелательная реакция |
Лечение | Профилактика | Категория частоты* | ||
| Осельтамивир (75 мг 2 раза/сут) N=2647 |
Плацебо N=1977 |
Осельтамивир (75 мг 1 раз/сут) N=1945 |
Плацебо N=1588 |
||
| Нарушения со стороны желудочно-кишечного тракта | |||||
| Тошнота | 0% | 6% | 8% | 4% | очень часто |
| Рвота | 8% | 3% | 2% | 1% | часто |
| Нарушения со стороны нервной системы | |||||
| Головная боль | 2% | 1% | 17% | 16% | очень часто |
| Общие расстройства | |||||
| Боль | <1% | <1% | 4% | 3% | часто |
*Категория частоты представлена только для группы осельтамивира. Для оценки частоты HP использованы следующие категории частоты: очень часто (>1/10); часто (>1/100, <1/10).Далее представлены нежелательные явления, которые возникали с частотой >1% у взрослых и подростков, получавших осельтамивир в качестве терапии и профилактики гриппозной инфекции. Данные нежелательные явления либо более часто наблюдались у пациентов, получавших плацебо, либо различия в частоте между группами осельтамивира и плацебо составили менее 1%.
Нарушения со стороны желудочно-кишечного тракта (осельтамивир против плацебо):
лечение — диарея (6% против 7%), боль в животе (включая боль в верхней части живота, 2% против 3%);
профилактика — диарея (3% против 4%), боль в верхней части живота (2 % против 2 %), диспепсия (1% против 1%).
Инфекции и инвазии (осельтамивир против плацебо):
лечение — бронхит (3% против 4%), синусит (1% против 1%), простой герпес (1% против 1%);
профилактика — назофарингит (4% против 4%), инфекции верхних дыхательных путей (3% против 3%), гриппозная инфекция (2% против 3%).
Общие расстройства (осельтамивир против плацебо):
лечение — головокружение (включая вертиго, 2% против 3%);
профилактика — усталость (7% против 7%), пирексия (2% против 2%), гриппоподобное заболевание (1% против 2%), головокружение (1% против 1%), боль в конечности (1% против 1%).
Нарушения со стороны нервной системы (осельтамивир против плацебо):
лечение — бессонница (1% против 1%);
профилактика-бессонница (1% против 1%).
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения (осельтамивир против плацебо):
лечение — кашель (2% против 2%), заложенность носа (1% против 1%);
профилактика — заложенность носа (7% против 7%), ангина (5% против 5%), кашель (5% против 6%), ринорея (1% против 1%).
Нарушения со стороны скелетно-мышечной и соединительной ткани (осельтамивир против плацебо):
профилактика — боль в спине (2% против 3%), артралгия (1% против 2%), миалгия (1% против 1%).
Нарушения со стороны половых органов и молочной железы (осельтамивир против плацебо): профилактика — дисменорея (3% против 3%).
Лечение и профилактика гриппозной инфекции лиц пожилого и старческого возраста
Профиль безопасности у 942 пациентов пожилого и старческого возраста, получавших осельтамивир или плацебо, клинически не отличался от такового у лиц более молодого возраста (до 65 лет).
Профилактика гриппозной инфекции у пациентов с ослабленным иммунитетом
В 12-недельном исследовании по профилактике гриппа с участием 475 пациентов с ослабленным иммунитетом (включая 18 детей в возрасте от 1 до 12 лет), у пациентов, принимавших осельтамивир (п = 238), профиль безопасности соответствовал описанному ранее в исследованиях по профилактике гриппа.
Лечение и профилактика гриппозной инфекции у детей без сопутствующих заболеваний в возрасте 1-12 лет и пациентов с бронхиальной астмой
В исследованиях по лечению естественной гриппозной инфекции у детей в возрасте от 1 года до 12 лет HP при применении осельтамивира (n=858), отмеченной с частотой >1% и как минимум на 1% чаще по сравнению с плацебо (n=622), была рвота. У детей, получавших рекомендованную дозу препарата 1 раз в сутки в качестве постконтактной профилактики в домашних условиях, наиболее часто встречалась рвота (8% в группе осельтамивира против 2% в группе, не получавшей профилактическое лечение). Осельтамивир хорошо переносился, зарегистрированные нежелательные явления соответствовали описанным ранее при проведении лечения гриппа у детей. Далее представлены нежелательные явления, отмеченные у детей с частотой >1 % в исследованиях по лечению гриппа (n=858) или с частотой >5 % в исследованиях по профилактике гриппа (n=148). Данные нежелательные явления более часто наблюдались в группе плацебо/отсутствие профилактики, различия между группами осельтамивира и плацебо/отсутствие профилактики составили менее 1%.
Нарушения со стороны желудочно-кишечного тракта (осельтамивир против плацебо):
лечение — диарея (9% против 9%), тошнота (4% против 4%), боль в животе (включая боль в верхней части живота, 3% против 3%).
Инфекции и инвазии (осельтамивир против плацебо):
лечение — средний отит (5% против 8%), бронхит (2% против 3%), пневмония (1% против 3%), синусит (1% против 2%).
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения (осельтамивир против плацебо):
лечение — астма (включая обострение, 3% против 4%), носовое кровотечение (2% против 2%);
профилактика — кашель (12% против 26%), заложенность носа (11% против 20%).
Нарушения со стороны кожи и подкожных тканей (осельтамивир против плацебо):
лечение — дерматит (включая аллергический и атопический дерматит, 1% против 2%).
Нарушения со стороны органа слуха и лабиринтные нарушения (осельтамивир против плацебо):
лечение — боль в ухе (1% против 1%).
Нарушения со стороны органа зрения (осельтамивир против плацебо):
лечение — конъюнктивит (включая покраснение глаз, выделения из глаза и боль в глазах, 1% против <1%).
Дополнительные нежелательные явления, отмеченные при проведении лечения гриппа у детей, не соответствовавшие описанным выше критериям.
Нарушения со стороны крови и лимфатической системы (осельтамивир против плацебо):
лечение — лимфоаденопатия (<1% против 1%).
Нарушения со стороны органа слуха и лабиринтные нарушения (осельтамивир против плацебо):
лечение — повреждение барабанной перепонки (<1% против 1%).
Постмаркет инговое наблюдение
Далее представлены нежелательные явления при применении осельтамивира, которые наблюдались в период постмаркетингового наблюдения. Частота данных нежелательных явлений и/или причинно-следственная связь с применением препарата не может быть установлена, так как не известен истинный размер популяции в виду добровольного характера сообщений.
Нарушения со стороны кожи и подкожных тканей:
реакции гиперчувствительности -дерматит, кожная сыпь, экзема, крапивница, мультиформная экссудативная эритема, синдром Стивенса-Джонсона и токсический эпидермальный некролиз, аллергия, анафилактические и анафилактоидные реакции, отек Квинке.
Нарушения со стороны печени и желчевыводящих путей:
гепатит, увеличение активности «печеночных» ферментов у пациентов с гриппоподобными симптомами, получавших осельтамивир; фульминантный гепатит (в том числе с фатальным исходом), печеночная недостаточность, желтуха.
Нарушения со стороны нервно-психической сферы
Гриппозная инфекция может ассоциироваться с различными неврологическими симптомами и изменениями поведения, включая такие симптомы, как галлюцинации, бред и анормальное поведение. В некоторых случаях они могут привести к смертельному исходу. Такие явления могут возникать как на фоне развития энцефалопатии или энцефалита, так и без проявления данных заболеваний.
У пациентов (в основном у детей и подростков), принимавших осельтамивир с целью лечения гриппа, были зарегистрированы судороги и делирий (включая такие симптомы, как нарушение сознания, дезориентация во времени и пространстве, анормальное поведение, бред, галлюцинации, возбуждение, тревога, ночные кошмары). Эти случаи редко сопровождались опасными для жизни действиями. Роль осельтамивира в развитии этих явлений неизвестна. Подобные психоневрологические нарушения так же отмечены у пациентов с гриппом, не получавших осельтамивир.
Нарушения со стороны желудочно-кишечного тракта:
желудочно-кишечные кровотечения после приема осельтамивира (в частности, нельзя исключить связь между явлениями геморрагического колита и приемом осельтамивира, поскольку указанные явления исчезали как после выздоровления пациента от гриппа, так и после отмены препарата).
Нарушения со стороны органа зрения: нарушение зрения.
Нарушения со стороны сердца: аритмия.
Передозировка
В большинстве случаев передозировка в ходе клинических исследований и при постмаркетинговом применении осельтамивира не сопровождалась какими-либо нежелательными явлениями. В остальных случаях симптомы передозировки соответствовали нежелательным явлениям, представленным в разделе «Побочное действие».
Взаимодействие с другими лекарственными средствами
Клинически значимые лекарственные взаимодействия маловероятны по данным фармакологических и фармакокинетических исследований. Осельтамивира фосфат в высокой степени превращается в активный метаболит под действием эстераз, в основном расположенных в печени. Лекарственные взаимодействия, обусловленные конкуренцией за связывание с активными центрами эстераз, в литературных источниках широко не представлены. Низкая степень связывания осельтамивира и активного метаболита с белками плазмы не дают оснований предполагать наличие взаимодействий, связанных с вытеснением лекарственных средств из связи с белками.
Исследования in vitro показывают, что ни осельтамивира фосфат, ни его активный метаболит не являются предпочтительным субстратом для полифункциональных оксидаз системы цитохрома Р450 или для глюкуронилтрансфераз. Оснований для взаимодействия с пероральными контрацептивами нет.
Циметидин, неспецифический ингибитор изофермента системы цитохрома Р450 и конкурирующий в процессе канальцевой секреции с препаратами щелочного типа и катионами, не влияет на плазменные концентрации осельтамивира и его активного метаболита.
Маловероятны клинически значимые межлекарственные взаимодействия, связанные с конкуренцией за канальцевую секрецию, принимая во внимание резерв безопасности для большинства подобных препаратов, пути выведения активного метаболита осельтамивира (клубочковая фильтрация и анионная канальцевая секреция), а также выводящую способность каждого из путей.
Пробенецид приводит к увеличению AUC активного метаболита осельтамивира примерно в 2 раза (за счет снижения активной канальцевой секреции в почках). Однако коррекции дозы при одновременном применении с пробенецидом не требуется, учитывая резерв безопасности активного метаболита.
Одновременный прием с амоксициллином не влияет на плазменные концентрации осельтамивира и его компонентов, демонстрируя слабую конкуренцию за выведение путем анионной канальцевой секреции.
Одновременный прием с парацетамолом не влияет на плазменные концентрации осельтамивира и его активного метаболита или парацетамола.
Фармакокинетических взаимодействий между осельтамивиром, его основным метаболитом не обнаружено при одновременном приеме с парацетамолом, ацетилсалициловой кислотой, циметидином или антацидными средствами (магния и алюминия гидроксид, кальция карбонат), варфарином, римантадином или амантадином.
При использовании осальтемивира с часто применяемыми препаратами, такими как ингибиторы ангиотензинпревращающего фермента (эналаприл, каптоприл), тиазидные диуретики (бендрофлуметиазид), антибиотики (пенициллин, цефалоспорины азитромицин, эритромицин и доксициклин), блокаторы Н2-гистаминовых рецепторов (ранитидин, циметидин), бета-адреноблокаторы (пропранолол), ксантины (теофиллин), симпатомиметики (псевдоэфедрин), опиаты (кодеин), глюкокортикостероиды, ингаляционные бронхолитики и ненаркотические анальгетики (ацетилсалициловая кислота, ибупрофен и парацетамол), изменений характера или частоты нежелательных явлений не наблюдалось.
Применять осельтамивир в комбинации с препаратами, имеющими узкую широту терапевтического действия (например, хлорпропамид, метотрексат, бутадион), необходимо с осторожностью.
Особые указания
Нарушения психики
У пациентов (в основном у детей и подростков), принимавших осельтамивир с целью лечения гриппа, были зарегистрированы судороги и делирий-подобные психоневрологические нарушения. Эти случаи редко сопровождались опасными для жизни действиями. Роль осельтамивира в развитии этих явлений неизвестна. Подобные психоневрологические нарушения так же отмечены у пациентов с гриппом, не получавших осельтамивир. Риск развития психоневрологических нарушений у пациентов, получающих осельтамивир, не превышает таковой у пациентов с гриппом, не получающих противовирусные препараты.
Рекомендуется тщательное наблюдение за состоянием и поведением пациентов, особенно детей и подростков, с целью выявления признаков анормального поведения и оценки риска продолжения приема препарата при развитии данных явлений.
Данных по эффективности осельтамивира при любых заболеваниях, вызванных другими возбудителями, кроме вирусов гриппа А и В, нет.
Осельтамивир не является заменой вакцинации.
Профилактический прием препарата возможен по эпидемиологическим показаниям. Рекомендации по коррекции дозы у больных с поражением почек представлены в подразделе «Дозирование в особых случаях» (также см. «Фармакокинетика в особых группах пациентов»).
Влияние на способность управлять транспортными средствами и механизмами
Исследования по изучению влияния препарата на способность управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций, не проводились. Исходя из профиля безопасности, влияние осельтамивира на данные виды деятельности маловероятно.
Форма выпуска
Капсулы по 30 мг; 45 мг; 75 мг.
Первичная упаковка лекарственного препарата.
По 5 или 10 капсул в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой печатной лакированной.
По 20, 30 капсул в банку полимерную с крышкой натягиваемой с контролем первого вскрытия. Свободное пространство заполняют ватой медицинской. На банки наклеивают этикетки из бумаги этикеточной или писчей или из полимерных материалов, самоклеящиеся.
Вторичная упаковка лекарственного препарата.
По 1 или 2 контурной ячейковой упаковке вместе с инструкцией по применению помещают в пачку из картона для потребительской тары. Пачки помещают в групповую упаковку.
По 1 банке вместе с инструкцией по применению помещают в пачку из картона для потребительской тары. Пачки помещают в групповую упаковку.
Условия хранения
Хранить в оригинальной упаковке производителя при температуре не выше 25°С.
Хранить в недоступном для детей месте.
Срок годности
3 года. Не использовать по истечении срока, указанного на упаковке.
Условия отпуска
Отпускается по рецепту.
Производитель
АО «Фармасинтез», Россия.
Юридический адрес:
Россия, 664007, г. Иркутск, ул. Красногвардейская, д. 23, оф. 3.
Адрес производственной площадки:
Россия, 664040, г. Иркутск, ул. Р. Люксембург, д. 184.
Претензии потребителей направлять по адресу:
АО «Фармасинтез», Россия, 664040, г. Иркутск, ул. Р. Люксембург, д. 184,
Купить Номидес в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
МНН: Осельтамивир
Производитель: АО Фармасинтез
Анатомо-терапевтическо-химическая классификация: Oseltamivir
Номер регистрации в РК:
РК-ЛС-5№023154
Информация о регистрации в РК:
03.08.2017 — 03.08.2022
- Скачать инструкцию медикамента
Торговое название
Номидес
Международное непатентованное название
Осельтамивир
Лекарственная форма
Капсулы,
30 мг, 45 мг, 75 мг
Фармакотерапевтическая группа
Противоинфекционные
препараты для системного использования. Противовирусные препараты для
системного применения. Противовирусные препараты прямого действия.
Ингибиторы нейраминидазы. Осельтамивир.
Код
АТХ J05AH02
Показания к применению
Лечение
гриппа
-
Препарат
Номидес показан для лечения взрослых у которых наблюдаются
характерные симптомы гриппа во время вспышки гриппа. Доказано, что
препарат обеспечивает терапевтический эффект, если лечение
начинается в течение первых двух дней с момента появления симптомов.
Профилактика
гриппа
-
постконтактная
профилактика у взрослых после контакта с больным с подтвержденным
клиническим диагнозом гриппа во время вспышки заболевания. -
соответствующий
порядок применения препарата Номидес для профилактики гриппа
определяется в каждом конкретном случае, исходя из конкретных
обстоятельств и характеристик популяции, требующей профилактической
защиты. В исключительных случаях (например, если имеет место
несовпадение циркулирующего штамма вируса и штамма, содержащегося в
вакцине, или в случае пандемии) можно рассмотреть возможность
назначения сезонной профилактики.
Препарат
Номидес не является заменой вакцинации.
Применение
противовирусных препаратов для лечения и профилактики гриппа должно
проводиться на основании официальных рекомендаций. Решение об
использовании осельтамивира для лечения и профилактики гриппа должно
приниматься с учетом известных характеристик циркулирующих штаммов
вируса, имеющейся информации о лекарственной чувствительности для
каждого сезона и влиянии, оказываемом заболеванием в различных
географических регионах и популяциях пациентов.
Перечень сведений,
необходимых до начала применения
Противопоказания
-
Повышенная
чувствительность к активному веществу или к любому компоненту
препарата -
Терминальная
стадия почечной недостаточности (клиренс креатинина ≤10 мл/мин) -
Тяжелая
печеночная недостаточность -
Дети
и подростки до 18 лет
Необходимые
меры предосторожности при применении
С осторожностью
применять во время беременности и в период грудного вскармливания.
Взаимодействия
с другими лекарственными препаратами
Клинически
значимые лекарственные взаимодействия маловероятны. Осельтамивира
фосфат в высокой степени превращается в активный метаболит под
действием эстераз, в основном расположенных в печени. Лекарственные
взаимодействия, обусловленные конкуренцией за связывание с активными
центрами эстераз, в литературных источниках широко не представлены.
Низкая степень связывания осельтамивира и активного метаболита с
белками плазмы не дают оснований предполагать наличие взаимодействий,
связанных с вытеснением лекарственных средств из связи с белками.
Ни
осельтамивира фосфат, ни его активный метаболит не являются
предпочтительным субстратом для полифункциональных оксидаз системы
цитохрома P450
или для глюкуронилтрансфераз. Оснований для взаимодействия с
пероральными контрацептивами нет.
Циметидин,
неспецифический ингибитор изофермента системы цитохрома P450
и конкурирующий в процессе канальцевой секреции с препаратами
щелочного типа и катионами, не влияет на плазменные концентрации
осельтамивира и его активного метаболита.
Маловероятны
клинически значимые межлекарственные взаимодействия, связанные с
конкуренцией за канальцевую секрецию, принимая во внимание резерв
безопасности для большинства подобных препаратов, пути выведения
активного метаболита осельтамивира (клубочковая фильтрация и анионная
канальцевая секреция), а также выводящую способность каждого из
путей.
Пробенецид
приводит к увеличению AUC
активного метаболита осельтамивира примерно в 2 раза (за счет
снижения активной канальцевой секреции в почках). Однако коррекции
дозы при одновременном применении с пробенецидом не требуется,
учитывая резерв безопасности активного метаболита.
Одновременный
прием с амоксициллином
не
влияет на плазменные концентрации осельтамивира и его компонентов,
демонстрируя слабую конкуренцию за выведение путем анионной
канальцевой секреции.Одновременный прием с парацетамолом
не влияет на плазменные концентрации осельтамивира и его активного
метаболита или парацетамола.
Фармакокинетических
взаимодействий между осельтамивиром, его основным метаболитом не
обнаружено при одновременном приеме с парацетамолом,
ацетилсалициловой кислотой, циметидином или антацидными средствами
(магния и алюминия гидроксид, кальция карбонат), варфарином,
римантадином или амантадином.
При
использовании осальтемивира с часто применяемыми препаратами, такими
как ингибиторы ангиотензинпревращающего фермента (эналаприл,
каптоприл), тиазидные диуретики (бендрофлуметиазид), антибиотики
(пенициллин, цефалоспорины, азитромицин, эритромицин и доксициклин),
блокаторы Н2-гистаминовых
рецепторов (ранитидин, циметидин), бета-адреноблокаторы
(пропранолол), ксантины (теофиллин), симпатомиметики (псевдоэфедрин),
опиаты (кодеин), глюкокортикостероиды, ингаляционные бронхолитики и
ненаркотические анальгетики (ацетилсалициловая кислота, ибупрофен и
парацетамол), изменений характера или частоты нежелательных явлений
не наблюдалось.
Применять
осельтамивир в комбинации с препаратами, имеющими узкую широту
терапевтического действия (например, хлорпропамид, метотрексат,
бутадион), необходимо с осторожностью.
Специальные
предупреждения
Осельтамивир
эффективен только при заболеваниях, вызванных вирусами гриппа.
Отсутствуют доказательства эффективности осельтамивира в отношении
заболеваний, вызванных агентами, отличными от вируса гриппа.
Номидес не является
заменителем вакцины против гриппа. Применение осельтамивира не должно
влиять на определение лиц для ежегодной вакцинации против гриппа.
Защита от гриппа длится только во время приема осельтамивира.
Лекарственное средство Номидес следует применять для лечения и
профилактики гриппа только при наличии надежных эпидемиологических
данных, подтверждающих факт циркуляции гриппа в популяции.
Чувствительность циркулирующих штаммов гриппа к осельтамивиру очень
вариабельна. Следовательно, медицинские работники, назначающие
рецептурные препараты, должны учитывать наиболее свежую информацию о
характере чувствительности циркулирующих в данный момент вирусов к
осельтамивиру при принятии решения об использовании лекарственного
средства Номидес.
Сопутствующие
тяжелые состояния
Отсутствуют данные о
безопасности и эффективности осельтамивира у пациентов с любыми в
достаточной степени тяжелыми или нестабильными медицинскими
состояниями. При которых риск госпитализации рассматривается как
неизбежный.
Пациенты с
иммунодефицитом
Эффективность
осельтамивира как для лечения, так и для профилактики гриппа у
пациентов с ослабленным иммунитетом не была четко установлена. Однако
у взрослых пациентов с ослабленным иммунитетом лечение гриппа следует
проводить на протяжении 10 дней, так как клинические исследования при
более коротком курсе терапии не проводилось.
Сердечные/респираторные
заболевания
Эффективность
осельтамивира для лечения пациентов, страдающих хроническим
заболеванием сердца и/или дыхательных путей, не была установлена. У
таких пациентов не отмечалось различий в частоте возникновения
осложнений между группами, получавшими лекарственное средство и
плацебо.
Тяжелая почечная
недостаточность
Рекомендуется
коррекция дозы при лечении и профилактике у пациентов с тяжелой
почечной недостаточностью. Чтобы дать
рекомендации по дозированию
см. раздел «Режим дозирования».
Нейропсихиатрические
расстройства
Нейропсихиатрические
расстройства во время приема осельтамивира отмечались у пациентов,
больных гриппом, особенно у подростков. Подобные проявления
наблюдались также у пациентов, больных гриппом, не принимавших
осельтамивир. Следует тщательно контролировать пациентов на предмет
поведенческих изменений и тщательно оценивать пользу и риск
продолжения лечения для каждого пациента.
Вспомогательные вещества
Лекарственное
средство Номидес содержит натрий в количестве менее 1 ммоль (23
мг) в дозе, т.е. практически «не содержит натрия»
Во время
беременности или лактации
При беременности и в
период грудного вскармливания осельтамивир применяют только в случае,
если предполагаемая польза для матери превышает потенциальный риск
для плода и ребенка.
Беременность
Заболевание гриппом
связано с неблагоприятным течением беременности, может вызывать
аномалии развития плода, а также является риском развития серьезных
врожденных пороков, в том числе пороков сердца. Большое количество
данных о применении осельтамивира у беременных женщин не указывает на
наличие фето/неонатальной токсичности осельтамивира и влияния на риск
пороков развития.
Отсутствуют данные о
влиянии осельтамивира на репродуктивную токсичность.
Применение препарата
Номидес при беременности возможно в случае необходимости и после
оценки имеющейся информации о безопасности и преимуществ терапии, а
также патогенности циркулирующего штамма вируса гриппа.
Кормление
грудью
Осельтамивир и
активный метаболит проникают в молоко. Данные по экскреции
осельтамивира с грудным молоком у человека и применению осельтамивира
кормящими женщинами ограничены. Ограниченные данные показывают, что
осельтамивир и его активный метаболит в небольших количествах
проникают в грудное молоко, создавая субтерапевтические концентрации
в крови младенца. При назначении осельтамивира кормящим женщинам
следует также учитывать имеющиеся сопутствующие заболевания и
патогенность циркулирующего штамма вируса гриппа. В период грудного
вскармливания осельтамивир применяют только в случае, если явные
ожидаемые преимущества лечения для кормящей матери превышают риски
для ребенка.
Особенности
влияния препарата на способность управлять транспортным средством или
потенциально опасными механизмами
Исследования по
изучению влияния лекарственного средства на способность управлять
транспортными средствами и заниматься другими потенциально опасными
видами деятельности, требующими повышенной концентрации внимания и
быстроты психомоторных реакций, не проводились. Исходя из профиля
безопасности, влияние осельтамивира на данные виды деятельности
маловероятно.
Рекомендации по
применению
Режим
дозирования
Взрослые
Лечение
Рекомендованная
доза для приема внутрь составляет 75 мг осельтамивира два раза в
сутки в течение 5 дней.
|
Масса |
Рекомендуемая |
|
˃ |
75 |
Лечение
необходимо начинать не позднее 2 суток с момента развития симптомов
гриппа.
Постконтактная
профилактика:
Рекомендованная
доза для профилактики гриппа после тесного контакта с больным гриппом
составляет 75 мг осельтамивира один раз в сутки в течение 10 дней.
Лечение необходимо начинать не позднее 2 суток от момента контакта с
больным.
|
Масса |
Рекомендуемая |
|
˃ |
75 |
Профилактика
во время эпидемии гриппа в сообществе:
для профилактики гриппа во время вспышки эпидемии рекомендовано
применение 75 мг осельтамивира один раз в сутки в течение 6 недель.
Инструкции по разовому
приготовлению суспензии приведены в разделе «Экстемпоральное
приготовление суспензии Номидес».
Особые
группы пациентов
Почечная
недостаточность
Лечение
гриппа: Для пациентов с почечной
недостаточностью средней и высокой степенью тяжести рекомендуется
снижение дозы препарата. В следующей таблице приведены рекомендации
по коррекции дозы у данных пациентов.
|
Клиренс |
Рекомендуемая |
|
>60 |
75 |
|
>30 |
30 |
|
>10 |
30 |
|
≤10 |
Не |
|
Пациенты, |
30 |
|
Пациенты, |
30 |
* ожидается,
что клиренс осельтамивира карбоксилата повышается при использовании
режима автоматического перитонеального диализа (АПД). Режим терапии
можно менять с ХАПД на АПД, если это необходимо по мнению нефролога.
Профилактика
гриппа: в следующей таблице содержатся
рекомендации по коррекции дозы препарата при профилактике гриппа у
пациентов со средней и тяжелой почечной недостаточностью.
|
Клиренс |
Рекомендуемая |
|
>60 |
75 |
|
>30 |
30 |
|
>10 |
30 |
|
≤10 |
Не |
|
Пациенты, |
30 |
|
Пациенты, |
30 |
* Данные
получены в исследованиях с участием пациентов, находящихся на
хроническом амбулаторном перитонеальном диализе (ХАПД); ожидается,
что клиренс осельтамивира карбоксилата повышается при использовании
режима автоматического перитонеального диализа (АПД). Режим терапии
можно менять с ХАПД на АПД, если это необходимо по мнению нефролога.
Пациенты
с печеночной недостаточностью
Коррекции
дозы при лечении и профилактике гриппа у пациентов с нарушением
функции печени легкой и средней степени тяжести не требуется.
Безопасность и фармакокинетика осельтамивира у пациентов с тяжелыми
нарушениями функции печени не изучалась.
Больные
пожилого и старческого возраста
Коррекции
дозы для профилактики или лечения гриппа не требуется.
Пациенты
с ослабленным иммунитетом (после трансплантации)
Лечение
Рекомендованная
доза осельтамивира составляет 75 мг 2 раза в сутки внутрь у взрослых
пациентов. Прием препарата необходимо начинать не позднее 2 суток с
момента развития симптомов заболевания.
Сезонная
профилактика
Для
сезонной профилактики гриппа у больных с ослабленным иммунитетом в
течение 12 недель, коррекции дозы не требуется.
Метод
и путь введения
Препарат
предназначен для приема внутрь.
Пациентам,
которые не могут проглотить капсулу, можно назначать соответствующие
дозы препарата Номидес в виде суспензии для приема внутрь (6 мг/мл).
Экстемпоральное приготовление
суспензии Номидес
В
случаях, когда у взрослых существует проблема с проглатыванием капсул
и отсутствует доступ к готовой пероральной суспензии, то необходимо
открыть капсулу и смешать её содержимое не более чем с одной чайной
ложкой подходящего подслащенного продукта питания (сахарная вода) для
того, чтобы скрыть горький вкус. Смесь необходимо тщательно
перемешать и дать пациенту целиком. Следует проглотить смесь сразу же
после приготовления.
Капсулы
75 мг
Если
пациентам требуется доза 75
мг, то
необходимо следовать следующим инструкциям:
1.
Держа одну капсулу 75 мг Номидес над маленькой емкостью,
аккуратно раскрыть капсулу и высыпать порошок в емкость.
2.
Добавить небольшое количество (не более 1 чайной ложки) подходящего
подслащенного продукта питания (чтобы скрыть горький вкус) и хорошо
перемешать.
3.
Тщательно перемешать смесь и выпить ее сразу же после приготовления.
Если в емкости осталось небольшое количество смеси, то следует
ополоснуть емкость небольшим количеством воды и выпить оставшуюся
смесь.
Если
пациентам требуются дозы 30-60
мг, то для
правильного дозирования необходимо следовать следующим инструкциям:
1.
Держа одну капсулу 75 мг препарата Номидес над маленькой
емкостью, аккуратно раскрыть капсулу и высыпать порошок в емкость.
2.
Добавить в порошок 5 мл воды с помощью шприца с метками,
показывающими количество набранной жидкости. Тщательно перемешать в
течение 2 минут.
3.
Набрать в шприц необходимое количество смеси из емкости согласно
нижеприведенной таблице:
|
Масса |
Рекомендованная |
Количество |
|
>23-40 |
60 |
4 |
Нет
необходимости в заборе нерастворенного белого порошка, поскольку он
является неактивным наполнителем. Нажав на поршень шприца, ввести все
его содержимое во вторую емкость. Оставшуюся неиспользованную смесь
необходимо выбросить.
4.
Во вторую емкость добавить небольшое количество (не более 1 чайной
ложки) подходящего подслащенного продукта питания, чтобы скрыть
горький вкус, и хорошо перемешать.
5.
Тщательно перемешать смесь и выпить ее сразу же после приготовления.
Если в емкости осталось небольшое количество смеси, то следует
ополоснуть емкость небольшим количеством воды и выпить оставшуюся
смесь.
Данную
процедуру следует повторять перед каждым приемом препарата.
Капсулы
30 мг и 45 мг
Для
правильного дозирования необходимо следовать следующим инструкциям:
1.
Определить необходимое количество капсул Номидес, требующееся для
приготовления смеси:
|
Масса |
Количество |
Количество |
|
>23-40 |
2 |
2 |
*Пациенты
с массой тела >40 кг в возрасте от 18 лет и взрослые могут
получать Номидес, используя для приготовления смеси одну капсулу 45
мг + одну капсулу 30 мг 2 раза в сутки для лечения или 1 раз в
сутки для профилактики.
2.
Убедитесь, что используется правильная доза препарата (в соответствии
с вышеприведенной таблицей). Держа одну или несколько капсул
Номидес над маленькой емкостью, аккуратно раскрыть одну или
несколько капсул и высыпать порошок в емкость.
3.
Добавить небольшое количество (не более 1 чайной ложки)
подходящего подслащенного продукта питания, чтобы скрыть горький
вкус, и хорошо перемешать.
4.
Тщательно перемешать смесь и выпить ее сразу же после приготовления.
Если в емкости осталось небольшое количество смеси, то следует
ополоснуть емкость небольшим количеством воды и выпить оставшуюся
смесь.
Повторяйте
данную процедуру перед каждым приемом препарата.
Меры,
которые необходимо принять в случае передозировки
Большинство
случаев передозировки, о которых сообщалось, не сопровождалось
какими-либо нежелательными явлениями. Нежелательные реакции в случаях
передозировки были аналогичны и сопоставимы по частоте возникновения
с нежелательными реакциями, наблюдавшимися при применении препарата в
терапевтических дозах, перечисленными в разделе «Нежелательные
реакции».
Специфический
антидот неизвестен.
Рекомендации
по обращению за консультацией к медицинскому работнику для
разъяснения способа применения лекарственного препарата
Рекомендовано
обратиться за консультацией к медицинскому работнику для разъяснения
способа применения лекарственного препарата.
Описание
нежелательных реакций, которые проявляются при стандартном применении
ЛП и меры, которые следует принять в этом случае
Очень
часто
—
головная боль
—
тошнота
Часто
—
бронхит, простой герпес, назофарингит, инфекции верхних дыхательных
путей, синусит
—
бессонница
—
кашель, боль в горле, ринорея
—
рвота, боль в животе (включая боль в верхнем отделе брюшной полости),
диспепсия
-
боль, головокружение (включая
вестибулярное), усталость, гипертермия, боль в конечностях
Нечасто
—
реакции гиперчувствительности
—
помутнение сознания, судороги
—
нарушения сердечного ритма
—
экзема, дерматит, сыпь, крапивница
Редко
—
тромбоцитопения
—
анафилактические реакции, анафилактоидные реакции
—
возбуждение, необычное поведение, тревожность, спутанность сознания,
мания, бред, галлюцинации, кошмары, членовредительство
—
зрительное расстройство
—
желудочно– кишечные кровотечения, геморрагический колит
—
ангионевротический отек, мультиформная эритема, синдром
Стивенса-Джонсона, токсический эпидермальный некролиз
При
возникновении нежелательных лекарственных реакций обращаться к
медицинскому работнику, фармацевтическому работнику или напрямую в
информационную базу данных по нежелательным реакциям (действиям) на
лекарственные препараты, включая сообщения о неэффективности
лекарственных препаратов
РГП
на ПХВ «Национальный центр экспертизы лекарственных средств и
медицинских изделий» Комитет контроля качества и безопасности
товаров и услуг Министерства здравоохранения Республики Казахстан
http://www.ndda.kz
Дополнительные
сведения
Состав
лекарственного препарата
Одна
капсула содержит
активное
вещество – осельтамивир, 30 мг,
45 мг, 75 мг
(в
виде осельтамивира фосфата, 39,4 мг, 59,1 мг, 98,5 мг)
вспомогательные
вещества: кремния диоксид коллоидный
(аэросил), коповидон, крахмал прежелатинизированный, кроскармеллоза
натрия, натрия стеарилфумарат, тальк.
состав
капсул:
для
дозировки 30 мг: натрия лаурилсульфат, титана диоксид (Е171), вода
очищенная, желатин;
для
дозировки 45 мг: натрия лаурилсульфат, титана диоксид (Е171),
краситель бриллиантовый голубой (Е133), вода очищенная, желатин;
для
дозировки 75 мг: натрия лаурилсульфат, титана диоксид (Е171),
краситель солнечный закат желтый (Е110), краситель пунцовый
[Понсо 4R] (Е124), вода очищенная, желатин.
Описание
внешнего вида, запаха, вкуса
Для
дозировки 30 мг: твердые желатиновые капсулы № «3»,
корпус белого цвета, крышечка белого цвета.
Для
дозировки 45 мг: твердые желатиновые капсулы № «2»,
корпус голубого цвета, крышечка голубого цвета.
Для
дозировки 75 мг: твердые желатиновые капсулы № «1»,
корпус белого цвета, крышечка оранжевого цвета.
Содержимое
капсул – белый или белый с желтоватым оттенком порошок.
Форма выпуска и упаковка
По
5 или 10 капсул в контурную ячейковую упаковку из пленки
поливинилхлоридной и фольги алюминиевой печатной лакированной
По
20, 30 капсул в банку полимерную из полиэтилена низкого давления с
крышкой натягиваемой с контролем первого вскрытия из полиэтилена
высокого давления. Свободное пространство заполняют ватой
медицинской. На банки наклеивают этикетки из бумаги этикеточной или
писчей или из полимерных материалов, самоклеющиеся.
По
1 или 2 контурной ячейковой упаковке вместе с инструкцией по
применению помещают в пачку из картона для потребительской тары.
Пачки помещают в групповую упаковку. Пачки помещают в групповую
упаковку.
По
1 банке вместе с инструкцией по применению помещают в пачку из
картона для потребительской тары. Пачки помещают в групповую упаковку
Срок хранения
Срок
хранения 3 года.
Не
применять по истечении срока годности!
Условия хранения
Хранить
в оригинальной упаковке при температуре не выше 25 °С.
Хранить
в недоступном для детей месте!
Условия отпуска из аптек
По
рецепту.
Сведения
о производителе
АО
«Фармасинтез», Россия.
Юридический
адрес: 664007, г. Иркутск, ул. Красногвардейская,
д. 23, оф. 3.
тел.:
+7 (3952) 550-355
факс:
+7 (3952) 550-325
адрес
электронной почты: info@pharmasyntez.com
Владелец регистрационного удостоверения
АО
«Фармасинтез», Россия.
Юридический
адрес: 664007, г. Иркутск, ул. Красногвардейская,
д. 23, оф. 3.
тел.:
+7 (3952) 550-355
факс:
+7 (3952) 550-325
адрес
электронной почты info@pharmasyntez.com
Наименование,
адрес и контактные данные (телефон, факс, электронная почта)
организации на территории Республики Казахстан, принимающей претензии
(предложения) по качеству лекарственных средств от потребителей и
ответственная ответственной за пострегистрационное наблюдение за
безопасностью лекарственного средства
г.
Алматы,
ТОО
«СonsultAsia»
ул.
Шевченко 165 Б
адрес
электронной почты: registration@consultingasia.kz
pv@consultingasia.kz
Тел/факс:
+77051708825/+727-3794258
| ЛВ_Номидес_итог_рус.docx | 0.06 кб |
| Номидес_каз.docx | 0.06 кб |
Отправить прикрепленные файлы на почту
Sarepta Therapeutics объявила о том, что FDA утвердило ее очередной препарат генной терапии. Лекарство, которое будет продаваться под брендом Amondys 45, теперь разрешено к применению у пациентов с мышечной дистрофией Дюшенна, несущих определенные мутации в гене, отвечающем за выработку дистрофина (ключевого для роста мышц белка). По оценкам Sarepta Therapeutics, такие мутации имеют 8% пациентов с мышечной дистрофией Дюшенна.
Согласно данным пациентсткой организации CureDuchenne, частично спонсируемой такими производителями лекарств, как Sarepta Therapeutics, утверждение Amondys 45 означает, что в настоящее время 30% пациентов с этим орфанным заболеванием имеют варианты лечения.
Amondys 45 (касимирсен) – антисмысловой олигонуклиотид, в конструкции которого задействован запатентованный Sarepta Therapeutics фосфородиамидат-морфолиноолигомер. Похожая технология используется в двух других препаратах этого же производителя, Exondys 51 (этеплирсен) и Vyondys 53 (голодирсен), эффективность которых неоднократно подвергалась сомнениям.
Как и в случае двух других одобренных продуктов компании, стоимость лечения последним препаратом Sarepta рассчитывается по весу – например, терапия 20-килограммового ребенка обойдется в 300 000 долларов в год.
Источник https://pharma.net.ua
Похожие статьи: