Одна капсула содержит: дутастерида — 0,5 мг.
Вспомогательные вещества: моно- и диглицериды каприловой/каприновой кислоты, бутилгидрокситолуол.
Состав оболочки капсулы: желатин, глицерин, титана диоксид Е-171, вода очищенная, железа оксид желтый Е-172, лецитин, триглицериды средней цепи.
Капсулы мягкие желатиновые овальной формы со швом, непрозрачные, светло-желтого цвета.
Средства для лечения урологических заболеваний. Средства для лечения
Доброкачественной гиперплазии предстательной железы.
Код ATX: G04CB02
— Лечение среднетяжелых и тяжелых симптомов доброкачественной гиперплазии предстательной железы (ДГПЖ).
— Снижение риска острой задержки мочи и потребности в хирургическом лечении у пациентов со среднетяжелыми и тяжелыми симптомами ДГПЖ.
Авопрост принимается внутрь. Капсулы необходимо глотать целиком, запивая стаканом воды. Не следует капсулы открывать и/или разжевывать, поскольку содержимое капсулы может вызвать раздражение слизистой ротоглотки.
Авопрост можно принимать независимо от приема пищи.
Авопрост можно применять в виде монотерапии, а также в комбинации с аг -адреноблокатором тамсулозином (0,4 мг) (см. разделы «Меры предосторожности», «Побочное действие»).
Взрослые мужчины (включая пожилых)
Рекомендуемая доза лекарственного средства Авопрост составляет одну капсулу (0,5 мг) 1 раз в сутки внутрь.
Улучшение симптомов может наблюдаться на ранних сроках лечения, однако для достижения ответа на терапию может потребоваться до 6 месяцев.
Коррекция дозы при применении у пациентов пожилого возраста не требуется.
Пациенты с нарушениями функции почек
Влияние почечной недостаточности на фармакокинетику дутастерида не изучалось. У пациентов с почечной недостаточностью коррекция дозы не предполагается.
Пациенты с нарушениями функции печени
Влияние печеночной недостаточности на фармакокинетику дутастерида не изучалось, поэтому при применении у пациентов с печеночной недостаточностью в степени от легкой до средней следует соблюдать осторожность (см. разделы «Меры предосторожности»). Дутастерид противопоказан к применению у пациентов с тяжелой печеночной недостаточностью (см. раздел «Противопоказания»).
Комбинированная терапия должна назначаться только после тщательной оценки пользы и риска в связи с увеличением вероятности возникновения побочных реакций (включая сердечную недостаточность), а также после рассмотрения альтернативных вариантов лечения, включая монотерапии (см.раздел «Способ применения и дозировка»).
Рак предстательной железы и опухоли низкой степени дифференцировки
В четырехлетнем многоцентровом рандомизированном двойном слепом плацебо-контролируемом клиническом исследовании REDUCF изучалось влияние приема дутастерида в дозе 0,5 мг в сутки на пациентов с высоким риском развития рака предстательной железы (включая мужчин в возрасте от 50 до 75 лет с уровнем ПСА в пределах 2,5-10 нг/мл и отрицательным результатом биопсии за 6 месяцев до включения в исследование) в сравнении с плацебо. Результаты данного исследования выявили повышение частоты случаев рака предстательной железы (8-10 по шкале Глисона) у мужчин, находящихся на лечении дутастеридом (n=29, 0,9%), по сравнению с группой мужчин, принимающих плацебо (n=19, 0,9%). Связь между приемом дутастерида и раком предстательной железы (8-10 по шкале Глисона) не понятна. Необходимо регулярно проводить обследование мужчин, принимающих дутастерид, на предмет развития рака предстательной железы.
Простат-специфический антиген (ПСА)
Показатель концентрации ПСА в сыворотке является важной составляющей процесса выявления рака предстательной железы. После 6 месяцев применения дутастерида средняя концентрация ПСА в сыворотке снижается примерно на 50%.
По прошествии 6 месяцев терапии дутастеридом у пациентов следует определить новый исходный показатель концентрации ПСА. Впоследствии рекомендуется регулярно контролировать концентрацию ПСА. Любое подтвержденное увеличение уровня ПСА от минимального значения при проведении терапии дутастеридом может свидетельствовать о наличии рака предстательной железы либо об отсутствии комплаентности к терапии дутастеридом и должно быть тщательно изучено, даже если оцениваемые показатели не выходят за пределы нормы для мужчин, не получающих ингибитор 5-α-редуктазы. При интерпретации показателя уровня ПСА у пациента, получающего дутастерид, данный показатель следует сравнивать с предыдущими показателями уровня ПСА.
Применение дутастерида не препятствует использованию такого маркера, как уровень ПСА, в процессе диагностирования рака предстательной железы после определения нового исходного уровня.
Показатели концентрации общего ПСА в сыворотке возвращаются к исходным значениям в течение 6 месяцев после прекращения терапии. Отношение несвязанного ПСА к общему ПСА остается постоянным даже при применении дутастерида. Если клиницисты используют процентное содержание несвязанного ПСА при диагностировании рака предстательной железы у мужчин, получающих дутастерид, корректировка дозы с учетом его значения не представляется необходимой. Необходимо проводить пальцевое ректальное исследование и другое обследование для исключения рака предстательной железы до начала лечения дутастеридом и периодически в дальнейшем.
Нарушения со стороны сердечно-сосудистой системы
В ходе двух четырехлетних клинических исследований частота случаев сердечной недостаточности (составной термин для ряда зафиксированных явлений, в основном, сердечная недостаточность и застойная сердечная недостаточность) была чуть выше у пациентов, принимающих комбинацию дутастерида и α-адреноблокаторов, преимущественно тамсулозина, по сравнению с пациентами, находящимися на монотерапии. Однако в данных исследованиях частота возникновения сердечной недостаточности была ниже во всех группах активного лечения по сравнению с группой плацебо. Другие данные, полученные для дутастерида или α-адреноблокаторов, не свидетельствуют о повышении риска заболеваний сердечно-сосудистой системы.
Рак молочной железы
В ходе клинических исследований и постмаркетингового наблюдения поступали редкие сообщения о развитии рака молочной железы у мужчин, принимающих дутастерид. Однако в эпидемиологических исследованиях не было показано увеличения риска развития рака грудной железы у мужчин при применении ингибиторов 5-α-редуктазы. Врачам следует проинструктировать пациентов о необходимости сразу же сообщать о любых изменениях в тканях молочной железы (например, появлении узелков или выделений из сосков).
Печеночная недостаточность
Применение дутастерида у пациентов с печеночной недостаточностью не изучалось. Поэтому дутастерид следует с осторожностью применять у пациентов с нарушениями функции печени от легкой до умеренной степени.
Поврежденные капсулы
Дутастерид всасывается через кожу, поэтому женщины, дети и подростки должны избегать контакта с поврежденными капсулами. В случае контакта с поврежденными капсулами необходимо сразу промыть соответствующий участок кожи водой с мылом.
Сведения по снижению показателей концентрации ПСА в сыворотке крови при проведении терапии дутастеридом и рекомендации по выявлению рака предстательной железы представлены в разделе «Меры предосторожности».
Влияние других препаратов на фармакокинетику дутастерида
Совместное использование с ингибиторами CYP3A4 и/или ингибиторами Р-гликопротеина
Дутастерид преимущественно выводится путем метаболизма. In vitro метаболизм дутастерида катализируется изоферментами CYP3A4 и CYP3A5. Официальные исследования взаимодействия с мощными ингибиторами CYP3A4 не проводились. В то же время, результаты одного популяционного фармакокинетического исследования свидетельствовали о том, что показатели концентрации дутастерида в сыворотке крови у небольшого количества пациентов, получавших одновременно верапамил или дилтиазем (умеренный ингибитор CYP3A4 и ингибитор Р-гликопротеина), были в среднем в 1,6-1,8 раз выше, чем у других пациентов.
Продолжительное комбинированное применение дутастерида и мощных ингибиторов изофермента CYP3A4 (ритонавира, индинавира, нефазодона, итраконазола, кетоконазола при пероральном введении) может вызвать увеличение концентрации дутастерида в сыворотке. Дополнительное ингибирование 5-α-редуктазы при увеличении экспозиции дутастерида маловероятно. Вместе с тем, при возникновении побочных эффектов следует рассмотреть возможность уменьшения частоты приема дутастерида. Следует также отметить, что в случае ингибирования действия фермента, длительный период полувыведения может еще больше увеличиться, в результате чего для достижения нового равновесного состояния может понадобиться более 6 месяцев.
Применение холестирамина в дозе 12 г через 1 час после однократной дозы дутастерида 5 мг не повлияло на фармакокинетику дутастерида.
Влияние дутастерида на фармакокинетику других лекарственных средств
Дутастерид не влияет на фармакокинетику варфарина или дигоксина. Это говорит о том, что дутастерид не ингибирует/индуцирует ни изофермент CYP2C9, ни транспортный белок Р-гликопротеин. In vitro дутастерид не ингибирует такие изоферменты, как СУР1А2, CYP2D6, CYP2C9, CYP2C19 и CYP3A4.
В малом клиническом исследовании (n=24) продолжительностью в две недели с участием здоровых мужчин применение дутастерида (0,5 мг в сутки) не повлияло на фармакокинетику тамсулозина и тетразозина. Результаты, свидетельствующие о фармакодинамическом взаимодействии, в данном исследовании получены не были.
Дутастерид противопоказан к применению у женщин.
Беременность
Как и другие ингибиторы 5-α-редуктазы, дутастерид препятствует превращению тестостерона в дигидротестостерон; воздействие дутастерида на организм беременной женщины, вынашивающей плод мужского пола, может отрицательно отразиться на развитии наружных гениталий плода (см. раздел «Меры предосторожности»), Дутастерид в небольших количествах был выявлен в сперме испытуемых, получавших его в суточной дозе 0,5 мг. Неизвестно, оказывает ли отрицательное влияние на плод мужского пола контакт матери со спермой пациента, получающего дутастерид (наибольший риск контакта имеет место в течение первых 16 недель беременности).
Как и в случае со всеми ингибиторами 5-α-редуктазы, если наступила беременность или если есть подозрение на беременность, контакт женщины со спермой получающего препарат мужчины необходимо исключить при помощи презерватива.
Лактация
Неизвестно, выделяется ли дутастерид с грудным молоком.
Фертильность
Сообщалось о влиянии дутастерида на свойства спермы (уменьшение количества сперматозоидов, объема спермы и подвижности сперматозоидов) у здоровых мужчин. Возможность снижения мужской фертильности нельзя исключать.
Применение дутастерида в виде монотерапии
Примерно у 19% из 2167 пациентов, которые применяли дутастерид в ходе двухлетнего плацебо-контролируемого клинического исследования фазы III, побочные реакции развивались в ходе первого года лечения. Большинство побочных реакций были слабо или умеренно выраженными и затрагивали репродуктивную систему. В ходе дальнейшего двухлетнего открытого расширенного исследования изменений в профиле побочных реакций выявлено не было.
В таблице ниже описаны побочные реакции из контролируемых клинических исследований и постмаркетингового наблюдения. Перечисленные ниже побочные реакции, которые, по мнению исследователя, связаны с приемом препарата (частота возникновения не менее 1%) в ходе первого года лечения чаще встречались у пациентов из группы, принимающей дутастерид, чем в группе, принимающей плацебо. О побочных реакциях в ходе постмаркетинговых исследований сообщалось в спонтанных отчетах, поэтому фактическая частота реакций не известна.
Оценка нежелательных эффектов основана на нижеследующих данных о частоте возникновения: очень частые — 1/10 назначений (>10%); частые — 1/100 назначений (>1% и <10%); не частые — 1/1000 назначений (>0,1% и <1%); редкие — 1/10000 назначений (> 0,01% и < 0,1%); очень редкие — 1/10000 назначений (<0,01%) и частота не известна (не может быть оценена по имеющимся данным).
| Системноорганный класс | Побочные реакции | Частота возникновения побочных реакций в ходе клинических исследований | |
| Частота в ходе 1-го года лечения (n=2167) | Частота в ходе 2-го года лечения (n=1744) | ||
| Нарушения со стороны половой системы и молочной железы | Импотенция1 | 6,0% | 1,7% |
| Изменение (снижение) либидо1 | 3,7% | 0,6% | |
| Нарушение эякуляции2 | 1,8% | 0,5% | |
| Нарушения со стороны молочных желез (включая болезненность и увеличение грудных желез) | 1,3% | 1,3% | |
| Нарушения со стороны иммунной системы | Аллергические реакции, включая сыпь, зуд, крапивницу, ограниченные отеки, ангионевротический отек | Частота побочных реакций в ходе постмаркетинговых исследований | |
| Частота не известна | |||
| Психические нарушения | Депрессия | Частота не известна | |
| Нарушения со стороны кожи и подкожных тканей | Алопеция(в основном, выпадение волос), гипертрихоз | Нечасто | |
| Нарушения со стороны репродуктивной системы и молочной железы | Боль и опухание яичек | Частота не известна |
1 Данные нежелательные явления со стороны репродуктивной системы связаны с применением дутастерида (в режиме монотерапии и в комбинации с тамсулозином). После прекращения терапии они могут сохраниться. Роль дутастерида в сохранении этих нежелательных явлений не установлена.
2 включает снижением объема спермы.
Комбинированная терапия лекарственным средством Авопрост и α-адреноблокатором тамсулозином
Данные четырехлетнего исследования CombAT, в ходе которого монотерапию дутастеридом 0,5 мг (n=1623) 1 раз в сутки сравнивали с монотерапией тамсулозином 0,4 мг (n=1611) 1 раз в сутки и с комбинированной терапией (n=1610), показали, что частота возникновения побочных реакций, которые, по мнению исследователя, связаны с лечением, в ходе первого, второго, третьего и четвертого годов лечения составила соответственно 22%, 6%, 4% и 2% для комбинированной терапии дутастеридом/тамсулозином, 15%, 6%, 3% и 2% для монотерапии дутастеридом и 13%, 5%, 2% и 2% для терапии тамсулозином. Более высокая частота возникновения побочных реакций в ходе первого года лечения в группе комбинированной терапии была связана с более высокой частотой нарушений со стороны половой системы, в частности, с нарушением эякуляции, наблюдаемым в данной группе. Ниже описаны побочные реакции, о которых сообщалось с частотой не менее 1% в ходе первого года исследования CombAT. Частота возникновения данных реакций в ходе четырех лет лечения представлена в таблице ниже:
|
Системно-органный класс |
Побочные реакции
|
Частота возникновения реакций в ходе лечения | ||
| Год 1 | Год 2 | Год 3 | Год 4 | |
| Комбинация* | n=1610 | n=1428 | n=1238 | n=1200 |
| Дутастерид | n=1623 | n=1464 | n=1325 | n=1200 |
| Тамсулозин | n=1611 | n=1468 | n =1281 | n=1112 |
| Нарушения со стороны половой системы и молочной железы | Импотенция*** | |||
| Комбинация* | 6,3% | 1,8% | 0,9% | 0,4% |
| Дутастерид | 5,1% | 1,6% | 0,6% | 0,3% |
| Тамсулозин | 3,3% | 1,0% | 0,6% | 1,1% |
| Изменение (снижение) либидо*** | ||||
| Комбинация* | 5,3% | 0,8% | 0,2% | 0% |
| Дутастерид | 3,8% | 1,0% | 0,2% | 0% |
| Тамсулозин | 2,5% | 0,7% | 0,2% | <0,1% |
| Нарушение эякуляции***1 | ||||
| Комбинация* | 9,0% | 1,0% | 0,5% | <0,1% |
| Дутастерид | 1,5% | 0,5% | 0,2% | 0,3% |
| Тамсулозин | 2,7% | 0,5% | 0,2% | 0,3% |
| Нарушение со стороны молочной железы** | ||||
| Комбинация* | 2,1% | 0,8% | 0,9% | 0,6% |
| Дутастерид | 1,7% | 1,2% | 0,5% | 0,7% |
| Тамсулозин | 0,8% | 0,4% | 0,2% | 0% |
| Нарушения со стороны нервной системы | Головокружение | |||
| Комбинация* | 1,4% | 0,1% | <0,1% | 0,2% |
| Дутастерид | 0,7% | 0,1% | <0,1% | <0,1% |
| Тамсулозин | 1,3% | 0,4% | <0,1% | 0% |
| Нарушения со стороны сердечно- сосудистой системы | Сердечная недостаточность (составной термин)**** | |||
| Комбинация* | 0,2% | 0,4% | 0,2% | 0,2% |
| Дутастерид | <0,1% | 0,1% | <0,1% | 0% |
| Тамсулозин | 0,1% | <0,1% | 0,4% | 0,2% |
* комбинация дутастерида 0,5 мг 1 раз в сутки и тамсулозина 0,4 мг 1 раз в сутки.
** включает болезненность и увеличение грудных желез.
***данные нежелательные явления связаны с применением дутастерида (в режиме монотерапии и в комбинации с тамсулозином). После прекращения терапии они могут сохраниться. Роль дутастерида в сохранении этих нежелательных явлений не установлена.
**** составной термин «сердечная недостаточность» включает в себя застойную сердечную недостаточность, сердечную недостаточность, левожелудочковую недостаточность, острую сердечную недостаточность, кардиогенный шок, острую левожелудочковую недостаточность, правожелудочковую недостаточность, острую правожелудочковую недостаточность, желудочковую недостаточность, кардиопульмональную недостаточность и застойную кардиомиопатию.
1 включает снижения объема спермы.
Другие данные
В ходе клинического исследования REDUCE были получены данные, свидетельствующие о более высокой, чем в группе плацебо, частоте случаев рака предстательной железы, оценивавшегося 8-10 баллами по шкале Глисона, в группе терапии дутастеридом. Что именно повлияло на результаты данного исследования: свойство дутастерида уменьшать объем предстательной железы или факторы, связанные с проведением исследования, установлено не было.
Следующее явление было отмечено в клинических исследованиях и за период пострегистрационного применения: рак молочной железы у мужчин (см. раздел «Меры предосторожности»).
Вы можете сообщить о нежелательных реакциях в информационную базу данных по нежелательным реакциям (действиям) на лекарственные средства, включая сообщения о неэффективности лекарственных средств, выявленным в Республике Беларусь (УП «Центр экспертиз и испытаний в здравоохранении» Министерства здравоохранения Республики Беларусь», http:www.rceth.by). Сообщая о нежелательных реакциях, Вы помогаете получить больше сведений о безопасности препарата.
В ходе клинических испытаний дутастерида с участием здоровых добровольцев однократные суточные дозы дутастерида до 40 мг/сутки (в 80 раз больше терапевтической дозы) применялись на протяжении 7 дней без существенных проблем безопасности. В клинических исследованиях дозы 5 мг/сутки применялись в течение 6 месяцев без развития неблагоприятных реакций, отличных от тех, которые наблюдались при применении терапевтических доз 0,5 мг.
Специфический антидот при передозировке дутастерида отсутствует, поэтому при подозрении на передозировку следует проводить адекватную симптоматическую и поддерживающую терапию.
Дутастерид противопоказан:
— женщинам, детям и подросткам (см. раздел «Применение во время беременности и в период грудного вскармливания. Влияние на фертильность»);
— пациентам с гиперчувствительностью к дутастериду, другим ингибиторам 5-а- редуктазы или к любому ингредиенту этого препарата;
— пациентам с тяжелой печеночной недостаточностью.
С учетом фармакодинамических свойств дутастерида не ожидается, что прием дутастерида будет оказывать влияние на вождение автомобиля и работу с механизмами.
Капсулы мягкие желатиновые по 10 капсул в контурной ячейковой упаковке из пленки непрозрачной поливинилхлоридной/поливинилдихлоридной и фольги алюминиевой печатной лакированной, по 3 или 6 контурных ячейковых упаковок вместе с листком-вкладышем в пачке из картона.
Хранят при температуре не выше 25 °C.
Хранят в недоступном для детей месте.
2 года. Не использовать после истечения срока годности, указанного на упаковке.
Отпуск производится по рецепту врача.
Информация о производителе:
УП «Минскинтеркапс», Республика Беларусь,
220075, г. Минск, а/я 112, ул. Инженерная, д. 26
тел./факс (+ 37517) 276-01-59
e-mail: info@mic.by, www.mic.by
Информацию о нежелательных реакциях направлять по адресу:
УП «Минскинтеркапс», Республика Беларусь,
220075, г. Минск, а/я 112, ул. Инженерная, д. 26, каб. 204
e-mail: fnadzor@mic.by
тел: (+ 37517) 276-01-59
Фармакодинамика
Дутастерид снижает циркулирующие уровни дигидротестостерона (ДГТ) путем подавления активности изоферментов 5-α-редуктазы 1 и 2 типа, которые ответственны за превращение тестостерона в ДГТ.
ДУТАСТЕРИД В РЕЖИМЕ МОНОТЕРАПИИ
Влияние на концентрацию ДГТ / тестостерона
Влияние ежедневного приема дутастерида на снижение уровня ДГТ является дозозависимым и отмечается через 1-2 недели (снижение на 85% и 90%, соответственно).
У пациентов с доброкачественной гиперплазией предстательной железы (ДГПЖ), получавших дутастерид в дозе 0,5 мг/сутки, медиана снижения концентрации ДГТ в сыворотке составила 94% через 1 год терапии и 93% через 2 года терапии, а медиана увеличения концентрации тестостерона в сыворотке составила 19% через 1 и 2 года терапии.
Влияние на объем предстательной железы
Значительное уменьшение объема предстательной железы обнаруживается уже через один месяц после начала лечения и продолжается по 24-й месяц (р < 0,001). На 12-й месяц лечения применение дутастерида привело к среднему сокращению объема предстательной железы на 23,6% (с 54,9 мл на исходном уровне до 42,1 мл), в то время как в группе плацебо среднее сокращение объема составило 0,5% (с 54,0 мл до 53,7 мл). Существенное (р < 0,001) уменьшение также имело место в переходной зоне предстательной железы уже после одного месяца терапии, оно продолжалось по 24-й месяц; через 12 месяцев среднее сокращение объема переходной зоны предстательной железы в группе терапии дутастеридом составило 17,8% (с 26,8 мл на исходном уровне до 21,4 мл), при этом в группе плацебо имело место увеличение объема в среднем на 7,9% (с 26,8 мл до 27,5 мл). Сокращение объема предстательной железы, наблюдавшееся в течение первых 2 лет двойной слепой терапии, сохранилось на протяжении дополнительных 2 лет терапии в ходе расширенных открытых исследований. Уменьшение размеров предстательной железы ведет к облегчению симптомов и к снижению риска острой задержки мочи (ОЗМ) и хирургического вмешательства в связи с ДГПЖ.
Клиническая эффективность и безопасность
Применение дутастерида в дозе 0,5 мг/сутки изучалось в сравнении с плацебо на примере 4325 испытуемых мужского пола с ДГПЖ с симптомами в степени от умеренной до тяжелой, с объемом предстательной железы ≥30 мл и с концентрацией ПСА в пределах 1,5-10 нг/мл в ходе трех двухгодичных многоцентровых международных плацебо-контролируемых двойных слепых первичных исследований эффективности. Данные клинические исследования были продлены до 4 лет за счет дополнительного периода открытой терапии, при этом все пациенты, оставшиеся в исследовании, продолжали получать ту же самую дозу 0,5 мг. По прошествии 4 лет из первоначально рандомизированных пациентов в группе плацебо и в группе дутастерида осталось 37% и 40% испытуемых, соответственно. Большинство (71%) из 2340 испытуемых в дополнительных периодах с открытой терапией получали лечение в течение 2 дополнительных лет.
Наиболее важными параметрами клинической эффективности были: индекс симптомов американской урологической ассоциации (AUA-SI), максимальная скорость мочеиспускания (Qmax), частота случаев острой задержки мочи и хирургического вмешательства в связи с ДГПЖ.
Максимальное значение индекса AUA-SI, определяемого с помощью опросника для оценки симптомов, связанных с ДГПЖ, из семи пунктов, составляет 35 баллов. Исходное среднее значение индекса составляло примерно 17 баллов. По прошествии шести месяцев, одного года и двух лет терапии улучшение индекса в группе плацебо составляло 2,5, 2,5 и 2,3 балла, соответственно, а в группе дутастерида – 3,2, 3,8 и 4,5 балла, соответственно. Различия между двумя группами терапии были статистически значимыми. Улучшение индекса AUA-SI, наблюдавшееся в течение первых 2 лет двойной слепой терапии, сохранилось на протяжении еще 2 лет в ходе расширенных открытых исследований.
Qmax (максимальная скорость мочеиспускания)
Среднее значение Qmax в клинических исследованиях на исходном уровне было около 10 мл/сек (нормальное значение Qmax 15 мл/сек). По прошествии одного года и двух лет терапии скорость мочеиспускания увеличилась в группе плацебо на 0,8 и 0,9 мл/сек, соответственно, а в группе дутастерида на 1,7 и 2,0 мл/сек, соответственно. Различия между двумя группами терапии на отрезке времени с 1-го по 24-й месяц было статистически значимым. Увеличение максимальной скорости мочеиспускания, наблюдавшееся в течение первых 2 лет двойной слепой терапии, сохранилось на протяжении еще 2 лет в ходе расширенных открытых исследований.
Острая задержка мочи (ОЗМ) и хирургическое вмешательство
По прошествии двух лет терапии частота случаев ОЗМ в группе плацебо составляла 4,2%, а в группе дутастерида – 1,8% (снижение риска на 57%). Данное различие является статистически значимым, оно означает, что лечение 42 (95% ДИ 30-73) пациентов дутастеридом на протяжении двух лет предотвращает один случай ОЗМ.
После двух лет терапии частота случаев хирургического вмешательства в связи с ДГПЖ в группе плацебо составляла 4,1%, а в группе дутастерида — 2,2% (снижение риска на 48%). Данное различие является статистически значимым, оно означает, что лечение 51 пациента (95% ДИ 33-109) дутастеридом на протяжении двух лет позволяет избежать одного хирургического вмешательства.
Распределение волосяного покрова
В рамках реализации программы клинических исследований фазы III влияние дутастерида на распределение волосяного покрова официально не изучалось; вместе с тем, применение ингибиторов 5-α-редуктазы может снизить потерю волос и способствовать их росту у пациентов с облысением мужского типа (мужская андрогенная алопеция).
Функция щитовидной железы
Влияние на функцию щитовидной железы изучалось в ходе годичного клинического исследования с участием здоровых мужчин. После одного года терапии дутастеридом показатели уровня несвязанного тироксина не изменились, в то же время в сравнении с плацебо уровень тиреостимулирующего гормона (ТСГ) незначительно увеличился (на 0,4 мкМЕ/мл). Вместе с тем, поскольку показатели уровня ТСГ варьировались, причем диапазон медианных значений уровня ТСГ (1,4-1,9 мкМЕ/мл) находился в пределах нормы (0,5 — 5/6 мкМЕ/мл), а показатели концентрации тироксина были устойчивыми в пределах нормы и схожими при применении плацебо и дутастерида, указанные изменения уровня ТСГ были расценены как клинически незначимые. Результаты всех клинических исследований свидетельствуют об отсутствии отрицательного влияния дутастерида на функцию щитовидной железы.
Новообразования молочной железы
В двухлетних клинических исследованиях с продолжительностью применения дутастерида 3374 пациенто-лет по состоянию на момент перехода участников в 2-летнее расширенное (дополнительное) открытое исследование случаи рака молочной железы у мужчин были отмечены у 2 пациентов в группе дутастерида и у 1 пациента в группе плацебо. В клинических исследованиях CombAT и REDUCE, проводившихся на протяжении 4 лет, случаи рака молочной железы не были отмечены ни в одной группе терапии, при этом воздействие дутастерида составило 17489 пациенто-лет, а воздействие комбинации тамсулозина и дутастерида – 5027 пациенто-лет.
В двух эпидемиологических исследованиях типа случай-контроль, одно из которых было проведено в США (n = 339 случаев рака грудной железы и n = 6780 контрольных случаев), а другое в базе данных здравоохранения Великобритании (n = 398 случаев рака грудной железы и n = 3930 контрольных случаев) не было продемонстрировано увеличения риска развития рака грудной железы у мужчин при применении ингибиторов 5-α-редуктазы (см. раздел «Меры предосторожности»). Результаты первого исследования не выявили положительной связи между раком грудной железы у мужчин (относительный риск для ≥ 1 года применения до постановки диагноза рака грудной железы по сравнению с < 1 годом применения: 0,70: 95% ДИ 0,34; 1,45). Во втором исследовании оцененное отношение шансов для рака грудной железы, связанного с применением ингибиторов 5-α-редуктазы, по сравнению с отсутствием применения составляло 1,08: 95 % ДИ 0,62; 1,87. Взаимосвязь между длительным применением дутастерида и раком грудной железы у мужчин не установлена.
Влияние на мужскую фертильность
Влияние дутастерида в дозе 0,5 мг/сутки на свойства спермы изучалось в исследовании с участием здоровых добровольцев в возрасте от 18 до 52 лет (n = 27 в группе дутастерида; n = 23 в группе плацебо) на протяжении 52 недель терапии и 24 недель последующего наблюдения. Через 52 недели лечения средние показатели процентного уменьшения общего количества сперматозоидов, объема спермы и подвижности сперматозоидов с корректировкой по изменению от исходного уровня в группе плацебо составляли 23%, 26% и 18%, соответственно. Изменение концентрации и морфологии сперматозоидов не отмечалось. Через 24 недели последующего наблюдения среднее процентное изменение общего количества сперматозоидов в группе дутастерида оставалось на 23% ниже исходного показателя. При том, что средние значения всех параметров во всех отметках времени оставались в пределах нормы и не соответствовали заранее определенным критериям клинически существенного изменения (30%), у двух пациентов в группе дутастерида через 52 недели терапии количество сперматозоидов уменьшилось более чем на 90% от исходного уровня, при этом через 24 недели последующего наблюдения было отмечено частичное восстановление. Возможность снижения мужской фертильности нельзя исключать.
ДУТАСТЕРИД В КОМБИНАЦИИ С АЛЬФА-АДРЕНОБЛОКАТОРОМ ТАМСУЛОЗИНОМ
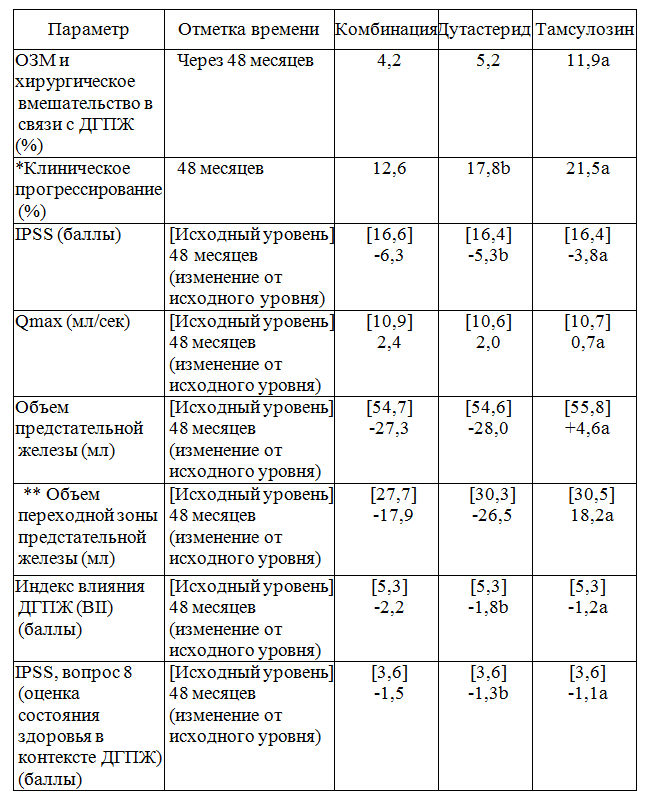
В ходе многоцентрового международного рандомизированного двойного слепого клинического исследования в параллельных группах (исследование CombAT), в котором участвовали пациенты с симптомами ДГПЖ в степени от умеренной до тяжелой с объемом предстательной железы ≥30 мл и концентрацией ПСА в пределах 1,5-10 нг/мл, изучалось применение следующих препаратов: дутастерид 0,5 мг/сутки (n = 1623), тамсулозин 0,4 мг/сутки (n = 1611) и комбинация дутастерида 0,5 мг плюс тамсулозин 0,4 мг (n = 1610). Примерно 53% пациентов ранее получали терапию с применением ингибиторов 5-а-редуктазы или блокаторов α-адренорецепторов. Первичной конечной точкой в течение первых 2 лет терапии было изменение суммы баллов по международной шкале оценки простатических симптомов (IPSS) (шкала из 8 пунктов, основанная на AUA-SI с дополнительным вопросом по качеству жизни). Вторичные конечные точки, оценивавшиеся после 2 лет лечения, включали такие показатели, как максимальная скорость мочеиспускания (Qmax) и объем предстательной железы. В сравнении с группой дутастерида и группой тамсулозина результаты в отношении IPSS, полученные в группе комбинированной терапии, были значимыми, начиная с отметок времени Месяц 3 и Месяц 9, соответственно. Результаты в отношении Qmax в группе комбинированной терапии были значимыми, начиная с отметки времени Месяц 6, в сравнении с группами дутастерида и тамсулозина.
Первичной конечной точкой после 4 лет терапии было время до развития первого случая ОЗМ или хирургического вмешательства в связи с ДГПЖ. После 4 лет терапии снижение риска ОЗМ или хирургического вмешательства в связи с ДГПЖ в группе комбинированной терапии было статистически значимым (снижение риска на 65,8% при значении р < 0,001 [95% ДИ 54,7% — 74,1%]) в сравнении с результатом в группе монотерапии тамсулозином. Показатели частоты случаев ОЗМ и хирургического вмешательства в связи с ДГПЖ за 4 года в группе комбинированной терапии и в группе тамсулозина составили 4,2% и 11,9%, соответственно (р < 0,001). По сравнению с группой монотерапии дутастеридом в группе комбинированной терапии риск случаев ОЗМ и хирургического вмешательства в связи с ДГПЖ снизился на 19,6% (р = 0,18 [95% ДИ 10,9% — 41,7%]). Показатели частоты случаев ОЗМ и хирургического вмешательства в связи с ДГПЖ за 4 года в группе комбинированной терапии и в группе дутастерида составили 4,2% и 5,2%, соответственно.
Вторичные конечные точки, оценивавшиеся после 4 лет терапии, включали время до клинического прогрессирования (комбинированный показатель, включавший следующие составляющие: ухудшение, подтвержденное изменением суммы баллов по шкале IPSS на 4 балла, случаи ОЗМ, связанные с ДГПЖ, недержание мочи, инфекция мочевыводящих путей (ИМП) и почечная недостаточность); изменение суммы баллов по международной шкале оценки простатических симптомов (IPSS), изменение максимальной скорости мочеиспускания и объема предстательной железы. Результаты исследования после 4 лет терапии представлены далее.
Значения показателей на исходном уровне — средние, значения изменений от исходного уровня — откорректированные средние значения.
* Клиническое прогрессирование является комбинированным показателем, включавшим следующие составляющие: ухудшение, подтвержденное изменением суммы баллов по шкале IPSS на 4 балла, случаи ОЗМ, связанные с ДГПЖ, недержание мочи, ИМП и почечная недостаточность.
** Оценка проводилась в отдельных исследовательских центрах (13% рандомизированных пациентов).
a. Результаты были значимыми в группе комбинированной терапии (р < 0,001) в сравнении с группой тамсулозина по прошествии 48 месяцев.
b. Результаты были значимыми в группе комбинированной терапии (р < 0,001) в сравнении с группой дутастерида по прошествии 48 месяцев.
Нежелательные явления со стороны сердечно-сосудистой системы
В 4-летнем исследовании ДГПЖ с применением дутастерида в комбинации с тамсулозином у 4844 пациентов (исследование CombAT) частота случаев, описываемых комбинированным термином «сердечная недостаточность», в группе комбинированной терапии (14/1610, 0,9%) была выше, чем в обеих группах монотерапии: дутастерид — 4/1623, 0,2%, тамсулозин — 10/1611, 0,6%.
В отдельном 4-летнем клиническом исследовании (исследование REDUCE) с участием 8231 пациента в возрасте от 50 до 75 лет с полученным ранее отрицательным результатом биопсии на рак предстательной железы и с концентрацией ПСА на исходном уровне в пределах 2,5 — 10,0 нг/мл (у мужчин в возрасте от 50 до 60 лет) и 3 10 нг/мл (у мужчин в возрасте старше 60 лет) частота случаев, описываемых комбинированным термином «сердечная недостаточность», в группе дутастерида 0,5 мг один раз в сутки (30/4105, 0,7%) была выше, чем в группе плацебо (16/4126, 0,4%). Ретроспективный анализ результатов данного исследования свидетельствовал о том, что частота случаев, описываемых комбинированным термином «сердечная недостаточность», у пациентов, получавших одновременно дутастерид и блокатор α-адренорецепторов (12/1152, 1,0%), была выше, чем у пациентов, получавших дутастерид в режиме монотерапии (18/2953, 0,6%), плацебо и блокатор α-адренорецепторов (1/1399, <0,1%) или только плацебо (15/2727, 0,6%) (см. раздел «Меры предосторожности»).
В мета-анализе 12 рандомизированных клинических исследований с контролем плацебо или препаратом сравнения клинических исследований (n = 18802), в которых оценивали риски развития сердечно-сосудистых нежелательных явлений при применении дутастерида (по сравнению с контролем), не было обнаружено стабильного статистически значимого увеличения риска развития сердечной недостаточности (ОР (относительный риск) 1,05; 95 % ДИ 0,71; 1,57), острого инфаркта миокарда (ОР 1,00; 95% ДИ 0,77; 1,30) или инсульта (ОР 1,20; 95 % ДИ 0,88; 1,64).
Рак предстательной железы и рак предстательной железы высокой степени злокачественности
В 4-летнем клиническом исследовании дутастерида в сравнении с плацебо (исследование REDUCE) с участием 8231 пациента в возрасте от 50 до 75 лет с полученным ранее отрицательным результатом биопсии на рак предстательной железы и с концентрацией ПСА на исходном уровне в пределах 2,5 10,0 нг/мл (у мужчин в возрасте от 50 до 60 лет) и 3 10 нг/мл (у мужчин в возрасте старше 60 лет) результаты пункционной биопсии (первоначально обязательной по протоколу) для определения суммы баллов по шкале Глисона имелись в отношении 6706 пациентов. Рак предстательной железы в этом исследовании был диагностирован у 1517 пациентов. Большинство случаев выявляемого путем биопсии рака предстательной железы в обеих группах терапии были случаями низкозлокачественных опухолей (сумма баллов по шкале Глисона 5 6, 70%).
Частота случаев рака предстательной железы с суммой баллов по шкале Глисона 8-10 в группе дутастерида (n = 29, 0,9%) была выше, чем в группе плацебо (n = 19, 0,6%) (р = 0,15). На протяжении первых двух лет терапии показатели частоты случаев рака с суммой баллов по шкале Глисона 8-10 в группе дутастерида (n = 17, 0,5%) и в группе плацебо (n = 17, 0,5%) были схожие. В течение следующих двух лет (год 3 – год 4) частота случаев диагностированного рака предстательной железы с суммой баллов по шкале Глисона 8-10 в группе дутастерида (n = 12, 0,5%) была выше, чем в группе плацебо (n = 1, <0,1%) (р = 0,0035). Данные о результатах применения дутастерида на протяжении более 4 лет у пациентов с риском развития рака предстательной железы отсутствуют. Процент пациентов с диагностированным раком предстательной железы с суммой баллов по шкале Глисона 8-10 был устойчивым на протяжении всех периодов исследования (годы 1-2, годы 3-4) в группе дутастерида (0,5% в каждом периоде); вместе с тем, в группе плацебо процент пациентов с диагностированным раком предстательной железы с суммой баллов по шкале Глисона 8-10 на отрезке времени Год 3 – Год 4 был ниже, чем на отрезке времени Год 1 – Год 2 (<0,1% и 0,5%, соответственно) (см. раздел «Меры предосторожности»). Различия по показателю частоты случаев рака с суммой баллов по шкале Глисона 7-10 (р = 0,81) отсутствовали.
В дополнительном исследовании последующего наблюдения продолжительностью 2 года после окончания исследования REDUCE не было выявлено новых случаев выявления рака предстательной железы с суммой баллов по шкале Глисона 8-10.
В 4-летнем исследовании с участием пациентов с ДГПЖ (исследование CombAT), в котором проведение биопсии не было определено протоколом, а все диагнозы рака предстательной железы основывались на биопсии по показаниям, частота рака с оценкой 8-10 баллов по шкале Глисона была следующей: группа дутастерида n = 8, 0,5%; группа тамсулозина n = 11, 0,7% и группа комбинированной терапии n = 5, 0,3%. Результаты 4 различных эпидемиологических популяционных исследований (2 из которых включали общую популяцию 174 895 человек, одно — 13 892 человека и одно -38 058 человек) показали, что применение ингибиторов 5-а-редуктазы не сопровождалось ни повышением числа случаев рака предстательной железы высокой степени злокачественности, ни случаев рака предстательной железы, ни общей смертности.
Связь между применением дутастерида и высокозлокачественным раком предстательной железы не представляется очевидной.
Влияние на половую функцию
Влияние фиксированной комбинации дутастерид-тамсулозин на половую функцию было оценено в двойном слепом плацебо-контролируемом исследовании с участием мужчин с ДГПЖ, ведущих половую жизнь (n = 243 комбинация дутастерид-тамсулозин, n = 246 плацебо). Через 12 месяцев было отмечено статистически значимое (р < 0,001) более выраженное снижение (ухудшение) баллов по Опроснику оценки состояния сексуального здоровья мужчин (MSHQ) в группе комбинированной терапии. Снижение баллов преимущественно было связано с ухудшением по показателям эякуляции и общего уровня удовлетворенности, а не показателя эрекции. Эти изменения не повлияли на отношение участников исследования к комбинированному препарату, удовлетворенность которым на протяжении всего исследования оценивалась как статистически значимо более высокая по сравнению с плацебо (р < 0,05). В этом исследовании нежелательные явления со стороны половой функции возникали в течение 12 месяцев терапии и примерно в половине случаев разрешились в течение 6 месяцев после терапии.
Известно, что комбинация дутастерид-тамсулозин и монотерапия дутастеридом вызывают нежелательные эффекты со стороны половой функции (см. раздел «Побочное действие»).
Как было отмечено в других клинических исследованиях, включая CombAT и REDUCE, частота развития нежелательных явлений со стороны половой функции уменьшается со временем при продолжении терапии.
Фармакокинетика
Абсорбция
После приема одной дозы 0,5 мг внутрь максимальная концентрация дутастерида в сыворотке достигается в течение 1-3 ч.
Абсолютная биодоступность составляет около 60%. Биодоступность дутастерида не зависит от приема пищи.
Распределение
Дутастерид характеризуется большим объемом распределения (от 300 до 500 л) и высокой степенью связывания с белками плазмы (>99,5%). При ежедневном приеме концентрация дутастерида в сыворотке достигает 65% от равновесных концентраций через 1 мес. и примерно 90% от этого уровня через 3 мес. Равновесная концентрация дутастерида в сыворотке (Css), равная примерно 40 нг/мл, достигается через 6 мес. ежедневного приема 0,5 мг один раз в сутки. Из сыворотки в сперму попадает примерно 11,5% дутастерида.
Биотрансформация
Дутастерид значительно метаболизируется in vivo. In vitro дутастерид метаболизируется изоферментами CYP3A4 и CYP3A5 системы Р450 с образованием трех моногидроксилированных метаболитов и одного дигидроксилированного метаболита. После приема внутрь дутастерида в дозе 0,5 мг в сутки и достижения равновесного состояния в сыворотке от 1,0 до 15,4% (в среднем 5,4%) принятой дозы экскретируется с калом в неизмененном виде. Остальная часть дозы экскретируется в виде 4 крупных метаболитов, составляющих 39%, 21%, 7% и 7% соответственно, и 6 малых метаболитов (на долю каждого из которых приходится менее 5%). В моче у человека обнаруживаются только следовые количества неизмененного дутастерида (менее 0,1% дозы).
Элиминация
Выведение дутастерида является дозозависимым. Процесс выведения может быть описан как два параллельных процесса элиминации, один насыщаемый при клинически значимых концентрациях и один ненасыщаемый. При низких концентрациях в сыворотке (менее 3 нг/мл) дутастерид быстро выводится с помощью обоих процессов элиминации: зависимого и независимого от концентрации. После однократного приема в дозах 5 мг и менее дутастерид быстро элиминируется из организма и имеет короткий период полувыведения, равный 3-9 дням.
При терапевтических концентрациях на фоне ежедневного применения дутастерида в дозе 0,5 мг/сутки преобладает более медленное, линейное выведение, период полувыведения составляет около 3-5 недель.
Пожилые мужчины
Фармакокинетика дутастерида изучалась в исследовании с участием 36 здоровых добровольцев мужского пола в возрасте от 24 до 87 лет после применения однократной дозы 5 мг. Существенное влияние возраста на показатели экспозиции дутастерида отсутствовало, однако период полувыведения у мужчин в возрасте до 50 лет был меньше. Между показателями периода полувыведения у пациентов в возрасте от 50 до 69 лет и у пациентов в возрасте старше 70 лет статистически значимые различия отсутствовали.
Почечная недостаточность
Влияние почечной недостаточности на фармакокинетику дутастерида не изучалось. Вместе с тем, поскольку менее 0,1% от дозы 0,5 мг дутастерида в равновесном состоянии выделяется с мочой, клинически значимое увеличение концентрации дутастерида в плазме крови у пациентов с почечной недостаточностью не прогнозируется (см. раздел «Способ применения и дозировка»).
Печеночная недостаточность
Влияние печеночной недостаточности на фармакокинетику дутастерида не изучалось (см. раздел «Противопоказания»). Поскольку дутастерид преимущественно выводится путем метаболизма, у пациентов с печеночной недостаточностью концентрация дутастерида в плазме может повышаться, и период полувыведения может увеличиваться (см. разделы «Способ применения и дозировка» и «Меры предосторожности»).
Авопрост инструкция по применению
Официальная инструкция лекарственного препарата Авопрост капсулы 0,5 мг. Описание и применение Avoprost, аналоги и отзывы. Инструкция Авопрост капсулы утвержденная компанией производителем.
Общая характеристика
Международное непатентованное наименование
Dutasteride.
Описание
Капсулы мягкие желатиновые овальной формы со швом, непрозрачные, светло-желтого цвета.
Состав лекарственного средства
Одна капсула содержит: дутастерида — 0,5 мг.
Вспомогательные вещества: моно- и диглицериды каприловой/каприновой кислоты, бутилгидрокситолуол.
Состав оболочки капсулы: желатин, глицерин, титана диоксид Е-171, вода очищенная, железа оксид желтый Е-172, лецитин, триглицериды средней цепи.
Фармакотерапевтическая группа
Средства для лечения урологических заболеваний. Средства для лечения.
Доброкачественной гиперплазии предстательной железы.
Код ATX: G04CB02
Фармакологические свойства
Авопрост Показания к применению
— Лечение среднетяжелых и тяжелых симптомов доброкачественной гиперплазии предстательной железы (ДГПЖ).
— Снижение риска острой задержки мочи и потребности в хирургическом лечении у пациентов со среднетяжелыми и тяжелыми симптомами ДГПЖ.
Способ применения Авопрост и дозировка
Авопрост принимается внутрь. Капсулы необходимо глотать целиком, запивая стаканом воды. Не следует капсулы открывать и/или разжевывать, поскольку содержимое капсулы может вызвать раздражение слизистой ротоглотки.
Авопрост можно принимать независимо от приема пищи.
Авопрост можно применять в виде монотерапии, а также в комбинации с аг -адреноблокатором тамсулозином (0,4 мг) (см. разделы «Меры предосторожности», «Побочное действие»).
Взрослые мужчины (включая пожилых)
Рекомендуемая доза лекарственного средства Авопрост составляет одну капсулу (0,5 мг) 1 раз в сутки внутрь.
Улучшение симптомов может наблюдаться на ранних сроках лечения, однако для достижения ответа на терапию может потребоваться до 6 месяцев.
Коррекция дозы при применении у пациентов пожилого возраста не требуется.
Пациенты с нарушениями функции почек
Влияние почечной недостаточности на фармакокинетику дутастерида не изучалось. У пациентов с почечной недостаточностью коррекция дозы не предполагается.
Пациенты с нарушениями функции печени
Влияние печеночной недостаточности на фармакокинетику дутастерида не изучалось, поэтому при применении у пациентов с печеночной недостаточностью в степени от легкой до средней следует соблюдать осторожность (см. разделы «Меры предосторожности»). Дутастерид противопоказан к применению у пациентов с тяжелой печеночной недостаточностью (см. раздел «Противопоказания»).
Побочные действия
Применение дутастерида в виде монотерапии
Примерно у 19% из 2167 пациентов, которые применяли дутастерид в ходе двухлетнего плацебо-контролируемого клинического исследования фазы III, побочные реакции развивались в ходе первого года лечения. Большинство побочных реакций были слабо или умеренно выраженными и затрагивали репродуктивную систему. В ходе дальнейшего двухлетнего открытого расширенного исследования изменений в профиле побочных реакций выявлено не было.
В таблице ниже описаны побочные реакции из контролируемых клинических исследований и постмаркетингового наблюдения. Перечисленные ниже побочные реакции, которые, по мнению исследователя, связаны с приемом препарата (частота возникновения не менее 1%) в ходе первого года лечения чаще встречались у пациентов из группы, принимающей дутастерид, чем в группе, принимающей плацебо. О побочных реакциях в ходе постмаркетинговых исследований сообщалось в спонтанных отчетах, поэтому фактическая частота реакций не известна.
Оценка нежелательных эффектов основана на нижеследующих данных о частоте возникновения: очень частые — 1/10 назначений (>10%); частые — 1/100 назначений (>1% и <10%); не частые — 1/1000 назначений (>0,1% и <1%); редкие — 1/10000 назначений (> 0,01% и < 0,1%); очень редкие — 1/10000 назначений (<0,01%) и частота не известна (не может быть оценена по имеющимся данным).
| Системноорганный класс | Побочные реакции | Частота возникновения побочных реакций в ходе клинических исследований | |
| Частота в ходе 1-го года лечения (n=2167) | Частота в ходе 2-го года лечения (n=1744) | ||
| Нарушения со стороны половой системы и молочной железы | Импотенция1 | 6,0% | 1,7% |
| Изменение (снижение) либидо1 | 3,7% | 0,6% | |
| Нарушение эякуляции2 | 1,8% | 0,5% | |
| Нарушения со стороны молочных желез (включая болезненность и увеличение грудных желез) | 1,3% | 1,3% | |
| Нарушения со стороны иммунной системы | Аллергические реакции, включая сыпь, зуд, крапивницу, ограниченные отеки, ангионевротический отек | Частота побочных реакций в ходе постмаркетинговых исследований | |
| Частота не известна | |||
| Психические нарушения | Депрессия | Частота не известна | |
| Нарушения со стороны кожи и подкожных тканей | Алопеция(в основном, выпадение волос), гипертрихоз | Нечасто | |
| Нарушения со стороны репродуктивной системы и молочной железы | Боль и опухание яичек | Частота не известна |
1 Данные нежелательные явления со стороны репродуктивной системы связаны с применением дутастерида (в режиме монотерапии и в комбинации с тамсулозином). После прекращения терапии они могут сохраниться. Роль дутастерида в сохранении этих нежелательных явлений не установлена.
2 включает снижением объема спермы.
Комбинированная терапия лекарственным средством Авопрост и α-адреноблокатором тамсулозином
Данные четырехлетнего исследования CombAT, в ходе которого монотерапию дутастеридом 0,5 мг (n=1623) 1 раз в сутки сравнивали с монотерапией тамсулозином 0,4 мг (n=1611) 1 раз в сутки и с комбинированной терапией (n=1610), показали, что частота возникновения побочных реакций, которые, по мнению исследователя, связаны с лечением, в ходе первого, второго, третьего и четвертого годов лечения составила соответственно 22%, 6%, 4% и 2% для комбинированной терапии дутастеридом/тамсулозином, 15%, 6%, 3% и 2% для монотерапии дутастеридом и 13%, 5%, 2% и 2% для терапии тамсулозином. Более высокая частота возникновения побочных реакций в ходе первого года лечения в группе комбинированной терапии была связана с более высокой частотой нарушений со стороны половой системы, в частности, с нарушением эякуляции, наблюдаемым в данной группе. Ниже описаны побочные реакции, о которых сообщалось с частотой не менее 1% в ходе первого года исследования CombAT. Частота возникновения данных реакций в ходе четырех лет лечения представлена в таблице ниже:
|
Системно-органный класс |
Побочные реакции |
Частота возникновения реакций в ходе лечения | ||
| Год 1 | Год 2 | Год 3 | Год 4 | |
| Комбинация* | n=1610 | n=1428 | n=1238 | n=1200 |
| Дутастерид | n=1623 | n=1464 | n=1325 | n=1200 |
| Тамсулозин | n=1611 | n=1468 | n =1281 | n=1112 |
| Нарушения со стороны половой системы и молочной железы | Импотенция*** | |||
| Комбинация* | 6,3% | 1,8% | 0,9% | 0,4% |
| Дутастерид | 5,1% | 1,6% | 0,6% | 0,3% |
| Тамсулозин | 3,3% | 1,0% | 0,6% | 1,1% |
| Изменение (снижение) либидо*** | ||||
| Комбинация* | 5,3% | 0,8% | 0,2% | 0% |
| Дутастерид | 3,8% | 1,0% | 0,2% | 0% |
| Тамсулозин | 2,5% | 0,7% | 0,2% | <0,1% |
| Нарушение эякуляции***1 | ||||
| Комбинация* | 9,0% | 1,0% | 0,5% | <0,1% |
| Дутастерид | 1,5% | 0,5% | 0,2% | 0,3% |
| Тамсулозин | 2,7% | 0,5% | 0,2% | 0,3% |
| Нарушение со стороны молочной железы** | ||||
| Комбинация* | 2,1% | 0,8% | 0,9% | 0,6% |
| Дутастерид | 1,7% | 1,2% | 0,5% | 0,7% |
| Тамсулозин | 0,8% | 0,4% | 0,2% | 0% |
| Нарушения со стороны нервной системы | Головокружение | |||
| Комбинация* | 1,4% | 0,1% | <0,1% | 0,2% |
| Дутастерид | 0,7% | 0,1% | <0,1% | <0,1% |
| Тамсулозин | 1,3% | 0,4% | <0,1% | 0% |
| Нарушения со стороны сердечно- сосудистой системы | Сердечная недостаточность (составной термин)**** | |||
| Комбинация* | 0,2% | 0,4% | 0,2% | 0,2% |
| Дутастерид | <0,1% | 0,1% | <0,1% | 0% |
| Тамсулозин | 0,1% | <0,1% | 0,4% | 0,2% |
* комбинация дутастерида 0,5 мг 1 раз в сутки и тамсулозина 0,4 мг 1 раз в сутки.
** включает болезненность и увеличение грудных желез.
***данные нежелательные явления связаны с применением дутастерида (в режиме монотерапии и в комбинации с тамсулозином). После прекращения терапии они могут сохраниться. Роль дутастерида в сохранении этих нежелательных явлений не установлена.
**** составной термин «сердечная недостаточность» включает в себя застойную сердечную недостаточность, сердечную недостаточность, левожелудочковую недостаточность, острую сердечную недостаточность, кардиогенный шок, острую левожелудочковую недостаточность, правожелудочковую недостаточность, острую правожелудочковую недостаточность, желудочковую недостаточность, кардиопульмональную недостаточность и застойную кардиомиопатию.
1 включает снижения объема спермы.
Другие данные
В ходе клинического исследования REDUCE были получены данные, свидетельствующие о более высокой, чем в группе плацебо, частоте случаев рака предстательной железы, оценивавшегося 8-10 баллами по шкале Глисона, в группе терапии дутастеридом. Что именно повлияло на результаты данного исследования: свойство дутастерида уменьшать объем предстательной железы или факторы, связанные с проведением исследования, установлено не было.
Следующее явление было отмечено в клинических исследованиях и за период пострегистрационного применения: рак молочной железы у мужчин (см. раздел «Меры предосторожности»).
Противопоказания Авопрост
Дутастерид противопоказан:
— женщинам, детям и подросткам (см. раздел «Применение во время беременности и в период грудного вскармливания. Влияние на фертильность»);
— пациентам с гиперчувствительностью к дутастериду, другим ингибиторам 5-а- редуктазы или к любому ингредиенту этого препарата;
— пациентам с тяжелой печеночной недостаточностью.
Передозировка
В ходе клинических испытаний дутастерида с участием здоровых добровольцев однократные суточные дозы дутастерида до 40 мг/сутки (в 80 раз больше терапевтической дозы) применялись на протяжении 7 дней без существенных проблем безопасности. В клинических исследованиях дозы 5 мг/сутки применялись в течение 6 месяцев без развития неблагоприятных реакций, отличных от тех, которые наблюдались при применении терапевтических доз 0,5 мг.
Специфический антидот при передозировке дутастерида отсутствует, поэтому при подозрении на передозировку следует проводить адекватную симптоматическую и поддерживающую терапию.
Меры предосторожности
Комбинированная терапия должна назначаться только после тщательной оценки пользы и риска в связи с увеличением вероятности возникновения побочных реакций (включая сердечную недостаточность), а также после рассмотрения альтернативных вариантов лечения, включая монотерапии (см.раздел «Способ применения и дозировка»).
Рак предстательной железы и опухоли низкой степени дифференцировки
В четырехлетнем многоцентровом рандомизированном двойном слепом плацебо-контролируемом клиническом исследовании REDUCF изучалось влияние приема дутастерида в дозе 0,5 мг в сутки на пациентов с высоким риском развития рака предстательной железы (включая мужчин в возрасте от 50 до 75 лет с уровнем ПСА в пределах 2,5-10 нг/мл и отрицательным результатом биопсии за 6 месяцев до включения в исследование) в сравнении с плацебо. Результаты данного исследования выявили повышение частоты случаев рака предстательной железы (8-10 по шкале Глисона) у мужчин, находящихся на лечении дутастеридом (n=29, 0,9%), по сравнению с группой мужчин, принимающих плацебо (n=19, 0,9%). Связь между приемом дутастерида и раком предстательной железы (8-10 по шкале Глисона) не понятна. Необходимо регулярно проводить обследование мужчин, принимающих дутастерид, на предмет развития рака предстательной железы.
Простат-специфический антиген (ПСА)
Показатель концентрации ПСА в сыворотке является важной составляющей процесса выявления рака предстательной железы. После 6 месяцев применения дутастерида средняя концентрация ПСА в сыворотке снижается примерно на 50%.
По прошествии 6 месяцев терапии дутастеридом у пациентов следует определить новый исходный показатель концентрации ПСА. Впоследствии рекомендуется регулярно контролировать концентрацию ПСА. Любое подтвержденное увеличение уровня ПСА от минимального значения при проведении терапии дутастеридом может свидетельствовать о наличии рака предстательной железы либо об отсутствии комплаентности к терапии дутастеридом и должно быть тщательно изучено, даже если оцениваемые показатели не выходят за пределы нормы для мужчин, не получающих ингибитор 5-α-редуктазы. При интерпретации показателя уровня ПСА у пациента, получающего дутастерид, данный показатель следует сравнивать с предыдущими показателями уровня ПСА.
Применение дутастерида не препятствует использованию такого маркера, как уровень ПСА, в процессе диагностирования рака предстательной железы после определения нового исходного уровня.
Показатели концентрации общего ПСА в сыворотке возвращаются к исходным значениям в течение 6 месяцев после прекращения терапии. Отношение несвязанного ПСА к общему ПСА остается постоянным даже при применении дутастерида. Если клиницисты используют процентное содержание несвязанного ПСА при диагностировании рака предстательной железы у мужчин, получающих дутастерид, корректировка дозы с учетом его значения не представляется необходимой. Необходимо проводить пальцевое ректальное исследование и другое обследование для исключения рака предстательной железы до начала лечения дутастеридом и периодически в дальнейшем.
Нарушения со стороны сердечно-сосудистой системы
В ходе двух четырехлетних клинических исследований частота случаев сердечной недостаточности (составной термин для ряда зафиксированных явлений, в основном, сердечная недостаточность и застойная сердечная недостаточность) была чуть выше у пациентов, принимающих комбинацию дутастерида и α-адреноблокаторов, преимущественно тамсулозина, по сравнению с пациентами, находящимися на монотерапии. Однако в данных исследованиях частота возникновения сердечной недостаточности была ниже во всех группах активного лечения по сравнению с группой плацебо. Другие данные, полученные для дутастерида или α-адреноблокаторов, не свидетельствуют о повышении риска заболеваний сердечно-сосудистой системы.
Рак молочной железы
В ходе клинических исследований и постмаркетингового наблюдения поступали редкие сообщения о развитии рака молочной железы у мужчин, принимающих дутастерид. Однако в эпидемиологических исследованиях не было показано увеличения риска развития рака грудной железы у мужчин при применении ингибиторов 5-α-редуктазы. Врачам следует проинструктировать пациентов о необходимости сразу же сообщать о любых изменениях в тканях молочной железы (например, появлении узелков или выделений из сосков).
Печеночная недостаточность
Применение дутастерида у пациентов с печеночной недостаточностью не изучалось. Поэтому дутастерид следует с осторожностью применять у пациентов с нарушениями функции печени от легкой до умеренной степени.
Поврежденные капсулы
Дутастерид всасывается через кожу, поэтому женщины, дети и подростки должны избегать контакта с поврежденными капсулами. В случае контакта с поврежденными капсулами необходимо сразу промыть соответствующий участок кожи водой с мылом.
Применение в период беременности и кормления грудью
Дутастерид противопоказан к применению у женщин.
Беременность
Как и другие ингибиторы 5-α-редуктазы, дутастерид препятствует превращению тестостерона в дигидротестостерон; воздействие дутастерида на организм беременной женщины, вынашивающей плод мужского пола, может отрицательно отразиться на развитии наружных гениталий плода (см. раздел «Меры предосторожности»), Дутастерид в небольших количествах был выявлен в сперме испытуемых, получавших его в суточной дозе 0,5 мг. Неизвестно, оказывает ли отрицательное влияние на плод мужского пола контакт матери со спермой пациента, получающего дутастерид (наибольший риск контакта имеет место в течение первых 16 недель беременности).
Как и в случае со всеми ингибиторами 5-α-редуктазы, если наступила беременность или если есть подозрение на беременность, контакт женщины со спермой получающего препарат мужчины необходимо исключить при помощи презерватива.
Лактация
Неизвестно, выделяется ли дутастерид с грудным молоком.
Фертильность
Сообщалось о влиянии дутастерида на свойства спермы (уменьшение количества сперматозоидов, объема спермы и подвижности сперматозоидов) у здоровых мужчин. Возможность снижения мужской фертильности нельзя исключать.
Способность влиять на скорость реакции при управлении транспортом
С учетом фармакодинамических свойств дутастерида не ожидается, что прием дутастерида будет оказывать влияние на вождение автомобиля и работу с механизмами.
Взаимодействие с другими лекарственными средствами
Сведения по снижению показателей концентрации ПСА в сыворотке крови при проведении терапии дутастеридом и рекомендации по выявлению рака предстательной железы представлены в разделе «Меры предосторожности».
Влияние других препаратов на фармакокинетику дутастерида
Совместное использование с ингибиторами CYP3A4 и/или ингибиторами Р-гликопротеина
Дутастерид преимущественно выводится путем метаболизма. Invitroметаболизм дутастерида катализируется изоферментами CYP3A4 и CYP3A5. Официальные исследования взаимодействия с мощными ингибиторами CYP3A4 не проводились. В то же время, результаты одного популяционного фармакокинетического исследования свидетельствовали о том, что показатели концентрации дутастерида в сыворотке крови у небольшого количества пациентов, получавших одновременно верапамил или дилтиазем (умеренный ингибитор CYP3A4 и ингибитор Р-гликопротеина), были в среднем в 1,6-1,8 раз выше, чем у других пациентов.
Продолжительное комбинированное применение дутастерида и мощных ингибиторов изофермента CYP3A4 (ритонавира, индинавира, нефазодона, итраконазола, кетоконазола при пероральном введении) может вызвать увеличение концентрации дутастерида в сыворотке. Дополнительное ингибирование 5-α-редуктазы при увеличении экспозиции дутастерида маловероятно. Вместе с тем, при возникновении побочных эффектов следует рассмотреть возможность уменьшения частоты приема дутастерида. Следует также отметить, что в случае ингибирования действия фермента, длительный период полувыведения может еще больше увеличиться, в результате чего для достижения нового равновесного состояния может понадобиться более 6 месяцев.
Применение холестирамина в дозе 12 г через 1 час после однократной дозы дутастерида 5 мг не повлияло на фармакокинетику дутастерида.
Влияние дутастерида на фармакокинетику других лекарственных средств
Дутастерид не влияет на фармакокинетику варфарина или дигоксина. Это говорит о том, что дутастерид не ингибирует/индуцирует ни изофермент CYP2C9, ни транспортный белок Р-гликопротеин. Invitro дутастерид не ингибирует такие изоферменты, как СУР1А2, CYP2D6, CYP2C9, CYP2C19 и CYP3A4.
В малом клиническом исследовании (n=24) продолжительностью в две недели с участием здоровых мужчин применение дутастерида (0,5 мг в сутки) не повлияло на фармакокинетику тамсулозина и тетразозина. Результаты, свидетельствующие о фармакодинамическом взаимодействии, в данном исследовании получены не были.
Условия и срок хранения Авопрост
Хранят при температуре не выше 25 °C.
Хранят в недоступном для детей месте.
2 года. Не использовать после истечения срока годности, указанного на упаковке.
Упаковка
Капсулы мягкие желатиновые по 10 капсул в контурной ячейковой упаковке из пленки непрозрачной поливинилхлоридной/поливинилдихлоридной и фольги алюминиевой печатной лакированной, по 3 или 6 контурных ячейковых упаковок вместе с листком-вкладышем в пачке из картона.
Правила отпуска
Отпуск производится по рецепту врача.
Информация о производителе
УП «Минскинтеркапс», Республика Беларусь,
220075, г. Минск, а/я 112, ул. Инженерная, д. 26
тел./факс (+ 37517) 276-01-59.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Авопрост только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание! Эта инструкция по применению лекарственного средства является официальной инструкцией производителя УП «Минскинтеркапс».
Авторское право:
- https://www.mic.by — УП «Минскинтеркапс»
- https://www.rceth.by — Государственный реестр ЛС Республики Беларусь
| Тип данных | Сведения из реестра |
| Торговое наименование: | Авопрост |
| Форма выпуска: | капсулы 0,5 мг в контурной ячейковой упаковке №10х3, №10х6 |
| Международное наименование: | Dutasteride |
| Производитель: | УП «Минскинтеркапс», Республика Беларусь |
| Заявитель: | УП «Минскинтеркапс», Республика Беларусь |
| Номер регистрации: | 21/03/3120 |
| Дата регистрации: | 24.03.2021 |
| Срок действия: | 24.03.2026 |
| Дата переоформления: | 01.01.2100 |
| Тип: | Лекарственное средство |
| Оригинальное: | генерик |
| Состав лекарственного средства: | Dutasteride |
| Код АТХ: | G04CB02 |
| Производитель готовой лекарственной формы: | Минскинтеркапс УП, Республика Беларусь |
| Производитель, осуществляющий фасовку/упаковку: | Минскинтеркапс УП, Республика Беларусь |
| Контроль качества: | |
| Выдача разрешения на выпуск лекарственного средства: | Минскинтеркапс УП, Республика Беларусь |
| Другие участники производства: | |
| Заявленная цена: | №10х3 — 12,00; №10х6 — 25,00USD |
| Порядок отпуска: | по рецепту |
| Список хранения: | |
| Срок годности лекарства: | 2 года |
| Нормативная документация: | ФСП РБ 2907-21 |
| Дата утверждения нормативной документации: | 24 марта 2021 г. 0:00 |
| Срок действия нормативной документации: | 24 марта 2026 г. 0:00 |
| Изменение в нормативной документации: | |
| Номер разрешения НД: |
| Код АТХ | Название группы |
| G | Мочеполовая система и половые гормоны |
| G04 | Препараты для лечения урологических заболеваний |
| G04C | Препараты для лечения доброкачественной гиперплазии предстательной железы |
| G04CB | Ингибиторы 5-альфа-редуктазы тестостерона |
| G04CB02 |
Dutasteride
|
Алфупрост МР — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП 001176-111111
Торговое название препарата:
Алфупрост® MP.
Международное непатентованное название:
Алфузозин.
Химическое название:
N-[3-[(4-Амино-6,7-диметокси-2 хиназолинил) метиламино] пропил]тетрагидро-2-фуранкарбоксамида гидрохлорид.
Лекарственная форма:
таблетки пролонгированного действия.
Состав:
Каждая таблетка пролонгированного действия содержит:
Активное вещество: алфузозина гидрохлорид 10 мг.
Вспомогательные вещества: лактоза безводная 77 мг, магния стеарат 2,5 мг, кремния диоксид коллоидный 3 мг, повидон (PVP — К 30) 15 мг, тальк 2,5 мг, гипромеллоза 85 мг, гипролоза 155 мг.
Описание:
От белого до почти белого цвета, круглые, двояковыпуклые таблетки без оболочки с гравировкой «RY 10» на одной из сторон.
Фармакотерапевтическая группа:
Альфа-1-адреноблокатор.
Код ATX: [G04CA01].
Фармакологические свойства:
Фармакодинамика
Алфузозин является производным хиназолина, активным при приеме внутрь. Это избирательный антагонист постсинаптических альфа-1-адренорецепторов. Фармакологические испытания in vitro показали избирательность действия алфузозина на альфа-1-рецепторы, расположенные в предстательной железе, на дне мочевого пузыря и в предстательной части мочеиспускательного канала. В результате прямого воздействия на гладкую мускулатуру тканей предстательной железы, альфа-1-адреноблокаторы уменьшают сопротивление оттоку мочи.
Алфузозин улучшает параметры мочеиспускания, снижая тонус уретры и сопротивляемость оттоку из мочевого пузыря, облегчая опорожнение пузыря. Приемом алфузозина у больных с доброкачественной гиперплазией предстательной железы достигается:
среднее значение относительной биодоступности составляет 104,4% по сравнению с формой немедленного высвобождения (2,5 мг дважды в день) у здоровых добровольцев среднего возраста, а максимальная концентрация в плазме достигается через 9 часов после приема алфузозина, по сравнению с 1 часом для формы немедленного высвобождения.
Период полувыведения алфузозина составляет 9,1 часа. Исследования показали, что площадь под кривой «концентрация-время» при приеме алфузозина после еды сопоставима с результатами при приеме алфузозина до еды, следовательно прием пищи не влияет на фармакокинетический профиль препарата. По сравнению со здоровыми добровольцами среднего возраста у пожилых больных фармакокинетические параметры не увеличиваются.
По сравнению с лицами с нормальной функцией почек средние значения максимальной концентрации площади под кривой «концентрация-время» у больных с почечной недостаточностью умеренно увеличены, без изменения периода полувыведения. Это изменение фармакокинетического профиля алфузозина не считается обладающим клиническим значением, поэтому оно и не требует корректировки дозы.
Фармакокинетический профиль алфузозина не изменяется при хронической сердечной недостаточности.
Показания к применению:
Лечение функциональных нарушений мочеиспускания при доброкачественной гиперплазии предстательной железы.
Противопоказания:
Повышенная чувствительность к алфузозину и/или другим компонентам препарата. Ортостатическая гипотензия. Тяжелые нарушения функции печени. Тяжелая почечная недостаточность (клиренс креатинина < 30 мл/мин).
Врожденный дефицит лактазы, непереносимость лактозы, глюкозо-галактозная мальабсорбция.
Способ применения и дозы:
Внутрь.
Рекомендованная доза составляет: 1 таблетка пролонгированного действия 10 мг ежедневно после еды. Таблетки должны приниматься целиком.
Побочные эффекты:
Указанные ниже нежелательные эффекты даются в соответствии со следующими градациями частоты их возникновения:
Очень часто: (≥10%);
Часто: (≥1% — <10%);
Не часто: (≥0,1%-<1%);
Редко: (0,01%-0,1%);
Очень редко: (<0,01%) (включая отдельные случаи).
Со стороны ЦНС и психики: часто — слабость, ощущение общего дискомфорта, головная боль; нечасто — сонливость, головокружение, ишемия головного мозга у пациентов с ишемической болезнью мозга.
Со стороны сердечно-сосудистой системы: нечасто — тахикардия, сердцебиение, обморок, ортостатическая гипотензия; очень редко — стенокардия у пациентов с ИБС, мерцание предсердий.
Со стороны органов дыхания: нечасто — ринит.
Со стороны пищеварительной системы: часто — тошнота, боль в животе, сухость во рту; нечасто — диарея; очень редко — повреждение гепатоцитов, заболевания печени с холестазом.
Кожные и аллергические реакции: нечасто — сыпь, зуд; очень редко — крапивница, ангионевротический отек.
Прочие: часто — астения; нечасто — гиперемия кожи, отеки, боль в груди; очень редко -приапизм.
Передозировка:
Симптомы: снижение артериального давления.
В случае передозировки больной должен быть госпитализирован, находиться в положении «лежа». Следует проводить симптоматическое лечение гипотензии (введение сосудосуживающих средств и плазмозаменителей (для увеличения объема циркулирующей крови)). Диализ неэффективен из-за высокой степени связывания алфузозина с белками.
Взаимодействие с другими лекарственными препаратами:
Нерекомендованные комбинации:
С блокаторами альфа-1-рецепторов (празозин, урапидил, миноксидил): усиление гипотензивного эффекта, риск тяжелой постуральной гипотензии.
Комбинации, которые следует принимать во внимание:
С гипотензивными препаратами: усиление гипотензивного эффекта и риск постуральной гипотензии (аддитивное действие). С ингибиторами изофермента CYP3A4 (кетоконазол, итраконазол, ритонавир): повышение концентрации алфузозина в крови.
Особые указания:
У некоторых лиц, в особенности, у больных, получающих гипотензивное лечение, в течение нескольких часов после приема алфузозина, как и с другими альфа-1-адреноблокаторами, может развиться постуральная гипотензия, с симптомами или без них (головокружение, усталость, потоотделение). В таких случаях больной должен лежать до полного исчезновения симптомов. Эти явления обычно бывают временными, встречаются в начале лечения и обычно не влияют на продолжение лечения. Больного следует предупредить о возможности таких явлений.
Больным с коронарной недостаточностью не следует назначать алфузозин в монотерапии. Необходимо продолжать лечение коронарной недостаточности. Если стенокардия возвращается или ухудшается, лечение алфузозином следует прекратить. Больных следует предупредить о том, что таблетки следует проглатывать целиком. Таблетки нельзя раскусывать, разжевывать, измельчать или растирать в порошок. Эти действия могут привести к несоответствующему высвобождению и всасыванию действующего вещества и, соответственно, к побочным явлениям, которые могут быстро развиться. Особый риск связан с началом лечения, когда могут наблюдаться такие явления, как головокружение, нарушения зрения и астения. Это следует принимать во внимание при выполнении потенциально опасных видов деятельности, требующих особого внимания и быстрых реакций (управление автомобилем и другими транспортными средствами, работа с движущимися механизмами, работа диспетчера и оператора и т.п.).
Форма выпуска:
Таблетки пролонгированного действия 10 мг.
10 таблеток в блистер из алюминиевой фольги, ПВХ и аклара. По 1, 2, 3 и 6 блистеров вместе с инструкцией по применению помещают в пачку картонную.
Хранение:
В сухом, защищенном от света месте, при температуре не выше 25°С.
Хранить в недоступном для детей месте.
Срок годности:
3 года.
Не применять после истечения срока годности.
Условия отпуска:
по рецепту.
Владелец регистрационного удостоверения:
Ранбакси Лабораториз Лимитед, Сахибзада Аджит Сингх Нагар (Мохали) — 160055, (Пенджаб), Индия
Ranbaxy Laboratories Limited , Sahibzada Ajit Singh Nagar (Mohali) — 160055, (Punjab), India
Производитель:
Ранбакси Лабораториз Лимитед, Паонта Сахиб, Диет. Сирмур — 173 025, Химачал Прадеш, Индия
Ranbaxy Laboratories Limited, Paonta Sahib, Dist. Sirmour — 173 025, Himachal Pradesh, India
Претензии потребителей направлять в представительство компании Ранбакси Лабораториз Лимитед по адресу:
129223, г. Москва, пр. Мира, ВВЦ, Деловой Центр «Технопарк», строение 537/4, офис 45-48.
Купить Алфупрост МР в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Витапрост® (Vitaprost) инструкция по применению
📜 Инструкция по применению Витапрост®
💊 Состав препарата Витапрост®
✅ Применение препарата Витапрост®
📅 Условия хранения Витапрост®
⏳ Срок годности Витапрост®
Описание лекарственного препарата
Витапрост®
(Vitaprost)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для электронного издания справочника Видаль 2020
года, дата обновления: 2021.04.13
Владелец регистрационного удостоверения:
Контакты для обращений:
ШТАДА
(Россия)
Код ATX:
G04BX
(Препараты для лечения урологических заболеваний другие)
Лекарственные формы
| Витапрост® |
Супп. ректальные 10 мг: 5 или 10 шт. рег. №: ЛП-(000363)-(РГ-RU) |
|
|
Таб., покр. кишечнорастворимой оболочкой, 20 мг: 10, 20, 30 или 60 шт. рег. №: ЛП-(000638)-(РГ-RU) |
Форма выпуска, упаковка и состав
препарата Витапрост®
Таблетки, покрытые кишечнорастворимой оболочкой от голубого до светло-синего цвета, двояковыпуклые, допустимы вкрапления.
Вспомогательные вещества: сахароза, лактозы моногидрат, кальция стеарат, кросповидон, целлюлоза микрокристаллическая.
Состав оболочки: метакриловой кислоты и этилакрилата сополимер (1:1), титана диоксид, тальк, триэтилцитрат, кремния диоксид коллоидный, натрия гидрокарбонат, натрия лаурилсульфат, индигокармин.
10 шт. — упаковки ячейковые контурные (1) — пачки картонные.
10 шт. — упаковки ячейковые контурные (2) — пачки картонные.
10 шт. — упаковки ячейковые контурные (3) — пачки картонные
Суппозитории ректальные от белого до белого с желтоватым или серовато-буроватым оттенком цвета, торпедообразной формы; допускается появление белого налета на поверхности суппозитория и наличие на срезе воздушного стержня и воронкообразного углубления.
Вспомогательные вещества: жир твердый (витепсол, марки H15, W35; суппосир, марки NA15, NAS50) — достаточное количество до получения суппозитория массой 1.25 г.
5 шт. — упаковки ячейковые контурные (1) — пачки картонные.
5 шт. — упаковки ячейковые контурные (2) — пачки картонные.
Фармакологическое действие
Витапрост® обладает органотропным действием в отношении предстательной железы. Уменьшает степень отека, лейкоцитарной инфильтрации предстательной железы, нормализует секреторную функцию эпителиальных клеток, увеличивает число лецитиновых зерен в секрете ацинусов, стимулирует мышечный тонус мочевого пузыря. Улучшает микроциркуляцию в предстательной железе за счет уменьшения тромбообразования, антиагрегантной активности, препятствует развитию тромбоза венул в предстательной железе.
На основании данных клинических исследований доказано, что Витапрост® умеренно уменьшает объем предстательной железы. Препарат уменьшает выраженность обструкции и ирритативной симптоматики при доброкачественной гиперплазии предстательной железы, что выражается в увеличении максимальной и средней объемных скоростей потока мочи и уменьшении объема остаточной мочи.
Данные клинических исследований доказали, что применение препарата Витапрост® уменьшает вероятность развития обострения хронического абактериального простатита, не вызывает изменений показателей клинического и биохимического анализа крови, общего анализа мочи. Эффективность применения препарата Витапрост® для профилактики обострений хронического абактериального простатита по оценке врачей-исследователей составляет 97.5%.
Витапрост® нормализует параметры предстательной железы и эякулята. Уменьшает боль и дискомфорт, вызванные простатитом, устраняет дизурические явления, улучшает копулятивную функцию.
Фармакокинетика
Данные о фармакокинетике препарата Витапрост® не предоставлены.
Показания препарата
Витапрост®
- хронический абактериальный простатит;
- профилактика обострений хронического абактериального простатита (для таблеток);
- доброкачественная гиперплазия предстательной железы (для таблеток);
- состояния до и после оперативных вмешательств на предстательной железе.
Режим дозирования
Таблетки для приема внутрь
Таблетки следует принимать внутрь по 1 таб. 2 раза/сут. Длительность курса лечения препаратом Витапрост® при доброкачественной гиперплазии предстательной железы — не менее 30 дней; при хроническом простатите — не менее 10 дней.
Для профилактики обострений хронического простатита применяют по 1 таб. 2 раза/сут в течение не менее 30 дней — 1-2 раза/год.
Суппозитории ректальные
Ректально — по 1 суп. 1 раз/сут после самопроизвольного опорожнения кишечника или клизмы. После введения суппозитория пациенту рекомендуется находиться в постели в течение 30-40 мин. Длительность курса лечения суппозиториями Витапрост® — не менее 10 дней. При необходимости возможно проведение повторных курсов.
Если после лечения улучшения не наступает или симптомы усугубляются, или появляются новые симптомы, необходимо проконсультироваться с врачом.
Побочное действие
Аллергические реакции: возможны — при применении суппозиториев Витапрост®; очень редко — при применении таблеток Витапрост®.
Если любые из указанных выше побочных эффектов усугубляются или возникают любые другие побочные эффекты, пациент должен сообщить об этом врачу.
Противопоказания к применению
- повышенная чувствительность к компонентам препарата;
- для таблеток: дефицит лактазы, дефицит сахаразы/изомальтазы, непереносимость лактозы, глюкозо-галактозная мальабсорбция (таблетки содержат лактозу и сахарозу).
Применение при беременности и кормлении грудью
Препарат не применяется у женщин.
Применение у детей
Не применяют у детей.
Особые указания
Применяют только для лечения взрослых мужчин, не применяют у женщин ии детей.
Лечение хронического простатита, состояний до и после оперативных вмешательств на предстательной железе должно быть комплексным, предполагающим наряду с назначением таблеток Витапрост® применение других групп лекарственных препаратов и немедикаментозных методов лечения.
До начала лечения хронического простатита и, при необходимости, в процессе лечения, рекомендуется проводить анализ секрета предстательной железы.
В период применения препарата для лечения доброкачественной гиперплазии предстательной железы следует регулярно посещать врача для проведения стандартного контроля данного заболевания. Прежде чем начать курс лечения необходимо убедиться, что патология носит доброкачественный характер.
Влияние на способность к управлению транспортными средствами и механизмами
Применение препарата не оказывает влияния на способность к вождению автотранспорта и занятиям другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Передозировка
О случаях передозировки препарата не сообщалось.
Лекарственное взаимодействие
Лекарственное взаимодействие препарата не описано.
Условия хранения препарата Витапрост®
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°C.
Срок годности препарата Витапрост®
Срок годности таблеток — 3 года, суппозиториев ректальных — 2 года.
Условия реализации
Препарат отпускается без рецепта.
Контакты для обращений
ШТАДА
(Россия)

|
|
Московский офис STADA |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код