Топ 20 лекарств с такими-же компонентами:
Название медикамента
Описание Название медикамента Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Дефителио 80 мг / мл концентрат для приготовления раствора для инфузий
Состав
Описание Состав Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Один мл содержит дефибротид * 80 мг, соответствующий количеству 200 мг в 2,5 мл во флаконе и соответствующий концентрации в диапазоне от 4 мг / мл до 20 мг / мл после разбавления
* производится из слизистой оболочки кишечника свиньи.
Формы выпуска
Описание Формы выпуска Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Концентрат для приготовления раствора для инфузий (стерильный концентрат).
Раствор прозрачный от светло-желтого до коричневого, без твердых частиц или мутности.
Терапевтические показания
Описание Терапевтические показания Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Дефителио показан для лечения тяжелой печеночной веноокклюзивной болезни (VOD), также известной как синдром синусоидальной обструкции (SOS) в терапии гемопоэтической трансплантации стволовых клеток (HSCT).
Показано у взрослых и подростков, детей и младенцев старше 1 месяца.
Способ применения и дозы
Описание Способ применения и дозы Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Дефителио должен назначаться и назначаться пациентам специализированными врачами, имеющими опыт диагностики и лечения осложнений ГСКТ
Дозировка
Рекомендуемая доза составляет 6,25 мг / кг массы тела каждые 6 часов (25 мг / кг / день).
Имеются ограниченные данные об эффективности и безопасности доз выше этого уровня, и, следовательно, не рекомендуется увеличивать дозу выше 25 мг / кг / день.
Дефителио следует вводить не менее 21 дня и продолжать до тех пор, пока симптомы и признаки тяжелой VOD не исчезнут.
Почечная недостаточность
Коррекция дозы не требуется для пациентов с почечной недостаточностью или находящихся на прерывистом гемодиализе.
Печеночная недостаточность
Формальные фармакокинетические исследования не проводились у пациентов с печеночной недостаточностью; однако лекарственное средство использовалось в клинических испытаниях пациентов, у которых развивается печеночная недостаточность без коррекции дозы без каких-либо проблем с безопасностью. Поэтому коррекция дозы не рекомендуется, но следует проводить тщательный мониторинг пациентов.
Детская популяция
Рекомендуемая доза для детей в возрасте от 1 месяца до 18 лет — это та же доза мг / кг, что и для взрослых, т.е. 6,25 мг / кг массы тела каждые 6 часов.
Способ применения
Дефителио вводится внутривенно, в течение двух часов.
Дефителио всегда следует разбавлять перед использованием.
Противопоказания
Описание Противопоказания Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
‘
«Современное использование тромболитической терапии» (например,. т-ПА).
Особые предупреждения и меры предосторожности
Описание Особые предупреждения и меры предосторожности Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Использование лекарственных препаратов, которые увеличивают риск кровотечения в течение 24 часов после введения Дефителио (в течение 12 часов в случае нефракционированного гепарина), не рекомендуется.
Сопутствующая системная антикоагулянтная терапия (например,. гепарин, варфарин, ингибиторы прямого тромбина и ингибиторы прямого фактора Ха), за исключением планового поддержания или повторного открытия центральной венозной линии, требуют тщательного мониторинга. Следует рассмотреть вопрос о прекращении дефителио во время использования такой терапии.
Лекарственные средства, которые влияют на агрегацию тромбоцитов (например,. нестероидные противовоспалительные средства) следует вводить с осторожностью, под пристальным наблюдением врача, во время введения Defitelio.
У пациентов, у которых есть или развиться клинически значимое острое кровотечение, требующее переливания крови, Defitelio не рекомендуется или должен быть прекращен. Временное прекращение Defitelio рекомендуется у пациентов, которые подвергаются хирургическому вмешательству или инвазивным процедурам со значительным риском сильного кровотечения.
Введение Defitelio пациентам с гемодинамической нестабильностью, определяемой как неспособность поддерживать среднее артериальное давление при поддержке одного прессора, не рекомендуется.
Безопасность и эффективность Defitelio у детей в возрасте до 1 месяца еще не установлены. Данные недоступны. Использование Defitelio у детей в возрасте до одного месяца не рекомендуется.
Болюсное введение Defitelio может вызвать приливы или ощущение «обобщенного тепла».
Этот лекарственный препарат содержит менее 1 ммоль натрия (23 мг) на дозу, т.е. по сути «без натрия».
Взаимодействие с другими лекарствами
Описание Взаимодействие с другими лекарствами Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Потенциальные взаимодействия с рекомбинантным t-PA
В мышиной модели тромбоэмболии рекомбинантный t-PA усиливал антитромботический эффект дефибротида при внутривенном введении и, следовательно, при совместном применении может представлять повышенный риск кровотечения и противопоказан.
Потенциальные взаимодействия с антитромботическими фибринолитическими агентами
Дефибротид обладает профибринолитическим эффектом, и это может потенциально повысить активность антитромботических / фибринолитических лекарственных средств.
В настоящее время нет опыта у пациентов по сопутствующему лечению гепаринами с низкой молекулярной массой (LMWH), варфарином или сопутствующему лечению прямыми ингибиторами тромбина (например,., дабигатран) или прямые ингибиторы фактора Ха (например,., ривароксабан и апиксабан). Поэтому использование дефибротида с антитромботическими / фибринолитическими лекарственными средствами не рекомендуется.
Однако при использовании в исключительных случаях следует соблюдать осторожность, внимательно следя за параметрами коагуляции.
Потенциальные взаимодействия с другими лекарственными средствами
Дефителио не ингибирует и не индуцирует CYP450.
Применение при беременности и кормлении грудью, фертильность
Описание Применение при беременности и кормлении грудью, фертильность Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Беременность
Нет исследований с использованием дефибротида у беременных женщин. Исследования токсикологии развития эмбриона и плода у беременных крыс и кроликов с дозами дефибротида, близкими к рекомендуемой терапевтической дозе для человека, выявили высокий уровень геморрагического аборта.
Дефителио не следует использовать во время беременности, если только клиническое состояние женщины не требует лечения Дефителио.
Контрацепция у мужчин и женщин
Эффективная контрацепция необходима пациентам и партнерам пациентов во время воздействия Defitelio и в течение одной недели после прекращения.
Грудное вскармливание
Неизвестно, выделяется ли дефибротид с грудным молоком. Учитывая характер продукта, риск для новорожденных / младенцев не ожидается. Дефителио может использоваться во время кормления грудью.
Плодородие
Нет исследований, изучающих влияние дефибротида на фертильность человека.
Влияние на способность управлять и использовать машины
Описание Влияние на способность управлять и использовать машины Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Ожидается, что Defitelio не окажет или окажет незначительное влияние на способность управлять автомобилем и работать с ним. Тем не менее, пациенты не должны управлять или управлять механизмами из-за характера основного заболевания.
Побочные эффекты
Описание Побочные эффекты Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Краткое описание профиля безопасности
В исследовании фазы 3 основного лечения (исследование 2005-01 гг.) Общая частота нежелательных явлений была одинаковой в группе лечения дефибротидом и в контрольной группе (исторической).
Любые события, о которых сообщалось как о возможных, по крайней мере в двух случаях, были определены как ADR и включены в таблицу ниже.
Наиболее частыми побочными реакциями, наблюдаемыми во время лечения печеночной VOD при предпродажном применении, являются кровоизлияние (включая, помимо прочего, желудочно-кишечное кровотечение, легочное кровотечение и носовое кровотечение), гипотония и коагулопатия.
Кроме того, хотя в исследованиях дефибротида в VOD не было сообщений о гиперчувствительности, случаи гиперчувствительности, включая анафилаксию, были зарегистрированы из ранее проданного состава дефибротида, следовательно, гиперчувствительность включена в ADR
Табличный список побочных реакций
Наблюдаемые побочные реакции перечислены ниже по классу и частоте системного органа. В каждой группе частот нежелательные эффекты представлены в порядке уменьшения серьезности. Частоты определяются как: очень распространенный (> 1/10), общий (> 1/100 до <1/10), необычный (> 1/1000 до <1/100), редкий (> 1/10000 до <1/1000), очень редкий (<1/10000).
|
Расстройства крови и лимфатической системы |
|
|
Общие |
Коагулопатия |
|
Расстройства иммунной системы |
|
|
Нечасто |
Гиперчувствительность |
|
Анафилактическая реакция |
|
|
Расстройства нервной системы |
|
|
Общие |
Кровоизлияние в мозг |
|
Нечасто |
Гематома головного мозга |
|
Нарушения зрения |
|
|
Нечасто |
Конъюнктивальное кровоизлияние |
|
Сосудистые нарушения |
|
|
Общие |
Гипотония |
|
Кровотечение |
|
|
Респираторные, грудной и средостения расстройства |
|
|
Общие |
Легочное кровотечение |
|
Носовое кровотечение |
|
|
Нечасто |
Гемоторакс |
|
Желудочно-кишечные расстройства: |
|
|
Общие |
Желудочно-кишечные кровотечения |
|
Рвота |
|
|
Нечасто |
Haematemesis |
|
Melaena |
|
|
Кровоизлияние в рот |
|
|
Диарея |
|
|
Тошнота |
|
|
Расстройства кожи и подкожной клетчатки |
|
|
Нечасто |
Экхимоз |
|
Petechiae |
|
|
Сыпь |
|
|
Зуд |
|
|
Почечные и мочевые расстройства |
|
|
Общие |
Гематурия |
|
Общие расстройства и условия сайта администрации |
|
|
Общие |
Кровоизлияние в катетерное место |
|
Нечасто |
Кровоизлияние в месте инъекции |
|
Pyrexia |
Детская популяция
В исследованиях лечения более 50% пациентов были дети. В дозах, превышающих рекомендуемую дозу 25 мг / кг / день, была более высокая доля пациентов с кровотечением в группе с высокой дозой, но, поскольку в период наблюдения произошло много событий, четкая связь с лечением дефибротидом не могла быть определено. В педиатрическом профилактическом исследовании в дозе 25 мг / кг / день частота возникновения кровотечений в группе дефибротидов увеличилась по сравнению с группой лечения. Однако не было никакой разницы в частоте серьезных кровотечений или кровотечений с летальным исходом.
Частотная природа и тяжесть побочных реакций у детей в остальном такие же, как у взрослых. Никаких особых мер предосторожности не указано.
Сообщение о предполагаемых побочных реакциях
Сообщение о предполагаемых побочных реакциях после разрешения лекарственного средства имеет важное значение. Это позволяет продолжать мониторинг баланса пользы / риска лекарственного средства. Медицинским работникам предлагается сообщать о любых предполагаемых побочных реакциях через национальную систему отчетности, указанную в Приложение V.
Передозировка
Описание Передозировка Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Не существует специфического противоядия от передозировки, и лечение должно быть симптоматическим. Дефибротид не удаляется диализом.
Фармакодинамика
Описание Фармакодинамика Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Фармакотерапевтическая группа: другие антитромботические средства; Код ATC: B01AX01.
Механизм действия
In vitroбыло показано, что дефибротид связывается с различными участками на сосудистом эндотелии, которые участвуют в регуляции клеток, обеспечивая стимул, который способствует защите активированных эндотелиальных клеток. Также было показано, что дефибротид защищает эндотелиальные клетки от опосредованного флударабином апоптоза, не влияя на его антилейкемический эффект. Дефибротид также ингибирует экспрессию гепараназы, способствуя целостности внеклеточного матрикса и, следовательно, гомеостазу тканей. Предполагается, что эти действия защищают эндотелиальные клетки.
Кроме того, было показано, что in vitro дефибротид повышает функцию плазминогенного активатора тканевого типа (t-PA) и снижает активность ингибитора-1 активатора плазминогена (PAI-1), что приводит к снижению активности прокоагулянта и увеличению фибринолитического потенциала эндотелиальные клетки. Также было показано, что дефибротид обладает слабой профибринолитической активностью in vitro.
Патофизиология VOD является многофакторной и сложной. Как повреждение эндотелиальных клеток, так и протромботическо-гипофибринолитическое состояние являются критическими факторами в патофизиологии этого заболевания.
Хотя механизм действия дефибротида не был полностью выяснен, данные in vitro подтверждают роль дефибротида как в защите эндотелиальных клеток, так и в восстановлении тромбофибринолитического баланса. Однако никаких фармакодинамических эффектов от дефибротида не было выявлено in vivo.
Клиническая эффективность и безопасность
Эффективность и безопасность Defitelio при лечении тяжелой VOD были изучены в главном историческом исследовании фазы 3 (2005-01). Сорок четыре ребенка и 58 взрослых пациентов с тяжелым VOD после HSCT получали внутривенное введение Defitelio 25 мг / кг / день путем инфузии и сравнивали с 32 историческими контрольными пациентами. Средняя продолжительность терапии у тех, кто получал Дефителио, составляла 22 дня.
Значительно более высокая доля пациентов в группе, получавшей дефителио, достигла полного ответа, определяемого как общий билирубин менее 2 мг / дл и разрешение MOF (неудачность нескольких органов); День + 100 полный ответ составил 23,5% (24/102) с дефителио против 9,4% (3/32) в историческом контроле (р = 0,0,013). Кроме того, выживаемость в день + 100 была улучшена в группе Defitelio с 38,2% (39/102) выживших пациентов против 25,0% (8/32) в исторической контрольной группе (р = 0,034).
Данные об эффективности этого ключевого исследования подтверждаются и подтверждаются данными исследования по определению дозы (25 мг / кг в группе) и промежуточного анализа текущего исследования Taperation IND (тяжелое подмножество VOD), как представлено в таблицах 1 и 2.
Таблица 1: Результаты исследования лечения: полный ответ тяжелого VOD в день + 100
|
Индивидуальные занятия |
||||
|
Dose-Finding (25 мг / кг / день руки) |
Открытая этикетка для лечения IND (25 мг / кг / день) |
Исторически контролируемое испытание (25 мг / кг / день) |
||
|
Дефибротидная группа |
Исторический контроль |
|||
|
Полный ответ по дням + 100 |
43% (32/75) |
25,9% (57/220) |
23,5% (24/102) |
9,4% (3/32) |
|
р = 0,0131 |
Таблица 2: Результаты исследования лечения: День + 100 Выживание
|
Индивидуальные занятия |
||||
|
Dose-Finding (25 мг / кг / день руки) |
Открытая этикетка для лечения IND (25 мг / кг / день) |
Исторически контролируемое испытание (25 мг / кг / день) |
||
|
Дефибротидная группа |
Исторический контроль |
|||
|
Выживание днем + 100 |
43,9% * |
44,8% * |
38,2% * |
25,0% * |
|
р = 0,0341 |
*= Оценки Каплана Мейера для анализа времени до события по Day100
Данные результатов, доступные у 611 пациентов, получавших Defitelio на основе сострадательного использования для не тяжелых и тяжелых VOD после трансплантации, соответствуют контролируемым клиническим исследованиям, с полным уровнем ответа 24% (51/212) и выживаемостью 37% (78 / 212) в подгруппе пациентов с тяжелым VOD .
Контролируемое рандомизированное профилактическое исследование (исследование 2004-000592-33) было проведено у педиатрических пациентов, перенесших ГСКТ. Пациенты (n = 356) были рандомизированы для получения 25 мг / кг / день с начала кондиционирования или были рандомизированы для отсутствия профилактики.
Было показано снижение общей частоты VOD в группе профилактики Defitelio на 40% (с 19,9% в контрольной группе до 12,2% в группе Defitelio). Использование спасательного лечения Defitelio для всех пациентов, у которых развился VOD, означало, что исследование не было предназначено для оценки каких-либо преимуществ выживания, и ни одно из них не было замечено в этом исследовании.
Во вторичных анализах подгруппы пациентов, перенесших аллогенные трансплантации, профилактика дефителио также была связана с более низкой частотой и меньшей степенью тяжести острого трансплантата по сравнению с заболеванием хозяина (aGvHD) в 2-4 степени к дню + 100.
Coppell et al. В 2010 году представили данные большого метаанализа 235 пациентов с тяжелым VOD, показывающие уровень фоновой смертности при тяжелом VOD 84,3%, и что этот уровень смертности оставался постоянным в течение нескольких десятилетий.
Данные, полученные из независимого реестра США, показали положительный эффект Defitelio в обычной клинической практике. При промежуточном анализе текущего реестра были доступны данные от 96 пациентов с тяжелым VOD.
Смертность от всех причин в день + 100 у пациентов с тяжелым VOD, которые не получали дефибротид, составила 69%, а у тех пациентов, которые получали дефибротид, — 61%. Эти данные взяты из открытого реестра меток, и субъекты не были рандомизированы.
Дополнительная информация показана в следующей таблице 3
Таблица 3: Данные реестра США
|
Не дефибротид обработан |
Дефибротид обработан |
|
|
55 |
41 |
|
|
Жив на День +100 |
17 (31%) |
16 (39%) |
|
VOD решен Днем +100 |
16 (29%) |
21 (51%) |
Детская популяция
В каждом из клинических исследований, проведенных при лечении VOD, более 50% пациентов были в возрасте до 18 лет. Информация о безопасности у детей доступна в профилактическом исследовании, проводимом исключительно у детей. Безопасность и эффективность у детей в возрасте до 1 месяца еще не установлены.
Сердечная электрофизиология
На основании результатов исследования QTc, проведенного на здоровых субъектах в терапевтических и надтерапевтических дозах, можно сделать вывод, что Defitelio не обладает значительным или клинически значимым потенциалом пролонгации QTc в дозах, в 4 раза превышающих терапевтически указанные. Дефителио можно считать свободным от проаритмической токсичности, связанной с изменениями QT.
Этот лекарственный препарат был разрешен при «исключительных обстоятельствах». Это означает, что из-за редкости заболевания и по этическим причинам, препятствующим проведению плацебо-контролируемого исследования, не удалось получить полную информацию об этом лекарственном средстве.
Европейское агентство по лекарственным средствам будет проверять любую новую информацию, которая может стать доступной каждый год, и этот SmPC будет обновляться по мере необходимости
Фармакокинетика
Описание Фармакокинетика Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Поглощение и Распределение
У 52 здоровых добровольцев после однократной дозы Дефителио 6,25 мг / кг, вводимой в виде 2-часовой инфузии, фармакокинетические параметры были следующими:
Таблица 4. Фармакокинетические параметры дефителио после внутривенной инфузии 6,25 мг / кг здоровым субъектам.
|
Параметр |
Defitelio PK Параметры Среднее ± SD |
|
CМаксимум (Мкг / мл) |
17,3 ± 3,83 |
|
tМаксимум (ч) # |
2,00 (1,00-2,00) |
|
AUCt (мкг / мл * ч) |
26,9 ± 8,53 |
|
AUC (мкг / мл * ч) |
48,1 ± 6,49 |
|
Vd (мл) |
9934 ± 3807 |
|
CL (L / h) |
10,4 ± 1,77 |
|
Кел (1 / ч) |
1,25 ± 0,66 |
|
t1/2 (час) |
0,71 ± 0,35 |
# медиана (мин-макс)
Максимальные концентрации в плазме достигли пика в конце периода инфузии и после этого снизились с быстрым клиренсом, и большинство образцов не были обнаружены через 3,5 часа после начала инфузии.
Анализ моделирования фармакокинетического моделирования показал, что концентрации дефителио в плазме не накапливаются при многократном введении дозы и в дозах, в 4 раза превышающих терапевтическую дозу.
Объем распределения составляет около 10 л . In vitro исследования показывают, что 93% Defitelio связано с белками плазмы.
Ликвидация
После введения терапевтической дозы (6,25 мг / кг) здоровым субъектам в среднем 9,48% от общей введенной дозы выводится с мочой в виде неизмененного дефибротида в течение 24 часов, причем большинство из них выводится в течение первого интервала сбора 0-4. часов (приблизительно 98%).
Метаболизм
Дефителио не ингибирует и не индуцирует CYP450.
Особые группы населения
Почечная недостаточность
Шесть пациентов с предполагаемой скоростью клубочковой фильтрации <30 мл / мин / 1,73 м2 (рассчитано с использованием изменения диеты в уравнении почечной недостаточности) и не в настоящее время на диализе сравнивали с 6 здоровыми субъектами с аналогичной базовой демографией. Дефителио 6,25 мг / кг вводили субъектам внутривенно в течение 2 часов каждые 6 часов. По сравнению со здоровым контролем субъекты с почечной недостаточностью продемонстрировали увеличение AUC и C в 1,6 и 1,4 разаМаксимумсоответственно и период полураспада примерно вдвое больше, чем у здоровых людей.
Количество дефибротида, выделяемого с мочой в течение 24 часов, составляло около 5% от общей дозы, вводимой у людей с почечной недостаточностью, по сравнению с около 12% у здоровых людей.
Почти вся почечная экскреция происходит в течение первых 4 часов. Накопление дефибротида в течение 4 доз не обнаружено. Разница в воздействии не считается клинически значимой, поэтому коррекция дозы не рекомендуется для пациентов с почечной недостаточностью.
В подисследовании было показано, что гемодиализ не удаляет дефибротид
Печеночная недостаточность
Формальные фармакокинетические исследования у пациентов с нарушениями печени не проводились. Дефителио использовался в клинических испытаниях у пациентов с печеночной недостаточностью без коррекции дозы без каких-либо серьезных проблем безопасности.
Фармокологическая группа
Описание Фармокологическая группа Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
другие антитромботические агенты; Код ATC: B01AX01.
Доклинические данные по безопасности
Описание Доклинические данные по безопасности Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Доклинические данные не показывают особой опасности для человека, основанной на традиционных исследованиях фармакологии безопасности, токсичности при повторных дозах, генотоксичности или канцерогенности.
У обоих видов основными находками были накопление вакуолированных макрофагов в печени собак и в печени, почках и лимфатических узлах крыс. Макрофаги считаются основным органом-мишенью.
Эмбрио-фетальное развитие
В репродуктивных исследованиях сегмента II на крысах и кроликах дефибротид показал материнскую токсичность, вызывая высокий уровень геморрагического аборта при внутривенном введении в течение двух часов при всех протестированных уровнях дозы, включая дозы, близкие к дозе для человека. Из-за этой материнской токсичности нельзя сделать вывод о влиянии дефибротида на развитие эмбриона и плода. Известно, что PAI-2 однозначно регулируется в плаценте.
Ювенильная токсичность
Повторное внутривенное введение дефибротида в дозах ниже и близко к терапевтической дозе для человека ювенильным крысам привело к задержке среднего возраста препуциального разделения, что свидетельствует о задержке начала полового созревания у самцов у крыс. Однако клиническая значимость этих результатов неизвестна.
Сопутствующие вещества
Описание Сопутствующие вещества Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Цитрат натрия, дигидрат
Соляная кислота (для корректировки pH)
Гидроксид натрия (для корректировки pH)
Вода для инъекций
Срок годности
Описание Срок годности Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Неоткрытые флаконы: 3 года
Стабильность при использовании после первого вскрытия и / или разбавления: с микробиологической точки зрения после разбавления восстановленный лекарственный препарат следует использовать немедленно. Однако химическая и физическая стабильность при использовании была продемонстрирована в течение 72 часов при 15-25 ° C для диапазона концентраций от 4 мг / мл до 20 мг / мл в растворе хлорида натрия 9 мг / мл (0,9%) для инфузии или 5 % раствора глюкозы для инфузий при 15-25 ° С в течение 72 часов.
Если не использовать немедленно, время хранения и условия перед использованием являются обязанностью пользователя и обычно не должны превышать 24 часа при 2-8 ° C.
Хранение
Описание Хранение Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Этот лекарственный препарат не нуждается в особых условиях хранения.
Не замерзай.
Упаковка и содержимое
Описание Упаковка и содержимое Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Флаконы по 2,5 мл (Ph. Eur. Прозрачное стекло типа I), закрытое пробкой (бутилкаучук) и уплотнением (алюминий).
Размер упаковки 10 флаконов.
Особые меры предосторожности при утилизации и другой обработке
Описание Особые меры предосторожности при утилизации и другой обработке Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Defitelio предназначен только для одноразового использования.
Раствор концентрата для инфузии необходимо разбавлять асептическим методом.
Дефителио следует разбавлять раствором хлорида натрия 9 мг / мл (0,9%) для инфузии или 5% раствором глюкозы для инфузии (см. Раздел 6.3 для диапазона концентраций и стабильности разбавленного раствора) до подходящей концентрации, чтобы обеспечить 2 часа инфузии.
Подготовка Defitelio (используйте асептическую технику):
1. Количество флаконов, подлежащих разбавлению, должно определяться на основе веса отдельного пациента.
2. Перед разбавлением каждый флакон следует проверять на наличие частиц. Если частицы наблюдаются и / или жидкость во флаконе не прозрачна, флакон нельзя использовать.
3. Общий объем инфузии должен быть определен на основе веса отдельного пациента. Конечная концентрация Дефителио должна находиться в диапазоне концентраций 4 мг / мл — 20 мг / мл
4. Объем раствора хлорида натрия 9 мг / мл (0,9%) для инфузии или 5% раствора глюкозы для инфузии из инфузионного пакета следует извлечь и выбросить, что соответствует общему объему добавляемого раствора Defitelio.
5. Требуемый объем из флаконов Defitelio должен быть снят и объединен.
6. Комбинированные объемы Defitelio следует добавлять в раствор 9 мг / мл (0,9%) хлорида натрия для инфузии или раствор 5% глюкозы для инфузии.
7. Раствор для инфузии следует смешивать осторожно.
8. Перед использованием раствор должен быть визуально осмотрен на наличие твердых частиц. Следует использовать только прозрачные растворы без видимых частиц. В зависимости от типа и количества разбавителя цвет разбавленного раствора может варьироваться от бесцветного до светло-желтого. Рекомендуется вводить разбавленный раствор Defitelio пациентам с использованием инфузионного набора, снабженного поточным фильтром 0,2 Î1⁄4 м.
9. После завершения инфузии внутривенную линию следует промыть раствором 9 мг / мл (0,9%) хлорида натрия для инфузии или раствором 5% глюкозы для инфузии.
Любой неиспользованный лекарственный препарат или отходы должны быть утилизированы в соответствии с местными требованиями.
Владелец разрешения на продажу и производитель
Описание Владелец разрешения на продажу и производитель Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Gentium S.r.l.
Пьяцца XX Settembre 2,
Вилла Гуардия,
22079 Италия
Телефон: +39 031 5373200
Факс: +39 031 5373241
[email protected]
Номер авторизации
Описание Номер авторизации Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
EU / 1/13/878/001
Дата первого разрешения
Описание Дата первого разрешения Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Дата первого разрешения: 18 октября 2013 г
Дата пересмотра текста
Описание Дата пересмотра текста Defitelioявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
26 мая 2016 г
Доступно в странах
Найти в стране:
А
Б
В
Г
Д
Е
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ч
Ш
Э
Ю
Я
Defitelio Prescribing Information
Package insert / product label
Generic name: defibrotide sodium
Dosage form: injection, solution
Drug class: Miscellaneous coagulation modifiers
Medically reviewed by Drugs.com. Last updated on Dec 1, 2022.
On This Page
- Indications and Usage
- Dosage and Administration
- Dosage Forms and Strengths
- Contraindications
- Warnings and Precautions
- Adverse Reactions/Side Effects
- Drug Interactions
- Use In Specific Populations
- Overdosage
- Description
- Clinical Pharmacology
- Nonclinical Toxicology
- Clinical Studies
- How Supplied/Storage and Handling
- Patient Counseling Information
Indications and Usage for Defitelio
Defitelio is indicated for the treatment of adult and pediatric patients with hepatic veno-occlusive disease (VOD), also known as sinusoidal obstruction syndrome (SOS), with renal or pulmonary dysfunction following hematopoietic stem-cell transplantation (HSCT).
Defitelio Dosage and Administration
Recommended Dosage
The recommended dosage of Defitelio for adult and pediatric patients is 6.25 mg/kg every 6 hours given as a 2‑hour intravenous infusion. The dose should be based on patient’s baseline body weight, defined as the patient’s weight prior to the preparative regimen for HSCT.
Administer Defitelio for a minimum of 21 days. If after 21 days signs and symptoms of hepatic VOD have not resolved, continue Defitelio until resolution of VOD or up to a maximum of 60 days.
Administration Instructions
- •
- Defitelio must be diluted prior to infusion [see Dosage and Administration (2.4)].
- •
- Prior to administration of Defitelio, confirm that the patient is not experiencing clinically significant bleeding and is hemodynamically stable on no more than one vasopressor [see Warnings and Precautions (5.1)].
- •
- Administer Defitelio by constant intravenous infusion over a 2-hour period.
- •
- Administer the diluted Defitelio solution using an infusion set equipped with a 0.2 micron in-line filter. Flush the intravenous administration line (peripheral or central) with 5% Dextrose Injection, USP or 0.9% Sodium Chloride Injection, USP immediately before and after administration.
- •
- Do not co‑administer Defitelio and other intravenous drugs concurrently within the same intravenous line.
Treatment Modification
Treatment modification, including temporary or permanent discontinuation of Defitelio, should follow the recommendations in Table 1.
Table 1: Treatment Modifications for Toxicity or Invasive Procedures
|
Event |
Recommended Action |
|
Hypersensitivity Reaction |
|
|
Severe or life-threatening (anaphylaxis) |
|
|
Bleeding |
|
|
Persistent, severe or potentially life-threatening |
|
|
Recurrent significant bleeding |
|
|
Invasive Procedures |
|
|
Preparation Instructions
Dilute Defitelio in 5% Dextrose Injection, USP or 0.9% Sodium Chloride Injection, USP to a concentration of 4 mg/mL to 20 mg/mL. Administer the diluted solution over 2 hours.
Vials contain no antimicrobial preservatives and are intended for a single-patient-use only. Partially used vials should be discarded. Use the diluted Defitelio solution within 4 hours if stored at room temperature or within 24 hours if stored under refrigeration. Up to four doses of Defitelio solution may be prepared at one time, if refrigerated.
Preparation Instructions:
- •
- Determine the dose (mg) and number of vials of Defitelio based on the individual patient’s baseline weight (weight prior to the preparative regimen for HSCT).
- •
- Calculate the volume of Defitelio needed, withdraw this amount from the vial(s) and add it to the infusion bag containing 0.9% Sodium Chloride Injection or 5% Dextrose Injection for each dose to make a final concentration of 4 mg/mL to 20 mg/mL.
- •
- Gently mix the solution for infusion.
- •
- Parenteral drug products should be inspected visually for particulate matter and discoloration prior to administration, whenever solution and container permit. Only clear solutions without visible particles should be used. Depending on the type and amount of diluent, the color of the diluted solution may vary from colorless to light yellow.
Dosage Forms and Strengths
Injection: 200 mg/2.5 mL (80 mg/mL) of defibrotide sodium as a clear, light yellow to brown solution in a single-patient-use glass vial.
Contraindications
The use of Defitelio is contraindicated in the following conditions:
- •
- Concomitant administration with systemic anticoagulant or fibrinolytic therapy [see Warnings and Precautions (5.1)]
- •
- Known hypersensitivity to Defitelio or to any of its excipients [see Warnings and Precautions (5.2)]
Warnings and Precautions
Hemorrhage
Defitelio increased the activity of fibrinolytic enzymes in vitro, and it may increase the risk of bleeding in patients with VOD after hematopoietic stem-cell transplantation (HSCT). Do not initiate Defitelio in patients with active bleeding. Monitor patients for signs of bleeding. If patients on Defitelio develop bleeding, discontinue Defitelio, treat the underlying cause, and provide supportive care until the bleeding has stopped [see Dosage and Administration (2.3)].
Concomitant use of Defitelio and a systemic anticoagulant or fibrinolytic therapy (not including use for routine maintenance or reopening of central venous lines) may increase the risk of bleeding. Discontinue anticoagulants and fibrinolytic agents prior to Defitelio treatment, and consider delaying the start of Defitelio administration until the effects of the anticoagulant have abated [see Contraindications (4)].
Hypersensitivity Reactions
Hypersensitivity reactions have occurred in less than 2% of patients treated with Defitelio. These reactions include rash, urticaria and angioedema. One case of an anaphylactic reaction was reported in a patient who had previously received Defitelio. Monitor patients for hypersensitivity reactions, especially if there is a history of previous exposure. If a severe hypersensitivity reaction occurs, discontinue Defitelio, treat according to the standard of care, and monitor until symptoms resolve [see Dosage and Administration (2.3)].
Adverse Reactions
The following adverse reactions are discussed in greater detail in other sections of the labeling:
- •
- Hemorrhage [see Warnings and Precautions (5.1)]
- •
- Hypersensitivity Reactions [see Warnings and Precautions (5.2)]
Clinical Trials Experience
Because clinical trials are conducted under widely varying conditions, adverse reaction rates observed in the clinical trials of a drug cannot be directly compared to rates in the clinical trials of another drug and may not reflect the rates observed in practice.
The safety of Defitelio was determined in 176 adult and pediatric patients with hepatic VOD with pulmonary and/or renal dysfunction following HSCT who were treated with Defitelio 6.25 mg/kg every 6 hours [see Clinical Studies (14)]. Patients were excluded from these trials if at time of study entry they had significant acute bleeding, active grades B-D graft-versus-host disease, or a requirement for multiple vasopressors to provide blood pressure support. For the purposes of adverse event recording in the clinical trials, events were not required to be reported if they were related to the hepatic VOD, or if they were expected to occur after hematopoietic stem-cell transplantation (HSCT), unless they were serious or Grade 4-5.
The median age of the safety population was 25 years (range: 1 month to 72 years), and 63% were ≥17 years of age. A total of 60% of patients were male, 78% were white, 89% had undergone allogeneic HSCT, and the underlying diagnosis was acute leukemia for 43%. At study entry, 13% were dialysis dependent and 18% were ventilator dependent. Defitelio was administered for a median of 21 days (range: 1 to 83 days).
Information about adverse reactions resulting in permanent discontinuation of Defitelio was available for 102 patients, and 35 (34%) of these patients had an adverse reaction with permanent discontinuation. Adverse reactions leading to permanent discontinuation included pulmonary alveolar hemorrhage in 5 (5%) patients; pulmonary hemorrhage, hypotension, catheter site hemorrhage, and multi-organ failure, each in 3 (3%) patients; and cerebral hemorrhage and sepsis, each in 2 (2%) patients.
Information about adverse reactions of any grade was available for all 176 patients. The most common adverse reactions (incidence ≥10% and independent of causality) were hypotension, diarrhea, vomiting, nausea, and epistaxis. The most common serious adverse reactions (incidence ≥5% and independent of causality) were hypotension (11%) and pulmonary alveolar hemorrhage (7%). Hemorrhage events of any type and any grade were reported for 104 (59%) of the patients, and the events were grade 4-5 in 35 (20%).
Table 2 presents adverse reactions independent of causality ≥10% any grade or Grade 4/5 ≥2% reported in patients treated with Defitelio.
Table 2: Adverse Reactionsa ≥10% or Grade 4-5 Adverse Reactions ≥2%
|
Defitelio (n=176) |
||
|
Adverse Reaction a |
Any grade |
Grade 4-5b |
|
Hypotension |
65 (37%) |
12 (7%) |
|
Diarrhea |
43 (24%) |
0 |
|
Vomiting |
31 (18%) |
0 |
|
Nausea |
28 (16%) |
0 |
|
Epistaxis |
24 (14%) |
0 |
|
Pulmonary alveolar hemorrhage |
15 (9%) |
12 (7%) |
|
Gastrointestinal hemorrhage |
15 (9%) |
5 (3%) |
|
Sepsis |
12 (7%) |
9 (5%) |
|
Graft versus host disease |
11 (6%) |
7 (4%) |
|
Lung infiltration |
10 (6%) |
5 (3%) |
|
Pneumonia |
9 (5%) |
5 (3%) |
|
Pulmonary hemorrhage |
7 (4%) |
4 (2%) |
|
Infection |
6 (3%) |
4 (2%) |
|
Hemorrhage intracranial |
5 (3%) |
4 (2%) |
|
Hyperuricemia |
4 (2%) |
4 (2%) |
|
Cerebral hemorrhagec |
3 (2%) |
3 (2%) |
a Excludes events considered to be due to the underlying disease: multi-organ failure, veno-occlusive disease, respiratory failure, renal failure, and hypoxia
b Adverse reactions considered life-threatening or fatal
c Cerebral hemorrhage has been included in the table due to clinical relevance
Drug Interactions
Antithrombotic Agents
Defitelio may enhance the pharmacodynamic activity of antithrombotic/fibrinolytic drugs such as heparin or alteplase. Concomitant use of Defitelio with antithrombotic or fibrinolytic drugs is contraindicated because of an increased risk of hemorrhage [see Contraindications (4)].
USE IN SPECIFIC POPULATIONS
Pregnancy
Risk Summary
There are no available data on Defitelio use in pregnant women. When administered to pregnant rabbits during the period of organogenesis at doses that were comparable to the recommended human dose based on body surface area, defibrotide sodium decreased the number of implantations and viable fetuses. Advise pregnant women of the potential risk of miscarriage.
The estimated background risk of major birth defects and miscarriage for the indicated population is unknown. In the U.S. general population, the estimated background risks of major birth defects and miscarriage in clinically recognized pregnancies are 2-4% and 15-20%, respectively.
Data
Animal Data
Embryo-Fetal toxicity assessment was attempted in rats and rabbits, but was not possible because of high maternal mortality, abortion, and fetal resorption at all doses. Pregnant rats were administered defibrotide sodium from gestational day (GD) 6 to 15 at 0, 240, 1200, and 4800 mg/kg/day by continuous intravenous infusion over 24 hours or at 60, 120, and 240 mg/kg/day by 2-hour infusions 4 times per day. Pregnant rabbits were administered defibrotide sodium at 0, 30, 60, or 120 mg/kg/day from GD 6 to 18 by 2-hour infusions 4 times per day.
In another study in pregnant rabbits, 3 separate subgroups of animals were treated with doses of 80 mg/kg/day defibrotide sodium administered by 2-hour infusions 4 times per day for 5 days each in a staggered manner during the organogenesis period. The dose of 80 mg/kg/day is approximately equivalent to the recommended clinical dose on a mg/m2 basis. Subgroup 1 was dosed from GD 6 to 10, subgroup 2 was dosed from GD 10 to 14, and subgroup 3 was dosed from GD 14 to 18. An increased incidence of unilateral implantation was observed in defibrotide sodium-treated animals. Treatment with defibrotide sodium resulted in a decreased number of implantations and viable fetuses.
Lactation
Risk Summary
There is no information regarding the presence of Defitelio in human milk, the effects on the breastfed infant, or the effects on milk production. Because of the potential for serious adverse reactions, including bleeding in a breastfed infant, advise patients that breastfeeding is not recommended during treatment with Defitelio.
Pediatric Use
The safety and effectiveness of Defitelio have been established in pediatric patients. Use of Defitelio is supported by evidence from an adequate and well-controlled study and a dose finding study of Defitelio in adult and pediatric patients with VOD with evidence of renal or pulmonary dysfunction following HSCT. The clinical trials enrolled 66 pediatric patients in the following age groups: 22 infants (1 month up to less than 2 years), 30 children (2 years up to less than 12 years), and 14 adolescents (12 years to less than 17 years). The efficacy and safety outcomes were consistent across pediatric and adult patients in the clinical trials [see Adverse Reactions (6) and Clinical Studies (14)].
Juvenile Animal Toxicity Data
A juvenile toxicity study in 21-day-old rats was conducted with intravenous bolus administration of defibrotide sodium at 40, 150, or 320 mg/kg/day for 4 weeks. A delayed mean age of preputial separation was observed at all doses, suggesting a delay in onset of male puberty. The dose of 40 mg/kg/day is approximately 0.4 times the clinical dose on a mg/m2 basis for a child. The relevance of this finding for the onset of male puberty in humans is unknown.
Geriatric Use
Clinical studies of Defitelio did not include sufficient numbers of subjects aged 65 and over to determine whether they respond differently from younger subjects. Other reported clinical experience has not identified differences in responses between the elderly and younger patients.
Overdosage
There are no known cases of overdose with Defitelio. There is no known antidote for Defitelio, and Defitelio is not dialyzable. If an overdose occurs, institute general supportive measures.
Defitelio Description
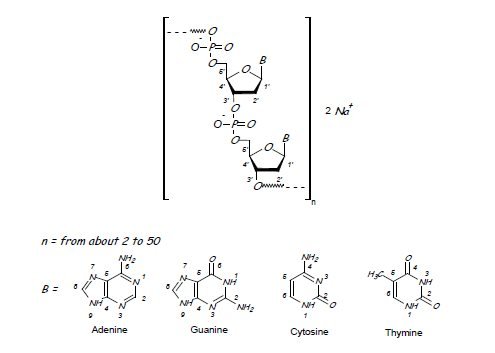
Defibrotide sodium is an oligonucleotide mixture with profibrinolytic properties. The chemical name of defibrotide sodium is polydeoxyribonucleotide, sodium salt. Defibrotide sodium is a polydisperse mixture of predominantly single-stranded (ss) polydeoxyribonucleotide sodium salts derived from porcine intestinal tissue having a mean weighted molecular weight of 14-19 kDa, and a potency of 27-39 and 28-38 biological units per mg as determined by two separate assays measuring the release of a product formed by contact between defibrotide sodium, plasmin and a plasmin substrate. The primary structure of defibrotide sodium is shown below.
Defitelio (defibrotide sodium) injection is a clear, light yellow to brown, sterile, preservative-free solution in a single-patient-use vial for intravenous use. Each milliliter of the injection contains 80 mg of defibrotide sodium and 10 mg of Sodium Citrate, USP, in Water for Injection, USP. Hydrochloric Acid, NF, and/or Sodium Hydroxide, NF, may have been used to adjust pH to 6.8-7.8.
Defitelio — Clinical Pharmacology
Mechanism of Action
The mechanism of action of defibrotide sodium has not been fully elucidated. In vitro, defibrotide sodium enhances the enzymatic activity of plasmin to hydrolyze fibrin clots. Studies evaluating the pharmacological effects of defibrotide sodium on endothelial cells (ECs) were conducted primarily in the human microvascular endothelial cell line. In vitro, defibrotide sodium increased tissue plasminogen activator (t-PA) and thrombomodulin expression, and decreased von Willebrand factor (vWF) and plasminogen activator inhibitor‑1 (PAI-1) expression, thereby reducing EC activation and increasing EC‑mediated fibrinolysis. Defibrotide sodium protected ECs from damage caused by chemotherapy, tumor necrosis factor-α (TNF-α), serum starvation, and perfusion.
Pharmacodynamics
Cardiac Electrophysiology
At a dose 2.4 times the maximum recommended dose, Defitelio does not prolong the QTc interval to any clinically relevant extent.
PAI-1 Inhibition
Plasma concentrations of PAI-1 were assessed on an exploratory basis as a potential pharmacodynamic marker for efficacy in Study 2. PAI-1 is an inhibitor of t-PA and therefore of fibrinolysis. Mean PAI-1 levels on Days 7 and 14 were lower than those at baseline in patients with complete response (CR) and in those who were alive at Day+100, but this trend did not reach statistical significance. There were no statistically significant differences in mean PAI-1 levels by treatment or outcome.
Pharmacokinetics
Absorption
After intravenous administration, peak plasma concentrations of defibrotide sodium occur approximately at the end of each infusion.
Distribution
Defibrotide sodium is highly bound to human plasma proteins (average 93%) and has a volume of distribution of 8.1 to 9.1 L.
Elimination
Metabolism followed by urinary excretion is likely the main route of elimination. The estimated total clearance was 3.4 to 6.1 L/h. The elimination half-life of defibrotide sodium is less than 2 hours. Similar plasma concentration profiles were observed in VOD patients after initial and multiple-dose administration of 6.25 mg/kg every 6 hours for 5 days. Therefore, no accumulation is expected following multiple-dose administration.
Metabolism
Though the precise pathway of defibrotide sodium degradation in plasma in vivo is largely unknown, it has been suggested that nucleases, nucleotidases, nucleosidases, deaminases, and phosphorylases metabolize polynucleotides progressively to oligonucleotides, nucleotides, nucleosides, and then to the free 2′-deoxyribose sugar, purine and pyrimidine bases.
The biotransformation of defibrotide sodium was investigated in vitro by incubation with human hepatocytes from donors of different ages and showed that defibrotide sodium does not undergo appreciable metabolism by human hepatocyte cells.
Excretion
After administration of 6.25 mg/kg to 15 mg/kg doses of Defitelio as 2-hour infusions, approximately 5-15% of the total dose was excreted in urine as defibrotide sodium, with the majority excreted during the first 4 hours.
Specific Populations
Age: Pediatric Population
Insufficient PK data were collected in pediatric patients to draw conclusions.
Renal Impairment
The safety, tolerability, and pharmacokinetics of 6.25 mg/kg as 2-hour intravenous infusions of Defitelio were evaluated in patients with Hemodialysis-dependent End Stage Renal Disease (ESRD) during hemodialysis and on days off dialysis, and in patients with severe renal disease or ESRD not requiring dialysis. Defibrotide sodium was not removed by hemodialysis, which had no notable effect on plasma clearance of defibrotide sodium. Terminal half-lives were consistently less than 2 hours, and there was no accumulation of defibrotide sodium following repeated dosing. Defibrotide sodium exposure (AUC) in patients with severe renal impairment or ESRD was 50% to 60% higher than that observed in matched healthy subjects. Peak concentration (Cmax) was 35% to 37% higher following single- and multiple-dose administration of defibrotide sodium.
Drug Interactions
Pharmacokinetic drug-drug interactions are unlikely at therapeutic dose. Data from in vitro studies using human biomaterial demonstrate that defibrotide sodium does not induce (CYP1A2, CYP2B6, CYP3A4, UGT1A1) or inhibit (CYP1A2, CYP2B6, CYP3A4, CYP2C8, CYP2C9, CYP2C19, CYP2D6, UGT1A1, UGT2B7) the major drug metabolizing enzymes and is not a substrate or inhibitor of the major drug uptake transporters (OAT1, OAT3, OCT1, OCT2, OATP1B1, OATP1B3) or efflux transporters (P-gp and BCRP).
There is some evidence (animal studies, ex vivo human plasma, and healthy volunteers) that defibrotide sodium may enhance the pharmacodynamic activity of heparin and alteplase [see Drug Interactions (7)].
Nonclinical Toxicology
Carcinogenesis, Mutagenesis, Impairment of Fertility
No carcinogenicity studies have been conducted with intravenous administration of defibrotide sodium.
Defibrotide sodium was not mutagenic in vitro in a bacterial reverse mutation assay (Ames assay). Defibrotide sodium was not clastogenic in an in vitro chromosomal aberrations assay in Chinese hamster ovary cells or an in vivo micronucleus assay conducted in bone marrow from rats administered defibrotide sodium by intravenous infusion.
Studies of fertility were not conducted with defibrotide sodium administered by the intravenous route. In repeat dose general toxicology studies, when defibrotide sodium was administered intravenously to rats and dogs for up to 13 weeks, there were no effects on male or female reproductive organs.
Animal Toxicology and/or Pharmacology
In the 13-week toxicity studies in rats and dogs, intravenous administration of defibrotide sodium transiently prolonged activated partial thromboplastin time (APTT) at 1200 and 4800 mg/kg/day administered as a continuous infusion in rats and at 300 and 1600 mg/kg/day administered in 2-hour infusions 4 times daily in dogs. Prothrombin time (PT) was also transiently increased at 4800 mg/kg/day in rats. These findings were observed at doses at least 6 times higher on a mg/m2 basis than the clinical dose of 25 mg/kg/day. The effects on APTT and PT may be due to direct effects on coagulation based on the dose-dependent response observed.
Clinical Studies
The efficacy of Defitelio was investigated in three studies: two prospective clinical trials (Study 1 and Study 2), and an expanded access study (Study 3).
Study 1 enrolled 102 adult and pediatric patients in the Defitelio treatment group with a diagnosis of VOD according to the following criteria (bilirubin of at least 2 mg/dL and at least two of the following findings: hepatomegaly, ascites, and weight gain greater than 5% by Day+21 post-HSCT) with an associated diagnosis of multi-organ dysfunction (pulmonary, renal, or both) by Day+28 post-HSCT. Defitelio was administered to the treatment group at a dose of 6.25 mg/kg infused every 6 hours for a minimum of 21 days and continued until patient was discharged from the hospital. Patients enrolled in the Defitelio treatment group were not permitted to receive concomitant medications such as heparin, warfarin, or alteplase because of an increased risk of bleeding.
Study 2 included adult and pediatric patients with a diagnosis of hepatic VOD and multi-organ dysfunction following HSCT, with 75 patients treated with Defitelio at a dose of 6.25 mg/kg infused every 6 hours. The planned minimum duration of treatment was 14 days. The treatment could be continued until signs of hepatic VOD resolved.
Study 3 is an expanded access program for Defitelio for the treatment of adult and pediatric patients with hepatic VOD. The efficacy of defibrotide was evaluated in 351 patients who had received a HSCT and developed hepatic VOD with renal or pulmonary dysfunction. All patients received Defitelio at a dose of 6.25 mg/kg infused every 6 hours.
Baseline demographic information and details for patients treated in these studies are provided below in Table 3.
Table 3: Baseline Demographics of Patients Treated with Defitelio at 6.25 mg/kg Every 6 Hours
| Data Source | Study 1 | Study 2 | Study 3 |
|---|---|---|---|
|
Design |
Prospective |
Prospective |
Expanded Access Study |
|
Number of patients |
102 |
75 |
351 |
|
Median age (years) (range) |
21 years (<1, 72) |
32 years (<1, 61) |
15 years (<1, 69) |
|
Age, n(%) < 17 years ≥ 17 years |
44 (43%) 58 (57%) |
22 (29%) 53 (71%) |
189 (54%) 162 (46%) |
|
Race, n(%) White Black/African American Asian Other |
77 (75%) 6 (6%) 4 (4%) 15 (15%) |
61 (81%) 6 (8%) 2 (3%) 6 (8%) |
237 (68%) 21 (6%) 15 (4%) 78 (22%) |
|
Gender, n(%) Male Female |
64 (63%) 38 (37%) |
41 (55%) 34 (45%) |
184 (52%) 167 (48% ) |
|
Median number of days on treatment (days) (range) |
21.5 days (1,58) |
19.5 days (3,83) |
21.0 daysa (1,93) |
|
Type of graft, n(%) Allograft Autograft |
90 (88%) 12 (12%) |
67 (89%) 8 (11%) |
317 (90%) 34 (10%) |
|
Ventilator or Dialysis Dependent at Study Entry, n(%) |
34 (33%) |
8 (11%) |
149 (42%) |
- a Duration of treatment from first dose to last dose is presented because days without treatment were not captured for the expanded access study.
The efficacy of Defitelio was based on survival at Day + 100 after HSCT. In Study 1, the survival rate was 38% (95% CI: 29%, 48%) at 100 days after transplantation. In Study 2 the survival rate was 44% (95% CI: 33%, 55%) at 100 days after transplantation. In Study 3, the Day + 100 survival was 45% (95% CI: 40%, 51%).
Based on published reports and analyses of patient level data for individuals with hepatic VOD with renal or pulmonary dysfunction who received supportive care or interventions other than Defitelio, the expected Day +100 survival rates are 21% to 31%.
How Supplied/Storage and Handling
Defitelio (defibrotide sodium) injection is supplied in a single-patient-use, clear glass vial as a clear, light yellow to brown, sterile, preservative-free solution for intravenous infusion. Each vial (NDC 68727-800-01) contains 200 mg/2.5 mL (at a concentration of 80 mg/mL) of defibrotide sodium.
Each carton of Defitelio (defibrotide sodium) injection (NDC 68727-800-02) contains 10 vials.
Store Defitelio (defibrotide sodium) injection at 20°C-25°C (68°F-77°F); excursions permitted between 15°C to 30°C (59°F to 86°F) (see USP controlled room temperature).
Patient Counseling Information
- •
- Hemorrhage: Advise patients and caregivers that Defitelio may increase the risk of bleeding (hemorrhage). Instruct patients to immediately report any signs or symptoms suggestive of hemorrhage (unusual bleeding, easy bruising, blood in urine or stool, headache, confusion, slurred speech, or altered vision) [see Warnings and Precautions (5.1)].
- •
- Hypersensitivity Reactions: Ask patients if they have been treated with defibrotide sodium previously. Instruct patients on the risk of allergic reactions, including anaphylaxis. Describe the symptoms of allergic reactions, including anaphylaxis, and instruct the patient to seek medical attention immediately if they experience such symptoms [see Warnings and Precautions (5.2)].
PACKAGE/LABEL PRINCIPAL DISPLAY PANEL
This product’s label may have been updated. For full prescribing information, please visit labels.fda.gov.
Distributed by:
Jazz Pharmaceuticals, Inc.
Palo Alto, CA 94304
Protected by U.S. Patent Nos. 11,085,043 and 11,236,328
Defitelio® is a registered trademark of Jazz Pharmaceuticals plc or its subsidiaries.
© 2022 Jazz Pharmaceuticals
| Defitelio defibrotide sodium injection, solution |
|||||||||||
|
|||||||||||
|
|||||||||||
|
|||||||||||
|
|||||||||||
|
Labeler — Jazz Pharmaceuticals, Inc. (135926363)
Registrant — Jazz Pharmaceuticals, Inc. (135926363)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Gentium S.r.L | 432729114 | API MANUFACTURE(68727-800), ANALYSIS(68727-800) |
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Patheon Italia S.p.A. | 434078638 | MANUFACTURE(68727-800) |
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Jazz Pharmaceuticals Ireland Limited | 896650210 | MANUFACTURE(68727-800) |
Jazz Pharmaceuticals, Inc.
Medical Disclaimer
Как проверить лекарство на сертификат? Что вы покупаете, оригинал или подделку? Подробнее по ссылке.
Цена: от 351500 руб.
Точные цены утоняйте по телефону +7 (909) 925-56-48. Скидки до 5%!
Запросить через форму
- Оплатить и забрать заказ можно в аптеке.
- Торговое название препарата: Дефибротид (Defibrotide).
- Производитель: Jazz.
- Действующее вещество: Дефибротид (Defibrotide).
- Форма выпуска: 200 мг, 10 инъекций.
- Страна производства: Италия.
Аналог препарата Дефибротид — уточняйте по телефону.
Узнать о скидках первым — напишите в Ватсап или Вайбер по телефону +7 (909) 925-56-48, мы поставим вас в очередь.
Сравнить
-
Описание
-
Отзывы (0)
Дефибротид 200 мг (Defibrotide) инструкция по применению
Закажите Дефибротид в Москве у нас, и получите скидку! Узнайте подробнее по телефону.
Дефибротид – мощное лекарственное средство с профибринолитическими свойствами. Этот препарат назначается для лечения веноокклюзионной болезни после трансплантации стволовых клеток и других патологических состояний.
Фармакологическое действие
Данное лекарство успешно прошло клинические испытания во многих странах мира. Компоненты препарата из слизистых и легочных тканей домашнего скота. Основные фармакологические действия препарата — антитромботическое, противовоспалительное, антиишемическое и тромболитическое.
Показания
Данный препарат показан детям и взрослым пациентам, у которых диагностирована веноокклюзионная болезнь печени. Эту болезнь также называют синдромом синусоидальной обструкции. Болезнь сопровождается дисфункцией легких или почек, возникает после трансплантации стволовых клеток.
Противопоказания
Данный препарат противопоказан:
- людям, проходящим фибринолитическую терапию;
- людям, принимающим системные антикоагулянты;
- при наличии гиперчувствительности к любому из компонентов препарата;
- в период беременности и кормления грудью.
Побочные эффекты
У десяти процентов людей, принимающих данный препарат, наблюдается обильное носовое кровотечение, гипотония, приступы рвоты и тошноты, диарея. Также распространенной побочной реакцией на данный препарат считается легочное альвеолярное кровотечение.
Особенности приема
- Рекомендованная специалистами доза препарата для взрослого и ребенка – 6,25 мг/кг. Принимать одну дозу следует каждые 6 часов. Препарат в форме внутривенной инфузии в течение 2 часов.
- Стандартный курс лечения составляет три недели. Если по истечении этого отрезка времени симптомы патологии остаются, курс продлевается до 60 дней. Если у пациента зафиксировано развитие кровотечения, терапия с включением Дефибротида временно прекращается.
Условия хранения
Препарат Дефибротид хранится при температуре от 20 до 25 градусов по Цельсию.
Заказать оригинальный препарат Дефибротид и получить грамотную консультацию специалиста в любое время можно у нас. Действует консультация по России.
Информация не является публичной офертой! Точные условия продажи и хранения, а также стоимость препаратов уточняйте по телефону.
Дефибротид
Defibrotide
Фармакодинамика
Механизм действия дефибротида натрия не был полностью выяснен. In vitro дефибротид натрия усиливает ферментативную активность плазмина при гидролизе сгустков фибрина. Исследования, оценивающие фармакологические эффекты дефибротида натрия на эндотелиальных клетках, проводились в основном в линии микрососудистых эндотелиальных клеток человека. In vitro дефибротид натрия увеличивал уровень тканевого активатора плазминогена (t-PA) и экспрессию тромбомодулина, а также уменьшал экспрессию фактора Виллебранда и ингибитора активатора плазминогена-1 (PAI-1), тем самым уменьшая активацию эндотелиальных клеток и увеличивая эндотелиальноклеточно-опосредованный фибринолиз. Дефибротид натрия защищает клетки эндотелия от повреждений, вызванных химиотерапией, фактором некроза опухоли-α (TNF-α), сывороточным голоданием и перфузией.
Фармакокинетика
Абсорбция
После внутривенного введения пиковые концентрации в плазме дефибротида натрия отмечаются в конце каждой инфузии.
Распределение
Дефибротид натрия в среднем на 93 % связывается с белками плазмы и имеет объём распределения от 8,1 до 9,1 л.
Выведение
Метаболизм, за которым следует выделение с мочой, вероятно, является основным путём выведения. Общий клиренс составил 3,4–6,1 л/ч. Период полувыведения дефибротида натрия составляет менее 2 часов. Аналогичные профили концентрации плазмы наблюдались у пациентов после начального и многократного введения 6,25 мг/кг каждые 6 часов в течение 5 дней.
Метаболизм
Хотя точный путь деградации дефибротида натрия в плазме in vivo в значительной степени неизвестен, было высказано предположение, что нуклеазы, нуклеотидазы, нуклеозидазы, дезаминазы и фосфорилазы постепенно превращают полинуклеотиды в олигонуклеотиды, нуклеотиды, нуклеозиды, а затем в свободную 2′-дезоксирибозу, пурины и пиримидины.
Биотрансформацию дефибротида натрия исследовали in vitro путём инкубации с гепатоцитами человека от доноров разного возраста и показали, что дефибротида натрия не претерпевает заметного метаболизма клетками гепатоцитов человека.
Экскреция
После введения 6,25 мг/кг дозы дефибротида приблизительно 5–15 % общей дозы выделялась с мочой в виде дефибротида натрия, причём большая часть выделялась в течение первых 4 часов.
Показания
Веноокклюзионная болезнь печени (синдром синусоидальной обструкции) с почечной или лёгочной дисфункцией после трансплантации гемопоэтических стволовых клеток.
Противопоказания
- Повышенная чувствительность к дефибротиду;
- сочетание с системными антикоагулянтами или фибринолитической терапией;
- беременность;
- лактация.
Беременность и грудное вскармливание
Применение при беременности
Категория действия на плод по FDA — N.
Адекватных и строго контролируемых исследований по безопасности применения дефибротида при беременности не проведено.
Препарат противопоказан к применению во время беременности.
Применение в период грудного вскармливания
Специальных исследований по безопасности применения дефибротида в период грудного вскармливания не проведено.
Следует отказаться от кормления грудью в случае применения препарата.
Способ применения и дозы
Рекомендуемая доза дефибротида для взрослых и детей составляет 6,25 мг/кг каждые 6 часов в виде внутривенной инфузии в течение 2 часов.
Курс лечения как минимум 21 дня. Если через 21 день симптомы веноокклюзионной болезни печени не разрешаются — лечение необходимо продолжать до разрешения симптомов, но не более 60 дней.
Побочные действия
Наиболее распространёнными побочными реакциями дефибротида (≥10 %) были гипотония, диарея, рвота, тошнота и носовое кровотечение.
Наиболее распространёнными серьёзными побочными реакциями дефибротида (≥5 %) были гипотония (11 %) и лёгочное альвеолярное кровотечение (7 %).
Взаимодействие
Дефибротид может усиливать фармакодинамическую активность антитромботических/ фибринолитических препаратов, таких как гепарин или алтеплаза. Совместное использование дефибротида с антитромботическими или фибринолитическими средствами противопоказано из-за повышенного риска кровотечений.
Особые указания
Кровотечения
Дефибротид увеличивал активность фибринолитических ферментов in vitro и может повышать риск кровотечения у пациентов с веноокклюзионной болезни печени после трансплантации гемопоэтических стволовых клеток. Не рекомендуется начинать использовать дефибротид у пациентов с активным кровотечением. Если у пациента развивается кровотечение, необходимо прекратить терапию дефибротидом до тех пор, пока кровотечение не прекратится.
Реакции гиперчувствительности
Реакции гиперчувствительности наблюдались у менее 2 % пациентов, получавших дефибротид. К данным реакциям относятся сыпь, крапивница и ангионевротический отёк. Один случай анафилактической реакции наблюдался у пациента, который ранее получал дефибротид. Если возникает серьёзная реакция гиперчувствительности, необходимо прекратить терапию дефибротидом до тех пор, пока симптомы гиперчувствительности не исчезнут.
Классификация
-
АТХ
B01AX01
-
Код МКБ 10
-
Категория при беременности по FDA
N
(не классифицировано FDA)
Информация о действующем веществе Дефибротид предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Дефибротид, содержатся в инструкции производителя, прилагаемой к упаковке.

Процедура ТГСК проводится в ходе лечения определенных видов рака крови или костного мозга. Непосредственно перед процедурой пациенты проходят химиотерапию. ВОБ печени может развиться у пациентов в результате химиотерапии или ТГСК.
ВОБ печени – это заболевание, при котором некоторые вены печени блокируются, вызывая отек и ухудшение кровообращения внутри печени, что может привести к нарушению ее функции. Тяжелые формы ВОБ печени могут вызвать почечную или легочную недостаточность. Тяжелая форма ВОБ печени как результат ТГСК развивается менее чем у 2 % пациентов, однако в 80 % случаев приводит к летальному исходу.
Эффективность препарата Дефителио оценивалась в трех клинических испытаниях с участием 528 пациентов. Всем участникам был поставлен диагноз ВОБ печени с сопутствующими повреждениями печени или почек в результате ТГСК. В исследовании оценивалась доля выживших пациентов спустя 100 дней после ТГСК (общая выживаемость). По результатам трех исследований, общая выживаемость пациентов, которые принимали Дефителио, составила от 38 до 45 % (при этом ожидаемая ОВ составляла от 21 до 31 %).
Наиболее распространенные побочные эффекты включают низкое давление, диарею, тошноту, рвоту и носовые кровотечения. Серьезные побочные эффекты включают кровотечения и аллергические реакции. Препарат противопоказан пациентам с геморрагическими осложнениями и тем, кто принимает антикоагулянты или другие препараты, снижающие свертываемость крови.