Содержание
-
Русское название
-
Английское название
-
Латинское название
-
Фармакологическая группа вещества Дорназа альфа
-
Нозологическая классификация
-
Код CAS
-
Фармакологическое действие
-
Характеристика
-
Фармакология
-
Применение вещества Дорназа альфа
-
Противопоказания
-
Ограничения к применению
-
Применение при беременности и кормлении грудью
-
Побочные действия вещества Дорназа альфа
-
Взаимодействие
-
Передозировка
-
Способ применения и дозы
-
Торговые названия с действующим веществом Дорназа альфа
Русское название
Дорназа альфа
Английское название
Dornase alfa
Латинское название
Dornasum alfa* (род. Dornasi alfa*)
Фармакологическая группа вещества Дорназа альфа
Нозологическая классификация
Список кодов МКБ-10
-
E84.0 Кистозный фиброз с легочными проявлениями
-
J18 Пневмония без уточнения возбудителя
-
J44.9 Хроническая обструктивная легочная болезнь неуточненная
-
J47 Бронхоэктатическая болезнь [бронхоэктаз]
-
J99.8 Респираторные нарушения при других болезнях, классифицированных в других рубриках
-
Q33 Врожденные аномалии [пороки развития] легкого
-
R09.3 Мокрота
Код CAS
9003-98-9
Фармакологическое действие
—
муколитическое.
Характеристика
Рекомбинантная человеческая дезоксирибонуклеаза I — фермент, который селективно расщепляет ДНК. Дорназа альфа представляет собой белок, полученный методами генной инженерии с использованием клеток яичника китайских хомячков. Очищенный продукт — гликопротеин, содержащий 260 аминокислот, первичная последовательность которых идентична таковой природного фермента человека — дезоксирибонуклеазе I (ДНКазе), примерная молекулярная масса 37 кД.
Фармакология
Гнойный легочный секрет содержит очень высокие концентрации внеклеточной ДНК — вязкого полианиона, высвобождающегося из разрушающихся лейкоцитов, которые накапливаются при инфекции. In vitro дорназа альфа гидролизирует ДНК в мокроте и снижает вязкость мокроты при муковисцидозе.
Фармакокинетика
При ингаляционном введении 2,5 мг дорназы альфа пациентам с муковисцидозом (n=18) средняя концентрация в мокроте через 15 мин достигала 3 мкг/мл, затем она постепенно снижалась и спустя 2 ч после ингаляции составляла 0,6 мкг/мл. Ингаляции в дозах по 10 мг трижды в день у 4 пациентов с муковисцидозом в течение 6 дней не вызывали достоверного повышения концентрации ДНКазы в сыворотке крови по сравнению с нормальными эндогенными уровнями. После применения дорназы альфа по 2,5 мг 2 раза в сутки на протяжении 6 мес кумуляции вещества в сыворотке не выявлено (n=321).
У 98 пациентов в возрасте от 3 мес до 10 лет после ежедневных ингаляций (2,5 мг) дорназы альфа проводилось бронхоальвеолярное орошение жидкостью спустя 90 мин после 1-й дозы. Концентрации ДНКазы в полученной бронхоальвеолярной жидкости определялись у всех пациентов, но их значения находились в широком диапазоне: от 0,07 до 1,8 мкг/мл. На протяжении примерно 14 дней применения сывороточные концентрации ДНКазы увеличились в группе детей в возрасте от 3 мес до 5 лет на (1,3±1,3) нг/мл и в группе детей от 5 лет до 10 лет на (0,8±1,2) нг/мл. Взаимосвязь между концентрациями в бронхоальвеолярной жидкости или сывороточными концентрациями дорназы альфа и клиническими эффектами не выявлена.
Канцерогенность, мутагенность, влияние на фертильность
Канцерогенность. В длительных исследованиях у крыс Sprague Dawley, которые получали дорназу альфа в дозах до 246 мкг/кг/сут, канцерогенного эффекта не выявлено. Дорназу альфа применяли в виде аэрозоля до 30 мин в день ежедневно в течение двух лет в дозе до 246 мкг/кг/сут, что соответствует дозе, в 28,8 раз превышающей клиническую. После длительного воздействия у крыс не было выявлено увеличения развития доброкачественных или злокачественных опухолей, не отмечалось развития необычных типов опухолей.
Мутагенность. Не проявлял мутагенных свойств в тесте Эймса с использованием 6 различных штаммов бактерий для тестирования (4 штамма S.typhimurium и 2 штамма E.coli) при концентрациях до 5000 мкг на чашку Петри, в цитогенетическом тесте с использованием периферических человеческих лимфоцитов при концентрациях до 2000 мкг на чашку Петри и в тесте с использованием лимфомы мышей при концентрациях до 1000 мкг на чашку Петри, с/без метаболической активации. Не отмечено хромосомных повреждений in vivo в микроядерном тесте на клетках костного мозга у мышей после болюсного в/в введения дорназы альфа в дозе 10 мг/кг в течение двух дней подряд.
Влияние на фертильность. В исследованиях у крыс, получавших до 10 мг/кг/сут, что в 600 раз превышает системную экспозицию у человека при использовании в рекомендуемых дозах, нарушения фертильности не выявлено как у самцов, так и у самок.
Клинические исследования
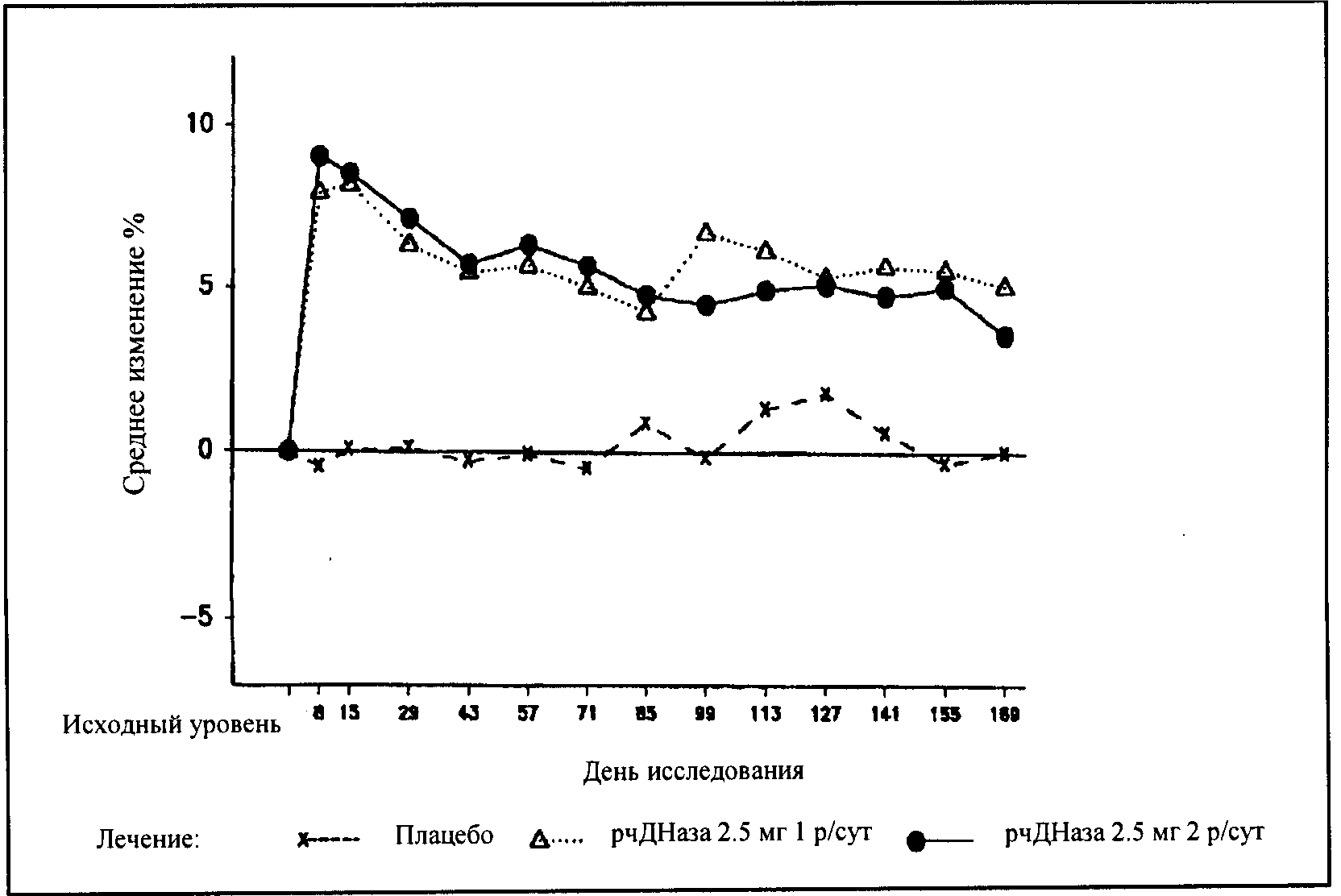
Эффективность и безопасность дорназы альфа оценивали в рандомизированном плацебо-контролируемом испытании у пациентов с клинически стабильным муковисцидозом в возрасте 5 лет и старше, при форсированной жизненной емкости легких (ФЖЕЛ) не менее 40% от нормы, получающих стандартную лекарственную терапию. Пациенты принимали плацебо 1 раз в день (n=325), или 2,5 мг дорназы альфа 1 раз в день (n=322), или по 2,5 мг дорназы альфа 2 раза в день (n=321) в течение 6 мес. Обе дозы ЛС приводили к значимому уменьшению числа пациентов, у которых наблюдались инфекции респираторного тракта, требовавшие парентерального использования антибиотиков, в сравнении с плацебо-группой. Применение дорназы альфа снижало относительный риск развития инфекции респираторного тракта на 27 и 29% при дозах 2,5 мг однократно или по 2,5 мг дважды в день соответственно. Данные свидетельствуют, что влияние дорназы альфа на развитие инфекций респираторного тракта у больных старше 21 года может быть меньше, чем у более молодых пациентов, и для пациентов старше 21 года может быть необходим прием ЛС 2 раза в сутки. Для пациентов с начальным показателем ФЖЕЛ >85% также может быть полезен прием ЛС 2 раза в день. Снижение риска респираторной инфекции, отмечавшееся у пациентов, леченных дорназой альфа, не коррелирует напрямую с улучшением объема форсированного выдоха (ОФВ1) за период первых двух недель терапии.
В течение первых 8 дней лечения дорназой альфа величина ОФВ1 увеличилась на 7,9% у пациентов, получавших одну дозу в сутки, и на 9,0% у пациентов, принимавших ЛС дважды в сутки, по сравнению с начальными показателями. Суммарное значение ОФВ1 во время длительной терапии увеличилось на 5,8% в сравнении с начальным при ежедневном приеме 2,5 мг и на 5,6% при приеме по 2,5 мг дважды в день.
Исследование показало, что у пациентов старше 5 лет, с начальным показателем ФЖЕЛ не менее 40% от нормы прием дорназы альфа не только приводит к снижению частоты развития инфекций респираторного тракта, для лечения которых требуется парентеральное введение антибиотиков, но и улучшает показатели ОФВ1 вне зависимости от возраста пациентов или показателя ФЖЕЛ в группах пациентов, участвующих в исследовании.
В другом рандомизированном плацебо-контролируемом исследовании у пациентов с клинически стабильным муковисцидозом при ФЖЕЛ менее 40% от нормы, пациенты получали плацебо (n=162) или по 2,5 мг дорназы альфа 4 раза в день (n=158) на протяжении 12 недель. У пациентов, получавших дорназу альфа, отмечалось увеличение среднего изменения ОФВ1 (как процент по отношению к начальному показателю) в сравнении с плацебо (9,4 и 2,1%; p<0,01) и ФЖЕЛ (12,4 и 7,3%; p<0,01).
Другие клинические исследования показали, что терапия дорназой альфа может быть продолжена или начата при обострении респираторного процесса.
Кратковременные исследования по изучению режимов дозирования продемонстрировали, что дозы, превышающие 2,5 мг дважды в день, не обеспечивают дальнейшего улучшения показателя ОФВ1. Исследования, в которых пациентам назначали ЛС в прерывистом режиме (т.е. применение дорназы альфа 10 мг дважды в день в течение 14 дней и 14-дневный перерыв), показали, что после прекращения терапии улучшение функции легких быстро исчезает (отмечалось быстрое улучшение ОФВ1 в начале каждого цикла и возвращение к исходным показателям после прекращения терапии).
Применение у детей. Поскольку опыт использования дорназы альфа у детей младше 5 лет ограничен, следует применять это ЛС у данной группы пациентов только в случае предполагаемой пользы для дыхательной функции легких или при риске развития инфекции респираторного тракта.
Применение у пожилых пациентов. Муковисцидоз — заболевание, встречающееся главным образом у детей и молодых людей (до 21 года). В клинические исследования не было включено достаточное количество пациентов в возрасте 65 лет и старше для оценки различий эффекта по сравнению с таковым у молодых пациентов.
Применение вещества Дорназа альфа
Улучшение функции дыхания у больных муковисцидозом в возрасте старше 5 лет с показателем ФЖЕЛ не менее 40% от нормы (в составе комплексной терапии). Может применяться для лечения больных некоторыми хроническими заболеваниями легких (в т.ч. бронхоэктатическая болезнь, ХОБЛ, врожденный порок развития легких у детей, хроническая пневмония, иммунодефицитные состояния, протекающие с поражением легких), если по оценке врача муколитическое действие дорназы альфа обеспечивает преимущества для пациентов.
Противопоказания
Гиперчувствительность, аллергические реакции на препараты из клеток яичника китайских хомячков.
Ограничения к применению
Детский возраст до 5 лет, а также пациенты с показателем ФЖЕЛ менее 40%. Безопасность и эффективность препарата не доказаны.
Применение при беременности и кормлении грудью
При беременности следует назначать только по абсолютным показаниям, в случае если польза для матери превышает риск для ребенка (адекватных и строго контролируемых исследований у человека не проведено). Исследования дорназы альфа на крысах и кроликах при в/в введении в дозах до 10 мг/кг/сут (системная экспозиция более чем в 600 раз превышала ожидаемую после приема рекомендованной дневной дозы для человека) не свидетельствовали о нарушении фертильности, тератогенности или влиянии на развитие плода.
Категория действия на плод по FDA — B.
Неизвестно, проникает ли ЛС в грудное молоко женщин. Небольшое количество дорназы альфа определялось в материнском молоке у обезьян Cynomolgus при болюсной дозе (100 мг/кг) дорназы альфа после 6 ч в/в инфузии (80 мг/кг/сут). При использовании в соответствии с рекомендациями попадание дорназы альфа в системный кровоток минимально, однако применение у кормящих матерей не рекомендуется.
Побочные действия вещества Дорназа альфа
В клинических испытаниях пациенты применяли дорназу альфа до 12 мес.
В рандомизированном плацебо-контролируемом испытании по сравнению дорназы альфа с плацебо у пациентов с показателем ФЖЕЛ не менее 40% от нормы свыше 600 пациентов получали дорназу альфа 1 или 2 раза в сутки ежедневно в течение 6 мес; большинство наблюдавшихся нежелательных явлений, возможно, представляли собой проявления или осложнения основного заболевания. В большинстве случаев эти побочные эффекты были слабо выраженными, транзиторными, и не требовали отмены ЛС. Нежелательные явления, приведшие к полному прекращению лечения дорназой альфа, наблюдались у очень небольшого числа больных, а частота прерывания терапии была одинаковой в группе плацебо (2%) и в группе, получавшей дорназу альфа (3%). Побочные эффекты, наблюдавшиеся более часто (более 3%) у пациентов с муковисцидозом, получавших дорназу альфа, по сравнению с плацебо, представлены в таблице.
В рандомизированном плацебо-контролируемом испытании у пациентов с клинически выраженным муковисцидозом (ФЖЕЛ менее 40% от нормы) профиль нежелательных явлений был сходным с отмеченным в испытаниях у пациентов с муковисцидозом от слабой до умеренной степени выраженности. В этом исследовании побочные эффекты, которые были отмечены с большей частотой (более 3%) у пациентов, леченных дорназой альфа, также представлены в таблице.
Таблица
Побочные эффекты, встречавшиеся с частотой более 3% у больных муковисцидозом при проведении клинических испытаний дорназы альфа
|
Испытания у пациентов с муковисцидозом от слабой до умеренной степени выраженности (ФЖЕЛ ?40%), леченных в течение 24 нед |
Испытания у пациентов с клинически выраженным муковисцидозом (ФЖЕЛ <40%), леченных в течение 12 нед |
||||
| Побочный эффект (любой выраженности и тяжести) |
Плацебо (n=325), % | Дорназа альфа 2,5 мг 4 раза в день (n=322), % |
Дорназа альфа 2,5 мг 2 раза в день (n=321), % |
Плацебо (n=159), % |
Дорназа альфа 2,5 мг 4 раза в день (n=161), % |
| Изменение голоса | 7 | 12 | 16 | 6 | 18 |
| Фарингит | 33 | 36 | 40 | 28 | 32 |
| Сыпь | 7 | 10 | 12 | 1 | 3 |
| Ларингит | 1 | 3 | 4 | 1 | 3 |
| Боль в груди | 16 | 18 | 21 | 23 | 25 |
| Конъюнктивит | 2 | 4 | 5 | 0 | 1 |
| Ринит |
Разница в выраженности этих побочных эффектов составляла менее 3% |
24 | 30 | ||
| Снижение ФЖЕЛ ?10%* |
17 | 22 | |||
| Лихорадка | 28 | 32 | |||
| Диспепсия | 0 | 3 | |||
| Диспноэ (когда сообщается как о тяжелом) |
Разница в выраженности этого побочного эффекта составляла менее 3% |
Общее количество сообщений об одышке (вне зависимости от степени выраженности и тяжести) имело разницу менее 3% |
* Только однократное изменение, не отражает все изменения ФЖЕЛ
Нежелательные явления, наблюдавшиеся с одинаковой частотой у больных муковисцидозом с показателем ФЖЕЛ не менее 40% от нормы при ингаляциях дорназы альфа и плацебо
Организм в целом: абдоминальная боль, астения, лихорадка, гриппоподобный синдром, недомогание, сепсис.
Пищеварительная система: кишечная непроходимость, заболевания желчного пузыря, печени, поджелудочной железы.
Метаболизм: сахарный диабет, гипоксия, снижение массы тела.
Респираторная система: апноэ, бронхоэктаз, бронхит, изменение характеристик мокроты, усиление кашля, диспноэ, кровохарканье, снижение функции легких, назальные полипы, пневмония, пневмоторакс, ринит, синусит, повышенное отделение мокроты, свистящее дыхание.
В контролируемых испытаниях смертность была сходной в группе пациентов, принимавших дорназу альфа, и в группе плацебо. Причины летальных исходов были связаны с прогрессированием муковисцидоза и включали апноэ, остановку сердца, сердечно-легочную недостаточность, легочное сердце, сердечную недостаточность, массивное кровохарканье, пневмонию, пневмоторакс, дыхательную недостаточность.
Переносимость дорназы альфа 2,5 мг в виде ингаляций была исследована при двухнедельном ежедневном назначении у 98 пациентов с муковисцидозом (65 в возрасте от 3 мес до 5 лет, 33 в возрасте от 5 лет до 10 лет). Применяли небулайзер многократного использования. Число пациентов, у которых отмечался кашель, было выше в более младшей возрастной группе (29/65, 45% в сравнении с 10/33, 30%) так же, как и число случаев средней и тяжелой степени выраженности кашля (24/65, 37% в сравнении с 6/33, 18%).
Другие побочные эффекты имели слабую или среднюю степень выраженности. Число пациентов, у которых отмечался ринит, было выше в более младшей возрастной группе (23/65, 35% в сравнении с 9/33, 27%) так же, как и число пациентов, у которых отмечалась сыпь (4/65, 6% в сравнении с 0/33).
Аллергические реакции
Не было сообщений о случаях анафилаксии, которую можно было бы связать с назначением дорназы альфа. Наблюдались преходящие крапивница слабой или средней степени выраженности и слабо выраженная кожная сыпь. На протяжении всех исследований примерно у 2–4% пациентов обнаруживались антитела к дорназе альфа. Ни у одного из этих пациентов не развивалась анафилаксия и клиническая важность сывороточных антител к дорназе альфа неизвестна.
Взаимодействие
Совместим с другими ЛС, применяющимися при лечении муковисцидоза (включая антибиотики, бронходилататоры, пищеварительные ферменты, витамины, ингаляционные и системные глюкокортикоиды, анальгетики).
Фармацевтическая несовместимость: водный раствор дорназы альфа не обладает буферными свойствами и не должен разводиться или смешиваться в ингаляционных системах с другими ЛС (возможны нежелательные структурные и/или функциональные изменения).
Передозировка
Симптомы: случаев передозировки не зафиксировано. В исследованиях на крысах и обезьянах показано, что однократная ингаляция препарата в дозах, превышающих обычно используемые в клинических исследованиях вплоть до 180 раз, переносилась хорошо. Однократное пероральное введение крысам дорназы альфа в дозах до 200 мг/кг также переносилось хорошо.
В клинических исследованиях больные муковисцидозом получали до 20 мг дорназы альфа 2 раза в сутки в течение 6 дней и по 10 мг 2 раза в сутки по прерывистой схеме (двухнедельный прием/двухнедельный перерыв) на протяжении 168 дней. Оба режима дозирования переносились хорошо.
Способ применения и дозы
Ингаляционно. Раствор в ампулах предназначен только для разового ингаляционного применения, вводится с помощью компрессорного воздушного небулайзера (джет-небулайзера); рекомендуемая доза — 2500 ЕД (2,5 мг) дорназы альфа 1 раз в сутки, что соответствует содержимому 1 ампулы (2,5 мг неразведенного раствора). У некоторых больных старше 21 года лучшего эффекта лечения можно добиться при применении препарата 2 раза в сутки.
У большинства больных оптимального эффекта удается достичь при постоянном ежедневном применении дорназы альфа. Исследования, в которых дорназу альфа назначали в прерывистом режиме, показывают, что после прекращения терапии улучшение функции легких быстро исчезает, поэтому рекомендуется ежедневный прием препарата. В настоящее время рекомендаций по оптимальному времени суток для приема препарата нет.
Безопасность и эффективность ежедневного применения в период времени более 12 месяцев не установлены.
При обострении инфекции дыхательных путей на фоне лечения применение препарата можно продолжать без какого-либо риска для больного.
Торговые названия с действующим веществом Дорназа альфа
| Торговое название | Цена за упаковку, руб. |
|---|---|
| Тигераза® |
от 6715.00 до 6715.00 |
Системное всасывание дорназы альфа после ингаляции аэрозоля у человека невысоко.
В норме ДНаза присутствует в сыворотке крови человека. Ингаляции дорназы альфа в дозах до 40 мг на протяжении 6 дней не приводили к достоверному увеличению концентрации в сыворотке крови по сравнению с нормальными эндогенными уровнями. Сывороточная концентрация ДНазы не превышала 10 нг/мл. После назначения в дозе 2500 ЕД (2,5 мг) 2 раза/сут на протяжении 24 недель средние сывороточные концентрации ДНазы не отличались от средних показателей до лечения (3,5±0,1 нг/мл), что свидетельствует о низком системном всасывании или малой кумуляции.
Распределение. У больных муковисцидозом средняя концентрация ДНазы в мокроте через 15 мин после ингаляции в дозе 2500 ЕД (2,5 мг) составляет примерно 3,0 мкг/мл. После ингаляции концентрация ДНазы в мокроте быстро уменьшается.
Метаболизм. По видимому, ДНаза метаболизируется под действием протеаз, присутствующих в биологических жидкостях.
Выведение. После в/в введения ДНазы T1/2 составляет 3-4 ч.
В течение 2 ч концентрация ДНазы в мокроте снижается более чем в 2 раза по сравнению со значением сразу после ингаляции, однако действие на реологию мокроты сохраняется более 12 ч.
Тигераза — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-005537
Торговое наименование:
Тигераза®
МНН:
дорназа альфа
Лекарственная форма:
раствор для ингаляций.
Состав.
1 ампула полимерная (2,5 мл) содержит
| действующее вещество: | |
| дорназа альфа (rDnz-α)* | 2,5 мг |
| вспомогательные вещества: | |
| натрия хлорид | 21,93 мг, |
| кальция хлорида дигидрат | 0,38 мг, |
| вода для инъекций | до 2,5 мл |
* 1 мг дорназы альфа соответствует 1000 ЕД.
Описание:
прозрачный бесцветный или желтоватого цвета раствор.
Фармакотерапевтическая группа:
отхаркивающее муколитическое средство.
Код ATX:
[R05CB13]
Фармакологические свойства
Фармакодинамика и механизм действия
Дорназа альфа (рекомбинантная человеческая дезоксирибонуклеаза I – ДНаза) – генно-инженерный вариант человеческого природного фермента, который расщепляет внеклеточную ДНК.
Накопление вязкого гнойного секрета в дыхательных путях играет роль в нарушении функции внешнего дыхания и в обострениях инфекционного процесса у больных муковисцидозом. Гнойный секрет содержит очень высокие концентрации внеклеточной ДНК – вязкого полианиона, высвобождающегося из разрушающихся лейкоцитов, которые накапливаются в ответ на инфекцию. In vitro дорназа альфа гидролизирует ДНК в мокроте и выраженно уменьшает вязкость мокроты при муковисцидозе.
Фармакокинетика
Всасывание. Системное всасывание дорназы альфа после ингаляции аэрозоля у человека невысоко.
В норме ДНаза присутствует в сыворотке крови человека. Ингаляции дорназы альфа в дозах до 40 мг на протяжении 6 дней не приводили к достоверному увеличению концентрации ДНазы в сыворотке крови по сравнению с нормальными эндогенными уровнями. Сывороточная концентрация ДНазы не превышала 10 нг/мл. После назначения дорназы альфа по 2500 ЕД (2,5 мг) два раза в сутки на протяжении 24 недель средние сывороточные концентрации ДНазы не отличались от средних показателей до лечения (3,5±0,1 нг/мл), что свидетельствует о низком системном всасывании или малой кумуляции.
Распределение. У больных муковисцидозом средняя концентрация дорназы альфа в мокроте через 15 минут после ингаляции препарата в дозе 2500 ЕД (2,5 мг) равняется примерно 3,0 мкг/мл. После ингаляции концентрация дорназы альфа в мокроте быстро уменьшается.
Метаболизм. Ожидается, что дорназа альфа метаболизируется под действием протеаз, присутствующих в биологических жидкостях.
Выведение. После внутривенного введения дорназы альфа период полувыведения из сыворотки крови составляет 3-4 часа.
В течение 2 часов значение концентрации ДНазы в мокроте снижается более чем в два раза по сравнению со значением сразу после ингаляции, однако действие на реологию мокроты сохраняется более 12 часов.
Фармакокинетика у особых групп пациентов
Пациенты в возрасте от 3 месяцев до 9 лет
Дорназа альфа применялась у детей, больных муковисцидозом, в возрасте от 3 месяцев до 9 лет в дозе 2,5 мг в виде ингаляций 1 раз в сутки в течение 2 недель. В период 90 минут после первой ингаляции проводился бронхоальвеолярный лаваж (БАЛ). Концентрация ДНазы в жидкости БАЛ достигла детектируемого уровня у всех пациентов, но варьировала в широком диапазоне от 0,007 до 1,8 мкг/мл.
После применения дорназы альфа в течение в среднем 14 дней концентрация ДНазы в сыворотке крови (среднее значение ± стандартное отклонение) повышалась на 1,1±1,6 нг/мл у детей от 3 месяцев до 5 лет и на 0,8±1,2 нг/мл у детей от 5 до 9 лет. Взаимосвязь величины концентрации ДНазы в сыворотке или в жидкости БАЛ с развитием нежелательных реакций или эффективностью терапии не установлена.
Показания к применению
Симптоматическая терапия в комбинации со стандартной терапией муковисцидоза у пациентов со значением форсированной жизненной емкости легких (ФЖЕЛ) не менее 40% от нормы с целью улучшения функции легких.
Противопоказания
Повышенная чувствительность к действующему веществу препарата или его компонентам.
С осторожностью
Беременность, период грудного вскармливания. Дети до 5 лет.
Беременность и период грудного вскармливания
Беременность
Безопасность применения дорназы альфа при беременности не установлена. Исследования дорназы альфа не свидетельствовали о нарушении фертильности, тератогенности или влиянии препарата на развитие плода у животных. Препарат Тигераза® следует назначать при беременности с осторожностью и только в том случае, если польза для матери превышает потенциальный риск для плода.
Период грудного вскармливания
Учитывая минимальное системное всасывание дорназы альфа при соблюдении рекомендованного режима дозирования, появления измеряемых концентраций дорназы альфа в грудном молоке у женщин ожидать не следует. Назначать препарат Тигераза® кормящим матерям следует с осторожностью. У лактирующих яванских макак, получавших высокие дозы дорназы альфа внутривенно (в/в), были обнаружены низкие концентрации дорназы альфа в материнском молоке (<0,1% от сывороточных концентраций).
Способ применения и дозы
Раствор в ампулах предназначен только для разового ингаляционного применения.
Препарат Тигераза® нельзя разводить или смешивать с другими препаратами или растворами в емкости небулайзера. Смешивание препарата с другими лекарственными средствами может привести к нежелательным структурным и/или функциональным изменениям препарата Тигераза® или другого компонента смеси.
2,5 мг дорназы альфа (соответствует содержимому 1 ампулы – 2,5 мл неразведенного раствора, 2500 ЕД) один раз в сутки, ингаляционно, без разведения, с помощью джет-небулайзера (см. раздел «Правила проведения ингаляции»).
У некоторых пациентов старше 21 года лучшего эффекта лечения можно добиться при применении суточной дозы препарата 2 раза в сутки. У большинства пациентов оптимального эффекта удается достичь при постоянном ежедневном применении дорназы альфа. Исследования, в которых дорназу альфа назначали в прерывистом режиме, показывают, что после прекращения терапии улучшение функции легких исчезает. Следовательно, пациентам следует рекомендовать ежедневное применение препарата без перерыва.
Пациентам следует продолжать комплексную терапию, включая физиотерапию грудной клетки.
При обострении инфекции дыхательных путей на фоне лечения препаратом Тигераза® его применение можно продолжать без какого-либо риска для больного.
Правила проведения ингаляции
Препарат Тигераза® можно вводить с помощью джет-небулайзера с компрессором многоразового использования, кроме ультразвуковых, поскольку они могут инактивировать действующее вещество препарата или не обеспечить необходимой степени распыления жидкости.
- Тщательно моют руки перед проведением нижеописанных процедур.
- В соответствии с инструкцией фирмы-изготовителя собирают небулайзер, присоединяют мундштук или респираторную маску.
- Вскрывают ампулу полимерную, обрезая ножницами верхнюю часть капилляра, содержимое переливают в специальную емкость небулайзера.
- Вставляют в рот мундштук, зажимают его зубами, плотно сомкнув губы.
Пациенты, которым трудно дышать ртом в течение всего времени ингаляции, могут использовать респираторную маску.
Надевают респираторную маску, плотно прижимая ее к лицу. - Включают компрессор.
- Начинают дышать глубоко и ровно, задерживая дыхание на две секунды после вдоха, выдыхают через нос.
- Ингаляционную процедуру продолжают до использования всего препарата (начало прерывистой подачи аэрозоля).
- Выключают компрессор.
- Полощут рот кипяченой водой. При использовании респираторной маски промывают глаза и лицо водой.
- Разбирают небулайзер.
- Промывают и высушивают детали системы, в соответствии с инструкцией фирмы-изготовителя.
- Пациент должен соблюдать инструкции фирмы изготовителя по эксплуатации и уходу за небулайзером.
Предупреждения
- Перед первым использованием производят дезинфекцию и проверку правильности работы небулайзера, в соответствии с инструкцией фирмы-изготовителя.
- Перед процедурой запрещается: принимать отхаркивающие препараты, полоскать рот антисептическим раствором (перманганат калия, перекись водорода, борная кислота).
- До и после ингаляции не рекомендуется курить в течение 1 часа.
- Ингаляцию проводят сидя, при прямом положении спины, в одежде, не мешающей и не затрудняющей дыхание.
- При возникновении головокружения следует прервать ингаляционную процедуру.
Побочное действие
Нежелательные реакции при лечении дорназой альфа возникают редко (<1/1000), в большинстве случаев слабо выражены, носят преходящий характер и не требуют коррекции дозы.
Нарушения со стороны органа зрения: конъюнктивит.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: изменение голоса, одышка, фарингит, ларингит, ринит (все неинфекционной природы), инфекции дыхательных путей, в том числе вызванные Pseudomonas, увеличение бронхиального секрета.
Нарушения со стороны желудочно-кишечного тракта: диспепсия.
Нарушения со стороны кожи и подкожных тканей: сыпь, крапивница.
Общие расстройства: боль в груди (плевральная/некардиогенная), пирексия, головная боль.
Влияние на результаты лабораторных и инструментальных исследований: снижение показателей функции дыхания.
Пациенты, у которых возникают нежелательные явления, совпадающие с симптомами муковисцидоза, могут, как правило, продолжать применение дорназы альфа.
Нежелательные явления, приведшие к полному прекращению лечения дорназой альфа, наблюдались у очень небольшого числа пациентов, а частота прерывания терапии была сходной с назначением плацебо (2%) и дорназы альфа (3%).
Антитела к дорназе альфа были обнаружены менее чем у 5% пациентов, однако ни у одного из них они не относились к классу IgE. Улучшение показателей функции легких отмечалось даже после появления антител к дорназе альфа.
В клиническом исследовании у 50 пациентов, получавших препарат Тигераза®, не было обнаружено статистически значимых различий с референтным препаратом по частоте образования антител классов IgG и IgM; так же, как и у референтного препарата, не выявлены антитела, относящиеся к классу IgE.
Пациенты в возрасте от 3 месяцев до 9 лет
Безопасность ингаляции 2,5 мг дорназы альфа 1 раз в сутки в течение 2 недель сравнивали у детей, больных муковисцидозом, в двух возрастных группах – от 3 месяцев до <5 лет и от 5 до 9 лет. Нежелательные явления были аналогичны тем, что наблюдались в других клинических исследованиях с участием детей. В младшей группе пациентов по сравнению с детьми старшего возраста чаще наблюдался кашель (как побочное действие) (45% и 30%, соответственно), в том числе тяжелой и средней степени тяжести (37% и 18%, соответственно). Остальные нежелательные реакции были легкой или средней степеней тяжести. Также в младшей группе пациентов чаще, чем в старшей группе, наблюдались ринит (35% против 27%) и сыпь (6% против 0%).
Передозировка
Случаи передозировки дорназы альфа не зарегистрированы. Пациенты с муковисцидозом получали 20 мг дорназы альфа ингаляционно два раза в день (что превышает рекомендуемую ежедневную дозу в 16 раз) в течение 6 дней или 10 мг два раза в день (что превышает рекомендуемую ежедневную дозу в 8 раз) по прерывистой схеме (2 недели терапии дорназой альфа с последующим 2-недельным периодом без терапии) в течение 168 дней. Шесть взрослых пациентов, не больных муковисцидозом, получали дорназу альфа внутривенно, однократно, в дозе 125 мкг/кг массы тела, а затем через 7 дней эти же пациенты получали по 125 мкг/кг дорназы альфа в виде подкожной инъекции в течение двух последовательных 5-дневных периодов. При этом не наблюдалось образования нейтрализующих антител к ДНазе и изменений концентрации антител к двухцепочечной ДНК в сыворотке крови. Все перечисленные выше режимы дозирования переносились хорошо.
Системная токсичность дорназы альфа не выявлена и не является ожидаемой из-за низкой степени всасывания и короткого периода полувыведения дорназы альфа. Таким образом, в случае передозировки дорназы альфа системная терапия не требуется.
Взаимодействие с другими лекарственными средствами
Совместим со стандартными препаратами для лечения муковисцидоза: антибиотиками, бронхолитиками, пищеварительными ферментами, витаминами, ингаляционными и системными глюкокортикостероидами и анальгетиками.
Препарат Тигераза® представляет собой водный раствор без буферных свойств и не должен разводиться или смешиваться с другими препаратами или растворами в емкости небулайзера. Смешивание препарата с другими лекарственными средствами может привести к нежелательным структурным и/или функциональным изменениям препарата Тигераза® или другого компонента смеси.
Особые указания
При терапии препаратом Тигераза® необходимо продолжать регулярное медицинское наблюдение пациента и стандартную физиотерапию.
После начала терапии препаратом Тигераза®, как и любым аэрозолем, функция легких может несколько снизиться, а отхождение мокроты возрасти.
Опыт применения дорназы альфа у детей в возрасте до 5 лет ограничен. Эффективность дорназы альфа у детей в возрасте до 5 лет не изучалась.
Назначать дорназу альфа детям в возрасте до 5 лет следует только в случае возможного улучшения функции легких или снижения риска возникновения инфекций дыхательных путей.
Эффективность и безопасность дорназы альфа у пациентов с ФЖЕЛ менее 40% от нормы не установлены.
Допускается однократное воздействие повышенной температуры (не выше 25 °С) не более 3 суток при хранении в защищенном от света месте.
Влияние на способность управлять транспортными средствами, механизмами
О влиянии дорназы альфа на способность пациентов управлять транспортными средствами и работать с механизмами сообщений не поступало.
Форма выпуска
По 2,5 мг/2,5 мл раствора для ингаляций в ампулы полимерные, изготовленные методом термической экструзии. 6 ампул полимерных – в светозащитном пакете из комбинированного материала (фольга алюминиевая, покрытая с двух сторон пленкой полиэтиленовой).
Запаянный светозащитный пакет вместе с инструкцией по медицинскому применению – в пачке из картона.
Для контроля первого вскрытия клапаны пачки фиксируют самоклеящимися этикетками.
Условия хранения
В защищенном от света месте, при температуре от 2 до 8 °С. Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не использовать позже срока, указанного на упаковке.
Условия отпуска
Отпускают по рецепту.
Держатель регистрационного удостоверения
АО «ГЕНЕРИУМ»
601125, Владимирская обл., Петушинский район, пос. Вольгинский, ул. Заводская, стр. 273.
Производитель
АО «ГЕНЕРИУМ»
601125, Владимирская обл., Петушинский район, пос. Вольгинский, ул. Заводская, стр. 273.
Фасовщик (первичная упаковка)
ФГУП «Московский эндокринный завод»
109052, г. Москва, ул. Новохохловская, д. 25, стр. 1, стр. 2.
Упаковщик (вторичная /потребительская упаковка)
АО «ГЕНЕРИУМ»
601125, Владимирская обл., Петушинский район, пос. Вольгинский, ул. Заводская, стр. 263.
Выпускающий контроль качества
АО «ГЕНЕРИУМ»
601125, Владимирская обл., Петушинский район, пос. Вольгинский, ул. Заводская, стр. 273.
Организация, принимающая претензии от потребителей
АО «ГЕНЕРИУМ»
601125, Владимирская обл., Петушинский район, пос. Вольгинский, ул. Заводская, стр. 273.
Купить Тигераза в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
1 ампула (2.5 мл) раствора для ингаляций содержит:
действующее вещество: дорназа альфа* − 2.5 мг;
Рекомбинантная человеческая дезоксирибонуклеаза I (рчДНаза), полученная с помощью генной инженерии с использованием клеток яичника китайских хомячков, состоящая из активной смеси ДНазы и Дезамидо-ДНазы (спецификация: 65±17% Дезамидо-ДНазы).
вспомогательные вещества: натрия хлорид − 21.93 мг, кальция хлорида дигидрат − 0.38 мг, вода для инъекций q.s. до 2.5 мл.
*1 мг дорназы альфа соответствует 1000 ЕД.
Прозрачный бесцветный или слегка желтоватый раствор.
Симптоматическая терапия в комбинации со стандартной терапией муковисцидоза у пациентов со значением форсированной жизненной емкости легких (ФЖЕЛ) не менее 40% от нормы.
В настоящее время доступны клинические данные у пациентов в возрасте старше 5 лет, получавших лечение в течение до 2 лет.
Длительное лечение препаратом Пульмозим® показано для профилактики респираторных осложнений, возникающих из-за скопления ДНК в инфицированной слизи, которая накапливается при кистозном фиброзе (муковисцидозе) в дыхательных путях. Такое длительное лечение способствует:
− снижению повторно возникающих симптоматических инфекций, требующих парентерального лечения пациента антибиотиками и стационарного лечения;
− улучшению дыхательной функции и ослаблению симптомов, таких как одышка, кашель и скопления слизи;
− улучшению общего состояния пациента.
Режим дозирования
Для пациентов с кистозным фиброзом рекомендовано длительное лечение с ежедневными ингаляциями 2.5 мг дорназы альфа, что соответствует содержимому 1 ампулы − 2.5 мл неразведенного раствора (см. раздел «Инструкции по использованию препарата или при работе с ним»).
У некоторых больных старше 21 года лучшего эффекта лечения можно добиться при применении суточной дозы препарата 2 раза в сутки.
Способ применения
У большинства больных оптимального эффекта удается достигнуть при регулярном ежедневном применении препарата Пульмозим®. Исследования, в которых дорназу альфа назначали в прерывистом режиме, показывают, что после прекращения терапии улучшение функции легких исчезает. Следовательно, больным следует рекомендовать ежедневный прием препарата без перерыва.
Во время лечения препаратом Пульмозим® пациентам следует продолжать комплексную терапию, включая физиотерапевтические процедуры, для улучшения дыхательной функции.
При обострении инфекции дыхательных путей на фоне лечения препаратом Пульмозим® его применение можно продолжать без какого-либо риска для больного. Пациентам следует продолжать физиотерапию для улучшения дыхательной функции.
Опыт применения препарата Пульмозим® у детей в возрасте младше 5 лет ограничен. Согласно фармакокинетическим и проспективным исследованиям после внедрения препарата на рынок, применение препарата Пульмозим® у детей младше 5 лет безопасно в таких же дозах, как и для детей старшего возраста, при использовании маски. Такое применение следует учитывать, если существует потенциальная польза для функции легких и риск инфекции дыхательных путей (см. раздел «Побочное действие»).
Эффективность и безопасность у этой возрастной группы не доказана.
У пациентов с ФЖЕЛ менее 40% от нормы эффективность и безопасность применения препарата Пульмозим® до сих пор не доказана в клинических исследованиях.
Особые указания
Для того чтобы обеспечить прослеживаемость биологических лекарственных средств, в случае возникновения нежелательных реакций, торговое наименование и номер серии должны быть указаны в медицинской документации пациента при каждом назначении препарата.
Повышенная чувствительность к действующему веществу препарата или его компонентам.
Не требуется особых мер предосторожности.
Препарат Пульмозим® совместим со стандартными лекарственными средствами для лечения кистозного фиброза (антибиотики, бронхолитики, препараты, содержащие панкреатические ферменты, витамины, анальгетики, кортикостероиды для системного и ингаляционного применения). Препарат Пульмозим® нельзя смешивать в ингаляторе (распылителе) с другими препаратами (см. раздел «Дополнительная информация»/«Несовместимость»).
Беременность
Безопасность применения дорназы альфа при беременности не установлена. В экспериментальных исследованиях на животных не получено данных о нарушении фертильности или о влиянии препарата на развитие плода (см. раздел «Доклинические данные»), но контролируемые исследования у беременных женщин не проводились. При применении во время беременности рекомендуется соблюдать осторожность.
Лактация
При применении препарата у пациентов согласно рекомендациям по дозировке наблюдалось минимальное системное всасывание дорназы альфа; не следует ожидать измеряемых концентраций дорназы альфа в грудном молоке у женщин. С осторожностью следует применять препарат в период лактации (грудного вскармливания) (см. разделы «Всасывание» и «Доклинические данные»).
В исследовании у лактирующих яванских макак, получавших высокие дозы дорназы альфа внутривенно, были обнаружены низкие концентрации дорназы альфа в грудном молоке (< 0,1% от сывороточных концентраций).
Нет сообщений о влиянии препарата на способность управлять транспортными средствами или работать с механизмами.
Нежелательные реакции при лечении препаратом Пульмозим® возникают редко (< 1/1000), в большинстве случаев слабо выражены, носят преходящий характер и не требуют коррекции дозы.
Нарушения со стороны органа зрения: конъюнктивит.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: изменение голоса, одышка, фарингит, ларингит, ринит (все не инфекционной природы).
Нарушения со стороны желудочно-кишечного тракта: диспепсия.
Нарушения со стороны кожи и подкожных тканей: сыпь, крапивница.
Общие расстройства: боль в груди (плевральная/не кардиогенная), повышение температуры тела.
Влияние на результаты лабораторных и инструментальных исследований: снижение показателей функции дыхания.
Следующие нежелательные реакции возникали в плацебо-контролируемых двойных слепых исследованиях:
| Нежелательные реакции | Плацебо (n=325) | 2.5 мг однократно ежедневно (n=322) | 2.5 мг двукратно ежедневно (n=321) |
| Нарушения co стороны органа зрения | |||
| Конъюнктивит | 2% | 4% | 5% |
| Нарушения co стороны дыхательной системы, органов грудной клетки и средостения | |||
| Фарингит | 33% | 36% | 40% |
| Изменение голоса | 7% | 12% | 16% |
| Ларингит | 1% | 3% | 4% |
| Нарушения со стороны кожи и подкожных тканей | |||
| Кожная сыпь | 7 % | 10 % | 12 % |
| Общие расстройства | |||
| Боли в грудной клетке | 16 % | 18 % | 21 % |
Пациенты, у которых возникают нежелательные реакции, совпадающие с симптомами муковисцидоза, могут, как правило, продолжать применение препарата Пульмозим®, о чем свидетельствует высокий процент пациентов, завершивших клинические испытания препарата Пульмозим®.
В клинических исследованиях только небольшое количество пациентов имело соответствующие жалобы, которые требовали прекращения лечения дорназой альфа. Нежелательные явления, приведшие к полному прекращению лечения препаратом Пульмозим®, наблюдались у очень небольшого числа пациентов, а частота отмены лечения в группе плацебо (2%) и препарата Пульмозим® (3%) была схожа.
После начала терапии дорназой альфа, как и любым аэрозолем, функция легких может несколько снизиться, а отхождение мокроты возрасти.
Антитела к дорназе альфа обнаружены менее чем у 5% больных, однако ни у одного из них они не относились к классу IgE. Улучшение показателей функции легких отмечалось даже после появления антител к дорназе альфа.
Дети младше 5 лет
В фармакокинетическом исследовании, в котором 65 детей младше 5 лет и 33 ребенка в возрасте от 5 до 9 лет ежедневно принимали 2.5 мг препарата Пульмозим® в течение 14 дней, в обеих возрастных группах не наблюдалось клинически существенных различий относительно профиля нежелательных реакций препарата Пульмозим® (см. раздел «Фармакокинетика у особых групп пациентов»).
Проспективное наблюдение, которое проводилось во время лечения препаратом Пульмозим® и после окончания лечения, не выявило увеличения частоты серьезных нежелательных реакций у детей младше 5 лет.
Назначать препарат Пульмозим® детям младше 5 лет следует только в случае возможного улучшения функции легких или снижения риска возникновения инфекций дыхательных путей.
Нежелательные реакции в пострегистрационном периоде
Спонтанные сообщения, полученные в пострегистрационном периоде, и проспективно собранные данные о безопасности из наблюдательных исследований, подтверждают профиль безопасности, который представлен в клинических исследованиях.
Случаи передозировки препаратом Пульмозим® не зарегистрированы. Пациенты с муковисцидозом получали 20 мг препарата Пульмозим® ингаляционно два раза в день (что превышает рекомендуемую ежедневную дозу в 16 раз) в течение 6 дней или 10 мг два раза в день (что превышает рекомендуемую ежедневную дозу в 8 раз) по прерывистой схеме (2 недели терапии препаратом Пульмозим® с последующим 2-х недельным периодом без терапии) в течение 168 дней.
Системная токсичность препарата Пульмозим® не выявлена и не является ожидаемой из-за низкой степени всасывания и короткого периода полувыведения дорназы альфа.
Муколитические средства.
Код АТС: R05CB13
Механизм действия/фармакодинамика
Рекомбинантная человеческая ДНаза (дорназа альфа) – генно-инженерный вариант человеческого природного фермента, который расщепляет внеклеточную ДНК.
Накопление вязкого гнойного секрета в дыхательных путях приводит к нарушению функции легких и появлению инфекций. Гнойный секрет содержит очень высокие концентрации внеклеточной ДНК − вязкого полианиона, высвобождающегося из разрушающихся лейкоцитов, которые накапливаются в ответ на инфекцию. In vitro дорназа альфа гидролизирует ДНК в мокроте и значительно уменьшает вязкость мокроты у пациентов с кистозным фиброзом.
Ингаляция дорназы альфа in vivo улучшает функцию легких и снижает частоту обострений при кистозном фиброзе, при этом дыхательные пути лучше освобождаются от секрета и слизи.
Клинические исследования эффективности
Препарат Пульмозим® исследовался у пациентов с кистозным фиброзом старше 5 лет и с различной степенью тяжести легочного заболевания. Большинство исследований были двойные слепые и плацебо-контролируемые. Все пациенты получали лечение по назначению лечащих врачей.
Пациенты старше 5 лет с ФЖЕЛ > 40% от нормы
Препарат Пульмозим® 2.5 мг один или два раза в день ежедневно, введенный посредством небулайзера Hudson Т Up-draft II с компрессором Pulmo-Aide, снижал частоту первой инфекции дыхательных путей (инфекции, которая требует парентерального применения антибиотиков) и улучшал средний ОФВ1 (объем форсированного выдоха за 1 секунду) по сравнению с плацебо.
Препарат Пульмозим® при однократном или двукратном ежедневном приеме снижал относительный риск обострения инфекции дыхательных путей на 27% или 29% (см. Таблицу 1). Субанализ данных показал, что эффект препарата Пульмозим® в отношении обострения инфекций у старших пациентов (старше 21 года) меньше; этим пациентам может потребоваться режим дозирования два раза в день. Пациенты с исходной ФЖЕЛ > 85% могут получить положительный эффект от двукратной ежедневной дозы (см. Таблицу 1). Пониженный риск обострения инфекций у пациентов, получавших лечение препаратом Пульмозим®, сохранялся в течение шестимесячного исследования и не коррелировал непосредственно с улучшением ОФВ1 в течение первых двух недель терапии.
Таблица 1. Частота возникновения первой инфекции дыхательных путей, что обусловливает необходимость парентерального введения антибиотиков в контролируемом исследовании.
|
Плацебо n=325 |
2.5 мг однократно ежедневно n=322 |
2.5 мг двукратно ежедневно n=321 |
|
| Процент пациенток с инфекцией | 43% | 37% | 33% |
| Относительный риск (против плацебо) | 0.73 | 0.71 | |
| р-значение (против плацебо) | 0.015 | 0.007 | |
| Субгруппы по возрасту и исходной ФЖЕЛ | Плацебо (n) | 2.5 мг однократно ежедневно (n) | 2.5 мг двукратно ежедневно (n) |
| Возраст | |||
| 5 – 20 лет | 42% (201) | 25% (199) | 28% (184) |
| 21 лет и старше | 44% (124) | 48% (123) | 39% (137) |
| Исходная ФЖЕЛ | |||
| 40-85% от нормы | 54% (194) | 41% (201) | 44% (203) |
| > 85% от нормы | 27% (131) | 21% (121) | 14% (118) |
В течении первых восьми дней после начала терапии препаратом Пульмозим® однократно или двукратно ежедневно среднее значение ОФВ1 улучшилось на 7,9% или 9,0%, соответственно, по сравнению с исходным значением. После терапии в течение шести месяцев улчшение ОФВ1 составило 5,8% или 5,6% по сравнению с исходным значением при однократной или двукратной ежедневной дозировке. У пациентов, получавших плацебо, значительных изменений в показателях легочной функции в период исследования не выявлено (см. Рисунок 1).
Рисунок 1. Среднее изменение ОФВ1 в % от исходного уровня у пациентов старше 5 лет с ФЖЕЛ > 40% от нормы.
Пациенты младше 5 лет
Фармакокинетические данные исследования 65 детей в возрасте от 3 месяцев до 5 лет и 33 детей в возрасте от 5 до 10 лет показывают, что при введении 2.5 мг препарата Пульмозим® посредством небулайзера Pari Baby и компрессора Proneb (= PariBoy) у пациентов младше 5 лет наблюдали такие же концентрации ДНазы в легких, как и при применении небулайзера Pari LC Plus Vemebler и такого же компрессора у старших детей, которые ответили на лечение препаратом Пульмозим® (см. «Фармакокинетика у особых групп пациентов»).
Для обеспечения безопасности в данной популяции пациентов см. раздел «Побочные действия».
Эффективность препарата Пульмозим® у детей в возрасте до 5 лет не изучалась.
Фармакокинетика
Результаты доклинических исследований
Всасывание
Ингаляционные исследования на крысах и обезьянах показали, что лишь небольшая часть дорназы альфа всасывается системно (< 15% у крыс и < 2% у обезьян). В соответствии с этими исследованиями на животных обнаружено, что дорназа альфа, которую пациент получает в виде аэрозоля для ингаляции, системно всасывается в незначительном количестве.
После перорального введения крысам всасывание дорназы альфа из желудочно-кишечного тракта является незначительным.
Распределение/Выведение
Исследования на крысах и обезьянах показали, что препарат Пульмозим® после внутривенного введения быстро выводится из сыворотки. В этих исследованиях начальный объем распределения примерно соответствовал объему сыворотки.
Исследования на крысах показывают, что после введения аэрозоля дорназа альфа выводится из легких с периодом полувыведения 11 часов.
В настоящее время фармакокинетические данные для очень молодых или старых животных отсутствуют.
Результаты клинических исследований
Всасывание
В норме ДНаза присутствует в сыворотке крови человека. Ингаляция дорназы альфа в дозах до 40 мг в течение 6 дней не приводила к существенному увеличению концентрации ДНазы в сыворотке крови по сравнению с нормальными эндогенными уровнями. Сывороточная концентрация ДНазы не превышала 10 нг/мл. После назначения дорназы альфа по 2.5 мг два раза в сутки на протяжении 24 недель средние сывороточные концентрации ДНазы не отличались от средних показателей до лечения (3.5±0.1 нг/мл), что свидетельствует о низком системном всасывании или малой аккумуляции (см. ниже раздел «Доклинические данные»).
Распределение
У больных с кистозным фиброзом средняя концентрация дорназы альфа в мокроте через 15 минут после ингаляции 2.5 мг достигала примерно 3 мкг/мл. После ингаляции концентрация дорназы альфа в мокроте быстро уменьшается.
Метаболизм
Считается, что дорназа альфа метаболизируется под действием протеаз, присутствующих в биологических жидкостях.
Выведение
Исследования на людях показывают, что после внутривенного введения дорназы альфа период полувыведения из сыворотки крови составляет 3-4 часа. Исследования на крысах и обезьянах показали, что ДНаза после внутривенного введения быстро выводится из сыворотки.
После введения аэрозоля крысам дорназа альфа выводилась из легких с периодом полувыведения 11 часов.
В течение 2 часов значение концентрации ДНазы в мокроте снижается менее чем в два раза по сравнению со значением сразу после ингаляции, однако действие на реологию мокроты сохраняется более 12 часов.
Фармакокинетика у особых групп пациентов
Проводилось открытое двухнедельное исследование препарата Пульмозим® у пациентов с кистозным фиброзом в возрасте от 3 месяцев до 9 лет. Препарат Пульмозим® в дозе 2.5 мг вводился ингаляционного ежедневно 98 пациентам (из них 65 пациентов в возрасте от 3 месяцев и < 5 лет, а также 33 пациента в возрасте от 5 и < 10 лет). В течение 90 минут после первой ингаляции проводился бронхоальвеолярный лаваж (БАЛ). Небулайзер Pari Baby (при котором используется маска вместо мундштука) использовался у пациентов, которые не могли в период ингаляции вдыхать и выдыхать через рот (54 из 65 (83%) младших и 2 из 33 (6%) старших пациентов). Концентрация ДНазы в жидкости БАЛ достигла детектируемого уровня у всех пациентов, но варьировала в широком диапазоне от 0.007 до 1.8 мкг/мл. После применения препарата Пульмозим® в течение в среднем 14 дней концентрация ДНазы в сыворотке крови (среднее значение ± стандартное отклонение) повышалась на 1.1±1.6 нг/мл у детей от 3 месяцев до < 5 лет и на 0.8±1.2 нг/мл у детей от 5 до < 10 лет.
Доклинические данные
Канцерогенность
Двухлетнее исследование на крысах не обнаружило никаких доказательств онкогенного потенциала при введении путем ингаляции.
У групп 60 крыс каждого пола дорназа альфа вводилась в течение 2 лет в дозах 51, 101 или 246 мкг/кг/день в нижний отдел респираторного тракта. Две контрольные группы сопоставимого размера получали воздух или растворитель, соответственно. Дорназа альфа хорошо переносилась. Не было выявлено опухолей необычного типа и не отмечалось увеличения развития опухолей, которые можно было бы объяснить онкогенностью дорназы альфа в дыхательном тракте, других органах или тканях крыс.
Мутагенность
В тесте Эймса, тесте на клетках лимфомы мышей, тесте на аберрации хромосом в культивированных лимфоцитах периферической крови человека и в микроядерном тесте на мышах признаков генотоксического потенциала не выявлено.
Нарушения фертильности
Исследования дорназы альфа не свидетельствовали о нарушении фертильности, тератогенности или влиянии препарата на развитие плода у животных.
Тератогенность
У кроликов и грызунов исследования дорназы альфа не выявили никаких признаков нарушения фертильности и тератогенности.
Другие исследования
У лактирующих яванских макак, получавших высокие дозы дорназы альфа внутривенно (100 мкг/кг однократная доза, за которой последовало 80 мкг/кг/час на 6 часов), были обнаружены низкие концентрации дорназы альфа в материнском молоке (< 0.1% от сывороточных концентраций).
Четырехнедельное исследование по ингаляционной токсичности было начато в отношении крыс через 22 дня после рождения в дозах 0, 51, 102 и 260 мкг/кг/сут. Дорназа альфа хорошо переносилась. В дыхательном тракте поражений обнаружено не было.
Дополнительная информация
Несовместимость
Препарат Пульмозим® представляет собой водный раствор без буферных свойств. Препарат Пульмозим® нельзя разводить или смешивать с другими препаратами или растворами. Смешивание препарата с другими лекарственными средствами может привести к нежелательным структурным и/или функциональным изменениям препарата Пульмозим® или другого компонента смеси.
Содержимое (2.5 мг) пластиковой ампулы для однократного применения препарата Пульмозим® со стерильным раствором следует использовать для ингаляции один раз в день с помощью рекомендованного небулайзера.
Содержимое одной ампулы необходимо перелить в емкость небулайзера; можно использовать следующие типы небулайзера: Hudson Т Up-draft II/Pulmo-Aide, Airlife Misty/Pulmo-Aide, а также изготовленные с учетом конкретных особенностей: Respigard/Pulmo-Aide или Acorn II/Pulmo-Aide.
Препарат Пульмозим® также можно использовать посредством таких ингаляторов, как: Pari LL/Inhalierboy, Pari LC/Inhalierboy или Master, Aiolos/2 Aiolos, Side Stream/CR50, Mobil Air или Porta-Neb; возможно использование небулайзера Pari eRapid универсального электронного небулайзера на основе технологии мембранной вибрации.
Пациенты, неспособные дышать ртом в течение всего периода ингаляции, могут использовать небулайзер Pari Baby с плотно облегающей маской для лица.
Ультразвуковые небулайзеры не подходят для введения препарата Пульмозим®, поскольку они могут инактивировать препарат Пульмозим®, или продуцировать аэрозоль с неподходящими характеристиками.
Пациент должен соблюдать инструкции компании-производителя по эксплуатации и уходу
за небулайзером/компрессором.
Ампулы препарата Пульмозим® предназначены для однократного применения.
Препарат Пульмозим® не предназначен для инъекций или приема внутрь.
Раствор для ингаляций 2.5 мг/2.5 мл
По 2.5 мл препарата в бесцветные пластиковые ампулы, изготовленные методом термоштамповки. 6 ампул помещают в защитный контейнер из фольги алюминиевой многослойной. 1 защитный контейнер вместе с инструкцией по применению помещают в картонную пачку.
3 года.
Препарат не следует использовать по истечении срока годности, указанного на упаковке.
Хранить при температуре 2-8 °C, в защищенном от света месте. Хранить в недоступном для детей месте.
По рецепту.
Информация о производителе/заявителе
Владелец Регистрационного удостоверения
Ф. Хоффманн-Ля Рош Лтд., Швейцария
F. Hoffmann-La Roche Ltd, Grenzacherstrasse 124,4070 Basel, Switzerland
Производитель
Дженентек Инк, США
Genentech Inc, 1 DNA Way, South San Francisco, CA 94080, USA
В случае поставок и реализации на территории Республики Беларусь претензии потребителей направлять на адрес ИООО «Рош Продакте Лимитед»:
220073, г. Минск, 1-й Загородный пер., 20, 8-й этаж, кабинет 20.
Тел. (017) 256 23 08; факс (017) 256 23 06.
Email: belarus.safety@roche.com
Действующее вещество : dornase alfa;
1 ампула (2,5 мл) раствора для ингаляций содержит дорназы альфа 1 2,5 мг
Вспомогательные вещества: натрия хлорид, кальция хлорид, дигидрат; вода для инъекций.
1) 1 мг дорназы альфа соответствует 1000 ЕД.
Прозрачный бесцветный или несколько желтоватый раствор.
Муколитические средства. Дорназа альфа (дезоксирибонуклеаза).
Код АТХ R05C B13.
Фармакологические.
Рекомбинантная человеческая ДнаЗ (дорназа альфа) — генно-инженерный вариант природного фермента человека, расщепляет внеклеточную ДНК.
Накопление вязкого гнойного секрета в дыхательных путях к нарушению функции внешнего дыхания и обострение инфекционного процесса. Гнойный секрет содержит очень высокие концентрации внеклеточной ДНК — вязкого полианион, который высвобождается из лейкоцитов, разрушаются, и накапливается в ответ на инфекцию. In vitro дорназа альфа гидролизует ДНК в мокроте и существенно уменьшает вязкость мокроты при муковисцидозе.
Фармакокинетика.
Всасывания.
Исследование ингаляционного применения у крыс и приматов показали низкий процент системного всасывания дорназы альфа <15% у крыс и <2% в обезьян. Согласно результатам этих исследований на животных, дорназа альфа при применении пациентам в виде ингаляции аэрозоля демонстрирует низкую системную экспозицию. Всасывания дорназы альфа из желудочно-кишечного тракта после перорального применения у крыс незначительно. В норме ДнаЗ имеется в сыворотке крови человека. Ингаляция дорназы альфа в дозах до 40 мг в течение срока до 6 дней не приводила к достоверному увеличению концентрации ДнаЗ в сыворотке крови по сравнению с нормальными эндогенными уровнями. Сывороточная концентрация ДнаЗ не превышала 10 нг / мл. После назначения дорназы альфа по 2500 ЕД (2,5 мг) дважды в сутки в течение 24 недель средние сывороточные концентрации ДнаЗ не отличались от средних показателей к лечению (3,5 ± 0,1 нг / мл), что свидетельствует о малом системное всасывание или малую кумуляции.
Распределение.
Исследования на крысах и обезьянах показали, что после введения дорназа альфа быстро выводится из сыворотки крови. Начальный объем распределения был подобен объема сыворотки в этих исследованиях.
У больных муковисцидозом средняя концентрация дорназы альфа в мокроте через 15 минут после ингаляции 2500 ЕД (2,5 мг) составляет около 3 мкг / мл. После ингаляции концентрация дорназы альфа в сыворотке крови быстро уменьшается.
Метаболизм.
Ожидается, что дорназа альфа метаболизируется протеазами, которые находятся в биологических жидкостях.
Вывод.
Исследования на крысах и обезьянах показали, что после введения рекомбинантного человеческого ДнаЗ быстро выводится из сыворотки крови. Исследование введения в человека свидетельствуют, что период полувыведения из сыворотки крови составляет 3-4 часа.
Исследования на крысах показывают, что после введения аэрозоля период полувыведения дорназы альфа с легких составляет 11:00. Уровень ДнаЗ в мокроте снижается ниже половины уровня, который наблюдается сразу же после введения, в течение 2:00, однако влияние на реологические свойства мокроты сохраняется в течение 12:00.
Дети.
Препарат Пульмозим ® применяли в дозе 2,5 мг ингаляционно 1 раз в сутки в течение 2 недель в 98 детей в возрасте от 3 месяцев до 9 лет (65 детей в возрасте от 3 месяцев до <5 лет, 33 детей в возрасте от 5 до 9 лет). В течение 90 минут после применения первой дозы была получена жидкость при бронхоальвеолярном лаваже. Небулайзер многократного применения Pari Baby (в котором используется маска для ингаляции вместо наконечника) применяли у пациентов, которые не смогли продемонстрировать способность вдыхать или выдыхать через рот в течение всего периода лечения (54/65 (83%) пациентов младшего возраста и 2/33 (6 %) пациентов старшего возраста). Концентрации ДнаЗ с широким диапазоном колебаний (от 0,007 до 1,8 мкг / мл) были обнаружены у всех детей в жидкости, полученной при бронхоальвеолярном лаваже. В среднем через 14 дней ингаляций концентрации ДнаЗ (средние ± стандартные отклонения) в сыворотке крови увеличились на 1,1 ± 1,6 нг / мл в группе детей в возрасте от 3 месяцев до <5 лет и на 0,8 ± 1,2 нг / мл в группе детей в возрасте от 5 до 9 лет. Частота возникновения лихорадки была выше у детей младшей возрастной группы по сравнению с детьми старшей возрастной группы (41% и 24% соответственно). Лихорадка является известным осложнением бронхоскопии.
Терапия пациентов в возрасте от 5 лет с муковисцидозом с показателем форсированной жизненной емкости легких (ФЖЕЛ) более 40% от прогнозируемой с целью улучшения функции легких.
Повышенная чувствительность к дорназы альфа или к любому из компонентов препарата.
Препарат Пульмозим ® можно эффективно и безопасно применять в сочетании со стандартными препаратами для лечения муковисцидоза, такими как антибиотики, бронхолитики, ферменты поджелудочной железы, витамины, ингаляционные и системные кортикостероиды и анальгетики.
Для обеспечения улучшения отслеживания препарата Пульмозим ® , торговое название и номер серии введенной дорназы альфа должны быть четко указаны в медицинской карте (документации) пациента.
Применение в период беременности или кормления грудью.
беременность
Безопасность дорназы альфа для беременных женщин не установлена.
Исследования на животных свидетельствуют об отсутствии непосредственного или косвенного вредного влияния на беременность или эмбриофетальной развитие. Следует проявлять осторожность при назначении дорназы альфа беременным женщинам.
кормление грудью
При применении дорназы альфа согласно рекомендациям по дозировке наблюдается минимальная системная абсорбция препарата. В связи с этим ожидается обнаружение в грудном молоке у женщин измеряемых концентраций дорназы альфа. Однако следует проявлять осторожность при назначении дорназы альфа кормления грудью.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Препарат Пульмозим ® не имеет или оказывает незначительное влияние на способность управлять автомобилем и работать с механизмами.
2,5 мг дезоксирибонуклеазы (соответствует содержимого 1 ампулы — 2,5 мл неразбавленного раствора, 2500 ЕД) применяют ингаляционно 1 раз в сутки с помощью небулайзерной системы.
У некоторых пациентов в возрасте от 21 года лучшего эффекта лечения можно добиться при применении суточной дозы препарата 2 раза в сутки.
У большинства пациентов оптимальный эффект достигается при постоянном ежедневном применении Пульмозим ® . Исследование, в ходе которых препарат Пульмозим ® применяли в прерывистом режиме, показывают, что после прекращения терапии улучшение функции легких исчезает. Поэтому пациентам следует рекомендовать ежедневный прием препарата без перерыва.
Пациентам следует продолжать регулярное комплексное лечение, включая стандартную схему физиотерапии грудной клетки.
При обострении инфекции дыхательных путей применения препарата Пульмозим ® можно продолжать без всякого риска для пациентов.
Безопасность и эффективность применения препарата не установлены у пациентов с ФЖЕЛ менее 40% от прогнозируемой.
Инструкция по обращению с препаратом
Содержание одной ампулы препарата Пульмозим ® 2,5 мг (2500 ЕД) для однократного применения, представляет собой стерильный раствор для ингаляций, следует применять ингаляционно один раз в сутки, применяя небулайзер.
Препарат Пульмозим ® не следует смешивать с другими лекарственными средствами или растворами в небулайзере (см. Раздел «Несовместимость»).
- Содержание одной ампулы перелить в емкость джет-небулайзера / компрессора типа Pari TurboBOY N, составными частями которого являются небулайзер Pari LC Plus и компрессор Pari Turbo Boy N.
Пациенты, которые не могут дышать ртом в течение всего периода ингаляции через небулайзер, могут использовать небулайзер Pari JuniorBOY N, составными частями которого являются Pari LC Plus Junior, в том числе небулайзер Pari LC Plus, маску для лица Pari BABY, а также компрессор, удобный для применения детям.
- Препарат Пульмозим ® можно применять вместе со струйным небулайзером / компрессорной системой, например, Hudson T Up-draft II / Pulmo-Aide, Airlife Misty / Pulmo-Aide, индивидуальным Respirgard / Pulmo-Aide, или AcornII / Pulmo-Aide.
- Препарат Пульмозим ® можно применять вместе с многократным струйным небулайзером / компрессорной системой, например, Pari LL / Inhalierboy, Pari LC / Inhalierboy или Master, Aiolos / 2 Aiolos, Side Stream / CR50 или MobilAire или Porta-Neb.
- Можно применять электронный вибрирующий мембранный небулайзер общего назначения Pari eFlow Rapid. Было продемонстрировано соответствие между электронным небулайзером eFlow Rapid и струйным небулайзером LC Plus in vitro и in vivo . Среднее распределение по размерам капель аэрозоля небулайзера eFlow Rapid является сопоставимым с таким струйного небулайзера LC Plus, что показано ниже, при применении профиля симуляции дыхания у взрослых. Масс-медианный аэродинамический диаметр (MMAD) составлял 4,8 ± 0,4 мкм (n = 16) для eFlow Rapid и 4,6 ± 0,4 мкм (n = 12) для LC Plus. Геометрическое стандартное отклонение (GSD) составило 1,80 ± 0,11 для eFlow Rapid и 2,14 ± 0,04 для LC Plus. Скорость доставки лекарственного средства составляла 380 ± 60 мкг / мин (n = 88) для eFlow Rapid и 93 ± 16 мкг / мин (n = 40) для LC Plus. Общее количество доставленного лекарственного средства составляла 567 ± 62 мкг для eFlow Rapid и 570 ± 80 мкг для LC Plus. Небулайзер Pari eFlow Rapid следует применять со средствами для очистки Pari EasyCare, и очистки следует выполнять каждый седьмой цикл распыления (цикл определен как распыления одной ампулы препарата Пульмозим ® с последующей очисткой и дезинфекцией в соответствии с инструкциями для применения небулайзерной системы PARI eFlow Rapid). Применение небулайзера eFlow Rapid без средств для очистки EasyCare может привести к снижению и вариабельности доставки дозы.
- Ультразвуковые небулайзеры могут быть непригодными для введения препарата Пульмозим ® , поскольку они могут инактивировать препарат Пульмозим ® или иметь недопустимы характеристики доставки аэрозоля.
Следует соблюдать инструкции компании-производителя по эксплуатации и уходу за небулайзером и компрессором.
Дети.
Безопасность и эффективность у пациентов в возрасте до 5 лет не установлены.
Симптомы передозировки препаратом Пульмозим ® не установлены.
Во время клинических исследований больные муковисцидозом получали ингаляционно до 20 мг Пульмозим ® 2 раза в сутки (доза в 16 раз превышает рекомендуемую суточную дозу) в течение 6 дней и по 10 мг 2 раза в сутки (доза в 8 раз превышает рекомендованную суточную дозу) по прерывистой схеме (двухнедельный прием, двухнедельный перерыв) в течение 168 дней. 6 взрослых пациентов без муковисцидоза получили единовременно Дорназа альфа внутривенно в дозе 125 мкг / кг с последующим введением дорназы альфа подкожно в дозе 125 мкг / кг через 7 дней в течение двух последовательных 5-дневных периодов. При этом нейтрализующие антитела к дорназы альфа и любые изменения в антителам к двуспиральной ДНК в сыворотке крови не были обнаружены. Все указанные дозы переносились хорошо.
Системная токсичность препарата Пульмозим ® не отмечено, ее возникновение не ожидается из-за незначительного всасывания и короткий период полувыведения дорназы альфа. В связи с этим необходимость системного лечения передозировки маловероятна (см. Раздел «Фармакокинетика»).
Нежелательные явления, указанные ниже, наблюдались в ходе клинических исследований и в послерегистрационный период при применении препарата Пульмозим ® согласно рекомендованной схеме дозирования.
Побочные реакции при лечении препаратом Пульмозим ® возникают редко (<1/1000), в большинстве случаев они легкой степени тяжести, носят преходящий характер и не требуют коррекции дозы.
Со стороны органов зрения : конъюнктивит.
Со стороны дыхательной системы, органов грудной клетки и средостения: дисфония, одышка, фарингит, ларингит, ринит (неинфекционной этиологии).
Со стороны желудочно-кишечного тракта : диспепсия.
Со стороны кожи и подкожной клетчатки : сыпь, крапивница.
Общие расстройства: боли в грудной клетке (плевральные / некардиальных), лихорадка.
Исследование : снижение показателей функции дыхания.
Пациенты, у которых возникают нежелательные явления, совпадающие с симптомами муковисцидоза, могут, как правило, безопасно продолжать применение препарата Пульмозим ® , что подтверждается высоким процентом пациентов, завершивших участие в клинических исследованиях препарата Пульмозим ® .
В клинических исследованиях побочные явления, которые привели к полному прекращению лечения Дорназа альфа, наблюдались у очень небольшого числа больных, а частота прерывания терапии была подобной при применении плацебо (2%) и дорназы альфа (3%).
После начала терапии Дорназа альфа, как и любым аэрозолем, функция легких может несколько уменьшиться, а отхождение мокроты — увеличиться.
Антитела к дорназы альфа обнаружены меньше чем у 5% больных, однако у одного из этих пациентов не принадлежали к классу IgE. Улучшение показателей функции легких отмечалось даже после появления антител к дорназы альфа.
Хранить в недоступном для детей месте. Хранить в защищенном от света месте при температуре от 2 до 8 ° С. Одноразовая кратковременная действие повышенных температур (в течение ≤ 24 часов до 30 ° С) не влияет на стабильность препарата.
Препарат Пульмозим ® представляет собой водный раствор без буферных свойств, и его не следует разводить или смешивать с другими препаратами или растворами в емкости небулайзера. Смешивания этого раствора может привести к нежелательным структурных и / или функциональных изменений препарата Пульмозим ® или иного компонента смеси.
По 2,5 мл препарата в бесцветных пластиковых ампулах, произведенных методом термоштампування. 6 ампул в защитном контейнере с алюминиевой многослойной фольги.
1 контейнер в картонной упаковке.