Химическое название
(+)-(S)-N-Метил-3-(1-нафтилокси)-3-(тиофен-2-ил )пропан-1-амин
Химические свойства
Дулоксетин относят к антидепрессантам из группы селективных ингибиторов обратного захвата норадреналина и серотонина.
Молекулярная масса химического соединения = 297,4 грамма на моль.
Выпускается в капсулах и таблетках, дозировкой 30 и 60 мг.
Чаще всего находится в препаратах в виде гидрохлорида.
Фармакологическое действие
Антидепрессивное.
Фармакодинамика и фармакокинетика
Средство предотвращает обратный захват серотонина и норадреналина, частично – дофамина. Благодаря чему, эти нейромедиаторы накапливаются, и повышается их трансмиссия в центральной нервной системе. Вещество подавляет болевой синдром, повышает порог болевой чувствительности при боли, развившейся вследствие невропатии.
Средство быстро всасывается после приема внутрь. Максимальная концентрация вещества в крови достигается в течение двух часов. Параллельный прием пищи удлиняет время достижения максимальной концентрации до 10 часов. Более 90% лекарства связывается с белками плазмы, альбумином и гликопротеином. У пациентов с заболеваниями почек и печени степень связывания с белками плазмы не изменяется.
Дулоксетин подвергается метаболизму, метаболиты не активны. Глюкуроновый конъюгат 4-гидроксидулоксетина и сульфат конъюгат 5-гидрокси-6-метоксидулоксетина выводятся с помощью почек. Метаболизм протекает с участием CYP1A2 и CYP2D6. Период полувыведения лекарства примерно 11-12 часов.
У женщин выведение метаболитов и метаболизм средства протекает медленнее, чем у мужчин. Также у пациентов среднего и пожилого возраста увеличивается площадь под кривой «время-концентрация» и время выведения вещества из организма. Однако, коррекция дозировки не проводится. Печеночная недостаточность приводит к замедлению клиренса лекарства. На терминальной стадии почечной недостаточности, максимальная концентрация повышается вдвое.
Показания к применению
Лекарство назначают при депрессии, для лечения болевой формы диабетической нейропатии.
Противопоказания
Дулоксетин не назначают:
- при некомпенсированной закрытоугольной глаукоме;
- в сочетании с ингибиторами МАО, ингибиторами CYP1A2;
- при аллергии на данное вещество;
- пациентам с выраженной печеночной недостаточностью;
- при тяжелой почечной недостаточности, пациентам на гемодиализе;
- больным с неконтролируемой артериальной гипертензией;
- в период грудного вскармливания;
- детям до 18 лет.
Побочные действия
Во время лечения данным антидепрессантом часто развиваются:
- головные боли, тремор, сонливость, головокружение, парестезии, бессонница, яркие сновидения, ажитация;
- тревожность, заторможенность, тошнота;
- диарея, рвота, сухость во рту, запоры, несварение желудка;
- повышенное газообразование, боли в области эпигастрия;
- снижение сексуального влечения, отсутствие эрекции, аноргазмия;
- приливы, ощущение сердцебиения, шум в ушах, снижение остроты зрения, зевота;
- мышечные спазмы, скованность, боли в мышцах и костях, аллергические высыпания, потливость, особенно по ночам;
- отсутствие аппетита, похудание, усталость.
Реже могут возникнуть следующие побочные действия:
- нервозность, неспособность сконцентрироваться, дискинезия, апатия, бруксизм;
- стоматит, отрыжка, гепатит, повышение активности ферментов печени;
- анурия, дизурия, никтурия, полиурия, проблемы с мочеиспусканием, снижение сексуальной функции и влечения;
- гастроэнтерит, гастрит, искажение вкуса, реакции повышенной чувствительности;
- обмороки, тахикардия, снижение или повышение артериального давления, холодные руки и пальцы ног;
- мидриаз, болезненные ощущения в ушах, вертиго, кровь из носа, чувство давления в глотке;
- повышенная чувствительность к свету, подкожные кровоизлияния, крапивница, контактный дерматит, холодный липкий пот, непроизвольные подергивания мышцами;
- гипергликемия (при сахарном диабете), ларингит, увеличение веса, нестойкость походки, жажда, озноб, рост уровня креатинфосфокиназы.
Редко возникают:
- агрессивное поведение, мании, гнев, судороги, психомоторное возбуждение;
- серотониновый синдром, попытки покончить с жизнью, мысли о самоубийстве, галлюцинации;
- неприятный запах изо рта, примесь крови в кале, желтуха, печеночная недостаточность, изменение запаха мочи и симптомы менопаузы, гипертонический криз;
- фибрилляция предсердий, наджелудочковая аритмия;
- мидриаз, глаукома, тризм, дегидратация;
- гипонатриемия, гиперхолестеринемия, боли в грудине, анафилактоидные реакции.
При резком прекращении приема вещества возникает синдром отмены: головокружение, парестезия, бессонница, яркие сновидения, тревожность, рвота, тремор, повышенная раздражительность, вертиго и потливость.
Дулоксетин, инструкция по применению (Способ и дозировка)
Лечение начинают с дозировки 60 мг, принимают ее один раз в день. Затем можно постепенно увеличивать дозировку до 0,12 г в сутки (принимают два раза в день).
При тяжелой почечной недостаточности нельзя принимать более 30 мг вещества в день. При печеночной недостаточности начальную дозировку снижают и сокращают кратность приема.
Передозировка
При передозировке пациента рвет, снижается аппетит, возникают клонические судороги и тремор, атаксия.
Лечение направлено на поддержание жизненно важных функций, симптоматическое. Рекомендуется контролировать работу сердца. Антидота нет.
Зарегистрировано несколько случаев приема 1,4 грамма антидепрессанта без фатальных последствий.
Взаимодействие
При сочетании Дулоксетина с теофилином фармакокинетика последнего препарата значительно не изменяется.
Применение вещества с ингибиторами CYP1A2 может привести к росту плазменной концентрации лекарства. Например, флувоксамин снижает интенсивность плазменного клиренса приблизительно на 75%. Рекомендуется с осторожностью сочетать лекарство с дезипрамином, толтеродином и прочими средствами, в метаболизме которых принимает участие CYP2D6.
Потенциальные ингибиторы CYP2D6 могут вызвать рост концентрации Дулоксетина.
С особой осторожностью сочетают данное лекарственное средство с другими антидепрессантами, в частности Пароксетином. Снижается его клиренс.
Сочетанный прием средства с бензодиазепинами, Фенобарбиталом, антипсихотическими средствами и антигистаминными ЛС, с этанолом не рекомендуется.
С осторожностью сочетают препарат с препаратами, у которых высокая степень связывания с белками плазмы.
Крайне не рекомендуется принимать данное средство совместно с селективными ингибиторами МАО, даже с обратимыми ингибиторами МАО, моклобемидом. Это может привести к развитию гипертермии, миоклонуса, мышечной ригидности, резким колебаниям жизненно важных показателей, коме, вплоть до летального исхода.
Сочетанный прием лекарства с антикоагулянтами и антитромбоцитарными ЛС приводит к развитию кровотечений. При сочетании с Варфарином может повыситься МНО.
Редко развивается серотониновый синдром при применении других СИОЗС в сочетании с лекарством. Необходимо соблюдать осторожность при лечении трициклическими антидепрессантами, Амитриптилином, кломипрамином, Венлафаксином, зверобоем, триптанамом, петидином, Трамадолом и Триптофаном.
Условия продажи
Необходимо иметь рецепт от врача.
Условия хранения
Температурный режим от 15 до 30 градусов. Хранят лекарство в недоступном для детей месте.
Срок годности
Препараты Дулоксетина хранят в течение 3 лет.
Особые указания
Не рекомендуется превышать суточную дозировку 0,12 грамм.
Необходима коррекция дозировки во время лечения пациентов с ХПН и печеночной недостаточностью.
Отмена препарата проводится постепенно, существует высокий риск развития синдрома отмены.
После приема лекарства не происходит нарушения психомоторных реакций, памяти и других когнитивных функций, однако часто возникает сонливость. Поэтому водить автомобиль и выполнять потенциально опасные виды деятельность не рекомендуется.
С алкоголем
Лекарство лучше не сочетать с алкоголем.
Препараты, в которых содержится (Аналоги)
Совпадения по коду АТХ 4-го уровня:
Аналоги Дулоксетина: Дулоксетин Канон, Симбалта, таблетки Дулоксетин.
Отзывы о Дулоксетине
Несмотря на достаточно лестные отзывы врачей об этом препарате, у пациентов мнение о нем зачастую противоположное. Многие пишут, что средство плохо переносится, развиваются серьезные побочные эффекты, синдром отмены сильный при прерывании лечения, эффект наступает медленно, иногда через несколько месяцев приема.
Некоторые отзывы о препаратах Дулоксетина:
- “… Это последнее поколение антидепрессантов, лекарство обладает двойным действием, хорошо помогает пациентам с неврологическими заболеваниями, депрессией, болевым синдромом, у него очень широкая сфера клинического применения. Больные, которым я его назначал довольны”;
- “… Пью лекарство уже почти год, с побочками мне повезло – их нет. Правда недавно пыталась его резко бросить принимать, был синдром отмены. Сейчас снова начала, мне подходит”;
- “… Сильно похудела от этого средства, вялая, голова болит постоянно. Все лечусь, лечусь, а толку нет, не знаю, как дальше с этим жить”.
Цена Дулоксетина, где купить
Цена Дулоксетина в составе капсул Симбалта, дозировкой 30 мг составляет приблизительно 1800 рублей за 14 таблеток. Купить Дулоксетин 20 мг, 60 таблеток можно за 3100 рублей.
Дупиксент — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-005440
Торговое наименование препарата:
Дупиксент®.
Международное непатентованное наименование:
дупилумаб.
Лекарственная форма:
раствор для подкожного введения.
Состав
| Ингредиент | Количество (дозировка 50 мг/мл) | Количество (дозировка 175 мг/мл) | ||
| в 1 мл | в шприцеa | в 1 мл | в шприцеb | |
| Действующее вещество | ||||
| Дупилумаб | 150 мг | 300 мг | 175 мг | 200 мг |
| Вспомогательные вещества | ||||
| L-гистидин | 3,1 мгc | 6,2 мгc | 3,1 мгc | 3,54 мгc |
| L-гистидина гидрохлорида моногидрат | ||||
| L-аргинина гидрохлорид | 4,35 мгd | 8,7 мгd | 10,51 мгe | 12,01 мгe |
| Натрия ацетата тригидрат | 0,75 мгf | 1,5 мгf | 0,75 мгf | 0,86 мгf |
| Уксусная кислота ледяная | ||||
| Сахароза | 50 мгg | 100 мг | 49,88 мгg | 57,00 мг |
| Полисорбат-80 | 2 мгi | 4 мг | 2 мгi | 2,28 мг |
| Вода для инъекций | до 1,0 мл | до 2,0 мл | до 1,0 мл | до 1,14 мл |
a) В расчете на 2,0 мл препарата.
b) В расчете на 1,14 мл препарата.
c) Содержание L-гистидина и L-гистидина гидрохлорида приведено в пересчете на L-гистидин (М=155,16 г/моль), исходя из общей концентрации гистидина в препарате 20 мМ.
d) Содержание L-аргинина гидрохлорида приведено в пересчете на L-аргинин (М=174,20 г/моль), исходя из молярной концентрации L-аргинина в препарате 25 мМ. Номинальное содержание L-аргинина гидрохлорида (М=210,66 г/моль) в одном шприце составляет 10,5 мг.
e) Содержание L-аргинина гидрохлорида приведено в пересчете на L-аргинин (М= 174,20 г/моль), исходя из молярной концентрации L-аргинина в препарате 50 мМ. Номинальное содержание L-аргинина гидрохлорида (М=210,66 г/моль) для дозировки 175 мг/мл составляет 9,93 мг.
f) Содержание натрия ацетата тригидрата и уксусной кислоты ледяной приведено, исходя из общей концентрации ацетат иона в препарате 12,5 мМ.
g) Содержание сахарозы приведено в пересчете на миллиграммы, исходя из масса-объемной концентрации сахарозы в препарате 5%.
h) Содержание полисорбата-80 приведено в пересчете на миллиграммы, исходя из масса-объемной концентрации полисорбата-80 в препарате 0,2%.
Описание
Прозрачная или слегка опалесцирующая, бесцветная или желтоватого цвета жидкость.
Фармакотерапевтическая группа:
ингибиторы интерлейкина.
Код ATX:
D11AH05.
Фармакологические свойства
Механизм действия
Препарат Дупиксент® является рекомбинантным человеческим моноклональным антителом (IgG4), которое блокирует передачу сигналов интерлейкина-4 (ИЛ-4) и интерлейкина-13 (ИЛ-13) путем специфического связывания с 1L-4Rа-субъединицей, общей для рецепторных комплексов ИЛ-4 и ИЛ-13. Препарат Дупиксент® блокирует передачу сигналов ИЛ-4 через рецепторы I типа (IL-4Rα/γc) и общую передачу сигналов ИЛ-4 и ИЛ-13 через рецепторы II типа (IL-4Rα/IL-13Ra). ИЛ-4 и ИЛ-13 являются ключевыми цитокинами воспаления 2-го типа (в том числе продуцируемые и Th2-лимфоцитами), вовлеченными в патогенез атопических заболеваний.
Воспаление 2-го типа играет важную роль в патогенезе многих атонических заболеваний, включая бронхиальную астму, способствует ограничению воздушного потока и увеличивает риск обострений. ИЛ-4 и ИЛ-13 выступают в качестве основных факторов воспаления 2-го типа, активируя множественные типы клеток (например, тучные клетки, лимфоциты, эозинофилы, нейтрофилы, макрофаги) и индуцируя множественные медиаторы (например, иммуноглобулин Е, гистамин, эйкозаноиды, лейкотриены, хемокины и цитокины, включая эотаксин/CCL11, TARC/CCL17 и ИЛ-5), участвующие в воспалении 2-го типа. Блокирование пути передачи сигналов ИЛ-4/ИЛ-13 дупилумабом у пациентов снижает концентрации многих из этих маркеров воспаления 2-го типа, включая иммуноглобулин Е, периостин и множественные провоспалительные цитокины и хемокины (например, эотаксин, TARC), а также снижает уровень фракции оксида азота в выдыхаемом воздухе (FeNO) – маркер воспаления в легких. Было показано, что блокирование пути передачи сигналов ИЛ-4/ИЛ-13 дупилумабом в гуманизированных моделях животных предотвращает последующие действия этих цитокинов и хемокинов, в том числе гиперплазию бокаловидных клеток, гиперреактивность гладкомышечных клеток дыхательных путей, эозинофильное воспаление в легких, другие воспалительные процессы в легких, а также предотвращает нарушение функции легких; при этом снижение выраженности эозинофильного воспаления в легких происходит независимо от нормального или повышенного уровня эозинофилов в крови.
Дупилумаб производится с помощью технологии рекомбинантной ДНК в суспензионной культуре клеток яичника китайского хомячка.
Дупилумаб имеет молекулярную массу приблизительно 147 кДа.
Фармакодинамика
Атопический дерматит
В клинических исследованиях лечение препаратом Дупиксент® приводило к снижению в сыворотке крови концентраций биомаркеров, связанных с цитокинами воспаления 2-го типа, таких как тимус ассоциированного регуляторного хемокина (TARC/CCL17), общего сывороточного иммуноглобулина Е и аллерген-специфического иммуноглобулина Е. Также наблюдалось снижение активности лактатдегидрогеназы (ЛДГ), биомаркера, связанного со степенью тяжести атопического дерматита и его активностью. Препарат Дупиксент® уже в начале 2-й недели лечения вызывал супрессию хемокина TARC по сравнению с плацебо, с тенденцией продолжения его снижения до максимальной и устойчивой супрессии к 12-й неделе лечения.
У пациентов, получавших препарат Дупиксент® в дозе 300 мг 1 раз в 2 недели и в дозе 300 мг 1 раз в неделю, общий сывороточный иммуноглобулин Е к 52-й неделе терапии снизился на -74,8% и -73,9% (медиана изменения по сравнению с исходным уровнем), соответственно, по сравнению с -0% в группе плацебо. Аналогичные тенденции наблюдались в отношении антиген-специфических иммуноглобулинов Е, в том числе энтеротоксина А, специфического для золотистого стафилококка (S. aureus), аллергенов трав и деревьев.
Бронхиальная астма
В соответствии с ингибированием передачи сигналов ИЛ-4 и ИЛ-13, лечение дупилумабом заметно уменьшало уровень FeNO и концентрации эотаксина-3, общего иммуноглобулина Е, аллерген-специфического иммуноглобулина Е, TARC и периостина у пациентов с бронхиальной астмой по сравнению с плацебо. Эти снижения уровней биомаркеров воспаления были сопоставимы для режимов дозирования 200 мг 1 раз в 2 недели и 300 мг 1 раз в 2 недели и были близки к максимальному подавлению через 2 недели лечения, за исключением иммуноглобулина Е, который уменьшался медленнее. Описанные эффекты были устойчивыми во время лечения.
Клиническая эффективность
Атонический дерматит
Эффективность и безопасность препарата Дупиксент® в монотерапии или в сочетании с топическими глюкокортикостероидами (ГКС) оценивали в трех основных рандомизированных, двойных слепых, плацебо-контролируемых исследованиях (SOLO 1, SOLO 2 и CHRONOS) с участием 2119 пациентов в возрасте 18 лет и старше со среднетяжелым и тяжелым течением атопического дерматита
16-недельные исследования монотерапии (SOLO 1 и SOLO 2)
Показателя общей оценки исследователя (IGA) 0 или 1 («чистая» или «почти чистая кожа») к 16-й неделе лечения в клиническом исследовании SOLO 1 достигли 37,9% пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в 2 недели, и 37,2% пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в неделю, против 10,3% пациентов в группе плацебо, а в исследовании SOLO 2 – 36,1% и 36,4% против 8,5%, пациентов, соответственно.
Улучшение не менее чем на 75% от исходного значения по индексу тяжести и площади экземы (EASI-75) к 16-й неделе лечения в исследовании SOLO 1 достигли 51,3% пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в 2 недели, и 52,5% пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в неделю, против 14,7% пациентов в группе плацебо, а в исследовании SOLO 2 – 44,2% и 48,1% против 11,9%, соответственно.
Не менее чем 4-бального уменьшения зуда по пиковым значениям числовой шкалы оценки выраженности зуда (NRS) к 16-й неделе лечения в исследовании SOLO 1 достигли 40,8% пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в 2 недели, и 40,3% пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в неделю, против 12,3% пациентов в группе плацебо, а в исследовании SOLO 2 – 36,0% и 39,0% пациентов против 9,5%, соответственно. Значительно больший процент пациентов, получавших Дупиксент®, достигал быстрого улучшения по шкале оценки тяжести зуда NRS по сравнению с пациентами в группе плацебо (определяемого как ≥4-балльное улучшение уже на 2-й неделе), причем процент пациентов, у которых наблюдалось уменьшение тяжести зуда по шкале NRS, продолжал увеличиваться в течение всего периода лечения.
Эффекты лечения в подгруппах (с распределением на подгруппы по массе тела, возрасту, полу, расе и сопутствующей терапии, в том числе с применением иммунодепрессантов) в исследованиях SOLO 1 и SOLO 2 в целом согласуются с результатами, полученными в общей исследуемой популяции.
52-недельное клиническое исследование с одновременным применением топических ГКС (CHRONOS)
IGA 0 или 1 к 16-й неделе лечения достигли 38,7% пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в 2 недели + топические ГКС, и 39,2% пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в неделю + топические ГКС, против 12,4% пациентов в группе плацебо, а к 52-й неделе – 36,0% и 40,0% против 12,5% пациентов, соответственно.
EASI-75 к 16-й неделе лечения достигли 68,9% пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в 2 недели + топические ГКС, и 63,9% пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в неделю + топические ГКС, против 23,2% пациентов в группе плацебо + топические ГКС, а к 52-й неделе – 65,2% и 64,1% против 21,6% пациентов, соответственно.
Не менее чем 4-бального улучшения по шкале тяжести зуда NRS к 16-й неделе лечения достигли 58,8% пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в 2 недели + топические ГКС, и 50,8% пациентов, получавших препарат Дупиксент® в дозе 300 мг 1 раз в неделю + топические ГКС, против 19,7% пациентов в группе плацебо + топические ГКС, а к 52-й неделе – 51,2% и 39,0% против 12,9% пациентов, соответственно. Более значительный процент пациентов, получавших препарат Дупиксент® + топические ГКС, достигал быстрого улучшения по шкале тяжести зуда NRS по сравнению с пациентами в группе плацебо + топические ГКС (определяемого как >4-балльное улучшение уже на 2-й неделе; р <0,05), причем доля пациентов, у которых наблюдалось уменьшение тяжести зуда по шкале NRS, продолжала увеличиваться в течение всего периода лечения.
Эффекты лечения в подгруппах (с распределением по массе тела, возрасту, полу, расе и сопутствующей терапии, в том числе с применением иммунодепрессантов) в исследовании CHRONOS в целом согласуются с результатами, полученными в общей исследуемой популяции.
Клиническая эффективность у пациентов, которым не рекомендовалось лечение циклоспорином
У пациентов, которым не рекомендовалось лечение циклоспорином или оно было неэффективно, монотерапия препаратом Дупиксент® в обеих группах лечения, приводила к значительному улучшению признаков и симптомов атопического дерматита по сравнению с плацебо. Больший процент пациентов, получавших Дупиксент®, по сравнению с группой плацебо достигал IGA 0 или 1 и снижения по сравнению с исходным значением на ≥2 балла к 16-й неделе (29,5% против 6,8%), EASI-75 к 16-й неделе (38% против 11,4%), а также снижения не менее чем на 4 балла индекса тяжести зуда от исходного значения к 16-й неделе (34,9% по сравнению с 8%) (р <0,001 для всех 3 конечных точек). Аналогичные результаты наблюдались у пациентов, получавших Дупиксент® одновременно с топическими ГКС. Эффективность комбинации препарата Дупиксент® + топические ГКС сохранялась до 52-й недели терапии.
Бронхиальная астма
Было проведено три рандомизированных, двойных слепых, плацебо-контролируемых, многоцентровых исследования в параллельных группах (DRI12544, QUEST и VENTURE) продолжительностью от 24 до 52 недель с участием 2888 пациентов (в возрасте 12 лет и старше). Во все три исследования пациенты были включены независимо от минимального исходного уровня эозинофилов или другого биомаркера воспаления 2-го типа (например, уровня FeNO или иммуноглобулина Е).
Обострения бронхиальной астмы
В исследованиях DRI12544, QUEST и VENTURE оценивали частоту тяжелых обострений астмы независимо от минимального количества эозинофилов или любых других биомаркеров воспаления 2-го типа (например, FeNO или иммуноглобулин Е) в начале исследования. В общей популяции, независимо от содержания эозинофилов и других биомаркеров воспаления 2-го типа, у пациентов, получавших 200 или 300 мг препарата Дупиксент® один раз в две недели, произошло значительное снижение частоты тяжелых обострений астмы по сравнению с группой плацебо. В исследованиях DRI12544 и QUEST частота тяжелых обострений при применении препарата Дупиксент® в дозе 200 мг 1 раз в 2 недели снижалась на 70% и 48%; а при применении в дозе 300 мг 1 раз в 2 недели – на 70% и 46%, соответственно; и на 59% в исследовании VENTURE.
В объединенном анализе исследований DRI12544 и QUEST частота тяжелых обострений, приводящих к госпитализации и/или посещениям отделений неотложной помощи, снизилась на 25,5% и 46,9% при применении препарата Дупиксент® в дозах 200 мг или 300 мг 1 раз в 2 недели, соответственно.
Кумулятивное среднее число тяжелых обострений было более низкое у пациентов, получавших препарат Дупиксент® по сравнению с плацебо в исследованиях DRI12544, QUEST и VENTURE (в общей популяции и в популяции с исходным числом эозинофилов ≥150 клеток/мкл или FeNO ≥25 ppb) в течение 24- или 52-недельного периода лечения в обеих группах режимов дозирования препарата.
В исследовании QUEST у пациентов, получавших ингаляционные глюкокортикостероиды (ИКС) в средней дозе, наблюдалось сходное снижение частоты тяжелых обострений астмы по сравнению с пациентами, получавшими ИКС в высокой дозе.
Функция легких
Клинически значимое увеличение предбронходилатационного значения объема форсированного выдоха за 1-ю секунду (ОФВ1) наблюдалось на 12-й неделе в общей популяции независимо от уровня эозинофилов или других биомаркеров воспаления 2-го типа (например, FeNO или иммуноглобулин Е). В исследованиях DRI12544, QUEST и VENTURE, по сравнению с плацебо, большее улучшение ОФВ1 наблюдалось также у пациентов с FeNO ≥25 ppb. Улучшение ОФВ1 было одинаковым, независимо от того, получали ли пациенты ИКС в средней дозе, ИКС в высокой дозе или пероральные глюкокортикостероиды (ОКС).
Значительные улучшения ОФВ1 наблюдались уже в течение второй недели (DRI12544, QUEST и VENTURE) после первой инъекции препарата Дупиксент® в дозе как 200 мг, так и 300 мг и сохранялись в течение 24 недель (DRI12544 и VENTURE) и 52 недель (QUEST).
Скорректированная средняя разность абсолютных значений ОФВ1 была 0,20 л и 0,14 л в группах, получавших Дупиксент® 200 мг 1 раз в 2 недели, по сравнению с плацебо; 0,16 и 0,13 л в группах, получавших 300 мг 1 раз в 2 недели по сравнениюс плацебо, соответственно в исследованиях DR112544 и QUEST. Соответствующее процентное изменение ОФВ1 составляло от 9,2 до 11,9% для дозы 200 мг 1 раз в 2 недели и от 9,4 до 11,7% для дозы 300 мг 1 раз в 2 недели. Скорректированная средняя разность абсолютных значений пре-бронходилатационного ОФВ1 от исходного уровня к 24-й неделе (достаточное время для достижения максимального снижения дозы пероральных глюкокортикостероидов) в исследовании VENTURE составила 0,22 л в группе применения препарата Дупиксент® по сравнению с плацебо, что соответствовало улучшению на 15,1% по сравнению с исходным уровнем.
Кроме того, у пациентов, получавших препарат Дупиксент®, значительно улучшился пост-бронходилатационный показатель ОФВ1 по сравнению с исходным уровнем на 12-й и 52-й неделях по сравнению с плацебо, что указывает на то, что препарат Дупиксент® улучшает фиксированную обструкцию дыхательных путей. В группе применения препарата Дупиксент® в течение года наблюдения не было зарегистрировано снижения функции легких с учетом значения пост-бронходилатационного значения ОФВ1.
Снижение дозы пероральных глюкокортикостероидов
В исследовании VENTURE оценивалось влияние препарата Дупиксент® на снижение применения поддерживающих пероральных глюкокортикостероидов. Исходная средняя доза пероральных кортикостероидов составляла 11,75 мг в группе плацебо и 10,75 мг в группе, получавшей препарат Дупиксент®. По сравнению с плацебо, у пациентов, получавших Дупиксент®, отмечалось большее снижение ежедневной дозы пероральных глюкокортикостероидов при сохранении контроля над астмой. Среднее общее снижение ежедневной дозы пероральных глюкокортикостероидов при сохранении контроля над астмой составляло 70,1% по сравнению с исходным уровнем у пациентов, получавших Дупиксент® и 41,9% в группе плацебо.
Исходы, сообщаемые пациентами
Кроме того, во всех 3-х исследованиях Дупиксент® обеспечил клинически значимое улучшение показателей контроля бронхиальной астмы в общей популяции по сравнению с группой плацебо, о чем свидетельствуют показатели ACQ-5 и соответствующее улучшение качества жизни, измеренное по шкале AQLQ(S). Улучшение показателей ACQ-5 и AQLQ(S) были зарегистрированы уже через 2 недели и это улучшение сохранялось на протяжении 24-х недель в исследовании DRI12544 и 52-х недель в исследовании QUEST. В общей популяции исследования QUEST доля пациентов, ответивших на лечение, что выражалось в достижении минимального клинически-значимого различия показателей ACQ-5 и AQLQ(S), была существенно выше к 52-й неделе в группе, получавшей обе дозы препарата Дупиксент®.
Фармакокинетика
Фармакокинетика дупилумаба аналогична у пациентов с атопическим дерматитом и бронхиальной астмой.
Абсорбция
После однократного подкожного введения 75-600 мг дупилумаба, медиана времени достижения максимальной концентрации в сыворотке крови (Тmax) составляла 3-7 дней. Абсолютная биодоступность дупилумаба после введения подкожной дозы сходна между пациентами с атопическим дерматитом и бронхиальной астмой и составляет 61-64% (установлена при популяционном фармакокинетическом анализе).
Введение однократной нагрузочной дозы в первый день приводит к быстрому достижению клинически эффективных концентраций в течение 2-х недель.
При схеме лечения 200 мг или 300 мг 1 раз в 2 недели, начиная с нагрузочной дозы 400 мг или 600 мг, равновесные концентрации дупилумаба обычно достигаются в среднем к 16-й неделе лечения. В состоянии достижения равновесных концентраций средняя остаточная концентрация перед введением следующей дозы составляла 39 мг/л при применении 200 мг 1 раз в 2 недели и 70-74 мг/л при применении 300 мг 1 раз в 2 недели.
При еженедельном подкожном введении 300 мг препарата Дупиксент®, начиная с нагрузочной дозы 600 мг, равновесные концентрации обычно достигаются в среднем после 13 недель лечения. В состоянии достижения равновесных концентраций средняя остаточная концентрация перед введением следующей дозы составляла 189 мг/л.
Линейность дозы
Из-за нелинейности клиренса системная экспозиция дупилумаба, определяемая по площади под фармакокинетической кривой «концентрация-время» (AUC), увеличивается быстрее, непропорционально увеличению дозы после однократного подкожного введения препарата в дозах от 75 мг до 600 мг.
Распределение
Объем распределения дупилумаба составляет приблизительно 4,6 л, что указывает на его распределение главным образом в сосудистой системе.
Метаболизм
Поскольку дупилумаб является белком, специальных исследований его метаболизма не проводилось. Предполагается, что дупилумаб расщепляется до низкомолекулярных пептидов и отдельных аминокислот.
Выведение
Выведение дупилумаба осуществляется параллельно линейными и нелинейными путями. При более высоких концентрациях выведение дупилумаба осуществляется главным образом через не насыщаемый протеолитический путь, в то время как при более низких концентрациях выведение препарата преимущественно осуществляется через нелинейное насыщаемое связывание с мишенью IL-4Rα.
После введения последней дозы в состоянии равновесной концентрации медиана времени до неопределяемых концентраций дупилумаба, составляет 9 недель при введении 200 мг 1 раз в 2 недели, 10-11 недель при введении 300 мг 1 раз в 2 недели и 13 недель при введении 300 мг 1 раз в неделю.
Особые группы пациентов
Пол
Пол пациента не влиял на фармакокинетические показатели препарата. Дупиксент®.
Возраст
Возраст пациента не влиял на фармакокинетические показатели препарата. Дупиксент®.
Пациенты пожилого возраста
По данным популяционного анализа фармакокинетических показателей возраст пациентов не влиял на эффективность и безопасность препарата Дупиксент®.
Пациенты детского возраста
Фармакокинетика дупилумаба у детей и подростков до 18 лет с атопическим дерматитом и у детей с бронхиальной астмой младше 12 лет не изучалась. Эффективность и профиль нежелательных реакций у подростков с бронхиальной астмой старше 12 лет были схожи с таковыми у взрослых.
Расовая принадлежность
Согласно результатам популяционного фармакокинетического анализа расовая принадлежность не влияла на фармакокинетические показатели препарата Дупиксент®.
Печеночная недостаточность
Дупилумаб представляет собой моноклональное антитело, поэтому не ожидается, что он подвергается значительной печеночной элиминации. Клинические исследования для оценки влияния печеночной недостаточности на фармакокинетику дупилумаба не проводились.
Почечная недостаточность
Дупилумаб представляет собой моноклональное антитело, поэтому не ожидается, что он подвергается значительной почечной элиминации. Клинические исследования для оценки влияния почечной недостаточности на фармакокинетику дупилумаба не проводились. Результаты популяционных фармакокинетических анализов показали, что нарушение функции почек легкой и средней степени тяжести существенным образом не влияет на системную экспозицию дупилумаба. Нет данных о применении дупилумаба у пациентов с тяжелой почечной недостаточностью.
Масса тела
Не требуется коррекции режима дозирования в зависимости от массы тела пациента.
Показания к применению
- Атопический дерматит среднетяжелого и тяжелого течения у взрослых пациентов при недостаточном ответе на терапию топическими лекарственными препаратами или в случае, когда такие препараты не рекомендованы к применению.
Препарат Дупиксент® может применяться в монотерапии или одновременно с топическими лекарственными препаратами. - В качестве дополнительной поддерживающей терапии бронхиальной астмы среднетяжелого и тяжелого течения у пациентов в возрасте 12 лет и старше с эозинофильным фенотипом или у пациентов с гормональнозависимой бронхиальной астмой, получающих пероральные глюкокортикостероиды.
- В качестве дополнительной поддерживающей терапии взрослых пациентов с плохо контролируемым тяжелым хроническим полипозным риносинуситом (ХПРС)
Противопоказания
Повышенная чувствительность к дупилумабу или любому из вспомогательных веществ препарата (см. раздел «Особые указания).
Детский возраст до 18 лет у пациентов с атопическим дерматитом среднетяжелого и тяжелого течения в связи с неустановленными эффективностью и безопасностью.
Детский возраст до 12 лет у пациентов с бронхиальной астмой среднетяжелого и тяжелого течения в связи с неустановленными эффективностью и безопасностью.
С осторожностью
При беременности (только если ожидаемая польза превышает потенциальный риск для плода).
Применение при беременности и в период грудного вскармливания
Беременность
Имеются лишь ограниченные данные по применению дупилумаба у беременных женщин. В исследованиях, проведенных на животных, прямых и косвенных неблагоприятных эффектов в отношении репродуктивной токсичности не обнаружено. Препарат Дупиксент® можно применять во время беременности только в том случае, если ожидаемая польза для матери превышает потенциальный риск для плода.
Период грудного вскармливания
Неизвестно, экскретируется ли дупилумаб в грудное молоко человека. Следует, с учетом пользы грудного вскармливания для ребенка и преимущества дальнейшего применения препарата для матери, принять решение о прекращении кормления грудью или отмене препарата Дупиксент® в течение периода грудного вскармливания.
Способ применения и дозы
Общие рекомендации
Препарат Дупиксент® вводится подкожно.
Атопический дерматит
• Рекомендуемая доза препарата Дупиксент® у взрослых пациентов: начальная доза – 600 мг (2 инъекции по 300 мг), далее – по 300 мг каждые 2 недели. В зависимости от индивидуального терапевтического ответа доза может быть увеличена до 300 мг еженедельно.
Бронхиальная астма
Рекомендуемая доза препарата Дупиксент® у взрослых пациентов и детей (12 лет и старше):
• начальная доза – 400 мг (2 инъекции по 200 мг), далее – по 200 мг каждые 2 недели. В зависимости от индивидуального терапевтического ответа доза может быть увеличена до 300 мг каждые 2 недели.
• начальная доза – 600 мг (2 инъекции по 300 мг), далее – по 300 мг каждые 2 недели для пациентов с глюкокортикостероидозависимой бронхиальной астмой или с сопутствующим среднетяжелым или тяжелым атопическим дерматитом, при котором показано применение препарата Дупиксент®.
В случае пропуска дозы пациент должен получить инъекцию как можно скорее и затем продолжить лечение в соответствии с назначенным ему режимом введения препарата.
Особые группы пациентов
Дети
Безопасность и эффективность препарата Дупиксент® у детей и подростков до 18 лет с атопическим дерматитом не установлена.
Безопасность и эффективность препарата Дупиксент® у детей в возрасте до 12 лет с бронхиальной астмой не установлена.
Пациенты пожилого возраста
У пациентов пожилого возраста коррекции дозы не требуется (см. раздел «Фармакокинетика»).
Печеночная недостаточность
Отсутствуют данные по применению препарата у пациентов с печеночной недостаточностью (см. раздел «Фармакокинетика»).
Почечная недостаточность
У пациентов с легкой или средней степенью тяжести почечной недостаточности коррекции дозы не требуется. Отсутствуют данные по применению препарата у пациентов с тяжелой почечной недостаточностью (см. раздел «Фармакокинетика»).
Масса тела
Не требуется коррекции режима дозирования в зависимости от массы тела пациента (см. раздел «Фармакокинетика»).
Способ применения
Перед введением препарата следует осмотреть его на предмет наличия в растворе твердых частиц или появления нехарактерной окраски раствора. Если в препарате содержатся твердые частицы или у раствора появилась нехарактерная окраска, вводить препарат нельзя.
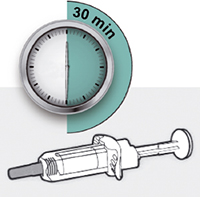
Раствор в предварительно заполненном шприце с системой защиты или предварительно заполненном шприце перед проведением инъекции препарата Дупиксент® должен нагреться до комнатной температуры. Для этого рекомендуется выдержать его при комнатной температуре в течение 45 мин (для дозировки 300 мг) или 30 мин (для дозировки 200 мг).
В случае необходимости предварительно заполненный шприц можно хранить при комнатной температуре (до 25 °С) в течение максимум 14 дней. Препарат нельзя хранить при температуре выше 25 °С. После извлечения из холодильника Дупиксент® должен быть использован в течение 14 дней или утилизирован.
Шприцы следует защищать от нагревания и воздействия прямого солнечного света.
Если начальная доза составляет 600 мг, следует сделать две инъекции по 300 мг в разные места для инъекций.
Если начальная доза составляет 400 мг, следует сделать две инъекции по 200 мг в разные места для инъекций.
Лечение препаратом Дупиксент® следует проводить под медицинским наблюдением. Инъекцию препарата может делать себе либо сам пациент, либо лицо, ухаживающее за ним.
Необходимо до начала применения препарата Дупиксент® обучить пациентов и/или ухаживающих за ними лиц подготовке и проведению инъекции препарата Дупиксент®, согласно указаниям в «Инструкции по подготовке и проведению инъекции препарата Дупиксент®, 300 мг в предварительно заполненном одноразовом шприце с системой защиты», «Инструкции по подготовкеи проведению инъекции препарата Дупиксент®, 300 мг в предварительно заполненном одноразовом шприце» и «Инструкции по подготовке и проведению инъекции препарата Дупиксент®, 200 мг в предварительно заполненном одноразовом шприце с системой защиты».
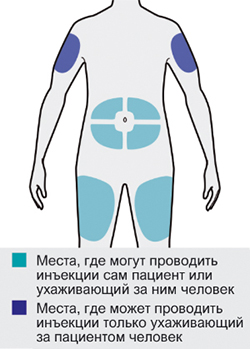
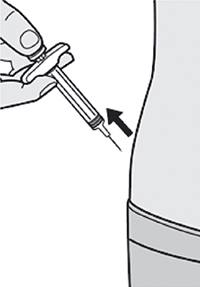
Препарат Дупиксент® может вводиться самим пациентом подкожно с помощью предварительно заполненного одноразового шприца в область бедра или живота, за исключением области диаметром 5 см непосредственно вокруг пупка. Если инъекцию проводит другой человек, препарат также можно вводить в верхнюю часть плеча.
Рекомендуется менять места инъекций при каждом введении препарата.
Инъекцию препарата Дупиксент® не следует проводить в участки с болезненной и поврежденной кожей, в места с кровоподтеками или рубцами.
Все остатки неиспользованного препарата и расходные материалы должны утилизироваться в соответствии с требованиями местного законодательства.
Побочное действие
Атопический дерматит
Для описания частоты встречаемости нежелательных реакций используется следующая классификация: очень часто ≥10%; часто ≥1% и <10%; нечасто ≥0,1% и <1%; редко ≥0,01% и <0,1%; очень редко <0,01%; частота неизвестна (невозможно определить по имеющимся данным частоту встречаемости нежелательной реакции).
Табл. 1. Нежелательные реакции, наблюдавшиеся в клинических исследованиях у пациентов с атопическим дерматитомa
| Системно-органный класс | Частота | Нежелательные реакции |
| Инфекционные и паразитарные заболевания | Часто | Конъюнктивит (4,0%) |
| Герпес ротовой полости (3,8%) | ||
| Бактериальный конъюнктивит (1,9%) | ||
| Простой герпес (Herpes simplex)b (1,7%) | ||
| Нарушения со стороны крови и лимфатической системы | Часто | Эозинофилия (1,7%) |
| Нарушения со стороны органа зрения | Часто | Аллергический конъюнктивит (7,0%) |
| Зуд в глазах (2,9%) | ||
| Блефарит (4,5%) | ||
| Синдром сухого глаза (1,8%) | ||
| Общие нарушения и нарушения в месте введения препарата | Очень часто | Реакции в месте инъекции (15,9%) |
a Объединенные данные плацебо-контролируемых клинических исследований с проведением монотерапии (SOLO 1, SOLO 2 и исследования по подбору доз 2 фазы) и плацебо-контролируемого исследования CHRONOS с одновременным применением топических ГКС для лечения атопического дерматита: пациенты получали препарат в дозе 300 мг 1 раз в 2 недели и 300 мг 1 раз в неделю с или без топических ГКС в течение 16 недель.
b В клинических исследованиях случаи с герпетическими инфекциями (Herpes simplex) проявлялись поражениями кожи и слизистых оболочек, обычно были легкой или средней степени тяжести и не включали герпетическую экзему. О случаях герпетической экземы сообщалось отдельно, частота таких случаев была ниже у пациентов, получавших препарат Дупиксент®, по сравнению с группой плацебо.
Профиль безопасности комбинированного лечения препаратом Дупиксент® + топические ГКС в течение 52 недель соответствует профилю его безопасности, наблюдавшемуся к 16-й неделе.
Бронхиальная астма
Табл. 2. Нежелательные реакции, наблюдавшиеся в клинических исследованиях у пациентов с бронхиальной астмой
| Системно-органный класс | Частота | Нежелательные реакции |
| Общие нарушения и нарушения в месте введения препарата | Очень часто | Эритема в месте инъекции (14,6%) |
| Часто | Отек в месте инъекции (4,8%) | |
| Часто | Зуд в месте инъекции (4,7%) | |
| Очень редко | Анафилаксия (0,04%) |
Описание отдельных нежелательных реакций
Конъюнктивит
За время 52-недельного периода лечения в клиническом исследовании с одновременным применением топических ГКС (CHRONOS) конъюнктивит был зарегистрирован в 16% случаев в группе пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в 2 недели + топические ГКС (20 на 100 пациенто-лет), и в 9% случаев, в группе плацебо + топические ГКС (10 на 100 пациенто-лет). В клинических исследованиях у пациентов с бронхиальной астмой частота конъюнктивита была схожей в группах, получающих препарат Дупиксент® или плацебо.
Герпетическая экзема и Herpes zoster
В клинических исследованиях у пациентов с атопическим дерматитом частота герпетической экземы была схожей в группах, получающих препарат Дупиксент® и в группе плацебо. По данным 16-недельных исследований монотерапии, Herpes zoster был зарегистрирован в <0,1% случаев в группе, получающей Дупиксент® (<1 на 100 пациенто-лет) и <1% в группе плацебо (1 на 100 пациенто-лет). В 52-недельном клиническом исследовании с одновременным применением топических ГКС (CHRONOS) Herpes zoster был зарегистрирован в 1% случаев в группе, получающей Дупиксент® + топические ГКС (1 на 100 пациенто-лет) и в 2% в группе плацебо (2 на 100 пациенто-лет). В клинических исследованиях у пациентов с бронхиальной астмой частота Herpes zoster была схожей в группах, получающих препарат Дупиксент® или плацебо.
Гиперчувствительность
В клинических исследованиях при атопическом дерматите сообщалось об одном случае развития сывороточной болезни и одном случае реакции, подобной сывороточной болезни, после введения препарата Дупиксент® (оба нежелательных явления оценивались как серьезные). В исследовании при применении препарата при бронхиальной астме сообщалось об одном серьезном случае развития анафилаксии после введения препарата Дупиксент® (см. раздел «Особые указания»).
Эозинофилы
У пациентов, получавших препарат Дупиксент®, наблюдалось более высокое среднее начальное увеличение от исходного уровня эозинофилов по сравнению с пациентами, получавшими плацебо. Количество эозинофилов снижалось почти до базовых уровней во время исследования.
Частота эозинофилии, вызванной лечением (≥ 500 клеток/мкл), была сходной в группах пациентов, получавших препарат Дупиксент® и плацебо.
Эозинофилия, вызванная лечением (≥5000 клеток/мкл), была зарегистрирована менее чем у 2% пациентов, получавших препарат Дупиксент®, и менее чем у 0,5% пациентов, получавших плацебо.
Инфекции
В клинических исследованиях не наблюдалось увеличения общей частоты инфекций или серьезных инфекций во время лечения препаратом Дупиксент® по сравнению с плацебо. В 16-недельных клинических исследованиях, в которых проводилась монотерапия препаратом Дупиксент®, были зарегистрированы серьезные инфекции у 1,0% пациентов, получавших плацебо, и у 0,5% пациентов, получавших дупилумаб. В 52-недельном исследовании CHRONOS серьезные инфекции были зарегистрированы у 0,6% пациентов, получавших плацебо, и у 0,2% пациентов, получавших препарат Дупиксент®.
В клинических исследованиях у пациентов с бронхиальной астмой не наблюдалось увеличения общей частоты инфекций или серьезных инфекций во время лечения препаратом Дупиксент® по сравнению с плацебо. В 24-недельном клиническом исследовании были зарегистрированы серьезные инфекции у 1,0% пациентов, получавших дупилумаб, и у 1,1% пациентов, получавших плацебо. В 52-недельном исследовании QUEST серьезные инфекции были зарегистрированы у 1,3% пациентов, получавших дупилумаб, и у 1,4% пациентов, получавших плацебо.
Сердечно-сосудистые события
В 1-летнем плацебо контролируемом исследовании у пациентов с бронхиальной астмой (QUEST) сердечно-сосудистые тромбоэмболические события (сердечно-сосудистые смерти, нефатальные инфаркты миокарда и нефатальные инсульты) были зарегистрированы в 1 случае (0,2%) в группе пациентов, получавших Дупиксент® 200 мг 1 раз в 2 недели; в 4 случаях (0,6%) в группе пациентов, получавших Дупиксент® 300 мг 1 раз в 2 недели и в 2 случаях (0,3%) в группе плацебо. В 1-летнем плацебо контролируемом исследовании у пациентов с атопическим дерматитом (CHRONOS) сердечно-сосудистые тромбоэмболические события (сердечно-сосудистые смерти, нефатальные инфаркты миокарда и нефатальные инсульты) были зарегистрированы в 1 случае (0,9%) в группе пациентов, получавших Дупиксент® 300 мг 1 раз в 2 недели + топические ГКС; в 0 случаев (0,0%) в группе пациентов, Дупиксент® 300 мг 1 раз в неделю + топические ГКС и в 1 случае (0,3%) в группе плацебо + топические ГКС.
Иммуногенность
Как и все белковые лекарственные препараты, препарат Дупиксент® может вызывать аллергические реакции.
Примерно у 6% пациентов с атопическим дерматитом или бронхиальной астмой, которые получали препарат Дупиксент® в дозе 300 мг 1 раз в 2 недели в течение 52 недель, отмечалось образование антител против дупилумаба (АТ); приблизительно у 2% пациентов АТ стойко сохранялись и приблизительно 2% имели нейтрализующие антитела.
Примерно у 9% пациентов с бронхиальной астмой, которые получали препарат Дупиксент® в дозе 200 мг 1 раз в 2 недели в течение 52 недель, отмечалось образование антител против дупилумаба; приблизительно у 4% АТ стойко сохранялись и приблизительно 4% имели нейтрализующие антитела.
Приблизительно 5% пациентов в группах плацебо в 52-недельных исследованиях имели положительные антитела к препарату Дупиксент®; приблизительно у 2% АТ стойко сохранялись и приблизительно 1% имел нейтрализующие антитела.
Реакция образования антител обычно не влияла на системную экспозицию дупилумаба, безопасность или эффективность препарата. Менее чем у 0,4% пациентов были выявлены высокие титры антител к дупилумабу, ассоциирующиеся со снижением его системной экспозиции и эффективности. Кроме того, у одного пациента была обнаружена сывороточная болезнь, а у другого реакция, подобная сывороточной болезни (<0,1%), ассоциировавшиеся с высокими титрами антител (см. раздел «Особые указания»).
Наблюдаемая частота стойкого сохранения АТ и нейтрализующей активности в значительной степени зависят от чувствительности и специфичности используемого аналитического метода. Кроме того, наблюдаемая частота АТ-положительного статуса в анализе может зависеть от нескольких факторов, в том числе методики анализа, способа обработки проб, времени сбора проб, сопутствующих препаратов, а также статуса основного заболевания в каждом отдельном случае. По этим причинам сравнение частоты образования антител к дупилумабу с частотой выработки антител к другим препаратам может ввести в заблуждение.
Передозировка
В клинических исследованиях не было выявлено проблем, связанных с безопасностью, при однократном внутривенном введении доз до 12 мг/кг.
Специфического антидота при передозировке препаратом Дупиксент® не существует. В случае передозировки необходимо контролировать состояние пациента для своевременного выявления признаков и симптомов нежелательных явлений и незамедлительно назначать соответствующее симптоматическое лечение.
Взаимодействие с другими лекарственными средствами
Живые вакцины
Применение препарата Дупиксент® с живыми вакцинами не изучалось.
Во время лечения препаратом Дупиксент® не следует проводить вакцинацию живыми вакцинами.
Неживые (инактивированные) вакцины
Иммунные реакции на вакцинацию изучались в исследовании, в котором пациенты с атопическим дерматитом получали еженедельно препарат Дупиксент® в дозе 300 мг в течение 16 недель. После 12 недель терапии дупилумабом пациентов вакцинировали вакциной Tdap (Т-клеточно-зависимая, Adacel®) и менингококковой полисахаридной вакциной (Т-клеточно-независимая, Menomune®) и оценивали иммунные реакции по истечении 4 недель. У пациентов, получавших как дупилумаб, так и плацебо, реакции с образованием антител к противостолбнячной и менингококковой полисахаридной вакцинам были сходными. В этом исследовании не было обнаружено нежелательных взаимодействий между любой из этих неживых вакцин и дупилумабом.
Взаимодействие с субстратами изоферментов СУР450
В клиническом исследовании, проведенном у пациентов с атопическим дерматитом, оценивались эффекты дупилумаба на фармакокинетику субстратов изоферментов CYP. Данные, полученные в этом исследовании, не указывают на клинически значимое влияние дупилумаба на активность изоферментов CYP1A2, CYP3A, CYP2C19, CYP2D6 или CYP2C9.
Взаимодействие с другими лекарственными средствами для лечения бронхиальной астмы
Влияние дупилумаба на фармакокинетику одновременно назначаемых препаратов не ожидается. Данные, полученные на основании популяционного анализа, не указывают на влияние одновременно назначаемых препаратов на фармакокинетику дупилумаба у пациентов со среднетяжелым или тяжелым течением бронхиальной астмы.
Особые указания
Гиперчувствительность
При возникновении системной реакции гиперчувствительности лечение препаратом Дупиксент® должно быть немедленно прекращено, и начата соответствующая терапия. В клинических исследованиях при применении препарата Дупиксент® при атопическом дерматите сообщалось об одном случае развития реакции, подобной сывороточной болезни, и одном случае развития сывороточной болезни после введения препарата (обе нежелательные реакции расценивались как серьезные). В исследовании при применении препарата при бронхиальной астме сообщалось об одном случае развития анафилаксии после введения препарата Дупиксент® (см. раздел «Побочное действие»).
Конъюнктивит
Конъюнктивит чаще встречался у пациентов с атопическим дерматитом, получавших препарат Дупиксент®. Большинство пациентов с конъюнктивитом выздоровели или выздоравливали в течение периода лечения. Среди пациентов с бронхиальной астмой частота конъюнктивита была низкой и сходной в группах, получавших препарат Дупиксент® и плацебо. Пациенты должны сообщать о первом появлении или ухудшении симптомов со стороны глаз своему лечащему врачу.
Эозинофильные состояния
У пациентов с бронхиальной астмой может развиться серьезная системная эозинофилия, иногда в виде клинических признаков эозинофильной пневмонии или васкулита, соответствующих эозинофильному гранулематозу с полиангиитом, которые часто лечатся системными кортикостероидами. Эти события, как правило, но не всегда, могут быть связаны с сокращением приема пероральных кортикостероидов. Врачи должны быть внимательны к васкулитной сыпи, ухудшающимся легочным симптомам, сердечным осложнениям и/или нейропатии, возникающим у их пациентов с эозинофилией. Сообщалось о случаях эозинофильной пневмонии и васкулита, соответствующих эозинофильному гранулематозу с полиангиитом, при применении препарата Дупиксент® у взрослых пациентов, которые участвовали в клиническом исследовании препарата при бронхиальной астме. Связь между применением препарата Дупиксент® и этими состояниями не была установлена.
Симптомы обострения бронхиальной астмы или ухудшающееся состояние
Препарат Дупиксент® не следует назначать для лечения симптомов остро возникшего ухудшения или обострений астмы. Препарат Дупиксент® не применяется для лечения острого бронхоспазма или астматического статуса.
Снижение дозы глюкокортикостероидов
Не следует резко прерывать применение системных, местных или ингаляционных глюкокортикостероидов после начала терапии препаратом Дупиксент®. Сокращение дозы глюкокортикостероидов, при необходимости, должно быть постепенным и должно выполняться под непосредственным наблюдением врача. Уменьшение дозы глюкокортикостероидов может сопровождаться системными симптомами отмены и/или манифестацией состояний, которые ранее не проявлялись из-за системной терапии глюкокортикостероидами.
Гельминтозы (глистные инвазии)
Пациенты с обнаруженным гельминтозом не включались в клинические исследования. Неизвестно, может ли препарат Дупиксент® повлиять на иммунный ответ при гельминтозах. Необходимо провести лечение пациентов с имеющимся гельминтозом перед тем, как начинать лечение препаратом Дупиксент®. Если во время лечения препаратом Дупиксент® пациент заражается гельминтозом, а антигельминтные препараты оказываются неэффективными, следует прекратить лечение препаратом Дупиксент® до излечения паразитарного заболевания.
Сопутствующие атопические заболевания
Пациентам с атопическим дерматитом и с сопутствующей бронхиальной астмой следует рекомендовать не изменять своего лечения, не проконсультировавшись с лечащим врачом. Прекращая лечение препаратом Дупиксент®, следует принимать во внимание возможные эффекты на течение других атопических заболеваний.
Влияние на способность управлять транспортными средствами и механизмами
Препарат Дупиксент® не оказывает или оказывает незначительное влияние на способность управлять транспортными средствами и работать с другими механизмами.
Форма выпуска
Раствор для подкожного введения, 150 мг/мл, 175 мг/мл.
Для дозировки 150 мг/мл:
По 2,00 мл в одноразовый шприц/шприц с системой защиты из прозрачного стекла (тип I), снабженный несъемной иглой из нержавеющей стали, защищенной колпачком из мягкого эластомера с/без твердой крышкой(-и).
По 1 или 2 шприца/шприца с системой защиты с инструкцией по применению в картонную пачку с заклеенными клапанами.
Или
По 2 шприца/шприца с системой защиты в промежуточную картонную упаковку, по 3 промежуточных картонных упаковки с инструкцией по применению в картонную пачку с заклеенными клапанами.
На каждую картонную пачку нанесен анти контрафактный стикер.
Для дозировки 175 мг/мл:
По 1,14 мл в одноразовый шприц с системой защиты из прозрачного стекла (тип I), снабженный несъемной иглой из нержавеющей стали, защищенной колпачком из мягкого эластомера с/без твердой крышкой(-и).
По 1 или 2 шприца с системой защиты с инструкцией по применению в картонную пачку с заклеенными клапанами.
Или
По 2 шприца с системой защиты в промежуточную картонную упаковку, по 3 промежуточных картонных упаковки с инструкцией по применению в картонную пачку с заклеенными клапанами.
На каждую картонную пачку нанесен анти контрафактный стикер.
Условия хранения
Хранить при температуре от 2 до 8 °С в оригинальной упаковке для защиты от света. Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
Для дозировки 150 мг/мл – 24 мес.
Для дозировки 175 мг/мл – 18 мес.
Не использовать после окончания срока годности, указанного на упаковке.
Условия отпуска
Отпускают по рецепту.
Юридическое лицо, на имя которого выдано регистрационное удостоверение
АО Санофи-авентис груп, Франция.
Производитель
Санофи Винтроп Индустрия, Франция (150 мг/мл, 175 мг/мл; шприцы, шприцы с системой защиты)
Кук Фармика ЛЛС, США (150 мг/мл; шприцы)
Фасовщик (первичная упаковка)
Санофи Винтроп Индустрия, Франция (150 мг/мл, 175 мг/мл; шприцы, шприцы с системой защиты)
Кук Фармика ЛЛС, США (150 мг/мл; шприцы)
Упаковщик (вторичная (потребительская) упаковка)
Санофи Винтроп Индустрия, Франция (150 мг/мл, 175 мг/мл; шприцы, шприцы с системой защиты)
Кук Фармика ЛЛС, США (150 мг/мл; шприцы)
Выпускающий контроль качества
Санофи-Авентис Дойчланд ГмбХ, Германия (150 мг/мл, 175 мг/мл; шприцы, шприцы с системой защиты)
Sanofi-Aventis Deutschland GmbH, Germany.
Industriepark Hoechst – Brueningstrasse 50
H500, H590, H600 65926 Frankfurt am Main, Germany.
Санофи Винтроп Индустрия, Франция (150 мг/мл, 175 мг/мл; шприцы, шприцы с системой защиты)
Sanofi Winthrop Industrie, France.
1051 boulevard Industriel 76580 Le Trait, France.
Претензии потребителей направлять по адресу в России:
АО «Санофи Россия».
125009, г. Москва, ул. Тверская, 22.
В случае использования одноразового шприца с системой защиты, содержащего 300 мг препарата Дупиксент®, к инструкции по медицинскому применению лекарственного препарата прилагается «Инструкция по подготовке и проведению инъекции препарата Дупиксент®, 300 мг в предварительно заполненном одноразовом шприце с системой защиты»
Инструкция по подготовке и проведению инъекции препарата Дупиксент®, 300 мг в предварительно заполненном одноразовом шприце с системой защиты
Перед началом применения препарата Дупиксент® в предварительно заполненном одноразовом шприце с системой защиты внимательно прочитайте эту инструкцию.
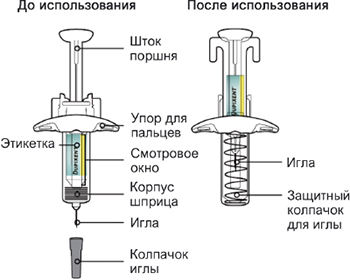
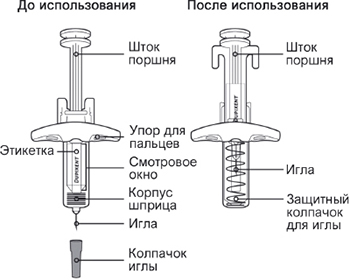
Элементы предварительно заполненного одноразового шприца с системой защиты показаны на рисунке ниже:
Данное устройство представляет собой предварительно заполненный одноразовый шприц с системой защиты (далее называется «шприц»). В нём содержится раствор для подкожного введения, содержащий 300 мг препарата Дупиксент®.
Важная информация
- Не пытайтесь провести инъекцию самостоятельно или с помощью кого-то до тех пор, пока лечащий врач или медицинский работник не обучат Вас правильной технике проведения подкожной инъекции.
- Перед использованием шприца внимательно прочитайте информацию по его использованию.
- Узнайте у своего лечащего врача, как часто Вам необходимо проводить инъекции препарата Дупиксент®.
- Попросите своего лечащего врача или медицинского работника показать, как правильно пользоваться шприцем, перед тем как в первый раз самостоятельно провести инъекцию препарата Дупиксент®.
- Рекомендуется менять место инъекции при каждом введении препарата.
- Не используйте шприц, если он упал на твердую поверхность или поврежден.
- Нельзя использовать шприц, если отсутствует колпачок иглы, или он не был надежно зафиксирован.
- Не дотрагивайтесь до штока поршня до тех пор, пока вы не будете готовы провести инъекцию.
- Не проводите инъекции через одежду.
- Не пытайтесь удалить воздушные пузырьки из шприца.
- Для того чтобы снизить риск случайного укола иглой, каждый предварительно заполненный одноразовый шприц оборудован устройством безопасности с системой защиты, которое автоматически активируется, закрывая иглу, после того, как Вы провели инъекцию.
- Не тяните шток поршня назад.
- Шприц не подлежит повторному использованию.
Как хранить шприц
- Храните шприцы в недоступном для детей месте.
- Храните неиспользуемые шприцы в оригинальной картонной упаковке в холодильнике при температуре от 2 °С до 8 °С.
- После извлечения из холодильника, шприц следует оставить на 45 мин при комнатной температуре и дать возможность ему нагреться перед тем, как делать инъекцию препарата Дупиксент®.
- Шприцы можно хранить при комнатной температуре в течение не более чем 14 дней.
- Не встряхивайте шприц.
- Не подвергайте шприц тепловому воздействию.
- Не замораживайте шприц.
- Не допускайте воздействия на шприц прямых солнечных лучей.
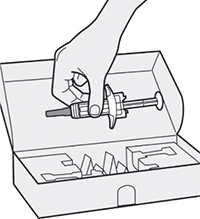
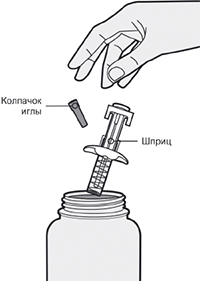
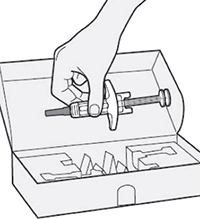
Шаг 1: Извлечение шприца из упаковки
Извлеките шприц из картонной упаковки, взяв его за середину корпуса.
Не снимайте колпачок иглы до момента проведения инъекции.
Нельзя использовать шприц, если он упал на твёрдую поверхность или повреждён.

Шаг 2: Подготовка
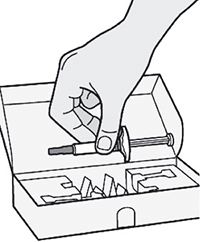
Убедитесь, что у Вас есть все необходимое для проведения инъекции:
— предварительно заполненный шприц;
— 1 салфетка, смоченная спиртом;*
— 1 ватный тампон или марлевая салфетка;*
— устойчивый к проколам контейнер* (см. Шаг 12).
* не содержатся в картонной упаковке.
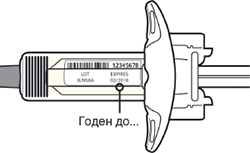
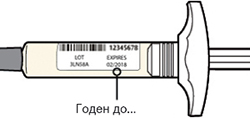
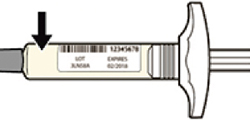
Внимательно проверьте маркировку:
— проверьте дату истечения срока годности;
— убедитесь в том, что у Вас правильный препарат и правильная доза.
Нельзя использовать шприц после истечения срока годности, указанного на этикетке.

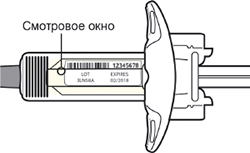
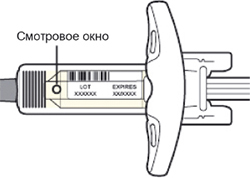
Шаг 3. Проверка
Осмотрите раствор через смотровое окно на шприце: проверьте, является ли раствор прозрачным, является ли жидкость бесцветной или имеющей светло-желтый оттенок.
Примечание: Вы можете обнаружить воздушные пузырьки, это нормально.
Нельзя использовать шприц, если жидкость изменила цвет или помутнела, или если в ней есть заметные хлопья или частицы.

Шаг 4: Подождите 45 мин
Положите шприц на плоскую поверхность, не менее чем на 45 мин, пусть шприц нагреется до комнатной температуры.
Не нагревайте шприц.
Не подвергайте шприц прямому воздействию солнечных лучей.

Шаг 5: Выбор места инъекции
Выберите место инъекции.
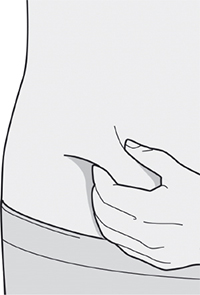
— Вы можете сделать инъекцию в наружную поверхность бедра или в переднюю часть живота, за исключением области диаметром 5 см непосредственно вокруг пупка.
— Если инъекцию осуществляет другой человек, для инъекции также можно использовать участок кожи в верхней части плеча.
Инъекции препарата Дупиксент® не следует осуществлять на участках с болезненной или поврежденной кожей, кровоподтеками или рубцами.

Шаг 6: Обработка места инъекции
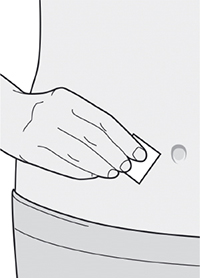
- Вымойте руки.
- Протрите участок кожи, предназначенный для инъекции салфеткой, смоченной спиртом.
- Дайте коже высохнуть перед проведением инъекции.
Не дотрагивайтесь до обработанного участка кожи руками и не дуйте на него перед проведением инъекции.

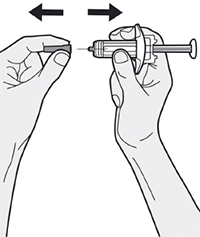
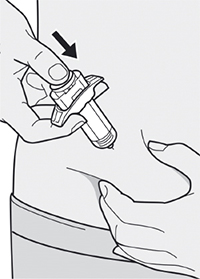
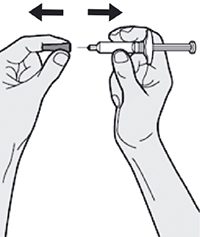
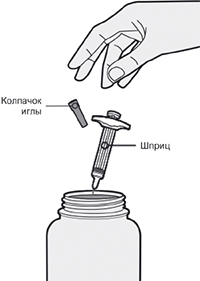
Шаг 7: Удаление колпачка иглы
Держите шприц за середину корпуса, игла должна быть направлена в сторону от Вас, и снимите колпачок с иглы.
Не надевайте колпачок обратно на иглу.
Не касайтесь иглы.
Лекарственный препарат необходимо ввести сразу же после удаления колпачка иглы.
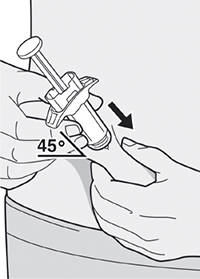
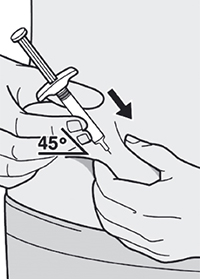
Шаг 8: Формирование складки кожи
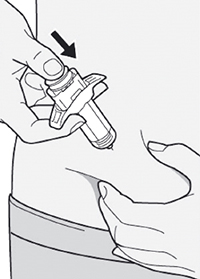
Сформируйте складку кожи в месте инъекции, как показано на рисунке.
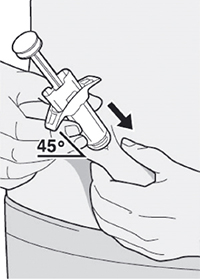
Шаг 9: Введение иглы
Полностью введите иглу в сформированную складку кожи под углом приблизительно 45°.
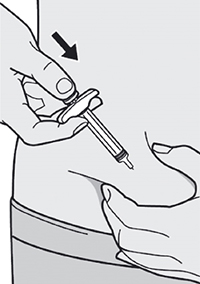
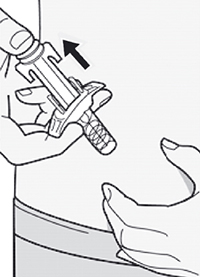
Шаг 10: Введение раствора
Ослабьте сформированную складку кожи.
Медленно и непрерывно нажимайте на шток поршня для введения всего раствора, пока шприц не опустеет.
Примечание: Вы почувствуете некоторое сопротивление. Это нормально.
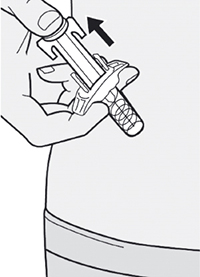
Шаг 11: Завершение инъекции и извлечение иглы
Поднимите большой палец, снимая давление со штока поршня, игла будет втянута внутрь защитного колпачка для иглы, а затем удалите шприц из места инъекции.
Слегка прижмите ватный тампон или марлевую салфетку к месту инъекции, если Вы заметите кровь.
Не надевайте колпачок иглы снова на иглу.
Не растирайте кожу после инъекции.

Шаг 12: Утилизация
После использования следует поместить шприц и колпачок иглы в устойчивый к проколам контейнер.
Не надевайте колпачок иглы снова на иглу.
Храните контейнер в недоступном для детей месте.
В случае использования одноразового шприца, содержащего 300 мг препарата Дупиксент®, к инструкции по медицинскому применению лекарственного препарата прилагается «Инструкция по подготовке и проведению инъекции препарата Дупиксент®, 300 мг в предварительно заполненном одноразовом шприце»
Инструкция по подготовке и проведению инъекции препарата Дупиксент®, 300 мг в предварительно заполненном одноразовом шприце
Перед началом применения препарата Дупиксент® в предварительно заполненном одноразовом шприце внимательно прочитайте эту инструкцию. Элементы предварительно заполненного шприца показаны на рисунке ниже:
* Шприц может иметь твердый или мягкий колпачок иглы.
Данное устройство представляет собой предварительно заполненный одноразовый шприц (далее называется «шприц»). В нём содержится раствор для подкожного введения, содержащий 300 мг препарата Дупиксент®.
Важная информация
- Не пытайтесь провести инъекцию самостоятельно или с помощью кого-то до тех пор, пока лечащий врач или медицинский работник не обучат Вас правильной технике проведения подкожной инъекции.
- Перед использованием шприца внимательно прочитайте информацию по его использованию.
- Узнайте у своего лечащего врача, как часто Вам необходимо проводить инъекции препарата Дупиксент®.
- Попросите своего лечащего врача или медицинского работника показать, как правильно пользоваться шприцем, перед тем как в первый раз самостоятельно провести инъекцию препарата Дупиксент®.
- Рекомендуется менять место инъекции при каждом введении препарата.
- Не используйте шприц, если он поврежден.
- Нельзя использовать шприц, если отсутствует колпачок иглы или он не был надежно зафиксирован.
- Не дотрагивайтесь до штока поршня до тех пор, пока Вы не будете готовы провести инъекцию.
- Не проводите инъекции через одежду.
- Не пытайтесь удалить воздушные пузырьки из шприца.
- Не тяните шток поршня назад.
- Шприц не подлежит повторному использованию.
Как хранить шприц
- Храните шприцы в недоступном для детей месте.
- Храните неиспользуемые шприцы в оригинальной картонной упаковке в холодильнике при температуре от 2 °С до 8 °С.
- После извлечения из холодильника, шприц следует оставить на 45 мин при комнатной температуре и дать возможность ему нагреться перед тем, как проводить инъекцию препарата Дупиксент®.
- Шприцы можно хранить при комнатной температуре в течение не более чем 14 дней.
- Не встряхивайте шприц.
- Не подвергайте шприц тепловому воздействию.
- Не замораживайте шприц.
- Не допускайте воздействия на шприц прямых солнечных лучей.
Шаг 1: Извлечение шприца из упаковки
Извлеките шприц из картонной упаковки, взяв его за середину корпуса.
Не снимайте колпачок иглы до момента проведения инъекции.
Нельзя использовать шприц, если он был повреждён.

Шаг 2: Подготовка
Убедитесь, что у Вас есть все необходимое для проведения инъекции:
— предварительно заполненный шприц;
— 1 салфетка, смоченная спиртом;*
— 1 ватный тампон или марлевая салфетка;*
— устойчивый к проколам контейнер* (см. Шаг 12).
* не содержатся в картонной упаковке.
Внимательно проверьте маркировку:
— проверьте дату истечения срока годности;
— убедитесь в том, что у Вас правильный препарат и правильная доза.
Нельзя использовать шприц после истечения срока годности, указанного на этикетке.

Шаг 3. Проверка
Осмотрите раствор в шприце: проверьте, является ли раствор прозрачным, является ли жидкость бесцветной или имеющей светло-желтый оттенок. Примечание: Вы можете обнаружить воздушные пузырьки, это нормально.
Нельзя использовать шприц, если жидкость изменила цвет или помутнела, или если в ней есть заметные хлопья или частицы.

Шаг 4: Подождите 45 мин
Положите шприц на плоскую поверхность, не менее чем на 45 мин, пусть шприц нагреется до комнатной температуры.
Не нагревайте шприц.
Не подвергайте шприц прямому воздействию солнечных лучей. Шприц нельзя хранить при комнатной температуре более 14 дней.

Шаг 5: Выбор места инъекции
Выберите место инъекции.
— Вы можете сделать инъекцию в наружную поверхность бедра или в переднюю часть живота, за исключением области диаметром 5 см непосредственно вокруг пупка.
— Если инъекцию осуществляет другой человек, для инъекции также можно использовать участок кожи в верхней части плеча.
Инъекции препарата Дупиксент® не следует осуществлять на участках с болезненной или поврежденной кожей, кровоподтеками или рубцами.

Этап 6: Обработка участка инъекции
- Вымойте руки.
- Протрите участок кожи, предназначенный для инъекции салфеткой, смоченной спиртом.
- Дайте коже высохнуть перед проведением инъекции.
Не дотрагивайтесь до обработанного участка кожи руками и не дуйте на него перед проведением инъекции.

Шаг 7: Удаление колпачка иглы
Держите шприц за середину корпуса, игла должна быть направлена в сторону от Вас, и снимите колпачок иглы.
Не надевайте колпачок иглы обратно на иглу.
Не касайтесь иглы.
Лекарственный препарат необходимо ввести сразу же после удаления колпачка иглы.
Шаг 8: Формирование складки кожи
Сформируйте складку кожи на участке инъекции, как показано на рисунке.
Шаг 9: Введение иглы
Полностью введите иглу в сформированную складку под углом приблизительно 45°.
Шаг 10: Введение раствора
Ослабьте сформированную складку кожи.
Медленно и непрерывно нажимайте на шток поршня для введения всего раствора, пока шприц не опустеет.
Примечание: Вы почувствуете некоторое сопротивление. Это нормально.
Шаг 11: Извлечение иглы
Извлеките иглу из кожи под тем же углом, под которым она была введена.
Не надевайте колпачок иглы снова на иглу.
Слегка прижмите ватный тампон или марлевую салфетку к месту инъекции, если Вы заметите кровь.
Не растирайте кожу после инъекции.

Шаг 12: Утилизация
После использования следует поместить шприц и колпачок иглы в устойчивый к проколам контейнер.
Не надевайте колпачок иглы снова на иглу.
Храните контейнер в недоступном для детей месте.
В случае использования одноразового шприца с системой защиты, содержащего 200 мг препарата Дупиксент®, к инструкции по медицинскому применению лекарственного препарата прилагается «Инструкция по подготовке и проведению инъекции препарата Дупиксент®, 200 мг в предварительно заполненном одноразовом шприце с системой защиты»
Инструкция по подготовке и проведению инъекции препарата Дупиксент®, 200 мг в предварительно заполненном одноразовом шприце с системой защиты
Перед началом применения препарата Дупиксент® в предварительно заполненном одноразовом шприце с системой защиты внимательно прочитайте эту инструкцию.
Элементы предварительно заполненного одноразового шприца с системой защиты показаны на рисунке ниже:
Данное устройство представляет собой предварительно заполненный одноразовый шприц с системой защиты (далее называется «шприц»). В нём содержится раствор для подкожного введения, содержащий 200 мг препарата Дупиксент®.
Важная информация
- Не пытайтесь провести инъекцию самостоятельно или с помощью кого-то до тех пор, пока лечащий врач или медицинский работник не обучат Вас правильной технике проведения подкожной инъекции.
- Перед использованием шприца внимательно прочитайте информацию по его использованию.
- Узнайте у своего лечащего врача, как часто Вам необходимо проводить инъекции препарата Дупиксент®.
- Попросите своего лечащего врача или медицинского работника показать, как правильно пользоваться шприцем, перед тем как в первый раз самостоятельно провести инъекцию препарата Дупиксент®.
- Рекомендуется менять место инъекции при каждом введении препарата.
- Не используйте шприц, если он упал на твердую поверхность или поврежден.
- Нельзя использовать шприц, если отсутствует колпачок иглы, или он не был надежно зафиксирован.
- Не дотрагивайтесь до штока поршня до тех пор, пока вы не будете готовы провести инъекцию.
- Не проводите инъекции через одежду.
- Не пытайтесь удалить воздушные пузырьки из шприца.
- Для того чтобы снизить риск случайного укола иглой, каждый предварительно заполненный одноразовый шприц оборудован устройством безопасности с системой защиты, которое автоматически активируется, закрывая иглу, после того, как Вы провели инъекцию.
- Не тяните шток поршня назад.
- Шприц не подлежит повторному использованию.
Как хранить шприц
- Храните шприцы в недоступном для детей месте.
- Храните неиспользуемые шприцы в оригинальной картонной упаковке в холодильнике при температуре от 2 °С до 8 °С.
- После извлечения из холодильника, шприц следует оставить на 30 мин при комнатной температуре и дать возможность ему нагреться перед тем, как делать инъекцию препарата Дупиксент®.
- Шприцы можно хранить при комнатной температуре в течение не более чем 14 дней.
- Не встряхивайте шприц.
- Не подвергайте шприц тепловому воздействию.
- Не замораживайте шприц.
- Не допускайте воздействия на шприц прямых солнечных лучей.
Шаг 1: Извлечение шприца из упаковки
Извлеките шприц из картонной упаковки, взяв его за середину корпуса.
Не снимайте колпачок иглы до момента проведения инъекции.
Нельзя использовать шприц, если он упал на твёрдую поверхность или повреждён.

Шаг 2: Подготовка
Убедитесь, что у Вас есть все необходимое для проведения инъекции:
— предварительно заполненный шприц;
— 1 салфетка, смоченная спиртом;*
— 1 ватный тампон или марлевая салфетка;*
— устойчивый к проколам контейнер* (см. Шаг 12).
* не содержатся в картонной упаковке.
Внимательно проверьте маркировку:
— проверьте дату истечения срока годности;
— убедитесь в том, что у Вас правильный препарат и правильная доза.
Нельзя использовать шприц после истечения срока годности, указанного на этикетке.

Шаг 3. Проверка
Осмотрите раствор через смотровое окно на шприце: проверьте, является ли раствор прозрачным, является ли жидкость бесцветной или имеющей светло-желтый оттенок.
Примечание: Вы можете обнаружить воздушные пузырьки, это нормально.
Нельзя использовать шприц, если жидкость изменила цвет или помутнела, или если в ней есть заметные хлопья или частицы.

Шаг 4: Подождите 30 мин
Положите шприц на плоскую поверхность, не менее чем на 30 мин, пусть шприц нагреется до комнатной температуры.
Не нагревайте шприц.
Не подвергайте шприц прямому воздействию солнечных лучей.
Шприц нельзя хранить при комнатной температуре более 14 дней.

Шаг 5: Выбор места инъекции
Выберите место инъекции.
— Вы можете сделать инъекцию в наружную поверхность бедра или в переднюю часть живота, за исключением области диаметром 5 см непосредственно вокруг пупка.
— Если инъекцию осуществляет другой человек, для инъекции также можно использовать участок кожи в верхней части плеча.
Инъекции препарата Дупиксент® не следует осуществлять на участках с болезненной или поврежденной кожей, кровоподтеками или рубцами.

Шаг 6: Обработка места инъекции
- Вымойте руки.
- Протрите участок кожи, предназначенный для инъекции салфеткой, смоченной спиртом.
- Дайте коже высохнуть перед проведением инъекции.
Не дотрагивайтесь до обработанного участка кожи руками и не дуйте на него перед проведением инъекции.

Шаг 7: Удаление колпачка иглы
Держите шприц за середину корпуса, игла должна быть направлена в сторону от Вас, и снимите колпачок с иглы.
Не надевайте колпачок обратно на иглу.
Не касайтесь иглы.
Лекарственный препарат необходимо ввести сразу же после удаления колпачка иглы.
Шаг 8: Формирование складки кожи
Сформируйте складку кожи в месте инъекции, как показано на рисунке.
Шаг 9: Введение иглы
Полностью введите иглу в сформированную складку кожи под углом приблизительно 45°.
Шаг 10: Введение раствора
Ослабьте сформированную складку кожи.
Медленно и непрерывно нажимайте на шток поршня для введения всего раствора, пока шприц не опустеет.
Примечание: Вы почувствуете некоторое сопротивление. Это нормально.
Шаг 11: Завершение инъекции и извлечение иглы
Поднимите большой палец, снимая давление со штока поршня, игла будет втянута внутрь защитного колпачка для иглы, а затем удалите шприц из места инъекции.
Слегка прижмите ватный тампон или марлевую салфетку к месту инъекции, если Вы заметите кровь.
Не надевайте колпачок иглы снова на иглу.
Не растирайте кожу после инъекции.

Шаг 12: Утилизация
После использования следует поместить шприц и колпачок иглы в устойчивый к проколам контейнер.
Не надевайте колпачок иглы снова на иглу.
Храните контейнер в недоступном для детей месте.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Дупиксент® (Dupixent) инструкция по применению
📜 Инструкция по применению Дупиксент®
💊 Состав препарата Дупиксент®
✅ Применение препарата Дупиксент®
📅 Условия хранения Дупиксент®
⏳ Срок годности Дупиксент®
Описание лекарственного препарата
Дупиксент®
(Dupixent)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2022 года.
Дата обновления: 2021.12.10
Владелец регистрационного удостоверения:
Контакты для обращений:
САНОФИ
Лекарственные формы
| Дупиксент® |
Р-р д/п/к введения 150 мг/1 мл: шприцы 2 мл 1, 2 или 6 шт. рег. №: ЛП-005440 |
|
|
Р-р д/п/к введения 175 мг/1 мл: шприцы 1.14 мл 1, 2 или 6 шт. рег. №: ЛП-005440 |
Форма выпуска, упаковка и состав
препарата Дупиксент®
Раствор для п/к введения прозрачный или слегка опалесцирующий, бесцветный или желтоватого цвета.
Вспомогательные вещества: L-гистидин и L-гистидина гидрохлорида моногидрат — 3.1 мгc, L-аргинина гидрохлорид — 4.35 мгd, натрия ацетата тригидрат и уксусная кислота ледяная — 0.75 мгf, сахароза — 50 мгg, полисорбат 80 — 2 мгh, вода д/и — до 1 мл.
2 мл — шприцы одноразовые (1) — пачки картонные с заклеенными клапанами×.
2 мл — шприцы одноразовые (2) — пачки картонные с заклеенными клапанами×.
2 мл — шприцы одноразовые (2) — упаковки картонные промежуточные (3) — пачки картонные с заклеенными клапанами×.
2 мл — шприцы с системой защиты из прозрачного стекла (тип I) (1) — пачки картонные с заклеенными клапанами×.
2 мл — шприцы с системой защиты из прозрачного стекла (тип I) (2) — пачки картонные с заклеенными клапанами×.
2 мл — шприцы с системой защиты из прозрачного стекла (тип I) (2) — упаковки картонные промежуточные (3) — пачки картонные с заклеенными клапанами×.
Раствор для п/к введения прозрачный или слегка опалесцирующий, бесцветный или желтоватого цвета.
Вспомогательные вещества: L-гистидин и L-гистидина гидрохлорида моногидрат — 3.1 мгc, L-аргинина гидрохлорид — 10.51 мгe, натрия ацетата тригидрат и уксусная кислота ледяная — 0.75 мгf, сахароза — 49.88 мгg, полисорбат 80 — 2 мгh, вода д/и — до 1 мл.
1.14 мл — шприцы одноразовые с системой защиты из прозрачного стекла (тип I) (1) — пачки картонные с заклеенными клапанами×.
1.14 мл — шприцы одноразовые с системой защиты из прозрачного стекла (тип I) (2) — пачки картонные с заклеенными клапанами×.
1.14 мл — шприцы одноразовые с системой защиты из прозрачного стекла (тип I) (2) — упаковки картонные промежуточные (3) — пачки картонные с заклеенными клапанами×.
× На каждую пачку картонную нанесен антиконтрафактный стикер.
a В расчете на 2 мл препарата.
b В расчете на 1.14 мл препарата.
c Содержание L-гистидина и L-гистидина гидрохлорида приведено в пересчете на L-гистидин (М=155.16 г/моль), исходя из общей концентрации гистидина в препарате 20 мМ.
d Содержание L-аргинина гидрохлорида приведено в пересчете на L-аргинин (М=174,2 г/моль), исходя из молярной концентрации L-аргинина в препарате 25 мМ. Номинальное содержание L-аргинина гидрохлорида (М=210.66 г/моль) в одном шприце составляет 10.5 мг.
e Содержание L-аргинина гидрохлорида приведено в пересчете на L-аргинин (М=174.2 г/моль), исходя из молярной концентрации L-аргинина в препарате 50 мМ. Номинальное содержание L-аргинина гидрохлорида (М=210.66 г/моль) в одном шприце составляет 9.93 мг.
f Содержание натрия ацетата тригидрата и уксусной кислоты ледяной приведено, исходя из общей концентрации ацетат иона в препарате 12.5 мМ.
g Содержание сахарозы приведено в пересчете на миллиграммы, исходя из масса-объемной концентрации сахарозы в препарате 5%.
h Содержание полисорбата 80 приведено в пересчете на миллиграммы, исходя из масса-объемной концентрации полисорбата 80 в препарате 0.2%.
Фармакологическое действие
Механизм действия
Препарат Дупиксент® является рекомбинантным человеческим моноклональным антителом (IgG4), которое блокирует передачу сигналов интерлейкина-4 (ИЛ-4) и интерлейкина-13 (ИЛ-13) путем специфического связывания с IL-4Rα-субъединицей, общей для рецепторных комплексов ИЛ-4 и ИЛ-13. Препарат Дупиксент® блокирует передачу сигналов ИЛ-4 через рецепторы I типа (IL-4Rα/γc) и общую передачу сигналов ИЛ-4 и ИЛ-13 через рецепторы II типа (IL-4Rα/IL-13Rα). ИЛ-4 и ИЛ-13 являются ключевыми цитокинами воспаления 2 типа (в т.ч. продуцируемые и Th2-лимфоцитами), вовлеченными в патогенез атопических заболеваний.
Воспаление 2 типа играет важную роль в патогенезе многих атопических заболеваний, включая бронхиальную астму, способствует ограничению воздушного потока и увеличивает риск обострений. ИЛ-4 и ИЛ-13 выступают в качестве основных факторов воспаления 2 типа, активируя множественные типы клеток (например, тучные клетки, лимфоциты, эозинофилы, нейтрофилы, макрофаги) и индуцируя множественные медиаторы (например, иммуноглобулин Е, гистамин, эйкозаноиды, лейкотриены, хемокины и цитокины, включая эотаксин/CCL11, TARC/CCL17 и ИЛ-5), участвующие в воспалении 2 типа. Блокирование пути передачи сигналов ИЛ-4/ИЛ-13 дупилумабом у пациентов снижает концентрации многих из этих маркеров воспаления 2 типа, включая иммуноглобулин Е, периостин и множественные провоспалительные цитокины и хемокины (например, эотаксин, TARC), а также снижает уровень фракции оксида азота в выдыхаемом воздухе (FeNO) — маркер воспаления в легких. Было показано, что блокирование пути передачи сигналов ИЛ-4/ИЛ-13 дупилумабом в гуманизированных моделях животных предотвращает последующие действия этих цитокинов и хемокинов, в т.ч. гиперплазию бокаловидных клеток, гиперреактивность гладкомышечных клеток дыхательных путей, эозинофильное воспаление в легких, другие воспалительные процессы в легких, а также предотвращает нарушение функции легких; при этом снижение выраженности эозинофильного воспаления в легких происходит независимо от нормального или повышенного уровня эозинофилов в крови.
Дупилумаб производится с помощью технологии рекомбинантной ДНК в суспензионной культуре клеток яичника китайского хомячка.
Дупилумаб имеет молекулярную массу приблизительно 147 кДа.
Фармакодинамика
Атопический дерматит
В клинических исследованиях лечение препаратом Дупиксент® приводило к снижению в сыворотке крови концентраций биомаркеров, связанных с цитокинами воспаления 2 типа, таких как тимус-ассоциированного регуляторного хемокина (TARC/CCL17), общего сывороточного иммуноглобулина Е и аллерген-специфического иммуноглобулина Е. Также наблюдалось снижение активности ЛДГ, биомаркера, связанного со степенью тяжести атопического дерматита и его активностью. Препарат Дупиксент® уже в начале 2-й недели лечения вызывал супрессию хемокина TARC по сравнению с плацебо, с тенденцией продолжения его снижения до максимальной и устойчивой супрессии к 12-й неделе лечения.
У пациентов, получавших препарат Дупиксент® в дозе 300 мг 1 раз в 2 недели и в дозе 300 мг 1 раз в неделю, общий сывороточный иммуноглобулин Е к 52-й неделе терапии снизился на -74.8% и -73.9% (медиана изменения по сравнению с исходным уровнем), соответственно, по сравнению с -0% в группе плацебо. Аналогичные тенденции наблюдались в отношении антиген-специфических иммуноглобулинов Е, в т.ч. энтеротоксина А, специфического для золотистого стафилококка (S. aureus), аллергенов трав и деревьев.
Бронхиальная астма
В соответствии с ингибированием передачи сигналов ИЛ-4 и ИЛ-13, лечение дупилумабом заметно уменьшало уровень FeNO и концентрации эотаксина-3, общего иммуноглобулина Е, аллерген-специфического иммуноглобулина Е, TARC и периостина у пациентов с бронхиальной астмой по сравнению с плацебо. Эти снижения уровней биомаркеров воспаления были сопоставимы для режимов дозирования 200 мг 1 раз в 2 недели и 300 мг 1 раз в 2 недели и были близки к максимальному подавлению через 2 недели лечения, за исключением иммуноглобулина Е, который уменьшался медленнее. Описанные эффекты были устойчивыми во время лечения.
Хронический полипозный риносинусит
У участников исследований с хроническим полипозным риносинуситом (ХПРС) на фоне лечения дупилумабом также наблюдалось снижение в моче уровня лейкотриена 4 (LTE4), маркера, связанного с активацией тучных клеток, базофилов и эозинофилов.
Клиническая эффективность
Атопический дерматит
Эффективность и безопасность препарата Дупиксент® в монотерапии или в сочетании с топическими ГКС оценивали в трех основных рандомизированных, двойных слепых, плацебо-контролируемых исследованиях (SOLO1, SOLO2 и CHRONOS) с участием 2119 пациентов в возрасте 18 лет и старше со среднетяжелым и тяжелым течением атопического дерматита.
16-недельные исследования монотерапии (SOLO1 и SOLO2)
Показателя общей оценки исследователя (IGA) 0 или 1 («чистая» или «почти чистая кожа») к 16-й неделе лечения в клиническом исследовании SOLO1 достигли 37.9% пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в 2 недели, и 37.2% пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в неделю, против 10.3% пациентов в группе плацебо, а в исследовании SOLO2 — 36.1% и 36.4% против 8.5% пациентов соответственно.
Улучшение не менее чем на 75% от исходного значения по индексу тяжести и площади экземы (EASI-75) к 16-й неделе лечения в исследовании SOLO1 достигли 51.3% пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в 2 недели, и 52.5% пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в неделю, против 14.7% пациентов в группе плацебо, а в исследовании SOLO2 — 44.2% и 48.1% против 11.9% соответственно.
Не менее чем 4-бального уменьшения зуда по пиковым значениям числовой шкалы оценки выраженности зуда NRS к 16-й неделе лечения в исследовании SOLO1 достигли 40.8% пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в 2 недели, и 40.3% пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в неделю, против 12.3% пациентов в группе плацебо, а в исследовании SOLO2 — 36.0% и 39.0% пациентов против 9.5% соответственно. Значительно больший процент пациентов, получавших Дупиксент®, достигал быстрого улучшения по шкале оценки тяжести зуда NRS по сравнению с пациентами в группе плацебо (определяемого как ≥4-балльное улучшение уже на 2-й неделе), причем процент пациентов, у которых наблюдалось уменьшение тяжести зуда по шкале NRS, продолжал увеличиваться в течение всего периода лечения.
Эффекты лечения в подгруппах (с распределением на подгруппы по массе тела, возрасту, полу, расе и сопутствующей терапии, в т.ч. с применением иммунодепрессантов) в исследованиях SOLO1 и SOLO2 в целом согласуются с результатами, полученными в общей исследуемой популяции.
52-недельное клиническое исследование с одновременным применением топических ГКС (CHRONOS)
IGA 0 или 1 к 16-й неделе лечения достигли 38.7% пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в 2 недели + топические ГКС, и 39.2% пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в неделю + топические ГКС, против 12.4% пациентов в группе плацебо, а к 52-й неделе — 36.0% и 40.0% против 12.5% пациентов соответственно.
EASI-75 к 16-й неделе лечения достигли 68.9% пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в 2 недели + топические ГКС, и 63.9% пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в неделю + топические ГКС, против 23.2% пациентов в группе плацебо + топические ГКС, а к 52-й неделе — 65.2% и 64.1% против 21.6% пациентов соответственно.
Не менее чем 4-бального улучшения по шкале тяжести зуда NRS к 16-й неделе лечения достигли 58.8% пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в 2 недели + топические ГКС, и 50.8% пациентов, получавших препарат Дупиксент® в дозе 300 мг 1 раз в неделю + топические ГКС, против 19.7% пациентов в группе плацебо + топические ГКС, а к 52-й неделе — 51.2% и 39.0% против 12.9% пациентов соответственно. Более значительный процент пациентов, получавших препарат Дупиксент® + топические ГКС, достигал быстрого улучшения по шкале тяжести зуда NRS по сравнению с пациентами в группе плацебо + топические ГКС (определяемого как > 4-балльное улучшение уже на 2-й неделе; р <0.05), причем доля пациентов, у которых наблюдалось уменьшение тяжести зуда по шкале NRS, продолжала увеличиваться в течение всего периода лечения.
Эффекты лечения в подгруппах (с распределением по массе тела, возрасту, полу, расе и сопутствующей терапии, в т.ч. с применением иммунодепрессантов) в исследовании CHRONOS в целом согласуются с результатами, полученными в общей исследуемой популяции.
Клиническая эффективность у пациентов, которым не рекомендовалось лечение циклоспорином
У пациентов, которым не рекомендовалось лечение циклоспорином или оно было неэффективно, монотерапия препаратом Дупиксент® в обеих группах лечения, приводила к значительному улучшению признаков и симптомов атопического дерматита по сравнению с плацебо. Больший процент пациентов, получавших Дупиксент®, по сравнению с группой плацебо достигал IGA 0 или 1 и снижения по сравнению с исходным значением на ≥2 балла к 16-й неделе (29.5% против 6.8%), EASI-75 к 16-й неделе (38% против 11.4%), а также снижения не менее чем на 4 балла индекса тяжести зуда от исходного значения к 16-й неделе (34.9% по сравнению с 8%) (р <0.001 для всех 3 конечных точек). Аналогичные результаты наблюдались у пациентов, получавших Дупиксент® одновременно с топическими ГКС. Эффективность комбинации препарата Дупиксент® + топические ГКС сохранялась до 52-й недели терапии.
Подростки в возрасте от 12 до 17 лет
Эффективность и безопасность применения препарата Дупиксент® в монотерапии у пациентов оценивалась в мультицентровом, рандомизированном, двойном-слепом, плацебо-контролируемом исследовании (AD-1536) с участием 251 пациента в возрасте от 12 до 17 лет с атопическим дерматитом среднетяжелого и тяжелого течения. Соответствующие пациенты, включенные в данное исследование, продемонстрировали неадекватный ответ на предварительную терапию топическими препаратами.
Пациенты получали: начальную дозу 400 мг препарата Дупиксент® (2 инъекции по 200 мг) с последующим введением 200 мг каждые 2 недели для пациентов с базовой массой тела менее 60 кг или начальную дозу препарата Дупиксент® 600 мг (2 инъекции по 300 мг) с последующим введением 300 мг каждые 2 недели для пациентов с базовой массой тела более 60 кг; либо начальную дозу препарата Дупиксент® 600 мг (2 инъекции по 300 мг) с последующим введением 300 мг каждые 4 недели независимо от массы тела; либо плацебо.
Дупиксент® вводят п/к. При необходимости контролировать недопустимые симптомы пациентам разрешалось получать скоропомощное лечение по решению исследователя. Пациенты, которые получали такое лечение, были оценены как не отвечающие на терапию препаратом Дупиксент®.
В данном исследовании средний возраст пациентов составлял 14.5 лет, средний вес 59.4 кг, 41.0% пациентов были женщины, 62.5% белокожие, 15.1% азиаты и 12.0% темнокожие. В целом, 92.0% пациентов имели как минимум одно коморбидное аллергическое состояние; у 65.5% пациентов наблюдался аллергический ринит; у 53.6% пациентов была бронхиальная астма и у 68% пациентов наблюдалась пищевая аллергия.
Клинический ответ
Показателя общей оценки исследователя (IGA) 0 или 1 («чистая» или «почти чистая кожа») к 16-й неделе лечения в исследовании AD-1526 достигли 24.4% пациентов, получавших Дупиксент® в дозе 300 мг 1 раз в 2 недели (≥ 60 кг) или 200 мг 1 раз в 2 недели (< 60 кг) против 2.4% пациентов в группе плацебо.
Улучшение не менее чем на 75% от исходного значения по индексу тяжести и площади экземы (EASI-75) к 16-й неделе достигли 41.5% пациентов, получавших Дупиксент® против 8.2% пациентов в группе плацебо.
Не менее чем 4-бального уменьшения зуда по пиковым значениям числовой шкалы оценки выраженности зуда (NRS) к 16-й неделе лечения в исследовании достигли 36,6 % пациентов, получавших Дупиксент®, против 4.8% пациентов в группе плацебо. Значительно больший процент пациентов, получавших Дупиксент®, достигал быстрого улучшения по шкале оценки тяжести зуда NRS по сравнению с пациентами в группе плацебо (определяемого как ≥ 4-балльное улучшение уже на 2-й неделе), причем процент пациентов, у которых наблюдалось уменьшение тяжести зуда по шкале NRS, продолжал увеличиваться в течение всего периода лечения.
Значительно большее соотношение пациентов, рандомизированных на терапию препаратом Дупиксент®, достигли быстрого улучшения по шкале оценки выраженности зуда (NRS) по сравнению с плацебо (улучшение более чем в 4 раза уже на 4-й неделе; номинальное значение p <0.001) и доля пациентов, ответивших на терапию по шкале NRS, наблюдалась в сочетании с улучшением объективных признаков атопического дерматита.
Долгосрочные исследования эффективности терапии препаратом Дупиксент® у пациентов подросткового возраста с атопическим дерматитом среднетяжелого и тяжелого течения, которые принимали участие в предыдущих клинических исследованиях препарата Дупиксент®, были оценены в открытом продолженном исследовании (AD-1434). Данные в отношении эффективности, полученные в данном исследовании, предполагают, что клиническое преимущество, полученное на 16-й неделе терапии, является стабильным в течение 52 недель терапии.
Дети в возрасте от 6 до 11 лет
Эффективность и безопасность применения препарата Дупиксент® у пациентов детского возраста в сочетании с топическими ГКС изучалась в многоцентровом рандомизированном двойном слепом плацебо-контролируемом исследовании (AD-1652) с участием 367 пациентов в возрасте от 6 до 11 лет с атопическим дерматитом, характеризующимся значениями IGA ≥4 (по шкале от 0 до 4), EASI ≥21 (по шкале от 0 до 72), а также минимальной пораженной площади поверхности тела ≥15%. У подходящих пациентов, включенных в это исследование, ранее наблюдался недостаточный ответ на топические препараты. Пациентов стратифицировали в зависимости от массы тела на исходном уровне (<30 кг, ≥30 кг).
Пациенты в группе, получавшей препарат Дупиксент® 1 раз в 2 недели + топические ГКС с исходной массой тела <30 кг получали начальную дозу препарата 200 мг/сут и затем по 100 мг 1 раз в 2 недели со 2 по 14 неделю, а пациенты с исходной массой тела ≥30 кг получали первоначальную дозу препарата Дупиксент® 400 мг/сут и затем 200 мг 1 раз в 2 недели со 2 по 14 неделю. Пациенты в группе, получавшей препарат Дупиксент® 1 раз в 4 недели + топические ГКС получали первоначальную дозу препарата 600 мг/сут и затем 300 мг 1 раз в 4 недели с 4 по 12 неделю, независимо от массы тела. Пациентам было разрешено получать резервную терапию по усмотрению исследователя. Пациенты, получавшие резервную терапию, расценивались как не отвечающие на терапию препаратом Дупиксент®.
В данном исследовании средний возраст составлял 8.5 лет, средняя масса тела 29.8 кг, 50.1% пациентов были женского пола, 69.2% были белыми, 16.9% были темнокожими и 7.6% были азиатами.
В целом, 91.7% пациентов имели как минимум одно коморбидное аллергическое состояние; у 64.4% наблюдалась пищевая аллергия, у 62.7% – другие виды аллергии, у 60.2% наблюдался аллергический ринит, у 46.7% пациентов наблюдалась бронхиальная астма.
Клинический ответ
Показателя общей оценки исследователя (IGA) 0 или 1 («чистая» или «почти чистая кожа») к 16-й неделе лечения в исследовании AD-1652 достигли 29.5% пациентов c массой тела менее 30 кг, получавших Дупиксент® в дозе 300 мг 1 раз в 4 недели, против 13.1% в группе плацебо; 39.0% пациентов с массой тела 30 и более кг, получавших Дупиксент® в дозе 200 мг 1 раз в 2 недели, против 9.7% в группе плацебо.
Улучшение не менее чем на 75% от исходного значения по индексу тяжести и площади экземы (EASI-75) к 16-й неделе лечения в исследовании AD-1652 достигли 75.4% пациентов c массой тела менее 30 кг, получавших Дупиксент® в дозе 300 мг 1 раз в 4 недели, против 27.9% в группе плацебо; 74.6% пациентов с массой тела 30 и более кг, получавших Дупиксент® в дозе 200 мг 1 раз в 2 недели, против 25.8% в группе плацебо.
Не менее чем 4-бального уменьшения зуда по пиковым значениям числовой шкалы оценки выраженности зуда (NRS) к 16-й неделе лечения в исследовании AD-1652 достигли 54.1% пациентов c массой тела менее 30 кг, получавших Дупиксент® в дозе 300 мг 1 раз в 4 недели, против 11.7% в группе плацебо; 61.4% пациентов с массой тела 30 и более кг, получавших Дупиксент® в дозе 200 мг 1 раз в 2 недели, против 12.9% в группе плацебо.
Значительно больший процент пациентов, получавших Дупиксент®, достигал быстрого улучшения по шкале оценки тяжести зуда NRS по сравнению с пациентами в группе плацебо (определяемого как ≥ 4-балльное улучшение уже на 2-й неделе), причем процент пациентов, у которых наблюдалось уменьшение тяжести зуда по шкале NRS, продолжал увеличиваться в течение всего периода лечения.
Значительно больший процент пациентов, рандомизированных на терапию препаратом Дупиксент® в сочетании с топическими ГКС, достиг быстрого улучшения по шкале оценки выраженности зуда (NRS) по сравнению с плацебо (улучшение ≥4 балла на 4-й неделе).
Долгосрочная эффективность терапии препаратом Дупиксент® в сочетании с топическими ГКС у пациентов детского возраста с атопическим дерматитом, которые принимали участие в предшествующих клинических исследованиях препарата Дупиксент® в сочетании с топическими ГКС изучалась в продолженном открытом исследовании (AD-1434). Данные по эффективности из этого исследования позволяют предположить, что клиническое улучшение, наблюдавшееся на 16 неделе, сохранялось в течение 52 недель терапии включительно.
Бронхиальная астма
Было проведено три рандомизированных, двойных слепых, плацебо-контролируемых, многоцентровых исследования в параллельных группах (DRI12544, QUEST и VENTURE) продолжительностью от 24 до 52 недель с участием 2888 пациентов (в возрасте 12 лет и старше). Во все три исследования пациенты были включены независимо от минимального исходного уровня эозинофилов или другого биомаркера воспаления 2 типа (например, уровня FeNO или иммуноглобулина Е).
Обострения бронхиальной астмы
В исследованиях DRI12544, QUEST и VENTURE оценивали частоту тяжелых обострений астмы независимо от минимального количества эозинофилов или любых других биомаркеров воспаления 2 типа (например, FeNO или иммуноглобулин Е) в начале исследования. В общей популяции, независимо от содержания эозинофилов и других биомаркеров воспаления 2 типа, у пациентов, получавших 200 или 300 мг препарата Дупиксент® 1 раз в 2 недели, произошло значительное снижение частоты тяжелых обострений астмы по сравнению с группой плацебо. В исследованиях DRI12544 и QUEST частота тяжелых обострений при применении препарата Дупиксент® в дозе 200 мг 1 раз в 2 недели снижалась на 70% и 48%; а при применении в дозе 300 мг 1 раз в 2 недели — на 70% и 46% соответственно; и на 59% в исследовании VENTURE.
В объединенном анализе исследований DRI12544 и QUEST частота тяжелых обострений, приводящих к госпитализации и/или посещениям отделений неотложной помощи, снизилась на 25.5% и 46.9% при применении препарата Дупиксент® в дозах 200 мг или 300 мг 1 раз в 2 недели соответственно.
Кумулятивное среднее число тяжелых обострений было более низкое у пациентов, получавших препарат Дупиксент® по сравнению с плацебо в исследованиях DRI12544, QUEST и VENTURE (в общей популяции и в популяции с исходным числом эозинофилов ≥150 клеток/мкл или FeNO ≥25 ppb) в течение 24- или 52-недельного периода лечения в обеих группах режимов дозирования препарата.
В исследовании QUEST у пациентов, получавших ингаляционные ГКС в средней дозе, наблюдалось сходное снижение частоты тяжелых обострений астмы по сравнению с пациентами, получавшими ингаляционные ГКС в высокой дозе.
Функция легких
Клинически значимое увеличение предбронходилатационного значения объема форсированного выдоха за 1-ю секунду (ОФВ1) наблюдалось на 12-й неделе в общей популяции независимо от уровня эозинофилов или других биомаркеров воспаления 2 типа (например, FeNO или иммуноглобулин Е). В исследованиях DRI12544, QUEST и VENTURE, по сравнению с плацебо, большее улучшение ОФВ1 наблюдалось также у пациентов с FeNO ≥25 ppb. Улучшение ОФВ1 было одинаковым, независимо от того, получали ли пациенты ингаляционные ГКС в средней дозе, ингаляционные ГКС в высокой дозе или пероральные ГКС.
Значительные улучшения ОФВ1 наблюдались уже в течение второй недели (DRI12544, QUEST и VENTURE) после первой инъекции препарата Дупиксент® в дозе как 200 мг, так и 300 мг и сохранялись в течение 24 недель (DRI12544 и VENTURE) и 52 недель (QUEST).
Скорректированная средняя разность абсолютных значений ОФВ1 была 0.20 л и 0.14 л в группах, получавших Дупиксент® 200 мг 1 раз в 2 недели, по сравнению с плацебо; 0.16 и 0.13 л в группах, получавших 300 мг 1 раз в 2 недели по сравнению с плацебо, соответственно в исследованиях DRI12544 и QUEST. Соответствующее процентное изменение ОФВ1 составляло от 9.2 до 11.9% для дозы 200 мг 1 раз в 2 недели и от 9.4 до 11.7% для дозы 300 мг 1 раз в 2 недели. Скорректированная средняя разность абсолютных значений пре-бронходилатационного ОФВ1 от исходного уровня к 24-й неделе (достаточное время для достижения максимального снижения дозы пероральных ГКС) в исследовании VENTURE составила 0.22 л в группе применения препарата Дупиксент® по сравнению с плацебо, что соответствовало улучшению на 15.1% по сравнению с исходным уровнем.
Кроме того, у пациентов, получавших препарат Дупиксент®, значительно улучшился постбронходилатационный показатель ОФВ1 по сравнению с исходным уровнем на 12-й и 52-й неделях по сравнению с плацебо, что указывает на то, что препарат Дупиксент® улучшает фиксированную обструкцию дыхательных путей. В группе применения препарата Дупиксент® в течение года наблюдения не было зарегистрировано снижения функции легких с учетом значения постбронходилатационного значения ОФВ1.
Снижение дозы пероральных ГКС
В исследовании VENTURE оценивалось влияние препарата Дупиксент® на снижение применения поддерживающих пероральных ГКС. Исходная средняя доза пероральных кортикостероидов составляла 11.75 мг в группе плацебо и 10.75 мг в группе, получавшей препарат Дупиксент®. По сравнению с плацебо, у пациентов, получавших Дупиксент®, отмечалось большее снижение ежедневной дозы пероральных ГКС при сохранении контроля над астмой. Среднее общее снижение ежедневной дозы пероральных ГКС при сохранении контроля над астмой составляло 70.1% по сравнению с исходным уровнем у пациентов, получавших Дупиксент® и 41.9% в группе плацебо.
Исходы, сообщаемые пациентами
Кроме того, во всех 3 исследованиях Дупиксент® обеспечил клинически значимое улучшение показателей контроля бронхиальной астмы в общей популяции по сравнению с группой плацебо, о чем свидетельствуют показатели ACQ-5 и соответствующее улучшение качества жизни, измеренное по шкале AQLQ(S). Улучшение показателей ACQ-5 и AQLQ(S) были зарегистрированы уже через 2 недели, и это улучшение сохранялось на протяжении 24 недель в исследовании DRI12544 и 52 недель в исследовании QUEST. В общей популяции исследования QUEST доля пациентов, ответивших на лечение, что выражалось в достижении минимального клинически значимого различия показателей ACQ-5 и AQLQ(S), была существенно выше к 52-й неделе в группе, получавшей обе дозы препарата Дупиксент®.
Долгосрочное продленное исследование (TRAVERSE)
Долгосрочную эффективность препарата Дупиксент® у 2282 взрослых и подростков со среднетяжелой и тяжелой бронхиальной астмой, и у взрослых пациентов с гормонозависимой астмой, которые принимали участие в предыдущих клинических исследованиях препарата Дупиксент®, оценивали в рамках открытого продленного исследования (TRAVERSE). В данном исследовании препарата Дупиксент® улучшение клинических показателей, в т.ч. снижение количества обострений и улучшение функции легких, сохранялось в течение 96 недель. У пациентов с гормонозависимой астмой, несмотря на продолжающееся снижение или отмену пероральных ГКС, отмечалось снижение количества обострений и устойчивое улучшение функции легких в течение 96 недель.
Частота тяжелых обострений в течение 96 недель составила 0.3 и 0.27; а улучшение ОФВ1 от исходного значения — 0.33 л (21.1%) и 0.42 л (27.3%) у пациентов с уровнем эозинофилов в крови ≥150 клеток/мкл и ≥300 клеток/мкл соответственно. Аналогичное сохранение эффекта наблюдалось и по параметрам ACQ-5 и AQLQ(S). Аналогичные результаты отмечались и в подгруппе пациентов, получавших высокие дозы ингаляционных кортикостероидов.
Хронический полипозный риносинусит
Программа клинических исследований применения препарата при ХПРС включала два рандомизированных двойных слепых многоцентровых плацебо-контролируемых исследования в параллельных группах (SINUS-24 и SINUS-52) с участием 724 пациентов в возрасте 18 лет и старше, получающих базисную терапию интраназальными кортикостероидами. Эти исследования включали пациентов с тяжелым течением ХПРС, несмотря на ранее проведенное хирургическое вмешательство на придаточных пазухах носа или лечение системными кортикостероидами на протяжении последних 2 лет. В ходе исследования было разрешено лечение системными кортикостероидами или хирургическое вмешательство по решению исследователя. В исследовании SINUS-24 в общей сложности 276 пациентов были рандомизированы либо в группу Дупиксент® 300 мг (n=143), либо в группу плацебо (n=133), инъекции осуществляли 1 раз в 2 недели на протяжении 24 недель. В исследовании SINUS-52 в общей сложности 448 пациентов были рандомизированы либо в группу препарата Дупиксент® 300 мг 1 раз в 2 недели на протяжении 52 недель (n=150), либо в группу препарата Дупиксент® 300 мг 1 раз в 2 недели на протяжении 24 недель, а затем 300 мг 1 раз в 4 недели до недели 52 (n=145), либо в группу плацебо (n=153). При компьютерной томографии у всех пациентов было выявлено снижение пневматизации придаточных пазух носа, оценка проводилась по шкале Лунда-Маккея (ШЛМ) при компьютерной томографии придаточных пазух носа, при этом у 73-90% пациентов отмечалось снижение пневматизации всех придаточных пазух носа. Пациенты были стратифицированы в зависимости от наличия в анамнезе хирургических вмешательств и бронхиальной астмы/аспирин-индуцированного респираторного заболевания (АИРЗ, аспириновой астмы). Хирургическое вмешательство на придаточных пазух носа ранее выполнялось у 63% пациентов, в среднем 2.0 хирургических вмешательства, 74% участников на протяжении последних 2 лет получали системные кортикостероиды, среднее количество курсов за последние 2 года составляло 1.6. У 59% пациентов имелась сопутствующая бронхиальная астма, а у 28% — АИРЗ.
Комбинированными первичными конечными точками было изменение балла выраженности полипоза при эндоскопической риноскопии (по шкале NPS от 0 до 8 баллов) относительно исходного уровня к 24-й неделе (централизованная маскированная оценка результатов), а также изменение балла заложенности носа/назальной обструкции относительно исходного уровня к 24-й неделе (усредненный балл за 28 дней, шкала NC от 0 до 3 баллов), определяемое самим пациентом на основании ежедневных записей в дневнике. В обоих исследованиях вторичные конечные точки на 24 неделе включали изменения по сравнению с исходным уровнем таких показателей, как: балл по ШЛМ, оцененный при компьютерной томографии придаточных пазух носа (КТ ППН), количественная оценка выраженности симптомов (TSS), тест на идентификацию запахов Пенсильванского университета (UPSIT), ежедневная оценка снижения обоняния и опросник для оценки исхода болезней носа и околоносовых пазух из 22 вопросов (SNOT-22). Была выполнена обобщающая результаты двух исследований оценка уменьшения доли пациентов, которым не требовалось неотложное применение курсов системных кортикостероидов и/или хирургических вмешательств на придаточных пазухах носа, а также улучшения показателя ОФВ1 в подгруппе пациентов с бронхиальной астмой. Статистически и клинически значимая эффективность наблюдалась в отношении улучшения выраженности полипоза носа по шкале NPS на 24 неделе в SINUS-24 (скорректированная средняя разность -2.06 по сравнению с группой плацебо) и в SINUS-52 на 24 и 52 неделе с дальнейшим прогрессивным улучшением (скорректированная средняя разность -1.8 и -2.4 по сравнению с группой плацебо при терапии препаратом Дупиксент® 300 мг 1 раз в 2 недели, соответственно на 24 и 52 неделях). У пациентов, получавших препарат Дупиксент®, отмечалось значимое снижение заложенности носа/назальной обструкции по сравнению с плацебо на 24 неделе в SINUS-24 (скорректированная средняя разность -0.89 по сравнению с группой плацебо) и на 24 и 52 неделе в SINUS-52 (скорректированная средняя разность -0,87 и -0.98 по сравнению с группой плацебо при терапии препаратом Дупиксент® 300 мг 1 раз в 2 недели, соответственно на 24 и 52 неделях). В обоих исследованиях значимое улучшение в отношении заложенности носа/назальной обструкции относительно исходного уровня по шкале NC и ежедневной оценки снижения обоняния отмечалось уже при первой оценке на 4 неделе. Значимое снижение балла по ШЛМ, оцененного при КТ ППН, наблюдалось на 24 неделе в SINUS-24 (скорректированная средняя разность -7.44 по сравнению с группой плацебо) и в SINUS-52 на 24 неделе с дальнейшим улучшением к 52 неделе (скорректированная средняя разность -5.13 и -6.94 по сравнению с группой плацебо при терапии препаратом Дупиксент® 300 мг 1 раз в 2 недели, соответственно на 24 и 52 неделях). Обобщающая результаты двух исследований оценка продемонстрировала снижение доли пациентов, которым не требовалось неотложное применение курсов системных кортикостероидов, на 74%, хирургических вмешательств на придаточных пазухах носа — на 83%, при применении препарата Дупиксент® по сравнению с плацебо. В подгруппе пациентов с сопутствующей бронхиальной астмой отмечалось значимое улучшение показателей предбронходилатационного ОФВ1 на 24 неделе терапии препаратом Дупиксент® вне зависимости от исходного уровня эозинофилов: скорректированная средняя разность от исходного уровня ОФВ1 на 24 неделе для дозы препарата Дупиксент® 300 мг 1 раз в 2 недели составила 0.14 л против -0.07 л в группе плацебо, разность 0.21 л. Эффективность в отношении первичных конечных точек — изменения балла выраженности полипоза по шкале NPS и изменение балла заложенности носа/назальной обструкции по шкале NC относительно исходного уровня к 24-й неделе — и ключевой вторичной конечной точки (балл по ШЛМ, оцененный при КТ ППН) в подгруппах пациентов с сопутствующей бронхиальной астмой или АИРЗ была схожей с общей популяцией пациентов с хроническим полипозным риносинуситом.
Фармакокинетика
Фармакокинетика дупилумаба аналогична у пациентов с атопическим дерматитом, бронхиальной астмой и хроническим полипозным риносинуситом.
Всасывание
После однократного п/к введения 75-600 мг дупилумаба медиана времени достижения Cmax в сыворотке крови (Tmax) составляла 3-7 дней. Абсолютная биодоступность дупилумаба после введения п/к дозы сходна между пациентами с атопическим дерматитом, бронхиальной астмой и хроническим полипозным риносинуситом и составляет 61-64% (установлена при популяционном фармакокинетическом анализе).
Введение однократной нагрузочной дозы в первый день приводит к быстрому достижению клинически эффективных концентраций в течение 2 недель.
При схеме лечения 200 мг или 300 мг 1 раз в 2 недели, начиная с нагрузочной дозы 400 мг или 600 мг, Css дупилумаба обычно достигаются в среднем к 16-й неделе лечения. В состоянии достижения Css средняя остаточная концентрация перед введением следующей дозы составляла 39 мг/л при применении 200 мг 1 раз в 2 недели и 70-80 мг/л при применении 300 мг 1 раз в 2 недели.
При еженедельном п/к введении 300 мг препарата Дупиксент®, начиная с нагрузочной дозы 600 мг, Css обычно достигаются в среднем после 13 недель лечения. В состоянии достижения Css средняя остаточная концентрация перед введением следующей дозы составляла 189 мг/л.
Линейность дозы
Из-за нелинейности клиренса системная экспозиция дупилумаба, определяемая по AUC, увеличивается быстрее, непропорционально увеличению дозы после однократного п/к введения препарата в дозах от 75 мг до 600 мг.
Распределение
Vd дупилумаба составляет приблизительно 4.6 л, что указывает на его распределение главным образом в сосудистой системе.
Метаболизм
Поскольку дупилумаб является белком, специальных исследований его метаболизма не проводилось. Предполагается, что дупилумаб расщепляется до низкомолекулярных пептидов и отдельных аминокислот.
Выведение
Выведение дупилумаба осуществляется параллельно линейными и нелинейными путями. При более высоких концентрациях выведение дупилумаба осуществляется главным образом через ненасыщаемый протеолитический путь, в то время как при более низких концентрациях выведение препарата преимущественно осуществляется через нелинейное насыщаемое связывание с мишенью IL-4Rα.
После введения последней дозы в состоянии равновесной концентрации медиана времени до неопределяемых концентраций дупилумаба, составляет 9 недель при введении 200 мг 1 раз в 2 недели, 10-12 недель при введении 300 мг 1 раз в 2 недели и 13 недель при введении 300 мг 1 раз в неделю.
Фармакокинетика у особых групп пациентов
Пол пациента не влиял на фармакокинетические показатели препарата Дупиксент®.
Возраст пациентов не влиял на фармакокинетические показатели препарата Дупиксент®.
Пациенты пожилого возраста. По данным популяционного анализа фармакокинетических показателей возраст пациентов не влиял на эффективность и безопасность препарата Дупиксент®.
Пациенты детского возраста. Безопасность и эффективность препарата Дупиксент® были установлены у пациентов в возрасте 6 лет и старше со среднетяжелым и тяжелым атопическим дерматитом. Безопасность и эффективность у детей, подростков и взрослых были сопоставимы. Безопасность и эффективность у детей в возрасте младше 6 лет с атопическим дерматитом не изучена.
Бронхиальная астма. Долгосрочную безопасность и эффективность препарата Дупиксент® оценивали у 89 пациентов подросткового возраста со среднетяжелой и тяжелой бронхиальной астмой, которые были включены в открытое продленное исследование (TRAVERSE). В исследовании наблюдение продолжалось в течение 96 недель, что составило 99 пациенто-лет кумулятивного воздействия препарата Дупиксент®. Профиль безопасности препарата Дупиксент® в исследовании TRAVERSE соответствовал профилю безопасности, зарегистрированному в базовых исследованиях по лечению астмы в течение 52 недель терапии. Дополнительных нежелательных реакций выявлено не было. В этом исследовании клиническая польза препарата Дупиксент®, включая уменьшение количества обострений и улучшение функции легких, наблюдаемое в базовых исследованиях лечения пациентов с астмой, сохранялась до 96-й недели.
Безопасность и эффективность препарата у детей младше 12 лет с бронхиальной астмой не изучалась. Профиль нежелательных реакций у подростков сопоставим с таковым у взрослых (см. раздел «Побочное действие»).
Хронический полипозный риносинусит. Обычно хронический полипозный риносинусит не встречается у детей. Фармакокинетика дупилумаба не изучалась у детей (пациентов младше 18 лет) с хроническим полипозным риносинуситом.
Расовая принадлежность. Согласно результатам популяционного фармакокинетического анализа расовая принадлежность не влияла на фармакокинетические показатели препарата Дупиксент®.
Печеночная недостаточность. Дупилумаб представляет собой моноклональное антитело, поэтому не ожидается, что он подвергается значительной печеночной элиминации. Клинические исследования для оценки влияния печеночной недостаточности на фармакокинетику дупилумаба не проводились.
Почечная недостаточность. Дупилумаб представляет собой моноклональное антитело, поэтому не ожидается, что он подвергается значительной почечной элиминации. Клинические исследования для оценки влияния почечной недостаточности на фармакокинетику дупилумаба не проводились. Результаты популяционных фармакокинетических анализов показали, что нарушение функции почек легкой и средней степени тяжести существенным образом не влияет на системную экспозицию дупилумаба. Нет данных о применении дупилумаба у пациентов с тяжелой почечной недостаточностью.
Масса тела. Не требуется коррекции режима дозирования в зависимости от массы тела для пациентов с бронхиальной астмой в возрасте старше 12 лет и взрослых пациентов с атопическим дерматитом.
Для пациентов в возрасте 6-17 лет с атопическим дерматитом рекомендованная доза 300 мг каждые 4 недели (с массой тела 15-<30 кг), 200 мг каждые 2 недели (с массой тела 30-<60 кг) и 300 мг каждые две недели (с массой тела более 60 кг).
Показания препарата
Дупиксент®
- атопический дерматит среднетяжелого и тяжелого течения у пациентов от 6 лет и старше при недостаточном ответе на терапию топическими лекарственными препаратами или в случае, когда такие препараты не рекомендованы к применению. Препарат Дупиксент® может применяться в монотерапии или одновременно с топическими лекарственными препаратами;
- в качестве дополнительной поддерживающей терапии бронхиальной астмы среднетяжелого и тяжелого течения у пациентов в возрасте 12 лет и старше с эозинофильным фенотипом или у пациентов с гормональнозависимой бронхиальной астмой, получающих пероральные ГКС;
- в качестве дополнительной поддерживающей терапии взрослых пациентов с плохо контролируемым тяжелым хроническим полипозным риносинуситом.
Режим дозирования
Препарат Дупиксент® вводят п/к.
Атопический дерматит
Рекомендуемая доза препарата Дупиксент® у взрослых пациентов:
- начальная доза — 600 мг (2 инъекции по 300 мг), далее — по 300 мг каждые 2 недели. В зависимости от индивидуального терапевтического ответа доза может быть увеличена до 300 мг еженедельно.
Рекомендуемая доза препарата Дупиксент® у пациентов в возрасте 6-17 лет:
- для пациентов с массой тела от 15 до <30 кг: начальная доза – 600 мг (2 инъекции по 300 мг), далее по 300 мг каждые 4 недели;
- для пациентов с массой тела от 30 до <60 кг: начальная доза — 400 мг (2 инъекции по 200 мг), далее по 200 мг каждые 2 недели;
- для пациентов с массой тела 60 кг и более: начальная доза — 600 мг (2 инъекции по 300 мг), далее по 300 мг каждые 2 недели.
Бронхиальная астма
Рекомендуемая доза препарата Дупиксент® у взрослых пациентов и детей (12 лет и старше):
- начальная доза — 400 мг (2 инъекции по 200 мг), далее — по 200 мг каждые 2 недели. В зависимости от индивидуального терапевтического ответа доза может быть увеличена до 300 мг каждые 2 недели;
- начальная доза — 600 мг (2 инъекции по 300 мг), далее — по 300 мг каждые 2 недели для пациентов с глюкокортикостероидозависимой бронхиальной астмой или сопутствующим среднетяжелым или тяжелым атопическим дерматитом, при котором показано применение препарата Дупиксент®.
Хронический полипозный риносинусит
В случае пропуска дозы пациент должен получить инъекцию как можно скорее и затем продолжить лечение в соответствии с назначенным ему режимом введения препарата.
Особые группы пациентов
Безопасность и эффективность препарата Дупиксент® у детей до 6 лет и подростков с атопическим дерматитом, бронхиальной астмой и у пациентов с хроническим полипозным риносинуситом младше 18 лет не установлена.
У пациентов пожилого возраста коррекции дозы не требуется.
Отсутствуют данные по применению препарата у пациентов с печеночной недостаточностью.
У пациентов с легкой или средней степенью тяжести почечной недостаточности коррекции дозы не требуется. Отсутствуют данные по применению препарата у пациентов с тяжелой почечной недостаточностью.
Не требуется коррекции режима дозирования в зависимости от массы тела для пациентов с бронхиальной астмой старше 12 лет и взрослых пациентов с атопическим дерматитом и хроническим полипозным риносинуситом.
Для пациентов 6-17 лет с атопическим дерматитом рекомендованная доза 300 мг каждые 4 недели (с массой тела 15-<30 кг), 200 мг каждые 2 недели (с массой тела 30-<60 кг) и 300 мг каждые 2 недели (с массой тела более 60 кг).
Способ применения
Перед введением препарата следует осмотреть его на предмет наличия в растворе твердых частиц или появления нехарактерной окраски раствора. Если в препарате содержатся твердые частицы или у раствора появилась нехарактерная окраска, вводить препарат нельзя.
Раствор в предварительно заполненном шприце с системой защиты или предварительно заполненном шприце перед проведением инъекции препарата Дупиксент® должен нагреться до комнатной температуры. Для этого рекомендуется выдержать его при комнатной температуре в течение 45 мин (для дозировки 300 мг) или 30 мин (для дозировки 200 мг).
В случае необходимости предварительно заполненный шприц можно хранить при комнатной температуре (до 25°С) в течение максимум 14 дней. Препарат нельзя хранить при температуре выше 25°С. После извлечения из холодильника Дупиксент® следует использовать в течение 14 дней или утилизировать.
Шприцы следует защищать от нагревания и воздействия прямого солнечного света.
Если начальная доза составляет 600 мг, следует сделать две инъекции по 300 мг в разные места для инъекций.
Если начальная доза составляет 400 мг, следует сделать две инъекции по 200 мг в разные места для инъекций.
Лечение препаратом Дупиксент® следует проводить под медицинским наблюдением. Инъекцию препарата может делать себе либо сам пациент, либо лицо, ухаживающее за ним.
Необходимо до начала применения препарата Дупиксент® обучить пациентов и/или ухаживающих за ними лиц подготовке и проведению инъекции препарата Дупиксент®, согласно указаниям в «Инструкции по подготовке и проведению инъекции препарата Дупиксент®, 300 мг в предварительно заполненном одноразовом шприце с системой защиты», «Инструкции по подготовке и проведению инъекции препарата Дупиксент®, 300 мг в предварительно заполненном одноразовом шприце» и «Инструкции по подготовке и проведению инъекции препарата Дупиксент®, 200 мг в предварительно заполненном одноразовом шприце с системой защиты».
Препарат Дупиксент® может вводиться самим пациентом п/к с помощью предварительно заполненного одноразового шприца в область бедра или живота, за исключением области диаметром 5 см непосредственно вокруг пупка. Если инъекцию проводит другой человек, препарат также можно вводить в верхнюю часть плеча.
Рекомендуется менять места инъекций при каждом введении препарата.
Инъекцию препарата Дупиксент® не следует проводить в участки с болезненной и поврежденной кожей, в места с кровоподтеками или рубцами.
Все остатки неиспользованного препарата и расходные материалы необходимо утилизировать в соответствии с требованиями местного законодательства.
Инструкция по подготовке и проведению инъекции препарата Дупиксент® 300 мг в предварительно заполненном одноразовом шприце с системой защиты
Перед началом применения препарата Дупиксент® в предварительно заполненном одноразовом шприце с системой защиты внимательно прочитайте эту инструкцию.
Элементы предварительно заполненного одноразового шприца с системой защиты показаны на рисунке ниже:
Данное устройство представляет собой предварительно заполненный одноразовый шприц с системой защиты (далее называется «шприц»). В нем содержится раствор для п/к введения, содержащий 300 мг препарата Дупиксент®.
Важная информация
- Не пытайтесь провести инъекцию самостоятельно или с помощью кого-то до тех пор, пока лечащий врач или медицинский работник не обучат Вас правильной технике проведения подкожной инъекции.
- Перед использованием шприца внимательно прочитайте информацию по его использованию.
- Узнайте у своего лечащего врача, как часто необходимо проводить инъекции препарата Дупиксент®.
- Попросите своего лечащего врача или медицинского работника показать, как правильно пользоваться шприцем, перед тем как в первый раз самостоятельно провести инъекцию препарата Дупиксент®.
- Рекомендуется менять место инъекции при каждом введении препарата.
- Не используйте шприц, если он упал на твердую поверхность или поврежден.
- Нельзя использовать шприц, если отсутствует колпачок иглы, или он не был надежно зафиксирован.
- Не дотрагивайтесь до штока поршня до тех пор, пока не будете готовы провести инъекцию.
- Не проводите инъекции через одежду.
- Не пытайтесь удалить воздушные пузырьки из шприца.
- Для того чтобы снизить риск случайного укола иглой, каждый предварительно заполненный одноразовый шприц оборудован устройством безопасности с системой защиты, которое автоматически активируется, закрывая иглу, после того, как проведена инъекция.
- Не тяните шток поршня назад.
- Шприц не подлежит повторному использованию.
Как хранить шприц
- Храните шприцы в недоступном для детей месте.
- Храните неиспользуемые шприцы в оригинальной картонной упаковке в холодильнике при температуре от 2°C до 8°C.
- После извлечения из холодильника шприц следует оставить на 45 мин при комнатной температуре и дать возможность ему нагреться перед тем, как делать инъекцию препарата Дупиксент®.
- Шприцы можно хранить при комнатной температуре в течение не более чем 14 дней.
- Не встряхивайте шприц.
- Не подвергайте шприц тепловому воздействию.
- Не замораживайте шприц.
- Не допускайте воздействия на шприц прямых солнечных лучей.
Шаг 1. Извлечение шприца из упаковки
Извлеките шприц из картонной упаковки, взяв его за середину корпуса.
Не снимайте колпачок иглы до момента проведения инъекции.
Нельзя использовать шприц, если он упал на твердую поверхность или поврежден.
Шаг 2. Подготовка
Убедитесь, что в наличии есть все необходимое для проведения инъекции:
- предварительно заполненный шприц;
- 1 салфетка, смоченная спиртом*;
- 1 ватный тампон или марлевая салфетка*;
- устойчивый к проколам контейнер* (см. Шаг 12).
* Не содержатся в картонной упаковке.
Внимательно проверьте маркировку:
- проверьте дату истечения срока годности;
- убедитесь в том, что у Вас правильный препарат и правильная доза.
Нельзя использовать шприц после истечения срока годности, указанного на этикетке.
Шаг 3. Проверка
Осмотрите раствор через смотровое окно на шприце: проверьте, является ли раствор прозрачным, является ли жидкость бесцветной или имеющей светло-желтый оттенок.
Примечание: Вы можете обнаружить воздушные пузырьки, это нормально.
Нельзя использовать шприц, если жидкость изменила цвет или помутнела, или если в ней есть заметные хлопья или частицы.
Шаг 4. Подождите 45 мин
Положите шприц на плоскую поверхность не менее чем на 45 мин, пусть шприц нагреется до комнатной температуры.
Не нагревайте шприц.
Не подвергайте шприц прямому воздействию солнечных лучей.
Шприц нельзя хранить при комнатной температуре более 14 дней.
Шаг 5. Выбор места инъекции
Выберите место инъекции
- Вы можете сделать инъекцию в наружную поверхность бедра или в переднюю часть живота, за исключением области диаметром 5 см непосредственно вокруг пупка;
- Если инъекцию осуществляет другой человек, для инъекции также можно использовать участок кожи в верхней части плеча.
Инъекции препарата Дупиксент® не следует осуществлять на участках с болезненной или поврежденной кожей, кровоподтеками или рубцами.
Шаг 6. Обработка места инъекции
- Вымойте руки.
- Протрите участок кожи, предназначенный для инъекции салфеткой, смоченной спиртом.
- Дайте коже высохнуть перед проведением инъекции.
Не дотрагивайтесь до обработанного участка кожи руками и не дуйте на него перед проведением инъекции.
Шаг 7. Удаление колпачка иглы
Держите шприц за середину корпуса, игла должна быть направлена в сторону от Вас; снимите колпачок с иглы.
Не надевайте колпачок обратно на иглу.
Не касайтесь иглы.
Лекарственный препарат необходимо ввести сразу же после удаления колпачка иглы.
Шаг 8. Формирование складки кожи
Сформируйте складку кожи в месте инъекции, как показано на рисунке.
Шаг 9. Введение иглы
Полностью введите иглу в сформированную складку кожи под углом приблизительно 45°.
Шаг 10. Введение раствора
Ослабьте сформированную складку кожи.
Медленно и непрерывно нажимайте на шток поршня для введения всего раствора, пока шприц не опустеет.
Примечание: Вы почувствуете некоторое сопротивление. Это нормально.
Шаг 11. Завершение инъекции и извлечение иглы
Поднимите большой палец, снимая давление со штока поршня, игла будет втянута внутрь защитного колпачка для иглы; затем удалите шприц из места инъекции.
Слегка прижмите ватный тампон или марлевую салфетку к месту инъекции, если заметите кровь.
Не надевайте колпачок иглы снова на иглу.
Не растирайте кожу после инъекции.
Шаг 12. Утилизация
После использования следует поместить шприц и колпачок иглы в устойчивый к проколам контейнер.
Не надевайте колпачок иглы снова на иглу.
Храните контейнер в недоступном для детей месте.
Инструкция по подготовке и проведению инъекции препарата Дупиксент® 300 мг в предварительно заполненном одноразовом шприце
Перед началом применения препарата Дупиксент® в предварительно заполненном одноразовом шприце внимательно прочитайте эту инструкцию.
Элементы предварительно заполненного шприца показаны на рисунке ниже:
*Шприц может иметь твердый или мягкий колпачок иглы
Данное устройство представляет собой предварительно заполненный одноразовый шприц (далее называется «шприц»). В нем содержится раствор для подкожного введения, содержащий 300 мг препарата Дупиксент®.
Важная информация
- Не пытайтесь провести инъекцию самостоятельно или с помощью кого-то до тех пор, пока лечащий врач или медицинский работник не обучат Вас правильной технике проведения подкожной инъекции.
- Перед использованием шприца внимательно прочитайте информацию по его использованию.
- Узнайте у своего лечащего врача, как часто Вам необходимо проводить инъекции препарата Дупиксент®.
- Попросите своего лечащего врача или медицинского работника показать, как правильно пользоваться шприцем, перед тем как в первый раз самостоятельно провести инъекцию препарата Дупиксент®.
- Рекомендуется менять место инъекции при каждом введении препарата.
- Не используйте шприц, если он поврежден.
- Нельзя использовать шприц, если отсутствует колпачок иглы или он не был надежно зафиксирован.
- Не дотрагивайтесь до штока поршня до тех пор, пока Вы не будете готовы провести инъекцию.
- Не проводите инъекции через одежду.
- Не пытайтесь удалить воздушные пузырьки из шприца.
- Не тяните шток поршня назад.
- Шприц не подлежит повторному использованию.
Как хранить шприц
- Храните шприцы в недоступном для детей месте.
- Храните неиспользуемые шприцы в оригинальной картонной упаковке в холодильнике при температуре от 2°C до 8°C.
- После извлечения из холодильника шприц следует оставить на 45 мин при комнатной температуре и дать возможность ему нагреться перед тем, как проводить инъекцию препарата Дупиксент®.
- Шприцы можно хранить при комнатной температуре в течение не более чем 14 дней.
- Не встряхивайте шприц.
- Не подвергайте шприц тепловому воздействию;
- Не замораживайте шприц.
- Не допускайте воздействия на шприц прямых солнечных лучей.
Шаг 1. Извлечение шприца из упаковки
Извлеките шприц из картонной упаковки, взяв его за середину корпуса.
Не снимайте колпачок иглы до момента проведения инъекции.
Нельзя использовать шприц, если он был поврежден.
Шаг 2. Подготовка
Убедитесь, что у Вас есть все необходимое для проведения инъекции:
- предварительно заполненный шприц;
- 1 салфетка, смоченная спиртом*;
- 1 ватный тампон или марлевая салфетка*;
- устойчивый к проколам контейнер* (см. Шаг 12).
* Не содержатся в картонной упаковке.
Внимательно проверьте маркировку:
- проверьте дату истечения срока годности;
- убедитесь в том, что у Вас правильный препарат и правильная доза.
Нельзя использовать шприц после истечения срока годности, указанного на этикетке.
Шаг 3. Проверка
Осмотрите раствор в шприце: проверьте, является ли раствор прозрачным, является ли жидкость бесцветной или имеющей светло-желтый оттенок.
Примечание: Вы можете обнаружить воздушные пузырьки, это нормально.
Нельзя использовать шприц, если жидкость изменила цвет или помутнела, или если в ней есть заметные хлопья или частицы.
Шаг 4. Подождите 45 мин
Положите шприц на плоскую поверхность не менее чем на 45 мин; пусть шприц нагреется до комнатной температуры.
Не нагревайте шприц.
Не подвергайте шприц прямому воздействию солнечных лучей.
Шприц нельзя хранить при комнатной температуре более 14 дней.
Шаг 5. Выбор места инъекции
Выберите место инъекции.
- Вы можете сделать инъекцию в наружную поверхность бедра или в переднюю часть живота, за исключением области диаметром 5 см непосредственно вокруг пупка.
- Если инъекцию осуществляет другой человек, для инъекции также можно использовать участок кожи в верхней части плеча.
Инъекции препарата Дупиксент® не следует осуществлять на участках с болезненной или поврежденной кожей, кровоподтеками или рубцами.
Этап 6. Обработка участка инъекции
- Вымойте руки.
- Протрите участок кожи, предназначенный для инъекции салфеткой, смоченной спиртом.
- Дайте коже высохнуть перед проведением инъекции.
- Не дотрагивайтесь до обработанного участка кожи руками и не дуйте на него перед проведением инъекции.
Шаг 7. Удаление колпачка иглы
Держите шприц за середину корпуса, игла должна быть направлена в сторону от Вас; снимите колпачок иглы.
Не надевайте колпачок иглы обратно на иглу.
Не касайтесь иглы.
Лекарственный препарат необходимо ввести сразу же после удаления колпачка иглы.
Шаг 8. Формирование складки кожи
Сформируйте складку кожи на участке инъекции, как показано на рисунке.
Шаг 9. Введение иглы
Полностью введите иглу в сформированную складку под углом приблизительно 45°.
Шаг 10. Введение раствора
Ослабьте сформированную складку кожи.
Медленно и непрерывно нажимайте на шток поршня для введения всего раствора, пока шприц не опустеет.
Примечание: Вы почувствуете некоторое сопротивление. Это нормально.
Шаг 11. Извлечение иглы
Извлеките иглу из кожи под тем же углом, под которым она была введена.
Не надевайте колпачок иглы снова на иглу.
Слегка прижмите ватный тампон или марлевую салфетку к месту инъекции, если Вы заметите кровь.
Не растирайте кожу после инъекции.
Шаг 12. Утилизация
После использования следует поместить шприц и колпачок иглы в устойчивый к проколам контейнер.
Не надевайте колпачок иглы снова на иглу.
Храните контейнер в недоступном для детей месте.
Инструкция по подготовке и проведению инъекции препарата Дупиксент® 200 мг в предварительно заполненном одноразовом шприце с системой защиты
Перед началом применения препарата Дупиксент® в предварительно заполненном одноразовом шприце с системой защиты внимательно прочитайте эту инструкцию.
Элементы предварительно заполненного одноразового шприца с системой защиты показаны на рисунке ниже:
Данное устройство представляет собой предварительно заполненный одноразовый шприц с системой защиты (далее называется «шприц»). В нем содержится раствор для подкожного введения, содержащий 200 мг препарата Дупиксент®.
Важная информация
- Не пытайтесь провести инъекцию самостоятельно или с помощью кого-то до тех пор, пока лечащий врач или медицинский работник не обучат Вас правильной технике проведения подкожной инъекции.
- Перед использованием шприца внимательно прочитайте информацию по его использованию.
- Узнайте у своего лечащего врача, как часто Вам необходимо проводить инъекции препарата Дупиксент®.
- Попросите своего лечащего врача или медицинского работника показать, как правильно пользоваться шприцем, перед тем как в первый раз самостоятельно провести инъекцию препарата Дупиксент®.
- Рекомендуется менять место инъекции при каждом введении препарата.
- Не используйте шприц, если он упал на твердую поверхность или поврежден.
- Нельзя использовать шприц, если отсутствует колпачок иглы, или он не был надежно зафиксирован.
- Не дотрагивайтесь до штока поршня до тех пор, пока вы не будете готовы провести инъекцию.
- Не проводите инъекции через одежду.
- Не пытайтесь удалить воздушные пузырьки из шприца.
- Для того чтобы снизить риск случайного укола иглой, каждый предварительно заполненный одноразовый шприц оборудован устройством безопасности с системой защиты, которое автоматически активируется, закрывая иглу, после того, как Вы провели инъекцию.
- Не тяните шток поршня назад.
- Шприц не подлежит повторному использованию.
Как хранить шприц
- Храните шприцы в недоступном для детей месте.
- Храните неиспользуемые шприцы в оригинальной картонной упаковке в холодильнике при температуре от 2°C до 8°C.
- После извлечения из холодильника шприц следует оставить на 30 мин при комнатной температуре и дать возможность ему нагреться перед тем, как делать инъекцию препарата Дупиксент®.
- Шприцы можно хранить при комнатной температуре в течение не более чем 14 дней.
- Не встряхивайте шприц.
- Не подвергайте шприц тепловому воздействию.
- Не замораживайте шприц.
- Не допускайте воздействия на шприц прямых солнечных лучей.
Шаг 1. Извлечение шприца из упаковки
Извлеките шприц из картонной упаковки, взяв его за середину корпуса.
Не снимайте колпачок иглы до момента проведения инъекции.
Нельзя использовать шприц, если он упал на твердую поверхность или поврежден.
Шаг 2. Подготовка
Убедитесь, что у Вас есть все необходимое для проведения инъекции:
- предварительно заполненный шприц;
- 1 салфетка, смоченная спиртом*;
- 1 ватный тампон или марлевая салфетка*;
- устойчивый к проколам контейнер* (см. Шаг 12).
* Не содержатся в картонной упаковке.
Внимательно проверьте маркировку:
- проверьте дату истечения срока годности;
- убедитесь в том, что у Вас правильный препарат и правильная доза.
Нельзя использовать шприц после истечения срока годности, указанного на этикетке.
Шаг 3. Проверка
Осмотрите раствор через смотровое окно на шприце: проверьте, является ли раствор прозрачным, является ли жидкость бесцветной или имеющей светло-желтый оттенок.
Примечание: Вы можете обнаружить воздушные пузырьки, это нормально.
Нельзя использовать шприц, если жидкость изменила цвет или помутнела, или если в ней есть заметные хлопья или частицы.
Шаг 4. Подождите 30 мин
Положите шприц на плоскую поверхность не менее чем на 30 мин; пусть шприц нагреется до комнатной температуры.
Не нагревайте шприц.
Не подвергайте шприц прямому воздействию солнечных лучей.
Шприц нельзя хранить при комнатной температуре более 14 дней.
Шаг 5. Выбор места инъекции
Выберите место инъекции.
- Вы можете сделать инъекцию в наружную поверхность бедра или в переднюю часть живота, за исключением области диаметром 5 см непосредственно вокруг пупка.
- Если инъекцию осуществляет другой человек, для инъекции также можно использовать участок кожи в верхней части плеча.
Инъекции препарата Дупиксент® не следует осуществлять на участках с болезненной или поврежденной кожей, кровоподтеками или рубцами.
Шаг 6. Обработка места инъекции
- Вымойте руки.
- Протрите участок кожи, предназначенный для инъекции салфеткой, смоченной спиртом.
- Дайте коже высохнуть перед проведением инъекции.
- Не дотрагивайтесь до обработанного участка кожи руками и не дуйте на него перед проведением инъекции.
Шаг 7. Удаление колпачка иглы
Держите шприц за середину корпуса, игла должна быть направлена в сторону от Вас; снимите колпачок с иглы.
Не надевайте колпачок обратно на иглу.
Не касайтесь иглы.
Лекарственный препарат необходимо ввести сразу же после удаления колпачка иглы.
Шаг 8. Формирование складки кожи
Сформируйте складку кожи в месте инъекции, как показано на рисунке.
Шаг 9. Введение иглы
Полностью введите иглу в сформированную складку кожи под углом приблизительно 45°.
Шаг 10. Введение раствора
Ослабьте сформированную складку кожи.
Медленно и непрерывно нажимайте на шток поршня для введения всего раствора, пока шприц не опустеет.
Примечание: Вы почувствуете некоторое сопротивление. Это нормально.
Шаг 11. Завершение инъекции и извлечение иглы
Поднимите большой палец, снимая давление со штока поршня, игла будет втянута внутрь защитного колпачка для иглы, а затем удалите шприц из места инъекции.
Слегка прижмите ватный тампон или марлевую салфетку к месту инъекции, если Вы заметите кровь.
Не надевайте колпачок иглы снова на иглу.
Не растирайте кожу после инъекции.
Шаг 12. Утилизация
После использования следует поместить шприц и колпачок иглы в устойчивый к проколам контейнер.
Не надевайте колпачок иглы снова на иглу.
Храните контейнер в недоступном для детей месте.
Побочное действие
Атопический дерматит
Для описания частоты встречаемости нежелательных реакций используется следующая классификация: очень часто (≥10%); часто (≥1% и <10%); нечасто (≥0.1% и <1%); редко (≥0.01% и <0.1%); очень редко (<0.01%); частота неизвестна (невозможно определить по имеющимся данным частоту встречаемости нежелательной реакции).
Таблица 1. Нежелательные реакции, наблюдавшиеся в клинических исследованиях у пациентов с атопическим дерматитомa
* Пострегистрационные данные.
a Объединенные данные плацебо-контролируемых клинических исследований с проведением монотерапии (SOLO1, SOLO2 и исследования по подбору доз 2 фазы) и плацебо-контролируемого исследования CHRONOS с одновременным применением топических ГКС для лечения атопического дерматита; пациенты получали препарат в дозе 300 мг 1 раз в 2 недели и 300 мг 1 раз в неделю с или без топических ГКС в течение 16 недель.
b В клинических исследованиях случаи с герпетическими инфекциями (Herpes simplex) проявлялись поражениями кожи и слизистых оболочек, обычно были легкой или средней степени тяжести и не включали герпетическую экзему. О случаях герпетической экземы сообщалось отдельно, частота таких случаев была ниже у пациентов, получавших препарат Дупиксент®, по сравнению с группой плацебо.
Подростки в возрасте от 12 до 17 лет
Безопасность применения препарата Дупиксент® была оценена в исследовании с 250 пациентами в возрасте от 12 до 17 лет с атопическим дерматитом среднетяжелого и тяжелого течения (AD-1526). Профиль безопасности в течение 16 недель был сопоставим с профилем безопасности взрослых пациентов, принимавших участие в исследованиях.
Безопасность при длительном применении препарата Дупиксент® была оценена в долгосрочном открытом продолженном исследовании с участием пациентов в возрасте 12-17 лет с атопическим дерматитом среднетяжелого и тяжелого течения (AD-1434). Профиль безопасности в течение 52 недель был сравним с профилем безопасности пациентов, принимавших участие в 16-недельном исследовании (AD-1526). Профиль безопасности при длительном применении препарата Дупиксент® подростками соответствовал таковому у взрослых пациентов. Профиль безопасности комбинированного лечения препаратом Дупиксент® в сочетании с топическими ГКС в течение 52 недель соответствует профилю его безопасности, наблюдавшемуся к 16-й неделе.
Дети в возрасте от 6 до 11 лет
Безопасность препарата Дупиксент® изучали в исследовании при участии 367 пациентов в возрасте от 6 до 11 лет с тяжелым атопическим дерматитом (AD-1652). Профиль безопасности препарата Дупиксент® в сочетании с топическими ГКС у этих пациентов, наблюдение за которыми вели до 16 недели включительно, оказался сопоставимым с профилем безопасности препарата в исследованиях с участием взрослых пациентов и подростков с атопическим дерматитом.
Долгосрочная безопасность препарата Дупиксент® в сочетании с топическими ГКС оценивали в открытом продолженном исследовании у 368 пациентов в возрасте от 6 до 11 лет с атопическим дерматитом (AD-1434). На момент включения в исследование AD-1434 у 110 (29.9%) пациентов был среднетяжелый атопический дерматит, а у 72 (19.6%) пациентов был тяжелый атопический дерматит. Профиль безопасности препарата Дупиксент® в сочетании с топическими ГКС у пациентов, наблюдение за которыми вели в течение 52 недель, был схожим с профилем безопасности, установленным на 16 неделе в исследовании AD-1652. Долгосрочный профиль безопасности препарата Дупиксент® в сочетании с топическими ГКС у детей был сопоставим с таковым у взрослых пациентов и подростков с атопическим дерматитом.
Бронхиальная астма
Таблица 2. Нежелательные реакции, наблюдавшиеся в клинических исследованиях у пациентов с бронхиальной астмой
* Пострегистрационные данные.
Долгосрочную безопасность препарата Дупиксент® оценивали в открытом продленном исследовании с участием 2282 пациентов в возрасте от 12 лет и старше со среднетяжелой и тяжелой бронхиальной астмой (TRAVERSE). В этом исследовании наблюдение продолжалось в течение 96 недель, что составило 3169 пациенто-лет кумулятивного воздействия препарата Дупиксент®. Профиль безопасности препарата Дупиксент® в исследовании TRAVERSE соответствовал профилю безопасности, зарегистрированному в базовых исследованиях по лечению астмы в течение 52 недель. Не было выявлено дополнительных нежелательных реакций.
Хронический полипозный риносинусит
Таблица 3. Нежелательные реакции, наблюдавшиеся в клинических исследованиях у пациентов с хроническим полипозным риносинуситом
* Пострегистрационные данные.
Описание отдельных нежелательных реакций
Явления, связанные с конъюнктивитом и кератитом
Конъюнктивит и кератит чаще всего наблюдались у пациентов с атопическим дерматитом, получавших препарат Дупиксент®. У большинства пациентов конъюнктивит или кератит разрешался полностью или частично в течение периода лечения. Среди пациентов с астмой частота конъюнктивита и кератита была низкой и сходной между группами, получавшим препарат Дупиксент® и плацебо. У пациентов с хроническим полипозным риносинуситом частота конъюнктивита была низкой, хотя частота в группе, получавших препарат Дупиксент® была выше, чем в группе плацебо. В программе клинических исследований у пациентов с хроническим полипозным риносинуситом не было зарегистрировано ни одного случая кератита (см. раздел «Особые указания»).
Герпетическая экзема и Herpes zoster
В клинических исследованиях у пациентов с атопическим дерматитом частота герпетической экземы была схожей в группах, получающих препарат Дупиксент® и в группе плацебо. По данным 16-недельных исследований монотерапии Herpes zoster был зарегистрирован в <0.1% случаев в группе, получающей Дупиксент® (<1 на 100 пациенто-лет) и <1% в группе плацебо (1 на 100 пациенто-лет). В 52-недельном клиническом исследовании с одновременным применением топических ГКС (CHRONOS) Herpes zoster был зарегистрирован в 1% случаев в группе, получающей Дупиксент® + топические ГКС (1 на 100 пациенто-лет) и в 2% в группе плацебо (2 на 100 пациенто-лет). В клинических исследованиях у пациентов с бронхиальной астмой частота Herpes zoster была схожей в группах, получающих препарат Дупиксент® или плацебо.
Гиперчувствительность
Сообщалось о реакциях гиперчувствительности, включая анафилаксию и сывороточную болезнь или реакциях, подобных сывороточной болезни (см. разделы «Противопоказания» и «Особые указания»).
Эозинофилы
У пациентов, получавших препарат Дупиксент®, наблюдалось более высокое среднее начальное увеличение от исходного уровня эозинофилов по сравнению с пациентами, получавшими плацебо. Количество эозинофилов снижалось почти до базовых уровней во время исследования. В рамках открытого продленного исследования у пациентов с бронхиальной астмой количество эозинофилов продолжало снижаться ниже исходного уровня.
Частота эозинофилии, вызванной лечением (≥500 клеток/мкл), была сходной в группах пациентов, получавших препарат Дупиксент® и плацебо. Эозинофилия, вызванная лечением (≥5000 клеток/мкл), была зарегистрирована менее чем у 2% пациентов, получавших препарат Дупиксент®, и менее чем у 0.5% пациентов, получавших плацебо.
Инфекции
Количество серьезных инфекций у пациентов с атопическим дерматитом, бронхиальной астмой и хроническим полипозным риносинуситом было сопоставимо у пациентов, принимавших Дупиксент® и плацебо.
В первичных исследованиях безопасности клинических исследованиях пациентов с атопическим дерматитом не наблюдалось увеличения общей частоты инфекций или серьезных инфекций во время лечения препаратом Дупиксент® по сравнению с плацебо. В 16-недельных первичных клинических исследованиях безопасности, в которых проводилась монотерапия препаратом Дупиксент®, были зарегистрированы серьезные инфекции у 0.5% пациентов, получавших дупилумаб и у 1.0% пациентов, получавших плацебо. В 52-недельном исследовании CHRONOS серьезные инфекции были зарегистрированы у 0.2% пациентов, получавших препарат Дупиксент® и у 0.6% пациентов, получавших плацебо.
В клинических исследованиях у пациентов с бронхиальной астмой не наблюдалось увеличения общей частоты инфекций или серьезных инфекций во время лечения препаратом Дупиксент® по сравнению с плацебо. В 24-недельном клиническом исследовании были зарегистрированы серьезные инфекции у 1.0% пациентов, получавших дупилумаб, и у 1.1% пациентов, получавших плацебо. В 52-недельном исследовании QUEST серьезные инфекции были зарегистрированы у 1.3% пациентов, получавших дупилумаб, и у 1.4% пациентов, получавших плацебо.
В клинических исследованиях у пациентов с хроническим полипозным риносинуситом не наблюдалось увеличения общей частоты инфекций. В 24-недельном клиническом исследовании серьезные инфекции были зарегистрированы у 0.7% пациентов, получавших Дупиксент® и у 1.1% пациентов, получавших плацебо.
В ходе исследования SINUS-52 продолжительностью 52 недели инфекции были зарегистрированы у 1.3% пациентов, получавших дупилумаб, и у 1.3% пациентов, получавших плацебо.
Сердечно-сосудистые события
В 1-летнем плацебо-контролируемом исследовании у пациентов с бронхиальной астмой (QUEST) сердечно-сосудистые тромбоэмболические события (сердечно-сосудистые смерти, нефатальные инфаркты миокарда и нефатальные инсульты) были зарегистрированы в 1 случае (0.2%) в группе пациентов, получавших Дупиксент® 200 мг 1 раз в 2 недели; в 4 случаях (0.6%) в группе пациентов, получавших Дупиксент® 300 мг 1 раз в 2 недели и в 2 случаях (0.3%) в группе плацебо. В 1-летнем плацебо-контролируемом исследовании у пациентов с атопическим дерматитом (CHRONOS) сердечно-сосудистые тромбоэмболические события (сердечно-сосудистые смерти, нефатальные инфаркты миокарда и нефатальные инсульты) были зарегистрированы в 1 случае (0.9%) в группе пациентов, получавших Дупиксент® 300 мг 1 раз в 2 недели + топические ГКС; в 0 случаев (0.0%) в группе пациентов, получавших Дупиксент® 300 мг 1 раз в неделю + топические ГКС и в 1 случае (0.3%) в группе плацебо + топические ГКС.
Иммуногенность
Как и все белковые лекарственные препараты, препарат Дупиксент® обладает потенциалом иммуногенности.
Примерно у 5% пациентов с атопическим дерматитом, бронхиальной астмой или хроническим полипозным риносинуситом, которые получали препарат Дупиксент® в дозе 300 мг 1 раз в 2 недели в течение 52 недель, отмечалось образование антител против дупилумаба (АТ); приблизительно у 2% пациентов АТ стойко сохранялись и приблизительно 2% имели нейтрализующие антитела. Аналогичные результаты наблюдались у пациентов детского возраста (от 6 до 11 лет) с атопическим дерматитом, которые получали препарат Дупиксент® в дозе 200 мг 1 раз в 2 недели или 300 мг 1 раз в 4 недели в течение 16 недель.
Приблизительно у 16% подростков с атопическим дерматитом, получавших препарат Дупиксент® в дозе 300 мг или 200 мг 1 раз в 2 недели в течение 16 недель, отмечалось образование антител к дупилумабу; приблизительно у 3% зарегистрирован стойкий ответ со стороны АТ, и приблизительно у 5% пациентов были выявлены нейтрализующие антитела.
Примерно у 9% пациентов с бронхиальной астмой, которые получали препарат Дупиксент® в дозе 200 мг 1 раз в 2 недели в течение 52 недель, отмечалось образование антител к дупилумабу; приблизительно у 4% АТ стойко сохранялись и приблизительно 4% имели нейтрализующие антитела.
Независимо от возраста и популяции примерно у 2-4% пациентов в группах плацебо в 52-недельных исследованиях имелись антитела к дупилумабу; приблизительно у 2% антитела устойчиво сохранялись и приблизительно 1% имел нейтрализующие антитела.
Реакция образования антител обычно не влияла на системную экспозицию, безопасность или эффективность препарата Дупиксент®. Менее чем у 1% пациентов, получавших препарат Дупиксент® в зарегистрированной дозе, были выявлены высокие титры антител к препарату, ассоциирующиеся со снижением его системной экспозиции и эффективности. Кроме того, у одного пациента была обнаружена сывороточная болезнь, а у другого реакция, подобная сывороточной болезни (<0.1%), ассоциировавшиеся с высокими титрами антител (см. раздел «Особые указания»).
Наблюдаемая частота стойкого сохранения АТ и нейтрализующей активности в значительной степени зависят от чувствительности и специфичности используемого аналитического метода. Кроме того, наблюдаемая частота АТ-положительного статуса в анализе может зависеть от нескольких факторов, в т.ч. методики анализа, способа обработки проб, времени сбора проб, сопутствующих препаратов, а также статуса основного заболевания в каждом отдельном случае. По этим причинам сравнение частоты образования антител к дупилумабу с частотой выработки антител к другим препаратам может ввести в заблуждение.
Противопоказания к применению
- повышенная чувствительность к дупилумабу или любому из вспомогательных веществ препарата;
- детский возраст до 6 лет у пациентов с атопическим дерматитом среднетяжелого и тяжелого течения и бронхиальной астмой среднетяжелого и тяжелого течения в связи с неустановленными эффективностью и безопасностью;
- детский возраст до 12 лет у пациентов с бронхиальной астмой среднетяжелого и тяжелого течения в связи с неустановленной эффективностью и безопасностью.
С осторожностью
При беременности (только если ожидаемая польза превышает потенциальный риск для плода).
Применение при беременности и кормлении грудью
Беременность
Имеются лишь ограниченные данные по применению дупилумаба у беременных женщин. В исследованиях, проведенных на животных, прямых и косвенных неблагоприятных эффектов в отношении репродуктивной токсичности не обнаружено. Препарат Дупиксент® можно применять во время беременности только в том случае, если ожидаемая польза для матери превышает потенциальный риск для плода.
Период грудного вскармливания
Неизвестно, экскретируется ли дупилумаб с грудным молоком человека. С учетом пользы грудного вскармливания для ребенка и преимущества дальнейшего применения препарата для матери следует принять решение о прекращении кормления грудью или отмене препарата Дупиксент® в течение периода грудного вскармливания.
Применение при нарушениях функции печени
У пациентов с легкой или средней степенью тяжести почечной недостаточности коррекции дозы не требуется. Отсутствуют данные по применению препарата у пациентов с тяжелой почечной недостаточностью.
Применение при нарушениях функции почек
Отсутствуют данные по применению препарата у пациентов с печеночной недостаточностью.
Применение у детей
Противопоказания: детский возраст до 6 лет у пациентов с атопическим дерматитом среднетяжелого и тяжелого течения и бронхиальной астмой среднетяжелого и тяжелого течения в связи с неустановленными эффективностью и безопасностью; детский возраст до 12 лет у пациентов с бронхиальной астмой среднетяжелого и тяжелого течения в связи с неустановленной эффективностью и безопасностью.
Применение у пожилых пациентов
У пациентов пожилого возраста коррекции дозы не требуется.
Особые указания
Гиперчувствительность
При возникновении системной реакции гиперчувствительности лечение препаратом Дупиксент® должно быть немедленно прекращено, и начата соответствующая терапия.
В клинических исследованиях при применении препарата Дупиксент® при атопическом дерматите сообщалось об одном случае развития реакции, подобной сывороточной болезни, и одном случае развития сывороточной болезни после введения препарата (обе нежелательные реакции расценивались как серьезные). В исследовании при применении препарата при бронхиальной астме сообщалось об одном случае развития анафилаксии после введения препарата Дупиксент® (см. раздел «Побочное действие»).
Конъюнктивит и явления, связанные с кератитом
Конъюнктивит и явления, связанные кератитом, чаще встречались у пациентов с атопическим дерматитом, получавших препарат Дупиксент®. У некоторых пациентов наблюдалось нарушение зрения (например, затуманенное зрение), связанное с конъюнктивитом или кератитом (см. раздел «Побочное действие»). Пациенты должны сообщать о первом появлении или ухудшении симптомов со стороны глаз своему лечащему врачу. Пациенты, получающие лечение препаратом Дупиксент®, у которых развивался конъюнктивит, не проходящий после стандартного лечения, или признаки и симптомы кератита, должны пройти соответствующее офтальмологическое обследование (см. раздел «Побочное действие»).
Эозинофильные состояния
У пациентов с бронхиальной астмой может развиться серьезная системная эозинофилия, иногда в виде клинических признаков эозинофильной пневмонии или васкулита, соответствующих эозинофильному гранулематозу с полиангиитом, которые часто лечатся системными кортикостероидами. Эти события, как правило, но не всегда, могут быть связаны с сокращением приема пероральных кортикостероидов. Врачи должны быть внимательны к васкулитной сыпи, ухудшающимся легочным симптомам, сердечным осложнениям и/или нейропатии, возникающим у их пациентов с эозинофилией. Сообщалось о случаях эозинофильной пневмонии и васкулита, соответствующих эозинофильному гранулематозу с полиангиитом, при применении препарата Дупиксент® у взрослых пациентов, которые участвовали в клиническом исследовании препарата при бронхиальной астме. Связь между применением препарата Дупиксент® и этими состояниями не была установлена.
Симптомы обострения бронхиальной астмы или ухудшающееся состояние
Препарат Дупиксент® не следует назначать для лечения симптомов остро возникшего ухудшения или обострений астмы. Препарат Дупиксент® не применяется для лечения острого бронхоспазма или астматического статуса.
Снижение дозы ГКС
Не следует резко прерывать применение системных, местных или ингаляционных ГКС после начала терапии препаратом Дупиксент®. Сокращение дозы ГКС, при необходимости, должно быть постепенным и должно выполняться под непосредственным наблюдением врача. Уменьшение дозы ГКС может сопровождаться системными симптомами отмены и/или манифестацией состояний, которые ранее не проявлялись из-за системной терапии ГКС.
Гельминтозы (глистные инвазии)
Пациенты с обнаруженным гельминтозом не включались в клинические исследования. Неизвестно, может ли препарат Дупиксент® повлиять на иммунный ответ при гельминтозах. Необходимо провести лечение пациентов с имеющимся гельминтозом перед тем, как начинать лечение препаратом Дупиксент®. Если во время лечения препаратом Дупиксент® пациент заражается гельминтозом, а антигельминтные препараты оказываются неэффективными, следует прекратить лечение препаратом Дупиксент® до излечения паразитарного заболевания.
Сопутствующие атопические заболевания
Пациентам с атопическим дерматитом или ХПРС и с сопутствующей бронхиальной астмой следует рекомендовать не изменять своего лечения, не проконсультировавшись с лечащим врачом. Прекращая лечение препаратом Дупиксент®, следует принимать во внимание возможные эффекты на течение других атопических заболеваний.
Влияние на способность к управлению транспортными средствами и механизмами
Препарат Дупиксент® не оказывает или оказывает незначительное влияние на способность управлять транспортными средствами и работать с другими механизмами.
Передозировка
В клинических исследованиях не было выявлено проблем, связанных с безопасностью, при однократном в/в введении в дозах до 12 мг/кг.
Лечение: специфического антидота при передозировке препаратом Дупиксент® не существует. В случае передозировки необходимо контролировать состояние пациента для своевременного выявления признаков и симптомов нежелательных явлений и незамедлительно назначать соответствующее симптоматическое лечение.
Лекарственное взаимодействие
Живые вакцины
Применение препарата Дупиксент® с живыми вакцинами не изучалось. Во время лечения препаратом Дупиксент® не следует проводить вакцинацию живыми вакцинами.
Неживые (инактивированные) вакцины
Иммунные реакции на вакцинацию изучались в исследовании, в котором пациенты с атопическим дерматитом получали еженедельно препарат Дупиксент® в дозе 300 мг в течение 16 недель. После 12 недель терапии дупилумабом пациентов вакцинировали вакциной Tdap (Т-клеточно-зависимая, Adacel®) и менингококковой полисахаридной вакциной (Т-клеточно-независимая, Menomune®) и оценивали иммунные реакции по истечении 4 недель. У пациентов, получавших как дупилумаб, так и плацебо, реакции с образованием антител к противостолбнячной и менингококковой полисахаридной вакцинам были сходными. В этом исследовании не было обнаружено нежелательных взаимодействий между любой из этих неживых вакцин и дупилумабом.
Взаимодействие с субстратами изоферментов CYP450
В клиническом исследовании, проведенном у пациентов с атопическим дерматитом, оценивались эффекты дупилумаба на фармакокинетику субстратов изоферментов CYP. Данные, полученные в этом исследовании, не указывают на клинически значимое влияние дупилумаба на активность изоферментов CYP1A2, CYP3A, CYP2C19, CYP2D6 или CYP2C9.
Взаимодействие с другими лекарственными средствами для лечения бронхиальной астмы
Влияние дупилумаба на фармакокинетику одновременно назначаемых препаратов не ожидается. Данные, полученные на основании популяционного анализа, не указывают на влияние одновременно назначаемых препаратов на фармакокинетику дупилумаба у пациентов со среднетяжелым или тяжелым течением бронхиальной астмы.
Условия хранения препарата Дупиксент®
Препарат следует хранить в недоступном для детей месте, в оригинальной упаковке для защиты от света, при температуре от 2° до 8°С; не замораживать.
Срок годности препарата Дупиксент®
Срок годности — 36 мес. Не использовать после окончания срока годности, указанного на упаковке.
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
САНОФИ

|
|
Представительство |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Классификация частоты развития побочных эффектов ВОЗ: очень часто — ≥1/10; часто — от ≥1/100 до <1/10; нечасто — от ≥1/1000 до <1/100; редко — от ≥1/10000 до <1/1000; очень редко — <1/10000; частота неизвестна — не может быть оценена на основе имеющихся данных.
Duplex®
Инфекционные и паразитарные заболевания: часто — назофарингит, грипп.
Со стороны иммунной системы: редко — гиперчувствительность.
Со стороны обмена веществ и питания: часто — гипокалиемия; нечасто — анорексия, гиперкальциемия, гиперлипидемия, гиперурикемия, гипонатриемия.
Нарушения психики: редко — тревожность.
Со стороны нервной системы: часто — головная боль; нечасто — нарушение координации, головокружение, постуральное головокружение, парестезия, сонливость.
Со стороны органа зрения: нечасто — ухудшение зрения; редко — нарушение зрения.
Со стороны органа слуха и лабиринтные нарушения: нечасто — вертиго; редко — шум в ушах.
Со стороны сердца: нечасто — ощущение сердцебиения, тахикардия; редко — обморок.
Со стороны сосудов: нечасто — ортостатическая гипотензия; редко — выраженное снижение АД.
Со стороны дыхательной системы, органов грудной клетки и средостения: нечасто — кашель, боль в глотке и гортани.
Со стороны пищеварительной системы: нечасто — диарея, тошнота, чувство дискомфорта в животе, боль в верхней части живота, запор, сухость слизистой оболочки полости рта.
Со стороны кожи и подкожных тканей: нечасто — эритема, кожная сыпь; редко — экзантема, гипергидроз, кожный зуд.
Со стороны скелетно-мышечной и соединительной ткани: нечасто — артралгия, боль в спине, припухлость суставов; редко — мышечные спазмы, ощущение тяжести во всем теле.
Со стороны почек и мочевыводящих путей: редко — поллакиурия, полиурия.
Со стороны половых органов и молочной железы: редко — эректильная дисфункция.
Общие расстройства и нарушения в месте введения: часто — астения, повышенная утомляемость, отек лица, ощущение прилива крови к коже лица, отеки, периферические отеки, пастозность.
Дополнительная информация
У пациентов, получавших комбинацию амлодипин/валсартан, периферические отеки встречались реже (5,8%), чем у пациентов, получавших терапию только амлодипином (9%).
Амлодипин
Со стороны крови и лимфатической системы: очень редко — лейкопения, тромбоцитопения иногда с пурпурой.
Со стороны иммунной системы: очень редко — гиперчувствительность.
Со стороны обмена веществ и питания: очень редко — гипергликемия.
Нарушения психики: нечасто — депрессия, бессонница/нарушения сна, лабильность настроения; редко — спутанность сознания.
Со стороны нервной системы: часто — головокружение, головная боль, сонливость; нечасто — нарушение вкуса, парестезия, обморок, тремор, гипестезия; очень редко — мышечный гипертонус, периферическая нейропатия, нейропатия; частота неизвестна — экстрапирамидные нарушения.
Со стороны органа зрения: нечасто — ухудшение зрения, нарушение зрения.
Со стороны органа слуха и лабиринтные нарушения: нечасто — шум в ушах.
Со стороны сердца: часто — ощущение сердцебиения; очень редко — аритмии (включая брадикардию, желудочковую тахикардию и фибрилляцию предсердий), инфаркт миокарда.
Со стороны сосудов: часто — ощущение прилива крови к коже лица, выраженное снижение АД; очень редко — васкулит.
Со стороны дыхательной системы, органов грудной клетки и средостения: нечасто — одышка, ринит; очень редко — кашель.
Со стороны пищеварительной системы: часто — тошнота, чувство дискомфорта в животе, боль в верхней части живота; нечасто — изменение стула, диарея, сухость слизистой оболочки полости рта, диспепсия, рвота; редко — гастрит, гиперплазия десен, панкреатит.
Со стороны печени и желчевыводящих путей: очень редко — повышение активности печеночных ферментов (чаще с явлениями холестаза), повышение концентрации билирубина в плазме крови, гепатит, внутрипеченочный холестаз, желтуха.
Со стороны кожи и подкожных тканей: нечасто — алопеция, экзантема, эритема, реакции фоточувствительности, кожный зуд, гипергидроз, пурпура, кожная сыпь, изменение цвета кожи; очень редко — многоформная эритема, крапивница, эксфолиативный дерматит, синдром Стивенса-Джонсона, ангионевротический отек.
Со стороны скелетно-мышечной и соединительной ткани: часто — отек лодыжек; нечасто — артралгия, боль в спине, мышечные спазмы, миалгия.
Со стороны почек и мочевыводящих путей: нечасто — нарушение мочеиспускания, никтурия, поллакиурия.
Со стороны половых органов и молочной железы: нечасто — эректильная дисфункция, гинекомастия.
Общие расстройства и нарушения в месте введения: часто — повышенная утомляемость, периферические отеки; нечасто — астения, дискомфорт, недомогание, некардиогенная боль в сердце, боль.
Лабораторные и инструментальные данные: нечасто — снижение/повышение массы тела.
Валсартан
Со стороны крови и лимфатической системы: частота неизвестна — снижение гемоглобина и гематокрита, лейкопения, нейтропения, тромбоцитопения иногда с пурпурой.
Со стороны иммунной системы: очень редко — гиперчувствительность.
Со стороны органа слуха и лабиринтные нарушения: нечасто — вертиго.
Со стороны сосудов: частота неизвестна — васкулит.
Со стороны дыхательной системы, органов грудной клетки и средостения: нечасто — кашель.
Со стороны пищеварительной системы: нечасто — чувство дискомфорта в животе, боль в верхней части живота.
Со стороны печени и желчевыводящих путей: частота неизвестна — повышение активности печеночных ферментов, повышение концентрации билирубина в плазме крови.
Со стороны кожи и подкожных тканей: частота неизвестна — кожный зуд, кожная сыпь, ангионевротический отек.
Со стороны скелетно-мышечной и соединительной ткани: частота неизвестна — миалгия.
Со стороны почек и мочевыводящих путей: частота неизвестна — повышение концентрации креатинина в плазме крови, нарушение функции почек, включая острую почечную недостаточность.
Общие расстройства и нарушения в месте введения: нечасто — повышенная утомляемость.
Лабораторные и инструментальные данные: частота неизвестна — повышение содержания калия в сыворотке крови.
Дополнительная информация о компонентах препарата
Нежелательные явления, о которых сообщалось ранее при применении каждого из компонентов, могут иметь место при применении препарата Duplex®, даже если они не наблюдались в клинических исследованиях.
Амлодипин
Часто — сонливость, головокружение, ощущение сердцебиения, боль в животе, тошнота, отеки лодыжек.
Нечасто — бессонница, лабильность настроения (в т.ч. тревожность), депрессия, тремор, нарушение вкуса, обморок, гипестезия, нарушения зрения (в т.ч. диплопия), шум в ушах, выраженное снижение АД, одышка, ринит, рвота, диспепсия, алопеция, пурпура, изменение цвета кожи, гипергидроз, кожный зуд, экзантема, миалгия, судороги в мышцах, боль, нарушение мочеиспускания, учащение мочеиспускания, импотенция, гинекомастия, боль в груди, недомогание, увеличение массы тела, снижение массы тела.
Редко — спутанность сознания.
Очень редко — лейкопения, тромбоцитопения, аллергические реакции, гипергликемия, мышечный гипертонус, периферическая нейропатия, инфаркт миокарда, аритмии (включая брадикардию, желудочковую тахикардию и фибрилляцию предсердий), васкулит, панкреатит, гастрит, гиперплазия десен, гепатит, желтуха, повышение активности печеночных ферментов (чаще всего вследствие холестаза), ангионевротический отек, мультиформная эритема, крапивница, эксфолиативный дерматит, синдром Стивенса-Джонсона, фоточувствительность.
Описаны отдельные случаи экстрапирамидного синдрома.
Валсартан
Частота неизвестна — снижение гемоглобина и гематокрита, нейтропения, тромбоцитопения, увеличение содержания калия в сыворотке крови, повышение активности печеночных ферментов, повышение концентрации билирубина в плазме крови, повышение концентрации креатинина в плазме крови, нарушение функции почек, включая почечную недостаточность, ангионевротический отек, миалгия, васкулит, гиперчувствительность, включая сывороточную болезнь.
МНН: Амлодипин, Аторвастатин
Производитель: Гедеон Рихтер Румыния А.О.
Анатомо-терапевтическо-химическая классификация: Аторвастатин и амлодипин
Номер регистрации в РК:
№ РК-ЛС-5№020685
Информация о регистрации в РК:
25.06.2014 — 25.06.2019
- Скачать инструкцию медикамента
Торговое название
Дуплекор®
Международное непатентованное название
Нет
Лекарственная форма
Таблетки, покрытые пленочной оболочкой 10 мг/5 мг, 10 мг/10 мг, 20 мг/5 мг и 20 мг/10 мг
Состав
Одна таблетка содержит
активные вещества: аторвастатин L-лизин 12,628 мг (эквивалентно аторвастатину 10 мг), амлодипина бесилат 6,944 мг (эквивалентно амлодипину 5 мг) для дозировки 10 мг/5 мг; аторвастатин L-лизин 12,628 мг (эквивалентно аторвастатину 10 мг), амлодипина бесилат 13,888 мг (эквивалентно амлодипину 10 мг) для дозировки 10 мг/10 мг; аторвастатин L-лизин 25,256 мг (эквивалентно аторвастатину 20 мг), амлодипина бесилат 6,944 мг (эквивалентно амлодипину 5 мг) для дозировки 20 мг/5 мг; аторвастатин L-лизин 25,256 мг (эквивалентно аторвастатину 20 мг), амлодипина бесилат 13,888 мг (эквивалентно амлодипину 10 мг) для дозировки 20 мг/10 мг
вспомогательные вещества: целлюлоза микрокристаллическая (тип 102), кальция карбонат, крахмал кукурузный частично прежелатинизированный, натрия кроскармеллоза, натрия карбоксикрахмал (тип А), кремния диоксид коллоидный безводный, гидроксипропилцеллюлоза, магния стеарат, полисорбат 80, кальция оксид
состав пленочной оболочки Опадрай II 85F 18422 белый:
спирт поливиниловый, частично гидролизованный, титана диоксид (Е 171), макрогол 4000, тальк
Описание
Таблетки, покрытые пленочной оболочкой белого цвета, круглой формы, двояковыпуклые, с гравировкой на одной стороне «СЕ3» и диаметром около 9,0 мм (для дозировки 10 мг/5 мг).
Таблетки, покрытые пленочной оболочкой белого цвета, круглой формы, двояковыпуклые, с гравировкой на одной стороне «СЕ5» и диаметром около 9,0 мм (для дозировки 10 мг/10 мг).
Таблетки, покрытые пленочной оболочкой белого цвета, круглой формы, двояковыпуклые, с гравировкой на одной стороне «СЕ4» и диаметром около 15,5 х 8 мм (для дозировки 20 мг/5 мг).
Таблетки, покрытые пленочной оболочкой белого цвета, круглой формы, двояковыпуклые, с гравировкой на одной стороне «СЕ6» и диаметром около 15,5 х 8 мм (для дозировки 20 мг/10 мг).
Фармакотерапевтическая группа
Гиполипидемические препараты. Гиполипидемические средства, комбинации. Ингибитор ГМГ-КоА редуктазы, прочие комбинации. Аторвастатин и амлодипин.
Код АТХ C10BX03
Фармакологические свойства
Фармакокинетика
Аторвастатин
Всасывание: Аторвастатин быстро всасывается после приема внутрь; максимальные концентрации в плазме достигаются в течение 1-2 часов. Степень абсорбции увеличивается в зависимости от дозы аторвастатина. Абсолютная биодоступность аторвастатина составляет приблизительно 12 %, а системная биодоступность ингибирующей активности в отношении ГМГ-КоА-редуктаз — приблизительно 30 %. Низкая системная биодоступность обусловлена пресистемным метаболизмом (всасыванием) в слизистой оболочке желудочно-кишечного тракта и/или метаболизмом при «первичном прохождении» через печень.
Распределение: Средний объем распределения аторвастатина составляет приблизительно 381 л. Аторвастатин более чем на 98 % связывается с белками плазмы крови.
Метаболизм: Аторвастатин метаболизируется с помощью изоферментов системы цитохрома Р450 ЗА4 до орто- и парагидроксилированных производных и различных продуктов бета-окисления. Кроме других путей метаболизма, эти продукты в дальнейшем метаболизируются посредством конъюгации с глюкоронидом. In vitro, ингибирование ГМГ-КоА редуктазы орто- и парагидроксилированными метаболитами эквивалентно ингибированию, наблюдающемуся для аторвастатина. Примерно 70 % снижения активности ГМГ-КоА-редуктазы происходит за счет действия активных циркулирующих метаболитов.
Выведение: Аторвастатин выводится в основном с желчью после печеночного и/или внепеченочного метаболизма. Однако лекарственное средство, по-видимому, не подвергается существенной кишечно-печеночной рециркуляции. Средний период полувыведения аторвастатина из плазмы крови составляет приблизительно 14 часов. Вследствие действия активных метаболитов период половинного снижения ингибирующей активности ГМГ-КоА редуктазы составляет приблизительно 20 — 30 часов.
Особые популяции пациентов
Пациенты пожилого возраста
Концентрации аторвастатина и его метаболитов в плазме крови у пациентов пожилого возраста выше, чем у лиц молодого возраста, хотя гиполипидемические эффекты сопоставимы с таковыми у молодых.
Пол
Концентрация аторвастатина в плазме крови у женщин отличается от таковой у мужчин (максимальная концентрация (Сmах) у женщин примерно на 20 % выше, а площадь под кривой «концентрация-время» (AUC) на 10 % ниже), однако клинически значимых различий влияния препарата на липидный обмен у мужчин и женщин не выявлено.
Пациенты детского возраста
Для данной популяции пациентов фармакокинетичекие данные отсутствуют.
Пациенты с нарушениями функции почек
Заболевания почек не влияют на концентрацию аторвастатина в плазме крови, в связи с этим коррекции дозы у пациентов с нарушением функции почек не требуется.
Пациенты с нарушениями функции печени
Концентрации аторвастатина и его метаболитов в плазме крови значительно повышены (Стах приблизительно в 16 раз, AUC — в 11 раз) у пациентов с хроническим заболеванием печени, вызванным чрезмерным употреблением алкоголя (класс В по классификации Чайлд-Пью).
Амлодипин
Всасывание:
После приема внутрь амлодипин хорошо всасывается, максимальная концентрация в плазме достигается через 6 — 12 часов. Абсолютная биодоступность 64 — 80 %. Биодоступность амлодипина не изменяется при приеме пищи.
Распределение:
Объем распределения составляет приблизительно 21 л/кг. Приблизительно 97 % циркулирующего амлодипина связывается с белками плазмы крови. Равновесные концентрации амлодипина в плазме крови достигаются через 7 — 8 дней регулярного приема лекарственного средства.
Метаболизм и выведение:
Амлодипин метаболизируется в печени с образованием неактивных метаболитов, 10 % неизмененного амлодипина и 60 % метаболитов выводятся почками. Выведение из плазмы крови является двухфазным с конечным периодом полувыведения приблизительно 30 — 50 часов.
Особые популяции пациентов
Возраст, сердечная недостаточность
Время, необходимое для достижения Сmах амлодипина в плазме крови, практически не зависит от возраста. У пациентов пожилого возраста отмечена тенденция к снижению клиренса амлодипина, что приводит к увеличению AUC и периода полувыведения (T½). У пациентов различных возрастных групп с хронической сердечной недостаточностью (ХСН) наблюдалось увеличение AUC и T½. Подобное увеличение AUC отмечалось у пациентов с печеночной недостаточностью.
Нарушения функции почек
Концентрации амлодипина в плазме не зависят от степени почечной недостаточности. Пациенты с нарушениями функции почек могут принимать обычные начальные дозы препарата. Амлодипин не выводится при диализе.
Нарушения функции печени
У пациентов с нарушениями функции печени период полувыведения увеличивается.
Фармакодинамика
Комбинированный препарат: аторвастатин — гиполипидемическое средство, ингибитор ГМГ-КоА (З-гидрокси-3-метилглютарилкоэнзим А) редуктазы, амлодипин — производное дигидропиридина, блокатор «медленных» кальциевых каналов (БМКК). Терапия комбинированным препаратом приводит к дозозависимому снижению систолического и диастолического артериального давления (АД) и концентрации холестерина липопротеинов низкой плотности (ХС ЛПНП).
Аторвастатин
Аторвастатин селективно и конкурентно ингибирует ГМГ-КоА-редуктазу, которая катализирует превращение 3-гидрокси-3-метилглютарилкоэнзима А в мевалоновую кислоту — предшественник стероидов, включая холестерин (ХС). Триглицериды и холестерин в печени включаются в состав холестерина липопротеинов очень низкой плотности (ХС ЛПОНП), поступают в плазму крови и транспортируются к периферическим тканям. Холестерин липопротеинов низкой плотности (ХС ЛПНП) образуются из ХС ЛПОНП в ходе взаимодействия с ХС ЛПНП-рецепторами, характеризующимися высоким сродством к данным липопротеидам.
Аторвастатин снижает концентрации холестерина и липопротеинов в плазме крови путем ингибирования ГМГ-КоА редуктазы и синтеза холестерина в печени и увеличении числа «печеночных» ХС ЛПНП-рецепторов на поверхности клетки, что приводит к усилению захвата и катаболизма ХС ЛПНП. Аторвастатин снижает образование ХС ЛПНП, обеспечивает значительное и стойкое повышение активности ХС ЛПНП-рецепторов, в сочетании с благоприятным изменением качества ЛПНП частиц. Снижает концентрации общего холестерина (30 — 46 %), холестерина ЛПНП (41 — 61 %), аполипопротеина В (34 — 50 %) и триглицеридов (14 — 33 %), при этом приводя к увеличению концентрации холестерина липопротеинов высокой плотности (ХС ЛПВП) и аполипопротеина А1. Данные результаты одинаковы для пациентов с гетерозиготной наследственной гиперхолестеринемией, ненаследственными формами гиперхолестеринемии, а также смешанной гиперлипидемией, включая пациентов с сахарным диабетом 2 типа. Аторвастатин эффективен для снижения концентрации ХС ЛПНП у пациентов с гомозиготной наследственной гиперхолестеринемией, т. е. у популяции, обычно резистентной к терапии другими гиполипидемическими средствами.
Амлодипин
Амлодипин блокирует поступление ионов кальция через мембраны в гладкомышечные клетки миокарда и сосудов. Механизм гипотензивного действия амлодипина обусловлен прямым расслабляющим влиянием на гладкие мышцы сосудов. Точный механизм действия амлодипина при стенокардии окончательно не установлен, но амлодипин уменьшает ишемию следующими двумя путями: амлодипин расширяет периферические артериолы и таким образом снижает общее периферическое сопротивление сосудов (ОПСС), т. е. постнагрузку на сердце. Так как частота сердечных сокращений (ЧСС) не изменяется, уменьшение нагрузки на сердце приводит к снижению потребления энергии и потребности в кислороде. Механизм действия амлодипина, включает в себя расширение главных коронарных артерий и коронарных артериол как в неизмененных, так и в ишемизированных зонах миокарда. Их дилатация увеличивает поступление кислорода в миокард у пациентов с вазоспастической стенокардией (стенокардия Принцметала или вариантная стенокардия). У пациентов с артериальной гипертензией прием амлодипина в разовой суточной дозе обеспечивает клинически значимое снижение АД на протяжении 24 ч как в положении «лежа», так и «стоя». Благодаря медленному началу действия амлодипин не вызывает острую артериальную гипотензию. У пациентов со стенокардией применение амлодипина 1 раз в сутки увеличивает время выполнения физической нагрузки, предотвращает развитие приступа стенокардии и депрессию сегмента ST (на 1 мм), снижает частоту приступов стенокардии и количество принимаемых таблеток короткодействующего нитроглицерина (подъязычного). Амлодипин не оказывает неблагоприятного влияния на обмен веществ и липиды плазмы крови и может применяться у пациентов с сахарным диабетом и подагрой, а также у пациентов с бронхиальной астмой. У пациентов с сердечной недостаточностью II — IV функционального класса (по классификации NYHA) прием амлодипина не приводил к ухудшению клинического состояния (переносимости физической нагрузки, фракции выброса левого желудочка сердца и клинической симптоматики).
Показания к применению
— лечение артериальной гипертензии у пациентов с дислипидемией, состояние которых адекватно контролируется приемом амлодипина и аторвастатина при следующих заболеваниях:
— первичная гиперхолестеринемия, включая семейную гиперхолестеринемию (семейная гетерозиготная гиперхолестеринемия), либо комбинированная (смешанная) гиперлипидемия
-
гомозиготная семейная гиперхолестеринемия
-
гиполипидемическая диета и другие нефармакологические методы лечения дислипидемии оказываются мало- или неэффективными
Препарат рекомендуется применять в тех случаях, когда необходима комбинированная терапия амлодипином и невысокими дозами аторвастатина.
Способ применения и дозы
Внутрь, по 1 таблетке 1 раз в сутки в любое время суток, независимо от времени приема пищи.
Применять Дуплекор® в качестве стартовой монотерапии не рекомендуется, так как дозу препарата Дуплекор® следует определять путем титрования дозы отдельных компонентов препарата с учётом данных о дозах и способах применения амлодипина и аторвастатина.
В соответствии с результатами титрования дозы, рекомендуемой дозой является одна таблетка препарата Дуплекор® 10 мг/5 мг, одна таблетка препарата Дуплекор® 10 мг/10 мг, одна таблетка препарата Дуплекор® 20 мг/5 мг или одна таблетка препарата Дуплекор® 20 мг/10 мг один раз в сутки. Максимальная суточная доза составляет одна таблетка препарата Дуплекор® 20 мг/10 мг один раз в сутки.
Препарат применяют в сочетании с немедикаментозными средствами лечения, включая диету, физические нагрузки, снижение массы тела у пациентов с ожирением, отказ от курения. При применении у пациентов с артериальной гипертензией в дозе 5 мг/10 мг (в начале терапии) необходим контроль АД каждые 2 — 4 недели и, при необходимости, возможно увеличение дозы до 10 мг/10 мг/сутки. При ИБС рекомендуемая доза 10 мг/5 мг один раз в сутки.
Пациенты пожилого возраста
Коррекции дозы препарата Дуплекор® не требуется.
Пациенты с нарушением функции печени
Дуплекор® противопоказан пациентам с заболеваниями печени в активной фазе или со стойким повышением активности «печеночных» ферментов в сыворотке крови, превышающей верхнюю границу нормы (ВГН) в 3 раза
Пациенты с нарушением функции почек
Коррекции дозы препарата не требуется.
Побочные действия
Часто (от ≥ 1/100 до < 1/10)
— головная боль, головокружение, бессонница, сонливость, парестезия, гипестезия, утомляемость
— учащенное сердцебиение, приливы крови к коже лица
— тошнота, диспепсия, диарея, запор, метеоризм, боли в области живота
— миалгия, артралгия, астения, боль в груди и, боль в области поясницы
— отеки, отеки голеностопных суставов
— повышенная чувствительность
— кожная сыпь, зуд
— увеличение уровня аланин-аминотрансаминазы, креатинфосфокиназы в сыворотке крови
Нечасто (от ≥ 1/1000 до <1/100)
— изменение настроения (в т. ч. тревожность), депрессия, амнезия, периферическая невропатия, обморочное состояние, тремор, дисгевзия, общее недомогание
— гипергликемия, гипогликемия
— расстройства зрения (в т.ч. диплопия)
— шум в ушах
— гипотензия
— сухость во рту, рвота
— алопеция, пурпура, нарушение пигментации кожи, гипергидроз, экзантема
— миопатия, мышечные спазмы
— ринит, диспноэ
— нарушение мочеиспускания, никтурия, поллакиурия
— эректильная дисфункция, гинекомастия
— увеличение или снижение массы тела
— тромбоцитопения
Редко (от ≥ 1/10 000 до < 1/1 000)
— психоз
— панкреатит, гепатит, холестатическая желтуха
— миозит, острый некроз скелетных мышц
— периферические отеки
— гипербилирубинемия
Очень редко (< 1/10 000)
— анафилактические реакции, ангионевротический отёк, крапивница, отёк Квинке, буллезная сыпь (включая мультиформную эритему, эксфолиативный дерматит, синдром Стивенса — Джонсона, токсический эпидермальный некролиз), светочувствительность
— инфаркт миокарда, желудочковая тахикардия, брадикардия, фибрилляция предсердий, аритмии, васкулит
— кашель
— гастрит, гипертрофический гингивит, печеночная недостаточность
— мышечный гипертонус, разрыв сухожилия
— лейкопения
Противопоказания
— повышенная чувствительность к амлодипину и другим производным дигидропиридина, аторвастатину или любому компоненту препарата
— выраженная артериальная гипотензия
— шок (включая кардиогенный шок);
— гемодинамически нестабильная сердечная недостаточность после острого инфаркта миокарда, гемодинамически значимый аортальный стеноз, нестабильная стенокардия
— миопатия
— женщины репродуктивного возраста, не пользующиеся адекватными методами контрацепции
— активные заболевания печени или стойкое повышение активности «печеночных» ферментов более чем в 3 раза выше нормы неясной этиологии
— сочетанное применение с итраконозолом, кетоконозолом и телитромицином
— беременность и период лактации
— детский и подростковый возраст до 18 лет (из-за недостаточности данных по безопасности и эффективности)
Лекарственные взаимодействия
Взаимодействие препарата Дуплекор® с другими лекарственными средствами специально не изучалось, но проводились исследования каждого из компонентов в отдельности.
Возможные взаимодействия с амлодипином
Применение следующих комбинаций лекарственных средств не рекомендовано
Инфузионный раствор дантролена: следует избегать одновременного применения амлодипина и дантролена, отмечалась фибрилляция желудочков.
Применение следующих комбинаций следует проводить с особой осторожностью
Баклофен: Усиливается гипотензивный эффект. В данном случае может потребоваться контроль АД и снижение дозы гипотензивного лекарственного средства.
Ингибиторы изофермента CYP3A4: при одновременном применении ингибитора изофермента CYP3A4 эритромицина здоровыми добровольцами молодого возраста и ингибитора изофермента CYP3A4 дилтиазема пациентами пожилого возраста отмечалось увеличение концентрации амлодипина в плазме крови на 22 % и 50 % соответственно.
Однако клиническая значимость этих данных неизвестна. Нельзя исключать, что мощные ингибиторы изофермента CYP3A4 (например, кетоконазол, итраконазол, ритонавир) могут увеличивать концентрации амлодипина в плазме крови в большей степени, нежели дилтиазем.
Индукторы изофермента CYP3A4: противоэпилептические средства (например, карбамазепин, фенобарбитал, фенитоин, фосфенитоин, примидон), рифампицин: из-за индуцирования метаболизма амлодипина можно ожидать снижение концентрации блокаторов «медленных» кальциевых каналов (в частности амлодипина) в плазме крови. В случае приема указанных выше индукторов изофермента CYP3A4 рекомендуется клиническое наблюдение и при необходимости коррекция дозы амлодипина, в противном случае одновременный прием индуктора изофермента CYP3A4 следует прекратить.
Применение следующих комбинаций допустимо
Блокаторы α-1-адренорецепторов (празозин, альфузозин, доксазозин, тамсулозин, теразозин): можно ожидать усиления гипотензивного эффекта с риском развития выраженной ортостатической гипотензии.
Амифостин: усиление гипотензивного эффекта из-за проявления нежелательных явлений амифостина.
Трициклические антидепрессанты / нейролептики: увеличивается риск развития артериальной гипотензии или ортостатической гипотензии (аддитивный эффект).
Бета-адреноблокаторы (бисопролол, карведилол, метопролол): риск развития артериальной гипотензии или сердечной недостаточности в случае латентной или неконтролируемой сердечной недостаточности (отрицательный инотропный эффект бета — адреноблокаторов может усиливаться). В случае одновременного применения амлодипина и бета-адреноблокаторов симпатические рефлекторные реакции, проявляющиеся как результат чрезмерного гемодинамического эффекта, могут ослабевать.
Кортикостероиды, тетракозактид: гипотензивный эффект может ослабевать из-за снижения абсорбции натрия и воды, вызываемого глюкокортикостероидами.
Другие гипотензивные средства: сопутствующий прием гипотензивных средств (бета — адреноблокаторы, антагонисты рецептора ангиотензина II, диуретики, ингибиторы ангиотензинпревращающего фермента (АПФ)) может усиливать гипотензивный эффект амлодипина. Одновременное применение с нитратами или другими сосудорасширяющими средствами может привести к дополнительному снижению АД.
Силденафил: при первичной артериальной гипертензии однократный прием 100 мг силденафила не оказывал влияния на фармакокинетические параметры амлодипина. При приеме амлодипина в комбинации с силденафилом каждое лекарственное средство снижает АД независимо от другого.
Циметидин, аторвастатин, алюминий — или магнийсодержащие антациды, грейпфрутовый сок не оказывают влияния на фармакокинетику амлодипина.
Возможные взаимодействия с аторвастатином
Применение следующих комбинаций противопоказано
Итраконазол, кетоконазол, телитромицин: риск дозозависимых нежелательных явлений, например, рабдомиолиза, увеличивается (снижается метаболизм аторвастатина в печени).
Гемфиброзил и другие производные фиброевой кислоты: риск дозозависимых нежелательных явлений, например, рабдомиолиза, увеличивается (снижается метаболизм аторвастатина в печени).
Применение следующих комбинаций следует осуществлять с особой осторожностью
Ингибиторы изоферментов или системы цитохрома Р450 ЗА4: аторвастатин метаболизируется с помощью изоферментов системы цитохрома Р450, CYP 3A4. Эритромицин, ингибитор CYP 3A4, повышал концентрацию аторвастатина в плазме крови на 40 %. Одновременный прием аторвастатина и ингибиторов CYP 3A4, некоторых макролидных антибиотиков (например, эритромицина, кларитромицина), иммунодепрессантов (циклоспорина), противогрибковых средств, относящихся к азолам (например, итраконазола, кетоконазола), амиодарона, ингибиторов протеаз или антидепрессантов, нефазодона, может привести к взаимодействию, которое приведет к повышению концентрации аторвастатина в плазме крови. Поэтому одновременное применение с указанными препаратами следует осуществлять с осторожностью.
Индукторы изоферментов системы цитохрома Р450 ЗА4: одновременное применение аторвастатина и индукторов изоферментов системы цитохрома Р450 ЗА4 (например, фенитоина, рифампицина) может привести к значительному снижению концентрации аторвастатина в плазме крови. Вследствие наличия двойного механизма взаимодействия рифампицина (индукция ферментов системы цитохрома Р450 ЗА4 и ингибирование переносчика захвата гепатоцита ОАТР1В1), совместное применение аторвастатина и рифампицина приводило к среднему увеличению параметров Сmах и AUC аторвастатина на 12 и 90 %, соответственно. Напротив, прием аторвастатина через некоторое время после приема рифампицина сопровождался значительным снижением (приблизительно на 80 %) концентрации аторвастатина в плазме крови.
Ингибиторы протеазы: Одновременный прием аторвастатина и ингибиторов протеазы, известных ингибиторов цитохрома P450 3A4, сопровождалось двукратным увеличением концентрации аторвастатина в плазме крови.
Варфарин: прием аторвастатина совместно с варфарином может привести к усилению антикоагулянтного эффекта с риском развития кровотечения. Пациенты, получающие варфарин, должны находиться под наблюдением врача, поскольку может потребоваться коррекция дозы антикоагулянта.
Никотиновая кислота: гиполипидемические дозы никотиновой кислоты (более 1г/сут) могут повысить риск развития миопатии при одновременном приеме с ингибиторами ГМГ-КоА редуктазы. Редко, как следствие рабдомиолиза и миоглобинурии, может развиться почечная недостаточность. Поэтому необходимо рассмотреть соотношение «польза — риск» одновременного применения аторвастатина и никотиновой кислоты в липидоснижающих дозах.
Применение следующих комбинаций допустимо
Антациды: одновременный прием внутрь суспензии, содержащей магния и алюминия гидроксиды, снижал концентрацию аторвастатина в плазме крови примерно на 35 %, однако степень уменьшения содержания ХС ЛПНП при этом не менялась.
Грейпфрутовый сок: грейпфрутовый сок содержит один или более компонентов, которые ингибируют CYP3A4 и, поэтому, может приводить к увеличению концентраций в плазме крови лекарственных средств, метаболизм которых протекает с помощью изоферментов системы цитохрома CYP3A4. Потребление одного стакана (240 мл) грейпфрутового сока приводило к увеличению AUC аторвастатина на 37 % и к снижению AUC активного орто-гидрокси- метаболита аторвастатина на 20,4 %. Однако, большие количества грейпфрутового сока (более 1,2 л в сутки в течение 5 дней) увеличивают AUC аторвастатина в 2,5 раза и AUC активных ингибиторов ГМГ-КоА редуктазы (аторвастатин и метаболиты) в 1,3 раза.
Одновременный прием больших количеств грейпфрутового сока и аторвастатина не рекомендуется.
Пероральные контрацептивы: применение аторвастатина совместно с пероральным контрацептивом, содержащим норэтистерон и этинилэстрадиол, приводило к повышению концентраций норэтистерона и этинилэстрадиола в плазме крови. Этот эффект следует учитывать при выборе перорального контрацептива для женщины, получающей аторвастатин.
Колестипол: гиполипидемический эффект комбинации с колестиполом превосходит таковой для каждого препарата в отдельности, несмотря на снижение концентрации аторвастатина на 25 % при его одновременном использовании с колестиполом.
Другие взаимодействия
Антипирин (феназон): одновременный прием многократных доз аторвастатина и феназона выявил незначительный эффект на клиренс феназона, либо отсутствие данного эффекта.
Для аторвастатина не отмечено взаимодействия нестероидными противовоспалительными препаратами, антибиотиками, гипогликемическими препаратами, циметидином, антигипертензивными средствами.
Особые указания
Хроническая сердечная недостаточность
У пациентов с ХСН неишемической этиологии при применении амлодипина существует вероятность возникновения отека легких. Поэтому таким пациентам препарат следует назначать с осторожностью.
Нарушения функции печени
Перед началом лечения аторвастатином и периодически во время лечения необходимо контролировать функцию печени. В случае повышения активности «печеночных» ферментов, превышающих верхнюю границу нормы (ВГН) в 3 раза, рекомендуется снизить дозу препарата или прекратить его прием. У пациентов с нарушениями функции печени период полувыведения амлодипина увеличивается, поэтому препарат Дуплекор® таким пациентам следует назначать с осторожностью.
С осторожностью следует назначать Дуплекор® пациентам, злоупотребляющим алкоголем и/или имеющим заболевания печени в анамнезе.
Действие на скелетные мышцы
У пациентов, получавших аторвастатин, наблюдалась миалгия. Диагноз миопатии следует предполагать у пациентов, принимающих ингибиторы ГМГ-КоА редуктазы, у которых отмечаются необъяснимые симптомы, например, боль или болезненность мышц, мышечная слабость или мышечные судороги. В таких случаях необходим контроль активности креатинфосфокиназы (КФК). Активность КФК не следует измерять после интенсивных физических нагрузок или при наличии вероятной альтернативной причины повышения активности КФК. Если активность КФК значительно превышает норму более чем в 5 раз по сравнению с верхней границей нормы, активность КФК следует определять регулярно в течение 5 — 7 дней для подтверждения результатов.
Перед началом применения препарата Дуплекор®, при приеме аторвастатина в монотерапии, пациентам с факторами риска развития рабдомиолиза следует принимать препарат с осторожностью. Активность КФК необходимо определять перед началом лечения аторвастатином в следующих ситуациях:
— нарушение функции почек
— гипотиреоз
— собственный или семейный анамнез мышечных заболеваний
— наличие в анамнезе миотоксичности на фоне приема других ингибиторов ГМГ-КоА- редуктазы или фибратов
— заболевания печени в анамнезе и/или злоупотребление алкоголем
— у пациентов пожилого возраста (> 65 лет) в случае наличия факторов риска развития рабдомиолиза.
Во время лечения
— рекомендуется проинформировать пациентов о необходимости незамедлительно сообщать врачу о случаях неожиданного появления мышечных болей, мышечной слабости или спазмах, особенно в сочетании с недомоганием или лихорадкой.
— если мышечная боль, слабость или судороги возникают в процессе лечения препаратом Дуплекор®, следует осуществлять контроль активности КФК. Если будет установлено, что активность КФК более чем в 5 раз превысила верхнюю границу нормы лечение, следует прекратить.
— если мышечные симптомы резко выражены и вызывают ежедневный дискомфорт в течение всего дня, даже в том случае, если активность КФК повышена менее чем в 5 раз в сравнении с верхней границей нормы, лечение следует прекратить.
В случае исчезновения симптомов и возвращении к норме активности КФК, следует рассмотреть вопрос о повторном назначении препарата Дуплекор® с меньшей дозой аторвастатина и тщательном наблюдении за пациентом.
Повышение активности КФК следует учитывать при дифференциальной диагностике болей в грудной клетке при оценке вероятности развития инфаркта миокарда. При применении аторвастатина, как и других препаратов этого класса, описаны редкие случаи рабдомиолиза с острой почечной недостаточностью, обусловленной миоглобинурией.
Особенности влияния на способность управлять транспортным средством и потенциально опасными механизмами
Исследования по влиянию препарата на способность к управлению транспортными средствами и использованию механизмов не проводились. Следует соблюдать осторожность при вождении автотранспорта и управлении механизмами при приеме препарата Дуплекор®, учитывая возможное развитие чрезмерного снижения АД, головокружения и обморока.
Передозировка
Сведений о передозировке препарата нет.
Как амлодипин, так и аторвастатин активно связываются с белками плазмы крови, поэтому существенное увеличение клиренса комбинированного препарата при гемодиализе маловероятно.
Симптомы: чрезмерная периферическая вазодилатация, приводящая к рефлекторной тахикардии, и выраженное и стойкое снижение АД, в том числе с развитием шока и летального исхода.
Лечение: прием активированного угля сразу или в течение 2 ч после приема амлодипина в дозе 10 мг приводит к значительной задержке всасывания препарата. В некоторых случаях может быть эффективным промывание желудка. Выраженное снижение АД, вызванное передозировкой амлодипина, требует проведения активных мероприятий, направленных на поддержание функции сердечно-сосудистой системы, включая контроль показателей работы сердца и легких, возвышенного положения конечностей и контроль объема циркулирующей крови и диуреза. Для восстановления тонуса сосудов и АД может быть полезным применение сосудосуживающего препарата, если нет противопоказаний к его назначению, для устранения последствий блокады кальциевых каналов — в/в введение кальция глюконата.
Следует проводить оценку функции печени и определять активность креатинфосфокиназы (КФК) в сыворотке крови.
Форма выпуска и упаковка
По 10 таблеток помещают в контурную ячейковую упаковку из фольги алюминиевой и пленки ПА/Ал/ПВХ.
По 3 контурных упаковок вместе с инструкцией по медицинскому применению на государственном и русском языках вкладывают в картонную пачку.
Условия хранения
В оригинальной упаковке в защищенном от света и влаги месте, при температуре от 15 0С до 25 0С.
Хранить в недоступном для детей месте!
Срок хранения
2 года
Не использовать после истечения срока годности!
Условия отпуска из аптек
По рецепту
Наименование и страна организации-производителя
«Гедеон Рихтер Румыния» А.О., Румыния
Наименование и страна владельца регистрационного удостоверения
ОАО «Гедеон Рихтер», Венгрия
Наименование и страна организации упаковщика
«Гедеон Рихтер Румыния» А.О., Румыния
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции:
Представительство ОАО «Гедеон Рихтер» в РК
E-mail: info@richter.kz
Телефон: 8-(727) — 258-26-22, 8-(727) — 258-26-23
| 999796761477976705_ru.doc | 136 кб |
| 332191481477977840_kz.doc | 185.5 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники