Фазенра — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-005492
Торговое наименование:
Фазенра
Международное непатентованное наименование:
бенрализумаб
Лекарственная форма:
раствор для подкожного введения
Состав
Один шприц содержит:
Действующее вещество: бенрализумаб 30 мг
Вспомогательные вещества: L-гистидин 1,4 мг, L-гистидина гидрохлорида моногидрат 2,3 мг, α,α-трегалозы дигидрат 95 мг, полисорбат 20 (растительного происхождения) 0,06 мг, вода для инъекций приблизительно 910 мг.
Описание
От прозрачной до опалесцирующей, от бесцветной до желтого цвета жидкость.
Фармакотерапевтическая группа:
другие лекарственные препараты системного действия, применяемые при обструктивных заболеваниях дыхательных путей
Код ATX:
R03DX10
Фармакологические свойства
Фармакодинамика
Механизм действия
Бенрализумаб представляет собой антиэозинофильное гуманизированное, афукозилированное, моноклональное антитело (IgG1/каппа). Бенрализумаб связывается с альфа-субъединицей рецептора к человеческому интерлейкину-5 (IL-5Rα), обладая высоким сродством (16 пМ) и специфичностью. Рецептор к IL-5 находится на поверхности эозинофилов и базофилов. Отсутствие фукозы в Fc домене бенрализумаба облегчает процесс связывания (45,5 нМ) с FcyRHI-рецепторами на поверхности иммунных эффекторных клеток, таких как натуральные киллеры, что приводит к апоптозу эозинофилов и базофилов посредством антителозависимой клеточноопосредованной цитотоксичности (АЗКЦ).
Эозинофильное воспаление является важным компонентом патогенеза бронхиальной астмы. В эозинофилах содержатся медиаторы воспаления (такие как эйкозаноиды, лейкотриены, цитокины) и белковые гранулы (такие как эозинофильный катионный белок, эозинофильная пероксидаза, эозинофильный нейротоксин и главный основной белок). Бенрализумаб, посредством АЗКЦ, уменьшает эозинофильное воспаление.
Фармакодинамические свойства
Фармакодинамический ответ (уменьшение количества эозинофилов в крови) после подкожного введения препарата пациентам с бронхиальной астмой изучалось в 12-недельном исследовании фазы II. Пациенты получали в виде подкожных инъекций бенрализумаб в одной из трех доз (25 мг (n=7), 100 мг (n=6) и 200 мг (n=6)) или плацебо (n=6) однократно каждые 4 недели (всего 3 дозы). Исходная медиана количества эозинофилов до начала лечения составляла 400, 200, 120 и 200 клеток/мкл для групп бенрализумаба 25 мг, 100 мг, 200 мг и плацебо, соответственно.
Снижение количества эозинофилов в крови после подкожного введения бенрализумаба было отмечено для всех доз и не наблюдалось в группе плацебо. Через 24 ч после введения препарата отмечалось полное или практически полное снижение медианы количества эозинофилов в крови (0, 0 и 5 клеток/мкл, соответственно). В группе плацебо медиана количества эозинофилов в крови не изменилась. Эффект в отношении количества эозинофилов сохранялся на протяжении терапии.
В клиническом исследовании фазы I изучалось влияние бенрализумаба на эозинофилы в слизистой оболочке дыхательных путей у пациентов с бронхиальной астмой, с содержанием эозинофилов в мокроте 2,5% и более. Пациенты получали бенрализумаб 100 мг или 200 мг подкожно однократно каждые четыре недели в течение 8 недель (общее количество пациентов в общей группе бенрализумаба n=9) или плацебо (n=5). По окончании 12-недельного периода лечения медиана снижения количества эозинофилов в слизистой оболочке дыхательных путей в общей группе бенрализумаба составила 96% по сравнению с 47% в группе плацебо (статистически значимое различие, р=0,039).
В клиническом исследовании фазы I лечение бенрализумабом также сопровождалось снижением уровня базофилов крови, и в исследованиях фазы I и фазы II – снижением сывороточной концентрации веществ, содержащихся в гранулах эозинофилов, таких как эозинофильный нейротоксин и эозинофильный катионный белок.
В исследованиях фазы I и II после введения бенрализумаба в рекомендованной дозе медиана абсолютного количества эозинофилов в крови составила 0 клеток/мкл, что соответствует медиане снижения на 100%. Это снижение было отмечено уже при первом измерении, после 4 недель терапии, и сохранялось на протяжении терапии.
Иммуногенность
В целом, антитела к исследуемому препарату были обнаружены у 107 из 809 (13%) пациентов, получавших препарат Фазенра по рекомендованной схеме в течение 48 и 56 недель. У большинства пациентов с наличием антител были выявлены нейтрализующие антитела. Наличие антител к бенрализумабу ассоциировалось с повышением клиренса бенрализумаба и повышенным уровнем эозинофилов в крови у пациентов с высокими титрами антител к препарату в сравнении с пациентами без антител. Данных о наличии связи между образованием антител к препарату и эффективностью и безопасностью препарата не получено.
Представленные данные были получены у пациентов с наличием антител к бенрализумабу по результатам специфических методов определения. Наблюдаемая частота образования антител (в том числе, нейтрализующих) может зависеть от нескольких факторов, включая анализ чувствительности и специфичности, метод определения антител, хранение проб, время сбора проб, применение сопутствующих препаратов и основное заболевание. По этим причинам сравнение частоты случаев образования антител к бенрализумабу с таковой к другим препаратам в других исследованиях может давать недостоверные результаты.
Фармакокинетика
Фармакокинетика бенрализумаба у пациентов с бронхиальной астмой изменялась пропорционально дозе подкожно вводимого бенрализумаба (от 2 мг до 200 мг).
Всасывание
После подкожного введения пациентам с бронхиальной астмой период полуабсорбции составлял 3,5 дня. На основании результатов популяционного анализа фармакокинетики расчетная абсолютная биодоступность составила приблизительно 59%, клинически значимые различия в биодоступности при введении в область живота, бедра или плеча не наблюдались.
Распределение
На основании результатов популяционного анализа фармакокинетики центральный и периферический объем распределения бенрализумаба составил 3,1 л и 2,5 л, соответственно, у пациента с массой тела 70 кг.
Метаболизм
Бенрализумаб представляет собой гуманизированное моноклональное антитело класса IgGl. Бенрализумаб расщепляется с участием протеолитических ферментов, которые широко распределены по всему организму человека и не локализованы только в печени.
Выведение
Популяционный анализ фармакокинетики бенрализумаба продемонстрировал, что фармакокинетика препарата носит линейный характер, и его выведение из организма не зависит от связывания с каким-либо рецептором. Рассчитанный системный клиренс бенрализумаба составляет 0,29 л/день у пациента с массой тела 70 кг. После подкожного введения период полувыведения составляет приблизительно 15,5 дней.
Фармакокинетика у особых групп пациентов
Пожилой возраст (≥ 65 лет)
Популяционный анализ фармакокинетики показал, что возраст пациента не влиял на фармакокинетику бенрализумаба.
Пол, раса
Популяционный анализ фармакокинетики показал, что пол и расовая принадлежность существенно не влияли на клиренс бенрализумаба.
Нарушение функции почек
Клинических исследований для изучения влияния нарушения функции почек на фармакокинетические параметры бенрализумаба не проводилось. Популяционный анализ фармакокинетики показал, что клиренс бенрализумаба у пациентов с клиренсом креатинина от 30 до 80 мл/мин сопоставим с клиренсом бенрализумаба у пациентов с нормальной функцией почек. Данные о пациентах с клиренсом креатинина менее 30 мл/мин ограничены; тем не менее, бенрализумаб не выводится почками.
Нарушение функции печени
Клинических исследований бенрализумаба у пациентов с нарушением функции печени не проводилось. Метаболизм в печени не является основным способом выведения моноклональных антител класса IgG; изменение функции печени не должно сопровождаться изменением клиренса бенрализумаба. Согласно результатам популяционного анализа фармакокинетики, исходные параметры биомаркеров функции печени (АЛТ, ACT и билирубин) не оказывают клинически значимого эффекта на клиренс бенрализумаба.
Детский возраст
Популяционный анализ фармакокинетики показал, что фармакокинетика бенрализумаба у подростков в возрасте 12-17 лет соответствовала таковой у взрослых. Бенрализумаб не изучался у детей в возрасте 5-11 лет (см. раздел «Способ применения и дозы»).
Лекарственные взаимодействия
Клинических исследований для изучения лекарственных взаимодействий не проводилось. Ожидается, что применение бенрализумаба не будет оказывать какого-либо влияния на фармакокинетику одновременно применяемых препаратов. Согласно результатам популяционного анализа, часто применяемые одновременно с бенрализумабом препараты у пациентов с бронхиальной астмой не оказывают никакого влияния на клиренс бенрализумаба.
Показания к применению
Тяжелая бронхиальная астма с эозинофильным фенотипом у взрослых пациентов в качестве дополнительной поддерживающей терапии.
Противопоказания
- Повышенная чувствительность к бенрализумабу или вспомогательным веществам, входящим в состав препарата.
- Детский возраст до 18 лет.
С осторожностью:
беременность и период грудного вскармливания, пациенты с повышенным риском развития гельминтных инвазий.
Применение при беременности и в период грудного вскармливания
Беременность
Данных о применении препарата у беременных в клинических исследованиях недостаточно для информирования о рисках, связанных с применением препарата.
Моноклональные антитела, такие как бенрализумаб, проникают через плацентарный барьер, и по мере прогрессирования беременности проницаемость плаценты для бенрализумаба увеличивается. Следовательно, потенциальное воздействие на плод наиболее вероятно во втором и третьем триместрах беременности.
В исследовании влияния препарата на развитие плода в пренатальный и постнатальный периоды беременные яванские макаки получали бенрализумаб с 20 по 22 день гестации (в зависимости от срока определения беременности), на 35 день гестации, один раз в 14 дней в течение всего периода гестации и затем спустя 1 месяц после родов в дозах 10 мг/кг и 30 мг/кг внутривенно болюсно. Применение бенрализумаба не сопровождалось развитием нежелательных реакций у матери, плода или новорожденного, а также нарушением постнатального развития.
Рекомендуется избегать применения препарата Фазенра при беременности. Назначение препарата Фазенра беременным женщинам возможно только в случае, если ожидаемая польза для матери превышает любые возможные риски для плода.
Грудное вскармливание
Неизвестно, проникает ли бенрализумаб в молоко животных или грудное молоко человека, поэтому нельзя исключить риск для ребенка, получающего грудное вскармливание. Следует оценить пользу грудного вскармливания для здоровья и развития новорожденного, пользу от терапии бенрализумабом для матери и принять решение либо о прекращении грудного вскармливания, либо о приостановлении/прекращении терапии бенрализумабом.
Фертильность
Исследований по изучению влияния препарата на фертильность у людей не проводились.
Влияние бенрализумаба на фертильность изучалось в исследовании с повторным введением препарата на протяжении 9 месяцев яванским макакам внутривенно в дозах до 25 мг/кг или подкожно в дозах до 30 мг/кг однократно каждые 2 недели (что приблизительно в 409 и 275 раз выше максимальной рекомендованной дозы у человека на основании AUC, и в 396 и 193 раза выше максимальной рекомендованной дозы у человека на основании Сmax). Влияния бенрализумаба на репродуктивную функцию у самцов и самок отмечено не было.
Способ применения и дозы
Для подкожного введения. В соответствии с требованиями клинической практики рекомендуется проводить наблюдение за пациентами после инъекции биологических препаратов (см. раздел «Побочное действие», Реакции гиперчувствительности). Препарат вводят в область плеча, бедра или живота. Не следует вводить препарат в чувствительную область, в область ушиба, гематомы или уплотнения.
Перед введением препарат Фазенра в оригинальной упаковке необходимо оставить в помещении при комнатной температуре в течение 30 минут. Препарат Фазенра необходимо ввести в течение 24 часов или утилизировать в соответствии с локальными инструкциями.
Не следует встряхивать препарат. Препарат Фазенра не следует применять, если он был заморожен.
Дозы
Рекомендуемая доза препарата Фазенра составляет 30 мг. Препарат необходимо вводить один раз в 4 недели (первые 3 инъекции) и затем один раз в 8 недель. Если инъекция препарата пропущена в запланированное время, следует ее выполнить как можно быстрее; двойная доза в связи с пропуском препарата не может быть назначена.
Применение у особых групп пациентов
Дети
Безопасность и эффективность бенрализумаба у пациентов младше 18 лет не были установлены.
Пациенты пожилого возраста
Пациентам пожилого возраста коррекция дозы не требуется (см. раздел «Фармакокинетика»).
Нарушение функции почек и печени
Пациентам с нарушением функции почек и печени коррекция дозы не требуется (см. раздел «Фармакокинетика»).
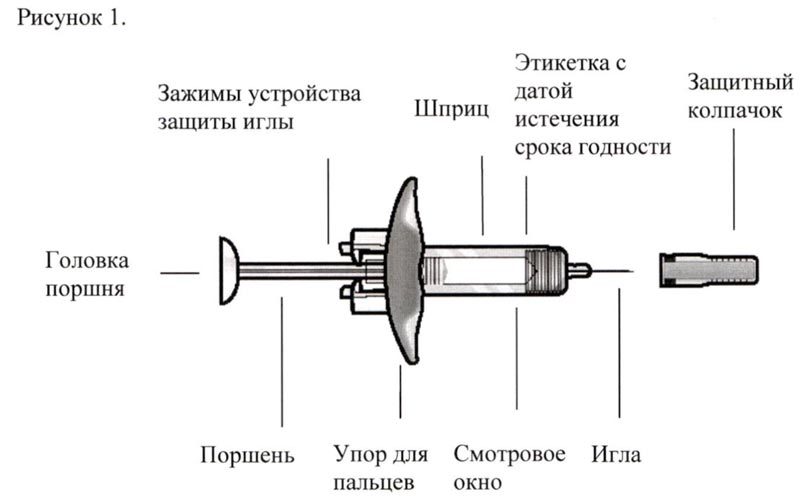
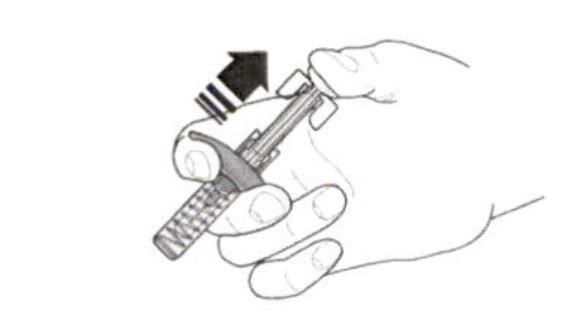
Инструкция по использованию препарата Фазенра в шприце с безопасной системой введения
В целях предотвращения преждевременной активации устройства защиты иглы не касайтесь зажимов устройства защиты иглы.
- Возьмите шприц, не касаясь поршня, и извлеките из упаковки. Проверьте этикетку с датой истечения срока годности. Перед введением препарата Фазенра осмотрите его на наличие частиц и изменение цвета. Препарат Фазенра должен быть от прозрачного до опалесцирующего, от бесцветного до желтого цвета и может содержать несколько прозрачных или от белого до почти белого цвета частиц. Не используйте препарат Фазенра, если раствор мутный, имеет другой цвет или при наличии крупных частиц или инородных тел. В шприце может быть небольшой пузырёк воздуха; это нормально. Не пытайтесь удалить пузырёк перед введением препарата.
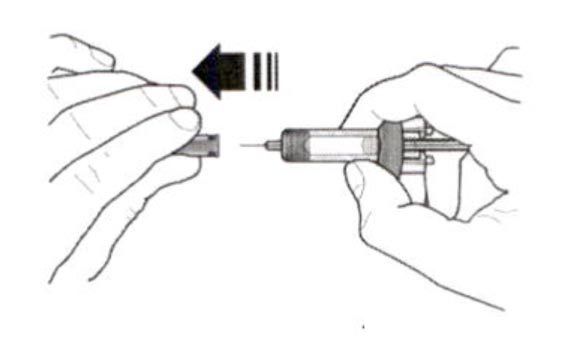
- Не снимайте колпачок иглы до момента непосредственного введения. Держите шприц одной рукой и снимите колпачок, потянув за него. В процессе снятия колпачка не держитесь за поршень или головку поршня; в противном случае поршень может переместиться. Если шприц поврежден или нестерилен (например, упал на пол без колпачка), его необходимо утилизировать и использовать новый.
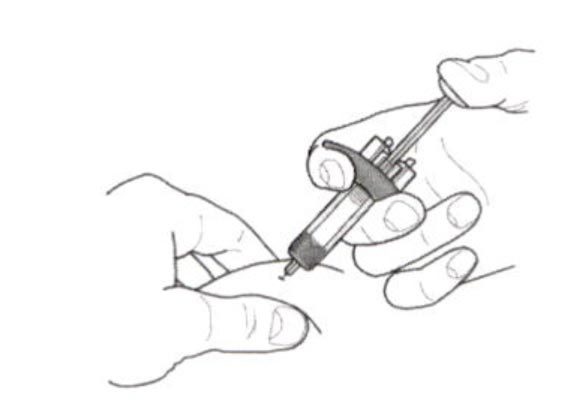
- Аккуратно возьмите кожную складку и введите иглу (например, в область плеча, бедра или живота).
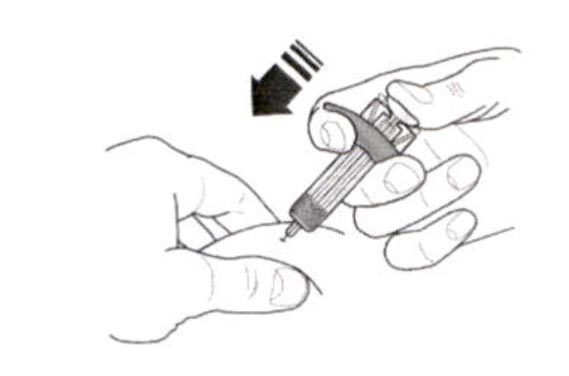
- Введите весь препарат, нажимая на поршень до упора, пока головка поршня не окажется целиком за фиксаторами устройства защиты иглы. Это необходимо для активации устройства защиты иглы.
- После введения препарата извлеките иглу из кожи, продолжая нажимать на поршень большим пальцем. Прекратите оказывать давление на поршень для активации устройства защиты иглы. Не надевайте колпачок на шприц.
- Утилизируйте шприц в соответствии с локальными требованиями.
Побочное действие
Профиль безопасности
В клинических исследованиях с участием пациентов с тяжелой бронхиальной астмой и эозинофильным фенотипом наиболее часто отмечаемыми побочными реакциями были головная боль и фарингит.
Побочные реакции в клинических исследованиях
В двух плацебо-контролируемых исследованиях фазы III продолжительностью от 48 до 56 недель лечения 1663 пациента с тяжелой неконтролируемой бронхиальной астмой получали бенрализумаб. В Таблице 1 представлены побочные реакции, отмеченные в двух плацебо-контролируемых исследованиях у пациентов, получавших бенрализумаб 30 мг однократно каждые 4 недели (первые 3 дозы), а затем каждые 8 недель. Частота возникновения побочных реакций представлена в следующей градации: очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (≥1/1000, <1/100), редко (≥1/10000, <1/1000), очень редко (<1/10000), неуточненной частоты (частота не может быть определена на основании имеющихся данных). Внутри одной категории частоты реакции представлены в порядке убывания серьезности.
Таблица 1. Перечень побочных реакций бенрализумаба
| Класс системы органов | Побочные реакции | Частота |
| Нервная система | Головная боль | часто |
| Инфекции и инвазии | Фарингит1 | часто |
| Общие нарушения и нарушения в месте введения | Лихорадка Реакции в месте введения |
часто |
| Нарушения иммунной системы | Реакции гиперчувствительности2 | часто |
1Фарингит включал в себя следующие термины: «фарингит», «бактериальный фарингит», «вирусный фарингит», «стрептококковый фарингит».
2 Реакции гиперчувствительности включали в себя следующие термины: «крапивница», «папулёзная крапивница» и «кожная сыпь» (см. раздел «Особые указания»).
Описания отдельных побочных реакций
Реакции в месте введения
В плацебо-контролируемых исследованиях реакции в месте введения (такие как боль, эритема, кожный зуд, папула) имели место у 2,2% пациентов, получавших бенрализумаб в рекомендованной дозе, и у 1,9% пациентов в группе плацебо.
Постмаркетинговые данные
Как правило, достоверная оценка частоты побочных реакций не представляется возможной, поскольку информацию получают в виде спонтанных сообщений от популяции неустановленного размера. Следовательно, такие побочные реакции являются реакциями неуточненной частоты (частота не может быть определена на основании имеющихся данных).
Со стороны иммунной системы: анафилаксия (определяемая групповыми терминами предпочтительного употребления: «анафилактическая реакция», «ангионевротический отек»).
Передозировка
В клинических исследованиях пациенты с эозинофилией получали препарат подкожно в дозах до 200 мг, при этом каких-либо дозозависимых токсических реакций не наблюдалось. Специфическое лечение передозировки бенрализумабом отсутствует. В случае передозировки необходимо проводить поддерживающую терапию и вести наблюдение за состоянием пациента.
Взаимодействие с другими лекарственными препаратами
Клинических исследований по изучению лекарственных взаимодействий не проводилось. Ферменты семейства цитохрома Р450, эффлюксные насосы и механизмы связывания с белками не вовлечены в клиренс бенрализумаба. Экспрессия IL-5Rα на гепатоцитах не была установлена. Снижение количества эозинофилов не сопровождается системным изменением уровня провоспалительных цитокинов.
Особые указания
Препарат Фазенра не предназначен для лечения обострения бронхиальной астмы. Следует информировать пациентов о необходимости обратиться к врачу, если после начала терапии добиться контроля заболевания не удалось, или имеет место ухудшение течения заболевания.
После начала применения препарата Фазенра не следует резко отменять пероральные глюкокортикостероиды. При необходимости, снижение дозы пероральных глюкокортикостероидов следует производить поэтапно и под наблюдением врача. Лечащему врачу следует периодически повторно оценивать необходимость продолжения терапии препаратом.
Реакции гиперчувствительноcmи
После введения препарата Фазенра отмечались реакции гиперчувствительности (такие как анафилаксия, ангионевротический отек, крапивница, папулезная крапивница, кожная сыпь). Эти реакции могут развиваться в течение нескольких часов после введения препарата Фазенра, однако, в некоторых случаях реакции развиваются позже (спустя несколько дней). При симптомах реакции гиперчувствительности пациенту следует прекратить применение препарата Фазенра.
Паразитарные инвазии (гельминтозы)
Эозинофилы могут принимать непосредственное участие в развитии иммунологической реакции организма в ответ на паразитарную инвазию. Пациенты с гельминтозами были исключены из клинических исследований. Вероятность изменения реакции организма на гельминтоз при введении препарата Фазенра не установлена.
Перед началом применения препарата Фазенра необходимо провести лечение ранее выявленного гельминтоза. Если паразитарная инвазия развилась на фоне применения препарата Фазенра, и пациент не отвечает на применение противогельминтных средств, необходимо прекратить лечение препаратом Фазенра до разрешения паразитарной инвазии.
Влияние на способность к управлению транспортными средствами и механизмами
Препарат Фазенра не влияет или оказывает незначительное влияние на способность к управлению транспортными средствами и механизмами.
Форма выпуска
Раствор для подкожного введения, 30 мг/мл.
По 1,0 мл в стеклянный шприц (тип I Евр. Ф.) с иглой, защитным колпачком для иглы, безопасной системой введения и вытянутым упором для пальцев. По 1 шприцу в запечатанной контурной ячейковой упаковке. По 1 контурной ячейковой упаковке с инструкцией по применению препарата в картонной пачке с контролем первого вскрытия.
Условия хранения
При температуре от 2 до 8 °С.
Хранить в местах, недоступных для детей.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска
Отпускают по рецепту.
Наименование и юридический адрес держателя (владельца) регистрационного удостоверения
АстраЗенека АБ, SE-151 85 Содерталье, Швеция
AstraZeneca АВ, SE-151 85 Sodertalje, Sweden
Производитель, фасовщик (первичная упаковка), упаковщик (вторичная (потребительская) упаковка)
Кук Фармика ЛЛС, США
1300 Саут Паттерсон Драйв, Блумингтон, Индиана 47403, США
Cook Pharmica LLC, USA
1300 South Patterson Drive, Bloomington, IN 47403, USA
Выпускающий контроль качества
АстраЗенека Фармасьютикалс ЛП
633 Ресерч Корт, Фредерик, Мэриленд (MD) 21703, США
AstraZeneca Pharmaceuticals LP
633 Research Court, Frederick, Maryland (MD) 21703, USA
Наименование, адрес организации, уполномоченной держателем или владельцем регистрационного удостоверения лекарственного препарата для медицинского применения на принятие претензий от потребителя:
Представительство АстраЗенека ЮК Лимитед, Великобритания, в г. Москве и ООО АстраЗенека Фармасьютикалз
125284 Москва, ул. Беговая д. 3, стр. 1
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Обобщенные научные материалы по действующему веществу препарата Фазенра (раствор для подкожного введения, 30 мг/мл)
Дата последней актуализации: 22.04.2020
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Владелец РУ
- Условия хранения
- Срок годности
- Источники информации
- Фармакологическая группа
- Характеристика
- Фармакология
- Показания к применению
- Противопоказания
- Ограничения к применению
- Применение при беременности и кормлении грудью
- Побочные действия
- Взаимодействие
- Передозировка
- Способ применения и дозы
- Меры предосторожности
- Заказ в аптеках Москвы
- Отзывы
Действующее вещество
ATX
Владелец РУ
АстраЗенека АБ
Условия хранения
В защищенном от света месте, при температуре от 2 до 8 °C, в оригинальной упаковке, не замораживать.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Источники информации
Обобщенные материалы www.grls.rosminzdrav.ru, 2019.
Фармакологическая группа
Характеристика
Антиэозинофильное гуманизированное, афукозилированное моноклональное антитело (IgG1/каппа).
Фармакология
Фармакодинамика
Механизм действия
Бенрализумаб связывается с альфа-субъединицей рецептора к человеческому интерлейкину-5 (IL-5Rα), обладая высоким сродством (16 пМ) и специфичностью. Рецептор к IL-5 находится на поверхности эозинофилов и базофилов. Отсутствие фукозы в Fc-домене бенрализумаба облегчает процесс связывания (45,5 нМ) с Fcγ RHI-рецепторами на поверхности иммунных эффекторных клеток, таких как натуральные киллеры, что приводит к апоптозу эозинофилов и базофилов посредством антителозависимой клеточноопосредованной цитотоксичности (АЗКЦ).
Эозинофильное воспаление является важным компонентом патогенеза бронхиальной астмы. В эозинофилах содержатся медиаторы воспаления (такие как эйкозаноиды, лейкотриены, цитокины) и белковые гранулы (такие как эозинофильный катионный белок, эозинофильная пероксидаза, эозинофильный нейротоксин и главный основной белок). Бенрализумаб посредством АЗКЦ уменьшает эозинофильное воспаление.
Фармакодинамические свойства
Фармакодинамический ответ (уменьшение количества эозинофилов в крови) после п/к введения бенрализумаба пациентам с бронхиальной астмой изучался в 12-нед исследовании II фазы. Пациенты получали в виде п/к инъекций бенрализумаб в одной из трех доз (25 мг (N=7), 100 мг (N=6) и 200 мг (N=6) или плацебо (N=6) однократно каждые 4 нед (всего 3 дозы). Исходная медиана количества эозинофилов до начала лечения составляла 400, 200, 120 и 200 клеток/мкл для групп бенрализумаба 25 мг, 100 мг, 200 мг и плацебо соответственно.
Снижение количества эозинофилов в крови после п/к введения бенрализумаба было отмечено для всех доз и не наблюдалось в группе плацебо. Через 24 ч после введения отмечалось полное или практически полное снижение медианы количества эозинофилов в крови (0; 0 и 5 клеток/мкл соответственно). В группе плацебо медиана количества эозинофилов в крови не изменилась. Эффект в отношении количества эозинофилов сохранялся на протяжении терапии.
В клиническом исследовании I фазы изучалось влияние бенрализумаба на эозинофилы в слизистой оболочке дыхательных путей у пациентов с бронхиальной астмой с содержанием эозинофилов в мокроте 2,5% и более. Пациенты получали бенрализумаб 100 или 200 мг п/к однократно каждые 4 нед в течение 8 нед (общее количество пациентов, получавших бенрализумаб, N=9) или плацебо (N=5). По окончании 12-нед периода лечения медиана снижения количества эозинофилов в слизистой оболочке дыхательных путей у пациентов, получавших бенрализумаб, составила 96% по сравнению с 47% в группе плацебо (статистически значимое различие, р=0,039).
В клиническом исследовании I фазы лечение бенрализумабом также сопровождалось снижением уровня базофилов крови и в исследованиях I и II фазы — сывороточной концентрации веществ, содержащихся в гранулах эозинофилов, таких как эозинофильный нейротоксин и эозинофильный катионный белок.
В исследованиях I и II фазы после введения бенрализумаба в рекомендованной дозе медиана абсолютного количества эозинофилов в крови составила 0 клеток/мкл, что соответствует медиане снижения 100%. Это снижение было отмечено уже при первом измерении, после 4 нед терапии, и сохранялось на протяжении терапии.
Иммуногенностъ
В целом антитела к бенрализумабу обнаружены у 107 из 809 (13%) пациентов, получавших его по рекомендованной схеме в течение 48 и 56 нед. У большинства пациентов с наличием антител были выявлены нейтрализующие антитела. Наличие антител к бенрализумабу ассоциировалось с повышением клиренса бенрализумаба и повышенным уровнем эозинофилов в крови у пациентов с высокими титрами антител к бенрализумабу в сравнении с пациентами без антител. Данных о наличии связи между образованием антител и эффективностью и безопасностью бенрализумаба не получено.
Представленные данные получены у пациентов с наличием антител к бенрализумабу по результатам специфических методов определения. Наблюдаемая частота образования антител (в т.ч. нейтрализующих) может зависеть от нескольких факторов, включая анализ чувствительности и специфичности, метод определения, условия хранения проб, время сбора проб, применение сопутствующих ЛС и основное заболевание. По этим причинам сравнение частоты случаев образования антител к бенрализумабу с таковой к другим ЛС в других исследованиях может давать недостоверные результаты.
Фармакокинетика
Фармакокинетика бенрализумаба у пациентов с бронхиальной астмой изменялась пропорционально дозе бенрализумаба (от 2 до 200 мг), вводимого п/к.
Всасывание
После п/к введения пациентам с бронхиальной астмой период полуабсорбции составлял 3,5 дня. На основании результатов популяционного анализа фармакокинетики, расчетная абсолютная биодоступность составила приблизительно 59%, клинически значимые различия в биодоступности при введении в область живота, бедра или плеча не наблюдались.
Распределение
На основании результатов популяционного анализа фармакокинетики, центральный и периферический Vd бенрализумаба составил 3,1 и 2,5 л соответственно у пациента с массой тела 70 кг.
Метаболизм
Бенрализумаб представляет собой гуманизированное моноклональное антитело класса IgG1. Он расщепляется с участием протеолитических ферментов, которые широко распределены по всему организму человека и не локализованы только в печени.
Выведение
Популяционный анализ фармакокинетики бенрализумаба продемонстрировал, что она носит линейный характер и выведение бенрализумаба из организма не зависит от связывания с каким-либо рецептором. Рассчитанный системный клиренс бенрализумаба составляет 0,29 л/сут у пациента с массой тела 70 кг. После п/к введения T1/2 составляет приблизительно 15,5 дня.
Особые группы пациентов
Пожилой возраст (>65 лет). Популяционный анализ фармакокинетики показал, что возраст пациента не влиял на фармакокинетику бенрализумаба.
Пол, раса. Популяционный анализ фармакокинетики показал, что пол и расовая принадлежность существенно не влияли на клиренс бенрализумаба.
Нарушение функции почек. Клинических исследований для изучения влияния нарушения функции почек на фармакокинетические параметры бенрализумаба не проводилось. Популяционный анализ фармакокинетики показал, что клиренс бенрализумаба у пациентов с Cl креатинина от 30 до 80 мл/мин сопоставим с таковым у пациентов с нормальной функцией почек. Данные о пациентах с Cl креатинина менее 30 мл/мин ограничены, тем не менее бенрализумаб не выводится почками.
Нарушение функции печени. Клинических исследований бенрализумаба у пациентов с нарушением функции печени не проводилось. Метаболизм в печени не является основным способом выведения моноклональных антител класса IgG; изменение функции печени не должно сопровождаться изменением клиренса бенрализумаба. Согласно результатам популяционного анализа фармакокинетики, исходные параметры биомаркеров функции печени (АЛТ, ACT и билирубин) не оказывают клинически значимого эффекта на клиренс бенрализумаба.
Детский возраст. Популяционный анализ фармакокинетики показал, что фармакокинетика бенрализумаба у подростков в возрасте 12–17 лет соответствовала таковой у взрослых. Бенрализумаб не изучался у детей в возрасте 5–11 лет.
Взаимодействие
Клинических исследований для изучения взаимодействия бенрализумаба и других ЛС не проводилось. Ожидается, что применение бенрализумаба не будет оказывать какого-либо влияния на фармакокинетику одновременно применяемых ЛС. Согласно результатам популяционного анализа, ЛС, часто применяемые одновременно с бенрализумабом, не оказывают влияния на клиренс бенрализумаба у пациентов с бронхиальной астмой.
Показания к применению
Тяжелая бронхиальная астма с эозинофильным фенотипом у взрослых пациентов, в качестве дополнительной поддерживающей терапии.
Противопоказания
Повышенная чувствительность к бенрализумабу; детский возраст до 18 лет.
Ограничения к применению
Беременность и период грудного вскармливания; повышенный риск развития гельминтных инвазий.
Применение при беременности и кормлении грудью
Данных о применении бенрализумаба у беременных в клинических исследованиях недостаточно для информирования о рисках, связанных с его применением.
Моноклональные антитела, такие как бенрализумаб, проникают через плацентарный барьер, и по мере прогрессирования беременности проницаемость плаценты для бенрализумаба увеличивается. Следовательно, потенциальное воздействие на плод наиболее вероятно во втором и третьем триместрах беременности.
В исследовании влияния бенрализумаба на развитие плода в пренатальный и постнатальный периоды беременные яванские макаки получали бенрализумаб с 20 по 22-й день гестации (в зависимости от срока определения беременности), на 35-й день гестации, один раз в 14 дней в течение всего периода гестации и затем спустя 1 мес после родов в дозах 10 и 30 мг/кг в/в болюсно. Применение бенрализумаба не сопровождалось развитием нежелательных реакций у матери, плода или новорожденного, а также нарушением постнатального развития.
Рекомендуется избегать применения бегрализумаба при беременности. Назначение бенрализумаба беременным женщинам возможно только в случае, если ожидаемая польза для матери превышает любые возможные риски для плода.
Неизвестно, проникает ли бенрализумаб в молоко животных или грудное молоко человека, поэтому нельзя исключить риск для ребенка, получающего грудное вскармливание. Следует оценить пользу грудного вскармливания для здоровья и развития новорожденного, пользу от терапии бенрализумабом для матери и принять решение либо о прекращении грудного вскармливания, либо о приостановлении/прекращении терапии бенрализумабом.
Фертильность. Исследования по изучению влияния бенрализумаба на фертильность у людей не проводились. Влияние бенрализумаба на фертильность изучалось в исследовании с повторным введением на протяжении 9 мес яванским макакам в/в в дозах до 25 мг/кг или п/к в дозах до 30 мг/кг однократно каждые 2 нед (что приблизительно в 409 и 275 раз выше максимальной рекомендованной дозы у человека на основании AUC, и в 396 и 193 раза выше максимальной рекомендованной дозы у человека на основании Сmах). Влияния бенрализумаба на репродуктивную функцию у самцов и самок отмечено не было.
Побочные действия
Профиль безопасности
В клинических исследованиях с участием пациентов с тяжелой бронхиальной астмой и эозинофильным фенотипом наиболее часто отмечаемыми побочными реакциями были головная боль и фарингит.
Побочные реакции в клинических исследованиях
В двух плацебо-контролируемых исследованиях III фазы продолжительностью от 48 до 56 нед лечения 1663 пациента с тяжелой неконтролируемой бронхиальной астмой получали бенрализумаб. Ниже представлены побочные реакции, отмеченные в этих исследованиях у пациентов, получавших бенрализумаб 30 мг однократно каждые 4 нед (первые 3 дозы), а затем каждые 8 нед. Частота возникновения побочных реакций представлена в следующей градации: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000); неуточненной частоты (частота не может быть определена на основании имеющихся данных). Внутри одной категории частоты реакции представлены в порядке убывания серьезности.
Перечень побочных реакций
Со стороны нервной системы: часто — головная боль.
Инфекции и инвазии: часто — фарингит1.
Общие нарушения и нарушения в месте введения: часто — лихорадка и реакции в месте введения.
Со стороны иммунной системы: часто — реакции гиперчувствительности2.
1 Фарингит включал в себя следующие термины: «фарингит», «бактериальный фарингит», «вирусный фарингит», «стрептококковый фарингит».
2 Реакции гиперчувствительности включали в себя следующие термины: «крапивница», «папулезная крапивница» и «кожная сыпь» (см. «Меры предосторожности»).
Описания отдельных побочных реакций
Реакции в месте введения. В плацебо-контролируемых исследованиях реакции в месте введения (такие как боль, эритема, кожный зуд, папула) отмечались у 2,2% пациентов, получавших бенрализумаб в рекомендованной дозе, и у 1,9% пациентов в группе плацебо.
Постмаркетинговые данные. Как правило, достоверная оценка частоты побочных реакций не представляется возможной, поскольку информацию получают в виде спонтанных сообщений от популяции неустановленного размера. Следовательно, такие побочные реакции являются реакциями неуточненной частоты (частота не может быть определена на основании имеющихся данных).
Со стороны иммунной системы: анафилаксия (определяемая групповыми терминами предпочтительного употребления «анафилактическая реакция», «ангионевротический отек»).
Взаимодействие
Клинических исследований по изучению лекарственных взаимодействий не проводилось.
Ферменты семейства цитохрома Р450, эффлюксные насосы и механизмы связывания с белками не вовлечены в клиренс бенрализумаба. Экспрессия IL-5Rα на гепатоцитах не установлена. Снижение количества эозинофилов не сопровождается системным изменением уровня провоспалительных цитокинов.
Передозировка
В клинических исследованиях пациенты с эозинофилией получали бенрализумаб п/к в дозах до 200 мг, при этом каких-либо дозозависимых токсических реакций не наблюдалось.
Специфическое лечение передозировки бенрализумаба отсутствует. В случае передозировки необходимо проводить поддерживающую терапию и вести наблюдение за состоянием пациента.
Способ применения и дозы
П/к, в область плеча, бедра или живота, 1 раз в 4 нед (первые 3 инъекции) и затем 1 раз в 8 нед.
Меры предосторожности
Бенрализумаб не предназначен для лечения обострения бронхиальной астмы. Пациент должен быть проинформирован о необходимости обратиться к врачу, если после начала терапии добиться контроля заболевания не удалось или наблюдается ухудшение течения заболевания.
После начала применения бенрализумаба не следует резко отменять пероральные ГКС. При необходимости снижение дозы перорального ГКС следует производить поэтапно и под наблюдением врача.
Необходимо периодически оценивать необходимость продолжения терапии бенрализумабом.
Реакции гиперчувствительности
После введения бенрализумаба отмечались реакции гиперчувствительности (такие как анафилаксия, ангионевротический отек, крапивница, папулезная крапивница, кожная сыпь). Эти реакции могут развиваться в течение нескольких часов после введения бенрализумаба, однако в некоторых случаях могут развиваться позже (спустя несколько дней). При симптомах реакции гиперчувствительности пациенту следует прекратить применение бенрализумаба.
Паразитарные инвазии (гельминтозы)
Эозинофилы могут принимать непосредственное участие в развитии иммунологической реакции организма в ответ на паразитарную инвазию. Пациенты с гельминтозами были исключены из клинических исследований. Вероятность изменения реакции организма на гельминтоз при введении бенрализумаба не установлена. Перед началом его применения необходимо провести лечение ранее выявленного гельминтоза. Если паразитарная инвазия развилась на фоне применения бенрализумаба и пациент не отвечает на применение противогельминтных ЛС, необходимо прекратить лечение до разрешения паразитарной инвазии.
Влияние на способность к управлению транспортными средствами и механизмами. Бенрализумаб не влияет или оказывает незначительное влияние на способность к управлению транспортными средствами и механизмами.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Фазенра (Fasenra)
💊 Состав препарата Фазенра
✅ Применение препарата Фазенра
Описание активных компонентов препарата
Фазенра
(Fasenra)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2022.05.31
Владелец регистрационного удостоверения:
Код ATX:
R03DX10
(Бенрализумаб)
Лекарственная форма
| Фазенра |
Р-р д/п/к введения 30 мг/1 мл: шприц 1 мл, шприц-ручка 1 мл рег. №: ЛП-005492 |
Форма выпуска, упаковка и состав
препарата Фазенра
Раствор для п/к введения в виде от прозрачной до опалесцирующей, от бесцветной до желтого цвета жидкости.
Вспомогательные вещества: L-гистидин — 1.4 мг, L-гистидина гидрохлорида моногидрат — 2.3 мг, α,α-трегалозы дигидрат — 95 мг, полисорбат 20 (растительного происхождения) — 0.06 мг, вода д/и — приблизительно 910 мг.
1 мл — шприцы стеклянные (1) с иглой, защитным колпачком для иглы, безопасным устройством введения и вытянутым упором для пальцев — упаковки ячейковые контурные (1) — пачки картонные с контролем первого вскрытия.
1 мл — шприцы стеклянные (1) с иглой и защитным колпачком для иглы, встроенный в шприц-ручку, состоящую из блока привода и блока для шприца — пачки картонные с контролем первого вскрытия.
Фармакологическое действие
Лекарственное средство, применяемое при обструктивных заболеваниях дыхательных путей.
Бенрализумаб представляет собой антиэозинофильное гуманизированное, афукозилированное, моноклональное антитело (IgG1/каппа). Бенрализумаб связывается с альфа-субъединицей рецептора к человеческому интерлейкину-5 (IL-5Rα), обладая высоким сродством (16 пМ) и специфичностью. Рецептор к IL-5 находится на поверхности эозинофилов и базофилов. Отсутствие фукозы в Fc домене бенрализумаба облегчает процесс связывания (45.5 нМ) с FcγRIII-рецепторами на поверхности иммунных эффекторных клеток, таких как натуральные киллеры, что приводит к апоптозу эозинофилов и базофилов посредством антитело-зависимой клеточно-опосредованной цитотоксичности (АЗКЦ).
Эозинофильное воспаление является важным компонентом патогенеза бронхиальной астмы. В эозинофилах содержатся медиаторы воспаления (такие как эйкозаноиды, лейкотриены, цитокины) и белковые гранулы (такие как эозинофильный катионный белок, эозинофильная пероксидаза, эозинофильный нейротоксин и главный основной белок). Бенрализумаб, посредством АЗКЦ, уменьшает эозинофильное воспаление.
У большинства пациентов с наличием антител были выявлены нейтрализующие антитела. Наличие антител к бенрализумабу ассоциировалось с повышением клиренса бенрализумаба и повышенным уровнем эозинофилов в крови у пациентов с высокими титрами антител к лекарственному средству в сравнении с пациентами без антител.
Фармакокинетика
После подкожного введения пациентам с бронхиальной астмой период полуабсорбции составлял 3.5 дня. На основании результатов популяционного анализа фармакокинетики расчетная абсолютная биодоступность составила приблизительно 59%, клинически значимые различия в биодоступности при введении в область живота, бедра или плеча не наблюдались. На основании результатов популяционного анализа фармакокинетики центральный и периферический Vd бенрализумаба составил 3.1 л и 2.5 л, соответственно, у пациента с массой тела 70 кг.
Бенрализумаб представляет собой гуманизированное моноклональное антитело класса IgG1. Бенрализумаб расщепляется с участием протеолитических ферментов, которые широко распределены по всему организму человека и не локализованы только в печени. Популяционный анализ фармакокинетики бенрализумаба продемонстрировал, что фармакокинетика препарата носит линейный характер, и его выведение из организма не зависит от связывания с каким-либо рецептором. Рассчитанный системный клиренс бенрализумаба составляет 0.29 л/день у пациента с массой тела 70 кг. После подкожного введения T1/2 составляет приблизительно 15.5 дней.
Показания активных веществ препарата
Фазенра
Тяжелая бронхиальная астма с эозинофильным фенотипом у взрослых пациентов в качестве дополнительной поддерживающей терапии.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Для п/к введения. Лекарственное средство вводят в область плеча, бедра или живота.
Рекомендуемая доза составляет 30 мг. Необходимо вводить один раз в 4 недели (первые 3 инъекции) и затем один раз в 8 недель. Если инъекция пропущена в запланированное время, следует ее выполнить как можно быстрее; двойная доза в связи с пропуском не может быть назначена.
Побочное действие
Со стороны нервной системы: часто — головная боль.
Со стороны иммунной системы: часто — реакции гиперчувствительности.
Инфекции и инвазии: часто — фарингит.
Системные реакции: часто — лихорадка.
Местные реакции: часто — реакции в месте введения.
Противопоказания к применению
Детский возраст до 18 лет.
С осторожностью
Беременность и период грудного вскармливания, пациенты с повышенным риском развития гельминтных инвазий.
Применение при беременности и кормлении грудью
Рекомендуется избегать применения лекарственного средства при беременности. Применение при беременности возможно только в том случае, когда предполагаемая польза для матери превосходит потенциальный риск для плода.
Следует оценить пользу грудного вскармливания для здоровья и развития новорожденного, пользу от терапии бенрализумабом для матери и принять решение либо о прекращении грудного вскармливания, либо о приостановлении/прекращении терапии бенрализумабом.
Применение при нарушениях функции печени
Пациентам с нарушением функции печени коррекция дозы не требуется.
Применение при нарушениях функции почек
Пациентам с нарушением функции почек коррекция дозы не требуется.
Применение у детей
Применение противопоказано в детском возрасте до 18 лет.
Применение у пожилых пациентов
Коррекция дозы не требуется.
Особые указания
Лекарственное средство не предназначено для лечения обострения бронхиальной астмы. Следует информировать пациентов о необходимости обратиться к врачу, если после начала терапии добиться контроля заболевания не удалось, или имеет место ухудшение течения заболевания.
После начала применения не следует резко отменять пероральные ГКС. При необходимости, снижение дозы пероральных ГКС следует производить поэтапно и под наблюдением врача. Лечащему врачу следует периодически повторно оценивать необходимость продолжения терапии лекарственным средством.
После введения бенрализумаба отмечались реакции гиперчувствительности (такие как анафилаксия, ангионевротический отек, крапивница, папулезная крапивница, кожная сыпь). Эти реакции могут развиваться в течение нескольких часов после введения, однако, в некоторых случаях реакции развиваются позже (спустя несколько дней). При симптомах реакции гиперчувствительности пациенту следует прекратить применение лекарственного средства.
Эозинофилы могут принимать непосредственное участие в развитии иммунологической реакции организма в ответ на паразитарную инвазию. Пациенты с гельминтозами были исключены из клинических исследований. Вероятность изменения реакции организма на гельминтоз при введении бенрализумаба не установлена.
Перед началом применения необходимо провести лечение ранее выявленного гельминтоза. Если паразитарная инвазия развилась на фоне применения лекарственного средства, и пациент не отвечает на применение противогельминтных средств, необходимо прекратить лечение до разрешения паразитарной инвазии.
Лекарственное взаимодействие
Ферменты семейства цитохрома Р450, эффлюксные насосы и механизмы связывания с белками не вовлечены в клиренс бенрализумаба. Экспрессия IL-5Rα на гепатоцитах не была установлена. Снижение количества эозинофилов не сопровождается системным изменением уровня провоспалительных цитокинов.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Фазенра®
МНН: Бенрализумаб
Производитель: Catalent Indiana LLC
Анатомо-терапевтическо-химическая классификация: Бенрализумаб
Номер регистрации в РК:
РК-БП-5№024939
Информация о регистрации в РК:
25.02.2021 — 25.02.2026
- Скачать инструкцию медикамента
Торговое название
Фазенра®
Международное непатентованное название
Бенрализумаб
Лекарственная
форма, дозировка
Раствор
для подкожного введения, 30 мг/1 мл
Фармакотерапевтическая группа
Фармакотерапевтическая
группа: Респираторная система..
Препараты
для лечения обструктивных заболеваний дыхательных путей. Другие
препараты системного действия при обструктивных заболеваниях
дыхательных путей. Другие препараты лечения
обструктивных заболеваний дыхательных путей
для системного использования. Бенрализумаб
Код
АТХ R03DX10
Показания к применению
Препарат
Фазенра®
применяется в качестве дополнительной поддерживающей терапии у
взрослых пациентов с тяжелой бронхиальной эозинофильной астмой,
недостаточно контролируемой, несмотря на использование высоких доз
ингаляционных кортикостероидов в комбинации с β-агонистами
длительного действия.
Перечень
сведений, необходимых до начала применения
Противопоказания
—
гиперчувствительность к активному веществу или любому из
вспомогательных веществ препарата
—
паразитарные инвазии (гельминтозы)
—
второй и третий триместры беременности и период грудного
вскармливания.
Необходимые
меры предосторожности при применении
Препарат
применяют по назначению врача. Следует проинформировать врача перед
назначением препарата и в период терапии препаратом в следующих
случаях:
— наличие паразитарной
инфекции или проживание в районе, где
распространены паразитарные инфекции, или посещение таковой местности
планируется в ближайшее время
— наличие аллергических
реакций на другие лекарственные препараты или на введение инъекции в
анамнезе
—
в случае, если не удается достичь адекватного контроля над астмой или
имеет место ухудшение течения заболевания во время лечения данным
препаратом
—
в случае появления симптомов аллергических реакций.
Взаимодействия
с другими лекарственными препаратами
Нет
данных о том, что лечение бенрализумабом влияет на гуморальный
иммунный ответ, вызванный сезонной вакцинацией против вируса гриппа.
Не ожидается влияния бенрализумаба на фармакокинетику совместно
вводимых лекарственных препаратов.
Ферменты
группы цитохрома P450, эффлюксные насосы и механизмы связывания с
белками не вовлечены в клиренс бенрализумаба. Нет доказательств
экспрессии IL-5Rα на гепатоцитах. Снижение количества
эозинофилов не сопровождается системным изменением уровня
противовоспалительных цитокинов.
Специальные
предупреждения
Препарат
Фазенра®
не предназначен для лечения обострения бронхиальной астмы.
Следует
информировать пациентов о необходимости обращения к врачу, в случае
если после начала терапии не удалось добиться адекватного контроля
заболевания, или имеет место ухудшение течения заболевания.
Не
рекомендуется резко отменять прием кортикостероидов после начала
лечения препаратом Фазенра®.
При необходимости, снижение дозы кортикостероидов следует производить
поэтапно и под наблюдением врача.
Реакции
гиперчувствительности
После
введения бенрализумаба отмечались острые системные реакции, в том
числе анафилактические реакции и реакции гиперчувствительности, такие
как крапивница, папулезная крапивница, сыпь. Эти реакции могут
развиваться в течении нескольких часов после введения препарата,
однако, в некоторых случаях реакции развиваются несколько позже (т.е.
через несколько дней).
Наличие
в анамнезе аллергических реакций немедленного типа (анафилаксии), не
связанных с применением бенрализумаба, может быть фактором риска
развития анафилаксии и после введения препарата Фазенра®.
В соответствии с требованиями клинической практики, после введения
препарата Фазенра®
следует контролировать состояние пациентов в течение необходимого
времени.
В
случае возникновения реакции гиперчувствительности следует полностью
прекратить лечение препаратом Фазенра®
и начать соответствующую терапию.
Паразитарные
инвазии (гельминтозы)
Эозинофилы
могут принимать непосредственное участие в развитии иммунологической
реакции организма в ответ на паразитарную инвазию. Вероятность
изменения реакции организма на гельминтоз при введении препарата
Фазенра®
не установлена.
Перед
началом применения препарата Фазенра®
следует провести лечение ранее выявленного гельминтоза. В случае,
если паразитарная инвазия развилась на фоне применения препарата
Фазенра®,
и пациент не отвечает на применение антигельминтных средств,
необходимо прекратить лечение препаратом Фазенра®
до разрешения паразитарной инвазии.
Применение в педиатрии
Безопасность
и эффективность препарата Фазенра®
у детей и подростков в возрасте от 6 до 18 лет не установлены.
Нет
данных о применении препарата у детей в возрасте от 6 до 11 лет.
Имеются данные о применении препарата у подростков в возрасте от 12
до 18 лет, но рекомендации в отношении режима дозирования
отсутствуют.
Во
время беременности или лактации
Имеются
ограниченные данные о применении бенрализумаба у беременных женщин.
Проницаемость плацентарного барьера для моноклональных антител, таких
как бенрализумаб, увеличивается по мере развития беременности,
поэтому потенциальное воздействие на плод наиболее вероятно во втором
и третьем триместрах беременности.
Рекомендуется
избегать применения бенрализумаба во время беременности. Назначение
терапии препаратом Фазенра®
у
беременных женщин следует рассматривать только в случае, если
ожидаемая польза для матери превышает любые возможные риски для
плода.
Неизвестно,
проникает ли бенрализумаб или его метаболиты в грудное молоко
человека. Нельзя исключать риск для ребенка, находящегося на грудном
вскармливании. Следует оценить пользу грудного вскармливания для
ребенка и пользу от терапии бенрализумабом для матери и принять
решение либо о прекращении грудного вскармливания, либо о
приостановлении/прекращении применения препарата Фазенра®.
Особенности влияния лекарственного средства на
способность управлять транспортным средством или потенциально
опасными механизмами
Препарат
Фазенра®
не
оказывает или оказывает незначительное влияние на способность
управлять транспортными
средствами и механизмами.
Рекомендации по применению
Лечение
препаратом Фазенра® должно
назначаться врачом, имеющим опыт в диагностике и лечении тяжелой
астмы.
Если
врач сочтет это целесообразным, пациенты не имеющие анафилактических
реакций в анамнезе или лица, осуществляющие уход за такими
пациентами, могут вводить препарат Фазенра®
самостоятельно после проведенного обучения
методике выполнения подкожных инъекций, а также ознакомления с
признаками и симптомами реакций гиперчувствительности, с последующим
наблюдением медицинским работником, при необходимости.
Самостоятельное введение инъекций следует рассматривать только у
пациентов, уже имеющих опыт лечения препаратом Фазенра®.
Режим дозирования
Рекомендуемая
доза бенрализумаба составляет 30 мг в виде подкожной инъекции: первые
3 дозы следует вводить один раз в 4 недели, а затем — один раз в 8
недель.
Препарат
Фазенра®
предназначен для длительного лечения. Решение о продолжении терапии
следует принимать не реже одного раза в год в зависимости от тяжести
заболевания, уровня контроля обострений и количества эозинофилов в
крови.
Особые группы пациентов
Пациенты
пожилого возраста
Коррекция
дозы не требуется.
Пациенты
с нарушением функции почек и печени
Пациентам
с нарушением функции почек и печени коррекция дозы не требуется.
Дети
Имеются
данные о применении препарата у подростков в возрасте от 12 до 18
лет, но рекомендации в отношении режима дозирования отсутствуют.
Метод
и путь введения
Для
подкожного введения. В соответствии с требованиями клинической
практики, рекомендуется проводить наблюдение за пациентами после
инъекции биологических препаратов. Препарат вводят в область плеча,
бедра или живота. Не следует вводить препарат в чувствительную
область, в область ушиба, гематомы или уплотнения.
Перед
введением препарат рекомендуется извлечь из холодильника и дать
нагреться при комнатной температуре в течении 30 минут.
Перед
введением необходимо визуально осмотреть препарат Фазенра®
на наличие механических включений и изменение цвета. Раствор
препарата должен быть прозрачным или слегка опалесцирующим от
бесцветного до желтого цвета и может содержать несколько
полупрозрачных или от белого до почти белого цвета частиц. Препарат
не должен быть использован, если раствор является мутным, имеет
другой цвет или присутствуют крупные частицы или инородные
механические включения.
Подробные
указания по использованию, подготовке и введению предварительно
заполненного шприца или автоинжектора с препаратом Фазенра®
описаны в приложенной инструкции «Руководство по применению
предварительно заполненного шприца» или «Руководство по
применению предварительно заполненного автоинжектора».
Меры,
которые необходимо принять в случае передозировки
Не
выявлено признаков связанной с дозой токсичности.
Лечение:
специфическое лечение передозировки бенрализумабом отсутствует. В
случае передозировки необходимо проводить поддерживающую терапию и
вести наблюдение за состоянием пациента.
Меры, необходимые при пропуске одной
или нескольких доз лекарственного препарата
В
случае, если инъекция не выполнена в запланированную дату, дозу
следует ввести как можно скорее в соответствии с указанной схемой,
при этом введение двойной дозы не допускается.
Указание
на наличие риска симптомов отмены
Не
следует прекращать лечение препаратом Фазенра®
без рекомендации врача. Прерывание или
прекращение лечения препаратом может привести к возобновлению
симптомов и приступов астмы.
Рекомендации
по обращению за консультацией к медицинскому работнику для
разъяснения способа применения лекарственного препарата
В
случаях появления каких-либо вопросов касательно способа применения
препарата Фазенра®,
пациенту рекомендуется обратиться за консультацией к медицинскому
работнику для
разъяснения способа применения данного лекарственного препарата.
Описание
нежелательных реакций, которые проявляются при стандартном применении
лекарственного препарата и меры, которые следует принять в этом
случае
Подобно
всем лекарственным препаратам препарат может вызывать нежелательные
реакции, однако они возникают не у всех. Частота
возникновения побочных реакций представлена в следующей градации:
очень часто (≥ 1/10), часто (≥ 1/100 до <1/10), не часто
(≥1/1000 до <1/100), редко (≥1/10000 до <1/1000),
очень редко (<1/10000), неизвестно (исходя из известных данных, не
может быть оценена). Внутри
одной категории частоты побочные реакции представлены в порядке
убывания серьезности.
Часто
—
головная боль
—
нарушения со стороны иммунной системы такие как реакции
гиперчувствительности, включая крапивницу, папулезную крапивницу,
кожную сыпь)
—
фарингит (фарингит, бактериальный фарингит, вирусный
фарингит, стрептококковый фарингит)
—
лихорадка
—
реакции в месте введения
Неизвестно
(не может быть
оценена исходя из известных данных)
—
анафилаксия (симптомы
обычно включают: отек лица, языка или рта, проблемы с дыханием,
обморок, головокружение (из-за падения артериального давления)).
При
возникновении нежелательных лекарственных реакций обращаться к
медицинскому работнику, фармацевтическому работнику или напрямую в
информационную базу данных по нежелательным реакциям (действиям) на
лекарственные препараты, включая сообщения о неэффективности
лекарственных препаратов
РГП
на ПХВ «Национальный центр экспертизы лекарственных средств и
медицинских изделий» Комитета медицинского и фармацевтического
контроля Министерства здравоохранения Республики Казахстан
http://www.ndda.kz
Дополнительные
сведенияСостав лекарственного препарата
Один
мл препарата содержит
активное
вещество
— бенрализумаб*,
30 мг,
*Бенрализумаб
представляет собой гуманизированное моноклональное антитело,
получаемое из клеток яичников китайского хомячка путем технологии
рекомбинантных ДНК
вспомогательные
вещества — L-гистидин,
L-гистидина гидрохлорида моногидрат, α,α-трегалозы
дигидрат, полисорбат 20, вода для инъекций.
Описание
внешнего вида, запаха, вкуса
Прозрачный
или слегка опалесцирующий раствор от бесцветного до слегка желтого
цвета, практически свободный от видимых механических включений. Может
содержать небольшое количество полупрозрачных или от белого до почти
белого цвета частиц.
Форма
выпуска и упаковка
По
1.0 мл препарата в предварительно заполненные шприцы (APFS). APFS
включает предварительно заполненный узел шприца (PFS-SA) в качестве
основной системы закрытия контейнера для лекарственного препарата.
PFS-SA состоит из стеклянного шприца с закаленной 29-дюймовой иглой с
тонкой стенкой и жесткой защитной оболочкой иглы, которая закрывается
эластомерной пробкой поршня. Принадлежности (защитная оболочка иглы,
удлиненный фланец пальца и стержень поршня) добавляются к PFS-SA для
полной комплектации APFS.
1
предварительно заполненный шприц помещают в пластиковый лоток
(прозрачный PETG или эквивалентный), запечатывают крышкой (Tyvek или
эквивалентной). 1 лоток вместе с инструкцией по медицинскому
применению (листок-вкладыш) и руководством по применению
предварительно заполненного шприца на казахском и русском языках и
помещают коробку в картонную.
По
1.0 мл препарата в предварительно заполненные автоинжекторы (AI). AI
включает предварительно заполненный узел шприца (PFS-SA) в качестве
основной системы закрытия контейнера для лекарственного препарата.
PFS-SA состоит из стеклянного шприца с закаленной 29-дюймовой иглой с
тонкой стенкой и жесткой защитной оболочкой иглы, которая закрывается
эластомерной пробкой поршня. Принадлежности (AI шприц и компоновочный
узел привода) добавляются к PFS-SA для полной комплектации AI.
1
автоинжектор с инструкцией по медицинскому применению
(листок-вкладыш) и руководством по применению предварительно
заполненного автоинжектора на казахском и русском языках помещают в
коробку картонную.
Срок хранения
3
года (предварительно заполненный шприц)
3
года (предварительно заполненный автоинжектор)
Не
применять по истечении срока годности.
Условия хранения
Хранить в оригинальной упаковке для защиты
от света, при температуре от 2 °C до 8 °C. Не замораживать!
Не нагревать! Не встряхивать! При комнатной температуре до 25 °C
хранить не более 14 дней.
Хранить в недоступном для детей месте!
Условия отпуска из аптек
По
рецепту
Сведения
о
производителе
Catalent
Indiana LLC, США
1300
South Patterson Drive, Bloomington, IN 47403, США
Тел.:
+1 (812) 355-6746
Факс:
+1 (812) 336-7167
Держатель
регистрационного удостоверения
AstraZeneca
AB,
Швеция
18
СЕ- 151 85, Södertälje,
Швеция
Тел.:
+46 8 553 260 00
Факс:
+46 8 553 290 00
Наименование,
адрес и контактные данные (телефон, факс, электронная почта)
организации на территории Республики Казахстан, принимающей претензии
(предложения) по качеству лекарственных средств от
потребителей и ответственной за
пострегистрационное наблюдение за безопасностью лекарственного
средства
Представительство
ЗАК “АстраЗенека Ю-Кей Лимитед”,
Республика
Казахстан, г. Алматы, 050022
Ул.
Шевченко, 144
Тел.:
+7 727 232 14 15; +7
701 0326745
adverse.events.kz@astrazeneca.com
(руководство приложено отдельно от
листка-вкладыша и отдельно для каждого из двух устройств,
соответственно)
Руководство
по применению предварительно заполненного шприца с препаратом
Фазенра®
Фазенра®
, 30 мг/1 мл
Раствор
для подкожного введения
Бенрализумаб
Для подкожного введения
Предварительно заполненный шприц для
одноразового использования
Перед использованием предварительно
заполненного шприца с препаратом Фазенра®
медицинскому работнику необходимо разъяснить и показать пациенту или
лицу, осуществляющему уход за пациентом
как правильно использовать шприц.
Перед использованием обязательно необходимо
прочесть инструкцию по применению лекарственного средства
(листок-вкладыш) и данное руководство. Необходимо учитывать, что
данная информация не заменяет консультацию с лечащим врачом о
необходимом лечении и состоянии здоровья пациента. В случае
возникновения каких-либо дополнительных вопросов при применении
препарата необходимо проконсультироваться с врачом.
Важная информация
Препарат Фазенра®
следует хранить в холодильнике в оригинальной упаковке для защиты от
света, при температуре от 2 °C до 8 °C. Препарат Фазенра®
может храниться при комнатной температуре до 25 °C не более 14
дней. После извлечения из холодильника препарат Фазенра®
необходимо использовать в течение 14 дней или утилизировать.
|
Не Фазенра®, • он • его • нарушена • истек |
Не • встряхивать • разделять |
Необходимо выбросить
шприц в стойкий к проколам и повреждениям контейнер для острых
предметов и использовать новый предварительно заполненный шприц в
случае если замечено что-либо из перечисленного выше.
Каждый предварительно
заполненный шприц содержит 1 дозу препарата Фазенра®,
предназначенную только для одноразового использования.
Хранить препарат
Фазенра®,
как и другие лекарственные средства, следует в недоступном для детей
месте.
При
использовании предварительно заполненного шприца
Не
следует снимать защитный колпачок с иглы, пока не выполнены шаги до
шага 6 данной инструкции для готовности введения препарата Фазенра®.
Не
следует касаться зажимов устройства защиты
иглы для предотвращения слишком быстрого срабатывания защитного
устройства.
Шаг
1. Соберите все необходимое
-
Один предварительно
заполненный шприц с препаратом Фазенра®
из
холодильника -
Одна спиртовая
салфетка -
Один ватный или
марлевый тампон -
Один стойкий к
проколам контейнер для острых предметов
(см. шаг 9
«Утилизация использованного предварительно заполненного
шприца»)
|
Шаг 2.
Проверьте срок
Прежде чем
Не
Используйте |
|
|
Шаг 3. |
|
|
Откройте
Возьмитесь за
Осмотрите
Не
Вы можете увидеть |
|
Шаг 4.
Рекомендуемое
Не вводите
• ближе
• в
• в
• через
Тот, кто за вами |
|
|
Шаг 5. |
|
|
Тщательно вымойте
Круговыми
Дайте высохнуть
Не
Не |
|
|
Шаг 6. Снимите |
|
|
Держа шприц одной
Не
Отложите колпачок
На конце иглы
Не используйте
Не
Незамедлительно |
|
Шаг 7. Введите |
||
|
Держите
Другой рукой
Не нажимайте
Не
Вводите препарат |
||
|
Резким движением
Игла вводится под |
Большим пальцем
Нажимайте, пока
Это необходимо |
Выньте иглу из
Медленно |
|
Шаг 8. |
||
|
В месте инъекции
Осторожно
Не
При |
||
|
Шаг 9. |
||
|
• Каждый
• Сразу
Не
Не
Защитный колпачок |
||
|
Рекомендации
Утилизируйте
Не |
(руководство приложено отдельно от
листка-вкладыша и отдельно для каждого из двух устройств,
соответственно)
Руководство
по применению предварительно заполненного автоинжектора с препаратом
Фазенра®
Фазенра®
, 30 мг/1 мл
Раствор
для подкожного введения
Бенрализумаб
Для подкожного введения
Предварительно заполненный автоинжектор для
одноразового использования
Перед использованием автоинжектора с
препаратом Фазенра®
медицинскому работнику необходимо разъяснить и показать пациенту или
лицу, осуществляющему уход за пациентом
как правильно использовать автоинжектор.
Перед использованием обязательно необходимо
прочесть инструкцию по применению лекарственного средства
(листок-вкладыш) и данное руководство. Необходимо учитывать, что
данная информация не заменяет консультацию с лечащим врачом о
необходимом лечении и состоянии здоровья и пациента. В случае
возникновения каких-либо дополнительных вопросов при применении
препарата необходимо проконсультироваться с врачом.
Важная информация
Препарат Фазенра®
следует хранить в холодильнике в оригинальной упаковке для защиты от
света, при температуре от 2 °C до 8 °C. Препарат Фазенра®
может храниться при комнатной температуре до 25 °C не более 14
дней. После извлечения из холодильника препарат Фазенра®
необходимо использовать в течение 14 дней или утилизировать.
|
Не • он • его • нарушена • истек |
Не • встряхивать • разделять |
Необходимо выбросить
автоинжектор в стойкий к проколам и повреждениям контейнер для острых
предметов и использовать новый автоинжектор в случае если замечено
что-либо из перечисленного выше.
Каждый предварительно
заполненный автоинжектор содержит 1 дозу препарата Фазенра®,
предназначенную только для одноразового использования.
Храните препарат
Фазенра®,
как и другие лекарственные средства, следует в недоступном для детей
месте.
При
использовании предварительно заполненного автоинжектора
Не
следует снимать защитный колпачок с иглы, пока не выполнены шаги до
шага 6 данной инструкции для готовности введения препарата Фазенра®.
|
Перед использованием |
После использования |
|||||||
|
Смотровое |
||||||||
|
Колпачок |
Раствор |
Этикетка |
Устройство |
Зеленый |
Шаг 1.
Соберите все необходимое
-
1 автоинжектор с
препаратом Фазенра®
из холодильника -
Одна спиртовая
салфетка -
Один ватный или
марлевый тампон -
Один стойкий к
проколам контейнер для острых предметов
(см. шаг 10
«Безопасная утилизация использованного автоинжектора)
|
Автоинжектор с препаратом |
Спиртовая салфетка |
Ватный или марлевый тампон |
Контейнер для острых предметов |
Шаг 2. Подготовка
автоинжектора с препаратом к использованию
|
Проверьте срок
Прежде чем
Не
Используйте
Не |
|
Шаг 3. |
|
|
Посмотрите на
окно. Жидкость
Не
Вы можете увидеть |
|
|
Шаг 4. |
|
|
Рекомендуемое
Не вводите
• ближе
• в
• в
• через
Тот, кто за вами |
|
|
Шаг 5. |
|
|
Тщательно вымойте
Круговыми
Не |
|
|
Шаг 6. Снимите |
|
|
Держите
Отложите его в
Теперь устройство
Не
Не
Сразу же после |
Шаг 7. Введение
препарата Фазенра®
Вы можете либо
осторожно собрать кожу в складку в месте инъекции, либо сделать
инъекцию, не образуя складку кожи.
Введите препарат
Фазенра®,
следуя шагам, изображенным на рисунках а,
б,
в
и г.
На протяжении всей
инъекции удерживайте автоинжектор с препаратом в одном положении.
Не
изменяйте положение автоинжектора, в процессе выполнения инъекции.
Положение
автоинжектора с препаратом в месте инъекции.
Разместите устройство
защиты иглы автоинжектора с препаратом
под углом 90 градусов
к коже. Убедитесь, что смотровое окно хорошо видно.
|
Крепко
Вы услышите |
Плотно
Вы услышите |
Поднимите
Защитный механизм |
||
|
Шаг 8. |
||||
|
Посмотрите в
Если зеленый |
||||
|
Перед инъекцией |
После инъекции |
|||
|
Шаг 9. |
||||
|
В месте инъекции
Осторожно
Не
При |
|
Шаг 10. |
|
|
• Каждый
• Сразу
Не |
|
|
Рекомендации
Утилизируйте
Не |
| Fasenra_кз.docx | 1.32 кб |
| Fasenra_рус.docx | 1.35 кб |
Отправить прикрепленные файлы на почту
62% пациентов прекратили прием системных глюкокортикостероидов (для приема внутрь) (сГКС) в крупнейшем на сегодняшний день клиническом исследовании по снижению дозы сГКС у пациентов с тяжелой БА
Результаты открытого клинического исследования PONENTE IIIb фазы показали, что препарат бенрализумаб позволил полностью отказаться от приема сГКС части пациентам со стероидозависимой БА с различными уровнями эозинофилов в крови.
Тяжелая БА – это зачастую инвалидизирующее заболевание, которым страдают около 34 миллионов человек во всем мире.1,2 Более трети этих пациентов в настоящее время постоянно или периодически принимают сГКС в дополнение к другой поддерживающей терапии, чтобы контролировать симптомы и приступы БА.3,4 Однако частое или постоянное использование сГКС может привести к серьезным нежелательным явлениям.5-7
В исследовании PONENTE приняло участие около 600 пациентов с тяжелой БА из Европы, Северной Америки, Южной Америки и Тайваня. Что касается результатов исследования в отношении первой первичной конечной точки: 62% пациентов полностью отказались от ежедневного использования сГКС. Оценка результатов второй первичной конечной точки показала, что 81% пациентов смогли полностью исключить или снизить суточную дозу сГКС до 5 мг и менее (дальнейшее снижение было невозможно из-за надпочечниковой недостаточности). Результаты по обеим первичным конечным точкам поддерживались в течение как минимум четырех недель при сохранении контроля над БА.
Профессор Эндрю Мензис-Гоу (Andrew Menzies-Gow), директор клиники бронхолегочных заболеваний Royal Brompton Hospital, Лондон, Великобритания, главный исследователь PONENTE, прокомментировал: «Эти впечатляющие результаты показывают, что препарат бенрализумаб позволяет полностью исключить или сократить использование сГКС. Снижение дозы, достигаемое за счет персонализированного графика постепенного уменьшения дозы сГКС (для приема внутрь), особенно важно, поскольку надпочечниковая недостаточность может стать препятствием для безопасного и значимого снижения приема сГКС. Данные клинического исследования PONENTE могут быть основой для рекомендаций по лечению пациентов с тяжелой БА и укрепить уверенность врачей в необходимости прекращения приема сГКС у пациентов».
Мене Пангалос (Mene Pangalos), исполнительный вице-президент подразделения клинических исследований и разработок биофармацевтических препаратов компании «АстраЗенека», добавил: «Около 13,5 миллионов человек во всем мире с тяжелой БА в настоящее время используют сГКС для терапии обострений и предотвращения госпитализаций. Чрезмерная зависимость от сГКС может создавать значительные риски для здоровья пациентов, а также обуславливать дополнительную нагрузку на систему здравоохранения. Полученные данные исследования PONENTE дополнительно подтверждают эффективность препарата бенрализумаб в отношении отказа от сГКС среди более широкой популяции пациентов с тяжелой БА».
Результаты исследования PONENTE расширяют данные, ранее полученные в исследовании III фазы ZONDA, – о возможности снижения приема cГКС за счет уменьшения высоких доз сГКС у пациентов с тяжелой БА без надпочечниковой недостаточности. Исследование PONENTE имеет длительную поддерживающую фазу – примерно 24-32 недели, снижение приема сГКС при сохранении контроля БА в течение еще более продолжительного периода по сравнению с исследованием ZONDA и всеми другими опубликованными исследованиями по биологическим препаратам.8,9 Профиль безопасности и переносимость препарата бенрализумаб в исследовании PONENTE соответствовали ранее полученным данным.
ФАЗЕНРА® — препарат, снижающий эозинофильное воспаление у пациентов с тяжелой БА уже в 1й день терапии, позволяющий полностью отказаться от приема сГКС и не иметь обострений ко 2му году терапии 9-16.
Препарат бенрализумаб в настоящее время одобрен в качестве поддерживающей терапии тяжелой эозинофильной БА в США, Евросоюзе, Японии и других странах, а также одобрен для самостоятельного приема в США, Евросоюзе и других странах.
Тяжелая БА
В настоящее время БА во всем мире страдает примерно 339 миллионов человек.1,2 Примерно у 10% пациентов БА протекает в тяжелой форме и не поддается лечению, даже несмотря на высокие дозы стандартных лекарственных средств для контроля этого заболевания, что может потребовать длительного применения сГКС.2,17,18 Тяжелая неконтролируемая БА обуславливает инвалидизирующее течение болезни и потенциально приводит к летальному исходу, так как пациенты испытывают частые обострения и значительное ограничение функции легких, а также снижение качества жизни, обусловленное состоянием здоровья.2,18,19 При тяжелой неконтролируемой БА риск смертельного исхода выше, чем при тяжелой контролируемой БА.17 70 или более % людей с тяжелой БА имеют повышенное количество эозинофилов – лейкоцитов, которые являются нормальными клетками иммунной системы и могут вызывать воспаление дыхательных путей у некоторых пациентов.17,18,20,21
Тяжелая неконтролируемая БА может привести к зависимости от сГКС, при этом воздействие сГКС приводит к серьезным краткосрочным и долгосрочным нежелательным явлениям, включая увеличение массы тела, сахарный диабет, остеопороз, глаукому, тревожность, депрессию, подавление иммунного ответа при сердечно-сосудистых заболеваниях и надпочечниковую недостаточность.5-7 Чрезмерная зависимость пациентов от сГКС может создать дополнительную нагрузку на систему здравоохранения: проведенный в Великобритании анализ показал, что у пациентов с БА на сГКС прямые затраты на лечение в среднем на 43% выше, чем у пациентов, не получающих поддерживающую терапию сГКС.22
Об исследовании PONENTE
PONENTE – это многоцентровое открытое исследование IIIb фазы для оценки эффективности и безопасности снижения ежедневного приема сГКС после начала терапии препаратом бенрализумаб подкожно в дозе 30 мг у взрослых пациентов с тяжелой эозинофильной БА на высоких дозах иГКС и ДДБА и длительное время получающих сГКС с дополнительной поддерживающей терапией БА или без нее. Включенные в исследование PONENTE пациенты получали поддерживающую дозу cГКС ≥5 мг преднизолона в течение не менее трех месяцев и имели исходное количество эозинофилов в периферической крови ≥150 клеток/мкл или исходное количество эозинофилов ниже 150 клеток/мкл с документированным количеством эозинофилов ≥300 клеток/мкл за последние 12 месяцев. Период лечения состоял из четырехнедельной индукционной фазы без корректировки дозы сГКС, фазы снижения дозы сГКСи 24-32-недельной поддерживающей фазы.8,25
Первичными конечными точками исследования были доля пациентов, достигших 100% снижения суточной дозы сГКС, и доля пациентов, сумевших полностью исключить или снизить суточную дозу сГКС до 5 мг и менее (дальнейшее снижение было невозможно из-за надпочечниковой недостаточности), при этом снижение дозы сГКС сохранялось не менее четырех недель без обострения БА.8,25
В сравнении с другими опубликованными исследованиями, в клиническом исследовании PONENTE предусмотрен персонализированный график снижения дозы сГКС, что позволяет быстрее уменьшать высокие дозы сГКС с последующей оценкой функции надпочечников с целью снижения риска надпочечниковой недостаточности. В исследовании PONENTE также предусмотрена значительно более длительная поддерживающая фаза (примерно 24-32 недели по сравнению с четырьмя неделями для опубликованных исследований других биологических препаратов), что позволяет оценить снижение дозы сГКС в долгосрочной перспективе.8,25
О препарате Фазенра®
Препарат Фазенра® (бенрализумаб) является моноклональным антителом, которое напрямую связывается с альфа-субъединицей рецептора интерлейкина-5 (ИЛ-5) на поверхности эозинофилов и привлекает естественные киллеры, что приводит к быстрой и практически полной деплеции эозинофилов посредством активного апоптоза.26,27
Препаратбенрализумаб находится в разработке для лечения других эозинофильных заболеваний и хронической обструктивной болезни легких.28-32 В 2018 году американское управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) присвоило препарату бенрализумаб статус орфанного лекарственного препарата для лечения эозинофильного гранулематоза с полиангиитом, а в 2019 – для лечения гиперэозинофильного синдрома и эозинофильного эзофагита.
О работе компании «АстраЗенека» в области респираторных заболеваний и иммунологии
Пульмонология и иммунология – одно из трех основных терапевтических направлений компании «АстраЗенека», которое является ключевым фактором роста для компании.
Компания «АстраЗенека» обладает 50-летним опытом и является признанным лидером в области лечения респираторных заболеваний с использованием ингаляционных технологий и биологических препаратов. Компания намерена изменить традиционные подходы к лечению БА и хронической обструктивной болезни легких (ХОБЛ) за счет снижения частоты обострений у пациентов с любой степенью тяжести заболевания, а также удалить ХОБЛ из числа основных причин смерти за счет более раннего лечения с применением биологических методов. Первые исследования компании в области респираторной медицины сосредоточены на передовых научных достижениях, связанных с иммунными механизмами, повреждением легких и аномальными процессами восстановления клеток при заболеваниях и дисфункциях нейронов.
Располагая данными об общих путях развития и факторах риска развития респираторных заболеваний и патологии иммунной системы, компания «АстраЗенека» использует научные достижения при разработке препаратов для лечения самых разных болезней, от хронических заболеваний легких до заболеваний иммунной системы. Растущее присутствие компании в области иммунологии сфокусировано на пяти терапевтических областях с потенциалом лечения множественных заболеваний в ревматологии (включая системную красную волчанку), дерматологии, гастроэнтерологии, кроме того на системных эозинофильных заболеваниях. Амбиции компании «АстраЗенека» в области иммунологии заключаются в достижении контроля над заболеваниями.
О компании «АстраЗенека»
«АстраЗенека» является международной научно-ориентированной биофармацевтической компанией, нацеленной на исследование, разработку и вывод на рынок рецептурных препаратов преимущественно в таких терапевтических областях, как онкология, кардиология, нефрология и метаболизм, респираторные и аутоиммунные заболевания. Компания «АстраЗенека», базирующаяся в Кембридже (Великобритания), представлена более чем в 100 странах мира, а ее инновационные препараты используют миллионы пациентов во всем мире.
Для получения дополнительной информации, пожалуйста, обращайтесь:
Евгения Касьяненко
Руководитель отдела по корпоративным коммуникациям «АстраЗенека», Россия и Евразия
Тел: +7 (495) 799 5699, эл. почта: evgeniya.kasyanenko@astrazeneca.com
Расшифровка аббревиатур:
сГКС – системные глюкокортикостероиды
иГКС – ингаляционные глюкокортикостероиды
ДДБА – длительнодействущие бета2 агонисты
БА – бронхиальная астма
Список литературы:
-
The Global Asthma Network. The Global Asthma Report 2018. [Online]. Available at: http://www.globalasthmanetwork.org/publications/Global_Asthma_Report_2018.pdf.[ Last accessed: October 2020].
-
Chung KF, Wenzel SE, Brozek JL, et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J 2014; 43: 343–73.
-
Moore WC, Bleecker ER, Curran-Everett D, et al. Characterization of the severe asthma phenotype by the National Heart, Lung, and Blood Institute’s severe asthma research program. J Allergy Clin Immunol 2007; 119: 405–413
-
Shaw DE, Sousa AR, Fowler SJ, et al. Clinical and inflammatory characteristics of the European U-BIOPRED adult severe asthma cohort. Eur Respir J 2015; 46: 1308–1321.
-
Sweeney J, Patterson CC, Menzies-Gow A, et al. Comorbidity in severe asthma requiring systemic corticosteroid therapy: cross-sectional data from the Optimum Patient Care Research Database and the British Thoracic Difficult Asthma Registry. Thorax. 2016; 71 (4): 339-346
-
Sullivan PW, Ghushchyan VH, Globe G, Schatz M. Oral corticosteroid exposure and adverse effects in asthmatic patients. J Allergy Clin Immunol. 2018; 141 (1): 110-116.e7
-
Hyland ME, Whalley B, Jones RC, et al. A qualitative study of the impact of severe asthma and its treatment showing that treatment burden is neglected in existing asthma assessment scales. Quality of Life Research. 2015: 24 (3) 631-619.
-
Menzies-Gow A, Corren J, Bel EH, et al. Corticosteroid tapering with benralizumab treatment for eosinophilic asthma: PONENTE Trial. ERJ Open Res 2019; 5: 00009-2019.
-
Nair P, Wenzel S, Rabe KF, et al, on behalf of the ZONDA trial investigators. Oral Glucocorticoid–Sparing Effect of Benralizumacomb in Severe Asthma. N Engl J Med 2017; 376: 2448-2458
-
Инструкция по медицинскому применению лекарственного препарата Фазенра® (бенрализумаб 30 мг), с учетом изменений № 1. Регистрационное удостоверение ЛП-005492 от 25.04.2019 (переоформлено 15.10.2019 г)
-
Laviolette M, et al. J Allergy Clin Immunol.2013; 132: 1086-1096. doi: 10.1016/j.jaci.2013.05.020.
-
Busse WW, et al. Long-term safety of benralizumab in patients with severe, uncontrolled asthma: 1-year results from the BORA phase 3 extension trial. Lancet Respir Med. 2019;7:46-59.
-
Инструкция по медицинскому применению лекарственного препарата Фазенра® (бенрализумаб 30 мг), с учетом изменений № 1. Регистрационное удостоверение ЛП-005492 от 25.04.2019 (переоформлено 15.10.2019 г)
-
Laviolette M, et al. J Allergy Clin Immunol.2013; 132: 1086-1096. doi: 10.1016/j.jaci.2013.05.020.
-
Busse WW, et al. Long-term safety of benralizumab in patients with severe, uncontrolled asthma: 1-year results from the BORA phase 3 extension trial. Lancet Respir Med. 2019;7:46-59.
-
Nair P, Wenzel S, Rabe KF, et al. Oral corticosteroid-sparing effect of benralizumab in severe asthma. N Engl J Med 2017;376:2448-58.
-
Wenzel S. Severe Asthma in Adults. Am J Respir Crit Care Med. 2005; 172; 149–60.
-
Peters SP, Ferguson G, Deniz Y, et al. Uncontrolled asthma: a review of the prevalence, disease burden and options for treatment. Respir Med 2006: 100 (7): 1139-51.
-
Fernandes AG, Souza-Machado C, Coelho RC, et al. Risk factors for death in patients with severe asthma. J Bras Pneumol. 2014; 40 (4): 364-372.
-
Schleich F, Demarche S, Louis R. Biomarkers in the Management of Difficult Asthma. Current Topics in Medicinal Chemistry. 2016;16(14):1561-1573.
-
Leckie MJ, Brinke AT, Khan J, et al. Effects of an interleukin-5 blocking monoclonal antibody on eosinophils, airway hyper-responsìveness, and the late asthmatic response. The Lancet. 2000;356(9248):2144-2148.
-
O’Neill S, Sweeney J, Patterson CC, et al. The cost of treating severe refractory asthma in the UK: An economic analysis from the British Thoracic Society Difficult Asthma Registry. Thorax 2015;70:376-378.
-
Paragliola RM, Corsello SM. Secondary adrenal insufficiency: from the physiopathology to the possible role of modified-release hydrocortisone treatment. Minerva Endocrinol. 2018 Jun;43(2):183-197. doi: 10.23736/S0391-1977.17.02701-8. Epub 2017 Jul 27. PMID: 28750490.
-
NIDDK. Adrenal Insufficiency and Addison’s Disease. Available at: https://www.niddk.nih.gov/health-information/endocrine-diseases/adrenal-insufficiency-addisons-disease/definition-facts. [Last accessed: October 2020].
-
Clinicaltrials.gov. Study to Evaluate Efficacy and Safety of Benralizumab in Reducing Oral Corticosteroid Use in Adult Patients With Severe Asthma (PONENTE). Available at: https://clinicaltrials.gov/ct2/show/NCT03557307 [Last accessed: October 2020].
-
Kolbeck R, Kozhich A, Koike M, et al. MEDI-563, a humanized anti–IL-5 receptor a mAb with enhanced antibody-dependent cell-mediated cytotoxicity function. J Allergy Clin Immunol. 2010; 125 (6): 1344-1353.e2.
-
Pham TH, Damera G, Newbold P, Ranade K. Reductions in eosinophil biomarkers by benralizumab in patients with asthma. Respir Med. 2016; 111: 21-29.
-
Clinicaltrials.gov. Effect of Benralizumab in Atopic Dermatitis. Available at: https://clinicaltrials.gov/ct2/show/NCT03563066 [Last accessed: October 2020].
-
AstraZeneca data on file (MESSINA trial).
-
Clinicaltrials.gov. A Study to Evaluate if Benralizumab Compared to Mepolizumab May be Beneficial in the Treatment of Eosinophilic Granulomatosis With Polyangiitis (EGPA) (MANDARA). Available at: https://clinicaltrials.gov/ct2/show/NCT04157348. [Last accessed: October 2020].
-
Clinicaltrials.gov. A Phase 3 Study to Evaluate the Efficacy and Safety of Benralizumab in Patients With Hypereosinophilic Syndrome (HES) (NATRON). Available at: https://clinicaltrials.gov/ct2/show/NCT04191304 [Last accessed: October 2020].
-
Clinicaltrials.gov. Efficacy and Safety of Benralizumab in Moderate to Very Severe Chronic Obstructive Pulmonary Disease (COPD) With a History of Frequent Exacerbations (RESOLUTE). Available at: https://clinicaltrials.gov/ct2/show/NCT04053634 [Last accessed: October 2020].