Натрия гиалуронат, прозрачный вязкий раствор без видимых примесей в предварительно заполненном шприце (стекло типа I, 2 мл), закрытом эластомерным (безлатексным) ограничителем хода поршня.
Действующее вещество: натрия гиалуронат – 20 мг.
Вспомогательные вещества: натрия хлорид – 17 мг; натрия дигидрофосфата дигидрат – 0,1 мг; динатрия гидрофосфата додекагидрат – 1,2 мг; вода для инъекций – до 2 мл.
Прочие средства для лечения заболеваний костно-мышечной системы.
Код ATX: М09АХ01.
Фармакокинетические свойства
Благодаря повсеместному распространению гиалуроновой кислоты в организме, экзогенная гиалуроновая кислота физиологически метаболизируется организмом после парентерального введения по свойственному для гексоз пути.
Результаты исследований, проведенных на собаках и кроликах, с одноразовым или повторным внутрисуставным введением гиалуроновой кислоты показали, что гиалуроновая кислота быстро распространяется в суставных тканях и остается там в течение длительного времени. В ходе научных исследований с применением меченной радиоактивным изотопом гиалуроновой кислоты, ее определяли в синовиальной мембране через 2 часа после введения и обнаруживали ее там на протяжении 7 дней. Максимальная концентрация меченого препарата наблюдалась в синовиальной жидкости, а затем, в убывающих концентрациях, в суставной капсуле, связках и прилегающих мышцах. В отношении системного действия установлено, что введенная меченная изотопом гиалуроновая кислота обнаруживается в печени, почках, костном мозге и в лимфатических узлах. Препарат выводится, главным образом, через почки.
Исследование, проведенное на беременных мышах путем внутривенного введения, продемонстрировали наличие радиоактивности в плаценте и различных органах плода.
Фармакодинамические свойства
Гиалуроновая кислота – природный полимер, относящийся к классу глюкозаминогликанов (кислые мукополисахариды), который является важным компонентом всех экстрацеллюлярных матриксов и присутствует в высоких концентрациях в суставном хряще и синовиальной жидкости. Действующее вещество оригинального лекарственного средства Гиалган – это высокомолекулярная фракция гиалуроновой кислоты высокой степени очистки с точно определенной молекулярной массой, обладающая специфическими биохимическими, физико-химическими и фармакологическими свойствами.
Введение Гиалгана в суставы, пораженные артритом, ведет к нормализации вязкоэластичных свойств синовиальной жидкости и активизации восстановительных процессов тканей суставного хряща.
Различные экспериментальные модели продемонстрировали противовоспалительный и анальгетический эффект гиалуроновой кислоты. Данная особенность ведет к улучшению функций сустава, что означает собой возможность держать под контролем объективную и субъективную симптоматику артрита.
Гонартроз легкой и средней степени тяжести.
2 мл Гиалгана (20 мг) вводятся внутрисуставно, курсом один раз в неделю на протяжении 5 недель, если врачом не прописан другой режим.
Снять эластомерный колпачок и навинтить иглу на шприц, следя за тем, чтобы не надавить на поршень. Проверить правильность соединения иглы с люэровским наконечником. Избегать слишком сильного навинчивания иглы, которое может повлечь за собой отделение люэровского наконечника от шприца.
Неиспользованные остатки продукта и другие отходы подлежат утилизации в соответствии с местными нормативами.
Были отмечены случаи местных реакций, таких как болезненность, отек/выпот, теплота или покраснение в месте введения. Как правило, такие симптомы являются преходящими и проходят спонтанно в течение нескольких дней при условии покоя и прикладывания льда. В отдельных случаях такие симптомы носили длительный и сильно выраженный характер. Зарегистрировано несколько случаев повышения температуры. В некоторых случаях, повышение температуры было связано с местными реакциями.
В присутствии объективных признаков воспалительного процесса введение Гиалгана могло, в некоторых случаях, ухудшить указанное состояние.
Были описаны очень редкие случаи внутрисуставной инфекции. При введении Гиалгана необходимо строго соблюдать правила асептики.
Зарегистрированы редкие случаи системных аллергических реакций. Единичные случаи анафилактически-подобных реакций выявлены на протяжении опыта пострегистрационного применения.
Признаки, подобные аллергии, и такие симптомы, как сыпь, зуд и крапивница являются очень редкими.
Побочные реакции, приведенные в таблице согласно международному словарю классификации нежелательных реакций (MedDRA), наблюдались у пациентов, которым вводился Гиалган в ходе контролируемых и открытых клинических исследований, а также из опыта пострегистрационного применения лекарственного средства на протяжении использования продукта.
Частота развития побочных реакций представлена в соответствии с условными обозначениями MedDRA: очень часто (≥ 1/10); часто (≥ 1/100 до < 1/10); нечасто (≥ 1/1000 до <1/100); редко (≥ 1/10000 до < 1/1000); очень редко (<1/10000) и неизвестно (невозможно оценить на основании имеющихся данных).
| КЛАСС СИСТЕМЫ ОРГАНОВ |
ЧАСТОТА |
ОПРЕДЕЛЕНИЯ |
| Общие нарушения и нарушения в месте инъекции |
Редко (≥ 1/10000 до < 1/1000) |
Реакции в месте инъекции, такие как: Болезненность в суставе после инъекции Выпот в суставе после инъекции Отек сустава после инъекции Раздражение в месте инъекции Нарушение подвижности сустава после инъекции Воспаление сустава после инъекции Покраснение сустава после инъекции Сыпь в месте инъекции Дискомфорт в месте инъекции Теплота сустава после инъекции Зуд в месте инъекции Гиперчувствительность в месте инъекции Крапивница в месте инъекции |
| Очень редко (<1/10000) |
Другие местные реакции, такие как: Уплотнение в месте инъекции Кровоизлияние в месте инъекции Экхимоз в месте инъекции Гематома в месте инъекции Дерматит в месте инъекции Парестезия в месте инъекции Пустула в месте инъекции Пузырьки в месте инъекции Ощущение жара Повышение температуры |
|
| Нарушения со стороны мышц, скелета и соединительной ткани | Очень редко (<1/10000) |
Псевдосептический артрит Синовит Тугоподвижность сустава |
| Инфекции и инвазии | Очень редко (<1/10000) | Септический артрит |
| Нарушения со стороны иммунной системы | Очень редко (<1/10000) |
Гиперчувствительность Крапивница Анафилактоидная реакция Анафилактический шок Сывороточная болезнь Другие признаки и симптомы аллергических реакций, такие как: |
| Нарушения со стороны кожи и подкожной системы | Очень редко (<1/10000) |
Сыпь Генерализованная сыпь Зуд Генерализованный зуд Экзема Эритема Генерализованная эритема Дерматит |
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного средства. Это позволяет обеспечить непрерывный мониторинг соотношения пользы и риска лекарственного средства. Работники здравоохранения обязаны сообщать о подозреваемых нежелательных реакциях согласно национальной системе организации отчётности.
Сообщение о любых нежелательных реакциях при применении лекарственного средства Гиалган могут быть направлены:
— производителю: Фидиа фармацеутиси Эс.Пи.Эй., по электронной почте phv@fidiapharma.it или по адресу: Fidia Farmaceutici S.p.A., Via Ponte della Fabbrica 3/A, 35031 Abano Terme (PD), Italy (Италия).
— в УП «Центр экспертиз и испытаний в здравоохранении»: с использованием формы извещения о нежелательной реакции на сайте www.rceth.by, по электронной почте rcpl@rceth.by или по адресу: Товарищеский пер. 2а, г. Минск, 220037, Республика Беларусь, тел/факс 242-00-29.
— Повышенная чувствительность к действующему веществу или к какому-либо из вспомогательных веществ
— Аллергический анамнез на куриные белки
— Пациенты с тяжелыми заболеваниями печени
— Пациенты детского и подросткового возраста.
Случаев передозировки не выявлено.
— Не рекомендуется использовать дезинфицирующие средства на основе четвертичной соли аммония, поскольку присутствие гиалуроновой кислоты может привести к образованию осадка.
Процедура внутрисуставного введения должна выполняться квалифицированным медицинским работником, в соответствии с техникой введения и правилами асептики, предписанными для данного типа введения лекарственного средства.
— Необходимо принять особые меры предосторожности в случае наличия у пациента инфекции вблизи места введения во избежание развития бактериального артрита.
Перед выполнением внутрисуставной инъекции необходимо тщательно осмотреть пациента на предмет выявления возможных признаков острого воспаления. В случае наличия таковых признаков, врач должен сделать оценку целесообразности выполнения инъекции.
— В случае наличия выпота, следует удалить его перед введением Гиалгана.
— Рекомендуется избегать статических нагрузок (более часа) или тренировок (например, бег, теннис) в течение нескольких часов после введения.
Дети и подростки
Не рекомендуется вводить Гиалган детям и подросткам в виду отсутствия клинических данных о безопасности использования лекарственного средства в этой популяции.
Пациенты и почечной/печеночной недостаточность
Отсутствуют клинические исследования о применении гиалуроновой кислоты у пациентов с нарушением функции почек и печени. Поэтому при назначении лекарственного средства Гиалган следует оценить преимущества и риск для пациента.
Пациенты пожилого возраста
Гиалган показан для лечения гонартроза легкой и средней степени тяжести, заболевания, обычно поражающего пациентов пожилого возраста. Возраст-ассоциированная частота диагностирования остеоартроза и опыт практического применения свидетельствуют о положительном влиянии лекарственного средства Гиалган на течение болезни у пожилых пациентов. Поэтому при назначении лекарственного средства Гиалган пожилым пациентам следует оценить преимущества и риск для пациента.
Гиалуроновая кислота взаимодействует с некоторыми местными анестетиками, увеличивая время действия анестезии.
Доклинические данные
Результаты стандартных доклинических исследований фармакологической безопасности, токсичности после повторного введения, генотоксичности, возможного канцерогенного действия и токсического действия на репродуктивную функцию выявили отсутствие рисков для человека.
Несмотря на то, что в ходе экспериментов на животных эмбриотоксического или тератогенного действия выявлено не было, рекомендуется ограничить введение лекарственного средства беременным женщинам или кормящим матерям, применяя его только в случаях крайней, по мнению врача, необходимости, после тщательного анализа соотношения риск/польза.
Гиалган не оказывает влияния на способность управлять механизмами или автотранспортным средством.
Хранить в оригинальной упаковке при температуре не выше 25°С. Не замораживать.
Отпускается по рецепту врача.
Стерильный предварительно заполненный шприц из прозрачного бесцветного боросиликатного стекла (тип I) вместимостью 2.25 мл. Укомплектованный предварительно заполненный шприц помещен в блистер из ПВХ, термозапечатанный упаковочной бумагой для медицинских изделий. Блистер помещен в картонную коробку вместе с инструкцией по медицинскому применению.
Информации о производителе
Фидиа фармацеутиси Эс.Пи.Эй., 35031 Абано Терме, Виа Понте делла Фаббрика, 3/А, Италия.
Гиалган Фидия (Hyalgan Fidia) инструкция по применению
📜 Инструкция по применению Гиалган Фидия
💊 Состав препарата Гиалган Фидия
✅ Применение препарата Гиалган Фидия
📅 Условия хранения Гиалган Фидия
⏳ Срок годности Гиалган Фидия
Описание лекарственного препарата
Гиалган Фидия
(Hyalgan Fidia)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для электронного издания справочника Видаль 2014
года, дата обновления: 2021.10.01
Владелец регистрационного удостоверения:
Код ATX:
M09AX01
(Гиалуроновая кислота)
Лекарственные формы
| Гиалган Фидия |
Р-р д/внутрисуставного введения 20 мг/2 мл: шприцы 1 или 5 шт. рег. №: ЛСР-006134/08 |
|
|
Р-р д/внутрисуставного введения 20 мг/2 мл: фл. 1 или 5 шт. рег. №: ЛСР-006134/08 |
Форма выпуска, упаковка и состав
препарата Гиалган Фидия
Раствор для внутрисуставного введения бесцветный, прозрачный, вязкий.
Вспомогательные вещества: натрия хлорид — 17 мг, динатрия гидрофосфат додекагидрат — 1.2 мг, натрия дигидрофосфат дигидрат — 0.1 мг, вода д/и — до 2 мл.
2 мл — флаконы бесцветного стекла (1) — пачки картонные.
2 мл — флаконы бесцветного стекла (5) — пачки картонные.
Раствор для внутрисуставного введения бесцветный, прозрачный, вязкий.
Вспомогательные вещества: натрия хлорид — 17 мг, динатрия гидрофосфат додекагидрат — 1.2 мг, натрия дигидрофосфат дигидрат — 0.1 мг, вода д/и — до 2 мл.
2 мл — шприцы бесцветного стекла (1) — упаковки ячейковые контурные (1) — пачки картонные.
2 мл — шприцы бесцветного стекла (1) — упаковки ячейковые контурные (5) — пачки картонные.
Фармакологическое действие
Стимулятор репаративных процессов. Гиалган Фидия представляет собой стерильный, апирогенный, вязкий буферный водный раствор фракции натриевой соли гиалуроновой кислоты высокой степени очистки с молекулярной массой от 500 до 730 кДальтон. Гиалуроновая кислота — необходимый компонент экстрацеллюлярного матрикса, присутствует в высоких концентрациях в составе суставного хряща и синовиальной жидкости. Эндогенная гиалуроновая кислота обеспечивает вязкость и эластичность синовиальной жидкости, а также она необходима для формирования протеогликанов в суставном хряще.
При остеоартрозе отмечаются дефицит и качественные изменения гиалуроновой кислоты в составе синовиальной жидкости и хряща. Внутрисуставное введение гиалуроновой кислоты на фоне дегенеративных изменений поверхности синовиального хряща и патологии синовиальной жидкости приводит к улучшению функционального состояния сустава.
При применении Гиалгана Фидия отмечается улучшение клинического течения остеоартроза на протяжении 6 месяцев с момента лечения, наблюдается противовоспалительный и анальгезирующий эффект.
Фармакокинетика
Всасывание и распределение
При внутрисуставном введении натриевая соль гиалуроновой кислоты элиминируется из синовиальной жидкости в течение 2-3 дней. Фармакокинетические исследования показали быстрое распределение субстанции в синовиальной мембране. Cmax меченой гиалуроновой кислоты обнаружена в синовиальной жидкости и суставной капсуле, меньшие концентрации — в синовиальной мембране, связках и прилегающих мышцах.
Метаболизм и выведение
Гиалуроновая кислота в составе синовиальной жидкости не подвергается значимым метаболическим изменениям. На экспериментальных моделях основной метаболизм происходит в околосуставных тканях и печени, экскреция в основном осуществляется почками.
Показания препарата
Гиалган Фидия
- для купирования болей и улучшения подвижности синовиальных суставов, при остеоартрозе и посттравматических изменениях;
- в качестве вспомогательного средства при ортопедической хирургии.
Режим дозирования
Препарат предназначен для внутрисуставного введения.
В коленные и тазобедренные суставы препарат вводят в дозе 20 мг 1 раз в неделю (содержимое 1 флакона 20 мг/2 мл или заполненного шприца). Курс состоит из 3-5 инъекций.
Правила введения препарата
Следует соблюдать правила асептики и антисептики при выполнении процедуры.
Перед введением Гиалгана Фидия следует удалить выпот из суставной сумки. Вводить препарат следует точно в полость сустава по стандартным методикам, учитывая анатомические особенности. Для удаления выпота и введения препарата можно использовать одну и ту же иглу, однократно введенную перед аспирацией. При этом шприц с препаратом следует присоединить к игле, освобожденной от шприца с аспирированной жидкостью. Для подтверждения нахождения иглы в полости сустава следует аспирировать доступное количество синовиальной жидкости перед медленным введением препарата. Введение препарата в полость сустава следует прекратить при появлении боли во время инъекции.
Следует избегать попадания воздуха в шприц с препаратом.
Оставшийся в шприце препарат не подлежит хранению.
Побочное действие
Местные реакции: возможно — умеренная транзиторная болезненность, отек, увеличение содержания экссудата в полости сустава, повышение температуры и покраснение в области инъекции. Эти реакции носят преходящий характер и обычно исчезают через 24 ч (при возникновении указанных симптомов рекомендуется разгрузить пораженный сустав и приложить лед).
Аллергические реакции: в единичных случаях — зуд, сыпь, крапивница, анафилактические реакции.
Противопоказания к применению
- тяжелые заболевания печени;
- инфекции или повреждение кожного покрова в области инъекции;
- повышенная чувствительность к компонентам препарата;
- повышенная чувствительность к птичьим протеинам.
Применение при беременности и кормлении грудью
Не следует назначать препарат при беременности и в период лактации (грудного вскармливания) в связи с отсутствием клинических данных о применении у данной категории пациентов.
Применение при нарушениях функции печени
Препарат противопоказан при тяжелых заболеваниях печени.
Применение у детей
В связи с отсутствием клинических данных по применению в педиатрии препарат не следует назначать детям.
Особые указания
В течение первых 2 суток после проведения процедуры рекомендуется не перегружать сустав, особенно следует избегать длительной активности.
При получении аспирационной жидкости перед введением препарата следует провести соответствующие исследования для исключения бактериальной этиологии артрита.
Использование в педиатрии
В связи с отсутствием клинических данных по применению в педиатрии препарат не следует назначать детям.
Влияние на способность к управлению транспортными средствами и механизмами
Гиалган Фидия не влияет на способность к управлению автотранспортом и к другим потенциально опасным видам деятельности, требующим повышенной концентрации внимания и быстроты психомоторных реакций.
Передозировка
В настоящее время случаев передозировки не отмечено.
Лекарственное взаимодействие
Гиалган Фидия не следует назначать одновременно с другими препаратами для внутрисуставного введения из-за отсутствия достаточного клинического опыта.
Не следует применять дезинфицирующие средства, содержащие соли четвертичного аммония, поскольку гиалуроновая кислота осаждается в присутствии этих веществ.
Условия хранения препарата Гиалган Фидия
Препарат следует хранить в недоступном для детей, защищенном от света месте при температуре не выше 25°С; не замораживать.
Срок годности препарата Гиалган Фидия
Срок годности — 3 года при хранении в оригинальной упаковке.
Не следует использовать препарат Гиалган Фидия с поврежденной или вскрытой упаковкой.
Условия реализации
Препарат отпускается по рецепту.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Состав
Гиалуронат натрия, дигидрат натрия дигидрофосфат, динатрия додекагидрат гидрофосфат, натрия хлорид, вода д/и.
Форма выпуска
Раствор для введения внутрь сустава 20 мг вязкий прозрачный, бесцветный в стеклянном шприце 2 мл в контурной ячейковой упаковке в картонной пачке №1, 5.
Фармакологическое действие
Противовоспалительное, анальгезирующее, корректирующее метаболизм хрящевой ткани.
Фармакодинамика и фармакокинетика
Фармакодинамика
Препарат с противовоспалительным и обезболивающим действием. Гиалуроновая кислота необходима для процесса формирования протеогликанов в хряще суставов и поддержания эластичности и вязкости синовиальной жидкости.
Остеоартроз сопровождается недостатком и изменениями качественного состава гиалуроновой кислоты в хряще и синовиальной жидкости. Применение препарата при наличии дегенеративных изменений поверхности хряща и изменения состава синовиальной жидкости обеспечивает улучшение функции сустава и клинического течения остеоартроза.
Фармакокинетика
При внутрисуставном введении в течение 2–3 дней гиалуроновая кислота выводится из синовиальной жидкости. Максимальная концентрация гиалуроновой кислоты отмечается в суставной капсуле и синовиальной жидкости, в меньших объемах — в синовиальной мембране, прилегающих мышцах и связках. Метаболизм происходит в печени и околосуставных тканях, выводится препарат с мочой.
Показания к применению
В комплексном лечении остеоартроза и дегенеративных посттравматических изменений суставов и улучшения их подвижности, купирование суставных болей.
Противопоказания
Высокая чувствительность к препарату, период беременности и лактации, заболевания печени, повреждения кожи или наличие инфекции в области инъекции.
Побочные действия
В редких случаях появление умеренной болезненности и отека сустава, увеличение экссудата, покраснение в месте введения препарата и повышение температуры. Реже — местные аллергические реакции на препарат.
Гиалган Фидия, инструкция по применению (Способ и дозировка)
Внутрисуставное введение препарата по стандартной методике с учетом анатомических особенностей в дозе — 20 мг/2 мл (одного наполненного шприца) 1 раз в неделю, всего 5 инъекций.
Передозировка
Нет данных.
Взаимодействие
Гиалган Фидия нельзя вводить в сустав совместно с другими инъекциями в сустав. Нельзя использовать дезинфектанты, в состав которых входят соли аммония, так как эти вещества осаждают гиалуроновую кислоту.
Условия продажи
Отпуск по рецепту.
Условия хранения
При температуре до 25°C.
Срок годности
36 месяцев.
Аналоги Гиалгана Фидия
Совпадения по коду АТХ 4-го уровня:
Рестилайн, Гиалуроновая кислота.
Отзывы о Гиалгане Фидия
Отзывы о препарате у большинства пациентов положительные. Введение этого лечебного средства в сустав, помогло многим пациентам восстановить подвижность и купировать болезненность в суставе. Некоторые пациенты отмечают побочное действие препарата.
«… Ввели 5 уколов Гиалгана Фидия. Первые три укола пошли нормально, а последние два сопровождались подъемом температуры, которая через сутки нормализуется. Но в целом, подвижность сустава улучшилась».
Цена Гиалгана Фидия, где купить
Цена раствора Гиалган Фидия 20 мг/2 мл в комплекте с шприцом 2 мл № 5 варьирует в 5242 —5869 рублей за упаковку. Купить Гиалган Фидия в большинстве аптек Москвы можно без затруднений.
- Интернет-аптеки РоссииРоссия
ЛюксФарма* специальное предложение
-
Гиалган Фидия (Hyalgan Fidia) 2мл 20мг 5шт
-
Гиалган Фидия (Hyalgan Fidia) шприц 2мл 20мг 1шт
показать еще
Флексотрон Кросс — инструкция по применению
Синонимы, аналоги
Статьи
Изделие медицинского назначения. Не является лекарством
1. Наименование медицинского изделия.
Имплантат вязкоэластичный стерильный для внутрисуставных инъекций Флексотрон® Кросс (Flexotron® Cross), на основе перекрестно-сшитого гиалуроната натрия, 60 мг/3,0 мл
2. Состав медицинского изделия.
Состав:
| Ингредиент | Содержание |
| Гиалуронат натрия | 2% |
| Солевой раствор фосфатного буфера: | |
| Na2HPO4*12H2O | 0,134% |
| NaH2PO4*2H2O | 0,004% |
| Хлорид натрия | 0,85% |
| Вода для инъекций | сколько потребуется до 100% |
Технические характеристики:
pH 6,8-7,8
вязкоупругость (G’/G”) 100-200 Па /20-40 Па.
показатель осмоляльности 0,9-1,3 к 0,9% физиологическому раствору
осмоляльность 270~390 мОсм/кг
3. Назначение медицинского изделия.
Медицинское изделие применяется для лечения болей в суставах при остеоартрозе (ОА).
Терапевтическая эффективность:
Имплантат позволяет сбалансировать внешние механические нагрузки на сустав.
Имплантат действует в качестве барьера, защищающего сустав.
3.1. Назначения:
Имплантат Флексотрон® Кросс вязкоэластичный стерильный для внутрисуставной инъекции представляет собой медицинское изделие на основе перекрестно-сшитого гиалуроната натрия, поставляемый в стеклянных шприцах. Изделие представляет собой бесцветный прозрачный вязкий стерильный непирогенный раствор. Стабилизированная гиалуроновая кислота получена методом экстракции из микроорганизмов. Изделие подлежит одноразовому использованию. Гиалуроновая кислота является естественным полисахаридом и важным структурным элементом кожных покровов, подкожных и соединительных тканей, в частности, синовиальной жидкости. Гиалуроновая кислота обладает высокой биологической совместимостью и одинаковая у всех живых организмов. 1 мл имплантата содержит 20 мг натрия гиалуроната в солевом растворе фосфатного буфера.
3.2. Показания:
Медицинское изделие показано для лечения болей в суставах при остеоартрозе (ОА).
3.3. Противопоказания:
- Не используйте имплантат для лечения пациентов с повышенной чувствительностью к продуктам на основе гиалуроната.
- Внутрисуставные инъекции противопоказаны в случае перенесенных или текущих инфекций или кожных заболеваний в непосредственной близости от места инъекции.
Предупреждение:
Медицинское изделие предназначено для использования в качестве внутрисуставного имплантата. Запрещено подвергать имплантат повторной стерилизации или смешивать его с другими препаратами.
Необходимо избегать введения имплантата в кровеносные сосуды и окружающие ткани. Лечащий врач должен проявить особое внимание к пациентам, имеющим в анамнезе случаи аллергических реакций на лекарственные препараты, а также заболевания печени.
Не используйте имплантат, если его упаковка нарушена.
Повторное использование одного и того же шприца с имплантатом может привести к развитию инфекции и серьезной воспалительной реакции.
Пациенты пожилого возраста
По причине ослабленного состояния организма у пожилых людей лечащему врачу необходимо пристально следить за их состоянием при применении имплантата.
Период беременности и грудного вскармливания
В случае, если ожидаемый положительный терапевтический эффект перевешивает негативное влияние побочных эффектов, рекомендуется использовать имплантат. В период лечения кормящим женщинам необходимо прервать грудное вскармливание.
Дети
Точные данные о безопасности применения имплантата у детей отсутствуют, поэтому при лечении врач обязан внимательно следить за состоянием пациентов детского возраста.
3.4. Возможные побочные эффекты:
Основными побочными эффектами применения имплантата являются боль, отек и скованность в колене, в которое была произведена инъекция.
Внимание!
Не следует скручивать или поворачивать поршень шприца, так как это может привести к утечке имплантата, деформации поршня и увеличению силы экструзии. Шприц, игла и любые неиспользованные материалы необходимо утилизировать сразу же после проведения инъекции.
Не используйте имплантат, если его упаковка нарушена. Перед использованием внимательно ознакомьтесь с инструкцией.
3.5. Способ применения:
Имплантат вводится в объеме, содержащимся в одном шприце, рассчитанного на одного взрослого пациента, в сустав, пораженный остеоартрозом (ОА). Имплантат вводится путем инъекции непосредственно в сустав.
Изделие назначается рекомендованным курсом внутрисуставно 1 шприц на лечение для взрослых в сустав, пораженный остеоартритом (ОА). Изделие используется для инъекций в полость сустава. Дозировка составляет 3 мл на курс лечения, поэтому взрослым следует вводить всё содержимое шприца. Эффективность изделия сохраняется не менее 6 месяцев.
Перед проведением инъекции необходимо:
- Удалить покрывающую мембрану и извлечь наполненный шприц с имплантатом из блистера.
- Аккуратно вверх снять крышку вместе с защитным колпачком.
- Присоединить необходимую по размеру (21-23G) стерильную иглу и закрепить ее, слегка повернув.
- Перед инъекцией выпустить из шприца пузырьки воздуха в случае их наличия.
3.6. Условия применения:
Изделие предназначено для использования квалифицированными специалистами и медицинскими работниками в лицензированных учреждениях или больницах.
3.7. Меры предосторожности при применении.
Необходимо соблюдать общие меры предосторожности для внутрисуставных инъекций, а также меры по предотвращению инфицирования сустава. Следует вводить имплантат только в полость сустава, при необходимости применяя средства визуального контроля. Избегать попадания изделия медицинского назначения в окружающие ткани или кровеносные сосуды! При воспалительных явлениях в суставе проявлять повышенную осторожность. Не рекомендуется применять при ревматоидных артритах в активной стадии.
3.8. Извлечение импланта.
В случае выраженных проявлений может быть рекомендовано удаление импланта из полости сустава, в том числе с применением лаважа согласно действующим клиническим рекомендациям.
Запрещаются повторные инъекции имплантатов синовиальной жидкости в сустав до купирования симптомов острого воспаления!
4. Описание принципов работы.
4.1. Изделие показано для лечения боли в суставах при остеоартрите (ОА) у пациентов, у которых отсутствует адекватная реакция на консервативную немедикаментозную терапию и на легкие анальгетики.
4.2. Рекомендуемый курс лечения предполагает внутрисуставное введение содержимого 1 шприца взрослому пациенту в пораженный остеоартритом (ОА) сустав. Изделие используется для инъекции в сустав. Терапевтический эффект применения изделия сохраняется в течение как минимум 6 месяцев.
4.3. Молекула гиалуроновой кислоты имеет спиральную длинноцепочечную структуру, которая позволяет удерживать или поглощать молекулы воды. Данные свойства обеспечивают смазывающее и амортизирующее действие внутри сустава. Остеоартрит, известный как дегенеративный артрит, часто приводит к разрушению коллагена и потере протеогликанов. Инъекция гиалуроновой кислоты может защитить ткани полости суставов, смягчая внешнее механическое давление.
4.4. Химические свойства: Имплантат представляет собой бесцветный, прозрачный, вязкий, стерильный и апирогенный гидрогель. Функциональным ингредиентом изделия является 2% гиалуроновая кислота, получаемая посредством ферментации бактерий Streptococcus zooepidemicus.
Диглицидиловый эфир 1,4-бутандиола (ДГЭБД/BDDE) используется в качестве перекрестносшивающего агента для получения перекрестносшитой гиалуроновой кислоты.
4.5. Электромагнитные свойства: Имплантат не обладает электромагнитным действием.
4.6. Радиация: Имплантат не испускает радиоактивного излучения и не является возможным источником радиационного загрязнения.
4.7. Теплоизоляционные свойства: Имплантат не обладает теплоизолирующим действием.
4.8. Механическая часть: Имплантат не имеет механизированного функционала.
4.9. Сочетание с другими лекарственными средствами: Имплантат не включает в себя лекарственные средства.
4.10. Производные крови человека: Имплантат не включает в себя производные крови человека.
4.11. Животная ткань: Имплантат не включает в себя животные ткани.
5. Техническое описание.
Вариантов исполнения не имеется.
Содержимое помещается в стерильный стеклянный шприц и закрывается пробкой. На шприц помещается наклейка с информацией об изделии. Перед помещением в блистер шприц укомплектовывается ограничителем обратного хода поршня и поршнем. Блистер затем запаивается мембраной, и на него приклеивается этикетка с информацией об изделии. Запаянный блистер и инструкция по применению (IFU) помещаются в коробку.
6. Методы и средства дезинфекции и предстерилизационной очистки.
Имплантат предназначен только для одноразового применения. Имплантат стерилизован влажным жаром. Перед использованием повторная стерилизация не требуется.
7. Стерильность.
Изделие проходит финишную стерилизацию влажным жаром в соответствии с EN 556-1. Валидация данного процесса осуществляется в соответствии со стандартами EN ISO 11138-3, EN ISO 17665-1 и EN ISO 17665-2 для подтверждения стерильности.
8. Транспортировка
Допустимые температурные границы от 2 до 30°С. Беречь от солнечных лучей и замораживания.
9. Упаковка
Первичная упаковка включает бесфталатный шприц с защитным колпачком и пробкой, которая непосредственно контактирует с содержимым. Затем наполненный шприц закрывается штоком поршня и ограничителем хода поршня, после чего неподвижно закрепляется во вторичной упаковке, которая выполняет защитную функцию и представляет собой блистер, запаянный материалом TYVEK.
Одна единица продукции включает:
- заполненный стерильный шприц в запаянном блистере;
- инструкцию пользователя;
- 3 имплантационных стикера;
- картонную коробку (третичная упаковка).
10. Маркировка
Расшифровка маркировочных символов на упаковке:
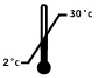





НЕТОКСИЧНО
Не токсичен

PINF-01(02) 20180320
11. Хранение и срок годности
Хранить в соответствии с информацией, указанной на упаковке при комнатной температуре. Допустимый температурные границы от 2 до 30 градусов. Не допускать воздействия солнечного света, не замораживать.
Срок хранения: 3 года.
12. Порядок осуществления утилизации и уничтожения
Уничтожение использованных медицинских изделий и медицинских изделий с истекшим сроком годности осуществляется в соответствии с природоохранными требованиями национальных, местных и ведомственных руководящих положений о безопасном уничтожении и утилизации.
13. Гарантийные обязательства
Имплантат Флексотрон® Кросс (Flexotron® Cross) – продукт одноразового использования. Срок годности протеза синовиальной жидкости ограничен и составляет 3 года с даты изготовления. Дата истечения срока годности указана на упаковке («Использовать до») и действительна при соблюдении условий транспортировки и хранения.
14. Требования к техническому обслуживанию и ремонту медицинского изделия. Сервисное обслуживание.
Не применимо.
15. Производитель
«СайВижн Байотек Инк.», Тайвань, Китайская Республика
SciVision Biotech Inc. 9, South 6th Rd., K.E.P.Z., Kaohsiung 806, Taiwan, R.O.C.
16. Уполномоченный представитель производителя
Общество с ограниченной ответственностью «МКНТ Импорт» (ООО «МКНТ Импорт») 119071, город Москва, улица Орджоникидзе, дом 12, стр. 2, Российская Федерация.
17. Применимые стандарты
17.1 Зарубежные стандарты.
| Стандарт | Заголовок стандарта |
| ISO 13485: 2016 | ИЗДЕЛИЯ МЕДИЦИНСКИЕ – СИСТЕМЫ МЕНЕДЖМЕНТА КАЧЕСТВА – ТРЕБОВАНИЯ ДЛЯ ЦЕЛЕЙ РЕГУЛИРОВАНИЯ. |
| ISO 14630:2012 | ИМПЛАНТАТЫ ХИРУРГИЧЕСКИЕ НЕАКТИВНЫЕ. ОБЩИЕ ТРЕБОВАНИЯ. |
| IEC 62366-1:2015 | ИЗДЕЛИЯ МЕДИЦИНСКИЕ. ПРИМЕНЕНИЕ ТЕХНОЛОГИЙ ПО ЭФФЕКТИВНОСТИ ИСПОЛЬЗОВАНИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ |
| ISO 14602:2010 | ИМПЛАНТАТЫ ХИРУРГИЧЕСКИЕ НЕАКТИВНЫЕ. ИМПЛАНТАТЫ ДЛЯ ОСТЕОСИНТЕЗА. ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ |
| EN ISO 14971:2012 | ИЗДЕЛИЯ МЕДИЦИНСКИЕ – ПРИМЕНЕНИЕ МЕНЕДЖМЕНТА РИСКА К МЕДИЦИНСКИМ ИЗДЕЛИЯМ. |
| ISO 14155:2011 | ИСПЫТАНИЯ КЛИНИЧЕСКИЕ МЕДИЦИНСКИХ ИЗДЕЛИЙ ДЛЯ ЛЮДЕЙ – НАДЛЕЖАЩАЯ КЛИНИЧЕСКАЯ ПРАКТИКА. |
| ФСША | ФАРМАКОПЕЯ СОЕДИНЕННЫХ ШТАТОВ АМЕРИКИ |
| Европейская фармакопея | ЕВРОПЕЙСКАЯ ФАРМАКОПЕЯ |
| ISO 10993-1:2018 | ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ – ЧАСТЬ 1: ОЦЕНКА И ИССЛЕДОВАНИЯ. |
| ISO 10993-3:2014 | ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ – ЧАСТЬ 3: ИССЛЕДОВАНИЕ ГЕНОТОКСИЧНОСТИ, КАНЦЕРОГЕННОСТИ И ТОКСИЧЕСКОГО ДЕЙСТВИЯ НА РЕПРОДУКТИВНУЮ ФУНКЦИЮ. |
| ISO 10993-5:2009 | ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ – ЧАСТЬ 5: ИССЛЕДОВАНИЯ НА ЦИТОТОКСИЧНОСТЬ: МЕТОДЫ IN VITRO. |
| ISO 10993-6:2016 | ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ – ЧАСТЬ 6: ИССЛЕДОВАНИЯ МЕСТНОГО ДЕЙСТВИЯ ПОСЛЕ ИМПЛАНТАЦИИ. |
| ISO 10993-10:2010 | ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ – ЧАСТЬ 10: ИССЛЕДОВАНИЯ РАЗДРАЖАЮЩЕГО И СЕНСИБИЛИЗИРУЮЩЕГО ДЕЙСТВИЯ. |
| ISO 10993-11:2017 | ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ – ЧАСТЬ 11: ИССЛЕДОВАНИЯ ОБЩЕТОКСИЧЕСКОГО ДЕЙСТВИЯ. |
| ISO 10993-12:2012 | ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ – ЧАСТЬ 12: ПРИГОТОВЛЕНИЕ ПРОБ И КОНТРОЛЬНЫЕ ОБРАЗЦЫ. |
| ISO 10993-18:2005 | ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ. ИССЛЕДОВАНИЕ ХИМИЧЕСКИХ СВОЙСТВ МАТЕРИАЛОВ |
| ASTM F1980-16:2016 | СТАНДАРТНОЕ РУКОВОДСТВО ПО УСКОРЕННОМУ СТАРЕНИЮ СИСТЕМ ЗАЩИТЫ СТЕРИЛЬНОСТИ МЕДИЦИНСКИХ ИЗДЕЛИЙ |
| EN 556-1:2001 | СТЕРИЛИЗАЦИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ – ТРЕБОВАНИЯ К МЕДИЦИНСКИМ ИЗДЕЛИЯМ КАТЕГОРИИ «СТЕРИЛЬНЫЕ» – ЧАСТЬ 1:ТРЕБОВАНИЯ К МЕДИЦИНСКИМ ИЗДЕЛИЯМ, ПОДЛЕЖАЩИМ ФИНИШНОЙ СТЕРИЛИЗАЦИИ. |
| ISO 11138-1:2017 | СТЕРИЛИЗАЦИЯ МЕДИЦИНСКОЙ ПРОДУКЦИИ – БИОЛОГИЧЕСКИЕ ИНДИКАТОРЫ – ЧАСТЬ 1: ОБЩИЕ ТРЕБОВАНИЯ. |
| ISO 11138-3:2017 | СТЕРИЛИЗАЦИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ – БИОЛОГИЧЕСКИЕ ИНДИКАТОРЫ – ЧАСТЬ 3: БИОЛОГИЧЕСКИЕ ИНДИКАТОРЫ ДЛЯ СТЕРИЛИЗАЦИИ ВЛАЖНЫМ ЖАРОМ. |
| ISO 11737-1:2018 | СТЕРИЛИЗАЦИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ – МИКРОБИОЛОГИЧЕСКИЕ МЕТОДЫ – ЧАСТЬ 1: ОЦЕНКА ПОПУЛЯЦИИ МИКРООРГАНИЗМОВ НА ПРОДУКЦИИ. |
| ISO 11737-2:2009 | СТЕРИЛИЗАЦИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ. МИКРОБИОЛОГИЧЕСКИЕ МЕТОДЫ. ИСПЫТАНИЯ НА СТЕРИЛЬНОСТЬ, ПРОВОДИМЫЕ ПРИ ОПРЕДЕЛЕНИИ, ВАЛИДАЦИИ И ПОДДЕРЖАНИИ ПРОЦЕССОВ СТЕРИЛИЗАЦИИ |
| ISO 17665-1:2006 | СТЕРИЛИЗАЦИЯ МЕДИЦИНСКОЙ ПРОДУКЦИИ – ВЛАЖНЫЙ ЖАР – ЧАСТЬ 1: ТРЕБОВАНИЯ К РАЗРАБОТКЕ, ВАЛИДАЦИИ И ТЕКУЩЕМУ КОНТРОЛЮ ПРОЦЕССА СТЕРИЛИЗАЦИИ МЕДИЦИНСКИХ ИЗДЕЛИЙ. |
| ISO 14644-1:2015 | ЧИСТЫЕ ПОМЕЩЕНИЯ И СВЯЗАННЫЕ С НИМИ КОНТРОЛИРУЕМЫЕ СРЕДЫ. КЛАССИФИКАЦИЯ ЧИСТОТЫ ВОЗДУХА. |
| ISO 14644-2:2015 | ЧИСТЫЕ ПОМЕЩЕНИЯ И СВЯЗАННЫЕ С НИМИ КОНТРОЛИРУЕМЫЕ СРЕДЫ. ТРЕБОВАНИЯ К КОНТРОЛЮ И МОНИТОРИНГУ ДЛЯ ПОДТВЕРЖДЕНИЯ ПОСТОЯННОГО СООТВЕТСТВИЯ СТАНДАРТУ ISO 14644-1. |
| ISO 13408-1:2008 | АСЕПТИЧЕСКОЕ ПРОИЗВОДСТВО МЕДИЦИНСКОЙ ПРОДУКЦИИ – ЧАСТЬ 1: ОБЩИЕ ТРЕБОВАНИЯ. |
| ISO 11607-1:2019 | УПАКОВКА ДЛЯ ОКОНЧАТЕЛЬНО СТЕРИЛИЗОВАННЫХ МЕДИЦИНСКИХ ИЗДЕЛИЙ. ЧАСТЬ 1. ТРЕБОВАНИЯ К МАТЕРИАЛАМ, СТЕРИЛЬНЫМ БАРЬЕРНЫМ СИСТЕМАМ И УПАКОВОЧНЫМ СИСТЕМАМ |
| ISO 11607-2:2019 | УПАКОВКА ДЛЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ, ПОДЛЕЖАЩИХ ФИНИШНОЙ СТЕРИЛИЗАЦИИ – ЧАСТЬ 2: ТРЕБОВАНИЯ К ВАЛИДАЦИИ ПРОЦЕССОВ ФОРМИРОВАНИЯ, ГЕРМЕТИЗАЦИИ И СБОРКИ. |
| ISO 11040-8:2016 | ШПРИЦЫ ПРЕДВАРИТЕЛЬНО ЗАПОЛНЕННЫЕ. ЧАСТЬ 8. ТРЕБОВАНИЯ И МЕТОДЫ ИСПЫТАНИЙ ГОТОВЫХ ПРЕДВАРИТЕЛЬНО ЗАПОЛНЕННЫХ ШПРИЦЕВ |
| ISO 80369-7:2016 | СОЕДИНИТЕЛИ МАЛОГО ДИАМЕТРА ДЛЯ ЖИДКОСТЕЙ И ГАЗОВ В ЗДРАВООХРАНЕНИИ. ЧАСТЬ 7. СОЕДИНИТЕЛИ ДЛЯ ВНУТРИСОСУДИСТОГО ИЛИ ПОДКОЖНОГО ПРИМЕНЕНИЯ |
17.2 Национальные стандарты Российской Федерации
| Стандарт | Заголовок стандарта |
| ГОСТ Р 50444-92 | «Приборы, аппараты и оборудование медицинские. Общие технические условия» |
| ГОСТ Р ИСО 14630-2017 | «Имплантаты хирургические неактивные. Общие требования» |
| ГОСТ ISO 11607-2011 | «Упаковка для медицинских изделий, подлежащих финишной стерилизации. Общие требования» |
| ГОСТ Р ИСО 15223-1-2014 | Изделия медицинские. Символы, применяемые при маркировании на медицинских изделиях, этикетках и в сопроводительной документации. Часть 1. Основные требования |
| ГОСТ ISO 7886-1-2011 | Шприцы инъекционные однократного применения стерильные. Часть 1. Шприцы для ручного использования |
| ГОСТ ISO 14602-2012 | «Неактивные хирургические имплантаты. Имплантаты для остеосинтеза. Технические требования» |
| ГОСТ Р МЭК 62366-2013 | Изделия медицинские. Проектирование медицинских изделий с учетом эксплуатационной пригодности |
| ГОСТ Р ИСО 15223-1-2014 | «Изделия медицинские. Символы, применяемые при маркировании на медицинских изделиях, этикетках и в сопроводительной документации. Часть 1. Основные требования» |
| ГОСТ Р 52770-2016 | «Изделия медицинские. Требования безопасности. Методы санитарно-химических и токсикологических испытаний» |
| ГОСТ ISO 10993-1-2011 | «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка исследования» |
| ГОСТ ISO 10993-12-2015 | «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 12. Приготовление проб и контрольные образцы» |
| ГОСТ Р ИСО 10993-2-2009 | «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 2. Требования к обращению с животными» |
| ГОСТ ISO 10993-9-2015 | «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 9. Основные принципы идентификации и количественного определения потенциальных продуктов деструкции» |
Купить Флексотрон Кросс в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 |
Международное непатентованное название? Нет |
 |
Содержимое предварительно наполненного шприца 2 млсоставляет 30 мг натрия гиалуроната, 18 мг натрия хлорида и вода для инъекций, достаточная до достижения объема препарата 2 мл. |
 |
Средства, замещающие синовиальную и слезную жидкости |
 |
ПроизводителиК.О. Ромфарм(Румыния) |
 |
Показания к применению Гиалуром раствор 1,5% 2млПри болях и ограниченной подвижности, вызванных дегенеративнодистрофическими и травматическими изменениями коленного, тазобедренного и других синовиальных суставов;для временного замещения и восполнения синовиальной жидкости; при лечении пациентов, ведущих активный образ жизни и регулярно нагружающих пораженный сустав |
 |
Способ применения и дозировка Гиалуром раствор 1,5% 2млИнъекции производятся врачами-специалистами.Раствор предназначен только для внутрисуставного применения. Не применяют внутривенно. Введение гиалуроната натрия осуществляется при комнатной температуре.Введенный объем зависит от размера сустава, но не превышает 2 мл в коленный сустав и другие большие суставы, или 1 мл для маленьких суставов. Врач является ответственным за установлением применимого объема и должен убедиться, что сустав не перегружен.Раствор вводится внутрь полости сустава один раз в неделю в течение 3-х недель подряд. Возможно одновременное лечение нескольких суставов. Повторный цикл лечения нельзя проводить ранее чем через 6 месяцев, для одного и того жесустава.Перед применением препарата накопления жидкости в суставе должны быть удалены путем высасывания шприцем.Раствор выпускается в виде предварительно наполненного шприца, содержимое которого не нужно разбавлять. Препарат является стерильным и нужно использовать сразу после открытия упаковки. Препарат предназначен только дляодноразового использования и должен аккуратно вводиться в полость сустава, тщательно соблюдаясхему введения. Введение является асептической процедурой, поэтому соблюдайте соответствующие меры предосторожности.Готовый шприц извлекается из стерильного футляра, колпачок снимается, после чего надевается стерильная игла, которая фиксируется небольшим поворотом. Перед введением нужно удалить воздух из шприца. |
 |
Противопоказания Гиалуром раствор 1,5% 2млИндивидуальная непереносимость (в т.ч. гиперчувствительность в анамнезе) компонентов раствора ; наличие инфицированных ран, ссадин в области сустава; инфекционные заболевания суставов; известные системные нарушения свертываемости крови.Может содержать следы бактериальных белков и противопоказанпациентам с соответствующей гиперчувствительностью. |
 |
Фармакологическое действиеВ синовиальной жидкости гиалуронат натрия выступаеткак смазка и поглотитель удара, что способствует нормальному движению без боли.При заболевании типа артрита, вязкоупругость синовиальной жидкости снижается, так что значительно увеличивает механическую нагрузку на сустав и усиливаетсяразрушение суставного хряща, проявляется ограничением и болями при движении в суставах.Смазывающее и амортизирующее действие этого препарата смягчают боли и улучшают подвижность сустава при внутрисуставном применении. Данные эффектыпродолжаются более 6 месяцев после одного курса лечения. |
 |
Побочное действие Гиалуром раствор 1,5% 2млГиалуронат натрия отличается превосходной переносимостью. Возможно появление местных вторичных явлений, таких как боли, ощущение тепла, покраснение и опухание, могут наблюдаться на суставе, в который введен препарат (наложение льда на сустав в течение пяти — десяти минут снимут все подобные явления).Крайне редко могут наблюдаться аллергические реакции.При внутрисуставном введении существуют минимальные риски, связанные с инфекцией и кровотечением |
 |
Особые указанияНужно соблюдать схему введения и правила асептики и антисептики при внутрисуставном введении.Инъекции гиалуроната натрия должны производиться исключительно дипломированными и сертифицированными врачами соответствующего профиля.Не использовать натрия гиалуронат в избыточном количестве, тщательно наблюдать за пациентами. Не перегружать межсуставное пространство. Если боль усиливается вовремя введения, процедура должна быть остановлена.Перед применением раствора пациенты должны быть тщательнообследованы для обнаружения признаков острого воспаления, и врач должен определить возможность и схему лечения таких пациентов указанным препаратом.Как и после любой другой инвазивной процедуры на суставе, после инъекции гиалуроната натрия, пациенту рекомендуется придерживаться щадящего режима и избегать излишней нагрузки на сустав в течение нескольких дней.Пациентам с болезненными последствиями после внутрисуставного введения гиалуроната натрия следует немедленно обратиться к врачу.До сегодняшнего дня не существуют достаточных данных, чтобы рекомендовать использование данного препарата у детей и подростков.Не следует использовать одновременно или в смеси с другимипрепаратами, предназначенными для внутрисуставного применения.Раствор предназначен только для одноразового использования. Не допускается повторное использование.Использование открытой и/или поврежденной стерильной упаковки не допускается.Повторная стерилизация не допускается. Препарат вводится только, если раствор является прозрачным. |
 |
Условия храненияХранить при температуре ниже 25°C, в оригинальной упаковке, в сухом месте.Не замораживать.Хранить в недоступном для детей месте.Не применять по истечении срока годности. |

