- Состав: гипохлорит натрия, вода. Содержание активного хлора — не менее 140 г/дм3.
- Тара: канистры по 12, 26 и 33 литров.
- Предназначено: для обеззараживания воды в плавательных бассейнах в соответствии с требованиями санитарно-эпидемиологической безопасности. Обладает антимикробной активностью на: вегетативные формы грамположительных и грамотрицательных бактерий, колиформные бактерии, колифаги, споры сульфитредуцирующих клостридий, цисты лямблий. Средство предназначено также для мытья и дезинфекции санитарно-технического оборудования, кафеля, пластика, унитазов, мусорных ведер и т.д.
Вы можете купить гипохлорит натрия и другие хлорсодержащие дезинфекторы в компании «Good Pools»




Лонгафор таблетированный препарат 20 г Маркопул-Кемиклс (1 кг)
Медленнорастворимые хлорные таблетки (по 20 г) для долгосрочной дезинфекции воды в бассейне. Активно борется с бактериями и вирусами, воздействует на вегетативные формы спорообразующих микроорганизмов, а также микроспоры зеленого планктона. Обладает осветляющим эффектом.
Цена по запросу
В корзину



Инструкция по применению гипохлорита натрия для бассейнов
Применяется в виде водного раствора. Препарат дозируется в воду бассейна с помощью дозирующего автоматического устройства. Расход препарата определяется в соответствии с показателем уровня свободного хлора в воде бассейна, при этом необходимо постоянно производить контроль и корректировку содержания активного хлора в воде бассейна. Содержание свободного хлора после введения средства и распределения его по объему бассейна должно составлять 0,1-0,5 мг/л.
При отсутствии дозирующего автоматического устройства рекомендуется растворить препарат в отдельной емкости в воде, взяв соотношение дезинфицирующего средства к воде равное 1:5 или 1:10 по объему, и полученный раствор добавить в бассейн вблизи места подачи воды.
Дезинфекция гипохлоритом натрия
| Время начала обработки | Дозировка, л, на: | |||||
| 10 м3 | 20 м3 | 40 м3 | 60 м3 | 80 м3 | 100 м3 | |
| Не менее чем за 12 часов до приема посетителей | 0,20-0,25 | 0,40-0,50 | 0,80-1,00 | 1,20-1,50 | 1,60-2,10 | 2,00-2,60 |
| Не менее чем за два часа до приема посетителей | 0,07-0,10 | 0,15-0,20 | 0,30-0,40 | 0,45-0,65 | 0,60-0,80 | 0,70-1,00 |
| Ежечасная текущая обработка во время приема посетителей | 0,04 | 0,08 | 0,16 | 0,23 | 0,27 | 0,40 |
Предварительно растворить указанное количество средства в отдельной ёмкости, понизив исходную концентрацию в 5-10 раз, и полученный раствор добавить в бассейн, вблизи места подачи воды.
Для мытья и дезинфекции санитарно-технического оборудования, кафеля, пластика, унитазов, мусорных ведер и т.д.: растворить 80 мл средства в одном литре воды, тщательно обработать поверхность, оставить на 15-20 мин, смыть водой.
Аналог гипохлорита натрия — жидкий хлор для бассейна
Гипохлорит натрия и жидкий хлор это одно и то же. Применяют данный препарат в основном для станций автоматической дозации. Содержания натрия в химии влияет на PH воды в бассейне, нужно контролировать и делать замеры. Если стоит автоматика, то она сама все выравнивает. Основные продукты, представленные на рынке РФ, — Дезинфектор Aqualeon и Эмовекс (Маркопул Кемиклс).
- Гипохлорит натрия Эмовекс (ручная дозация) и Эмовекс новая формула (для автоматических станций). Поставляется в непрозрачных канистрах, что неудобно при работе с автоматикой, не видно уровня гипохлорита натрия в канистре.
- Гипохлорит натрия Aqualeon применяется для дезинфекции при помощи станций автоматической дозации. Фасуется в прозрачные канистры, что позволяет легко контролировать уровень дезинфектора в таре.
- Гипохлорит натрия Bayrol — встречается редко, т.к. срок годности гипохлорита 6 мес. и доставлять его из Германии дорого и долго.
Хранение гипохлорита натрия
- Хранить при температуре не выше плюс 30 С в крытом сухом проветриваемом помещении на расстоянии не менее 1 м от нагревательных приборов отдельно от горючих материалов и кислот.
- Беречь от попадания прямых солнечных лучей.
- Избегать попадания на окрашенные предметы во избежание их обесцвечивания.
- Хранить герметично закрытым в полимерных емкостях или емкостях из коррозионно-стойких материалов.
- По истечении срока годности средство утилизируют как бытовой отход.
- Средство замерзает, после размораживания сохраняет свои свойства.
- Срок годности средства с содержанием активного хлора не менее 140 г/дм3 – шесть месяцев с даты изготовления.
При проведении любой инфузии необходимо наблюдать за состоянием пациента, за клиническими и биологическими показателями, особенно важно оценивать электролиты плазмы. В организме детей из-за незрелости функции почек может замедляться экскреция натрия. Поэтому у таких пациентов повторные инфузии следует проводить только после определения концентрации натрия в плазме.
Применять только прозрачный раствор, без видимых включений, если упаковка не повреждена. Вводить непосредственно после подключения к инфузионной системе. Не применять последовательное соединение пластиковых контейнеров. Это может привести к воздушной эмболии вследствие засасывания воздуха, оставшегося в первом контейнере, которое может произойти до того, как поступит раствор из следующего контейнера. Раствор следует вводить с применением стерильного оборудования с соблюдение правил асептики и антисептики. Во избежание попадания воздуха в инфузионную систему ее следует заполнить раствором, выпустив остаточный воздух из контейнера полностью. Добавлять другие препараты в раствор можно до или во время инфузии путем инъекции в специально предназначенную для этого область контейнера.
Как и для всех парентеральных растворов, совместимость добавляемых веществ с раствором должна определяться перед растворением.
Не должны применяться с раствором натрия хлорида 0.9% препараты, известные как несовместимые с ним. Определять совместимость добавляемых лекарственных веществ с раствором натрия хлорида 0.9% должен врач, проверив возможное изменение окраски и/или появления осадка, нерастворимых комплексов или кристаллов.
Перед добавлением необходимо определить, является ли добавляемое вещество растворимым и стабильным в воде при уровне рН, что и у раствора натрия хлорида 0.9%.
При добавлении препарата необходимо определить изотоничность полученного раствора до вливания. Перед добавлением в раствор препаратов их необходимо тщательно перемешать с соблюдением правил асептики. Приготовленный раствор следует ввести сразу после приготовления, не хранить!
Добавление других препаратов или нарушение техники введения может вызвать лихорадку вследствие возможного попадания в организм пирогенов. В случае развития нежелательных реакций, необходимо немедленно прекратить введение раствора. До начала применения раствора не следует извлекать контейнер из внешнего защитного полипропилен/полиамидного пакета, в который он помещен, так как он поддерживает стерильность препарата.
Инструкция по использованию контейнеров Viaflo (Виафло)
1. Вскрытие упаковки.
а. Извлеките контейнер Виафло из внешнего пакета непосредственно перед применением.
б. Плотно сжимая контейнер, необходимо проверить его на предмет его целостности. Если обнаружены механические повреждения, контейнер следует утилизировать, так как стерильность может быть нарушена.
в. Проверьте раствор на прозрачность и отсутствие включений. Контейнер следует утилизировать, если нарушена прозрачность или имеются включения.
2. Подготовка к применению.
Для подготовки и введения раствора используйте стерильные материалы, а. Подвесьте контейнер за петлю к штативу. Удалите пластиковый предохранитель с выходного порта, расположенного в нижней части контейнера:
- возьмитесь одной рукой за маленькое крылышко на горловине выходного порта,
- возьмитесь другой рукой за большое крылышко на крышке и перекрутите,
- крышка откроется.
в. При постановке инфузионной системы следует придерживаться правил антисептики.
г. Установите инфузионную систему в соответствии с указаниями по присоединению, заполнению системы и введению раствора, которые содержатся в инструкции к системе.
3. Добавление в раствор других препаратов.
Внимание: добавленные препараты могут оказаться несовместимыми с раствором.
Для добавления перед введением:
а. Продезинфицируйте область для инъекции препаратов на контейнере (порт для ввода препаратов).
б. Используя шприц с иглой 19-22 размера (1.10-0.70 мм), сделайте прокол в этой области и введите препарат.
в. Тщательно перемешайте препарат с раствором. Для препаратов с высокой плотностью, такого как калия хлорид, аккуратно введите препарат через шприц, удерживая контейнер таким образом, чтобы порт для ввода препаратов находился сверху (вверх дном),после чего перемешайте.
Внимание: не храните контейнеры, в которые добавлены препараты.
Для добавления препарата во время введения:
а. Переведите зажим системы, регулирующий подачу раствора в положение «Закрыто».
б. Продезинфицируйте область для инъекции препаратов на контейнере (порт для ввода препаратов).
в. Используя шприц с иглой 19-22 размера (1.10-0.70 мм), сделайте прокол в этой области и введите препарат.
г. Снимите контейнер со штатива и/или переверните его вверх дном.
д. Удалите воздух из обоих портов.
е. Тщательно перемешайте препарат с раствором.
ж. Верните контейнер в рабочее положение, переведите зажим системы в положение «Открыто» и продолжите введение.
Следует утилизировать емкости после однократного применения. Следует утилизировать каждую неиспользованную дозу.
Не соединять повторно частично использованные контейнеры (независимо от количества оставшегося в нем раствора).
Влияние на способность к управлению транспортными средствами и механизмами
Не описано.
Д. А. Меркулов, к.х.н., зав. кафедрой фундаментальной и прикладной химии, ФГБОУ ВПО «Удмуртский государственный университет», г. Ижевск
Введение
Гипохлоритами называют соли хлорноватистой кислоты HClO. Наиболее распространенными из них являются гипохлорит натрия, гипохлорит кальция и гипохлорит калия. Гипохлориты широко применяются для обеззараживания питьевой воды, отбеливания, дегазации и дезинфекции. Гипохлориты являются одними из самых важных химических соединений.
Таблица 1. Наиболее распространенные гипохлориты.
| Систематическое наименование | Традиционное название | Хим. формула | CAS № | М, г/моль |
|---|---|---|---|---|
| Гипохлорит натрия | Хлорноватистокислый натрий, лабарракова вода (гипохлорит натрия в смеси с хлоридом натрия и гидроксидом натрия) | NaClO | 7681–52–9 | 74,44 |
| Гипохлорит калия | Хлорноватистокислый калий,
жавелевая вода (гипохлорит калия в смеси с гидрокарбонатом калия и хлоридом калия) |
KClO | 7778–66–7 | 90,55 |
| Гипохлорит кальция | Хлорноватистокислый кальций, хлорная известь (гипохлорит кальция в смеси с хлоридом кальция, оксихлоридом кальция и гидроксидом кальция) | Ca(ClO)2 | 7778–54–3 | 142,98 |
История открытия
В 1774 г. шведский химик Карл Вильгельм Шееле получил хлор (Cl2) в результате взаимодействия оксида марганца(IV) MnO2 и соляной кислоты (HCl). Позже, в 1785 г. французский химик Клод Луи Бертолле обнаружил, что водный раствор газообразного хлора («хлорная вода»), содержащий хлорноватистую и хлороводородную кислоты, может отбелить белье, и сообщил о своих выводах Французской академии наук.
Cl2 + H2O = HClO + HCl
Знания об отбеливающих свойствах хлора были незамедлительно использованы Джеймсом Уаттом на текстильной фабрике в Глазго. Несмотря на то, что отбеливание с использованием хлора был значительно эффективнее традиционных способов отбеливания солнечным светом, слабыми растворами кислот и щелочей, применение хлора ограничивалось его токсичностью и разрушающим действием на ткани. Для стабилизации раствора газообразного хлора в воде и безопасности его применения, в 1787 г. на Парижском предприятии Societe Javel хлор стали пропускать через водный раствор карбоната калия (поташа)
Cl2 + K2СO3 = 2KHCO3 + KClO + KCl.
Глава предприятия Леонард Альбан назвал новый продукт «Eau de Javel» («жавелевая вода»), и вскоре белильная жидкость стала популярной во Франции и Англии.
В 1820 г. француз Антуан Лабаррак усовершенствовал способ получения отбеливателя, заменив поташ на более дешевый гидроксид натрия (каустическую соду). Полученный раствор гипохлорита и хлорида натрия получил название «Eau de Labarraque» («лабарракова вода»).
Cl2 + 2NaOH = NaClO + NaCl + H2O.
Широкое применение гипохлоритов для обеззараживания питьевой воды и дезинфекции стало возможным гораздо позже, в начале XX века, благодаря развитию промышленного производства хлора электролизом поваренной соли.
Физические свойства
Гипохлориты встречаются нам преимущественно в виде водных растворов, хотя некоторые из них можно выделить в твердом виде. Так, известен безводный гипохлорит натрия, который представляет собой неустойчивое бесцветное кристаллическое вещество. Из кристаллогидратов наиболее устойчивой формой является NaClO×5H2O. Это соединение представляет собой белые или бледно-зеленые ромбические кристаллы, расплывающиеся на воздухе. При нагревании пентагидрата гипохлорита натрия до температуры 24,4°С, он плавится. Кристаллогидрат NaClO×2,5H2O плавится при температуре 57,5°С. Моногидрат крайне неустойчив и разлагается выше 60°С, при более высоких температурах разложение протекает со взрывом.
Таблица 2. Плотности и температуры замерзания водных растворов гипохлорита натрия.
| Концентрация, % | 1 | 2 | 4 | 6 | 8 | 10 | 14 |
| Плотность, г/мл (18 °С) | 1,0053 | 1,0121 | 1025,8 | 1,0397 | 1,0538 | 1,0681 | 1,0977 |
| Концентрация, % | 18 | 22 | 26 | 30 | 34 | 38 | 40 |
| Плотность, г/мл (18 °С) | 1,1288 | 1,1614 | 1,1953 | 1,2307 | 1,2680 | 1,3085 | 1,3285 |
| Концентрация, % | 2 | 4 | 6 | 8 | 10 | 12 | 15,6 |
| tзам, °С | – 2,2 | – 4,4 | – 7,5 | – 10,0 | – 13,9 | – 19,4 | –29,7 |
В отличие от гипохлорита калия, известного только в растворах, гипохлорит кальция можно выделить в форме бесцветных кристаллов, устойчивых в сухой атмосфере без углекислого газа. Из водных растворов гипохлорит кальция можно выделить в виде кристаллогидратов Ca(ClO)2×2H2O, Ca(ClO)2×3H2O, Ca(ClO)2×4H2O.
Кислотно-основное равновесие между хлорноватистой кислотой и гипохлорит-ионом описывается обратимой реакцией с константой равновесия Ka = 2,63×10–8 при 20°С.
HClO = H+ + ClO–.
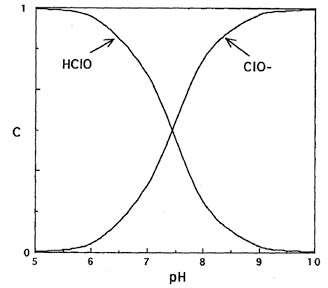
Используя константу равновесия Ka, можно рассчитать мольное долевое распределение хлорноватистой кислоты и гипохлорит-ионов в зависимости от рН (рис.1).
Данные свидетельствуют, что при подкислении растворов гипохлоритов увеличивается доля неустойчивой хлорноватистой кислоты. При рН < 7,58 в растворе присутствует преимущественно хлорноватистая кислота, а при рН > 7,58 существуют преимущественно гипохлорит-ионы.
Рис. 1. Мольное долевое распределение хлорноватистой кислоты и гипохлорит-ионов в зависимости от кислотности среды.
Химические свойства
Гипохлориты являются неустойчивыми соединениями, легко разлагающимися с выделением кислорода. Разложение твердых гипохлоритов натрия и кальция можно представить уравнениями
2NaClO = 2NaCl + O2↑ и 2Сa(ClO)2 = СaCl2 + O2↑.
Процессы при комнатной температуре происходят медленно, а при нагревании могут протекать со взрывом. Параллельно реакциям, сопровождающимся образованием хлоридов и свободного кислорода, могут протекать реакции диспропорционирования
3NaClO = NaClO3 + 2NaCl и 3Сa(ClO)2 = Ca(ClO3)2 + 2СaCl2.
Разложение гипохлоритов в водных растворах зависит от кислотности раствора и его температуры. В сильнокислых средах при рН ≤ 3 хлорноватистая кислота при комнатной температуре разлагается до хлора и кислорода
4HClO = 2Cl2↑ + O2↑ + 2H2O.
Если при подкислении используется соляная кислота или в растворе присутствуют хлориды, образование кислорода не происходит
HClO + HCl = Cl2↑ + H2O.
Хлорноватистая кислота очень слабая, поэтому она может быть вытеснена из раствора ее солей действием углекислого газа
ClO– + CO2 + H2O = HCO3– + HClO.
В слабокислых и нейтральных средах при 3 < рН < 7,5 протекает следующая окислительно-восстановительная реакция
2HClO = 2HCl + O2↑.
В нейтральных и щелочных растворах имеет место конкурирующая реакция образования хлоридов и хлоратов
3ClO– = ClO3– + 2Cl–.
При комнатной температуре реакция диспропорционирования протекает медленно, но при температурах выше 70°С эта реакция становится преобладающей.
В щелочных средах при рН > 7,5 в растворах преобладают гипохлорит-ионы, разлагающиеся следующим образом:
2ClO– = 2Cl– + O2↑.
Стабилизация гипохлоритов в водных растворах. Соли хлорноватистой кислоты значительно устойчивее самой кислоты. С ростом рН уменьшается мольная доля хлорноватистой кислоты в растворе и тем самым повышается стабильность гипохлоритов (рис. 1). В области рН > 11 содержание хлорноватистой кислоты крайне низкое, однако, и при этой кислотности наблюдается медленное разложение соединений хлора(I). Протекающие реакции можно записать в виде:
2ClO– = ClO2– + Cl–, (1)
ClO2– + ClO– = ClO3– + Cl–, (2)
2ClO– = O2 + 2Cl–. (3)
Около 95% от общего количества гипохлорит-ионов разлагается в результате последовательных реакций (1) и (2), причем реакция (1) является самой медленной (лимитирующей) и определяет общую скорость процесса. Реакция (3) не является основной, но отвечает за выделение кислорода, количество которого может быть значительным.
В присутствии некоторых ионов металлов, например, меди, никеля, кобальта наблюдается каталитическое разложение гипохлорит-ионов. Ионы железа обладают слабым каталитическим действием и являются сокатализаторами в сочетании с другими ионами металлов. В простейшем случае, при содержании ионов меди(II) в растворе в концентрации 1мг/кг порядки гомогенной реакции по гипохлориту и по меди(II) равны единице.
Гетерогенный катализ металлами и их нерастворимыми соединениями, является сложным и плохо воспроизводимым. Из нерастворимых катализаторов наибольшее мешающее влияние оказывает никель и его оксиды, которые попадают в растворы гипохлоритов при их контакте с легированными никелевыми сталями, используемыми для изготовления трубопроводов и резервуаров.
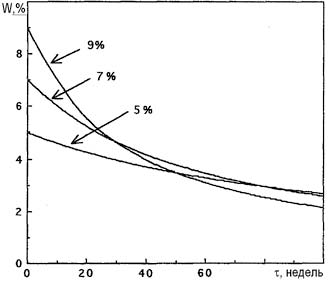
На константы скорости реакций (1)-(3) большое влияние оказывает ионная сила растворов. Высокие концентрации электролитов уменьшают константы скорости реакций и обеспечивают разумную стабильность при хранении растворов электролитов. Увеличение концентрации гипохлорит-ионов, напротив, уменьшает их стабильность в водных растворах. На рис. 2 показан феномен «кривой пересечения». Растворы гипохлорита натрия с концентрацией 9% и 5% при хранении разлагаются настолько, что через 50 недель показывают одинаковую концентрацию вещества, а через 100 недель первоначально более концентрированный раствор содержит гипохлорит-ионов меньше, чем разбавленный.
Рис. 2. Разложение гипохлорита натрия различных концентраций при 30°С.
Повышение температуры способствует ускорению процессов разложения гипохлоритов, поэтому целесообразно хранить растворы гипохлоритов в прохладном месте для обеспечения срока годности (рис. 3).
Рис. 3. Влияние температуры на разложение 5%-ного раствора NaClO.
Для стабилизации водных растворов гипохлоритов, а так же продуктов на их основе, каждый производитель применяет собственные методы, которые редко публикуются в виде статей. Однако известны некоторые запатентованные методы, которые, не претендуя на полноту, можно представить следующим списком:
- удаление хлорид-ионов, сопутствующих гипохлорит-ионам, методом кристаллизации;
- приготовление хлорноватистой кислоты, свободной от хлорид-ионов, методами электродиализа, дистилляции и жидкостной экстракции с последующей нейтрализацией щелочью;
- добавление многоатомных спиртов (например галактита, маннита, сорбита, инозита и пентаэритрита);
- добавление амидов;
- осаждение и фильтрация после добавления соединений щелочноземельных металлов;
- добавление перйодатов или перйодат-образующих соединений, способных образовывать комплексы с ионами металлов – катализаторов разложения гипохлоритов;
- добавление силикатов совместно с добавками или без добавок;
- добавление бромидов;
- добавление арилсульфаниламидов или их производных;
- увеличение светостойкости гипохлоритов путем добавления солей имидодисульфатов; солей церия и ЭДТА; феррицианидов; изоциануровой кислоты и цитрата натрия;
- добавление избытка хлорида железа с последующей фильтрацией;
- добавление гептоната натрия или боргептоната натрия;
- добавление 2-оксазолидинонов;
- добавление фосфата натрия;
- добавление бихромата калия;
- добавление солей кальция;
- добавление полидентатных гетероароматических соединений.
Направление окислительно-восстановительных процессов с участием гипохлорит-ионов и хлорноватистой кислоты обусловлены значениями стандартных электродных потенциалов полуреакций в водной среде:
в кислой среде
2HClO + 2H+ + 2e– = Cl2↑ + 2H2O, E° = 1,630 В,
HClO + H+ + 2e– = Cl– + H2O, E° = 1,500 В.
в нейтральной и щелочной среде
ClO– + H2O + 2e– = Cl– + 2OH–, E° = 0,890 В,
2ClO– + 2H2O + 2e– = Cl2↑ + OH–, E° = 0,421 В.
Таким образом, гипохлорит-ионы и хлорноватистая кислота обладают выраженными окислительными свойствами, причем их окисляющая способность в кислой среде значительно выше, чем в нейтральной и щелочной средах.
Дезинфицирующее действие
Гипохлориты являются одними из лучших антибактериальных средств. Они убивают микроорганизмы очень быстро даже при очень низких концентрациях.
Наивысшее бактерицидное действие гипохлоритов проявляется в нейтральной среде, когда концентрации хлорноватистой кислоты и гипохлорит-ионов приблизительно равны (рис. 1). Образующиеся при разложении гипохлоритов активные частицы (атомарный кислород и хлор) обладают высоким биоцидным действием. Они уничтожают микроорганизмы, взаимодействуя с биополимерами в их структуре, способными к окислению. Аналогичным образом, например, действуют клетки человека нейтрофилы, гепатоциты и др., которые синтезируют хлорноватистую кислоту и сопутствующие высокоактивные радикалы для борьбы с микроорганизмами и чужеродными субстанциями.
Бактерицидная активность гипохлоритов настолько велика, что они способны привести к гибели дрожжеподобных грибов, вызывающих кандидоз, Candida albicans, в течение 30 секунд при действии 5,0 – 0,5%-го гипохлоритного раствора. Патогенный Enterococcus faecalis погибает через 30 секунд после обработки 5,25%-ым раствором и через 30 минут после обработки 0,5%-ым раствором. Грамотрицательные анаэробные бактерии, такие как Porphyromonas gingivalis, Porphyromonas endodontalis и Prevotella intermedia, погибают в течение 15 секунд после обработки 5,0 – 0,5%-м раствором гипохлорит-ионов.
Несмотря на высокую биоцидную активность гипохлоритов, некоторые потенциально опасные простейшие организмы, например, возбудители лямблиоза или криптоспоридиоза, к сожалению, устойчивы к его действию.
При помощи гипохлорит-ионов можно успешно обезвреживать различные токсины (табл. 3).
Таблица 3. Результаты инактивации токсинов при 30-минутной экспозиции различных концентраций гипохлорита натрия («+» – токсин инактивирован; «–» – токсин остался активен).
| Токсин | 2,5% NaClO + 0,25 н. NaOH | 2,5% NaClO | 1,0% NaClO | 0,1% NaClO |
|---|---|---|---|---|
| Т-2 токсин | + | – | – | – |
| Бреветоксин | + | + | – | – |
| Микроцистин | + | + | + | – |
| Тетродотоксин | + | + | + | – |
| Сакситоксин | + | + | + | + |
| Палитоксин | + | + | + | + |
| Рицин | + | + | + | + |
| Ботулотоксин | + | + | + | + |
Методы анализа
Качественными реакциями на гипохлорит-ион могут служить:
- окисление йодид-иона до йода в сильнокислой среде;
- выпадение коричневого осадка метагидроксида таллия(III) (TlO(OH)) при действии щелочного раствора соли таллия (I);
- цветная реакция с 4,4´-тетраметилдиаминодефенилметаном или N,N´-диокситрифенил метаном в присутствии бромата калия.
Наиболее распространенным методом количественного анализа гипохлорит-иона является титриметрический метод с использованием йодида калия. Для проведения испытания водный раствор или водную суспензию, содержащие гипохлорит-ион, смешивают с избытком раствора йодида калия в сернокислой среде. Выдерживают герметично закрытую смесь в течение 5 минут в темном месте. Выделившийся йод титруют стандартизированным раствором тиосульфата натрия. В качестве индикатора вблизи точки эквивалентности используют крахмальный раствор.
При количественном определении гипохлорит-иона косвенным йодометрическим методом результаты анализа пересчитывают на концентрацию «активного хлора» в ыделившегося при реакции
2H+ + ClO– + Cl– = Cl2↑ + H2O.
Альтернативным методом количественного определения гипохлорит-иона является потенциометрический анализ с использованием бром-ионселективного электрода. Концентрацию гипохлорит-иона находят методом добавок анализируемого раствора к стандартному раствору или методом уменьшения концентрации анализируемого раствора при его добавлении к стандартному раствору.
Способы получения наиболее важных товарных продуктов
Крупнотоннажными гипохлоритсодержащими продуктами являются гипохлорит натрия и гипохлорит кальция. Их глобальный объем производства превышает 1 млн тонн/год. При этом почти половина этого объема используется в быту, а другая половина в промышленности. Гипохлорит калия, являющийся исторически первым гипохлоритом, нашедшим промышленное применение, производится в ограниченном количестве.
Для промышленного производства гипохлорита натрия используются химический и электрохимический методы. При химическом методе производится хлорирование водных растворов гидроксида натрия. Суть химического превращения не изменилась со времен его открытия и применения Лабарраком
Cl2 + 2NaOH = NaClO + NaCl + H2O.
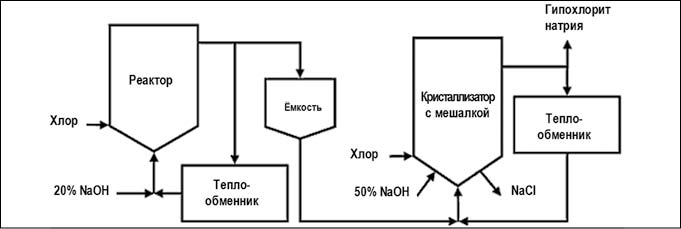
Существуют две производственные схемы данного метода:
- основной процесс, в результате которого производится 16%-ный раствор гипохлорита натрия в смеси с хлоридом натрия и гидроксидом натрия (рис. 4).
- низко-солевой или концентрированный процесс позволяет получить концентрированные растворы (25–40%) гипохлорита натрия с меньшим содержанием примесей. Его отличие от основного способа заключается в добавлении второй стадии хлорирования. Во второй реактор подается не гидроксид натрия, а раствор гипохлорита натрия из первого реактора, в результате происходит концентрирование готового продукта (рис. 5).
Рис. 4. Химический метод получения гипохлорита натрия основным процессом (рис. с сайта https://ru.wikipedia.org)
Рис. 5. Химический метод получения гипохлорита натрия концентрированным процессом (рис. с сайта https://ru.wikipedia.org)
При электрохимическом методе получения гипохлорита натрия водный раствор хлорида натрия подвергается электролизу в электролизере с открытыми электродными зонами (бездиафрагменный способ). Гидроксид натрия, образующийся на катоде, и хлор, выделяющийся на аноде, беспрепятственно смешиваются в ходе электрохимического процесса
NaCl + H2O = NaClO + H2↑(суммарная реакция).
Гипохлорит кальция производится в виде хлорной извести, представляющей собой смесь целевого продукта с хлоридом кальция и гидроксидом кальция. В качества сырья для получения хлорной извести используется порошкообразный гидроксид кальция (пушенка), содержащий менее 1% свободной влаги и разбавленный влажным воздухом хлор. Небольшая влажность исходных веществ обеспечивает начало реакции гидролиза хлора, сопровождающейся нейтрализацией образующихся кислот известью. Затем реакция продолжается за счет воды, выделяющейся из гидроксида кальция при хлорировании
2Сa(OH)2 + 2Cl2 = Сa(ClO)2 + СaCl2 + 2H2O (суммарно).
Хлорирование пушенки осуществляется в аппаратах непрерывного действия – механических полочных камерах Бакмана.
Таблица 4. Производители гипохлорита натрия в России.
| Название предприятия | Сайт предприятия |
|---|---|
| «Каустик» ЗАО, г. Стерлитамак | www.kaus.ru/ |
| «Каустик» ОАО, г. Волгоград | www.kaustik.ru/ |
| «Новомосковский хлор» ООО, г. Новомосковск | www.hlor.biz/ |
| «Сода-хлорат» ООО, г. Березняки | www.soda.perm.ru/ |
Характеристика товарных гипохлоритов, обращение, хранение и транспортировка
В Российской Федерации гипохлориты производятся в соответствии с ГОСТ 11086–76 «Гипохлорит натрия. Технические условия» и ГОСТ 1692–85 «Известь хлорная. Технические условия». Гипохлорит натрия по назначению и показателям выпускается двух марок «А» и «Б» (табл. 5).
Таблица 5. Физико-химические показатели и назначение гипохлорита натрия по ГОСТ 11086–76
| Наименование показателя |
Марка А |
Марка Б |
|---|---|---|
| Внешний вид |
Жидкость зеленовато-желтого цвета |
|
| Коэффициент светопропускания, % не менее |
20 |
20 |
| Массовая концентрация активного хлора, г/дм3, не менее |
190 |
170 |
| Массовая концентрация щелочи в пересчете на NaOH, г/дм3 |
10–20 |
40–60 |
| Массовая концентрация железа, г/дм3, не более |
0,02 |
0,06 |
| Область применения |
В химической промышленности для обеззараживания питьевой воды и воды плавательных бассейнов, для дезинфекции и отбелки |
В витаминной промышленности как окислитель и для отбеливания ткани |
Гипохлорит натрия должен храниться в специальных полиэтиленовых, стальных гуммированных или других, покрытых коррозионно-стойкими материалами ёмкостях, наполненных на 90% объёма и оборудованных воздушником для сброса образующегося при распаде кислорода. Емкости с гипохлоритом натрия хранят в защищённых от света закрытых складских неотапливаемых помещениях. Перевозка продукции осуществляется в соответствии с правилами транспортировки опасных грузов.
Хлорная известь в зависимости от способа получения выпускается двух марок «А» и «Б» и трех сортов для каждой марки (табл. 6).
Таблица 6. Физико-химические показатели и способ получения хлорной извести по ГОСТ 1692–85
|
Наименование показателя |
Марка А | Марка Б | ||||
| 1-й сорт | 2-й сорт | 3-й сорт | 1-й сорт | 2-й сорт | 3-й сорт | |
|
Внешний вид |
Порошок белого цвета или слабоокрашенный, с наличием комков |
|||||
|
Массовая концентрация активного хлора, %, не менее |
28 | 25 | 20 | 35 | 32 | 27 |
|
Коэффициент термостабильности, не менее |
0,90 | 0,90 | 0,80 | 0,75 | 0,70 | 0,60 |
|
Способ получения |
Хлорирование пушенки в кипящем слое | Хлорирование пушенки в аппаратах Бакмана |
Хлорную известь упаковывают в полиэтиленовые мешки и стальные барабаны, окрашенные со всех сторон химически стойкой краской. Хлорную известь хранят в закрытых складских неотапливаемых, затемненных и хорошо проветриваемых помещениях. Не допускается хранение с хлорной известью взрывчатых веществ, огнеопасных грузов и баллонов со сжатыми газами. Гарантийный срок хранения хлорной извести марки А 1-го и 2-го сортов – 3 года со дня изготовления, марки А 3-го сорта и марки Б – 1 год со дня изготовления. Перевозка продукции осуществляется в соответствии с правилами транспортировки опасных грузов.
Требования безопасности
Гипохлориты являются окислителями, вызывающими раздражение кожных покровов и слизистых оболочек. Гипохлориты при попадании на кожу могут вызвать ожоги, а при попадании в глаза – слепоту. При попадании гипохлоритов на кожные покровы необходимо обмывать их обильной струей воды в течение 10–15 мин. При попадании гипохлоритов в глаза следует немедленно промыть их обильным количеством воды и направить пострадавшего к врачу. Приём внутрь разбавленных растворов (3 – 6%) гипохлоритов приводит обычно только к раздражению пищевода и иногда ацидозу, в то время как концентрированные растворы способны вызвать довольно серьёзные повреждения, вплоть до перфорации желудочно-кишечного тракта. При работе с гипохлоритами следует иметь специальные средства защиты: защитные очки, резиновые сапоги, резиновые перчатки, фартук из прорезиненной ткани и противогаз, а также использовать специальную одежду.
Несмотря на свою высокую химическую активность, безопасность гипохлоритов для человека документально подтверждена исследованиями токсикологических центров Северной Америки и Европы. Результаты показывают, что гипохлориты не являются мутагенными, канцерогенными и тератогенными соединениями, а также кожными аллергенами. Международное агентство по изучению рака пришло к выводу, что питьевая вода, прошедшая обработку гипохлоритом натрия, не содержит человеческих канцеро- генов.
При нагревании выше 35°С растворы гипохлоритов разлагаются с образованием хлоратов и выделением кислорода. Слабощелочной раствор достаточно устойчив. Растворы гипохлоритов негорючи и невзрывоопасны. Однако в процессе высыхания гипохлориты могут вызвать загорание органических продуктов и горючих веществ. При взаимодействии гипохлоритов с кислотами выделяется токсичный хлор (раздражающий и удушающий эффект), поэтому не допускается смешение и совместное хранение данных веществ.
При работе с гипохлоритами производственные помещения должны быть оборудованы приточно-вытяжной вентиляцией. Оборудование должно быть герметичным. Негерметичные узлы должны быть снабжены местными вентиляционными отсосами.
Применение в средствах бытовой химии
Применение гипохлоритов в средствах бытовой химии обусловлено их окислительными и дезинфицирующими свойствами. Гипохлориты являются основными действующими веществами в химических отбеливателях, пятновыводителях, средствах для обеззараживания воды в бассейнах, в чистящих и моющих средствах с дезинфицирующим эффектом.
Отбеливатели
Мировое производство гипохлорита натрия оценивается в 5 миллионов тонн. Более половины всего производимого гипохлорита натрия используется в качестве отбеливателя и пятновыводителя для тканей. Гипохлорит натрия может быть использован для многих видов тканей, включая хлопок, полиэстер, нейлон, ацетат, лен, вискозу и другие. Он эффективен для удаления следов почвы и широкого спектра пятен, в том числе, от кофе, крови, травы, горчицы, ягодных и фруктовых соков и т.д.
Содержание гипохлорита натрия в отбеливателях и пятновыводителях для тканей обычно находится в диапазоне от 2,5 до 10%. В большинстве случаев эти средства выпускаются в жидкой форме в пластиковых бутылках или канистрах. Дополнительными компонентами отбеливателей являются поверхностно-активные вещества, модификаторы реологии, оптические отбеливатели, стабилизаторы разложения и др.
Преимуществами отбеливателей на основе гипохлоритов являются:
- быстрое и качественное отбеливание;
- использование отбеливателя без нагревания и даже в холодной воде;
- доступная цена;
- более удобная форма выпуска: не «пылят», в отличие от порошков и легко дозируются;
- многофункциональность, так как помимо отбеливания и удаления пятен подходят для дезинфекции различных поверхностей.
Недостатками отбеливателей на основе гипохлоритов являются:
- активное использование хлорсодержащих отбеливателей приводит к тому, что ткани быстрее изнашиваются и, как следствие, легко рвутся;
- невозможность отбеливания шёлковых, шерстяных и некоторых синтетических волокон из-за интенсивного разрушения;
- относительно короткий срок хранения;
- невозможность использования в автоматической стиральной машине, особенно в сочетании с современными порошками;
- сильный специфичный запах хлора.
Моющие и чистящие средства с дезинфицирующими свойствами
Гипохлориты используются во многих жидких и порошкообразных средствах:
- для автоматических посудомоечных машин;
- для ухода за ванными комнатами, душевыми и туалетами;
- для очистки кухонных плит;
- для мытья каменных и бетонных полов;
- для очистки коптилен и грилей;
- очистки канализационных сливов;
- для уборки поверхностей в кухнях и столовых и др.
Эффективность очистки средствами, содержащими гипохлорит-ионы, обусловлена их сильным окисляющим действием. При деструкции крупных молекул загрязнителей образуются низкомолекулярные продукты разложения, характеризующиеся высокой растворимостью, отсутствием окраски и запаха. Одновременно с очищающим действием, гипохлориты проявляют высокую дезинфицирующую способность. В целом эффективность гипохлоритов возрастает с увеличением концентрации и температуры раствора, а так же при понижении кислотности раствора.
Гипохлоритсодержащие средства с дезинфицирующими свойствами обладают следующими достоинствами:
- эффективны в отношении различных бактерий, грибов и вирусов;
- дезинфицирующая активность мало зависит от жесткости воды;
- при использовании не образуют побочных токсичных продуктов;
- выпускаются в жидкой, порошкообразной и гранулированной формах.
К недостаткам можно отнести:
- нестабильность и потерю активности с увеличением температуры и при взаимодействии с органическими веществами;
- снижение биологической активности с увеличением кислотности среды;
- коррозия нержавеющей стали и других металлов, что допускает лишь кратковременный контакт с поверхностями и оборудованием из металлов;
- потеря активности при хранении на свету;
- ограниченный перечень поверхностно-активных веществ, комплексообразователей, красителей, отдушек, способных быть устойчивыми в композиции моющего или чистящего средства, содержащего гипохлориты.
В заключение следует отметить, что рост производства и потребления гипохлоритов составляет более 2,5% ежегодно. Причем более половины всех произведенных гипохлоритов используется для бытовых целей, а менее половины для промышленных. Широкое использование гипохлоритов в средствах бытовой химии стало возможным благодаря их коммерческой доступности и высокой эффективности. Гипохлорит натрия является безусловным лидером среди других солей хлорноватистой кислоты, занимая 91% мирового рынка. Почти 9% остается за гипохлоритом кальция. Использование гипохлорита калия имеет историческое значение, однако, объемы его современного применения незна- чительные.
Источники
- Handbook of detergents. Part A: Properties/ Edited by Guy Broze. New York: Marsell Dekker, 1999. 809 p.
- Фурман Л. А. Хлорсодержащие окислительно-отбеливающие и дезинфицирующие вещества. М.: Химия, 1976. 88 с.
- Ушакова В.Н. Мойка и дезинфекция. Пищевая промышленность, торговля, общественное питание. – СПб.: Профессия, 2009. 288 с.
- ГОСТ 1692–85. Известь хлорная. Технические условия.
- ГОСТ 11086–76. Гипохлорит натрия. Технические условия.
- Лидин Р.А. и др. Константы неорганических веществ: справочник / Под ред. проф. Р.А. Лидина. М.: Дрофа, 2000. 480 с.
- Химическая энциклопедия/ Гл. ред. И.Л. Кнунянц. М.: Советская энциклопедия, 1992. Т. 3. 555 с.
- Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей/ Под ред. проф. Н.В. Лазарева и проф. И.Д. Гадаскиной. Л.: Химия, 1977. Т. 3. 608 с.
- https://ru.wikipedia.org/wiki/Гипохлорит_натрия
Гипохлорит натрия — это химический материал, используемый в разных сферах в качестве дезинфектанта. Применяться это соединение может для обеззараживания всевозможных поверхностей, материалов, жидкостей и пр. Разновидностей такого вещества существует несколько. Очень часто в качестве дезинфектанта применяется, к примеру, гипохлорит натрия марки А.
Что собой представляет
На рынок это средство поставляется в виде жидкости зеленовато-желтого цвета. Получают его путем электролиза поваренной соли. Иногда гипохлорита натрия делают и посредством хлорирования водного раствора едкого натра. Химическая формула этого соединения выглядит следующим образом — NaClO. Основной отличительной чертой гипохлорита натрия марки А является высокая антибактериальная активность.
По-другому это соединение называют «жавелевой» или «лабарраковой» водой. В свободном состоянии гипохлорит натрия является веществом довольно-таки неустойчивым.
Сфера применения
Изготавливаться гипохлорит натрия может по ГОСТ или по ТУ. Первая разновидность средств при этом используется в основном для обеззараживания воды. Это может быть:
-
питьевая и техническая вода в централизованных коммунальных сетях;
-
промышленные и бытовые стоки;
-
вода в плавательных бассейнах.
Гипохлорит натрия, выпускаемый по ТУ и имеющий качество ниже, также применяется, конечно же, с целью дезинфекции. Это средство, к примеру, часто используют для:
-
обеззараживания природных и сточных вод;
-
очистки воды в рыбохозяйственных водоемах;
-
дезинфекции в пищевой промышленности.
Также такой гипохлорит натрия может использоваться и для изготовления разного рода отбеливающих средств. К плюсам этого соединения при применении в качестве обеззараживателя относят и экологическую безопасность. В окружающей среде гипохлорит натрия быстро разлагается на воду, поваренную соль и кислород.
Принцип действия
Одной из отличительных черт гипохлорита натрия марки А является то, что он способен оказывать губительное влияние на болезнетворные микроорганизмы самых разных типов. То есть отнесен он может быть к группе универсальных дезинфектантов.
При растворении в воде это соединение, наподобие обычной хлорки, образует кислоту, которая и оказывает обеззараживающее действие. Формула образования дезинфицирующего средства при этом выглядит следующим образом:
-
NaClO + H20 / NaOH + HClO.
Такая реакция является равновесной. Зависит же процесс образования хлорноватистой кислоты прежде всего от pH воды и от ее температуры.
Уничтожать в воде гипохлорит натрия может, к примеру, следующие виды бактерий:
-
патогенные энтерококки;
-
грибок Candida albicans;
-
некоторые разновидности анаэробных бактерий.
Убивает вредные микроорганизмы это средство не только эффективно, но еще и очень быстро — в течение 15-30 секунд.
Гипохлорит натрия марки А: характеристики
Как уже упоминалось, представляет собой это соединение зеленоватую жидкость. Техническими же характеристиками этот дезинфектант отличается следующими:
-
массовая концентрация хлора — минимум 190 г/дм3;
-
коэффициент светопропускания — минимум 20%;
-
концентрация щелочи — 10-20 г/дм3 в пересчете на NaOH;
-
концентрация железа — не более 0.02 г/дм3.
Активного хлора в состав этого соединения может доходить до 95%.
Транспортировка и хранение
Разливаться гипохлорит натрия может в тару разных типов. Чаще всего его перевозят в гуммированных стальных железнодорожных цистернах. Расфасовываться же этот материал может в контейнеры из стеклопластика и полиэтилена. Также в качестве тары могут использоваться бочки и стеклянные бутылки. Автомобильным транспортом гипохлорит натрия перевозят в контейнерах с соблюдением соответствующих норм безопасности.
Хранить это соединение полагается в неотапливаемых помещениях. При этом нельзя допускать попадания на складированный гипохлорит натрия солнечных лучей. В больших объемах этот материал хранят обычно в гуммированных стальных или же в покрытых стойкими к коррозии материалами емкостях.
К сожалению, гарантийного срока годности для гипохлорита натрия марки А не предусмотрено. Предприятия, отвечающие за обеззараживание воды, должны самостоятельно проверять пригодность этого средства перед использованием. Качество этого соединения должно быть не ниже рекомендуемого нормативной документацией для дезинфекции данных конкретных объектов.
Маркировка упаковки
Срока хранения для гипохлорита натрия марки А, таким образом, не предусматривается. Перед использованием на качество это соединение проверяют сами компании-потребители. Но конечно же, определенную информацию организации, занимающиеся обеззараживанием воды, о том, какое именно средство они покупают, иметь должны.
Разумеется, на тару с гипохлоритом натрия, как и с любым другим химическим соединением, наносится маркировка, которая должна, помимо всего прочего, содержать:
-
наименование компании-производителя и ее контакты;
-
название собственно самого продукта и его марку;
-
номер партии и дату изготовления.
Основные правила использования
Для того чтобы обеззараживание воды было эффективным, использовать для этой процедуры, конечно же, нужно только качественный гипохлорит натрия марки А. Согласно действующим нормативам ГОСТ (измененный, ред №1) и ТУ, потери хлора по прошествии 10 суток со дня отгрузки в этом соединении не должны превышать 30%.
Также нормативы не запрещают использовать изготовленный по ТУ или ГОСТ (с изменениями) гипохлорит натрия марки А, изменивший свой цвет на красно-коричневый. Такое соединение также обеззараживает воду очень эффективно.
Техника безопасности
Представляет собой гипохлорит натрия хотя и негорючее, но очень едкое вещество. Поэтому при работе с ним специалисты в обязательном порядке должны защищать руки и глаза. Класс опасности гипохлорита натрия марки А — II (по хлору). При попадании на кожу этот дезинфектант способен вызывать серьезные ожоги. Если же это соединение попадет в глаза, человек и вовсе может ослепнуть. Вдыхание паров этого средства может вызывать удушье и раздражающий эффект.
Использовать гипохлорит натрия для обеззараживания персонал должен в спецодежде с применением спецсредств:
-
в противогазе БКФ или Б;
-
резиновых перчатках;
-
защитных очках;
- специальных костюмах.
Тот участок кожи, на который по неосторожности попало это соединение, следует промывать обильным количеством проточной воды в течение не менее 10 мин. При попадании брызг в глаза пострадавшего нужно доставить к врачу. Перед этим, конечно же, также следует сделать тщательное промывание.
Изготовленный по ГОСТ 11086-76 гипохлорит натрия марки А при высыхании может вызывать самовозгорание разного рода органических веществ. Поэтому хранить это соединение в одном помещении, к примеру, с опилками или ветошью нельзя.
Другие марки
Помимо гипохлорита натрия марки А, в качестве дезинфектанта может использоваться NaClO:
-
марки Б;
-
В;
-
Г;
-
Э.
Такие растворы являются менее концентрированными (за исключением гипохлорита натрия марки Б, изготавливаемого по ТУ). NaClO марки Э, помимо этого, представляет собой не зеленую жидкость, а бесцветную. На упаковки с гипохлоритом Б, помимо всего прочего, должна наноситься надпись «Непригоден к обеззараживанию воды питьевой и в плавательных бассейнах».
Соединения этой марки допускается использовать в основном только для отбеливания тканей. Также такой гипохлорит натрия может применяться в качестве окислителя в витаминной промышленности.
1. Общие сведения
1.1. Изготавливается по СТО 14175996-03-2011 и представляет собой жидкость зеленовато-желтого цвета с запахом хлора; массовая концентрация активного хлора — не менее 140 г/дм3 , массовая концентрация щелочи в пересчете на NaOH — не более 6,0 г/дм3. Срок годности средства в невскрытой упаковке производителя составляет 6 месяцев.
1.2. Средство изготавливается из белизны и представляет собой очищенный водный раствор гипохлорита натрия марки А по ГОСТ 11086 и NaOH.
1.3. Бактерицидными агентами гипохлорита натрия являются хлорноватистая кислота НОС1 и анион ОСГ, которые образуются при растворении реагента в воде.
1.4. Гипохлорит натрия по степени воздействия на организм человека по ГОСТ 12.1.007- 76 (1999) при поступлении в желудок относится к 4 классу — малоопасное вещество. При растворении в воде сильный окислитель, обладает раздражающим действием на кожу, слизистые оболочки и дыхательные пути. Поражает центральную нервную систему, почки, печень, селезенку. При попадании на кожу может вызвать химические ожоги, а при попадании в глаза — слепоту.
1.5. При высоких концентрациях гипохлорита натрия в окружающей среде гипохлорит натрия может вызвать поражение живых организмов, разрушать растительные ткани. При попадании в водные объекты вызывает изменение органолептических свойств воды, процессов самоочищения воды в водных объектах, оказывает токсическое действие на водную фауну.
1.6. В водном растворе на свету и при нагревании выше 35 С гипохлорит натрия разлагается с образованием хлоратов и выделением кислорода. Поэтому для гипохлорита натрия установлены следующие гигиенические нормативы: ПДКр.з. — 5 мг/м3 (по хлорату натрия), 3 класс опасности; ПДКр.з. — 1 мг/м3 (по хлору), 2 класс опасности; ПДКа.в. — 0,1 мг/м3 (по хлору, макс, раз.), 2 класс опасности; ПДКа.в. — 0,03 мг/м3 (по хлору, ср.-сут.), 2 класс опасности; ОБУВа.в. — 0,1 мг/м3 (по гипохлориту натрия); ПДКв.в. — отсутствие, общ. (по хлору активному), 3 класс опасности; ПДКв.в. — 20 мг/л (по хлорату натрия), 3 класс опасности; ПДКрыб.хоз. — отсутствие, токе, (по хлору), 1 класс опасности.
1.7. При использовании средства для обеззараживания воды необходимо осуществлять контроль содержания брома (не более 0,2 мг/л) в обработанной воде.
2. Назначение
2.1. Дезинфицирующее средство применяется для обеззараживания воды в системе хозяйственно-питьевого водоснабжения, воды в плавательных бассейнах и аквапарках в соответствии с требованиями санитарно-эпидемиологической безопасности и поддержания воды в бассейнах в пределах санитарных норм; для мытья и дезинфекции санитарно-технического оборудования, кафеля, пластика, унитазов, мусорных ведер.
3. Способ применения
3.1. Дезинфицирующее средство применяется в виде водного раствора, концентрация которого зависит от обеззараживающего объекта. При обеззераживании воды дозу средства определяют эмпирически в зависимости от хлорпоглощаемости и качества воды.
3.2. Для точного приготовления рабочих растворов дезинфицирующего средства в требуемой концентрации по активному хлору можно руководствоваться следующим расчетом:

А — концентрация активного хлора в рабочем растворе, г/дм3
В — концентрация активного хлора в реагенте, г/дм3
Например, из средства с концентрацией активного хлора 140 г/дм3 необходимо приготовить 1000 см3 раствора с концентрацией 10 мг/дм3 по активному хлору. Подставляем в формулу указанные значения:

3.2.1. Для обеззараживания воды в практике хозяйственно-питьевого водоснабжения рабочая доза дезинфицирующего средства и время контакта его с водой должны обеспечивать соответствие качества воды СанПиН 2.1.4.1074-01:
- Время контакта с водой — не менее 30 минут;
- По содержанию остаточного хлора — 0,3-0,5 мг/л (свободный хлор);
- Связанного остаточного хлора — 0,8-1,2 мг/л;
- Хлороформ — не более 0,2 мг/л;
- По микробиологическим показателям — ОКБ, ТКБ, колифаги — не должны содержаться в 100 мл; цисты лямблий — не должны содержаться в 50 л; споры сульфитредуцирующих 3 клостридий — не должны содержаться в 20 мл; общее микробное число — не более 50 в 1 мл.
Реагент вводится в трубопроводы перед резервуарами чистой воды. Для обеспечения обеззараживания питьевой воды продолжительность контакта средства с водой перед поступлением потребителю должно быть не менее 30 минут. Расход средства устанавливается в зависимости от качества обрабатываемой воды (среди которых наибольшее значение имеют температура, водородный показатель рН и мутность воды) на основании данных технологических изысканий. При их отсутствии — для предварительных расчетов ориентировочно следует принимать, что расход средства составляет:
- для поверхностных вод 3-4 мл средства на 1 м3 воды;
- для подземных вод 5-8 мл средства на 1 м3 воды.
Контакт реагента с водой осуществлять в резервуарах чистой воды или специальных контактных резервуарах. При отсутствии попутного водоразбора допускается учитывать продолжительность контакта в водоводах.
3.2.2. Для обеззараживания воды плавательных бассейнов рабочая доза дезинфицирующего средства и время контакта его с водой должны обеспечивать соответствие качества воды СанПиН 2.1.2.1188-03:
- Время контакта с водой — не менее 30 минут;
- По содержанию остаточного хлора — 0,3-0,5 мг/л (свободный хлор);
- Хлороформ — не более 0,1 мг/л;
- По микробиологическим показателям — ОКБ — не более 1 в 100 мл, ТКБ, колифаги, золотистый стафилококк, синегнойная палочка — не должны содержаться в 100 мл; цисты лямблий, яйца и личинки гельминтов — не должны содержаться в 50 л; возбудители ки- шечных инфекций — отсутствие.
3.2.3. Для дезинфекции воды аквапарков рабочая доза дезинфицирующего средства и время контакта его с водой должны обеспечивать соответствие качества воды СанПиН 2.1.2.1331-03:
- Время контакта с водой — не менее 30 минут;
- По содержанию остаточного свободного хлора — 0,3-0,6 мг/л (кроме гидроаэромас- сажных бассейнов);
- По содержанию остаточного свободного хлора — 0,3-1,0 мг/л (в гидроаэромассажных бассейнах);
- По содержанию остаточного связанного хлора — не более 1,2 мг/л;
- Хлороформ — не более 0,2 мг/л;
- По микробиологическим показателям — ОКБ, ТКБ, колифаги, золотистый стафилококк, синегнойная палочка, легионелла — не должны содержаться в 100 мл; цисты лямблий, яй- ца и личинки гельминтов — не должны содержаться в 50 л; возбудители кишечных инфек- ций — не должны содержаться в 1000 мл; общее микробное число — не более 100 в 1 мл.
Применяется в виде водного раствора.
Препарат дозируется в воду бассейна с помощью дозирующего автоматического устройства. Расход препарата определяется в соответствии с показателем уровня свободного хлора в воде бассейна, при этом необходимо постоянно производить контроль и корректировку содержания активного хлора в воде бассейна. Содержание свободного хлора после введения средства и распределения его по объему бассейна должно составлять 0,1-0,5 мг/л.
При отсутствии дозирующего автоматического устройства рекомендуется растворить препарат в отдельной емкости в воде, взяв соотношение дезинфицирующего средства к воде равное 1:5 или 1:10 по объему, и полученный раствор добавить в бассейн вблизи места подачи воды.
Дозировка средства для дезинфекции воды в бассейнах и аквапарках — см. Этикетку.
Предварительно растворить указанное количество средства в отдельной ёмкости, понизив исходную концентрацию в 5-10 раз, и полученный раствор добавить в бассейн, вблизи места подачи воды.
Примечание: оптимальное время контакта дезинфицирующего средства с водой устанавливается опытным путем, однако оно должно составлять в летнее время не менее 30 минут, и в зимнее время — не менее одного часа.
3.3. После спуска в водный объект питьевого, хозяйственно-бытового и рекреационного водопользования бытовых и промышленных сточных вод, обработанных дезинфицирующим средством, вода должна соответствовать требованиям СанПиН 2.1.5.980-00 и ГН 2.1.5.1315-03:
- По содержанию активного хлора — отсутствие;
- По содержанию галогенсодержащих соединений — не выше ПДК;
- По микробиологическим показателям — жизнеспособные яйца гельминтов (власоглав, аскарид, токсокар, фасциол), онкосферы тениид и жизнеспособные цисты патогенных кишечных простейших — не должны содержаться в 25 л, ОКБ — не более 1000 КОЕ/мл (для питьевого и хозяйственно-бытового водоснабжения) или 500 КОЕ/мл (для рекреационно- го водопользования), ТКБ — не более 100 КОЕ/100 мл, колифаги — не более 10 БОЕ/ЮО мл.
3.4. Для мытья и дезинфекции санитарно-технического оборудования, кафеля, пластика, унитазов, мусорных ведер и т.д.: растворить 80 мл средства в 1 литре воды, тщательно обработать поверхность, оставить на 10-15 минут, смыть водой.
Купить Дезинцифирующее средство
4. Меры предосторожности и безопасности
4.1. Дезинфицирующее средство негорючее и невзрывоопасное.
4.2. Следует избегать попадания дезинфицирующего средства на окрашенные предметы всех марок, так как он может вызвать их обесцвечивание. 4.3. Помещения для производства и применения дезинфицирующего средства должны быть оборудованы принудительной приточно- вытяжной вентиляцией. Оборудова- ние должно быть герметичным.
4.4. Индивидуальная защита персонала должна осуществляться с применением специальной одежды в соответствии с ГОСТ 12.4.011-89 и индивидуальных средств защиты: противогазов марок В или ВКФ по ГОСТ 12.4.121-83, перчаток резиновых, сапог резиновых, очков защитных по ГОСТ 12.4.013-85.
4.5. Разлитое дезинфицирующее средство необходимо смыть большим количеством воды. В случае возгорания — тушить водой, песком, углекислотными огнетушителями.
5. Меры первой помощи
5.1. При ингаляционном отравлении (при вдыхании) дезинфицирующим средством необходимо вывести пострадавшего из загазованной среды, обеспечить покой и согревание. Вдыхание распыленного 2% раствора тиосульфата натрия, щелочных растворов (питьевой соды, буры). Произвести ингаляцию кислородом. При остановке дыхания сделать искусственное дыхание методом «рот в рот».
5.2. При попадании в глаза немедленно промыть глаза обильной струей воды в течение 15 — 20 минут, затем ввести в конъюнктивный мешок 1 — 2 капли 2% раствора новокаина, а также 30% раствора альбуцида. Немедленно направить пострадавшего к врачу.
5.3. При попадании на кожу поврежденный участок промывать проточной водой не менее 15 минут, сделать примочки 5% раствором уксусной кислоты.
5.4. При отравлении пероральным путем (при проглатывании) промыть желудок водой с молоком или яичным белком, затем вызвать рвоту. Противоядием является 1% раствор тиосульфата натрия.
5.5. Для оказания немедленной помощи на рабочем месте должны быть установлены восходящие фонтанчики, раковины самопомощи, аварийные души.
6. Физико-химические и аналитические методы контроля качества
6.1. Качество дезинфицирующего средства контролируют по следующим показа- телям:
- внешний вид — жидкость зеленовато-желтого цвета;
- коэффициент светопропускания, %, не менее — 95;
- массовая концентрация активного хлора, г/дм3 , не менее — 140;
- массовая концентрация щелочи в пересчете на NaOH, г/дм3 , не более-6,0;
- массовая концентрация железа, г/дм3 , не более — 0,003.
6.2.Определение содержания доли активного хлора в дезинфицирующем средстве .
6.2.1 Аппаратура, реактивы, растворы.
- Бюретка по ГОСТ 29252-91 вместимостью 50 см3.
- Колба коническая типа Кн по ГОСТ 25336-82 вместимостью 250 см3
- Колба мерная по ГОСТ 1770-74 вместимостью 250 см3 .
- Пипетка по ГОСТ 29169-91 вместимостью 10 см3 .
- Цилиндр мерный по ГОСТ 1770-74 вместимостью 25 см3 .
- Термометр с пределом измерения температуры от 0 до 100 °С. Вода дистиллированная по ГОСТ 6709-72.
- Калий йодистый, раствор с массовой долей 10%, готовят по ГОСТ 4517-87.
- Кислота серная, раствор с концентрацией 1 моль/дм3 , готовят по ГОСТ 25794.1-83.
- Крахмал растворимый, раствор с массовой долей 1%, готовят по ГОСТ 4517-87.
- Натрий серноватистокислый (тиосульфат натрия), раствор с концентрацией 0,1 моль/дм3 , готовят по ГОСТ 25794.2-83.
6.2.2 Проведение анализа
5 мл исходного раствора дезинфицирующего средства переносили в мерную колбу на 250 мл и доводили до метки дистиллированной водой и тщательно перемешивали. 6 10 мл полученного раствора вносили в коническую колбу на 250 мл, добавляли туда 100 мл дистиллированной воды, 10 мл 10%-го раствора иодистого калия и 10 мл 1 Н раствора серной кислоты, перемешивали и помещали в темное место на 5 минут для прохождения реакции.
По прошествии 5 минут выделившийся йод оттитровывали 0,1 Н раствором серноватисто- кислого натрия, используя в качестве индикатора 1% раствор крахмала.
Массовую концентрацию активного хлора (г/дм3 ) вычислить по формуле:

За результат анализа принять среднее арифметическое значение 3-х параллельных опре- делений, абсолютное расхождение между которыми не превышает 2 г/дм3 при доверитель- ной вероятности Р=0,95.
7. Транспортировка и хранение
7.1. Дезинфицирующее средство транспортируют всеми видами транспорта в соответствии с правилами перевозок грузов, действующими на данном виде транспорта.
7.2. Дезинфицирующее средство хранят в герметичной таре, изготовленной из коррозионностойких материалов в местах, защищенных от солнечного света и тепла.
7.3. Дезинфицирующее средство замерзает, после размораживания сохраняет свои свойства.
7.3. Дезинфицирующее средство не допускается хранить с органическими продуктами, горючими материалами и кислотами.
7.4. Пригодность дезинфицирующего средства при хранении определяется по остаточной концентрации активного хлора, которая должна быть не ниже рекомендуемой в нормативной документации для дезинфекции воды. Некондиционное дезинфицирующее средство уничтожается методом нейтрализации.
7.5 Дезинфицирующее средство транспортируется всеми видами транспорта в крытых транспортных средствах в соответствии с правилами перевозки грузов, действую- щими на данном виде транспорта.
7.6. Отгрузка дезинфицирующего средства должна производиться не позднее одного месяца с даты изготовления.
8. Меры защиты окружающей среды
8.1. Не допускать попадания неразбавленного средства в сточные, поверхностные или подземные воды и в канализацию.
8.2. Сброс всех видов вод, обеззараженных с использованием средства «Натрия гипохлорит технический», в водные объекты (хозяйственно-питьевого, культурно-бытового водопользования, рыбохозяйственного назначения) допустим только после нейтрализации остаточного хлора восстановителями сульфитного ряда (тиосульфат натрия, бисульфит аммония и др.).
9. Нормативные ссылки
1. СанПиН 2.1.4.1074-01. Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества.
2. СанПиН 2.1.5.980-00. Гигиенические требования к охране поверхностных вод.
3. СанПиН 2.1.2.1188-03. Плавательные бассейны. Гигиенические требования к устройству, эксплуатации и качеству воды. Контроль качества.
4. СанПиН 2.1.2.1331-03. Гигиенические требования к устройству, эксплуатации и качеству воды аквапарков.
5. ГН 2.1.5.1315-03. Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования
Информация с сайта http://www.kaustik.ru/