| Регистрационное удостоверение |
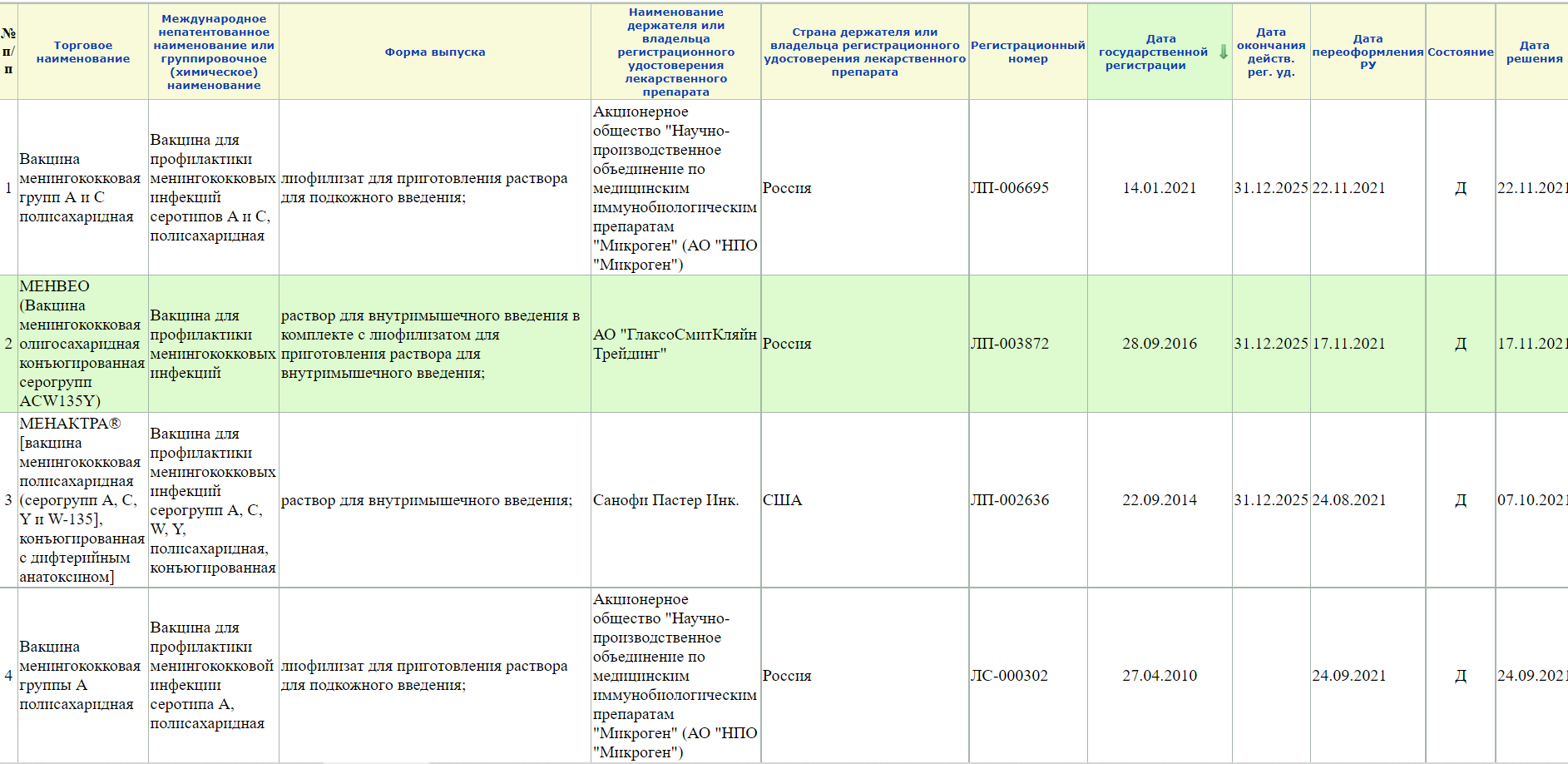
| 1 |
|
|||||||||||||||||||||||||||||||||||||||||
| 2 | Наименование держателя или владельца регистрационного удостоверения лекарственного препарата |
|
||||||||||||||||||||||||||||||||||||||||
| 3 |
Торговое наименование лекарственного препарата |
|||||||||||||||||||||||||||||||||||||||||
| 4 | Международное непатентованное или группировочное или химическое наименование |
|||||||||||||||||||||||||||||||||||||||||
| 5 | Формы выпуска |
|
||||||||||||||||||||||||||||||||||||||||
| 6 | Сведения о стадиях производства |
|
||||||||||||||||||||||||||||||||||||||||
| 7 | Инструкция по применению лекарственного препарата | |||||||||||||||||||||||||||||||||||||||||
| 8 | Нормативная документация |
|
||||||||||||||||||||||||||||||||||||||||
| 9 | Фармако-терапевтическая группа |
|
||||||||||||||||||||||||||||||||||||||||
| 10 | Анатомо-терапевтическая химическая классификация |
|
||||||||||||||||||||||||||||||||||||||||
| 11 | Фармацевтическая субстанция |
|
||||||||||||||||||||||||||||||||||||||||
| 12 | Особые отметки |
|
Безопасность лекарственных препаратов
Отмена государственной регистрации лекарственного препарата.
ТромбоМаг®
Регистрационное удостоверение: ЛП-003550 от 01.04.2016г.
Отмена государственной регистрации лекарственного препарата.
Тризенокс
Регистрационное удостоверение: ЛП-004346 от 21.06.2017г.
Отмена государственной регистрации лекарственного препарата.
Никоретте
Регистрационное удостоверение: П N012587/01 от 02.08.2007г.
Отмена государственной регистрации лекарственного препарата.
Гексикон® Д
Регистрационное удостоверение: ЛС-000185 от 19.02.2010г.
Заявителям регистрации и производителям лекарственных препаратов, содержащих в качестве действующего вещества гидроксихлорохин или хлорохин.
Департамент регулирования обращения лекарственных средств и медицинских изделий в связи с письмом ФГБУ «НЦЭСМП» Минздрава России от 01.12.2022 № 27934 сообщает о рекомендации внесения изменений в инструкции по медицинскому применению зарегистрированных в Российской Федерации лекарственных препаратов для медицинского применения, содержащих в качестве действующего вещества гидроксихлорохин или хлорохин, согласно актуальной информации по безопасности применения гидроксихлорохина или хлорохина.
Приложение: письмо ФГБУ «НЦЭСМП» Минздрава России от 01.12.2022 № 27934 на 2 л.

Заявителям регистрации и производителям лекарственных препаратов, относящихся к классу «антибиотик-макролид».
Департамент регулирования обращения лекарственных средств и медицинских изделий в связи с письмом ФГБУ «НЦЭСМП» Минздрава России от 01.12.2022 № 27933 сообщает о рекомендации внесения изменений в инструкции по медицинскому применению, общие характеристики лекарственных препаратов (ОХЛП) зарегистрированных в Российской Федерации лекарственных препаратов для медицинского применения, относящихся к классу «антибиотик-макролид», согласно актуальной информации по безопасности применения макролидных антибиотиков.
Приложение: письмо ФГБУ «НЦЭСМП» Минздрава России от 01.12.2022 № 27933 на 2 л. № 25662 на 1 л.

Отмена государственной регистрации лекарственного препарата.
Энцефабол®
Регистрационное удостоверение: П N013412/02 от 19.09.2011г.
Отмена государственной регистрации лекарственного препарата.
Никоретте
Регистрационное удостоверение: П N012587/01 от 02.08.2007г.
Все публикации раздела «Безопасность ЛП»
Новости

Проведение аттестации экспертов ФГБУ «НЦЭСМП» Минздрава России в соответствии с Порядком определения уровня профессиональной подготовки экспертов федерального государственного бюджетного учреждения по проведению экспертизы лекарственных средств для медицинского применения и аттестации их на право проведения экспертизы лекарственных средств для медицинского применения, утвержденного приказом Минздрава России от 26 августа 2010 г. № 755н, назначено на 15.11.2022 (тестирование) и на 17.11.2022 (собеседование) в 10:00 по московскому времени.
Субъектам обращения лекарственных средств
Министерство здравоохранения Российской Федерации в связи с техническими
работами в Государственном реестре предельных отпускных цен производителей
на лекарственные препараты, включенные в перечень жизненно необходимых
и важнейших лекарственных препаратов, который размещен на официальном сайте
в сети Интернет (http://grls.rosminzdrav.ru), сообщает, что в соответствии с пунктом
16 Особенностей государственного регулирования предельных отпускных цен
производителей на лекарственные препараты, включенные в перечень жизненно
необходимых и важнейших лекарственных препаратов, утвержденных
Постановлением Правительства Российской Федерации от 31.10.2020 № 1771,
и решения Федеральной антимонопольной службы (далее – ФАС России) от
09.09.2022 № ТН/84479/22 о снижении перерегистрированных предельных
отпускных цен производителей на лекарственные препараты, включенные в перечень
жизненно необходимых и важнейших лекарственных препаратов, (копия
прилагается) размещает актуальные сведения о предельных отпускных ценах
на лекарственные препараты, соответствующие Международному непатентованному
наименованию или группировочному (химическому) наименованию Эноксапарин
натрия.

Информация о результатах проведения аттестации уполномоченных лиц производителей биомедицинских клеточных продуктов

Субъектам обращения лекарственных средств
Департамент регулирования обращения лекарственных средств и медицинских изделий Министерства здравоохранения Российской Федерации информирует, что с 01.09.2022 на Едином портале государственных и муниципальных услуг (функций) доступно предоставление следующих государственных услуг:
- по выдаче заключений (разрешительных документов) на ввоз в Российскую Федерацию конкретной партии зарегистрированных и (или) незарегистрированных лекарственных средств, предназначенных для проведения клинических исследований лекарственных препаратов, конкретной партии незарегистрированных лекарственных средств для проведения экспертизы лекарственных средств в целях регистрации и экспертизы лекарственных средств, предназначенных для обращения в Российской Федерации или на общем рынке лекарственных средств в рамках Евразийского экономического союза, осуществления государственной регистрации лекарственных препаратов, включения фармацевтической субстанции в государственный реестр лекарственных средств, конкретной партии незарегистрированных лекарственных средств для оказания медицинской помощи по жизненным показаниям конкретного пациента либо оказания медицинской помощи ограниченному контингенту пациентов с редкой и (или) особо тяжелой патологией;
- по выдаче заключений (разрешительных документов) на ввоз в Российскую Федерацию и вывоз из Российской Федерации биологических материалов, полученных при проведении клинического исследования лекарственного препарата для медицинского применения.
Для получения заключений (разрешительных документов) в форме электронного документа представление документов и сведений заявителем осуществляется в форме электронного документа (пакета электронных документов), подписанного усиленной неквалифицированной электронной подписью.
Услуга оказывается на основании оптимизированного стандарта, разработанного в соответствии с постановлением Правительства Российской Федерации от 30 июля 2021 г. № 1279. Утвержденные оптимизированные стандарты прилагаются.
Письмо о размещённых услугах на ЕПГУ
ОС по выдаче заключений (разрешительных документов) на ввоз в Российскую Федерацию и вывоз из Российской Федерации биологических материалов, полученных при проведении клинического исследования лекарственного препарата для медицинского применения
ОС по выдаче заключений (разрешительных документов) на ввоз в Российскую Федерацию конкретной партии зарегистрированных и (или) незарегистрированных лекарственных средств, предназначенных для проведения клинических исследований лекарственных препаратов, конкретной партии незарегистрированных лекарственных средств для проведения экспертизы лекарственных средств в целях регистрации и экспертизы лекарственных средств, предназначенных для обращения в Российской Федерации или на общем рынке лекарственных средств в рамках Евразийского экономического союза, осуществления государственной регистрации лекарственных препаратов, включения фармацевтической субстанции в государственный реестр лекарственных средств, конкретной партии незарегистрированных лекарственных средств для оказания медицинской помощи по жизненным показаниям конкретного пациента либо оказания медицинской помощи ограниченному контингенту пациентов с редкой и (или) особо тяжелой патологией
ИНФОРМАЦИЯ
В соответствии с Порядком аттестации уполномоченного лица производителя биомедицинского клеточного продукта, требования к уровню образования и квалификации указанного уполномоченного лица и его полномочий по обеспечению качества биомедицинского клеточного продукта, вводимого в обращение, утвержденного приказом Минздрава России
от 29 сентября 2017 г. № 694н «Об утверждении порядка аттестации уполномоченного лица производителя биомедицинского клеточного продукта, требований к уровню образования и квалификации указанного уполномоченного лица и его полномочий по обеспечению качества биомедицинского клеточного продукта, вводимого в обращение»,
14 сентября 2022 года с 10.00 по московскому времени планируется проведение аттестации уполномоченного лица производителя биомедицинского клеточного продукта.
Аттестация будет проводиться Аттестационной комиссией Министерства здравоохранения Российской Федерации по аттестации уполномоченного лица производителя биомедицинского клеточного продукта в помещении Минздрава России, расположенном по адресу: Москва, Успенский переулок, д.10, стр. 1.
Субъектам обращения лекарственных средств
Департамент регулирования обращения лекарственных средств и медицинских изделий Минздрава России сообщает, что 25 августа 2022 года официально опубликовано распоряжение Правительства Российской Федерации от 24 августа 2022 г. № 2419-р, которым внесены изменения в перечень ЖНВЛП, в том числе в части корректировки лекарственных форм, являющихся эквивалентными по отношению к уже включенным лекарственным формам (http://publication.pravo.gov.ru/Document/View/0001202208250043).
Обращаем внимание на необходимость оперативной подачи документов для государственной регистрации предельных отпускных цен производителей на лекарственные препараты, лекарственные формы которых были включены в данное распоряжение.
В отношении лекарственных препаратов, по которым внесены изменения в части написания лекарственных форм или группировочных наименований необходимо подать заявление о внесении изменений в Государственный реестр предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов.
Департамент регулирования обращения лекарственных средств и медицинских изделий направляет для сведений и учета в работе письмо ФГБУ «НЦЭСМП» Минздрава России от 16.03.2021 №5761.

Департамент регулирования обращения лекарственных средств
и медицинских изделий Министерства здравоохранения Российской Федерации
в связи с вступлением в силу постановления Правительства Российской Федерации
от 17.11.2021 №1961 «О внесении изменений в постановление Правительства
Российской Федерации от 3 апреля 2020 г. № 441» (далее – Постановление № 1961),
продлевающего срок действия постановления Правительства Российской Федерации
от 3 апреля 2020 г. № 441 «Об особенностях обращения лекарственных препаратов
для медицинского применения, которые предназначены для применения в условиях
угрозы возникновения, возникновения и ликвидации чрезвычайной ситуации и для
организации оказания медицинской помощи лицам, пострадавшим в результате
чрезвычайных ситуаций, предупреждения чрезвычайных ситуаций, профилактики
и лечения заболеваний, представляющих опасность для окружающих, заболеваний
и поражений, полученных в результате воздействия неблагоприятных химических,
биологических, радиационных факторов» до 01.01.2023, сообщает следующее.
В соответствии с п.2 Постановления №1961 разрешения на временное обращение
серии (партии) лекарственного препарата, не зарегистрированного в Российской
Федерации и разрешенного для медицинского применения на территории
иностранных государств уполномоченными органами соответствующих
иностранных государств, выданные в соответствии с постановлением Правительства
Российской Федерации от 3 апреля 2020г. №441 до дня вступления в силу настоящего
постановления, действительны до 1 января 2023 г. и подлежат замене до 1 января
2022 г. по заявлению юридического лица, действующего в собственных интересах
или уполномоченного представлять интересы другого юридического лица, на имя
которого выдано соответствующее разрешение, представленному в Министерство
здравоохранения Российской Федерации в срок до 20 декабря 2021 г.
В связи с изложенным информируем, что в случае необходимости продления
разрешения на временное обращение необходимо предоставить заявление в форме
письменного обращения в Министерство здравоохранения Российской Федерации
в срок до 20.12.2021.

Департамент государственного регулирования обращения лекарственных средств Министерства здравоохранения Российской Федерации обращает внимание на необходимость в соответствии с пунктом 15 постановления Правительства Российской Федерации от 01.06.2021 № 853 «Об утверждении правил ввоза лекарственных средств для медицинского применения в Российскую Федерацию и признании утратившими силу некоторых актов и отдельных положений некоторых актов Правительства Российской Федерации», организациям, осуществившим ввоз в Российскую Федерацию лекарственных препаратов, предназначенных для оказания медицинской помощи по жизненным показаниям конкретного пациента, а также организациям, осуществившим ввоз не зарегистрированных в Российской Федерации лекарственных препаратов для оказания медицинской помощи ограниченному контингенту пациентов с редкой и (или) особо тяжелой патологией, в течение 10 рабочих дней со дня получения лекарственных препаратов медицинской организацией, в которой оказывается медицинская помощь пациенту, уведомить об этом Министерство здравоохранения Российской Федерации.

Департамент государственного регулирования обращения лекарственных средств Министерства здравоохранения Российской Федерации информирует,
что с 01.09.2021 предоставление государственной услуги по выдаче заключений (разрешительных документов) на ввоз в Российскую Федерацию конкретной партии зарегистрированных и (или) незарегистрированных лекарственных средств, предназначенных для проведения клинических исследований лекарственных препаратов, конкретной партии незарегистрированных лекарственных средств для проведения экспертизы лекарственных средств в целях регистрации и экспертизы лекарственных средств, предназначенных для обращения в Российской Федерации или на общем рынке лекарственных средств в рамках Евразийского экономического союза, осуществления государственной регистрации лекарственных препаратов, включения фармацевтической субстанции в государственный реестр лекарственных средств, конкретной партии незарегистрированных лекарственных средств для оказания медицинской помощи по жизненным показаниям конкретного пациента, осуществляется в форме электронного документа, подписанного усиленной квалифицированной электронной подписью.
Для получения заключений (разрешительных документов) в форме
электронного документа представление документов и сведений заявителем осуществляется в форме электронного документа (пакета электронных
документов), подписанного электронной подписью (простой электронной подписью, либо усиленной квалифицированной электронной подписью, либо усиленной неквалифицированной электронной подписью).

С целью выполнения требований регуляторов в области защиты информации и предотвращения несанкционированного доступа к ресурсам информационной системы «Государственный реестр лекарственных средств для медицинского применения» просим в срок до 12.07.2021 года провести смену пароля для входа всем пользователям Системы.
Все публикации раздела «Новости»
Телефонные номера службы технической поддержки (с 9:00 до 18:00 по Московскому времени): +7(800) 500-30-80 +7(495) 105-99-77
M
Sur.ly
Home
How it Works
Downloads
Help
X
Powered
by SUR.LY
!
Report this website
We got your feedback. Thank you!
Report this website
Adult content
Suspicious activity or malware
Spam or abuse
Other
Share your thoughts with us:
G
T
F
Trust
70
Privacy
70
Child safety
N/A
grls.rosminzdrav.ru
Site Rating
Trust
Privacy
Child safety
N/A
Site Advisor
0 /
0
Alexa Rank
N/A
Daily visitors
3 962
Daily pageviews
19 022
D
U
Recent posts: Sur.ly for WordPress
Sur.ly for WordPress
Sur.ly plugin for WordPress is free of charge.
Sur.ly for Joomla
Sur.ly plugin for Joomla 2.5/3.0 is free of charge.
Sur.ly for Drupal
Sur.ly extension for both major Drupal version is free of charge.
Sur.ly for any website
In case your platform is not in the list yet, we provide Sur.ly Development Kit (SDK) for free, which allows you to implement Sur.ly on any website using PHP 4.3 and newer.
Как пользоваться сайтом ГРЛС
Обласова Антонина t.me/ninavaccinaИнструкция как искать действующие официальные инструкции к лекарственным препаратам, в т.ч. к вакцинам.
Сразу совет: лучше это делать с компьютера, а не с мобильного
1.Заходим на сайт ГРЛС по прямой ссылке https://grls.rosminzdrav.ru/ или просто гуглим
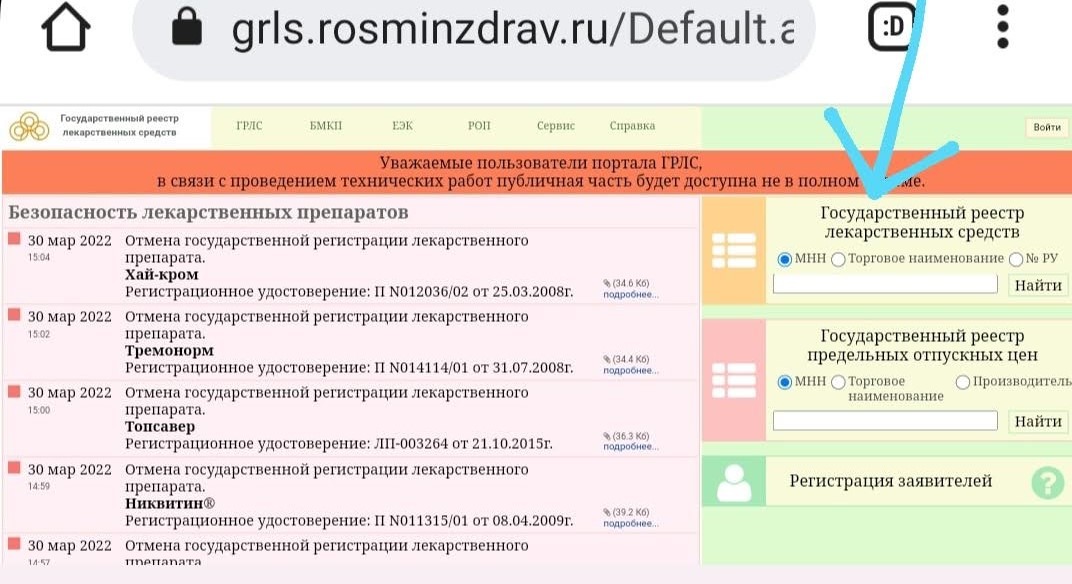
2. На открывшемся сайте нажимаете на надпись, отмеченную стрелкой
3. Попадаете в Н̶а̶р̶н̶и̶ю̶ вот на такую страницу
4. Воспользуйтесь нужными вам фильтрами
- Например, можно ввести торговое наименование вакцины,
- или в строке МНН набрать название инфекции
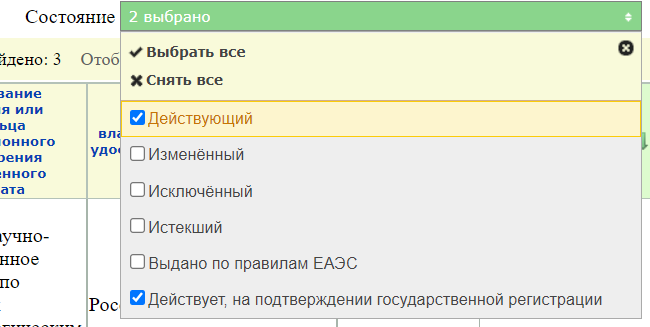
- и нажать кнопку «найти«
По умолчанию стоит фильтр на действующие записи
но можно найти и старые, которые уже не действуют.
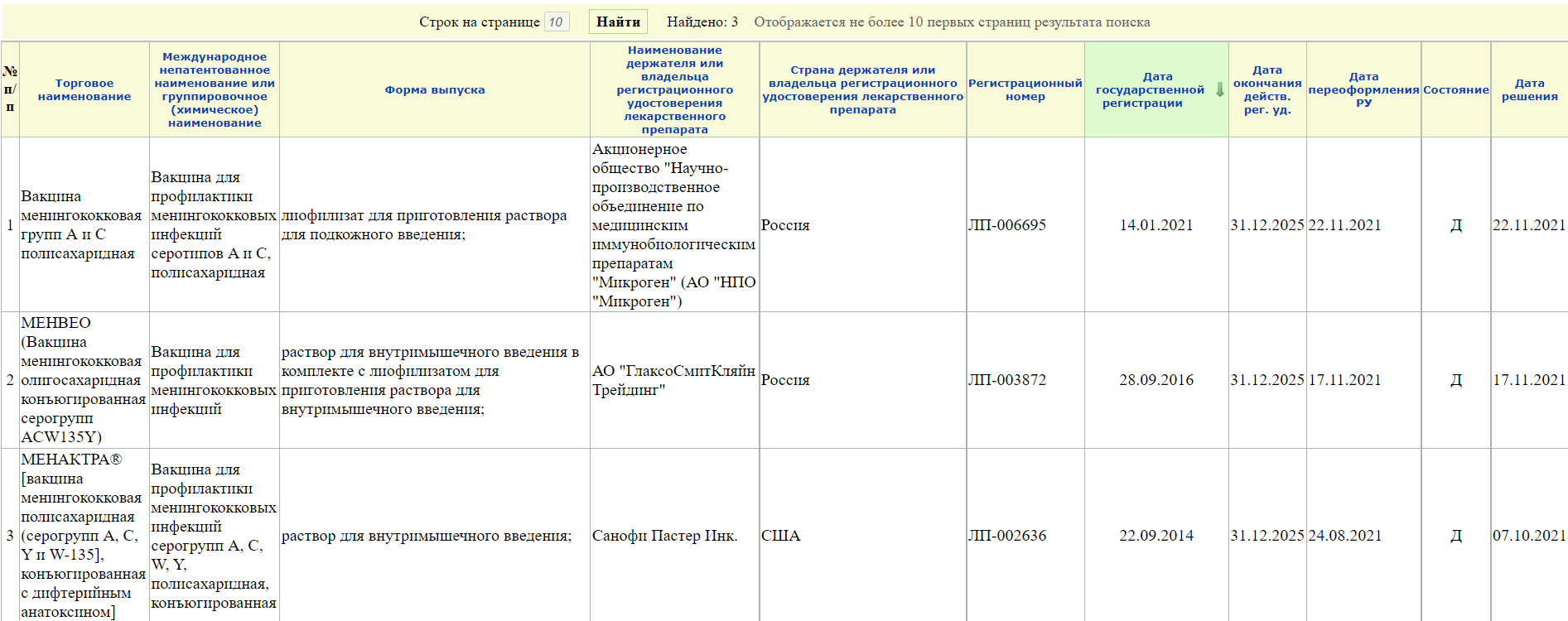
5. Вам откроется перечень имеющихся препаратов
Кстати! Лучше все-таки вводить неполный запрос, а что-то типа «менингококк» или «коклюш», так как если выбирать из подсказок системы, то может отображаться не все (или вообще ничего). Так, например при запросе Вакцина для профилактики менингококковых инфекций» сайт не выдает вот эту карточку на вакцину против менингококка серогруппы А.
А при запросе «менингококк» открывается 4 записи
Хотя, иногда, это усложняет поиск, так как могут отображаться препараты, которые просто имеют в названии однокоренные слова.
6. Идете в карточку препарата (нажимаете на запись)
Вы попадаете на страницу с информацией, где есть данные о производителе, фасовках, и др.
7. Пролистываете эту страницу вниз и ищете там вот такую кнопку, жмете на нее
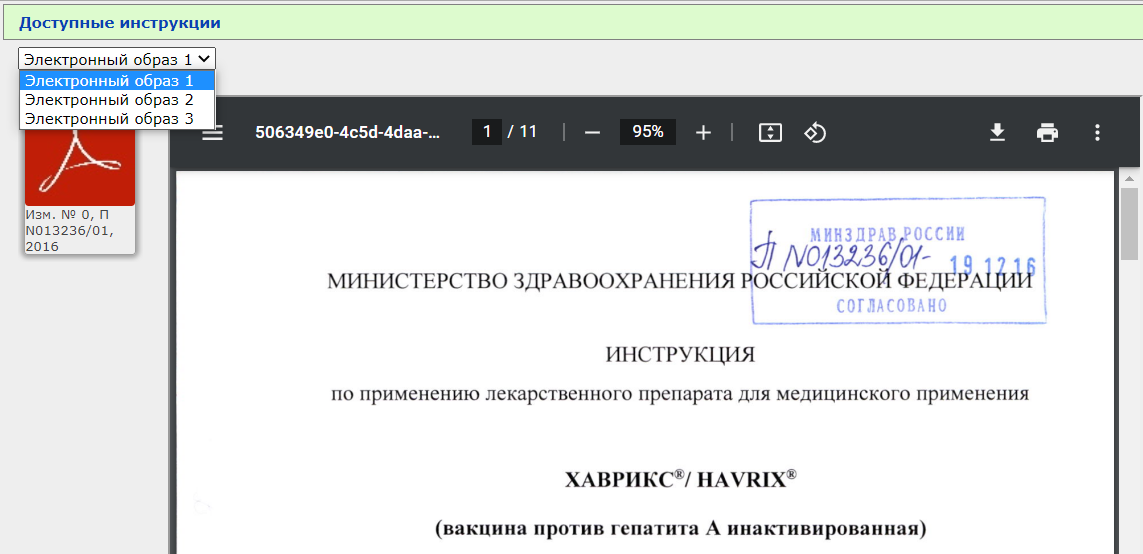
8. Вам открывается вот такая страница.
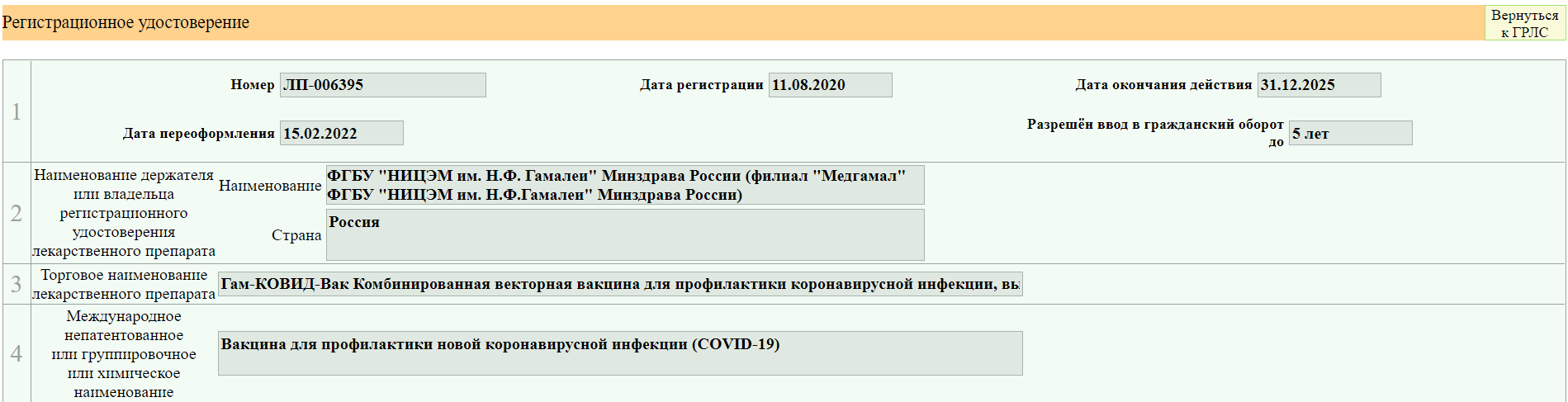
Я взяла для примера вакцину от ковида, так как там много изменений вносилось
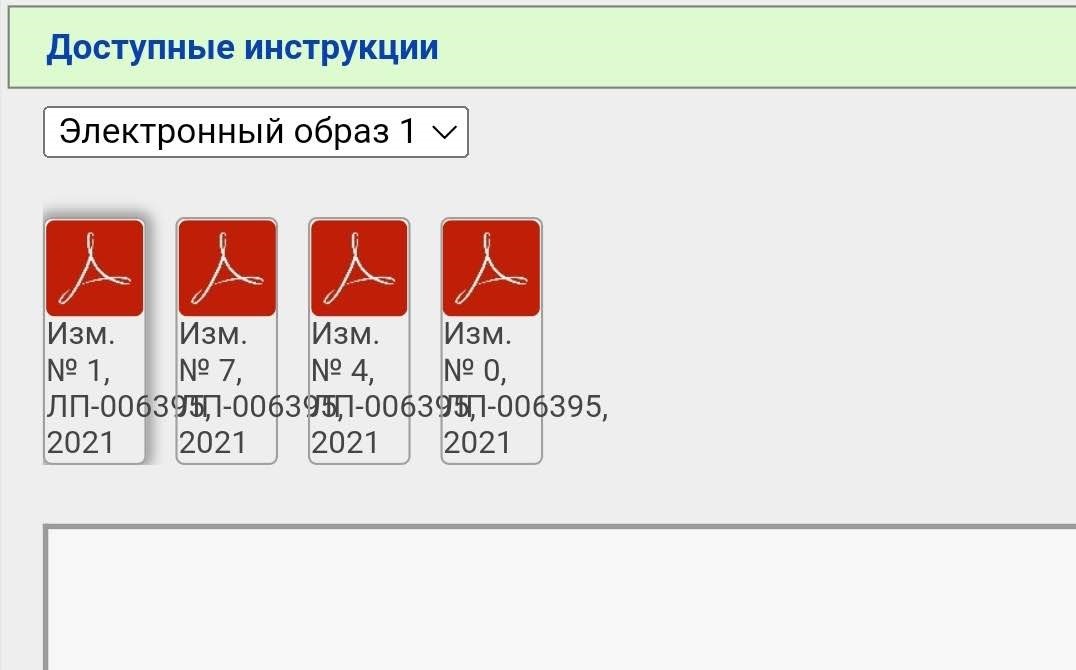
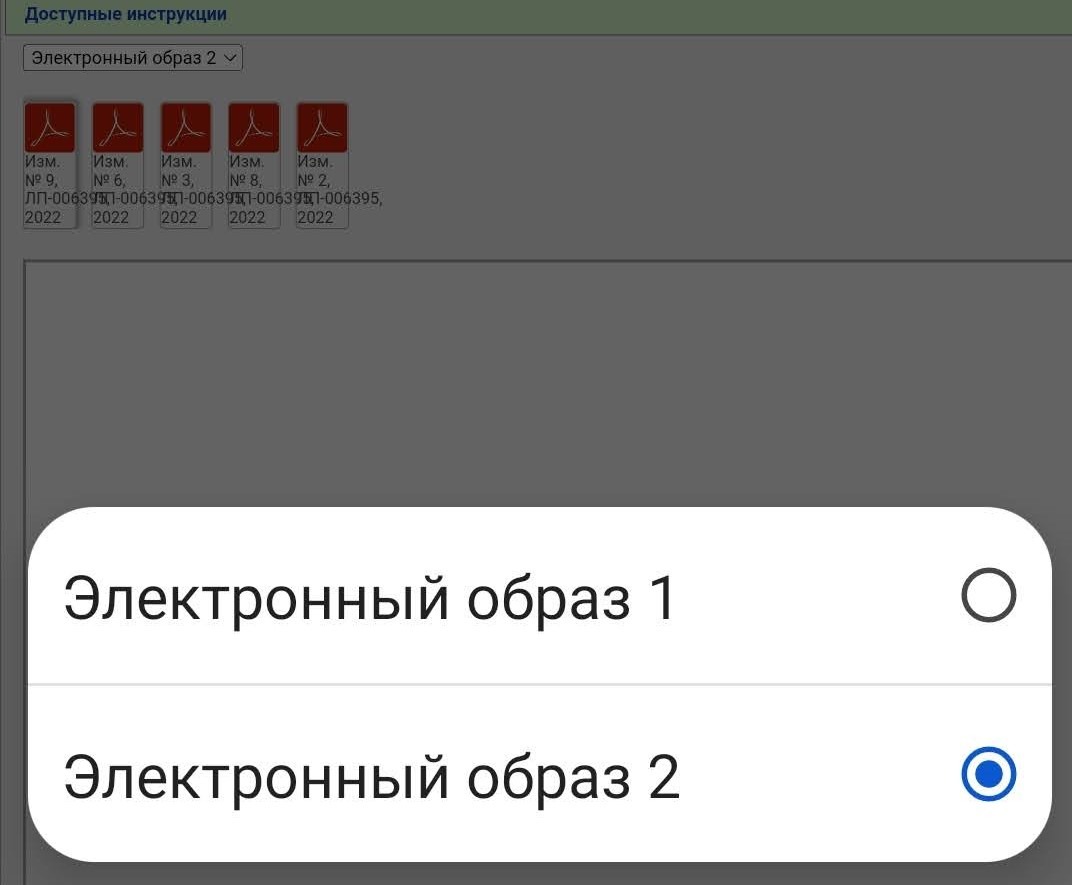
Вы видите несколько PDF файлов, но не спешите их открывать. Вначале нажимаем сюда
В случае с Гам-Ковид-Ваком электронный образ — это как бы «полная инструкция», которая изначально выкладывается. В данном примере исходный документ — это «Имз. № О». Когда появляются какие-то изменения/дополнения, то публикуется не новая полная инструкция, а только изменение в формате было/стало. Когда изменений накапливается много их наконец могут собрать в кучу и опубликовать новый электронный образ. Но это не общее правило. Изменения и дополнения тоже могут публиковаться отдельными образами (короче, бардак).
В нашем примере электронных образов два, мы выбираем более новый (второй). Тут тоже уже появился ряд правок.
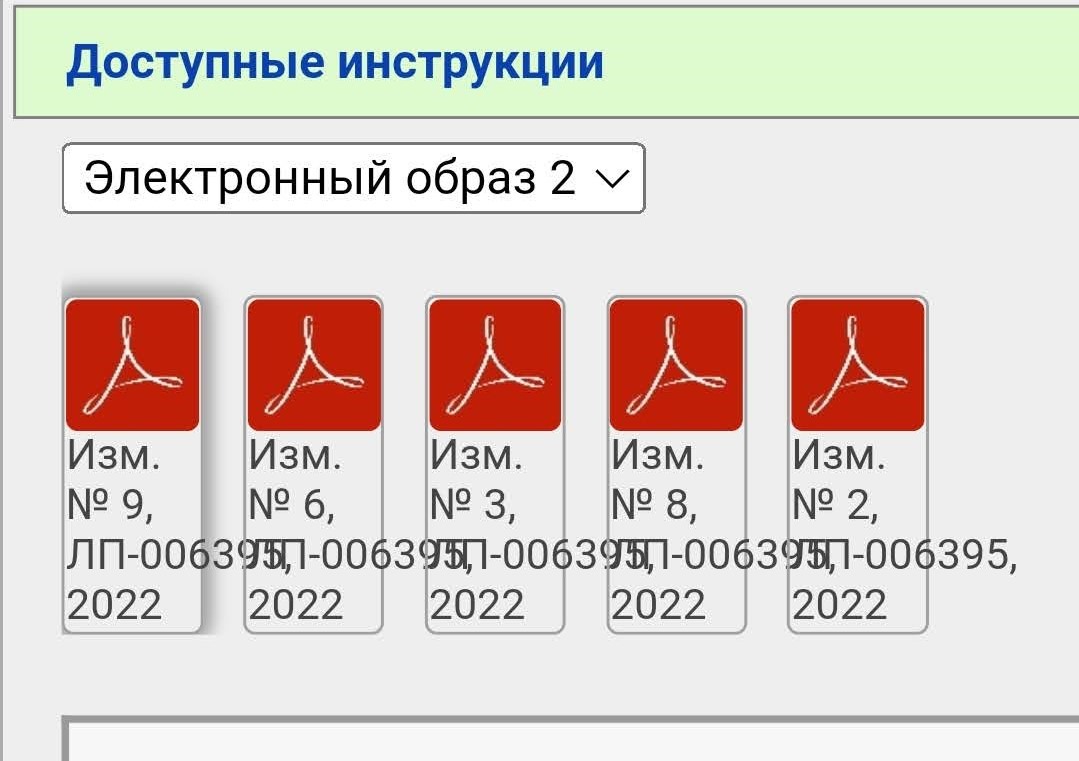
Чтобы «собрать» в голове полную инструкцию нужно скачать все документы. Почему в данном случае есть изменения 2, 3, 6, 8 и 9, но нет 1, 4, 5 и 7 — не знаю.
Обычно изменений не так много. Вот, например, для препарата Хаврикс (вакцина против гепатита А) добавлено 3 электронных образа:
- Полная инструкция
- Два дополнения
- еще одно дополнение
Очень не рекомендую пользоваться другими ресурсами с инструкциями. Они могут содержать ошибки, неполные или неактуальные данные. Тут хоть и через жо, но хотя бы точно актуально.
На территории России действуют строгие правила ведения государственного реестра лекарственных препаратов для последующего их использования в медицинской практике. Для противодействия мошенническим действиям предусмотрено наличие Федерального закона №61-ФЗ «Об обращении лекарственных средств».
В базе данных указан список медикаментов импортного и отечественного производства, а также зарегистрированных Минздравом РФ препаратов для проведения диагностических манипуляций и профилактики развития патологий. В электронной базе содержатся номера и даты регистрации лекарств, их названия в международном формате. Реестр опубликован на официальном интернет-портале Министерством здоровья и социального развития России.
Все данные в госреестре являются открытыми и общедоступными, благодаря чему у любого врача, а также обычного человека есть возможность убедиться в том, что необходимое лекарственное средство разрешено использовать на территории РФ.
Что это такое
Госреестр лекарственных средств представляет собой многофункциональную информационную систему, в которой указаны актуальные данные о препаратах, прошедших необходимую регистрацию, благодаря чему их можно использовать для лечения и профилактики развития определенных заболеваний.
Дополнительно предусмотрено наличие информации об активных и вспомогательных компонентах, которые входят в состав медикаментов. Также указаны различные фармакологические субстанции, задействованные в процессе производства.
В госреестре предусмотрено наличие таблицы ЖНВЛП, в которой указаны медикаментозные средства под уникальным наименованием фармацевтического вещества, описываемого с помощью номенклатуры или химической формулы. Препараты из этого раздела используются практически во всех отраслях традиционной медицины, которая доступна гражданам России. Например, стационарная, высококачественная амбулаторно-поликлиническая и скорая медицинская помощь.
История создания реестра данных
Госреестр импортных и зарубежных лекарственных средств с 1971 г. оформляется как система документации, в которой собрана вся необходимая информация о препаратах. В электронной базе данных обязательно содержатся: листок-вкладыш, удостоверение, подтверждающее успешное прохождение регистрации, а также заказ на промышленное производство. Специалистами определен рекомендуемый объем вносимой в каждый блок информации. Дополнительно действуют четкие сроки для ввода данных.
Благодаря созданию государственного реестра собранные специалистами сведения о торговых и международных непатентованных названиях, упаковках, формах выпуска, рекомендуемых дозировках и фармакологических группах препаратов используются в качестве основы при составлении различных списков:
- Сильнодействующие и ядовитые компоненты. Составлением списка занимаются специалисты из Постоянного комитета по контролю наркотиков.
- Таблица ЖНВЛП.
- Перечень медикаментов, которые можно получить на льготных основаниях.
- Списки А и Б, в которых указаны МНН и основные торговые названия (синонимы) препаратов. К данным спискам необходимо относить все синонимы входящих в перечень медикаментов.
Если было принято решение отменить регистрацию медикамента, тогда соответствующая запись вносится в реестр в течение 24 ч. Защита данных осуществляется в соответствии с действующими законами РФ. Резервная копия хранящейся в базе информации создается через каждые 30 дней.
Какую информацию содержит
Госреестр лекарственных средств представляет собой универсальную автоматизированную систему. База данных постоянно обновляется, благодаря чему пользователям в любое время суток доступна исключительно актуальная информация.
В госреестре при регистрации медикаментозного средства указывают:
- Название фармакологического препарата.
- Фармакотерапевтическую классификацию.
- Уникальный номер записи в реестре и точную дату регистрации.
- Форму выпуска, дозировку и объем препарата в 1 упаковке.
- Наименование и местонахождение изготовителя.
- Данные разработчика медикаментозного средства.
- Показания к применению, противопоказания.
- Возможные побочные реакции после использования медикаментозного средства.
- Рекомендуемые условия хранения.
- Срок годности.
- Фармакопею (собрание нормативно-правовых актов, регламентирующих требования к качеству фармакологических средств).
- Дату регистрации и присвоенный препарату номер.
Принцип ведения реестра фармакологических средств для применения в традиционной медицине соответствует требованиям, которые прописаны в приказе Минздравсоцразвития России от 26.08.2010 (№746H).
Зачем и для кого предназначен
Госреестр лекарственных средств издается в России ежегодно. Этот реестр определяет номенклатуру препаратов, которая рассматривается специалистами как основная характеристика национального фармацевтического рынка и системы здравоохранения любой из стран.
Законодательство не контролирует качество информации в неофициальных справочниках, из-за чего не рекомендуется ориентироваться на указанные в них сведения. Данные могут быть актуальными, но они предназначены для получения основной, а не исчерпывающей информации. Именно по этой причине госреестр пользуется большим спросом.
Государственный реестр лекарственных средств необходим для достижения следующих результатов:
- Организация статистических наблюдений в различных сферах обращения медикаментозных препаратов.
- Идентификация субъектов предпринимательской деятельности, которые на серийном уровне занимаются производством и последующей реализацией лекарств. В этом случае обязательно должны быть соблюдены все установленные стандарты и действующие правила.
- Получение законного основания для оптово-розничных продаж медикаментозных средств на территории РФ.
- Обеспечение открытости и гласности актуальной информации о субъектах предпринимательской деятельности.
- Официальное подтверждение проведения исследований, а также изучения заявленных производителем свойств препарата.
- Достижение слаженного взаимодействия в пределах общих методических принципов с информационными базами других центральных органов исполнительной власти.
- Ознакомление медицинских работников с утвержденными на территории России фармакологическими средствами.
Госреестр Министерства здравоохранения включает в себя перечень безопасных препаратов с их международными названиями и датами регистрации/снятия с регистрации в пределах России.
Реестр доступных лекарственных средств активно используется при сборе заявок от областных центров на поставку необходимых препаратов, при оценке производства на предприятиях, при продаже медикаментов за пределами РФ, а также при создании необходимого государственного равновесия предложения и спроса на определенные медикаменты.
В реестре указаны данные, которые необходимы не только специалистам из медицинской отрасли, но и учреждениям государственной власти, принимающим участие в регулировании лекарственного обращения. По этой причине к информационной базе имеют доступ органы управления здравоохранением, Федеральная налоговая служба, Министерство экономического развития, Федеральная таможенная служба.
Как пользоваться
В категорию разрешенных препаратов входят только те средства, которые прошли обязательную регистрацию в Минздраве РФ и были записаны в соответствующий реестр. Только в этом случае государство берет на себя ответственность за проверку безопасности и эффективности медикаментозного средства. Дополнительно специалисты проводят необходимые клинические исследования, даже если они уже были ранее проведены в других странах.
Для широкого доступа к Единому федеральному реестру лекарственных препаратов был создан официальный сайт Министерства здравоохранения, который имеет собственную базу данных по зарегистрированным производителям, их уполномоченным лицам и самим медикаментам.
На официальном интернет-портале госреестра доступны следующие категории:
- Медицинские организации.
- Лекарственные средства и их производители.
- Максимальные цены для реализации.
- Уполномоченные лица.
- Главные исследователи.
- Разрешенные клинические исследования.
Дополнительно предусмотрено наличие официальных документов, писем и приказов, которые связаны с операциями в сфере изготовления, реализации и применения фармакологических средств.
При посещении официального сайта Единого государственного реестра препаратов можно в любое время подать заявление на регистрацию либо аттестацию уполномоченных лиц. Также можно отыскать максимально развернутую информацию по любому лекарственному средству, разрешенному к использованию на территории России. Для получения доступа к базе данных необходимо пройти предварительную процедуру регистрации в системе.
Что такое ЖНВЛП
Разработанный специалистами Перечень жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП) представляет собой таблицу, которая включает в себя несколько категорий. В каждом из разделов указаны эффективные медикаментозные средства для определенной системы организма, а также доступные формы выпуска препаратов. Правительство РФ периодически вносит изменения в таблицу, издавая для этого официальные указы.
| АТХ классификация | Медикаментозные препараты | Формы выпуска |
| А02 | Медикаментозные средства для комплексного лечения патологий, которые развиваются на фоне нарушения кислотности. | |
| A02BA | Фармакологические средства для борьбы с язвенной болезнью, ГЭРБ.
Препараты, угнетающие продукцию соляной кислоты обкладочными клетками слизистой оболочки желудка. |
|
| Фамотидин |
|
|
| Ранитидин |
|
|
| A03 | Медикаментозные средства для комплексного лечения патологий органов ЖКТ. | |
| А03АА | Препараты для борьбы с нарушениями физиологических функций кишечника.
Синтетические холиноблокаторы и антихолинергические средства. |
|
| Платифиллин |
|
|
| Мебеверин |
|
|
| А03ВА | Алкалоиды красавки, азотсодержащие органические вещества (производные аммиака). | |
| Атропин |
|
|
| A03FA | Препараты, улучшающие моторику органов ЖКТ. | |
| Метоклопрамид |
|
|
| A04 | Лекарственные средства, подавляющие или снижающие рвотный рефлекс. | |
| A04AA | Противорвотные медикаментозные средства.
Лекарственные средства, предотвращающие или устраняющие физиологические эффекты серотонина в организме. |
|
| Ондансетрон |
|
|
| M01 | Препараты для купирования воспалительного процесса и устранения нарушений сердечного ритма. | |
| М01АВ | Группа лекарственных средств, обладающих обезболивающим, жаропонижающим и противовоспалительным эффектом.
НПВС (уксусная кислота и ее производные). |
|
| Кеторолак |
|
|
| Диклофенак |
|
|
| М01АЕ | Производные фенилуксусной кислоты (ненаркотические болеутоляющие лекарства). | |
| Кетопрофен |
|
|
| Декскетопрофен |
|
|
| Ибупрофен |
|
Список ЖНВЛП составляется специалистами только по международным непатентованным названиям (МНН).
Льготные рецепты могут быть выписаны лечащим врачом исключительно в том случае, если больной на законных основаниях пользуется социальными услугами. Если речь касается торгового наименования препарата, тогда получить рецепт можно при доказанной неэффективности средства.
Дополнительно врачебная комиссия лечебного учреждения должна выдать письменное одобрение. За собственные деньги больной может купить любой препарат, а вот льготные рецепты выдаются на лекарства, которые имеют МНН в указанной лекарственной форме. Следует учесть, что международное непатентованное название указывает на химическое название либо главное вещество препарата.
Чтобы отыскать необходимый препарат, нужно открыть официальный сайт госреестра и ввести в строку поиска название медикамента. По торговому наименованию можно посмотреть, как именно называется активный компонент. Необходимо выбрать нужный препарат из списка и открыть его официальное регистрационное удостоверение. В самом низу страницы остается проверить запись, относится ли фармакологическое средство к категории ЖНВЛП или нет.
Стоимость медикаментов из категории жизненно необходимых препаратов контролируются на государственном уровне. На все лекарства из списка устанавливаются допустимые надбавки к итоговым ценам.
Люди из льготной категории (например, чернобыльцы, инвалиды, участники ВОВ) могут получать препараты из категории ЖНВЛП абсолютно бесплатно. Ознакомиться с перечнем зарегистрированных в России медикаментов, а также изучить официальную инструкцию к прописанному лечащим врачом препарату можно при наличии доступа к электронной базе данных госреестра лекарственных средств.
Видео о госреестре лекарственных средств
Государственный реестр лекарственных средств: