Как пользоваться сайтом ГРЛС
Обласова Антонина t.me/ninavaccinaИнструкция как искать действующие официальные инструкции к лекарственным препаратам, в т.ч. к вакцинам.
Сразу совет: лучше это делать с компьютера, а не с мобильного
1.Заходим на сайт ГРЛС по прямой ссылке https://grls.rosminzdrav.ru/ или просто гуглим
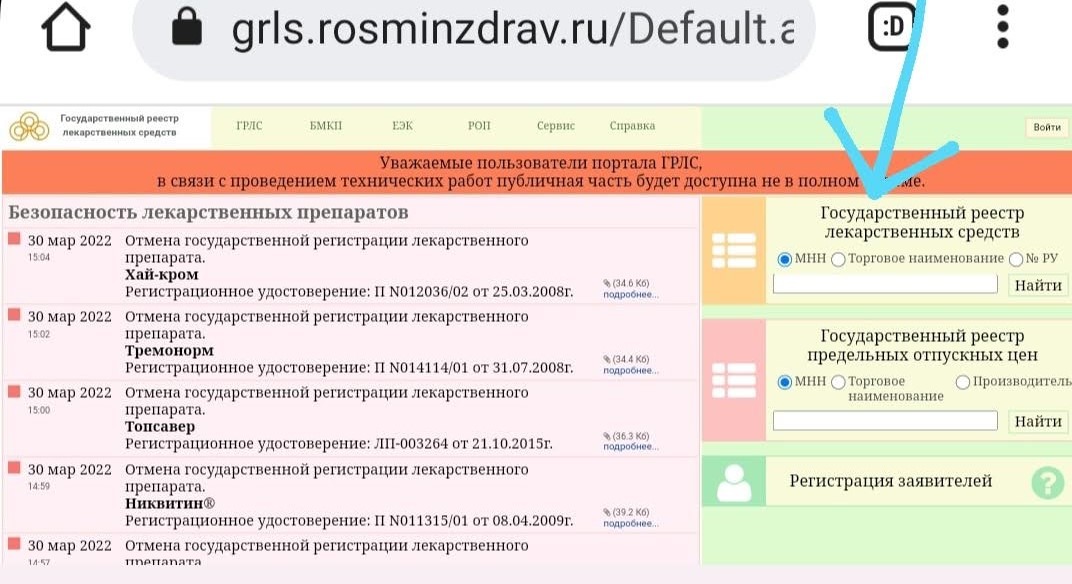
По умолчанию стоит фильтр на действующие записи но можно найти и старые, которые уже не действуют.2. На открывшемся сайте нажимаете на надпись, отмеченную стрелкой
3. Попадаете в Н̶а̶р̶н̶и̶ю̶ вот на такую страницу
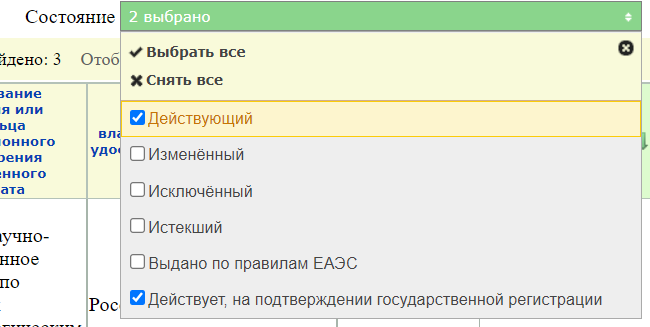
4. Воспользуйтесь нужными вам фильтрами
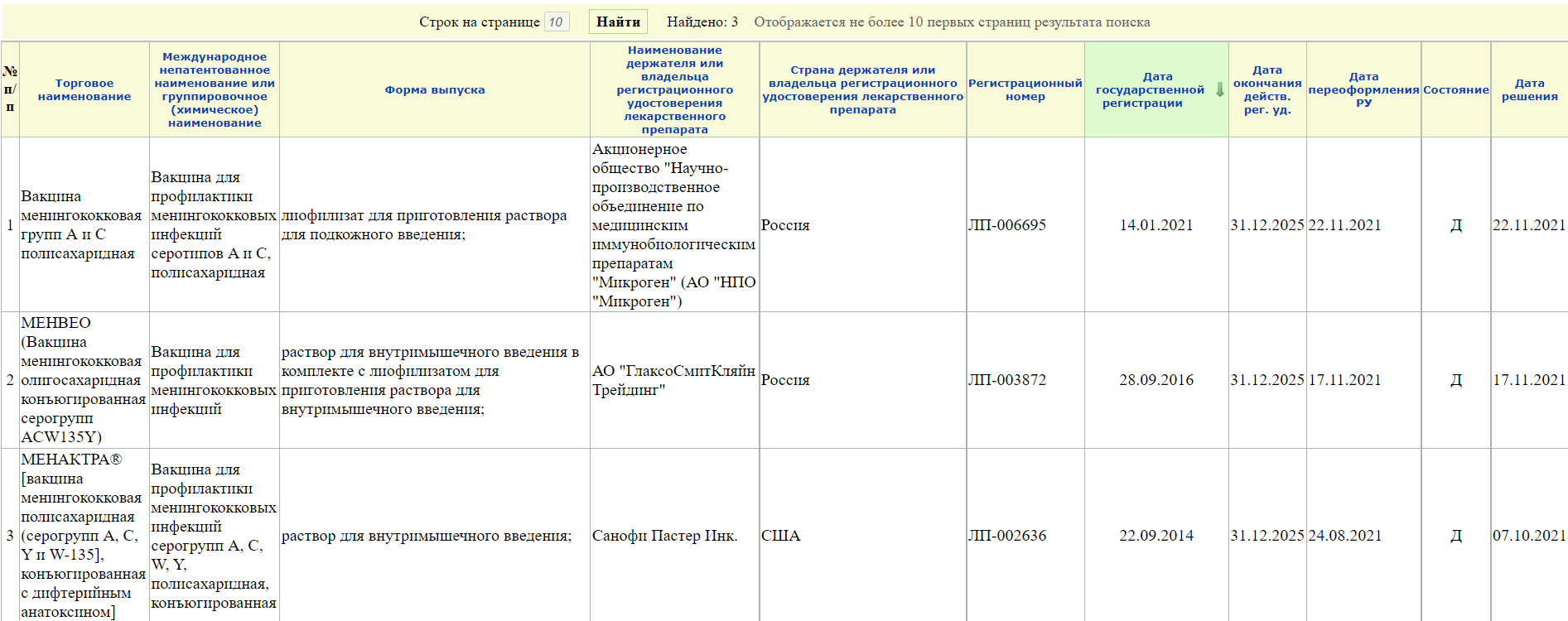
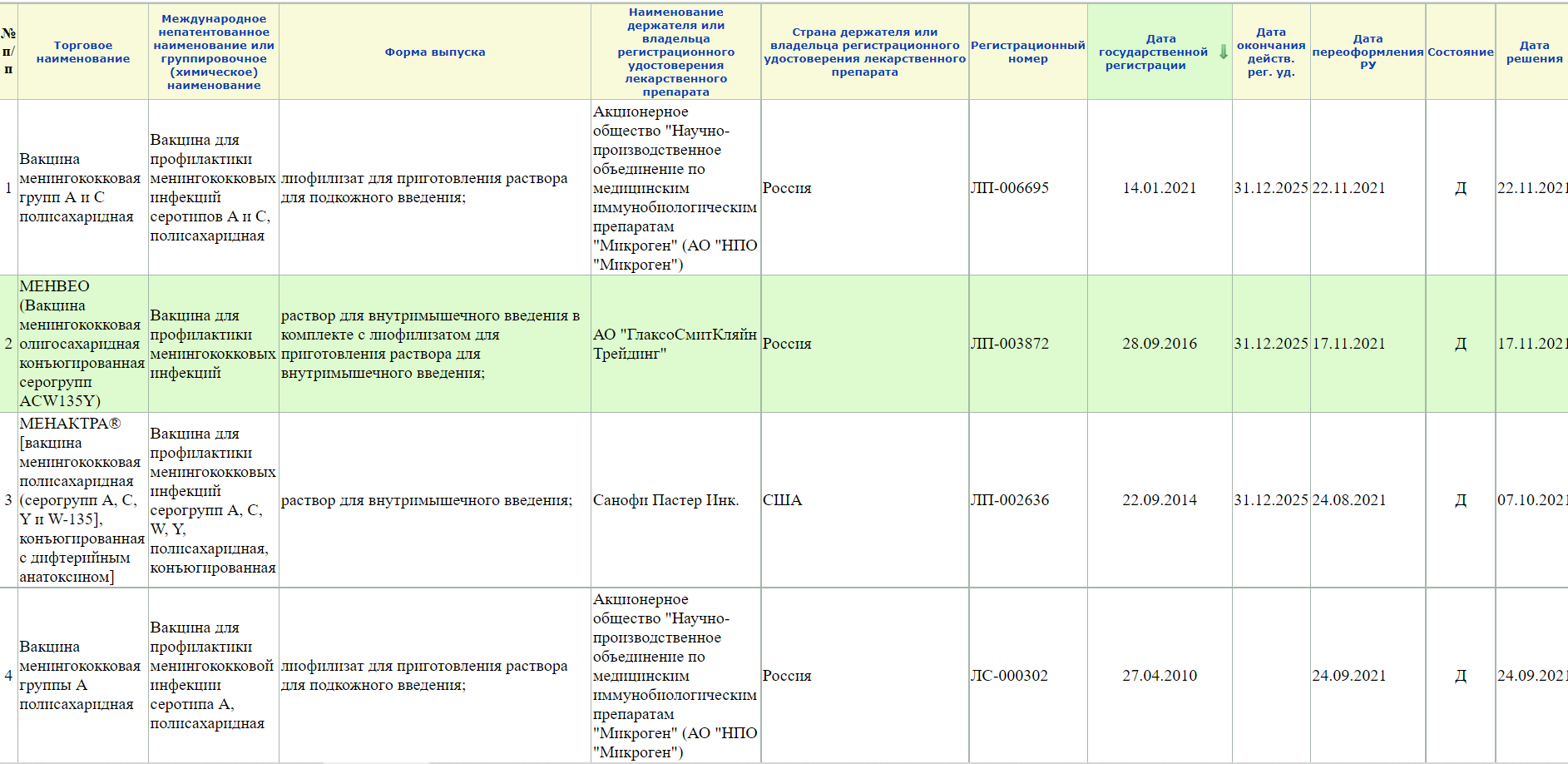
5. Вам откроется перечень имеющихся препаратов
Кстати! Лучше все-таки вводить неполный запрос, а что-то типа «менингококк» или «коклюш», так как если выбирать из подсказок системы, то может отображаться не все (или вообще ничего). Так, например при запросе Вакцина для профилактики менингококковых инфекций» сайт не выдает вот эту карточку на вакцину против менингококка серогруппы А.
А при запросе «менингококк» открывается 4 записи
Хотя, иногда, это усложняет поиск, так как могут отображаться препараты, которые просто имеют в названии однокоренные слова.
6. Идете в карточку препарата (нажимаете на запись)
Вы попадаете на страницу с информацией, где есть данные о производителе, фасовках, и др.
7. Пролистываете эту страницу вниз и ищете там вот такую кнопку, жмете на нее
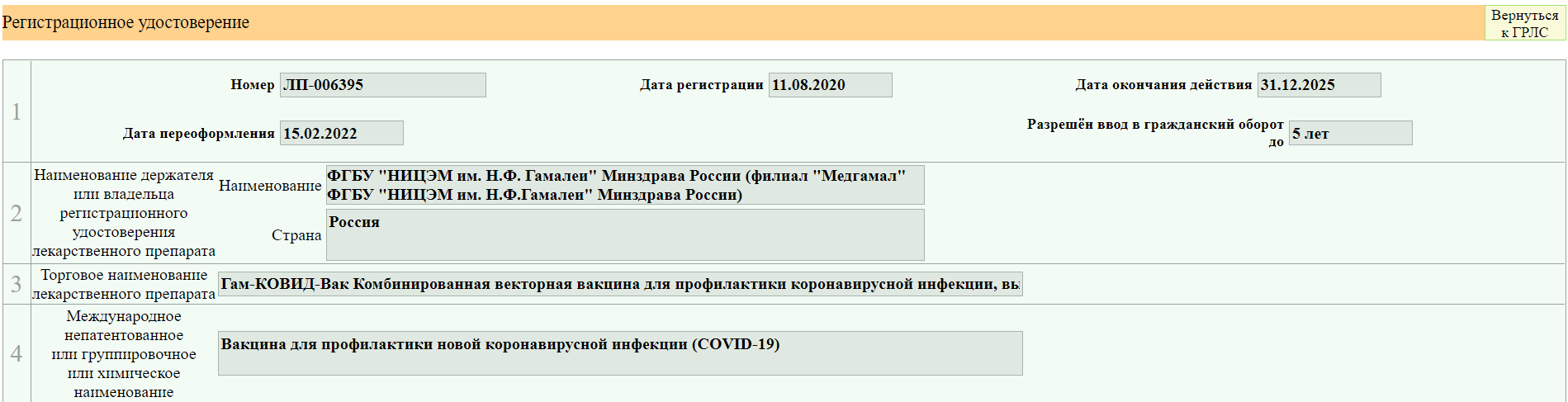
8. Вам открывается вот такая страница.
Я взяла для примера вакцину от ковида, так как там много изменений вносилось
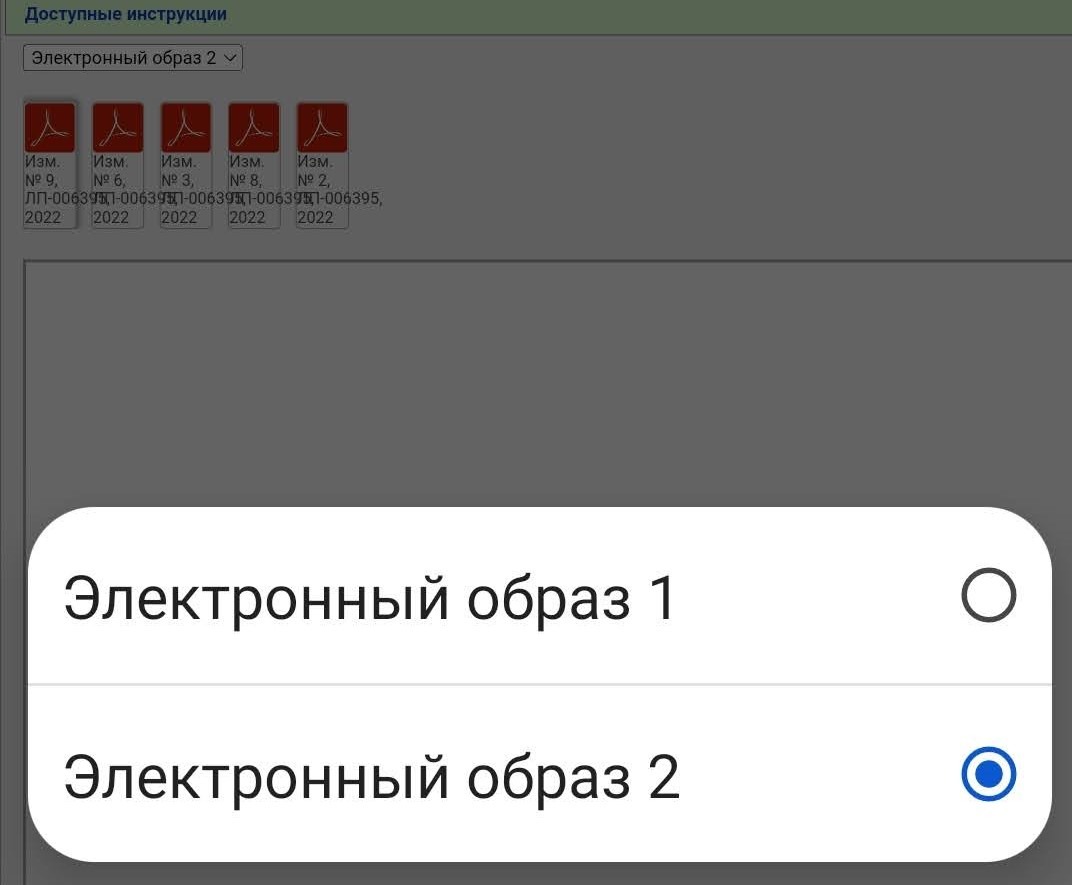
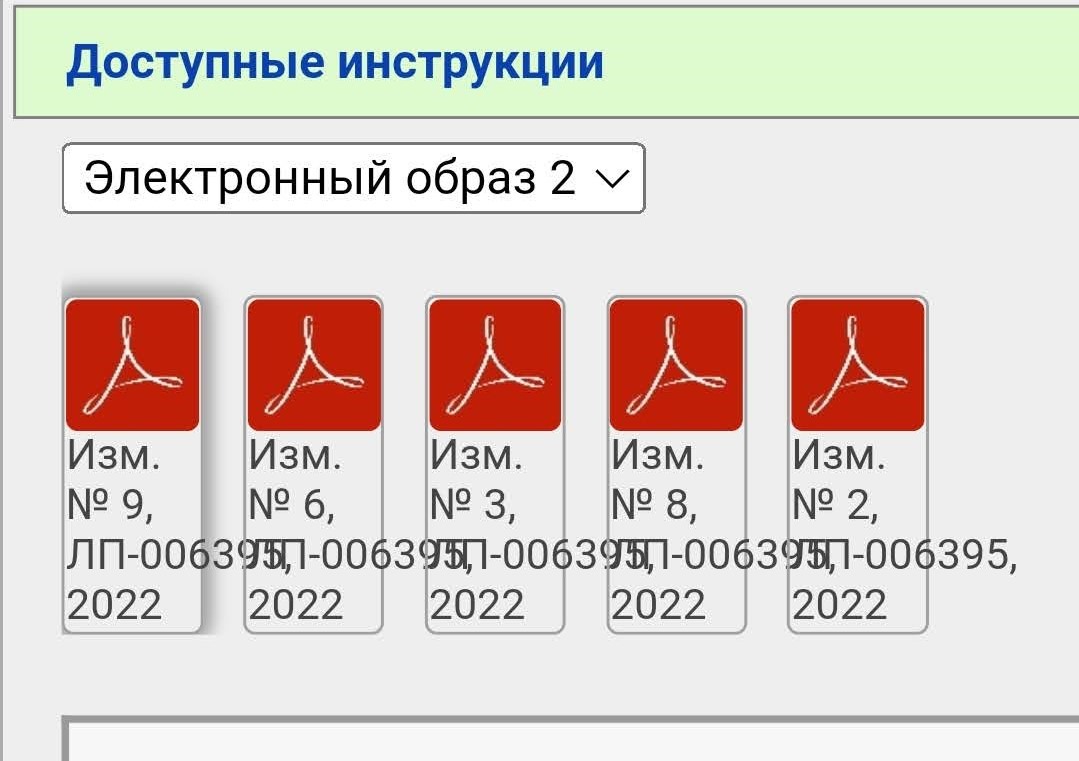
Вы видите несколько PDF файлов, но не спешите их открывать. Вначале нажимаем сюда
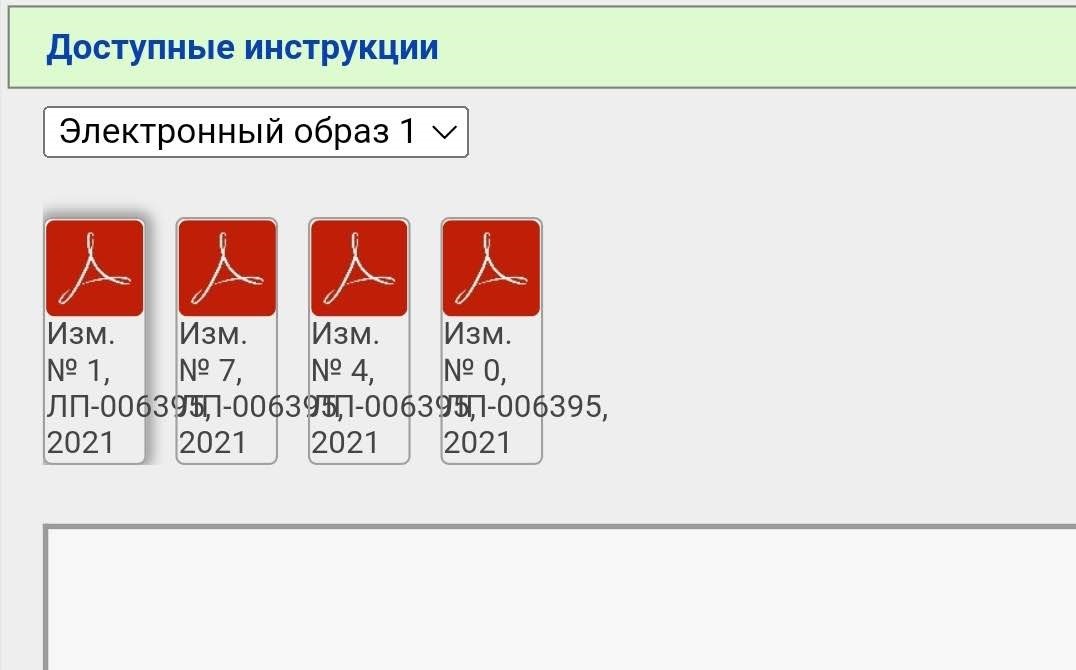
В случае с Гам-Ковид-Ваком электронный образ — это как бы «полная инструкция», которая изначально выкладывается. В данном примере исходный документ — это «Имз. № О». Когда появляются какие-то изменения/дополнения, то публикуется не новая полная инструкция, а только изменение в формате было/стало. Когда изменений накапливается много их наконец могут собрать в кучу и опубликовать новый электронный образ. Но это не общее правило. Изменения и дополнения тоже могут публиковаться отдельными образами (короче, бардак).
В нашем примере электронных образов два, мы выбираем более новый (второй). Тут тоже уже появился ряд правок.
Чтобы «собрать» в голове полную инструкцию нужно скачать все документы. Почему в данном случае есть изменения 2, 3, 6, 8 и 9, но нет 1, 4, 5 и 7 — не знаю.
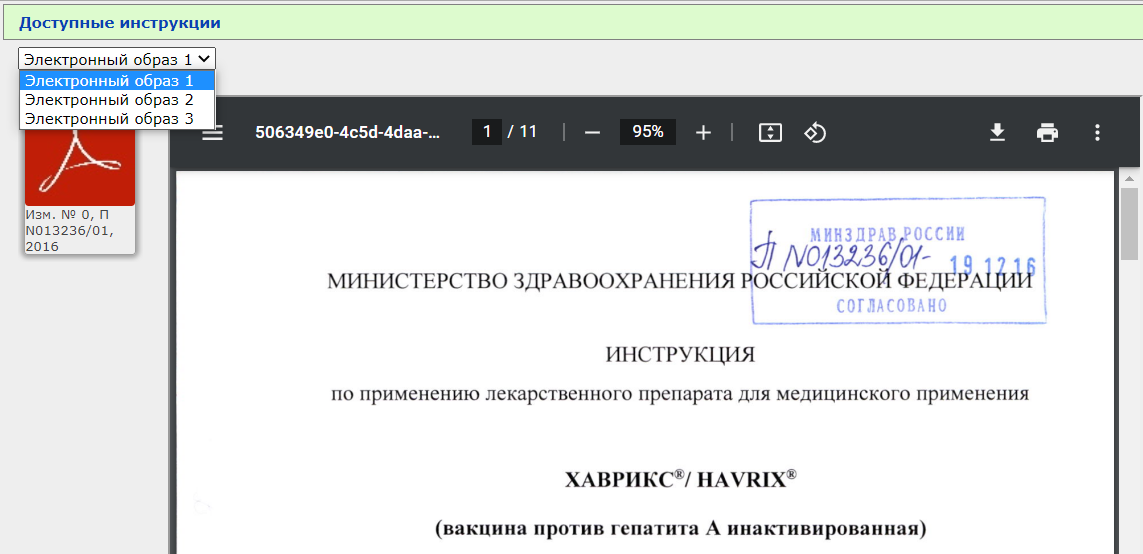
Обычно изменений не так много. Вот, например, для препарата Хаврикс (вакцина против гепатита А) добавлено 3 электронных образа:
- Полная инструкция
- Два дополнения
- еще одно дополнение
Очень не рекомендую пользоваться другими ресурсами с инструкциями. Они могут содержать ошибки, неполные или неактуальные данные. Тут хоть и через жо, но хотя бы точно актуально.
M
Sur.ly
Home
How it Works
Downloads
Help
X
Powered
by SUR.LY
!
Report this website
We got your feedback. Thank you!
Report this website
Adult content
Suspicious activity or malware
Spam or abuse
Other
Share your thoughts with us:
G
T
F
Trust
70
Privacy
70
Child safety
N/A
grls.rosminzdrav.ru
Site Rating
Trust
Privacy
Child safety
N/A
Site Advisor
0 /
0
Alexa Rank
N/A
Daily visitors
3 962
Daily pageviews
19 022
D
U
Recent posts: Sur.ly for WordPress
Sur.ly for WordPress
Sur.ly plugin for WordPress is free of charge.
Sur.ly for Joomla
Sur.ly plugin for Joomla 2.5/3.0 is free of charge.
Sur.ly for Drupal
Sur.ly extension for both major Drupal version is free of charge.
Sur.ly for any website
In case your platform is not in the list yet, we provide Sur.ly Development Kit (SDK) for free, which allows you to implement Sur.ly on any website using PHP 4.3 and newer.
Безопасность лекарственных препаратов
Отмена государственной регистрации лекарственного препарата.
ТромбоМаг®
Регистрационное удостоверение: ЛП-003550 от 01.04.2016г.
Отмена государственной регистрации лекарственного препарата.
Тризенокс
Регистрационное удостоверение: ЛП-004346 от 21.06.2017г.
Отмена государственной регистрации лекарственного препарата.
Никоретте
Регистрационное удостоверение: П N012587/01 от 02.08.2007г.
Отмена государственной регистрации лекарственного препарата.
Гексикон® Д
Регистрационное удостоверение: ЛС-000185 от 19.02.2010г.
Заявителям регистрации и производителям лекарственных препаратов, содержащих в качестве действующего вещества гидроксихлорохин или хлорохин.
Департамент регулирования обращения лекарственных средств и медицинских изделий в связи с письмом ФГБУ «НЦЭСМП» Минздрава России от 01.12.2022 № 27934 сообщает о рекомендации внесения изменений в инструкции по медицинскому применению зарегистрированных в Российской Федерации лекарственных препаратов для медицинского применения, содержащих в качестве действующего вещества гидроксихлорохин или хлорохин, согласно актуальной информации по безопасности применения гидроксихлорохина или хлорохина.
Приложение: письмо ФГБУ «НЦЭСМП» Минздрава России от 01.12.2022 № 27934 на 2 л.

Заявителям регистрации и производителям лекарственных препаратов, относящихся к классу «антибиотик-макролид».
Департамент регулирования обращения лекарственных средств и медицинских изделий в связи с письмом ФГБУ «НЦЭСМП» Минздрава России от 01.12.2022 № 27933 сообщает о рекомендации внесения изменений в инструкции по медицинскому применению, общие характеристики лекарственных препаратов (ОХЛП) зарегистрированных в Российской Федерации лекарственных препаратов для медицинского применения, относящихся к классу «антибиотик-макролид», согласно актуальной информации по безопасности применения макролидных антибиотиков.
Приложение: письмо ФГБУ «НЦЭСМП» Минздрава России от 01.12.2022 № 27933 на 2 л. № 25662 на 1 л.

Отмена государственной регистрации лекарственного препарата.
Энцефабол®
Регистрационное удостоверение: П N013412/02 от 19.09.2011г.
Отмена государственной регистрации лекарственного препарата.
Никоретте
Регистрационное удостоверение: П N012587/01 от 02.08.2007г.
Все публикации раздела «Безопасность ЛП»
Новости

Проведение аттестации экспертов ФГБУ «НЦЭСМП» Минздрава России в соответствии с Порядком определения уровня профессиональной подготовки экспертов федерального государственного бюджетного учреждения по проведению экспертизы лекарственных средств для медицинского применения и аттестации их на право проведения экспертизы лекарственных средств для медицинского применения, утвержденного приказом Минздрава России от 26 августа 2010 г. № 755н, назначено на 15.11.2022 (тестирование) и на 17.11.2022 (собеседование) в 10:00 по московскому времени.
Субъектам обращения лекарственных средств
Министерство здравоохранения Российской Федерации в связи с техническими
работами в Государственном реестре предельных отпускных цен производителей
на лекарственные препараты, включенные в перечень жизненно необходимых
и важнейших лекарственных препаратов, который размещен на официальном сайте
в сети Интернет (http://grls.rosminzdrav.ru), сообщает, что в соответствии с пунктом
16 Особенностей государственного регулирования предельных отпускных цен
производителей на лекарственные препараты, включенные в перечень жизненно
необходимых и важнейших лекарственных препаратов, утвержденных
Постановлением Правительства Российской Федерации от 31.10.2020 № 1771,
и решения Федеральной антимонопольной службы (далее – ФАС России) от
09.09.2022 № ТН/84479/22 о снижении перерегистрированных предельных
отпускных цен производителей на лекарственные препараты, включенные в перечень
жизненно необходимых и важнейших лекарственных препаратов, (копия
прилагается) размещает актуальные сведения о предельных отпускных ценах
на лекарственные препараты, соответствующие Международному непатентованному
наименованию или группировочному (химическому) наименованию Эноксапарин
натрия.

Информация о результатах проведения аттестации уполномоченных лиц производителей биомедицинских клеточных продуктов

Субъектам обращения лекарственных средств
Департамент регулирования обращения лекарственных средств и медицинских изделий Министерства здравоохранения Российской Федерации информирует, что с 01.09.2022 на Едином портале государственных и муниципальных услуг (функций) доступно предоставление следующих государственных услуг:
- по выдаче заключений (разрешительных документов) на ввоз в Российскую Федерацию конкретной партии зарегистрированных и (или) незарегистрированных лекарственных средств, предназначенных для проведения клинических исследований лекарственных препаратов, конкретной партии незарегистрированных лекарственных средств для проведения экспертизы лекарственных средств в целях регистрации и экспертизы лекарственных средств, предназначенных для обращения в Российской Федерации или на общем рынке лекарственных средств в рамках Евразийского экономического союза, осуществления государственной регистрации лекарственных препаратов, включения фармацевтической субстанции в государственный реестр лекарственных средств, конкретной партии незарегистрированных лекарственных средств для оказания медицинской помощи по жизненным показаниям конкретного пациента либо оказания медицинской помощи ограниченному контингенту пациентов с редкой и (или) особо тяжелой патологией;
- по выдаче заключений (разрешительных документов) на ввоз в Российскую Федерацию и вывоз из Российской Федерации биологических материалов, полученных при проведении клинического исследования лекарственного препарата для медицинского применения.
Для получения заключений (разрешительных документов) в форме электронного документа представление документов и сведений заявителем осуществляется в форме электронного документа (пакета электронных документов), подписанного усиленной неквалифицированной электронной подписью.
Услуга оказывается на основании оптимизированного стандарта, разработанного в соответствии с постановлением Правительства Российской Федерации от 30 июля 2021 г. № 1279. Утвержденные оптимизированные стандарты прилагаются.
Письмо о размещённых услугах на ЕПГУ
ОС по выдаче заключений (разрешительных документов) на ввоз в Российскую Федерацию и вывоз из Российской Федерации биологических материалов, полученных при проведении клинического исследования лекарственного препарата для медицинского применения
ОС по выдаче заключений (разрешительных документов) на ввоз в Российскую Федерацию конкретной партии зарегистрированных и (или) незарегистрированных лекарственных средств, предназначенных для проведения клинических исследований лекарственных препаратов, конкретной партии незарегистрированных лекарственных средств для проведения экспертизы лекарственных средств в целях регистрации и экспертизы лекарственных средств, предназначенных для обращения в Российской Федерации или на общем рынке лекарственных средств в рамках Евразийского экономического союза, осуществления государственной регистрации лекарственных препаратов, включения фармацевтической субстанции в государственный реестр лекарственных средств, конкретной партии незарегистрированных лекарственных средств для оказания медицинской помощи по жизненным показаниям конкретного пациента либо оказания медицинской помощи ограниченному контингенту пациентов с редкой и (или) особо тяжелой патологией
ИНФОРМАЦИЯ
В соответствии с Порядком аттестации уполномоченного лица производителя биомедицинского клеточного продукта, требования к уровню образования и квалификации указанного уполномоченного лица и его полномочий по обеспечению качества биомедицинского клеточного продукта, вводимого в обращение, утвержденного приказом Минздрава России
от 29 сентября 2017 г. № 694н «Об утверждении порядка аттестации уполномоченного лица производителя биомедицинского клеточного продукта, требований к уровню образования и квалификации указанного уполномоченного лица и его полномочий по обеспечению качества биомедицинского клеточного продукта, вводимого в обращение»,
14 сентября 2022 года с 10.00 по московскому времени планируется проведение аттестации уполномоченного лица производителя биомедицинского клеточного продукта.
Аттестация будет проводиться Аттестационной комиссией Министерства здравоохранения Российской Федерации по аттестации уполномоченного лица производителя биомедицинского клеточного продукта в помещении Минздрава России, расположенном по адресу: Москва, Успенский переулок, д.10, стр. 1.
Субъектам обращения лекарственных средств
Департамент регулирования обращения лекарственных средств и медицинских изделий Минздрава России сообщает, что 25 августа 2022 года официально опубликовано распоряжение Правительства Российской Федерации от 24 августа 2022 г. № 2419-р, которым внесены изменения в перечень ЖНВЛП, в том числе в части корректировки лекарственных форм, являющихся эквивалентными по отношению к уже включенным лекарственным формам (http://publication.pravo.gov.ru/Document/View/0001202208250043).
Обращаем внимание на необходимость оперативной подачи документов для государственной регистрации предельных отпускных цен производителей на лекарственные препараты, лекарственные формы которых были включены в данное распоряжение.
В отношении лекарственных препаратов, по которым внесены изменения в части написания лекарственных форм или группировочных наименований необходимо подать заявление о внесении изменений в Государственный реестр предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов.
Департамент регулирования обращения лекарственных средств и медицинских изделий направляет для сведений и учета в работе письмо ФГБУ «НЦЭСМП» Минздрава России от 16.03.2021 №5761.

Департамент регулирования обращения лекарственных средств
и медицинских изделий Министерства здравоохранения Российской Федерации
в связи с вступлением в силу постановления Правительства Российской Федерации
от 17.11.2021 №1961 «О внесении изменений в постановление Правительства
Российской Федерации от 3 апреля 2020 г. № 441» (далее – Постановление № 1961),
продлевающего срок действия постановления Правительства Российской Федерации
от 3 апреля 2020 г. № 441 «Об особенностях обращения лекарственных препаратов
для медицинского применения, которые предназначены для применения в условиях
угрозы возникновения, возникновения и ликвидации чрезвычайной ситуации и для
организации оказания медицинской помощи лицам, пострадавшим в результате
чрезвычайных ситуаций, предупреждения чрезвычайных ситуаций, профилактики
и лечения заболеваний, представляющих опасность для окружающих, заболеваний
и поражений, полученных в результате воздействия неблагоприятных химических,
биологических, радиационных факторов» до 01.01.2023, сообщает следующее.
В соответствии с п.2 Постановления №1961 разрешения на временное обращение
серии (партии) лекарственного препарата, не зарегистрированного в Российской
Федерации и разрешенного для медицинского применения на территории
иностранных государств уполномоченными органами соответствующих
иностранных государств, выданные в соответствии с постановлением Правительства
Российской Федерации от 3 апреля 2020г. №441 до дня вступления в силу настоящего
постановления, действительны до 1 января 2023 г. и подлежат замене до 1 января
2022 г. по заявлению юридического лица, действующего в собственных интересах
или уполномоченного представлять интересы другого юридического лица, на имя
которого выдано соответствующее разрешение, представленному в Министерство
здравоохранения Российской Федерации в срок до 20 декабря 2021 г.
В связи с изложенным информируем, что в случае необходимости продления
разрешения на временное обращение необходимо предоставить заявление в форме
письменного обращения в Министерство здравоохранения Российской Федерации
в срок до 20.12.2021.

Департамент государственного регулирования обращения лекарственных средств Министерства здравоохранения Российской Федерации обращает внимание на необходимость в соответствии с пунктом 15 постановления Правительства Российской Федерации от 01.06.2021 № 853 «Об утверждении правил ввоза лекарственных средств для медицинского применения в Российскую Федерацию и признании утратившими силу некоторых актов и отдельных положений некоторых актов Правительства Российской Федерации», организациям, осуществившим ввоз в Российскую Федерацию лекарственных препаратов, предназначенных для оказания медицинской помощи по жизненным показаниям конкретного пациента, а также организациям, осуществившим ввоз не зарегистрированных в Российской Федерации лекарственных препаратов для оказания медицинской помощи ограниченному контингенту пациентов с редкой и (или) особо тяжелой патологией, в течение 10 рабочих дней со дня получения лекарственных препаратов медицинской организацией, в которой оказывается медицинская помощь пациенту, уведомить об этом Министерство здравоохранения Российской Федерации.

Департамент государственного регулирования обращения лекарственных средств Министерства здравоохранения Российской Федерации информирует,
что с 01.09.2021 предоставление государственной услуги по выдаче заключений (разрешительных документов) на ввоз в Российскую Федерацию конкретной партии зарегистрированных и (или) незарегистрированных лекарственных средств, предназначенных для проведения клинических исследований лекарственных препаратов, конкретной партии незарегистрированных лекарственных средств для проведения экспертизы лекарственных средств в целях регистрации и экспертизы лекарственных средств, предназначенных для обращения в Российской Федерации или на общем рынке лекарственных средств в рамках Евразийского экономического союза, осуществления государственной регистрации лекарственных препаратов, включения фармацевтической субстанции в государственный реестр лекарственных средств, конкретной партии незарегистрированных лекарственных средств для оказания медицинской помощи по жизненным показаниям конкретного пациента, осуществляется в форме электронного документа, подписанного усиленной квалифицированной электронной подписью.
Для получения заключений (разрешительных документов) в форме
электронного документа представление документов и сведений заявителем осуществляется в форме электронного документа (пакета электронных
документов), подписанного электронной подписью (простой электронной подписью, либо усиленной квалифицированной электронной подписью, либо усиленной неквалифицированной электронной подписью).

С целью выполнения требований регуляторов в области защиты информации и предотвращения несанкционированного доступа к ресурсам информационной системы «Государственный реестр лекарственных средств для медицинского применения» просим в срок до 12.07.2021 года провести смену пароля для входа всем пользователям Системы.
Все публикации раздела «Новости»
Телефонные номера службы технической поддержки (с 9:00 до 18:00 по Московскому времени): +7(800) 500-30-80 +7(495) 105-99-77
ФРМР аккредитация медицинских работников
ФРМР аккредитация медицинских работников
Как узнать результаты аккредитации — читать.
Начиная с марта 2022 года подавать документы на периодическую аккредитацию дистанционно в электронной форме возможно только через ФРМР.
Как это сделать
1. Войдите в личный кабинет ФРМР
Для этого перейдите на сайт по ссылке: https://lkmr.egisz.rosminzdrav.ru/
На открывшейся странице появится форма аутентификации. Доступ в личный кабинет медицинского работника осуществляется через учетную запись портала «Госуслуги».

Введите свои данные: СНИЛС и пароль.
Если после этого ФРМР не открывается, значит работодатель не внес в систему ваши данные.
2. Подаем заявление
После успешного входа необходимо зайти по ссылке «Аккредитация» вверху страницы:

Появится следующая страница :

Проверяем коректность данных в профессиональной и образовательной частях:

Для подачи заявления жмем на соотвествующую кнопку в правом верхнем углу:

Откроется форма для формирования заявления.
3. Выбераем свою специальность
В пункте «Портфолио» нужно указать уровень образования:
Появится список доступных специальностей:
Необходимо указать только ту, по которой вы проходите аккредитацию.
4. Загрузите дополнительные документы
Если у вас есть ещё информация то можете отправить файлы или написать коментарий:

Необходимо учитывать, что документы они должны быть в формате PDF и их общий вес не должен превышать 25 мб.
5. Отправьте документы в ФАЦ
После того как всё добавлено, ставим галочку на согласии с обработкой персональных данных:

Жмем на верху «Сформировать»:

Будет создан черновой вариант. Если всё верно, то отправляем заявление:

При успешном завершении должно появится соотвествуещее сообщение:
Теперь остается только ждать результатов от аккредитационного центра, который придет на указанную вами электронную почту или сообщением на номер телефона.
Какие могут возникнуть проблемы
Самыми распространёнными являются:
- Ошибки со входом в личный кабинет медицинского работника.
- Работодатель может вовремя не внести информацию в ФРМР, и вы не успеете в срок сдать аккредитацию.
- Могут не сохраняться введённые данные.
Техническая поддержка по проблемам с ФРМР — подробнее
Прохождение аккредитации
Сбор и подача документов на аккредитацию через ФРМР. Добор баллов.
от 15 000 руб.
Специальные предложения по обзорам литературы и статистической обработке
(для статей, кандидатских, докторских, магистерских и PhD диссертаций) для медицинских специалистов из СНГ и ближнего зарубежья!
Инструкция по поиску клинических исследований
Существует два ресурса, чаще всего используемых для поиска клинических исследований, проводимых в Российской Федерации. Первый – официальный реестр Минздрава России www.grls.rosminzdrav.ru». Его преимущество в том, что он на русском языке и содержит список медицинских центров в России, в которых проводится исследование. Второй – www.clinicaltrials.gov– международный реестр клинических исследований Национального института здоровья США. Этот ресурс полезен более подробной и важной информацией об исследованиях как, например, критерии включения, но он ведется на английском языке. Поэтому при поиске клинического исследования мы рекомендуем пользоваться двумя ресурсами параллельно
1. Поиск клинического исследования на сайте grls.rosminzdrav.ru
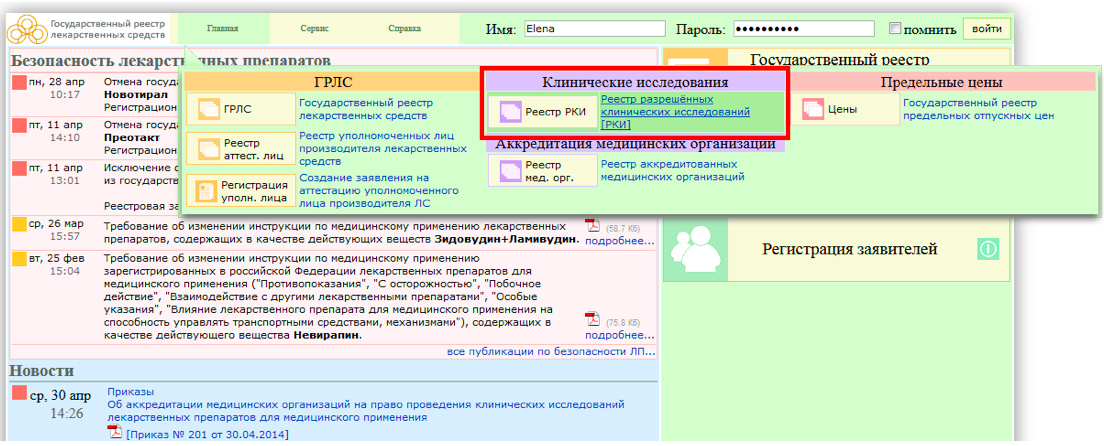
Шаг 1. Зайдите на сайт www.grls.rosminzdrav.ru. Наведите курсор мышки на кнопку «Главная» в верхнем меню сайта. Появится выпадающее меню, где нужно кликнуть на ссылку «Реестр разрешенных клинических исследований», после чего Вы попадете на страницу поиска.
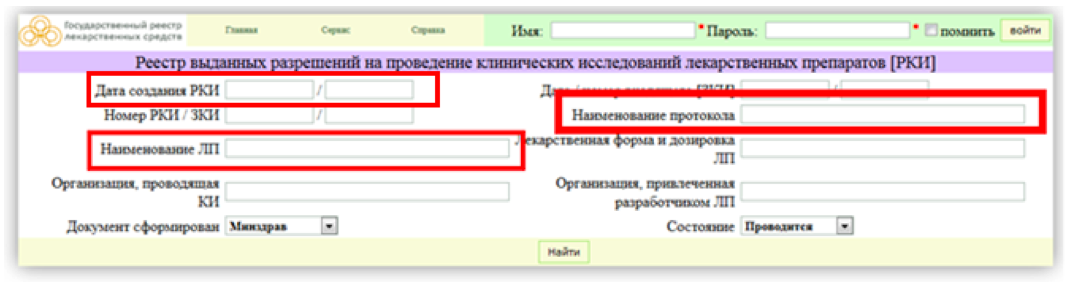
Шаг 2. Основные параметры поиска в «Реестре разрешенных клинических исследований» — «Наименование ЛП» или «Наименование протокола». Это применимо, если Вы знаете данную информацию. Если нет, то мы рекомендуем просмотреть все клинические исследования за последние полгода/год. Для этого введите нужные даты в графу «Дата создания РКИ».
Шаг 3. Если поиск дал результаты и Вам кажется, что Вы нашли подходящее исследование, то следующим шагом нужно попробовать найти информацию о критериях включения, так как это одно из условий того, чтобы стать участником исследования.
Критерии включения – это те характеристики, при соответствии которым пациент может быть принят в клиническое исследование. В числе таких характеристик могут быть пол, возраст, определенное заболевание, стадия и его длительность, особенности предшествующего лечения и пр.
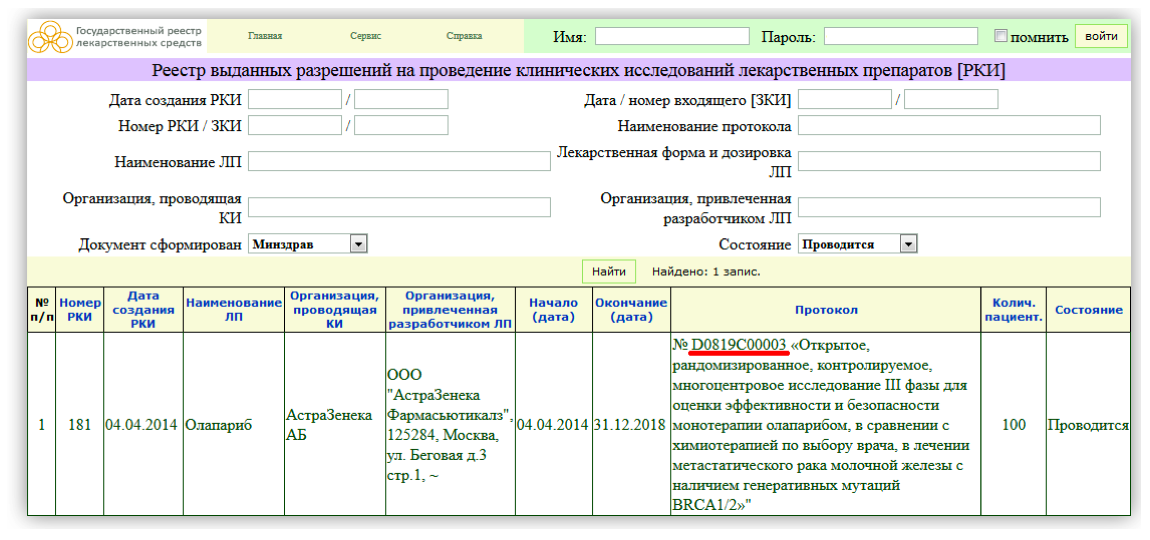
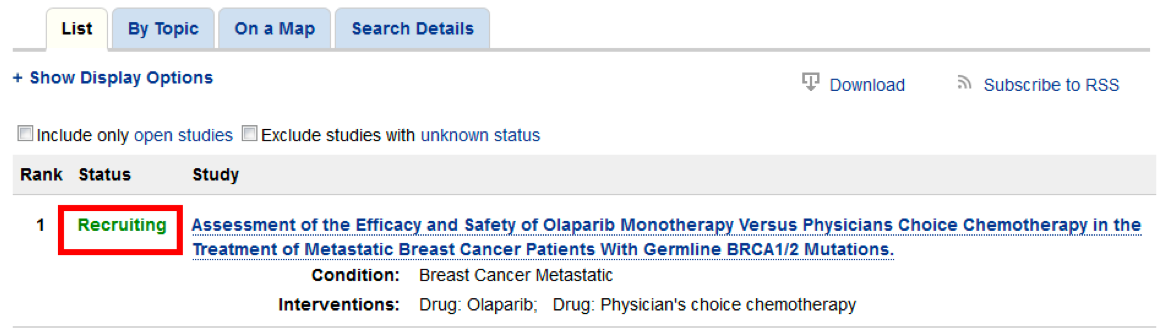
Эту информацию можно попробовать найти на сайте www.clinicaltrials.gov (см. §2), осуществив поиск по номеру протокола, который указан в графе «Протокол» (ниже на рисунке-примере номер протокола подчеркнут красной линией).
Шаг 4. Обратите отдельное внимание на даты проведения исследования, если оно началось давно, набор пациентов, возможно, уже закрыт. В любом случае, уточнить это Вы можете либо в медицинском центре, либо в компании, организующей исследование.
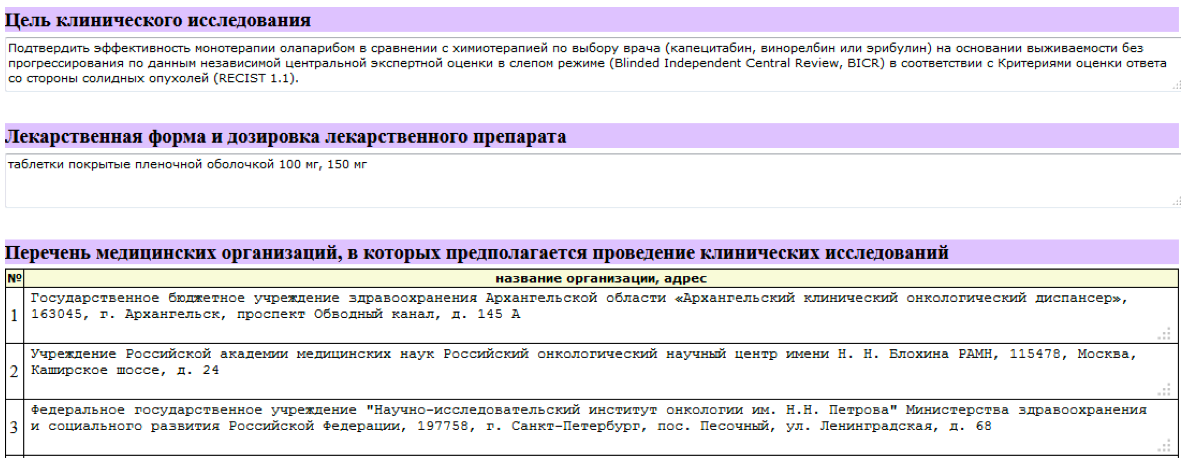
Шаг 5. Кликнув на строку с исследованием, Вы можете посмотреть список медицинских центров, в которых оно проходит, а также цель клинического исследования, лекарственную форму и дозировку препарата.
2. Поиск на сайте www.clinicaltrials.gov
Данный ресурс дает много возможностей поиска, поэтому рекомендуем пробовать варианты поиска по разным параметрам. Со всеми возможностями поиска Вы можете ознакомиться по ссылке http://www.clinicaltrials.gov/ct2/help/how-find/basic
Ниже описан способ поиска исследования по отдельным критериям.
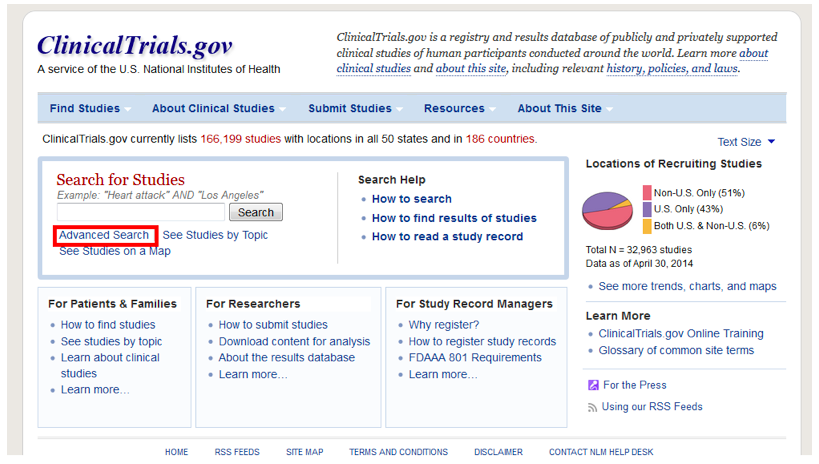
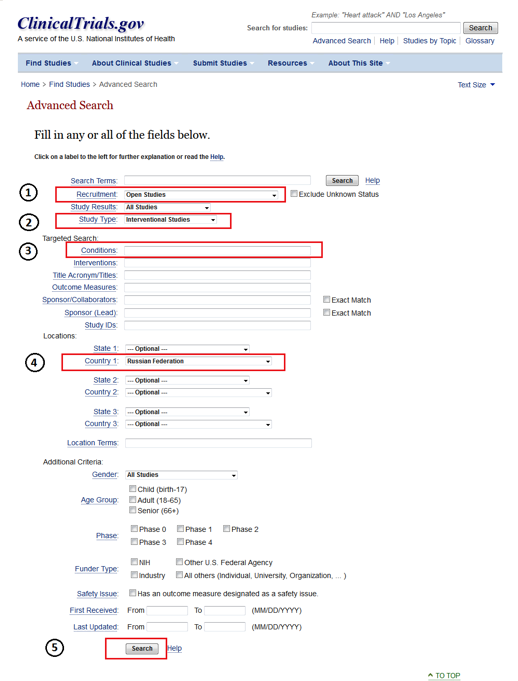
Шаг 1. Зайдите на сайт http://www.clinicaltrials.gov/ и выберете раздел “Advanced search”
Шаг 2. Далее в разделе “Advanced search” укажите следующую информацию:
- Recruitment – выберите Open studies (исследования, в которых в данный момент уже идет набор пациентов, либо он еще не начался, а также программы расширенного доступа);
- Study Type – выберите Interventional Studies;
- Conditions – диагноз на английском языке;
- Country 1 – Russian Federation (Надо отметить, что Российская Федерация не всегда указана в списке стран, поэтому также рекомендуем повторно осуществить поиск, не указывая страну);
- 5. Search – поиск.
Шаг 2. Основные параметры поиска в «Реестре разрешенных клинических исследований» — «Наименование ЛП» или «Наименование протокола». Это применимо, если Вы знаете данную информацию. Если нет, то мы рекомендуем просмотреть все клинические исследования за последние полгода/год. Для этого введите нужные даты в графу «Дата создания РКИ».
Шаг 3. Если поиск дал результаты и Вам кажется, что Вы нашли подходящее исследование, то следующим шагом нужно попробовать найти информацию о критериях включения, так как это одно из условий того, чтобы стать участником исследования.
Критерии включения – это те характеристики, при соответствии которым пациент может быть принят в клиническое исследование. В числе таких характеристик могут быть пол, возраст, определенное заболевание, стадия и его длительность, особенности предшествующего лечения и пр.
Эту информацию можно попробовать найти на сайте www.clinicaltrials.gov (см. §2), осуществив поиск по номеру протокола, который указан в графе «Протокол» (ниже на рисунке-примере номер протокола подчеркнут красной линией).
Шаг 4. Обратите отдельное внимание на даты проведения исследования, если оно началось давно, набор пациентов, возможно, уже закрыт. В любом случае, уточнить это Вы можете либо в медицинском центре, либо в компании, организующей исследование.
Шаг 5. Кликнув на строку с исследованием, Вы можете посмотреть список медицинских центров, в которых оно проходит, а также цель клинического исследования, лекарственную форму и дозировку препарата.
2. Поиск на сайте www.clinicaltrials.gov
Данный ресурс дает много возможностей поиска, поэтому рекомендуем пробовать варианты поиска по разным параметрам. Со всеми возможностями поиска Вы можете ознакомиться по ссылке http://www.clinicaltrials.gov/ct2/help/how-find/basic
Ниже описан способ поиска исследования по отдельным критериям.
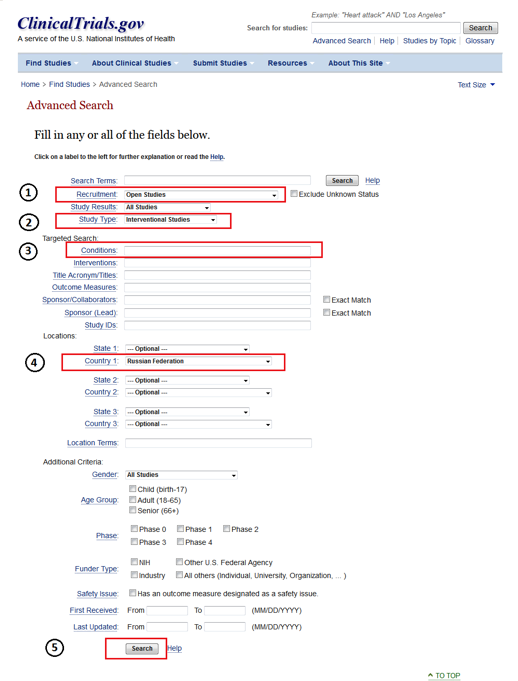
Шаг 1. Зайдите на сайт http://www.clinicaltrials.gov/ и выберете раздел “Advanced search”
Шаг 2. Далее в разделе “Advanced search” укажите следующую информацию:
- Recruitment – выберите Open studies (исследования, в которых в данный момент уже идет набор пациентов, либо он еще не начался, а также программы расширенного доступа);
- Study Type – выберите Interventional Studies;
- Conditions – диагноз на английском языке;
- Country 1 – Russian Federation (Надо отметить, что Российская Федерация не всегда указана в списке стран, поэтому также рекомендуем повторно осуществить поиск, не указывая страну);
- 5. Search – поиск.
Шаг 3. Если поиск дал результаты, Вы увидите список исследований, подходящих под параметры запроса.
Шаг 4. Вы можете ознакомиться с более подробной информацией, кликнув на строчку с интересующем Вас исследованием.
Обратите особое внимание на следующую информацию:
- Purpose – цель исследования;
- Drug — название лекарственного препарата;
- Eligibility – критерии включения в клиническое исследование.
- Other Study ID Numbers – номера протоколов для идентификации в других реестрах, в том числе для поиска в реестре Минздрава России.
Шаг 4. Вы можете ознакомиться с более подробной информацией, кликнув на строчку с интересующем Вас исследованием.
Обратите особое внимание на следующую информацию:
- Purpose – цель исследования;
- Drug — название лекарственного препарата;
- Eligibility – критерии включения в клиническое исследование.
- Other Study ID Numbers – номера протоколов для идентификации в других реестрах, в том числе для поиска в реестре Минздрава России.
Шаг 5. Если Вам кажется, что Вы нашли походящее клиническое исследование, следующим шагом проверьте, идет ли оно в России. Для этого зайдите на сайт www.grls.rosminzrav.ru и попробуйте найти это исследование в реестре Минздрава России – см. §1.
Исследование можно найти по номеру протокола, указанному в строке «Other Study ID Numbers».
Если в этой строке указано более одного номера протокола, попробуйте поочередный поиск.