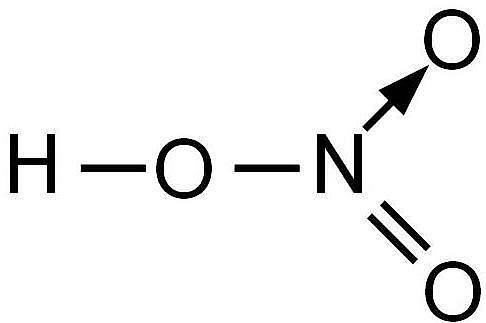
Азотная кислота — одноосновное сильное соединение в форме маслянистой бесцветной жидкости со специфическим запахом. Хорошо растворяется в воде.
Область применения
Применяется в быту для очистки столового серебра и ювелирных серебряных изделий от налета.
Инструкция
Для очистки серебряных изделий с помощью азотной кислоты потребуются дистиллированная вода и стеклянная миска или стакан вместимостью 100-500 мл). Последовательность действий, следующая:
- разбавить азотную кислоту водой до достижения концентрации 30-35% (при приготовлении раствора нужно учитывать размеры серебряных изделий);
- погрузить ювелирные изделия или столовое серебро в раствор и ждать, пока раствор окрасится в голубой (при наличии в изделии меди) или зеленоватый (при присутствии солей железа) цвет;
- после прекращения выделения газа слить раствор в емкость. Изделие промыть дистиллированной водой и просушить.
Внимание! Концентрированная азотная кислота негативно воздействует на кожу и органы зрения. Все работы с ней необходимо проводить в средствах индивидуальной защиты (перчатки, защитные очки, респиратор).
Товары, упоминаемые в статье
Азотная кислота HNO3 — одна из важнейших неорганических кислот. Как ключевой компонент удобрений, она является одним из наиболее часто производимых химических сырьевых материалов в мире. По мнению аналитиков Fortune Business Insights, в ближайшие десятилетия спрос на нее будет продолжать расти.

Азотная кислота — свойства
Самые ранние записи об азотной кислоте относятся к 14 веку и первым смелым алхимическим опытам. В то время она использовалась для получения так называемой королевской воды (aqua regia) — раствора, способного растворять золото и платину. На самом деле, HNO3 обладает высокой коррозионной и химической активностью.
Азотная кислота (V) — это бесцветная жидкость с очень резким запахом и едкими свойствами. При длительном хранении под воздействием температуры меняет цвет на желтый в результате самопроизвольного разложения на оксиды азота и воду. Она легко вступает в реакцию со многими веществами, а при растворении в воде выделяет тепло. Значительная часть реакций с ее участием даже взрывоопасна.
Как сама азотная кислота, так и ее соли являются сильными окислителями. Этот факт объясняет бурную реакцию с металлами, в результате которой выделяется водород. Реакциям с HNO3 также подвержены неактивные металлы и некоторые неметаллы, например сера, фосфор и углерод в форме графита. Последние окисляются с образованием кислот.
Концентрированная азотная кислота представляет собой вещество, очень опасное для здоровья. При попадании на кожу вызывает сильные ожоги и даже некроз. В виде пара она поражает дыхательные пути, вызывая отек и пневмонию. Случайное употребление HNO3 может привести к смерти из-за перфорации желудка или стенки кишечника.
Азотную кислоту можно получить в результате реакции диоксида азота с водой. В коммерческих целях основным методом производства является так называемый процесс Оствальда. Речь идет о каталитическом окислении аммиака до оксида азота, которое с помощью специальных абсорбционных башен позволяет получить концентрированную кислоту HNO3. Для коммерческих целей наиболее желательна концентрация 65-68%.
В лабораторных условиях альтернативным методом производства является реакция нитрата калия с серной кислотой, в результате чего получается чистая азотная кислота (V).
Применение азотной кислоты
В результате нейтрализации азотной кислоты аммиаком образуется нитрат аммония — важнейший компонент минеральных удобрений, используемых во всем мире. Он обеспечивает культурные и декоративные растения азотом, необходимым для роста, в высоких легкоусвояемых дозах. Кроме того, кислоту HNO3 можно использовать в садоводстве для подкисления почвы.
В химической промышленности азотная кислота (V) это в первую очередь прекурсор органических азотных соединений, таких как нитробензолы. В сочетании с ароматическими соединениями он дает вещества, используемые в производстве взрывчатых веществ, такие как тротил (TNT) или нитроглицерин.
Еще одно важное применение — ракетное топливо. Для этого готовят смесь HNO3, тетроксида диазота и перекиси водорода, также известную как красная дымящаяся азотная кислота. Его использование в космической промышленности зависит от возможности эффективного хранения сырья.
Также стоит отметить потенциал азотной кислоты в производстве пластмасс. В результате ее окисления образуется адипиновая кислота, которая используется в производстве синтетических волокон, таких как нейлон.
Другие, более нишевые области применения азотной кислоты (V) включают:
- производство органических красок и лаков;
- фармацевтическую промышленность;
- производство фунгицидов;
- очистку и травление металлических поверхностей;
- аффинаж драгоценных металлов в ювелирной промышленности;
- искусственное старение древесины для получения желаемого оттенка;
- производство чистящих средств для бытового использования;
- обнаружение следов металлов в исследуемых в лаборатории веществах.
Концентрированная азотная кислота и меры предосторожности
Из-за взрывоопасного характера реакций и образующихся смесей, а также исключительной опасности для здоровья, азотная кислота (V) требует особой осторожности при хранении и использовании. В соответствии с правилами ДОПОГ по перевозке опасных грузов, ее следует перевозить в алюминиевых цистернах или автоцистернах с соответствующей маркировкой.
Для хранения азотной кислоты используются специальные резервуары, устойчивые к ее воздействию. Они должны быть надлежащим образом закрыты и храниться вдали от прямых солнечных лучей при температуре ниже 20°C. Рядом не должно быть металлов или легковоспламеняющихся веществ. Само помещение должно хорошо проветриваться.
Концентрированная азотная кислота также требует использования средств индивидуальной защиты при работе с сырьем. Каждый человек, контактирующий с кислотой, обязан носить респиратор, защитные очки, кислотостойкую одежду и перчатки. После работы рекомендуется тщательно вымыть руки и лицо и покрыть кожу барьерным кремом.
Как азотная кислота (V) влияет на окружающую среду?
Случайный выброс кислоты HNO3 в окружающую среду представляет угрозу для людей, животных и растений. Поэтому утечку кислоты в поверхностные и грунтовые воды необходимо предотвращать любой ценой. Возможные разливы должны быть немедленно устранены с помощью абсорбирующих материалов или путем откачки.
Азотная кислота является широко используемым сырьем и играет ключевую роль в производстве удобрений, взрывчатых веществ и синтетических пластмасс. Однако преимущества, связанные с его использованием, не должны перевешивать потенциальные риски. Ответственное соблюдение действующих правил — лучшая форма предотвращения опасных для жизни несчастных случаев.
ХимЭксперт осуществляет оптовые продажи азотной кислоты с возможностью доставки заказываемого химического реагента в различные регионы России. Купить азотную кислоту оптом по видам и концентрации по ценам от производителя возможно в компании Химэксперт. К товару прилагается обязательная сертификация продукции завода изготовителя. Чтобы купить азотную кислоту оптом по безналичному расчёту, свяжитесь с нашим специалистом, или отправьте заявку на электронный адрес компании. Химэксперт предлагает к продаже азотную кислоту разбавленную, концентрированную, химически чистую по ГОСТам. Также в наличии и другие виды химической продукции и химреактивов.
Условия транспортировки и хранения азотной кислоты
Растворы азотной кислоты перевозятся железнодорожным и автомобильным транспортом в соответствии с правилами перевозок опасных грузов, действующими на данном виде транспорта. Цистерны должны быть заполнены не более чем на 90% их вместимости.
Неконцентрированную азотную кислоту хранят в герметичных резервуарах-хранилищах, изготовленных из кислотостойких материалов, на открытых площадках. Неконцентрированную азотную кислоту, упакованную в тару, хранят в крытых складских помещениях при температуре не более 40°С. Не допускается совместное хранение и транспортирование неконцентрированной азотной кислоты с органическими веществами, легковоспламеняющимися и горючими веществами
Применение азотной кислоты
Основным индустриальным направлением, в котором может использоваться данный химикат, является получение его нитратов. И азотная кислота, как производная для их синтеза, востребована в производстве минеральных удобрений, взрывчатых веществ, пиротехники и так далее. Кроме этого, данный реактив может эксплуатироваться в некоторых прикладных отраслях химического производства. В частности, в изготовлении широкой номенклатуры лакокрасочных материалов, лекарственных средств. Востребована, как присадка к реактивному топливу. А также может использоваться, как сырьё для получения широчайшего спектра азотосодержащих химических веществ: анилин, нитроцеллюлоза, алканы и прочие.
В зависимости от концентрации азотная кислота применяется в различных отраслях:
- производство широкого спектра азотных удобрений;
- травление печатных форм в станковой графике;
- подкисление тонирующих растворов при производстве фотографии;
- изготовление лекарственных средств;
- производство отравляющих и взрывчатых веществ;
- производство ракетного топлива;
- растворение, травление, гравировка металлов, гальванизация и многое другое
Азотная кислота. Применение, свойства и характеристики Что такое азотная кислота?
Азотная кислота – это неорганическая сильная кислота. Внешне выглядит, как прозрачная, жидкость с насыщенным желтоватым оттенком. Химическая формула соединения HNO3 Физические свойства азотной кислоты В естественных условиях, будучи помещённой в любой открытый сосуд, азотная кислота создаёт ощущение постоянно дымящей жидкости в силу изобилия исходящих от неё испарений. Вещество превосходно смешивается с водой, по этой причине в технических целях редко используется в чистом виде, чаще применяются водные растворы кислоты. Не растворяет и не взаимодействует со стеклом и фторопластом-4. Температура плавления — 41°С, температура кипения в стандартных условиях +82,6°С, кипение сопровождается некоторым распадом вещества. В результате кристаллизации водных растворов данный химикат способен образовывать кристаллогидраты. Азотная кислота – это тяжёлая жидкость. Обусловлено это повышенной плотностью вещества. Удельный вес кислоты в полтора раза выше аналогичного показателя у воды. Смешивается с другими неорганическими кислотами. Смесь азотной кислоты и серной называется «меланж». Смесь азотной и соляной кислоты в пропорции 1:3 называется «царской водкой», эта смесь обладает уникальными свойствами, в числе которых способность растворять некоторые инертные металлы и прочее.
Химические свойства азотной кислоты
Вещество обладает набором свойств, характерным для своего класса, то есть, азотная кислота взаимодействует с широчайшей номенклатурой соединений и химических элементов. Способна взаимодействовать с основаниями, с солями других кислот, вытесняя при этом более слабые кислоты из образованных ими солей. Обладая свойствами сильного окислителя, реагирует с неметаллами, образовывая кислоты: при реакции с серой образовывает серную кислоту, с фосфором – фосфорную и так далее. Вступает во взаимодействие с органическими веществами, при этом, некоторые из них при такой реакции воспламеняются. Примеры: скипидар, амины и прочие химикаты. Взаимодействие азотной кислоты с металлами — азотная кислота не реагирует с инертными (благородными – золото, платина, тантал и другие) металлами ни будучи в концентрированном виде, ни в водном растворе любой пропорции. С остальными же металлами (их оксидами) данный химикат вступает в классическую реакцию замещения, образовывая соли азотной кислоты – нитраты. Нитраты по-другому называются селитрами и являются одной из наиболее распространённых разновидностей удобрений. Известен также нитрат, образованный при взаимодействии с неметаллом – аммониевая селитра с формулой NH4NO3. Сильные окислительные свойства, присущие азотной кислоте, присущи также и её солям. Селитры, как правило, являются взрывоопасными и горючими веществами, что существенно повлияло на область их применения в производственно-хозяйственных целях.
Получение азотной кислоты
Современный промышленный способ синтеза этого химиката основан на, так называемом, методе Оствальда. Данный метод состоит в окислении синтетического аммиака с применением платино-родиевых катализаторов. На первом этапе образуется окись азота, которая при последующей переработке преобразуется в диоксид азота, трансформирующийся в результате окислительной реакции и насыщении водой в водный раствор азотной кислоты с концентрацией вещества 45-58%.
Виды азотной кислоты и маркировка
Синтезированный реактив в зависимости от условий, в которых он был получен, включает в себя некоторое количество воды, и в дальнейшем может подвергаться обработке с целью придания ему необходимых свойств. Таким образом, различные разновидности этого химиката:
Азотная кислота ХЧ – это водный раствор с концентрацией основного вещества 65%. Химически чистая кислота, применяемая для различных производственных нужд, в том числе, для лабораторной практики, травильных работ и прочих отраслей индустрии. Азотная кислота тех – это водный раствор с концентрацией основного вещества 56%. Азотная кислота ОСЧ – водный раствор с концентрацией основного вещества не менее 70%. Особо чистая кислота с широчайшей областью использования в производстве.
Азотная кислота ЧДА – это водный раствор с концентрацией основного вещества на уровне 57%. Чистая для анализа кислота, применяемая в исследовательских работах и в прочих направлениях хозяйственной деятельности.
Азотная кислота. Класс опасности — 2 основной, 8 — дополнительный
Данный реактив принадлежит к числу опасных химических веществ. Его непосредственное соприкосновение с кожными покровами человеческого тела оставляет на коже сильный химический ожог, незаживающий на протяжении длительного времени. Опасны также и испарения азотной кислоты. При вдыхании они поражают слизистые оболочки органов дыхательной системы. Концентрированная кислота крайне нестабильна по причине повышенной химической активности и в результате распада образовывает отравляющее вещество – диоксид азота, газ бурого цвета, крайне опасный для здоровья человека. Поэтому азотная кислота должна храниться в плотно закупоренных сосудах, при работе с ней необходимо использовать индивидуальные средства защиты. Обязательным является наличие в рабочих помещениях эффективной вентиляционной системы, и соблюдение правил техники безопасности при работе с химикатом.
Стоит отметить, что оперируют двумя ГОСТами при определении класса опасности. Согласно ГОСТу 12.1.007-76 СИСТЕМА СТАНДАРТОВ БЕЗОПАСНОСТИ ТРУДА ВРЕДНЫЕ ВЕЩЕСТВА КЛАССИФИКАЦИЯ И ОБЩИЕ ТРЕБОВАНИЯ БЕЗОПАСНОСТИ, азотная кислота относится ко 2-му классу опасности. Данный ГОСТ распространяется на вредные вещества, содержащиеся в сырье, продуктах, полупродуктах и отходах производства, и устанавливает общие требования безопасности при их производстве, применении и хранении. Стандарт не распространяется на вредные вещества, содержащие радиоактивные и биологические вещества (сложные биологические комплексы, бактерии, микроорганизмы и т.п.). По степени воздействия на организм вредные вещества подразделяют на четыре класса опасности: 1-й — вещества чрезвычайно опасные; 2-й — вещества высокоопасные; 3-й — вещества умеренно опасные; 4-й — вещества малоопасные.
А по ГОСТу 19433-88 азотная кислота относится к 8 классу опасности, стандарт определяет классификацию перевозки опасных грузов (ADR), и распространяется на опасные грузы и устанавливает: классификацию; номенклатуру показателей и критерии для отнесения грузов к опасным и их классификации; методы определения показателей для классификации опасных грузов; маркировку и правила ее нанесения на грузовые единицы с опасными грузами, в том числе поставляемыми на экспорт. Классификация опасных грузов (отнесение к классу, подклассу, категории и группе) производится в зависимости от вида и степени опасности груза. 1.1.2. Установлены следующие классы опасных грузов: класс 1 — взрывчатые материалы (ВМ); класс 2 — газы сжатые, сжиженные и растворенные под давлением; класс 3 — легковоспламеняющиеся жидкости (ЛВЖ); класс 4 — легковоспламеняющиеся твердые вещества (ЛВТ); самовозгорающиеся вещества (СВ); вещества, выделяющие воспламеняющиеся газы при взаимодействии с водой; класс 5 — окисляющие вещества (ОК) и органические пероксиды (ОП); класс 6 — ядовитые вещества (ЯВ) и инфекционные вещества (ИВ); класс 7 — радиоактивные материалы (РМ); класс 8 — едкие и (или) коррозионные вещества (ЕК); класс 9 — прочие опасные вещества.
Азотная кислота – важный, но опасный химический реактив
Химические реактивы, лабораторное оборудование и приборы, 
Современная химия насчитывает огромное количество химических реактивов: щелочи, кислоты, реагенты, соли и другие. Среди них кислоты – самая распространенная группа. Кислоты – это сложные водородосодержащие соединения, атомы которых могут замещаться атомами металла. Сфера их применения обширна. Она охватывает многие отрасли производства: химическую, машиностроительную, нефтеперерабатывающую, пищевую, а также медицину, фармакологию, косметологию; широко используется в быту.
Азотная кислота и ее определение

Форма выпуска азотной кислоты зависит от ее концентрации:
— обычная – 65 %, 68 %;
— дымная – 86 % и более. Цвет «дыма» может быть белым, если концентрация составляет от 86 % до 95 %, или красным – свыше 95 %.
Получение
В настоящее время производство сильно- или слабоконцентрированной азотной кислоты проходит следующие этапы:
1. процесс каталитического окисления синтетического аммиака;
2. как результат – получение смеси нитрозных газов;
3. впитывания воды;
4. процесс концентрирования азотной кислоты.
Хранение и транспортировка
Данный реактив является самой агрессивной кислотой, 
— хранить и перевозить в специальных герметически закрытых резервуарах из хромистой стали или алюминия, а также в бутылях из лабораторного стекла.
— каждая тара помечается надписью «Опасно».
Где применяется химический реактив?
Сфера применения азотной кислоты в настоящее время огромна. Она охватывает многие отрасли промышленности, такие как:
— химическую (изготовление взрывчатых веществ, органических красителей, пластмасс, натрия, калия, пластмасс, некоторых видов кислот, искусственного волокна);
— сельскохозяйственную (производство азотных минеральных удобрений или селитры);
— металлургическую (растворение и травление металлов);
— фармакологическую (входит в состав препаратов по удалению кожных образований);
— ювелирное производство (определение чистоты драгоценных металлов и сплавов);
— военную (входит в состав взрывчатых веществ как нитрующий реагент);
— ракетно-космическую (одна из составляющих ракетного топлива);
— медицину (для прижигания бородавок и других кожных образований).
Меры предосторожности
При работе с азотной кислотой нужно учесть, что данный химический реактив является сильной кислотой, которая относиться к веществам 3 класса опасности. Для сотрудников лабораторий, а также лиц, допущенных к работе с подобными веществами, существуют особые правила. Во избежание прямого контакта с реактивом все работы проводить строго в специальной одежде, которая включает: кислотозащитные рукавицы и обувь, комбинезон, перчатки нитриловые, а также очки и респираторы, как средства защиты органов дыхания и зрения. Несоблюдение данных требований может привести к самым серьезным последствиям: при попадании на кожу – ожогам, язвам, а при попадании в вдыхательные пути – отравлениям, вплоть до отека легких.
Азотная кислота является одной из самых узнаваемых кислот. Это вещество имеет широкий спектр применения, интересные химические свойства и, самое главное, обладает высокой коррозионной активностью. Рассказываем, как производится это вещество и какие опасности могут быть связаны с его использованием.Читать далее →
Содержание:
- Определение
- Химические и физические свойства азотной кислоты
- Производство
- Применение
- Опасность для здоровья
- Хранение
Азотная кислота является одной из самых узнаваемых кислот. Это вещество имеет широкий спектр применения, интересные химические свойства и, самое главное, обладает высокой коррозионной активностью. Рассказываем, как производится это вещество и какие опасности могут быть связаны с его использованием.
Определение
Азотная кислота (лат. acidum nitricum) с химической формулой HNO3 — неорганическое химическое соединение, относящееся к сильнейшим известным оксикислотам. Имеет кислотный остаток в виде нитратной группы, содержащей азот в пятой степени окисления. В концентрированном виде обладает сильным коррозионным действием.
Это интересно! В результате смешивания азотной кислоты с соляной в соотношении 1:3 образуется так называемый царская водка, способная растворять даже драгоценные металлы (даже золото).
В коммерческом применении азотная кислота применяется в виде водного раствора (также отсутствует дымящий эффект, возникающий при концентрации выше 86%).
Химические и физические свойства азотной кислоты
Чистая азотная кислота представляет собой бесцветную жидкость, хорошо растворимую в воде. Имеет резкий и удушающий запах. На открытом воздухе можно заметить легкий коричневый дым, вызванный оксидом азота (IV), который очень ядовит. Поэтому даже кратковременное вдыхание паров азотной кислоты может вызвать раздражение органов дыхания, слезотечение или кашель. Азотная кислота при длительном хранении подвергается частичному разложению и приобретает желтую или коричневую окраску. Такое окрашивание происходит из-за разложения азотной кислоты на оксиды азота и воды. Этот процесс протекает быстрее при наличии света и повышенной температуры.
Концентрированный раствор азотной кислоты химически очень активен. С некоторыми веществами он может реагировать очень бурно. Благодаря вышеперечисленным свойствам он может воспламенять легковоспламеняющиеся материалы. При растворении в воде выделяется большое количество тепла (экзотермическая реакция).
Как сама азотная кислота, так и ее соли обладают сильным окислительным действием. Это заставляет его бурно реагировать с металлами, не вытесняющими водород (медь, серебро). Эта кислота способна растворять даже некоторые неметаллы. Алюминий, хром и железо пассивируются при контакте с концентрированной азотной кислотой.
|
Формула азотной кислоты |
HNO3 |
|
Молярная масса |
63,01 г/моль |
|
Вид |
Прозрачная бесцветная жидкость |
|
Плотность |
1,5129 г/см³ (20 °C) |
|
Кислотность |
−1,4 пК а |
|
Точка кипения |
83 °С |
|
Температура плавления |
−41,6 ° С |
|
Давление газа |
48 мм рт.ст. (20°C) |
Производство
Техническая азотная кислота концентрацией от 52 до 68% производится по методу Оствальда. Вкратце, он заключается в каталитическом окислении аммиака на платиновой или платинородиевой сетке (требуется высокая температура 227°С и высокое давление до 9 атм.). В свою очередь, сам аммиак для целей этого процесса получают путем прямого синтеза водорода и азота (реакция Габера и Боша). Первым образуется оксид азота (II), который окисляется до оксида азота (IV) в присутствии воздуха. Затем полученный таким образом оксид азота подвергают диспропорционированию в воде, в результате чего получают азотную кислоту и азотистую кислоту. Из-за того, что азотистая кислота не обладает высокой стабильностью, происходит ее дальнейшее диспропорционирование.
Водный раствор азотной кислоты окончательно получают перегонкой всего отвара до уровня 68%. Его концентрат можно получить обезвоживанием концентрированной серной кислотой.
Применение
Азотная кислота является важным промежуточным звеном в производстве удобрений и других химических соединений, например, фосфорной кислоты, щавелевой кислоты, коллодия, аминов, красителей или лекарств. Это также сырье для производства взрывчатых веществ, таких как нитроглицерин.
Азотная кислота также используется в:
- производство нитратов, сложных эфиров и нитросоединений (таких как тротил);
- обнаружение белков в ксантопротеиновой реакции (аналитическая химия);
- очистка металлических поверхностей;
- быстрое травление печатных плат;
- производство красителей, лаков, удобрений и пластмасс;
- окисление топлива — в том числе гиперголических ракетных топлив, которые самовозгораются в результате смешения компонентов.
Цены на азотную кислоту обычно колеблются в районе 600 рублей за 1 литр 55-65% водного раствора. Купить азотную кислоту можно в нашем интернет-магазине.
Опасность для здоровья
Как азотная кислота в жидком виде, так и ее пары очень вредны для организма человека. Вдыхание азотной кислоты приводит к отеку и пневмонии. Пролитая на кожу, она вызывает трудно поддающиеся лечению ожоги, которые обычно заканчиваются некрозом. Более обширные ожоги азотной кислотой могут даже привести к коллапсу или шоку и могут представлять серьезную опасность для жизни. Наибольшую опасность вызывает попадание в организм азотной кислоты, что нередко приводит к смерти человека (прожигаются стенки желудка и кишечника).
Хранение
Из-за своих высококоррозийных свойств азотную кислоту следует хранить в соответствующей таре (кислотостойкой) и хранить в хорошо проветриваемых помещениях без доступа света. Следует строго избегать хранения азотной кислоты вблизи легковоспламеняющихся или взрывоопасных материалов.