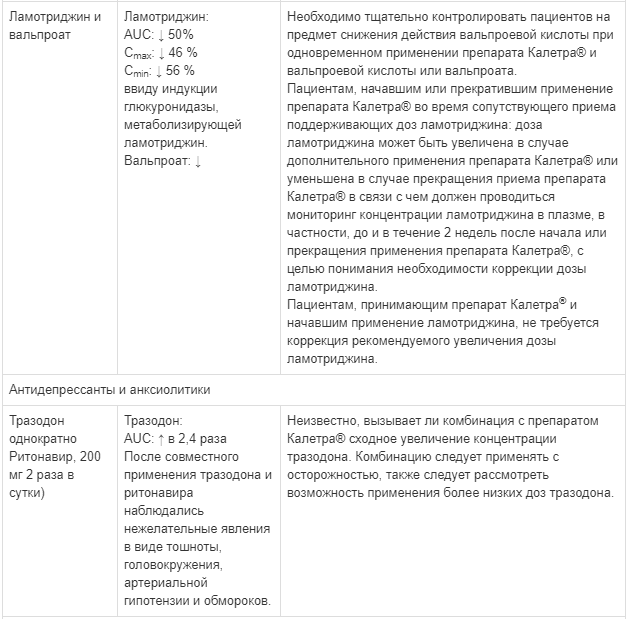
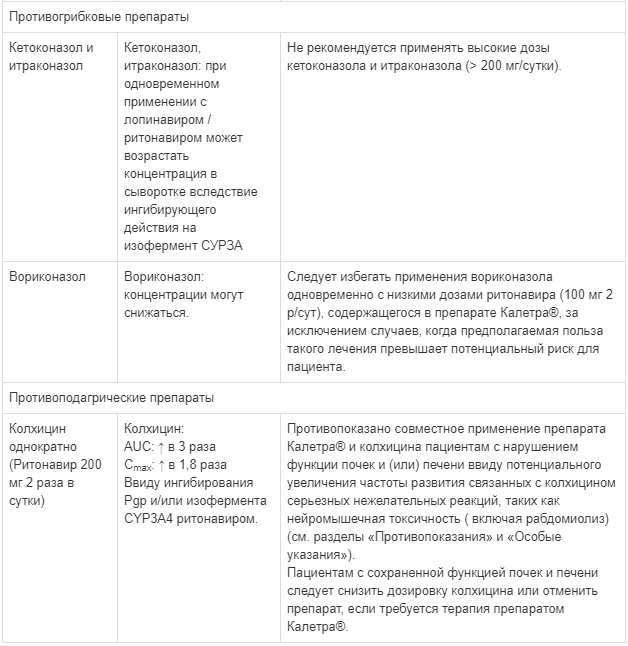
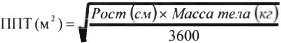Калетра — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-000116
Торговое наименование:
Калетра
Международное непатентованное или группировочное наименование:
Лопинавир + Ритонавир
Лекарственная форма:
Таблетки покрытые пленочной оболочкой
Состав
Каждая таблетка содержит:
Активные вещества
Лопинавир — 100,0 мг, ритонавир — 25,0 мг;
Вспомогательные вещества
Коповидон К 28 — 426,9 мг; сорбитана лаурат — 41,95 мг; кремния диоксид коллоидный — 6,0 мг; второй слой: натрия стеарилфумарат — 6, 15 мг; кремния диоксид коллоидный — 4,0 мг; пленочное покрытие: Опадрай II розовый 85 F 14399 — 15,0 мг (поливиниловый спирт — 40,00 %, титана диоксид — 24,85 %, тальк — 14,80 %, макрогол 3350 — 20,20 %, краситель железа оксид красный Е 172 — 0,15 %).
Описание
Овальные таблетки, покрытые пленочной оболочкой бледно-розового цвета. На одной стороне таблетки выдавлены символы «АС» и
Фармакотерапевтическая группа
Противовирусное (ВИЧ) средство
Код АТХ
J05ARI0
Фармакологические свойства
Фармакодинамика
Препарат Калетра® — это комбинированный препарат, который содержит в своем составе лопинавир и ритонавир.
Лопинавир является ингибитором протеазы ВИЧ-1 и ВИЧ-2 вируса иммунодефицита человека (ВИЧ) и обеспечивает противовирусную активность препарата. Препарат Калетра®, таблетки, покрытые пленочной оболочкой, производится по технологии MELTREX®с использованием вспомогательного вещества коповидон К 28 (от 65 до 75 вес %). Ингибирование ВИЧ протеаз препятствует синтезу белков вируса и предотвращает расщепление полипептида gag-pol, что приводит к образованию незрелого и неспособного к инфицированию вируса.
Влияние на показатели электрокардиограммы
В рандомизированном перекрестном исследовании с контролем по плацебо и активному препарату (моксифлоксацин 400 мг 1 раз в сутки) у 39 здоровых взрослых добровольцев проводилась оценка влияния препарата на интервал QTcF, включавшая 10 измерений в течение 12 ч на 3-й день исследования. Максимальная средняя величина различия в интервале QTcF (верхняя граница 95 % доверительного интервала) по сравнению с группой плацебо, составила 3,6 (6,3) и 13,1 (15,8) для групп, получающих дозу 400/100 мг 2 раза в сутки и дозу, превышающую терапевтическую (800/200 мг 2 раза в сутки) лопинавира/ритонавира соответственно. Удлинение интервала QRS на 6-9,5 мс при приеме высоких доз лопинавира/ритонавира (800/200 мг 2 раза в сутки) способствует удлинению интервала QT. На 3 день приема препаратов этот показатель был примерно в 1,5 раза и 3 раза выше, чем при рекомендованном приеме LPV/r 1 или 2 раза в сутки в равновесном состоянии. Ни у одного из пациентов не наблюдалось увеличения интервала QTcF более чем на 60 мс от исходного значения или интервала QTcF, превышающего потенциально клинически значимый порог 500 мс.
На 3 день того же исследования у испытуемых, получавших лопинавир/ритонавир, также было отмечено умеренное удлинение интервала PR. Среднее изменение интервала PR относительно исходного составляло 11,6-24,4 мс в течение 12-часового интервала после приема дозы. Максимальный интервал PR составил 286 мс, а блокады сердца второй или третьей степени не наблюдалось (см. раздел Особые указания).
Противовирусная активность in vitro
Противовирусная активность лопинавира in vitro против лабораторных штаммов ВИЧ и клинических изолятов ВИЧ была изучена на остро инфицированных лимфобластных клеточных линиях и лимфоцитах периферической крови соответственно. В отсутствие сыворотки крови человека среднее значение IС50 лопинавира в отношении 5 различных лабораторных штаммов ВИЧ-1 составило 19 нМ. В отсутствие и в присутствии 50% сыворотки крови человека среднее значение IC50 лопинавира в отношении ВИЧ-IIIIВ в МТ4-клетках составило 17 нМ и 102 нМ соответственно. В отсутствие сыворотки крови человека среднее значение IC50 лопинавира в отношении нескольких клинических изолятов ВИЧ-1 составило 6,5 нМ.
Резистентность
Выделение резистентных штаммов in vitro
ВИЧ-1 изоляты со сниженной чувствительностью к лопинавиру были выделены in vitro. ВИЧ-1 был пассирован in vitro отдельно с лопинавиром или комбинацией лопинавира с ритонавиром в концентрациях, эквивалентных концентрациям в плазме, наблюдаемым при лечении препаратом Калетра® Генотипический и фенотипический анализ выделенных в этих пассажах вирусов, показывает, что присутствие ритонавира при таком соотношении концентрации не оказывает значительного влияния на выделение резистентных к лопинавиру вирусов.
В целом, изучение in vitro характеристик фенотипичной перекрестной резистентности между лопинавиром и другими ингибиторами протеазы дает основания полагать, что снижение чувствительности к лопинавиру тесно связано со снижением чувствительности к ритонавиру и индинавиру, но не сопряжено со снижением чувствительности к ампренавиру, саквинавиру и нелфинавиру.
Анализ резистентности у пациентов, ранее не получавших антиретровирусную терапию
В клинических исследованиях с ограниченным числом проанализированных штаммов не было отмечено селективной резистентности к лопинавиру у пациентов, ранее не получавших антиретровирусную терапию без выраженной резистентности к ингибиторам протеазы в начале исследования.
Анализ резистентности у пациентов, получавших лечение ингибиторами протеазы (ИП)
Возникновение резистентности к лопинавиру у пациентов, прошедших безуспешно лечение ингибиторами протеазы, изучалось на основе изолятов, выделенных в ходе проспективного наблюдения у 19 пациентов, получавших ингибиторы протеазы, в двух исследованиях II фазы и одном исследовании III фазы. У пациентов наблюдалась неполная супрессия вируса или феномен вирусной отдачи, возобновление симптомов, являющийся результатом первоначального ответа на препарат Калетра» и показавший нарастающую резистентность in vitro между исходным уровнем и отдачей (определяется как возникновение новых мутаций или двукратное изменение фенотипической чувствительности к лопинавиру). Нарастающая резистентность была свойственна пациентам, характеризовавшимся наличием исходных штаммов, претерпевших несколько мутаций при лечении ингибиторами протеазы, при не более чем в 40 раз сниженной изначальной чувствительностью к лопинавиру. Наиболее часто проявляются мутации V82A, 154V и M46I. Также наблюдались мутации L33F, 150V и V321 в сочетании с 147V/A. У 19 штаммов отмечено 4,3-кратное увеличение IC50 по сравнению с исходными штаммами (6,2-43-кратное изменение по сравнению с вирусом дикого типа).
Существует генотипическая корреляция снижения фенотипической чувствительности к лопинавиру у вирусов, выделенных после лечения другими ингибиторами протеазы. Была проведена оценка противовирусной активности лопинавира in vitro в отношении 112 клинических изолятов, выделенных у пациентов, безуспешно прошедших лечение одним или несколькими ингибиторами протеазы. В пределах данной группы следующие мутации в протеазе ВИЧ были связаны со снижением in vitro чувствительности к лопинавиру: L10F/I/R/V, K20M/R, L24I, M46I/L, F53L, I54L/T/V, L63P, А711 L/T/V, V82A/F/T, 184V и L90M. Медиана ЕС50 лопинавира в отношении изолятов с мутациями 0-3, 4-5, 6-7 и 8-10 в вышеуказанных аминокислотных позициях была в 0,8, 2,7, 13,5 и 44,0 раза выше, чем ЕС50 в отношении дикого типа вируса ВИЧ соответственно. Все 16 типов вируса, у которых отмечено повышение чувствительности более чем в 20 раз, имели мутации в позициях 10, 54, 63 и 82 и (или) 84. Кроме того, медиана числа мутаций в аминокислотных позициях 20, 24, 46, 53, 71 и 90 составила 3. Дополнительно к вышеуказанным мутациям, мутации V32I и I47A были отмечены у характеризующихся рецидивами штаммов со сниженной чувствительностью к лопинавиру у пациентов, прошедших лечение ингибиторами протеазы и получающих лечение препаратом Калетра®. У пациентов, принимавших препарат Калетра®, были выявлены мутации I47A и L76V у рецидивирующих штаммов со сниженной чувствительностью к лопинавиру.
Оценка важности отдельных мутаций или наборов мутаций может меняться с получением дополнительных данных. Рекомендуется всегда консультироваться по поводу текущей системы оценки результатов исследований резистентности.
Противовирусная активность препарата Калетра® у пациентов, безуспешно прошедших лечение ингибиторами протеазы
Клиническая значимость снижения чувствительности к лопинавиру in vitro исследовалась методом оценки вирусологического ответа на лечение препаратом Калетра» с учетом исходного вирусного генотипа и фенотипа у 56 пациентов, не получивших положительного эффекта от лечения различными ингибиторами протеазы. ЕС50 лопинавира в отношении 56 исходных вирусных изолятов превысило ЕС50 в отношении дикого типа ВИЧ в 0,6-96 раз. После 48 недель лечения препаратом Калетра® эфавирензом и нуклеозидными ингибиторами обратной транскриптазы уровень в плазме РНК ВИЧ составил ≤ 400 копий/мл у 93 % (25/27), 73 % (11/15), и 25 % (2/8) пациентов с менее чем 10-кратным, 10-40-кратным и более чем 40-кратным снижением чувствительности к лопинавиру соответственно по сравнению с исходным уровнем.
Кроме того, вирусологический ответ наблюдался у 91 % (21/23), 71 % (15/21) и 33 % (2/6) пациентов с 0-5, 6-7 и 8-10 мутациями из вышеуказанного списка мутаций в протеазе ВИЧ, связанными со снижением чувствительности к лопинавиру in vitro. Поскольку эти пациенты ранее не получали лечение лопинавиром/ритонавиром или эфавирензом, частично эффект может быть приписан антивирусной активности эфавиренза, особенно для пациентов с высокорезистентным типом вируса. Исследование не включало контрольную группу пациентов, не получающих лечение препаратом Калетра®.
Перекрестная резистентность
Эффективность других ингибиторов протеазы против штаммов, выработавших нарастающую резистентность к лопинавиру после лечения препаратом Калетра» у принимавших ингибиторы протеазы пациентов: Наличие перекрестной резистентности к другим ингибиторам протеазы была проанализирована у 18 рецидивирующих штаммов, продемонстрировавших повышение резистентности к лопинавиру в течение трех исследований II фазы и одного исследования III фазы по изучению применения препарата Калетра® у пациентов, ранее получавших ингибиторы протеазы. Медиана IC50 лопинавира для этих 18 изолятов в исходном состоянии и при феномене вирусологической отдачи оказалась выше в диапазоне от 6,9 до 63 раз соответственно по сравнению с дикими типами вируса. Как правило, штаммы с вирусологической отдачей либо сохраняют (при исходной перекрестной резистентности), либо развивают существенную перекрестную резистентность к индинавиру, саквинавиру, атазанавиру. Умеренное снижение активности ампренавира было замечено при медиане кратности повышения IC50 от 3,7 до 8 для исходных и рецидивирующих штаммов соответственно. Штаммы сохранили чувствительность к типранавиру с медианой повышения IC50 на исходном уровне и при феномене вирусологической отдачи с кратностью 1,9 и 1,8 соответственно по сравнению с дикими типами вируса. Для получения дополнительной информации по типранавиру, включая генотипические показатели ответа при лечении резистентной к лопинавиру ВИЧ-1 инфекции следует обратиться к инструкции по применению для типранавира.
Фармакокинетика
Фармакокинетику лопинавира в комбинации с ритонавиром изучали у здоровых добровольцев и ВИЧ-инфицированных пациентов; существенных различий между двумя группами не выявили. Лопинавир практически полностью метаболизируется под действием изофермента CYP3A. Ритонавир ингибирует метаболизм лопинавира и вызывает увеличение его концентраций в плазме. При применении лопинавира/ритонавира в дозе 400/100 мг два раза в день средние равновесные концентрации лопинавира в плазме у ВИЧ-инфицированных пациентов в 15-20 раз превышали таковые ритонавира, а концентрация ритонавира в плазме составляла менее 7 % от концентрации при приеме ритонавира в дозе 600 мг два раза в день. ЕС50 лопинавира in vitro примерно в 10 раз ниже таковой ритонавира. Таким образом, противовирусная активность комбинации лопинавира и ритонавира определяется лопинавиром.
Всасывание
В фармакокинетическом исследовании с участием ВИЧ-положительных пациентов при приеме 400/100 мг лопинавира/ритонавира два раза в день совместно с пищей в течение 2 недель определено среднее значение максимальной концентрации лопинавира в плазме (Стах) 12,3 ± 5,4 мкг/мл, отмечающейся спустя приблизительно четыре часа после приема препарата. Средняя равновесная концентрация перед утренней дозой составляла 8,1 ± 5,7 мкг/мл. Площадь под кривой «концентрация-время» (AUC) лопинавира в течение 12 часов после приема препарата составляла в среднем 113,2 ± 60,5 мкг х ч/мл. Абсолютная биодоступность лопинавира в комбинации с ритонавиром в организме человека установлена не была.
Влияние пищи на всасывание при приеме внутрь
Прием однократной дозы 400/100 мг препарата Калетра® в лекарственной форме таблетки после приема пищи (высокой жирности, 872 ккал, из них 56 % поступили с жиром) не приводил к существенным изменениям Сmах и AUCinf по сравнению с приемом натощак. Поэтому препарат Калетра» в лекарственной форме таблетки можно принимать как с пищей, так и без нее.
Распределение
В равновесном состоянии приблизительно 98-99 % лопинавира находятся в связи с белками плазмы. Лопинавир связывается с альфа!-кислым гликопротеином (АКГ) и альбумином, однако, у лопинавира более высокое сродство к АКГ. В равновесном состоянии связывание лопинавира с белками плазмы остается постоянным в диапазоне зарегистрированных концентраций, создающихся после приема 400/100 мг лопинавира/ритонавира два раза в день, и является сопоставимым у здоровых добровольцев и ВИЧ-положительных пациентов.
Метаболизм
В исследованиях in vitro показано, что лопинавир преимущественно подвергается окислительному метаболизму с участием системы цитохрома Р450 гепатоцитов, в основном под воздействием изофермента CYP3A. Ритонавир — мощный ингибитор изофермента CYP3A, который ингибирует метаболизм лопинавира. что обеспечивает увеличение концентраций лопинавира в плазме крови. После однократного приема 400/100 мг лопинавира/ритонавира (с меченым 14С-лопинавиром), 89 % радиоактивности обеспечено исходным лекарственным препаратом. В организме человека было выявлено, по крайней мере, 13 окислительных метаболитов лопинавира. Ритонавир способен индуцировать изоферменты цитохрома Р450, что приводит к индукции его собственного метаболизма. В ходе длительного применения концентрации лопинавира перед приемом следующей дозы снижались со временем, стабилизируясь приблизительно через 10-14 дней.
Выведение
После приема 400/100 мг 14С-лопинавира/ритонавира через восемь дней приблизительно 10,4 ± 2,3 % и 82,6 ± 2,5 % от принятой дозы 14С-лопинавира обнаруживаются в моче и кале соответственно. При этом 2,2% и 19,8% от принятой дозы неизмененного лопинавира обнаруживаются в моче и кале соответственно. После длительного применения менее 3 % дозы лопинавира экскретируется в неизмененном виде через почки. Эффективный период полувыведения составляет в среднем 5-6 часов. Клиренс (CL/F) лопинавира при приеме внутрь составляет от 6 до 7 л/ч.
Прием один раз в день
Фармакокинетика лопинавира/ритонавира с кратностью приема один раз в день была оценена у ВИЧ-инфицированных пациентов, не получавших ранее антиретровирусную терапию. Лопинавир/ритонавир 800/200 мг применялся в комбинации с эмтрицитабином 200 мг и тенофовиром 300 мг один раз в день ежедневно. При длительном приеме 800/200 мг лопинавира/ритонавира один раз в день в течение 2 недель во время приема пищи средняя максимальная концентрация лопинавира в плазме (Сmах) составила 14,8 ± 3,5 мкг/мл и достигалась приблизительно через 6 часов после приема. Средняя равновесная концентрация лопинавира перед приемом утренней дозы составляла 5,5 ± 5,4 мкг/мл. AUC лопинавира при 24 часовом интервале приема составляла в среднем 206,5 ± 89,7 мкг ч/мл. При применении 1 раз в сутки происходит снижение Cmin/Ctrough на 50% по сравнению с режимом дозирования 2 раза в сутки.
Особые группы пациентов
Дети
Данные о фармакокинетике у детей в возрасте до 2 лет ограничены.
Была изучена фармакокинетика при приеме таблеток лопинавира/ритонавира 100/25 мг дважды в день, с режимом дозирования на основании массы тела без невирапина у 53 детей. Среднее значение лопинавира в равновесном состоянии AUC, Сmах и С12 составило 112,5 ± 37,1 мкг*ч / мл, 12,4 ± 3,5 мкг/мл и 5,71 ± 2,99 мкг/мл, соответственно.
Прием два раза в день с дозированием на основании массы тела без невирапина обеспечивает концентрацию лопинавира в плазме равную полученным данным у взрослых пациентов, принимавших 400/100 мг два раза в день без невирапина.
Пол, раса и возраст
Фармакокинетика лопинавира не была изучена у пожилых пациентов. Никаких зависящих от пола фармакокинетических различий у взрослых пациентов не наблюдалось. Никаких клинически значимых фармакокинетических различий, зависящих от расы, не установлено.
Беременность и послеродовой период
В открытом фармакокинетическом исследовании 12 ВИЧ-инфицированных беременных женщин, с менее 20 неделями беременности принимавших комбинированную антиретровирусную терапию первоначально получали лопинавир/ритонавир 400 мг / 100 мг (две таблетки 200/50 мг) два раза в день до гестационного возраста 30 недель. В 30 недель гестации доза была увеличена до 500/125 мг (две таблетки по 200/50 мг плюс одна таблетка по 100/25 мг) два раза в день, до того момента пока, не наступил период 2 недели до родов. Концентрации лопинавира в плазме крови измеряли в течение четырех 12-часовых периодов во втором триместре (20-24 недели беременности), третьем триместре до увеличения дозы (30 недель беременности), третьем триместре после увеличения дозы (32 недели беременности) и через 8 недель после родов. Увеличение дозы не привело к значительному увеличению концентрации лопинавира в плазме.
В другом открытом фармакокинетическом исследовании 19 ВИЧ-инфицированных беременных женщин получали лопинавир/ритонавир по 400/100 мг дважды в день в рамках комбинированной антиретровирусной терапии во время беременности и до зачатия. Для фармакокинетического анализа общего и несвязанного уровней концентрации лопинавира в плазме крови была собрана серия проб крови: в течение 12 часов в триместре 2 и триместре 3, при рождении и 4-6 недель после родов (у женщин, продолжавших лечение после родов). Фармакокинетические данные, полученные у ВИЧ-1-инфицированных беременных женщин, получающих таблетки, покрытые пленочной оболочкой, 400/100 мг лопинавир/ритонавир два раза в день, представлены в таблице ниже:
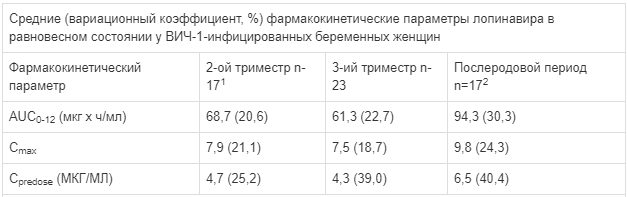
1- n=18 для Сmах
2 — n = 16 для Cpredose
Почечная недостаточность
Фармакокинетика лопинавира не была изучена у пациентов с почечной недостаточностью; однако, так как почечный клиренс лопинавира незначителен, снижения общего клиренса у пациентов с почечной недостаточностью не ожидается.
Печеночная недостаточность
В ходе сравнительного исследования фармакокинетические показатели лопинавира у ВИЧ-инфицированных пациентов с легкой и средней степенью печеночной недостаточности сравнивали с таковыми у ВИЧ-инфицированных пациентов с нормальной функцией печени при многократном применении лопинавира/ритонавира 400/100 мг дважды в сутки. Наблюдалось ограниченное увеличение общей концентрации лопинавира приблизительно на 30 %, что, предположительно, не имеет клинического значения.
Показания к применению
Лечение ВИЧ-инфекции у взрослых и детей от 3-х лет в составе комбинированной терапии.
Противопоказания
С осторожностью
Вирусный гепатит В и С.
Цирроз печени.
- Легкая и средней степени тяжести печеночная недостаточность.
Повышение активности «печеночных» ферментов.
Панкреатит.
Гемофилия А и В.
Дислипидемия (гиперхолестеринемия, гипертриглицеридемия).
Пожилой возраст (старше 65 лет). - Пациенты с органическими заболеваниями сердца, пациенты с расстройствами проводящей системы сердца в анамнезе или пациенты, принимающие препараты. удлиняющие интервал PR (такие как верапамил и атазанавир).
- Совместное применение не рекомендуется со следующими препаратами (см. разделы «Особые указания» и «Взаимодействие с другими лекарственными средствами»):
аторвастатин;
тадалафил (для лечения легочной гипертензии);
риоцигуат;
ворапаксар:
фузидовая кислота при костно-суставных инфекциях;
салметерол;
ривароксабан;
рифампицин;
флутиказон или другие глюкокортикоиды. которые метаболизируются СУРЗА4 (такие как будесонид и триамцинолон);
фосампренавир, фосампренавир/ритонавир;
типранавир/ритонавир;
кетоконазол (высокие дозы > 200 мг в день);
итраконазол (высокие дозы> 200 мг в день);
боцепревир;
симепревир;
телапревир.
Следует избегать совместного применения со следующими препаратами (см. разделы «Особые указания» и «Взаимодействие с другими лекарственными средствами»):
бедаквилин;
вориконазол;
ибрутиниб. - Следует применять с осторожностью со следующими препаратами (см. разделы «Особые указания» и «Взаимодействие с другими лекарственными средствами»):
дигоксин;
бепридил;
лидокаин;
хинидин;
кларитромицин;
эритромицин;
хлорфенирамин;
афатиниб;
церитиниб;
фенитоин;
карбамазепин;
фенобарбитал;
тразодон;
мидазолам (для парентерального введения);
силденафил, тадалафил (для лечения эректильной дисфункции);
розувастатин;
бозентан.
Применение при беременности и в период грудного вскармливания
Беременность
Как правило, при принятии решения использовать антиретровирусные препараты для лечения ВИЧ-инфекции у беременных женщин и, следовательно, для снижения риска вертикальной передачи ВИЧ новорожденному, необходимо учитывать данные исследований на животных, а также клинический опыт применения у беременных женщин для оценки безопасности и рисков для плода.
Лопинавир/ритонавир был изучен с участием 3000 беременных женщин, в том числе с участием более 1000 в течение первого триместра.
В пострегистрационном наблюдении при анализе Регистра по применению антиретровирусных препаратов во время беременности, утвержденном с января 1989 года, повышенный риск развития врожденных дефектов на фоне приема препарата Калетра® не был зарегистрирован среди более 1000 женщин, получавших препарат в течение первого триместра. Распространенность врожденных дефектов после применения лопинавира в течение любого триместра сравнима с распространенностью, наблюдаемой среди населения в целом. Не наблюдалось ни одной закономерности, указывающей на общую этиологию врожденных дефектов. В ходе исследований токсичности на животных было установлено токсическое воздействие на репродуктивную функцию. Основываясь на данных, указанных выше, такой риск маловероятен у людей. Применение лопинавира при беременности возможно только в том случае, когда предполагаемая польза для матери превосходит потенциальный риск для плода.
Период грудного вскармливания
В исследованиях на крысах показано, что лопинавир проникает в грудное молоко. Данные о выведении данного лекарственного препарата с женским молоком отсутствуют. ВИЧ-инфицированным женщинам не следует кормить грудью детей, чтобы избежать передачи ВИЧ-инфекции.
Фертильность
Исследования на животных не показали влияния препарата на фертильность. Данных касательно влияния лопинавира/ритонавира на фертильность у человека нет.
Способ применения и дозы
Внутрь, независимо от приема пищи. Таблетки препарата Калетра® следует проглатывать целиком, не разжевывая, не разламывая или измельчая.
Взрослые
Рекомендуемая пероральная доза препарата Калетра® составляет:
- По четыре таблетки препарата Калетра» 100/25 мг (400/100 мг) два раза в день независимо от приема пищи.
- По восемь таблеток препарата Калетра» 100/25 мг (800/200 мг) один раз в день независимо от приема пищи для пациентов, у которых выявлено менее 3-х мутаций, связанных с развитием резистентности к лопинавиру. Недостаточно данных для применения лопинавира/ритонавира один раз в день у взрослых пациентов с 3-мя и более мутациями, связанными с развитием резистентности к лопинавиру.
Сопутствующая терапия
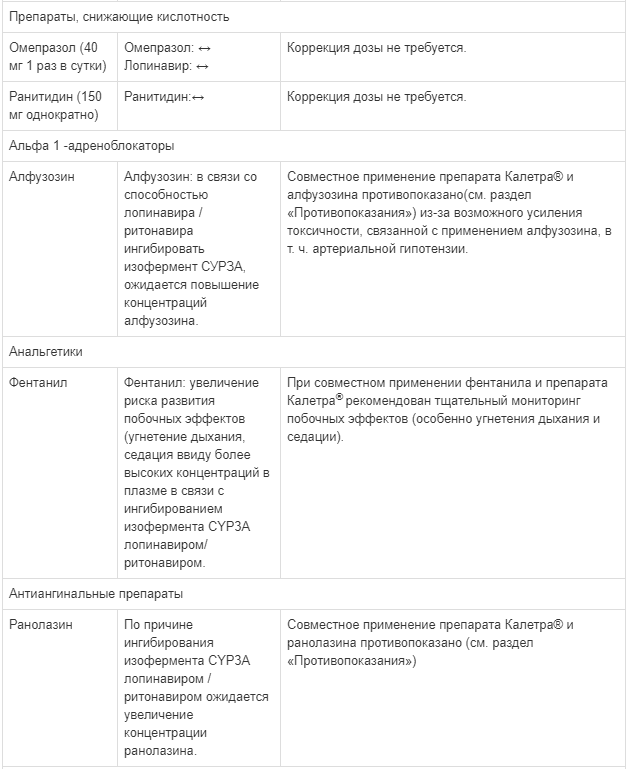
Применение таблеток препарата Калетра» в сочетании с омепразолом и ранитидином не требует коррекции дозы.
У пациентов с подозреваемой пониженной чувствительностью к лопинавиру (показанной клинически или лабораторно), получавших ранее антиретровирусную терапию, в сочетании с эфавирензом, невирапином, ампренавиром или нелфинавиром необходимо увеличить дозу таблеток препарата Калетра» до 500/125 мг (5 таблеток по 100/25 мг) 2 раза в день. При одновременном применении с данными препаратами таблетки препарата Калетра® не следует назначать 1 раз в день.
Дети
Применение препарата Калетра» один раз в день пациентами детского возраста противопоказано.
Взрослая доза таблеток препарата Калетра» (400/100 мг дважды в день) без одновременного применения эфавиренза, невирапина, нелфинавира или ампренавира может применяться у детей с массой тела 35 кг и более или с площадью поверхности тела (ППТ) 1,4 м2 и более. Для определения дозы для детей с массой тела менее 35 кг или с ППТ от 0,6 до 1,4 м2 рекомендуется использовать приведенные ниже таблицы.
Для детей с ППТ менее 0,6 м2 или для детей младше 3-х лет существует раствор препарата Калетра® для приема внутрь.
Таблицы 1 и 2 содержат руководства по дозированию таблеток Калетра® препарата 100/25 мг, основанные на ППТ.
Таблица № 1
|
Принципы дозирования для детей, основанные на ППТ, без одновременного применения эфавиренза, невирапина, нелфинавира или ампренавира |
|
|
Площадь поверхности тела* (м2) |
Рекомендуемое количество таблеток по 100/25 мг при приеме два раза в день |
|
≥ 0,6 до <0,9 |
2 таблетки (200/50 мг) |
|
≥ 0,9 до <1,4 |
3 таблетки (300/75 мг) |
|
≥ 1,4 |
4 таблетки (400/100 мг) |
* Площадь поверхности тела может быть рассчитана по следующей формуле:
Таблица № 2
|
Принципы дозирования для детей, основанные на ППТ, при одновременном применении с препаратами эфавиренз, невирапин, нелфинавир или ампренавир |
|
|
Площадь поверхности тела (м2) |
Рекомендуемое количество таблеток по 100/25 мг при приеме два раза в день |
|
≥ 0,6 до 0,8 |
2 таблетки (200/50 мг) |
|
≥ 0,8 до 1,2 |
3 таблетки (300/75 мг) |
|
≥ 1,2 до 1,7 |
4 таблетки (400/100 мг) |
|
≥ 1,7 |
5 таблеток (500/125 мг) |
Таблицы № 3 и 4 содержат руководства по дозированию таблеток препарата Калетра® 100/25 мг по массе тела.
Таблица № 3
|
Принципы дозирования для детей по массе тела, без одновременного применения препаратов эфавиренз, невирапин, нелфинавир или ампренавир |
|
|
Масса тела (кг) |
Количество таблеток 100/25 мг для приема два раза в день |
|
От 7 до <15 кг |
Прием таблеток не рекомендуется. Следует применять раствор для приема внутрь. |
|
От 15 до 25 кг |
2 |
|
> 25 до 35 кг |
3 |
|
> 35 кг |
4# |
# Альтернативно, пациентам, которые могут проглотить большую таблетку, можно применять две таблетки 200/50 мг.
Таблица № 4
|
Принципы дозирования для детей по массе тела, при одновременном применении препаратов эфавиренз, невирапин, нелфинавир или ампренавир |
|
|
Масса тела (кг) |
Количество таблеток 100/25 мг для приема два раза в день |
|
От 7 до <15 кг |
Прием таблеток не рекомендуется. Следует применять раствор для приема внутрь. |
|
От 15 до 20 кг |
2 |
|
> 20 до 30 кг |
3 |
|
> 30 до 45 кг |
4# |
|
> 45 кг |
5 |
# Альтернативно, пациентам, которые могут проглотить большую таблетку, можно применять две таблетки 200/50 мг.
Применение во время беременности и в послеродовом периоде
По данным ряда клинических исследований не требуется коррекции дозы препарата Калетра» во время беременности и в послеродовой период. Применение препарата один раз в день противопоказано у беременных женщин в связи с недостаточностью фармакокинетических и клинических данных.
Побочное действие
Краткий обзор профиля безопасности
Безопасность препарата Калетра® была изучена у более чем 2600 пациентов в клинических исследованиях П-IV фазы, из которых более 700 пациентов получали дозу 800/200 мг (6 капсул или 4 таблетки) 1 раз в сутки. Наряду с нуклеозидными ингибиторами обратной транскриптазы (НИОТ), в некоторых исследованиях препарат Калетра® назначался в сочетании с эфавирензом или невирапином.
Наиболее частыми нежелательными реакциями, связанными с лечением препаратом Калетра® во время клинических испытаний, были диарея, тошнота, рвота, гипертриглицеридемия и гиперхолестеринемия. При приеме препарата Калетра» 1 раз в сутки может быть повышен риск диареи. Диарея, тошнота и рвота могут возникать в начале лечения, в то время как гипертриглицеридемия и гиперхолестеринемия могут развиться позднее. Проявление нежелательных явлений привело к преждевременному прекращению лечения у 7 % пациентов в исследованиях II-IV фазы.
Важно отметить, что случаи панкреатита были зарегистрированы у пациентов, получающих препарат Калетра®, включая пациентов, у которых развилась гипертриглицеридемия. Кроме того, были зарегистрированы редкие случаи увеличения интервала PR в ходе лечения препаратом Калетра» (см. раздел «Особые указания»).
Перечень нежелательных реакций
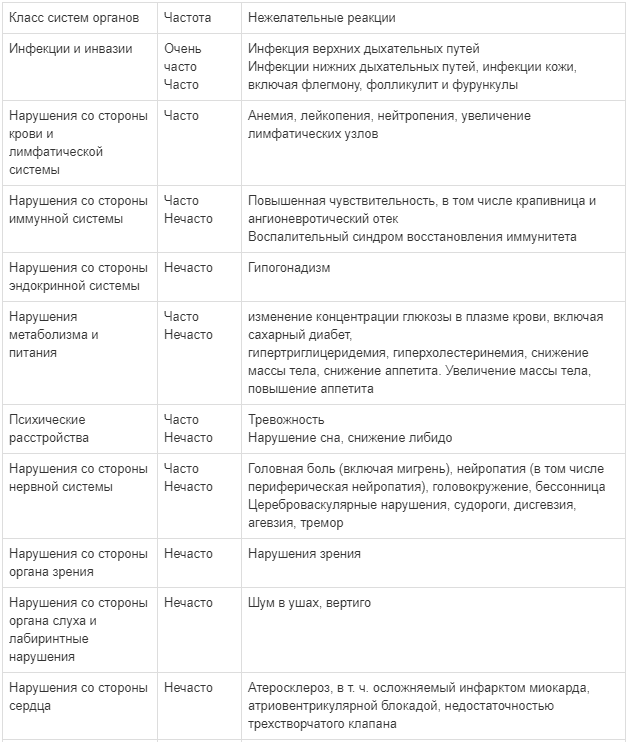
Нежелательные реакции, обнаруженные в ходе клинических исследований и периода пострегистрационного наблюдения у взрослых пациентов и детей:
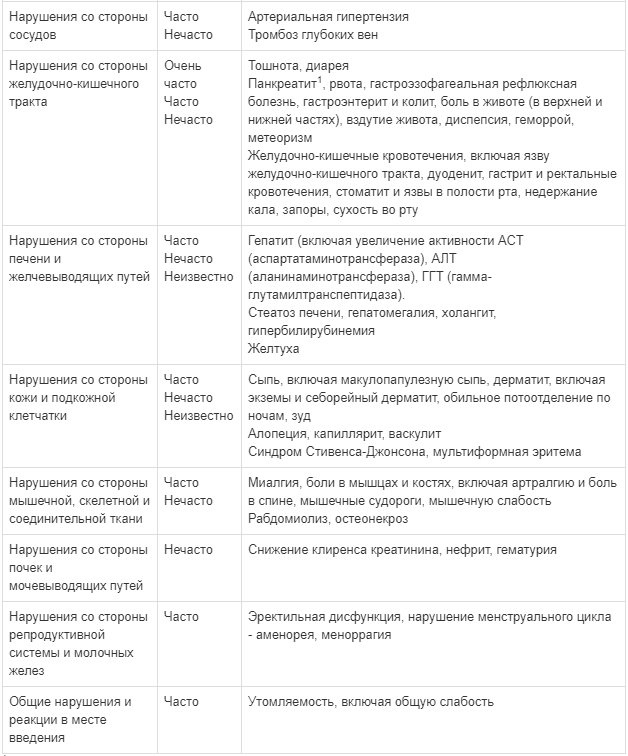
Следующие нежелательные явления были определены в качестве побочных действий. В категории, выделенные по частоте проявления, включены все сообщаемые нежелательные реакции от умеренных до тяжелых, независимо от индивидуальной оценки причинно-следственной связи. Побочные действия приводятся с разбиением по классам систем органов. По частоте проявления побочные действия представлены в порядке убывания серьезности: очень часто (≥ 1/10); часто (≥ 1/100 до < 1/10); нечасто (≥ 1/1000 до < 1/100): неизвестно (оценка не может быть проведена по имеющимся данным).Побочные действия, частота проявления которых неизвестна, были выявлены с помощью пострегистрационного наблюдения.
Таблица 1
Побочные действия, выявленные по данным клинических исследований и в период пострегистрационного наблюдения у взрослых пациентов

Описание отдельных нежелательных реакций
Сообщалось о развитии синдрома Иценко-Кушинга у пациентов, получавших ритонавир совместно с флутиказона пропионатом в виде ингаляций или интраназально; такие явления могут наблюдаться и при использовании других глюкокортикостероидов, метаболизм которых осуществляется по пути Р450 ЗА, например, будесонида (см. раздел «Особые указания» и «Взаимодействие с другими лекарственными средствами»).
Повышение уровня креатинфосфокиназы (КФК), миалгия, миозит и редко рабдомиолиз были зарегистрированы с ингибиторами протеазы, особенно в сочетании с ингибиторами нуклеозидными ингибиторами обратной транскриптазы.
Показатели обмена веществ
Во время антиретровирусной терапии может возрастать масса тела и концентрация липидов и глюкозы крови (см. раздел «Особые указания»).
У ВИЧ-инфицированных пациентов с тяжелым иммунодефицитом на момент начала комбинированной антиретровирусной терапии (КАРТ) может развиваться воспалительная реакция на бессимптомные или остаточные оппортунистические инфекции. Также сообщается об аутоиммунных нарушениях (например, болезни Грейвса). Однако время до наступления таких нарушений варьирует, и они могут развиться много месяцев спустя после начала лечения (см. раздел «Особые указания»).
Поступали сообщения о случаях остеонекроза, особенно у пациентов с общепризнанными факторами риска, ВИЧ-инфекцией поздней стадии и продолжительной комбинированной антиретровирусной терапией (КАРТ). Частота развития остеонекроза не установлена (см. раздел «Особые указания»).
Применение у детей
У детей в возрасте 3 лет и старше профиль безопасности аналогичен профилю, наблюдаемому у взрослых (см. таблицу I выше).
Передозировка
В настоящее время клинический опыт острой передозировки лопинавиром/ритонавиром у людей ограничен. Специального антидота не существует. Лечение должно включать общую поддерживающую терапию, включая контроль основных показателей жизнедеятельности и наблюдение за клиническим статусом пациента. При необходимости удаляют неабсорбированный лекарственный препарат с помощью промывания желудка и назначают активированный уголь. Так как лопинавир/ритонавир в высокой степени связывается с белками плазмы крови, то применение диализа нецелесообразно.
Взаимодействие с другими лекарственными средствами
Препарат Калетра® содержит лопинавир и ритонавир. являющиеся ингибиторами изофермента СУРЗА цитохрома Р450 in vitro. Совместное применение препарата Калетра® и других лекарственных средств, преимущественно метаболизируемых изоферментом СУРЗА, может привести к повышению концентрации в плазме данных лекарственных средств, и, как следствие, к усилению или продлению их терапевтического эффекта и нежелательных реакций. Препарат Калетра® не ингибирует изоферменты CYP2D6. СУР2С9. СУР2С19, CYP2E1, СУР2В6 или СУР1А2 в клинически значимых концентрациях (см. раздел «Противопоказания»).
Было показано. что препарат Калетра® индуцирует свой собственный метаболизм in vivo и увеличивает биотрансформацию некоторых препаратов, метаболизирующихся ферментами цитохрома Р450 (включая изоферменты СУР2С9 и СУР2С19) и путем глюкуронизации. Это может привести к снижению концентрации препарата в плазме и вероятному снижению эффективности назначаемых совместно лекарственных средств.
Лекарственные препараты, которые противопоказаны в связи с ожидаемым увеличением взаимодействия и потенциальным развитием серьезных побочных эффектов, перечислены в разделе «Противопоказания».
Все исследования взаимодействий, если не сказано иное, проводили с применением капсул препарата Калетра®. прием которых приводил к системному воздействию лопинавира. приблизительно на 20 % более низкому. чем при применении таблеток в дозировке 200/50 мг.
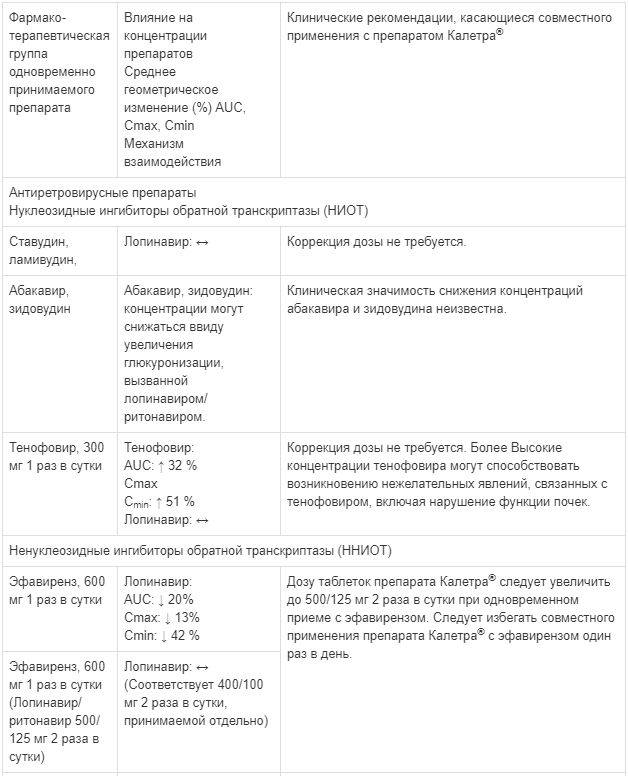
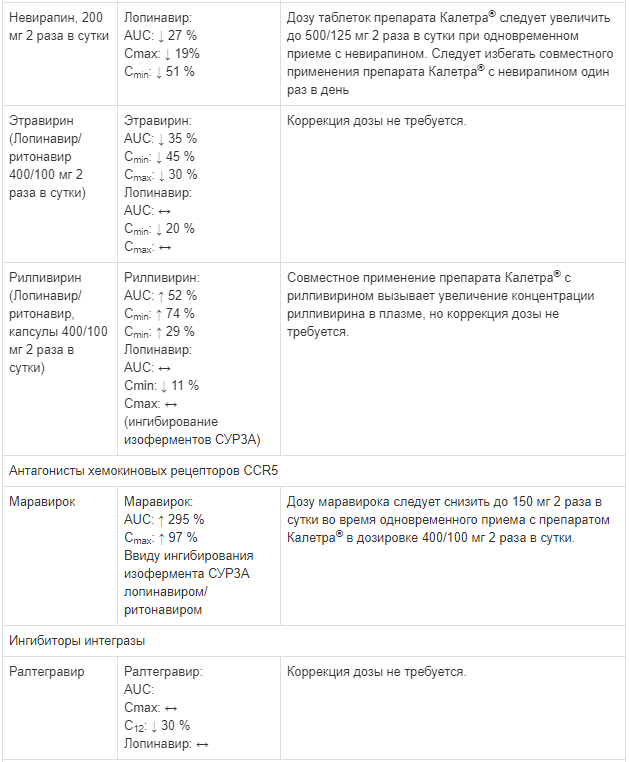
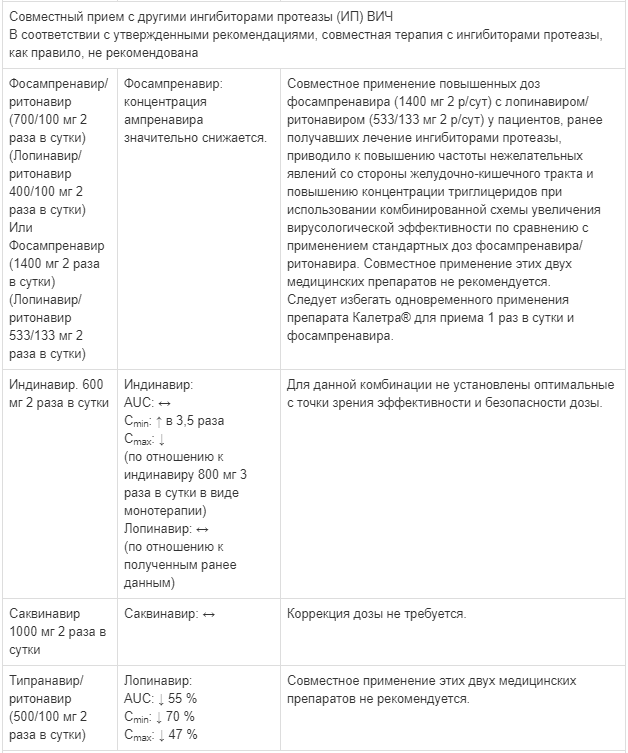
Известные и теоретически возможные взаимодействия с выбранным антиретровирусным препаратом и неантиретровирусными лекарственными средствами перечислены в таблице ниже.
Данные о лекарственных взаимодействиях
Взаимодействия между препаратом Калетра® и одновременно вводимыми лекарственными средствами представлены в таблице ниже, при этом увеличение обозначено как «↑», снижение — «↓», без изменений — «↔».
Если не указано иное, исследования. обозначенные ниже, проведены со стандартной рекомендуемой дозой лопинавира/ритонавира (т. е. 400/100 мг 2 раза в сутки).
Особые указания
Пациенты с сопутствующими заболеваниями
Нарушение функции печени
Безопасность и эффективность препарата Калетра® не была установлена у пациентов со значимыми нарушениями функции печени. Препарат Калетра® противопоказан пациентам с тяжелыми нарушениями функции печени (см. раздел «Противопоказания»).
Пациенты с хроническим гепатитом В или С, получающие комбинированную антиретровирусную терапию, имеют повышенный риск развития тяжелых и потенциально опасных для жизни нежелательных реакций со стороны печени. При проведении сопутствующей противовирусной терапии гепатитов В и С необходимо следовать указаниям соответствующих инструкций по применению.
У пациентов с уже существующим нарушением функции печени, включая пациентов с хроническим активным гепатитом, чаще развиваются нарушения функции печени на фоне комбинированной антиретровирусной терапии. Такие пациенты должны наблюдаться в соответствии со стандартной клинической практикой. В случае ухудшения или обострения заболевания печени у таких пациентов следует рассмотреть необходимость прерывания или прекращения лечения.
Сообщалось о повышении уровня трансаминаз с повышением или без повышения концентрации билирубина у ВИЧ-1 моноинфицированных пациентов и у лиц, получавших профилактическое лечение после интенсивного курса лечения через 7 дней после начала терапии лопинавиром/ритонавиром в сочетании с другими антиретровирусными препаратами. В некоторых случаях нарушения функции печени носили тяжелый характер.
До начала лечения лопинавиром/ритонавиром должны быть проведены соответствующие лабораторные исследования. За такими пациентами следует установить тщательный контроль во время лечения.
Нарушение функции почек
Поскольку почечный клиренс лопинавира и ритонавира незначителен, не ожидается повышение концентрации в плазме крови у пациентов с нарушением функции почек. Поскольку лопинавир и ритонавир прочно связываются с белками плазмы крови, маловероятно, что они будут значимо удалены с помощью гемодиализа или перитонеального диализа.
Гемофилия
Сообщалось об усилении кровотечений, включая спонтанные кожные гематомы и гемартроз у пациентов с гемофилией типа А и В. получавших лечение ингибиторами протеазы. Некоторым пациенты дополнительно применяли фактор VIII. Более чем в половине зарегистрированных случаев лечение ингибиторами протеазы было продолжено или возобновлено после приостановки лечения. Была установлена причинно-следственная связь, хотя ее механизм остается невыясненным. Пациентов с гемофилией необходимо предупредить о вероятности усиления кровотечений.
Панкреатит
Сообщалось о случаях панкреатита у пациентов, получавших препарат Калетра®, включая пациентов, у которых развилась гипертриглицеридемия. В большинстве случаев у пациентов в анамнезе присутствовал панкреатит и (или) сопутствующее лечение другими лекарственными средствами, связанными с развитием панкреатита.
Выраженное повышение концентрации триглицеридов является фактором риска развития панкреатита. Пациенты с ВИЧ-инфекцией поздней стадии могут иметь более высокий риск повышения концентрации триглицеридов и развития панкреатита.
Возможность развития панкреатита необходимо иметь в виду при появлении клинических симптомов (тошнота, рвота, боль в животе) или отклонений лабораторных показателей от нормы (повышение концентрации липазы или амилазы в сыворотке). Пациенты с перечисленными признаками или симптомами должны пройти дополнительное обследование, а в случае подтверждения диагноза панкреатита лечение препаратом Калетра® следует приостановить (см. раздел «Побочное действие»).
Синдром восстановления иммунитета
У ВИЧ-инфицированных пациентов с тяжелым иммунодефицитом на момент начала комбинированной антиретровирусной терапии (КАРТ) может развиться воспалительная реакция на бессимптомные или остаточные оппортунистические инфекции, что ведет к серьезным клинически значимым состояниям или усугублению симптомов. Такие реакции обычно наблюдаются в первые несколько недель или месяцев после начала КАРТ. В качестве примера можно привести цитомегаловирусный ретинит, диссеминированные и (или) локализованные микобактериальные инфекции и пневмонию, вызванную Pneumocystis jiroveci. Следует дополнительно оценить любые воспалительные симптомы и при необходимости назначить лечение.
Также на фоне синдрома восстановления иммунитета сообщалось о развитии аутоиммунных заболеваний (таких как болезнь Грейвса). Однако время до наступления таких нарушений варьирует, и они могут развиться много месяцев спустя после начала лечения.
Остеонекроз
Хотя этиология считается многофакторной (включая применение глюкокортикостероидов, употребление алкоголя, тяжелую иммуносупрессию, высокий индекс массы тела), случаи остеонекроза были зарегистрированы у пациентов с ВИЧ-инфекцией поздней стадии и (или) получающих в течение длительного времени комбинированную антиретровирусную терапию (КАРТ). Пациентам следует обратиться к врачу в случае появления ломоты, боли или скованности в суставах и при затруднении движения.
Удлинение интервала PR
Ритонавир/лопинавир может вызывать умеренное бессимптомное удлинение интервала PR у некоторых здоровых взрослых добровольцев. Сообщалось о редких случаях атриовентрикулярной блокады 2-й и 3-й степени у пациентов, получающих ритонавир/лопинавир, с сопутствующими органическими заболеваниями сердца и существующими ранее отклонениями отклонениями со стороны проводящей системы сердца, или у пациентов, принимающих лекарственные препараты, которые удлиняют интервал PR (например, верапамил и атазанавир). Таким пациентам препарат Калетра* следует назначать с осторожностью.
Масса тела и показатели обмена веществ
На фоне антиретровирусной терапии может увеличиваться масса тела, концентрация липидов и глюкозы в плазме крови. Такие изменения частично могут быть связаны с контролем заболевания и образом жизни. Существуют значимые свидетельства влияния лечения на увеличение концентрации липидов. Однако убедительных данных о связи увеличения массы тела с каким-либо конкретным лечением нет. Мониторинг концентрации липидов и глюкозы в плазме крови необходимо проводить в соответствии с разработанными руководствами по лечению ВИЧ-инфекции. Нарушения липидного обмена необходимо корректировать в соответствии с клинической необходимостью.
Взаимодействие с другими лекарственными препаратами
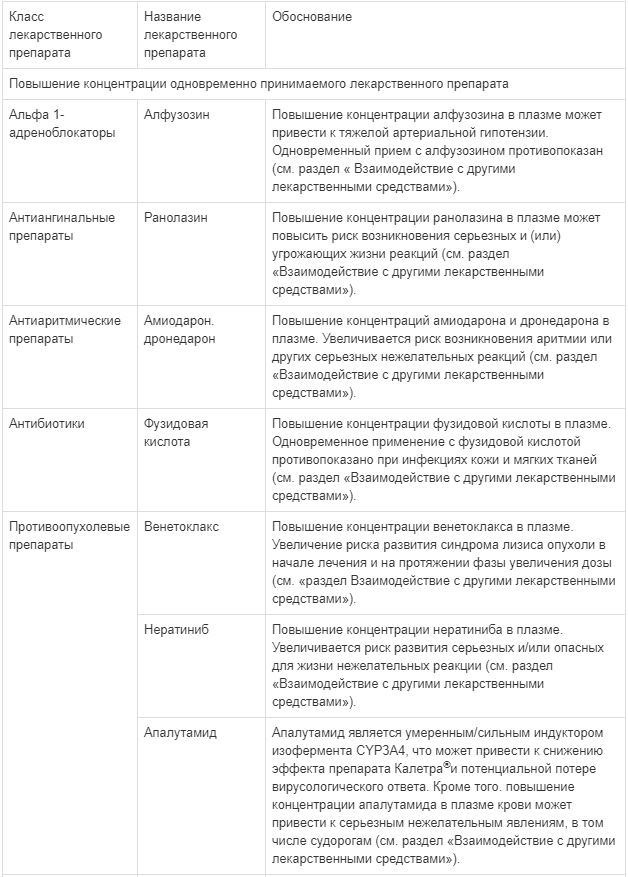
Препарат Калетра® содержит в составе лопинавир и ритонавир, оба из которых являются ингибиторами изофермента CYP3A цитохрома Р450. Вероятнее всего, препарат Калетра® повышает концентрации в плазме препаратов, метаболизируемых преимущественно CYP3A. Повышение концентрации одновременно назначаемых препаратов в плазме может привести к усилению или продлению их терапевтического действия и развитию нежелательных явлений (см. разделы «Противопоказания» и «Взаимодействие с другими лекарственными средствами»).
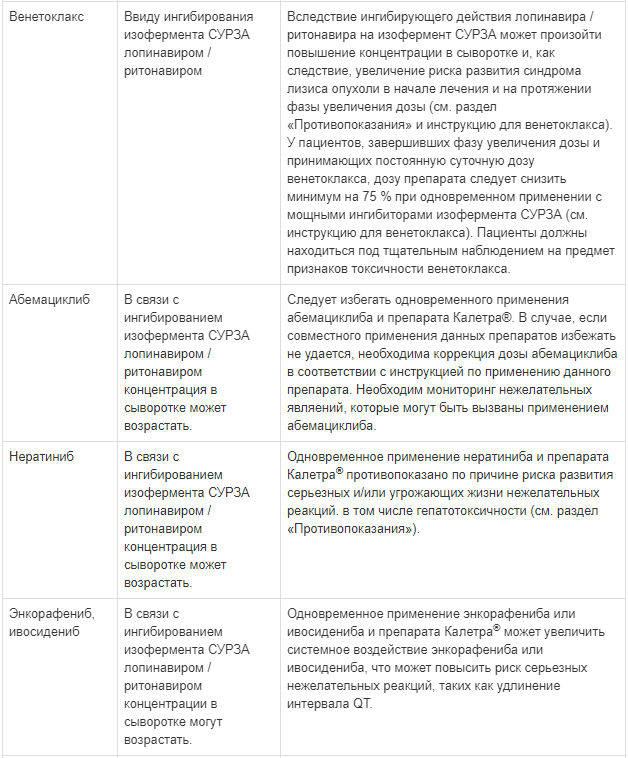
Мощные ингибиторы CYP3A4, такие как ингибиторы протеазы, могут усиливать действие бедаквилина, что потенциально может увеличить риск развития побочных реакций, связанных с бедаквилином. Таким образом, применения бедаквилина одновременно с лопинавиром/ритонавиром следует избегать. Тем не менее, если ожидаемая польза такого лечения превышает потенциальный риск, следует проявлять осторожность при одновременном применении бедаквилина с лопинавиром/ритонавиром. Рекомендуется более частый электрокардиографический мониторинг и контроль за уровнем трансаминаз (см. раздел «Взаимодействие с другими лекарственными средствами» и инструкцию по применению для бедаквилина).
Совместное применение деламанида с мощными ингибиторами CYP3A (такими как лопинавир/ритонавир) может усиливать действие метаболита деламанида, который, как известно, может удлинять интервал QTc. В связи с этим при одновременном применении деламанида и лопинавира/ритонавира требуется очень частый мониторинг ЭКГ на протяжении всего периода лечения деламанидом (см. раздел «Взаимодействие с другими лекарственными средствами» и инструкцию по применению для деламанида).
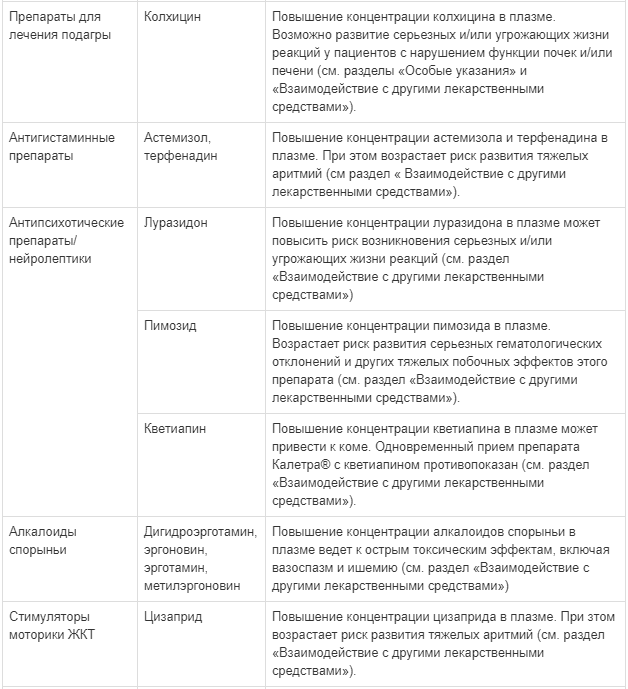
Сообщалось об угрожающих жизни реакциях и смертельных исходах по причине лекарственных взаимодействий у пациентов, получавших одновременно колхицин и мощные ингибиторы CYP3A, такие как ритонавир. Применение препарата Калетра® одновременно с колхицином, пациентам с нарушением функции почек или печени, противопоказано (см. разделы «Противопоказания» и «Взаимодействие с другими лекарственными средствами»).
Прием препарата Калетра® в сочетании со следующими лекарственными препаратами:
- Тадалафил: не рекомендуется назначать для лечения легочной артериальной гипертензии (см. раздел «Взаимодействие с другими лекарственными средствами»);
- Риоцигуат: не рекомендуется назначать вместе с препаратом Калетра® (см. раздел «Взаимодействие с другими лекарственными средствами»);
- Ворапаксар: не рекомендуется назначать вместе с препаратом Калетра® (см. раздел «Взаимодействие с другими лекарственными средствами»);
- Фузидовая кислота: не рекомендуется назначать при инфекционных заболеваниях костей и суставов (см. раздел «Взаимодействие с другими лекарственными средствами»);
- Салметерол: не рекомендуется назначать вместе с препаратом Калетра® (см. раздел «Взаимодействие с другими лекарственными средствами»);
- Ривароксабан: не рекомендуется назначать вместе с препаратом Калетра® (см. раздел «Взаимодействие с другими лекарственными средствами»).
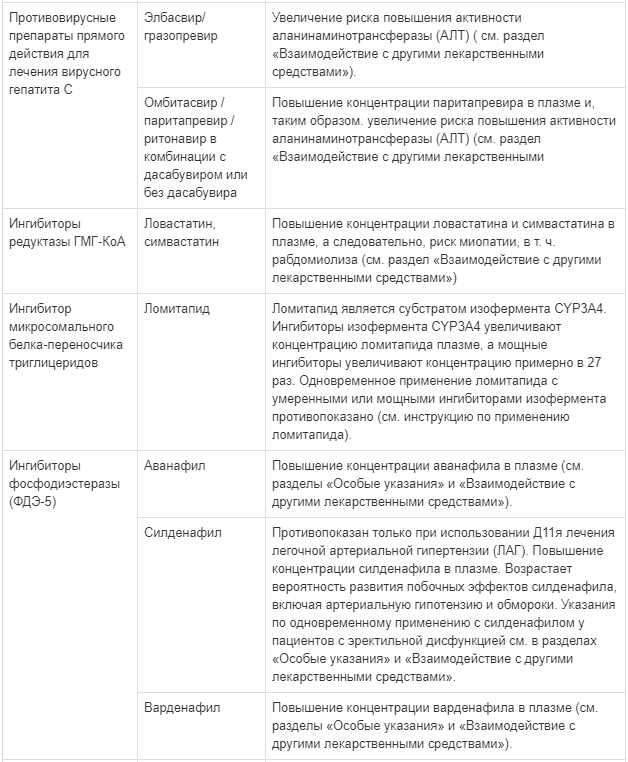
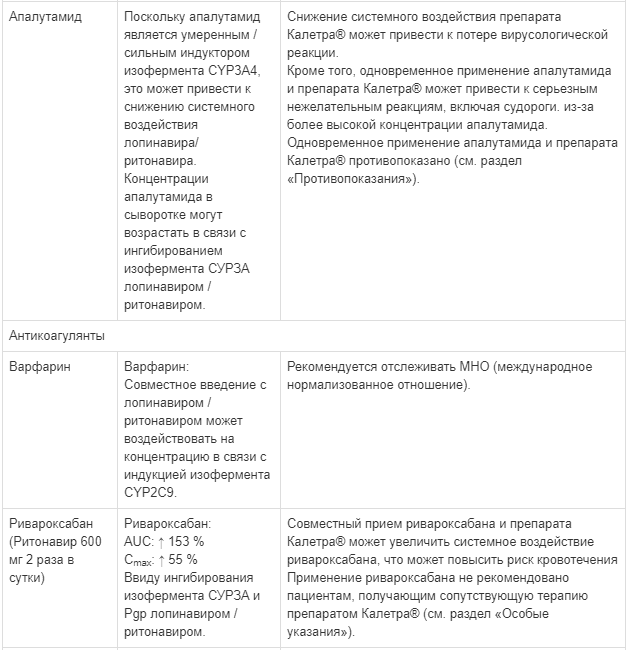
Одновременное применение препарата Калетра® с аторвастатином не рекомендуется. При необходимости одновременного применения препарата Калетра® с аторвастатином должны применяться наименьшие эффективные дозы аторвастатина. Следует проявлять осторожность и назначать более низкие дозы при одновременном применении препарата Калетра® и розувастатина. При необходимости проведения лечения ингибитором редуктазы ГМГ-КоА рекомендуется назначать правастатин или флувастатин (см. раздел «Взаимодействие с другими лекарственными средствами»).
Ингибиторы фосфодиэстеразы 5 типа (ФДЭ-5)
Следует с осторожностью применять силденафил или тадалафил для лечения эректильной дисфункции у пациентов, принимающих препарат Калетра®. Одновременное применение этих лекарственных средств с препаратом Калетра» может сопровождаться существенным повышением их концентрации и появлением нежелательных явлений, таких как артериальная гипотензия, обморок, нарушение зрения и длительная эрекция (см. раздел «Взаимодействие с другими лекарственными средствами»). Одновременное применение аванафила или варденафила с лопинавиром/ритонавиром противопоказано (см. раздел «Противопоказания»). Одновременное применение силденафила с препаратом Калетра® противопоказано пациентам с легочной артериальной гипертензией (см. раздел «Противопоказания»).
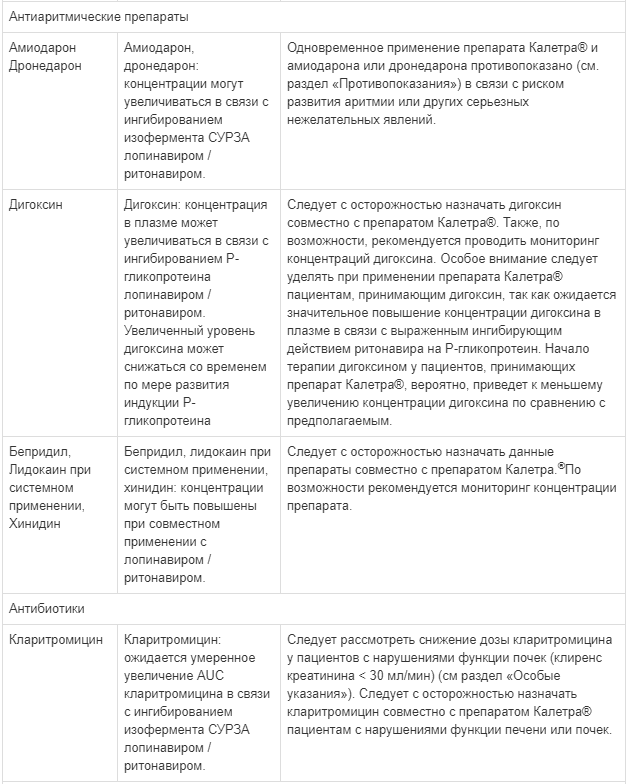
Особую осторожность следует проявлять при применении препарата Калетра® и лекарственных средств, вызывающих удлинение интервала QT, таких как хлорфенирамин, хинидин, эритромицин и кларитромицин. В действительности, прием препарата Калетра® может привести к увеличению концентрации одновременно принимаемых препаратов и увеличению частоты развития нежелательных реакций со стороны сердца, вызванных применением этих препаратов. В доклинических исследованиях препарата Калетра® сообщалось о нежелательных реакциях со стороны сердца, поэтому потенциальное воздействие на сердце препарата Калетра® не может быть полностью исключено (см. раздел «Побочное действие»).
Совместное применение препарата Калетра® с рифампицином не рекомендуется. Рифампицин в сочетании с препаратом Калетра® приводит к выраженному снижению концентрации лопинавира, что может значительно уменьшить терапевтический эффект лопинавира. Достаточное действие лопинавира/ритонавира может быть достигнуто с увеличением дозы препарата Калетра®, но это также связано с повышенным риском токсического поражения печени и желудочно-кишечного тракта. За исключением крайней необходимости, такие препараты не следует назначать одновременно (см. раздел «Взаимодействие с другими лекарственными средствами»).
Не рекомендуется одновременное применение препарата Калетра* с флутиказоном или другими глюкокортикостероидами, которые метаболизируются CYP3A4, такими как будесонид, триамцинолон кроме случаев, когда потенциальная польза лечения превышает риск развития системных эффектов глюкокортикостероидов, включая синдром Иценко-Кушинга и подавление функции надпочечников (см. раздел «Взаимодействие с другими лекарственными средствами»).
Другое
Препарат Калетра® не излечивает ВИЧ-инфекцию или СПИД. Несмотря на установленное существенное снижение риска передачи инфекции половым путем на фоне эффективной вирусной супрессии во время антиретровирусной терапии, остаточный риск не может быть исключен. С целью предотвращения передачи инфекции необходимо соблюдать меры предосторожности в соответствии с национальными руководствами. У пациентов, принимающих препарат Калетра®, по-прежнему, могут развиться инфекции или другие заболевания, связанные с заболеванием ВИЧ и СПИД.
Влияние на способность к вождению автотранспорта, управлению механизмами
Исследования влияния на способность к вождению автотранспорта и управлению механизмами не проводились. Пациентов следует предупредить, что при лечении препаратом Калетра» отмечены случаи возникновения тошноты (см. раздел «Побочное действие»).
Форма выпуска
Таблетки, покрытые пленочной оболочкой, 100 мг + 25 мг.
60 таблеток во флаконе из полиэтилена высокой плотности с завинчивающимся колпачком.
По 1 флакону вместе с инструкцией по применению в картонной пачке.
Срок годности
3 года. Не использовать после истечения срока годности, указанного на упаковке.
Условия хранения
При температуре от 15 до 30 °C. Хранить в местах, недоступных для детей.
Условия отпуска
Отпускается по рецепту.
Владелец регистрационного удостоверения / организация, принимающая претензии от потребителей:
ООО «ЭббВи»
125196, г. Москва, ул. Лесная, д.7,
БЦ «Белые Сады», здание «А»
Производитель
Производитель готовой лекарственной формы, фасовщик (первичная упаковка), упаковщик (вторичная упаковка), выпускающий контроль качества
ЭббВи Дойчланд ГмбХ и Ко.КГ,
Кнолльштрассе, 67061 Людвигсхафен, Германия /
AbbVie Deutschland GmbH & Co.KG,
Knollstrasse. 67061 Ludwigshafen, Germany
В случае упаковки выпускающего контроля качества на территории РФ указывают:
Производитель ютовой лекарственной формы. фасовщик (первичная упаковка)
ЭббВи Дойчланд ГмбХ и Ко.КГ.
Кнолльштрассе. 67061 Людвигсхафен. Германия /
AbbVie Deutschland GmbH & Co.KG.
Knollstrasse. 67061 Ludwigshafen. Germany
Упаковщик (вторичная упаковка), выпускающий контроль качества
АО «ОРТАТ», Россия
157092, Костромская обл., Сусанинский район, с. Северное, мкр. Харитоново.
Упаковано
ЭббВи Дойчланд ГмбХ и Ко.КГ, 67061 Людвигсхафен,
Кнолльштрассе, Германия
AbbVie Deutschland GmbH & Со.КС, 67061 Ludwigshafen,
Knollstrasse, Germany
или
АО «ОРТАТ», Россия
157092, Костромская обл., Сусанинский р-н, с. Северное, мкр-н Харитоново.
Наименование и адрес организации, уполномоченной принимать претензии на лекарственный препарат:
ООО «ЭббВи»
125047, г. Москва, ул. Лесная, д.7,
БЦ «Белые Сады», здание «А»
Купить Калетра в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Раствор для приема внутрь
1 мл раствора содержит
активные вещества: лопинавир 80 мг
ритонавир 20 мг
вспомогательные вещества: полиоксил 40, гидрогенизированное касторовое масло; вода очищенная, натрия хлорид, натрия цитрат, натрия сахарин, калия ацесульфам, лимонная кислота безводная, этанол безводный, пропиленгликоль, левоментол, повидон, глицерин, кукурузный сироп с высоким содержанием фруктозы, отдушка Магнасвит 110, масло мяты перечной, отдушка ванильная, отдушка хлопковая кондитерская.
Прозрачный раствор от светло-жёлтого до золотого цвета, не содержащий посторонних частиц.
Противовирусные препараты для системного применения. Противовирусные препараты прямого действия. Противовирусные препараты для лечения ВИЧ-инфекции, комбинации. Лопинавир и ритонавир.
Код АТХ [J05AR10]
Фармакологические свойства
Фармакокинетика
Не установлено существенных отличий в фармакокинетических параметрах у здоровых взрослых добровольцев и у ВИЧ-инфицированных лиц. Лопинавир практически полностью распадается под действием CYP3A. Ритонавир тормозит метаболическое разложение лопинавира, и таким образом, обусловливает увеличение концентрации лопинавира в плазме крови. Средняя концентрация лопинавира в равновесном состоянии выше в 15–20 раз, по сравнению с концентрацией ритонавира. Концентрация ритонавира в плазме крови составляет менее 7 % от концентрации, которая наблюдается после введения ритонавира в дозе 600 мг дважды в сутки. Антивирусная эффективная концентрация EC50 лопинавира приблизительно в 10 раз ниже, чем концентрация ритонавира. Антивирусная активность препарата обусловлена присутствием лопинавира.
Всасывание: максимальная концентрация (Сmax) лопинавира в плазме крови составляет (9,6 ± 4,4) мкг/мл приблизительно через 4 часа после введения. Средняя минимальная концентрация в равновесном состоянии перед введением утренней дозы составляет (5,5 ± 4,0) мкг/мл. Величина AUC (площадь под кривой концентрация-время) для лопинавира через 12 часов после введения составляет (82,8 ± 44,5) мкг/час/мл. После еды (500 ккал, 25 % жиров) концентрация лопинавира после применения препарата Калетра® в виде капсул или раствора не отличалась. При введении препарата натощак средние величины AUC и Сmax для лопинавира при применении препарата Калетра® в виде раствора были на 22 % меньше, по сравнению с величинами, полученными после введения капсул препарата Калетра®.
Влияние пищи на всасывание при пероральном введении
Биодоступность лопинавира/ритонавира в виде раствора не изменяется при приеме с пищей с умеренным содержанием жиров. Для увеличения биодоступности и минимизации колебаний фармакокинетических параметров препарат Калетра® рекомендуется принимать вместе с пищей.
Распределение: в равновесном состоянии приблизительно 98–99 % лопинавира связывается с белками плазмы.
Метаболический распад: лопинавир метаболизируется, преимущественно, путем окисления, интенсивно распадается в печени под действием системы цитохрома Р450, в частности, изофермента CYP3A. Ритонавир является мощным ингибитором активности CYP3A и, тем самым, тормозит распад лопинавира и обусловливает увеличение его концентрации в плазме крови. Выведение: период полувыведения лопинавира на протяжении 12-часового перерыва между введениями препарата, составляет 5–6 часов, а клиренс лопинавира равен 6–7 л/час.
Применение один раз в сутки
Многократное применение 800/200 мг лопинавира/ ритонавира 1 раз в сутки с едой приводит к Сmax лопинавира (11,8 ± 3,7) mг/мл через 6 часов после применения. Средние равновесные концентрации лопинавира до утренней дозы составляют (3,2 ± 2,1) mг/мл и минимальные концентрации между приёмами препарата — (1,7 ± 1,6) mг/мл.
Среднее значение AUC в течение 24 часов составляет (154,1 ± 61,4) mг·ч/мл.
Фармакокинетика у детей
В дозах лопинавир/ритонавира 300мг/75 мг/м2 перорально устойчивые средние уровни AUC, Сmax и Сmin составляют (72,6 ± 31,1) mг·час/мл, (8,2 ± 2,9) mг/мл и (3,4 ± 2,1) mг/мл, соответственно, после лопинавира/ ритонавира в пероральном растворе в дозах 230 мг/57,5 мг/м2 без невирапина, и (85,8 ± 36,9) mг·час/мл, (10,0 ± 3,3) mг/мл и (3,6 ± 3,5) mг/мл, соответственно, после лопинавира/ритонавира в пероральном растворе в дозах 300 мг/75 мг/м2 в комбинации с невирапином.
Пациенты пожилого возраста
Отличий, зависимых от возраста или наследственности не обнаружено.
Почечная недостаточность
Почечный клиренс лопинавира незначителен, уменьшение общего клиренса у больных с почечной недостаточностью не ожидается.
Печеночная недостаточность
У пациентов с нарушением функции печени от легкой до умеренной степени наблюдается ограниченное увеличение общих концентраций лопинавира, приблизительно на 30 %, не имеющее клинической значимости.
Фармакодинамика
Лопинавир — ингибитор протеаз ВИЧ-1 и ВИЧ-2 — предотвращает расщепление gag-pol-полипротеина, приводя к продукции незрелого неинфекционного вируса.
Ритонавир — пептидомиметический ингибитор ВИЧ-1- и ВИЧ-2- аспартилпротеаз для перорального применения. Торможение ВИЧ-протеазы делает этот фермент неспособным к обработке предшественника gag pol полипротеина, что приводит к образованию морфологически незрелых ВИЧ-частиц, не способных к инициированию новых циклов инфицирования. Ритонавир обладает селективным сродством к ВИЧ-протеазе и низкой ингибирующей активностью против аспартил-протеаз человека.
Препарат Калетра® показан для лечения вируса иммунодефицита человека (ВИЧ-1) в комбинации с другими антиретровирусными лекарственными препаратами ВИЧ-1-инфицированных взрослых, подростков и детей в возрасте старше 2 лет.
Выбор препарата Калетра® для лечения ВИЧ-1-инфицированных пациентов, имеющих опыт лечения ингибитором протеаз, должен быть основан на тестировании индивидуальной резистентности и истории болезни пациентов.
Препарат Калетра® должны назначать врачи, которые имеют опыт в лечении ВИЧ-инфекции.
Позология
Применение взрослым и подросткам. Рекомендованная доза препарата Калетра® составляет 5 мл перорального раствора (400/100 мг) дважды в день во время еды.
Применение в педиатрии (дети от 2 лет и старше).
Рекомендованная доза препарата Калетра® составляет 230/57,5 мг/м2 дважды в день, совместно с приемом пищи. Максимальная доза 400/100 мг дважды в день. Препарат Калетра® не должен применяться у детей в режиме один раз в день. Доза 230/57,5 мг/м2 может оказаться недостаточной у некоторых детей при сопутствующем приеме невирапина и эфавиренза. Для данных пациентов следует рассмотреть возможность повышения дозы препарата Калетра® до 300/75 мг/м2. Если предпочтительным является дозирование в пересчете на массу тела, то для пациентов с массой тела равной или превышающей 15–40 кг доза составляет 10/2,5 мг/кг два раза в день, если прием препарата Калетра® не сочетается с приемом невирапина или эфавиренза. Препарат должен применяться с использованием калиброванного дозирующего устройства.
Рекомендовано применение раствор для перорального применения в случаях необходимости точного дозирования у детей, исходя из площади поверхности тела. Однако в случаях необходимости использования твердых лекарственных форм у детей с массой тела менее 40 кг или с площадью поверхности тела от 0,5 до 1,4 м2 и способных проглотить таблетку, может применяться таблетка 100 мг/25 мг. Доза для взрослых, препарата в таблетках (400/100 мг дважды в день) может использоваться у детей с массой тела 40 кг и более, либо площадью поверхности тела более 1,4 м2. Таблетированные формы должны применяться перорально, их необходимо проглатывать целиком, не разжевывать, не ломать и не измельчать (см. инструкцию по медицинскому применению соответствующей лекарственной формы).
*Площадь поверхности тела (ППТ) рассчитывается по следующей формуле:
ППТ (м2) = √(Рост (см) х Вес (кг)/3600)
Дети до 2 лет. Эффективность и безопасность применения препарата Калетра® у детей до 2 лет еще не установлена. Имеющиеся в настоящий момент данные описаны в разделе «Фармакокинетика», однако нельзя дать рекомендаций по применению. Общее количество этанола и пропиленгликоля всех лекарственных средств, в том числе препарата Калетра®, раствора для приема внутрь, которые будут вводиться детям, должны быть приняты во внимание для того, чтобы избежать токсичности этих вспомогательных веществ (см. раздел «Особые указания»).
Пациенты с нарушением функции печени. У ВИЧ-инфицированных пациентов с легкой и умеренной степенью нарушения функции печени наблюдалось увеличение концентрации лопинавира в плазме крови на 30 %, однако клинического значения не ожидается (см. раздел «Фармакокинетика»). Нет данных в отношении пациентов с тяжелой степенью нарушений функций печени, Калетра® не должна использоваться у данных пациентов (см. раздел «Противопоказания»).
Пациенты с нарушением функции почек. С учетом низкого почечного клиренса лопинавира и ритонавира, увеличение концентрации в плазме у пациентов с почечной недостаточностью не предполагается. Ввиду высокой степени связывания с белками крови, маловероятно значимое выведение препарата при гемодиализе или перитонеальном диализе.
Метод применения. Калетра® применяется перорально и должна всегда приниматься совместно с приемом пищи (см. раздел «Фармакокинетика»).
Введение раствора для приема внутрь с помощью зонда для искусственного кормления
Назначенная доза раствора для приема внутрь может быть введена через зонд для искусственного кормления. Следуйте инструкциям для применения зонда для искусственного кормления, чтобы ввести препарат. Калетра®, как и другие препараты, содержащие спирт, не рекомендуется для применения с полиуретановыми зондами для искусственного кормления из-за потенциальной несовместимости.
а) Общий профиль безопасности
Безопасность лопинавир/ритонавира изучалась на 2600 пациентах в ІІ–ІV фазах клинических исследований, из которых более 700 получали дозу 800/200 мг (6 капсул или 4 таблетки) один раз в день вместе с нуклеозидными ингибиторами обратной транскриптазы (НИОТ), в некоторых исследованиях, Калетра® была использована в комбинации с эфавирензом или невирапином.
Наиболее частой побочной реакцией, связанной с терапией лопинавир/ритонавиром, была диарея, тошнота, рвота, гипертриглицеридемия и гиперхолестеринемия. Диарея, тошнота и рвота может иметь место в начале лечения, в то время как гипертриглицеридемия и гиперхолестеринемия может начаться позже. Лечение нежелательных явлений привело к преждевременному прекращению исследования у 7 % пациентов II–IV фазы исследований.
Важно отметить, что случаи панкреатита были зарегистрированы у пациентов, получающих лопинавир/ритонавир, в том числе тех, у кого проявлялась гипертриглицеридемия. Кроме того, сообщалось о редких случаях удлинения PR интервала от легкой до средней степени тяжести во время терапии лопинавир/ритонавиром.
б) Список побочных реакций
Побочные реакции, отмеченные в ходе клинических исследований у взрослых.
Побочные реакции, о которых сообщалось, были от средней до тяжелой степени тяжести, с возможной или вероятной причинно-следственной связью. Нижеприведенные побочные реакции распределены по органам и системам и по частоте возникновения: очень часто (свыше 10 %), часто (1–10 %), нечасто (0,1–1 %), редко (0,01–0,1 %).
Очень часто
— инфекции верхних дыхательных путей
— диарея, тошнота
Часто
— инфекции нижних дыхательных путей, инфекции кожи, включая целлюлит, фолликулит и фурункулы
— анемия, лейкопения, нейтропения, лимфоаденопатия
— гиперчувствительность, включая крапивницу и ангионевротический отек
— тревожность
— нарушение содержания глюкозы крови, включая сахарный диабет, гипертриглицеридемия, гиперхолестеринемия, снижение веса, снижение аппетита
— головная боль (включая мигрень), невропатия (включая периферическую невропатию), головокружение, бессонница
— гипертензия
— панкреатит, рвота, гастроэзофагеальная рефлюксная болезнь, гастроэнтерит и колит, боль в животе (в верхней и нижней частях), вздутие живота, диспепсия, геморрой, метеоризм
— гепатит, включая повышение АСТ, АЛТ и ГГТ (гамма-глютамилтранспептидаза)
— сыпь, включая макулопапулезную сыпь, дерматит/сыпь, включая экзему и себорейный дерматит, ночное потоотделение, зуд
— миалгия, мышечно-скелетная боль, включая артралгии и боль в спине, мышечные нарушения, включая мышечную слабость и судороги
— эректильная дисфункция, нарушения менструального цикла – аменорея, меноррагия
— утомляемость, включая астению
Нечасто
— синдром иммунной реактивации
— гипогонадизм
— необычные сновидения, снижение либидо
— цереброваскулярные нарушения, судороги, дисгевзия, агевзия, тремор
— нарушение со стороны органов зрения
— звон в ушах, головокружение
— атеросклероз и вызванный им инфаркт миокарда, атриовентрикулярная блокада, недостаточность трехстворчатого клапана
— тромбоз глубоких вен
— гастроинтестинальное кровотечение, включая гастроинтестинальные язвы, дуоденит, гастрит и ректальное кровотечение, стоматит и оральные язвы, недержание кала, запор, сухость во рту
— жировая дистрофия печени, гепатомегалия, холангит, гипербилирубинемия
— рабдомиолиз, остеонекроз
— снижение клиренса креатинина, нефрит, гематурия
— алопеция, капиллярит, васкулит
Редко
— увеличение веса, увеличение аппетита
Частота не установлена
-желтуха
— синдром Стивенса-Джонсона, мультиформная эритема
в) Описание побочных реакций
Сообщалось о синдроме Кушинга у пациентов принимающих лопинавир/ритонавир одновременно с флутиказоном интраназально или ингаляционно, также это может произойти с другими кортикостероидами которые метаболизируются через Р450 3А, например, будесонид.
Сообщалось о повышении креатинфосфокиназы (КФК), миалгии, миозите, и, редко, рабдомиолизе при применении ингибиторов протеазы, особенно в сочетании с ингибиторами нуклеозидов обратной транскриптазы.
Комбинированная антиретровирусная терапия была связана с метаболическими нарушениями, такими как гипертриглицеридемия, гиперхолестеринемия, инсулинорезистентность, гипергликемия и гиперлактатемия.
У ВИЧ инфицированных пациентов с тяжелым иммунодефицитом на момент начала комбинированной антиретровирусной терапии могут возникнуть воспалительные реакции на бессимптомные или опортунистические инфекции. Также сообщалось об аутоиммунных нарушениях (например, болезнь Грейвса).
Сообщалось о случаях остеонекроза, особенно у пациентов с общепризнанными факторами риска с прогрессирующей стадией ВИЧ или при долгосрочном применении комбинированной антиретровирусной терапии.
Побочные реакции, отмеченные в клинических исследованиях у детей.
У детей в возрасте от 2 лет и старше профиль побочных реакций и переносимость препарата были такими же, как у взрослых пациентов.
— повышенная чувствительность к лопинавиру или ритонавиру или к какому-либо неактивному компоненту препарата
— одновременное применение с препаратами, клиренс которых в значительной мере зависит от CYP3A, и повышение концентрации в плазме крови которых может привести к появлению серьезных и/или опасных для жизни реакций: альфузозин, ранолазин, дронедарон, фузидиевая кислота, колхицин (у пациентов с почечной и/или печеночной недостаточностью), астемизол, терфенадин, блонансерин, луразидон, пимозид, мидазолам перорально, триазолам, цизаприд, ловастатин, симвастатин, сальметерол, кветиапин амиодарон, алкалоиды спорыньи (эрготамин, дигидроэрготамин, эргоновин и метилэргоновин) аванафил, силденафил для лечения легочной артериальной гипертензии и варденафил
— одновременное применение с препаратами растительного происхождения, содержащими зверобой продырявленный (Hypericum perforatum)
— тяжелая печеночная недостаточность
— дети до 2 лет, беременные женщины и пациенты, получавшим дисульфирам или метронидазол из-за возможного риска токсичности в сочетании с вспомогательным веществом (пропиленгликоль).
С осторожностью: пациентам с легкой и умеренной печеночной недостаточностью или почечной недостаточностью.
Лекарственные взаимодействия
Калетра® содержит лопинавир и ритонавир, которые являются ингибиторами изофермента CYP3A цитохрома Р450 in vitro. Одновременное назначение препарата Калетра® и лекарственных средств, которые первично метаболизируются системой CYP3A может привести к увеличению плазменных концентраций других лекарственных препаратов, что, в свою очередь, может увеличить или продлить их терапевтическое действие и побочные реакции. Калетра® не ингибирует CYP2D6, CYP2C9, CYP2C19, CYP2E1, CYP2B6 или CYP1A2 в концентрациях, применяемых в клинической практике (см. раздел «Противопоказания»).
Калетра® in vivo индуцирует собственный метаболизм и повышает биотрансформацию некоторых лекарственных препаратов, которые метаболизируются с помощью ферментной системы цитохрома P450 (включая CYP2C9 и CYP2C19), а также путем глюкуронизации. Это явление может привести к снижению плазменных концентраций и потенциальному снижению эффективности совместно назначаемых лекарственных средств.
Лекарственные препараты, противопоказанные именно в связи с предполагаемым спектром взаимодействий и возможностью серьёзных нежелательных явлений, перечислены в разделе «Противопоказания»
Известные и предполагаемые взаимодействия с отдельными антиретровирусными и не-антиретровирусными лекарственными препаратами перечислены в таблице ниже.
Пациенты с сопутствующими заболеваниями
Заболевания печени
Безопасность и эффективность препарата Калетра® не была установлена у больных с сопутствующими тяжелыми нарушениями функции печени. Калетра® противопоказана пациентам с тяжелой печеночной недостаточностью (см. раздел «Противопоказания»).
При лечении комбинацией антиретровирусных препаратов пациентов с хроническим гепатитом B или C существует повышенный риск развития тяжелых и потенциально опасных для жизни побочных реакций со стороны печени. В случае сопутствующей противовирусной терапии гепатита В или С, необходимо обратиться к инструкции по применению этих лекарственных средств.
У пациентов с предшествующим нарушением функции печени, включая хронический гепатит, наблюдается повышенная частота нарушений функциональных печеночных проб во время сочетанной противовирусной терапии, которые должны контролироваться согласно принятой стандартной практике. При появлении симптомов ухудшения заболевания печени, следует рассмотреть вопрос о прерывании или прекращении лечения.
Были получены сообщения о повышении уровня трансаминаз с или без повышения уровня билирубина у ВИЧ-1 моноинфицированных пациентов и у лиц, которым проводилась профилактика после контакта, через 7 дней после начала терапии лопинавиром/ритонавиром в сочетании с другими антиретровирусными препаратами. В некоторых случаях печеночная дисфункция носила тяжелый характер.
Соответствующие лабораторные исследования должны проводиться до начала терапии лопинавиром/ритонавиром, следует тщательно проводить мониторинг во время лечения.
Заболевания почек
Почечный клиренс лопинавира и ритонавира незначительный, увеличения концентрации в плазме крови, у пациентов с почечной недостаточностью не ожидается. В виду того, что лопинавир и ритонавир обладают высокой белковосвязывающей способностью, маловероятно, что их концентрация значительно снизится с помощью гемодиализа или перитонеального диализа.
Гемофилия
Были сообщения о повышенной кровоточивости, включая спонтанные кожные гематомы и гемартрозы, у пациентов с гемофилией типа А и B, которые лечились ингибиторами протеазы. Некоторым пациентам назначали дополнительный фактор VIII. В большинстве указанных случаев лечение ингибиторами протеазы было продолжено или возобновлено, если оно было прервано. Отмечали причинно-следственную связь, хотя механизм действия не был объяснен. Поэтому пациенты с гемофилией должны быть проинформированы о возможности повышенной кровоточивости.
Панкреатит
Были сообщения о случаях панкреатита у пациентов, получающих препарат Калетра®, включая пациентов, у которых развилась гипертриглицеридемия. В большинстве случаев у пациентов отмечалось наличие панкреатита в анамнезе и/или одновременная терапия другими препаратами, связанными с панкреатитом. Выраженное повышение уровня триглицеридов является фактором риска развития панкреатита. У лиц с прогрессирующей ВИЧ-инфекцией риск увеличения концентрации триглицеридов и развития панкреатита может повышаться. Следует рассмотреть возможность развития панкреатита в случае развития таких симптомов, как тошнота, рвота, боль в животе или в случае наличия отклонений по лабораторным тестам, таким как повышение уровня сывороточных липаз или амилаз. Следует обследовать пациентов, у которых появляются такие симптомы, а прием препарата Калетра® следует приостановить, если установлен диагноз панкреатит (см. раздел «Побочные действия»).
Синдром иммунной реактивации
У ВИЧ-инфицированных пациентов с тяжелым иммунным дефицитом при прохождении комбинированной антиретровирусной терапии (КАРТ) может возникать воспалительная реакция на условно-патогенные микроорганизмы. Как правило, такие реакции наблюдались в течение первых недель или месяцев после начала комбинированной антиретровирусной терапии. Примерами этого могут быть цитомегаловирусный ретинит, генерализованные и/или очаговые микобактериальные инфекции, а также пневмоцистная пневмония. Необходимо оценивать все симптомы воспаления, а при необходимости – назначать соответствующее лечение.
Так же были получены сообщения касательно аутоиммунных заболеваний (таких как болезнь Грейвса) в условиях реактивации иммунитета. Тем не менее, время сообщения о таких проявлениях очень различно и они могут появляться много месяцев спустя после начала лечения.
Остеонекроз
Хотя этиология остеонекроза является многофакторной (включая прием кортикостероидов, злоупотребление алкоголем, тяжелую иммуносупрессию, высокий индекс массы тела), случаи его наблюдались и у пациентов с прогрессирующей ВИЧ-инфекцией и/или при длительном действии комбинированной противовирусной терапии (CART). Если больной ощущает боль в суставах, трудности при движении, рекомендуется обратиться к врачу.
Удлинение интервала PR
Лопинавир/ритонавир вызвал умеренное асимптоматическое| удлинение интервала PR некоторых взрослых здоровых испытуемых. Имеются редкие сообщения об атриовентрикулярной блокаде 2-й, 3-й степени у больных с анамнезом заболевания сердца, нарушения проводимости и у пациентов, получавших препараты, удлиняющие интервал PR (например, верапамил или атазанавир), при одновременном применении лопинавира/ ритонавира. Препарат Калетра® следует назначать осторожно таким пациентам.
Масса тела и параметры метаболизма
Во время противовирусной терапии могут развиться увеличение массы тела и повышение уровней липидов крови. Такие изменения частично могут быть связаны с контролем за течением заболевания и образом жизни. В отношении липидов имеются доказательства связи с лечением в некоторых случаях, в то время как для увеличения массы тела такие доказательства связи с каким-либо конкретным лечением отсутствуют. В отношении контроля за уровнем липидов следует обратиться к действующим инструкциям по лечению ВИЧ. Липидные нарушения следует лечить в соответствии с клинической практикой.
Калетра® содержит лопинавир/ритонавир, которые являются ингибиторами изофермента CYP3A цитохрома Р450. Препарат Калетра® может повышать в плазме концентрации лекарственных средств, которые в основном метаболизируют под воздействием CYP3A. Такое повышение концентрации в плазме принимаемых совместно лекарственных средств может усиливать или удлинять их терапевтическое действие и их нежелательные явления (см. разделы «Противопоказания» и «Лекарственные взаимодействия»). Сильные ингибиторы CYP3A, такие как ингибиторы протеаз, могут повышать экспозицию бедаквилина, что может приводить к увеличению риск связанных с бедаквилином нежелательных явлений. Таким образом, следует избегать сочетания бедаквилина и лопинавира/ритонавира. Однако если польза перевешивает риск, то сочетанное применение этих препаратов должно проводиться с осторожностью. Рекомендуется более частый контроль ЭКГ и контроль трансаминаз (см. раздел «Лекарственные взаимодействия» и инструкцию по применению бедаквилина).
Препарат Калетра® не назначают одновременно с колхицином, в особенности у пациентов с почечной или печеночной недостаточностью (см. раздел «Лекарственные взаимодействия»). Были зарегистрированы угрожающие жизни случаи и случаи со смертельным исходом у пациентов, получавших терапию колхицином и сильными ингибиторами изофермента CYP3A, такими как ритонавир (см. разделы «Противопоказания» и «Лекарственные взаимодействия»).
Сочетание препарата Калетра® с:
— тадалафилом, показанным для лечения легочной артериальной гипертензии, не рекомендуется (см. раздел «Лекарственные взаимодействия»);
— фузидовой кислотой при костно-суставных инфекциях не рекомендуется (см. раздел «Лекарственные взаимодействия»);
— салметеролом не рекомендуется (см. раздел «Лекарственные взаимодействия»);
— ривароксабаном не рекомендуется (см. раздел «Лекарственные взаимодействия»).
Сочетание препарата Калетра® с аторвастатином не рекомендуется. Если использование аторвастатина крайне необходимо, то следует применять наименьшие возможные дозы аторвастатина при условии тщательного контроля безопасности. Осторожность следует проявлять и учитывать возможность уменьшения дозы при использовании препарата Калетра® одновременно с розувастатином. Если показано лечение ингибиторами ГМГ-CoA-редуктазы, то рекомендуются правастатин и флувастатин (см. раздел «Лекарственные взаимодействия»).
Ингибиторы фосфодиэстеразы PDE5
Следует с осторожностью применять силденафил или тадалафил для лечения эректильной дисфункции у пациентов, применяющих препарат Калетра®. Ожидается, что совместное применение этих лекарственных средств с препаратом Калетра® значительно повысит их концентрацию в плазме крови и приведет к появлению побочных реакций, таких как артериальная гипотензия, обмороки, зрительные нарушения, длительная эрекция (см. раздел «Лекарственные взаимодействия»). Одновременное применение аванафила или варденафила с лопинавиром/ритонавиром противопоказано (см. раздел «Лекарственные взаимодействия»). Применение силденафила и препарата Калетра® противопоказано у пациентов с легочной артериальной гипертензией. Одновременный прием лопинавира/ритонавира с варденафилом противопоказан (см. раздел «Противопоказания»).
Особую осторожность следует проявлять при назначении препарата Калетра® и лекарственных средств, известных как препараты, способные удлинить интервал QT, такие как: хлорфенирамин, хинидин, эритромицин, кларитромицин. Препарат Калетра® может повышать их концентрацию при совместном приеме и приводить к усилению их нежелательного действия на сердце. Сообщалось о нежелательных явлениях со стороны сердца при применении препарата Калетра® в доклинических исследованиях; поэтому в настоящее время нельзя полностью исключить возможное потенцирование препаратом Калетра® сердечных эффектов (см. раздел «Побочные действия»).
Не рекомендуется сочетанное назначение препарата Калетра® с рифампицином. Рифампицин в сочетании с препаратом Калетра® вызывает значительное снижение концентраций лопинавира, что может, в свою очередь, существенно уменьшать его терапевтический эффект. Адекватной экспозиции лопинавира/ритонавира можно достичь при использовании более высоких доз препарата Калетра®, но это связано с более высоким риском токсического действия на печень и желудочно-кишечный тракт. Таким образом, такого сочетанного применения следует избегать, если оно не является крайне необходимым (см. раздел «Лекарственные взаимодействия»).
Кортикостероиды
Одновременное применение препарата лопинавира/ритонавира и ингаляционного, инъекционного или интраназального флутиказона, будесонида, триамцинолона или иных глюкокортикоидов, которые метаболизируются под действием CYP3A, не рекомендуется, если потенциальная польза от лечения не перевешивает риск системных кортикостероидных эффектов, включая синдром Кушинга и подавление функции надпочечников.
Одновременное применение лопинавира/ритонавира и флутиказона пропионата может значительно повышать плазменные концентрации флутиказона пропионата и снижать сывороточные концетрации кортизола. Сообщалось о развитии системных эффектов кортикостероидов, включая синдром Кушинга и подавление функции надпочечников, у больных, получавших лопинавир/ритонавир и ингаляции или интраназальное введение флутиказона пропионата или будесонида, или инъекции триамцинолона (см. раздел «Лекарственные взаимодействия»).
Другие
Пациенты, принимающие препарат Калетра®, раствор для приема внутрь, особенно с нарушением функции почек или сниженной способностью к метаболизму пропиленгликоля (например, лица азиатского происхождения), должны находиться под строгим контролем в связи с возможностью развития побочных реакций, обусловленных токсическим действием пропиленгликоля (например, судороги, ступор, тахикардия, гиперосмолярность, лактатацидоз, нефротоксичность, гемолиз) (см. раздел «Противопоказания»).
Калетра® не излечивает ВИЧ-инфекции или СПИД. Хотя и было показано, что эффективное подавление вирусов противовирусными препаратами существенно снижает риск половой передачи, остаточный риск нельзя полностью исключить. Предосторожности против передачи инфекции половым путем необходимо принимать в соответствии с национальными руководствами. Лица, принимающие препарат Калетра®, также подвержены риску развития ВИЧ-ассоциированных заболеваний и СПИДа.
Кроме пропиленгликоля, Калетра® содержит этанол (42 объёмных %), который потенциально опасен для лиц с заболеваниями печени, алкоголизмом, эпилепсией, травмами и заболеваниями головного мозга, а также для беременных и детей. Он может изменить или усилить действие других лекарственных средств. Калетра® содержит до 0,8 г фруктозы в одной дозе, при надлежащем применении, что неуместно для лиц с врожденной непереносимостью фруктозы. Калетра® содержит до 0,3 г глицерина в одной дозе, что только при передозировке может вызвать головную боль и желудочно-кишечные расстройства. Также, в растворе препарата Калетра® содержится полиоксол 40, гидрогенизированное касторовое масло и калий, поэтому при употреблении больших доз препарата могут возникнуть желудочно-кишечные расстройства. О наличии калия в препарате следует предупреждать пациентов, получающих диету с низким содержанием калия.
Особый риск токсичности препарата Калетра®, раствор для приема внутрь, связан с содержанием в лекарственном средстве этанола и пропиленгликоля
Медицинские работники должны знать, что Калетра® раствор для перорального применения имеет высокую концентрацию и содержит 42,4 объемных % этанола и 15,3 % (масса на объём) пропиленгликоля. Каждый 1 мл раствора препарата Калетра® содержит 356,3 мг спирта и 152,7 мг пропиленгликоля.
Особое внимание должно быть уделено расчету дозы препарата Калетра®, выписке рецепта, распространению информации и инструкций по дозированию для сведения к минимуму риска для лекарственных ошибок и передозировки. Это особенно важно для маленьких детей.
Количество этанола и пропиленгликоля всех лекарств, которые назначены ребенку, должны быть приняты во внимание для того, чтобы избежать токсичности этих вспомогательных веществ. У детей необходимо внимательно следить за токсичностью, связанной с препаратом Калетра®, раствор для приема внутрь, в том числе: гиперосмолярность с или без молочнокислого ацидоза, почечная токсичность, угнетение центральной нервной системы (в том числе ступор, кома и апноэ), судороги, гипотония, нарушения ритма сердца и изменения на ЭКГ, гемолиз.
Случаи кардиотоксичности, которые угрожали жизни в постмаркетинговых данных (в том числе полная атриовентрикулярная (AV) блокада, брадикардия и кардиомиопатия), молочнокислый ацидоз, острая почечная недостаточность, угнетение ЦНС и респираторные осложнения, приводящие к смерти, были зарегистрированы в основном у недоношенных новорожденных, принимающих препарат Калетра®, раствор для перорального применения (см. разделы «Противопоказания» и «Передозировка»).
Применение у детей
В клинических исследованиях с участием ВИЧ-инфицированных детей в возрасте от 6 месяцев до 18 лет профиль побочных эффектов был сходным с таковым у взрослых.
Препарат Калетра® не должен применяться у детей в режиме один раз в день.
Беременность и период лактации
Как правило, при принятии решения об использовании антиретровирусных препаратов для лечения ВИЧ-инфекции у беременных женщин и, следовательно, для снижения риска вертикальной передачи ВИЧ новорожденному, данные исследований на животных, а также клинический опыт у беременных женщин следует принимать во внимание для того, чтобы охарактеризовать безопасность для плода.
Действие лопинавира/ ритонавира было изучено более чем у 3000 женщин во время беременности, включая более 1000 женщин во время первого триместра.
В постмаркетинговых наблюдениях Антиретровирусного Реестра Беременных, основанного в январе 1989 года, о повышенном риске врожденных дефектов не сообщалось, среди более чем 600 женщин, принимавших лопинавир/ритонавир в первом триместре беременности. Распространенность врожденных дефектов при применении лопинавира в любом триместре беременности можно сравнить с распространенностью врожденных дефектов в общей популяции. Врожденные дефекты, указывающие на общую этиологию, не наблюдались.
На основе вышеуказанных данных, мальформативный риск у человека маловероятен. При клинических показаниях лопинавир может использоваться во время беременности.
Период лактации
Исследования у мышей показали, что лопинавир выделяется с молоком. Не известно, выделяется ли это лекарственное средство с молоком женщин. В качестве общего правила рекомендуется, чтобы матери, инфицированные ВИЧ, не кормили детей грудью ни при каких обстоятельствах для того, чтобы избежать передачи ВИЧ.
Фертильность
Данные исследований у животных не показали влияния на фертильность. Отсутствуют данные о влиянии лопинавира/ритонавира на фертильность у человека.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Не проводилось исследований по изучению влияния препарата на способность управлять транспортными средствами и механизмами. Пациентов следует проинформировать, что во время приема препарата Калетра® наблюдалась тошнота (см. раздел «Побочные действия»).
Раствор для приема внутрь Калетра® содержит примерно 42 объемных % спирта.
Симптомы: слюнотечение, рвота, диарея, атаксия, кахексия, дегидратация, тремор.
Лечение: общая терапия на фоне наблюдения за жизненно важными функциями и клиническим состоянием больного. Специфического антидота для лопинавира/ритонавира не существует. При возможности следует удалить из желудка остатки не всосавшегося препарата путём стимуляции рвоты или промывания желудка. Для облегчения удаления остатков препарата можно использовать активированный уголь. Поскольку лопинавир/ритонавир активно связываются с белками плазмы, проведение диализа не приведет к значительному выведению препарата из организма.
По 60 мл препарата в полиэтилентерефталевом пластиковом флаконе янтарного цвета с навинчивающимся полипропиленовым колпачком, имеющим приспособление, препятствующее открытию флакона детьми.
По 5 флаконов вместе с 5 дозаторами (5 мл) с ценой деления 0.1 мл вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в картонную пачку.
Хранить при температуре от 2ºС до 8ºС. После вскрытия раствор можно хранить вне холодильника при температуре ниже 25ºС в течение 42 дней, после чего остаток уничтожается. Рекомендуется указать на упаковке дату начала хранения вне холодильника. Не подвергать воздействию тепла!
Хранить в недоступном для детей месте!
2 года
Не употреблять после истечения срока годности, указанного на упаковке.
Аесика Квинборо Лтд, Великобритания
Цены в аптеках на Калетра 100 мг+25 мг, таблетки, покрытые пленочной оболочкой, 60 шт.
История стоимости Калетра 100 мг+25 мг, таблетки, покрытые пленочной оболочкой, 60 шт.
12.06-18.06
4 368 ₽ (-96 ₽)
19.06-25.06
4 260 ₽ (-108 ₽)
26.06-02.07
4 331 ₽ (+71 ₽)
03.07-09.07
4 228 ₽ (-103 ₽)
10.07-13.07
4 200 ₽ (-28 ₽)
Указана средняя стоимость товара в аптеках региона Москва и МО за период и разница по сравнению с предыдущим периодом
Калетра® (Kaletra)
💊 Состав препарата Калетра®
✅ Применение препарата Калетра®
Описание активных компонентов препарата
Калетра®
(Kaletra)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2018.05.16
Владелец регистрационного удостоверения:
Код ATX:
J05AR10
(Лопинавир и ритонавир)
Лекарственная форма
| Калетра® |
Таб., покр. пленочной оболочкой, 100 мг+25 мг: 60 шт. рег. №: ЛП-000116 |
Форма выпуска, упаковка и состав
препарата Калетра®
Таблетки, покрытые пленочной оболочкой бледно-розового цвета, овальные, на одной стороне нанесена гравировка логотипа компании Эбботт и «AC».
Вспомогательные вещества: коповидон К28 — 426.9 мг, сорбитана лаурат — 41.95 мг, кремния диоксид коллоидный — 6 мг; второй слой: натрия стеарилфумарат — 6.15 мг, кремния диоксид коллоидный — 4 мг.
Состав пленочной оболочки: Опадрай® II розовый 85F14399 — 15 мг (поливиниловый спирт — 40%, титана диоксид — 24.85%, тальк — 14.8%, макрогол 3350 — 20.2%, краситель железа оксид красный (E172) — 0.15%).
60 шт. — флаконы из полиэтилена высокой плотности (1) — пачки картонные.
Фармакологическое действие
Комбинированное противовирусное лекарственное средство.
Лопинавир является ингибитором протеазы ВИЧ-1 и ВИЧ-2 вируса иммунодефицита человека (ВИЧ) и обеспечивает противовирусную активность данной комбинации. Ингибирование ВИЧ-протеаз препятствует синтезу белков вируса и предотвращает расщепление полипептида gag-pol, что приводит к образованию незрелого и неспособного к инфицированию вируса.
Ритонавир ингибирует опосредованный изоферментом CYP3A4 метаболизм лопинавира в печени, что приводит к повышению концентрации лопинавира в плазме крови. Ритонавир также является ингибитором протеазы ВИЧ.
Фармакокинетика
Лопинавир практически полностью метаболизируется под действием изоферментов CYP3A. Ритонавир ингибирует метаболизм лопинавира и вызывает увеличение его концентрации в плазме крови. При применении лопинавира/ритонавира в дозе 400/100 мг 2 раза/сут средние Css лопинавира в плазме у ВИЧ-инфицированных пациентов в 15-20 раз превышали таковые ритонавира, а концентрация ритонавира в плазме составляла менее 7% от концентрации при приеме ритонавира в дозе 600 мг 2 раза/сут. EC50 лопинавира in vitro примерно в 10 раз ниже таковой ритонавира. Таким образом, противовирусная активность комбинации лопинавира и ритонавира определяется лопинавиром.
При приеме 400/100 мг лопинавира/ритонавира 2 раза/сут во время еды в течение 3 недель, средняя Cmax составила 9.8±3.7 мкг/мл и достигалась примерно через 4 ч . Css перед утренней дозой составляла 7.1±2.9 мкг/мл и минимальная концентрация (Cmin) в пределах интервала дозирования составляла 5.5±2.7 мкг/мл. AUC лопинавира в течение 12 ч после приема препарата составляла в среднем 92.6±36.7 мкг×ч/мл. Абсолютная биодоступность лопинавира в комбинации с ритонавиром в организме человека установлена не была.
В равновесном состоянии приблизительно 98-99% лопинавира находятся в связи с белками плазмы. Лопинавир связывается с альфа1-кислым гликопротеином и альбумином, однако, у лопинавира более высокое сродство к альфа1-кислому гликопротеином. В равновесном состоянии связывание лопинавира с белками плазмы остается постоянным при концентрациях, которые устанавливаются в крови после приема лопинавира/ритонавира в дозе 400/100 мг 2 раза/сут.
В исследованиях in vitro показано, что лопинавир преимущественно подвергается окислительному метаболизму с участием системы цитохрома Р450 гепатоцитов в основном под воздействием изофермента CYP3A. Ритонавир — мощный ингибитор изофермента CYP3A, который ингибирует метаболизм лопинавира, что обеспечивает увеличение концентрации лопинавира в плазме крови. После однократного приема 400/100 мг лопинавира/ритонавира (с меченым 14C-лопинавиром), 89% радиоактивности обеспечено исходным лекарственным препаратом. В организме человека было выявлено, по крайней мере, 13 окислительных метаболитов лопинавира. Ритонавир способен индуцировать изоферменты цитохрома Р450, что приводит к индукции его собственного метаболизма. В ходе длительного применения концентрации лопинавира перед приемом следующей дозы снижались со временем и стабилизировалось приблизительно через 10-16 дней.
После приема 400/100 мг 14C-лопинавира/ритонавира через 8 дней около 10.4±2.3% и 82.6±2.5% от принятой дозы 14C-лопинавира обнаруживается в моче и кале, соответственно. Причем неизмененный лопинавир составляет соответственно 2.2% и 19.8%. После длительного применения менее 3% дозы лопинавира экскретируется в неизмененном виде почками. Клиренс лопинавира при приеме внутрь составляет 5.98±5.75 л/ч.
Печеночная недостаточность. Лопинавир метаболизируется и выводится в основном печенью. Комбинированное дозирование лопинавира/ритонавира по 400/100 мг 2 раза/сут у пациентов, одновременно инфицированных ВИЧ и вирусом гепатита С, с нарушением функции печени средней и легкой степени тяжести приводило к 30%-ому увеличению AUCлопинавира и 20%-ому увеличению Cmax по сравнению с ВИЧ-инфицированными пациентами с нормальной функцией печени. Связывание лопинавира с белками плазмы было ниже при легкой и средней степени печеночной недостаточности по сравнению с контрольными группами (99.09% по сравнению с 99.31% соответственно).
Показания активных веществ препарата
Калетра®
Лечение ВИЧ-инфекции у взрослых и детей от 3 лет в составе комбинированной терапии.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Для приема внутрь. Дозу устанавливают индивидуально, в зависимости от схемы лечения, предшествующей и одновременно применяемой терапии.
Побочное действие
Взрослые
Определение частоты побочных реакций: очень часто (≥1/10), часто (≥1/100, но <1/10), нечасто (≥1/1000, но <1/100).
Со стороны иммунной системы: часто — реакции гиперчувствительности, в т.ч. крапивница и ангионевротический отек; нечасто — синдром восстановления иммунитета.
Со стороны пищеварительной системы: очень часто — диарея, тошнота; часто — рвота, боль в животе (в верхних и нижних отделах), гастроэнтерит, колит, диспепсия, панкреатит, гастроэзофагеальный рефлюкс, геморрой, метеоризм, вздутие живота, гепатит, гепатомегалия, холангит, стеатоз печени; нечасто — запор, стоматит, язвы слизистой оболочки полости рта, дуоденит, гастрит, желудочно-кишечное кровотечение (в т.ч. ректальное кровотечение), сухость во рту, язвы желудка и кишечника, недержание кала.
Со стороны нервной системы: часто — головная боль, мигрень, бессонница, невропатия периферическая невропатия, головокружение, тревожность; нечасто — агевзия, судороги, тремор, цереброваскулярные нарушения, нарушения сна, снижение либидо.
Со стороны сердечно-сосудистой системы: часто — артериальная гипертензия; нечасто — атеросклероз, инфаркт миокарда, AV-блокада, недостаточность трехстворчатого клапана, тромбоз глубоких вен; частота неизвестна — увеличение интервала PR.
Со стороны кожи и подкожно-жировой клетчатки: часто — сыпь (в т.ч. макуло-папулезная), дерматит, экзема, себорея, усиленное потоотделение в ночное время, зуд; нечасто — алопеция, капиллярит, васкулит; частота неизвестна — липодистрофия и перераспределение подкожно-жировой клетчатки.
Со стороны костно-мышечной системы: часто — скелетно-мышечная боль (в т.ч. артралгия и боль в спине), миалгия, мышечная слабость, спазмы мышц; нечасто — рабдомиолиз, остеонекроз.
Со стороны обмена веществ и эндокринной системы: часто — гиперхолестеринемия, гипертриглицеридемия, снижение массы тела, снижение аппетита, сахарный диабет; нечасто — увеличение массы тела, лактацидоз, повышение аппетита, мужской гипогонадизм; частота неизвестна — инсулинорезистентность.
Со стороны мочевыделительной системы: часто — почечная недостаточность; нечасто — гематурия, нефрит.
Со стороны репродуктивной системы: часто — эректильная дисфункция, аменорея, меноррагия.
Со стороны системы кроветворения: часто — анемия, лейкопения, нейтропения, лимфаденопатия.
Со стороны органов чувств: нечасто — вестибулярное головокружение, шум в ушах, нарушения зрения.
Инфекции: очень часто — инфекции верхних дыхательных путей; часто — инфекции нижних дыхательных путей, инфекции кожи и подкожной жировой клетчатки, в т.ч. целлюлит, фолликулит, фурункулез.
Общие реакции: часто — слабость, астения.
Изменение лабораторных показателей: увеличение концентрации глюкозы, мочевой кислоты, общего холестерина, общего билирубина, триглицеридов, повышение активности АСТ, АЛТ, ГГТ, липазы, амилазы, КФК, снижение концентрации неорганического фосфора, гемоглобина, снижение КК.
Дети
Профиль побочных эффектов у детей в возрасте от 6 мес до 12 лет был сходен с таковым у взрослых. Чаще всего наблюдались сыпь, дисгевзия, рвота, диарея.
Со стороны лабораторных показателей у детей зарегистрированы следующие изменения: увеличение содержания общего билирубина, общего холестерина, повышение активности амилазы, повышение активности АСТ, АЛТ, нейтропения, тромбоцитопения, повышение или понижение содержания натрия.
При применении лопинавира/ритонавира были также зарегистрированы отдельные случаи гепатита, токсического эпидермального некролиза, синдрома Стивенса-Джонсона, многоформной экссудативной эритемы и брадиаритмии.
Описание отдельных побочных эффектов
У ВИЧ-инфицированных пациентов с тяжелым иммунным дефицитом во время начала комбинированной антиретровирусной терапии (кАРТ) могут возникнуть бессимптомные или остаточные оппортунистические инфекции. Также сообщалось об аутоиммунных нарушениях (таких как диффузный токсический зоб), время начала которых, однако, более вариабельно — заболевание может начаться через продолжительный срок после начала лечения.
Были отмечены случаи остеонекроза, в особенности у пациентов с факторами риска в анамнезе, прогрессирующей ВИЧ-инфекцией или после продолжительного применения антиретровирусной терапии. Частота их возникновения неизвестна.
Противопоказания к применению
Тяжелая печеночная недостаточность; одновременное применение препаратов, клиренс которых значительно зависит от метаболизма посредством изофермента CYP3A. К таким препаратам относятся астемизол, блонансерин, терфенадин, мидазолам (при пероральном применении), триазолам, цизаприд, пимозид, салметерол, силденафил (только в случае лечения легочной гипертензии), тадалафил (только в случае лечения легочной гипертензии), варденафил, аванафил, вориконазол, алкалоиды спорыньи (например, эрготамин и дигидроэрготамин, эргометрин и метилэргометрин), ингибиторы ГМГ-КоА редуктазы (ловастатин, симвастатин, аторвастатин), фосампренавир, алфузозин, фузидовая кислота (при лечении кожных инфекций), амиодарон, кветиапин; одновременное применение с препаратами зверобоя, боцепревиром, симепревиром; одновременное применение с кетоконазолом и итраконазолом в высоких дозах (более 200 мг/сут); одновременное применение стандартной дозы комбинации с рифампицином; одновременное применение комбинации типранавира с низкой дозой ритонавира; детский возраст до 6 месяцев; детский возраст до 3 лет (для лекарственных форм, предназначенных для детей старше 3 лет и взрослых); применение комбинации в сочетании с карбамазепином, фенобарбиталом или фенитоином; применение комбинации в сочетании с препаратами эфавиренз, невирапин, ампренавир или нелфинавир; применение комбинации у детей и подростков до 18 лет; применение комбинации при беременности; повышенная чувствительность к лопинавиру и/или ритонавиру.
С осторожностью
Вирусный гепатит В и С; цирроз печени; печеночная недостаточность легкой и средней степени тяжести; повышение активности печеночных ферментов; панкреатит; гемофилия А и В; дислипидемия (гиперхолестеринемия, гипертриглицеридемия); пациенты пожилого возраста старше 65 лет; пациенты с органическими заболеваниями сердца, пациенты с расстройствами проводящей системы сердца в анамнезе или пациенты, принимающие препараты, удлиняющие интервал PR (такие как верапамил или атазанавир), или препараты, удлиняющие интервал QT (фенирамин, хинидин, эритромицин, кларитромицин); одновременное применение с препаратами для лечения эректильной дисфункции, а именно с силденафилом, тадалафилом; одновременное применение с фентанилом, розувастатином, бупропионом, вдыхаемыми или вводимыми через нос ГКС (например, флутиказоном, будесонидом), с антиаритмическими препаратами (такими как бепридил, лидокаин и хинидин), с дигоксином, ламотриджином, вальпроевой кислотой, бедаквилином, с тразодоном.
Применение при беременности и кормлении грудью
Доступные данные показывают, что лопинавир/ритонавир не увеличивает риск общих серьезных врожденных пороков развития по сравнению с исходной частотой возникновения врожденных пороков развития. При необходимости лопинавир/ритонавир можно использовать во время беременности.
Исследования на крысах выявили, что лопинавир выделяется с молоком матери. Неизвестно, выделяются ли активные вещества комбинации в грудным молоком у человека. При необходимости применения в период лактации грудное вскармливание следует прекратить.
Применение при нарушениях функции печени
Состорожностью следует применять препарат при вирусном гепатите В и С; циррозе печени; печеночной недостаточности легкой и средней степени; повышении активности печеночных ферментов.
Применение лопинавира/ритонавира противопоказано у пациентов с тяжелым нарушением функции печени.
Применение при нарушениях функции почек
Фармакокинетика лопинавира у пациентов с почечной недостаточностью не изучалась. Поскольку почечный клиренс лопинавира и ритонавира незначителен, у пациентов с почечной недостаточностью не ожидается увеличение их плазменной концентрации.
Применение у детей
Противопоказано применение у детей в возрасте до 3 месяцев; у детей в возрасте до 3 лет (для лекарственных форм, предназначенных для детей старше 3 лет и взрослых).
Применение комбинации лопинавир/ритонавир 1 раз/сут у детей и подростков в возрасте до 18 лет противопоказано.
Применение у пожилых пациентов
Состорожностью следует применять препарат у пациентов пожилого возраста (старше 65 лет).
Особые указания
Фармакокинетические данные свидетельствуют о том, что у ВИЧ-позитивных больных с гепатитом С и легким или средней степени тяжести нарушением функции печени возможно увеличение концентрации лопинавира в плазме крови примерно на 30%, а также снижение его связывания с белками плазмы крови. При наличии у пациента гепатита В или С или значительного увеличения активности аминотрансфераз перед началом лечения повышен риск дальнейшего их увеличения.
У пациентов с уже имеющимися нарушениями со стороны печени, включая хронические гепатиты, наблюдается повышенная частота нарушений функции печени во время комбинированной антиретровирусной терапии. В связи с этим необходимо проводить тщательный мониторинг в соответствии со стандартной клинической практикой. В случае ухудшения состояния пациентов терапию лопинавиром/ритонавиром следует отменить.
ВИЧ-инфицированные пациенты с хроническим гепатитом В или С, получающие комбинированную антиретровирусную терапию, находятся в группе повышенного риска развития серьезных и потенциально смертельных побочных эффектов. Они обычно наблюдались у больных с прогрессирующей ВИЧ-инфекцией и сопутствующим хроническим гепатитом или циррозом печени, получавших избыточную лекарственную терапию. Причинно-следственная связь таких случаев с терапией лопинавиром/ритонавиром не установлена.
В постмаркетинговом периоде у ВИЧ-инфицированных больных, получавших ингибиторы протеаз, были зарегистрированы случаи развития и декомпенсации сахарного диабета и гипергликемии. Для лечения данных состояний в некоторых случаях приходилось назначать инсулин или пероральные гипогликемические препараты, или повышать их дозы. В некоторых случаях развивался диабетический кетоацидоз. У некоторых больных гипергликемия сохранялась после отмены ингибитора протеаз. Сообщения об этих случаях поступали в добровольном порядке, поэтому оценить их частоту и связь с терапией ингибиторами протеаз не представляется возможным. При применении лопинавира/ритонавира у пациентов с сахарным диабетом необходимо мониторировать концентрацию глюкозы в крови.
У пациентов с прогрессирующей ВИЧ-инфекцией повышен риск развития гипертриглицеридемии и панкреатита, а у больных с панкреатитом в анамнезе повышен риск его рецидива во время лечения лопинавиром/ритонавиром. Пациентов, у которых наблюдаются тошнота, рвота, боль в животе или отклонения лабораторных показателей (например, повышенные активности липазы или амилаза), следует обследовать, и в случае подтверждения диагноза панкреатит, лечение данной комбинацией следует прекратить.
У больных гемофилией типа А и В при лечении ингибиторами протеаз описаны случаи кровотечений, включая спонтанное образование подкожных гематом и развитие гемартроза. Некоторым пациентам назначали дополнительные дозы фактора VIII. Более чем в половине описанных случаев лечение ингибиторами протеаз удалось продолжить или возобновить.
На фоне приема лопинавир/ритонавира у некоторых пациентов отмечалось умеренное бессимптомное удлинение интервала PR. При приеме лопинавира/ритонавира редко сообщалось о случаях AV-блокады II и III степени у больных с органическим заболеванием сердца и существующими ранее расстройствами проводящей системы сердца или у больных, принимающих препараты, удлиняющие интервал PR (такие как верапамил или атазанавир). У таких пациентов лопинавир/ритонавир следует применять с осторожностью.
На фоне антиретровирусной терапии наблюдали перераспределение/накопление жировой ткани с отложением в центральных частях тела, в области спины, шеи, появлением «горба буйвола», уменьшением жировых отложений на лице и конечностях, увеличением молочных желез и кушингоидом. Механизм и отдаленные последствия этих нежелательных явлений не известны. Их связь с терапией комбинацией лопинавир/ритонавир не установлена.
Высокий риск развития липодистрофии связан с индивидуальными особенностями, такими как пожилой возраст, сопутствующая терапия (длительная антиретровирусная терапия и связанные с ней метаболические нарушения). Клиническое обследование должно включать оценку как физических признаков перераспределения жира, так и лабораторных показателей (измерение натощак липидов в сыворотке крови и концентрации глюкозы в крови). Лечение нарушения липидного обмена следует проводить в соответствии со стандартной клинической практикой.
Лечение лопинавиром/ритонавиром приводило к увеличению концентраций общего холестерина и триглицеридов. Перед началом лечения лопинавиром/ритонавиром и регулярно во время терапии следует контролировать концентрации триглицеридов и холестерина. При наличии липидных нарушений показана соответствующая терапия. Особую осторожность следует соблюдать при назначении лопинавира/ритонавира пациентам с высокими исходными концентрациями липидов в крови и нарушениями обмена липидов в анамнезе. Лечение нарушений липидного обмена следует проводить в соответствии со стандартной клинической практикой.
У больных, получавших комбинированную антиретровирусную терапию, в т.ч. с применением лопинавира/ритонавира, наблюдали развитие синдрома восстановления иммунитета. На фоне восстановления иммунной функции в начале комбинированной антиретровирусной терапии возможно обострение бессимптомных или остаточных оппортунистических инфекций (вызванных такими возбудителями, как Mycobacterium avium, цитомегаловирус, Pneumocystis jirovecii (Pneumocystis carinii) или Mycobacterium tuberculosis), что может потребовать дополнительного обследования и лечения.
На фоне развития синдрома восстановления иммунитета наблюдалось развитие аутоиммунных заболеваний, таких как болезнь Грейвса, полимиозит и синдром Гийена-Барре, однако срок возникновения данных явлений может значительно варьировать и составлять несколько месяцев от начала терапии.
Известно, что многие факторы играют роль в этиологии остеонекроза (прием ГКС, злоупотребление алкоголем, высокий ИМТ, выраженная иммуносупрессия и другие). В частности, сообщается о случаях развития остеонекроза у больных с прогрессирующей ВИЧ-инфекцией и/или длительным применением комбинированной антиретровирусной терапии. Поэтому таким пациентам необходимо рекомендовать обращение к врачу при появлении боли, скованности в суставах и нарушении двигательной функции.
Применение у пациентов пожилого возраста
Количество больных в возрасте 65 лет и старше было недостаточным для оценки возможных отличий их ответа на лечение лопинавиром/ритонавиром по сравнению с таковым у пациентов более молодого возраста. При применении лопинавира/ритонавира у пожилых пациентов следует соблюдать осторожность, учитывая повышенную частоту снижения функции печени, почек или сердца, сопутствующие заболевания и сопутствующую терапию.
Применение у детей
Безопасность и фармакокинетический профиль лопинавира/ритонавира у детей в возрасте до 6 мес не установлены. У ВИЧ-инфицированных детей в возрасте от 6 месяцев до 18 лет профиль побочных эффектов в клиническом исследовании был сходным с таковым у взрослых.
Применение лопинавира/ритонавира 1 раз/сут у детей противопоказано.
Взаимодействие
Препараты, одновременное применение которых с лопинавиром/ритонавиром противопоказано: астемизол, блонансерин, терфенадин, мидазолам (для приема внутрь), триазолам, цизаприд, пимозид, салметерол, силденафил (только в случае его применения для лечения легочной гипертензии, см. раздел «Лекарственное взаимодействие»), тадалафил (только в случае его применения для лечения легочной гипертензии, см. раздел «Лекарственное взаимодействие»), варденафил, аванафил, вориконазол, алкалоиды спорыньи (например, эрготамин и дигидроэрготамин, эргометрин и метилэргометрин), ингибиторы ГМГ-КоА-редуктазы (ловастатин, симвастатин), фосампренавир, алфузозин, фузидовая кислота, амиодарон, кветиапин, препараты зверобоя, боцепревир, кетоконазол и итраконазол в высоких дозах (более 200 мг/сут), применение стандартной дозы препарата Калетра® с рифампицином, применение препарата Калетра® и типранавира с ритонавиром в низкой дозе, применение препарата Калетра® 1 раз/сут в комбинации с карбамазепином, фенобарбиталом или фенитоином, применение препарата Калетра® 1 раз/сут в комбинации с препаратами эфавиренз, невирапин, ампренавир или нелфинавир, симепревир.
Препараты, одновременное применение которых с лопинавиром/ритонавиром не рекомендуется: одновременное применение лопинавира/ритонавира и флутиказона, а также других ГКС, которые метаболизируются изоферментом CYP3A4, таких как будесонид, за исключением случаев, когда потенциальная польза от такой терапии перевешивает риск возникновения системных кортикостероидных эффектов, включая синдром Кушинга и угнетение функции коры надпочечников. Совместное применение ривароксабана и препарата Калетра® может увеличить риск кровотечения. Совместное применение препарата Калетра® и колхицина не рекомендуется из-за потенциального увеличения нервно- мышечной токсичности колхицина (включая рабдомиолиз), особенно у больных с почечной или печеночной недостаточностью.
Препараты, при одновременном применении которых с лопинавиром/ритонавиром необходимо соблюдать осторожность: верапамил, атазанавир, фенирамин, хинидин, эритромицин, кларитромицин, одновременное применение с препаратами для лечения эректильной дисфункции, а именно — с силденафилом, тадалафилом, одновременное применение с фентанилом, розувастатином, бупропионом, одновременное применение с антиаритмическими средствами, такими как бепридил, лидокаин и хинидин, одновременное применение с дигоксином, ламотриджином, вальпроевой кислотой, тразодоном.
Влияние на способность к управлению транспортными средствами и механизмами
В период лечения необходимо соблюдать осторожность при управлении транспортными средствами и занятии другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. При развитии побочных эффектов, которые могут влиять на указанные способности (например, головокружения) рекомендуется воздержаться от вождения автотранспорта и управления механизмами. Исследования способности к вождению автотранспорта и управлению механизмами не проводились.
Лекарственное взаимодействие
Совместное применение комбинации лопинавир/ритонавир и лекарственных средств, которые преимущественно метаболизируются CYP3A, может привести к увеличению концентрации в плазме крови другого лекарственного средства, которое могло бы усилить его терапевтические и побочные реакции.
Комбинация лопинавир/ритонавир in vivo индуцирует собственный метаболизм и увеличивает биотрансформацию некоторых лекарственных средств, метаболизирующихся с участием цитохрома Р450 (в т.ч. изоферментов CYP2C9 и CYP2C19), и глюкуронизацию. Это может привести к понижению концентрации в плазме крови и уменьшению эффективности совместно применяемых лекарственных средств.
Лопинавир/ритонавир in vitro и in vivo ингибирует изофермент CYP3A. Одновременное применение комбинации лопинавир/ритонавир и препаратов, метаболизирующихся изоферментами CYP3A (в т.ч. дигидропиридиновые антагонисты кальция, ингибиторы ГМГ-КоА-редуктазы, иммунодепрессанты и ингибиторы ФДЭ-5 может привести к увеличению их концентраций в плазме и усилению или продлению терапевтического действия и побочных эффектов.
Значительное увеличение AUC (≥3 раза) на фоне лечения лопинавиром/ритонавиром наблюдается при одновременном применении препаратов, активно метаболизирующихся под действием изоферментов CYP3A и подвергающихся метаболизму при первом прохождении через печень.
Лопинавир/ритонавир метаболизируется под действием изоферментов CYP3A. Одновременное применение лопинавира/ритонавира с индукторами этого изофермента может привести к снижению концентраций лопинавира в плазме и его терапевтического эффекта. Другие препараты, ингибирующие изоферменты CYP3A, могут вызвать увеличение концентрации лопинавира в плазме, хотя эти изменения не были отмечены при одновременном применении с кетоконазолом.
Показано, что лопинавир/ритонавир вызывает повышение концентрации тенофовира. Механизм взаимодействия не известен. У пациентов, получающих лопинавир/ритонавир одновременно с тенофовиром, следует проводить мониторинг возможности возникновения связанных с тенофовиром побочных эффектов.
Сообщалось о случаях увеличения активности КФК, миалгии, миозита и рабдомиолиза (редко) при приеме ингибиторов протеазы ВИЧ, особенно в комбинации с НИОТ.
Эфавиренз и невирапин индуцируют изофермент CYP3A и, таким образом, могут уменьшить плазменные концентрации других ингибиторов протеазы ВИЧ при применении в комбинации с лопинавиром/ритонавиром.
Делавирдин может вызвать повышение концентрации лопинавира в плазме.
Одновременная терапия лопинавиром/ритонавиром и ампренавиром вызывает снижение концентрации лопинавира.
Исследование показало, что одновременное применение лопинавира/ритонавира с фосампренавиром снижает концентрации фосампренавира и лопинавира. Адекватные в отношении безопасности и эффективности дозы фосампренавира и лопинавира/ритонавира в комбинации не установлены. Одновременное применение фосампренавира и лопинавира/ритонавира не рекомендуется.
При применении лопинавира/ритонавира в дозе 400/100 мг 2 раза/сут может потребоваться снижение дозы индинавира. Применение лопинавира/ритонавира в комбинации с индинавиром 1 раз/сут не изучено.
Одновременное применение лопинавира/ритонавира с нелфинавиром приводит к снижению концентрации лопинавира.
При совместном применении лопинавира/ритонавира с дополнительной дозой ритонавира (100 мг 2 раза/сут) наблюдалось увеличение AUC лопинавира на 33% и Сmin на 64% по сравнению с таковыми при применении только лопинавира/ритонавира в дозе 400/100 мг 2 раза/сут.
Лопинавир/ритонавир увеличивает концентрацию саквинавира (применение саквинавира в дозе 800 мг 2 раза/сут в сочетании с лопинавиром/ритонавиром ведет к увеличению AUC, Cmax и Сmin по сравнению с приемом саквинавира в дозе 1200 мг 3 раза/сут). При применении лопинавира/ритонавира в дозе 400/100 мг 2 раза/сут может потребоваться снижение дозы саквинавира. Применение лопинавира/ритонавира в комбинации с саквинавиром 1 раз/сут не изучалось.
При одновременном применении типранавира (500 мг 2 раза/сут) с ритонавиром (200 мг 2 раза/сут) и лопинавиром/ритонавиром (400/100 мг 2 раза/сут) происходит уменьшение AUC и Сmin на 55% и 70% соответственно. Одновременное применение лопинавира/ритонавира и типранавира с низкой дозой ритонавира противопоказано.
Одновременное применение лопинавира/ритонавира с телапревиром приводит к снижению Css телапревира без изменения Css лопинавира. Одновременное применение не рекомендуется.
Одновременное применение лопинавира/ритонавира с боцепревиром приводит к снижению Css боцепревира и лопинавира в плазме крови. Одновременное применение лопинавира/ритонавира с боцепревиром противопоказано.
Одновременное применение симепревира с лопинавиром/ритонавиром может вызвать повышение концентрации симепревира в плазме крови. Одновременное применение лопинавира/ритонавира и симепревира противопоказано.
Одновременное применение маравирока с лопинавиром/ритонавиром приводит к увеличению концентрации маравирока в плазме крови. При одновременном применении с лопинавиром/ритонавиром в дозе 400/100 мг 2 раза/сут дозу маравирока необходимо снизить.
Т.к. лопинавир/ритонавир ингибирует изофермент CYP3A4, возможно повышение концентрации фентанила в плазме крови. При одновременном применении лопинавира/ритонавира и фентанила необходимо внимательно контролировать терапевтические и побочные эффекты (включая угнетение дыхания).
При одновременном назначении с лопинавиром/ритонавиром возможно повышение концентраций бепридила, лидокаина и хинидина. Необходима осторожность при применении данных препаратов; следует контролировать их терапевтические концентрации в плазме, если возможно.
В литературных источниках имеются сведения о том, что одновременное применение ритонавира (300 мг каждые 12 ч) и дигоксина приводило к значительному увеличению концентрации дигоксина в крови. Необходимо соблюдать осторожность при применении лопинавира/ритонавира одновременно с дигоксином и контролировать концентрацию дигоксина в сыворотке крови.
Под влиянием лопинавира/ритонавира концентрации фенирамина, хинидина, эритромицина, кларитромицина могут увеличиваться с последующим удлинением интервала QT и развитием побочных явлений со стороны сердца. Необходимо соблюдать особую осторожность при одновременном применении лопинавира/ритонавира вместе с препаратами, удлиняющими интервал QT.
Возможно увеличение сывороточных концентраций дазатиниба, нилотиниба, винкристина, винбластина при применении одновременно с лопинавиром/ритонавиром, что может привести к возникновению побочных эффектов, характерных для данных противоопухолевых препаратов. Дозу нилотиниба и дазатиниба следует подбирать в соответствии с инструкциями по применению данных препаратов.
Возможно влияние на концентрацию варфарина при одновременном применении с лопинавиром/ритонавиром.
Одновременное применение ривароксабана с лопинавиром/ритонавиром может вызвать увеличение концентрации ривароксабана в плазме крови, что может привести к повышению риска возникновения кровотечений. Одновременное применение не рекомендуется.
Кроме того, одновременное применение фенитоина и лопинавира/ритонавира приводит к умеренному уменьшению Css фенитоина. При одновременном применении фенитоина и лопинавира/ритонавира следует контролировать концентрации фенитоина в плазме крови.
Снижение концентраций ламотриджина и вальпроевой кислоты наблюдалось при их совместном применении с лопинавиром/ритонавиром; снижение концентрации ламотриджина достигало 50%. Данные комбинации лекарственных препаратов следует применять с осторожностью. При одновременном применении данных препаратов с лопинавиром/ритонавиром, особенно в период подбора дозы, может потребоваться повышение дозы ламотриджина или вальпроевой кислоты, а также контроль их концентраций в плазме крови.
Одновременное применение бупропиона с лопинавиром/ритонавиром уменьшает плазменные концентрации бупропиона и его активного метаболита (гидроксибупропиона). Если одновременное применение лопинавира/ритонавира с бупропионом необходимо, то его следует проводить под тщательным клиническим контролем эффективности бупропиона без превышения рекомендуемой дозы, несмотря на наблюдаемое усиление метаболизма.
Одновременное применение ритонавира и тразодона может привести к увеличению концентрации тразодона. Наблюдались побочные эффекты: тошнота, головокружение, снижение АД и обморок. Применять тразодон с ингибитором изофермента CYP3A4, таким как лопинавир/ритонавир, следует с осторожностью, при необходимости снижая дозу тразодона.
С осторожностью следует применять данную комбинацию и мидазолам для парентерального введения. Терапию мидазоламом следует проводить в отделении интенсивной терапии или аналогичных условиях, которые могут обеспечить клинический контроль и соответствующее медицинское оборудование в случае угнетения дыхания и/или продолжительного седативного эффекта. Коррекция дозы мидазолама необходима в случае применения более одной инъекции.
При одновременном применении колхицина с лопинавиром/ритонавиром возможно повышение концентрации колхицина в плазме крови. Назначение и подбор дозы колхицина следует производить в соответствии с его инструкцией по применению. Одновременное применение не рекомендуется из-за побочных действий колхицина, связанных с нервно-мышечной токсичностью (включая рабдомиолиз), особенно у пациентов с почечной и печеночной недостаточностью.
Лопинавир/ритонавир может вызвать умеренное увеличение AUC кларитромицина. У пациентов с нарушением функции почек (при КК <30 мл/мин) или печени следует рассмотреть возможность уменьшения дозы кларитромицина при одновременном применении с лопинавиром/ритонавиром.
При одновременном применении рифабутина и лопинавира/ритонавира в течение 10 дней Cmax и AUC рифабутина (неизмененное лекарственное средство и активный 25-О-дезацетил метаболит) увеличились в 3.5 и в 5.7 раз соответственно.
В исследованиях с более высокими дозами лопинавира/ритонавира при одновременном применении с рифампицином было отмечено повышение активности АЛТ и ACT; это явление может зависеть от последовательности приема дозы.
В исследовании на здоровых добровольцах применялось 400 мг бедаквилина однократно и лопинавира/ритонавира 400/100 мг 2 раза/сут в течение 24 дней, что привело к увеличению AUC бедаквилина на 22%.
Исследования по взаимодействию деламанида только с ритонавиром не проводились. В исследованиях на здоровых добровольцах применялся деламанид 100 мг 2 раза/сут и лопинавир/ритонавир 400/100 мг 2 раза/сут в течение 14 дней, при этом наблюдалось небольшое увеличение концентраций деламанида и метаболита деламанида (DM-6705). Если применение деламанида и ритонавира действительно необходимо, следует мониторировать ЭКГ на протяжении всего периода лечения деламанидом в связи с риском удлинения интервала QTc, связанным с метаболитом DM-6705.
Возможно уменьшение терапевтической концентрации атовахона при одновременном применении с лопинавиром/ритонавиром. Может потребоваться увеличение дозы атовахона.
Дексаметазон может вызвать повышение активности изофермента CYP3A и снижение концентрации лопинавира. Необходимо проводить мониторинг противовирусной активности.
Одновременное применение лопинавира/ритонавира и флутиказона может значительно увеличить плазменные концентрации флутиказона и снизить сывороточные концентрации кортизола. Применять следует с осторожностью. Рекомендуется рассмотреть альтернативы флутиказону, особенно при необходимости длительного применения.
При одновременном применении ритонавира с интраназальными и ингаляционными формами флутиказона и будесонида сообщалось о системных эффектах ГКС, включая синдром Иценко-Кушинга и угнетение коры надпочечников. Совместное применение лопинавира/ритонавира и флутиказона, а также других ГКС, которые метаболизируются изоферментом CYP3A4, таких как будесонид, не рекомендуется, за исключением случаев, когда потенциальная польза от такой терапии перевешивает риск возникновения системных кортикостероидных эффектов, включая синдром Кушинга и угнетение функции коры надпочечников.
При одновременном применении лопинавира/ритонавира и любого ГКС для ингаляционного и интраназального применения следует проявлять особую осторожность.
Следует рассматривать возможность уменьшения дозы ГКС при тщательном контроле местных и общих реакций или переход на ГКС, который не является субстратом для изофермента CYP3A4 (например, беклометазон). В случае прекращения терапии ГКС следует проводить постепенное снижение дозы в течение длительного периода.
Может наблюдаться увеличение серологических концентраций фелодипина, нифедипина, никардипина при приеме лопинавира/ритонавира. Необходимо проводить клинический мониторинг при совместном применении с лопинавиром/ритонавиром.
Особую осторожность следует проявлять при применении силденафила и тадалафила с целью лечения эректильной дисфункции у пациентов, принимающих лопинавир/ритонавир. Одновременное применение лопинавира/ритонавира с этими препаратами может значительно увеличить их концентрации, что может привести к увеличению частоты побочных эффектов, таких как артериальная гипотензия и длительная эрекция.
Пациентам, получающим лечение лопинавиром/ритонавиром противопоказан одновременный прием препаратов, содержащих зверобой продырявленный, т.к. данная комбинация может способствовать снижению концентраций лопинавира/ритонавира в плазме крови. Этот эффект может происходить вследствие индукции изофермента CYP3A4 и может привести к потере терапевтического эффекта и развитию резистентности.
В случае если пациент уже принимает препараты зверобоя продырявленного и ему назначен лопинавир/ритонавир, то необходимо отменить препараты зверобоя продырявленного и проверить уровень вирусной нагрузки. При отмене препаратов, содержащих зверобой продырявленный, концентрация лопинавира/ритонавира в плазме крови может увеличиваться. Может потребоваться изменение дозы лопинавира/ритонавира. Индуцирующий эффект может сохраняться в течение по крайней мере 2 недель после прекращения лечения препаратами зверобоя продырявленного. Лопинавир/ритонавир рекомендуется назначать через 2 недели после прекращения приема препаратов зверобоя продырявленного.
Признаков клинически значимого взаимодействия лопинавира/ритонавира с правастатином не выявлено. Метаболизм правастатина и флувастатина не зависит от изофермента CYP3A4, поэтому не ожидается взаимодействие с лопинавиром/ритонавиром. Если показано лечение ингибиторами ГМГ-КоА-редуктазы в период применения лопинавира/ритонавира, то рекомендуется применять правастатин или флувастатин.
Концентрации этих препаратов (например, циклоспорина, такролимуса и сиролимуса) могут повыситься при одновременном применении с лопинавиром/ритонавиром. Рекомендуется более частый контроль терапевтических концентраций до тех пор, пока концентрации этих препаратов в крови не будут стабилизированы.
Известно, что лопинавир/ритонавир снижает плазменные концентрации метадона. Рекомендуется контролировать плазменные концентрации метадона.
Т.к. концентрации этинилэстрадиола в плазме крови может быть снижена при одновременном применении лопинавира/ритонавира и эстроген-содержащих пероральных контрацептивов или контрацептивных средств в форме пластыря, следует применять альтернативные или дополнительные методы контрацепции.
При одновременном применении бозентана в сочетании с лопинавиром/ритонавиром наблюдалось увеличение Сmax и AUC бозентана в 6 и 5 раз соответственно.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Каждая таблетка Калетра содержит:
Ритонавира – 25 мг;
Лопинавира – 100 мг;
Прочие компоненты: диоксид кремния коллоидный, сорбитана лаурат, коповидон К28, стеарилфумарат натрия, Опадрай II розовый.
Калетра – противовирусный препарат, применяемый в терапии ВИЧ. Калетра является комплексным средством, содержащим ритонавир и лопинавир.
Лопинавир – вещество группы ингибиторов протеаз ВИЧ-1 и ВИЧ-2. Лопинавир предупреждает синтез белков вируса вследствие ингибирования ВИЧ протеаз, также препарат предупреждает расщепление gag-pol полипептида, вследствие чего образуется неспособный к инфицированию и незрелый вирус.
Ритонавир – угнетает метаболизм лопинавира, который проходит при участии CYP3 A4 в печени, что приводит к повышению уровней лопинавира в сыворотке. Ритонавир также обладает активностью ингибитора ВИЧ протеазы.
Резистентность
Изоляты ВИЧ-1, имеющие сниженную чувствительность к лопинавиру, были отобраны in vitro (присутствие ритонавира не оказывало влияния на выделение штаммов резистентных к лопинавиру). В ходе исследований у всех оцениваемых пациентов, которые принимали ритонавир/лопинавир, не было выявлено признаков фенотипической или генотипической резистентности к терапии. Дети, которые ранее не получали антиретровирусную терапию, также не имели резистентности.
На втором этапе клинических исследований Калетры у 227 пациентов с ВИЧ, которые ранее получали или не получали антиретровирусную терапию, было выявлено резистентность у 4 из 23 больных с отсутствием вирусологической эффективности терапии (показатели РНК ВИЧ более 400 копий/мл). У данных пациентов снижение эффективности Калетры регистрировалось через 12–100 недель от начала приема, при этом 3 из 4 больных получали ранее терапию одним из ингибиторов ВИЧ протеаз, а 1 из 4 пациентов получал комбинированное лечение ингибиторами ВИЧ протеаз. У всех 4 пациентов выявлены мутации, которые связаны с нечувствительностью к ингибиторам ВИЧ протеаз.
Перекрестная резистентность
Данные о перекрестной резистентности при использовании ритонавира/лопинавира ограничены.
Вирусологический ответ на фоне терапии ритонавиром/лопинавиром изменялся при присутствии 3 и больше аминокислотных замен в генах ВИЧ протеаз (в частности I84V, L33F, L24I, K20M/N/R, I54L/T/V, G48V, I47V, L10F/I/R/V, V82A/C/F/S/T, M36I).
Клиническое значение уменьшения чувствительности in vitro к лопинавиру изучалось на основании вирусологического ответа на применение ритонавира/лопинавира с учетом исходного фенотипа и генотипа вируса у 56 больных с РНК ВИЧ более 1000 копий/мл, которые ранее получали индинавир, ритонавир, нелфинавир или саквинавир. Пациентам рекомендовали ритонавир/лопинавир в одной из доз в комбинации с нуклеозидными ингибиторами обратной транскриптазы и эфавирензом. До начала лечения показатели ЕС50 лопинавира для 56 штаммов вируса были выше в 0,5–96 раз в сравнении с ЕС50 для вируса «дикого» типа. У 31 из 56 штаммов определялось уменьшение чувствительности к лопинавиру в 4 и более раз, среднее снижение чувствительности среди 31 штамма достигало 27,9 раз. Спустя 48 недель от начала приема ритонавира/лопинавира, нуклеозидного ингибитора обратной транскриптазы и эфавиренза уровни РНК ВИЧ менее 400 копий/мл регистрировались у 25 из 27, 11 из 15 и 2 из 8 больных, исходная чувствительность к лопинавиру у которых была снижена, соответственно, менее чем в 10 раз, 10–40 раз и более чем в 40 раз (концентрация РНК ВИЧ менее 50 копий/мл регистрировалась у 22 из 27, 9 из 15 и 2 из 8 больных соответственно). Для более подробного изучения мутаций, которые приводят к развитию резистентности к лопинавиру, требуются дополнительные исследования.
Фармакокинетический профиль препарата Калетра
Существенных различий в фармакокинетическом профиле ритонавира/лопинавира у добровольцев (здоровых) и ВИЧ-положительных пациентов не выявлено.
Лопинавир практически полностью превращается в печени при участии CYP3 A4, при этом ритонавир угнетает превращение лопинавира, приводя к увеличению сывороточных уровней последнего.
При использовании ритонавира/лопинавира в дозе 100/400 мг дважды в сутки средние равновесные уровни лопинавира в сыворотке в 15–20 раз превышали уровни ритонавира, уровни ритонавира при этом составляли не более 7% от аналогичных при приеме 600 мг дважды в сутки.
ЕС50 лопинавира in vitro ниже аналогичных для ритонавира в 10 раз (противовирусная эффективность Калетры определяется, в основном, действием лопинавира).
Пиковые уровни лопинавира в сыворотке при приеме таблеток Калетра (по 4 дважды в день) составляют порядка 9,8 ± 3,7 мкг/мл и достигаются в среднем за 4 часа после принятия таблеток. Средние равновесные уровни перед утренней дозой достигали 7,1 ± 2,8 мкг/мл, минимальные уровни между приемами доз составляли 5,5 ± 2,7 мкг/мл.
До 99% лопинавира в сыворотке связываются белками. Экскретируется ритонавир/лопинавир с мочой и калом.
У пожилых пациентов фармакокинетика таблеток Калетра не изучалась.
При приеме доз препарата Калетра, соответствующих возрастным рекомендациям по дозированию, у детей отмечалось сходство фармакокинетики с таковой у взрослых пациентов.
Калетра не изучалась у пациентов с недостаточностью почек; если учитывать низкий клиренс лопинавира почками, можно говорить о том, что значительных изменений фармакокинетики препарата у таких пациентов не ожидается.
При умеренной недостаточности печени отмечалось повышение AUC лопинавира на 30% и максимальных концентраций на 20%. При тяжелой недостаточности печени препарат Калетра не изучался.
Калетра применяется в комбинированном лечении взрослых и детей старше 3 лет с ВИЧ инфекцией.
Таблетки Калетра предназначены для приема перорально. При приеме необходимо сохранять целостность оболочки. Допускается использование таблеток Калетра вне зависимости от пищи.
Дозирование у взрослых пациентов:
Взрослым пациентам обычно рекомендует прием 4 таблеток Калетра дважды в сутки.
Альтернативной схемой является прием 8 таблеток Калетра один раз в день. Данную схему можно рекомендовать только пациентам, у которых выявлено не более 3 мутаций, которые связаны с механизмами развития резистентности к действию лопинавира.
Если в комплексной терапии применяют омепразол или ранитидин, коррекция дозы таблеток Калетра не требуется.
Если пациенту назначают комплексную терапию с использованием эфавиренза, ампренавира, невирапина или нелфинавира (при подозрении на пониженную чувствительность к лопинавиру, в том числе в случае, если ранее пациент получал антиретровирусную терапию), дозу препарата Калетра увеличивают до 5 таблеток дважды в сутки.
Дозирование у детей:
Взрослые дозы препарата Калетра (по 4 таблетки дважды в день) могут назначаться пациентам без сочетанной терапии нелфинавиром, эфавирензом, невирапином или ампренавиром в случае, если масса тела и площадь поверхности тела более 35 кг и 1,4 м2.
Доза таблеток Калетра для детей с массой тела до 35 кг и площадью поверхности тела (ППТ) 0,6–1,4 м2 определяют индивидуально:
Без назначения эфавиренза, ампренавира, невирапина или нелфинавира:
При ППТ 0,6–0,9 м2 и массе 15–25 кг назначают по 2 таблетки Калетра дважды в сутки.
При ППТ 0,9–1,4 м2 и массе 25–30 кг назначают по 3 таблетки Калетра дважды в сутки.
При ППТ более 1,4 м2 и массе более 35 кг назначают по 4 таблетки Калетра дважды в сутки.
При сочетанном назначении эфавиренза, ампренавира, невирапина или нелфинавира:
При ППТ 0,6–0,8 м2 и массе 15–20 кг назначают по 2 таблетки Калетра дважды в сутки.
При ППТ 0,8–1,2 м2 и массе 20–30 кг назначают по 3 таблетки Калетра дважды в сутки.
При ППТ 1,2–1,7 м2 и массе 30–45 кг назначают по 4 таблетки Калетра дважды в сутки.
При ППТ более 1,7 м2 и массе более 45 кг назначают по 5 таблеток Калетра дважды в сутки.
Детям младше 3 лет, а также при ППТ менее 0,6 м2 таблетки Калетра не назначают.
У взрослых пациентов в ходе исследований регистрировалось чаще всего развитие диареи. Также у взрослых регистрировались такие нежелательные явления:
- Иммунная система: синдром восстановления иммунитета, гиперчувствительность.
- ЖКТ: нарушения стула, боль в эпигастрии, рвота, тошнота, изменение частоты стула, метеоризм, сухость во рту, гастрит, геморрагический энтероколит, дискомфорт, недержание кала, гепатит, панкреатит. Редко: боль в абдоминальной области, дуоденит, дисфагия, энтерит, отрыжка, энтероколит, язва желудка, эзофагит, изъязвление слизистой рта, гепатомегалия, геморрой, периодонтит, стоматит, холецистит, желтуха, ректальное кровотечение, стеатоз печени, холангит.
- ЦНС: парестезии, головная боль, уменьшение либидо, нарушения сна, депрессивное состояние, головокружение, нервозность, беспокойство, сонливость, периферическая нейропатия, изменение вкуса. Редко: спутанность сознания, атаксия, нарушения мышления, дезориентация, возбуждение, дискинезия, экстрапирамидальный синдром, энцефалопатия, мышечный тонус, парез лицевого нерва, мигрень, тремор, апатия, судороги, церебральный инфаркт.
- ССС: сосудистые патологии, стенокардия, гипертензия, инфаркт миокарда, недостаточность трехстворчатого клапана, атриовентрикулярная блокада, чувство сердцебиения, тромбофлебит, тромбоз глубоких вен, варикозное расширение вен, васкулит. Редко: ортостатическая гипотензия, фибрилляция предсердий.
- Кожа и подкожные ткани: липодистрофия, аллергический дерматит, алопеция, сыпь, акне, зуд, гипергидроз, макулопапулезная сыпь. Редко: идиопатический капиллярит, отек лица, экзема, эксфолиативный дерматит, сухость кожи, изменение структуры ногтей, стрии, изменение пигментации, себорея, язвы, гипертрофия кожи.
- Костно-мышечная система: артралгия, миалгия, некроз костей, артрит, остеоартрит, мышечная слабость.
- Мочевыделительная система: нефролитиаз, гематурия, изменение запаха и лабораторных показателей мочи, нефрит.
- Репродуктивная система: аменорея, эректильная дисфункция, увеличение молочных желез, нарушения эякуляции, меноррагия, гинекомастия.
- Дыхательная система: кашель, бронхит, отек легких, одышка, бронхоспазм.
- Система крови: лейкопения, лимфаденопатия, анемия.
- Обмен веществ: синдром Иценко – Кушинга, дегидратация, ожирение, сахарный диабет, изменение массы тела, анорексия. Редко: гипохолестеринемия, гиперурикемия, изменение аппетита, мужской гипогонадизм, гиперлипаземия, гиперамилаземия, гипофосфатемия, гиповитаминоз, лактатацидоз, гипотиреоз, липоматоз. Кроме того, возможно повышение общего холестерина, гипертриглицеридемия, увеличение активности гамма-глутамилтранспептидазы, увеличение уровня глюкозы в сыворотке, повышение активности АСТ/АЛТ и ЩФ, снижение клиренса креатинина, увеличение активности липазы, гипербилирубинемия, снижение уровня гемоглобина, повышение активности креатинфосфокиназы.
- Инфекции: бронхопневмония, бактериальная инфекция, фолликулит, гастроэнтерит, фурункулез, воспаление подкожно-жировой ткани, ринит, фарингит, перинеальный абсцесс, средний отит, сиалоаденит, синусит, грипп.
- Другие: нарушения зрения, изменения равновесия, шум в ушах, гиперакузия, киста, новообразования, слабость, отеки, озноб, боль в груди, спленомегалия.
Нежелательные явления у детей
Побочные явления, которые регистрировались у детей, схожи с таковыми у взрослых. Наиболее частыми нежелательными явлениями были понос, изменение вкуса, сыпь и рвота. Кроме того, регистрировалось развитие вирусных инфекций, лихорадки, запора, гепатомегалии, панкреатита, сухости кожи, снижения гемоглобина, изменений минерального обмена (уровней калия, натрия и кальция), гипербилирубинемии, уменьшения числа тромбоцитов. Также сообщалось о развитии повышения активности АСТ/АЛТ, гиперхолестеринемии, увеличения активности амилазы, гиперурикемии, мультиформной эритемы, гепатита, токсического эпидермального некролиза, брадиаритмии и синдрома Стивенса – Джонсона.
Постмаркетинговые исследования
У пациентов с хроническим гепатитом или циррозом, получавших соответствующую терапию, регистрировалось развитие печеночной дисфункции (в том числе летальной) на фоне терапии таблетками Калетра прогрессирующей ВИЧ-инфекции. Причинно-следственная прямая связь с приемом ритонавира/лопинавира установлена не была. Пациентам с заболеваниями почек рекомендован контроль уровня АСТ/АЛТ.
У некоторых пациентов на фоне приема таблеток Калетра отмечалось обострение или возникновение сахарного диабета, которое требовало назначения/коррекции дозы инсулина или пероральных препаратов для лечения диабета. После окончания приема таблеток Калетра у некоторых пациентов сохранялась гипергликемия.
На фоне терапии ритонавиром/лопинавиром регистрировалось развитие панкреатита у пациентов со значительным повышением уровня триглицеридов. Некоторые случаи панкреатита были летальными, при этом прямая связь ритонавира/лопинавира с развитием панкреатита не установлена, однако риск повышения уровня триглицеридов повышает возможность развития панкреатита. При лечении прогрессирующей ВИЧ инфекции необходимо контролировать уровень триглицеридов.
При развитии побочных эффектов необходима срочная консультация специалиста.
Таблетки Калетра противопоказаны при таких состояниях:
- непереносимость действующих и дополнительных компонентов;
- выраженные нарушения функций печени;
- терапия препаратами, оказывающими выраженное влияние на изофермент CYP3 A4 (см. «Взаимодействия с другими лекарственными препаратами»).
Таблетки Калетра не используют в педиатрии для лечения детей до 3 лет.
Рекомендуется соблюдать осторожность, рекомендуя препарат Калетра пациентам с такими состояниями:
- вирусные гепатиты С и В;
- цирроз печени;
- умеренная и легкая форма недостаточности печени;
- повышение активности АСТ/АЛТ;
- гемофилия В и А;
- панкреатит;
- нарушения липидного обмена;
- возраст более 65 лет.
Органические заболевания сердца и ранее существующие нарушения проводимости сердца, а также терапия препаратами, способствующими удлинению интервала PR.
Необходимо придерживаться осторожности при вождении автомобиля на фоне приема ритонавира/лопинавира.
На фоне терапии женщин препаратом Калетра показано прекращение грудного вскармливания.
В период беременности таблетки Калетра назначают исключительно в случаях, когда польза для матери превышает возможные негативные последствия для плода.
Ритонавир и лопинавир ингибируют изофермент CYP3 A, поэтому их сочетанное применение с препаратами, превращение которых проходит при участии этого фермента, может приводить к повышению сывороточных уровней подобных препаратов.
Отмечается более чем трехкратное увеличение AUC препаратов, которые широко метаболизируются CYP3 A, при сочетанном приеме с таблетками Калетра.
Калетра метаболизируется при участии CYP3 A, препараты, оказывающие влияние на данный фермент, могут изменять плазменные уровни, эффективность и токсичность лопинавира и ритонавира.
Взаимодействие с препаратами, предназначенными для терапии ВИЧ
Не отмечалось взаимодействия ритонавира/лопинавира с ставудином и ламивудином.
При необходимости сочетанного приема с диданозином рекомендуется использовать диданозин натощак, а таблетки Калетра отдельно от пищи.
Ритонавир/лопинавир при одновременном приеме могут снижать уровни абакавира и зидовудина в сыворотке.
Возможно повышение уровня тенофовира в сыворотке при сочетанном приеме с таблетками Калетра. Механизм данного явления неясен, при необходимости сочетанного приема необходимо контролировать состояние пациента, учитывая риск развития нежелательных эффектов тенофовира.
При сочетанном приеме таблеток Калетра с нуклеозидными ингибиторами обратной транскриптазы возможно развитие миалгии, повышения активности креатинфосфокиназы, а также появления рабдомиолиза.
Не рекомендуется сочетанный прием невирапина и эфавиренза с ритонавиром/лопинавиром в связи с вероятностью снижения плазменных уровней лопинавира.
Делавирдин при сочетанном приеме с таблетками Калетра может повышать сывороточные уровни лопинавира.
Отмечается снижение уровня лопинавира и увеличение уровня ампренавира при сочетанном приеме ампренавира и таблеток Калетра. Одновременный прием данных препаратов не рекомендован.
Не следует назначать таблетки Калетра сочетано с фосампренавиром (в связи со снижением уровня фосампренавира и лопинавира).
Калетра при одновременном приеме увеличивает сывороточные уровни индинавира, при необходимости такой комбинации дозу индинавира следует корректировать.
Отмечается снижение уровня лопинавира и увеличение уровня нелфинавира при сочетанном приеме. Не рекомендуется принимать данные препараты в один день.
Калетра повышает сывороточные уровни саквинавира при сочетанном приеме, что может требовать коррекции дозы последнего.
Таблетки Калетра не следует применять сочетано с типранавиром.
Взаимодействие препарата Калетра с прочими препаратами
Необходимо учитывать, что Калетра при сочетанном приеме может увеличивать уровни фентанила, бепридила, амиодарона, лидокаина, хинидина, дигоксина, некоторых противоопухолевых препаратов, а также повышать побочные эффекты данных препаратов.
Калетра может изменять плазменные уровни антикоагулянтов, при необходимости одновременного применения необходимо контролировать международное нормализованное отношение.
Калетра снижает сывороточные уровни бупропиона при одновременном использовании.
Сочетанное применение препарата Калетра с тразодоном приводит к повышению сывороточных уровней последнего.
Карбамазепин, фенитоин и фенобарбитал при сочетанном применении с препаратом Калетра могут приводить к снижению уровня лопинавира вследствие влияния на CYP3 A4. Также не исключено влияние препарата Калетра на уровни фенитоина при приеме в один день. Одновременный прием ритонавира/лопинавира с противосудорожными препаратами не рекомендуется.
Лопинавир и ритонавир при сочетанном применении могут изменять сывороточные уровни итраконазола, кетоконазола и вориконазола.
На фоне терапии препаратом Калетра возможно изменение сывороточных уровней кларитромицина, если необходим сочетанный прием данных препаратов, следует корректировать дозы кларитромицина (особенно у пациентов с нарушенными функциями почек и печени).
При одновременном приеме препарата Калетра с рифабутином на протяжении 10 дней отмечалось повышение уровней рифабутина и его активного производного соответственно в 3,5 и 5,7 раз. Учитывая данный эффект, при необходимости сочетанного применения рекомендуется снижать дозу рифабутина на 75%, в зависимости от индивидуальной вариабельности фармакокинетических показателей может требоваться дальнейшее снижение дозы рифабутина.
При сочетанном приеме препарата Калетра с рифампицином возможно снижение уровня лопинавира и потеря вирусологического ответа, а также развитие резистентности к ритонавиру/лопинавиру и другим ингибиторам протеаз ВИЧ. Кроме того, при сочетанном приеме рифампицина и Калетры возможно повышение уровней АСТ/АЛТ. При необходимости сочетанного приема терапию ритонавиром/лопинавиром следует начинать за 10 дней до приема рифампицина; кроме того, дозу ритонавира/лопинавира необходимо увеличивать при приеме рифампицина. Пациентам, получающим подобную комбинацию, необходим регулярный контроль функциональной активности печени.
Калетра может снижать терапевтическую активность атовахона при одновременном приеме.
Дексаметазон при сочетанном применении может снижать сывороточные уровни лопинавира.
Калетра при сочетанном применении может повышать сывороточные уровни флутиказона и снижать концентрацию кортизола. При сочетанном использовании данных препаратов возможно развитие значительного системного влияния кортикостероидов, включая синдром Иценко – Кушинга. Подобный эффект возможен и при ингаляционном применении других кортикостероидов, которые превращаются подобно флутиказону (например, при использовании будесонида). Необходимо соблюдать особую осторожность при назначении подобной комбинации и корректировать дозу кортикостероида при контроле общих и местных реакций на препарат. Альтернативным вариантом является назначение кортикостероидов, которые метаболизируются без участия CYP3 A4, например, беклометазона.
Калетра может повышать уровни нифедипина, фелодипина и никардипина при сочетанном приеме.
При сочетанном приеме препарата Калетра с ингибиторами фосфодиэстеразы 5 (включая тадалафил и силденафил) возможно значительное увеличение уровней последних и увеличение частоты побочных эффектов, включая гипотензию и приапизм. Силденафил и тадалафил сочетано с препаратом Калетра допустимо применять только в низких дозах (не более 25 мг и 10 мг соответственно) с особым контролем побочных эффектов, запрещен сочетанный прием данных препаратов пациентам с легочной гипертензией.
Запрещен одновременный прием препарата Калетра с варденафилом.
Препараты зверобоя снижают сывороточные уровни ритонавира/лопинавира, одновременный прием данных препаратов противопоказан.
Калетра может изменять уровни ингибиторов ГМГ-КоА редуктазы, наибольшее влияние препарата Калетра отмечается на уровни ловастатина и симвастатина, в меньшей степени Калетра увеличивает уровни аторвастатина и розувастатина. Допускается сочетанный прием препарата Калетра с аторвастатином и розувастатином при условии коррекции дозы последних.
Не отмечено фармакокинетического взаимодействия препарата Калетра с правастатином и флувастатином (метаболизм данных препаратов не зависит от CYP3 A4), если пациенту необходима терапия ингибиторами ГМГ-КоА редуктазы на фоне приема препарата Калетра, рекомендуется отдавать предпочтение при назначении правастатину и флувастатину.
Калетра может повышать уровни такролимуса, сиролимуса и циклоспорина при сочетанном применении, рекомендуется контролировать уровни данных препаратов до полной их стабилизации.
Калетра снижает сывороточные концентрации метадона.
Калетра снижает эффективность пероральных противозачаточных препаратов, а также гормональных контрацептивов в форме пластыря; в период приема препарата Калетра женщинам, которые используют гормональные контрацептивы, необходима дополнительная контрацепция.
Данные об острой передозировке препарата Калетра ограничены. Данных о специфическом антидоте нет.
При передозировке рекомендуется проводить поддерживающую терапию и мониторить основные функции организма.
Снизить абсорбцию в первые часы после передозировки можно, проведя промывание желудка и назначив пациенту сорбенты.
Теоретически гемодиализ неэффективен при передозировке препарата Калетра, так как активные компоненты имеют высокую степень связи с белками плазмы.
Таблетки в оболочке Калетра по 60 штук в полимерных флаконах с завинчивающейся крышкой, в пачках из картона по 1 флакону.
Таблетки Калетра хранят при комнатной температуре, в местах, детям недоступных.
Срок годности – 2 года.
Страна-производитель – Германия.
Инструкция составлена коллективом авторов и редакторов сайта Piluli. Список авторов справочника лекарств представлен на странице редакции сайта: Редакция сайта.
Описание препарата «Калетра» на данной странице является упрощённой и дополненной версией официальной инструкции по применению. Перед приобретением или использованием препарата вы должны проконсультироваться с врачом и ознакомиться с утверждённой производителем аннотацией.
Информация о препарате предоставлена исключительно с ознакомительной целью и не должна быть использована как руководство к самолечению. Только врач может принять решение о назначении препарата, а также определить дозы и способы его применения.
Количество просмотров: 1927.