Калия хлорид (Potassium chloride) инструкция по применению
📜 Инструкция по применению Калия хлорид
💊 Состав препарата Калия хлорид
✅ Применение препарата Калия хлорид
📅 Условия хранения Калия хлорид
⏳ Срок годности Калия хлорид
Описание лекарственного препарата
Калия хлорид
(Potassium chloride)
Основано на официально утвержденной инструкции по применению препарата и подготовлено для электронного издания справочника Видаль 2011 года, дата обновления: 2019.05.16
Владелец регистрационного удостоверения:
Код ATX:
B05XA01
(Калия хлорид)
Лекарственные формы
| Калия хлорид |
Конц. д/пригот. р-ра д/инф. 30 мг/1 мл: бут. 100 мл или 200 мл 1 шт. рег. №: ЛП-000345 |
|
|
Конц. д/пригот. р-ра д/инф. 40 мг/1 мл: бут. 100 мл или 200 мл 1 шт. рег. №: ЛП-000345 |
||
|
Конц. д/пригот. р-ра д/инф. 75 мг/1 мл: бут. 100 мл или 200 мл 1 шт. рег. №: ЛП-000345 |
||
|
Конц. д/пригот. р-ра д/инф. 150 мг/1 мл: бут. 100 мл или 200 мл 1 шт. рег. №: ЛП-000345 |
Форма выпуска, упаковка и состав
препарата Калия хлорид
Вспомогательные вещества: хлористоводородная кислота 0.1М до рН 3-4, вода д/и до 1 мл.
100 мл — бутыли (1) — пачки картонные.
100 мл — бутыли (1) — пачки картонные (35) — коробки картонные.
200 мл — бутыли (1) — пачки картонные.
200 мл — бутыли (1) — пачки картонные (28) — коробки картонные.
Вспомогательные вещества: хлористоводородная кислота 0.1М до рН 3-4, вода д/и до 1 мл.
100 мл — бутыли (1) — пачки картонные.
100 мл — бутыли (1) — пачки картонные (35) — коробки картонные.
200 мл — бутыли (1) — пачки картонные.
200 мл — бутыли (1) — пачки картонные (28) — коробки картонные.
Вспомогательные вещества: хлористоводородная кислота 0.1М до рН 3-4, вода д/и до 1 мл.
100 мл — бутыли (1) — пачки картонные.
100 мл — бутыли (1) — пачки картонные (35) — коробки картонные.
200 мл — бутыли (1) — пачки картонные.
200 мл — бутыли (1) — пачки картонные (28) — коробки картонные.
Вспомогательные вещества: хлористоводородная кислота 0.1М до рН 3-4, вода д/и до 1 мл.
100 мл — бутыли (1) — пачки картонные.
100 мл — бутыли (1) — пачки картонные (35) — коробки картонные.
200 мл — бутыли (1) — пачки картонные.
200 мл — бутыли (1) — пачки картонные (28) — коробки картонные.
Фармакологическое действие
Препарат калия, восстанавливает водно-электролитное равновесие. Оказывает отрицательное хроно- и батмотропное действие, в высоких дозах — отрицательное ино- и дромотропное, а также умеренное диуретическое действие. В малых дозах препарат калия расширяет коронарные сосуды, в больших — суживает. Участвует в процессе проведения нервных импульсов. При внутривенном введении увеличивает выделение адреналина надпочечниками.
Активирует многие цитоплазматические ферменты, участвует в поддержании внутриклеточного осмотического давления, в белковосинтетических реакциях и транспорте аминокислот. Улучшает сокращение скелетных мышц при мышечной дистрофии, миастении. Повышение концентрации калия снижает риск развития токсического действия сердечных гликозидов.
Показания препарата
Калия хлорид
Гипокалиемия (в т.ч. на фоне сахарного диабета, длительной диареи и/или рвоты, терапии гипотензивными препаратами, некоторыми диуретиками, глюкокортикостероидами), лечение и профилактика гликозидной интоксикации, пароксизмальной тахикардии, профилактика и лечение эктопических аритмий у больных инфарктом миокарда (в остром периоде).
Режим дозирования
В/в струйно, при необходимости в/в капельно в сочетании с 5% раствором декстрозы.
При гипокалиемии с нарушением сердечного ритма — по 1-1.5 г 4-5 раз в сут.; после восстановления сердечного ритма дозу уменьшают. При гликозидной интоксикации — по 2-3 г/сут., в тяжелых случаях — до 5 г. Для купирования приступов пароксизмальной тахикардии в первый день — 8-12 г, с последующим снижением до 3-6 г.
При тяжелых интоксикациях, требующих быстрого устранения патологических явлений, а также при упорной рвоте препарат вводят в/в. Применяют 4% раствор препарата в 40% растворе глюкозы. 50 мл раствора разводят (для получения изотонического раствора) водой для инъекций в 10 раз (до 500 мл) и вводят капельно 20-30 капель в мин). Можно также вводить в/в капельно из расчета 2.5 г в 500 мл 0.9% раствора натрия хлорида или 5% раствора декстрозы.
Для профилактики и лечения эктопических аритмий при инфаркте миокарда — поляризующая смесь: раствор калия хлорида в 5%-10% растворе декстрозы (добавляют инсулин короткого действия из расчета 1 ЕД на 3-4 г сухой декстрозы).
Побочное действие
Со стороны нервной системы: парестезии, мышечная слабость, спутанность сознания.
Со стороны сердечно-сосудистой системы: снижение артериального давления, аритмии, блокада сердца, остановка сердца.
Прочие: гиперкалиемия, аллергические реакции.
Противопоказания к применению
Гиперкалиемия, полная атриовентрикулярная блокада, надпочечниковая недостаточность, хроническая почечная недостаточность, сопутствующая терапия калийсберегающими диуретиками, метаболические нарушения (ацидоз, гиповолемия с гипонатриемией), возраст до 18 лет (эффективность и безопасность не установлены).
Применение при беременности и кормлении грудью
При необходимости применения при беременности следует сопоставить ожидаемую пользу для матери и потенциальный риск для плода.
В период грудного вскармливания следует решить вопрос о его прекращении.
Применение при нарушениях функции почек
Противопоказан при хронической почечной недостаточности.
Применение у детей
Безопасность и эффективность применения калия хлорида у детей до 18 лет не установлены.
Особые указания
В период лечения необходимо контролировать содержание ионов калия в сыворотке крови, электрокардиограмму, при лечении гипокалиемии — контроль кислотно-основного состояния.
Безопасность и эффективность применения калия хлорида у детей не установлены.
Диета с большим содержанием натрия увеличивает выведение калия из организма.
Следует учитывать, что гиперкалиемия, приводящая к летальному исходу, может развиваться быстро и протекать бессимптомно.
Передозировка
Симптомы: гиперкалиемия (мышечный гипотонус, парестезии конечностей, замедление атриовентрикулярной проводимости, аритмии, остановка сердца). Ранние клинические признаки гиперкалиемии обычно появляются при концентрации калия в сыворотке крови более 6 мэкв/л: заострение зубца Т, исчезновение зубца U(при его наличии в прежних кардиограммах), снижение сегмента S-T, удлинение интервала Q-T, расширение комплекса QRS. Более тяжелые симптомы гиперкалиемии — паралич мускулатуры и остановка сердца — развиваются при концентрации калия 9-10 мэкв/л.
Лечение: внутрь или в/в – 0.9% раствор натрия хлорида; в/в — 300-500 мл 5% раствора декстрозы (с 10-20 ЕД инсулина на 1 л); при необходимости — гемодиализ и перитонеальный диализ.
Лекарственное взаимодействие
Фармацевтически совместим с растворами сердечных гликозидов (улучшает их переносимость).
Усиливает отрицательное дромо- и батмотропное действие антиаритмических лекарственных средств.
Бета-адреноблокаторы, циклоспорин, калийсберегающие диуретики, гепарин, ингибиторы ангиотензинпревращающего фермента, нестероидные противовоспалительные препараты могут усилить риск развития гиперкалиемии.
Условия хранения препарата Калия хлорид
При температуре от 15 до 25°С. Хранить в недоступном для детей месте.
Срок годности препарата Калия хлорид
Срок годности — 1 год. По истечению срока годности препарат не применять.
Условия реализации
Препарат отпускается по рецепту.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Аналоги препарата
Калия хлорид
(НОВОСИБХИМФАРМ, Россия)
Калия хлорид
(МОСХИМФАРМПРЕПАРАТЫ им. Н.А.Семашко, Россия)
Калия хлорид
(АРМАВИРСКАЯ БИОФАБРИКА, Россия)
Калия хлорид
(АТОЛЛ, Россия)
Калия хлорид
(ГЕРТА, Россия)
Калия хлорид
(ЭСКОМ НПК, Россия)
Калия хлорид
(ГРОТЕКС, Россия)
Калия хлорид
(НПО МИКРОГЕН, Россия)
Калия хлорид
(БИННОФАРМ, Россия)
Калия хлорид
(БИОСИНТЕЗ, Россия)
Все аналоги
Лекция для врачей «Кризы при миастении. Диагностика и алгоритм лечения». Лекцию для врачей проводит д.м.н.,проф. Д.М. Меркулова. Неврологический центр им Б М. Гехта ОАО «РЖД» ММА им. ИМ Сеченова Росздрава НИИ ОПП РАМН
Миастения. Схема лечения. Часть 2. Лекция для врачей
Дополнительный материал
Миастения (myasthenia gravis) — хроническое аутоиммунное нервно-мышечное заболевание, клинически проявляющееся в виде слабости и патологической мышечной утомляемости, обусловленными образованием аутоантител к различным антигенным мишеням периферического нейромышечного аппарата.
Течение заболевания сопровождается выраженной лабильностью клиники, нередко с нарушением витальных функций, в связи с этим возникает необходимость динамического наблюдения и индивидуально подобранного лечения у неврологов при выявлении достоверного диагноза миастении. Пациент должен быть информирован о течении его заболевания, в том числе о возможных вариантах и непредсказуемых моментах, обо всех методах лечения, возможностях его эффективности и осложнений.
За последние 20-30 лет произошло коренное изменение подходов к лечению и прогнозу миастении, основанное на понимании патогенетических механизмов данной патологии. Реализация комплексного мультидисциплинарного подхода в лечении больных миастенией позволяет существенно снизить летальность, продлить жизнь пациентов и улучшить ее качество, тогда как в 60-х годах двадцатого века средняя длительность жизни больных миастенией составляла 4-7 лет.
Понимание сути заболевания, основных звеньев его патогенеза, знание спектра современных терапевтических агентов и алгоритмов их применения позволяют улучшить качество оказания медицинской помощи больным с миастенией.
Эпидемиология
Частота миастении в настоящее время составляет 20 случаев на 100 000 населения. Считается, что число больных, у которых это заболевание не выявлено, в 2-3 раза больше. Соотношение мужчин и женщин равно 1:3. В пожилом возрасте соотношение выравнивается, мужчины болеют также часто, как и женщины. Дебют заболевания у женщин чаще происходит в фертильном возрасте (средний возраст заболевания 31,7 лет с двумя пиками заболеваемости — в 20-29 лет и старше 50 лет), у мужчин в 30-40 лет, при этом развитие миастении может произойти в любое время от первых дней жизни (миастения новорожденных) до пожилого возраста, 75 % больных миастенией заболевают в возрасте 15-30 лет (20 % — у людей старше 60 лет). Детская миастения составляет 10-24 % от всех заболевших. В 10 % случаев заболевание сочетается с аутоиммунным гипотиреозом, в 80 % случаев ассоциируется с гиперплазией тимуса, в 15% — с тимомой (из них в 30 % злокачественной), также может сопровождаться тиреотоксикозом, ревматоидным артритом, системной красной волчанкой. Заболевание приводит к инвалидизации в 60-70 % случаев, а при отсутствии эффективного лечения — и к гибели больных. Встречается миастения одинаково часто во всех странах мира. Миастения не является наследственным заболеванием. В последние годы во всем мире отмечен рост числа больных миастенией, что связано с общим нарастанием количества аутоиммунной патологии, увеличением длительности жизни больных миастенией и повышением квалификации врачей-неврологов, что ведет к улучшению диагностики этого заболевания. Удельный вес миастении среди нервно-мышечной патологии составляет 60%. Колебания распространенности этой болезни в различных регионах мира определяются в большей степени качеством диагностики заболевания, чем истинными эпидемиологическими различиями.
Этиопатогенез
Механизмы развития приобретенной миастении тесно связаны с патологическими изменениями тимуса. Происходит образованием антител и аутореактивных Т-клеток, поражающих органы-мишени — структуры синапса и непосредственно мышечную ткань. К антигенным мишеням относят: мышечный ацетилхолиновый рецептор (АХР), мышечно-специфическая тирозинкиназа, рианодиновый рецептор, титин-протеин и другие. Также при миастении обнаружены антитела к некоторым цитокинам, ганглиозидам миелина нервной ткани и другим белковым структурам.
Поражение описанных выше и некоторых других антигенных мишеней приводит к нарушению нервно-мышечной передачи, проявляющейся мышечной слабостью и патологической утомляемостью.
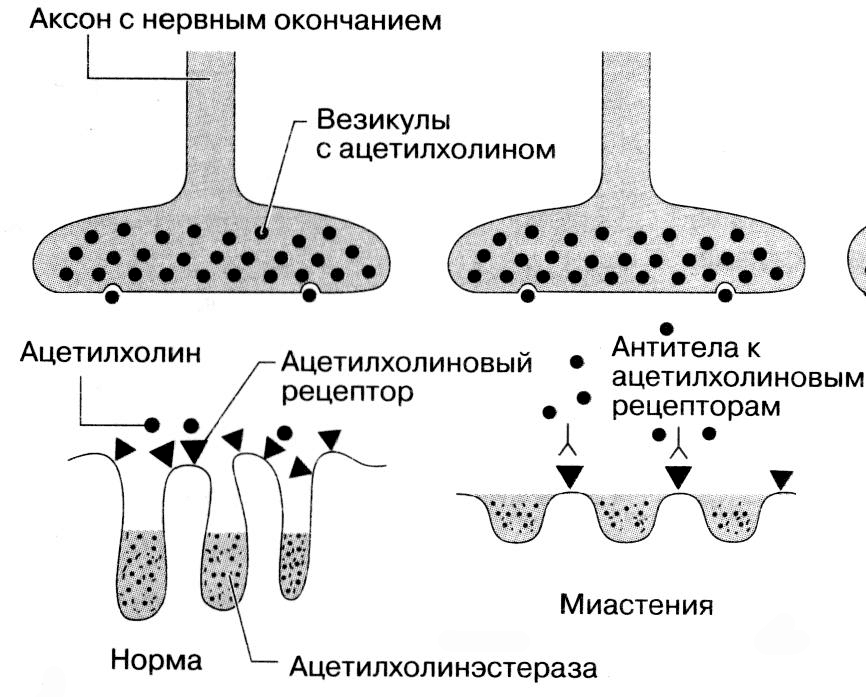
Перенос импульса от нерва к мышце происходит в нервно-мышечном синапсе. Потенциал действия, дошедший до нервного окончания, приводит к высвобождению в синаптическую щель кванта ацетилхолина, который содержится в везикулах нервных окончаний. На постсинаптической мембране молекулы ацетилхолина взаимодействуют с ацетилхолиновыми рецепторами, что приводит к временному открытию катионных каналов рецепторов и генерированию потенциала концевой пластинки. Когда он достигает критической величины, возникает потенциал действия, который распространяется вдоль мышечного волокна по поперечной тубулярной системе, вызывая высвобождение кальция в саркоплазму, взаимодействие актина и миозина и, вследствие этого, мышечное сокращение. Миастения — приобретенное расстройство нервно-мышечной передачи. Количество ацетилхолиновых рецепторов значительно снижено. Расстояние между нервным окончанием и постсинаптической мембраной увеличено, а складки постсинаптической мембраны, которые содержат рецепторы, оказываются более широкими, но менее глубокими, чем в норме (рис. 1). Снижение числа АХР ведет к уменьшению потенциала концевой пластинки, поэтому в вовлеченных мышцах не генерируется потенциал действия. Если нарушается передача импульсов достаточно большой части мышечных волоки, развивается клинически выраженная мышечная слабость. При повторном сокращении нарушение передачи распространяется на все большее количество синапсов, и сила мышцы прогрессивно уменьшается.
Следует отметить, что тимус является активным индуктором аутоиммунного процесса, в среднем, первые 3-5 лет развития болезни. В дальнейшем выработка аутоантител к ацетилхолиновым рецепторам становится функцией других органов ретикулоэндотелиальной системы (лимфоузлы брыжейки, селезенка и др.). Это имеет определенное значение в выборе тактики лечения больных в зависимости от сроков заболевания. Выработка антител генетически детерминирована, при миастении патологический процесс обусловлен, в основном, локусами НБА-В8, ЭК3, реже А2, В7, ЭК2.
Рис. 1. Нервно-мышечный синапс в норме и при миастении. При миастении продукция антител к ацетилхолиновым рецепторам на постсинаптической мембране приводит к деструкции рецепторов. Процесс высвобождения ацетилхолина в синаптическую щель происходит нормально, но из-за уменьшенного числа рецепторов потенциал концевой пластины не достигает порогового значения, необходимого для возникновения потенциала действия.
Врожденная миастения обусловлена генетически-детерминированными дефектами в иммунной системе, а также дефектом генов различных белков, отвечающих за построение и работу нервно-мышечных синапсов. Неонатальная или транзиторная миастения — преходящее состояние, наблюдающееся у младенцев, родившихся от матерей, страдающих миастенией, и обусловленное переходом через плаценту материнских антител к ацетилхолиновым рецепторам в кровь ребенка при рождении.
Классификация
Предложены различные классификации миастении. Зачастую они сложны для использования в клинике. Поэтому для практических врачей представляют удобство классификации Б. М. Гехта, А. Г. Панова и соавторов, которые используются в нашей стране.
Клиническая классификация миастении (Гехт Б. М., 1965)
По степени генерализации:
1. Генерализованная
2. Локальная
По степени тяжести двигательных расстройств:
1. Легкая
2. Средняя
3. Тяжелая
По характеру течения:
1. Миастенические эпизоды
2. Стационарное течение
3. Прогрессирующее течение
4. Злокачественная форма
По степени компенсации при приеме АХЭП:
1. Полная
2. Достаточная для самообслуживания
3. Недостаточная для самообслуживания
Классификация миастении (Панов А. Г., Догель Л. В., Лобзин В. С., 1965)
Генерализованная форма миастении:
1. Без нарушения дыхания и сердечной деятельности
2. С нарушением дыхания и сердечной деятельности Локальные формы миастении:
1. Глоточно-лицевая форма:
— Без нарушения дыхания и сердечной деятельности
— С нарушением дыхания и сердечной деятельности
2. Глазная форма
3. Скелетно-мышечная форма
— Без нарушения дыхания и сердечной деятельности
— С нарушением дыхания и сердечной деятельности
Примеры формулировки диагноза:
Миастения. Генерализованная форма, прогрессирующее течение, средняя степень тяжести, достаточная компенсация на фоне АХЭП.
Миастения, локальная (глазная) форма, стационарное течение, легкая степень тяжести, хорошая компенсация на АХЭП.
Миастения, генерализованная форма с выраженными дыхательными нарушениями, прогрессирующее тяжелое течение с недостаточной компенсацией на АХЭП.
Клиническая картина
Для миастении типично хроническое течение с периодическими обострениями и ремиссиями и возможным развитием тяжёлых состояний, называемых кризами. Ведущий клинический симптом — слабость и патологическая мышечная утомляемость, усиливающаяся на фоне физических нагрузок и уменьшающаяся после отдыха или приёма антихолинэстеразных препаратов.
Клиническая картина миастении разнообразна и может включать в себя глазодвигательные, бульбарные нарушения, слабость жевательных, экстраокулярных, мимических, дыхательных мышц, слабость мышц шеи, туловища и конечностей. Распространенность патологического процесса на различные группы мышц может быть весьма вариабельной: от одностороннего птоза до вовлечения практически всех произвольных мышц.
Заболевание чаще начинается с глазных симптомов (птоз, диплопия). Особенностью является динамичность симптомов: утром птоз может быть меньше, чем вечером, двоение меняется по выраженности. Затем чаще присоединяется слабость проксимальных отделов мышц конечностей (трудно подняться по лестнице, подняться со стула, поднимать руки вверх). При этом на фоне физической нагрузки слабость отчётливо нарастает во всех группах мышц (после пробы с 10 приседаниями слабость увеличивается не только в мышцах ног, но и рук, усиливается птоз). Могут присоединяться бульбарные нарушения (на фоне длительного разговора или во время приёма пищи голос приобретает гнусавый оттенок, появляется дизартрия, трудно выговаривать «Р», «Ш», «С». После отдыха эти явления проходят). Далее бульбарные нарушения могут стать более выраженными (появляется нарушение глотания, поперхивания, попадание жидкой пищи в нос).
Птоз у больных миастенией характеризуется асимметрией, может наблюдаться то с одной, то с другой стороны в разные периоды времени и сопровождаться ретракцией противоположного верхнего века, усиливается при фиксации взора и движениях глазными яблоками в стороны.
Глазодвигательные нарушения асимметричны, не укладываются в зону иннервации III, IV, VI пар черепно-мозговых нервов. Характерен так называемый мышечный нистагмоид — отклонение глазных яблок в крайних отведениях при фиксации взора с возвращением на место. Диплопия при миастении усиливается при зрительной и физической нагрузке, на ярком свету, во второй половине дня, более выражена при взгляде вдаль (два одинаковых предмета на улице, раздвоение дороги, ступенек, два телевизора, и т.д.).
Слабость жевательных мышц проявляется в виде утомления при жевании, иногда до отвисания нижней челюсти, больные во время еды поддерживают челюсть и помогают себе при жевании рукой. Мимическая слабость более выражена в верхней половине лица — круговых мышц глаз, усиливается при повторном зажмуривании, возможен лагофтальм. Отмечается также затруднение при надувании щек, улыбка «рычания», реже — «поперечная» улыбка вследствие слабости круговой мышцы рта.
Бульбарный синдром характеризуется нарушениями глотания (поперхивание, попадание жидкой пищи в носовые ходы), гнусавостью, дизартрией, реже — охриплостью голоса и очень редко нарушениями модуляции голоса, напоминающими заикание. Эти нарушения могут достигать крайней степени выраженности — невозможность глотания и разговора, но встречаются также очень легкие формы бульбарного синдрома — дизартрия или гнусавость только при длительном чтении вслух и глотание со вспомогательными движениями — второй глоток, наклон или поворот головы. Бульбарные нарушения также носят динамичный характер — усиливаются при речевой, общей физической нагрузке, во время еды (особенно при приеме горячей пищи, питья).
Слабость мышц конечностей может быть «изолированной» (т.е. без других симптомов миастении) — так называемая туловищно-конечностная форма, а также сочетаться со слабостью произвольной мускулатуры другой локализации. Типичны для миастении слабость проксимальных мышц конечностей, преобладание слабости разгибателей над сгибателями (например, трехглавой над двуглавой мышцей плеча), усиление слабости при нагрузке (невозможность войти в транспорт после быстрой ходьбы или бега, падение при попытке пойти быстрее, подъеме по лестнице, при работе на приусадебном участке и т.п.), существенное уменьшение слабости утром и после отдыха. Наиболее поражаемые мышечные группы: дельтовидная мышца, трехглавая мышца плеча, подвздошно-поясничная мышца, но возможно также появление слабости после нагрузки (или усиление ее) в других мышечных группах: разгибателях кистей и стоп, реже — в двуглавых мышцах плеча, четырехглавых мышцах бедра, мелких мышцах кистей, т.е. может поражаться практически вся произвольная мускулатура конечностей. Слабость мышц туловища и шеи чаще встречается у больных пожилого возраста и выражается в согнутой позе за счет слабости мышц спины, свисающей голове за счет слабости задней группы мышц шеи. Наличие слабости мышц шеи даже в отсутствии бульбарного синдрома должно насторожить врача, так как часто следом за этим симптомом развиваются бульбарные и дыхательные нарушения.
Дыхательные расстройства при миастении связаны с несколькими причинами: ослаблением межреберной мускулатуры, диафрагмы, реже с западением надгортанника вследствие ослабления мышц гортани. Респираторные нарушения у больных миастенией характеризуются затруднением вдоха, ослаблением кашлевого толчка, скоплением густой, вязкой слюны, которую невозможно сплюнуть и, как правило, невозможно проглотить.
Внезапные нарушения витальных функций, называемые кризами, наблюдают у 10-15% пациентов. Кризы при миастении бывают миастенические, холинергические и смешанные. Миастенические кризы возникают при недостаточном лечении АХЭП. Холинергический криз развивается при передозировке АХЭП. Смешанный криз в клинической практике наблюдают чаще всего. В клиническом течении смешанных кризов выделяют 2 фазы — миастеническая и холинергическая, которые характеризуются клиническими проявлениями соответствующих кризов.
Необходимо отметить, что далеко не все кратковременные эпизоды изменения состояния следует рассматривать как криз, в связи с чем уместно дополнить выше приведенное определение следующим уточнением: под миастеническим кризом подразумевается состояние больного с миастенией, требующее интубации пациента вследствие дыхательных нарушений. При миастеническом кризе жизненная емкость легких падает до 1 л и меньше. В этом случае пациенты нуждаются в срочной госпитализации в блок интенсивной терапии для наблюдения, проведения ургентной терапии, включая искусственную вентиляцию легких (ИВЛ).
Таблица 1
| Миастенический криз |
Холинергический криз |
|
Быстрое развитие (часы, минуты) |
Медленное развитие (сутки и более) |
|
Мидриаз |
Миоз |
|
Сухость кожи |
Гипергидроз |
|
Повышение АД, тахикардия |
Снижение АД, брадикардия |
|
Задержка при мочеиспускании |
Учащенное мочеиспускание |
|
Парез кишечника |
Усиление перистальтики, диарея |
|
Отсутствие фасцикуляций |
Наличие фасцикуляций |
|
Дыхательные нарушения |
Дыхательные нарушения |
6. ДИАГНОСТИКА
В пользу миастении свидетельствуют:
- выраженные колебания симптоматики в течение суток и изо дня в день;
- нарастание симптоматики на фоне физической нагрузки (например, усиление дисфагии во время еды, а дисфонии — во время беседы — феномен патологической утомляемости) и генерализация мышечной слабости (например, повторные сжимания и разжимания кистей вызывают слабость не только мышц предплечий, но и нарастание птоза = феномен Уолкер); уменьшение выраженности слабости после отдыха.
- избирательность вовлечения мышц (сгибатели шеи часто оказываются более слабыми, чем разгибатели, а на руках слабость более выражена в разгибателях предплечья), что позволяет отличить миастению от астении или истерии;
- сохранность сухожильных рефлексов, отсутствие нарушений чувствительности, тазовых расстройств и амиотрофий.
- быстро открывать и закрывать рот (у здорового до 100 движений за 30 сек.);
- лежа на спине приподнять голову и в течение 1 минуты смотреть на свой живот;
- постоять с вытянутыми руками 3 минуты;
- сделать 15-20 глубоких приседаний;
- патогномоничен феномен М. Уолкер: повторные сжимания и разжимания кистей вызывают слабость не только мышц предплечий, но и нарастание птоза.
Для объективизации феномена патологической мышечной утомляемости используются специальные пробы.
Необходимо попросить больного:
Диагностические критерии миастении
- 1.Фармакологический тест — проба с введением антихолинэстеразных препаратов. Используют неостигмина метилсульфат (при массе тела пациента 50-60 кг — 1,5 мл; 60-80 кг — 2 мл; 80-100 кг — 2,5 мл 0,05 % раствора) или пиридостигмина бромид (при массе тела пациента 50-60 кг — 10 мг; 60-80 кг — 20 мг; 80-100 кг — 30 мг). У детей доза указанных препаратов составляет 1,0 мл или 5 мг соответственно. Оценку результатов теста проводят в интервале от 40 мин до 1,5 ч после введения препарата. При полной и неполной компенсации двигательных нарушений (увеличение мышечной силы) пробу считают позитивной, при частичной — сомнительной, при отсутствии реакции — негативной.
- 2.Инструментальные исследования
Один из основных критериев диагностики миастении — нарушение нервномышечной передачи, выявляемое посредством электромиографии. Электромиографическое исследование нервно-мышечной передачи (декремент-тест) проводится всем пациентам с подозрением на миастению: проводится оценка амплитуды негативной фазы М-ответа (суммарного потенциала действия, возникающего в мышце при электрическом раздражении её двигательного нерва), величины декремента — уменьшения амплитуды пятого М-ответа по отношению к первому (в процентах) при низкочастотной (3 имп/с) непрямой супрамаксимальной стимуляции m. deltoideus и величины постактивационного облегчения — увеличения амплитуды первого М-ответа после максимального произвольного усилия в течение 30 с по отношению к первому М-ответу контрольной серии при стимуляции мышцы частотой 3 имп/с (в процентах). Исследование показывает снижение (декремент) амплитуды М-ответа более чем на 10%.
Проводится исследование величины декремента (или инкремента) амплитуды М-ответа при стимуляции мышцы частотой 50 имп/с в процентах по отношению 150-го М-ответа к 1-му («тетаническая стимуляция»), исследование изменения амплитуды М-ответа степени декремента при стимуляции частотой 3 имп/с сразу после окончания «тетанической серии» или после максимального произвольного усилия (в течение 10 с) по отношению к исходным данным (посттетаническое или постактивационное облегчение — ПТО, ПАО). Возможно проведение пробы с введением АХЭП с последующим исследованием ЭМГ.
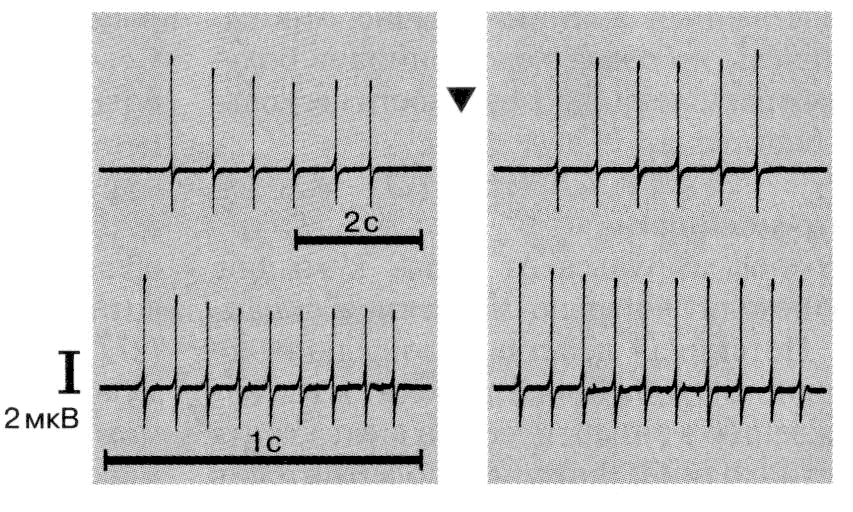
Рис. 3. Изменение ЭМГ у больного с миастенией. Суммарный потенциал двигательных единиц, зарегистрированных с мышцы, отводящей мизинец, при повторной стимуляции локтевого нерва. Обращает на себя внимание резкое снижение (декремент) амплитуды потенциалов (слева). Справа — нормализация амплитуды потенциалов после введения АХЭП
3. Лабораторная диагностика — иммунологические исследования (исследование сыворотки крови на уровень аутоантител). У всех больных миастенией необходимо проведение исследования сыворотки крови на уровень аутоантител к мышечному ацетилхолиновому рецептору (Acetylcholine Receptor Antibody, ACHR antibody), который считается одним из основных критериев диагностики заболевания. Важное значение имеет динамика этого показателя для оценки эффективности патогенетической терапии. Изучение уровня аутоантител к титин-белку (anti-titin-antibody) наиболее показательно у больных миастенией, сочетающейся с тимомой (повышение этого показателя отмечено в 78% случаев), а также у больных с поздним началом миастении без тимомы (84%). При миастении, сочетающейся с тимомой, важным показателем считают увеличение уровня антител к рианодиновым рецепторам саркоплазматического ретикулума (выявляют в 35% случаев), свидетельствующее о тяжёлом течении заболевания. Аутоантитела к мышечно-специфической тирозинкиназе (МИ8К) обнаруживают у 40-50% больных с серонегативной миастенией.
4. Лучевые методы. Исследование вилочковой железы (КТ, МРТ, пневмомедиатенография, рентгенография). Обнаружение тимомы, гиперплазии или, реже, атрофии вилочковой железы подтверждает заинтересованность патологического процесса в патологии вилочковой железы и усиливает показания к оперативному лечению.
Однако следует помнить, что томография переднего средостения не полностью решает вопрос о состоянии тимуса. Обнаружение зоны повышенной плотности еще не свидетельствуют о тимоме или гиперплазии тимуса. У здоровых людей, не страдающих миастенией или не имеющих тимомы при томографическом исследовании часто выявляется «жировая подушка», напоминающая контуры тимомы. Увеличение вилочковой железы по данным КТ или МРТ не является критерием диагностики миастении.
Степени достоверности диагноза
- Сомнительный: клиническая картина
- Вероятный: клиническая картина
- Достоверный (несомненный):
+ прозериновый тест
клиническая картина
+ прозериновый тест
+ декремент-тест
+ иммунологические исследования
Для объективной оценки тяжести клинических проявлений миастении используют количественную шкалу (QMGS), предложенную R. J. Barohn et al (1998). Она предусматривает оценку выраженности (0, 1, 2, 3) вовлечения в патологический процесс различных мышц (глазодвигательных, бульбарных, мимических, дыхательных, проксимальных и дистальных мышц конечностей, а также мышц шеи). Для выполнения исследования необходимы секундомер, динамометр, спирометр, а также стакан с водой. Исследование проводят после предварительной отмены антихолинэстеразных препаратов.
Таблица 2
Шкала количественной оценки тяжести клинических проявлений миастении QMGS (quantitative myasthenia gravis score) – Barohn R. J., 1998
|
Показатель |
Тяжесть симптома |
|||
|
0 (отсутствует) |
1 (умеренная) |
2 (средняя) |
3 (тяжёлая) |
|
|
Диплопия при боковом взгляде влево или вправо, с |
61 |
11-60 |
1-10 |
Спонтанно |
|
Птоз (взгляд верх), секунды |
61 |
11-60 |
1-10 |
Спонтанно |
|
Мышцы лица Нормальное закрытие века |
Нормальное |
Полное, слабое, некоторое сопротивление |
Полное, без сопротивления |
Неполное |
|
Глотание 1/2 чашки воды |
Нормальное |
Минимальное покашливание или прочистка горла |
Тяжелый кашель, удушье или новая регургитация |
Не может глотать |
|
Разговор после счета вслух от 1 до 50 (начало дизартрии) |
Отсутствует |
на 30-49 дизартрия |
на 10-29 дизартрия |
на 9 дизартрия |
|
Вытягивание правой руки (90 градусов сидячее положение), с |
240 |
90-239 |
10-89 |
0-9 |
|
Вытягивание левой руки (90 градусов сидячее положение), с |
240 |
90-239 |
10-89 |
0-9 |
|
ЖЁЛ, % от должного |
>80 |
65-79 |
50-64 |
<50 |
|
Динамометрия справа, кг: -мужчины |
>45 |
15-44 |
5-14 5-9 |
0-4 |
|
Динамометрия слева, кг: -мужчины -женщины |
>35 |
15-34 |
5-14 5-9 |
0-4 |
|
Подъем головы (в положении лежа на спине 45 градусов), с |
120 |
30-119 |
1-29 |
0 |
|
Вытягивание правой ноги (в положении лежа на спине 45 градусов), с |
100 |
31-99 |
1-30 |
0 |
|
Вытягивание левой ноги (в положении лежа на спине 45 градусов), с |
100 |
31-99 |
1-30 |
0 |
Предложено оценивать тяжесть клинических проявлений миастении по пятибалльной шкале МОТА (Вагойп К. I., 1996).
Шкала оценки тяжести клинических проявлений миастении MGFA (Myasthenia Gravis Foundation of America – Barohn R. J., 1996)
|
1 |
Изолированная слабость только окулярных мышц, во всех других мышцах сила нормальная. |
|
2А |
Преобладание умеренной слабости мышц туловища, либо проксимальных отделов конечностей, либо и того и другого. Также могут быть умеренное вовлечение в процесс бульбарной мускулатуры и слабость окулярных мышц любой степени выраженности. |
|
2В |
Преобладание умеренной слабости бульбарной и дыхательной мускулатуры либо и того и другого. Также могут быть умеренное вовлечение мышц туловища либо проксимальных отделов конечностей и слабость окулярных мышц любой степени выраженности. |
|
ЗА |
Преобладание средней степени слабости мышц туловища, либо проксимальных отделов конечностей, либо и того и другого. Также могут быть умеренное вовлечение в процесс бульбарной и дыхательной мускулатуры и слабость окулярных мышц любой степени выраженности. |
|
ЗВ |
Преобладание средней степени слабости бульбарной и дыхательной мускулатуры, либо и того и другого. Также возможны умеренное или средней степени тяжести вовлечение мышц туловища либо проксимальных отделов конечностей и слабость окулярных мышц любой степени выраженности. |
|
4А |
Преобладание тяжёлой степени слабости мышц туловища, либо проксимальных отделов конечностей, либо и того и другого. Также могут быть умеренное вовлечение в процесс бульбарной и дыхательной мускулатуры и слабость окулярных мышц любой степени выраженности. |
|
4В |
Преобладание тяжёлой степени слабости бульбарной и дыхательной мускулатуры. Также возможны умеренное, среднее или тяжёлое вовлечение мышц туловища либо проксимальных отделов конечностей и слабость окулярных мышц любой степени выраженности. |
|
5 |
Интубация (с механической вентиляцией или без таковой), кроме случаев обычных послеоперационных вмешательств. |
В клинической практике для оценки степени выраженности двигательных расстройств используют шкалу силы мышц конечностей, предложенную A. Szobor (1976).
Шкала силы мышц конечностей (A. Szobor, 1976)
|
0 баллов |
Движения в мышце отсутствуют. |
|
1 балл |
Минимальные движения в мышце, но вес конечности пациент не удерживает. |
|
2 балла |
Пациент удерживает вес конечности, но сопротивление, оказываемое исследователю, минимально. |
|
3 балла |
Пациент оказывает сопротивление усилиям изменить положение конечности, но оно незначительно. |
| 4 балла | Пациент хорошо сопротивляется усилиям изменить положение конечности, но имеется некоторое снижение силы. |
|
5 баллов |
Сила мышцы соответствует возрастной и конституциональной норме обследуемого. |
Дифференциальная диагностика
Дифференциальная диагностика миастении проводится с несколькими группами заболеваний:
1. При нарушении функций наружных мышц глаза — с прогрессирующей надъядерной офтальмоплегией, окулофарингеальной мышечной дистрофией, эндокринной офтальмопатией, спино- и оливоцеребеллярной дегенерациями, рассеянным склерозом, синдромом Фишера, синдромом Толосы-Ханта, митохондриальными цитопатиями, конгенитальными миастеническими синдромами и др. Прогрессирующая надъядерная офтальмоплегия отличается от миастении отсутствием птоза и стойким характером ограничения глазных яблок. Специфическим признаком является феномен «кукольных глаз». Выявляются также признаки недостаточности функций экстрапирамидной системы. Миастенический синдром в виде слабости и утомляемости мышц нередко имеет место при рассеянном склерозе, однако наличие мозжечковых и пирамидных симптомов, выраженность патологических рефлексов, поражение зрительного и других черепных нервов, снижение брюшных рефлексов, тазовые, чувствительные расстройства, своеобразное отношение к жаре и холоду, колеблемость симптомов, данные дополнительных исследований (участки демиелинизации на МРТ, изменение на глазном дне и др.) дают возможность исключить миастению.
2. При нарушении функций бульбарных мышц и лицевой мускулатуры — с ОНМК, стволовыми опухолями и энцефалитами, для которых типичны выраженные общемозговые симптомы, а также отсутствие динамичности нарушений и реакции на введение антихолинэстеразных препаратов. Иногда значительные трудности возникают при дифференциальной диагностике миастении и бокового амиотрофического склероза (БАС), при котором в некоторых случаях возможны не только клинические симптомы миастении, но и нарушения нервно-мышечной передачи и реакции на введение антихолинэстеразных препаратов. В таких случаях правильный диагноз можно поставить только после проведения ЭМГ, выявляющей при БАС признаки денервации и реиннервации, а также наличие большого количества характерных потенциалов фасцикуляций.
3. При преимущественно скелетной слабости — с различными миопатиями и миопатическими синдромами, синдромом Гийена-Барре (СГБ), токсическим поражением нервно-мышечной передачи (например, дифтерийной, медикаментозной), отравлении ботулинотоксином, синдромом Ламберта- Итона. Дыхательные расстройства и кризы при миастении следует дифференцировать с СГБ, для которого характерна арефлексия, нарушение состава ликвора, отсутствие нарушений нервно-мышечной передачи и реакции на введение антихолинэстеразных препаратов. Слабость мышц туловища и конечностей у больных миастенией дифференцируют с различными формами врождённых и приобретённых миопатий. Миопатический процесс, как правило, характеризуется отличным от миастении характером распределения двигательных расстройств: отсутствием (за редким исключением) признаков поражения экстраокулярной и бульбарной мускулатуры, дыхательных нарушений; чаще сопровождается снижением или отсутствием сухожильных рефлексов, различной степенью выраженности мышечных атрофии.
Клинические симптомы, напоминающие миастению, возможны и при других формах нарушения нервно-мышечной передачи, таких, как синдром Ламберта-Итона и ботулизм. Причём если для синдрома Ламберта-Итона не типичны экстраокулярные, бульбарные и дыхательные нарушения, то именно они составляют основное клиническое ядро ботулизма. Характерные для синдрома Ламберта-Итона слабость и утомляемость мышц туловища и конечностей при ботулизме выявляют относительно редко. Для обеих форм характерна гипо- или арефлексия. Эффект от введения антихолинэстеразных препаратов при синдроме Ламберта-Итона минимальный, а при ботулизме отсутствует. Нарушения нервно-мышечной передачи характеризуются снижением исходной амплитуды М-ответа и её существенным увеличением в процессе высокочастотной стимуляции (инкремент) или после максимального произвольного усилия.
В целом следует подчеркнуть, что главное отличие миастении от других форм патологии — динамичность симптомов и положительная реакция на введение антихолинэстеразных препаратов. По утверждению 3. П. Лайсека, «любого больного с варьирующей слабостью мышц, особенно, если она связана с поражением мышц, иннервируемых черепными нервами, и не сопровождается нарушением чувствительности и рефлексов, следует рассматривать как потенциального больного миастенией до тех пор, пока диагноз миастении не будет отвергнут всеми другими исследованиями.
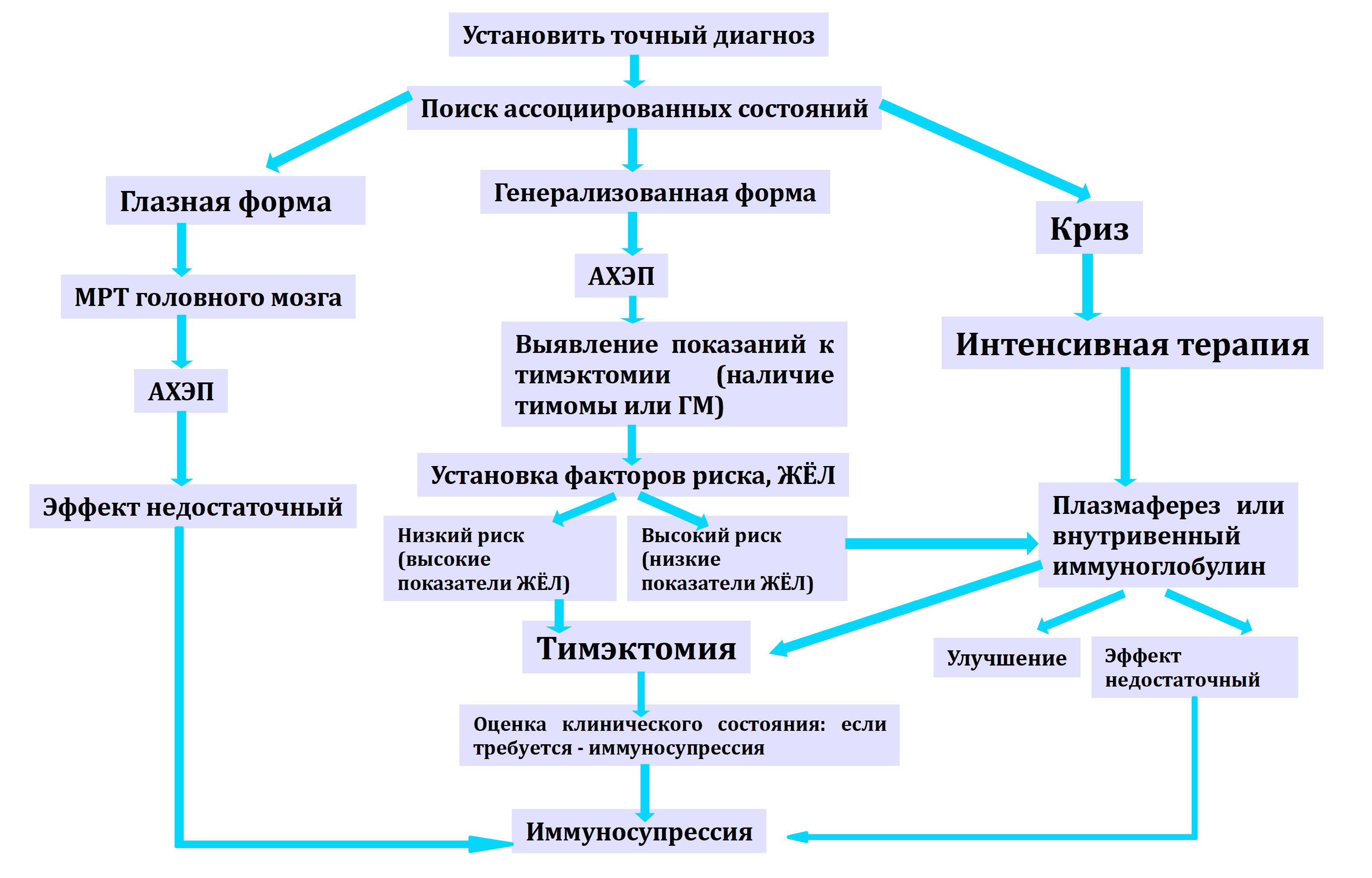
Алгоритм ведения пациентов с миастенией (A. Fauci et al., NY, 2005)
Лечение
Лечение миастении можно разделить на симптоматическое и патогенетическое. Первое направлено на улучшение нервно-мышечной передачи в синапсе, второе — на ликвидацию аутоиммунного процесса, лежащего в основе миастенических нарушений (как консервативным, так и оперативным способами). Существует также немедикаментозная терапия. Немедикаментозное лечение включает методы экстракорпоральной иммунокоррекции (гемосорбция и плазмаферез). К немедикаментозным методам лечения можно отнести и гамма-терапию на область тимуса. Данный метод применяют у пациентов, которым в силу тех или иных обстоятельств невозможно провести тимэктомию, а также как метод комплексной терапии после удалении тимомы (особенно в случаях инфильтрации опухоли в расположенные рядом органы). Суммарную дозу гамма-облучения подбирают индивидуально (в среднем 40-60 Грей).
I. Симптоматическая терапия
Улучшить передачу в нервно-мышечном синапсе можно за счет увеличения количества ацетилхолина и удлинения срока его пребывания в синаптической щели. Достигается это назначением антихолинэстеразных препаратов (АХЭП), которые относятся к базисной терапии миастении. Они разрушают холинэстеразу, препятствуя распаду ацетилхолина. Стандартных схем лечения АХЭП не существует. Важно подобрать оптимальный препарат и выработать режим его применения (дозировку и частоту приема). Оптимальной является минимальная доза АХЭП, оказывающая максимальный эффект без выраженных побочных реакций. Для определения суточной дозы используют прозериновую и калиминовую пробы. Начинают лечение с самой малой дозы и частоты (в зависимости от длительности действия АХЭП), постепенно увеличивая дозу до оптимальной. 1 таблетка и 1 ампула АХЭП = 1 стандартная доза. Максимальное суточное количество АХЭП — 24 стандартных дозы, однократно — 2 стандартных дозы.
Неостигмина бромид (Прозерин, простигмин) — АХЭП с длительностью действия до 2-3 часов. В связи с коротким и сильным действием используется для диагностики миастении, купирования острых ситуаций (инъекционная форма), реже — в качестве постоянной терапии (инъекционная и таблетированная формы). Лечебная дозировка соответствует диагностической. Хорошо действует на краниальные и скелетные мышцы.
Пиридостигмина бромид (Калимин, местинон) — АХЭП, наиболее широко используемый как в нашей стране, так и за рубежом. Длительность действия от 4 до 8 часов (в среднем 5-6 часов). Начинает действовать через 60 минут после приема внутрь, поэтому последующая доза принимается за 30 минут до окончания действия предыдущей. Основной препарат для базисного лечения миастении. Начальная доза 15-30 мг 3-4 раза в день, максимальная может достигать 120 мг каждые 3 часа. Дальнейшее наращивание дозы клинического эффекта не дает, но значительно увеличивает количество побочных эффектов. Более активно действует на краниальные мышцы.
Амбенония хлорид (Оксазил, мителаза) — АХЭП с длительностью действия 5-10 часов и началом действия через 0,5-1,5 часа после приема внутрь. Его особенность — преимущественное действие на мышцы туловища. Первоначально дается минимальная доза, которую затем постепенно увеличивают на 1 мг до оптимальной. В настоящее время при миастении используется редко.
Нейромидин (ипидакрин) — обратимый ингибитор холинэстеразы и блокатор калиевых каналов. Дозировка делится на 2-3 приема. Лечение курсовое (1-1,5 месяца) на фоне приема классических АХЭП.
Антихолинэстеразные препараты
| Препарат | Форма выпуска | Способ применения | ||||
| табл. | амп. | внутрь | п/к | в/м | в/в | |
| Прозерин (неостигмина метилсульфат) | 15 mg | 0,05%-1,0 | + | + | + | + |
| Аксамон (ипидакрин) | 20 mg | — | + | — | — | — |
| Нейромидин (ипидакрин) | 20 mg | 0,5%-1,0 1,5%-1,0 | + | + | + | + |
| Калимин (пиридостигмина бромид) | 60 mg | 0,5%-1,0 | + | + | + | + |
| Оксазил (амбеноний хлорид) | 5mg | — | + | — | — | — |
Препараты калия улучшают синтез и экскрецию ацетилхолина. Оптимальным является хлорид калия в порошке по 1,0 г 3 раза в день; порошок растворяют в стакане воды или сока и принимают во время еды. Противопоказания для использования больших доз калия — полная поперечная блокада проводящей системы сердца, нарушение выделительной функции почек.
Калийсберегающие диуретики вызывают задержку калия в организме за счет подавления активности альдостерона. Применяют спиронолактон перорально в дозе 0,025-0,05 г 3-4 раза в день.
II. Патогенетические методы лечения:
- 1.Иммуносупрессивная терапия:
- 2.Плазмаферез
- 3.Человеческий иммуноглобулин для внутривенного введения
- 4.Хирургическое лечение — операция тимэктомия.
- глюкокортикостероидная;
- цитостатическая.
Иммуносупрессивная терапия
Наибольшее распространение в качестве иммунорегуляторов получили кортикостероиды. Эффективность глюкокортикоидов при лечении миастении достигает, по отдельным данным, 80%. Из-за относительно быстрого наступающего эффекта их считают препаратами выбора у больных с витальными нарушениями, а также при дебюте заболевания с бульбарных нарушений и при глазной форме миастении. В настоящее время наиболее оптимальным считают приём глюкокортикоидов по схеме через день. Дозу преднизолона (метилпреднизолона) подбирают индивидуально, ориентируясь на тяжесть состояния больного. В среднем она составляет 1 мг/кг х сут.), но не менее 50 мг. Препарат принимают один раз в день утром. Лечение желательно начинать в условиях стационара. Эффект оценивают через 6-8 приёмов. В первые несколько дней некоторые пациенты могут отмечать эпизоды ухудшения состояния в виде нарастания мышечной слабости и утомляемости. Возможно, эти эпизоды связаны с прямым действием глюкокортикоидов на процессы освобождения синаптического медиатора и десенситизацией рецепторов. Это обстоятельство обусловливает необходимость временного уменьшения дозы антихолинэстеразных препаратов. По мере достижения эффекта и улучшения состояния больных дозу преднизолона постепенно уменьшают до поддерживающей. При длительном приёме глюкокортикоидов у ряда пациентов могут развиться побочные эффекты различной степени выраженности. Наиболее часто отмечают повышение массы тела, гирсутизм, катаракту, нарушение толерантности к глюкозе, артериальную гипертензию, остеопению. При развитии побочных эффектов, помимо симптоматической терапии, целесообразно уменьшить дозу препарата.
Цитостатики применяются при недостаточной эффективности глюкокортикоидов, при развитии выраженных побочных эффектов от применения ГКС, а также при наличии противопоказаний к их назначению (стойкая артериальная гипертензия, язвенная болезнь желудка и 12-перстной кишки, тяжелая форма сахарного диабета и др). Препаратом первого выбора считается азатиоприн, второго выбора — циклоспорин А (ЦСА), циклофосфамид, микофенолата мофетил и другие. По соотношению показателей эффективности и безопасности предпочтение отдают азатиоприну. При его длительном приеме примерно у 76% пациентов удается достичь ремиссии и отказаться от использования АХЭП. Недостатком лечения азатиоприном является медленное наступление эффекта. Препараты второго выбора применяют при тяжелом прогрессирующем течении миастении и недостаточном эффекте преднизолона и азатиоприна.
Азатиоприн (имуран). Начальная доза составляет 2,5-3 мг/кг в сутки, в дальнейшем — 1,5-2,5 мг/кг в сутки. Эффект наступает довольно поздно в сроки от 6 до 24 месяцев приема, имеется большое количество серьезных побочных эффектов: угнетение красного и белого кроветворения, поражение печени, повышение тератогенного риска. Возможно (у 20-30 % больных) развитие таких симптомов, как тошнота, рвота, диарея. Часто назначается в качестве дополнительного средства при ГКС-терапии.
Циклоспорин А. Начальная доза 5 мг/кг в сутки, делится на два приема, в дальнейшем эта доза уменьшается. В отличие от азатиоприна эффект наступает быстрее (от 1 до 3-х месяцев). Обладает высокой нефротоксичностью и тератогенностью. Нельзя сочетать с приемом нестероидных противовоспалительных средств. Оптимальный препарат при невозможности приема преднизолона.
Циклофосфамид используют при отсутствии эффекта от других иммунодепрессантов как в виде монотерапии, так и в сочетании с азатиоприном. Препарат вводят внутримышечно ежедневно в дозе 200 мг или через день в дозе 400 мг. Терапию начинают в условиях стационара, и только убедившись в хорошей переносимости препарата, можно переводить больных на амбулаторное лечение.
Микофенолата мофетил хорошо переносится и эффективен у 60-70% больных. По сравнению с азатиоприном он действует быстрее (клинический эффект появляется через 3-4 нед) и обладает меньшим количеством побочных эффектов. В качестве монотерапии препарат недостаточно эффективен, поэтому его назначают в дополнение к глюкокортикоидам в случаях, когда необходимо снижение их дозы. Микофенолата мофетил назначают перорально ежедневно по 2 г/сут с последующей коррекцией дозы в зависимости от эффективности лечения.
Анализ эффективности консервативного лечения проводится согласно международной классификации клинического эффекта, представленной в таблице 6.
Таблица 6 Международная классификация клинического эффекта
|
Полная безмедикаментозная ремиссия (эффект А) |
отсутствие симптомов заболевания > 1 года без специфической терапии. |
|
Медикаментозная ремиссия (эффект В) |
отсутствие симптомов заболевания либо минимальные проявления на фоне постоянного приема АХЭП или иммуносупрессивных препаратов. |
|
Хорошая компенсация состояния (эффект С) |
существенный регресс симптомов и отсутствие прогрессирования болезни на фоне постоянной антихолинэстеразной и/или иммуносупрессивной терапии. |
|
Отсутствие эффекта терапии (эффект О) |
прогрессирование заболевания, обострения с частотой > 1 раза в год, наличие стойких миастенических проявлений, ухудшающих работоспособность и самообслуживание пациентов |
Плазмаферез и внутривенное введение иммуноглобулина применяют для купирования обострения миастении, а также при миастеническом кризе. Плазмаферез также используют перед тимэктомией. Метод плазмафереза основан на заборе крови из локтевой или одной из центральных вен с последующим её центрифугированием, отделением форменных элементов и заменой плазмы либо на донорскую, либо на искусственную. Эта процедура приводит к быстрому (иногда в течение нескольких часов) улучшению состояния больных. Возможно повторное извлечение плазмы в течение нескольких дней или через день. Проводят замещение 2-3 л плазмы 3 раза в неделю до стойкого уменьшения слабости. Положительный эффект сохраняется 6-8 нед. Плазмаферез может приводить к водно-электролитным нарушениям, расстройствам гемостаза, гипотензии, гипоальбуминемии. Иммуноглобулин вводят внутривенно в течение 2-5 дней в суммарной дозе 2 г/кг. В среднем доза иммуноглобулина должна составлять 400 мг/кг/сутки в течение 5 дней. Улучшение, как правило, возникает через 3-10 дней и сохраняется в течение 1-4 мес. Метод эффективен у 78 % больных. Введение иммуноглобулина связано с риском инфицирования гепатитом В; изредка возможно развитие лихорадочного состояния, асептического менингита, транзиторной лейкопении, почечной недостаточности. При дефиците 1дА могут возникать анафилактические реакции.
Для коррекции возможных побочных эффектов глюкокортикоидной и иммуносупрессивной терапии можно применять иммуномодуляторы, полученные из вилочковой железы (тимуса экстракт, тималин и др.). Следует помнить, что эти препараты в редких случаях могут вызывать обострение миастении. Тималин регулирует количество Т- и В-клеток, активирует клеточный иммунитет, назначается по 5-10 мл/сут в/м, курс лечения 30-100 мл. Хирургическое лечение — операция тимэктомия или тимтимомэктомия.
Показания: опухоль вилочковой железы (тимома), вовлечение в процесс краниобульбарной мускулатуры, прогрессирующее или злокачественное течение миастении. У детей тимэктомия показана при генерализованной форме миастении, плохой компенсации нарушенных функций в результате медикаментозного лечения и при прогрессировании болезни.
Противопоказания: острая фаза миастении (выраженные
некомпенсированные бульбарные нарушения, а также нахождение больного в кризе), тяжёлые соматические заболевания, генерализация опухолевого процесса с наличием множественных отдаленных метастазов, когда речь идет о тимоме. Эффективность тимэктомии в настоящее время составляет 50-80%. Для оценки результатов операции используется схема С. Кеупез (1949) в модификации.
Таблица 7 Схема G. Keynes (1949) в модификации
|
А (отличный эффект) |
Полное восстановление двигательных функций, работоспособность без медикаментозной поддержки |
|
В (хороший эффект) |
Значительное улучшение состояния, практически полное восстановление двигательной функции и работоспособности при уменьшении суточной дозы калимина по сравнению с дооперационной в 2 раза и более и отсутствии необходимости в иммуносупрессивной терапии. |
|
С (удовлетворительный эффект) |
Незначительное улучшение двигательной функции при постоянном приеме АХЭП и иногда преднизолона, отсутствие прогрессирования заболевания. |
|
В (отсутствие эффекта) |
Отсутствие компенсации двигательных нарушений, сохранение прежних доз АХЭП или ухудшение после операции. |
|
Е (летальность) |
Летальный исход вследствие миастении или других причин. |
В настоящее время вопрос эффективности тимэктомии, равно как использования того или иного хирургического доступа для выполнения операции, остается дискутабельным. Как правило, эффект тимэктомии оценивают в интервале от 8 до 12 мес. после операции. Однако клинический анализ показывает, что улучшение состояния больных наблюдается и в раннем послеоперационном периоде, причем у значительной части больных этот эффект может быстро исчезать. По мнению ряда исследователей, эффективность операции составляет около 80 %.
Этапы лечения миастенического и холинергического кризов
Этап 1: если есть реакция на АХЭП:
1) подбор адекватных доз АХЭП:калимин форте по 1-1,5 мл в/в или в/м — каждые 4-5 ч. или прозерин по 1,5-2 мл п/к каждые 3-4 ч; 2) немедленно начать патогенетическую терапию: пульс-терапия преднизолоном в/в капельно по 1000-2000 мг через день + 300-500 мг в/в во 2-й день;
3) далее — преднизолон перорально ежедневно по 1,5-2 мг/кг массы тела по схеме большая/малая доза;
4) препараты калия — в/в по 3 г /сут;
5) плазмаферез или иммуноглобулины человека О;
N3! Пульс-терапия относительно противопоказана при холинергическом и смешанном кризах из-за десентитизации АХЭП.
Этап 2: если нет реакции на АХЭП:
1) интубация и ИВЛ и немедленная отмена всех АХЭП;
2) на следующие сутки: прозерин и попытка отключения ИВЛ;
3) при восстановлении дыхания, не экстубируя больного, п/к прозерин каждые 3-4 ч., при устойчивом состоянии — экстубировать пациента;
4) если остаются дыхательная недостаточность и нарушение глотания — вновь подключить ИВЛ и больше АХЭП не вводить;
5) на следующий день — п/к прозерин и снова попытаться отключить ИВЛ;
6) если дыхание не нормализуется через 3 сут. — трахеостома. Продолжать или начать патогенетическую терапию;
7) плазмаферез или иммуноглобулины О;

Введение АХЭП при миастеническом кризе на фоне ИВЛ считается грубой ошибкой!
Рекомендации пациенту
При миастении противопоказаны чрезмерные физические нагрузки, инсоляции, препараты, указанные в таблице. Некоторый положительный эффект дает диета, богатая калием — печеный картофель, курага, бананы и др.
Таблица 8. Применение лекарственных средств при миастении
|
Группа лекарственных средств |
Средства, которые могут увеличить слабость |
Безопасные средства |
|
Антибактериальные средства |
Стрептомицин, гентамицин и другие аминогликозиды, полимиксин В, колистин, тетрациклин, линкомицин, клиндамицин, пенициллин (в больших дозах), ампициллин, ципрофлоксацин, сульфаниламиды |
Рокситромицин, цефалоспорины, левомицетин, эритромицин рифампицин, нитрофураны, налидиксовая кислота, изониазид фурадонин |
|
Антиэпилептические средства |
Триметин, дифенин, барбитураты, бензодиазепины (в высокой дозе) |
Препараты вальпроевой кислоты, гексамидин, карбамазепин |
|
Психотропные средства |
Нейролептики (аминазин, препараты лития, бензодиазепины (в высокой дозе), амитриптилин |
Тиоридазин (сонапакс), бензодиазепины (малые дозы) |
|
Гормональные средства |
Кортикостероиды*, препараты АКТГ, оральные контрацептивы, окситоцин, гормоны щитовидной железы |
|
|
Кардиологические средства |
(Р-блокаторы, хинидин, лидокаин, новокаинамид, антагонисты ионов кальция, ганглиоблокаторы, гуанетидин |
Дигоксин, резерпин, метилдофа, спиронолактон, триамтерен |
|
Анальгетики и противовоспалительные средства |
Производные морфина, хинин, хлоракин, Э-пеницилламин |
Ацетилсасалициловая кислота, НПВС, пентазоцин, соли золота, бутадион |
|
Другие средства |
Миорелаксанты, соли магния (аспаркам), йодсодержащие контрастирующие средства |
|
|
Магний-содержащие слабительные средства |
Сульфат натрия |
|
|
Хинидин |
Новокаинамид |
* Применение возможно при строгом контроле; нарастание слабости обычно возникает в начале лечения.
Правильная диагностика и своевременное назначение адекватных методов лечения приводят к компенсации двигательных расстройств более чем у 80% больных миастенией.
Особенности клиники, диагностики и терапии миастении у детей
Согласно современным данным миастения с дебютом клинических проявлений в детском возрасте составляет 10-24 % всех больных с данной патологией. Имеется общая тенденция к увеличению заболеваемости, в том числе у детей и подростков. В целом, ежегодно регистрируется 10 случаев миастении на 1 млн населения. По данным исследователей миастения встречается чаще, но не во всех случаях диагностируется. Однако, существует мнение, что на каждого выявленного больного приходится 2 недиагностированных случая, что обусловлено разнообразием клинических проявлений, особенностями течения болезни, несвоевременным обращением к специалисту. Ошибки первоначальной диагностики у детей составляют 91%. Это связано с недостаточной настороженностью врачей в отношении данной патологии, неумением детей охарактеризовать свои жалобы, а родителей — расценить их как проявление болезни.
Установлено, что миастения у детей отличается от миастении у взрослых степенью выраженности симптомов, особенностями клинических проявлений. Как известно, миастения относится к аутоиммунным заболеваниям, проявляется слабостью и патологической утомляемостью различных мышечных групп вследствие поражения нервно-мышечного синапса антителами к ацетилхолиновым рецепторам (АХР). Вместе с тем, существует группа врожденных миастенических синдромов, клинические проявления которых в значительной степени близки к выявляемым у больных аутоиммунной миастенией, но имеющим другой патогенетический механизм. В настоящее время известно, что в основе патогенеза врожденных миастенических синдромов лежит мутация генов, определяющих изменение структуры и функции АХР: нарушение числа рецепторов или аномалия их функционирования.
При одних синдромах страдают пресинаптические механизмы нервно-мышечной передачи, при других — постсинаптические, при третьих — одновременно и пресинаптические, и постсинаптические. При пресинаптическом поражении нарушается синтез, депонирование или высвобождение ацетилхолина, при комбинированном процессе наблюдается недостаточность ацетилхолинэстеразы; постсинаптические расстройства характеризуются аномалией АХР, их врожденным отсутствием. Большинство известных к настоящему времени синдромов наследуются по аутосомно¬рецессивному типу, исключая миастенический синдром, связанный с медленным закрытием ионных каналов и являющийся аутосомно¬доминантным. В сыворотке крови больных детей антитела к АХР не обнаруживаются, поскольку антитела связываются с АХР.
В соответствии с клинической классификацией выделяют:
— миастению новорождённых (неонатальную),
— врожденную миастению:
а) доброкачественную с офтальмопарезом или офтальмоплегией,
б) семейную детскую,
— юношескую миастению.
Неонатальная миастения (транзиторный или преходящий
миастенический синдром)
Отмечается у детей, родившихся от матерей, страдающих миастенией в 10-15% случаев. Развивается в результате перехода антител против АХР от больной миастенией матери к ее здоровому плоду. Выраженность симптомов у новорождённого зависит от концентрации антител в его крови. Клинические проявления носят преходящий характер, так как вещество, блокирующее синапсы в последующем в организме ребёнка не образуется. Симптомы возникают через несколько часов после рождения (или в период до третьего дня жизни) и характеризуются выраженной мышечной гипотонией, вялостью движений, маскообразным лицом, слабостью крика, сосания, поперхиванием, снижением безусловных рефлексов. Редко наблюдаются расстройства дыхания, птоз, офтальмопарез. Степень выраженности клинических проявлений может быть разной. Слабость значительно увеличивается в первые дни, затем отмечается регресс симптомов. Длительность их проявлений в среднем составляет 18 дней (от 5 до 60 дней), затем состояние полностью нормализуется. Прогноз благоприятный. Однако дети, рожденные от матерей, страдающих миастенией, нуждаются в тщательном наблюдении в течение первых дней жизни даже в тех случаях, когда на первый взгляд кажутся здоровыми и не вызывают опасений. Диагноз подтверждает высокий уровень антител к АХР у новорождённого. Пациенткам с миастенией противопоказано грудное вскармливание — можно только искусственное! Новорождённым с тяжелой генерализованной слабостью и дыхательными нарушениями показано обменное переливание крови. В случаях выраженных симптомов в/м перед кормлением (каждые 4 часа) вводится неостигмина метилсульфат 0,1-0,2 мл (в зависимости от веса ребенка), что улучшает сосание, глотание и нормализует процесс питания. Препарат может вводиться через назогастральный зонд в дозе, десятикратно превышающей ту, которая выбирается при парентеральном применении препарата. По мере регресса клинических проявлений доза препарата уменьшается. Одновременно с прозерином — утром 30 мг преднизолона в инъекциях (до полной компенсации симптомов миастении, обычно от 1 до 4 недель).
Врожденная миастения, редкое, как правило аутосомно-рецессивное заболевание, которое обусловлено несколькими генетическими дефектами, включающими патологию ресинтеза (восстановление) или накопления ацетилхолина, уменьшение конечной активации ацетилхолинэстеразы и нарушение функции АХР. Выделяют три категории патологии: с пресинаптическими, синаптическими или постсинаптическими нарушениями. Патология у лиц мужского пола встречается в 2 раза чаще. При врожденной доброкачественной миастении с офтальмопарезом или офтальмоплегией сразу после рождения или несколько позже отмечают симметричный птоз и офтальмоплегию. Это единственная форма миастении, при которой офтальмоплегия выступает в качестве первого клинического симптома. Если офтальмоплегия после рождения является парциальной, то в раннем или детском возрасте она становится полной. Обычно проявляется в первые 2 года жизни. Может наблюдаться лёгкая слабость мышц лица, но она не ведет к тяжёлым нарушениям при кормлении.
Генерализованная мышечная слабость развивается редко. Стёртые формы распознаются с опозданием, иногда впервые диагностируются в 20-30 лет. Заболевание, как правило, носит доброкачественный характер, не представляет угрозы для жизни. Титр антител к АХР не повышен. Иммуносупрессивная терапия не эффективна. Некоторый положительный эффект возможен при назначении ингибиторов ацетилхолинэстеразы.
Семейная инфантильная (детская) миастения
В основе патогенеза семейной инфантильной миастении может быть как пресинаптический дефект, связанный с нарушением ресинтеза ацетилхолина, так и постсинаптические дефекты медиатора в области АХР или врожденный дефект ацетилхолинэстеразы. Первые патологические симптомы выявляются у новорождённых в виде тяжелых бульбарных и дыхательных нарушений. Многие дети нуждаются в искусственной вентиляции легких. Не исключен летальный исход. Часто наблюдается птоз, но другие нарушения мышц глаза, как правило, не вовлекаются. Движения глазных яблок не ограничены. Обращает на себя внимание общая мышечная слабость, слабость мимической мускулатуры, которая появляется с рождения или в течение первого года жизни. Через несколько недель состояние улучшается, однако эпизоды слабости и дыхательных нарушений повторяются в течение детского, а иногда и зрелого возраста. Положительный эффект даёт назначение ингибиторов ацетилхолинэстеразы. С годами потребность в терапии обычно уменьшается. Тимэктомия и иммуносупрессивная терапия не дают улучшения.
Проксимальная мышечная слабость может наблюдаться при генетически детерминированных миастенических синдромах, а также в случаях иммунозависимой миастении. Так в 1995 году был описан синдром, связанный с медленным закрытием ионных каналов (Gomez and Gammack). В 1992 — поясно-конечностная миастения (Oh and Kuruoglu).
Синдром, связанный с медленным закрытием ионных каналов — наследственное заболевание, обусловленное патологией ионных каналов ацетилхолиновых рецепторов скелетных мышц. Наследуется по аутосомно-доминантному типу. Заболевание обычно проявляется в грудном возрасте, но может быть и у взрослых. Отмечается слабость, утомляемость мышц шеи, лопаток, офтальмопарез, мышечные атрофии. Не характерны птоз, бульбарные нарушения, слабость в ногах. Заболевание характеризуется медленным прогрессированием, поздней диагностикой. (в 10 лет и позже). Ацетилхолинэстеразные препараты не эффективны. Методов лечения не разработано. Диагноз подтверждает ЭМГ: повторная стимуляция нерва, частотой 3 импульса в секунду вызывает патологическое уменьшение амплитуд мышечных ответов (при стимуляции одиночными импульсами этого не наблюдается). Мышечная биопсия выявляет превалирование тела волокон I типа, возможна пучковая атрофия, дефекты конфигурации концевых пластинок.
Поясно-конечностная миастения — иммунозависимая форма, начинающаяся в возрасте после 10 лет. Болеют преимущественно девочки. Проявляется прогрессирующей мышечной слабостью в конечностях. Физическая нагрузка не ухудшает состояние больного. Сухожильные рефлексы, как правило, вызываются, но могут быть снижены. Могут поражаться мимические мышцы. Бульбарные, глазодвигательные нарушения отсутствуют. Клинические симптомы дают возможность думать о поясно- конечностной миодистрофии. Диагноз миастении подтверждают сохранность сухожильных рефлексов; ЭМГ: повторная стимуляция нерва демонстрирует декремент (снижение) амплитуды мышечного ответа. Уровень антител, связывающих рецепторы ацетилхолина, повышен. Лечение проводится в соответствии с принципами терапии других серопозитивных форм миастении.
Ювенильная миастения — иммунозависимая форма, при которой в результате нарушения иммунных механизмов происходит образование антител против АХР постсинаптической мембраны нервно-мышечного синапса, что ведет к уменьшению числа действующих постсинаптических Н- холинорецепторов в поперечно-полосатых мышцах и, таким образом, к нарушению передачи нервных импульсов через нервно-мышечные синаптические аппараты. Термин «ювенильная» встречает возражение у зарубежных авторов, так как болезнь у детей и взрослых, по их мнению, нередко протекает идентично.
Заболевание у ребенка может проявиться в различные периоды жизни, начиная с 6-ти месяцев, в 75 % случаев — после 10-ти лет (11-16 лет), причем прогностически более благоприятным считается начало миастении в препубертатном периоде, нежели в постпубертатном периоде. В настоящее время, как правило, выделяют две клинические формы: глазную и генерализованную. При первой — преимущественно страдают мышцы глаз, однако не исключено легкое поражение мышц лица и конечностей. При второй — процесс носит генерализованный характер, преобладает выраженная слабость конечностей, заинтересованность бульбарной мускулатуры. Помимо указанных форм описывают бульбарную; поясно-конечностную (скелетную), при которой имеет место поражение мышц туловища и конечностей; глоточно-лицевую. Основными клиническими проявлениями миастении у детей, как и у взрослых, являются: мышечная слабость патологическая мышечная утомляемость. Развитие заболевания чаще носит подострый или хронический характер, хотя возможен и острый вариант. При этом провоцирующими факторами, как правило, являются острые респираторные инфекции, интоксикации, эндокринные сдвиги. Дебют болезни в препубертатном возрасте чаще наблюдается у мальчиков, в постпубертатном — у девочек. В целом, заболевание у мальчиков протекает менее тяжело, как правило в виде глазной формы. Локальная форма заболевания у детей встречается реже, чем у взрослых: глазная — у 3,7 %, скелетно-мышечная у 4,7%, глоточно-лицевая — у 6 % от общего числа больных детей.
Вне зависимости от формы миастении первыми патологическими проявлениями являются глазные симптомы. Генерализация процесса, как правило, происходит в течение первых месяцев. При глазной форме в клинической картине доминируют глазодвигательные расстройства: птоз, обычно двусторонний, асимметричный. Реже страдают отдельные мышцы глазного яблока, что сопровождается диплопией. Слабость глазодвигательных мышц в начале непостоянна. При повторных осмотрах клинические проявления могут меняться. Двоение и птоз нарастает при физической нагрузке, продолжительном взгляде вверх; усиливаются к вечеру, уменьшаются после отдыха. Степень выраженности симптомов разнообразна. В тяжелых случаях может отмечаться полная наружная офтальмоплегия. Зрачковые реакции не нарушаются. У 40-50% больных во время дебюта обнаруживается слабость других мышечных групп. У детей с глазной формой миастении могут иметь место слабость мышц лица (чаще круговой мышцы глаза с одной или обеих сторон), легкая утомляемость в конечностях. Отсутствие грубого нарастания других миастенических проявлений в течение 2х лет свидетельствует о том, что генерализация процесса в последующем становится все менее вероятной. Такая форма миастении опасности для жизни не представляет, чаще наблюдается у мальчиков, развивается в препубертатном периоде. Течение, как правило, носит ремитирующий характер (с обострениями и ремиссиями). Обострения варьируют по тяжести и продолжительности от нескольких недель до нескольких лет. У 20% больных отмечаются длительные ремиссии. Для этой формы характерна серонегативность по отношению к АХР (то есть отсутствуют антитела к АХР).
Генерализованная форма миастении у детей встречается наиболее часто, преимущественно у лиц женского пола. Как правило, заболевание начинается в постпубертатном возрасте, чаще моносимптомно — со слабости глазодвигательных мышц (птоз и/или диплопия) у 72,2% детей, затем вовлекаются мышцы шеи (77,8% детей), мышцы туловища и конечностей, причем в отличие от взрослых больных страдают дистальные отделы (кисти — в 75% случаев, стопы — 41,7%), мимическая (75% и жевательная мускулатура (38%). Уже через год обращает на себя внимание выраженная диффузная мышечная слабость, утомляемость, симптомы поражения бульбарной группы мышц. Больные жалуются на затруднение при глотании пищи, попадание жидкости в нос (эти симптомы усиливаются в процессе еды), носовой оттенок голоса, утомляемость во время разговора. Заболевание у детей протекает крайне тяжело, с поражением дыхательной мускулатуры (78% наблюдений), миастеническими кризами (25% случаев). Спонтанные ремиссии не характерны. У многих больных наблюдается резистентность к антихолинэстеразным препаратам. Как и при миастении взрослых, отмечается серопозитивность по отношению к АХР (наличие антител к АХР), что подтверждает аутоиммунную природу заболевания. Дети с данной формой болезни имеют высокий риск развития аутоиммунных заболеваний, особенно тиреоидитов и коллагенозов. В 5 % случаев миастения у детей сочетается с тимомой (для сравнения у взрослых тимома диагностируется в 15% случаев и больше).
Установлено, что миастения у детей отличается от миастении у взрослых степенью выраженности симптомов, особенностями клинических проявлений. У больных детской аутоиммунной миастенией, в сравнении со взрослыми пациентами, значительно больше выражен птоз, слабость мимической мускулатуры (в частности, круговой мышцы глаза), мышц шеи, дистальных отделов конечностей. Чаще отмечается поражение дыхательной мускулатуры, генерализованное снижение мышечного тонуса. Клинические исследования свидетельствуют о том, что детская аутоиммунная и врожденная миастения имеют некоторые различия. При врожденной форме обращает на себя внимание более тяжелое поражение глазодвигательных мышц, негрубый птоз, мышечная гипотония, страдание дистальных отделов конечностей, меньшая заинтересованность мимической, бульбарной мускулатуры. Электромиографическое исследование свидетельствует о том, что больные врождённой миастенией достоверно точно отличаются от больных детской 41 миастенией и взрослых больных значительно меньшей величиной декремента амплитуды М-ответа, что может быть использовано при проведении дифференциального диагноза между указанными формами заболевания. Все выше указанные сравнительные данные статистически достоверны.
Постановка диагноза проводится на основании клинических, фармакологических, электромиографических и иммунологических критериев (доказательством последнего является концентрация антител к АХР более 0,4012 ммоль). Повышение титра антител к АХР при генерализованной миастении выявляется в 80-90% случаев. Следует помнить, что увеличение вилочковой железы по данным КТ или МРТ не является критерием диагностики миастении. Диагноз считается несомненным при подтверждении его по 4 критериям, достоверным — по 3 критериям, вероятным — по 2 критериям и сомнительным — по 1. Диагностика миастении в детском возрасте должна быть проведена до назначения патогенетической терапии, так как методы лечения при аутоиммунной и врожденной формах разные. Лечение аутоиммунной формы миастении у взрослых и детей в целом проводится по одним канонам. Лечение направлено на коррекцию относительного дефицита ацетилхолина и подавление аутоиммунного процесса. Однако, по мнению зарубежных авторов, детям с генерализованной миастенией и повышенным уровнем антител к АХР как можно раньше после уточнения диагноза должна быть проведена тимэктомия. При операциях, выполненных на ранних стадиях болезни, у большинства больных в течение 3х лет сохраняется ремиссия. Сразу после хирургического вмешательства должна быть начата кортикостероидная терапия. Преднизолон 1,5 мг/кг/сут (не выше 100 мг) парентерально, затем перорально. Через 5 дней назначают преднизолон через день (в течение 1 месяца). Доза препарата уменьшается на 10% ежемесячно, до поддерживающей (при которой клинические проявления болезни отсутствуют). Попытка отмены проводится через 1 год после полной нормализации состояния. Следует помнить, что высокие дозы кортикостероидов вначале могут вызывать нарастание симптомов, поэтому лечение следует начинать, пока больной находится в стационаре. Улучшение наступает после первой недели лечения и продолжается в последующие месяцы. Антихолинэстеразные средства одновременно с кортикостероидами поначалу не назначаются, так как на фоне гормонов повышается чувствительность к ним, что может привести к холинэргическому кризу. При необходимости могут применяться в последующем в те дни, когда больной не принимает кортикостероиды. Плазмаферез или внутривенное введение иммуноглобулина используются при крайней необходимости: у больных с дыхательной недостаточностью или в случаях, когда больные настолько слабы, что таким образом должны быть подготовлены к проведению тимэктомии.
Содержание
-
Структурная формула
-
Русское название
-
Английское название
-
Латинское название
-
Брутто формула
-
Фармакологическая группа вещества Калия хлорид
-
Нозологическая классификация
-
Код CAS
-
Фармакологическое действие
-
Характеристика
-
Фармакология
-
Применение вещества Калия хлорид
-
Противопоказания
-
Применение при беременности и кормлении грудью
-
Побочные действия вещества Калия хлорид
-
Взаимодействие
-
Передозировка
-
Способ применения и дозы
-
Меры предосторожности
-
Торговые названия с действующим веществом Калия хлорид
Структурная формула
Русское название
Калия хлорид
Английское название
Potassium chloride
Латинское название
Kalii chloridum (род. Kalii chloridi)
Брутто формула
KCl
Фармакологическая группа вещества Калия хлорид
Нозологическая классификация
Код CAS
7447-40-7
Фармакологическое действие
—
восполняющее дефицит калия, нормализующее КЩС.
Характеристика
Бесцветные кристаллы или белый гранулированный порошок без запаха, соленый на вкус. Растворим в воде (1:3), нерастворим в спирте.
Фармакология
Активирует многие цитоплазматические ферменты, регулирует внутриклеточное осмотическое давление, синтез белка, транспорт аминокислот, проведение нервных импульсов, сокращение скелетных мышц. Ионы калия вызывают урежение ЧСС, снижают сократительную активность, уменьшают проводимость, автоматизм и возбудимость миокарда. В малых дозах они расширяют коронарные сосуды, в больших — суживают. Калий способствует повышению содержания ацетилхолина и возбуждению симпатического отдела ЦНС. Оказывает умеренное диуретическое действие. Увеличение уровня калия снижает риск развития токсического действия сердечных гликозидов на сердце.
Из таблеток ретард калий постепенно и медленно высвобождается на всем протяжении ЖКТ. Калия хлорид после приема внутрь легко и практически в любом количестве пассивно абсорбируется, т.к. его концентрация (как пищевого, так и освобожденного из лекарственных форм) выше в просвете тонкой кишки, чем в крови. В подвздошной и толстой кишках калий выделяется в просвет кишок по принципу сопряженного обмена с ионами натрия и выводится с фекалиями (10%). Распределение калия в организме продолжается около 8 ч с момента приема: T1/2 в фазе абсорбции — 1,31 ч; время высвобождения из таблеток (ретард) соответствует 5 таким периодам — 6 ч.
Применение вещества Калия хлорид
Гипокалиемия (в т.ч. на фоне сахарного диабета, длительной диареи и/или рвоты, терапии гипотензивными средствами, некоторыми диуретиками, глюкокортикоидами), лечение и профилактика дигиталисной интоксикации, профилактика аритмии у больных с острым инфарктом миокарда.
Противопоказания
Гиперчувствительность, острая и хроническая почечная недостаточность, полная блокада сердца, лечение калийсберегающими диуретиками, гиперкалиемия, метаболические нарушения (ацидоз, гиповолемия с гипонатриемией), заболевания ЖКТ в стадии обострения, возраст до 18 лет (эффективность и безопасность не установлены).
Применение при беременности и кормлении грудью
При необходимости применения при беременности следует сопоставить ожидаемую пользу для матери и потенциальный риск для плода.
Категория действия на плод по FDA — C.
На время лечения следует прекратить грудное вскармливание.
Побочные действия вещества Калия хлорид
Со стороны органов ЖКТ: тошнота, рвота, диарея, метеоризм, боль в животе, изъязвления слизистой оболочки ЖКТ, кровотечения, перфорация и непроходимость кишечника.
Со стороны нервной системы и органов чувств: парестезия, миастения, спутанность сознания.
Прочие: гиперкалиемия, снижение АД, аллергические реакции.
Взаимодействие
Калийсберегающие диуретики (в т.ч. спиронолактон, триамтерен, амилорид), НПВС, ингибиторы АПФ (в т.ч. каптоприл, эналаприл) повышают вероятность развития гиперкалиемии.
Передозировка
Симптомы: гиперкалиемия (мышечный гипотонус, парестезия, замедление AV проводимости, аритмия, остановка сердца). Ранние клинические признаки гиперкалиемии обычно появляются при концентрации K+ в сыворотке более 6 мэкв/л: заострение зубца T, уширение комплекса QRS. Более тяжелые симптомы гиперкалиемии — паралич мускулатуры и остановка сердца — развиваются при концентрации K+ 9–10 мэкв/л.
Лечение: внутрь или в/в — раствор натрия хлорида; при необходимости — гемодиализ и перитонеальный диализ.
Способ применения и дозы
Внутрь, в/в. Дозу и схему лечения устанавливают индивидуально в зависимости от показаний и концентрации K+ в крови. При тяжелых интоксикациях вводят в/в.
Меры предосторожности
С осторожностью назначают пациентам с нарушением AV проводимости. Во время лечения необходимо контролировать содержание K+ в сыворотке крови, ЭКГ, КЩС. Диета с большим содержанием натрия хлорида увеличивает выведение калия из организма.
Следует учитывать, что гиперкалиемия, приводящая к летальному исходу, может развиваться быстро и протекать бессимптомно.
Торговые названия с действующим веществом Калия хлорид
| Торговое название | Цена за упаковку, руб. |
|---|---|
| Калия хлорид |
от 64.00 до 121.00 |
| Калия хлорид буфус |
от 65.00 до 137.00 |
Миастения
Версия: Клинические протоколы МЗ РК — 2016 (Казахстан)
Категории МКБ:
Myasthenia gravis и другие нарушения нервно-мышечного синапса (G70)
Разделы медицины:
Неврология
Общая информация
Краткое описание
Одобрено
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения и социального развития Республики Казахстан
от «29» ноября 2016 года
Протокол № 16
Миастения (болезнь Эрба – Гольдфлама – Жолли) – аутоиммунное нервно-мышечное заболевание, клинически характеризующееся патологической слабостью и утомляемостью произвольной мускулатуры, и связанное с повреждением ацетилхолиновых рецепторов постсинаптической мембраны поперечно-полосатых мышц специфическими комплементфиксирующими антителами. [Кузин М.И., Гехт Б.М.]
Соотношение кодов МКБ-10 и МКБ-9
| КодМКБ-10 | Код МКБ-9 | ||
| Код | Название | Код | Название |
G70. |
Myasthenia gravis и другие нарушения нервно мышечного синапса. |
G70. |
Myasthenia gravis и другие нарушения нервно мышечного синапса. |
Дата разработки/пересмотра протокола: 2016 год.
Пользователи протокола: врачи общей практики, терапевты, врачи скорой медицинской помощи, анестезиологи-реаниматологи, эндокринологи, онкологи, клинические фармакологи, невропатологи.
Категория пациентов: взрослые.
Шкала уровня доказательности:
Соотношение между степенью убедительности доказательств и видом научных исследований
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортных или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С |
Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с не высоким риском систематической ошибки (+). Результаты, которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
| GPP | Наилучшая фармацевтическая практика. |
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»
Версия: Клинические протоколы МЗ РК — 2016 (Казахстан)
Категории МКБ:
Myasthenia gravis и другие нарушения нервно-мышечного синапса (G70)
Разделы медицины:
Неврология
Общая информация
Краткое описание
Одобрено
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения и социального развития Республики Казахстан
от «29» ноября 2016 года
Протокол № 16
Миастения (болезнь Эрба – Гольдфлама – Жолли) – аутоиммунное нервно-мышечное заболевание, клинически характеризующееся патологической слабостью и утомляемостью произвольной мускулатуры, и связанное с повреждением ацетилхолиновых рецепторов постсинаптической мембраны поперечно-полосатых мышц специфическими комплементфиксирующими антителами. [Кузин М.И., Гехт Б.М.]
Соотношение кодов МКБ-10 и МКБ-9
| КодМКБ-10 | Код МКБ-9 | ||
| Код | Название | Код | Название |
G70. |
Myasthenia gravis и другие нарушения нервно мышечного синапса. |
G70. |
Myasthenia gravis и другие нарушения нервно мышечного синапса. |
Дата разработки/пересмотра протокола: 2016 год.
Пользователи протокола: врачи общей практики, терапевты, врачи скорой медицинской помощи, анестезиологи-реаниматологи, эндокринологи, онкологи, клинические фармакологи, невропатологи.
Категория пациентов: взрослые.
Шкала уровня доказательности:
Соотношение между степенью убедительности доказательств и видом научных исследований
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортных или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С |
Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с не высоким риском систематической ошибки (+). Результаты, которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
| GPP | Наилучшая фармацевтическая практика. |
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Классификация [Б.М. Гехт 1965г]
По характеру течения:
• миастенические эпизоды (однократный или ремитирующее течение);
• миастенические состояния (т.е. стационарное течение);
• прогрессирующее течение;
• злокачественная форма.
По локализации
Локальные (ограниченные) процессы:
• глазные;
• бульбарные;
• лицевые;
• краниальные;
• туловищные.
Генерализованные процессы:
• генерализованные без бульбарных нарушений;
• генерализованные и генерализованные с нарушениями дыхания.
По степени тяжести двигательных расстройств:
• легкая;
• средней тяжести;
• тяжелая.
По степени компенсации двигательных нарушений на фоне АХЭР препаратов:
• полная;
• достаточная;
• недостаточная (плохая).
В зависимости от динамики клинической картины выделяют несколько форм миастении:
• миастенические эпизоды – представляющие из себя преходящие двигательные расстройства с полным восстановлением функции вне эпизода.
• миастеническое состояние – форма миастении, при которой клиника сохраняется на протяжении многих лет без изменений.
• прогрессирующая форма – форма миастении, при которой клинические проявления необратимо прогрессируют, без эпизодов восстановления сниженных двигательных функций.
• злокачественная форма – форма миастении, остро начинающаяся и неуклонно прогрессирующая весьма быстрыми темпами с неуклонным нарушением функций нервно-мышечного аппарата.
Классификации Американской Ассоциации неврологов, основанной на оценке тяжесть клинических проявлений миастении по пятибалльной шкале MGFA и распространенности патологического процесса:
· 1 — изолированная слабость только окулярных мышц, во всех других мышцах сила нормальная.
· 2А — преобладание умеренной слабости мышц туловища, либо проксимальных отделов конечностей, либо и того и другого. Также могут быть умеренное вовлечение в процесс бульбарной мускулатуры и слабость окулярных мышц любой степени выраженности.
· 2В — преобладание умеренной слабости бульбарной и дыхательной мускулатуры либо и того и другого. Также могут быть умеренное вовлечение мышц туловища либо проксимальных отделов конечностей и слабость окулярных мышц любой степени выраженности.
· 3А — преобладание средней степени слабости мышц туловища, либо проксимальных отделов конечностей, либо и того и другого. Также могут быть умеренное вовлечение в процесс бульбарной и дыхательной мускулатуры и слабость окулярных мышц любой степени выраженности.
· 3В — преобладание средней степени слабости бульбарной и дыхательной мускулатуры, либо и того и другого. Также возможны умеренное или средней степени тяжести вовлечение мышц туловища либо проксимальных отделов конечностей и слабость окулярных мышц любой степени выраженности.
· 4А — преобладание тяжёлой степени слабости мышц туловища, либо проксимальных отделов конечностей, либо и того и другого. Также могут быть умеренное вовлечение в процесс бульбарной и дыхательной мускулатуры и слабость окулярных мышц любой степени выраженности.
· 4В — преобладание тяжёлой степени слабости бульбарной и дыхательной мускулатуры. Также возможны умеренное, среднее или тяжёлое вовлечение мышц туловища либо проксимальных отделов конечностей и слабость окулярных мышц любой степени выраженности.
· 5 -интубация (с механической вентиляцией/без таковой), кроме случаев обычных послеоперационных вмешательств.
NB! Использование шкалы существенно облегчает формулировку диагноза (например, миастения (1) — миастения, глазная форма или миастения (3А) — миастения, генерализованная форма средней степени тяжести с преимущественным поражением мышц туловища и конечностей).
Диагностика (амбулатория)
ДИАГНОСТИКА НА АМБУЛАТОРНОМ УРОВНЕ
Диагностические критерии
Жалобы:
• слабость, патологическая утомляемость мышц, которая возникает после физической нагрузки;
• патологическая слабость мышц конечностей, туловища, невозможность подняться по ступенькам городского транспорта;
• невозможность удержать голову, нижнюю челюсть;
• опущение век;
• двоение предметов;
• утомляемость жевательных мышц при пережевывании твердой пищи, разговоре;
• осиплость голоса, «носовой» оттенок голоса, его «затухание»;
• нечеткость речи, на затрудненное глотание.
NB! Предположение о миастении должно возникнуть в каждом случае глазодвигательных и бульбарных расстройств.
Анамнез:
• наличие в прошлом кратковременных эпизодов слабости и утомляемости, полностью/частично регрессировавших самопроизвольно/на фоне неспецифического лечения;
• семейный анамнез, наличие у родственников нервномышечных, аутоиммунных и онкологических заболеваний.
NB Наиболее высокая заболеваемость встречается в двух возрастных категориях: 20-40 лет (в этот период чаще болеют женщины) и 65-75 лет (в этот период женщины и мужчины поражаются одинаково часто). При расспросе больного нужно уточнить: Когда началось заболевание? – сколько времени назад (дни, недели, месяцы, годы). Нарастают ли слабость в ногах и руках к вечеру? Имеется ли двоение в глазах, нарушение глотания, изменения голоса? Если болезнь прогрессирует, то с чего она началась? Какими хроническими заболеваниями болеет и что постоянно принимает?
Физикальное обследование:
неврологический статус:
• нарушение зрения (двоение, слепота);
• нарушение речи и глотания (плохо говорит, не понимает обращенную речь); нарушение движений (в одной или нескольких конечностях с одной стороны, с двух сторон);
• нарушение болевой и температурной чувствительности (на лице, туловище, в одной или нескольких конечностях с одной стороны, с двух сторон);
• наличие координаторных расстройств (испытывает затруднения при ходьбе, выполнении мелких движений, пользовании предметами, чувствует сильное головокружение в покое или при движениях и др);
• мышечная слабость (при повторении стереотипных движений она резко усиливается и может достичь степени пареза/полного паралича), после отдыха объем движений увеличивется;
• характерна динамичность симптомов: интенсивность птоза может изменяться на протяжении суток в зависимости от физической нагрузки. Зрачковые реакции преимущественно живые, иногда встречается анизокория или истощение зрачковых реакций во время повторных обследований (например, усиление дисфагии во время еды/дисфонии во время разговора – так называемый феномен патологической мышечной утомляемости) и феномен генерализации мышечной слабости (например усиление птоза после нагрузки на мышцы руки);
• при вовлечении в патологический процесс глазодвигательных, мимических и жевательных мышц при внешнем осмотре у пациента наблюдается характерное маскообразное лицо, с отсутствием морщин, бедной мимикой, с опущением век. Во время улыбки поднимается лишь верхняя губа, в то же время нижняя губа и углы рта остаются неподвижными. Чаще всего наблюдается слабость круговой мышцы рта, что приводит к невозможности произнести звук «Р», губные звуки «Б», «П».
• поражение бульбарной группы мышц вызывает нарушения функции мягкого неба и надгортанника. Из-за нарушения акта глотания могут развиваться аспирационная пневмония/алиментарное истощение.
• при наличии генерализированных форм миастении – наличие слабость дыхательных мышц и сердечной деятельности. Мышечная слабость, которая доходит иногда до состояния тетраплегии, сопровождается выраженными вегетативными нарушениями: тахикардией, вялым пульсом, мидриазом.
NB! В клинической практике для оценки степени выраженности двигательных расстройств используют шкалу силы мышц конечностей, предложенную А. Szobor (1976):
• 0 баллов — движения в мышце отсутствуют;
• 1 балл — минимальные движения в мышце, но вес конечности пациент не удерживает;
• 2 балла — пациент удерживает вес конечности, но сопротивление, оказываемое исследователю, минимально;
• 3 балла — пациент оказывает сопротивление усилиям изменить положение конечности, но оно незначительно;
• 4 балла — пациент хорошо сопротивляется усилиям изменить положение конечности, но имеется некоторое снижение силы;
• 5 баллов — сила мышцы соответствует возрастной и конституциональной норме обследуемого.
Фармакологические тесты:
Одним из наиболее значимых критериев диагностики миастении считают фармакологический тест с введением антихолинэстеразных препаратов.
Методика пробы с введением неостигмина метилсульфата: 0.05 % раствор неостигмина метилсульфат 1.5 мл вводят подкожно при весе больного 50-60 кг, при весе 60-80 кг доза препарата соответствует 2.0 мл и при весе 80-100 кг 2.5 мл соответственно. В детской практике вводится 1.0 мл препарата. Оценка проводится во временном интервале от 40 минут до 90 минут после введения препарата. В основе оценки теста лежит колебания выраженности клинических симптомов. Проба оценивается как позитивная при полной и неполной компенсации клинических симптомов, сомнительной – при частичной компенсации и негативной при отсутствии каких либо изменений. При возникновении мускариновых эффектов антихолинстеразных препаратов после оценки эффективности теста вводят 0.1 % раствор атропина 0.2-0.5 мл.
Лабораторные исследования:
• исследование сыворотки крови на уровень аутоантител к мышечному ацетилхолиновому рецептору – важное значение имеет динамика этого показателя для оценки эффективности патогенетической терапии;
• определение электролитов крови – снижение показателей калия крови;
• гормоны щитовидной железы: и тиреотоксикоз, и гипотиреоз могут усиливать слабость при миастении;
Инструментальные исследования
Электронейромиография (декремент тест):
• повторная ритмическая стимуляция нерва низкой (3 имп/с) и высокой (50 имп/с) частотой с использованием функциональных (постактивационные облегчение и истощение) и фармакологических (введение антихолинэстеразных препаратов) проб. При миастении ЭНМГ-исследование проводится именно на «клинически пораженной мышце».
• дополнительный метод диагностики – ЭНМГ с использованием концентрических игольчатых электродов (для выявления степени возможного вовлечения мышечного субстрата в патологический процесс, например, для выявления сопутствующего воспалительного процесса при полимиозите).
• электронейромиографическое исследование – для выявления нарушения нервно-мышечной передачи. В мышцах больных миастенией при стимуляции частотами 3 и 40 имп/с выявляется декремент амплитуды М-ответа в серии последовательных импульсов, который определяет степень нарушения нервно-мышечной передачи. Большое значение для диагностики имеет обратимость электрофизиологических феноменов на фоне АХЭП – нарастание амплитуды М-ответа и уменьшение декремента.
КТ/МРТ органов средостения: для исключения/подтверждения патологии вилочковой железы (тимома, гиперплазия вилочковой железы) с целью определения дальнейшей тактики лечения.
Сбор жалоб и анамнеза
Диагностический алгоритм:
Диагностика (скорая помощь)
ДИАГНОСТИКА НА ЭТАПЕ СКОРОЙ НЕОТЛОЖНОЙ ПОМОЩИ
Диагностические мероприятия:
· оценка общего состояния и жизненно важных функций пациента: сознания, дыхания, кровообращения (осмотр кожных покровов и видимых слизистых, измерение артериального давления, частоты пульса, частоты дыхания, температуры тела, и др.); визуальная оценка: положение больного, наличие асимметрии лица, птоза век.
· наличие очаговых неврологических симптомов: нарушение движений (в одной или нескольких конечностях с одной стороны, с двух сторон);
нарушение болевой и температурной чувствительности (на лице, туловище, в одной или нескольких конечностях с одной стороны, с двух сторон); наличие координаторных расстройств (испытывает затруднения при ходьбе, выполнении мелких движений, пользовании предметами, чувствует сильное головокружение в покое или при движениях и др.); нарушение зрения (двоение, слепота).
· установление или исключение критического состояния – миастенического криза.
NB! Каждый пациент с признаками миастении должен рассматриваться как пациент с потенциально возможной острой дыхательной недостаточностью. Обращают внимание на нарушения частоты, глубины и ритма дыхания, участие «вспомогательной» мускулатуры, обычно не участвующей в акте дыхания.
Поэтому в первую очередь оцениваются следующие признаки:
• одышка;
• ограниченная экскурсия грудной клетки и живота при вдохе;
• парадоксальное движение грудной клетки при дыхании;
• западание межреберных мышц на вдохе;
• попытка опираться руками при вдохе.
| Миастенический криз | Холинергический криз |
| Быстрое развитие (часы, минуты) | Медленное развитие (сутки и более) |
| Выраженная слабость произвольной мускулатуры с нарушением дыхания, сердечной деятельности, бульбарным синдромом, психомоторное возбуждение, нарушение сознания (сопор, кома) | |
| М-холинергические (вегетативные) симптомы | |
|
· сухость слизистых
|
· гипергидроз, слезотечение, бронхорея, ринорея · жидкая слюна · миоз · брадикардия · снижение АД · учащенное мочеиспускание, полиурия · усиление перистальтики, диарея тошнота, рвота, кишечная колика |
| Н-холинергические симптомы | |
|
· положительная реакция на введение АХЭпрепаратов · отсутствие фасцикуляций |
· ухудшение состояния после введения АХЭпрепаратов · наличие фасцикуляторных подергиваний мышц, крампи, тремор конечностей и тела |
Смешанный криз в клинической практике наблюдают чаще всего. Трудность его диагностики заключается в том, что он сочетает в себе все клинические черты миастенического и холинергического кризов, описанные выше. Это самый тяжёлый вариант витальных нарушений у больных миастенией.
Оказание неотложной помощи на догоспитальном этапе подразумевает проведение мероприятий по поддержанию витальных функций и срочную госпитализацию.
При наличии дыхательных нарушений выполняют следующие мероприятия:
· поддержание проходимости верхних дыхательных путей.
· во время криза следует обеспечить проходимость дыхательных путей, удалить слизь из глотки с помощью отсоса или другим методом (см. протокол «острая дыхательная недостаточность»).
· при наличии показаний перевод больного на ИВЛ.
· начать ИВЛ любым доступным методом, с последующим переводом больного на стационарное аппаратное дыхание.
· использование маски для подачи кислорода неприемлемо из-за избыточной саливации и нарушенного глотания.
· интубация должна проводиться с осторожностью.
· предупреждение осложнений (аспирация, травмы конечностей и суставов)
· нарушения функции сердечно-сосудистой системы купируются симптоматическими средствами.
· в качестве иммунодепрессанта назначается преднизолон 90-120 мг/сут.
· симптоматическая терапия осуществляется по общепринятым методикам.
· показания к интубации на догоспитальном этапе:
· выраженные формы нарушений дыхания вне зависимости от состояния сознания;
· тахипноэ — частота дыхания свыше 40 в мин;
· брадипноэ — частота дыхания менее 10 в мин;
· наличие патологических форм дыхания.
Диагностика (стационар)
ДИАГНОСТИКА НА СТАЦИОНАРНОМ УРОВНЕ
Диагностические критерии на стационарном уровне:
Жалобы и анамнез: см. амбулаторный уровень.
NB! При сборе анамнеза обращается внимание на изменчивость симптомов в течение суток, связь их с нагрузкой, наличие частичных/полных ремиссий, обратимость симптомов на фоне приема АХЭ препаратов (на время их действия) и на фоне адекватной иммуносупрессивной терапии. Исключатся в анамнезе прием лекарственных препаратов, усиливающих мышечную слабость.
Физикальное обследование: см. амбулаторный уровень.
Лабораторные исследования:
· общий анализ крови – определение основных показателей крови (возможны анемия, ускорение СОЭ, лейкоцитоз/лейкопения, тромбоцитоз/тромбоцитопения)
· общий анализ мочи — для диагностики воспалительных изменений (возможны протеинурия, лейкоцитурия, гематурия при онкопатологии мочеполовой системы);
· биохимический анализ крови – для уточнения показателей шлаков, электролитов, печеночных проб, воспалительных маркеров (определение глюкозы, мочевины, креатинина, аланинаминотрансферазы (АЛаТ), аспартатаминотрансферазы (АСаТ), общего билирубина, калия, натрия, кальция, С-реактивного белка, общего белка);
· гормоны щитовидной железы – для исключения патологии щитовидной железы;
· кровь на иммуноглобулины G,M,A – определение уровня иммуноглобулинов в периферической крови (терапия в стационаре подразумевает введение иммуноглобулина под контролем показателей в сыворотке крови больного).
Инструментальные исследования:
· КТ/МРТ органов средостения – для определения тимомы или гиперплазии вилочковой железы.
· электронейромиография – для определения нарушения нейро-мышечной проводимости (снижение амплитуды М-ответа (больше чем на 10-15%) во время ритмической стимуляции нерва с частотой 2-3 Гц).
Диагностический алгоритм:
Современные представления о патогенезе болезни позволяют выделить 4 группы основных критериев диагностики миастении: клинические, фармакологические, электромиографические (ЭМГ) и иммунологические критерии диагностики (см. амбулаторный уровень).
Диагноз миастении является несомненным при ее подтверждении по всем 4 критериям диагностики; достоверным — при 3 критериях; вероятным — при 2 и сомнительным – при наличиии 1 критерия.
Перечень основных диагностических мероприятий:
· тесты на выявление патологической утомляемости;
· фармакологическая проба с неостигмина метилсульфатом/пиридостигмина бромидом;
· электронейромиография;
· исследование антител к ацетилхолиновым рецепторам;
· КТ/МРТ органов средостения.
Перечень дополнительных диагностических мероприятий:
· кровь на иммуноглобулины;
· УЗИ щитовидной железы;
· гормоны щитовидной железы;
· электролиты крови.
Дифференциальный диагноз
| Диагноз | Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Миопатии (мышечные дистрофии, врожденные миопатии, воспалительные, метаболические, токсические миопатии) | Прогрессирующая мышечная слабость | Повышение активности КФК в крови; возможно увеличение СОЭ; биопсия мышц. | Мышечная слабость при миопатиях более выражена в проксимальных отделах и носит симметричный характер, характерны затруднения при поднимании рук, вставании со стула, подъеме по лестнице; возможны мышечные боли, мышечная гипотрофия или псевдогипертрофии; миотонический феномен; |
| Полинейропатии (идиопатические воспалительные; наследственные; полинейропатии при метаболических расстройствах, экзогенных интоксикациях, системных и инфекционных заболеваниях, вакцинациях, злокачественных новообразованиях) | Мышечная слабость, быстрая утомляемость | В спинномозговой жидкости белково-клеточная диссоциация (в определенные сроки заболевания); при ЭНМГ – признаки демиелинизациии аксонопатии. | Характерны периферические тетрапарезы, арефлексия, нарушения чувствительности по типу «носков» и «перчаток», вегетативные проявления. |
| Миастенический синдром Ламберта-Итона (МСЛИ) при бронхогенной карциноме (реже при раке предстательной железы, лимфоме, лейкозе). | Мышечная слабость, утомляемость |
Детальный сбор анамнеза; КТ органов грудной клетки; специфические онкомаркеры; |
Типичным признаком МСЛИ является слабость и утомляемость проксимальных отделов ног и тазового пояса, в меньшей степени характерны слабость в проксимальных отделах рук, также редки глазодвигательные нарушения, расстройства глотания и речи. Характерно развитие «сухого» синдрома в связи с дисфункцией автономной вегетативной нервной системы (нарушения саливации, потоотделения, ортостатическая гипотензия). Своеобразным проявлением МСЛИ является снижение или отсутствие сухожильных рефлексов и несоответствие жалоб больных на мышечную слабость и отсутствия снижения мышечной силы в исследуемых мышцах. |
| Митохондриаль-ные энцефаломио-патии, синдром Кирнса Сейра | 2-х сторонний птоз, наружный офтальмопарез, мышечная утомляемость в проксимальных отделах конечностей |
Повышение уровня белка в ЦСЖ; ЭКГ – атриовентрикулярная блокада различной степени. |
Заболевание обычно проявляется в детском возрасте, не позднее 2-го десятилетия жизни, типична пигментная ретинопатия, мозжечковая атаксия, нарушения проводимости сердца. Течение медленно прогрессирующее. |
| Конгенитальные миастенические синдромы | Мышечная слабость |
Слабость в окулярных, бульбарных и туловищных мышцах проявляются в младенчестве или раннего детства, положительного семейного анамнеза. Негатативный тест на антитела к ацетилхолиновым рецепторам. |
Группа наследственных нейро-мышечных заболеваний, обусловленных мутацией генов, ответственных за образование и функциональное состояние ацетилхолиновых рецепторов, ионных каналов, энзимов, обеспечивающих надёжность проведения возбуждения с нерва на мышцу. |
| Нарушение мозгового кровообращения в вербтебро-базилярной системе | Бульбарный синдром, офтальмоплегия | Магнитно резонансная томография головного мозга, осмотр глазного дна, консультация терапевта, инфекциониста. |
· острое начало, обусловленное физическим и/или эмоциональным перенапряжением на фоне высокого артериального давления; · наличие предшествующего сосудистого анамнеза; · наличие на МРТ-сканах признаков сосудистого заболевания головного мозга · на глазном дне – ангиопатия сосудов сетчатки, гиперемия; · подтверждение терапевтом артериальной гипертензии; · отсутствие динамичности бульбарных нарушений и реакции на введение антихолинэстеразных препаратов |
| Стволовой энцефалит | Бульбарные проявления, диплопия | Магнитно резонансная томография головного мозга, осмотр глазного дна, исследование ликвора |
· Для клинического течения стволового энцефалита характерно острое начало. · Определяются очаговые неврологические симптомы, альтернирующие синдромы · При исследовании глазного дна –признаки внутричерепной гипертензии, застоя дисков зрительных невров · В анализах спинномозговой жидкости – воспалительные изменения · МРТ головного мозга – очаговое поражение головного мозга воспалительного характера |
| Объемный процесс головного мозга | Опухоли головного мозга стволовой локализации некоторое время могут иметь латентный период и проявляться мышечной слабостью. | Магнитно резонансная томография головного мозга с котрастривоанием, осмотр глазного дна, консультация нейрохирурга. |
· подострое развитие общемозгового цефалгического синдрома · на МРТ-сканах наличие объемного образования головного мозга; · на глазном дне – признаки внутричерепной гипертензии, явления застойных дисков зрительных нервов; · подтверждение наличия объемного образования головного мозга нейрохирургом; · отсутствие динамичности бульбарных нарушений и реакции на введение антихолинэстеразных препаратов |
|
Миопатии |
Слабость мышц туловища и конечностей | ЭНМГ |
· при миопатиях отсутствуют признаки поражения экстраокулярной и бульбарной мускулатуры, дыхательных нарушений; · снижаются или отсутствуют сухожильные рефлексы, · отмечаются различной степени выраженности мышечные атрофии · На ЭНМГ нет признаков нарушения нервно-мышечной передачи |
| Миастенический синдром Итона-Ламберта (чаще связан с раком легкого, реже с раком предстательной железы, лимфомой, тимомой, лейкозом) | Мышечная слабость, птоз, диплопия | Консультация терапевта, онколога |
· сухожильные рефлексы снижены или отсутствуют , · имеются вегетативные расстройства (сухость во рту, импотенция), · при ритмической электростимуляции двигательного нерва амплитуда М-ответа не уменьшается, а увеличивается (феномен врабатывания). · при синдроме Итона — Ламберта вырабатываются антитела к кальциевым каналам P/Q-типа пресинаптических окончаний двигательных нервов. · Эффект от введения антихолинэстеразных препаратов минимальный, но имеется лечебный ответ на иммуносупрессию и плазмаферез |
| Боковой амиотрофический склероз (БАС) | признаки центрального и/или периферического паралича, отсутствие чувствительных и тазовых расстройств, клинические симптомы миастении, нарушения нервно-мышечной передачи и реакции на введение антихолинэстеразных препаратов. |
Электронейро — миография (ЭНМГ) |
— при ЭНМГ исследовании выявляются характерные для БАС признаки денервации и реиннервации, а также наличие большого количества потенциалов фасцикуляций |
Лечение
Препараты (действующие вещества), применяющиеся при лечении
| Азатиоприн (Azathioprine) |
| Атропин (Atropine) |
| Галантамин (Galantamine) |
| Галоперидол (Haloperidol) |
| Декстроза (Dextrose) |
| Иммуноглобулин человеческий нормальный (Human normal immunoglobulin) |
| Калия хлорид (Potassium chloride) |
| Микофеноловая кислота (Микофенолата мофетил) (Mycophenolic acid (Mycophenolate mofetil)) |
| Неостигмина метилсульфат (Neostigmine methylsulfate) |
| Оротовая кислота (Orotic acid) |
| Пиридостигмина бромид (Pyridostigmine) |
| Преднизолон (Prednisolone) |
| Спиронолактон (Spironolactone) |
| Циклоспорин (Cyclosporine) |
| Циклофосфамид (Cyclophosphamide) |
Лечение (амбулатория)
ЛЕЧЕНИЕ НА АМБУЛАТОРНОМ УРОВНЕ
Тактика лечения:
Тактика лечения миастении определяются такими направлениями:
• компенсация нервно-мышечной передачи (препараты калия, систематический прием антихолинэстеразных препаратов);
• коррекция аутоиммунных нарушений (глюкокортикоидных препаратов, цитостатиков и плазмафереза);
• влияние на вилочковую железу.
Немедикаментозное лечение:
Режим:
• противопоказаны чрезмерные физические нагрузки, инсоляции.
Диета:
• диета богатая калием (печеный картофель, курага, бананы и др.).
Медикаментозное лечение:
В основу стратегии лекарственной терапии миастении положены следующие принципы:
• этапность лечебных мероприятий;
• сочетания компенсирующей, патогенетической и неспецифической терапии.
Учёт фазы течения заболевания (хроническая/острая (кризы)).
NB! Противопоказаны лекарственные препараты, содержащие магний/хинин; нельзя употреблять миорелаксанты, транквилизаторы, нейролептики, мочегонные препараты, аминогликозиды, фторхинолины, тетрациклин.
Первый этап
Компенсирующая терапия предполагает назначение следующих препаратов:
Антихолинэстеразные средства (отличаются они в основном длительностью действия).
| Препарат и его синонимы | Лекарственная форма | Начало дейтсвия, минуты | Продолжительность действия, часы |
| Неостигмина метилсульфат | Таблетки по 15мг, 0,05% раствор по 1мл (0,5мг) в ампулах | 20-40 | 2-4 |
| Пиридостигмина бромид | Таблетки по 60мг, 0, 5% раствор по 1мл (5мг) в ампулах | 60 | 4-6 |
| Галантамина гидрохлорид | Растворы 0,1%, 0,25%:, 0,5% по 1мл в ампулах | 60 | 8-12 |
Иньекционная форма неостигмина метилсульфат используется для оказания быстрого действия. Принцип дозирования – следующая доза принимается за 30 минут до окончания действия предыдущей. При переводе больных на парентеральное введение препаратов учитывается, что 1 таблетка пиридостигмина бромида (60 мг) равноценна 1 мл 0,05% раствора неостигмина метилсульфат. В некоторых ситуациях (mensis, инфекции, ремиссия) – чувствительность к АХЭ препаратам повышается. В этом случае доза препаратов уменьшается. Больных нужно обучать коррегировать дозу индивидуально в зависимости от течения болезни.
Относительные противопоказания к применению АХЭП:
• бронхиальная астма;
• тяжелый атеросклероз;
• ИБС, стенокардия;
• эпилепсия.
Препараты калия. Препараты калия улучшают синтез ацетилхолина и синаптическую передачу, пролонгируют действие АХЭП. Они показаны на всех этапах лечения. У больных с локальными формами заболевания и при стабильной длительной ремиссии их применяют в виде монотерапии, в других случаях – в составе комбинированного лечения. Назначают калия оротат (после регистрации в РК) в таблетках по 0,5 г 3 раза в сут; калия хлорид в порошке или таблетках по 0,5 – 1 г или 1 г или по 50 мл 4% раствора (10 мл 10% раствора) внутрь 2–3 раза в сут.
Противопоказания для использования больших доз калия — полная поперечная блокада проводящей системы сердца, нарушение выделительной функции почек.
Калийсберегающие диуретики. Применяют, в частности, спиронолактон в таблетках по 25 мг 3—4 раза в день.
Спиронолактон противопоказан при мастопатии, гинекомастии, беременности, атриовентиркулярной блокаде и почечной недостаточности.
Второй этап
Лечение глюкокортикоидами назначается:
· при недостаточной эффективности препаратов, используемых на первом этапе;
· для создания своеобразного запаса прочности в компенсации миастенических расстройств перед подготовкой к операции (тимэктомии);
· больным миастенией с витальными нарушениями;
· при дебюте заболевания с бульбарных нарушений.
Применяемые чаще схемы – прием ГКС ежедневно или через день.
Дозу преднизолона (метилпреднизолона) подбирают индивидуально, ориентируясь на тяжесть состояния больного. В среднем она составляет 1 мг/кг/сут., но не менее 50 мг. Преднизолон 1 таблетка – 5 мг. При выраженном обострении назначают 60-150 мг/сутки утром ежедневно, через 5-7 дней (до терапевтического эффекта) переходят на схему через день. С больших доз следует уходить быстро. Эффект оценивают через 6-8 приёмов. В первые несколько дней некоторые пациенты могут отмечать эпизоды ухудшения состояния в виде нарастания мышечной слабости и утомляемости. Возможно, эти эпизоды связаны с прямым действием глюкокортикоидов на процессы освобождения синаптического медиатора и десенситизацией рецепторов. Это обстоятельство обусловливает необходимость временного уменьшения дозы антихолинэстеразных препаратов. По мере достижения эффекта и улучшения состояния больных дозу преднизолона постепенно уменьшают до поддерживающей. Длительно применяется поддерживающая доза через день 20-30 мг в сутки, возможно в течение нескольких месяцев или даже лет. При ухудшении состояния доза может быть увеличена. Используется так же ступенчатая схема приема ГКС. В разработанной схеме предлагается увеличение начальной дозы препарата до 25-30 мг в один прием утром. Каждый последующий прием гормонов увеличивается на 25-30 мг до достижения максимальной дозы 100 мг.
Третий этап
При недостаточной эффективности глюкокортикоидов/развитии выраженных побочных эффектов целесообразно назначение цитостатических препаратов.
• Азатиоприн можно использовать в качестве монотерапии/в сочетании с глюкокортикоидами, если они не оказывают достаточного эффекта/если из-за побочных эффектов необходимо снижение их дозы. Азатиоприн назначают перорально ежедневно по 50 мг/cyт с последующим увеличением дозы до 150-200 мг/cyт.
• Микофенолата мофетил назначают в дополнение к глюкокортикоидам в случаях, когда необходимо снижение их дозы. Микофенолата мофетил назначают перорально ежедневно по 2 г/cyт с последующей коррекцией дозы в зависимости от эффективности лечения.
• Циклоспорин успешно применяют при лечении тяжёлых форм миастении в случаях резистентности к другим препаратам. Препарат назначают перорально в дозе 3 мг/кг. При отсутствии токсических реакций дозу можно увеличить до 5 мг/кг 2 раза в день. После достижения стойкого терапевтического эффекта дозу циклоспорина можно снизить до минимальной поддерживающей.
• Циклофосфамид используют при отсутствии эффекта от других иммунодепрессантов как в виде монотерапии, так и в сочетании с азатиоприном. Препарат вводят внутримышечно ежедневно в дозе 200 мг/через день в дозе 400 мг. Терапию начинают в условиях стационара, и только убедившись в хорошей переносимости препарата, можно переводить больных на амбулаторное лечение.
NB! Следует отметить, что беременность не является противопоказанием к назначению основных препаратов лечения миастении. На время беременности желательно воздержаться от поддерживающей гормональной терапии, сеансов плазмафереза, использования больших доз калийсодержащих препаратов. Также следует строго придерживаться особых подходов терапии других заболеваний. Существует перечень препаратов, которые нельзя использовать при миастении.
Применение лекарств при миастении (по С. А. Мальбергу, 2001)
| Группа лекарственных препаратов | Препараты, усиливающие мышечную слабость | Безопасные препараты |
| Антибактериальные препараты | Стрептомицин, гентамицин и др., аминогликозиды, полимиксин В, колистин, тетрациклин, линкомицин, клиндамицин, пенициллин, ампициллин, ципрфлоксацин, сульфаниламиды | Цефалоспорины, хлорамфеникол, рифампицин, нитрофураны, налидиксовая к-та, изониазид |
| Антиэпилептические препараты | Триметин, дифенин, барбитураты, карбамазепин, бензодиазепины в высокой дозе | Препараты вальпроевой к-ты, примидон* |
| Гормональные препараты | Кортикостероиды, препараты АКТГ, оральные контрацептивы, окситоцин, гормоны щитовидной железы | – |
| Кардиологические препараты | В-блокаторы, хинидин, лидокаин, новокаинамид, антагонисты кальция, ганглиоблокаторы, гуанетедин | Дигоксин, метилдопа, спиронолактон, триамтерен |
| Анальгетики, противовоспалительные препараты | Производные морфина, хинин, хлорохин, D-пеницилламин, | Ацетилсалициловая к-та, НПВП, соли золота |
| Другие препараты | Миорелаксанты, соли магния, йосодержащие контрастирующие средства, анатациды, слабительные, в/в токолитики |
Алгоритм действий при неотложных ситуациях:
Кризы при миастении:
· миастенические
· холинергические
· смешанные.
Характеристика симптомов при миастеническом и холинергическом кризах
| Симптомы | При миастеническом кризе | При холинергическом кризе |
| Величина зрачков | широкие | узкие; парез аккомодации |
| Пульс | тахикардия | брадикардия |
| Артериальное давление | Нормально или нерезко снижено | быстро резко снижается |
| Мышечные фасцикуляции | не характерны | резко выражены |
| Боли в животе; бурная перистальтика кишечника; понос; рвота | не наблюдаются | резко выражены |
| Одышка, афония, невозможность отхаркивания содержимого ротоглотки | очень характерны | не характерны |
Важнейший метод дифференциации кризов при миастении — оценка эффективности пробы с введением адекватной дозы антихолинэстеразного препарата:
• при миастеническом кризе проба позитивная;
• при холинергическом кризе проба негативная, возможна частичная компенсация;
• при смешанном характере криза наиболее часто отмечают частичную/ неполную компенсацию.
Алгоритм действий при миастеническом и/или холинергическом кризах
Другие виды лечения:
При хорошей эффективности препаратов первого этапа, но сохраняющихся лёгких бульбарных нарушениях на фоне отмены пиридостигмина бромида показано проведение тимэктомии.
Показания к тимэктомии у взрослых:
• опухоль вилочковой железы (тимома);
• вовлечение в процесс краниобульбарной мускулатуры;
• прогрессирующее течение миастении.
Показания к тимэктомии у детей:
• генерализованная форма миастении;
• прогрессирование заболевания при плохой лекарственной компенсации нарушенных функций.
Противопоказания к тимэктомии:
• тяжёлые соматические заболевания;
• острая фаза миастении (выраженные некомпенсированные бульбарные нарушения, а также нахождение больного в кризе);
• пациенты длительно страдающих миастенией при стабильном её течении, а также при локальной глазной форме миастении.
NB! Результатом операции могут стать полное клиническое выздоровление (эффект А), стойкая ремиссия при значительном уменьшении дозы антихолинэстеразных препаратов (эффект В), значительное улучшение состояния на фоне сохранения потребности в антихолинэстеразных препаратах (эффект С), отсутствие улучшения (эффект D).
Показания для консультации специалистов:
· консультация торакального хирурга – установление/исключения объемного образования средостения (тимома);
· консультация терапевта – установление/исключение терапевтического заболевания, онкопатологии внутренних органов (артериальная гипертензия, злокачественное новообразование, пневмония);
· консультация эндокринолога – установление/исключение заболевания щитовидной железы;
· консультация онколога – установления онкологического заболевания, проявлении паранеопластического синдрома.
· консультация офтальмолога – осмотр глазного дна для исключения патологии глаза, признаков внутричерепной гипертензии, застоя дисков зрительных нервов;
Профилактические мероприятия:
Первичная профилактика:
Постоянное лечение и регулярное посещение врача невролога является обязательным для больного миастенией, только так можно добиться улучшений и повысить качество жизни. Но также очень важно придерживаться следующих рекомендаций:
• нельзя загорать;
• нельзя заниматься тяжелым физическим трудом;
• избегать утомляемости и больше отдыхать;
• нельзя производить лечение самостоятельно или принимать лекарственные травы;
• нельзя употреблять лекарственные препараты, содержащие магний или хинин;
• нельзя употреблять миорелаксанты, транквилизаторы, нейролептики, мочегонные препараты, аминогликозиды, фторхинолины, тетрациклин.
Вторичная профилактика направлена на профилактику осложнений:
• тенденция к нарастанию веса требует систематического использования ограничения калорийности употребляемой пищи, в особенности углеводов;
• тенденция к снижению толерантности к углеводам и периодическое повышение сахара в крови, требует назначения препаратов, способствующих увеличению толерантности к углеводам, нормализации перекисного окисления липидов и сокращению переносимости к углеводным нагрузкам.
Мониторинг состояния пациента:
• оценка жизнеобеспечивающих функций – дыхания, гемодинамики;
• оценка неврологического статуса для выявления и мониторинга динамичности мышечной слабости и реакции на введение антихолинэстеразных препаратов (полная, неполная частичная компенсация, проба позитивная, сомнительная, негативная).
Индикаторы эффективности лечения:
• стойкая/частичная ремиссия на фоне приема медикаментозных средств/без них у больных миастенией.
Лечение (скорая помощь)
ЛЕЧЕНИЕ НА ЭТАПЕ СКОРОЙ НЕОТЛОЖНОЙ ПОМОЩИ
Медикаментозное лечение
Алгоритм экстренных мероприятий при любом варианте кризов:
· купирование нарушений дыхания: санация ротоглотки и трахеобронхиального дерева во избежание аспирационного трахеобронхита и пневмонии;
· интубация трахеи или перевод на ИВЛ — в зависимости от степени тяжести состояния больного.
· назначение антибактериальной терапии (класс цефалоспоринов) с учетом высокого риска возникновения аспирационной пневмонии.
· адекватное энтеральное или — при бульбарных нарушениях — парентеральное питание.
Алгоритм экстренных мероприятий при миастеническом кризе:
· неостигмина метилсульфат в/в по 1–2 мл 0,05% раствора; при необходимости 2–3 раза в сутки.
· иммуноглобулин в/в в суточной дозе 400 мг.
· при неэффективности перечисленных мероприятий дополнительно назначается преднизолон в суточной дозе 100 мг.
· для купирования возбуждения — в/в или в/м 1 мл 0,5% раствора галоперидола (до 20 мг/сут).
Алгоритм экстренных мероприятий при холинергическом кризе:
· немедленная отмена антихолинэстеразных препаратов.
· внутримышечное или подкожное – в зависимости от тяжести состояния больного – введение 0,5–1,0 мл 0,1% раствора атропина. Инъекции могут при необходимости повторяться с интервалом в 1–2 ч до появления сухости во рту.
Лечение (стационар)
ЛЕЧЕНИЕ НА СТАЦИОНАРНОМ УРОВНЕ
Тактика лечения:
На стационарном этапе в карте наблюдения за пациентом (история болезни) ежедневно отмечаются показатели гемодинамики (А/Д, пульс, ЧСС), оценивается дыхание и ЧДД, в неврологическом статусе определяется динамика синдрома патологической мышечной утомляемости, отмечается проводимая коррекция и переносимость медикаментозной терапии, уровень компенсации мышечной слабости после приема антихолинэстезаного препарата.
Немедикаментозное лечение:
Режим:
• противопоказаны чрезмерные физические нагрузки, инсоляции.
Диета:
• диета богатая калием (печеный картофель, курага, бананы и др.).
Искусственная вентиляция лёгких
В качестве первого мероприятия предполагает необходимость адекватного дыхания с помощью принудительной ИВЛ.
Показания к переводу на ИВЛ:
• нарушение ритма дыхания;
• цианоз;
• возбуждение;
• потеря сознания;
• участие вспомогательной мускулатуры;
• изменение величины зрачков отсутствие реакции на введение АХЭ препаратов.
Перевод пациента на самостоятельное дыхание после ИВЛ:
• отсутствия цианоза;
• тахипноэ;
• тахикардии;
• сохранности мышечного тонуса;
• достаточного дыхательного объёма (>300 мл), p.Oz более 80 мм рт.ст. при дыхании смесью с 50% кислорода;
• способности больного создать разрежение вдоха не менее 20 см вод.ст., полного восстановления сознания.
NB! В период проведения искусственной вентиляции полностью исключается введение антихолинэстеразных препаратов, проводится интенсивное лечение интеркуррентных заболеваний и патогенетическое лечение миастении.
NB! Введение АХЭП и использование ИВЛ одновременно недопустимо.
NB! Через 16-24 часа после начала ИВЛ, при условии ликвидации клинических черт холинергического или смешанного кризов, следует провести пробу с введением АХЭП (неостигмина метилсульфат) с учетом начала действия препарата и отключить от аппарата ИВЛ (не экстубируя!), затем оценить эффективность самостоятельного дыхания. Если в течение 1,5-2 часов больной самостоятельно дышит, процедуру повторить в течение суток 3-4 раза с АХЭП. В случае положительного результата больного экстубируют. Убедившись в возможности адекватного дыхания, перевести больного на прием пероральных антихолинэстеразных препаратов.
Если функция дыхания остается недостаточной и эффект от введения АХЭП непродолжительный, больного подключают к аппарату ИВЛ. До следующих суток неостигмина метилсульфат не вводить! Вышеуказанные действия повторить на следующие сутки. Если в течение 3-4 суток не наблюдается положительного эффекта (самостоятельное дыхание) больному необходимо наложить трахеостому для исключения пролежня трахеи. По мере восстановления жизненно важных функций дыхания и глотания больного отключают от аппарата ИВЛ и назначают прием АХЭП.
Медикаментозное лечение:
Лечение миастенических кризов должно быть направлено на компенсацию нарушений нервно-мышечной передачи и коррекцию иммунных расстройств.
Иммуноглобулины G:
• общепринятым режимом терапии считают короткие 5-дневные курсы внутривенного введения препарата Человеческий Ig в доза 400 мг/кг ежедневно. В среднем клинический эффект отмечается на 4 день терапии и продолжается в течение 50-100 дней.
Антихолинэстеразные препараты:
• чаще применяют парентеральное введение. Применение АХЭп в количестве диагностической пробы показаны при любой форме криза (наиболее эффективно их введение при миастеническом кризе). Неостигмина метилсульфат вводится п/к от 1,5 до 2,5 мл, для уменьшения нежелательных эффектов вводят атропин 0,2-0,5 мл 01% раствора. Результат оценивается как при неостигмина метилсульфатной пробе.
При назначении антихолинэстеразных препаратов должен соблюдаться определенный временной режим: применение каждой последующей дозы не чаще, чем через 3-4 часа для неостигмина метилсульфат и 5-6 часов для пиридостигмина бромида, в связи с опасностью возникновения холинергической интоксикации. В период максимальной выраженности клинических симптомов криза целесообразно парентеральное введение антихолинэстеразных препаратов. Препарат вводят под кожу, а при остановке дыхания внутривенно в дозе 20 мг при весе больного до 80 кг, в дозе 30 мг при весе более 80 кг. Для уменьшения нежелательных мускариновых эффектов антихолинэстеразных препаратов их вводят с атропином в виде 0,2 – 0,5 мл 0,1% раствора.
Своевременно и в правильной дозировке произведенное введение антихолинэстеразных препаратов, как правило, помогает восстановлению функции дыхания и бульбарной мускулатуры. По мере достижения стабильного клинического эффекта, восстановления жизненно важных функций дыхания и глотания, вместо парентерального введения назначается прием препаратов внутрь.
Для определения времени приема последующих доз пероральных препаратов следует ориентироваться на длительность и эффективность действия применяемой дозы. Вместе с тем необходимо помнить, что в различных состояниях длительность и эффективность действия каждого препарата может меняться.
Глюкокортикостероидные препараты.
В период развития кризов наиболее эффективным является метод “пульстерапии” — внутривенного введения больших доз преднизолона (1000 — 2000 мг), который является одним из вариантов хронотерапевтической регуляции стимуляции тропных гормонов гипофизарно-диенцефально-надпочечниковой системы. После проведения “пульстерапии” рекомендуется использовать ежедневный прием преднизолона в неравных дозах, например, один день 100 мг, другой день 50 мг. По мере улучшения состояния больных они переводятся на прием преднизолона по схеме через день. Для этого постепенно уменьшается доза препарата в день приема меньшей дозы по 5 мг на прием.
Необходимо отметить следующее обстоятельство: нередко развитие кризов (особенно холинергических и смешанных) при миастении иногда совпадает с проведением “пульстерапии” или началом назначения высоких доз преднизолона. Это обстоятельство диктует необходимость осторожного назначения или изменения дозы преднизолона у больных миастенией.
Введение хлористого калия. Обычно назначается хлорид калия по 1,0 г 3 раза в сутки. При миастенических кризах хлорид калия вводят внутривенно (70 мл 4% раствора) на 400 мл 5% раствора глюкозы капельно медленно (со скоростью 20-30 капель в минуту) с уколом 4 — 7 ед. инсулина короткого действия в конце капельницы.
Спиронолактон является антагонистом минералкортикоидного гормона альдостерона, необходимого для регуляции обмена электролитов в организме. Способность спиронолактона задерживать калий в клетках служит основанием для широкого его применения при лечении миастении. Препарат принимают внутрь в дозе 0,025 – 0,05 г 3-4 раза в день. Побочные явления: в отдельных случаях тошнота, головокружение, сонливость, кожные сыпи, обратимая форма гинекомастии.
Профилактика пневмонии (не применять аминогликозиды).
Проведение симптоматической терапии.
Специальный уход.
Некоторые лекарственные препараты могут сами по себе провоцировать обострение миастении (смотрите таблицу 2).
Перечень основных диагностических мероприятий:
— Определение электролитов крови
— Проведение неостигмина метилсульфатной пробы
— ЭНМГ
— КТ/МРТ органов средостения
— ЭКГ
Перечень дополнительных диагностических мероприятий:
— Определение гормонов щитовидной железы
— Определение уровня КФК
— МРТ головного мозга – для проведения дифференциального диагноза миастении с заболеваниями, при которых локализация патологического процесса определяется в стволе мозга: стволовым энцефалитом, опухолью ствола головного мозга, нарушением мозгового кровообращения в системе вертебрально-базилярных сосудов;
— УЗИ щитовидной железы – для исключения патологии щитовидной железы (обязательно надо проводить при подозрении на миастению. И тиреотоксикоз, и гипотиреоз могут усиливать слабость при миастении).
— КТ/МРТ органов грудной клетки, брюшной полости, органов малога таза.
— УЗИ органов брюшной полости, малого таза.
— глазное дно
Хирургическое вмешательство:
Тимэктомия:
Показанием к оперативному лечению:
• злокачественные формы;
• прогрессирующая форма;
• миастеническое состояние в зависимости от степени выраженности дефекта.
При локальных формах подходят избирательно.
Противопоказания к тимэктомии:
• тяжелые декомпенсированные соматические заболевания;
• старческий возраст.
До оперативного лечения обязательна предоперационная подготовка:
• общеукрепляющая терапия;
• проведение лечебного плазмафереза;
• при необходимости – курс глюкокортикостероидов.
Другие виды лечения:
Рентгеновское облучение вилочковой железы, когда противопоказана тимэктомия (как альтернатива тимэктомии).
Гамма-терапия на область тимуса. Данный метод применяют у пациентов, которым в силу тех/иных обстоятельств невозможно провести тимэктомию, а также как метод комплексной терапии после удалении тимомы (особенно в случаях инфильтрации опухоли в расположенные рядом органы). Суммарную дозу гамма-облучения подбирают индивидуально (в среднем 40-60 Грей).
Противопоказания гамма-терапии:
• дети пубертатного периода.
Методы экстракорпоральной иммунокоррекции (гемосорбция и плазмаферез – смотрите клинический протокол диагностики и лечения «Лечение кризов»). Можно использовать такие методы, как гемосорбция/энтеросорбция (угольные сорбенты СУМС 15-30 мг/кг веса 3 раза в сутки в течение 2-3 недель).
Проведение плазмафереза/плазмасорбции:
Основные показания для проведения плазмафереза:
· миастенический криз;
· острое течение миастении;
· начальная стадия стероидной терапии в связи с возможным обострением заболевания.
Обследование больного перед плазмаферезом включает:
· оценку состояния жизненно важных функций;
· полный клинический анализ крови (в том числе тромбоциты, гематокрит);
· определение группы крови и резус-фактора;
· серологические тесты на сифилис, ВИЧ, вирус гепатита В;
· определение концентрации общего белка, белковых фракций;
· определение основных показателей свёртываемости крови;
· клинический анализ мочи.
Как правило, плазмаферез проводится курсом на протяжении 1-2 недель с кратностью 2-5 операций. Прерывистый плазмаферез приводит к улучшению после проведения 3 – 4 сеансов.
Противопоказаний к применению плазмафереза нет.
Показания для консультации специалистов:
· консультация терапевта – при необходимости/в случае отсутствия специалиста на догоспитальном уровне – установление/исключение терапевтического заболевания (артериальная гипертензия, пневмония), коррекция показателей гемодинамики, электролитного баланса в ходе проводимой терапии;
· консультация эндокринолога – при необходимости/в случае отсутствия специалиста на догоспитальном уровне с целью коррекции терапии гормональных и электролитных нарушений;
· консультация торакального хирурга – при решении вопроса об оперативном лечении;
· консультация реаниматолога – для решения вопроса о переводе в отделение реанимации и интенсивной терапии.
Показания для перевода в отделение интенсивной терапии и реанимации:
· появление и нарастание симптомов миастенического криза;
· нестабильность гемодинамики;
· нарушение функции дыхания.
Индикаторы эффективности лечения:
· компенсация витальных нарушений;
· устранение метаболических нарушений, возникающих вследствие гипоксии и оксидантного стресса;
· снятие обострения миастенического процесса;
· полная или достаточная компенсации двигательных нарушений на фоне АХЭ препаратов.
Дальнейшее ведение.
· диспансерное наблюдение в поликлинике по месту жительства. Проведение первичной и вторичной профилактики при миастении (см.амбулаторный уровень).
Медицинская реабилитация
проводится согласно Стандарту организации оказания медицинской реабилитации населению Республики Казахстан, утвержденной приказом Министра здравоохранения Республики Казахстан от 27.12.2013 года №759.
Паллиативная помощь
Диетотерапия – пища богатая калием (томаты, бананы, курага, изюм, вареная картофель), белковая пища (мясные продукты).
Психологическая поддержка больного и родственников (разъяснительные беседы по улучшению качества жизни пациентов.
Госпитализация
Показания для плановой госпитализации:
· пациенты с неполной компенсации двигательных нарушений;
· пациенты с частичной компенсации двигательных нарушений.
Показания для экстренной госпитализации:
· миастенический криз.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗСР РК, 2016
- 1) Кузин М.И., Гехт Б.М. Миастения. – М.: Медицина. – 1996. – 224 с.
2) Beekman R., Kuks J.B.M., Oosterhuis H.J.G.H. Myasthenia gravis: diagnosis and follow-up of 100 consecutive patients // J Neurol. – 1997. – Vol. 244. – P. 112-118.
3) Kalb B., Matell G., Pirskanen R., Lambe M. Epidemiology of myasthenia gravis: A population-based study in Stockholm, Sweden // Neuroepidemiology. – 2002. – Vol. 21 (5). – P. 221-225.
4) Mantegazza R., Baggi F., Antozzi C., Confalonieri P., Morandi L., Bernasconi P., Andreetta F., Simoncini O., Campanella A., Beghi E., Cornelio F. Myasthenia gravis (MG): epidemiological data and prognostic factors // Ann NY Acad Sci. – 2003. – Vol. 998. – P. 413-423.
5) Phillips L.H. 2nd. The epidemiology of myasthenia gravis // Ann NY Acad Sci. – 2003. – Vol. 998. – P. 407-412.
6) Phillips L.H. The epidemiology of myasthenia gravis // Semin Neurol. – 2004. – Vol. 24. – P. 17-20.
7) Somnier F.E. Increasing incidence of late-onset anti-AChR antibody-seropositive myasthenia gravis // Neurology. – 2005. – Vol. 65. – P. 928-930.
Pekmezoviс T., Lavrniс D., Jarebinski M., Apostolski S. Epidemiology of myasthenia gravis // Srp Arh Celok Lek. – 2006. – Vol. 134 (9-10) . – P. 453-456.
9) DeChiara T.M., Bowen D.C., Valenzuela D.M., Simmons M.V., Poueymirou W.T., Thomas S., Kinetz E., Compton D.L., Rojas E., Park J.S., Smith C., DiStefano P.S., Glass D.J., Burden S.J., Yancopoulos G.D. The receptor tyrosine kinase MuSK is required for neuromuscular junction formation in vivo // Cell. – 1996. – Vol. 85 (4). – P. 501-512.
10) Источник: http://medbe.ru/materials/farmakoterapiya-v-nevrologii/farmakoterapiya-pri-miastenii-i-miastenicheskikh-sindromakh
11) Клиника, диагностика и лечение миастении http://www.thoracoscopy.ru/aboutmiastenia
12) Источник: http://meduniver.com/Medical/Neotlogka/226.html MedUniver
13) Источник: http://nardar.ru/lechenie-i-simptomy-miastenii.html
- 1) Кузин М.И., Гехт Б.М. Миастения. – М.: Медицина. – 1996. – 224 с.
Информация
СОКРАЩЕНИЯ, ИСПОЛЬЗУЕМЫЕ В ПРОТОКОЛЕ
| IgG | иммуноглобулин G |
| NB | обратить внимание |
| А/Д | артериальная гипертония |
| АЛТ | аланинаминотрансфераза |
| АСТ | аспартатаминотрансфераза |
| АТ к АХР | аутоантитела к мышечному ацетилхолиновому рецептору |
| АХР | ацетилхолиновые рецепторы |
| АХЭП | антихолинэстеразные препараты. |
| ГКС | глюкокортикостероиды |
| КТ | компьютерная томография |
| МРТ | магнитно-резонансная томография |
| ЧСС | число сердечных сокращений |
| ЭНМГ | электронейромиография |
Список разработчиков протокола с указанием квалификационных данных:
1) Жумагулова К. Г. – кандидат медицинских наук, АО «Казахский медицинский университет непрерывного образования», доцент кафедры неврологии, член «Всемирной Ассоциации неврологов», член «Ассоциации неврологов РК», член Лиги неврологов РК;
2) Жаркинбекова Н. А. – кандидат медицинских наук, врач невропатолог высшей категории Южно-Казахстанская областная клиническая больница, заведующая неврологическим отделением, член «Ассоциации неврологов южного Казахстана»
3) Кожаканова С. Т. – ассистент кафедры невропатологии с курсом психиатрии и наркологии АО «Медицинский университет Астана», член ОЮЛ «Ассоциация неврологов РК»;
4) Жусупова А. С. – доктор медицинских наук, профессор, врач невропатолог высшей категории, АО «Медицинский университет Астана» заведующая кафедрой невропатологии с курсом психиатрии и наркологии, главный внештатный невропатолог МЗСР РК, председатель ОЮЛ «Ассоциации неврологов
5) Тулеутаева Р. Е. – кандидат медицинских наук, заведующая кафедрой фармакологии и доказательной медицины Государственного медицинского университета г. Семей, член «Ассоциации врачей терапевтического профиля».
Указание на отсутствие конфликта интересов: нет.
Список рецензентов: Нургужаев Еркен Смагулович – доктор медицинских наук, профессор, заведующий кафедрой нервных болезней РГП на ПХВ «КазНМУ».
Указание условий пересмотра протокола: Пересмотр протокола через 3 года после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Миастения: диагностика и лечение
Статьи
Опубликовано в журнале:
Неврологический журнал »» 2003, Приложение №1
ЛЕКЦИЯ
Б.М. Гехт, А.Г. Санадзе
*Центр нервно-мышечной патологии НИИ общей патологии и патофизиологии Российской академии медицинских наук, Москва
Изложены представления о современных методах диагностики и лечения миастении.
Ключевые слова: миастения,диагностика, лечение
На протяжении многих лет симптомы миастении, проявляющиеся в тяжелых случаях нарушениями витальных функций, внушают страх практическим врачам различного профиля. Несмотря на большой круг публикаций по проблемам, связанным с диагностикой этой болезни и с показаниями к применению различных видов терапии, информация по критериям диагностики и схеме поэтапного патогенетического лечения недостаточно систематизирована.
Миастения является классическим аутоиммунным заболеванием, в основе патогенеза которого лежит явление аутоагрессии, направленной на холинорецепторы постсинаптической мембраны [Lindstrom J., Lambert E., 1978; Engel A., Banker B.Q., 1987; Mosmann T.R. et al., 1989; 1991; Hodgkin P.D. et al., 1991; Coffman R.L., 1993]. Вместе с тем, в последние годы получен целый ряд доказательств вовлечения в патологический процесс и пресинаптических структур, в первую очередь это относится к выявлению аутоантител, приводящих к изменению функционального состояния ионных каналов [Ruff R., 1998; Vernino S. et al., 1999]. Современные представления о патогенезе миастении, включающие гетерогенность и разнонаправленность аутоантител, а также различие их взаимодействия с холинорецептором и рецепторами ионных каналов, позволяют определить критерии диагностики и новые пути лечения болезни [Fornesa V. et al., 1990; Cosi V. et al., 1991; Ferrero B. et al., 1993; Deng C. et al., 1996].
Обследование большой группы больных с миастенией (256 пациентов), показало, что поставить или отвергнуть диагноз наиболее сложно в ситуации, когда выявляемые клинические признаки болезни не соответствуют представлениям врача о характере и типе распределения двигательных расстройств и их обратимости на фоне введения антихолинэстеразных (АХ) препаратов. Не обнаружив того или иного из симптомов заболевания, врач, как правило, приходит к неправильному заключению, которое, в свою очередь, является причиной неадекватной терапии. В этой связи, разработка клинических критериев диагностики миастении является одной из актуальных проблем.
Наиболее частыми клиническими проявлениями миастении являются нарушения функции экстраокулярной и бульбарной мускулатуры, а также слабость и утомляемость мышц туловища и конечностей. Проведенный анализ выраженности клинических симптомов показал, что минимальная степень глазодвигательных расстройств в виде преходящей диплопии наблюдалась у 23%, умеренная, в виде рецидивирующего офтальмопареза и стойкой диплопии — у 48% и максимальная, проявляющаяся офтальмоплегией — у 4 из 75% больных, у которых имелись нарушения функции экстраокулярной мускулатуры. Минимальные бульбарные раcстройства, проявляющиеся периодическими нарушениями глотания и речи, выявлялись у 31% больных, умеренные, в виде постоянной, но колеблющейся по степени выраженности дисфонии, гнусавости голоса и периодическими нарушениями глотания — у 16% и выраженные, проявляющиеся афонией и дисфагией — у 7 из 54% больных, имевших бульбарные нарушения. Дыхательные расстройства, которые расценивались как минимальные, проявлялись периодическими нарушениями дыхания, возникающими после физической нагрузки выявлялись у 6%, умеренные, в виде одышки на фоне отмены антихолинэстеразных препаратов либо в период возникновения интеркуррентных инфекций — у 6% и выраженные, требующие проведения ИВЛ — у 8 из 20% больных, имевших нарушения функции дыхательной мускулатуры.
Нарушения функции мышц туловища и конечностей оценивались по стандартной шести балльной шкале, где минимальное снижение функции оценивалось как 4 балла и выявлялось у 11%, умеренное (3-2 балла) у 37% и выраженное (менее 2 баллов) — у 12 из 60% больных, имевших нарушение функции мышц туловища и конечностей. Мышечные атрофии минимальной и умеренной степени выраженности выявлялись у 5% больных, возникали, как правило, на фоне выраженных бульбарных расстройств и носили алиментарный характер у 4% больных. Умеренные амиотрофии наблюдались у 1% обследованных больных, у которых миастения сочеталась с тимомой. Снижение сухожильных и периостальных рефлексов выявлялось у 7% обследованных больных. Вегетативно-трофические нарушения в виде сухости кожи и слизистых, парестезий, нарушений сердечного ритма, непереносимости ортостатических нагрузок и др. выявлялись у 10% больных миастенией, среди которых у большинства больных (82%) миастения сочеталась с тимомой.
Еще одним важным критерием диагностики миастении является фармакологический тест, связанный с исследованием обратимости двигательных нарушений после введения препаратов, улучшающих состояние нервно-мышечной передачи. Изучение эффективности введения прозерина и калимина-форте показало, что полная компенсация двигательных нарушений выявляется у 15% больных миастенией. Необходимо обратить внимание, что полная компенсация предполагает восстановление силы мышцы до нормальных значений (5 баллов) независимо от степени ее исходного снижения. У большинства больных миастенией (75%) реакция на введение прозерина была неполной, т.е., сопровождалась увеличением силы мышцы на 2-3 балла, но не достигала 5 баллов. Частичная реакция характеризовалась увеличением силы на 1 балл в отдельных мышцах, тогда как в других тестируемых мышцах отсутствовала.
Третьим критерием диагностики миастении являлся электромиографический критерий, отражающий состояние нервно-мышечной передачи.
Данные исследования показали, что в мышцах больных миастенией, как правило, регистрировались нормальные параметры М-ответов, выявлялся декремент при стимуляции частотами 3 и 40 имп/с. В 30% исследованных мышц отмечался феномен посттетанического облегчения (ПТО) более 120% и в 85% мышц выявлялся феномен посттетанического истощения (ПТИ). Необходимо подчеркнуть, что величина декремента при низкочастотной стимуляции в мышцах больных миастенией пропорциональна степени их клинического поражения.
Несомненно, учитывая аутоиммунную природу заболевания, большое значение в диагностике миастении имеет иммунологический критерий. В настоящее время в Миастеническом центре появилась возможность определения титра антител к ацетилхолиновым рецепторам и антител к мышцам, что существенно облегчило диагностику миастении и позволило оценить эффективность различных методов патогенетической терапии. Учитывая приведенные выше данные, диагноз является сомнительным при наличии только одного из четырех диагностических критериев, например, клинической картины болезни, вероятным — при двух (клиника и фармакологический тест) и несомненным — при всех четырех критериях (клиника, фармакологический тест, электрофизиологическое и иммунологическое исследования).
Лечение миастении
По современным представлениям, патофизиологические механизмы прогрессирующей формы миастении и развития кризов связаны с различными вариантами изменения плотности и функционального состояния холинорецепторов вследствие их аутоиммунного поражения. В соответствии с этим лечение миастении может и должно быть разделено на лечение острых состояний — кризов — и прогредиентных форм болезни.
Искусственная вентиляция легких
Развитие кризов в качестве первого мероприятия предполагает необходимость обеспечения адекватного дыхания с помощью принудительной искусственной вентиляции легких (ИВЛ).
В каждом конкретном случае вопрос о переводе пациента на ИВЛ решается на основании данных клинической картины (нарушение ритма и глубины дыхания, цианоз, возбуждение, потеря сознания, участие в дыхании вспомогательной мускулатуры, изменение величины зрачков, отсутствие реакции на введение антихолинэстеразных препаратов и др.), а также объективных показателей, отражающих газовый состав крови, насыщение гемоглобина кислородом, кислотно-основное состояние (КОС) и др. (ЧД — свыше 40 в 1 мин., ЖЕЛ менее 15 мл/кг, РаО2 ниже 60 мм. рт. ст., РаСО2 выше 60 мм. рт. ст., рН около 7,2, НbО2 ниже 70-80%).
Одной из проблем является адаптация больного к респиратору, т.к. несоответствие дыхательных циклов пациента и респиратора может привести к ухудшению его состояния. Рекомендуются определенные действия для синхронизации самостоятельного дыхания больного и дыхательных циклов респиратора или подавление дыхания пациента в случае невозможности синхронизации:
Собственный опыт и данные, имеющиеся в литературе, показывают, что иногда бывает достаточным проведение ИВЛ и лишение больного антихолинэстеразных препаратов на 16 – 24 часа для прекращения холинергического и смешанного кризов. В этой связи, ИВЛ вначале может проводиться через интубационную трубку, и только при затянувшихся нарушениях дыхания в течение 3 – 4 дней и более показано наложение трахеостомы в связи с опасностью развития пролежня трахеи. В период проведения искусственной вентиляции полностью исключается введение антихолинэстеразных препаратов, проводится интенсивное лечение интеркуррентных заболеваний и патогенетическое лечение миастении. Через 16-24 часа после начала ИВЛ, при условии ликвидации клинических черт холинергического или смешанного кризов, следует провести пробу с введением прозерина. При положительной реакции на введение прозерина можно прервать ИВЛ и, убедившись в возможности адекватного дыхания, перевести больного на прием пероральных антихолинэстеразных препаратов. При отсутствии положительной реакции на введение прозерина необходимо продолжить ИВЛ, повторяя прозериновую пробу через каждые 24-36 часов.
Плазмаферез
Наиболее эффективным лечебным мероприятием при развитии миастенических и холинергических кризов является проведение обменного плазмафереза. Плазмаферез может применяться и при лечении прогрессирующей формы миастении, однако, наиболее эффективен в лечении кризов. Метод плазмафереза основан на заборе крови из локтевой или одной из центральных вен с последующим центрифугированием ее, отделением форменных элементов и заменой плазмы либо на донорскую, либо на искусственную плазму. Эта процедура приводит к быстрому [иногда в течение нескольких часов] улучшению состояния больных. Возможно повторное извлечение плазмы в течение нескольких дней или через день.
Операция проводится в операционной или реанимационной палате, оборудованной и оснащенной в соответствии с требованиями ведения больных, находящихся в критическом состоянии, наличием следящей и лечебной аппаратуры, соответствующих медикаментов и инфузионных сред, возможностью проведения сердечно-легочной реанимации.
При дискретном плазмаферезе забор крови и разделение плазмы проводится раздельно, для чего кровь забирается в большой мешок “Гемакон 500/300” и после немедленного центрифугирования в центрифуге в течение 15 минут ручным плазмаэкстрактором плазма переводится в малый мешок “ Гемакона”. Оставшаяся в большом мешке клеточная масса ресуспендируется в изотоническом кровезаменителе и реинфузируется больному. После реинфузии клеточной взвеси проводится повторный забор крови в новый “Гемакон 500/300” и центрифужная обработка новой дозы крови с отделением плазмы и реинфузией эритроцитов. Общая доза удаленной плазмы у больного этим методом составляет 500-1500 мл. Кратность и частота операций определяется особенностями состояния больного. Аппаратный плазмаферез проводят на фракционаторах крови непрерывного действия с системой одноразовых магистралей. Подготовка и проведение экстракорпоральной операции осуществляется в соответствии с инструкцией к данному типу аппаратов.
При тяжелых миастенических, холинергических кризах, у больных с выраженными бульбарными нарушениями и другими расстройствами, эффективно проводить плазмаобмены. Высокий объем плазмаэксфузии при плазмаобмене должен быть компенсирован по ходу операции (или немедленно по ее завершении) инфузионной терапией, программа которой может включать не только кристаллоиды, коллоиды, но и нативную донорскую плазму, растворы альбумина В случаях нарушения белкового обмена и дефицита инфузионных сред, содержащих донорские белки, в экстракорпоральный контур для плазмафереза включается колонка сорбционная и проводится операция плазмасорбции.
Как правило, плазмаферез проводится курсом на протяжении 1-2 недель с кратностью 2-5 операций. Прерывистый плазмаферез приводит к улучшению после проведения 3 – 4 сеансов. Эффективность непрерывного плазмафереза, несмотря на большие возможности по объему заменяемой плазмы, существенно не отличается от прерывистого. Длительность улучшения состояния больных после проведения обменного плазмафереза колеблется от 2 недель до 2 — 3 месяцев. Противопоказаний к применению плазмафереза нет.
Иммуноглобулины
Возможность использования иммуноглобулинов в лечении миастении обсуждалась еще в середине 80-х – начале 90-х годов [Arsura E. et al., 1986; 1988; Cosi V. et. al., 1991]. Человеческий иммуноглобулин представляет собой иммуноактивный белок. Препараты, содержащие высокое количество таких белков, выделяются из плазмы здоровых людей. В невысоких дозах данные вещества оказывают положительных эффект при различных иммунодепрессивных состояниях, поэтому первоначально круг использования этих препаратов ограничивался тяжелыми септическими процессами, иммунодефицитами. Применение высоких доз иммуноглобулинов обладает способностью подавлять иммунные процессы. При миастении в настоящее время терапия этими веществами рассматривается как альтернатива плазмафереза на основании сходства механизмов, лежащих в основе этих методов лечения [Evoli A. et al., 1993].
Общепринятым режимом терапии считаются короткие [5-ти дневные курсы] внутривенного введения препарата в дозе 400 мг на 1 кг массы тела ежедневно. Как правило, показанием к такому лечению являются кризы с тяжелыми дыхательными и бульбарными нарушениями, не поддающиеся другой иммуносупрессивной терапии [Arsura E. et al., 1986; 1988; Cosi V. et. al., 1991]. Не смотря на высокую стоимость препарата, некоторые клиницисты рекомендуют введение иммуноглобулинов больным, имеющим противопоказания для назначения плазмафереза [Evoli A. et al., 1993]. Arsura E. [1986] отмечал относительно быстрое начало терапевтического действия и пролонгирование эффекта иммуноглобулинов. В среднем клинический эффект наступает на 4-й день от начала лечения и продолжается в течение 50-100 дней после окончания курса. Ряд клиницистов наблюдали улучшение состояния и при использовании малых доз иммуноглобулинов. Так, Bamberg с соавторами [1996] отмечали положительный терапевтический эффект от длительного прерывистого (в течение 12 месяцев) лечения невысокими дозами препарата после начального короткого курса общепринятым количеством (400 мг/кг массы тела). Эффективной также оказалась терапия и более низкими дозами иммуноглобулина (300 мг/кг массы тела) в режиме 4 курса по одному дню [Сhu C.C. et al., 1996]. Имеющийся наш собственный опыт при введении минимальных доз октагама и биавена 15 больным миастенией показал его высокую эффективность в дозах, в 100 раз меньше рекомендуемых (4 — 5 мг на 1 кг массы тела). Препарат вводился внутривенно капельно по 2,5 – 5.0 г с частотой 15 капель в минуту. Курс лечения в среднем составлял 10 введений в суммарной дозе 25 г. В качестве аналогичного препарата возможно использование нормального человеческого иммуноглобулина производства объединения “НИЖФАРМ” в дозе 50 мл внутривенно капельно на 100-150 мл физиологического раствора. Введения повторяют через день в количестве 3-5 г. на курс лечения. Побочные эффекты проявляются в виде повышения температуры тела (4%) тошноты (1.5%), головной боли (1.5%). Другие незначительные реакции наблюдались в виде головокружения, слабости, сонливости, болей в спине, повышения слюноотделения, сердцебиения. Большинство из этих явлений проходило после уменьшения скорости введения препарата или после временного прекращения инфузии.
Антихолинэстеразные препараты
Введение антихолинэстеразных препаратов в качестве диагностической пробы показано при любой форме миастении. Введение антихолинэстеразных препаратов блокирует активность ацетилхолинэстеразы, что способствует более длительному взаимодействию ацетилхолина с холинорецепторами. Клинический эффект проявляется увеличением силы и уменьшением утомляемости, что позволяет оценить обратимость и степень возможной компенсации нарушенных функций. Сравнительный анализ эффективности антихолинэстеразных препаратов и выраженности побочных явлений в виде признаков холинергической интоксикации показывает преимущества таких препаратов как калимин (пиридостигмина бромид) по сравнению с оксазилом (мителаза). Выбор препарата диктуется его индивидуальной переносимостью. Ряд клиницистов отдает предпочтение прозерину, который оказывает, по их мнению, более быстрое (20 – 30 мин), но менее продолжительное действие (3 — 3,5 часа). При назначении антихолинэстеразных препаратов должен соблюдаться определенный временной режим: применение каждой последующей дозы не чаще, чем через 3-4 часа для прозерина и 5-6 часов для калимина, в связи с опасностью возникновения холинергической интоксикации. В период максимальной выраженности клинических симптомов криза целесообразно парентеральное введение антихолинэстеразных препаратов. Причем предпочтение должно отдаваться калимину-форте. Препарат вводят под кожу, а при остановке дыхания внутривенно в дозе 20 мг при весе больного до 80 кг, в дозе 30 мг при весе более 80 кг. Для уменьшения нежелательных мускариновых эффектов антихолинэстеразных препаратов их вводят с атропином в виде 0,2 – 0,5 мл 0,1% раствора. Своевременно и в правильной дозировке произведенное введение антихолинэстеразных препаратов, как правило, помогает восстановлению функции дыхания и бульбарной мускулатуры. По мере достижения стабильного клинического эффекта, восстановления жизненно важных функций дыхания и глотания, вместо парентерального введения назначается прием препаратов внутрь. Для определения времени приема последующих доз пероральных препаратов следует ориентироваться на длительность и эффективность действия применяемой дозы. Вместе с тем необходимо помнить, что в различных состояниях длительность и эффективность действия каждого препарата может меняться.
Глюкортикоидные препараты
В период развития кризов наиболее эффективным является метод “пульстерапии” — внутривенного введения больших доз преднизолона (1000 — 2000 мг), который является одним из вариантов хронотерапевтической регуляции стимуляции тропных гормонов гипофизарно-диенцефально-надпочечниковой системы. Внутривенное введение столь больших доз гормонов в ряде случаев способствует быстрому улучшению состояния больных, особенно на фоне длительной терапии обычными дозами преднизолона по схеме через день. После проведения “пульстерапии” рекомендуется использовать ежедневный прием преднизолона в неравных дозах, например, один день 100 мг, другой день 50 мг. В ряде случаев этот метод приводит к быстрому улучшению состояния больных. Однако быстрота развития побочных действий при такой схеме более высока. По мере улучшения состояния больных они переводятся на прием преднизолона по схеме через день. Для этого постепенно уменьшается доза препарата в день приема меньшей дозы по 5 мг на прием. Необходимо отметить следующее обстоятельство: нередко развитие кризов (особенно холинергических и смешанных) при миастении иногда совпадает с проведением “пульстерапии” или началом назначения высоких доз преднизолона. Возможно, что эти эпизоды не случайны, а связаны с прямым действием глюкокортикоидных препаратов на процессы освобождения синаптического передатчика и способствуют десенситизации рецепторов, вызывая тем самым ухудшение состояния больных. Это обстоятельство диктует необходимость осторожного назначения или изменения дозы преднизолона у больных миастенией.
Иммуносупресанты
Азатиоприн. Стартовая доза назначения азатиоприна — 50 мг в день с последующим увеличением ее до 150-200 мг в сутки. Из побочных эффектов азатиоприна нередко отмечается появление макроцитарной анемии, что не требует изменения дозы препарата. Снижения дозы азатиоприна вплоть до его полной отмены требуют лейкопения (лейкоциты < 3500 мм3) и/или серьезные нарушения функции печени (признаки токсического гепатита). Другие осложнения — инфекции, желудочно-кишечные расстройства и аллергические реакции — отмечаются у 15-35% больных и обычно исчезают на фоне уменьшения дозы препарата [Evoli A. et al., 1993].
Циклоспорин. Ряд авторов рекомендуют использовать начальную дозу препарата 3 мг на 1 кг массы тела, которая при отсутствии токсических реакций может быть увеличена до 5-6 мг на 1 кг веса 2 раза в день. Улучшение отмечается у большинства больных через 1-2 месяца от начала терапии и достигает максимума к 3-4 месяцам. Доза препарата может быть снижена до минимума, а контроль лечения осуществляться на основе клинического ответа и концентрации препарата в плазме [Evoli A. et al., 1996].
Циклофосфан. Вводится по 200 мг ежедневно или по 400 мг через день. Терапевтическая доза 6-8 г, после чего возможно переводить пациента на поддерживающий курс лечения по 200 мг 2 раза в неделю или по 400 мг 1 раз в 1-2 недели.
Хлорид калия
Обычно назначается хлорид калия по 1,0 г 3 раза в сутки. При миастенических кризах хлорид калия вводят внутривенно (70 мл 4% раствора) на 400 мл 5% раствора глюкозы капельно медленно (со скоростью 20-30 капель в минуту) с уколом 4 — 7 ед. инсулина короткого действия в конце капельницы.
Верошпирон
Верошпирон (альдактон, спиронолактон) является антагонистом минералкортикоидного гормона альдостерона, необходимого для регуляции обмена электролитов в организме. Способность верошпирона задерживать калий в клетках служит основанием для широкого его применения при лечении миастении. Препарат принимают внутрь в дозе 0,025 – 0,05 г 3-4 раза в день. Побочные явления: в отдельных случаях тошнота, головокружение, сонливость, кожные сыпи, обратимая форма гинекомастии.
Антиоксиданты
Антиоксидантные свойства производного липоевой кислоты тиоктацида дают основание для его применения у больных миастенией. Препараты липоевой кислоты способствуют активации митохондриального синтеза. Кроме того, они уменьшают выраженность окислительного стресса у больных, находящихся в состоянии миастенического и холинергического кризов, путем снижения содержания в крови свободных радикалов, способствующих повреждению клеточных и митохондриальных мембран во время ишемии. Лечение следует начинать с внутривенного капельного введения тиоктацида в количестве 600 – 900 мг/сутки с дальнейшим переходом на пероральный прием в той же дозировке.
Таким образом, адекватная оценка клинических, фармакологических, электрофизиологических и иммунологических критериев диагностики миастении должна определять стратегию и тактику лечения этого тяжелого, но вполне курабельного заболевания.
Плива — Неврология и психиатрия
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)