Соликва СолоСтар® (Soliqua SoloStar) инструкция по применению
📜 Инструкция по применению Соликва СолоСтар®
💊 Состав препарата Соликва СолоСтар®
✅ Применение препарата Соликва СолоСтар®
📅 Условия хранения Соликва СолоСтар®
⏳ Срок годности Соликва СолоСтар®
Описание лекарственного препарата
Соликва СолоСтар®
(Soliqua SoloStar)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2022 года.
Дата обновления: 2021.12.06
Владелец регистрационного удостоверения:
Контакты для обращений:
САНОФИ РОССИЯ АО
(Россия)
Код ATX:
A10AE54
(Инсулин гларгин и ликсисенатид)
Лекарственные формы
| Соликва СолоСтар® |
Р-р д/п/к введения 100 ЕД+50 мкг/мл: шприц-ручки СолоСтар® 3 мл 3 или 5 шт. рег. №: ЛП-004874 |
|
|
Р-р д/п/к введения 100 ЕД+33 мкг/1 мл: шприц-ручки СолоСтар® 3 мл 3 или 5 шт. рег. №: ЛП-004874 |
Форма выпуска, упаковка и состав
препарата Соликва СолоСтар®
Раствор для п/к введения прозрачный, бесцветный или почти бесцветный.
Вспомогательные вещества: глицерол (85%), метионин (L-метионин), метакрезол (м-крезол), цинка хлорид, хлористоводородная кислота, натрия гидроксид, вода д/и.
3 мл — картриджи бесцветного стекла (3), вмонтированные в одноразовые шприц-ручки СолоСтар® — пачки картонные.
3 мл — картриджи бесцветного стекла (5), вмонтированные в одноразовые шприц-ручки СолоСтар® — пачки картонные.
Раствор для п/к введения прозрачный, бесцветный или почти бесцветный.
Вспомогательные вещества: глицерол (85%), метионин (L-метионин), метакрезол (м-крезол), цинка хлорид, хлористоводородная кислота, натрия гидроксид, вода д/и.
3 мл — картриджи бесцветного стекла (3), вмонтированные в одноразовые шприц-ручки СолоСтар® — пачки картонные.
3 мл — картриджи бесцветного стекла (5), вмонтированные в одноразовые шприц-ручки СолоСтар® — пачки картонные.
Фармакологическое действие
Механизм действия
Препарат Соликва СолоСтар®
Препарат Соликва СолоСтар® является комбинированным препаратом, в состав которого входят два гипогликемических средства с дополняющими друг друга механизмами действия: инсулин гларгин, аналог инсулина длительного действия, и ликсисенатид, агонист рецепторов глюкагоноподобного пептида-1 (ГПП1). Действие препарата направлено на снижение концентрации глюкозы в крови натощак и после приема пищи (постпрандиальной концентрации глюкозы в крови), что улучшает гликемический контроль у пациентов с сахарным диабетом 2 типа (СД2), но при этом минимизируется увеличение массы тела и риск развития гипогликемии.
Инсулин гларгин
Основной функцией инсулина, в т.ч. инсулина гларгин, является регуляция метаболизма глюкозы. Инсулин и его аналоги снижают концентрацию глюкозы крови, за счет увеличения потребления глюкозы периферическими тканями (в особенности, скелетными мышцами и жировой тканью) и подавления образования глюкозы в печени. Инсулин подавляет липолиз и протеолиз, а также увеличивает синтез белка.
Ликсисенатид
Ликсисенатид является агонистом рецепторов ГПП1. Рецептор ГПП1 является мишенью для нативного ГПП1, эндогенного гормона внутренней секреции, который потенцирует глюкозозависимую секрецию инсулина бета-клетками и подавляет секрецию глюкагона альфа-клетками поджелудочной железы.
Действие ликсисенатида, подобно действию эндогенного ГПП1, осуществляется через специфическое взаимодействие с рецепторами ГПП1, включая рецепторы ГПП1, находящиеся в альфа- и бета-клетках поджелудочной железы. После приема пищи ликсисенатид активирует следующие физиологические реакции:
- увеличение секреции инсулина бета-клетками поджелудочной железы;
- замедление опорожнения желудка;
- подавление секреции глюкагона альфа-клетками поджелудочной железы.
Ликсисенатид стимулирует секрецию инсулина в ответ на повышение концентрации глюкозы в крови. Одновременно подавляется секреция глюкагона. Кроме этого, ликсисенатид замедляет опорожнение желудка, уменьшая за счет этого скорость абсорбции глюкозы из пищи и ее поступление в системный кровоток. Было показано, что ликсисенатид в изолированных островках поджелудочной железы человека сохраняет функцию бета-клеток и предотвращает их гибель (апоптоз).
Фармакодинамические свойства
Препарат Соликва СолоСтар®
Комбинация инсулина гларгин и ликсисенатида не оказывает влияния на фармакологическое действие инсулина гларгин. Влияние комбинации инсулина гларгин и ликсисенатида на фармакологическое действие ликсисенатида в клинических исследованиях I фазы не изучалось.
Аналогично относительно постоянному профилю «концентрация/время» без выраженных пиков в течение 24 ч при введении только инсулина гларгин, при введении комбинации инсулин гларгин + ликсисенатид профиль «скорость утилизации глюкозы/время» был схожим, без выраженных пиков.
Длительность действия инсулинов, включая препарат Соликва СолоСтар®, может варьировать как у разных пациентов, так и у одного и того же пациента.
Инсулин гларгин
В клинических исследованиях инсулина гларгин (100 ЕД/мл) гипогликемическое действие в/в вводимого инсулина гларгин было приблизительно таким же, как и у человеческого инсулина (при в/в введении обоих препаратов в одинаковых дозах).
Ликсисенатид
В 28-дневном плацебо-контролируемом исследовании у пациентов с СД2 по оценке влияния ликсисенатида в дозах 5-20 мкг 1 или 2 раза в сутки на концентрацию глюкозы в крови после приема стандартного завтрака, ликсисенатид в дозах 10 мкг и 20 мкг 1 или 2 раза в сутки улучшал гликемический контроль за счет снижения как постпрандиальной (после приема пищи) концентрации глюкозы в крови, так и концентрации глюкозы в крови натощак. Ликсисенатид, вводимый в этом исследовании утром в дозе 20 мкг 1 раз в сутки, поддерживал статистически значимое снижение постпрандиальной концентрации глюкозы в крови после завтрака, обеда и ужина.
Влияние на постпрандиальную концентрацию глюкозы в крови
В 4-недельном исследовании в комбинации с метформином и в 8-недельном исследовании в комбинации с инсулином гларгин с/без метформина, ликсисенатид в дозе 20 мкг 1 раз в сутки, вводимый перед завтраком у пациентов с СД2, показал снижение постпрандиальной концентрации глюкозы в крови (кривая «концентрация глюкозы/время 0:30-4:30 ч») после пробного завтрака. Количество пациентов с 2-часовой постпрандиальной концентрацией глюкозы ниже 140 мг/дл (7.77 ммоль/л) составляло 69.3% после 28 дней лечения и 76.1% после 56 дней лечения.
Влияние на секрецию инсулина
У пациентов с СД2 монотерапия ликсисенатидом по сравнению с плацебо восстанавливает первую фазу секреции инсулина в глюкозозависимом режиме, увеличивая ее в 2.8 раз (90% доверительный интервал, 2.5-3.1) и увеличивает вторую фазу секреции инсулина в 1.6 раз (90% доверительный интервал 1.4-1.7) (измерялось по AUC).
Влияние на опорожнение желудка
После стандартизированного тестового приема меченной изотопом пищи, ликсисенатид замедлял опорожнение желудка, снижая за счет этого скорость постпрандиальной абсорбции глюкозы. У пациентов с СД2 при монотерапии ликсисенатидом эффект замедления опорожнения желудка сохранялся после 28 дней лечения.
Влияние на секрецию глюкагона
Ликсисенатид в дозе 20 мкг 1 раз в сутки в монотерапии демонстрировал снижение постпрандиальной концентрации глюкагона по сравнению с исходом после тестового приема пищи у пациентов с СД2. В плацебо-контролируемом гипогликемическом клэмп-исследовании, проведенном у здоровых добровольцев, по оценке однократного введения ликсисенатида в дозе 20 мкг на секрецию глюкагона, реакция секреции глюкагона в ответ на снижение концентрации глюкозы в крови при гипогликемических состояниях сохранялась, несмотря на присутствие эффективных концентраций ликсисенатида в плазме крови.
Влияние на электрофизиологию сердца (интервал QTc)
Влияние ликсисенатида на реполяризацию сердца было изучено в исследовании интервала QTc (в дозе, в 1.5 раза превышающей рекомендуемую поддерживающую дозу), которое показало отсутствие какого-либо влияния ликсисенатида на реполяризацию желудочков.
Влияние на ЧСС
В плацебо-контролируемых клинических исследованиях III фазы было показано отсутствие повышения средних значений ЧСС.
Клиническая эффективность
Эффективность и безопасность применения препарата Соликва СолоСтар® были изучены в трех рандомизированных, контролируемых клинических исследованиях с активным контролем у пациентов с СД2:
- клиническое исследование (LixiLan-O) с активным контролем, проведенном у пациентов с СД2, не получавших ранее терапию инсулином и с недостаточным гликемическим контролем при применении пероральных гипогликемических препаратов;
- клиническое исследование (LixiLan-L) с активным контролем в сравнении с инсулином гларгин (переход с терапии базальным инсулином);
- клиническое исследование (LixiLan-G) с активным контролем в сравнении с агонистами рецепторов ГПП1 (переход с терапии агонистами рецепторов ГПП1).
Клиническое исследование LixiLan-O
В рандомизированном открытом 30-недельном клиническом исследовании (LixiLan-O) с активным контролем, проведенном у пациентов с СД2, не получавших ранее терапию инсулином и с недостаточным гликемическим контролем при применении пероральных гипогликемических препаратов, оценивались эффективность и безопасность препарата Соликва СолоСтар® (n=468) в сравнении с инсулином гларгин (n=466) и ликсисенатидом (n=233).
При добавлении к лечению препарата Соликва СолоСтар® 74% (n=345) пациентов к 30-й неделе достигли значений гликированного гемоглобина A1c (HbA1c) <7%, по сравнению с 59% (n=277) пациентов при добавлении только инсулина гларгин и 33% (n=77) пациентов при добавлении только ликсисенатида.
Снижение средних значений HbA1с к 30-й неделе у пациентов, получавших препарат Соликва СолоСтар®, составило -1.6%, а у пациентов в группах лечения инсулином гларгин и ликсисенатидом оно составляло -1.3% и -0.9% соответственно.
Средние значения концентрации глюкозы в плазме крови натощак у пациентов, получавших препарат Соликва СолоСтар®, к концу исследования снизились на 3.46 ммоль/л, а при добавлении инсулина гларгин или ликсисенатида на 3.27 ммоль/л и 1.5 ммоль/л соответственно.
Снижение средних значений постпрандиальной концентрации глюкозы в крови (через 2 ч после приема пищи) у пациентов к 30-й неделе при добавлении к лечению препарата Соликва СолоСтар® составило -5,68 ммоль/л, по сравнению с -3.31 ммоль/л при добавлении только инсулина гларгин и -4.58 ммоль/л при добавлении только ликсисенатида.
К концу 30-недельного периода среднее значение изменения массы тела составило у пациентов, получавших препарат Соликва СолоСтар®, -0.3 кг, а инсулин гларгин +1.1 кг. При добавлении ликсисенатида изменение массы тела составило -2.3 кг.
Клиническое исследование (LixiLan-L) (переход с базального инсулина)
В рандомизированном, 30-недельном, контролируемом, открытом, многоцентровом клиническом исследовании (LixiLan-L) с активным контролем оценивалась эффективность и безопасность препарата Соликва СолоСтар® в сравнении с инсулином гларгин. В исследование было включено 736 пациентов с СД2 с недостаточным гликемическим контролем при терапии пероральными гипогликемическими препаратами в комбинации с базальным инсулином.
При применении препарата Соликва СолоСтар® 54.9% пациентов (n=201) к 30-й неделе достигли HbA1c <7%, по сравнению с 29.6% пациентов (n=108) в группе лечения только инсулином гларгин.
Среднее значение снижения HbA1C к 30-й неделе у пациентов, получавших препарат Соликва СолоСтар®, составило -1.1%, а у пациентов в группе лечения инсулином гларгин снижение HbA1C составило -0.6%.
Концентрация глюкозы в плазме крови натощак у пациентов, получавших препарат Соликва СолоСтар®, к концу исследования снизилась на 0.35 ммоль/л, а при применении инсулина гларгин на 0.47 ммоль/л.
Среднее значение снижения постпрандиальной концентрации глюкозы в крови (через 2 ч после приема пищи) у пациентов к 30-й неделе при лечении препаратом Соликва СолоСтар® составило -4.72 ммоль/л, по сравнению с -1.39 ммоль/л в группе инсулина гларгин.
К концу 30-недельного периода среднее изменение массы тела у пациентов, получавших препарат Соликва СолоСтар®, составило -0.7 кг, а у пациентов, получавших инсулин гларгин — +0.7 кг.
Таким образом, лечение препаратом Соликва СолоСтар® вызывало клинически и статистически значимое улучшение показателя HbA1c. Причем, достижение более низких значений HbA1c и большего снижения HbA1c при применении препарата Соликва СолоСтар® не увеличивало частоту развития гипогликемии по сравнению с монотерапией инсулином гларгин.
Клиническое исследование (LixiLan-G) (переход с терапии агонистами рецепторов ГПП1)
В рандомизированном, 26-недельном, открытом, многоцентровом клиническом исследовании (LixiLan-G) с активным контролем оценивалась эффективность и безопасность препарата Соликва СолоСтар® в сравнении с агонистами рецепторов ГПП1. В исследование было включено 514 пациентов с СД2 с недостаточным гликемическим контролем при терапии пероральными гипогликемическими препаратами в комбинации с агонистами рецепторов ГПП1.
При применении препарата Соликва СолоСтар® 61.9% пациентов (n=156) к 30-й неделе достигли HbA1c <7%, по сравнению с 25.7% пациентов (n=65) в группе лечения агонистами рецепторов ГПП1.
Среднее значение снижения HbA1C к 30-й неделе у пациентов, получавших препарат Соликва СолоСтар®, составило -1.0%, а у пациентов в группе лечения агонистами рецепторов ГПП1 снижение HbA1C составило -0.4%.
Концентрация глюкозы в плазме крови натощак у пациентов, получавших препарат Соликва СолоСтар®, к концу исследования снизилась на 2.28 ммоль/л, а при применении агонистов рецепторов ГПП1 на 0.60 ммоль/л.
Среднее значение снижения постпрандиальной концентрации глюкозы в крови (через 2 ч после приема пищи) у пациентов к 30-й неделе при лечении препаратом Соликва СолоСтар® составило -4.0 ммоль/л, по сравнению с -1.1 ммоль/л в группе агонистов рецепторов ГПП1.
К концу 30-недельного периода среднее изменение массы тела у пациентов, получавших препарат Соликва СолоСтар®, составило +1.9 кг, а у пациентов, получавших агонисты рецепторов ГПП1, -1.1 кг.
- Сочетанное применение препарата Соликва СолоСтар® и ингибиторов НГЛТ2 (натрий-глюкозных ко-транспортеров 2 типа)
В рамках исследования LixiLan-G была доказана целесообразность сочетанного применения препарата Соликва СолоСтар® и ингибиторов НГЛТ2 (подгруппа 26 пациентов). Данные, полученные в ходе исследования, указывают на то, что назначение препарата Соликва СолоСтар® пациентам, у которых не удается достичь надлежащего контроля СД2 при применении ингибиторов НГЛТ2, ведет к благоприятному изменению уровня HbA1c в отличие от препаратов сравнения. У пациентов, принимавших ингибиторы НГЛТ2, и пациентов, не принимавших ингибиторы НГЛТ2, не наблюдалось повышенного риска развития гипогликемии и существенной разницы в совокупном профиле безопасности.
Исследования влияния ликсисенатида и инсулина гларгин на сердечно-сосудистую систему (ССС)
Влияние на развитие осложнений со стороны ССС терапии инсулином гларгин было установлена в клиническом исследовании ORIGIN, а ликсисенатидом — в клиническом исследовании ELIXA. Исследований влияния терапии фиксированной комбинации инсулина гларгин и ликсисенатида на ССС не проводилось.
Инсулин гларгин. Клиническое исследование ORIGIN (Outcome Reduction with Initial Glargine Intervention) было открытым, рандомизированным исследованием, проведенным у 12537 пациентов, терапии препаратом Лантус® (инсулин гларгин 100 ЕД/мл) в сравнении со стандартной гипогликемической терапией в отношении времени развития первого крупного сердечно-сосудистого осложнения (КССО). КССО определялось, как композитная конечная точка: сердечно-сосудистая смерть, нефатальный инфаркт миокарда, нефатальный инсульт. Частота развития КССО в группах лечения препаратом Лантус® и группах стандартной гипогликемической терапии была сопоставимой [отношение рисков (95% доверительный интервал) 1.02 (0.94, 1.11)].
В клиническом исследовании ORIGIN средняя частота развития рака (всех видов) [отношение рисков (95% доверительный интервал) 0.99 (0.88, 1.11)] или смерти от рака [отношение рисков (95% доверительный интервал) 0.94 (0.77, 1.15)] была сопоставимой между группами лечения.
Ликсисенатид. Клиническое исследование ELIXA было рандомизированным, двойным слепым, плацебо-контролируемым, многонациональным исследованием, в котором проводилась оценка осложнений со стороны ССС во время лечения ликсисенатидом у пациентов c СД2 (n=6068) после недавно перенесенного острого коронарного синдрома. Первичной конечной точкой эффективности было время до первого возникновения любого из следующих событий, положительно расцененных Комитетом по оценке сердечно-сосудистых событий: сердечно-сосудистая смерть, нефатальный инфаркт миокарда, нефатальный инсульт или госпитализация по поводу нестабильной стенокардии. Вторичные сердечно-сосудистые конечные точки включали комбинацию первичной конечной точки либо с госпитализацией по поводу сердечной недостаточности, либо с реваскуляризацией коронарных артерий. Также заранее запланированной вторичной конечной точкой было изменение отношения альбумин/креатинин в моче к 108-й неделе.
Частота возникновения событий из первичной конечной точки была сопоставимой в группе ликсисенатида и в группе плацебо: отношение рисков для ликсисенатида против плацебо составляло 1.017, с двусторонним 95% доверительным интервалом, составляющим 0.886-1.168. Одинаковые проценты между группами лечения наблюдались для вторичных конечных точек и для всех отдельных компонентов композитных конечных точек. Проценты пациентов, госпитализированных по поводу сердечной недостаточности, составляли 4.0% и 4.2% в группах ликсисенатида и плацебо, соответственно [отношение рисков (95% доверительный интервал) 0.96 (0.75, 1.23)].
В группе ликсисенатида по сравнению с группой плацебо наблюдалось меньшее увеличение отношения альбумин/креатинин в моче к неделе 108, по сравнению с исходом: -10.04±3.53%; 95% доверительный интервал составлял -16.95%, -3.13%.
Фармакокинетика
Препарат Соликва СолоСтар®
Соотношение инсулина гларгин и ликсисенатида в препарате Соликва СолоСтар® не оказывало значимого влияния на фармакокинетику инсулина гларгин и ликсисенатида.
По сравнению с монотерапией ликсисенатидом, при введении препарата Соликва СолоСтар® Cmax ликсисенатида в плазме крови была ниже, в то время как AUC была в целом сопоставимой. Эти различия в фармакокинетике ликсисенатида при его введении в составе препарата Соликва СолоСтар® и при введении только ликсисенатида не являлись клинически значимыми.
Всасывание
Препарат Соликва СолоСтар®. После п/к введения комбинации инсулин гларгин/ликсисенатид пациентам с сахарным диабетом 1 типа, инсулин гларгин показал отсутствие пиковых подъемов его концентрации в плазме крови. Поступление инсулина гларгин в системный кровоток находилось в диапазоне 86-101% по сравнению с введением одного инсулина гларгин.
После п/к введения комбинации инсулин гларгин/ликсисенатид пациентам с сахарным диабетом 1 типа, медиана времени до достижения максимальной концентрации в плазме крови (Tmax) ликсисенатида находилась в диапазоне 2.5-3.0 ч. После подкожного введения комбинации инсулин гларгин/ликсисенатид наблюдалось небольшое снижение Cmax ликсисенатида на 22-34% по сравнению с раздельным одновременным введением инсулина гларгин и ликсисенатида, что не является клинически значимым.
Отсутствовали клинически значимые различия в скорости абсорбции при введении ликсисенатида подкожно в область передней стенки живота, бедра или плеча.
Распределение
Ликсисенатид. У человека ликсисенатид в умеренной степени (на 55%) связывается с белками плазмы крови.
Метаболизм и выведение
Инсулин гларгин. Исследование метаболизма у человека при введении только инсулина гларгин показывает, что инсулин гларгин частично метаболизируется с карбоксильного конца бета-цепи в подкожном депо с образованием двух активных метаболитов с активностью in vitro, сходной с человеческим инсулином: М1 (21A-Gly-инсулин) и М2 (21A-Gly-дез-30B-Thr-инсулин). Неизмененный инсулин гларгин и продукты его деградации также присутствуют в системном кровотоке.
Ликсисенатид. Являясь пептидом, ликсисенатид выводится путем гломерулярной фильтрации с последующей реабсорбцией в почечных канальцах и метаболической деградации, приводящей к образованию более мелких пептидов и аминокислот, которые повторно вступают в белковый обмен.
Фармакокинетика у особых групп пациентов
Пациенты с почечной недостаточностью
Открытое исследование оценивало фармакокинетику ликсисенатида 5 мкг при однократном введении у лиц с различной степенью нарушения функции почек [которая вычислялась с помощью формулы Кокрофта-Голта для расчета клиренса креатинина (КК)] по сравнению со здоровыми лицами. Не наблюдалось значимых различий в средних значениях Cmax и AUC ликсисенатида при нормальной функции почек и почечной недостаточности легкой степени тяжести (КК 60-90 мл/мин). У пациентов с почечной недостаточностью средней степени тяжести (КК 30-60 мл/мин) AUC ликсисенатида увеличивалась приблизительно на 51%, а у пациентов с почечной недостаточностью тяжелой степени (КК 15-30 мл/мин) AUC ликсисенатида увеличивалась приблизительно на 87%.
Пациенты с печеночной недостаточностью
- Ликсисенатид
Т.к. ликсисенатид выводится, главным образом, почками, фармакокинетических исследований у пациентов с острым или хроническим нарушением функции печени не проводилось. Не ожидается, что нарушение функции печени способно повлиять на фармакокинетику ликсисенатида.
Возраст, раса, пол и масса тела
- Инсулин гларгин
Влияние возраста, расы и пола на фармакокинетику инсулина гларгин до настоящего времени не оценивалось. В контролируемых клинических исследованиях у взрослых, проведенных с инсулином гларгин (100 ЕД/мл), анализ подгрупп, проведенный по возрасту, расовой и половой принадлежности, не показал различий в отношении безопасности и эффективности.
- Ликсисенатид
По данным популяционного фармакокинетического анализа возраст, масса тела, раса и пол не оказывали клинически значимого влияния на фармакокинетику ликсисенатида.
- Препарат Соликва Солостар®
Влияние индекса массы тела (ИМТ) на фармакокинетику препарата Соликва Солостар® до настоящего времени не оценивалось.
Показания препарата
Соликва СолоСтар®
В комбинации с метформином в сочетании или без сочетания с ингибиторами НГЛТ2 (натрий-глюкозных ко-транспортеров 2 типа) с целью улучшения гликемического контроля у взрослых пациентов с сахарным диабетом 2 типа (в качестве дополнения к диетотерапии и повышенной физической нагрузке) при неэффективности:
- пероральных гипогликемических препаратов;
- комбинации пероральных гипогликемических препаратов с базальным инсулином;
- комбинации пероральных гипогликемических препаратов с агонистами рецепторов ГПП1;
- монотерапии базальным инсулином.
Режим дозирования
Для удобства индивидуального подбора дозы препарат Соликва СолоСтар® выпускается в двух шприц-ручках, предоставляющих выбор различных доз.
Различия между этими двумя шприц-ручками заключаются в диапазоне доз действующих веществ в шприц-ручках (см. ниже).
- Соликва СолоСтар® 100 ЕД/мл и 50 мкг/мл: шприц-ручка 10-40
- 1 единица препарата в этой шприц-ручке Соликва СолоСтар® содержит 1 ЕД инсулина гларгин и 0.5 мкг ликсисенатида.
- Эта шприц-ручка дает возможность получения суточной дозы от 10 до 40 единиц препарата Соликва СолоСтар® (от 10 до 40 ЕД инсулина гларгин в комбинации с ликсисенатидом в дозе от 5 мкг до 20 мкг).
- Соликва СолоСтар® 100 ЕД/мл и 33 мкг/мл: шприц-ручка 30-60
- 1 единица препарата в этой шприц-ручке Соликва СолоСтар® содержит 1 ЕД инсулина гларгин и 0.33 мкг ликсисенатида.
- Эта шприц-ручка дает возможность получения суточной дозы от 30 до 60 единиц препарата Соликва СолоСтар® (от 30 до 60 ЕД инсулина гларгин в комбинации с ликсисенатидом в дозе от 10 мкг до 20 мкг).
Во избежание ошибочного введения препарата из другой шприц-ручки (с другой дозировкой), следует удостовериться в том, что в рецепте указана соответствующая назначению врача шприц-ручка Соликва СолоСтар®: шприц-ручка Соликва СолоСтар® (10-40) или шприц-ручка Соликва СолоСтар® (30-60).
Максимальная суточная доза препарата Соликва СолоСтар® составляет 60 единиц (60 ЕД инсулина гларгин и 20 мкг ликсисенатида).
Препарат Соликва СолоСтар® вводят п/к 1 раз/сут в течение 1 ч перед любым приемом пищи. Предпочтительно, чтобы прандиальная (перед приемом пищи) инъекция препарата Соликва СолоСтар® проводилась ежедневно перед одним и тем же приемом пищи, выбранным, как наиболее подходящий для пациента. В случае пропуска введения дозы препарата Соликва СолоСтар®, ее следует ввести в течение 1 ч перед следующим приемом пищи.
Дозу препарата Соликва СолоСтар® следует подбирать индивидуально на основании клинического ответа и титровать, исходя из потребности пациента в инсулине. Доза ликсисенатида увеличивается или уменьшается вместе с дозой инсулина гларгин, а также зависит от того, какая из вышеуказанных шприц-ручек используется.
Коррекцию дозы или изменение времени введения препарата Соликва СолоСтар® следует проводить только под врачебным наблюдением с соответствующим мониторингом концентрации глюкозы в крови (см. раздел «Особые указания»).
Начало терапии препаратом Соликва СолоСтар®
Начальная доза препарата Соликва СолоСтар®
Перед началом терапии препаратом Соликва СолоСтар® следует прекратить терапию любым другим базальным инсулином, агонистами рецепторов ГПП1, пероральными гипогликемическими средствами (кроме метформина и ингибиторов НГЛТ2).
Начальная доза препарата Соликва СолоСтар® выбирается, исходя из предшествующего лечения гипогликемическими препаратами, и не должна превышать начальную дозу ликсисенатида 10 мкг.
Начальная доза препарата Соликва СолоСтар®
* Если применялся другой базальный инсулин:
- Для расчета стартовой дозы препарата Соликва СолоСтар®, при переводе с базального инсулина, вводимого 2 раза в сутки, или инсулина гларгин 300 ЕД/мл, вводимого 1 раз в сутки, необходимо сначала уменьшить на 20% суточную дозу применяемого инсулина, а затем выбрать стартовую дозу препарата Соликва СолоСтар®, используя приведенную выше таблицу: 10 или 20 единиц препарата в шприц-ручке (10-40) или 30 единиц препарата в шприц-ручке (30-60).
- Для любых других базальных инсулинов следует применять те же рекомендации, что и для инсулина гларгин (100 ЕД/мл).
Титрование дозы препарата Соликва СолоСтар®
Препарат Соликва СолоСтар® следует дозировать в соответствии с индивидуальной потребностью пациента в инсулине. С целью улучшения гликемического контроля рекомендуется корректировать дозу препарата на основании определения концентрации глюкозы в плазме крови натощак.
При переходе на терапию препаратом Соликва СолоСтар® и в последующие недели рекомендуется проведение тщательного мониторинга концентрации глюкозы в крови.
- Если лечение пациента начинается с использования шприц-ручки Соликва СолоСтар® (10-40), то с помощью этой шприц-ручки доза может титроваться до 40 единиц препарата.
- При общих суточных дозах > 40 единиц препарата/сутки следует перейти на использование шприц-ручки Соликва СолоСтар® (30-60).
- Если лечение пациента начинается с использования шприц-ручки Соликва СолоСтар® (30-60), то с помощью этой шприц-ручки доза может титроваться до 60 единиц препарата.
- При общих суточных дозах > 60 единиц препарата/сутки нельзя использовать препарат Соликва СолоСтар®.
Способ введения
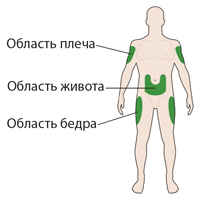
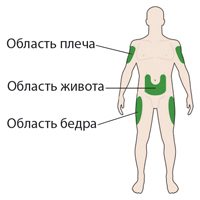
Препарат Соликва СолоСтар® следует вводить в подкожно-жировую клетчатку передней брюшной стенки, плеч или бедер.
С целью уменьшения риска развития липодистрофии место инъекций следует менять при каждой новой инъекции в пределах одной из рекомендуемых областей для введения.
На скорость абсорбции и, соответственно, на начало и продолжительность действия могут влиять физическая нагрузка и другие изменяющиеся факторы, такие как стресс, сопутствующие заболевания, или изменения одновременно принимаемых лекарственных препаратов или диеты.
Препарат Соликва СолоСтар® нельзя вводить в/в и в/м.
После первого введения препарата шприц-ручкой можно пользоваться в течение 4 недель, храня при температуре ниже 25°С в защищенном от света месте (не замораживать и не в холодильнике).
Более подробную информацию по проведению инъекций с помощью шприц-ручки Соликва СолоСтар® 10-40 см. далее в «Инструкции по использованию шприц-ручки Соликва СолоСтар® 10-40 (для доз 10-40 единиц препарата в сутки)».
Более подробную информацию по проведению инъекций с помощью шприц-ручки Соликва СолоСтар® 30-60 см. далее в «Инструкции по использованию шприц-ручки Соликва СолоСтар® 30-60 (для доз 30-60 единиц препарата в сутки)».
Применение в особых клинических группах пациентов
Дети и подростки до 18 лет. Безопасность и эффективность препарата Соликва СолоСтар® у детей и подростков младше 18 лет не установлена.
Пациенты в возрасте ≥ 65 лет. Препарат Соликва СолоСтар® можно применять у пациентов в возрасте ≥ 65 лет. Доза должна корректироваться индивидуально, исходя из мониторинга концентраций глюкозы в крови. Опыт применения препарата у пациентов в возрасте ≥ 75 лет ограничен.
Пациенты с печеночной недостаточностью. Влияние печеночной недостаточности на фармакокинетику препарата Соликва СолоСтар® не изучалось.
Коррекции дозы ликсисенатида у пациентов с печеночной недостаточностью не требуется. У пациентов с печеночной недостаточностью потребность в инсулине может уменьшаться вследствие снижения способности к глюконеогенезу и замедления метаболизма инсулина. У пациентов с печеночной недостаточностью может потребоваться частый мониторинг концентрации глюкозы в крови и коррекция дозы препарата Соликва СолоСтар®.
Пациенты с почечной недостаточностью. Отсутствует терапевтический опыт применения ликсисенатида у пациентов с почечной недостаточностью тяжелой степени (КК менее 30 мл/мин) и терминальной почечной недостаточностью, поэтому применение ликсисенатида у этих групп пациентов противопоказано. У пациентов с почечной недостаточностью легкой и средней степени тяжести может снижаться потребность в инсулине вследствие замедления метаболизма инсулина. У пациентов с почечной недостаточностью может потребоваться частый мониторинг концентрации глюкозы в крови и коррекция дозы препарата Соликва СолоСтар®.
В шприц-ручках Соликва СолоСтар® содержится инсулин гларгин и ликсисенатид в фиксированном соотношении.
Лекарственная комбинация в шприц-ручке Соликва СолоСтар® 10-40 предназначена для ежедневного введения от 10 до 40 ЕД инсулина гларгин и от 5 мкг до 20 мкг ликсисенатида.
- Никогда не используйте иглы повторно. В случае повторного использования иглы Вы можете не получить нужную Вам дозу (введение меньшей дозы) или получить слишком большую дозу (передозировка), т.к. возможна закупорка иглы.
- Никогда не используйте шприц для извлечения препарата из шприц-ручки. При использовании шприца Вы не сможете получить правильное количество препарата.
Сохраните эту инструкцию для обращения к ней за справками в будущем.
Важная информация
- Никогда не пользуйтесь одной шприц-ручкой одновременно с другим человеком – она предназначена для индивидуального использования.
- Никогда не пользуйтесь шприц-ручкой, если она повреждена или Вы не уверены в том, что она исправна.
- Всегда проводите тест на безопасность.
- Всегда имейте при себе запасную шприц-ручку и запасные иглы, на тот случай, если они потеряются или станут неисправными.
- Перед тем как начать пользоваться шприц-ручкой, узнайте у медицинского работника, как правильно проводить подкожную инъекцию.
- В случае наличия у Вас затруднений при обращении с этой шприц-ручкой, например, в случае проблем со зрением, Вам может потребоваться помощь других лиц, способных следовать всем рекомендациям данной инструкции по пользованию шприц-ручкой Соликва СолоСтар®.
- Перед использованием шприц-ручки, прочитайте эту инструкцию. Если Вы не будете следовать всем ее рекомендациям, Вы можете получить слишком много или слишком мало препарата.
Дополнительные средства, которые Вам потребуются:
- Новая стерильная игла (см. ШАГ 2).
- Спиртовая салфетка.
- Резистентный к проколам контейнер для использованных игл и шприц-ручек (см. раздел «Утилизация шприц-ручек»).
Указание мест для проведения инъекций
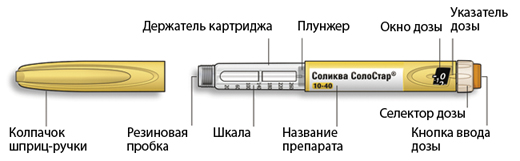
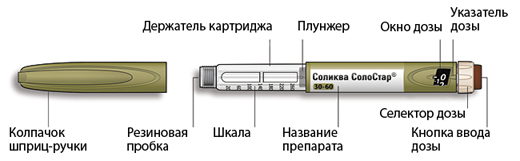
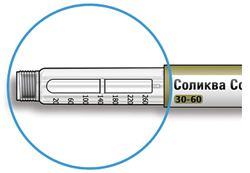
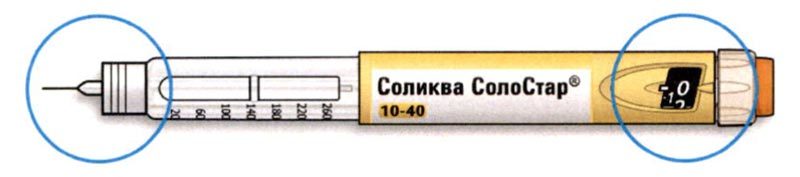
Внешний вид шприц-ручки Соликва СолоСтар® 10-40
* Вы можете не видеть плунжер, пока не введете несколько доз.
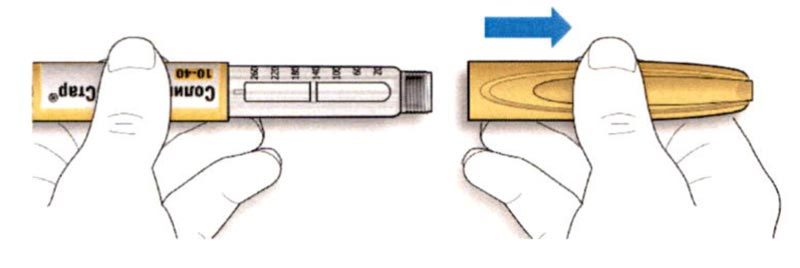
ШАГ 1: Проверка шприц-ручки
Выньте новую шприц-ручку из холодильника не менее чем за 1 час до проведения инъекции. Введение холодного препарата является более болезненным.
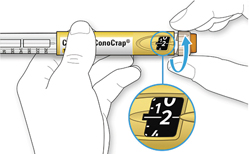
A. Проверка названия и срока годности на этикетке шприц-ручки.
Удостоверьтесь в том, что у Вас правильный (нужный Вам) препарат. Шприц-ручка Соликва СолоСтар® 10-40 имеет желтый цвет.
- Не используйте шприц-ручку Соликва СолоСтар® 10-40, если Вы нуждаетесь в суточной дозе менее 10 единиц или больше 40 единиц препарата.
- Не используйте шприц-ручку после окончания срока годности
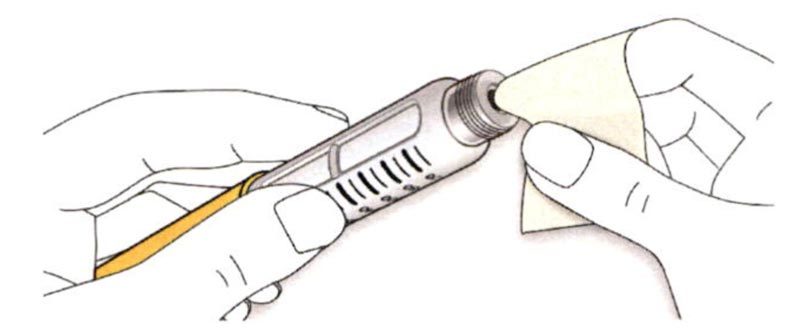
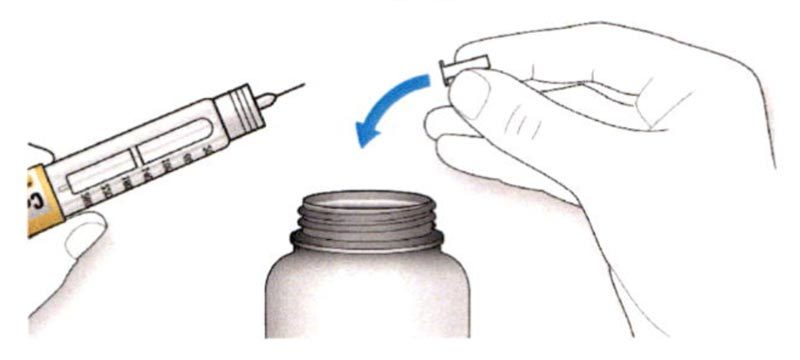
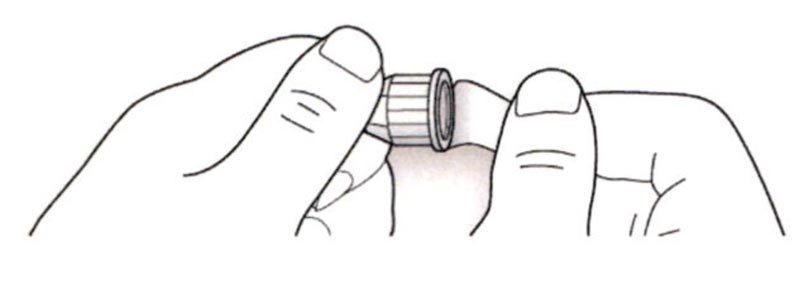
B. Снимите колпачок со шприц-ручки.
C. Проверьте прозрачность препарата.
- Не используйте шприц-ручку, если раствор препарата мутный, имеет окраску или содержит частицы.
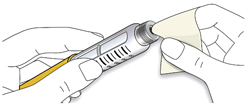
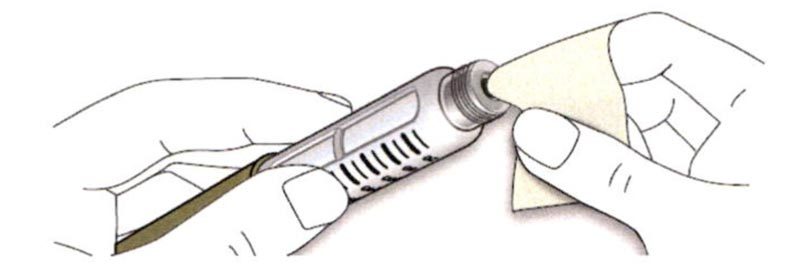
D. Протрите резиновую герметизирующую пробку спиртовой салфеткой.
Если у Вас имеются другие шприц-ручки
- Если Вы имеете другие шприц-ручки, особенно важно удостовериться в том, что Вы взяли правильный (нужный Вам) препарат.
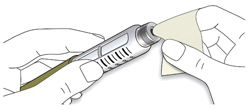
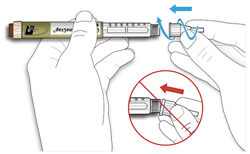
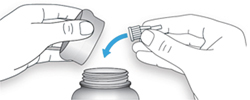
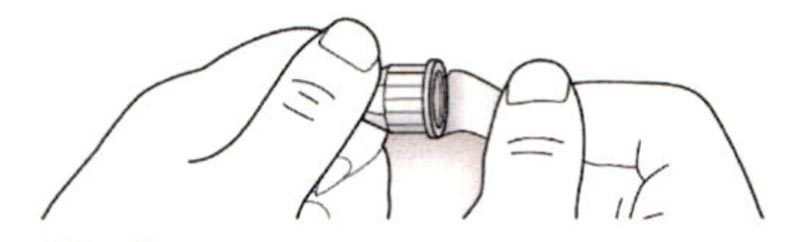
ШАГ 2: Присоединение новой иглы
- Не используйте иглы повторно. Всегда используйте новую стерильную иглу для каждой инъекции. Это поможет предотвратить закупорку иглы, контаминацию (загрязнение) иглы и инфекцию.
- Всегда используйте иглы, которые совместимы со шприц ручкой Соликва СолоСтар®, например, иглы BD Микро-Файн® Плюс (BD Micro-Fine® Plus), Юнифайн® Пентипс® Плюс (Unifine®Pentips®Plus), Инсупен (Insupen).
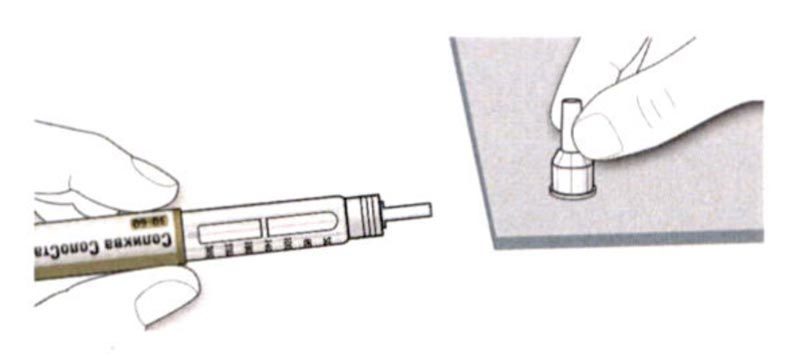
A. Возьмите новую иглу и удалите защитное покрытие.
B. Держите иглу прямо перед шприц-ручкой и прикрутите ее на шприц-ручку до фиксации. Не прилагайте чрезмерных усилий при прикручивании иглы.
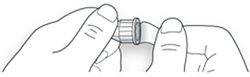
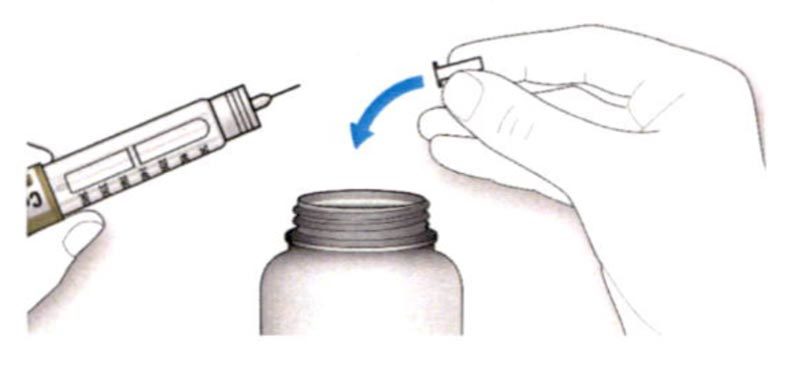
C. Снимите наружный колпачок иглы. Сохраните его для использования в дальнейшем.
D. Снимите внутренний колпачок с иглы и выбросьте его.
Обращение с иглами
- Будьте осторожны при обращении с иглами — это предотвратит повреждение иглой и перекрестное инфицирование.
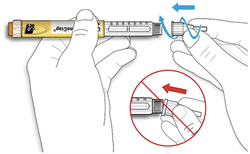
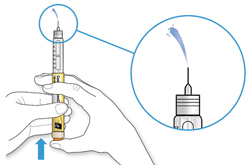
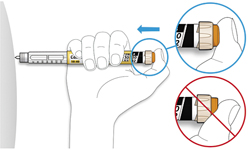
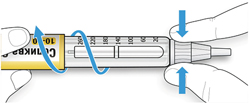
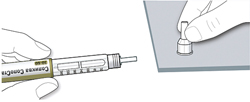
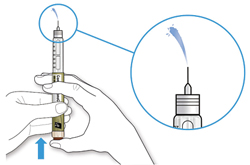
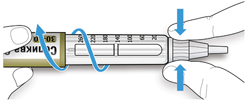
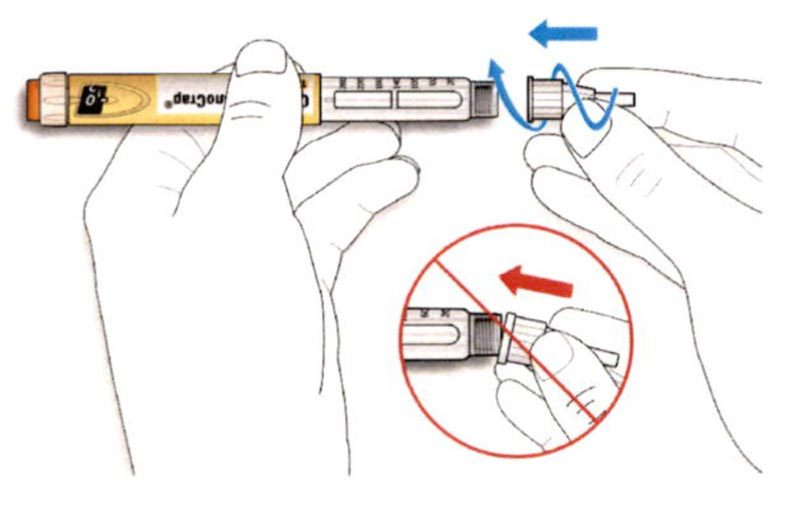
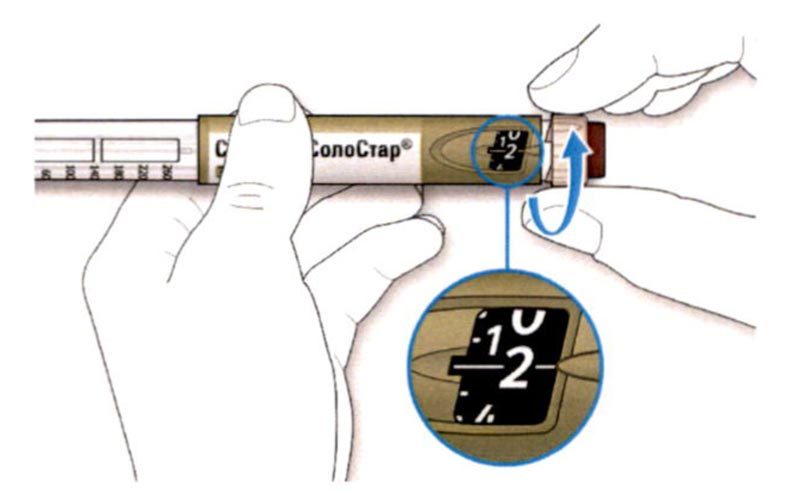
ШАГ 3: Проведите тест на безопасность
Обязательно перед каждой инъекцией проводите тест на безопасность — он проводится для проверки того, что шприц-ручка и игла работают надлежащим образом, а также для того чтобы быть уверенным, что Вы введете правильную дозу препарата.
A. Наберите 2 единицы препарата путем вращения селектора дозы до того момента, когда указатель дозы не окажется на отметке 2.
B. Нажмите до упора на кнопку ввода дозы.
- Если препарат выходит из кончика иглы, шприц-ручка работает правильно.
Если жидкость не показывается из кончика иглы:
- Вам может потребоваться повторить этот шаг до 3 раз, перед тем как покажется препарат.
- Если препарат не выходит из кончика иглы после третьего повтора этого шага, возможно, имеет место закупорка иглы. Если это произошло:
- Замените иглу (см. ШАГ 6 и ШАГ 2).
- Затем повторите тест на безопасность (ШАГ 3).
- Не используйте шприц-ручку, если препарат все же не выходит из кончика иглы. Используйте новую шприц-ручку.
- Никогда не используйте шприц для извлечения препарата из шприц-ручки.
Если Вы видите пузырьки воздуха
- Вы можете видеть пузырьки воздуха в препарате. Это нормально, они не причинят Вам вреда.
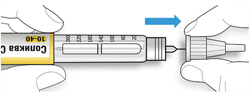
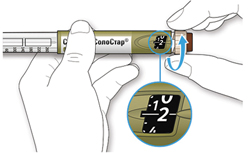
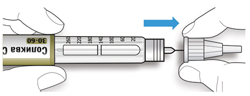
ШАГ 4: Набор дозы
- Используйте шприц-ручку только для введения однократной суточной дозы от 10 до 40 единиц препарата.
- Никогда не набирайте дозу и не нажимайте на кнопку введения дозы без присоединенной иглы. Это может повредить шприц-ручку.
A. Удостоверьтесь в том, что игла присоединена и доза установлена на «0».
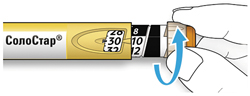
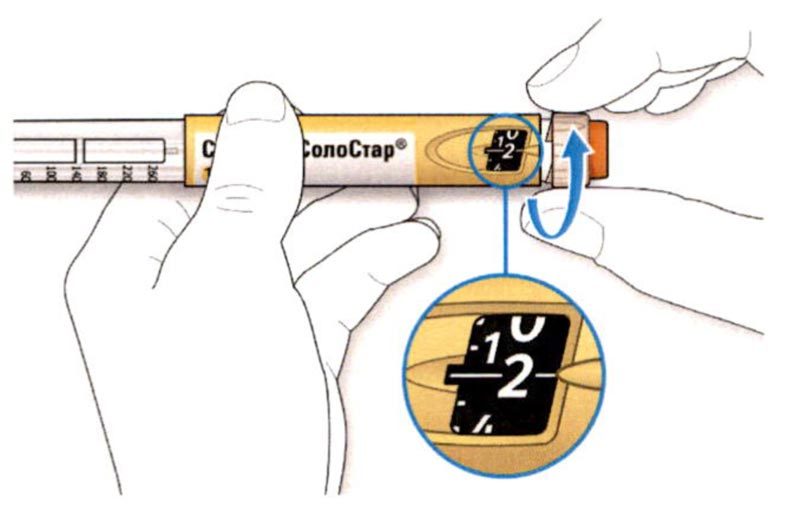
A. Вращайте селектор дозы до тех пор, пока указатель дозы не окажется на одной линии с нужной Вам дозой.
- Если Вы провернули селектор дозы дальше нужной Вам дозы, то можно повернуть его назад.
- Если в шприц-ручке нет достаточного количества единиц препарата для нужной Вам дозы, селектор дозы остановится на количестве оставшихся в шприц-ручке единиц препарата.
- Если Вы не можете набрать всю назначенную Вам дозу, используйте новую шприц-ручку или введите оставшиеся в шприц-ручке единицы препарата и используйте новую шприц-ручку для того, чтобы ввести недостающие единицы препарата до полной дозы. Только в этом случае допускается введение оставшейся дозы менее 10 единиц препарата. Всегда используйте другую шприц-ручку Соликва СолоСтар® 10-40, чтобы дополнить необходимую Вам дозу, а не шприц-ручку Соликва СолоСтар® 30-60.
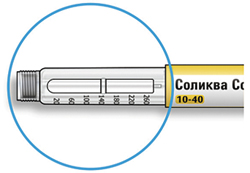
Как читать показания окна дозы
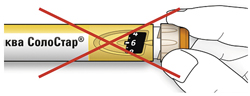
- Не используйте шприц-ручку, если Ваша однократная суточная доза менее 10 единиц препарата, которые показываются в виде белых цифр на черном фоне.
Единицы препарата в шприц-ручке
- Шприц-ручка содержит в общей сложности 300 единиц препарата. Вы может набирать Вашу дозу с шагом в 1 единицу.
- Не используйте эту шприц-ручку, если Вы нуждаетесь в суточной дозе менее 10 единиц или более 40 единиц препарата.
- Каждая шприц-ручка содержит более одной дозы.
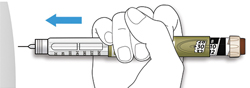
ШАГ 5: Введение дозы
Если Вы испытываете затруднения при нажатии на кнопку ввода дозы, не применяйте силу, так как это может повредить шприц-ручку. За помощью обратитесь к ШАГУ 5 E ниже.
A. Выберите место для инъекции, как показано на рисунке выше.
B. Введите иглу в кожу, как Вам было показано Вашим медицинским работником.
- Не прикасайтесь пока к кнопке ввода дозы.
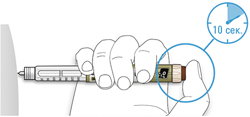
C. Поместите большой палец на кнопку ввода дозы. Затем нажмите до упора и удерживайте в этом положении.
- Не нажимайте на кнопку ввода дозы под углом — большой палец может блокировать проворачивание селектора дозы.
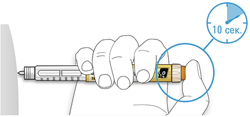
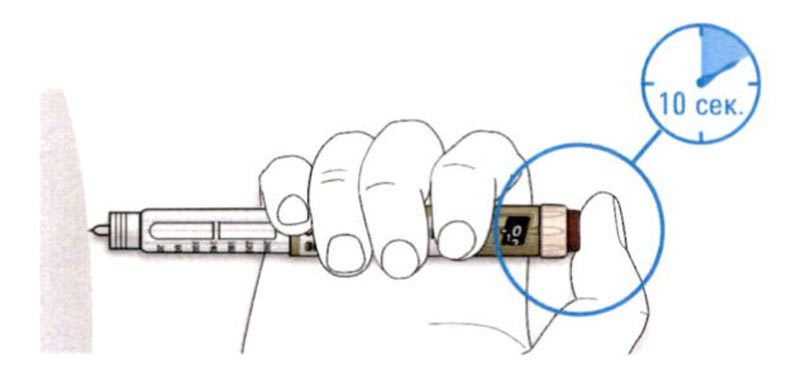
D. Нажимайте на кнопку ввода дозы, и когда вы увидите «0» в окне дозы, медленно досчитайте до 10.
- Это будет гарантировать, что Вы ввели полную дозу.
E. После удерживания кнопки ввода дозы и счета до 10 отпустите кнопку ввода. Затем извлеките иглу из кожи.
Если возникают затруднения при нажатии на кнопку ввода
- Смените иглу (см. ШАГ 6 и ШАГ 2), затем проведите тест на безопасность (см. ШАГ 3).
- Если все равно сохраняются затруднения при нажатии на кнопку ввода, возьмите новую шприц-ручку.
- Никогда не используйте шприц для извлечения препарата из шприц-ручки.
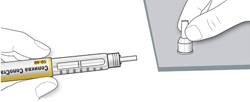
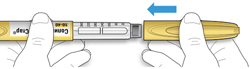
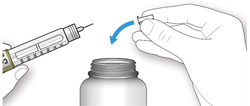
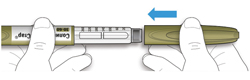
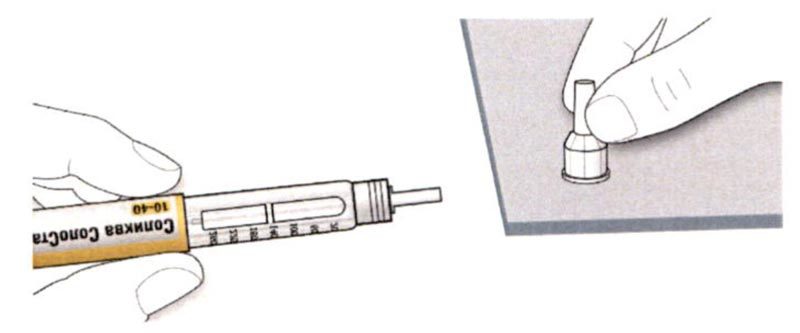
ШАГ 6: Удаление иглы
- Будьте осторожны при обращении с иглами — это предотвратит повреждение иглой и перекрестную инфекцию.
- Никогда не надевайте внутренний колпачок иглы назад на использованную иглу.
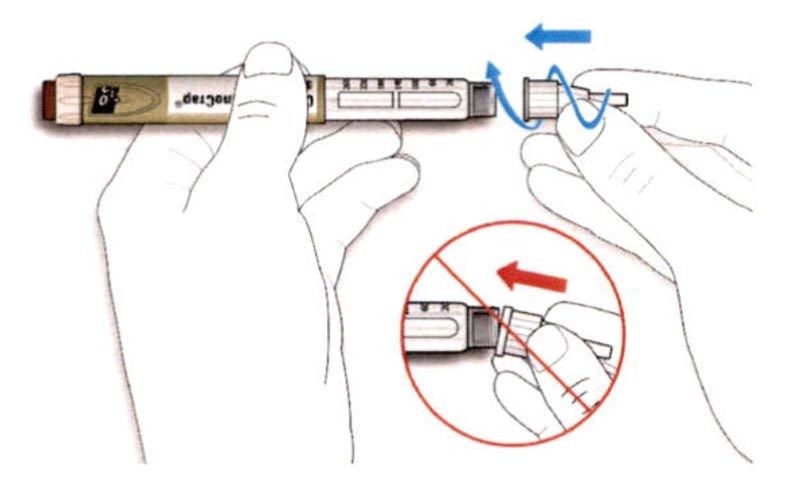
A. Возьмите наружный колпачок иглы двумя пальцами. Держите иглу прямо и введите ее в наружный колпачок иглы.
- Если игла будет введена в колпачок под углом, она может его проткнуть.
B. Крепко обхватите широкую часть наружного колпачка иглы. Прокрутите Вашу шприц-ручку несколько раз другой рукой, чтобы снять иглу.
- Если игла не снялась с первого раза, повторите попытку.
C. Выбросьте использованную иглу в резистентный к проколам контейнер (см. раздел «Утилизация шприц-ручки»)
D. Закройте шприц-ручку ее колпачком
- Не помещайте шприц-ручку в холодильник
Срок использования
- Шприц-ручку можно применять только в течение 4 недель после начала использования.
Как хранить шприц-ручку
Перед первым использованием
- Храните новые шприц-ручки в холодильнике при температуре 2-8°C.
- Шприц-ручки нельзя замораживать.
После первого использования
- Храните шприц-ручку при температуре ниже 25 °C.
- Не помещайте шприц-ручку обратно в холодильник.
- Не нагревайте шприц-ручку.
- Не подвергайте шприц-ручку воздействию прямого света.
- Никогда не храните шприц-ручку с присоединенной иглой.
- Храните шприц-ручку, закрытой колпачком, для защиты от света.
- Шприц-ручку можно применять только в течение 4 недель после начала использования.
Обращение со шприц-ручкой
Обращайтесь со шприц-ручкой с осторожностью.
- Не роняйте шприц-ручку, избегайте ее удара о твердые поверхности.
- Если Вы думаете, что шприц-ручка, возможно, повреждена, не пытайтесь починить ее, используйте новую шприц-ручку.
Предохраняйте шприц-ручку от попадания пыли и грязи.
- Вы можете очищать наружную поверхность шприц-ручки, протирая ее влажной тканью. Не замачивайте, не мойте и не смазывайте шприц-ручку – это может повредить ее.
Утилизация шприц-ручки
- Снимите иглу, перед тем как выбросить шприц-ручку.
- Утилизируйте использованные шприц-ручки согласно указаниям медицинского работника.
В шприц-ручках Соликва СолоСтар® содержится инсулин гларгин и ликсисенатид в фиксированном соотношении.
Лекарственная комбинация в шприц-ручке Соликва СолоСтар® 30-60 предназначена для ежедневного введения от 30 до 60 ЕД инсулина гларгин и от 10 мкг до 20 мкг ликсисенатида.
- Никогда не используйте иглы повторно. В случае повторного использования иглы Вы можете не получить нужную Вам дозу (введение меньшей дозы) или получить слишком большую дозу (передозировка), т.к. возможна закупорка иглы.
- Никогда не используйте шприц для извлечения препарата из шприц-ручки. При использовании шприца Вы не сможете получить правильное количество препарата.
Сохраните эту инструкцию для обращения к ней за справками в будущем.
Важная информация
- Никогда не пользуйтесь одной шприц-ручкой одновременно с другим человеком — она предназначена для индивидуального использования.
- Никогда не пользуйтесь шприц-ручкой, если она повреждена, или Вы не уверены в том, что она исправна.
- Всегда проводите тест на безопасность.
- Всегда имейте при себе запасную шприц-ручку и запасные иглы, на тот случай, если они потеряются или станут неисправными.
- Перед тем как начать пользоваться шприц-ручкой, узнайте у медицинского работника, как правильно проводить подкожную инъекцию.
- В случае наличия у Вас затруднений при обращении с этой шприц-ручкой, например, в случае проблем со зрением, Вам может потребоваться помощь других лиц, способных следовать всем рекомендациям данной инструкции по пользованию шприц-ручкой Соликва СолоСтар®.
- Перед использованием шприц-ручки, прочитайте эту инструкцию. Если Вы не будете следовать всем ее рекомендациям, Вы можете получить или слишком много или слишком мало препарата.
Дополнительные средства, которые Вам потребуются:
- Новая стерильная игла (см. ШАГ 2).
- Спиртовая салфетка.
- Резистентный к проколам контейнер для использованных игл и шприц-ручек (см. раздел «Утилизация шприц-ручек»).
Указание мест для проведения инъекций
Внешний вид шприц-ручки Соликва СолоСтар® 30-60
* Вы можете не видеть плунжер, пока не введете несколько доз.
ШАГ 1: Проверка шприц-ручки
Выньте новую шприц-ручку из холодильника не менее чем за 1 час до проведения инъекции. Введение холодного препарата является более болезненным.
А. Проверка названия и срока годности на этикетке шприц-ручки.
- Удостоверьтесь в том, что у Вас правильный (нужный Вам) препарат. Шприц-ручка Соликва СолоСтар® 30-60 имеет оливковый цвет.
- Не используйте шприц-ручку Соликва СолоСтар® 30-60, если Вы нуждаетесь в суточной дозе менее 30 единиц или больше 60 единиц препарата.
- Не используйте шприц-ручку после окончания срока годности.
В. Снимите колпачок со шприц-ручки.
С. Проверьте прозрачность препарата.
- Не используйте шприц-ручку, если раствор препарата мутный, имеет окраску или содержит частицы.
D. Протрите резиновую герметизирующую пробку спиртовой салфеткой.
Если у Вас имеются другие шприц-ручки
- Если Вы имеете другие шприц-ручки, особенно важно удостоверится в том, что Вы взяли правильный (нужный Вам) препарат.
ШАГ 2: Присоединение новой иглы
- Не используйте иглы повторно. Всегда используйте новую стерильную иглу для каждой инъекции. Это поможет предотвратить закупорку иглы, контаминацию иглы и инфекцию.
- Всегда используйте иглы, которые совместимы со шприц ручкой Соликва СолоСтар®, например, иглы компаний BD Микро-Файн® Плюс (BD Micro-Fine® Plus), Юнифайн® Пентипс® Плюс (Unifine®Pentips®Plus), Инсупен (Insupen).
A. Возьмите новую иглу и удалите защитное покрытие.
B. Держите иглу прямо перед шприц-ручкой и прикрутите ее на шприц-ручку до фиксации. Не прилагайте чрезмерных усилий при прикручивании иглы.
C. Снимите наружный колпачок иглы. Сохраните его для использования в дальнейшем.
D. Снимите внутренний колпачок с иглы и выбросьте его.
Обращение с иглами
- Будьте осторожны при обращении с иглами – это предотвратит повреждение иглой и перекрестное инфицирование.
ШАГ 3: Проведите тест на безопасность
Обязательно перед каждой инъекцией проводите тест на безопасность – он проводится для проверки того, что шприц-ручка и игла работают надлежащим образом, а также для того чтобы быть уверенным, что Вы введете правильную дозу препарата.
A. Наберите 2 единицы препарата путем вращения селектора дозы до того момента, когда указатель дозы не окажется на отметке 2.
B. Нажмите до упора на кнопку проведения инъекции.
- Если препарат выходит из кончика иглы, шприц-ручка работает правильно.
Если жидкость не показывается из кончика иглы:
- Вам может потребоваться повторить этот шаг до 3-х раз, перед тем как покажется препарат.
- Если препарат не выходит из кончика иглы после третьего повтора этого шага, возможно, имеет место закупорка иглы. Если это произошло:
- Замените иглу (см. ШАГ 6 и ШАГ 2).
- Затем повторите тест на безопасность (см. ШАГ 3).
- Не используйте шприц-ручку, если препарат все же не выходит из кончика иглы. Используйте новую шприц-ручку.
- Никогда не используйте шприц для извлечения препарата из шприц-ручки.
Если Вы видите пузырьки воздуха
- Вы можете видеть пузырьки воздуха в препарате. Это нормально, они не причинят Вам вреда.
ШАГ 4: Набор дозы
- Используйте шприц-ручку только для введения однократной суточной дозы от 30 до 60 единиц препарата.
- Никогда не набирайте дозу и нажимайте на кнопку введения дозы без присоединенной иглы. Это может повредить шприц-ручку.
A. Удостоверьтесь в том, что игла присоединена и доза установлена на «0».
B. Вращайте селектор дозы до тех пор, пока указатель дозы не окажется на одной линии с нужной Вам дозой.
- Если Вы провернули селектор дозы дальше нужной Вам дозы, то можно повернуть его назад.
- Если в шприц-ручке нет достаточного количества единиц препарата для нужной Вам дозы, селектор дозы остановится на количестве оставшихся в шприц-ручке единиц препарата.
- Если Вы не можете набрать всю назначенную Вам дозу, используйте новую шприц-ручку или введите оставшиеся в шприц-ручке единицы препарата и используйте новую шприц-ручку для того, чтобы ввести недостающие единицы препарата до полной дозы. Только в этом случае допускается введение оставшейся дозы менее 10 единиц препарата. Всегда используйте другую шприц-ручку Соликва СолоСтар® 30-60, чтобы дополнить необходимую Вам дозу, а не шприц-ручку Соликва СолоСтар® 10-40.
Как читать показания окна дозы
- Не используйте шприц-ручку, если Ваша однократная суточная доза менее 30 единиц препарата, которые показываются в виде белых цифр на черном фоне.
Единицы препарата в шприц-ручке
- Шприц-ручка содержит в общей сложности 300 единиц препарата. Вы может набирать Вашу дозу с шагом в 1 единицу.
- Не используйте эту шприц-ручку, если Вы нуждаетесь в суточной дозе менее 30 единиц или более 60 единиц препарата.
- Каждая шприц-ручка содержит более одной дозы.
ШАГ 5: Введение дозы
- Если Вы испытываете затруднения при нажатии на кнопку ввода дозы, не применяйте силу, так как это может повредить шприц-ручку. За помощью обратитесь к ШАГУ 5E ниже.
A. Выберите место для инъекции, как показано на рисунке выше.
B. Введите иглу в кожу, как Вам было показано Вашим медицинским работником.
- Не прикасайтесь пока к кнопке ввода дозы.
C. Поместите большой палец на кнопку ввода дозы. Затем нажмите до упора и удерживайте в этом положении.
- Не нажимайте на кнопку ввода дозы под углом – большой палец может блокировать проворачивание селектора дозы.
D. Нажимайте на кнопку ввода дозы, и когда вы увидите «0» в окне дозы, медленно досчитайте до 10.
- Это будет гарантировать, что Вы ввели полную дозу.
E. После удерживания кнопки ввода дозы и счета до 10 отпустите кнопку ввода. Затем извлеките иглу из кожи.
Если возникают затруднения при нажимании на кнопку ввода
- Смените иглу (см. ШАГ 6 и ШАГ 2), затем проведите тест на безопасность (см. ШАГ 3).
- Если все равно сохраняются затруднения при нажатии на кнопку ввода, возьмите новую шприц-ручку.
- Никогда не используйте шприц для извлечения препарата из шприц-ручки.
ШАГ 6: Удаление иглы
- Будьте осторожны при обращении с иглами – это предотвратит повреждение иглой и перекрестную инфекцию.
- Никогда не надевайте внутренний колпачок иглы назад на использованную иглу.
A. Возьмите наружный колпачок иглы двумя пальцами. Держите иглу прямо и введите ее в наружный колпачок иглы.
- Если игла будет введена в колпачок под углом, она может его проткнуть.
B. Крепко обхватите широкую часть наружного колпачка иглы. Прокрутите Вашу шприц-ручку несколько раз другой рукой, чтобы снять иглу.
- Если игла не снялась с первого раза, повторите попытку.
C. Выбросьте использованную иглу в резистентный к проколам контейнер (см. раздел «Утилизация шприц-ручки»).
D. Закройте шприц-ручку ее колпачком.
- Не помещайте шприц-ручку в холодильник.
Срок использования
- Шприц-ручку можно применять только в течение 4 недель после начала использования.
Как хранить шприц-ручку
Перед первым использованием
- Храните новые шприц-ручки в холодильнике при температуре 2-8°C.
- Шприц-ручки нельзя замораживать.
После первого использования
- Храните шприц-ручку при температуре ниже 25 °C.
- Не помещайте шприц-ручку обратно в холодильник.
- Не нагревайте шприц-ручку.
- Не подвергайте шприц-ручку воздействию прямого света.
- Никогда не храните шприц-ручку с присоединенной иглой.
- Храните шприц-ручку, закрытой колпачком, для защиты от света.
- Шприц-ручку можно применять только в течение 4 недель после начала использования.
Обращение со шприц-ручкой
Обращайтесь со шприц-ручкой с осторожностью.
- Не роняйте шприц-ручку, избегайте ее удара о твердые поверхности.
- Если Вы думаете, что шприц-ручка, возможно, повреждена, не пытайтесь починить ее, используйте новую шприц-ручку.
Предохраняйте шприц-ручку от попадания пыли и грязи
- Вы можете очищать наружную поверхность шприц-ручки, протирая ее влажной тканью. Не замачивайте, не мойте и не смазывайте шприц-ручку – это может повредить ее.
Утилизация шприц-ручки
- Снимите иглу, перед тем как выбросить шприц-ручку.
- Утилизируйте использованные шприц-ручки согласно указаниям медицинского работника.
Побочное действие
Наиболее частыми нежелательными реакциями (НР) во время лечения препаратом Соликва СолоСтар® являлись гипогликемия и НР со стороны желудочно-кишечного тракта (см. раздел «Описание отдельных нежелательных реакций» ниже).
НР, связанные с применением препарата и наблюдавшиеся в ходе клинических исследований, представлены по системно-органным классам в порядке убывания частоты их развития очень часто (≥10%); часто (≥1%; <10%); нечасто (≥ 0.1%; <1%); редко (≥ 0.01%; <0.1%); очень редко ( <0.01%), частота неизвестна (определить частоту встречаемости НР по имеющимся данным не представляется возможным).
Описание отдельных НР
Гипогликемия
Эпизоды тяжелой гипогликемии, особенно, если они возникают повторно, могут привести к развитию неврологических нарушений. Случаи длительной или тяжелой гипогликемии могут представлять угрозу для жизни.
У многих пациентов признакам и симптомам нейрогликопении — недостатка глюкозы в головном мозге (чувство усталости, неадекватная утомляемость или слабость, снижение способности к концентрации внимания, сонливость, зрительные расстройства, головная боль, тошнота, спутанность или потеря сознания, судороги) предшествуют признаки адренергической контррегуляции (активации симпатической нервной системы в ответ на гипогликемию): чувство голода, раздражительность, нервное возбуждение или тремор, беспокойство, бледность, «холодный» пот, тахикардия, ощущение сердцебиения. В целом, чем значительнее и быстрее происходит снижение концентрации глюкозы крови, тем сильнее выражена адренергическая контррегуляция и ее проявления.
Документированные гипогликемические НР, протекающие с клинической симптоматикой, или тяжелые гипогликемические НР
* Документированная, протекающая с клинической симптоматикой гипогликемия была эпизодом, во время которого типичные симптомы гипогликемии сочетались с установленной плазменной концентрацией глюкозы в крови ≤ 70 мг/дл (3.9 ммоль/л).
** Тяжелая, протекающая с клинической симптоматикой гипогликемия была эпизодом, потребовавшим помощи других людей для того, чтобы активно ввести углеводы, глюкагон или провести другие мероприятия, направленные на поддержание основных жизненных функций организма.
Нарушения со стороны ЖКТ
НР со стороны ЖКТ (тошнота, рвота и диарея) часто регистрировались во время лечения. У пациентов, получающих лечение препаратом Соликва СолоСтар®, частота случаев тошноты, диареи и рвоты, связанных с лечением, составляла 8.4%, 2.2% и 2.2% (в клинических исследованиях LixiLan-O и LixiLan-L) и 5.5%, 0.8% и 1.2% соответственно (в клиническом исследовании LixiLan-G). НР со стороны ЖКТ в основном были умеренно выраженными и преходящими. У пациентов, получавших лечение ликсисенатидом, частота тошноты, диареи и рвоты, связанных с лечением, составляла 22.3%, 3% и 3.9% соответственно.
Нарушения со стороны иммунной системы
Сообщалось о развитии аллергической реакции (крапивница), возможно связанной с применением препарата Соликва СолоСтар®, у 0.3% пациентов.
Во время пострегистрационного применения инсулина гларгин и ликсисенатида наблюдались случаи генерализованных аллергических реакций, включая анафилактические реакции и ангионевротический отек.
Иммуногенность (образование антител)
Применение препарата Соликва СолоСтар® может привести к образованию антител к инсулину гларгин и/или ликсисенатиду (см. раздел «Особые указания»).
После 30 недель лечения препаратом Соликва СолоСтар® в двух исследованиях фазы 3 (LixiLan-O и LixiLan-L) частота образования антител к инсулину гларгин составляла 21.0% и 26.2%. Примерно у 93% пациентов антитела к инсулину гларгин продемонстрировали перекрестную реактивность c человеческим инсулином. Частота образования антител к ликсисенатиду составляла приблизительно 43%. Наличие антител к инсулину гларгин и ликсисенатиду не оказывало клинически значимого влияния на безопасность или эффективность. В третьем клиническом исследовании 3 фазы (LixiLan-G) через 26 недель лечения у пациентов, получавших препарат Соликва СолоСтар®, частота формирования антител к инсулину гларгин и ликсисенатиду составляла 17.4% и 44.5% соответственно.
Реакции в месте введения
У некоторых пациентов (1.7%), получающих инсулинотерапию, включая препарат Соликва СолоСтар®, наблюдались эритема, локальный отек, зуд в месте инъекции. Эти явления обычно постепенно уменьшались и проходили без лечения.
ЧСС
При применении агонистов рецепторов ГПП1 сообщалось об увеличении ЧСС, а в некоторых исследованиях ликсисенатида также наблюдалось временное увеличение ЧСС. В плацебо-контролируемых клинических исследованиях III фазы было показано отсутствие повышения средних значений ЧСС.
Липодистрофия
П/к введение инъекционных препаратов, содержащих инсулин, может привести к развитию липоатрофии в месте инъекции (уменьшения подкожно-жировой ткани) или липогипертрофии (повышения плотности тканей). С целью уменьшения риска развития липодистрофии место инъекций следует менять при каждой новой инъекции в пределах одной из рекомендуемых областей (см. раздел «Режим дозирования».)
Противопоказания к применению
- гиперчувствительность к ликсисенатиду, инсулину гларгин или любому из вспомогательных веществ, входящих в состав препарата;
- сахарный диабет 1 типа;
- диабетический кетоацидоз;
- тяжелые заболевания желудочно-кишечного тракта (ЖКТ), включая гастропарез;
- почечная недостаточность тяжелой степени (КК менее 30 мл/мин);
- беременность;
- период грудного вскармливания;
- возраст до 18 лет (в связи с отсутствием данных по эффективности и безопасности применения в данной возрастной группе).
С осторожностью
- Панкреатит в анамнезе (из-за содержания в составе препарата ликсисенатида).
- У пациентов, одновременно принимающих препараты, требующие быстрой абсорбции из ЖКТ, имеющие узкий терапевтический индекс или нуждающиеся в тщательном клиническом мониторинге.
Применение при беременности и кормлении грудью
Беременность
Отсутствуют данные контролируемых клинических исследований по применению в период беременности препарата Соликва СолоСтар®, инсулина гларгин или ликсисенатида.
В исследованиях на животных была продемонстрирована репродуктивная токсичность ликсисенатида; отсутствие эмбриотоксичности и тератогенности инсулина гларгин.
Потенциальный риск для человека неизвестен. Препарат Соликва СолоСтар® противопоказан при беременности (из-за содержания в составе препарата ликсисенатида).
При планировании беременности или ее наступлении лечение препаратом Соликва СолоСтар® следует прекратить.
Период грудного вскармливания
Нет данных о проникновении в грудное молоко человека инсулина гларгин или ликсисенатида. Применение препарата Соликва СолоСтар® в период грудного вскармливания противопоказано.
Фертильность
Исследования, проведенные на животных с инсулином гларгин и ликсисенатидом, не показали их непосредственного неблагоприятного воздействия на фертильность.
Применение при нарушениях функции печени
У пациентов с печеночной недостаточностью может потребоваться частый мониторинг концентрации глюкозы в крови и коррекция дозы препарата Соликва СолоСтар®.
Применение при нарушениях функции почек
Противопоказание: почечная недостаточность тяжелой степени (КК менее 30 мл/мин).
Применение у детей
Противопоказание: возраст до 18 лет (в связи с отсутствием данных по эффективности и безопасности применения в данной возрастной группе).
Применение у пожилых пациентов
Препарат Соликва СолоСтар® можно применять у пациентов в возрасте ≥ 65 лет. Доза должна корректироваться индивидуально, исходя из мониторинга концентраций глюкозы в крови. Опыт применения препарата у пациентов в возрасте ≥ 75 лет ограничен.
Особые указания
Препарат Соликва СолоСтар® противопоказан у пациентов с сахарным диабетом 1 типа или для лечения кетоацидоза.
Гипогликемия
Гипогликемия является наиболее частой нежелательной реакцией во время лечения препаратом Соликва СолоСтар®. Гипогликемия может наблюдаться, если доза препарата Соликва СолоСтар® выше, чем потребность в нем.
Факторы, повышающие предрасположенность к гипогликемии, требуют тщательного мониторинга и могут потребовать коррекцию режима дозирования. К этим факторам относятся:
- изменение места инъекции;
- повышение чувствительности к инсулину (например, из-за прекращения действия стрессовых факторов);
- непривычные, более тяжелые или более длительные физические нагрузки;
- сопутствующие заболевания (например, рвота, диарея);
- недостаточное потребление пищи;
- пропуск приема пищи;
- употребление алкоголя (этанола);
- некоторые некомпенсированные эндокринные нарушения (такие как гипотиреоз и недостаточность гормонов передней доли гипофиза или коры надпочечников);
- сопутствующая терапия некоторыми лекарственными препаратами (см. раздел «Лекарственное взаимодействие»).
При одновременном применении ликсисенатида и/или инсулина с производными сульфонилмочевины повышен риск развития гипогликемии, в связи с чем, препарат Соликва СолоСтар® не следует применять в сочетании с препаратами сульфонилмочевины.
Пролонгированное действие введенного п/к инсулина гларгин может замедлить выход пациента из состояния гипогликемии.
Дозу препарату Соликва СолоСтар® следует подбирать индивидуально по клиническому эффекту и титроваться, исходя из потребности пациента в инсулине (см. раздел «Режим дозирования»).
Острый панкреатит
Применение агонистов рецепторов ГПП1 связано с риском развития острого панкреатита. Зарегистрировано несколько случаев острого панкреатита при применении ликсисенатида, хотя не было установлено причинно-следственной взаимосвязи между ними. Пациенты должны быть проинформированы о характерных симптомах панкреатита: длительно сохраняющиеся (персистирующие) сильные боли в животе. При подозрении на панкреатит применение препарата Соликва СолоСтар® следует прекратить. При подтверждении диагноз острого панкреатита, не следует возобновлять лечение препаратом Соликва СолоСтар®. Препарат Соликва СолоСтар® следует применять с осторожностью у пациентов с панкреатитом в анамнезе.
Применение у пациентов с тяжелым заболеваниями ЖКТ
Применение агонистов рецепторов ГПП1 может быть связано с развитием НР со стороны ЖКТ. Препарат Соликва СолоСтар® не изучался у пациентов с тяжелыми заболеваниями ЖКТ, включая тяжелый гастропарез, и поэтому применение препарата Соликва СолоСтар® у данных пациентов противопоказано.
Почечная недостаточность тяжелой степени
Отсутствует терапевтический опыт применения препарата у пациентов с почечной недостаточностью тяжелой степени (КК менее 30 мл/мин) или с терминальной стадией почечной недостаточности. Применение препарата противопоказано у пациентов с почечной недостаточностью тяжелой степени (КК менее 30 мл/мин) или терминальной почечной недостаточностью.
Одновременное применение лекарственных препаратов
Замедление опорожнения желудка ликсисенатидом может замедлять скорость абсорбции лекарственных препаратов, принимаемых внутрь. Препарат Соликва СолоСтар® следует применять с осторожностью у пациентов, принимающих внутрь лекарственные препараты, которые требуют быстрого всасывания в желудочно-кишечном тракте, требуют тщательного клинического контроля или имеют узкий терапевтический индекс (см. раздел «Лекарственное взаимодействие»).
Дегидратация
Пациентов, получающих лечение препаратом Соликва СолоСтар®, следует информировать о потенциальном риске дегидратации в связи с развитием НР со стороны ЖКТ и о соблюдении мер предосторожности во избежание потери жидкости.
Образование антител
Применение препарата Соликва СолоСтар® может вызывать образование антител к инсулину гларгин и/или ликсисенатиду. В редких случаях наличие таких антител может потребовать изменения дозы препарата Соликва СолоСтар® с целью коррекции тенденции к развитию гипер- или гипогликемии.
Предотвращение ошибок при введении препарата
Пациенты должны быть проинструктированы о необходимости всегда проверять этикетку шприц-ручки перед каждым введением препарата, чтобы избежать случайного перепутывания между собой двух шприц-ручек Соликва СолоСтар®, имеющих различные концентрации действующих веществ, или перепутывания с другими шприц-ручками с другими инъекционными противодиабетическими препаратами.
Для того чтобы избежать ошибок дозирования препарата и передозировки, пациенты и медицинские работники никогда не должны использовать шприц для извлечения препарата из картриджа предварительно заполненной шприц-ручки Соликва СолоСтар®.
Дополнительная информация
Не изучалось одновременное применение препарата Соликва СолоСтар® с ингибиторами дипептидилпептидазы IV, производными сульфонилмочевины, глинидами, пиоглитазоном.
Вспомогательные вещества
Препарат Соликва СолоСтар® содержит метакрезол, который может вызывать развитие аллергических реакций.
Влияние на способность к управлению транспортными средствами и механизмами
Способность пациента к концентрации внимания и его реакция могут быть нарушены в результате развития гипогликемии или гипергликемии, или в результате нарушения зрения. Это может представлять риск в ситуациях, когда эти способности имеют особое значение (например, при управлении транспортными средствами или работе с механизмами).
Пациентам следует рекомендовать принимать меры предосторожности для того, чтобы избежать развития гипогликемии во время управления транспортными средствами. Это особенно важно у тех пациентов, у которых ослаблено или отсутствует распознавание симптомов, предвещающих развитие гипогликемии, или у пациентов с частыми эпизодами гипогликемии. В таких случаях должен быть рассмотрен вопрос о целесообразности управления транспортными средствами или механизмами.
Передозировка
Симптомы: имеются ограниченные клинические данные в отношении передозировки препарата Соликва СолоСтар®. Возможно развитие гипогликемии НР со стороны ЖКТ в случае превышения требуемой дозы препарата Соликва СолоСтар®.
Лечение: эпизоды гипогликемии легкой степени выраженности обычно могут купироваться приемом легкоусвояемых углеводов внутрь. Может потребоваться коррекция дозы препарата, диеты или интенсивности физической нагрузки.
Более тяжелые эпизоды гипогликемии, вплоть до развития комы, судорог или неврологических нарушений могут купироваться внутримышечным/подкожным введением глюкагона или в/в введением концентрированного раствора декстрозы (глюкозы). Может потребоваться длительный прием углеводов и наблюдение врача, т.к. после видимого клинического улучшения возможен рецидив гипогликемии.
В зависимости от клинических проявлений и симптомов следует начать терапию, поддерживающую основные жизненные функции, а доза препарата Соликва СолоСтар® должна быть снижена до предписанной пациенту дозы.
Лекарственное взаимодействие
Исследования по взаимодействию препарата Соликва СолоСтар® с другими лекарственными средствами не проводились.
Инсулин гларгин
Ряд лекарственных средств влияет на метаболизм глюкозы, вследствие чего при их одновременном применении с инсулином может потребоваться коррекция дозы инсулина и особенно тщательное наблюдение, включая мониторинг концентрации глюкозы в крови.
- Лекарственные средства, которые могут увеличивать гипогликемическое действие инсулина и склонность к развитию гипогликемии: пероральные гипогликемические препараты, ингибиторы ангиотензинпревращающего фермента (АПФ), салицилаты, дизопирамид; фибраты; флуоксетин, ингибиторы моноаминоксидазы (MAO); пентоксифиллин; пропоксифен; противомикробные средства из группы сульфаниламидов.
- Лекарственные средства, которые могут ослаблять гипогликемическое действие инсулина: глюкокортикостероиды и минералокортикостероиды, даназол, диазоксид, диуретики, симпатомиметические препараты (такие как эпинефрин, сальбутамол, тербуталин); глюкагон, изониазид, производные фенотиазина; соматропин; гормоны щитовидной железы; эстрогены, прогестагены (например, в составе пероральных контрацептивов), ингибиторы протеаз и атипичные нейролептики (например, оланзапин и клозапин).
- Бета-адреноблокаторы, клонидин, соли лития и этанол могут, как усиливать, так и ослаблять гипогликемический эффект инсулина.
- Пентамидин может вызывать гипогликемию, после которой в некоторых случаях может развиваться гипергликемия.
Помимо этого, под воздействием симпатолитических лекарственных средств, таких как бета-адреноблокаторы, клонидин, гуанетидин и резерпин, признаки адренергической контррегуляции (активации симпатической нервной системы в ответ на гипогликемию) могут быть менее выражены или отсутствовать.
Ликсисенатид
Ликсисенатид является пептидом и не метаболизируется с помощью изоферментов системы цитохрома P450. В исследованиях in vitro ликсисенатид не влиял на активность протестированных изоферментов системы цитохрома P450 или транспортеров у человека.
Влияние задержки опорожнения желудка на абсорбцию принимаемых внутрь лекарственных препаратов
Задержка опорожнения желудка при применении ликсисенатида может уменьшить скорость абсорбции лекарственных препаратов, принимаемых внутрь. Следует соблюдать осторожность при одновременном приеме внутрь лекарственных препаратов с узким терапевтическим диапазоном или требующих тщательного клинического мониторинга. Если такие препараты следует принимать во время еды, пациентам следует рекомендовать их прием с тем приемом пищи, когда не вводится ликсисенатид. Лекарственные препараты для приема внутрь, эффективность которых особенно зависит от пороговых концентраций, такие как антибиотики, следует принимать не менее чем за 1 ч до или через 4 ч после инъекции препарата Соликва СолоСтар®.
Гастрорезистентные препараты следует принимать не менее чем за 1 ч до или через 4 ч после инъекции препарата Соликва СолоСтар®.
С парацетамолом
Коррекции доза парацетамола при одновременном применении с препаратом Соликва СолоСтар® не требуется, однако в случае необходимости быстрого начала действия парацетамола, его следует принимать через 1-4 ч после инъекции препарата Соликва СолоСтар® в виду возможного увеличения Tmax парацетамола в плазме крови.
С пероральными контрацептивными препаратами
Пациенткам, применяющим пероральные контрацептивные препараты, следует рекомендовать принимать не менее чем за 1 ч до или через 11 ч после инъекции препарата Соликва СолоСтар®.
С аторвастатином
Пациентам, принимающим аторвастатин, следует рекомендовать его прием не менее чем за 1 ч до или через 11 ч после инъекции препарата Соликва СолоСтар®.
С варфарином
Коррекции дозы варфарина при его совместном применении с препаратом Соликва СолоСтар® не требуется, однако рекомендуется частый мониторинг МНО в начале и после окончания терапии препаратом Соликва СолоСтар®.
С дигоксином
Коррекции дозы дигоксина при его совместном применении с препаратом Соликва СолоСтар® не требуется.
С рамиприлом
Коррекции дозы рамиприла при его совместном применении с препаратом Соликва СолоСтар® не требуется.
Условия хранения препарата Соликва СолоСтар®
Препарат следует хранить в недоступном для детей, защищенном от света месте, при температуре от 2° до 8°С. Не замораживать.
Срок годности препарата Соликва СолоСтар®
Срок годности — 2 года. Не применять препарат после истечения срока годности
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
САНОФИ РОССИЯ АО
(Россия)

|
|
Организация, принимающая претензии потребителей: |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Описание препарата Ликсумия® (раствор для подкожного введения, 0.05 мг/мл (10 мкг/доза)) основано на официальной инструкции, утверждено компанией-производителем в 2017 году
Дата согласования: 29.09.2017
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Отзывы
Фотографии упаковок
29.09.2017
Действующее вещество
ATX
Фармакологическая группа
Состав
| Раствор для подкожного введения |
| Компоненты | Раствор 0,05 мг/мл (10 мкг/доза) | Раствор 0,1 мг/мл (20 мкг/доза) | ||
| Содержание в 1 мл | Содержание в 1 дозе | Содержание в 1 мл | Содержание в 1 дозе | |
| Активное вещество | ||||
| Ликсисенатид, мг | 0,05 | 0,01 | 0,1 | 0,02 |
| Вспомогательные вещества | ||||
| Глицерол 85%, мг | 18 | 3,6 | 18 | 3,6 |
| Натрия ацетата тригидрат, мг | 3,5 | 0,7 | 3,5 | 0,7 |
| Метионин, мг | 3 | 0,6 | 3 | 0,6 |
| Метакрезол, мг | 2,7 | 0,54 | 2,7 | 0,54 |
| 1 М раствор хлористоводородной кислоты или 1 М раствор натрия гидроксида | до pH 4,5 | до pH 4,5 | до pH 4,5 | до pH 4,5 |
| Вода для инъекций | до 1 мл | до 0,2 мл | до 1 мл | до 0,2 мл |
Описание лекарственной формы
Раствор: прозрачная бесцветная жидкость.
Фармакологическое действие
Фармакологическое действие
—
гипогликемическое.
Фармакодинамика
Механизм действия
Ликсисенатид является сильным и селективным агонистом рецепторов глюкагоноподобного пептида-1 (ГПП-1). Рецептор ГПП-1 является мишенью для нативного ГПП-1, эндогенного гормона внутренней секреции, который потенцирует глюкозозависимую секрецию инсулина бета-клетками панкреатических островков. Действие ликсисенатида связано с его специфическим взаимодействием с рецепторами ГПП-1, приводящим к увеличению внутриклеточного содержания цАМФ. Ликсисенатид стимулирует секрецию инсулина бета-клетками панкреатических островков в ответ на гипергликемию. При снижении концентрации глюкозы в крови до нормальных значений стимуляция секреции инсулина прекращается, что уменьшает риск развития гипогликемии. При гипергликемии ликсисенатид одновременно подавляет секрецию глюкагона, однако при этом сохраняется защитная реакция секреции глюкагона в ответ на гипогликемию.
Показана тенденция к инсулинотропной активности ликсисенатида, включая увеличение биосинтеза инсулина и стимуляцию бета-клеток панкреатических островков у животных. Ликсисенатид замедляет опорожнение желудка, уменьшая за счет этого скорость повышения концентрации глюкозы в крови после приема пищи. Влияние на опорожнение желудка может также способствовать снижению массы тела.
Фармакодинамические эффекты
При введении 1 раз в сутки пациентам с сахарным диабетом типа 2 ликсисенатид улучшает гликемический контроль за счет быстро развивающегося после его введения и продолжительного снижения концентрации глюкозы в крови после еды и натощак. Этот эффект ликсисенатида на концентрацию глюкозы в крови после еды был подтвержден в 4-недельном исследовании, в котором проводилось сравнение применения ликсисенатида с применением лираглутида 1,8 мг 1 раз в сутки. Ликсисенатид в дозе 20 мкг 1 раз в сутки продемонстрировал большее снижение площади под кривой концентрации глюкозы в крови после стандартного приема пищи по сравнению с применением лираглутида 1,8 мг один раз в сутки: уменьшение по сравнению с исходным значением AUC0:30–4:30 ч для концентрации глюкозы в крови после стандартного приема пищи составляло: −227,25 ч·мг/дл (−12,61 ч·ммоль/л) в группе ликсисенатида и −72,83 ч·мг/дл (−4,04 ч·ммоль/л) в группе лираглутида.
Клиническая эффективность и безопасность
Влияние препарата Ликсумия® на гликемический контроль было изучено в 6 рандомизированных двойных слепых, плацебо-контролируемых клинических исследованиях и одном рандомизированном, открытом, контролируемом активным препаратом (эксенатид) исследовании, в которые, в общей сложности, вошло 3825 пациентов с сахарным диабетом типа 2 (ликсисенатид применялся у 2445 пациентов (48,2% мужчин и 51,8% женщин). 768 пациентов (447 пациентов были рандомизированы для приема ликсисенатида) были ≥ 65 лет и 103 пациента (57 пациентов были рандомизированы для приема ликсисенатида) ≥ 75 лет. Завершенные клинические исследования III фазы показали, что 90% пациентов к концу 24-недельного периода лечения продолжали лечение препаратом Ликсумия® в поддерживающей дозе 20 мкг 1 раз в сутки.
Влияние на гликемический контроль
При применении препарата Ликсумия® отмечено большее по сравнению с плацебо снижение показателя гликозилированного гемоглобина (HbA1C) в крови (независимо от сопутствующего лечения). Кроме этого, препарат Ликсумия® при однократном введении в течение суток показал не меньшее снижение показателя HbA1C, чем эксенатид при двукратном введении в течение суток. Это влияние на снижение показателя HbA1C сохранялось в долгосрочных исследованиях до 2 лет. Снижение показателя HbA1C было достоверным при ежедневном однократном введении препарата Ликсумия®, как утром, так и вечером.
Добавление ликсисенатида к лечению пероральными гипогликемическими препаратами
Препарат Ликсумия® в сочетании с метформином, пероральным гипогликемическим препаратом группы сульфонилмочевины или комбинациями этих препаратов в конце 24-недельного периода лечения по сравнению с плацебо, показал клинически и статистически значимое снижение показателя HbA1C, концентрации глюкозы в крови натощак и через 2 ч после еды (проба со стандартной пищевой нагрузкой).
Добавление ликсисенатида к монотерапии метформином
В плацебо-контролируемых исследованиях добавление ликсисенатида к метформину приводило к снижению показателя HbA1C на 0,83 и 0,42% при добавлении плацебо. Процент пациентов, достигших снижения показателя HbA1C до <7%, составлял 43% в группе ликсисенатида и 24% в группе плацебо.
В контролируемом активным препаратом (эксенатид) исследовании в конце основного 24-недельного периода лечения однократное в течение суток введение препарата Ликсумия® показало не меньшее снижение показателя HbA1C по сравнению с двукратным в течение суток введением эксенатида (соответственно на 0,79 и 0,96%); при этом наблюдался практически одинаковый процент пациентов, достигших снижения показателя HbA1C до <7%: 48,5% в группе ликсисенатида и 49,8% в группе эксенатида.
Добавление ликсисенатида к лечению одним из пероральных гипогликемических препаратов группы сульфонилмочевины в монотерапии и в сочетании с метформином
Добавление ликсисенатида к лечению одним из пероральных гипогликемических препаратов группы сульфонилмочевины в монотерапии и сочетании с метформином приводило к снижению показателя HbA1C на 0,85% по сравнению с таковым при добавлении плацебо, составляющим −0,1%. Процент пациентов, достигших снижения показателя HbA1C до <7%, составлял 36,4% при добавлении ликсисенатида и 13,5% при добавлении плацебо.
Добавление ликсисенатида к комбинированной терапии, включающей базальный инсулин
Препарат Ликсумия® при его совместном применении с базальным инсулином в монотерапии или комбинацией базального инсулина с метформином, или комбинацией базального инсулина с пероральным гипогликемическим препаратом группы сульфонилмочевины вызывал статистически значимое снижение показателя HbA1C и концентрации глюкозы через 2 ч после стандартного приема пищи по сравнению с плацебо. К концу основного 24-недельного периода лечения в группе препарата Ликсумия® по сравнению с группой плацебо наблюдалось большее снижение суточной дозы инсулина по сравнению с его дозами до добавления к лечению препарата Ликсумия®.
При добавлении ликсисенатида к лечению базальным инсулином в монотерапии или в комбинации с метформином наблюдалось снижение показателя HbA1C на 0,74% против −0,38% при добавлении плацебо, а при добавлении ликсисенатида к лечению базальным инсулином в монотерапии или комбинации с пероральным гипогликемическим препаратом группы сульфонилмочевины наблюдалось снижение показателя HbA1C на 0,77% против −0,11% при добавлении плацебо.
Влияние на концентрацию глюкозы в плазме крови натощак
В плацебо-контролируемых исследованиях средние значения снижения концентрации глюкозы в плазме крови натощак, достигаемого при лечении препаратом Ликсумия® к концу 24-недельного периода лечения, находились в диапазоне от −0,42 до −1,19 ммоль/л.
Влияние на постпрандиальную (после приема пищи) концентрацию глюкозы в крови
Лечение препаратом Ликсумия®, независимо от сопутствующей терапии, приводило к статистически превосходящему эффект плацебо снижению 2-часовой постпрандиальной (определяемой через 2 ч после стандартного приема пищи) концентрации глюкозы в крови. К концу 24-недельного периода лечения во всех исследованиях, в которых проводилось определение постпрандиальной концентрации глюкозы в крови, это снижение 2-часовой постпрандиальной концентрации глюкозы в крови находилось в диапазоне от −4,51 до −7,96 ммоль/л (по сравнению со значениями 2-часовой постпрандиальной концентрации глюкозы в крови до применения препарата Ликсумия®); у 26,2–46,8% пациентов наблюдались 2-часовые постпрандиальные концентрации глюкозы в крови ниже 7,8 ммоль/л.
Влияние на массу тела
Во всех контролируемых исследованиях лечение препаратом Ликсумия® в комбинации с метформином, базальным инсулином и/или пероральным гипогликемическим препаратом группы сульфонилмочевины к концу основного 24-недельного периода лечения приводило к среднему снижению массы тела до −2,96 кг, которое сохранялось в долгосрочных исследованиях до 2 лет. Снижение массы тела не зависело от возникновения тошноты и рвоты.
Влияние на функцию бета-клеток панкреатических островков
Препарат Ликсумия® улучшает функцию бета-клеток панкреатических островков, определяемую с помощью гомеостатической модели для оценки функции бета-клеток (HOMA-β, homeostatic model assessment). У пациентов с сахарным диабетом типа 2 (n=20) после однократного введения препарата Ликсумия® было продемонстрировано восстановление первой фазы секреции инсулина и улучшение второй фазы секреции инсулина в ответ на в/в болюсное введение глюкозы.
Влияние на ЧСС
В плацебо контролируемых клинических исследованиях III фазы не наблюдалось увеличение средних значений ЧСС.
В 4-недельном клиническом исследовании по сравнению с лираглутидом в группе ликсисенатида (20 мкг 1 раз в сутки) ЧСС уменьшалось в среднем на 3,6 уд./мин, а в группе лираглутида (1,8 мг 1 раз в сутки) ЧСС уменьшалось на 5,3 уд./мин.
Влияние на АД
В плацебо-контролируемых исследованиях III фазы наблюдалось снижение средних значений сАД и дАД на 2,1 мм рт. ст. и 1,5 мм рт. ст. соответственно.
Фармакокинетика
Абсорбция. После п/к введения ликсисенатида пациентам с сахарным диабетом типа 2 скорость его абсорбции является высокой и не зависит от введенной дозы. Независимо от дозы и того, вводился ли ликсисенатид однократно или ежедневно многократно, у пациентов с сахарным диабетом типа 2 медиана Tmax ликсисенатида в крови составляет 1–3,5 ч. Отсутствуют клинически значимые различия в скорости абсорбции ликсисенатида, когда он вводится п/к в область живота, бедра или плеча.
Распределение. Ликсисенатид имеет умеренную степень связи с белками крови у человека (55%). Независимо от вводимой дозы, Vd после п/к введения ликсисенатида у пациентов с сахарным диабетом типа 2 составляет 90–140 л после однократного введения и 90–120 л при повторном введении (в состоянии достижения Css ликсисенатида в крови).
Метаболизм. Как пептид ликсисенатид выводится с помощью гломерулярной фильтрации с последующей канальцевой реабсорбцией и метаболической деградацией, приводящей к образованию более мелких пептидов и аминокислот, которые повторно вовлекаются в белковый обмен.
Выведение. После повторного введения пациентам с сахарным диабетом типа 2 среднее значение T1/2 обычно находилось в диапазоне 1,5–4,5 ч, и среднее значение клиренса находилось в диапазоне 20–67 л/ч (в состоянии достижения Css ликсисенатида в крови).
Особые группы пациентов
Половая принадлежность. По данным анализа популяционных фармакокинетических данных, половая принадлежность не влияет на фармакокинетику ликсисенатида.
Пациенты пожилого возраста. По данным анализа популяционных фармакокинетических показателей у пациентов с сахарным диабетом типа 2 и анализа фармакокинетических исследований, проведенных у лиц пожилого возраста без сахарного диабета, возраст не оказывает клинически значимое воздействие на фармакокинетику ликсисенатида.
Этническая принадлежность. По данным фармакокинетических исследований, проведенных у лиц европеоидной расы, японцев и китайцев, этническая принадлежность не оказывает клинически значимый эффект на фармакокинетику ликсисенатида.
Печеночная недостаточность. Так как ликсисенатид выводится главным образом почками, не проводились никакие фармакокинетические исследования у пациентов с острым или хроническим нарушением функции печени. Не ожидается, что нарушение функции печени способно повлиять на фармакокинетику ликсисенатида.
Почечная недостаточность. Не наблюдались значимые различия в средних значениях клиренса, Cmax в крови и AUC ликсисенатида при нормальной функции почек и почечной недостаточности легкой степени. При увеличении степени тяжести недостаточности средние значения Cmax и AUC увеличивались.
Показания
Сахарный диабет типа 2 у взрослых для достижения гликемического контроля у пациентов, сахарный диабет которых не контролируется проводимой гипогликемической терапией.
Препарат Ликсумия® показан в комбинации со следующими пероральными гипогликемическими ЛС:
— метформин;
— пероральный гипогликемический препарат группы сульфонилмочевины;
— комбинация этих ЛС.
Препарат Ликсумия® показан в комбинации с базальным инсулином:
— в монотерапии;
— в комбинации с метформином;
— в комбинации с пероральным гипогликемическим препаратом группы сульфонилмочевины.
Противопоказания
гиперчувствительность к активному веществу или любому из вспомогательных веществ препарата;
сахарный диабет типа 1;
диабетический кетоацидоз;
тяжелые заболевания ЖКТ, включая гастропарез;
тяжелая почечная недостаточность (Cl креатинина менее 30 мл/мин);
беременность;
период грудного вскармливания;
дети и подростки до 18 лет.
С осторожностью: панкреатит в анамнезе.
Применение при беременности и кормлении грудью
Отсутствует достаточное количество данных по применению препарата Ликсумия® у беременных женщин. Исследования, проведенные у животных, продемонстрировали эмбрио- и фетотоксическое действие. Потенциальный риск применения препарата Ликсумия® во время беременности у человека неизвестен. Применение препарата Ликсумия® во время беременности противопоказано. Во время беременности рекомендуется применение инсулина. Если пациентка планирует беременность или у нее диагностирована беременность, лечение препаратом Ликсумия® следует прекратить.
Неизвестно, проникает ли ликсисенатид в грудное молоко. Применение препарата Ликсумия® противопоказано во время периода грудного вскармливания (в связи с отсутствием опыта применения).
Способ применения и дозы
П/к, в область бедра, брюшной стенки или плеча. Препарат Ликсумия® нельзя вводить в/в и в/м. Препарат Ликсумия® вводится 1 раз в сутки в пределах 1 ч до первого в течение дня приема пищи или в пределах 1 ч до вечернего приема пищи. В случае пропуска введения очередной дозы, ее следует ввести в пределах 1 ч до следующего приема пищи.
До использования шприц-ручка Ликсумия® должна храниться в холодильнике при температуре 2–8 °C в своей упаковке для того, чтобы защитить ее от воздействия света. После первого использования шприц-ручка Ликсумия® должна храниться при температуре не выше 30 °C. После каждого использования шприц-ручку Ликсумия® следует закрывать колпачком для того, чтобы защитить ее от воздействия света. Шприц-ручку Ликсумия® не следует хранить с присоединенной иглой. Не использовать шприц-ручку Ликсумия®, если она была заморожена. Шприц-ручка Ликсумия® подлежит утилизации через 14 дней. Для более подробной информации по проведению инъекций с помощью шприц-ручки Ликсумия® см. Описание шприц-ручек Ликсумия® и инструкция по их использованию.
Начальная доза составляет 10 мкг препарата Ликсумия® один раз в сутки в течение 14 дней. Затем доза препарата Ликсумия® должна быть увеличена до 20 мкг 1 раз в сутки. Эта доза является поддерживающей. Когда препарат Ликсумия® добавляется к уже проводимой терапии метформином, прием метформина может быть продолжен без изменения его дозы. Когда препарат Ликсумия® добавляется к уже проводимой терапии пероральным гипогликемическим препаратом группы сульфонилмочевины или комбинацией перорального гипогликемического препарата группы сульфонилмочевины и базального инсулина, для уменьшения риска развития гипогликемии можно рассмотреть вопрос о снижении дозы перорального гипогликемического препарата группы сульфонилмочевины или базального инсулина (см. «Особые указания»). Применение препарата Ликсумия® не требует специального мониторинга концентрации глюкозы в крови. Однако при применении его в комбинации с пероральным гипогликемическим препаратом группы сульфонилмочевины или базальным инсулином может потребоваться мониторинг концентрации глюкозы в крови или самоконтроль (контроль самим пациентом) концентрации глюкозы в крови для коррекции дозы перорального гипогликемического препарата группы сульфонилмочевины или базального инсулина.
Особые группы пациентов
Дети и подростки моложе 18 лет. В настоящее время безопасность и эффективность применения препарата Ликсумия® у пациентов моложе 18 лет не изучена.
Лица пожилого возраста. Не требуется коррекция дозы в зависимости от возраста пациента.
Печеночная недостаточность. Не требуется коррекция дозы у пациентов с печеночной недостаточностью.
Почечная недостаточность. Не требуется коррекция дозы у пациентов с легкой почечной недостаточностью (Cl креатинина 50–80 мл/мин) и умеренной почечной недостаточностью (Cl креатинина 30–50 мл/мин). Отсутствует терапевтический опыт применения препарата Ликсумия® у пациентов с тяжелой почечной недостаточностью (Cl креатинина менее 30 мл/мин) или с терминальной стадией почечной недостаточности, в связи с чем применение препарата Ликсумия® у этой группы пациентов противопоказано.
Описание шприц-ручек Ликсумия® и инструкция по их использованию
Перед использованием шприц-ручки Ликсумия® необходимо внимательно прочитать инструкцию и получить у лечащего врача информацию по правильной технике проведения инъекции. Если пациент не способен самостоятельно полностью следовать инструкции (например наличие серьезных проблем со зрением), следует использовать шприц-ручку только в том случае, если у пациента есть возможность воспользоваться помощью человека, который способен следовать инструкциям.
Препарат Ликсумия® выпускается в виде предварительно заполненных шприц-ручек для инъекций, в каждой из которых содержится 14 доз. Выпускается 2 вида шприц-ручек Ликсумия®, которые окрашены в разные цвета и имеют разный тактильный элемент на кнопке введения дозы и колпачке шприц-ручки: шприц-ручка с разовой дозой 20 мкг ликсисенатида в 0,2 мл имеет бордовый цвет и тактильный элемент в виде кругов, а шприц-ручка с разовой дозой 10 мкг ликсисенатида в 0,2 мл имеет зеленый цвет и тактильный элемент в виде линий.
С шприц-ручкой Ликсумия® необходимо использовать одноразовые иглы для шприц-ручек с просветом 29–32 G.
Черный поршень будет продвигаться по дозировочной шкале после каждой инъекции.
Важные рекомендации:
— вводить только по 1 дозе в сутки;
— шприц-ручка предназначена для использования только одним человеком. Не следует использовать ее вместе с кем-либо;
— если пациенту делает инъекцию другой человек, следует соблюдать особую осторожность для того, чтобы избежать случайного повреждения иглой, что может привести к передаче инфекций, передающихся через кровь;
— необходимо всегда проверять маркировку на шприц-ручке, ее цвет и тактильный элемент на колпачке и кнопке введения дозы, чтобы удостовериться, что шприц-ручка с нужной дозой и у нее не истек срок годности;
— каждая шприц-ручка Ликсумия® содержит 14 соответствующих доз. Нет необходимости набора требуемой дозы;
— необходимо проверить внешний вид резервуара с препаратом Ликсумия®. Жидкость должна быть прозрачной, бесцветной и не содержать механические включения. В противном случае не следует использовать эту шприц-ручку;
— всегда использовать новую стерильную иглу для каждой инъекции. Это поможет избежать контаминации и закупорки иглы;
— всегда иметь запасную шприц-ручку Ликсумия® на случай, если один экземпляр шприц-ручки потеряется или повредится;
— не пытаться извлечь жидкость из резервуара шприц-ручки Ликсумия® с помощью шприца;
— после первой активации шприц-ручки Ликсумия® она может использоваться в течение 14 дней;
— необходимо активировать шприц-ручку Ликсумия® перед использованием в первый раз, чтобы удостовериться в том, что она работает правильно и доза для первой инъекции является правильной;
— когда активируется шприц-ручка Ликсумия® первый раз, не следует вводить раствор. Вместо этого для сбора выделяющегося при активации шприц-ручки Ликсумия® избытка раствора использовать подходящий контейнер (бумажный стаканчик или ткань);
— перед первым использованием каждой новой шприц-ручки Ликсумия® процесс активации должен проводиться только однократно;
— не повторять процесс активации перед каждой инъекцией, в противном случае пациент не получит все 14 доз из шприц-ручки Ликсумия®.
Активация шприц-ручки Ликсумия®
Неактивированная шприц-ручка — с оранжевым окном; активированная (готовая для проведения инъекций) — с белым.
Этап 1. Снятие колпачка и проверка шприц-ручки:
— проверить, является ли активационное окно оранжевым;
— проверить раствор. Он должен быть прозрачным, бесцветным и не содержать механические включения. В противном случае не следует использовать эту шприц-ручку. В новой шприц-ручке черный поршень не должен быть виден на дозировочной шкале.
Этап 2. Присоединение иглы и удаление колпачков иглы:
— протереть пробку (на конце картриджа) ватным тампоном, смоченным спиртом;
— удалить защитную пленку с наружного колпачка иглы;
— расположить на одной линии иглу и шприц-ручку и держать их прямо при плотном закреплении иглы на шприц-ручке;
— соблюдать осторожность, чтобы не уколоться открытой иглой;
— снять наружный колпачок иглы и хранить его для того, чтобы позднее удалить иглу;
— снять внутренний колпачок и выбросить его.
Этап 3. Оттягивание кнопки введения дозы и проверка стрелки:
— проверить, чтобы стрелка указывала на кнопку введения дозы;
— полностью оттянуть кнопку введения дозы;
— стрелка должна поменять свое направление и стать направленной на иглу;
— проверить, чтобы стрелка указывала на иглу.
Этап 4. Нажатие и удерживание кнопки введения дозы для активации шприц-ручки:
— направить иглу в подходящий контейнер (например бумажный стаканчик или ткань), в который будет выпущен избыточный раствор для дальнейшего уничтожения;
— нажать на кнопку введения дозы до упора;
— можно почувствовать и услышать щелчок;
— удерживать кнопку введения дозы в нажатом состоянии и медленно считать до пяти для того, чтобы вытекли последние капли.
Этап 5. Проверка активации шприц-ручки:
— убедиться, что черный поршень продвинулся к пунктирной линии;
— удостовериться, что стрелка указывает на кнопку введения дозы;
— удостовериться, что активационное окно изменилось на белое;
— если этого не происходит, данную шприц-ручку использовать не следует;
— не повторять активацию для данной шприц-ручки;
— перейти к этапу C для введения первой дозы;
— нет необходимости заменять иглу между активацией и первой инъекцией;
— если пациенту был случайно введен препарат до активации шприц-ручки, не следует исправлять эту ошибку путем введения второй инъекции. Необходимо связаться с лечащим врачом для получения рекомендаций по контролю концентрации глюкозы в крови.
Ежедневное использование шприц-ручки
Переходить к этому разделу только тогда, когда активационное окно является белым.
Каждый день вводить только одну дозу.
Этап A. Снятие колпачка и проверка шприц-ручки:
— проверить внешний вид раствора в резервуаре шприц-ручки. Она должна быть прозрачной, бесцветной и не содержать механических включений. В противном случае не следует использовать эту шприц-ручку;
— проверить количество доз в шприц-ручке по указанию черного поршня;
— проверить маркировку, цвет и тактильные элементы шприц-ручки, чтобы удостовериться в использовании правильного препарата;
— удостовериться, что активационное окно является белым. Если оно оранжевое, то перейти к активации шприц-ручки Ликсумия®.
Этап B. Присоединение новой иглы и удаление колпачков иглы:
— протереть резиновую герметизирующую пробочку (на конце картриджа) ватным тампоном, смоченным спиртом;
— удалить защитную пленку с наружного колпачка иглы;
— расположить на одной линии иглу и шприц-ручку и держать их прямо во время закрепления иглы на шприц-ручке;
— соблюдать осторожность, чтобы не уколоться открытой иглой;
— снять наружный колпачок иглы и хранить его для того, чтобы позднее удалить иглу;
— снять внутренний колпачок и выбросить его;
— всегда использовать новую стерильную иглу для каждой инъекции.
Этап C. Оттягивание кнопки введения дозы и проверка направления стрелки:
— удостовериться, что стрелка направлена в сторону кнопки введения дозы;
— до упора оттянуть кнопку введения дозы;
— удостовериться, что стрелка изменила свое направление и направлена в сторону иглы;
— шприц-ручка готова для проведения инъекции.
Этап D. Нажатие на кнопку введения дозы и удерживание ее в этом положении для того, чтобы ввести дозу:
— собрать кожу в складку и ввести иглу;
— препарат Ликсумия® может вводиться п/к в любую из областей, которые находятся на бедре, животе и плече;
— нажать на кнопку введения дозы до упора;
— можно почувствовать или услышать щелчок;
— удерживать кнопку введения дозы в нажатом состоянии и медленно сосчитать до пяти, чтобы получить полную дозу;
— доза введена. Каждый день вводить только 1 дозу.
Примечание: маленькие воздушные пузырьки в резервуаре являются нормальным явлением. Они не повлияют на величину введенной дозы и не причинят вред.
Возникновение ощущения препятствия во время всего процесса надавливания на кнопку введения дозы может быть связано с закупоркой иглы или ее ненадлежащим подсоединением. Следует извлечь иглу из кожи и удалить ее из шприц-ручки, подсоединить новую иглу и попробовать ввести препарат снова. Если и после этого жидкость не вытекает наружу, то это говорит о том, что шприц-ручка Ликсумия® испорчена, и ее использовать нельзя.
Этап E. Проверка продвижения поршня:
— черный поршень должен продвинуться по шкале доз (например до 13 инъекций).
Этап F. Удаление и выбрасывание иглы после каждой инъекции:
— положить наружный колпачок иглы на плоскую поверхность;
— ввести иглу в наружный колпачок иглы;
— установить наружный колпачок иглы на прежнее место;
— надавить на наружный колпачок, чтобы выкрутить иглу из шприц-ручки;
— поместить иглу в резистентный к проколам контейнер или уничтожить ее в соответствии с указаниями врача;
— закрыть шприц-ручку колпачком.
Повторять все этапы раздела Ежедневное использование шприц-ручки для проведения следующих ежедневных инъекций.
Через 14 дней после активации выбросить шприц-ручку, даже если в ней осталось некоторое количество препарата.
Хранение
Общая информация:
— хранить шприц-ручку Ликсумия® в безопасном месте, недоступном для детей;
— защищать шприц-ручку от пыли и загрязнений;
— надевать колпачок шприц-ручки после каждого использования с целью защиты содержимого картриджа от воздействия света;
— активировать новую шприц-ручку непосредственно перед ее использованием в первый раз.
До активации: хранить неиспользованные шприц-ручки в холодильнике (при температуре 2–8 °C; 36–46 °F). Не замораживать шприц-ручки Ликсумия® и не использовать шприц-ручки Ликсумия®, если они были заморожены.
После активации:
— храните шприц-ручку Ликсумия® при температуре не выше 30 °C;
— не хранить шприц-ручку с присоединенной иглой;
— после активации шприц-ручка Ликсумия® может использоваться в течение 14 дней. Следует выбросить использованную шприц-ручку Ликсумия® через 14 дней, даже если в ней остается некоторое количество препарата;
— закрывать шприц-ручку колпачком шприц-ручки после каждого использования с целью защиты содержимого картриджа от воздействия света.
Уход за шприц-ручкой
— следует осторожно обращаться со шприц-ручкой Ликсумия®;
— можно очищать наружную поверхность шприц-ручки Ликсумия®, протирая ее влажной тряпочкой;
— не замачивать, не мыть и не смазывать шприц-ручку Ликсумия®, т.к. это может повредить ее;
— при подозрении, что шприц-ручка может быть повреждена, не использовать ее. Получить новую шприц-ручку. Не пытаться самостоятельно чинить шприц-ручку.
Утилизация
После введения 14 доз шприц-ручка Ликсумия® является пустой и не будет больше работать. Необходимо безопасно уничтожить шприц-ручку после того, как из нее будет введено 14 доз.
Шприц-ручка Ликсумия® пуста, если черный поршень достиг нулевой отметки на шкале доз. Кнопка введения дозы не может быть оттянута, когда шприц-ручка пуста.
Следует надеть колпачок на шприц-ручку Ликсумия® перед тем, как выбросить ее в отходы.
Побочные действия
Частота возникновения нежелательных реакций (HP) определялась следующим образом: очень часто — ≥10%; часто — ≥1%, <10%; нечасто — ≥0,1%, <1%; редко — ≥0,01%, <0,1%; очень редко — <0,01%.
В 8 крупных плацебо-контролируемых и контролируемых активным препаратом клинических исследованиях III фазы более 2600 пациентов получали препарат Ликсумия® в монотерапии или комбинации с метформином, пероральным гипогликемическим препаратом группы сульфонилмочевины (в сочетании с метформином или без сочетания с метформином) или базальным инсулином (в сочетании с метформином или без сочетания с метформином, или в сочетании с пероральным гипогликемическим препаратом группы сульфонилмочевины, или без сочетания с пероральным гипогликемическим препаратом группы сульфонилмочевины).
Наиболее частыми HP, о которых сообщалось в клинических исследованиях, были тошнота и рвота. Эти реакции были,главным образом слабовыраженными и преходящими. Ниже представлены HP, сообщения о которых поступали из плацебо-контролируемых и контролируемых активным препаратом клинических исследований III фазы, которые за весь период лечения (включая период, превышающий основной 24-недельный период лечения в исследованиях, в которых лечение проводилось в общей сложности ≥76 нед) возникали с частотой >5% (если их частота была выше у пациентов, принимавших препарат Ликсумия®, по сравнению с пациентами, принимавшими все другие препараты сравнения, включая плацебо); а также с частотой ≥1% у пациентов в группе препарата Ликсумия®, если их частота более чем в 2 раза превышала частоту возникновения этой HP у пациентов, получавших любой из препаратов сравнения (включая плацебо).
Инфекционные и паразитарные заболевания: часто — грипп, инфекции верхних отделов дыхательных путей.
Со стороны обмена веществ и питания: очень часто — гипогликемия, протекающая с клинической симптоматикой (когда препарат Ликсумия® применяется в комбинации с пероральным гипогликемическим препаратом группы сульфонилмочевины и/или базальным инсулином).
Со стороны нервной системы: очень часто — головная боль; часто — головокружение.
Со стороны ЖКТ: очень часто — тошнота, рвота, диарея; часто — диспепсия.
Со стороны скелетно-мышечной и соединительной ткани: часто — боли в спине.
Гипогликемия
У пациентов, получающих препарат Ликсумия® в монотерапии или комбинации с метформином, гипогликемия с клиническими проявлениями развивалась часто, а ее частота у пациентов, которым вводился препарат Ликсумия®, была подобной таковой при введении плацебо во время всего периода лечения.
У пациентов, которым вводился препарат Ликсумия® в сочетании с пероральным гипогликемическим препаратом группы сульфонилмочевины или базальным инсулином, частота развития гипогликемии, протекающей с клинической симптоматикой, была очень частой.
Во время всего периода лечения препаратом Ликсумия® частота возникновения протекающей с клинической симптоматикой гипогликемии была незначительно выше, чем при применении плацебо, когда препарат Ликсумия® применялся в комбинации:
— с пероральным гипогликемическим препаратом группы сульфонилмочевины и метформином;
— с монотерапией базальным инсулином;
— с комбинацией базального инсулина и метформина.
За время всего периода лечения, когда препарат Ликсумия® применялся в сочетании с монотерапией пероральным гипогликемическим препаратом группы сульфонилмочевины, гипогликемия с клиническими проявлениями возникала у 22,7% пациентов, получавших лечение препаратом Ликсумия®, и у 15,2% у пациентов, получавших плацебо. Когда препарат Ликсумия® применялся в тройной комбинации с пероральным гипогликемическим препаратом группы сульфонилмочевины и базальным инсулином, гипогликемия с клиническими проявлениями возникала у 47,2% пациентов, получавших лечение ликсисенатидом, и у 21,6% пациентов, получавших плацебо.
В целом за весь период приема препарата в контролируемых клинических исследованиях III фазы частота возникновения тяжелой гипогликемии с клиническими проявлениями соответствовала градации «нечасто» (у 0,4% у пациентов, получавших препарат Ликсумия®, и 0,2% у пациентов, получавших плацебо).
Со стороны ЖКТ
Тошнота и рвота были наиболее часто встречающимися HP, о которых сообщалось в течение основного 24-недельного периода лечения. Частота возникновения тошноты была выше у пациентов, получавших лечение препаратом Ликсумия® (26,1%), чем у пациентов, получавших плацебо (6,2%). Частота возникновения рвоты также была выше у пациентов, получавших лечение препаратом Ликсумия® (10,5%), чем у пациентов, получавших плацебо (1,8%). Эти HP были главным образом слабовыраженными и преходящими и возникали в течение первых 3 нед после начала лечения. В течение последующих недель они постепенно уменьшались.
У пациентов, получавших лечение препаратом Ликсумия®, частота возникновения тошноты была ниже (24,5%), чем у пациентов, получавших лечение эксенатидом 2 раза в сутки (35,1%), а частота других HP со стороны ЖКТ в обеих группах лечения была одинаковой.
Реакции в месте введения
Реакции в месте введения в течение 24-недельного периода лечения наблюдались у 3,9% пациентов, получавших препарат Ликсумия®, в то время как у пациентов, получавших плацебо, они наблюдались с частотой 1,4%. Большинство реакций были слабовыраженными по интенсивности и обычно не приводили к прекращению лечения.
Иммуногенность
В связи с потенциально иммуногенными свойствами лекарственных препаратов, содержащих белки или пептиды, после лечения препаратом Ликсумия® у пациентов возможно образование антител к ликсисенатиду. В конце 24-недельного периода лечения в плацебо-контролируемых исследованиях у 69,4% пациентов, получавших лечение ликсисенатидом, имелись положительные результаты исследования на наличие антител к ликсисенатиду. Однако изменение показателя HbA1C, по сравнению с таковым до применения ликсисенатида, было одинаковым, вне зависимости от положительного или отрицательного результата анализа на наличие антител к ликсисенатиду. Из получавших лечение ликсисенатидом пациентов, у которых определялся показатель HbA1C, у 79,3% имелся отрицательный результат анализа на наличие антител к ликсисенатиду или титр антител к ликсисенатиду был ниже нижней границы возможности его количественного определения, а у остальных 20,7% пациентов имелись количественно определяемые титры антител к ликсисенатиду.
Не наблюдались какие-либо различия в общем профиле безопасности у пациентов в зависимости от статуса антител к ликсисенатиду, за исключением увеличения частоты реакций в месте введения у антителопозитивных пациентов. Большинство реакций в месте введения были слабовыраженными, независимо от наличия или отсутствия антител к ликсисенатиду.
Отсутствовала перекрестная иммунологическая реактивность с нативным глюкагоном или эндогенным ГПП-1.
Аллергические реакции
Аллергические реакции, возможно связанные с применением ликсисенатида (такие как анафилактические реакции, ангионевротический отек и крапивница), в течение основного 24-недельного периода лечения, наблюдались у 0,4% пациентов, получавших препарат Ликсумия®, по сравнению с менее чем 0,1% пациентов в группе плацебо.
Преждевременное прекращение применения препарата
Частота прекращения лечения препаратом из-за возникновения НР составляла 7,4% в группе препарата Ликсумия® и 3,2% в группе плацебо. Наиболее частыми HP, приводящими к отмене лечения в группе препарата Ликсумия®, были тошнота (3,1%) и рвота (1,2%).
Взаимодействие
Ликсисенатид является пептидом и не метаболизируется с помощью изоферментов цитохрома Р450. В in vitro исследованиях, проведенных у человека, ликсисенатид не нарушал активность протестированных изоферментов цитохрома Р450 или транспортеров.
Задержка опорожнения желудка при применении ликсисенатида может повлиять на скорость абсорбции лекарственных препаратов, принимаемых внутрь. Для принимаемых внутрь лекарственных препаратов, эффективность которых особенно зависит от пороговых концентраций, пациентам следует рекомендовать принимать эти лекарственные препараты как минимум за 1 ч до или спустя 11 ч после инъекции ликсисенатида.
Парацетамол
После однократного приема парацетамола в дозе 1000 мг, AUC и T1/2 парацетамола не изменялись, независимо от времени его приема (до или после инъекции ликсисенатида). При приеме через 1 или 4 ч после инъекции 10 мкг ликсисенатида Cmax парацетамола снижалась на 29 и 31% соответственно, а медиана Tmax увеличивалось на 4,5 и 2 ч соответственно. Исходя из этих данных, не требуется коррекция дозы парацетамола при его применении совместно с ликсисенатидом.
Пероральные контрацептивные ЛС
После однократного приема внутрь перорального контрацептивного лекарственного препарата (этинилэстрадиол 0,03 мг/левоноргестрел 0,15 мг) за 1 ч до или спустя 11 ч после п/к инъекции ликсисенатида Cmax, AUC, T1/2 и Tmax этинилэстрадиола и левоноргестрела не изменялись. Прием внутрь этинилэстрадиола и левоноргестрела через 1 или 4 ч после п/к инъекции ликсисенатида не оказывал влияние на их AUC и T1/2, в то время как Cmax этинилэстрадиола снижалась на 52% (при приеме через 1 ч) и 39% (при приеме через 4 ч), а Cmax левоноргестрела снижалась на 46% (при приеме через 1 ч) и 20% (при приеме через 4 ч), а также медиана Tmax увеличивалась на 2–4 ч. Снижение Cmax имеет ограниченное клиническое значение, и не требуется коррекция дозы пероральных контрацептивных препаратов.
Аторвастатин
При одновременном применении утром ликсисенатида и аторвастатина в дозе 40 мг системная экспозиция аторвастатина не изменялась, его Cmax незначительно снижалась, а Tmax увеличивалось на 1,5–4 ч.
Если аторвастатин принимался вечером, а ликсисенатид утром, то не наблюдалось увеличение Tmax, но AUC и Cmax увеличивались на 27 и 66% соответственно. Эти изменения не были клинически значимыми, и поэтому не требуется коррекция дозы аторвастатина при его совместном применении с ликсисенатидом.
Варфарин
После одновременного применения варфарина 25 мг и ликсисенатида не наблюдалось влияние на AUC или МНО, в то время как Tmax увеличивалось до 7 ч. Исходя из этих данных, не требуется коррекция дозы варфарина при его совместном применении с ликсисенатидом.
Дигоксин
После одновременного применения ликсисенатида и дигоксина в дозе 0,25 мг AUC дигоксина не изменялась, Tmax увеличивалось на 1,5 ч и Cmax уменьшалось на 26%. Исходя из этих данных, не требуется коррекция дозы дигоксина при его совместном применении с ликсисенатидом.
Рамиприл
После одновременного применения ликсисенатида и рамиприла в дозе 5 мг в течение 7 дней AUC рамиприла увеличивалась на 21%, в то время как Cmax снижалась на 63%. AUC и Cmax активного метаболита (рамиприлат) не изменялись. Tmax рамиприла и рамиприлата увеличивалось приблизительно на 2,5 ч. Исходя из этих данных, не требуется коррекция дозы рамиприла при его совместном применении с ликсисенатидом.
Передозировка
Симптомы: во время 13-недельного клинического исследования пациентам с сахарным диабетом типа 2 вводились дозы ликсисенатида до 30 мкг 2 раза в сутки. Эти дозы хорошо переносились, наблюдалось только увеличение частоты возникновения нарушений со стороны ЖКТ.
Лечение: в зависимости от клинических проявлений и симптомов у пациента, следует проводить соответствующую поддерживающую терапию, а доза препарата Ликсумия® должна быть снижена до предписанной.
Особые указания
Применение при сахарном диабете типа 1
Отсутствует терапевтический опыт применения препарата Ликсумия® у пациентов с сахарным диабетом типа 1, и его применение у таких пациентов противопоказано. Применение препарата Ликсумия® при диабетическом кетоацидозе противопоказано.
Риск панкреатита
Применение агонистов рецепторов ГПП-1 ассоциировалось с риском развития острого панкреатита. Характерным симптомом острого панкреатита являются длительно сохраняющиеся сильные боли в животе. При подозрении на развитие панкреатита следует прекратить лечение препаратом Ликсумия®; при подтверждении диагноза острого панкреатита возобновлять лечение препаратом Ликсумия® нельзя. Следует с осторожностью применять препарат у пациентов с панкреатитом в анамнезе.
Применение при тяжелом гастропарезе
Применение агонистов рецепторов ГПП-1 может ассоциироваться с нежелательными реакциями со стороны ЖКТ. Применение препарата Ликсумия® у пациентов с тяжелыми заболеваниями ЖКТ, включая гастропарез, до настоящего времени не изучалось, и поэтому у таких пациентов применение препарата Ликсумия® противопоказано.
Риск развития гипогликемии
Пациенты, получающие лечение препаратом Ликсумия® в сочетании с пероральным гипогликемическим препаратом группы сульфонилмочевины или комбинацией базального инсулина и перорального гипогликемического препарата группы сульфонилмочевины, могут иметь повышенный риск развития гипогликемии. Для уменьшения риска развития гипогликемии может быть рассмотрен вопрос о снижении дозы перорального гипогликемического препарата группы сульфонилмочевины или базального инсулина.
Влияние на способность управлять транспортными средствами и работать с механизмами. Не проводились исследования по влиянию препарата на способность управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности. При применении препарата в комбинации с пероральным гипогликемическим препаратом группы сульфонилмочевины или базальным инсулином пациенты должны быть информированы о необходимости соблюдения мер предосторожности для предупреждения возникновения гипогликемии во время управления транспортными средствами или при занятии другими потенциально опасными видами деятельности.
Форма выпуска
Раствор для подкожного введения, 0,05 мг/мл (10 мкг/доза) и 0,1 мг/мл (20 мкг/доза). В картридже из бесцветного стекла (тип I), 3 мл. Картридж укупорен с одной стороны пробкой (ламинат из синтетической изопреновой резины и бромбутиловой резины), обжатой алюминиевым колпачком, с другой стороны закрыт притертым поршнем из бромбутиловой резины. Картридж вмонтирован в одноразовую шприц-ручку.
Для раствора 0,05 мг/мл (10 мкг/доза): по 1 шприц-ручке в картонной пачке, снабженной фиксатором.
Для раствора 0,1 мг/мл (20 мкг/доза): по 1, 2 или 6 шприц-ручек в картонной пачке, снабженной фиксатором.
Комплект: по 1 шприц-ручке с раствором 0,05 мг/мл (10 мкг/доза) и 1 шприц-ручке с раствором 0,1 мг/мл (20 мкг/доза) в картонной пачке, снабженной фиксатором.
Производитель
Санофи-Авентис Дойчланд ГмбХ, Германия.
Юридическое лицо, на имя которого выдано регистрационное удостоверение: Санофи, Франция.
Претензии потребителей направлять по адресу в России: 125009, Москва, ул. Тверская, 22.
Тел.: (495) 721-14-00; факс: (495) 721-14-11.
Условия отпуска из аптек
По рецепту.
Условия хранения
В защищенном от света месте, при температуре 2–8 °C (не замораживать).
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Соликва СолоСтар — инструкция по применению
Синонимы, аналоги
Статьи
Номер регистрационного удостоверения:
ЛП-004874
Торговое наименование препарата:
Соликва СолоСтар®.
Международное непатентованное или группировочное наименование:
инсулин гларгин + ликсисенатид.
Лекарственная форма:
раствор для подкожного введения.
Состав
В 1 мл раствора для подкожного введения 100 ЕД/мл инсулина гларгин и 50 мкг/мл ликсисенатида содержится:
действующие вещества: инсулин гларгин – 3,6378 мг (100 ЕД), ликсисенатид – 50 мкг;
вспомогательные вещества: глицерол (85%); метионин (L-метионин); метакрезол (м-крезол); цинка хлорид; хлористоводородная кислота; натрия гидроксид; вода для инъекций.
В 1 мл раствора для подкожного введения 100 ЕД/мл инсулина гларгин и 33 мкг/мл ликсисенатида содержится:
действующие вещества: инсулин гларгин – 3,6378 мг (100 ЕД), ликсисенатид – 33 мкг;
вспомогательные вещества: глицерол (85%); метионин (L-метионин); метакрезол (м-крезол); цинка хлорид; хлористоводородная кислота; натрия гидроксид; вода для инъекций.
Описание:
прозрачный, бесцветный или почти бесцветный раствор.
Фармакотерапевтическая группа:
гипогликемическое средство комбинированное (инсулина длительного действия аналог + глюкагоноподобного полипептида рецепторов агонист).
Код ATX:
А10АЕ54.
Фармакологические свойства
Фармакодинамика
Механизм действия
Препарат Соликва СолоСтар®
Препарат Соликва СолоСтар® является комбинированным препаратом, в состав которого входят два гипогликемических средства с дополняющими друг друга механизмами действия: инсулин гларгин, аналог инсулина длительного действия, и ликсисенатид, агонист рецепторов глюкагоноподобного пептида-1 (ГПП-1). Действие препарата направлено на снижение концентрации глюкозы в крови натощак и после приема пищи (постпрандиальной концентрации глюкозы в крови), что улучшает гликемический контроль у пациентов с сахарным диабетом 2 типа (СД2), но при этом минимизируется увеличение массы тела и риск развития гипогликемии.
Инсулин гларгин
Основной функцией инсулина, в том числе инсулина гларгин, является регуляция метаболизма глюкозы. Инсулин и его аналоги снижают концентрацию глюкозы крови, за счет увеличения потребления глюкозы периферическими тканями (в особенности, скелетными мышцами и жировой тканью) и подавления образования глюкозы в печени. Инсулин подавляет липолиз и протеолиз, а также увеличивает синтез белка.
Ликсисенатид
Ликсисенатид является агонистом рецепторов ГПП-1. Рецептор ГПП-1 является мишенью для нативного ГПП-1, эндогенного гормона внутренней секреции, который потенцирует глюкозозависимую секрецию инсулина бета-клетками и подавляет секрецию глюкагона альфа-клетками поджелудочной железы.
Действие ликсисенатида, подобно действию эндогенного ГПП-1, осуществляется через специфическое взаимодействие с рецепторами ГПП-1, включая рецепторы ГПП-1, находящиеся в альфа- и бета-клетках поджелудочной железы. После приема пищи ликсисенатид активирует следующие физиологические реакции:
— увеличение секреции инсулина бета-клетками поджелудочной железы;
— замедление опорожнения желудка;
— подавление секреции глюкагона альфа-клетками поджелудочной железы.
Ликсисенатид стимулирует секрецию инсулина в ответ на повышение концентрации глюкозы в крови. Одновременно подавляется секреция глюкагона. Кроме этого, ликсисенатид замедляет опорожнение желудка, уменьшая за счет этого скорость абсорбции глюкозы из пищи и ее поступление в системный кровоток. Было показано, что ликсисенатид в изолированных островках поджелудочной железы человека сохраняет функцию бета-клеток и предотвращает их гибель (апоптоз).
Фармакодинамические свойства
Препарат Соликва СолоСтар®
Комбинация инсулина гларгин и ликсисенатида не оказывает влияния на фармакологическое действие инсулина гларгин. Влияние комбинации инсулина гларгин и ликсисенатида на фармакологическое действие ликсисенатида в клинических исследованиях I фазы не изучалось.
Аналогично относительно постоянному профилю «концентрация/время» без выраженных пиков в течение 24 ч при введении только инсулина гларгин, при введении комбинации инсулин гларгин + ликсисенатид профиль «скорость утилизации глюкозы/время» был схожим, без выраженных пиков.
Длительность действия инсулинов, включая препарат Соликва СолоСтар®, может варьировать как у разных пациентов, так и у одного и того же пациента.
Инсулин гларгин
В клинических исследованиях инсулина гларгин (100 ЕД/мл) гипогликемическое действие внутривенно вводимого инсулина гларгин было приблизительно таким же, как и у человеческого инсулина (при внутривенном введении обоих препаратов в одинаковых дозах).
Ликсисенатид
В 28-дневном плацебо-контролируемом исследовании у пациентов с СД2 по оценке влияния ликсисенатида в дозах 5-20 мкг 1 или 2 раза в сутки на концентрацию глюкозы в крови после приема стандартного завтрака, ликсисенатид в дозах 10 мкг и 20 мкг 1 или 2 раза в сутки улучшал гликемический контроль за счет снижения как постпрандиальной (после приема пищи) концентрации глюкозы в крови, так и концентрации глюкозы в крови натощак. Ликсисенатид, вводимый в этом исследовании утром в дозе 20 мкг 1 раз в сутки, поддерживал статистически значимое снижение постпрандиальной концентрации глюкозы в крови после завтрака, обеда и ужина.
Влияние на постпрандиалъную концентрацию глюкозы в крови
В 4-недельном исследовании в комбинации с метформином и в 8-недельном исследовании в комбинации с инсулином гларгин с/без метформина, ликсисенатид в дозе 20 мкг 1 раз в сутки, вводимый перед завтраком у пациентов с СД2, показал снижение постпрандиальной концентрации глюкозы в крови (кривая «концентрация глюкозы/время 0:30-4:30 ч») после пробного завтрака. Количество пациентов с 2-часовой постпрандиальной концентрацией глюкозы ниже 140 мг/дл (7,77 ммоль/л) составляло 69,3% после 28 дней лечения и 76,1% после 56 дней лечения.
Влияние на секрецию инсулина
У пациентов с СД2 монотерапия ликсисенатидом по сравнению с плацебо восстанавливает первую фазу секреции инсулина в глюкозозависимом режиме, увеличивая ее в 2,8 раз (90% доверительный интервал, 2,5-3,1) и увеличивает вторую фазу секреции инсулина в 1,6 раз (90% доверительный интервал 1,4-1,7) (измерялось по площади под кривой «концентрация-время» [AUC]).
Влияние на опорожнение желудка
После стандартизированного тестового приема меченной изотопом пищи, ликсисенатид замедлял опорожнение желудка, снижая за счет этого скорость постпрандиальной абсорбции глюкозы. У пациентов с СД2 при монотерапии ликсисенатидом эффект замедления опорожнения желудка сохранялся после 28 дней лечения.
Влияние на секрецию глюкагона
Ликсисенатид в дозе 20 мкг 1 раз в сутки в монотерапии демонстрировал снижение постпрандиальной концентрации глюкагона по сравнению с исходом после тестового приема пищи у пациентов с СД2. В плацебо-контролируемом гипогликемическом клэмп-исследовании, проведенном у здоровых добровольцев, по оценке однократного введения ликсисенатида в дозе 20 мкг на секрецию глюкагона, реакция секреции глюкагона в ответ на снижение концентрации глюкозы в крови при гипогликемических состояниях сохранялась, несмотря на присутствие эффективных концентраций ликсисенатида в плазме крови.
Влияние на электрофизиологию сердца (интервал QTc)
Влияние ликсисенатида на реполяризацию сердца было изучено в исследовании интервала QTc (в дозе, в 1,5 раза превышающей рекомендуемую поддерживающую дозу), которое показало отсутствие какого-либо влияния ликсисенатида на реполяризацию желудочков.
Влияние на число сердечных сокращений (ЧСС)
В плацебо-контролируемых клинических исследованиях III фазы было показано отсутствие повышения средних значений частоты сердечных сокращений.
Клиническая эффективность
Эффективность и безопасность применения препарата Соликва СолоСтар® были изучены в двух рандомизированных, контролируемых клинических исследованиях с активным контролем у пациентов с СД2.
В одном рандомизированном открытом 30-недельном исследовании с активным контролем, проведенном у пациентов с СД2, не получавших ранее терапию инсулином и с недостаточным гликемическим контролем при применении пероральных гипогликемических препаратов, оценивались эффективность и безопасность препарата Соликва СолоСтар® (n=468) в сравнении с инсулином гларгин (n=466) и ликсисенатидом (n=233).
При добавлении к лечению препарата Соликва СолоСтар® 74% (n=345) пациентов к 30-ой неделе достигли значений гликированного гемоглобина Alc (HbAlc) <7%, по сравнению с 59% (n=277) пациентов при добавлении только инсулина гларгин и 33% (n=77) пациентов при добавлении только ликсисенатида.
Снижение средних значений HbAlc к 30-ой неделе у пациентов, получавших препарат Соликва СолоСтар®, составило -1,6%, а у пациентов в группах лечения инсулином гларгин и ликсисенатидом оно составляло -1,3% и -0,9%, соответственно.
Средние значения концентрации глюкозы в плазме крови натощак у пациентов, получавших препарат Соликва СолоСтар®, к концу исследования снизились на 3,46 ммоль/л, а при добавлении инсулина гларгин или ликсисенатида на 3,27 ммоль/л и 1,5 ммоль/л, соответственно.
Снижение средних значений постпрандиальной концентрации глюкозы в крови (через 2 ч после приема пищи) у пациентов к 30-й неделе при добавлении к лечению препарата Соликва СолоСтар® составило -5,68 ммоль/л, по сравнению с -3,31 ммоль/л при добавлении только инсулина гларгин и -4,58 ммоль/л при добавлении только ликсисенатида.
К концу 30-недельного периода среднее значение изменения массы тела составило у пациентов, получавших препарат Соликва СолоСтар, -0,3 кг, а инсулин гларгин +1,1 кг. При добавлении ликсисенатида изменение массы тела составило -2,3 кг.
Во втором рандомизированном, 30-недельном, контролируемом, открытом, многоцентровом клиническом исследовании с активным контролем оценивалась эффективность и безопасность препарата Соликва СолоСтар® в сравнении с инсулином гларгин. В исследование было включено 736 пациентов с СД2 с недостаточным гликемическим контролем при терапии пероральными гипогликемическими препаратами в комбинации с базальным инсулином.
При применении препарата Соликва СолоСтар® 54,9% пациентов (n=201) к 30-ой неделе достигли НЬА1с <7%, по сравнению с 29,6% пациентов (n=108) в группе лечения только инсулином гларгин. Среднее значение снижения HbAlC к 30-ой неделе у пациентов, получавших препарат Соликва СолоСтар®, составило -1,1% , а у пациентов в группе лечения инсулином гларгин снижение HbAlC составило -0,6%. Концентрация глюкозы в плазме крови натощак у пациентов, получавших препарат Соликва СолоСтар®, к концу исследования снизилась на 0,35 ммоль/л, а при применении инсулина гларгин на 0,47 ммоль/л.
Среднее значение снижения постпрандиальной концентрации глюкозы в крови (через 2 ч после приема пищи) у пациентов к 30-й неделе при лечении препаратом Соликва СолоСтар® составило -4,72 ммоль/л, по сравнению с -1,39 ммоль/л в группе инсулина гларгин.
К концу 30-недельного периода среднее изменение массы тела у пациентов, получавших препарат Соликва СолоСтар®, составило -0,7 кг, а у пациентов, получавших инсулин гларгин – +0,7 кг.
Таким образом, лечение препаратом Соликва СолоСтар® вызывало клинически и статистически значимое улучшение показателя HbAlc. Причем, достижение более низких значений HbAlc и большего снижения HbAlc при применении препарата Соликва СолоСтар® не увеличивало частоту развития гипогликемии по сравнению с монотерапией инсулином гларгин.
Исследования влияния ликсисенатида и инсулина гларгин на сердечно-сосудистую систему (ССС)
Влияние на развитие осложнений со стороны ССС терапии инсулином гларгин было установлена в клиническом исследовании ORIGIN, а ликсисенатидом – в клиническом исследовании ELIXA. Исследований влияния терапии фиксированной комбинации инсулина гларгин и ликсисенатида на ССС не проводилось.
Инсулин гларгин
Клиническое исследование ORIGIN (Outcome Reduction with Initial Glargine Intervention) было открытым, рандомизированным исследованием, проведенным у 12537 пациентов, терапии препаратом Лантус® (инсулин гларгин 100 ЕД/мл) в сравнении со стандартной гипогликемической терапией в отношении времени развития первого крупного сердечно-сосудистого осложнения (КССО). КССО определялось, как композитная конечная точка: сердечно-сосудистая смерть, нефатальный инфаркт миокарда, нефатальный инсульт. Частота развития КССО в группах лечения препаратом Лантус® и группах стандартной гипогликемической терапии была сопоставимой [отношение рисков (95% доверительный интервал) 1,02 (0,94, 1,11)].
В клиническом исследовании ORIGIN средняя частота развития рака (всех видов) [отношение рисков (95% доверительный интервал) 0,99 (0,88, 1,11)] или смерти от рака [отношение рисков (95% доверительный интервал) 0,94 (0,77, 1,15)] была сопоставимой между группами лечения.
Ликсисенатид
Клиническое исследование ELIXA было рандомизированным, двойным слепым, плацебо-контролируемым, многонациональным исследованием, в котором проводилась оценка осложнений со стороны ССС во время лечения ликсисенатидом у пациентов с СД2 (n=6068) после недавно перенесенного острого коронарного синдрома. Первичной конечной точкой эффективности было время до первого возникновения любого из следующих событий, положительно расцененных Комитетом по оценке сердечно-сосудистых событий: сердечно-сосудистая смерть, нефатальный инфаркт миокарда, нефатальный инсульт или госпитализация по поводу нестабильной стенокардии. Вторичные сердечно-сосудистые конечные точки включали комбинацию первичной конечной точки либо с госпитализацией по поводу сердечной недостаточности, либо с реваскуляризацией коронарных артерий. Также заранее запланированной вторичной конечной точкой было изменение отношения альбумин/креатинин в моче к 108-й неделе.
Частота возникновения событий из первичной конечной точки была сопоставимой в группе ликсисенатида и в группе плацебо: отношение рисков для ликсисенатида против плацебо составляло 1,017, с двусторонним 95% доверительным интервалом, составляющим 0,886, 1,168. Одинаковые проценты между группами лечения наблюдались для вторичных конечных точек и для всех отдельных компонентов композитных конечных точек. Проценты пациентов, госпитализированных по поводу сердечной недостаточности, составляли 4,0% и 4,2% в группах ликсисенатида и плацебо, соответственно [отношение рисков (95% доверительный интервал) 0,96 (0,75, 1,23)].
В группе ликсисенатида по сравнению с группой плацебо наблюдалось меньшее увеличение отношения альбумин/креатинин в моче к неделе 108, по сравнению с исходом: -10,04±3,53%; 95% доверительный интервал составлял -16,95%, -3,13%.
Фармакокинетика
Препарат Соликва СолоСтар®
Соотношение инсулина гларгин и ликсисенатида в препарате Соликва СолоСтар® не оказывало значимого влияния на фармакокинетику инсулина гларгин и ликсисенатида.
По сравнению с монотерапией ликсисенатидом, при введении, препарата Соликва СолоСтар® максимальная концентрация в плазме л крови (Сmax) ликсисенатида была ниже, в то время как AUC была в целом сопоставимой. Эти различия в фармакокинетике ликсисенатида при его введении в составе препарата Соликва СолоСтар® и при введении только ликсисенатида не являлись клинически значимыми.
Абсорбция
Препарат Соликва СолоСтар®
После подкожного введения комбинации инсулин гларгин/ликсисенатид пациентам с сахарным диабетом 1 типа, инсулин гларгин показал отсутствие пиковых подъемов его концентрации в плазме крови. Поступление инсулина гларгин в системный кровоток находилось в диапазоне 86-101% по сравнению с введением одного инсулина гларгин.
После подкожного введения комбинации инсулин гларгин/ликсисенатид пациентам с сахарным диабетом 1 типа, медиана времени до достижения максимальной концентрации в плазме крови (tmax) ликсисенатида находилась в диапазоне 2,5-3,0 ч. После подкожного введения комбинации инсулин гларгин/ликсисенатид наблюдалось небольшое снижение Сmax ликсисенатида на 22-34% по сравнению с раздельным одновременным введением инсулина гларгин и ликсисенатида, что не является клинически значимым. Отсутствовали клинически значимые различия в скорости абсорбции при введении ликсисенатида подкожно в область передней стенки живота, бедра или плеча.
Распределение
Ликсисенатид
У человека ликсисенатид в умеренной степени (на 55%) связывается с белками плазмы крови.
Метаболизм и элиминация
Инсулин гларгин
Исследование метаболизма у человека при введении только инсулина гларгин показывает, что инсулин гларгин частично метаболизируется с карбоксильного конца бета-цепи в подкожном депо с образованием двух активных метаболитов с активностью in vitro, сходной с человеческим инсулином: Ml (21А-Gly-инсулин) и М2 (21A-Gly-дез-30В-Thr-инсулин). Неизмененный инсулин гларгин и продукты его деградации также присутствуют в системном кровотоке.
Ликсисенатид
Являясь пептидом, ликсисенатид выводится путем гломерулярной фильтрации с последующей реабсорбцией в почечных канальцах и метаболической деградации, приводящей к образованию более мелких пептидов и аминокислот, которые повторно вступают в белковый обмен.
Фармакокинетика у особых групп пациентов
— Возраст, расовая и половая принадлежность
Инсулин гларгин
Влияние возраста, расовой и половой принадлежности на фармакокинетику инсулина гларгин до настоящего времени не оценивалось. В контролируемых клинических исследованиях у взрослых, проведенных с инсулином гларгин (100 ЕД/мл), анализ подгрупп, проведенный по возрасту, расовой и половой принадлежности, не показал различий в отношении безопасности и эффективности.
Ликсисенатид
По данным популяционного фармакокинетического анализа возраст, масса тела, половая и расовая принадлежность не оказывали клинически значимого влияния на фармакокинетику ликсисенатида.
— Ожирение
Влияние индекса массы тела (ИМТ) на фармакокинетику препарата Соликва до настоящего времени не оценивалось.
— Почечная недостаточность
Открытое исследование оценивало фармакокинетику ликсисенатида 5 мкг при однократном введении у лиц с различной степенью нарушения функции почек [которая вычислялась с помощью формулы Кокрофта-Голта для расчета клиренса креатинина (КК)] по сравнению со здоровыми лицами. Не наблюдалось значимых различий в средних значениях Сmax и AUC ликсисенатида при нормальной функции почек и почечной недостаточности легкой степени (КК 60-90 мл/мин). У пациентов с почечной недостаточностью средней тяжести (КК 30-60 мл/мин) AUC ликсисенатида увеличивалась приблизительно на 51%, а у пациентов с почечной недостаточностью тяжелой степени (КК 15-30 мл/мин) AUC ликсисенатида увеличивалась приблизительно на 87%.
— Печеночная недостаточность
Ликсисенатид
Так как ликсисенатид выводится, главным образом, почками, фармакокинетических исследований у пациентов с острым или хроническим нарушением функции печени не проводилось. Не ожидается, что нарушение функции печени способно повлиять на фармакокинетику ликсисенатида.
Показания к применению
У взрослых пациентов с сахарным диабетом 2 типа в комбинации с метформином в качестве дополнения к диетотерапии и повышенной физической нагрузке с целью улучшения гликемического контроля при неэффективности монотерапии метформином или комбинации метформина с другим пероральным гипогликемическим препаратом, или монотерапии базальным инсулином.
Противопоказания
- Гиперчувствительность к ликсисенатиду, инсулину гларгин или любому из вспомогательных веществ, входящих в состав препарата.
- Беременность.
- Период грудного вскармливания.
- Сахарный диабет 1 типа.
- Диабетический кетоацидоз.
- Тяжелые заболевания желудочно-кишечного тракта (ЖКТ), включая гастропарез.
- Почечная недостаточность тяжелой степени (КК менее 30 мл/мин).
- Возраст до 18 лет (в связи с отсутствием данных по эффективности и безопасности применения в данной возрастной группе).
С осторожностью
- Панкреатит в анамнезе (из-за содержания в составе препарата ликсисенатида, см. раздел «Особые указания»).
- У пациентов, одновременно принимающих препараты, требующие быстрой абсорбции из ЖКТ, имеющие узкий терапевтический индекс или нуждающиеся в тщательном клиническом мониторинге (см. раздел «Особые указания»).
Применение при беременности и в период грудного вскармливания
Беременность
Отсутствуют данные контролируемых клинических исследований по применению в период беременности препарата Соликва СолоСтар®, инсулина гларгин или ликсисенатида.
В исследованиях на животных была продемонстрирована репродуктивная токсичность ликсисенатида; отсутствие эмбриотоксичности и тератогенности инсулина гларгин.
Потенциальный риск для человека неизвестен. Препарат Соликва СолоСтар® противопоказан при беременности (из-за содержания в составе препарата ликсисенатида).
При планировании беременности или ее наступлении лечение препаратом Соликва СолоСтар® следует прекратить.
Период грудного вскармливания
Нет данных о проникновении в грудное молоко человека инсулина гларгин или ликсисенатида. Применение препарата Соликва СолоСтар® в период грудного вскармливания противопоказано.
Способ применения и дозы
Для удобства индивидуального подбора дозы препарат Соликва СолоСтар® выпускается в двух шприц-ручках, предоставляющих выбор различных доз. Различия между этими двумя шприц-ручками заключаются в диапазоне доз действующих веществ в шприц-ручках (см. ниже).
- Соликва СолоСтар® 100 ЕД/мл и 50 мкг/мл: шприц-ручка 10-40
— 1 единица препарата в этой шприц-ручке Соликва СолоСтар® содержит 1 ЕД инсулина гларгин и 0,5 мкг ликсисенатида.
— Эта шприц-ручка дает возможность получения суточной дозы от 10 до 40 единиц препарата Соликва СолоСтар® (от 10 до 40 ЕД инсулина гларгин в комбинации с ликсисенатидом в дозе от 5 мкг до 20 мкг). - Соликва СолоСтар® 100 ЕД/мл и 33 мкг/мл: шприц-ручка 30-60
— 1 единица препарата в этой шприц-ручке Соликва СолоСтар® содержит 1 ЕД инсулина гларгин и 0,33 мкг ликсисенатида.
— Эта шприц-ручка дает возможность получения суточной дозы от 30 до 60 единиц препарата Соликва СолоСтар® (от 30 до 60 ЕД инсулина гларгин в комбинации с ликсисенатидом в дозе от 10 мкг до 20 мкг).
Во избежание ошибочного введения препарата из другой шприц-ручки (с другой дозировкой), удостоверьтесь в том, что в рецепте указана соответствующая назначению врача шприц-ручка Соликва СолоСтар®: шприц-ручка Соликва СолоСтар® (10-40) или шприц-ручка Соликва СолоСтар® (30-60).
Максимальная суточная доза препарата Соликва СолоСтар® составляет 60 единиц (60 ЕД инсулина гларгин и 20 мкг ликсисенатида).
Препарат Соликва СолоСтар® вводится подкожно 1 раз в сутки в течение 1 ч перед любым приемом пищи. Предпочтительно, чтобы прандиальная (перед приемом пищи) инъекция препарата Соликва СолоСтар® проводилась ежедневно перед одним и тем же приемом пищи, выбранным, как наиболее подходящий для пациента. В случае пропуска введения дозы препарата Соликва СолоСтар®, ее следует ввести в течение 1 ч перед следующим приемом пищи.
Доза препарата Соликва СолоСтар® должна подбираться индивидуально на основании клинического ответа и титроваться, исходя из потребности пациента в инсулине. Доза ликсисенатида увеличивается или уменьшается вместе с дозой инсулина гларгин, а также зависит от того, какая из вышеуказанных шприц-ручек используется.
Коррекцию дозы или изменение времени введения препарата Соликва СолоСтар® следует проводить только под врачебным наблюдением с соответствующим мониторингом концентрации глюкозы в крови (см. раздел «Особые указания).
Начало терапии препаратом Соликва СолоСтар®
Начальная доза препарата Соликва СолоСтар®
Начальная доза препарата Соликва СолоСтар® выбирается, исходя из предшествующего лечения гипогликемическими препаратами, и не должна превышать начальную дозу ликсисенатида 10 мкг.
Начальная доза препарата Соликва СолоСтар®
| Предшествующее лечение | |||||
| Пероральные гипогликемические препараты (пациенты, не получавшие инсулина) | Инсулин гларгин (100 ЕД/мл)* <20 ЕД |
Инсулин гларгин (100 ЕД/мл)* ≥20 ЕД – <30 ЕД |
Инсулин гларгин (100 ЕД/мл)* ≥30 ЕД – ≤60 ЕД |
||
| Начальная доза и тип шприц-ручки | Шприц-ручка Соликва СолоСтар® (10-40) | 10 единиц препарата (10 ЕД инсулина гларгин/5 мкг ликсисенатида) |
20 единиц препарата (20 ЕД инсулина гларгин/10 мкг ликсисенатида) |
||
| Шприц-ручка Соликва СолоСтар® (30-60) | 30 единиц препарата (30 ЕД инсулина гларгин/10 мкг ликсисенатида) |
* Если применялся другой базальный инсулин:
• Для базального инсулина, вводимого 2 раза в сутки, или инсулина гларгин 300 ЕД/мл, вводимого 1 раз в сутки, начальная суточная доза препарата Соликва СолоСтар® должна быть снижена на 20%.
• Для любых других базальных инсулинов следует применять те же рекомендации, что и для инсулина гларгин (100 ЕД/мл).
Титрование дозы препарата Соликва СолоСтар®
Препарат Соликва СолоСтар® должен дозироваться в соответствии с индивидуальной потребностью пациента в инсулине. С целью улучшения гликемического контроля рекомендуется корректировать дозу препарата на основании определения концентрации глюкозы в плазме крови натощак.
При переходе на терапию препаратом Соликва СолоСтар® и в последующие недели рекомендуется проведение тщательного мониторинга концентрации глюкозы в крови.
- Если лечение пациента начинается с использования шприц-ручки Соликва СолоСтар® (10-40), то с помощью этой шприц-ручки доза может титроваться до 40 единиц препарата.
- При общих суточных дозах >40 единиц препарата/сутки следует перейти на использование шприц-ручки Соликва СолоСтар® (30-60).
- Если лечение пациента начинается с использования шприц-ручки Соликва СолоСтар® (30-60), то с помощью этой шприц-ручки доза может титроваться до 60 единиц препарата.
- При общих суточных дозах >60 единиц препарата/сутки нельзя использовать препарат Соликва СолоСтар®.
Способ введения
Препарат Соликва СолоСтар® вводится в подкожно-жировую клетчатку передней брюшной стенки, плеч или бедер.
С целью уменьшения риска развития липодистрофии место инъекций следует менять при каждой новой инъекции в пределах одной из рекомендуемых областей для введения.
На скорость абсорбции и, соответственно, на начало и продолжительность действия могут влиять физическая нагрузка и другие изменяющиеся факторы, такие как стресс, интеркуррентные заболевания, или изменения одновременно принимаемых лекарственных препаратов или диеты.
Препарат Соликва СолоСтар® нельзя вводить внутривенно и внутримышечно.
После первого введения препарата шприц-ручкой можно пользоваться в течение 4 недель, храня при температуре ниже 25 °С в защищенном от света месте (не замораживать и не в холодильнике).
Более подробную информацию по проведению инъекций с помощью шприц-ручки Соликва СолоСтар® 10-40 смотрите далее в «Инструкции по использованию шприц-ручки Соликва СолоСтар® 10-40 (для доз 10-40 единиц препарата в сутки)».
Более подробную информацию по проведению инъекций с помощью шприц-ручки Соликва СолоСтар® 30-60 смотрите далее в «Инструкции по использованию шприц-ручки Соликва СолоСтар® 30-60 (для доз 30-60 единиц препарата в сутки)».
Применение в особых клинических группах пациентов
Дети и подростки до 18 лет
Безопасность и эффективность препарата Соликва СолоСтар® у детей и подростков младше 18 лет не установлена.
Пациенты в возрасте ≥65 лет
Препарат Соликва СолоСтар® можно применять у пациентов в возрасте ≥65 лет. Доза должна корректироваться индивидуально, исходя из мониторинга концентраций глюкозы в крови. Опыт применения препарата у пациентов в возрасте ≥75 лет ограничен.
Пациенты с печеночной недостаточностью
Влияние печеночной недостаточности на фармакокинетику препарата Соликва СолоСтар® не изучалось.
Коррекции дозы ликсисенатида у пациентов с печеночной недостаточностью не требуется. У пациентов с печеночной недостаточностью потребность в инсулине может уменьшаться вследствие снижения способности к глюконеогенезу и замедления метаболизма инсулина. У пациентов с печеночной недостаточностью может потребоваться частый мониторинг концентрации глюкозы в крови и коррекция дозы препарата Соликва СолоСтар®.
Пациенты с почечной недостаточностью
Отсутствует терапевтический опыт применения ликсисенатида у пациентов с почечной недостаточностью тяжелой степени (КК менее 30 мл/мин) и терминальной почечной недостаточностью, поэтому применение ликсисенатида у этих групп пациентов противопоказано. У пациентов с почечной недостаточностью легкой и средней степени тяжести может снижаться потребность в инсулине вследствие замедления метаболизма инсулина. У пациентов с почечной недостаточностью может потребоваться частый мониторинг концентрации глюкозы в крови и коррекция дозы препарата Соликва СолоСтар®.
Побочное действие
Указанные ниже нежелательные реакции (HP) представлены по системам органов (в соответствии с классификацией Медицинского словаря для нормативно-правовой деятельности (MedDRA)), при этом использовалась классификация частоты возникновения HP CIOMS (Совета международных организаций по медицинским наукам): очень часто (≥10%); часто (≥1%; <10%); нечасто (≥0,1%; редко (≥0,01%; очень редко (<0,01%), частота неизвестна (определить частоту встречаемости HP по имеющимся данным не представляется возможным).
Краткое описание профиля безопасности
Наиболее часто наблюдаемыми HP во время применения препарата Соликва СолоСтар® было развитие гипогликемии и HP со стороны ЖКТ (см. ниже «Описание отдельных HP»).
Перечень HP
Инфекционные и паразитарные заболевания
Нечасто: назофарингит, инфекции верхних дыхательных путей.
Нарушения со стороны иммунной системы
Нечасто: крапивница.
Нарушения обмена веществ и питания
Очень часто: гипогликемия.
Нарушения со стороны нервной системы
Часто: головокружение.
Нечасто: головная боль.
Нарушения со стороны ЖКТ
Часто: тошнота, диарея, рвота.
Нечасто: диспепсия, боли в животе.
Общие нарушения и нарушения в месте введения
Нечасто: чувство усталости, реакции в месте введения.
Описание отдельных HP
Гипогликемия
Эпизоды тяжёлой гипогликемии, особенно, если они возникают повторно, могут привести к развитию неврологических нарушений. Случаи длительной или тяжёлой гипогликемии могут представлять угрозу для жизни.
У многих пациентов признакам и симптомам нейрогликопении – недостатка глюкозы в головном мозге (чувство усталости, неадекватная утомляемость или слабость, снижение способности к концентрации внимания, сонливость, зрительные расстройства, головная боль, тошнота, спутанность или потеря сознания, судороги) предшествуют признаки адренергической контррегуляции (активации симпатической нервной системы в ответ на гипогликемию): чувство голода, раздражительность, нервное возбуждение или тремор, беспокойство, бледность, «холодный» пот, тахикардия, ощущение сердцебиения. В целом, чем значительнее и быстрее происходит снижение концентрации глюкозы крови, тем сильнее выражена адренергическая контррегуляция и ее проявления.
Документированные гипогликемические HP, протекающие с клинической симптоматикой, или тяжелые гипогликемические HP
| Пациенты, не получавшие лечения инсулином | Перевод с базального инсулина | ||||
| Соликва СолоСтар® | Инсулин гларгин | Ликсисенатид | Соликва СолоСтар® | Инсулин гларгин | |
| Количество пациентов | 469 | 467 | 233 | 365 | 365 |
| Документированная протекающая с клинической симптоматикой гипогликемия * | |||||
| Пациенты с эпизодом гипогликемии, к-во пациентов | 120 | 110 | 15 | 146 | 155 |
| (%) | (25,6%) | (23,6%) | (6,4%) | (40,0%) | (42,5%) |
| Эпизоды гипогликемии на один пациенто-год, к-во | 1,44 | 1,22 | 0,34 | 3,03 | 4,22 |
| Тяжелая гипогликемия** | |||||
| Эпизоды гипогликемии на один пациенто-год, к-во | 0 | <0,01 | 0 | 0,02 | <0,01 |
* Документированная, протекающая с клинической симптоматикой гипогликемия была эпизодом, во время которого типичные симптомы гипогликемии сочетались с установленной плазменной концентрацией глюкозы в крови ≤70 мг/дл (3,9 ммоль/л).
** Тяжелая протекающая с клинической симптоматикой гипогликемия была эпизодом, потребовавшим помощи других людей для того, чтобы активно ввести углеводы, глюкагон или провести другие мероприятия, направленные на поддержание основных жизненных функций организма.
Нарушения со стороны ЖКТ
HP со стороны ЖКТ (тошнота, рвота и диарея) были часто наблюдаемыми HP во время лечения. У пациентов, получающих лечение препаратом Соликва СолоСтар®, частота тошноты, диареи и рвоты, связанных с лечением, составляла 8,4%, 2,2% и 2,2%, соответственно. HP со стороны ЖКТ в своем большинстве были умеренно выраженными и преходящими. У пациентов, получавших лечение ликсисенатидом, частота тошноты, диареи и рвоты, связанных с лечением, составляла 22,3%, 3% и 3,9% соответственно.
Липодистрофия
Подкожное введение инъекционных препаратов, содержащих инсулин, может привести к развитию липоатрофии в месте инъекции (уменьшения подкожно-жировой ткани) или липогипертрофии (повышения плотности тканей).
Нарушения со стороны иммунной системы
Сообщалось о развитии аллергической реакции (крапивница), возможно связанной с применением препарата Соликва СолоСтар® у 0,3% пациентов.
Во время постмаркетингового применения инсулина гларгин и ликсисенатида наблюдались случаи генерализованных аллергических реакций, включая анафилактические реакции и ангионевротический отек.
Образование антител
Применение препарата Соликва СолоСтар® может вызывать образование антител к инсулину гларгин и/или ликсисенатиду (см. раздел «Особые указания»).
Реакции в месте введения
У некоторых пациентов, получающих инсулинотерапию, включая препарат Соликва СолоСтар®, наблюдались эритема, локальный отек, зуд в месте инъекции. Эти явления обычно постепенно уменьшались и проходили без лечения.
Передозировка
Симптомы
Имеются ограниченные клинические данные в отношении передозировки препарата Соликва СолоСтар®.
Возможно развитие гипогликемии и HP со стороны ЖКТ в случае превышения требуемой дозы препарата Соликва СолоСтар®.
Лечение
Эпизоды гипогликемии легкой степени выраженности обычно могут купироваться приемом легкоусвояемых углеводов внутрь. Может потребоваться коррекция дозы препарата, диеты или интенсивности физической нагрузки.
Более тяжелые эпизоды гипогликемии, вплоть до развития комы, судорог или неврологических нарушений могут купироваться внутримышечным/подкожным введением глюкагона или внутривенным введением концентрированного раствора декстрозы (глюкозы). Может потребоваться длительный прием углеводов и наблюдение врача, так как после видимого клинического улучшения возможен рецидив гипогликемии.
В зависимости от клинических проявлений и симптомов следует начать терапию, поддерживающую основные жизненные функции, а доза препарата Соликва СолоСтар® должна быть снижена до предписанной пациенту дозы.
Взаимодействие с другими лекарственными средствами
Исследования по взаимодействию препарата Соликва СолоСтар® с другими лекарственными средствами не проводились.
Инсулин гларгин
Ряд лекарственных средств влияет на метаболизм глюкозы, вследствие чего при их одновременном применении с инсулином может потребоваться коррекция дозы инсулина и особенно тщательное наблюдение, включая мониторинг концентрации глюкозы в крови.
- Лекарственные средства, которые могут увеличивать гипогликемическое действие инсулина и склонность к развитию гипогликемии: пероральные гипогликемические препараты, ингибиторы ангиотензинпревращающего фермента (АПФ), салицилаты, дизопирамид; фибраты; флуоксетин, ингибиторы моноаминоксидазы (МАО); пентоксифиллин; пропоксифен; противомикробные средства из группы сульфаниламидов.
- Лекарственные средства, которые могут ослаблять гипогликемическое действие инсулина: глюкокортикостероиды и минералокортикостероиды, даназол, диазоксид, диуретики, симпатомиметические препараты (такие как эпинефрин, сальбутамол, тербуталин); глюкагон, изониазид, производные фенотиазина; соматропин; гормоны щитовидной железы; эстрогены, прогестагены (например, в составе пероральных контрацептивов), ингибиторы протеаз и атипичные нейролептики (например, оланзапин и клозапин).
- Бета-адреноблокаторы, клонидин, соли лития и этанол могут, как усиливать, так и ослаблять гипогликемический эффект инсулина.
- Пентамидин может вызывать гипогликемию, после которой в некоторых случаях может развиваться гипергликемия.
Помимо этого, под воздействием симпатолитических лекарственных средств, таких как бета-адреноблокаторы, клонидин, гуанетидин и резерпин, признаки адренергической контррегуляции (активации симпатической нервной системы в ответ на гипогликемию) могут быть менее выражены или отсутствовать.
Ликсисенатид
Ликсисенатид является пептидом и не метаболизируется с помощью изоферментов системы цитохрома Р450. В исследованиях in vitro ликсисенатид не влиял на активность протестированных изоферментов системы цитохрома Р450 или транспортеров у человека.
Влияние задержки опорожнения желудка на абсорбцию принимаемых внутрь лекарственных препаратов
Задержка опорожнения желудка при применении ликсисенатида может уменьшить скорость абсорбции лекарственных препаратов, принимаемых внутрь. Следует соблюдать осторожность при одновременном приеме внутрь лекарственных препаратов с узким терапевтическим диапазоном или требующих тщательного клинического мониторинга. Если такие препараты следует принимать во время еды, пациентам следует рекомендовать их прием с тем приемом пищи, когда не вводится ликсисенатид. Лекарственные препараты для приема внутрь, эффективность которых особенно зависит от пороговых концентраций, такие как антибиотики, следует принимать не менее чем за 1 ч до или через 4 ч после инъекции препарата Соликва СолоСтар®.
Гастрорезистентные препараты следует принимать не менее чем за 1 ч до-или через 4 ч после инъекции препарата Соликва СолоСтар®.
С парацетамолом
Коррекции доза парацетамола при одновременном применении с препаратом Соликва СолоСтар® не требуется, однако в случае необходимости быстрого начала действия парацетамола, его следует принимать через 1-4 часа после инъекции препарата Соликва СолоСтар® в виду возможного увеличения tmax парацетамола в плазме крови.
С пероральными контрацептивными препаратами
Пациенткам, применяющим пероральные контрацептивные препараты, следует рекомендовать принимать не менее чем за 1 ч до или через 11 ч после инъекции препарата Соликва СолоСтар®.
С аторвастатином
Пациентам, принимающим аторвастатин, следует рекомендовать его прием не менее чем за 1 ч до или через 11 ч после инъекции препарата Соликва СолоСтар®.
С варфарином
Коррекции дозы варфарина при его совместном применении с препаратом Соликва СолоСтар® не требуется, однако рекомендуется частый мониторинг международного нормализованного отношения (МНО) в начале и после окончания терапии препаратом Соликва СолоСтар®.
С дигоксином
Коррекции дозы дигоксина при его совместном применении с препаратом Соликва СолоСтар® не требуется.
С рамиприлом
Коррекции дозы рамиприла при его совместном применении с препаратом Соликва СолоСтар® не требуется.
Особые указания
Препарат Соликва СолоСтар® противопоказан у пациентов с сахарным диабетом 1 типа или для лечения кетоацидоза.
Перевод с агониста рецептора ГПП-1 на препарат Соликва СолоСтар® не изучался.
Не изучалось одновременное применение препарата Соликва СолоСтар® с ингибиторами дипептидилпептидазы IV, производными сульфонилмочевины, глинидами, пиоглитазоном и ингибиторами натрий-зависимых переносчиков глюкозы.
Риск панкреатита
Применение агонистов рецептора ГПП-1 ассоциировалось с риском развития острого панкреатита. Зарегистрированы редкие случаи острого панкреатита при применении ликсисенатида, хотя не было установлено причинно-следственной взаимосвязи между ними. Пациенты должны быть проинформированы о характерных симптомах панкреатита: длительно сохраняющиеся (персистирующие) сильные боли в животе. При подозрении на панкреатит применение препарата Соликва СолоСтар® следует прекратить. Если подтвердится диагноз острого панкреатита, не следует возобновлять лечение препаратом Соликва СолоСтар®. Препарат Соликва СолоСтар® следует применять с осторожностью у пациентов с панкреатитом в анамнезе.
Гипогликемия
Гипогликемия является наиболее часто встречавшимся нежелательным эффектом во время лечения препаратом Соликва СолоСтар®. Гипогликемия может наблюдаться, если доза препарата Соликва СолоСтар® выше, чем потребность в нем. Факторы, увеличивающие предрасположенность к гипогликемии, требуют тщательного мониторинга и могут потребовать коррекцию режима дозирования. К этим факторам относятся:
— изменение области инъекции;
— повышение чувствительности к инсулину (например, из-за прекращения действия стрессовых факторов);
— непривычные, более тяжелые или более длительные физические нагрузки;
— сопутствующие заболевания (например, рвота, диарея);
— недостаточное потребление пищи;
— пропуск приема пищи;
— употребление алкоголя (этанола);
— некоторые некомпенсированные эндокринные нарушения (такие как гипотиреоз и недостаточность гормонов передней доли гипофиза или коры надпочечников);
— сопутствующая терапия некоторыми лекарственными препаратами (см. раздел «Взаимодействие с другими лекарственными средствами»).
Доза препарата Соликва СолоСтар® должна подбираться индивидуально по клиническому эффекту и титроваться, исходя из потребности пациента в инсулине (см. раздел «Способ применения и дозы»).
Пролонгированное действие введенного подкожно инсулина гларгин может замедлить выход пациента из состояния гипогликемии.
При одновременном применении ликсисенатида и/или инсулина с производными сульфонилмочевины повышен риск развития гипогликемии, в связи с чем, препарат Соликва СолоСтар® не следует применять в сочетании с препаратами сульфонилмочевины.
Применение у пациентов с тяжелым гастропарезом
Применение агонистов рецептора ГПП-1 может ассоциироваться с HP со стороны ЖКТ. Препарат Соликва СолоСтар® не изучался у пациентов с тяжелыми заболеваниями ЖКТ, включая тяжелый гастропарез, и поэтому применение препарата Соликва СолоСтар® у данных пациентов противопоказано.
Почечная недостаточность
Отсутствует терапевтический опыт применения препарата у пациентов с почечной недостаточностью тяжелой степени (КК менее 30 мл/мин) или с терминальной стадией почечной недостаточности. Применение препарата противопоказано у пациентов с почечной недостаточностью тяжелой степени (КК менее 30 мл/мин) или терминальной почечной недостаточностью (см. раздел «Способ применения и дозы», подраздел «Применение в особых клинических группах пациентов»).
Одновременное применение лекарственных препаратов
Замедление опорожнения желудка ликсисенатидом может уменьшать скорость абсорбции лекарственных препаратов, принимаемых внутрь.
Препарат Соликва СолоСтар® следует применять с осторожностью у пациентов, принимающих лекарственные препараты, требующие быстрой абсорбции из ЖКТ, нуждающиеся в тщательном клиническом мониторинге или имеющие узкий терапевтический диапазон (см. раздел «Взаимодействие с другими лекарственными средствами»).
Дегидратация
Пациентов, получающих лечение препаратом Соликва СолоСтар®, следует информировать о потенциальном риске дегидратации в связи с развитием HP со стороны ЖКТ и о соблюдении мер предосторожности во избежание потери жидкости.
Образование антител
Применение препарата Соликва СолоСтар® может вызывать образование антител к инсулину гларгин и/или ликсисенатиду. В редких случаях наличие таких антител может потребовать изменения дозы препарата Соликва СолоСтар® с целью коррекции тенденции к развитию гипер- или гипогликемии.
Фертильность
Исследования, проведенные на животных с инсулином гларгин и ликсисенатидом, не показали их непосредственного неблагоприятного воздействия на фертильность.
Вспомогательные вещества
Препарат Соликва СолоСтар® содержит метакрезол, который может вызывать развитие аллергических реакций.
Предотвращение ошибок при введении препарата
Пациенты должны быть проинструктированы о необходимости всегда проверять этикетку шприц-ручки перед каждым введением препарата, чтобы избежать случайного перепутывания между собой двух шприц-ручек Соликва СолоСтар®, имеющих различные концентрации действующих веществ, или перепутывания с другими шприц-ручками с другими инъекционными противодиабетическими препаратами.
Для того чтобы избежать ошибок дозирования препарата и передозировки, пациенты и медицинские работники никогда не должны использовать шприц для извлечения препарата из картриджа предварительно заполненной шприц-ручки Соликва СолоСтар®.
Влияние на способность управлять транспортными средствами и механизмами
Способность пациента к концентрации внимания и его реакция могут быть нарушены в результате развития гипогликемии или гипергликемии, или в результате нарушения зрения. Это может представлять риск в ситуациях, когда эти способности имеют особое значение (например, при управлении транспортными средствами или работе с механизмами).
Пациентам следует рекомендовать принимать меры предосторожности для того, чтобы избежать развития гипогликемии во время управления транспортными средствами. Это особенно важно у тех пациентов, у которых ослаблено или отсутствует распознавание симптомов, предвещающих развитие гипогликемии, или у пациентов с частыми эпизодами гипогликемии. В таких случаях должен быть рассмотрен вопрос о целесообразности управления транспортными средствами или механизмами.
Форма выпуска
Раствор для подкожного введения, 100 ЕД/мл + 50 мкг/мл и 100 ЕД/мл + 33 мкг/мл.
По 3 мл препарата в картридж из бесцветного стекла (тип I). Картридж обжат с одной стороны алюминиевым колпачком с уплотнительным диском и укупорен с другой – плунжером. Картридж вмонтирован в одноразовую шприц-ручку СолоСтар®. По 3 или 5 шприц-ручек СолоСтар® вместе с инструкцией по применению в картонную пачку, снабженную картонным фиксатором.
Условия хранения
Хранить при температуре от 2 °С до 8 °С в защищенном от света месте. Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять препарат после истечения срока годности.
Условия отпуска
Отпускается по рецепту.
Производитель
Производство готовой лекарственной формы и фасовщик (первичная упаковка)
Санофи-Авентис Дойчланд ГмбХ, Германия.
Sanofi-Aventis Deutschland GmbH, Germany.
Brueningstrasse 50, 65926 Frankfurt am Main, Germany.
Упаковщик (вторичная (потребительская) упаковка) и выпускающий контроль качества
1. Санофи-Авентис Дойчланд ГмбХ, Германия.
Sanofi-Aventis Deutschland GmbH, Germany.
Brueningstrasse 50, 65926 Frankfurt am Main, Germany.
2. ЗАО «Санофи-Авентис Восток», Россия.
302516, Орловская область, Орловский район, с/п Большекуликовское, ул. Ливенская, д. 1.
Претензии потребителей направлять по адресу в России:
АО «Санофи Россия».
125009, г. Москва, ул. Тверская, 22.
В случае упаковки препарата на ЗАО «Санофи-Авентис Восток», Россия, претензии потребителей направлять по адресу в России:
302516, Россия, Орловская область, Орловский район, с/п Большекуликовское, ул. Ливенская, д. 1.
В случае использования шприц-ручки Соликва СолоСтар® 10-40 к инструкции по медицинскому применению лекарственного препарата Соликва СолоСтар® прилагается «Инструкция по использованию шприц-ручки Соликва СолоСтар® 10-40 (для доз 10-40 единиц препарата в сутки)».
Инструкция по использованию шприц-ручки Соликва СолоСтар® 10-40 (для доз 10-40 единиц препарата в сутки)
В шприц-ручках Соликва СолоСтар® содержится инсулин гларгин и ликсисенатид в фиксированном соотношении.
Лекарственная комбинация в шприц-ручке Соликва СолоСтар® 10-40 предназначена для ежедневного введения от 10 до 40 ЕД инсулина гларгин и от 5 мкг до 20 мкг ликсисенатида.
- Никогда не используйте иглы повторно. В случае повторного использования иглы Вы можете не получить нужную Вам дозу (введение меньшей дозы) или получить слишком большую дозу (передозировка), так как возможна закупорка иглы.
- Никогда не используйте шприц для извлечения препарата из шприц-ручки. При использовании шприца Вы не сможете получить правильное количество препарата.
Сохраните эту инструкцию для обращения к ней за справками в будущем.
Важная информация
- Никогда не пользуйтесь одной шприц-ручкой одновременно с другим человеком – она предназначена для индивидуального использования.
- Никогда не пользуйтесь шприц-ручкой, если она повреждена или Вы не уверены в том, что она исправна.
- Всегда проводите тест на безопасность.
- Всегда имейте при себе запасную шприц-ручку и запасные иглы, на тот случай, если они потеряются или станут неисправными.
- Перед тем как начать пользоваться шприц-ручкой, узнайте у медицинского работника, как правильно проводить (подкожную инъекцию.
- В случае наличия у Вас затруднений при обращении с этой шприц-ручкой, например, в случае проблем со зрением, Вам может потребоваться помощь других лиц, способных следовать всем рекомендациям данной инструкции по пользованию шприц-ручкой Соликва СолоСтар®.
- Перед использованием шприц-ручки, прочитайте эту инструкцию. Если Вы не будете следовать всем ее рекомендациям, Вы можете получить слишком много или слишком мало препарата.
Дополнительные средства, которые Вам потребуются:
- Новая стерильная игла (см. ШАГ 2).
- Спиртовая салфетка.
- Резистентный к проколам контейнер для использованных игл и шприц-ручек (см. раздел «Утилизация шприц-ручек»).
Указание мест для проведения инъекций
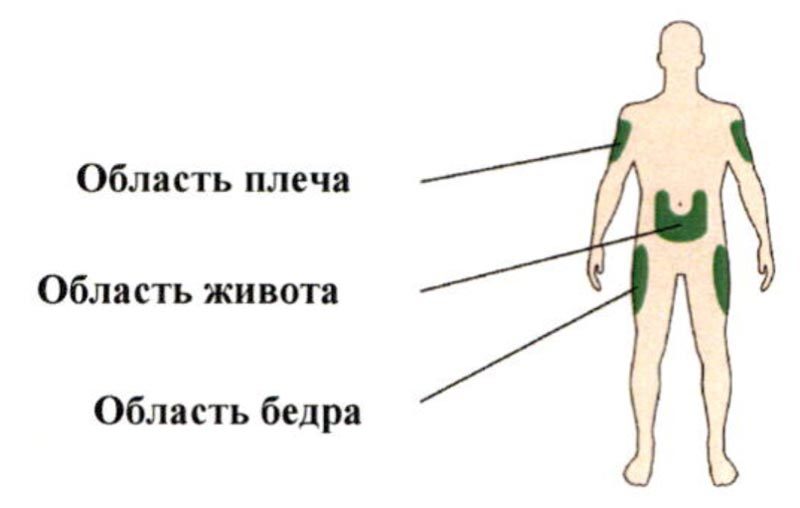
Внешний вид шприц-ручки Соликва СолоСтар® 10-40
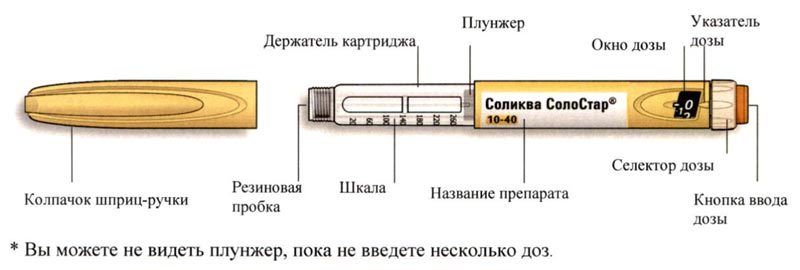
ШАГ 1: Проверка шприц-ручки
Выньте новую шприц-ручку из холодильника не менее чем за 1 час до проведения инъекции. Введение холодного препарата является более болезненным.
A. Проверка названия и срока годности на этикетке шприц-ручки.
Удостоверьтесь в том, что у Вас правильный (нужный Вам) препарат. Шприц-ручка Соликва СолоСтар® 10-40 имеет желтый цвет.
- Не используйте шприц-ручку Соликва СолоСтар® 10-40, если Вы нуждаетесь в суточной дозе менее 10 единиц или больше 40 единиц препарата.
- Не используйте шприц-ручку после окончания срока годности.

B. Снимите колпачок со шприц-ручки.
C. Проверьте прозрачность препарата.
- Не используйте шприц-ручку, если раствор препарата мутный, имеет окраску или содержит частицы.
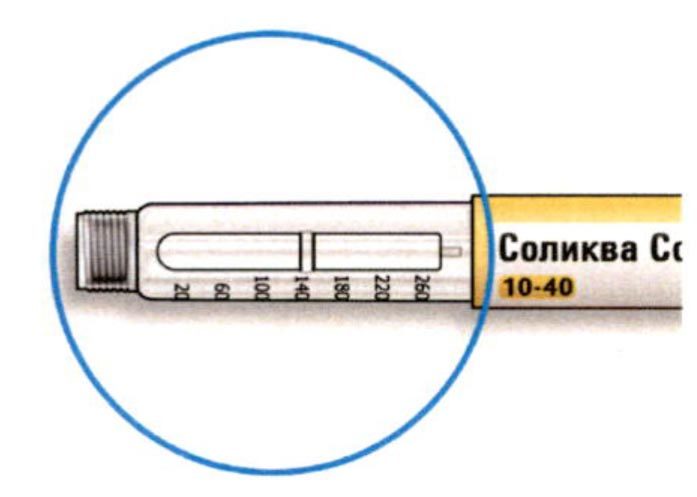
D. Протрите резиновую герметизирующую пробку спиртовой салфеткой.
Если у Вас имеются другие шприц-ручки
- Если Вы имеете другие шприц-ручки, особенно важно удостовериться в том, что Вы взяли правильный (нужный Вам) препарат.
ШАГ 2: Присоединение новой иглы
- Не используйте иглы повторно. Всегда используйте новую стерильную иглу для каждой инъекции. Это поможет предотвратить закупорку иглы, контаминацию (загрязнение) иглы и инфекцию.
- Всегда используйте иглы, которые совместимы со шприц ручкой Соликва СолоСтар®, например, иглы BD Микро-Файн® Плюс (BD Micro-Fine® Plus), Юнифайн® Пентипс® Плюс (Unifine® Pentips® Plus), Инсупен (Insupen).
A. Возьмите новую иглу и удалите защитное покрытие.
B. Держите иглу прямо перед шприц-ручкой и прикрутите ее на шприц-ручку до фиксации. Не прилагайте чрезмерных усилий при прикручивании иглы.
C. Снимите наружный колпачок иглы. Сохраните его для использования в дальнейшем.
D. Снимите внутренний колпачок с иглы и выбросьте его.
Обращение с иглами
- Будьте осторожны при обращении с иглами – это предотвратит повреждение иглой и перекрестное инфицирование.
ШАГ 3: Проведите тест на безопасность
Обязательно перед каждой инъекцией проводите тест на безопасность – он проводится для проверки того, что шприц-ручка и игла работают надлежащим образом, а также для того чтобы быть уверенным, что Вы введете правильную дозу препарата.
A. Наберите 2 единицы препарата путем вращения селектора дозы до того момента, когда указатель дозы не окажется на отметке 2.
B. Нажмите до упора на кнопку ввода дозы.
- Если препарат выходит из кончика иглы, шприц-ручка работает правильно.
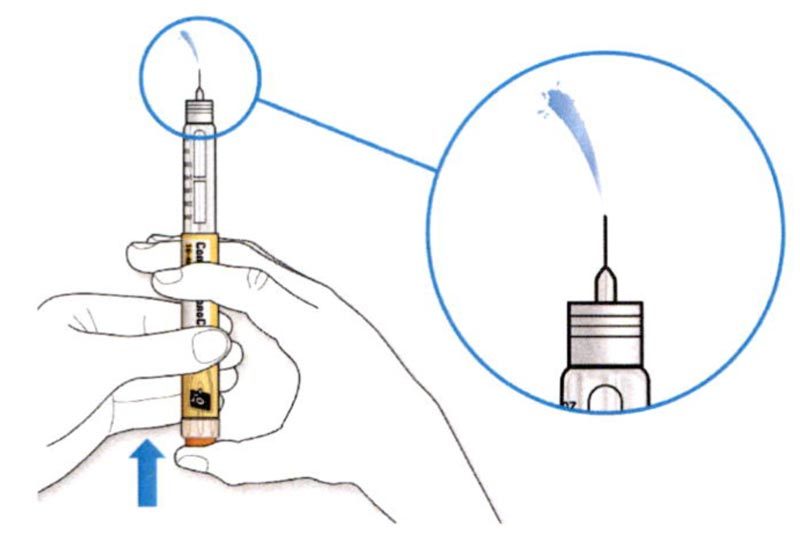
Если жидкость не показывается из кончика иглы:
- Вам может потребоваться повторить этот шаг до 3-х раз, перед тем как покажется препарат.
- Если препарат не выходит из кончика иглы после третьего повтора этого шага, возможно, имеет место закупорка иглы. Если это произошло:
- Замените иглу (см. ШАГ 6 и ШАГ 2).
- Затем повторите тест на безопасность (ШАГ 3).
- Не используйте шприц-ручку, если препарат все же не выходит из кончика иглы. Используйте новую шприц-ручку.
- Никогда не используйте шприц для извлечения препарата из шприц-ручки.
Если Вы видите пузырьки воздуха
- Вы можете видеть пузырьки воздуха в препарате. Это нормально, они не причинят Вам вреда.
ШАГ 4: Набор дозы
- Используйте шприц-ручку только для введения однократной суточной дозы от 10 до 40 единиц препарата.
- Никогда не набирайте дозу и не нажимайте на кнопку введения дозы без присоединенной иглы. Это может повредить шприц-ручку.
A. Удостоверьтесь в том, что игла присоединена и доза установлена на ‘0’.
B. Вращайте селектор дозы до тех пор, пока указатель дозы не окажется на одной линии с нужной Вам дозой.
- Если Вы провернули селектор дозы дальше нужной Вам дозы, то можно повернуть его назад.
- Если в шприц-ручке нет достаточного количества единиц препарата для нужной Вам дозы, селектор дозы остановится на количестве оставшихся в шприц-ручке единиц препарата.
- Если Вы не можете набрать всю назначенную Вам дозу, используйте новую шприц-ручку или введите оставшиеся в шприц-ручке единицы препарата и используйте новую шприц-ручку для того, чтобы ввести недостающие единицы препарата до полной дозы. Только в этом случае допускается введение оставшейся дозы менее 10 единиц препарата. Всегда используйте другую шприц-ручку Соликва СолоСтар® 10-40, чтобы дополнить необходимую Вам дозу, а не шприц-ручку Соликва СолоСтар® 30-60.
Как читать показания окна дозы
- Не используйте шприц-ручку, если Ваша однократная суточная доза менее 10 единиц препарата, которые показываются в виде белых цифр на черном фоне.
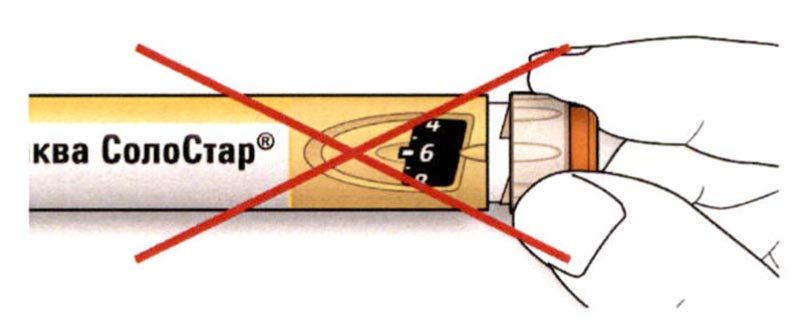
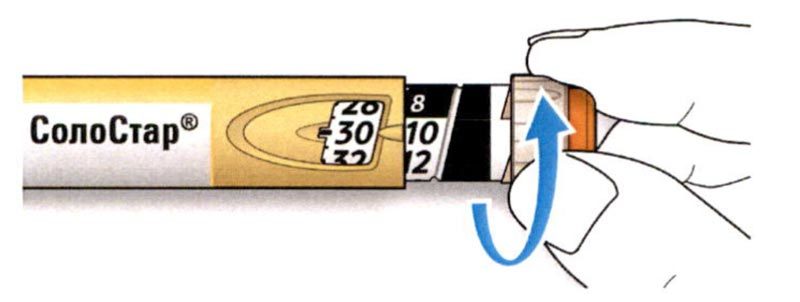
Единицы препарата в шприц-ручке
- Шприц-ручка содержит в общей сложности 300 единиц препарата. Вы может набирать Вашу дозу с шагом в 1 единицу.
- Не используйте эту шприц-ручку, если Вы нуждаетесь в суточной дозе менее 10 единиц или более 40 единиц препарата.
- Каждая шприц-ручка содержит более одной дозы.
ШАГ 5: Введение дозы
Если Вы испытываете затруднения при нажатии на кнопку ввода дозы, не применяйте силу, так как это может повредить шприц-ручку. За помощью обратитесь к ШАГУ 5Е ниже.
A. Выберите место для инъекции, как показано на рисунке выше.
B. Введите иглу в кожу, как Вам было показано Вашим медицинским работником.
- Не прикасайтесь пока к кнопке ввода дозы.
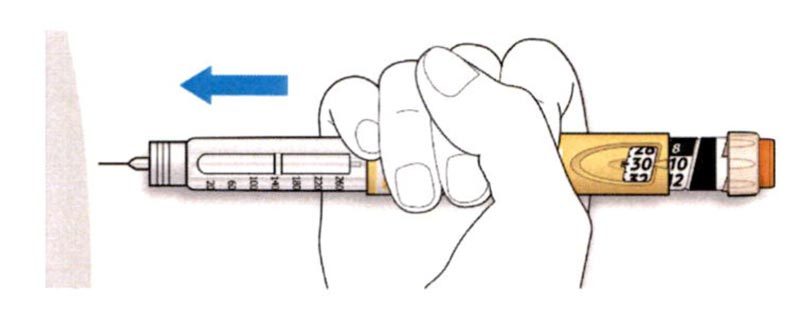
C. Поместите большой палец на кнопку ввода дозы. Затем нажмите до упора и удерживайте в этом положении.
- Не нажимайте на кнопку ввода дозы под углом – большой палец может блокировать проворачивание селектора дозы.
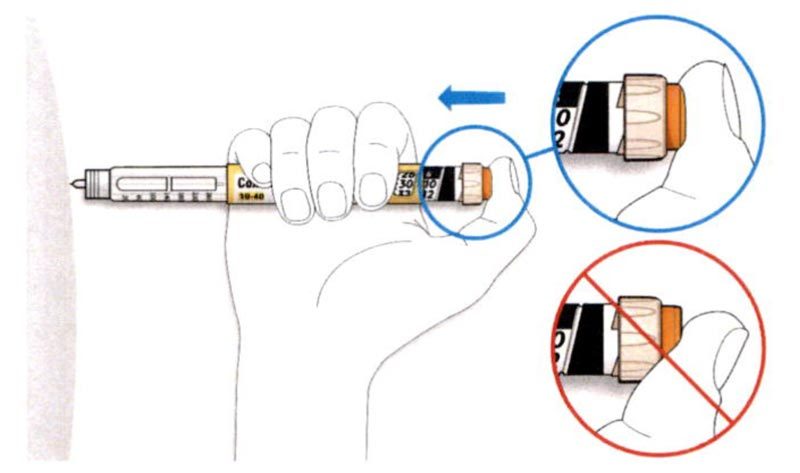
D. Нажимайте на кнопку ввода дозы, и когда вы увидите «0» в окне дозы, медленно досчитайте до 10.
- Это будет гарантировать, что Вы ввели полную дозу.
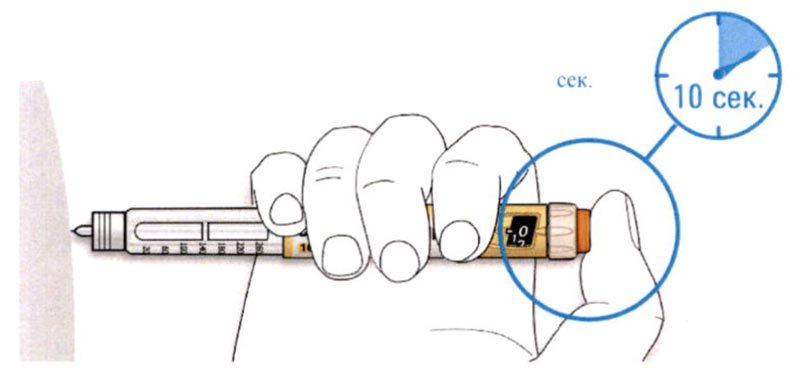
E. После удерживания кнопки ввода дозы и счета до 10 отпустите кнопку ввода. Затем извлеките иглу из кожи.
Если возникают затруднения при нажимании на кнопку ввода
- Смените иглу (см. ШАГ 6 и ШАГ 2), затем проведите тест на безопасность (см. ШАГ 3)
- Если все равно сохраняются затруднения при нажатии на кнопку ввода, возьмите новую шприц-ручку.
- Никогда не используйте шприц для извлечения препарата из шприц-ручки.
ШАГ 6: Удаление иглы
- Будьте осторожны при обращении с иглами – это предотвратит повреждение иглой и перекрестную инфекцию.
- Никогда не надевайте внутренний колпачок иглы назад на использованную иглу.
A. Возьмите наружный колпачок иглы двумя пальцами. Держите иглу прямо и введите ее в наружный колпачок иглы.
- Если игла будет введена в колпачок под углом, она может его проткнуть.
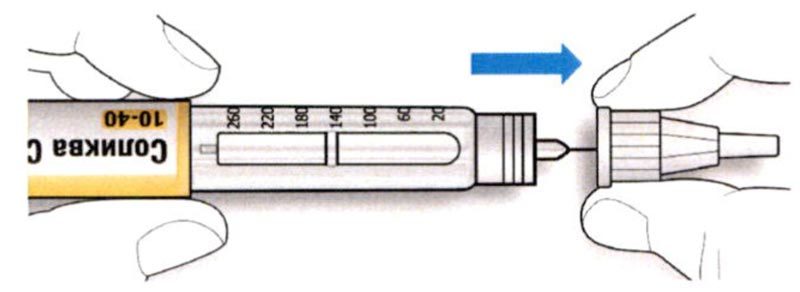
B. Крепко обхватите широкую часть наружного колпачка иглы. Прокрутите Вашу шприц-ручку несколько раз другой рукой, чтобы снять иглу.
- Если игла не снялась с первого раза, повторите попытку.
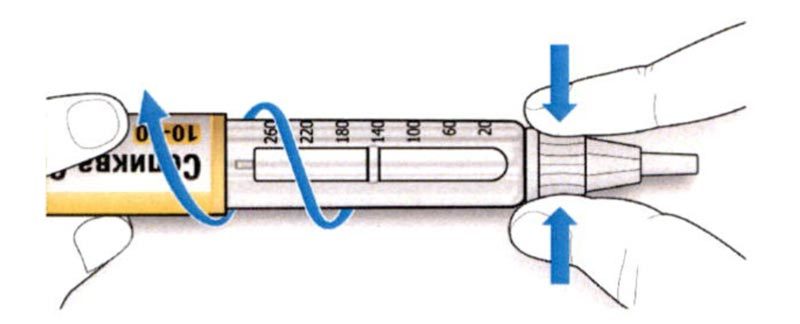
C. Выбросьте использованную иглу в резистентный к проколам контейнер (см. раздел «Утилизация шприц-ручки»).
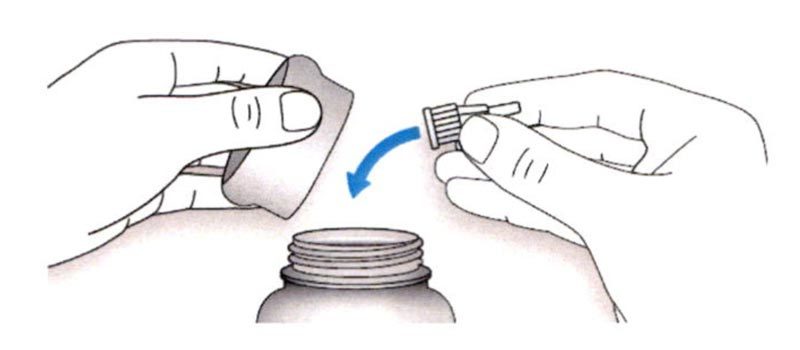
D. Закройте шприц-ручку ее колпачком
- Не помещайте шприц-ручку в холодильник.
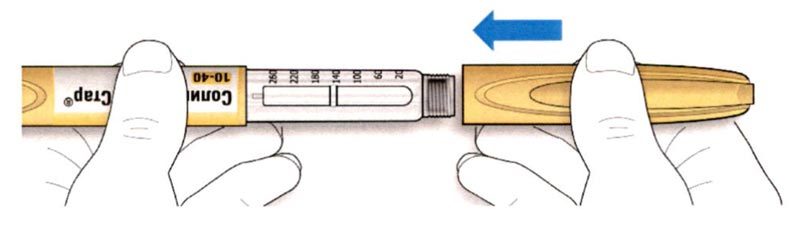
Срок использования
- Шприц-ручку можно применять только в течение 4 недель после начала использования.
Как хранить шприц-ручку
Перед первым использованием
- Храните новые шприц-ручки в холодильнике при температуре 2°С – 8°С.
- Шприц-ручки нельзя замораживать.
После первого использования
- Храните шприц-ручку при температуре ниже 25 °С.
- Не помещайте шприц-ручку обратно в холодильник.
- Не нагревайте шприц-ручку.
- Не подвергайте шприц-ручку воздействию прямого света.
- Никогда не храните шприц-ручку с присоединенной иглой.
- Храните шприц-ручку, закрытой колпачком, для защиты от света.
- Шприц-ручку можно применять только в течение 4 недель после начала использования.
Обращение со шприц-ручкой
Обращайтесь со шприц-ручкой с осторожностью.
- Не роняйте шприц-ручку, избегайте ее удара о твердые поверхности.
- Если Вы думаете, что шприц-ручка, возможно, повреждена, не пытайтесь починить ее, используйте новую шприц-ручку.
Предохраняйте шприц-ручку от попадания пыли и грязи.
- Вы можете очищать наружную поверхность шприц-ручки, протирая ее влажной тканью. Не замачивайте, не мойте и не смазывайте шприц-ручку – это может повредить ее.
Утилизация шприц-ручки
- Снимите иглу, перед тем как выбросить шприц-pyчку.
- Утилизируйте использованные шприц-ручки согласно указаниям медицинского работника.
В случае использования шприц-ручки Соликва СолоСтар® 30-60 к инструкции по медицинскому применению лекарственного препарата Соликва СолоСтар® прилагается «Инструкция по использованию шприц-ручки Соликва СолоСтар® 30-60 для доз 30-60 единиц препарата в сутки».
Инструкция по использованию шприц-ручки Соликва СолоСтар® 30-60 (для доз 30-60 единиц препарата в сутки)
В шприц-ручках Соликва СолоСтар® содержится инсулин гларгин и ликсисенатид в фиксированном соотношении. Лекарственная комбинация в шприц-ручке Соликва СолоСтар® 30-60 предназначена для ежедневного введения от 30 до 60 ЕД инсулина гларгин и от 10 мкг до 20 мкг ликсисенатида.
- Никогда не используйте иглы повторно. В случае повторного использования иглы Вы можете не получить нужную Вам дозу (введение меньшей дозы) или получить слишком большую дозу (передозировка), так как возможна закупорка иглы.
- Никогда не используйте шприц для извлечения препарата из шприц-ручки. При использовании шприца Вы не сможете получить правильное количество препарата.
Сохраните эту инструкцию для обращения к ней за справками в будущем.
Важная информация
- Никогда не пользуйтесь одной шприц-ручкой одновременно с другим человеком – она предназначена для индивидуального использования.
- Никогда не пользуйтесь шприц-ручкой, если она повреждена, или Вы не уверены в том, что она исправна.
- Всегда проводите тест на безопасность.
- Всегда имейте при себе запасную шприц-ручку и запасные иглы, на тот случай, если они потеряются или станут неисправными.
- Перед тем как начать пользоваться шприц-ручкой, узнайте у медицинского работника, как правильно проводить подкожную инъекцию.
- В случае наличия у Вас затруднений при обращении с этой шприц-ручкой, например, в случае проблем со зрением, Вам может потребоваться помощь других лиц, способных следовать всем рекомендациям данной инструкции по пользованию шприц-ручкой Соликва СолоСтар®.
- Перед использованием шприц-ручки, прочитайте эту инструкцию. Если Вы не будете следовать всем ее рекомендациям, Вы можете получить или слишком много или слишком мало препарата.
Дополнительные средства, которые Вам потребуются:
- Новая стерильная игла (см. ШАГ 2).
- Спиртовая салфетка.
- Резистентный к проколам контейнер для использованных игл и шприц-ручек (см. раздел «Утилизация шприц-ручек»).
Указание мест для проведения инъекций
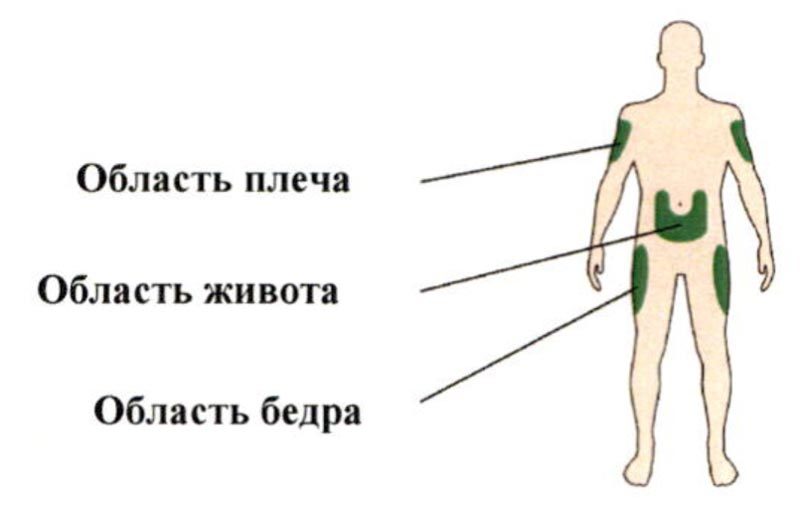
Внешний вид шприц-ручки Соликва СолоСтар® 30-60
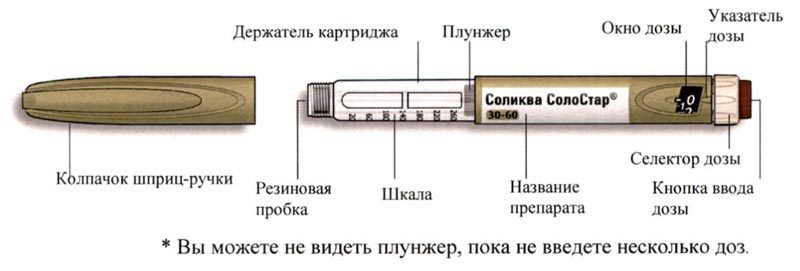
ШАГ 1: Проверка шприц-ручки
Выньте новую шприц-ручку из холодильника не менее чем за 1 час до проведения инъекции. Введение холодного препарата является более болезненным.
A. Проверка названия и срока годности на этикетке шприц-ручки.
- Удостоверьтесь в том, что у Вас правильный (нужный Вам) препарат. Шприц-ручка Соликва СолоСтар® 30-60 имеет оливковый цвет.
- Не используйте шприц-ручку Соликва СолоСтар® 30-60, если Вы нуждаетесь в суточной дозе менее 30 единиц или больше 60 единиц препарата.
- Не используйте шприц-ручку после окончания срока годности.

B. Снимите колпачок со шприц-ручки.
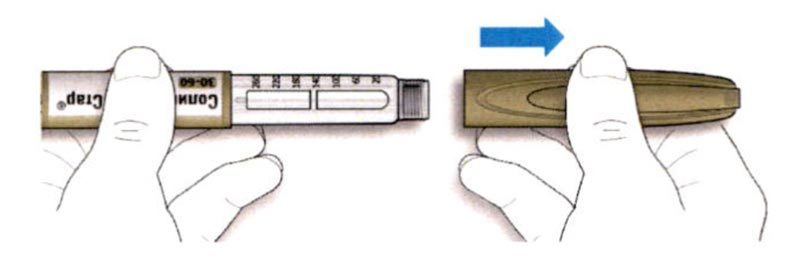
C. Проверьте прозрачность препарата.
- Не используйте шприц-ручку, если раствор препарата мутный, имеет окраску или содержит частицы.
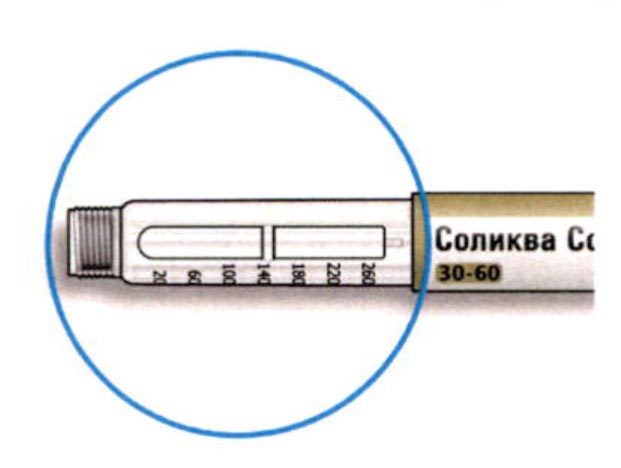
D. Протрите резиновую герметизирующую пробку спиртовой салфеткой.
Если у Вас имеются другие шприц-ручки
- Если Вы имеете другие шприц-ручки, особенно важно удостоверится в том, что Вы взяли правильный (нужный Вам) препарат.
ШАГ 2: Присоединение новой иглы
- Не используйте иглы повторно. Всегда используйте новую стерильную иглу для каждой инъекции. Это поможет предотвратить закупорку иглы, контаминацию иглы и инфекцию.
- Всегда используйте иглы, которые совместимы со шприц ручкой Соликва СолоСтар®, например, иглы компаний BD Микро-Файн® Плюс (BD Micro-Fine® Plus), Юнифайн® Пентипс® Плюс (Unifine® Pentips® Plus), Инсупен (Insupen).
A. Возьмите новую иглу и удалите защитное покрытие.
B. Держите иглу прямо перед шприц-ручкой и прикрутите ее на шприц-ручку до фиксации. Не прилагайте чрезмерных усилий при прикручивании иглы.
C. Снимите наружный колпачок иглы. Сохраните его для использования в дальнейшем.
D. Снимите внутренний колпачок с иглы и выбросьте его.
Обращение с иглами
- Будьте осторожны при обращении с иглами – это предотвратит повреждение иглой и перекрестное инфицирование.
ШАГ 3: Проведите тест на безопасность
Обязательно перед каждой инъекцией проводите тест на безопасность – он проводится для проверки того, что шприц-ручка и игла работают надлежащим образом, а также для того чтобы быть уверенным, что Вы введете правильную дозу препарата.
A. Наберите 2 единицы препарата путем вращения селектора дозы до того момента, когда указатель дозы не окажется на отметке 2.
B. Нажмите до упора на кнопку проведения инъекций.
- Если препарат выходит из кончика иглы, шприц-ручка работает правильно.
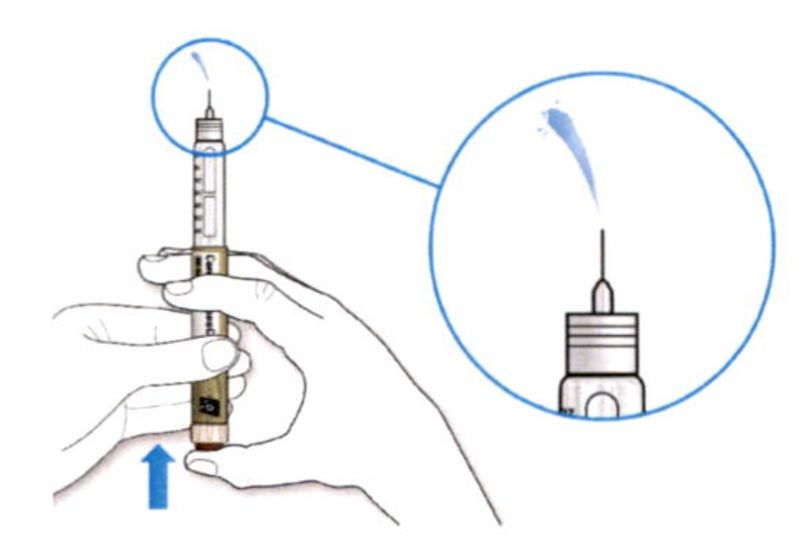
Если жидкость не показывается из кончика иглы:
- Вам может потребоваться повторить этот шаг до 3-х раз, перед тем как покажется препарат.
- Если препарат не выходит из кончика иглы после третьего повтора этого шага, возможно, имеет место закупорка иглы. Если это произошло:
- Замените иглу (см. ШАГ 6 и ШАГ 2).
- Затем повторите тест на безопасность (см. ШАГ 3).
- Не используйте шприц-ручку, если препарат все же не выходит из кончика иглы. Используйте новую шприц-ручку.
- Никогда не используйте шприц для извлечения препарата из шприц-ручки.
Если Вы видите пузырьки воздуха
- Вы можете видеть пузырьки воздуха в препарате. Это нормально, они не причинят Вам вреда.
ШАГ 4: Набор дозы
- Используйте шприц-ручку только для введения однократной суточной дозы от 30 до 60 единиц препарата.
- Никогда не набирайте дозу и нажимайте на кнопку введения дозы без присоединенной иглы. Это может повредить шприц-ручку.
A. Удостоверьтесь в том, что игла присоединена и доза установлена на ‘0’.
B. Вращайте селектор дозы до тех пор, пока указатель дозы не окажется на одной линии с нужной Вам дозой.
- Если Вы провернули селектор дозы дальше нужной Вам дозы, то можно повернуть его назад.
- Если в шприц-ручке нет достаточного количества единиц препарата для нужной Вам дозы, селектор дозы остановится на количестве оставшихся в шприц-ручке единиц препарата.
- Если Вы не можете набрать всю назначенную Вам дозу, используйте новую шприц-ручку или введите оставшиеся в шприц-ручке единицы препарата и используйте новую шприц-ручку для того, чтобы ввести недостающие единицы препарата до полной дозы. Только в этом случае допускается введение оставшейся дозы менее 10 единиц препарата. Всегда используйте другую шприц-ручку Соликва СолоСтар® 30-60, чтобы дополнить необходимую Вам дозу, а не шприц-ручку Соликва СолоСтар® 10-40.
Как читать показания окна дозы
- Не используйте шприц-ручку, если Ваша однократная суточная доза менее 30 единиц препарата, которые показываются в виде белых цифр на черном фоне.
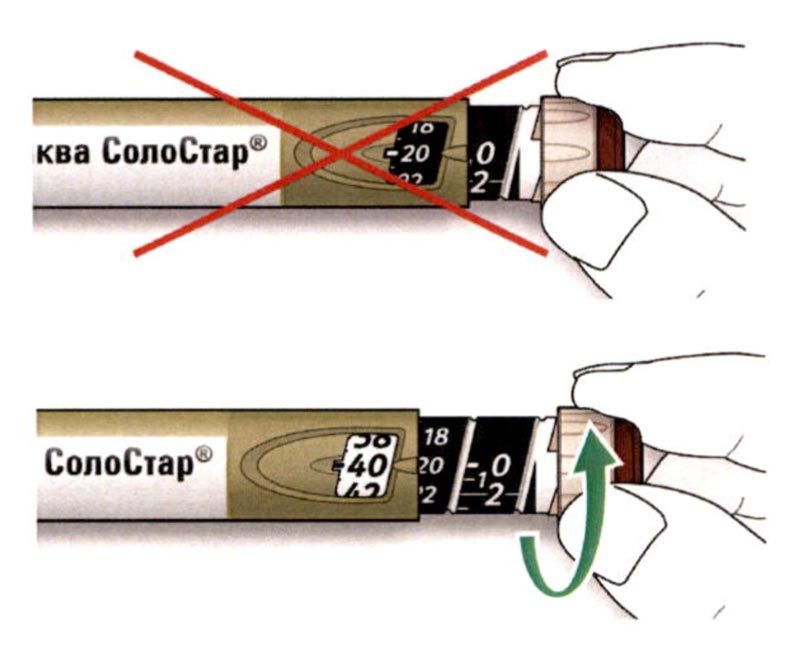
Единицы препарата в шприц-ручке
- Шприц-ручка содержит в общей сложности 300 единиц препарата. Вы может набирать Вашу дозу с шагом в 1 единицу.
- Не используйте эту шприц-ручку, если Вы нуждаетесь в суточной дозе менее 30 единиц или более 60 единиц препарата.
- Каждая шприц-ручка содержит более одной дозы.
ШАГ 5: Введение дозы
- Если Вы испытываете затруднения при нажатии на кнопку ввода дозы, не применяйте силу, так как это может повредить шприц-ручку. За помощью обратитесь к ШАГУ 5Е ниже.
A. Выберите место для инъекции, как показано на рисунке выше.
B. Введите иглу в кожу, как Вам было показано Вашим медицинским работником.
- Не прикасайтесь пока к кнопке ввода дозы.
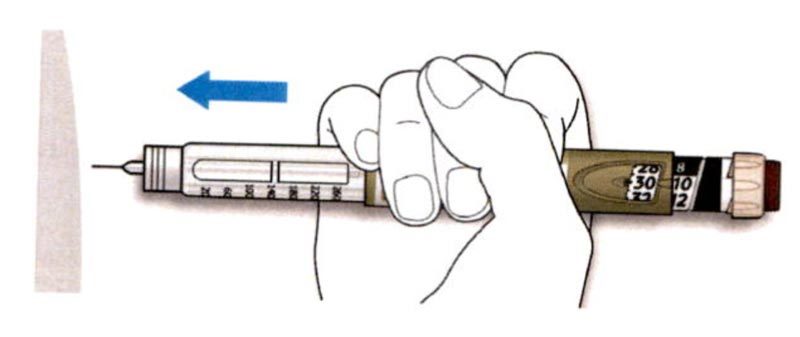
C. Поместите большой палец на кнопку ввода дозы. Затем нажмите до упора и удерживайте в этом положении.
- Не нажимайте на кнопку ввода дозы под углом – большой палец может блокировать проворачивание селектора дозы.
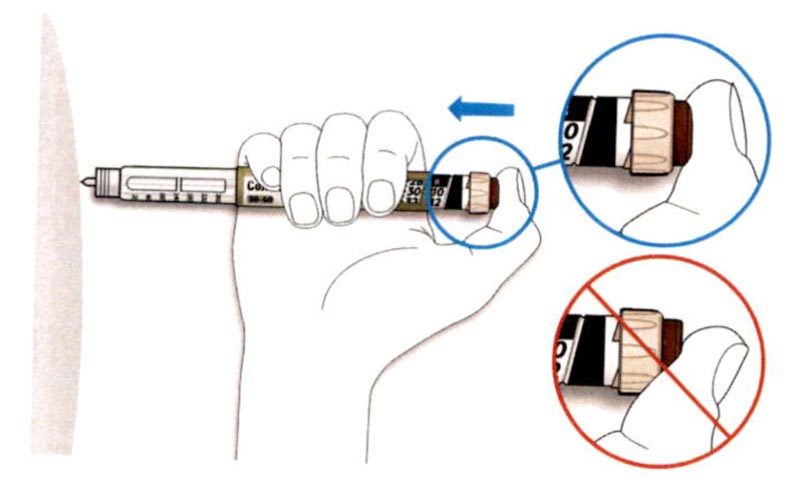
D. Нажимайте на кнопку ввода дозы, и когда вы увидите «0» в окне дозы, медленно досчитайте до 10.
- Это будет гарантировать, что Вы ввели полную дозу.
E. После удерживания кнопки ввода дозы и счета до 10 отпустите кнопку ввода. Затем извлеките иглу из кожи.
Если возникают затруднения при нажимании на кнопку ввода
- Смените иглу (см. ШАГ 6 и ШАГ 2), затем проведите тест на безопасность (см. ШАГ 3)
- Если все равно сохраняются затруднения при нажатии на кнопку ввода, возьмите новую шприц-ручку.
- Никогда не используйте шприц для извлечения препарата из шприц-ручки.
ШАГ 6: Удаление иглы
- Будьте осторожны при обращении с иглами – это предотвратит повреждение иглой и перекрестную инфекцию.
- Никогда не надевайте внутренний колпачок иглы назад на использованную иглу.
A. Возьмите наружный колпачок иглы двумя пальцами. Держите иглу прямо и введите ее в наружный колпачок иглы.
- Если игла будет введена в колпачок под углом, она может его проткнуть.
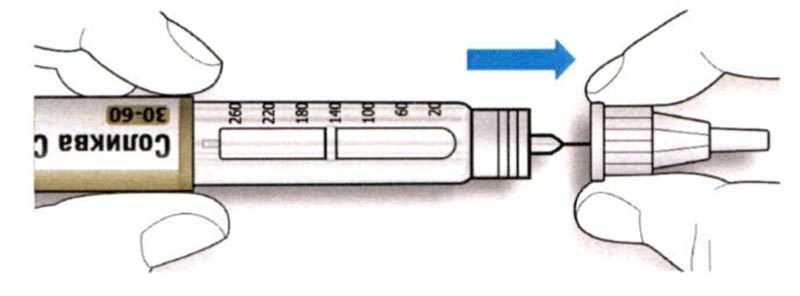
B. Крепко обхватите широкую часть наружного колпачка иглы. Прокрутите Вашу шприц-ручку несколько раз другой рукой, чтобы снять иглу.
- Если игла не снялась с первого раза, повторите попытку.
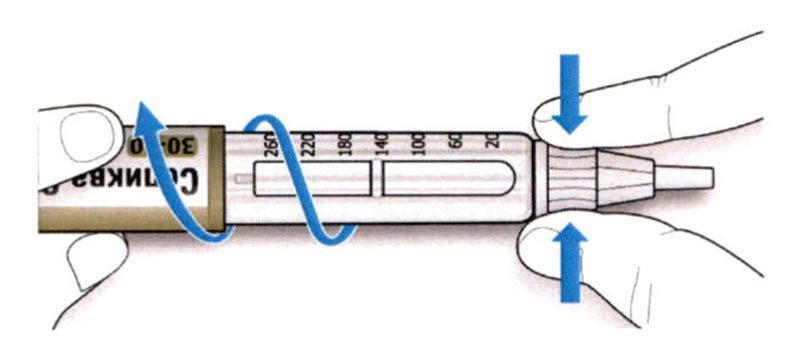
C. Выбросьте использованную иглу в резистентный к проколам контейнер (см. раздел «Утилизация шприц-ручки»).
D. Закройте шприц-ручку ее колпачком.
- Не помещайте шприц-ручку в холодильник.
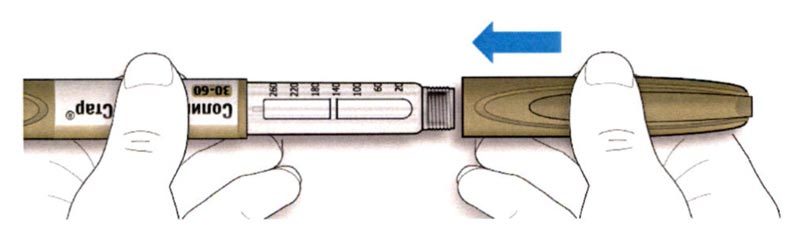
Срок использования
- Шприц-ручку можно применять только в течение 4 недель после начала использования.
Как хранить шприц-ручку
Перед первым использованием
- Храните новые шприц-ручки в холодильнике при температуре 2°С — 8°С
- Шприц-ручки нельзя замораживать.
После первого использования
- Храните шприц-ручку при температуре ниже 25 °С.
- Не помещайте шприц-ручку обратно в холодильник.
- Не нагревайте шприц-ручку.
- Не подвергайте шприц-ручку воздействию прямого света.
- Никогда не храните шприц-ручку с присоединенной иглой.
- Храните шприц-ручку, закрытой колпачком, для защиты от света.
- Шприц-ручку можно применять только в течение 4 недель после начала использования.
Обращение со шприц-ручкой
Обращайтесь со шприц-ручкой с осторожностью.
- Не роняйте шприц-ручку, избегайте ее удара о твердые поверхности.
- Если Вы думаете, что шприц-ручка, возможно, повреждена, не пытайтесь починить ее, используйте новую шприц-ручку.
Предохраняйте шприц-ручку от попадания пыли и грязи
- Вы можете очищать наружную поверхность шприц-ручки, протирая ее влажной тканью. Не замачивайте, не мойте и не смазывайте шприц-ручку – это может повредить ее.
Утилизация шприц-ручки
- Снимите иглу, перед тем как выбросить шприц-ручку.
- Утилизируйте использованные шприц-ручки согласно указаниям медицинского работника.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Ликсумия (0.1 мг/мл)
МНН: Ликсисенатид
Производитель: Санофи-Авентис Дойчланд ГмбХ
Анатомо-терапевтическо-химическая классификация: Ликсисенатид (lixisenatide)
Номер регистрации в РК:
№ РК-ЛС-5№021249
Информация о регистрации в РК:
22.01.2020 — бессрочно
Информация о реестрах и регистрах
Информация по ценам и ограничения
Предельная цена закупа в РК:
13 618.9 KZT
- Скачать инструкцию медикамента
Торговое название
Ликсумия
Международное непатентованное наименование
Ликсисенатид
Лекарственная форма
Раствор для инъекций 0.05 мг/мл и 0.1 мг/мл
Состав
1 мл раствора содержит:
активное вещество – ликсисенатида 0.05 мг или 0.10 мг
вспомогательные вещества: глицерин 85%, натрия ацетата тригидрат, L-метионин, метакрезол, кислота хлороводородная, натрия гидроксид, вода для инъекций.
Описание
Прозрачная бесцветная жидкость.
Фармакотерапевтическая группа
Средства для лечения сахарного диабета. Сахароснижающие препараты для перорального приема. Прочие сахароснижающие препараты. Ликсисенатид.
Код АТХ A10BX10
Фармакологические свойства
Фармакокинетика
Абсорбция
После подкожного введения пациентам с диабетом 2 типа скорость абсорбции ликсисенатида явялется быстрой, независимо от вводимой дозы. Независимо от дозы и независимо от того, применялся ли ликсисенатид в виде однократной или многократных доз, у пациентов с диабетом 2 типа средняя величина tмакс составляет от 1 до 3,5 часов. В отношении подкожного введения ликсисенатида в область живота, бедро или плечо не имеется клинически значимых различий по скорости абсорбции.
Распределение
Ликсисенатид имеет умеренную степень связывания (55%) с белками человека.
Кажущийся объем распределения после подкожного введения ликсисенатида (Vz/F) составляет приблизительно 100 л.
Биотрансформация и выведение
Как пептид, ликсисенатид выводится путем клубочковой фильтрации с последующей канальцевой реабсорбцией и дальнейшим метаболическим распадом, приводя к образованию меньших пептидов и аминокислот, которые вновь включаются в белковый обмен.
После введения многократных доз у пациентов с диабетом 2 типа средний конечный период полувыведения составлял приблизительно 3 часа и средний кажущийся клиренс (CL/F) около 35 л/час.
Особые популяции
Пациенты с нарушением функции почек
У пациентов с нормальной функцией почек и пациентов с легким нарушением функции почек (клиренс креатинина, рассчитанный по формуле Кокрофта-Голта, 50-80 мл/мин) не имелось значимых различий по показателям Cмакс и ППК ликсисенатида. У пациентов с умеренным нарушением функции почек (клиренс креатинина 30-50 мл/мин) показатель ППК (площадь под кривой) вырос на 24%, а у пациентов с тяжелым нарушением функции почек (клиренс креатинина 15-30 мл/мин) — на 46%.
Пациенты с нарушением функции печени
Поскольку ликсисенатид главным образом выводится почками, пациенты с острым или хроническим нарушением функции почек в фармакокинетических исследованиях не участвовали. Не предполагается, что печеночная дисфункция влияет на фармакокинетику ликсисенатида.
Пол
Пол не оказывает клинически значимого воздействия на фармакокинетику ликсисенатида.
Раса
На основании результатов фармакокинетических исследований у пациентов европеоидной расы, японцев и китайцев этническое происхождение не оказывает клинически значимого воздействия на фармакокинетику ликсисенатида.
Пожилые пациенты
Возраст не оказывает клинически значимого воздействия на фармакокинетику ликсисенатида. В фармакокинетическом исследовании у пожилых пациентов, не страдающих диабетом, применение ликсисенатида 20 мкг в группе пожилых пациентов (11 пациентов в возрасте от 65 до 74 лет и 7 пациентов в возрасте ≥ 75 лет), приводящее к среднему увеличению показателя ППК ликсисенатида на 29%, по сравнению с 18 пациентами в возрасте от 18 до 45 лет, вероятно связано со сниженной функцией почек у группы лиц пожилого возраста.
Масса тела
Масса тела не оказывает клинически значимого эффекта на показатель ППК ликсисенатида.
Фармакодинамика
Механизм действия
Ликсисенатид является селективным агонистом рецепторов ГПП-1 (глюкагоноподобный пептид-1). ГПП-1 рецептор является мишенью для нативного ГПП-1, эндогенного инкретинового гормона, который потенциирует глюкозозависимую секрецию инсулина бета-клетками поджелудочной железы.
Действие ликсисенатида опосредуется специфическим взаимодействием с рецепторами ГПП-1, приводя к увеличению внутриклеточного циклического аденозинмонофосфата (цАМФ). Ликсисенатид стимулирует секрецию инсулина, когда увеличивается содержание сахара в крови, но не при нормогликемии, которая ограничивает риск гипогликемии.
Одновременно подавляется секреция глюкагона. При гипогликемии сохраняется резервный механизм секреции глюкагона. Ликсисенатид замедляет эвакуацию из желудка, снижая скорость, при которой получаемая из пищи глюкоза оказывается в кровотоке.
Фармакодинамические эффекты
При применении один раз в сутки у пациентов с диабетом 2 типа ликсисенатид улучшает контроль гликемии за счет немедленного и пролонгированного эффектов снижения концентраций глюкозы как после приема пищи, так и натощак.
Такое воздействие на постпрандиальную глюкозу было подтверждено в 4-недельном исследовании, в сравнении с лираглутидом 1,8 мг один раз в сутки в комбинации с метформином. Снижение от исходного уровня показателя ППК 0:30–4:30 ч глюкозы в плазме после тестового приема пищи составляло:
–12,61 час*ммоль/л (-227,25 час*мг/дл) в группе ликсисенатида и
– 4,04 час*ммоль/л (–72,83 час*мг/дл) в группе лираглутида. Это также было подтверждено в 8-недельном исследовании в сравнении с лираглутидом, назначенном перед завтраком в комбинации с инсулином гларгином с или без метформина.
Клиническая эффективность и безопасность
Воздействие Ликсумии на контроль гликемии по сравнению с эксенатидом оценивались в шести рандомизированных двойных слепых плацебо-контролируемых исследованиях и одном рандомизированном открытом исследовании с активным контролем.
Исследования включали 3 825 пациентов с диабетом 2 типа (2 445 пациентов рандомизированы для применения ликсисенатида), 48,2% мужчины и 51,8% женщины.
768 пациентов (447 рандомизированы для применения ликсисенатида) были в возрасте ≥ 65 лет, и 103 пациента (57 рандомизированы для применения ликсисенатида) были в возрасте ≥ 75 лет.
В завершенных исследованиях III фазы было отмечено, что в конце основного 24-недельного периода лечения больше 90% популяции пациентов смогли сохранять поддерживающую дозу Ликсумии 20 мкг один раз в сутки.
Контроль гликемии
Дополнительная комбинированная терапия с применением пероральных противодиабетических препаратов
В конце основного 24-недельного периода лечения Ликсумия в комбинации с метформином, сульфонилмочевиной, пиоглитазоном или комбинацией этих препаратов показала статистически значимые снижения уровня HbA1c, глюкозы в плазме натощак и 2-х часовой постпрандиальной глюкозы после тестового приема пищи по сравнению с плацебо. Снижение показателя HbA1c было значимым при введении препарата один раз в сутки, независимо от того, применялся ли он утром или вечером. Такое воздействие на HbA1c было пролонгированным в долгосрочных исследованиях продолжительностью до 76 недель.
Дополнительное лечение в комбинации исключительно с метформином
Таблица 2: Плацебо-контролируемые исследования в комбинации с метформином (24-недельные результаты).
|
Метформин в качестве базовой терапии |
|||||
|
Ликсисенатид 20 мкг (N=160) |
Плацебо (N=159) |
Ликсисенатид Утро (N=255) |
20 мкг Вечер (N=255) |
Плацебо (N=170) |
|
|
Среднее значение HbA1c (%) |
|||||
|
Исходный уровень |
7,99 |
8,03 |
8,07 |
8,07 |
8,02 |
|
Изменение предела среднего от исходного уровня |
–0,92 |
–0,42 |
–0,87 |
–0,75 |
–0,38 |
|
Пациенты (%), у которых достигался уровень HbA1c < 7,0% |
47,4 |
24,1 |
43,0 |
40,6 |
22,0 |
|
Средняя масса тела (кг) |
|||||
|
Исходный уровень |
90,30 |
87,86 |
90,14 |
89,01 |
90,40 |
|
Изменение предела среднего от исходного уровня |
–2,63 |
–1,63 |
–2,01 |
–2,02 |
–1,64 |
В исследовании с активным контролем в конце основного 24-недельного периода лечения применение Ликсумии один раз в сутки показало уменьшение уровня HbA1c-0,79% по сравнению с -0,96% при применении эксенатида два раза в сутки, при средней разности показателей при терапии 0,17% (95% доверительный интервал (ДИ): 0,033; 0,297) и схожем проценте пациентов, у которых достигался уровень HbA1c менее 7%, в группе ликсисенатида (48,5%) и в группе эксенатида (49,8%). Во время основного 24-недельного периода лечения частота возникновения тошноты составила 24,5% в группе ликсисенатида по сравнению с 35,1% в группе эксенатида два раза в сутки, а частота возникновения симптоматической гипогликемии при применении ликсисенатида составила 2,5% по сравнению с 7,9% в группе эксенатида.
В 24-недельном открытом исследовании, ликсисенатид назначался до основного приема пищи и не уступал ликсисенатиду, назначенному до завтрака в рамках снижения HbA1c (изменение предела среднего от исходного уровня: — 0.65% по сравнению с 0.74%). Подобное снижение HbA1c наблюдалось несмотря на то, какой прием пищи был основным (завтрак, обед или ужин). В конце исследования, 43.6 % (группы основного приема пищи) и 42.8% (группа завтрака) пациентов достигли HbA1c меньше, чем 7%. Тошнота сообщалась в 14.7% и 15.5% пациентов, а симптоматическая гипогликемия в 5.8% и 2.2% пациентов группы основного приема пищи и группы завтрака соответственно.
Дополнительное лечение в комбинации исключительно с сульфонилмочевиной или в комбинации с метформином
Таблица 3: Плацебо-контролируемое исследование в комбинации с сульфонилмочевиной (24-недельные результаты)
|
Сульфонилмочевина в качестве базовой терапии в комбинации с метформином или без него |
|||||
|
Ликсисенатид 20 мкг (N=570) |
Плацебо (N=286) |
||||
|
Среднее значение HbA1c (%) |
|||||
|
Исходный уровень |
8,28 |
8,22 |
|||
|
Изменение предела среднего от исходного уровня |
–0,85 |
–0,10 |
|||
|
Пациенты (%), у которых достигался уровень HbA1c < 7,0% |
36,4 |
13,5 |
|||
|
Средняя масса тела (кг) |
|||||
|
Исходный уровень |
82,58 |
84,52 |
|||
|
Изменение предела среднего от исходного уровня |
–1,76 |
–0,93 |
Дополнительное лечение в комбинации исключительно с пиоглитазоном или в комбинации с метформином
В клиническом исследовании у пациентов, которые не достигали контроля на пиоглитазоне, добавление ликсисенатида к пиоглитазону в комбинации с метформином или без него, в конце основного 24-недельного периода лечения приводило к снижению показателя HbA1c от исходного уровня на 0,90% по сравнению со снижением от исходного уровня 0,34% в группе плацебо. В конце основного 24-недельного периода лечения у 52,3% пациентов, получавших ликсисенатид, показатель HbA1c составлял менее 7% по сравнению с 26,4% в группе плацебо. Во время основного 24-недельного периода лечения тошнота установлена у 23,5% в группе ликсисенатида по сравнению с 10,6% в группе плацебо, случаи симптоматической гипогликемии у 3,4% пациентов, получавших ликсисенатид, по сравнению с 1,2% в группе плацебо.
Дополнительное комбинированное лечение с базальным инсулином
Ликсумия, назначаемая в комбинации исключительно с базальным инсулином, либо в комбинации с базальным инсулином и метформином, либо в комбинации с базальным инсулином и сульфонилмочевиной, приводила к статистически значимым снижениям показателя HbA1c и 2-х часовой постпрандиальной глюкозы после тестового приема пищи по сравнению с плацебо.
Таблица 4: Плацебо-контролируемые исследования в комбинации с базальным инсулином (24-недельные результаты)
|
Базальный инсулин в качестве базового лечения В комбинации исключительно с базальным инсулином либо в комбинации с базальным инсулином и метформином |
Базальный инсулин в качестве базового лечения В комбинации исключительно с базальным инсулином либо в комбинации с сульфонилмочевиной* |
|||
|
Ликсисенатид 20 мкг (N = 327) |
Плацебо (N = 166) |
Ликсисенатид 20 мкг (N = 154) |
Плацебо (N = 157) |
|
|
Среднее значение HbA1c (%) |
||||
|
Исходный уровень |
8,39 |
8,38 |
8,53 |
8,53 |
|
Изменение предела среднего от исходного уровня |
–0,74 |
–0,38 |
–0,77 |
0,11 |
|
Пациенты (%), у которых достигался уровень HbA1c < 7,0% |
28,3 |
12,0 |
35,6 |
5,2 |
|
Средняя продолжительность лечения с применением базального инсулина на исходном уровне (года) |
3,06 |
3,2 |
2,94 |
3,01 |
|
Среднее изменение дозы базального инсулина (ЕД) |
||||
|
Исходный уровень |
53,62 |
57,65 |
24,87 |
24,11 |
|
Изменение предела среднего от исходного уровня |
–5,62 |
–1,93 |
–1,39 |
–0,11 |
|
Средняя масса тела (кг) |
||||
|
Исходный уровень |
87,39 |
89,11 |
65,99 |
65,60 |
|
Изменение предела среднего от исходного уровня |
–1,80 |
–0,52 |
–0,38 |
–0,06 |
* результаты азиатской группы населения
Клиническое исследование проводилось у пациентов, ранее не получавших инсулин, которым недостаточно контроля пероральными противодиабетическими средствами. Это исследование включало 12-недельный подготовительный период с вводом и титрованием инсулина гларгина и 24-недельный период лечения, во время которого пациенты получали либо ликсисенатид, либо плацебо в комбинации с инсулином гларгином и метформином с тиазолидиндионами или без них. Во время этого периода инсулин гларгин постоянно титровался.
Во время 12-недельного подготовительного периода добавление и титрование инсулина гларгина приводило к уменьшению HbA1c приблизительно на 1%. Добавление ликсисенатида приводило к значительно большему снижению показателя HbA1c 0,71% в группе ликсисенатида по сравнению с 0,40% в группе плацебо. В конце 24-недельного периода лечения у 56,3% пациентов с применением ликсисенатида показатель HbA1c составлял менее 7% по сравнению с 38,5% в группе плацебо.
Во время 24-недельного периода лечения 22,4% пациентов, получавших ликсисенатид, сообщали, по крайней мере, об одном явлении симптоматической гипогликемии по сравнению с 13,5% в группе плацебо. Частота возникновения гипогликемии увеличивалась в основном во время первых 6 недель лечения в группе ликсисенатида, а затем была схожа с группой применяющей плацебо.
Уровень глюкозы в плазме натощак
В плацебо-контролируемых исследованиях в конце 24-недельного периода лечения показатели уменьшения уровня глюкозы в плазме натощак от исходного уровня, достигаемые при лечении Ликсумией, находились в пределах от 0,42 ммоль/л до 1,19 ммоль/л.
Уровень постпрандиальной глюкозы
Лечение Ликсумией приводило к снижению уровня 2-х часовой постпрандиальной глюкозы после тестового приема пищи, статистически превосходящему плацебо, независимо от базового лечения.
В целом во всех исследованиях, в которых измерялись уровни постпрандиальной глюкозы, при применении Ликсумии в конце 24-недельного периода лечения показатели уменьшения от исходного уровня находились в пределах от 4,51 до 7,96 ммоль/л. От 26,2% до 46,8% пациентов 2-х часовой постпрандиальный уровень глюкозы находился ниже 7,8 ммоль/л (140.4 мг/дл).
Масса тела
В конце основного 24-недельного периода лечения терапия Ликсумией в комбинации с метформином и/или сульфонилмочевиной во всех контролируемых исследованиях приводила к устойчивому изменению массы тела в пределах от –1,76 кг до –2,96 кг.
Изменение массы тела от исходного уровня в пределах от – 0,38 кг до –1,80 кг также наблюдалось у пациентов, получавших ликсисенатид в комбинации с исключительно стабильной дозой базального инсулина, либо в комбинации с метформином или сульфонилмочевиной.
У пациентов, впервые начавших применять инсулин, в группе ликсисенатида масса тела оставалась почти неизменной, тогда как в группе плацебо было показано увеличение. В долгосрочных исследованиях продолжительностью до 76 недель уменьшение массы тела было устойчивым. Уменьшение массы тела не зависит от частоты тошноты и рвоты.
Функция бета-клеток
Клинические исследования Ликсумии показывают улучшенную функцию бета-клеток, что измеряется посредством гомеостатической модели оценки функции бета-клеток (ГОМО-β/HOMA-β).
Восстановление первой фазы секреции инсулина и улучшение второй фазы секреции инсулина в ответ на внутривенное болюсное введение глюкозы наблюдались после однократной дозы Ликсумии у пациентов с диабетом 2 типа (n = 20).
Оценка сердечно-сосудистой системы
Во всех плацебо-контролируемых исследованиях III фазы у пациентов с диабетом 2 типа не наблюдалось увеличения средней частоты сердечных сокращений.
В плацебо-контролируемых исследованиях III фазы наблюдалось снижение среднего показателя систолического и диастолического давления крови, соответственно, до 2,1 мм рт. ст. и до 1,5 мм рт. ст.
Мета-анализ всех независимо установленных сердечно-сосудистых событий (смерть по сердечно-сосудистым причинам, нефатальный инфаркт миокарда, нефатальный инсульт, госпитализация по причине нестабильной стенокардии, госпитализация по причине сердечной недостаточности и реваскуляризации коронарных артерий) в 8 плацебо-контролируемых исследованиях III фазы, которые включали 2 673 пациента с диабетом 2 типа, получавших ликсисенатид, и 1 448 пациентов, получавших плацебо, показал соотношение рисков 1,03 (95% доверительный интервал 0,64; 1,66) для ликсисенатида по сравнению с плацебо.
Число событий в клинических исследованиях было небольшим (1,9% у пациентов, получавших ликсисенатид, и 1,8% у пациентов, получавших плацебо), оно не позволяет сделать достоверные выводы. Частота возникновения отдельных сердечно-сосудистых событий (ликсисенатид в сравнении с плацебо) составляло: смерть по сердечно-сосудистым причинам (0,3% в сравнении с 0,3%), нефатальный инфаркт миокарда (0,4% в сравнении с 0,4%), нефатальный инсульт (0,7% в сравнении с 0,4%), госпитализация по причине нестабильной стенокардии (0 в сравнении с 0,1%), госпитализация по причине сердечной недостаточности (0,1% в сравнении с 0), реваскуляризация коронарных артерий (0,7% в сравнении с 1,0%).
Показания к применению
— лечение взрослых с сахарным диабетом 2 типа для достижения гликемического контроля в комбинации с пероральными сахароснижающими лекарственными средствами и/или базальным инсулином, в случае если последние наряду с диетой и физической нагрузкой не обеспечивают надлежащего контроля уровня глюкозы (см. «Особые указания» и «Фармакодинамика», в которых содержатся доступные данные относительно различных комбинаций)
Способ применения и дозы
Дозировка
Начальная доза: дозировка начинается с 10 мкг Ликсумии один раз в сутки в течение 14 дней.
Поддерживающая доза: введение фиксированной поддерживающей дозы 20 мкг Ликсумии один раз в сутки начинается на 15-й день.
Для поддерживающей дозы используется раствор для инъекции Ликсумия 20 мкг. Для стартовой дозы используется раствор для инъекции Ликсумия 10 мкг.
Ликсумия вводится один раз в сутки, за час до любого приема пищи. Предпочтительно, чтобы инъекция Ликсумии выполнялась ежедневно перед тем же приемом пищи, когда было выбрано самое удобное время приема. Если доза Ликсумии пропущена, необходимо сделать инъекцию за час до следующего приема пищи.
При назначении Ликсумии в дополнение к получаемому лечению метформином действующая доза метформина может оставаться неизменной.
При назначении Ликсумии в дополнение к получаемому лечению сульфонилмочевиной или базальным инсулином для снижения риска гипогликемии возможно уменьшение дозы сульфонилмочевины или базального инсулина.
Ликсумию не следует назначать в комбинации с базальным инсулином и сульфонилмочевиной по причине повышенного риска гипогликемии (см. «Особые указания»).
Применение Ликсумии не требует специального мониторинга уровня глюкозы крови. Тем не менее, когда она применяется в комбинации с сульфонилмочевиной или базальным инсулином, мониторинг уровня глюкозы крови или самоконтроль уровня глюкозы крови может быть необходим для того, чтобы скорректировать дозы сульфонилмочевины или базального инсулина.
Особые популяции
Пожилые пациенты (≥ 65 лет)
На основании возраста коррекции доз не требуется. Клинический опыт у пациентов ≥ 75 лет ограничен (см. «Фармакокинетика» и «Фармакодинамика»).
Пациенты с нарушением функции почек
У пациентов с легким нарушением функции почек коррекция дозы не требуется (клиренс креатинина 50-80 мл/мин).
Имеется ограниченный терапевтический опыт у пациентов с умеренным нарушением функции почек (клиренс креатинина 30-50 мл/мин), в этой популяции Ликсумия должна применяться с осторожностью.
Не имеется терапевтического опыта применения у пациентов с тяжелым нарушением функции почек (клиренс креатинина менее 30 мл/мин) или у пациентов на терминальной стадии заболевания почек, и по этой причине не рекомендуется применять Ликсумию у этих групп пациентов.
Пациенты с нарушением функции печени
Для пациентов с нарушением функции печени коррекции доз не требуется. Педиатрическая популяция
Безопасность и эффективность ликсисенатида у детей и подростков младше 18 лет не установлена. Данные отсутствуют.
Способ введения
Ликсумия показана для подкожного введения в бедро, живот или плечо. Нельзя вводить внутривенно или внутримышечно.
Ликсумию не следует использовать, если она замораживалась. Ликсумия может использоваться с одноразовыми иглами калибром от 29 до 32 для шприц-ручки. Иглы для шприц-ручки не включены.
Необходимо проинструктировать пациента выбрасывать иглу после каждого использования согласно требованиям локального законодательства по утилизации и хранить шприц-ручку без насаженной иглы. Это помогает предотвратить контаминацию и закупорку иглы. Шприц-ручка предназначена для использования только одним пациентом.
Любое неиспользованное лекарственное средство или отходы материалов должны быть утилизированы в соответствии с требованиями локального законодательства по утилизации.
Несовместимость
В условиях отсутствия исследований совместимости лекарственное средство не подлежит смешиванию с другими лекарственными средствами.
Побочные действия
Краткая характеристика профиля безопасности
Более 2 600 пациентов в 8 больших плацебо-контролируемых исследованиях или исследованиях III фазы с активным контролем получали Ликсумию либо в монотерапии, либо в комбинации с метформином, сульфонилмочевиной (с метформином или без него) или базальным инсулином (с метформином или без него или с сульфонилмочевиной или без нее).
Наиболее часто сообщаемыми нежелательными реакциями во время клинических исследований являлись тошнота, рвота и диарея. Реакции в основном были легкими и преходящими.
Также установлены случаи гипогликемии (когда Ликсумия применялась в комбинации с сульфонилмочевиной и/или базальным инсулином) и головной боли. Аллергические реакции отмечались у 0,4% пациентов, применяющих Ликсумию.
Ниже представлены нежелательные реакции, которые возникали с частотой > 5%, если частота возникновения была выше среди пациентов, получавших Ликсумию, чем среди пациентов, получавших все препараты сравнения; также включены нежелательные реакции с частотой возникновения ≥ 1% в группе пациентов, получавших Ликсумию, если частота возникновения была выше в 2 раза, чем частота среди группы пациентов, получавших все препараты сравнения.
Нежелательные реакции, установленные в плацебо-контролируемых и исследованиях III фазы с активным контролем в течение всего периода лечения (включая период свыше основного 24-недельного периода лечения в исследованиях с ≥ 76 неделями всего лечения).
Очень часто (≥ 1/10)
— гипогликемия (в комбинации с сульфонилмочевиной и/или базальным инсулином)
— головная боль
— тошнота, рвота, диарея
Часто (≥ 1/100 до < 1/10)
— грипп, инфекции верхних дыхательных путей, цистит, вирусная инфекция
— гипогликемия (в комбинации исключительно с метформином)
— головокружение, сонливость
— диспепсия
— боль в спине
— зуд в месте инъекции
Нечасто (≥ 1/1 000 до < 1/100)
— анафилактическая реакция
— крапивница
Описание отдельных нежелательных реакций
Гипогликемия
У пациентов, принимавших Ликсумию в монотерапии, симптоматическая гипогликемия возникала у 1,7% пациентов, получавших ликсисенатид, и у 1,6% пациентов, получавших плацебо. При применении Ликсумии в комбинации исключительно с метформином во время всего периода лечения симптоматическая гипогликемия возникала у 7,0% пациентов, получавших ликсисенатид, и у 4,8% пациентов, получавших плацебо.
У пациентов, принимавших Ликсумию в комбинации с сульфонилмочевиной и метформином, во время всего периода лечения симптоматическая гипогликемия возникала у 22,0% пациентов, получавших ликсисенатид, и у 18,4% пациентов, получавших плацебо (3,6% абсолютная разность). При применении Ликсумии в комбинации с базальным инсулином с метформином или без него во время всего периода лечения симптоматическая гипогликемия возникала у 42,1% пациентов, получавших ликсисенатид, и у 38,9% применяющих плацебо (3,2% абсолютная разность).
При применении Ликсумии в комбинации исключительно с сульфонилмочевиной во время всего периода лечения симптоматическая гипогликемия возникала у 22,7% пациентов, получавших ликсисенатид, в сравнении с 15,2%, получавших плацебо (7,5% абсолютная разность). При применении Ликсумии в комбинации с сульфонилмочевиной и базальным инсулином симптоматическая гипогликемия возникала у 47,2% пациентов, получавших ликсисенатид, по сравнению с 21,6%, получавших плацебо (25,6% абсолютная разность).
В целом во время всего периода лечения в плацебо-контролируемых исследованиях фазы III частота возникновения тяжелой симптоматической гипогликемии была нечастой (0,4% у пациентов, получавших ликсисенатид, и 0,2% у пациентов, получавших плацебо).
Нарушения со стороны желудочно-кишечного тракта
Во время основного 24-недельного периода лечения тошнота и рвота были наиболее часто сообщаемыми нежелательными реакциями. Частота возникновения тошноты была выше в группе ликсисенатида (26,1%) по сравнению с группой плацебо (6,2%), и частота возникновения рвоты была выше в группе ликсисенатида (10,5%) по сравнению с группой плацебо (1,8%). Реакции были в основном легкими и кратковременными и возникали в течение первых 3 недель после начала лечения. Впоследствии в течение следующих недель частота постепенно снижалась.
Реакции в месте введения
Во время основного 24-недельного периода лечения реакции в месте введения были установлены у 3,9% пациентов, получающих Ликсумию, реакции в месте введения были также установлены у 1,4% пациентов, получающих плацебо. Большинство реакций были легкими по интенсивности и обычно не приводили к прекращению лечения.
Иммуногенность
В связи с потенциальными иммуногенными свойствами лекарственных средств, содержащих протеины или пептиды, после лечения препаратом Ликсумия у пациентов могут вырабатываться антитела к ликсисенатиду, и в конце основного 24-недельного периода лечения в плацебо-контролируемых исследованиях у 69,8% пациентов, получавших ликсисенатид, был установлен положительный статус антител. В конце всего 76-недельного периода лечения процент серопозитивных пациентов был схожим. В конце основного 24-недельного периода лечения у 32,2% пациентов с положительным статусом антител концентрация антител была выше нижнего предела количественного выражения, а в конце всего 76-недельного периода лечения у 44,7% пациентов концентрация антител была выше нижнего предела количественного выражения. После прекращения лечения продолжалось наблюдение нескольких серопозитивных пациентов; в течение 3 месяцев процент уменьшился приблизительно до 90%, и через 6 месяцев и более-до 30%.
Изменение HbA1c от исходного уровня было схожим независимо от статуса антител (положительный или отрицательный).
Из числа пациентов с измерением HbA1c, получавших ликсисенатид, у 79,3% был либо негативный статус антител, либо концентрация антител была менее нижнего предела количественного выражения, а у остальных 20,7% пациентов концентрация антител была определена количественно. В подгруппе пациентов (5,2%) с самой высокой концентрацией антител средний показатель улучшения HbA1c в неделю 24 и в неделю 76 находился в клинически значимых пределах измерений; тем не менее, имелась вариабельность гликемической реакции, и у 1,9% отсутствовало уменьшение показателя HbA1c.
Статус антител (положительный или негативный) не позволяет прогнозировать уменьшение HbA1c у отдельных пациентов.
Не имелось различия по общему профилю безопасности у пациентов, независимо от статуса антител, за исключением увеличения числа возникновения реакций в месте введения препарата (в течение всего периода лечения 4,7% у пациентов с положительным статусом антител, по сравнению с 2,5% у серонегативных пациентов). Большинство реакций в месте введения препарата были легкими, независимо от статуса антител.
Не отмечалось перекрестной реактивности по сравнению либо с нативным глюкагоном, либо с эндогенным ГПП-1.
Аллергические реакции
Во время основного 24-недельного периода лечения аллергические реакции, возможно связанные с ликсисенатидом (такие как анафилактическая реакция, ангионевротический отек и крапивница), были установлены у 0,4% пациентов, получавших ликсисенатид, в то время как возможно связанные аллергические реакции возникали менее чем у 0,1% пациентов, получавших плацебо.
Анафилактические реакции были установлены у 0,2% пациентов, получавших ликсисенатид, по сравнению с отсутствием реакций в группе плацебо. Большинство из установленных аллергических реакций по тяжести были легкими. Один случай анафилактоидной реакции был установлен во время клинических испытаний ликсисенатида.
Частота сердечных сокращений
В исследованиях с участием здоровых добровольцев транзиторное увеличение частоты сердечных сокращений наблюдалось после введения ликсисенатида 20 мкг. Сердечная аритмия, в частности, тахикардия (0,8% в сравнении с < 0,1%), и учащенное сердцебиение (1,5% в сравнении с 0,8%) были установлены у пациентов, получавших ликсисенатид, по сравнению с пациентами, получавшими плацебо.
Отмена препарата
Во время основного 24-недельного периода лечения частота случаев прекращения лечения по причине нежелательных явлений составляла 7,4% в группе Ликсумии по сравнению с 3,2% в группе плацебо. Наиболее часто встречающимися нежелательными реакциями, которые приводили к прекращению лечения в группе ликсисенатида, являлись тошнота (3,1%) и рвота (1,2%).
Репортирование подозреваемых побочных реакций
Важно репортирование подозреваемых побочных реакций после регистрации лекарственного средства. Это позволяет продолжать мониторинг баланса пользы/риска лекарственного средства. Просим работников здравоохранения сообщать о любых подозреваемых побочных реакциях через национальную систему репортирования.
Противопоказания
— гиперчувствительность к активному веществу или любому из вспомогательных веществ
Лекарственные взаимодействия
Ликсисенатид-это пептид, который не метаболизируется при участии цитохрома P450. В исследованиях in vitro, ликсисенатид не воздействовал на активность тестируемых изоферментов цитохрома P450 или человеческих транспортеров.
Замедление эвакуации содержимого желудка при применении ликсисенатида может уменьшать скорость абсорбции применяемых перорально лекарственных средств. Необходимо тщательно наблюдать пациентов, получающих лекарственные средства либо с узким терапевтическим индексом, либо лекарственные средства, которые требуют тщательного клинического мониторинга, особенно во время начала лечения ликсисенатидом. В отношении ликсисенатида эти лекарственные средства должны приниматься обычным способом. Если такие лекарственные средства должны приниматься с пищей, необходимо рекомендовать пациентам по возможности принимать их во время еды, когда не применяется ликсисенатид.
В отношении пероральных лекарственных средств, таких как антибиотики, которые, особенно в отношении эффективности зависят от пороговой концентрации, необходимо рекомендовать пациентам принимать как минимум за 1 час до или через 4 часа после инъекции ликсисенатида.
Кишечнорастворимые лекарственные формы, содержащие вещества, чувствительные к расщеплению в желудке, должны применяться за 1 час до или через 4 часа после инъекции ликсисенатида.
Парацетамол
Парацетамол применялся в качестве модели лекарственного средства для того, чтобы оценить эффект ликсисенатида на эвакуацию содержимого желудка. После применения однократной дозы парацетамола 1 000 мг, площадь под кривой (ППК) и t1/2 парацетамола, оставались неизменными, независимо от времени его применения (до или после инъекции ликсисенатида). Когда он применялся через 1 час или 4 часа после 10 мкг ликсисенатида, показатель Cмакс парацетамола уменьшался, соответственно, на 29% и 31%, и средняя величина tмакс была замедлена, соответственно, на 2,0 и 1,75 часа. При применении 20 мкг поддерживающей дозы прогнозировалась дальнейшее замедление tмакс и уменьшение Cмакс парацетамола.
Не наблюдалось воздействия на Cмакс и tмакс парацетамола, когда парацетамол применялся за 1 час до применения ликсисенатида.
Учитывая приведенные данные необходимость в коррекции доз парацетамола отсутствует, но удлинение Tmax, которое наблюдалось, когда парацетамол предназначался через 1-4 часа после приема ликсисенатида, следует учитывать, когда для эффективности необходимо быстрое начало действия.
Пероральные контрацептивы
После применения однократной дозы перорального контрацептива (этинилэстрадиола 0,03 мг/левоноргестрела 0,15 мг) за 1 час до или 11 часов после применения 10 мкг ликсисенатида, Cмакс, ППК, t1/2 и tмакс этинилэстрадиола и левоноргестрела оставались неизмененными.
Применение перорального контрацептива через 1 час или 4 часа после применения ликсисенатида не повлияло на ППК и t1/2 этинилэстрадиола и левоноргестрела, тогда как показатель Cмакс этинилэстрадиола уменьшался, соответственно, на 52% и 39%, а Cмакс левоноргестрела уменьшался, соответственно, на 46% и 20%, и средняя величина tмакс замедлялась на 1-3 часа.
Уменьшение показателя Cмакс имеет ограниченную клиническую значимость, и коррекция дозы перорального контрацептива не требуется.
Аторвастатин
При применении 20 мкг ликсисенатида в комбинации с 40 мг аторвастатина утром в течение 6 дней, воздействие аторвастатина не изменялось, тогда как показатель Cмакс уменьшался на 31% и величина tмакс увеличилась на 3,25 часа.
Такого увеличения для величины tмакс не наблюдалось, если аторвастатин применялся вечером, а ликсисенатид утром, но показатели ППК и Cмакс аторвастатина, соответственно, увеличивались на 27% и 66%.
Эти изменения не являются клинически значимыми, и поэтому коррекции дозы аторвастатина не требуется, когда он применяется в комбинации с ликсисенатидом.
Варфарин и другие производные кумарина
После сопутствующего применения 25 мг варфарина с многократными дозами ликсисенатида 20 мкг, не отмечалось влияния на ППК или МНО (международное нормализованное отношение), тогда как показатель Cмакс снизился на 19%, а величина tмакс увеличивалась до 7 часов.
На основании этих результатов, коррекции дозы варфарина не требуется, когда он применяется в комбинации с ликсисенатидом; тем не менее, во время начала или окончания лечения ликсисенатидом рекомендуется частый мониторинг МНО у пациентов, принимающих варфарин и/или производные кумарина.
Дигоксин
После совместного применения ликсисенатида 20 мкг и 0,25 мг дигоксина в состоянии равновесия ППК дигоксина не изменялась. Величина tмакс дигоксина увеличилась на 1,5 часа, и показатель Cмакс снизился на 26%.
На основании этих результатов, коррекции доз дигоксина не требуется, когда он применяется в комбинации с ликсисенатидом.
Рамиприл
После совместного применения ликсисенатида 20 мкг и 5 мг рамиприла в течение 6 дней, показатель ППК рамиприла увеличивался на 21%, тогда как показатель Cмакс снизился на 63%. Показатели ППК и Cмакс активного метаболита (рамиприлата) не изменялись. Величина tмакс рамиприла и рамиприлата увеличилась приблизительно на 2,5 часа.
На основании этих результатов, коррекции дозы рамиприла не требуется, когда он применяется в комбинации с ликсисенатидом.
Особые указания
Терапевтический опыт применения ликсисенатида у пациентов с сахарным диабетом 1 типа отсутствует, его не следует применять у данных пациентов. Ликсисенатид не следует применять для лечения диабетического кетоацидоза.
Острый панкреатит
Применение агонистов рецепторов глюкагоноподобных пептидов-1 (ГПП-1) было связано с риском развития острого панкреатита. Сообщалось о нескольких событиях острого панкреатита при применении ликсисенатида, хотя причинной связи не было установлено. Необходимо информировать пациентов о типичных симптомах острого панкреатита: постоянные, сильные абдоминальные боли. При подозрении на панкреатит необходимо прекратить применение ликсисенатида; если острый панкреатит подтверждается, применение ликсисенатида не должно возобновляться. Необходимо проявлять осторожность при применении у пациентов, перенесших панкреатит.
Тяжелые желудочно-кишечные заболевания
Применение агонистов рецепторов ГПП-1 может быть связано с нежелательными реакциями со стороны желудочно-кишечного тракта. Ликсисенатид не исследовался у пациентов с тяжелыми желудочно-кишечными заболеваниями, включая тяжелый гастропарез, и по этой причине у таких пациентов применение ликсисенатида не рекомендуется.
Нарушение функции почек
Имеется ограниченный терапевтический опыт у пациентов с умеренным нарушением функции почек (клиренс креатинина 30-50 мл/мин), и не имеется терапевтического опыта применения у пациентов с тяжелым нарушением функции почек (клиренс креатинина менее 30 мл/мин) или у пациентов в терминальной стадии болезни почек. У пациентов с умеренным нарушением функции почек Ликсумия должна применяться с осторожностью. У пациентов с тяжелым нарушением функции почек или у пациентов в терминальной стадии болезни почек применение не рекомендуется (см. «Способ применения и дозы» и «Фармакокинетика»).
Гипогликемия
У пациентов, получающих Ликсумию с сульфонилмочевиной или базальным инсулином, может существовать повышенный риск гипогликемии. Для снижения риска гипогликемии возможно уменьшение дозы сульфонилмочевины или базального инсулина (см. «Способ применения и дозы»). Ликсумию не следует применять в комбинации с базальным инсулином и сульфонилмочевиной по причине повышенного риска гипогликемии.
Сопутствующие лекарственные средства
Замедление эвакуации содержимого желудка при применении ликсисенатида может уменьшать скорость абсорбции применяемых перорально лекарственных средств. У пациентов, получающих пероральные лекарственные средства, для которых требуется быстрая желудочно-кишечная абсорбция, клинический мониторинг, или средства с узким терапевтическим индексом, Ликсумия должна применяться с осторожностью. Специальные рекомендации относительно приема таких лекарственных средств даны в разделе «Лекарственные взаимодействия».
Неисследованные популяции
Ликсисенатид не исследовался в комбинации с ингибиторами дипептидилпептидазы-4 (ДПП-4). Имеется ограниченный опыт у пациентов с застойной сердечной недостаточностью.
Обезвоживание
Пациентам, получающим лечение препаратом Ликсумия, необходимо поставить в известность о потенциальном риске обезвоживания в связи с нежелательными реакциями со стороны желудочно-кишечного тракта и принимать меры предосторожности, чтобы избежать гиповолемии.
Вспомогательные вещества
Лекарственное средство содержит метакрезол, который может вызывать аллергические реакции.
Женщины детородного возраста
Ликсумия не рекомендуется женщинам детородного возраста, которые не применяют контрацептивы.
Беременность
Не имеется достаточных данных по применению Ликсумии у беременных женщин. Доклинические исследования показали репродуктивную токсичность. Потенциальный риск для людей неизвестен. Ликсумию не следует применять во время беременности. Вместо этого рекомендуется применение инсулина. Если пациентка желает забеременеть или беременность наступила, лечение Ликсумией необходимо прекратить.
Лактация
Неизвестно, проникает ли Ликсумия в грудное молоко человека. Ликсумию не следует применять в период лактации.
Фертильность
Доклинические исследования не показывают прямого вредного воздействия на фертильность.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Ликсумия не влияет или оказывает незначительное влияние на способность управлять транспортным средством или механизмами. При приеме в комбинации с сульфонилмочевиной или базальным инсулином необходимо рекомендовать пациентам принимать меры предосторожности, чтобы избежать гипогликемии во время управления транспортным средством или механизмами.
Передозировка
Во время клинических исследований дозы ликсисенатида до 30 мкг дважды в сутки вводились пациентам с диабетом 2 типа в 13-недельном исследовании. Наблюдалась повышенная частота возникновения случаев нарушений со стороны желудочно-кишечного тракта.
В случае передозировки в соответствии с клиническими признаками и симптомами у пациента должно быть начато соответствующее поддерживающее лечение, и доза ликсисенатида должна быть уменьшена до назначенной дозы.
Форма выпуска
По 3 мл препарата в картридже из бесцветного стекла (тип I). Картридж укупорен фланцевой крышкой со вставленной ламинированной герметизирующей мембраной на одном конце и ограничителем хода поршня на другом конце. Картридж вмонтирован в одноразовую шприц-ручку.
По 1 шприц-ручке зеленого цвета 10 мкг или по 2 шприц-ручки пурпурного цвета 20 мкг вместе с инструкцией по медицинскому применению на государственном и русском языках вкладывают в картонную коробку.
Условия хранения
Хранить при температуре от 2 оС до 8 оС в защищенном от света месте. Не замораживать. Хранить вдали от морозильной камеры.
После первого использования шприц-ручку можно применять в течение 14 дней при температуре не выше 30 оС. Не замораживать.
Хранить в недоступном для детей месте.
Срок хранения
2 года.
Не применять по истечении срока годности.
Условия отпуска из аптек
По рецепту
Владелец регистрационного удостоверения
санофи-авентис групп, Франция
Производитель
Санофи-Авентис Дойчланд ГмбХ, Германия
Адрес местонахождения: Industriepark Hoechst, Bruningstrasse 50, D-65926 Frankfurt am Main, Germany
Инструкция по применению шприц-ручки Ликсумия
Перед использованием шприц-ручки Ликсумия внимательно прочитайте инструкцию. Сохраните настоящую инструкцию по медицинскому применению лекарственного средства для дальнейшего обращения.
Ликсумия представляет собой предварительно заполненную шприц-ручку для инъекции содержащую 14 доз. Каждая доза содержит 10 мкг или 20 мкг ликсисенатида в 0,2 мл.
• Выполняйте только одну инъекцию в день.
• В каждой шприц-ручке Ликсумия содержится 14 предварительно заполненных доз. Измерять каждую дозу не требуется.
• Перед использованием шприц-ручки проконсультируйтесь с врачом о том, как правильно вводить препарат.
• Если следовать инструкциям самостоятельно совершенно не представляется возможным, или не можете справиться со шприц-ручкой (например, при наличии проблем со зрением), воспользуйтесь посторонней помощью.
Строение шприц-ручки с препаратом Ликсумия
окошко активации
кнопка для инъекций
окошко со стрелкой
дозировочная шкала
картридж
резиновый уплотнитель
колпачок шприц-ручки
окошко активации
кнопка для инъекций
окошко со стрелкой
дозировочная шкала
картридж
резиновый уплотнитель
колпачок шприц-ручки
Черный плунжер
После каждой инъекции черный плунжер будет продвигаться вдоль дозировочной шкалы. В примере выше количество доз показывает, что осталось 13 инъекций.
• Эта шприц-ручка предназначена только для одного человека. Совместное использование запрещено.
• Всегда проверяйте маркировку, чтобы не перепутать шприц-ручки Ликсумии. Также проверяйте, не истек ли срок хранения. Применение неподходящего препарата может нанести вред здоровью.
• Не пытайтесь извлекать жидкость из картриджа с помощью шприца.
Информация об иглах (поставляются отдельно)
наружный колпачок иглы
внутренний колпачок иглы
игла
защитная прокладка
• Используйте только иглы, одобренные для применения с Ликсумией. Используйте для шприц-ручки Ликсумия одноразовые иглы калибром от 29 до 32. Будет лучше, если Вы спросите врача о длине и калибре игл.
• Если инъекция вводится с посторонней помощью, необходимо соблюдать осторожность для того, чтобы не ранить кого-либо иглой. В противном случае возможна передача инфекции.
• Для каждой инъекции используйте новую иглу в целях предупреждения контаминации Ликсумии и возможной закупорки иглы.
Начало использования
• Активируйте шприц-ручку в день введения первой инъекции
Сначала активируйте новую шприц-ручку
• Перед введением дозы—перед введением препарата Вы должны удалить излишки жидкости из новой шприц-ручки. Это производится один раз и называется «активацией». Процедура активации изложена в шагах 1-5 далее.
• Активация выполняется для того, чтобы убедиться, что шприц-ручка функционирует нормально и что доза первой инъекции точная.
• Не повторяйте процесс активации. Иначе получить 14 доз из шприц-ручки Ликсумия не получится.
На рисунке ниже показано как после активации меняется окошко активации на кнопке для инъекций.
Новая шприц-ручка
(окошко оранжевого цвета)
| 269257581477976497_ru.doc | 1766 кб |
| 537797451477977655_kz.doc | 1847.5 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
| Компоненты | Раствор 0,05 мг/мл (10 мкг/доза) |
Раствор 0,1 мг/мл (20 мкг/доза) |
||
| Содержание в 1 мл |
Содержание в 1 дозе |
Содержание в 1 мл |
Содержание в 1 дозе |
|
| Активное вещество: | ||||
| Ликсисенатид | 0,05 мг | 0,01 мг | 0,1 мг | 0,02 мг |
| Вспомогательные вещества: | ||||
| Глицерол 85 % | 18,0 мг | 3,6 мг | 18,0 мг | 3,6 мг |
| Натрия ацетата тригидрат | 3,5 мг | 0,70 мг | 3,5 мг | 0,70 мг |
| Метионин | 3,0 мг | 0,60 мг | 3,0 мг | 0,60 мг |
| Метакрезол | 2,7 мг | 0,54 мг | 2,7 мг | 0,54 мг |
| 1 М раствор хлористоводородной кислоты или 1 М раствор натрия гидроксида |
до рН 4,5 | до рН 4,5 | до рН 4,5 | до рН 4,5 |
| Вода для инъекций | до 1 мл | до 0,2 мл | до 1,0 мл | до 0,2 мл |
Прозрачная бесцветная жидкость.
гипогликемическое средство — глюкагоноподобного полипептида рецепторов агонист.
Код АТХ
А10ВХ10.
Фармакодинамика
Механизм действия
Ликсисенатид является сильным и селективным агонистом рецепторов глюкагоноподобного пептида-1 (ГПП-1). Рецептор ГПП-1 является мишенью для нативного ГПП-1, эндогенного гормона внутренней секреции, который потенцирует глюкозозависимую секрецию инсулина бета-клетками панкреатических островков. Действие ликсисенатида связано с его специфическим взаимодействием с рецепторами ГПП-1, приводящим к увеличению внутриклеточного содержания циклического аденозинмонофосфата (цАМФ). Ликсисенатид стимулирует секрецию инсулина бета-клетками панкреатических островков в ответ на гипергликемию. При снижении концентрации глюкозы в крови до нормальных значений стимуляция секреции инсулина прекращается, что уменьшает риск развития гипогликемии. При гипергликемии ликсисенатид одновременно подавляет секрецию глюкагона, однако при этом сохраняется защитная реакция секреции глюкагона в ответ на гипогликемию.
Показана тенденция к инсулинотропной активности ликсисенатида, включая увеличение биосинтеза инсулина и стимуляцию бета-клеток панкреатических островков у животных. Ликсисенатид замедляет опорожнение желудка, уменьшая за счет этого скорость повышения концентрации глюкозы в крови после приема пищи. Влияние на опорожнение желудка может также способствовать снижению массы тела.
Фармакодинамические эффекты
При введении 1 раз в сутки пациентам с сахарным диабетом 2 типа ликсисенатид улучшает гликемический контроль за счет быстро развивающегося после его введения и продолжительного снижения концентрации глюкозы в крови после еды и натощак.
Этот эффект ликсисенатида на концентрацию глюкозы в крови после еды был подтвержден в 4-недельном исследовании, в котором проводилось сравнение применения ликсисенатида с применением лираглутида 1,8 мг 1 раз в сутки. Ликсисенатид в дозе 20 мкг 1 раз в сутки продемонстрировал большее снижение площади под кривой концентрации глюкозы в крови после стандартного приема пищи, по сравнению с применением лираглутида 1,8 мг один раз в сутки: уменьшение, по сравнению с исходным значением AUC0:30-4:30 ч (площади под кривой «концентрация-время») для концентрации глюкозы в крови после стандартного приема пищи составляло: -227,25 ч*мг/дл (-12,61 ч*ммоль/л) в группе ликсисенатида и -72,83 ч*мг/дл (-4,04 ч*ммоль/л) в группе лираглутида.
Клиническая эффективность и безопасность
Влияние препарата Ликсумия® на гликемический контроль было изучено в 6-ти рандомизированных двойных слепых, плацебо-контролируемых клинических исследованиях и одном рандомизированном, открытом, контролируемом активным препаратом (эксенатидом) исследовании, в которые, в общей сложности, вошло 3825 пациентов с сахарным диабетом 2 типа (ликсисенатид применялся у 2445 пациентов (48,2 % мужчин и 51,8 % женщин). 768 пациентов (447 пациентов были рандомизированы для приема ликсисенатида) были в возрасте >65 лет и 103 пациента (57 пациентов были рандомизированы для приема ликсисенатида) были в возрасте >75 лет.
Завершенные клинические исследования фазы III показали, что 90 % пациентов к концу 24-недельного периода лечения продолжали лечение препаратом Ликсумия® в поддерживающей дозе 20 мкг один раз в сутки.
Влияние на гликемический контроль
При применении препарата Ликсумия® отмечено большее, по сравнению с плацебо, снижение показателя гликозилированного гемоглобина (HbA1C) в крови (независимо от сопутствующего лечения). Кроме этого, препарат Ликсумия® при однократном введении в течение суток показал не меньшее снижение показателя HbAic, чем эксенатид при двукратном введении в течение суток. Это влияние на снижение показателя HbA1C сохранялось в долгосрочных исследованиях до 2-х лет.
Снижение показателя НЬА1C было достоверным при ежедневном однократном введении препарата Ликсумия®, как утром, так и вечером.
Добавление ликсисенатида к лечению пероральными гипогликемическими препаратами
Препарат Ликсумия® в сочетании с метформином, пероральным гипогликемическим препаратом группы сульфонилмочевины, или с комбинациями этих препаратов в конце 24-недельного периода лечения, по сравнению с плацебо, показал клинически и статистически значимое снижение показателя HbA1C, концентрации глюкозы в крови натощак и через 2 ч после еды (проба со стандартной пищевой нагрузкой).
Добавление ликсисенатида к монотерапии метформином
В плацебо-контролируемых исследованиях добавление ликсисенатида к метформину приводило к снижению показателя HbA1C на 0,83 % и снижению такового на 0,42 % при добавлении плацебо. Процент пациентов, достигших снижения показателя НЬА1C до <7 %, составлял 43 % в группе ликсисенатида и 24 % в группе плацебо.
В контролируемом активным препаратом (эксенатид) исследовании в конце основного 24-недельного периода лечения однократное в течение суток введение препарата Ликсумия® показало не меньшее снижение показателя HbA1C, по сравнению с двукратным в течение суток введением эксенатида (соответственно, на 0,79 % и 0,96 %,); при этом наблюдался практически одинаковый процент пациентов, достигших снижения показателя HbA1C до <7 %: 48,5 % в группе ликсисенатида и 49,8 % в группе эксенатида.
Добавление ликсисенатида к лечению одним из пероралъных гипогликемических препаратов группы сульфонилмочевины в монотерапии и в сочетании с метформином
Добавление ликсисенатида к лечению одним из пероральных гипогликемических препаратов группы сульфонилмочевины в монотерапии и в сочетании с метформином приводило к снижению показателя НЬА1C на 0,85 % по сравнению с таковым при добавлении плацебо, составляющим -0,10%. Процент пациентов, достигших снижения показателя HbAic до <7 %, составлял 36,4 % при добавлении ликсисенатида и 13,5 % при добавлении плацебо.
Добавление ликсисенатида к комбинированной терапии, включающей базальный инсулин
Препарат Ликсумия® при его совместном применении с базальным инсулином в монотерапии, или с комбинацией базального инсулина с метформином, или с комбинацией базального инсулина с пероральным гипогликемическим препаратом группы сульфонилмочевины вызывал статистически значимое снижение показателя HbA1C и концентрации глюкозы через 2 ч после стандартного приема пищи по сравнению с плацебо. К концу основного 24-недельного периода лечения в группе препарата Ликсумия®, по сравнению с группой плацебо, наблюдалось большее снижение суточной дозы инсулина, по сравнению с его дозами до добавления к лечению препарата Ликсумия®.
При добавлении ликсисенатида к лечению базальным инсулином в монотерапии или в комбинации с метформином наблюдалось снижение показателя НbА1C на 0,74 % против -0,38 % при добавлении плацебо, а при добавлении ликсисенатида к лечению базальным инсулином в монотерапии или в комбинации с пероральным гипогликемическим препаратом группы сульфонилмочевины наблюдалось снижение показателя HbA1C на 0,77 % против -0,11 % при добавлении плацебо.
Влияние на концентрацию глюкозы в плазме крови натощак
В плацебо-контролируемых исследованиях средние значения снижения концентрации глюкозы в плазме крови натощак, достигаемого при лечении препаратом Ликсумия® к концу 24-недельного периода лечения, находились в диапазоне от -0,42 ммоль/л до -1,19 ммоль/л.
Влияние на постпрандиальную (после приема пищи) концентрацию глюкозы в крови
Лечение препаратом Ликсумия®, независимо от сопутствующей терапии, приводило к статистически превосходящему эффект плацебо снижению 2-часовой постпрандиальной (определяемой через 2 ч после стандартного приема пищи) концентрации глюкозы в крови. К концу 24-недельного периода лечения во всех исследованиях, в которых проводилось определение постпрандиальной концентрации глюкозы в крови, это снижение 2-часовой постпрандиальной концентрации глюкозы в крови находилось в диапазоне от -4,51 ммоль/л до -7,96 ммоль/л (по сравнению значениями 2-часовой постпрандиальной концентрации глюкозы в крови до применения препарата Ликсумия®); у 26,2 % — 46,8 % пациентов наблюдались 2-часовые постпрандиальные концентрации глюкозы в крови ниже 7,8 ммоль/л.
Влияние на массу тела
Во всех контролируемых исследованиях лечение препаратом Ликсумия® в комбинации с метформином, базальным инсулином и/или пероральным гипогликемическим препаратом группы сульфонилмочевины к концу основного 24-недельного периода лечения приводило к среднему снижению массы тела до -2,96 кг, которое сохранялось в долгосрочных исследованиях до 2-х лет.
Снижение массы тела не зависело от возникновения тошноты и рвоты.
Влияние на функцию бета-клеток панкреатических островков
Препарат Ликсумия® улучшает функцию бета-клеток панкреатических островков, определяемую с помощью гомеостатической модели для оценки функции бета-клеток (НОМА-?).
У пациентов с сахарным диабетом 2 типа (n=20) после однократного введения препарата Ликсумия® было продемонстрировано восстановление первой фазы секреции инсулина и улучшение второй фазы секреции инсулина в ответ на внутривенное болюсное введение глюкозы.
Влияние на частоту сердечных сокращений (ЧСС)
В плацебо контролируемых клинических исследованиях III фазы не наблюдалось увеличения средних значений ЧСС.
В 4-недельном клиническом исследовании, по сравнению с лираглутидом в группе ликсисенатида (20 мкг 1 раз в сутки), ЧСС уменьшалось в среднем на 3,6 удара в минуту, а в группе лираглутида (1,8 мг 1 раз в сутки) ЧСС уменьшалось на 5,3 удара в минуту.
Влияние на артериальное давление (АД)
В плацебо-контролируемых исследованиях III фазы наблюдалось снижение средних значений систолического и диастолического АД на 2,1 мм рт. ст. и на 1,5 мм рт. ст., соответственно.
Фармакокинетика
Абсорбция После подкожного введения ликсисенатида пациентам с сахарным диабетом 2 типа скорость его абсорбции является высокой и не зависит от введенной дозы. Независимо от дозы и того, вводился ли ликсисенатид однократно или ежедневно многократно, у пациентов с сахарным диабетом 2 типа медиана времени достижения максимальной концентрации ликсисенатида в крови (tmax) составляет 1-3,5 ч. Отсутствуют клинически значимые различия в скорости абсорбции ликсисенатида, когда он вводится подкожно в область живота, область бедра или область плеча.
Распределение
Ликсисенатид имеет умеренную степень связи с белками крови у человека (55 %). Независимо от вводимой дозы, объем распределения после подкожного введения ликсисенатида у пациентов с сахарным диабетом 2 типа составляет 90-140 л после однократного введения и 90-120 л при повторном введении (в состоянии достижения равновесной концентрации ликсисенатида в крови).
Метаболизм
Как пептид, ликсисенатид выводится с помощью гломерулярной фильтрации с последующей канальцевой реабсорбцией и метаболической деградацией, приводящей к образованию более мелких пептидов и аминокислот, которые повторно вовлекаются в белковый обмен.
Выведение
После повторного введения пациентам с сахарным диабетом 2 типа среднее значение периода полувыведения (t?) обычно находилось в диапазоне 1,5-4,5 ч, и среднее значение клиренса находилось в диапазоне 20-67 л/ч (в состоянии достижения равновесной концентрации ликсисенатида в крови).
Особые группы пациентов
Половая принадлежность
По данным анализа популяционных фармакокинетических данных половая принадлежность не влияет на фармакокинетику ликсисенатида.
Пациенты пожилого возраста
По данным анализа популяционных фармакокинетических показателей у пациентов с сахарным диабетом 2 типа и анализа фармакокинетических исследований, проведенных у лиц пожилого возраста без сахарного диабета, возраст не оказывает клинически значимого воздействия на фармакокинетику ликсисенатида.
Этническая принадлежность
По данным фармакокинетических исследований, проведенных у лиц европеоидной расы, японцев и китайцев, этническая принадлежность не оказывает клинически значимого эффекта на фармакокинетику ликсисенатида.
Пациенты с печеночной недостаточностью
Так как ликсисенатид выводится, главным образом, почками, не проводилось никаких фармакокинетических исследований у пациентов с острым или хроническим нарушением функции печени. Не ожидается, что нарушение функции печени способно повлиять на фармакокинетику ликсисенатида.
Пациенты с почечной недостаточностью
Не наблюдалось значимых различий в средних значениях клиренса, максимальной концентрации в крови (Сmах) и площади под фармакокинетической кривой «концентрация-время» (AUC) ликсисенатида при нормальной функции почек и при почечной недостаточности легкой степени. При увеличении степени тяжести недостаточности средние значения Сmах и AUC увеличивались.
Сахарный диабет 2 типа у взрослых для достижения гликемического контроля у пациентов, сахарный диабет которых не контролируется проводимой гипогликемической терапией.
Препарат Ликсумия® показан в комбинации со следующими пероральными гипогликемическими лекарственными средствами:
- метформином,
- пероральным гипогликемическим препаратом группы сульфонилмочевины,
- комбинацией этих лекарственных средств.
Препарат Ликсумия® показан в комбинации с базальным инсулином:
- в монотерапии,
- в комбинации с метформином,
- в комбинации с пероральным гипогликемическим препаратом группы сульфонилмочевины.
- Гиперчувствительность к активному веществу или любому из вспомогательных веществ препарата.
- Беременность.
- Период грудного вскармливания.
- Сахарный диабет 1 типа.
- Диабетический кетоацидоз.
- Тяжелые заболевания желудочно-кишечного тракта, включая гастропарез.
- Тяжелая почечная недостаточность (клиренс креатинина менее 30 мл/мин).
- Дети и подростки до 18 лет.
С осторожностью
При панкреатите в анамнезе.
Применение при беременности и в период грудного вскармливания
Беременность
Отсутствует достаточное количество данных по применению препарата Ликсумия® у беременных женщин. Исследования, проведенные у животных, продемонстрировали эмбрио- и фетотоксическое действие. Потенциальный риск применения препарата Ликсумия® во время беременности у человека неизвестен. Применение препарата Ликсумия® во время беременности противопоказано. Во время беременности рекомендуется применение инсулина. Если пациентка планирует беременность, или у нее диагностирована беременность, лечение препаратом Ликсумия® следует прекратить.
Период грудного вскармливания
Неизвестно, проникает ли ликсисенатид в грудное молоко. Применение препарата Ликсумия® противопоказано во время периода грудного вскармливания (в связи с отсутствием опыта применения).
Способ применения и дозировка
Дозы
Начальная доза составляет 10 мкг препарата Ликсумия® один раз в сутки в течение 14 дней.
Затем доза препарата Ликсумия® должна быть увеличена до 20 мкг один раз в сутки. Эта доза является поддерживающей.
Когда препарат Ликсумия® добавляется к уже проводимой терапии метформином, прием метформина может быть продолжен без изменения его дозы.
Когда препарат Ликсумия® добавляется к уже проводимой терапии пероральным гипогликемическим препаратом группы сульфонилмочевины или к терапии комбинацией перорального гипогликемического препарата группы сульфонилмочевины и базального инсулина, для уменьшения риска развития гипогликемии можно рассмотреть вопрос о снижении дозы перорального гипогликемического препарата группы сульфонилмочевины или базального инсулина (см. раздел «Особые указания»).
Применение препарата Ликсумия® не требует специального мониторинга концентрации глюкозы в крови. Однако при применении его в комбинации с пероральным гипогликемическим препаратом группы сульфонилмочевины или базальным инсулином может потребоваться мониторинг концентрации глюкозы в крови или самоконтроль (контроль самим пациентом) концентрации глюкозы в крови для коррекции дозы перорального гипогликемического препарата группы сульфонилмочевины или базального инсулина.
Особые группы пациентов
Дети и подростки моложе 18 лет
В настоящее время безопасность и эффективность применения препарата Ликсумия® у пациентов моложе 18 лет не изучена.
Лица пожилого возраста
Не требуется коррекции дозы в зависимости от возраста пациента.
Пациенты с печеночной недостаточностью
Не требуется коррекции дозы у пациентов с печеночной недостаточностью.
Пациенты с почечной недостаточностью
Не требуется коррекции дозы у пациентов с легкой почечной недостаточностью (клиренс креатинина 50-80 мл/мин) и умеренной почечной недостаточностью (клиренс креатинина 30-50 мл/мин).
Отсутствует терапевтический опыт применения препарата Ликсумия® у пациентов с тяжелой почечной недостаточностью (клиренс креатинина менее 30 мл/мин) или с терминальной стадией почечной недостаточности, в связи с чем применение препарата Ликсумия® у этой группы пациентов противопоказано.
Способ применения
Препарат Ликсумия® вводится 1 раз в сутки в пределах 1 ч до первого в течение дня приема пищи или в пределах 1 ч до вечернего приема пищи. В случае пропуска введения очередной дозы, ее следует ввести в пределах 1 ч до следующего приема пищи.
Препарат Ликсумия® вводится подкожно в область бедра, брюшной стенки или плеча.
Препарат Ликсумия® нельзя вводить внутривенно и внутримышечно.
До использования шприц-ручка Ликсумия® должна храниться в холодильнике при температуре 2-8°С в своей упаковке для того, чтобы защитить ее от воздействия света. После первого использования шприц-ручка Ликсумия® должна храниться при температуре не выше 30°С.
После каждого использования шприц-ручку Ликсумия® следует закрывать колпачком для того, чтобы защитить ее от воздействия света. Шприц-ручку Ликсумия® не следует хранить с присоединенной иглой. Не использовать шприц-ручку Ликсумия®, если она была заморожена.
Шприц-ручка Ликсумия® подлежит утилизации через 14 дней.
Более подробную информацию по проведению инъекций с помощью шприц-ручки Ликсумия® см. ниже в разделе «Описание шприц-ручек Ликсумия® и инструкция по их использованию».
Частота возникновения нежелательных реакций (HP) определялась следующим образом: очень часто: >10%; часто: >1% — <10%; нечасто: >0,1% — <1%; редко: >0,01% — <0,1%; очень редко: <0,01%.
В 8-ми крупных плацебо-контролируемых и контролируемых активным препаратом клинических исследованиях III фазы более 2600 пациентов получали препарат Ликсумия® в монотерапии или в комбинации с метформином, пероральным гипогликемическим препаратом группы сульфонилмочевины (в сочетании с метформином или без сочетания с метформином) или базальным инсулином (в сочетании с метформином, или без сочетания с метформином, или в сочетании с пероральным гипогликемическим препаратом группы сульфонилмочевины, или без сочетания с пероральным гипогликемическим препаратом группы сульфонилмочевины).
Наиболее частыми HP, о которых сообщалось в клинических исследованиях, были тошнота и рвота. Эти реакции были, главным образом, слабовыраженными и преходящими.
Ниже представлены HP, сообщения о которых поступали из плацебо-контролируемых и контролируемых активным препаратом клинических исследований III фазы, которые за весь период лечения (включая период, превышающий основной 24-недельный период лечения в исследованиях, в которых лечение проводилось в общей сложности >76 недель) возникали с частотой >5% (если их частота была выше у пациентов, принимавших препарат Ликсумия®, по сравнению с пациентами, принимавшими все другие препараты сравнения, включая плацебо); а также с частотой >1% у пациентов в группе препарата Ликсумия®, если их частота более чем в 2 раза превышала частоту возникновения этой HP у пациентов, получавших любой из препаратов сравнения (включая плацебо).
Инфекционные и паразитарные заболевания
Часто
Грипп, инфекции верхних отделов дыхательных путей.
Нарушения обмена веществ и питания
Очень часто
Гипогликемия, протекающая с клинической симптоматикой (когда препарат Ликсумия® применяется в комбинации с пероральным гипогликемическим препаратом группы сульфонилмочевины и/или базальным инсулином).
Нарушения со стороны нервной системы
Очень часто
Головная боль.
Часто
Головокружение.
Нарушения со стороны желудочно-кишечного тракта
Очень часто
Тошнота, рвота, диарея.
Часто
Диспепсия.
Нарушения со стороны скелетно-мышечной и соединительной ткани
Часто
Боли в спине.
Гипогликемия
У пациентов, получающих препарат Ликсумия® в монотерапии или в комбинации с метформином, гипогликемия с клиническими проявлениями развивалась часто, а ее частота у пациентов, которым вводился препарат Ликсумия®, была подобной таковой при введении плацебо во время всего периода лечения.
У пациентов, которым вводился препарат Ликсумия® в сочетании с пероральным гипогликемическим препаратом группы сульфонилмочевины или базальным инсулином, частота развития гипогликемии, протекающей с клинической симптоматикой, была очень частой.
Во время всего периода лечения препаратом Ликсумия® частота возникновения протекающей с клинической симптоматикой гипогликемии была незначительно выше, чем при применении плацебо, когда препарат Ликсумия® применялся в комбинации:
- с пероральным гипогликемическим препаратом группы сульфонилмочевины и метформином,
- с монотерапией базальным инсулином,
- с комбинацией базального инсулина и метформина.
За время всего периода лечения, когда препарат Ликсумия® применялся в сочетании с монотерапией пероральным гипогликемическим препаратом группы сульфонилмочевины, гипогликемия с клиническими проявлениями возникала у 22,7 % пациентов, получавших лечение препаратом Ликсумия®, и у 15,2% у пациентов, получавших плацебо. Когда препарат Ликсумия® применялся в тройной комбинации с пероральным гипогликемическим препаратом группы сульфонилмочевины и базальным инсулином, гипогликемия с клиническими проявлениями возникала у 47,2 % пациентов, получавших лечение ликсисенатидом, и у 21,6 % пациентов, получавших плацебо. В целом за весь период приема препарата в контролируемых клинических исследованиях III фазы частота возникновения тяжелой гипогликемии с клиническими проявлениями соответствововала градации «нечасто» (у 0,4 % у пациентов, получавших препарат Ликсумия®, и у 0,2 % у пациентов, получавших плацебо).
Нарушения со стороны желудочно-кишечного тракта
Тошнота и рвота были наиболее часто встречающимися HP, о которых сообщалось в течение основного 24-недельного периода лечения. Частота возникновения тошноты была выше у пациентов, получавших лечение препаратом Ликсумия® (26,1 %), чем у пациентов, получавших плацебо (6,2 %). Частота возникновения рвоты также была выше у пациентов, получавших лечение препаратом Ликсумия® (10,5 %), чем у пациентов, получавших плацебо (1,8 %). Эти HP были, главным образом, слабовыраженными и преходящими и возникали в течение первых 3-х недель после начала лечения. В течение последующих недель они постепенно уменьшались.
У пациентов, получавших лечение препаратом Ликсумия®, частота возникновения тошноты была ниже (24,5%), чем у пациентов, получавших лечение эксенатидом 2 раза в сутки (35,1%), а частота других HP со стороны желудочно-кишечного тракта в обеих группах лечения была одинаковой.
Реакции в месте введения
Реакции в месте введения в течение 24-недельного периода лечения наблюдались у 3,9 % пациентов, получавших препарат Ликсумия®, в то время как у пациентов, получавших плацебо, они наблюдались с частотой 1,4%. Большинство реакций были слабовыраженными по интенсивности и обычно не приводили к прекращению лечения.
Иммуногенность
В связи с потенциально иммуногенными свойствами лекарственных препаратов, содержащих белки или пептиды, после лечения препаратом Ликсумия® у пациентов возможно образование антител к ликсисенатиду. В конце 24-недельного периода лечения в плацебо-контролируемых исследованиях у 69,4 % пациентов, получавших лечение ликсисенатидом, имелись положительные результаты исследования на наличие антител к ликсисенатиду. Однако изменение показателя HbA1C, по сравнению с таковым до применения ликсисенатида, было одинаковым, вне зависимости от положительного или отрицательного результата анализа на наличие антител к ликсисенатиду. Из получавших лечение ликсисенатидом пациентов, у которых определялся показатель HbA1C, у 79,3 % имелся отрицательный результат анализа на наличие антител к ликсисенатиду или титр антител к ликсисенатиду был ниже нижней границы возможности его количественного определения, а у остальных 20,7 % пациентов имелись количественно определяемые титры антител к ликсисенатиду.
Не наблюдалось каких-либо различий в общем профиле безопасности у пациентов в зависимости от статуса антител к ликсисенатиду, за исключением увеличения частоты реакций в месте введения у антитело-позитивных пациентов. Большинство реакций в месте введения были слабовыраженными, независимо от наличия или отсутствия антител к ликсисенатиду.
Отсутствовала перекрестная иммунологическая реактивность с нативным глюкагоном или эндогенным ГПП-1.
Аллергические реакции
Аллергические реакции, возможно связанные с применением ликсисенатида (такие как анафилактические реакции, ангионевротический отек и крапивница) в течение основного 24-недельного периода лечения, наблюдались у 0,4 % пациентов, получавших препарат Ликсумия®, по сравнению с менее чем 0,1 % пациентов в группе плацебо.
Преждевременное прекращение применения препарата
Частота прекращения лечения препаратом из-за возникновения нежелательных реакций составляла 7,4 % в группе препарата Ликсумия® и 3,2 % в группе плацебо. Наиболее частыми HP, приводящими к отмене лечения в группе препарата Ликсумия®, были тошнота (3,1 %) и рвота (1,2 %).
Симптомы передозировки
Во время 13-недельного клинического исследования пациентам с сахарным диабетом 2 типа вводились дозы ликсисенатида до 30 мкг 2 раза в сутки. Эти дозы хорошо переносились, наблюдалось только увеличение частоты возникновения нарушений со стороны желудочно-кишечного тракта.
Лечение
В случае передозировки, в зависимости от клинических проявлений и симптомов у пациента, следует проводить соответствующее поддерживающее лечение, а доза препарата Ликсумия® должна быть снижена до предписанной дозы.
Взаимодействие с другими лекарственными средствами
Ликсисенатид является пептидом и не метаболизируется с помощью изоферментов цитохрома Р450. В in vitro исследованиях, проведенных у человека, ликсисенатид не нарушал активности протестированных изоферментов цитохрома Р450 или транспортеров.
Задержка опорожнения желудка при применении ликсисенатида может повлиять на скорость абсорбции лекарственных препаратов, принимаемых внутрь. Для принимаемых внутрь лекарственных препаратов, эффективность которых особенно зависит от пороговых концентраций, пациентам следует рекомендовать принимать эти лекарственные препараты, как минимум, за 1 ч до или спустя 11 ч после инъекции ликсисенатида.
Парацетамол
После однократного приема парацетамола в дозе 1000 мг, AUC и t? парацетамола не изменялись, независимо от времени его приема (до или после инъекции ликсисенатида). При приеме через 1 ч или 4 ч после инъекции 10 мкг ликсисенатида Сmах парацетамола снижалась на 29 % и 31 %, соответственно, а медиана tmax увеличивалось на 4,5 ч и 2 ч, соответственно. Исходя из этих данных, не требуется коррекции дозы парацетамола при его применении совместно с ликсисенатидом.
Пероральные контрацептивные лекарственные средства
После однократного приема внутрь перорального контрацептивного лекарственного препарата (этинилэстрадиол 0,03 мг/левоноргестрел 0,15 мг) за 1 ч до или спустя 11 ч после подкожной инъекции ликсисенатида Cmax, AUC, t? и tmax этинилэстрадиола и левоноргестрела не изменялись. Прием внутрь этинилэстрадиола и левоноргестрела через 1 ч или 4 ч после подкожной инъекции ликсисенатида не оказывал влияния на их AUC и t?, в то время как Сmах этинилэстрадиола снижалась на 52 % (при приеме через 1 ч) и 39 % (при приеме через 4 ч), а Сmах левоногестрела снижалась на 46 % (при приеме через 1 ч) и 20 % (при приеме через 4 ч), а также медиана tmax увеличивалась на 2-4 ч. Снижение Сmах имеет ограниченное клиническое значение, и не требуется коррекции дозы пероральных контрацептивных препаратов.
Аторвастатин
При одновременном применении утром ликсисенатида и аторвастатина в дозе 40 мг системная экспозиция аторвастатина не изменялась, его Стах незначительно снижалась, а tmax увеличивалось на 1,5-4 ч.
Если аторвастатин принимался вечером, а ликсисенатад утром, то не наблюдалось увеличения tmax, но AUC и Сщзх увеличивались на 27 % и 66 %, соответственно.
Эти изменения не были клинически значимыми, и поэтому не требуется коррекции дозы аторвастатина при его совместном применении с ликсисенатидом.
Варфарин
После одновременного применения варфарина 25 мг и ликсисенатида не наблюдалось влияния на AUC или MHO (международное нормализованное отношение), в то время как tmax увеличивалось до 7 ч.
Исходя из этих данных, не требуется коррекции дозы варфарина при его совместном применении с ликсисенатидом.
Дигоксин
После одновременного применения ликсисенатида и дигоксина в дозе 0,25 мг AUC дигоксина не изменялась, tmax увеличивалось на 1,5 ч и Cmax уменьшалось на 26 %. Исходя из этих данных, не требуется коррекции дозы дигоксина при его совместном применении с ликсисенатидом.
Рамиприл
После одновременного применения ликсисенатида и рамиприла в дозе 5 мг в течение 7 дней AUC рамиприла увеличивалась на 21 %, в то время как Сmах снижалась на 63 %. AUC и Сmах активного метаболита (рамиприлата) не изменялись. tmax рамиприла и рамиприлата увеличивалось приблизительно на 2,5 ч.
Исходя из этих данных, не требуется коррекции дозы рамиприла при его совместном применении с ликсисенатидом.
Применение при сахарном диабете 1 типа
Отсутствует терапевтический опыт применения препарата Ликсумия® у пациентов с сахарным диабетом 1 типа, и его применение у таких пациентов противопоказано. Применение препарата Ликсумия® при диабетическом кетоацидозе противопоказано.
Риск панкреатита
Применение агонистов рецепторов ГПП-1 ассоциировалось с риском развития острого панкреатита. Характерным симптомом острого панкреатита являются длительно сохраняющиеся сильные боли в животе. При подозрении на развитие панкреатита следует прекратить лечение препаратом Ликсумия®; при подтверждении диагноза острого панкреатита возобновлять лечение препаратом Ликсумия® нельзя. Следует с осторожностью применять препарат у пациентов с панкреатитом в анамнезе.
Применение при тяжелом гастропарезе
Применение агонистов рецепторов ГПП-1 может ассоциироваться с нежелательными реакциями со стороны желудочно-кишечного тракта. Применение препарата Ликсумия® у пациентов с тяжелыми заболеваниями желудочно-кишечного тракта, включая гастропарез, до настоящего времени не изучалось, и поэтому у таких пациентов применение препарата Ликсумия® противопоказано.
Риск развития гипогликемии Пациенты, получающие лечение препаратом Ликсумия® в сочетании с пероральным гипогликемическим препаратом группы сульфонилмочевины или с комбинацией базального инсулина и перорального гипогликемического препарата группы сульфонилмочевины, могут иметь повышенный риск развития гипогликемии. Для уменьшения риска развития гипогликемии может быть рассмотрен вопрос о снижении дозы перорального гипогликемического препарата группы сульфонилмочевины или базального инсулина.
Влияние на способность управлять транспортными средствами или заниматься другими потенциально опасными видами деятельности
Не проводилось исследований по влиянию препарата на способность управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности.
При применении препарата в комбинации с пероральным гипогликемическим препаратом группы сульфонилмочевины или базальным инсулином пациенты должны быть информированы о необходимости соблюдения мер предосторожности для предупреждения возникновения гипогликемии во время управления транспортными средствами или при занятии другими потенциально опасными видами деятельности.
Раствор для подкожного введения 0,05 мг/мл (10 мкг/доза) и 0,1 мг/мл (20 мкг/доза).
По 3 мл препарата в картридж из бесцветного стекла (тип I). Картридж укупорен с одной стороны пробкой (ламинат из синтетической изопреновой резины и бромбутиловой резины), обжатой алюминиевым колпачком, с другой стороны закрыт притертым поршнем из бромбутиловой резины. Картридж вмонтирован в одноразовую шприц-ручку.
Для раствора 0,05 мг/мл (10 мкг/доза): по 1 шприц-ручке вместе с инструкцией по применению в картонную пачку, снабженную фиксатором.
Для раствора 0,1 мг/мл (20 мкг/доза): по 1, 2 или 6 шприц-ручек вместе с инструкцией по применению в картонную пачку, снабженную фиксатором.
Комплект: по 1 шприц-ручке с раствором 0,05 мг/мл (10 мкг/доза) и 1 шприц-ручке с раствором 0,1 мг/мл (20 мкг/доза) вместе с инструкцией по применению в картонную пачку, снабженную фиксатором.
Хранить в защищенном от света месте при температуре от 2°С до 8°С.
Не замораживать.
Хранить в недоступном для детей месте.
2 года.
Не применять по истечении срока годности.
Отпускается по рецепту.
Производитель
Санофи-Авентис Дойчланд ГмбХ, Германия.
Industriepark Hoechst, Brueningstrasse 50, D-65926 Frankfurt (Main), Germany.
Юридическое лицо, на имя которого выдано регистрационное удостоверение
Санофи, Франция.
Претензии потребителей направлять по адресу в России
125009, г. Москва, ул. Тверская, 22.
Описание шприц-ручек Ликсумия® и инструкция по их использованию
Перед использованием шприц-ручки Ликсумия® внимательно прочитайте инструкцию и получите у лечащего врача информацию по правильной технике проведения инъекции. Если Вы не способны сами полностью следовать инструкции (например, если Вы слепы или у Вас есть серьезные проблемы со зрением), используйте шприц-ручку только в том случае, если у Вас есть возможность воспользоваться помощью человека, который способен следовать инструкциям.
Препарат Ликсумия® выпускается в виде предварительно заполненных шприц-ручек для инъекций, в каждой из которых содержится 14 доз. Выпускается 2 вида шприц-ручек Ликсумия®, которые окрашены в разные цвета и имеют разный тактильный элемент на кнопке введения дозы и колпачке шприц-ручки: шприц-ручка с разовой дозой 20 мкг ликсисенатида в 0,2 мл имеет бордовый цвет и тактильный элемент в виде кругов, а шприц-ручка с разовой дозой 10 мкг ликсисенатида в 0,2 мл имеет зеленый цвет и тактильный элемент в виде линий.
Внешний вид шприц-ручки Ликсумия® 20 мкг
Внешний вид шприц-ручки Ликсумия® 10 мкг
Используйте с Вашей шприц-ручкой Ликсумия® одноразовые иглы для шприц-ручек с просветом 29-32 G.
Черный поршень будет продвигаться по дозировочной шкале после каждой инъекции.
Важные рекомендации
- Вводите только по одной дозе в сутки.
- Эта шприц-ручка предназначена для использования только одним человеком. Не пользуйтесь ей вместе с кем-либо.
- Если Вы делаете инъекцию другому человеку или если Ваша инъекция проводится другим человеком, следует соблюдать особую осторожность для того, чтобы избежать случайного повреждения иглой, что может привести к передаче инфекций, передающихся через кровь.
- Всегда проверяйте маркировку на шприц-ручке, ее цвет и тактильный элемент на колпачке и кнопке введения дозы, чтобы удостовериться, что у Вас имеется шприц-ручка с нужной Вам дозой, и у нее не истек срок годности
- Каждая шприц-ручка Ликсумия® содержит 14 соответствующих доз. Нет необходимости набора требуемой дозы.
- Проверьте внешний вид резервуара с препаратом Ликсумия®. Жидкость должна быть прозрачной, бесцветной и не содержать механических включений. В противном случае не используйте эту шприц-ручку.
- Всегда используйте новую стерильную иглу для каждой инъекции. Это поможет избежать контаминации и закупорки иглы
- Всегда имейте запасную шприц-ручку Ликсумия® на случай, если Ваш экземпляр шприц-ручки потеряется или повредится.
- Не пытайтесь извлечь жидкость из резервуара шприц-ручки Ликсумия® с помощью шприца.
- После первой активации Вашей шприц-ручки Ликсумия® она может использоваться в течение 14 дней.
- Вы должны активировать Вашу шприц-ручку Ликсумия® перед использованием ее в первый раз, чтобы удостовериться в том, что она работает правильно и что доза для Вашей первой инъекции является правильной
- Когда Вы активируете Вашу шприц-ручку Ликсумия® первый раз, не вводите себе раствор. Вместо этого для того, чтобы собрать выделяющийся при активации шприц-ручки Ликсумия® избыток раствора используйте подходящий контейнер (бумажный стаканчик или ткань).
- Перед первым использованием каждой новой шприц-ручки Ликсумия® процесс активации должен проводиться только однократно
- Не повторяйте процесс активации перед каждой инъекцией, в противном случае Вы не получите все 14 доз из шприц-ручки Ликсумия®.
На рисунке ниже показано, как выглядит шприц-ручка перед активацией и после активации.
Не активированная
(Оранжевое окно)
Активированная ручка — готова для проведения инъекций
(Белое окно)
Активация шприц-ручки Ликсумия®
Этап 1. Снятие колпачка и проверка шприц-ручки
Проверьте, является ли активационное окно оранжевым.
Проверьте раствор. Он должен быть прозрачным, бесцветным и не содержать механических включений. В противном случае не используйте эту шприц-ручку.
В новой шприц-ручке черный поршень не должен быть виден на дозировочной шкале.
Этап 2. Присоединение иглы и удаление колпачков иглы
Протрите пробку (на конце картриджа) ватным тампоном, смоченным спиртом.
Удалите защитную пленку с наружного колпачка иглы.
Расположите на одной линии иглу и шприц-ручку и держите их прямо, когда Вы плотно закрепляете иглу на шприц-ручке.
Соблюдайте осторожность, чтобы не уколоться открытой иглой.
Снимите наружный колпачок иглы и храните его для того, чтобы позднее удалить иглу. Снимите внутренний колпачок и выбросите его.
Храните Выбрасывайте
Этап 3. Оттягивание кнопки введения дозы и проверка стрелки
Проверьте, чтобы стрелка указывала на кнопку введения дозы.
Полностью оттяните кнопку введения дозы.
Стрелка должна поменять свое направление и стать направленной на иглу.
Проверьте, чтобы стрелка указывала на иглу.
Этап 4. Нажатие и удерживание кнопки введения дозы для активации шприц-ручки
Направьте иглу в подходящий контейнер (например, бумажный стаканчик или ткань), в который будет выпущен избыточный раствор для дальнейшего уничтожения.
Нажмите на кнопку введения дозы до упора
Вы можете почувствовать и услышать «щелчок».
Удерживайте кнопку введения дозы в нажатом состоянии и медленно сосчитайте до пяти для того, чтобы вытекли последние капли.
Этап 5. Проверка активирована ли шприц-ручка
Если этого не происходит, не используйте данную шприц-ручку.
Теперь эта шприц-ручка активирована. Не повторяйте активацию для этой шприц-ручки
Переходите непосредственно к этапу С для введения Вашей первой дозы
Вам не нужно заменять иглу между активацией и первой инъекцией.
Если Вы случайно ввели себе препарат до активации Вашей шприц-ручки, не исправляйте эту ошибку путем введения себе второй инъекции. Свяжитесь с Вашим лечащим врачом для получения рекомендаций по контролю за концентрацией глюкозы в крови.
Ежедневное использование шприц-ручки
Переходите к этому разделу только тогда, когда активационное окно является белым.
Каждый день вводите только ОДНУ дозу
Этап А. Снимите колпачок и проверьте шприц-ручку
Проверьте внешний вид раствора в резервуаре шприц-ручки. Она должна быть прозрачной, бесцветной и не содержать механических включений. В противном случае не используйте эту шприц-ручку.
Проверьте количество доз в шприц-ручке по указанию черного поршня.
Проверьте маркировку, цвет и тактильные элементы Вашей шприц-ручки, чтобы удостовериться в том, что Вы используете правильный препарат.
Удостоверьтесь в том, что активационное окно является белым. Если оно оранжевое, то перейдите в раздел «Активация шприц-ручки»
Этап В. Присоединение новой иглы и удаление колпачков иглы
Протрите резиновую герметизирующую пробочку (на конце картриджа) ватным тампоном, смоченным спиртом.
Удалите защитную пленку с наружного колпачка иглы.
Расположите на одной линии иглу и шприц-ручку и держите их прямо, когда Вы плотно закрепляете иглу на шприц-ручке.
Соблюдайте осторожность, чтобы не уколоться открытой иглой.
Снимите наружный колпачок иглы и храните его для того, чтобы позднее удалить иглу.
Снимите внутренний колпачок и выбросите его.
Всегда используйте
новую стерильную иглу
для каждой инъекции.
Этап С. Оттягивание кнопки введения дозы и проверка направления стрелки
Удостоверьтесь в том, что стрелка направлена в сторону кнопки введения дозы.
До упора оттяните кнопку введения дозы.
Удостоверьтесь в том, что стрелка изменила свое направления и направлена в сторону иглы.
Теперь шприц-ручка готова для проведения инъекции.
Этап D. Нажатие на кнопку введения дозы и удерживание ее в этом положении для того, чтобы ввести дозу
Соберите кожу в складку и введите иглу.
Места инъекций
Препарат Ликсумия® может вводиться подкожно в любую из указанных синим цветом на рисунках областей, которые находятся на бедре, животе и плече.
Нажмите на кнопку введения дозы до упора
. Вы можете почувствовать или услышать «щелчок».
Удерживайте кнопку введения дозы в нажатом состоянии и медленно сосчитайте до пяти (5)
, чтобы получить полную дозу.
Теперь Вам введена Ваша доза.
Каждый день
вводите только
ОДНУ дозу
.
Примечание
- Маленькие воздушные пузырьки в резервуаре являются нормальным явлением. Они не повлияют на величину введенной дозы и не причинят Вам вреда.
- Возникновение ощущения препятствия во время всего процесса надавливания на кнопку введения дозы, может быть связано с закупоркой иглы или ее ненадлежащим подсоединением. Следует извлечь иглу из кожи и удалить иглу из шприц-ручки, подсоединить новую иглу и попробовать ввести препарат снова. Если и после этого жидкость не вытекает наружу, то это говорит о том, что шприц-ручка Ликсумия® испорчена, и ее использовать нельзя.
Этап Е. Проверка продвижения поршня
Черный поршень должен продвинуться по шкале доз.
(На примере выше шкала доз показывает, что осталось 13 инъекций)
Этап F. Удаление и выбрасывание иглы после каждой инъекции
Положите наружный колпачок иглы на плоскую поверхность. Введите иглу в наружный колпачок иглы.
Установите наружный колпачок иглы на прежнее место.
Надавите на наружный колпачок, чтобы прижать его к игле используйте его для того, чтобы выкрутить иглу из шприц-ручки.
Поместите иглу в резистентный к проколам контейнер или уничтожьте ее в соответствии с указаниями Вашего врача.
Закройте шприц-ручку колпачком.
Повторяйте все этапы в разделе «Ежедневное использование шприц-ручки» для проведения Ваших следующих ежедневных инъекций.
Через 14 дней после активации выбросите шприц-ручку, даже если в ней осталось некоторое количество препарата.
Хранение
Общая информация
- Храните шприц-ручку Ликсумия® в безопасном месте, недоступном для детей.
- Защищайте шприц-ручку от пыли и загрязнений.
- Надевайте колпачок шприц-ручки после каждого использования с целью защиты содержимого картриджа от воздействия света.
- Активируйте новую шприц-ручку непосредственно перед ее использованием в первый раз.
До активации
- Храните неиспользованные шприц-ручки в холодильнике (при температуре 2-8 °С; 36-46 °F). Не замораживайте шприц-ручки Ликсумия® и не используйте шприц-ручки Ликсумия®, если они были заморожены.
После активации
- Храните шприц-ручку Ликсумия® при температуре не выше 30°С.
- Не храните шприц-ручку с присоединенной иглой.
- После активации шприц-ручка Ликсумия® может использоваться в течение 14 дней.
Следует выбросить использованную шприц-ручку Ликсумия® через 14 дней, даже если в ней остается некоторое количество препарата. - Закрывайте шприц-ручку колпачком шприц-ручки после каждого использования с целью защиты содержимого картриджа от воздействия света.
Таблица активации и утилизации
| Шприц-ручка | Дата активации | Дата утилизации |
| 1 | ||
| 2 | ||
| 3 | ||
| 4 | ||
| 5 | ||
| 6 |
Уход за шприц-ручкои
- Следует осторожно обращаться со шприц-ручкой Ликсумия®.
- Вы может очищать наружную поверхность Вашей шприц-ручки Ликсумия®, протирая ее влажной тряпочкой.
- Не замачивайте, не мойте или не смазывайте шприц-ручку Ликсумия®, так как это может повредить ее.
- Если Вы подозреваете, что шприц-ручка может быть повреждена, не используйте ее. Получите новую шприц-ручку. Не пытайтесь самостоятельно чинить шприц-ручку.
Утилизация
После введения 14 доз шприц-ручка Ликсумия® является пустой и не будет больше работать. Вы должны безопасно уничтожить шприц-ручку после того, как из нее будет введено 14 доз.
Наденьте колпачок на Вашу шприц-ручку Ликсумия® перед тем, как выбросить ее в отходы.