Исследовательская группа из университетов Тюбингена и Геттингена изучила эффекты нового класса антибиотиков, которые эффективны против патогенов с множественной лекарственной устойчивостью. Результаты были опубликованы в научном журнале Angewandte Chemie.
Как объяснила Надин Шиллинг из Института органической химии в Тюбингенском университете, пептидные антибиотики нарушают энергообеспечение бактериальных клеток, что приводит к их гибели. В Европейском союзе в 2015 году было зарегистрировано приблизительно 670 000 резистентных к антибиотикам инфекций, что привело к смерти 33 000 пациентов.
Ученые из Тюбингенского университета обнаружили в 2016 году первый пептидный антибиотик, который содержится в микробиоме человека. Ученые назвали вещество «лугдунином», в честь его производителя — Staphylococcus lugdunensis, который обитает в слизистой оболочке носа человека. Лугдунин имеет необычную химическую структуру и может быть прототипом для нового класса антибиотиков.
Staphylococcus lugdunensis — неподвижные грамположительные кокки диаметром от 0,8 до 1 мкм. Они растут индивидуально, парами, небольшими скоплениями или цепочками длиной от 3 до 5 клеток. Staphylococcus lugdunensis — факультативный анаэроб, который имеет слегка желтоватый цвет. Некоторые штаммы бактерий образуют большое количество лугдунина.
Лугдунин — новый тиазолидиновый циклопептид, который проявляет микромолярную активность против метициллин-резистентного золотистого стафилококка. Антибактериальная активность сильно коррелирует с изменением мембранного потенциала у Staphylococcus aureus.
Исследователи синтезировали различные вещества и изучили механизм действия нового класса антибиотиков. «Каждая бактериальная клетка нуждается в трансмембранном потенциале» — объясняет Шиллинг. — «То есть для патогена крайне важно, чтобы концентрации электрически заряженных частиц внутри и снаружи клетки различались. Антибиотик вызывает «энергетический сбой», поэтому бактериальная клетка умирает».
Многие из новых антибиотиков, используемых в настоящее время, отличаются незначительно от тех, которые имеют множественную резистентность. Лугдунин имеет уникальную химическую структуру и состоит из кольца аминокислотных строительных блоков (пептидной структуры), включающего характерное кольцевое серно-азотное соединение, называемое тиазолидином.
«Многие ранее известные пептидные антибиотики очень специфичны» — объясняет Шиллинг. Лекарственные средства связываются с ферментом благодаря своей пространственной структуре, блокируют необходимые процессы и, таким образом, предотвращают образование новых бактериальных клеток. Лугдунин, с другой стороны, не теряет антибиотический эффект при изменении пространственной структуры; т.е. действие не основано на пространственном взаимодействии.
Чтобы выяснить, эффективен ли новый пептидный антибиотик в качестве терапевтического средства, понадобятся кандидаты для доклинических и клинических исследований. Можно ли использовать лугдунин и сопутствующие препараты в будущем, ученые хотят выяснить, в частности, в рамках продолжающегося с начала 2019года в Тюбингенском университете исследования.
Источник: https://www.univadis.ru
Опубликовано: WILEY, Synthetic Lugdunin Analogues Reveal Essential Structural Motifs for Antimicrobial Action and Proton Translocation Capability
Немецкие ученые обнаружили новое оружие для борьбы с больничным монстром — мультирезистентным золотистым стафилококком. Долгие годы оно скрывалось не в вечной мерзлоте или Марианской впадине, а прямо под нашим носом. Вернее — в нём.
В последние годы во всем мире увеличилось количество инфекционных заболеваний, вызванных устойчивыми к антибиотикам бактериями. Организмы с множественной лекарственной резистентностью (multidrug-resistant organisms, MDRO), такие как метициллин-резистентный золотистый стафилококк, нечувствительные к ванкомицину энтерококки или резистентные к цефалоспоринам третьего поколения грамотрицательные бактерии, в ближайшие десятилетия могут стать более частыми причинами смерти, чем рак [1].
Доступные населению антибиотики теряют эффективность, а их частое и необоснованное применение приводит к отбору устойчивых форм бактерий внутри организмов людей и животных. MDRO в человеческом микробиоме трудно выявить, ведь обычно их носительство бессимптомно. Однако в стрессовых условиях (после хирургических операций, при травмах или иммуносупрессии) оно может перерасти в агрессивную инфекцию, побороть которую будет крайне сложно. А если еще учесть и частую устойчивость подобных бактерий к классическим дезинфектантам, становится понятным, почему MDRO считают настоящим бичом стационаров и роддомов. Они — куда более осязаемая угроза для населения всех континентов, чем тот же вирус Эбола, поэтому огромные усилия сейчас направляются на поиск и производство новых антибиотиков, способных «взломать» защитные системы MDRO.
Несколько лет назад удалось обнаружить, что представители человеческой микробиоты способны производить бактериоцины, поражающие близкородственных бактерий [2]. Например, в 2014 году из человеческого комменсала Lactobacillus gasseri выделили и описали новый синтезируемый рибосомами тиопептидный антибиотик — лактоциллин [3].
О пептидных антибиотиках «биомолекула» подробно рассказывала ранее: «Антимикробные пептиды — возможная альтернатива традиционным антибиотикам» [4].
Может показаться странным, что человеческая микробиота производит антибиотики, ведь индустрия поиска противомикробных веществ всегда была сосредоточена на почвенных бактериях: считалось, что именно там бурлит жизнь и активно идет борьба за существование. Однако в микробиоме человека насчитывается более тысячи видов бактерий, конкурирующих за место и питательные вещества. Это способствует появлению настоящего «оружия массового поражения» — бактериоцинов, производимых с помощью ферментов двух типов — поликетидсинтаз и нерибосомных пептидсинтетаз [5].
Семейные разборки
Немецкий исследователь Александр Ципперер со своими сотрудниками в июле 2016 года сообщил о том, что обнаружил в человеческом носу бактерию Staphylococcus lugdunensis IVK28, которая подавляет рост метициллин-резистентного золотистого стафилококка (methicillin-resistant Staphylococcus aureus, MRSA) [1].
Штамм S. lugdunensis IVK28 эффективно боролся со своим вредоносным родственником лишь в условиях недостатка железа и только на твердых агаризованных средах (рис. 3, слева). Механизм противостояния был неясен, а потому Ципперер провел транспозонный мутагенез клеток выделенного штамма — чтобы выявить ген, ответственный за синтез смертельного для S. aureus вещества.
Рисунок 3. Антибактериальная активность S. lugdunensis против метициллин-резистентного S. aureus. Слева — дикий штамм IVK28 образует зону лизиса на культуре S. aureus. В центре — штамм IVK28ΔlugD (с «выключенным» встраиванием транспозона геном lugD) не оказывает влияния на золотистого стафилококка. Справа — штамм с восстановленной активностью гена lugD снова лизирует клетки конкурента.
В итоге удалось получить мутанта IVK28, который не мог подавлять рост MRSA. Анализ места встройки транспозона показал, что тот нарушил структуру гена предполагаемой нерибосомной пептидсинтетазы (НРПС). Оказалось, что этот ген вместе с другими последовательностями, связанными с биосинтезом антибиотиков, входит в состав оперона размером 30 т.п.н. Это указывало на то, что предполагаемая молекула ингибитора может быть комплексом нерибосомных пептидов.
Оперон методом ПЦР обнаружили во всех культурах S. lugdunensis, а значит, он характерен для всего вида, а не только для штамма IVK28. Однако GC-состав оперона (26,9%) отличался от GC-состава остального генома S. lugdunensis (33,8%), что свидетельствовало о возможном заимствовании этого полезного генетического кластера у других видов бактерий — путем горизонтального переноса .
Разношерстные участники и пикантные подробности бактериального горизонтального генетического переноса описаны в статье «Мобильные генетические элементы прокариот: стратификация „общества“ бродяжек и домоседов» [11].
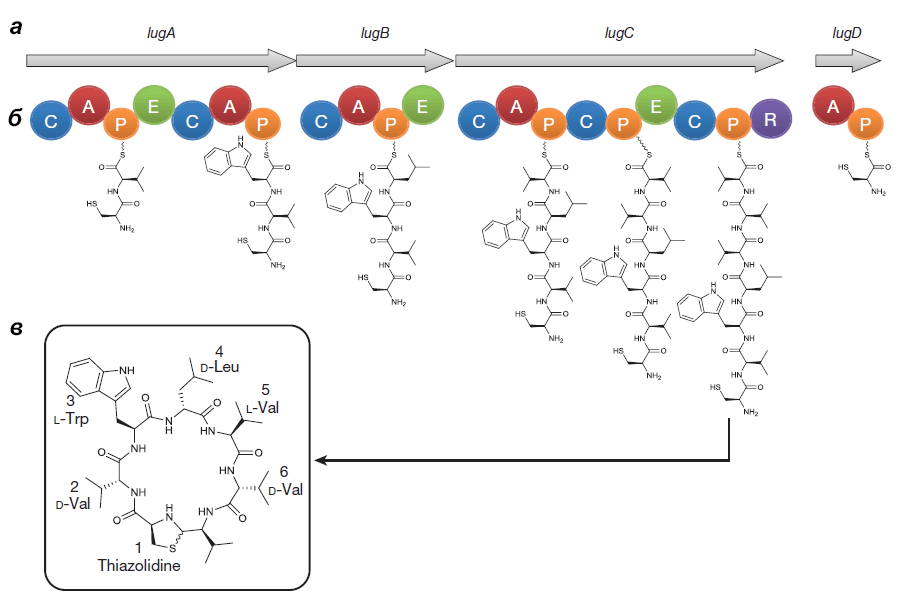
Оперон состоит из генов lugA, B, C и D, кодирующих пептидсинтетазные белки (см. врезку ниже), а также из других генов, чьи продукты необходимы для синтеза и транспорта нерибосомного пептида.
Чтобы окончательно вменить оперону участие в антибактериальной деятельности S. lugdunensis, наименьший ген (lugD) удалили. Мутант ΔlugD, как и ожидалось, не мог подавлять рост золотистого стафилококка, но когда в него ввели плазмиду с работающим геном lugD, агрессивный фенотип восстановился (рис. 3, в центре и справа).
Секретное оружие
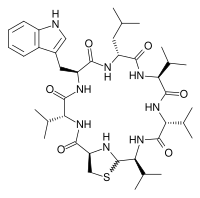
Выделенный Ципперером продукт lug-оперона оказался нерибосомным циклическим пептидом, состоящим из пяти аминокислот (двух D-валинов, L-валина, D-лейцина и L-триптофана) и тиазолидинового гетероцикла (рис. 4). Назвали антибиотик лугдунином.
Рисунок 4. Кластер генов, биосинтетический путь и химическая структура лугдунина. а — Гены «субъединиц» (не модулей!) нерибосомной пептидсинтетазы S. lugdunensis: lugA, B, C и D. б — Функциональные домены продуктов оперона: А — аденилирующий, Р — пептидильный, С — конденсирующий, Е — эпимеризующий, R — редуктазный. Их специфические комбинации составляют модули — обособленные каталитические единицы фермента. Биосинтез лугдунина начинается, видимо, в инициирующем модуле LugD и продолжается последовательно с помощью LugA-C. в — Структурная формула лугдунина.
Химическим синтезом удалось получить продукт с идентичными природному лугдунину химическими свойствами и антибактериальным эффектом. Ученые предположили, что этот антибиотик ингибирует синтез бактериальных биополимеров — белков, ДНК и пептидогликанов [5].
В экспериментах немецких ученых лугдунин действовал не только на метициллин-резистентных стафилококков, но и на гликопротеин-резистентных, и даже на других грамположительных бактерий типа листерии и ванкомицин-резистентного энтерококка (табл. 1). Минимальная ингибирующая концентрация (МИК) нового бактериоцина — 1,5–12 мкг × мл−1, что говорит о высокой активности вещества. При этом такие концентрации никак не влияли на человеческую сыворотку, не вызывали лизис нейтрофилов или эритроцитов и не ингибировали метаболическую активность моноцитов. Бактериальные же клетки под действием лугдунина в концентрации даже ниже МИК прекращали синтезировать ДНК, РНК, белки и компоненты клеточной стенки. В этом отношении лугдунин напоминает даптомицин, дающий такой же эффект, но способ действия которого пока не изучен. Не было отмечено возникновения резистентности клеток S. aureus к лугдунину даже после их месячного выращивания на малых концентрациях.
| Виды и штаммы | Резистентность | МИК лугдунина (мкг × мл−1) |
|---|---|---|
| Staphylococcus aureus USA300 (LAC) | MRSA | 1,5 |
| + 50% человеческой сыворотки крови | 1,5 | |
| Staphylococcus aureus USA300 (NRS384) | MRSA | 1,5 |
| Staphylococcus aureus Mu50 | GISA | 3 |
| Staphylococcus aureus SA113 | 3 | |
| Staphylococcus aureus RN4220 | 3 | |
| Enterococcus faecium BK463 | VRE | 3 |
| Enterococcus faecalis VRE366 | VRE | 12 |
| Listeria monocytogenes ATCC19118 | 6 | |
| Streptococcus pneumoniae ATCC49619 | 1,5 | |
| Bacillus subtilis 168 (trpC2) | 4 | |
| Pseudomonas aeruginosa PAO1 | >50 | |
| Escherichia coli DH5α | >50 | |
| Условные обозначения: MRSA — метициллин-резистентные S. aureus; GISA — устойчивые к гликопротеинам S. aureus; VRE — ванкомицин-резистентные Enterococcus. Таблица из [1]. |
Испытания в боевых условиях
Как и полагается, способность лугдунина лечить стафилококковые инфекции продемонстрировали in vivo на мышиной модели (рис. 5). У шести мышей сбрили шерсть на спине и, повредив кожу многократным приклеиванием/отклеиванием пластыря, нанесли на это место золотистого стафилококка. Затем кожу обработали мазью, содержащей 1,5 мкг лугдунина, и спустя шесть часов оценили результат. Обработка новым антибиотиком сильно сокращала или даже полностью уничтожала популяцию S. aureus. Причем не только на поверхности кожи, но и в более глубоких ее слоях.
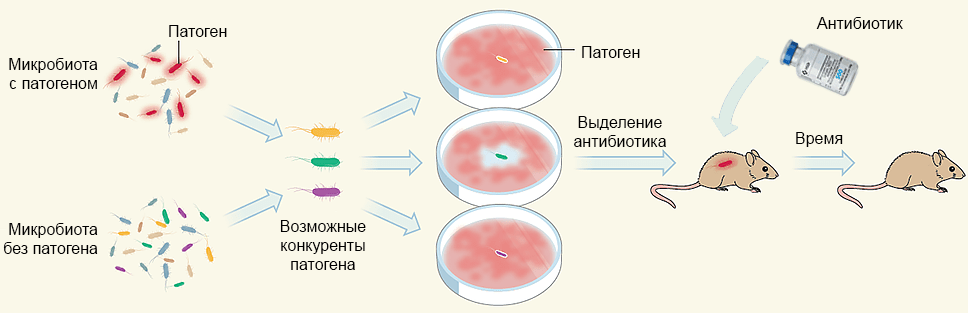
Рисунок 5. Общая схема подхода к идентификации природного антибиотика. Из бактериальных популяций человеческого тела отбирают представителей, которые не могут сосуществовать с интересующими патогенными бактериями. Этих возможных конкурентов тестируют по отдельности на средах с инфекционным агентом. Из культуры, успешно подавляющей рост патогенов, выделяют антибиотик, действие которого проверяют на животных моделях.
[5], рисунок модифицирован и адаптирован
Чтобы понять, может ли S. lugdunensis помешать колонизации носовой полости позвоночных животных золотистым стафилококком в естественных условиях, ученые провели следующий эксперимент. В носы хлопковых хомяков ввели два вида смешанных культур (S. aureus + S. lugdunensis IVK28 и S. aureus + S. lugdunensis IVK28ΔlugD) и каждую по отдельности. В контрольных случаях, когда вводили по одному штамму, все три культуры стабильно колонизировали носовую полость. Однако при введении смеси S. aureus + S. lugdunensis IVK28 количество золотистого стафилококка через 5 дней значительно уменьшилось по сравнению со смесью S. aureus + S. lugdunensis IVK28ΔlugD. Этот эксперимент показал, что продукция лугдунина позволяет штамму IVK28 эффективно конкурировать с золотистым стафилококком in vivo.
Оставалось разобраться, предотвращает ли присутствие S. lugdunensis в носу человека колонизацию бактериями S. aureus. Ципперер и его коллеги исследовали мазки из носовых ходов 187 госпитализированных больных. Из них у 60 человек (32,1%) обнаружили золотистого стафилококка и у 17 человек (9,1%) — S. lugdunensis. И только у одного пациента с S. lugdunensis в носу обитал S. aureus. У всех выделенных штаммов S. lugdunensis ПЦР-анализ продемонстрировал наличие lug-оперона, а все обнаруженные штаммы S. aureus оказались восприимчивы к лугдунину.
Перспективы
Из-за высокой эффективности лугдунина авторы обсуждаемой работы предлагают использовать S. lugdunensis в борьбе с золотистым стафилококком, особенно у пациентов с высокими рисками развития инфекции — после операций, иммуносупрессии или гемодиализа. Ранее пробиотическими, как правило, называли бактерий, активно действующих на благо макроорганизма в желудочно-кишечном тракте. Группа Ципперера выступает за расширение понятия «пробиотики» — включение туда бактерий, борющихся с инфекциями и в других местах человеческого тела, таких как носовая полость или кожа.
В очень редких случаях и сам S. lugdunensis может вызывать заболевания, но если удастся создать мутантов, полностью утративших факторы вирулентности, или встроить lug-оперон в абсолютно «мирные» бактерии, можно разработать безопасный пробиотический препарат.
Лугдунин оказался первым обнаруженным бактериоцином нового класса — макроциклических тиазолидиновых пептидных антибиотиков. Все проверенные штаммы S. aureus (как природные, так и лабораторные) не смогли выработать резистентности к нему. Это дает надежду на то, что лугдунин в будущем станет коммерческим препаратом для борьбы с золотистым стафилококком.
И наконец, сам факт обнаружения нового антибиотика у представителя человеческой микробиоты должен послужить стимулом для активизации поиска других продуцентов бактериоцинов в составе именно таких сообществ. В дальнейшем это поможет медикам успешнее сдерживать наступление мультирезистентных патогенов.
- Zipperer A., Konnerth M.C., Laux C., Berscheid A., Janek D., Weidenmaier C. et al. (2016). Human commensals producing a novel antibiotic impair pathogen colonization. Nature. 535, 511–516;
- Dobson A., Cotter P.D., Ross R.P., Hill C. (2012). Bacteriocin production: a probiotic trait? Appl. Environ. Microbiol. 78, 1–6;
- Donia M.S., Cimermancic P., Schulze C.J., Wieland Brown L.C., Martin J., Mitreva M. et al. (2014). A systematic analysis of biosynthetic gene clusters in the human microbiome reveals a common family of antibiotics. Cell. 158, 1402–1414;
- Антимикробные пептиды — возможная альтернатива традиционным антибиотикам;
- Lewis K. and Strandwitz P. (2016). Antibiotics right under our nose. Nature. 535, 501–502;
- Википедия: «Золотистый стафилококк»;
- Карпов И.А. и Качанко Е.Ф. (2005). Стафилококковая инфекция: клинические аспекты и перспективы терапии. Медицинские новости. 9, 53–56;
- Mandal A. (2012). What is Staphylococcus aureus? News-Medical.net;
- Naber C.K. (2009). Staphylococcus aureus bacteremia: epidemiology, pathophysiology, and management strategies. Clin. Infect. Dis. 48, S231–S237;
- Стафилококк золотистый (Staphylococcus aureus). ГастроСкан;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Википедия: «Нерибосомные пептиды»;
- Caboche S., Pupin M., Leclère V., Fontaine A., Jacques P., Kucherov G. (2008). NORINE: a database of nonribosomal peptides. Nucleic Acids Res. 36, D326–D331;
- Mironovskiĭ M.L., Ostash B.E., Fedorenko V.A. (2010). Diversity of genes encoding nonribosomal peptide synthetases in the Streptomyces sioyaensis genome. Genetika. 46, 896–903.
| Staphylococcus lugdunensis | |
|---|---|
| Научная классификация | |
| Царство: | Бактерии |
| Тип: | Фирмикуты |
| Класс: | Bacilli |
| Порядок: | Bacillales |
| Семейство: | Staphylococcaceae |
| Род: | Staphylococcus |
| Виды: | S. lugdunensis |
| Биномиальное название | |
| Staphylococcus lugdunensis . Freney et al. 1988 |
Staphylococcus lugdunensis является коагулазонегативным членом рода Staphylococcus, состоящим из грамположительных бактерий со сферическими клетками, которые появляются в кластеры.
Содержание
- 1 История
- 2 Описание
- 3 Острый послеоперационный эндофтальмит
- 4 Клинические особенности
- 5 См. также
- 6 Ссылки
- 7 Дополнительная литература
- 8 Внешние ссылки
История
Впервые он был описан в 1988 году после того, как был дифференцирован с помощью анализа ДНК. Его название происходит от Lugdunum, латинского названия Lyon, Франция, где этот организм был впервые изолирован.
Описание
Колонии S. lugdunensis обычно гемолитические, липкие. желтого или коричневого цвета и около 2–4 мм в диаметре после 48-часовой инкубации. Также они могут иметь характерный сладкий запах сена. S. lugdunensis может продуцировать связанную коагулазу (то есть фермент связывается с клетками), свойство, которое он разделяет с S. aureus, но в отличие от S. aureus, он не производят свободную коагулазу. В лаборатории он может дать положительный тест на слайд-коагулазу, но отрицательный тест на коагулазу в пробирке. Его довольно легко идентифицировать, потому что, в отличие от подавляющего большинства стафилококков, он декарбоксилат орнитин и положителен на пирролидонилариламидазу.
В прошлом его часто ошибочно определяли как S. hominis, S. aureus или другие виды. Он встречается как комменсал на коже человека, но был зарегистрирован как причина серьезных человеческих инфекций, таких как остеомиелит, артрит, сепсис, раневые инфекции и агрессивный эндокардит.
S. lugdunensis, как правило, очень восприимчив к антистафилококковым антибиотикам, но сообщается об увеличении устойчивости к пенициллину.
Острый послеоперационный эндофтальмит
Острый послеоперационный эндофтальмит, вызванный S. lugdunensis, редко встречается в клинических исследованиях. Пять случаев острого посткатарактального хирургического эндофтальмита были взяты из многоцентрового проспективного исследования, проведенного в четырех университетских больницах во Франции (с 2004 по 2005 год). Эти случаи характеризовались тяжелым воспалением глаз, которое происходило со средней задержкой в 7,6 дней после операции по удалению катаракты, тяжелой потерей зрения (движения рук или меньше в трех случаях) и плотной инфильтрацией стекловидного тела. Первоначально каждый из этих пациентов лечился по стандартному протоколу с использованием интравитреального (ванкомицин и цефтазидим), системного и местного антибиотиков. Учитывая тяжесть эндофтальмита, хотя бактерии были чувствительны к интравитреальным антибиотикам, в четырех случаях потребовалась витрэктомия pars plana. Окончательный прогноз зрения осложнился тяжелой отслойкой сетчатки в трех случаях. Микробиологический диагноз был поставлен с помощью обычных культур со специфическими биохимическими тестами и эубактериальной ПЦР-амплификации с последующим прямым секвенированием.
Клинические особенности
С. lugdunensis был связан с широким спектром инфекций, включая сердечно-сосудистые инфекции (тяжелый эндокардит нативного и протезного клапана, миокардит и инфицированную миксому), эмпиему, остеомиелит и инфекции протезных / нативных суставов, инфекции кожи и мягких тканей (фурункулы, целлюлит, и абсцессы), инфекции центральной нервной системы, перитонит, эндоцефалит и инфекции мочевыводящих путей.
См. Также
- Лугдунин
Ссылки
Дополнительная литература
- Crompton, Marcus J.; Данстан, Р. Хью; Макдональд, Маргарет М.; Готфрис, Йохан; фон Эйфф, Кристоф; Робертс, Тимоти К.; Чжоу, Дуншэн (8 апреля 2014 г.). «Небольшие изменения в параметрах окружающей среды приводят к изменениям устойчивости к антибиотикам, морфологии клеток и состава мембранных жирных кислот у Staphylococcus lugdunensis». PLOS ONE. 9 (4): e92296. doi : 10.1371 / journal.pone.0092296. PMC 3979647. PMID 24714666.
- Missineo, A.; Ди Пото, А.; Geoghegan, J. A.; Rindi, S.; Heilbronner, S.; Gianotti, V.; Arciola, C. R.; Фостер, Т. Дж.; Speziale, P.; Пьетрокола, Г. (июнь 2014 г.). «IsdC из Staphylococcus lugdunensis вызывает образование биопленок в условиях роста с низким содержанием железа». Инфекция и иммунитет. 82 (6): 2448–2459. DOI : 10.1128 / IAI.01542-14. PMC 4019187. PMID 24686057.
Внешние ссылки
- Типовой штамм Staphylococcus lugdunensis в BacDive — база метаданных по бактериальному разнообразию
Состав
В одной таблетке п/о для перорального приема содержится 0.25, 0.5 или 0.875 г амоксициллина тригидрата и 0.125 г клавулановой кислоты (при производстве лекарства клавуланат натрия закладывается с 5%-м избытком). Входящие в состав таблеток вспомогательные компоненты: Silicii dioxydum colloidale, Magnesium stearate, Carboxymethylamylum natricum, Cellulosum microcrystallicum.
Один флакон порошка для приготовления раствора для инъекций содержит 0,5 или 1 г амоксициллина тригидрата и 0.1 или 0.2 г клавулановой кислоты.
В состав порошка Аугментин для приготовления суспензии для перорального приема входят 0.125/0.2/0.4 г (5 мл) тригидрата амоксициллина и 0.03125/0.0285/0.057 г (5 мл) клавулановой кислоты. Вспомогательные компоненты: Xanthan gum, Hydroxypropyl methylcellulose, Silicii dioxydum colloidale, Acidum succinicum, Silicii dioxydum, Aspartamum (Е951), ароматизаторы сухие — апельсиновые (610271Е и 9/027108), малиновый и “светлая патока”.
В порошке Аугментин ЕС, предназначенном для приготовления 100 мл суспензии, содержится 0.6 г (5 мл) тригидрата амоксициллина и 0.0429 г (5 мл) клавулановой кислоты. Вспомогательные компоненты: Silicii dioxydum colloidale, Carboxymethylamylum natricum), Aspartamum (Е951), Хanthan gum, Silicii dioxydum, клубничный ароматизатор 544428.
В состав одной таблетки Аугментин СР с пролонгированным действием входят 1 г тригидрата амоксициллина и 0.0625 г клавулановой кислоты. Вспомогательные компоненты: Cellulosum microcrystallicum, Carboxymethylamylum natricum, Silicii dioxydum colloidale, Magnesium stearate, Xanthan gum, Аcidum citrinosum, Hypromellosum 6cps, Hypromellosum 15cps, Тitanium dioxide (Е171), Macrogolum 3350, Macrogolum 8000.
Форма выпуска
Препарат имеет следующие формы выпуска:
- Таблетки Аугментин 250 мг + 125 мг, Аугментин 500 мг + 125 мг и Аугментин 875 + 125 мг.
- Порошок 500/100 мг и 1000/200 мг, предназначенный для приготовления раствора для инъекций.
- Порошок для приготовления суспензии Аугментин 400 мг/57 мг, 200 мг/28,5 мг, 125 мг/31,25 мг.
- Порошок Аугментин ЕС 600 мг/42,9 мг (5 мл) для приготовления суспензии.
- Покрытые п/о таблетки с пролонгированным высвобождением Аугментин СР 1000 мг/62,5 мг.
Фармакологическое действие
Аугментин принадлежит к фармакотерапевтической группе антимикробных лекарственных препаратов для системного применения — пенициллинов.
Фармакологическое действие препарата — антибактериальное и бактерицидное.
Фармакодинамика и фармакокинетика
В соответствии с Википедией, амоксициллин — это бактерицидное средство, действенное в отношении широкого спектра патогенных и потенциально патогенных микроорганизмов и представляющее собой полусинтетический антибиотик группы пенициллина.
Подавляя транспептидазу и нарушая процессы выработки муреина (важнейшего компонента стенок бактериальной клетки) в период деления и роста, он провоцирует тем самым лизис (разрушение) бактерий.
Амоксициллин разрушается β-лактамазами, поэтому его антибактериальная активность не распространяется на микроорганизмы, вырабатывающие β-лактамазы.
Действуя как конкурентный и в большинстве случаев необратимый ингибитор, клавулановая кислота характеризуется способностью проникать сквозь стенки клеток бактерий и вызывать инактивацию ферментов, которые находятся как внутри клетки, так и на ее границе.
Клавуланат образовывает устойчивые инактивированные комплексы с β-лактамазами, а это в свою очередь предупреждает разрушение амоксициллина.
Антибиотик Аугментин эффективен в отношении:
- Грам(+) аэробов: пиогенных стрептококков группы А и В, пневмококков, золотистого и эпидермального стафилококка, (за исключением резистентных к метициллину штаммов), сапрофитного стафилококка и др.
- Грам(-) аэробов: палочки Пфайфера, коклюшной палочки, гарднереллы вагиналис , холерного вибриона и т.д.
- Грам(+) и грам(-) анаэробов: бактероидов, фузобактерий, превотеллы и т.д.
- Прочих микроорганизмов: хламидий, спирохет, бледной трепонемы и т.д.
После приема внутрь Аугментина оба входящих в его состав активных компонента быстро и полностью всасываются из пищеварительного тракта. Абсорбция оптимальна, если таблетки или сироп выпить во время приема пищи (в начале еды).
Как при приеме внутрь, так и при введении раствора Аугментин в/в, терапевтические концентрации активных компонентов препарата обнаруживаются во всех тканях и интерстициальной жидкости.
Оба активных компонента слабо связываются с плазменными белками крови (с плазменными белками связывается до 25% тригидрата амоксициллина и не более 18% клавулановой кислоты). Кумуляции Аугментина в каком-либо из внутренних органов не было обнаружено.
Амоксициллин подвергается активной метаболизации в организме и экскретируется почками, через пищеварительный тракт и в виде двуокиси углерода вместе с выдыхаемым воздухом. От 10 до 25% полученной дозы амоксициллина экскретируется почками в виде пенициллоевой кислоты, которая является его неактивным метаболитом.
Клавуланат экскретируется как почками, так и посредством внепочечного механизмов.
Показания к применению
Показаниями к применению комбинации тригидрата амоксициллина и клавулановой кислоты являются инфекции, спровоцированные чувствительными к действию этих веществ микроорганизмами.
Также допускается лечение Аугментином инфекций, причиной которых является активность микроорганизмов, чувствительных к действию амоксициллина, а также смешанных инфекций, спровоцированных чувствительными к амоксициллину бактериями и бактериями, которые вырабатывают β-лактамазу и характеризуются чувствительностью к комбинации активных веществ препарата.
В сети Интернет нередки вопросы “от чего таблетки Аугментин? ” или “от чего лечит сироп Аугментин?”. Область применения препарата довольно обширна. Его назначают при следующих инфекционно-воспалительных заболеваниях:
- при инфекциях, поражающих верхние и нижние отделы дыхательных путей (включая в том числе и ЛОР-инфекции);
- при инфекциях, поражающих мочеполовой тракт;
- при одонтогенных (поражающих полость рта) инфекциях;
- при гинекологических инфекциях;
- при гонорее;
- при инфекциях, поражающих кожу и мягкие ткани;
- при инфекциях, поражающих костную ткань (в том числе при необходимости назначения пациенту длительной терапии);
- при прочих инфекциях смешанного типа (например, после септического аборта, при сепсисе в послеродовом периоде, при септицемии (сепсисе без метастазов), перитоните; при сепсисе, вызванном интраабдоминальной инфекцией; при инфекциях, развивающихся после хирургического вмешательства).
Аугментин нередко применяется в профилактических целях перед проведением обширных хирургических операций на голове, шее, ЖКТ, почках, желчевыводящих путях, на органах, расположенных в полости таза, а также при проведении процедуры имплантации внутренних органов.
Противопоказания
Аугментин во всех лекарственных формах противопоказан:
- пациентам с гиперчувствительностью к одному или обоим активным компонентам препарата, к какому-либо из входящих в его состав вспомогательных веществ, а также к β-лактамам (то есть к антибиотикам из групп Пенициллина и цефалоспорина);
- пациентам, у которых терапии Аугментином предшествовали эпизоды желтухи или в анамнезе отмечались функциональные нарушения печени вследствие применения комбинации активных веществ препарата.
Дополнительным противопоказанием к назначению порошка для приготовления оральной суспензии с дозировкой активных веществ 125 + 31,25 мг является ФКУ (фенилкетонурия).
Порошок, используемый для приготовления оральной суспензии с дозировкой активных веществ (200 + 28,5) и (400 + 57) мг противопоказан:
- при ФКУ;
- пациентам с нарушенной функцией почек, при которой показатели пробы Реберга ниже 30 мл в минуту;
- детям, не достигшим трехмесячного возраста.
Дополнительным противопоказанием к применению таблеток с дозировкой активных веществ (250 + 125) и (500 + 125) мг является возраст моложе 12-ти лет и/или вес менее 40-ка килограмм.
Таблетки с дозировкой активных веществ 875 + 125 мг противопоказаны:
- при нарушении функциональной активности почек (показатели пробы Реберга ниже 30 мл в минуту);
- детям, не достигшим 12-летнего возраста;
- пациентам, масса тела которых не превышает 40 кг.
Побочные действия
Побочные действия Аугментина могут возникать со стороны различных систем и отдельных органов. Наиболее часто на фоне лечения препаратом могут отмечаться следующие реакции:
- кандидоз (молочница) кожных покровов и слизистых;
- диарея (очень часто — при приеме Аугментина в таблетках, часто — при приеме суспензии или введении препарата в инъекционной форме);
- приступы тошноты и рвота (тошнота чаще всего возникает при приеме препарата в повышенных дозах).
К нечасто возникающим побочным явлениям относятся:
- головокружения;
- головные боли;
- нарушения функции пищеварения;
- умеренно выраженное повышение активности печеночных ферментов аланинтрансаминазы (АЛТ) и аспартаттрансаминазы (АСТ);
- высыпания на коже, кожный зуд, проявления крапивницы.
В редких случаях организм может отреагировать на прием Аугментина:
- развитием обратимой лейкопении (включая в том числе агранулоцитоз);
- тромбоцитопенией;
- развитием тромбофлебита в месте введения раствора для инъекций;
- полиморфной эритемой.
Очень редко могут развиваться:
- гемолитическая анемия;
- состояния, характеризующиеся увеличением длительности кровотечений и повышением протромбинового индекса;
- реакции со стороны иммунной системы, которые выражаются в виде ангионевротического отека, синдрома, аналогичного проявляющемуся при сывороточной болезни, анафилаксии, аллергического васкулита;
- гиперактивности обратимого типа;
- повышения судорожной активности;
- колит, обусловленный приемом антибиотиков, включая в том числе псевдомембранозный (ПМК) и геморрагический (вероятность развития последнего снижается, если вводить Аугментин парентерально);
- ороговение и разрастание расположенных на языке нитевидных сосочков (заболевание, известное под названием “черный “волосатый” язык”);
- гепатит и внутрипеченочный холестаз;
- синдром Лайела;
- генерализованный экзантематозный пустуллез в острой форме;
- интерстициальный нефрит;
- появление в моче кристаллов солей (кристаллурия).
В случае появления любого дерматита аллергической природы лечение Аугментином следует прекратить.
Инструкция по применению Аугментина. Способ применения и дозировка взрослым пациентам и детям
Один из наиболее часто возникающих у пациента вопросов это вопрос о том как принимать — до еды или после нее — то или иное лекарственное средство. В случае с Аугментином прием препарата тесно связан с приемом пищи. Оптимальным считается принимать лекарство непосредственно перед едой.
Во-первых, это обеспечивает лучшее всасывание активных веществ их ЖКТ, а, во-вторых, позволяет существенно уменьшить выраженность диспептических нарушений со стороны ЖКТ, если последние имеют место.
Как рассчитать дозу Аугментина
Как принимать взрослым и детям препарат Аугментин, а также его терапевтическую дозу определяют в зависимости от того, какой микроорганизм является возбудителем, насколько он чувствителен к воздействию антибиотика, степени тяжести и особенностей течения заболевания, локализации инфекционного очага, возраста и веса пациента, а также того, насколько здоровы его почки пациента.
Продолжительность курса терапии зависит от того, как организм пациента реагирует на лечение.
Таблетки Аугментин, инструкция по применению
В зависимости от содержания в них активных веществ таблетки Аугментин взрослым пациентам рекомендуется принимать по следующей схеме:
- Аугментин 375 мг (250 мг + 125 мг) — по одной три раза в течение суток. В такой дозировке препарат показан при инфекциях, которые протекают в легкой или умеренно-тяжелой форме. При тяжело протекающих заболеваниях, включая хронические и рецидивирующие, назначаются более высокие дозы.
- Таблетки 625 мг (500 мг + 125 мг) — по одной три раза в течение суток.
- Таблетки 1000 мг (875 мг + 125 мг) — по одной два раза в течение суток.
Доза подлежит коррекции для пациентов с нарушениями функциональной активности почек.
Таблетки с пролонгированным высвобождением Аугментин СР 1000 мг/62,5 мг разрешены только для пациентов старше 16-ти лет. Оптимальная доза — две таблетки два раза в день.
Если пациент не может проглотить целую таблетку, ее делят надвое по линии разлома. Обе половинки принимают одновременно.
Пациентам с больными почками препарат назначают только в тех случаях, когда показатель пробы Реберга превышает 30 мл в минуту (то есть когда не требуется вносить корректировки в режим дозирования).
Порошок для приготовления раствора для инъекций, инструкция по применению
Согласно инструкции, раствор вводится в вену: струйным (всю дозу необходимо ввести за 3-4 минуты) или капельным способом (продолжительность инфузии — от получаса до 40 минут). Раствор не предназначен для введения в мышцу.
Стандартная доза для взрослого пациента — 1000 мг/200 мг. Вводить ее рекомендуется через каждые восемь часов, а при протекающих с осложнениями инфекциях — через каждые шесть или даже четыре часа (по показаниям).
Антибиотик в форме раствора 500 мг/100 мг или 1000 мг/200 мг назначают для профилактики развития инфекционного процесса после хирургического вмешательства. В тех случаях, когда продолжительность операции менее одного часа, достаточно разово ввести пациенту перед наркозом дозу Аугментина 1000 мг/200 мг.
Если предполагается, что операция будет длиться более часа, в предшествующие ей сутки на протяжении 24-х часов пациенту вводят до четырех доз 1000 мг/200 мг.
Суспензия Аугментин, инструкция по применению
Инструкция по применению Аугментина для детей рекомендует назначение суспензии 125 мг/31,25 мг в дозе равной от 2,5 до 20 мл. Кратность приемов — 3 в течение суток. Объем разовой дозы зависит от возраста и веса ребенка.
Если ребенок старше двухмесячного возраста, суспензия 200 мг/28,5 мг назначается в дозе, равной от 25/3,6 мг до 45/6,4 мг на 1 кг массы тела. Указанную дозу следует делить на два приема.
Суспензия с дозировкой активных веществ 400 мг/57 мг (Аугментин 2) показана к назначению, начиная с года. В зависимости от возраста и веса ребенка разовая доза варьируется от 5 до 10 мл. Кратность приемов — 2 в течение суток.
Аугментин ЕС назначают, начиная с 3-месячного возраста. Оптимальная доза — 90/6,4 мг на 1 кг массы тела в сутки (дозу следует делить на 2 приема, выдерживая между ними 12-часовой интервал).
На сегодняшний день препарат в разных лекарственных формах является одним из наиболее часто назначаемых средств для лечения ангины.
Детям Аугментин при ангине назначают в дозе, которую определяют исходя из массы тела и возраста ребенка. При ангине у взрослых рекомендуется применять Аугментин по 875 + 125 мг трижды в течение суток.
Также нередко к назначению Аугментина прибегают и при гайморите. Лечение дополняют промыванием носа морской солью и использованием назальных спреев типа Ринофлуимуцила. Оптимальная дозировка при гайморите: 875/125 мг 2 раза в день. Продолжительность курса обычно составляет 7 дней.
Передозировка
Превышение дозы Аугментина сопровождается:
- развитием нарушений со стороны пищеварительного тракта;
- нарушением водно-солевого баланса;
- кристаллурией;
- почечной недостаточностью;
- преципитацией (осаждением) амоксициллина в мочевом катетере.
При появлении подобных симптомов пациенту показана симптоматическая терапия, подразумевающая в том числе коррекцию нарушенного водно-солевого баланса. Выведению Аугментина из кровеносной системы способствует также процедура гемодиализа.
Взаимодействие
Одновременное назначение препарата с пробенецидом:
- способствует снижению канальцевой секреции амоксициллина;
- провоцирует повышение концентрации амоксициллина в плазме крови (эффект сохраняется в течение длительного времени);
- не оказывает влияния на свойства и уровень содержания в плазме крови клавулановой кислоты.
Сочетание амоксициллина с Аллопуринолом повышает вероятность развития проявлений аллергии. Данные о взаимодействии Аллопуринола одновременно с двумя активными компонентами Аугментина отсутствуют.
Аугментин оказывает влияние на содержащуюся в кишечном тракте микрофлору, что провоцирует снижение реабсорбции (обратного поглощения) эстрогенов, а также снижение эффективности применения комбинированных противозачаточных средств для перорального применения.
Препарат несовместим с препаратами крови и белоксодержащими жидкостями, включая в том числе гидролизаты сывороточных протеинов и жировыми эмульсиями, предназначенными для введения в вену.
Если Аугментин назначают одновременно с антибиотиками класса аминогликозидов, препараты перед введением не смешивают в одном шприце или какой-либо иной емкости, поскольку это приводит к инактивации аминогликозидов.
Условия продажи
По рецепту.
Условия хранения
Оригинально упакованный препарат хранят при температуре, не превышающей 25 °С. Суспензию следует хранить при температурном режиме 2-8 °С (оптимально — в холодильнике) не более 7-ми дней.
Срок годности
Годен к использованию в течение 2-х лет с даты изготовления.
Аналоги Аугментина
Совпадения по коду АТХ 4-го уровня:
Аналоги Аугментина — это препараты:
- Амоксиклав
- Флемоклав Солютаб
- Экоклав
- Кламосар
- Арлет
- Панклав
- Амоксиван
- Рапиклав
- Новаклав
- Фораклав
- Бетаклав
- Медоклав
- Ранклав
- Клавамокс
- Верклав
- Фибелл
- А-Клав-Фармекс
- Амоксил-К
- Клавамитин
- Тераклав
Каждый из вышеперечисленных препаратов — это то, чем можно заменить Аугментин при его отсутствии.
Аугментин для детей
Аугментин широко применяется в педиатрической практике. Благодаря тому, что он имеет детскую форму выпуска — сироп, его можно применять даже для лечения детей до года. Существенно облегчает прием и то, что лекарство имеет приятный вкус.
Детям антибиотик чаще всего назначают при ангине. Дозировка суспензии для детей определяется в зависимости от возраста и веса. Оптимальной считается разделенная на два приема доза, равная 45 мг/кг в сутки, или же разделенная на три приема доза, равная 40 мг/кг в сутки.
Как принимать детям препарат и кратность приемов зависит от назначенной лекарственной формы.
Детям, масса тела которых более 40-ка кг, Аугментин назначают в тех же дозах, что и взрослым пациентам.
Сироп Аугментин для детей до года применяют в дозировках 125 мг/31,25 мг и 200 мг/28,5 мг. Дозировка 400 мг/57 мг показана детям старше годовалого возраста.
Детям в возрастной категории 6-12 лет (при весе более 19 кг) допускается назначать как суспензию, так и Аугментин в таблетках. Режим дозирования таблетированной формы препарата следующий:
- одна таблетка 250 мг + 125 мг три раза в течение суток;
- одна таблетка 500 + 125 мг два раза в течение суток (эта лекарственная форма оптимальна).
Детям старше 12-летнего возраста назначают принимать по одной таблетке 875 мг + 125 мг дважды в течение суток.
Для того, чтобы правильно отмерить дозу суспензии Аугментин для детей не достигших 3-месячного возраста, сироп рекомендуется набирать шприцем с разметочной шкалой. Для облегчения применения суспензии у детей до двух лет допускается разводить сироп водой в соотношении 50/50
Аналоги Аугментина, которые являются его фармакологическими заменителями — это препараты:
- Амоксиклав
- Флемоклав Солютаб
- Арлет
- Рапиклав
- Экоклав
Совместимость с алкоголем
Аугментин и алкоголь теоретически не являются антагонистами, под воздействием этилового спирта антибиотик не изменяет своих фармакологических свойств.
Если на фоне лечения препаратом возникает необходимость употребления спиртных напитков, важно соблюдать два условия: умеренность и целесообразность.
Для людей, страдающих от алкогольной зависимости, одновременное употребление препарата с алкоголем может иметь более серьезные последствия.
Систематическое злоупотребление спиртным провоцирует различные нарушения в работе печени. Пациентам же с больной печенью инструкция рекомендует назначать Аугментин с особой осторожностью, поскольку предсказать, как поведет себя больной орган в попытках справиться с ксенобиотиком, крайне сложно.
Поэтому, чтобы избежать неоправданного риска, рекомендуется воздерживаться от употребления алкоголя в течение всего периода лечения препаратом.
Аугментин при беременности и лактации
Как и большинство антибиотиков пенициллиновой группы, амоксициллин, распределяясь в тканях организма, проникает также и в грудное молоко. Причем в молоке могут даже обнаруживаться следовые концентрации клавулановой кислоты.
Однако какого-либо клинически значимого негативного влияния на состояние ребенка при этом не отмечается. В отдельных случаях сочетание клавулановой кислоты с амоксициллином может спровоцировать у младенца диарею и/или кандидоз (молочницу) слизистых оболочек в ротовой полости.
Аугментин относится к категории разрешенных при грудном вскармливании препаратов. Если все же на фоне лечения матери Аугментином у ребенка развиваются те или иные нежелательные побочные эффекты, кормление грудью прекращают.
Проводившиеся на животных исследования показали, что активные вещества Аугментина способны проникать через гемато-плацентарный (ГПБ) барьер. Тем не менее, негативного влияния на развитие плода выявлено не было.
Причем тератогенные эффекты отсутствовали и при парентеральном, и при пероральном введении препарата.
Использование Аугментина у беременных женщин потенциально может привести к развитию у новорожденного младенца некротизирующего энтероколита (НЭК).
Как и все остальные лекарственные средства, Аугментин не рекомендуется назначать беременным женщинам. При беременности его применение допустимо лишь в тех случаях, когда по оценке врача польза для женщины превышает потенциальные риски для ее ребенка.
Отзывы об Аугментине
Отзывы о таблетках и суспензии для детей Аугментин в большинстве своем положительные. Многие оценивают препарат как эффективное и заслуживающее доверия средство.
На форумах, где люди делятся впечатлениями о тех или иных препаратах, средняя оценка антибиотика 4,3-4,5 из 5 баллов.
Оставленные мамами маленьких детей отзывы об Аугментине свидетельствуют о том, что средство помогает быстро справиться с такими частыми детскими болезнями как бронхит или ангина. Помимо эффективности препарата, мамы также отмечают его приятный вкус, который нравится детям.
Средство также эффективно при беременности. Несмотря на то, что инструкция не рекомендует лечить препаратом беременных женщин (особенно в 1-м триместре), Аугментин нередко назначают во 2 и 3-м триместрах.
По отзывам медиков, главное при лечении этим средством — соблюдать точность дозировки и следовать всем рекомендациям своего лечащего врача.
Цена Аугментина
Цена Аугментина в России: таблетки 500 мг/125 мг №14 — около 200 руб., таблетки 875 мг/125 мг №14 — около 350 руб., порошок для суспензии 200 мг + 28,5/5 мл 70 мл — около 150 руб., порошок для суспензии 400 мг + 57 мг/5 мл 12,6 г 70 мл — около 250 руб.
- Интернет-аптеки РоссииРоссия
Аптека Диалог
-
Аугментин порошок для суспензии 400мг+57мг/5мл 12,6г 70млSmith Kline Beecham
-
Аугментин (таб. п/о 500мг/125мг №14)Smith Kline Beecham
-
Аугментин ЕС порошок для суспензияензии 600мг+42,9мг/мл флаконакон 23,13гSmith Kline/Glaxo-Wellcome
-
Аугментин таблетки п/о 500мг/125мг №14)Smith Kline Beecham
-
Аугментин таблетки п/о 875мг/125мг №14)Smith Kline Beecham
показать еще
From Wikipedia, the free encyclopedia
|
|
| Names | |
|---|---|
| IUPAC name
(1R,4R,7S,10R,13S,16R,19S)-7-(1H-Indol-3-ylmethyl)-10-isobutyl-4,13,16,19-tetraisopropyl-21-thia-3,6,9,12,15,18,23-heptaazabicyclo[18.2.1]tricosane-2,5,8,11,14,17-hexone |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
|
PubChem CID |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
C40H62N8O6S |
| Molar mass | 783.05 g·mol−1 |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). Infobox references |
Lugdunin is an investigational antibiotic, classified as a thiazolidine-containing cyclic peptide. It was isolated in 2016 after Staphylococcus lugdunensis was identified as the species of bacteria from the human nose that suppressed growth of species of disease-causing bacteria in that part of the human microbiome.[1][2][3]
Lugdunin is a non-ribosomally synthesized cyclic peptide that inhibits growth of Staphylococcus aureus strains. The lugdunin genes are located on a 30-kbp operon. The genes lugA, lugB, lugC, and lugD encode four non-ribosomal peptide synthases, which are preceded by a putative regulator gene lugR.[4]
| Gene | locustag | protein size/aa | Genbank protein entry | RefSeq protein entry |
|---|---|---|---|---|
| lugR | SLUG_RS03935 | 196 | CCB53263.1 | WP_002460032.1 |
| lugA | SLUG_RS03940 | 2374 | CCB53264.1 | WP_002478842.1 |
| SLUG_RS03945 | 124 | CCB53265.1 | WP_002460029.1 | |
| lugB | SLUG_RS03950 | 1230 | CCB53266.1 | WP_014533237.1 |
| lugC | SLUG_RS03955 | 2937 | CCB53267.1 | WP_002478844.1 |
| lugT | SLUG_RS03960 | 228 | CCB53268.1 | WP_002460022.1 |
| lugD | SLUG_RS03965 | 579 | CCB53269.1 | WP_002478846.1 |
Biosynthesis[edit]
Lugdunin is synthesized by non ribosomal peptide synthetases in S. lugdunensis. The molecule is a cyclic peptide composed of a thiazolidine heterocycle and three D amino acids. The operon responsible for lugdunin synthesis is approximately 30 kb and contains four non ribosomal peptide synthetase genes. The operon contains a phosphopantetheinyl transferase, monooxygenase, an unknown tailoring enzyme, a regulator gene, and a type II thioesterase.[5] Phosphopantetheinyl transferases carry out the activation of T domains, which act as carrier proteins. Monooxygenases incorporate a single hydroxyl into a lugdunin intermediate. The type II thioesterase is utilized to remove intermediates that stall during biosynthesis.[citation needed]
A surprising note about lugdunin is that the operon only encodes five adenylation domains, an interestingly small amount for such a large molecule. This discrepancy is accounted for by the addition of three consecutive valine residues in alternating D and L configurations by LugC. The thiazolidine ring forms following the release of the metabolite via reduction. The N-terminal L-Cysteine residue nucleophilically attacks the carbonyl[6] on the C-terminal L-valine residue, thus forming an imine macrocycle. The Schiff base formed in this reaction is then nucleophilically attacked by a cysteine thiol which produces the thiazolidine heterocycle previously described.[citation needed]
References[edit]
- ^ Gallagher, James (2016-07-27). «Antibiotic resistance: ‘Snot wars’ study heralds new class of drugs». BBC News. Retrieved 2016-07-27.
- ^ Zipperer, Alexander; Konnerth, Martin C.; Laux, Claudia; Berscheid, Anne; Janek, Daniela; Weidenmaier, Christopher; Burian, Marc; Schilling, Nadine A.; Slavetinsky, Christoph (2016). «Human commensals producing a novel antibiotic impair pathogen colonization». Nature. 535 (7613): 511–516. Bibcode:2016Natur.535..511Z. doi:10.1038/nature18634. PMID 27466123. S2CID 205249755.
- ^ «Scientists find microbiotic treasure hidden in the nose». Los Angeles Times. 2016-07-27. Retrieved 2016-07-27.
- ^ Krismer, Bernhard; Peschel, Andreas; Grond, Stephanie; Brötz-Oesterhelt, Heike; Schittek, Birgit; Kalbacher, Hubert; Willmann, Matthias; Marschal, Matthias; Slavetinsky, Christoph; Schilling, Nadine A.; Burian, Marc; Weidenmaier, Christopher; Janek, Daniela; Berscheid, Anne; Laux, Claudia; Konnerth, Martin C.; Zipperer, Alexander (July 2016). «Extended Data Figure 1: Gene cluster of lugdunin and generation of S. lugdunensis IVK28-Xyl». Nature. 535 (7613): 511–516. Bibcode:2016Natur.535..511Z. doi:10.1038/nature18634. PMID 27466123. S2CID 205249755.
- ^ Krauss, Sophia; Zipperer, Alexander; Wirtz, Sebastian; Saur, Julian; Konnerth, Martin C.; Heilbronner, Simon; Torres Salazar, Benjamin O.; Grond, Stephanie; Krismer, Bernhard; Peschel, Andreas (2020-12-16). «Secretion of and Self-Resistance to the Novel Fibupeptide Antimicrobial Lugdunin by Distinct ABC Transporters in Staphylococcus lugdunensis». Antimicrobial Agents and Chemotherapy. 65 (1): e01734–20. doi:10.1128/AAC.01734-20. ISSN 0066-4804. PMC 7927808. PMID 33106269.
- ^ «Lugdunin — an overview | ScienceDirect Topics». www.sciencedirect.com. Retrieved 2022-06-04.
External links[edit]
- «Press release: A potential lifesaver lies unrecognized in the human body» (PDF). www.uni-tuebingen.de. University of Tübingen. Retrieved 2016-07-28.