Лукстурна — инструкция по применению
Синонимы, аналоги
Статьи
Листок-вкладыш – информация для пациента
Регистрационный номер:
ЛП-№(000712)-(РГ-RU)
5×1012 векторных геномов/мл, концентрат и растворитель для приготовления раствора для субретинального введения
Действующее вещество: воретиген непарвовек
▼ Лекарственный препарат подлежит дополнительному мониторингу, который способствует быстрому выявлению новых сведений по безопасности. Вы можете помочь, сообщая информацию о любых нежелательных реакциях, которые возникли в период применения лекарственного препарата (в том числе и о случаях его неэффективности). Способ сообщения о нежелательных реакциях описан в разделе 4 листка-вкладыша.
Перед применением препарата полностью прочитайте листок-вкладыш, поскольку в нем содержатся важные для Вас сведения.
- Сохраните листок-вкладыш. Возможно, Вам потребуется прочитать его еще раз.
- Если у Вас возникли дополнительные вопросы, обратитесь к Вашему лечащему врачу или медицинской сестре.
- Если у Вас возникли какие-либо нежелательные реакции, обратитесь к Вашему лечащему врачу или медицинской сестре. Данная рекомендация распространяется на любые возможные нежелательные реакции, в том числе на не перечисленные в разделе 4 листка-вкладыша.
Содержание листка-вкладыша:
- Что из себя представляет препарат Лукстурна® и для чего его применяют
- О чем следует знать перед применением препарата Лукстурна®
- Применение препарата Лукстурна®
- Возможные нежелательные реакции
- Хранение препарата Лукстурна®
- Содержимое упаковки и прочие сведения
1. Что из себя представляет препарат Лукстурна® и для чего его применяют
Препарат Лукстурна® представляет собой препарат генной терапии, содержащий действующее вещество воретиген непарвовек.
Препарат Лукстурна® применяется для лечения взрослых и детей с потерей зрения в результате наследственной дистрофии сетчатки, вызванной мутациями гена RPE65. Эти мутации препятствуют выработке в организме необходимого для зрения белка, приводя к снижению зрения и возможной слепоте.
Действующее вещество препарата Лукстурна®, воретиген непарвовек, представляет собой измененный вирус, содержащий рабочую копию гена RPE65, который после инъекции доставляет этот ген в клетки сетчатки (ткань с внутренней стороны задней части глаза, которая воспринимает световой сигнал). Это дает сетчатке возможность производить белки, необходимые для зрения. Применяемый для доставки генов вирус не вызывает заболеваний человека.
Препарат Лукстурна® назначают только в том случае, если результаты генетического исследования покажут, что снижение зрения обусловлено мутациями в гене RPE65.
2. О чем следует знать перед применением препарата Лукстурна®
Вам не назначат препарат Лукстурна®
- при аллергии на воретиген непарвовек или любой другой компонент этого лекарственного препарата (перечислены в разделе 6);
- при наличии инфекции глаз;
- при воспалении глаз.
Перед тем как начать лечение препаратом Лукстурна®, убедитесь, что к Вам не относятся указанные выше пункты. При возникновении вопросов проконсультируйтесь с Вашим врачом до применения препарата.
Особые указания и меры предосторожности
Перед началом лечения препаратом Лукстурна®:
- сообщите врачу, если у Вас есть признаки инфекции или воспаления глаз, например покраснение, повышенная чувствительность к свету, припухлость глаз или боль в глазу;
- сообщите врачу о наличии у Вас любой активной инфекции. Врач может отложить лечение, пока инфекция не пройдет. Дело в том, что препарат Лукстурна® может затруднить борьбу организма с инфекцией. См. также раздел 3.
После введения препарата Лукстурна®:
- Незамедлительно обратитесь к врачу в случае развития покраснения глаза (обоих глаз), боли, повышенной чувствительности к свету, появлении искр и плавающих «мушек» в поле зрения, либо если Вы заметите ухудшение и нечеткость зрения.
- Следует воздержаться от авиаперелетов и любых путешествий, связанных с подъемом на высоту, пока их не разрешит лечащий врач. Во время лечения данным препаратом врач вводит в глаз пузырек воздуха, который постепенно поглощается клетками вашего организма. Когда пузырек воздуха не поглощен полностью, авиаперелеты и другая деятельность, связанная с подъемом на высоту, может вызвать сильное увеличение размеров данного пузырька, что в свою очередь приведет к повреждению глаза, возможно, к потере зрения. Проконсультируйтесь с врачом перед планированием путешествий.
- Следует избегать плавания в связи с повышенным риском развития инфекции глаза. Проконсультируйтесь с врачом перед тем, как заняться плаванием после введения препарата Лукстурна®.
- Вам следует исключить интенсивную физическую активность в связи с повышенным риском повреждения глаза. Проконсультируйтесь с врачом перед тем, как возобновить интенсивные физические нагрузки после введения препарата Лукстурна®.
- В некоторых случаях может развиться катаракта. Это помутнение естественной линзы (хрусталика), находящейся внутри глаза, и оно может привести к нечеткости зрения. Развитие катаракты или ухудшение уже существующей катаракты – известное осложнение хирургической операции на глазу, которая требуется перед введением препарата Лукстурна®. Существует дополнительный риск развития катаракты, если хрусталик повредили иглой для введения в заднюю часть глаза.
- Вы можете испытывать временные нарушения зрения, например, повышенную чувствительность к свету и нечеткое зрение. Сообщите врачу о любых возникших нарушениях зрения. Ваш врач может помочь снизить дискомфорт, вызванный этими временными нарушениями.
- Некоторое количество лекарственного препарата может присутствовать в слезе. Вам и лицам, осуществляющим уход, следует помещать любые использованные повязки и отходы, содержащие слезу и отделяемое из носа, в герметично закрытые пакеты до утилизации. Такие меры предосторожности следует соблюдать в течение 14 дней.
- Вам и лицам, осуществляющим уход, особенно беременным и кормящим женщинам, а также лицам с подавленной иммунной системой, следует надевать перчатки при замене повязок и утилизации повязок и других отходов. Эти меры предосторожности следует соблюдать в течение 14 дней после лечения.
- После лечения препаратом Лукстурна® Вы не сможете становиться донором крови, органов, тканей или клеток для трансплантации, поскольку Лукстурна® является препаратом генной терапии.
Дети и подростки
Применение препарата Лукстурна® у детей в возрасте до 4 лет не изучалось.
Другие препараты и препарат Лукстурна®
Сообщите врачу о том, что Вы принимаете, недавно принимали или можете начать принимать какие-либо другие препараты.
Беременность, грудное вскармливание и фертильность
Если Вы беременны или кормите грудью, думаете, что забеременели, или планируете беременность, перед началом применения препарата Лукстурна® проконсультируйтесь с лечащим врачом или медсестрой.
Влияние данного препарата на беременность и не рожденного ребенка не изучено. В качестве меры предосторожности не следует применять препарат Лукстурна® во время беременности.
Исследования препарата Лукстурна® у кормящих женщин не проводились. Неизвестно, проникает ли препарат в грудное молоко. Спросите своего врача, следует ли Вам прекратить грудное вскармливание после приема препарата Лукстурна®.
Информация о влиянии препарата Лукстурна® на репродуктивную функцию мужчин и женщин отсутствует.
Управление транспортными средствами и работа с механизмами
После введения препарата Лукстурна® могут наблюдаться временные нарушения зрения. Не управляйте транспортными средствами и механизмами до тех пор, пока зрение не восстановится. Перед тем как вернуться к указанным видам деятельности, проконсультируйтесь с врачом.
Важная информация о некоторых компонентах препарата Лукстурна®
Препарат Лукстурна® содержит менее 1 ммоль (23 мг) натрия на дозу, то есть по сути не содержит натрия.
3. Применение препарата Лукстурна®
В операционной препарат Лукстурна® введет хирург, имеющий опыт выполнения операций на глазах.
Препарат Лукстурна® вводят с применением анестезии. Перед операцией врач обсудит с Вами выбранный вид анестезии и способы ее введения.
Врач проведет операцию по удалению из глаза прозрачного гелеобразного вещества, а затем введет препарат Лукстурна® непосредственно под сетчатку (тонкий светочувствительный слой с внутренней стороны задней части глазного яблока). Препарат введут во второй глаз не менее чем через 6 дней. Вам следует оставаться под наблюдением врача после проведения каждой операции в течение как минимум нескольких часов, чтобы можно было отслеживать Ваше состояние и признаки развития побочных эффектов от хирургического вмешательства или анестезии.
Перед началом лечения препаратом Лукстурна® врач может назначить Вам лекарственное средство для подавления функции иммунной системы (естественной защитной системы организма), чтобы иммунная система не препятствовала действию введенного препарата Лукстурна®. Важно принимать препарат, назначенный врачом, согласно его инструкциям. Не прекращайте прием препарата самостоятельно, не посоветовавшись предварительно с врачом.
Если Вы получили препарат Лукстурна® в дозе, превышающей рекомендованную
Поскольку данный лекарственный препарат вводит врач, то превышение дозы маловероятно. Если это все же произошло, при необходимости врач проведет лечение симптомов. Если у Вас возникнут какие-либо нарушения зрения, сообщите об этом врачу или медицинской сестре.
Если у Вас остались какие-то вопросы, связанные с применением данного препарата, обратитесь к Вашему врачу или медицинской сестре.
4. Возможные нежелательные реакции
Подобно всем лекарственным препаратам, препарат может вызывать нежелательные реакции, однако они возникают не у всех.
На фоне применения препарата Лукстурна® возможны следующие нежелательные реакции:
Часто (могут проявляться не более чем у 1 человека из 10)
- Отложения под сетчаткой
Возможны следующие нежелательные реакции, связанные с процедурой введения препарата:
Очень часто (могут проявляться более чем у 1 человека из 10)
- Покраснение глаза
- Катаракта (помутнение хрусталика)
- Повышение глазного давления
Часто (могут проявляться не более чем у 1 человека из 10)
- Разрыв сетчатки
- Истончение поверхности глаза
- Нарушения задней поверхности глаза
- Воспаление глаза
- Раздражение глаза
- Нарушение зрения
- Киста конъюнктивы (пузырек в слизистой оболочке глаза)
- Ощущение инородного тела в глазу
- Боль в глазу
- Припухлость глаз
- Отслойка сетчатки
- Тошнота, рвота, абдоминальная боль (боль в животе), боль в губах
- Изменение электрической активности сердца
- Головная боль, головокружение
- Кожная сыпь, отек лица
- Тревожность
- Проблемы, связанные с размещением дыхательной трубки в трахее
- Расхождение краев хирургической раны
Повреждение тканей глаза может сопровождаться кровотечением и отеком, а также повышенным риском развития инфекции. В послеоперационные дни наблюдается снижение зрения, которое обычно восстанавливается; сообщите врачу, если зрение не восстанавливается.
Сообщение о нежелательных реакциях
Если у Вас возникают какие-либо нежелательные реакции, проконсультируйтесь с врачом. Данная рекомендация распространяется на любые возможные нежелательные реакции, в том числе на не перечисленные в листке-вкладыше. Вы также можете сообщить о нежелательных реакциях напрямую через систему сообщений государств – членов Евразийского экономического союза. Сообщая о нежелательных реакциях, Вы помогаете получить больше сведений о безопасности препарата.
Российская Федерация
Федеральная служба по надзору в сфере здравоохранения Российской Федерации
Адрес: 109074, г. Москва, Славянская площадь, д. 4, стр. 1
Сайт: roszdravnadzor.gov.ru
5. Хранение препарата Лукстурна®
Храните препарат в недоступном и невидном для детей месте. Препарат Лукстурна® следует хранить в учреждении здравоохранения под контролем специалистов здравоохранения.
Концентрат и растворитель следует хранить и транспортировать при температуре не выше минус 65 °С. После размораживания лекарственный препарат не следует замораживать повторно. Размороженный лекарственный препарат оставляют при комнатной температуре (ниже 25 °С).
Не применяйте этот лекарственный препарат после истечения срока годности, указанного на этикетке и картонной пачке после букв ЕХР.
Не выбрасывайте препарат в канилизацию или вместе с бытовыми отходами. Уточните у медицинского работника, как следует утилизировать (уничтожать) препарат, который больше не потребуется. Эти меры позволят защитить окружающую среду.
6. Содержимое упаковки и прочие сведения
Препарат Лукстурна® содержит
- Действующее вещество – воретиген непарвовек. 1 мл концентрата содержит 5×1012 векторных геномов (вг). Перед применением необходимо разведение концентрата в соотношении 1:10 (извлекаемый объем 0,5 мл во флаконе вместимостью 2 мл, содержащем одну дозу лекарственного препарата).
- Каждая доза препарата Лукстурна® содержит 1,5×1011 векторных геномов воретигена непарвовека в общем объеме 0,3 мл.
- Другие ингредиенты концентрата – натрия хлорид, натрия дигидрофосфат моногидрат, динатрия гидрофосфат дигидрат, полоксамер 188 и вода для инъекций.
- Растворитель содержит натрия хлорид, натрия дигидрофосфат моногидрат, динатрия гидрофосфат дигидрат, полоксамер 188 и воду для инъекций.
Внешний вид препарата Лукстурна® и содержимое упаковки
Концентрат
Концентрат для приготовления раствора для субретинального введения, – замороженный раствор. После размораживания – прозрачный, бесцветный раствор, свободный от посторонних включений.
По 0,5 мл концентрата в полимерный флакон West Daikyo Crystal Zenith, укупоренный пробкой из хлорбутилкаучука и обжатый комбинированным алюминиевым колпачком Flip-Off с пластиковой крышкой лаймово-зеленого цвета.
Растворитель
Растворитель для приготовления раствора для субретинального введения – замороженный раствор. После размораживания – прозрачный, бесцветный раствор, свободный от посторонних включений.
По 1,7 мл растворителя в полимерный флакон Daikyo Crystal Zenith, укупоренный пробкой из хлорбутилкаучука и обжатый комбинированным алюминиевым колпачком Flip-Off с пластиковой крышкой белого цвета.
По 1 флакону с концентратом и по 2 флакона с растворителем вместе с инструкцией по медицинскому применению (листок-вкладыш) в картонную пачку с контурными ячейками из картона внутри. Допускается наличие контроля первого вскрытия.
Картонная пачка герметично запаивается в комбинированный PET/Alu пакет.
Держатель регистрационного удостоверения
Швейцария
«Новартис Фарма АГ»
Лихтштрассе 35, 4056 Базель
Switzerland
Novartis Pharma AG
Lichtstrasse 35, 4056 Basel
Производитель
«Новартис Фарма ГмбХ»
Роонштрассе 25 и Обере-турнштрассе 8
90429 Нюрнберг, Германия
За любой информацией о препарате следует обращаться к локальному представителю держателя регистрационного удостоверения:
Российская Федерация ООО «Новартис Фарма»
Адрес: 125315, г. Москва, Ленинградский проспект, дом 70
Листок-вкладыш пересмотрен:
Другие источники информации
Данный листок-вкладыш доступен в виде аудиофайла и в крупном шрифте на веб-сайте:
http://www.voretigeneneparvovec.support
Подробные сведения о препарате содержатся на веб-сайте Союза.
Следующие сведения предназначены исключительно для медицинских работников:
Инструкции по приготовлению, при случайном воздействии и по утилизации препарата Лукстурна®
Каждая картонная пачка содержит 1 флакон с концентратом и по 2 флакона с растворителем, которые предназначены для однократного применения.
Следует избегать случайного воздействия. При приготовлении, введении и обращении с препаратом Лукстурна® следует соблюдать требования местных руководств по биологической безопасности.
- При приготовлении и введении воретигена непарвовека следует надевать средства индивидуальной защиты (в т. ч. лабораторный халат, защитные очки и перчатки).
- Следует избегать случайного воздействия воретигена непарвовека, в том числе контакта с кожей, глазами и слизистыми оболочками. Перед манипуляциями с препаратом следует закрыть все открытые раны.
- Все поверхности, на которые попал воретиген непарвовек, необходимо обработать вирулицидным средством, таким как 1% гипохлорит натрия, и очистить с использованием абсорбирующих материалов.
- Все материалы, которые могли находиться в контакте с воретигеном непарвовеком (например, флакон, шприц, игла, марлевая салфетка, перчатки, маски или перевязочные материалы), необходимо утилизировать в соответствии с местными руководствами по биологической безопасности.
Случайное воздействие
- При случайном воздействии на рабочем месте (например, попадание брызг на глаза или слизистые оболочки) промыть чистой водой не менее 5 минут.
- В случае воздействия на поврежденную кожу или укола иглой тщательно очистить пораженный участок водой с мылом и (или) дезинфицирующим средством.
Данный лекарственный препарат содержит генетически модифицированные организмы. Неиспользованный лекарственный препарат следует утилизировать в соответствии с руководством по биобезопасности.
Порядок приготовления
Приготовление препарата Лукстурна® выполняют в пределах 4 часов до начала процедуры введения в асептических условиях в соответствии со следующей рекомендуемой процедурой.
При комнатной температуре размораживают один флакон, содержащий одну дозу концентрата, и два флакона с растворителем. Аккуратно пять раз переворачивают флаконы для перемешивания содержимого.
Осматривают на наличие видимых частиц и отклонений от нормы. О любых отклонениях от нормы и видимых частицах следует сообщить держателю регистрационного удостоверения и не применять препарат при наличии таковых.
С помощью шприца вместимостью 3 мл набирают 2,7 мл растворителя из двух размороженных флаконов и переносят в пустой стерильный стеклянный флакон вместимостью 10 мл.
Для разведения препарата переносят 0,3 мл размороженного концентрата с помощью шприца вместимостью 1 мл в стерильный стеклянный флакон вместимостью 10 мл, содержащий растворитель. Аккуратно переворачивают флакон вместимостью 10 мл не менее пяти раз для надлежащего перемешивания. Стеклянный флакон вместимостью 10 мл, содержащий разведенный концентрат, маркируют следующим образом: «Лукстурна в разведении».
Не следует подготавливать шприцы при повреждении флаконов или наличии в них видимых частиц. Подготавливают шприцы для инъекции, отбирая в каждый стерильный шприц вместимостью 1 мл по 0,8 мл разведенного раствора. Затем заполненные препаратом шприцы следует переместить в операционный блок в специально предназначенном для этого транспортном контейнере.
Режим дозирования
Лечение может быть назначено и проведено ретинальным хирургом, имеющим опыт проведения хирургических вмешательств на макуле.
Флакон препарата Лукстурна® предназначен для однократного введения одной дозы в один глаз. Каждую дозу препарата по 1,5×1011 вг воретигена непарвовека следует ввести в каждый глаз в объеме 0,3 мл. Процедура введения препарата в каждый глаз выполняется в различные дни с небольшим интервалом, но не менее 6 дней.
Курс иммуномодулирующей терапии
До начала курса иммуномодулирующей терапии и введения препарата Лукстурна® пациента необходимо обследовать на наличие симптомов активного инфекционного заболевания любой этиологии. При наличии такой инфекции начало лечения следует отложить до выздоровления пациента.
За 3 дня до введения препарата Лукстурна® в первый глаз рекомендовано начать курс иммуномодулирующей терапии, который проводят в соответствии с представленной ниже схемой (таблица 1). Курс иммуномодулирующей терапии для второго глаза следует начинать в соответствии с той же схемой, замещая завершение курса иммуномодулирующей терапии для первого глаза.
Таблица 1. Пред- и послеоперационный курс иммуномодулирующей терапии для каждого глаза
| Предоперационный период | За 3 дня до применения препарата Лукстурна® | Преднизон (или эквивалент), 1 мг/кг/сут (не более 40 мг/сут) |
| Послеоперационный период | 4 дня (в том числе день введения) | Преднизон (или эквивалент), 1 мг/кг/сут (не более 40 мг/сут) |
| Затем в течение 5 дней | Преднизон (или эквивалент), 0,5 мг/кг/сут (не более 20 мг/сут) |
|
| Затем в течение 5 дней по одной дозе один раз в два дня | Преднизон (или эквивалент), 0,5 мг/кг один раз в два дня (не более 20 мг/сут) |
Особые группы пациентов
Лица пожилого возраста
Безопасность и эффективность применения воретигена непарвовека у пациентов в возрасте 65 лет и старше не установлены. Тем не менее коррекции дозы у пожилых пациентов не требуется.
Нарушение функции печени и почек
Безопасность и эффективность применения воретигена непарвовека у пациентов с нарушение функции печени и почек не установлены. Коррекция дозы у этих пациентов не требуется (см. раздел 5.2).
Дети
Безопасность и эффективность применения воретигена непарвовека у детей в возрасте до 4 лет не установлены. Данные отсутствуют. Коррекция дозы у детей не требуется.
Способ применения
Для субретинального введения.
Препарат Лукстурна® представляет собой стерильный концентрат для приготовления раствора для субретинальных инъекций; перед применением требуется размораживание и разведение препарата.
Данный лекарственный препарат нельзя вводить интравитреально.
После проведения витрэктомии препарат применяют в виде субретинальной инъекции в каждый глаз. Препарат не следует вводить в непосредственной близости от фовеа для сохранения ее целостности.
Введение воретигена непарвовека следует производить в операционной при соблюдении асептических условий. Перед процедурой пациенту следует провести надлежащую анестезию. В соответствии со стандартной клинической практикой до операции следует расширить зрачок глаза, в который будет произведена инъекция, и местно ввести бактерицидное средство широкого спектра действия.
Меры предосторожности, принимаемые перед применением препарата или при работе с ним
При приготовлении и введении воретигена непарвовека следует надевать средства индивидуальной защиты (включая лабораторный халат, защитные очки и перчатки).
До и после введения лекарственного препарата следует контролировать внутриглазное давление и проводить соответствующее лечение.
После применения препарата пациентов необходимо предупредить о том, что при появлении любых симптомов, указывающих на развитие эндофтальмита или отслойки сетчатки, они должны незамедлительно сообщить о них врачу для проведения соответствующего лечения.
Введение воретигена непарвовека выполняют в соответствии с приведенной ниже инструкцией:
- Перед применением следует визуально осмотреть разведенный препарат Лукстурна®. Лекарственный препарат не следует применять при наличии видимых частиц, помутнении или изменении цвета.
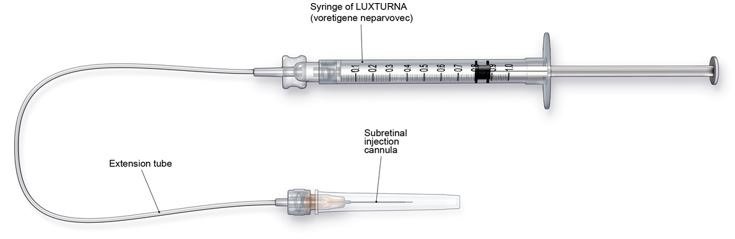
- Шприц, содержащий разведенный препарат, присоединяют к трубке и канюле для субретинальной инъекции. Препарат медленно вводят через трубку и канюлю для субретинальной инъекции, чтобы устранить все пузырьки воздуха в системе.
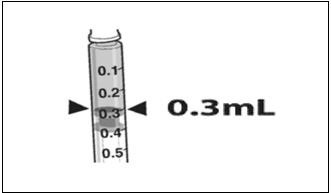
- Край поршня шприца устанавливают на отметке 0,3 мл, чтобы удостовериться в необходимом объеме препарата для инъекции.
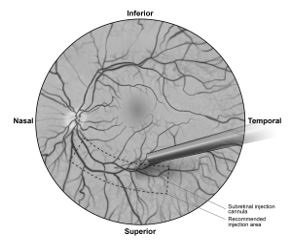
- В условиях зрительного контроля, кончик канюли для субретинальной инъекции устанавливают на поверхности сетчатки. Рекомендуемое место для инъекции должно располагаться рядом с верхней сосудистой аркадой, не менее чем на 2 мм дистальнее центра фовеа. Небольшое количество препарата медленно вводят до появления начального субретинального пузыря, затем медленно вводят оставшийся объем до достижения полного объема инъекции в 0,3 мл (рисунок 1).

- После завершения инъекции канюлю для субретинальной инъекции извлекают из глаза.
- Выполняют газо-жидкостной обмен, осторожно избегая дренажа жидкости в области ретинотомии, созданной для субретинальной инъекции.
- Сразу после операции пациента укладывают на спину в положении лицом вверх, которое следует сохранять в течение 24 часов в послеоперационном периоде.
- После инъекции неиспользованный препарат следует утилизировать. Запрещено оставлять резервный шприц для последующего применения. Препарат следует утилизировать согласно соответствующим местным руководствам по биологической безопасности.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Фармакологическое действие
Средство генной терапии. Применяется для лечения взрослых и детей с потерей зрения в результате наследственной дистрофии сетчатки, вызванной мутациями гена RPE65. Эти мутации препятствуют выработке в организме необходимого для зрения белка, приводя к снижению зрения и возможной слепоте.
Воретиген непарвовек представляет собой измененный вирус, содержащий рабочую копию гена RPE65, который после инъекции доставляет этот ген в клетки сетчатки (ткань с внутренней стороны задней части глаза, которая воспринимает световой сигнал). Это дает сетчатке возможность производить белки, необходимые для зрения. Применяемый для доставки генов вирус не вызывает заболеваний человека
Данное средство применяют только в том случае, если результаты генетического исследования покажут, что снижение зрения обусловлено мутациями в гене RPE65.
Показания активных веществ препарата
Лукстурна®
Для лечения взрослых и детей с потерей зрения в результате наследственной дистрофии сетчатки, вызванной мутациями гена RPE65.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Для субретинального введения.
Лечение может быть назначено и проведено ретинальным хирургом, имеющим опыт проведения хирургических вмешательств на макуле
Данное средство вводит офтальмохирург. Пациент должен находится под анестезией.
Однократная доза в один глаз составляет 5×1012 векторных геномов.
Побочное действие
Со стороны органа зрения: очень часто — покраснение глаза, помутнение хрусталика, повышение внутриглазного давления; часто — отложения под сетчаткой, разрыв сетчатки, истончение поверхности глаза, нарушения задней поверхности глаза, воспаление глаза, раздражение глаза, нарушение зрения, киста конъюнктивы, ощущение инородного тела в глазу, боль в глазу, припухлость глаз, отслойка сетчатки; неизвестно — очаги помутнения в стекловидном теле, хориоретинальная атрофия.
Со стороны пищеварительной системы: часто — тошнота, рвота, боль в животе, боль в губах
Со стороны сердечно-сосудистой системы: часто — изменение электрической активности сердца
Со стороны нервной системы: часто — головная боль, головокружение, тревожность
Со стороны кожи и подкожных тканей: часто — кожная сыпь, отек лица
Реакции, связанные с процедурой: часто — проблемы, связанные с размещением дыхательной трубки в трахее, расхождение краев хирургической раны
Прочие: повреждение тканей глаза может сопровождаться кровотечением и отеком, а также повышенным риском развития инфекции. В послеоперационные дни наблюдается снижение зрения, которое обычно восстанавливается.
Противопоказания к применению
Повышенная чувствительность к активному веществу; инфекционное заболевание глаз; воспалительное заболевание глаз.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период грудного вскармливания.
Применение при нарушениях функции печени
Безопасность и эффективность применения воретигена непарвовека у пациентов с нарушением функции печени не установлены. Коррекция дозы у этих пациентов не требуется
Применение при нарушениях функции почек
Безопасность и эффективность применения воретигена непарвовека у пациентов с нарушением функции почек не установлены. Коррекция дозы у этих пациентов не требуется.
Применение у детей
Применение у детей в возрасте до 4 лет не изучалось. Данные отсутствуют. Коррекция дозы у детей не требуется.
Применение у пожилых пациентов
Коррекция дозы у пациентов пожилого возраста старше 65 лет не требуется.
Особые указания
До начала курса и иммуномодулирующей терапии и введения данного средства пациента необходимо обследовать на наличие симптомов активного инфекционного заболевания любой этиологии. При наличии такой инфекции начало лечения следует отложить до выздоровления пациента.
После введения данного средства пациент должен незамедлительно обратиться к врачу в случае развития покраснения глаза (обоих глаз), боли, повышенной чувствительности к свету, появлении искр и плавающих «мушек» в поле зрения, ухудшение и нечеткость зрения.
Пациент должен воздержаться от авиаперелетов и любых путешествий, связанных с подъемом на высоту, пока их не разрешит лечащий врач. Перед планированием путешествия следует проконсультироваться с врачом перед планированием путешествий.
Следует избегать плавания в связи с повышенным риском развития инфекции глаза. Пациент должен проконсультироваться с врачом перед тем, как заняться плаванием после введения данного средства.
Необходимо исключить интенсивную физическую активность в связи с повышенным риском повреждения глаза. Следует проконсультироваться с врачом перед тем, как возобновить интенсивные физические нагрузки после введения данного средства.
В некоторых случаях может развиться катаракта, что может привести к нечеткости зрения. Развитие катаракты или ухудшение уже существующей катаракты — известное осложнение хирургической операции на глазу, которая требуется перед введением данного средства. Существует дополнительный риск развития катаракты, если хрусталик повредили иглой для введения в заднюю часть глаза.
Пациентам, лицам, осуществляющим уход, особенно беременным и кормящим женщинам, а также лицам с подавленной иммунной системой, следует надевать перчатки при замене повязок и утилизации повязок и других отходов. Эти меры предосторожности следует соблюдать в течение 14 дней после лечения.
После лечения данным средством пациент не может стать донором крови, органов, тканей или клеток для трансплантации, поскольку воретиген непарвовек является средством генной терапии.
Лекарственное средство содержит генетически модифицированные организмы.
Влияние на способность к управлению транспортными средствами и механизмами
После введения данного средства могут наблюдаться временные нарушения зрения. Не управляйте транспортными средствами и механизмами до тех лор, пока зрение не восстановится.
В России 20 апреля зарегистрирован первый препарат для генетической терапии пигментного ретинита (абиотрофии сетчатки) – это препарат Лукстурна (Luxturna , воретиген непарвовек), разработанный американской Spark Therapeutics.
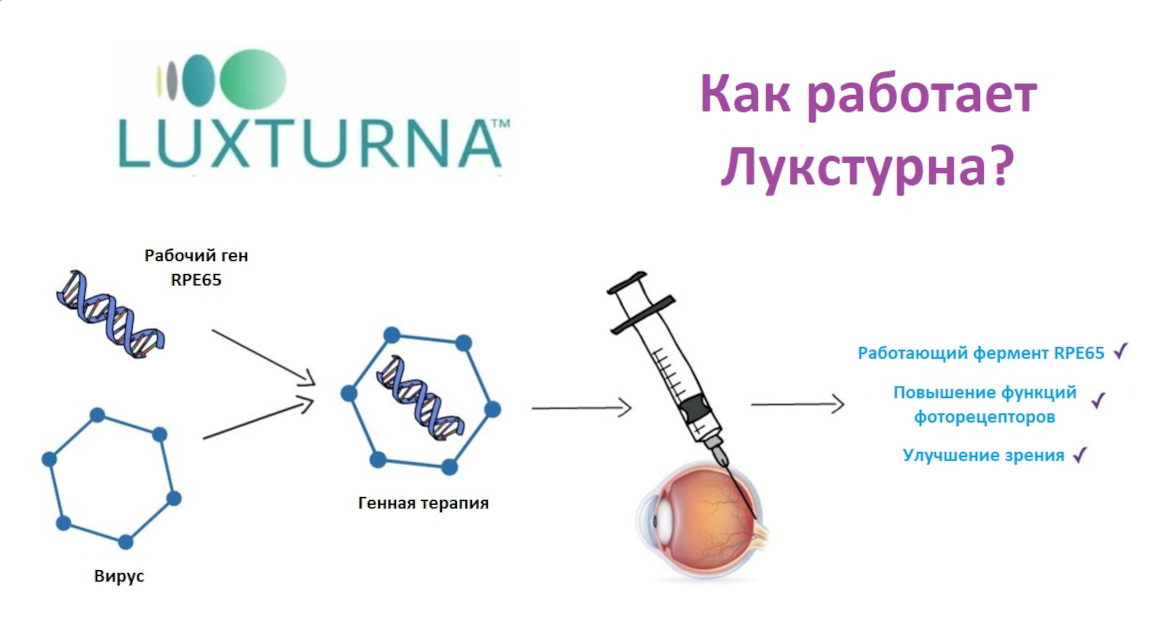
Как работает препарат
Лукструна состоит из вируса, который содержит нормальные копии гена RPE65. Когда Лукструна вводится в глаз, вирус переносит ген RPE65 в клетки сетчатки и позволяет им вырабатывать недостающий фермент. Это помогает клеткам сетчатки лучше функционировать, замедляя прогрессирование заболевания.
Тип вируса, используемый в этом лекарстве (аденоассоциированный вирус), не вызывает заболевания у людей.
Особенности применения
Люкстурна вводится в виде однократной инъекции в заднюю часть каждого глаза, под сетчатку. Второй глаз следует лечить по крайней мере через 6 дней после первого. Пациенты должны начать получать иммунодепрессанты (лекарства, которые снижают активность иммунной системы, естественные защитные силы организма) за 3 дня до введения препарата в первый глаз, чтобы снизить риск отторжения лекарства организмом, и это лечение должно продолжаться в течение 14 дней после инъекции.
Ожидаемый эффект
Эффективность препарата Лукстурна была изучена в одном основном исследовании с участием 31 пациента с наследственной дистрофией сетчатки из-за мутаций RPE65. Основным показателем эффективности было то, насколько хорошо пациенты справились с тестом на мобильность, где от них требовалось пройти маршрут с поворотами и препятствиями при различных условиях освещения. Пациенты считались прошедшими тест, если они прошли маршрут в течение 3 минут и столкнулись не более чем с 3 препятствиями.
После одного года лечения пациенты, получавшие Лукстурна, улучшили свои показатели на 1,8 балла, в то время как пациенты, которым не проходили лечение препаратом, улучшили свои показатели на 0,2 балла, что означает, что пациенты, получавшие Luxturna, смогли лучше передвигаться по маршруту.
Кроме того, 13 из 21 пациента (62%), получавших гететическую терапию пигметного ретинита, прошли тест на мобильность при самом низком уровне освещенности 1 люкс (аналогично условиям плохо освещенного тротуара ночью), в то время как ни один из пациентов, которым не давали лекарство, не смог этого сделать. Улучшение зрения пациентов сохранялось не менее трех лет.
Возможные риски и осложнения
Наиболее распространенными побочными эффектами препарата Люкстурна (которые могут поражать более 1 из 20 человек) являются гиперемия конъюнктивы (увеличение притока крови к глазу, приводящее к покраснению глаза), катаракта (помутнение хрусталика глаза) и повышение давления внутри глаза.
Luxturna не следует применять пациентам с глазной инфекцией или другим воспалением в острой фазе.
Стоимость Лукстурна
Согласно установленной стоимости на препарат, лечение обоих глаз в США составляет 850 000 долларов.
Летом 2021 года наследственная дистрофия сетчатки вошла в перечень болезней, для терапии которых закупка лексредств финансируется за счет госфонда «Круг добра». В сентябре попечительский совет фонда утвердил к закупке Лукстурну как незарегистрированный препарат.
В 2017 году Лукстурна была одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США для терапии наследственной дистрофии сетчатки, вызванной биаллельными мутациями в гене RPE65. Согласно установленной стоимости на препарат, лечение обоих глаз в США составляет $850 тысяч. В январе 2018 года Spark Therapeutics и Novaris заключили соглашение, согласно которому швейцарская фармкомпания получила права на продажу препарата за пределами США. Спустя несколько месяцев Европейское агентство лекарственных средств выдало разрешение на применение препарат Лукстурна по этому же показанию.
Летом 2021 года наследственная дистрофия сетчатки вошла в перечень болезней, для терапии которых закупка лексредств финансируется за счет госфонда «Круг добра». В сентябре попечительский совет фонда утвердил к закупке Лукстурну как незарегистрированный препарат.
В ноябре того же года госфонд «Круг добра» подписал с фармкомпанией «Ирвин 2», входящей в «Фармэко», и НМИЦ глазных болезней им. Гельмгольца договор на поставку Лукстурны для шести подопечных фонда.
Лукстурна не первый препарат, регистрируемый в РФ после утверждения к закупке для подопечных «Круга добра». Генотерапевтический препарат Золгенсма (онасемноген абепарвовек) от Novartis, предназначенный для лечения спинальной мышечной атрофии и также одобренный к закупке для подопечных фонда, зарегистрирован в России в начале декабря 2021 года. До этого препарат закупался фондом как незарегистрированный. За его поставку отвечала компания «Скопинфарм».
Первый аукцион на закупку Золгенсмы после ее регистрации ФКУ «Федеральный центр планирования и организации лекарственного обеспечения граждан» Минздрава РФ объявило в середине апреля 2022 года. Стоимость аукциона составила 5,5 млрд рублей.
Подписывайтесь на наши каналы
Telegram
Telegram Live
Generic name: VORETIGENE NEPARVOVEC 0.05mg;
Dosage form: kit
Drug class: Miscellaneous ophthalmic agents
Medically reviewed by Drugs.com. Last updated on Jun 22, 2022.
For subretinal injection only.
Dose
- The recommended dose of LUXTURNA for each eye is 1.5 x 1011 vector genomes (vg), administered by subretinal injection in a total volume of 0.3 mL.
- Perform subretinal administration of LUXTURNA to each eye on separate days within a close interval, but no fewer than 6 days apart.
- Recommend systemic oral corticosteroids equivalent to prednisone at 1 mg/kg/day (maximum of 40 mg/day) for a total of 7 days (starting 3 days before administration of LUXTURNA to the first eye), and followed by tapering the dose during the following 10 days. The same corticosteroid dosing regimen applies for the administration of LUXTURNA to the second eye. If the corticosteroid taper following LUXTURNA administration to the first eye is not complete three days prior to the planned LUXTURNA administration to the second eye, then the corticosteroid regimen for the second eye replaces the taper for the first eye.
Preparation
Prepare LUXTURNA within 4 hours of administration using sterile technique under aseptic conditions in a Class II vertical laminar flow biological safety cabinet (BSC). Below is the list of items required for dilution and administration syringe preparation:
- One single-dose vial of LUXTURNA
- Two vials of Diluent
- One 3-mL sterile syringe
- One 20G 1-inch sterile needle
- Three 1-mL sterile syringes
- Three 27G ½-inch sterile needles
- Two sterile syringe caps
- One 10-mL sterile empty glass vial
- One sterile utility drape
- One sterile plastic bag
- Two sterile labels for administration syringes
- One sterile plain label
- One sterile skin marker
Dilution of LUXTURNA
- Thaw one single-dose vial of LUXTURNA and two vials of Diluent at room temperature.
- Mix the contents of the thawed Diluent vials by gently inverting them approximately 5 times.
- Inspect the Diluent vials. If particulates, cloudiness, or discoloration are visible, do not use the vial(s); new vial(s) of Diluent should be used.
- Obtain a 3-mL sterile syringe, a 20G 1-inch sterile needle, and a 10-mL sterile empty glass vial.
- Using the 3-mL syringe with 20G 1-inch needle, transfer 2.7 mL of Diluent to the 10-mL glass vial. Dispose of the needle and syringe in an appropriate container.
- Mix the contents of the thawed LUXTURNA single-dose vial by gently inverting approximately 5 times.
- Inspect the LUXTURNA single-dose vial. If particulates, cloudiness, or discoloration are visible, do not use the vial; a new single-dose vial of LUXTURNA should be used.
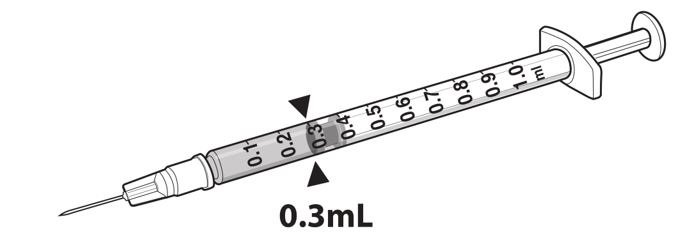
- Draw 0.3 mL of LUXTURNA into a 1-mL sterile syringe with a 27G ½-inch sterile needle. (Figure 1)
Figure 1. Syringe with 0.3 mL LUXTURNA
9. Transfer 0.3 mL of LUXTURNA to the glass vial containing 2.7 mL of Diluent from Step 5. Gently invert the 10-mL glass vial approximately 5 times to mix the contents.
10. Using the sterile plain label and sterile skin marker, label the 10-mL glass vial containing the diluted LUXTURNA as follows: «Diluted LUXTURNA».
11. Remove all items from the BSC except the glass vial labeled ‘Diluted LUXTURNA’ and the sterile skin marker.
12. Re-sanitize the BSC prior to the next steps and place the glass vial and the sterile marker to the left side in the BSC.
Preparation of LUXTURNA for Injection
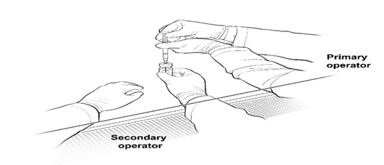
To keep the syringes sterile, two operators are required for transfer of the contents of the 10-mL glass vial labeled ‘Diluted LUXTURNA’ into each of two sterile 1-mL syringes.
13. Place a sterile utility drape, a sterile plastic bag, and two sterile labels into the BSC.
14. Place the sterile drape near the Primary Operator on the right side of the sanitized BSC surface, away from the diluted LUXTURNA.
15. The Secondary Operator unwraps two 1-mL syringes, two 27G ½-inch needles, and two syringe caps in the BSC, ensuring that the Primary Operator touches only sterile surfaces while transferring the items onto the sterile drape.
16. The Secondary Operator changes to a new pair of sterile gloves and stands or sits to the left of the Primary Operator. The Secondary Operator holds the 10-mL glass vial containing the diluted LUXTURNA (Figure 2a).
Figure 2a. First Position of the Operators During Preparation of LUXTURNA Syringes
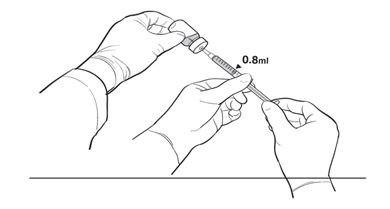
17. The Primary Operator withdraws 0.8 mL of the diluted LUXTURNA into a sterile 1-mL syringe using a 27G ½-inch sterile needle while the secondary operator holds the 10-mL glass vial. After the insertion of the needle, the Secondary Operator inverts the 10-mL glass vial enabling the Primary Operator to withdraw 0.8 mL without touching the 10-mL glass vial (Figure 2b).
Figure 2b. Second Position of the Operators During Preparation of LUXTURNA Syringes
18. The Primary Operator removes the needle and affixes a sterile cap to the sterile syringe, disposes of the needle in an appropriate container, and attaches a sterile label to the administration syringe.
19. The Primary Operator repeats Steps 17 and 18 to prepare a total of two administration syringes. Label the first syringe «Diluted LUXTURNA» and label the second syringe «Back-up Diluted LUXTURNA» using the sterile skin marker. The second syringe will serve as a backup for the surgeon performing the subretinal administration procedure. Discard the back-up syringe after surgery if not used.
20. Inspect both syringes. If particulates, cloudiness, or discoloration are visible, do not use the syringe.
21. Place the syringes into the sterile plastic bag after visual inspection and seal the bag.
22. Place the sterile plastic bag with syringes containing diluted LUXTURNA into an appropriate secondary container (e.g., hard plastic cooler) for delivery to the surgical suite at room temperature.
Administration
LUXTURNA should be administered in the surgical suite under controlled aseptic conditions by a surgeon experienced in performing intraocular surgery. In addition to the syringe containing the diluted LUXTURNA, the following items are required for administration:
- Subretinal injection cannula with a polyamide micro tip with an inner diameter of 41gauge.
- Extension tube made of polyvinyl chloride no longer than 6″ (15.2 cm) in length and with an inner diameter no greater than 1.4mm.
Figure 3. Injection Apparatus Assembly
Follow the steps below for subretinal injection:
- After confirming the availability of LUXTURNA, dilate the eye and give adequate anesthesia to the patient.
- Administer a topical broad spectrum microbiocide to the conjunctiva, cornea and eyelids prior to surgery.
- Inspect LUXTURNA prior to administration. If particulates, cloudiness, or discoloration are visible, do not use the product.
- Connect the syringe containing the diluted LUXTURNA to the extension tube and subretinal injection cannula. To avoid excess priming volume, the extension tube should not exceed 15.2 cm in length and 1.4 mm in inner diameter. Inject the product slowly through the extension tube and the subretinal injection cannula to eliminate any air bubbles.
- Confirm the volume of product available in the syringe for injection, by aligning the plunger tip with the line that marks 0.3 mL. (Figure 4)
Figure 4. Volume of LUXTURNA for Injection
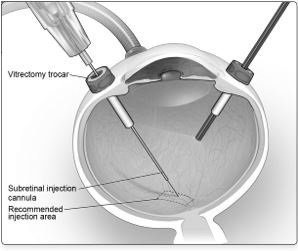
6. After completing a vitrectomy, identify the intended site of administration. The subretinal injection cannula can be introduced via pars plana. (Figure 5a)
7. Under direct visualization, place the tip of the subretinal injection cannula in contact with the retinal surface. The recommended site of injection is located along the superior vascular arcade, at least 2 mm distal to the center of the fovea (Figure 5b), avoiding direct contact with the retinal vasculature or with areas of pathologic features, such as dense atrophy or intraretinal pigment migration. Inject a small amount of the product slowly until an initial subretinal bleb is observed. Then inject the remaining volume slowly until the total 0.3 mL is delivered.
Figure 5a. Subretinal Injection Cannula Introduced via Pars Plana
Figure 5b. Tip of the Subretinal Injection Cannula Placed Within the Recommended Site of Injection (Surgeon’s Point of View)
8. After completing the injection, remove the subretinal injection cannula from the eye.
9. Following injection, discard all unused product. Dispose of the back-up syringe according to local biosafety guidelines applicable for handling and disposal of the product.
10. Perform a fluid-air exchange, carefully avoiding fluid drainage near the retinotomy created for the subretinal injection.
11. Initiate supine head positioning immediately in the post-operative period.
12. Upon discharge, advise patients to rest in a supine position as much as possible for 24 hours.
Frequently asked questions
- How much does Luxturna cost?
Further information
Always consult your healthcare provider to ensure the information displayed on this page applies to your personal circumstances.
Medical Disclaimer