Спинраза — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-005730
Торговое наименование:
Спинраза
Международное непатентованное наименование:
нусинерсен
Лекарственная форма:
раствор для интратекального введения
Состав
1 мл раствора содержит:
Действующее вещество: нусинерсен натрия 2,53 мг, в пересчете на нусинерсен (свободная кислота) 2,4 мг.
Вспомогательные вещества: натрия дигидрофосфата дигидрат, динатрия гидрофосфат безводный, натрия хлорид, калия хлорид, кальция хлорида дигидрат, магния хлорида гексагидрат, 1 М раствор натрия гидроксида, 1 М раствор хлористоводородной кислоты, вода для инъекций.
Описание
Прозрачный бесцветный раствор, свободный от легко обнаруживаемых нерастворенных частиц.
Фармакотерапевтическая группа:
Прочие препараты для лечения заболеваний костно-мышечной системы
Код ATX:
М09АХ07
Фармакологические свойства
Механизм действия
Препарат Спинраза представляет собой антисмысловой олигонуклеотид (АСО), структура которого специально разработана для лечения спинальной мышечной атрофии (СМА), представляющей собой прогрессирующее нервно-мышечное заболевание с аутосомно-рецессивным типом наследования, причиной развития которого являются мутации в длинном плече хромосомы 5 (5q). Эти мутации приводят к утрате функции гена SMN1 (survival motor neuron 1 – гена 1, отвечающего за выживание двигательных нейронов), следствием чего является дефицит белка SMN. За выработку белка SMN также отвечает ген SMN2, однако количество функционального белка, образуемого при участии SMN2, низкое. СМА представляет собой спектр различных клинических состояний, при этом тяжесть заболевания зависит от возраста дебюта и количества копий гена SMN2.
Препарат Спинраза увеличивает долю транскриптов матричной рибонуклеиновой кислоты (мРНК) с включением экзона 7 гена SMN2, связываясь с интронным сайленсером сплайсинга (intronic splice silencing site – ISS N1), расположенным в интроне 7 предшественника матричной рибонуклеиновой кислоты (пре-мРНК) гена SMN2. Связываясь с ним, АСО вытесняет факторы сплайсинга, в норме подавляющие его. Вытеснение этих факторов приводит к сохранению экзона 7 в мРНК SMN2. После синтеза мРНК SMN2 может происходить её трансляция в белок SMN с полной длиной цепи и сохранённой функциональной активностью.
Фармакодинамика
Фармакодинамические эффекты соответствуют биологическим эффектам нусинерсена. Образцы тканей спинного мозга в грудных отделах, полученные при вскрытии младенцев, получавших терапию, содержали более высокие уровни матричной рибонуклеиновой кислоты (мРНК) SMN2 с экзоном 7, по сравнению с младенцами с СМА, не получавшими такую терапию.
Фармакокинетика
Фармакокинетика нусинерсена после однократных и многократных интратекальных инъекций определялась у педиатрических пациентов с диагнозом СМА.
Абсорбция
Интратекальные инъекции нусинерсена в цереброспинальную жидкость (ЦСЖ) обеспечивают полное распределение нусинерсена по всей ЦСЖ в ткани центральной нервной системы (ЦНС), являющиеся мишенями его терапевтического действия.
Средние минимальные остаточные концентрации нусинерсена в ЦСЖ увеличивались примерно в 1,4-3 раза после многократного введения, достигая равновесного состояния примерно в течение 24 месяцев. При дополнительных введениях препарата после достижения равновесного состояния дальнейшего накопления в ЦСЖ или в тканях ЦНС не ожидается.
После интратекального введения нусинерсена минимальные остаточные концентрации в плазме крови были относительно низки, по сравнению с остаточными концентрациями в ЦСЖ. Медиана значений Тmax в плазме крови составляла от 1,7 до 6,0 часа. Наблюдалось дозопропорциональное увеличение средних значений Сmax и площади под кривой концентрация-время (AUC) в плазме в пределах изученного диапазона доз. После многократных введений не наблюдалось признаков кумуляции со стороны показателей, отражающих системные уровни в плазме (Сmax и AUC).
Распределение
Согласно материалам вскрытия пациентов (n=3), отмечается широкое распределение нусинерсена, введённого интратекально, в ЦНС, с достижением терапевтических концентраций в тканях спинного мозга, представляющих собой терапевтическую мишень. Кроме того, продемонстрировано наличие нусинерсена в нейронах и прочих клеточных популяциях спинного и головного мозга, а также в периферических тканях, в частности, в скелетных мышцах, печени и в почках.
Биотрансформация
Нусинерсен медленно метаболизируется под воздействием гидролиза, опосредованного экзонуклеазами (3’ и 5’); он не является субстратом, ингибитором или индуктором ферментов цитохрома Р450.
Выведение
Средний расчётный терминальный период полувыведения из ЦСЖ составляет 135-177 дней. Наиболее вероятный основной способ выведения – экскреция нусинерсена и его метаболитов с мочой.
Особые популяции пациентов
Пациенты с нарушением функции почек и печени
Фармакокинетика нусинерсена у пациентов с нарушением функции почек или печени не изучена.
Половая принадлежность
Популяционный фармакокинетический анализ говорит об отсутствии влияния пола на фармакокинетику нусинерсена.
Показания к применению
Препарат Спинраза показан для лечения спинальной мышечной атрофии (СМА).
Противопоказания
Гиперчувствительность к действующему или любому из вспомогательных веществ.
Меры предосторожности при применении
Процедура люмбальной пункции
Процедура люмбальной пункции сопровождается риском возникновения нежелательных реакций, таких как, головная боль, боль в спине, рвота. Потенциальные сложности могут возникнуть при введении препарата пациентам в ранней возрастной группе и пациентам со сколиозом. По решению врача может быть использованы ультразвуковой или иные визуализационные техники для облегчения интратекального введения препарата Спинраза.
Тромбоцитопения и нарушения свертываемости крови
Тромбоцитопения и случаи нарушения свертываемости крови, включая острую тяжёлую тромбоцитопению, наблюдались после подкожного или внутривенного введения других АСО. При наличии клинических показаний, рекомендовано выполнять лабораторные тесты для определения количества тромбоцитов и показателей свертываемости крови перед введением препарата Спинраза.
Нефротоксичность
Нефротоксичность наблюдалась после подкожного или внутривенного введения других АСО. При наличии клинических показаний, рекомендовано выполнять количественное определение белка в моче (предпочтительно в первой утренней порции мочи). В случае стабильного повышения содержания белка в моче рекомендуется дальнейшее обследование.
Гидроцефалия
Сообщалось о гидроцефалии, не связанной с менингитом и кровотечением, у пациентов, получающих нусинерсен. Некоторым пациентам был имплантирован вентрикулоперитонеальный шунт. Следует провести оценку развития гидроцефалии у пациентов со сниженным сознанием. Преимущества и риски лечения нусинерсеном пациентов с вентрикулоперитонеальным шунтом в настоящее время неизвестны, и необходимо тщательно оценить необходимость в продолжении лечения.
Применение при беременности и в период грудного вскармливания
Беременность
Данные о применении препарата Спинраза у женщин во время беременности отсутствуют. Должна быть проведена оценка соотношения пользы и риска лечения у женщин детородного возраста или женщин во время беременности.
Период грудного вскармливания
Данные о применении препарата Спинраза у женщин в период грудного вскармливания отсутствуют.
Фертильность
В токсикологических исследованиях на животных не обнаружено влияния на репродуктивные органы, фертильность мужских или женских особей, развитие эмбриона и плода.
Способ применения и дозы
Лечение должно проводиться медицинскими работниками, обладающими опытом выполнения люмбальных пункций.
Препарат Спинраза предназначен для интратекального введения посредством люмбальной пункции.
Режим дозирования
Рекомендованная доза составляет 12 мг (5 мл). Следует начинать терапию препаратом Спинраза как можно раньше после постановки диагноза.
Режим введения препарата Спинраза:
• в первый день лечения (день 0)
• в 14, 28, 63 день лечения
В случае задержки или пропуска введения дозы препарат Спинраза следует ввести как можно ранее, при этом интервал между дозами должен быть не менее 14 дней; далее следует продолжить введения с назначенной частотой.
• Далее дозу следует вводить 1 раз в 4 месяца.
В случае задержки или пропуска введения дозы препарат Спинраза следует ввести как можно ранее, и далее продолжить введения с назначенной частотой.
Препарат Спинраза должен применяться постоянно и длительно. Необходимость в продолжении терапии должна оцениваться лечащим врачом на основании клинического состояния пациента.
Инструкции по приготовлению и введению дозы
- Необходимо визуально оценить состояние раствора до использования. Использовать можно только прозрачные и бесцветные растворы, не содержащие никаких частиц. Использовать внешние фильтры не требуется.
- Приготовление и введение препарата Спинраза должны осуществляться в асептических условиях.
- Перед введением флакон следует достать из холодильника и согреть до комнатной температуры, не прибегая к внешним источникам тепла.
- Если флакон не был открыт и раствор не использовался, флакон может быть возвращен в холодильник. После извлечения из холодильника и картонной пачки флакон может храниться при температуре не выше 25 °С в течение не более 30 ч.
- Непосредственно перед введением, центр пробки флакона протыкают иглой шприца и извлекают требуемый объем раствора. Раствор не следует разводить. В случае, если раствор не использовался в течение 6 ч после его набора в шприц, раствор следует утилизировать.
- Для введения препарата Спинраза может потребоваться седация, если это показано на основании клинического состояния пациента.
- Можно рассмотреть вопрос о применении ультразвукового (или иного визуализационного) контроля при интратекальном введении препарата Спинраза, в особенности в более ранних возрастных группах и у пациентов со сколиозом.
- Перед введением препарата Спинраза рекомендуется извлечь объём ЦСЖ, эквивалентный вводимому объёму препарата Спинраза.
- Препарат Спинраза вводится интратекально болюсно на протяжении 1-3 минут с помощью иглы для спинальной анестезии. Не допускается проводить инъекцию в тех участках кожи, где имеются признаки инфекционного или воспалительного процесса.
- Любое неиспользованное содержимое флакона следует утилизировать.
Дети (до 18 лет)
Эффективность и безопасность применения Спинраза изучалась у детей в возрасте от 0 до 17 лет.
Взрослые пациенты
Опыт применения у пациентов старше 18 лет ограничен.
Пожилые пациенты (старше 65 лет)
Опыт применения у пожилых пациентов старше 65 лет отсутствует.
Пациенты с нарушением функции почек
Применение препарата Спинраза у пациентов с нарушением функции почек не изучено.
Пациенты с нарушением функции печени
Применение препарата Спинраза у пациентов с нарушением функции печени не изучено. Препарат Спинраза не метаболизируется ферментной системой цитохрома Р450, в связи с чем маловероятно, чтобы при нарушении функции печени потребовалась коррекция дозы.
Побочное действие
Оценка безопасности препарата Спинраза основывалась на результатах двух клинических исследованиях 3 фазы с участием младенцев (CS3B) и детей (CS4) с СМА, а также на результатах открытых исследований с участием младенцев с генетически диагностированной СМА до появления симптомов, а также младенцев и детей с СМА. Из 260 пациентов, получавших препарат Спинраза на протяжении максимум 4 лет, 154 пациента получали его в течение как минимум 1 года.
Нежелательные явления изложены по классам систем органов и согласно категориям частоты, основываясь на следующих определениях: очень часто (≥1/10); неизвестно (на основании имеющихся данных оценить частоту невозможно).
Таблица 1: Нежелательные реакции, связанные с люмбальной пункцией, зарегистрированные в исследовании CS4 (поздняя манифестация СМА), наблюдавшиеся с частотой как минимум на 5% выше у пациентов, получавших препарат Спинраза, по сравнению с пациентами из контрольной группы, получавшими плацебо
| Класс систем органов MedDRA | Термин предпочтительного употребления MedDRA | Категория частоты в группе препарата Спинраза, n = 84 |
| Нарушения со стороны нервной системы | Головная боль* | Очень часто |
| Нарушения со стороны желудочно-кишечного тракта | Рвота* | Очень часто |
| Нарушения со стороны скелетно-мышечной и соединительной ткани | Боль в спине* | Очень часто |
* Нежелательные явления, которые расценивались как связанные с процедурой люмбальной пункции. Эти нежелательные явления могут быть расценены как проявления постпункционного синдрома.
Пострегистрационное применение
В пострегистрационном периоде применения препарата Спинраза выявлен ряд нежелательных реакций. У пациентов, которым препарат Спинраза вводился посредством люмбальной пункции, наблюдались серьезные инфекции, например, менингит. Также имелись сообщения о случаях гидроцефалии. Частота возникновения подобных реакций неизвестна, поскольку все они наблюдались в пострегистрационном периоде.
Описание серьезных нежелательных реакций
При введении препарата Спинраза посредством люмбальной пункции наблюдались нежелательные реакции. Большинство подобных реакций зарегистрировано в течение 72 часов после процедуры. Частота возникновения и степень тяжести подобных явлений соответствует прогнозируемой частоте нежелательных явлений, возникающих при выполнении люмбальной пункции. Серьезные осложнения люмбальной пункции, например, серьезные инфекции, в клинических исследованиях препарата Спинраза не наблюдались.
Некоторые нежелательные явления, часто сопровождающие люмбальную пункцию (например, головная боль и боль в спине), невозможно оценить в популяции младенцев, которым вводится препарат Спинраза ввиду ограниченных коммуникативных возможностей данной возрастной группы.
Иммуногенность
Иммуногенные реакции на нусинерсен изучались на 229 пациентах, у которых проводилась оценка образцов плазмы, взятых до и после начала введения препарата, на содержание антилекарственных антител (АЛА). В целом, частота формирования АЛА была низкой, лишь у 13 (6%) появились АЛА на фоне лечения, из них у 2 пациентов они были транзиторными, у 5 были охарактеризованы как персистирующие, а у 6 не были подтверждены. При этом не выявлено достоверное влияние формирования АЛА на клинический ответ, нежелательные явления или фармакокинетический профиль нусинерсена.
Передозировка
Случаев передозировки, связанных с нежелательными реакциями, в клинических исследованиях не было.
В случае передозировки препаратом Спинраза пациенту следует дать указания обратиться за медицинской помощью при появлении любых признаков или симптомов, свидетельствующих о развитии нежелательных реакций.
Взаимодействие с другими лекарственными средствами и другие виды лекарственного взаимодействия
Клинических исследований взаимодействия с другими лекарственными средствами не проводилось.
Нусинерсен метаболизируется нуклеазами, а не ферментами цитохрома Р450.
Результаты исследований in vitro говорят о том, что нусинерсен не является индуктором или ингибитором метаболизма, опосредованного ферментами цитохрома Р450.
Результаты исследований in vitro говорят о низкой вероятности взаимодействия нусинерсена с другими препаратами на уровне конкуренции за связывание с белками плазмы крови или за использование транспортных систем, либо в связи с ингибированием активности транспортных систем.
Влияние на способность управлять транспортными средствами и другими механизмами
Исследований влияния терапии препаратом Спинраза на способность управлять транспортными средствами или другими механизмами не проводилось.
Форма выпуска
Раствор для интратекального введения, 2,4 мг/мл.
По 5 мл раствора во флаконе из стекла типа I, укупоренном пробкой из бромбутилового каучука и алюминиевым колпачком с пластмассовой крышкой. По 1 флакону вместе с инструкцией по медицинскому применению в пачке картонной. Пачка картонная может дополнительно иметь контроль первого вскрытия в виде стикера.
Условия хранения
При температуре 2-8 °С в оригинальной упаковке (флакон в пачке) для защиты от света. Не замораживать.
Допускается хранение в оригинальной упаковке (флакон в пачке) при температуре не выше 30 °С в течение не более 14 дней. В случае неиспользования в течение этих 14 дней повторное хранение при температуре 2-8 °С не допускается.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять после истечения срока годности, указанного на упаковке.
Условия отпуска
Отпускают по рецепту.
Держатель (владелец) регистрационного удостоверения
Биоген Айдек Лимитед, Великобритания
Biogen Idee Limited, United Kingdom
Innovation House, 70 Norden Road, Maidenhead, Berkshire SL6 4A Y, United Kingdom
Производитель, фасовщик (первичная упаковка)
Патеон Италия С.п.А., Италия
2. Трав. СКС Виа Мороленсе, 5, 03013 Ферентино (Фрозиноне), Италия
Patheon Italia S.p.A., Italy
2° Trav. SX Via Morolense, 5, 03013 Ferentino (FR), Italy
или
Веттер Фарма-Фертигунг ГмбХ и Ко. КГ, Германия
Айзенбанштрассе 2-4, 88085 Лангенарген, Германия
Vetter Pharma-Fertigung GmbH & Co. KG, Germany
Eisenbahnstr. 2-4, 88085 Langenargen, Germany
Упаковщик (вторичная (потребительская) упаковка), выпускающий контроль качества
Биоген (Денмарк) Манюфекчуринг АпС, Дания
Биоген Алле 1, 3400 Хиллерод, Дания
Biogen (Denmark) Manufacturing ApS, Denmark
Biogen Alle I, 3400 Hillerpd, Denmark
Организация, уполномоченная держателем (владельцем) РУ принимать сведения о рекламациях, нежелательных лекарственных реакциях и предоставлять потребителям дополнительные данные о препарате:
ООО «Джонсон & Джонсон», Россия, 121614, г. Москва, ул. Крылатская, д. 17 корп. 2
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Фармакологическое действие
Нусинерсен представляет собой антисмысловой олигонуклеотид (АСО), структура которого специально разработана для лечения спинальной мышечной атрофии, представляющей собой прогрессирующее нервно-мышечное заболевание с аутосомно-рецессивным типом наследования, причиной развития которого являются мутации в длинном плече хромосомы 5 (5q). Эти мутации приводят к утрате функции гена SMN1 (survival motor neuron1 — гена 1, отвечающего за выживание двигательных нейронов), следствием чего является дефицит белка SMN. За выработку белка SMN также отвечает ген SMN2, однако количество функционального белка, образуемого при участии SMN2, низкое. Спинальная мышечная атрофия представляет собой спектр различных клинических состояний, при этом тяжесть заболевания зависит от возраста дебюта и количества копий гена SMN2.
Нусинерсен увеличивает долю транскриптов матричной РНК (мРНК) с включением экзона 7 гена SMN2, связываясь с интронным сайленсером сплайсинга (intronic splice silencing site- ISS N1), расположенным в интроне 7 предшественника мРНК (rпре-мРНК) гена SMN2. Связываясь с ним, АСО вытесняет факторы сплайсинга, в норме подавляющие его. Вытеснение этих факторов приводит к сохранению экзона 7 в мРНК SMN2. После синтеза мРНК SMN2 может происходить ее трансляция в белок SMN с полной длиной цепи и сохраненной функциональной активностью.
Фармакодинамические эффекты соответствуют биологическим эффектам нусинерсена.
Фармакокинетика
Интратекальные инъекции нусинерсена в спинномозговую жидкость обеспечивают полное распределение нусинерсена по всей спинномозговой жидкости в ткани ЦНС, являющиеся мишенями его терапевтического действия.
Средние минимальные остаточные концентрации нусинерсена в спинномозговой жидкости увеличивались примерно в 1.4-3 раза после многократного введения, достигая равновесного состояния примерно в течение 24 мес. При дополнительных введениях препарата после достижения равновесного состояния дальнейшего накопления в спинномозговой жидкости или в тканях ЦНС не ожидается.
После интратекального введения нусинерсена минимальные остаточные концентрации в плазме крови были относительно низки, по сравнению с остаточными концентрациями в спинномозговой жидкости. Медиана значений Тmax в плазме крови составляла от 1.7 до 6 ч. Наблюдалось пропорциональное дозе увеличение средних значений Сmax и AUC в плазме в пределах изученного диапазона доз. После многократных введений не наблюдалось признаков кумуляции со стороны показателей, отражающих системные уровни в плазме (Сmax и AUC).
Нусинерсен характеризуется широким распределением с достижением терапевтических концентраций в тканях спинного мозга, представляющих собой терапевтическую мишень. Кроме того, продемонстрировано наличие нусинерсена в нейронах и прочих клеточных популяциях спинного и головного мозга, а также в периферических тканях, в частности, в скелетных мышцах, печени и в почках.
Нусинерсен медленно метаболизируется под воздействием гидролиза, опосредованного экзонуклеазами (3’ и 5’); он не является субстратом, ингибитором или индуктором ферментов цитохрома Р450.
Средний расчетный терминальный T1/2 из спинномозговой жидкости составляет 135-177 дней. Наиболее вероятный основной способ выведения — экскреция нусинерсена и его метаболитов с мочой.
Показания активного вещества
НУСИНЕРСЕН
Лечение спинальной мышечной атрофии.
Режим дозирования
Лечение должны проводить медицинские работники, обладающие опытом выполнения люмбальных пункций.
Терапию нусинерсеном следует начинать как можно раньше после постановки диагноза.
Предназначен для интратекального введения посредством люмбальной пункции.
Рекомендованная доза составляет 12 мг.
Режим введения: в первый день лечения (день 0); на 14, 28, 63 дни лечения.
Далее дозу следует вводить 1 раз в 4 месяца.
Нусинерсен следует применяться постоянно и длительно. Необходимость в продолжении терапии определяется лечащим врачом на основании клинического состояния пациента.
Эффективность и безопасность применения нусинерсена изучалась у детей в возрасте от 0 до 17 лет.
Опыт применения у пациентов старше 18 лет ограничен.
Опыт применения у пациентов пожилого возраста старше 65 лет отсутствует.
Побочное действие
Со стороны нервной системы: очень часто — головная боль.
Со стороны пищеварительной системы: очень часто — рвота.
Со стороны костно-мышечной системы: очень часто — боль в спине.
Эти побочные реакции могут быть расценены как проявления постпункционного синдрома.
Противопоказания к применению
Повышенная чувствительность к нусинерсену.
Применение при беременности и кормлении грудью
Данные отсутствуют.
Особые указания
Процедура люмбальной пункции сопровождается риском возникновения нежелательных реакций, таких как, головная боль, боль в спине, рвота. Потенциальные сложности могут возникнуть при введении препарата пациентам в ранней возрастной группе и пациентам со сколиозом. По решению врача может быть использованы ультразвуковой или иные визуализационные техники для облегчения интратекального введения.
При наличии клинических показаний, рекомендовано выполнять лабораторные тесты для определения количества тромбоцитов и показателей свертываемости крови перед введением нусинерсена.
При наличии клинических показаний, рекомендовано выполнять количественное определение белка в моче (предпочтительно в первой утренней порции мочи). В случае стабильного повышения содержания белка в моче рекомендуется дальнейшее обследование.
Сообщалось о гидроцефалии, не связанной с менингитом и кровотечением, у пациентов, получающих нусинерсен. Следует провести оценку развития гидроцефалии у пациентов со сниженным сознанием. Преимущества и риски лечения нусинерсеном пациентов с вентрикулоперитонеальным шунтом в настоящее время неизвестны, и необходимо тщательно оценить необходимость в продолжении лечения.
Спинраза™
МНН: Нусинерсен (в виде свободной кислоты)
Производитель: Патеон Италия С.п.А.
Анатомо-терапевтическо-химическая классификация: Nusinersen
Номер регистрации в РК:
№ РК-ЛС-5№025109
Информация о регистрации в РК:
29.07.2021 — 29.07.2026
- Скачать инструкцию медикамента
Торговое наименование
Спинраза™
Международное непатентованное название
Нусинерсен
Лекарственная
форма, дозировка
Раствор
для интратекального введения, 2.4
мг/мл
Фармакотерапевтическая группа
Костно-мышечная
система. Другие препараты для лечения заболеваний костно-мышечной
системы. Нусинерсен.
Код
AТХ M09AX07
Показания к применению
-
для
лечения спинальной мышечной атрофии 5q.
Перечень
сведений, необходимых до начала применения
Противопоказания
—
повышенная
чувствительность
на нусинерсен или любой из компонентов этого препарата (перечисленных
в разделе «Состав
лекарственного препарата»).
Необходимые
меры предосторожности при применении
Существует
риск возникновения нежелательных реакций после люмбальной пункции
препарата Спинраза™, в частности – головная боль, рвота и
боль в спине. Также могут возникать сложности при введении препарата
данным способом у детей и пациентов со сколиозом (скрученный и
искривленный позвоночник).
Другие
препараты из той же группы, что и препарат Спинраза™, оказывали
воздействие на клетки крови, способствующие ее свертыванию. Перед
введением препарата Спинраза™ лечащий врач может принять
решение о необходимости проведения анализа на свертываемость крови.
Возможно данная процедура будет необходима не перед каждым введением
препарата Спинраза™.
Другие
препараты, принадлежащие к той же группе лекарственных препаратов что
и препарат Спинраза™, влияют на почки. Перед введением
препарата Спинраза™ лечащий врач может принять решение о
необходимости проведения анализа мочи, чтобы убедиться в отсутствии
нарушения функции почек. Возможно данная процедура будет необходима
не перед каждым введением препарата Спинраза™.
Получено
незначительное количество сообщений о случаях гидроцефалии
(избыточное накопление жидкости в пространствах головного мозга)
после введения препарата Спинраза™. Некоторым пациентам для
лечения гидроцефалии был имплантирован вентрикуло-перитонеальный
шунт. Если наблюдаются такие изменения как: увеличение размеров
головы, снижение сознания, постоянная тошнота, рвота, головные боли
или другие симптомы, вызывающие беспокойство, сообщите лечащему врачу
для получения своевременного лечения. Преимущества и риски
продолжения терапии препаратом Спинраза™ при наличии
вентрикуло-перитонеального шунта в настоящее время неизвестны.
Применение
других лекарственных препаратов совместно с препаратом
Спинраза™Сообщите
лечащему врачу о всех принимаемых лекарственных препаратах, а также,
о тех, которые принимались в прошлом или возможно
будут
приниматься в будущем.
Взаимодействия
с другими лекарственными препаратами
Исследования
лекарственных взаимодействий не проводились. Исследования in
vitro
показали, что нусинерсен не является индуктором или ингибитором
метаболизма, опосредованного CYP450. Исследования in
vitro
показывают, что вероятность взаимодействий других лекарственных
препаратов с нусинерсеном, обусловленных конкурентным связыванием с
белками плазмы, конкуренцией или ингибированием транспортеров,
низкая.
Специальные
предупреждения
Каждый
флакон предназначен для однократного применения.
Невскрытые
флаконы препарата Спинраза™ можно доставать из холодильника и
затем вновь помещать обратно, при необходимости. После извлечения из
оригинальной картонной коробки общее время без охлаждения не должно
превышать 30 часов при температуре до 25°C.
Во
время беременности или лактации
При
беременности или кормлении грудью, предположении о наличии
беременности или планировании беременности, проконсультируйтесь с
лечащим врачом до начала приема данного препарата. Применение
препарата Спинраза™ во время беременности и кормлении грудью не
желательно.
Препарат
Спинраза™ содержит небольшое количество натрия
Данный
лекарственный препарат содержит менее 1 ммоль натрия (23 мг) на
флакон, объемом 5 мл, то есть, считается препаратом, свободным от
натрия и может применяться пациентами, соблюдающими диету с
ограниченным содержанием натрия.
Препарат
Спинраза™ содержит небольшое количество калия
Данный
лекарственный препарат содержит калий, менее 1 ммоль (39 мг) на
флакон, объемом 5 мл, то есть, считается препаратом, свободным от
калия.
Особенности
влияния препарата на способность управлять транспортным средством или
потенциально опасными механизмами
Препарат
Спинраза™ не влияет или оказывает незначительное влияние на
способность управлять транспортным средством и работать с
механизмами.
Рекомендации
по применению
Режим
дозирования
Рекомендуемая
доза препарата Спинраза™ составляет 12 мг.
Препарат
Спинраза™ вводят:
-
в
первый день терапии, день 0; -
затем
в день 14, день 28 и день 63; -
далее
один раз каждые 4 месяца.
Метод
и путь введения
Препарат
Спинраза™ вводят инъекционно в нижнюю часть спины, эта инъекция
называется люмбальная пункция и осуществляется путем введения иглы в
пространство вокруг спинного мозга. Процедура осуществляется врачом,
имеющим опыт проведения люмбальной пункции. Также перед проведением
процедуры возможно применение препарата, способствующего расслаблению
или сну во время процедуры.
Длительность
лечения
Лечащий
врач сообщит о продолжительности терапии препаратом Спинраза™.
Не прекращайте лечение препаратом Спинраза™ без рекомендации
лечащего врача.
Меры,
необходимые при пропуске одной или нескольких доз лекарственного
препарата
В
случае пропуска дозы препарата Спинраза™, сообщите об этом
лечащему врачу, для того, чтобы как можно скорее ввести препарат
Спинраза™.
При
наличии каких-либо дополнительных вопросов относительно способа
применения лекарственного препарата Спинраза™, следует
обратиться за консультацией к лечащему врачу.
Описание
нежелательных реакций, которые проявляются при стандартном применении
ЛП и меры, которые следует принять в этом случае
Подобно
всем лекарственным препаратам, данный препарат может вызывать
нежелательные реакции, однако они возникают не у всех.
Нежелательные
реакции, связанные с люмбальной пункцией, могут возникать во время
или после введения препарата Спинраза™. Большинство из этих
реакций отмечались в течение 72 часов после процедуры.
Определение
частоты побочных явлений проводится в соответствии со следующими
критериями:
очень часто (≥
1/10),
часто (от
≥ 1/100 до < 1/10),
нечасто (от
≥ 1/1000 до < 1/100),
редко (от
≥ 1/10000 до < 1/1000),
очень редко (< 1/10000),
неизвестно (невозможно
оценить на основании имеющихся данных).
Очень
часто
-
боль
в спине -
головная
боль -
рвота
Дополнительные
нежелательные реакции:
Неизвестно
-
тяжелые
инфекции, связанные с люмбальной пункцией (например, менингит) -
гидроцефалия
(накопление избыточного количества жидкости вокруг головного мозга) -
неинфекционный
менингит (воспаление мембраны вокруг спинного и головного мозга,
которое может проявляться в виде скованности в области шеи, головной
боли, лихорадки, тошноты и рвоты) -
гиперчувствительность
(аллергическая или подобная аллергии реакция, включающая отек лица,
губ или языка, сыпь или зуд).
При
возникновении нежелательных лекарственных реакций обращаться к
медицинскому работнику, фармацевтическому работнику или напрямую в
информационную базу данных по нежелательным реакциям (действиям) на
лекарственные препараты, включая сообщения о неэффективности
лекарственных препаратов: РГП
на ПХВ «Национальный центр экспертизы лекарственных средств и
медицинских изделий» Комитета медицинского и фармацевтического
контроля Министерства здравоохранения Республики Казахстан
http://www.ndda.kz
Дополнительные
сведения
Препарат
Спинраза™ содержит действующее вещество нусинерсен, которое
относится к группе лекарственных средств, известных как антисмысловые
олигонуклеотиды. Препарат Спинраза™ показан для лечения
генетического заболевания, называемого «спинальная мышечная
атрофия» (СМА).
Спинальная
мышечная атрофия вызвана дефицитом в организме белка, называемого ген
«выживаемости мотонейронов» (SMN). Это приводит к
дегенерации нейронов спинного мозга, что приводит к слабости мышц в
плечах, бедрах, голени и верхней части спины, а также это может
привести к слабости мышц, участвующих в дыхании и глотании.
Препарат
Спинраза™ помогает организму вырабатывать больше белка SMN,
недостаток которого испытывают люди со СМА. Это снижает потерю
нейронов и, таким образом, повышает мышечную силу.
Состав
лекарственного препарата
1
мл раствора содержит
активное
вещество –
нусинерсен, 2.4 мг,
вспомогательные
вещества:
натрия дигидрофосфата дигидрат, динатрия фосфат, натрия хлорид, калия
хлорид, кальция хлорида дигидрат, магния хлорида гексагидрат,
1
М раствор натрия гидроксида, 1 М раствор кислоты хлороводородной,
вода для инъекций.
Описание
внешнего вида, запаха, вкуса
Прозрачный,
бесцветный раствор.
Форма выпуска и упаковка
По
5 мл препарата во флаконе из бесцветного стекла типа I, укупоренном
пробкой из бромбутилового каучука c
фторированным полимерным покрытием и обжимным алюминиевым колпачком с
пластиковой крышкой flip
off.
По
1 флакону вместе с инструкцией по медицинскому применению на
казахском и русском языках помещают в пачку из картона.
Срок хранения
4 года
Не
применять по истечении срока годности.
Условия хранения
Хранить
при температуре от 2 °С до 8 °С, в защищенном от
света месте.
Не
замораживать!
Хранить
в оригинальной упаковке для защиты от света.
При
отсутствии холодильника, допускается хранение в оригинальной
упаковке, в защищенном от света месте, при температуре не выше 30 °С
в течение не более 14 дней.
Хранить
в недоступном для детей месте!
Условия отпуска из аптек
По
рецепту
Сведения
о производителе
Патеон
Италия С.п.А.
2
Трав SX.
Виа Мороленсе, 5-03013 Ферентино, Италия
(Patheon
Italia S.p.A., 2 Trav. SX. Via Morolense, 5-03013 Ferentino, Italy)
Тел.:
(727) 356-88-11
Факс:
(727) 356-88-13
Адрес
электронной почты:
DrugSafetyKZ@its.jnj.com
Держатель
регистрационного удостоверения
Биоген
Незерлендс Б.В.
Принс
Мауритслан 13, 1171 LP
Бадхуведорп, Нидерланды
(Biogen
Netherlands
B.V.,
Prins
Mauritslaan
13, 1171 LP
Badhoevedorp
The
Netherlands)
Тел.:
(727) 356-88-11
Факс:
(727) 356-88-13
Адрес
электронной почты:
DrugSafetyKZ@its.jnj.com
Наименование,
адрес и контактные данные (телефон, факс, электронная почта)
организации на
территории Республики Казахстан, принимающей претензии (предложения)
по качеству лекарственных средств от потребителей и
ответственной
за пострегистрационное наблюдение за безопасностью лекарственного
средства
Филиал
ООО «Джонсон & Джонсон» в Республике Казахстан
050040,
г. Алматы, ул. Тимирязева, 42, павильон №23 «А»
Тел.:
(727) 356-88-11
Факс:
(727) 356-88-13
Адрес
электронной почты:
DrugSafetyKZ@its.jnj.com
| 1.3_.3_Проект_ЛВ_Спинраза_русс_v_.2_.docx | 0.06 кб |
| 1.3_.3_Проект_ЛВ_Спинраза_каз_v_.2_.docx | 0.05 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
Статья на конкурс «био/мол/текст»: Не так давно, в мае 2019 года, произошло знаковое событие в сфере лечения генетических заболеваний: Управление по санитарному надзору за качеством продуктов и медикаментов США (FDA) одобрило препарат Zolgensma («Золгенсма», или онасемноген абепарвовек). Это лекарственное средство предназначено для генотерапевтического лечения спинально-мышечной атрофии (СМА). Сегодня «Золгенсма» является самым дорогим лекарственным препаратом в мире.
Что такое СМА?
Спинально-мышечной атрофией, или СМА, называют смертельно опасное нейродегенеративное заболевание, в процессе развития которого у пациента происходит постепенная атрофия скелетной мускулатуры. В результате человек теряет или так и не приобретает способности ходить, самостоятельно стоять, сидеть без поддержки. Со временем возникает сколиоз и другие ортопедические проблемы. Также СМА-пациенты, если они не получают должного ухода и лечения, постепенно утрачивают способность самостоятельно дышать, глотать, кашлять. Пациенты с первым, самым тяжелым, типом СМА еще несколько лет назад, как правило, не доживали и до двух лет [1].
СМА возникает из-за потери участка хромосомы или точечной мутации гена SMN1, расположенного в пятой хромосоме. В результате этого нарушается синтез SMN-белка, недостаток которого приводит к гибели моторных нейронов и атрофии скелетной мускулатуры [2].
Для того чтобы болезнь проявилась, носителем рецессивной мутации в гене SMN1 должны быть оба родителя. Примерно каждый 40-й житель Земли является таким носителем.
Подробнее о причинах возникновения, диагностике, течении спинально-мышечной атрофии читайте в статье «Надежда для СМАйликов» [3].
Терапия спинально-мышечной атрофии до появления «Золгенсмы»
До недавнего времени методы лечения СМА сводились к поддерживающей терапии. Больным рекомендовали специальное питание, витамины, умеренные физические нагрузки, при необходимости — хирургическое вмешательство, искусственная вентиляция легких. К сожалению, до сих пор значительная часть СМА-пациентов получает лишь такое лечение.
Рисунок 1. «Спинраза» — первый препарат, одобренный для лечения СМА
С 2016 года сначала в США, а затем и в Европе для лечения спинально-мышечной атрофии стали применять препарат «Спинраза» (нусинерсен) [4]. Он позволяет существенно увеличить продукцию полноценного SMN-белка, что ведет к сглаживанию симптомов заболевания. Терапия тем эффективнее, чем меньше возраст пациента.
Стоимость препарата составляет несколько сот тысяч долларов в год, поэтому его закупка осуществляется не за счет пациента. Одна за другой страны разных континентов одобрили препарат и стали применять для спасения жизней своих сограждан. В некоторых государствах этот процесс сильно затянулся из-за бюрократических проволочек и нехватки финансирования.
В РФ «Спинразу» Минздрав одобрил в начале 2019. В свою очередь компания «Биоген», производитель «Спинразы», в апреле 2019 г. объявила об открытии в России «Программы расширенного доступа» для лечения СМА нусинерсеном. Благодаря этой программе доступ к препарату получили 40 детей из России, страдающих СМА I типа [5].
В августе «Спинраза» была включена в Государственный реестр лекарственных средств РФ. Однако охват больных все еще слишком мал. В Российской Федерации зарегистрировано около 800 СМА-пациентов, и далеко не все они получают инъекции «Спинразы».
Отличия «Золгенсмы» от «Спинразы»
После появления на фармацевтическом рынке «Спинразы» все ждали выхода принципиально нового препарата для лечения СМА, основанного на генотерапевтическом подходе. Лидером в данной разработке оказалась компания «Новартис» (Novartis), которая в 2018 году купила компанию «Авексис» (AveXis) за 8,7 млрд долларов, а в 2019 вышла на рынок c препаратом «Золгенсма» (Zolgensma, он же AVXS-101, или онасемноген абепарвовек) [6].
Рисунок 2. Логотип препарата «Золгенсма»
Чем же «Золгенсма» принципиально отличается от препарата «Спинраза»? Самое важное различие заключается в механизме действия: «Спинраза» исправляет дефект сплайсинга матричной РНК гена SMN2, но она никак не затрагивает ген SMN1, мутации в котором и являются основной причиной развития спинально-мышечной атрофии.
Действие же препарата «Золгенсма» направлено именно на ген SMN1. Благодаря использованию этого лекарственного средства, мутировавший или отсутствующий ген SMN1 замещается функционально полноценным геном [1].
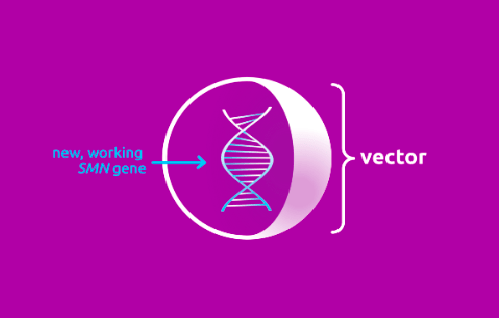
Происходит это следующим образом: препарат содержит функционально полноценный ген SMN1, который находится внутри вектора. Задача вектора — быстро доставить его в мотонейроны тела (рис. 3).
Рисунок 3. Условное изображение вектора, входящего в состав «Золгенсмы»
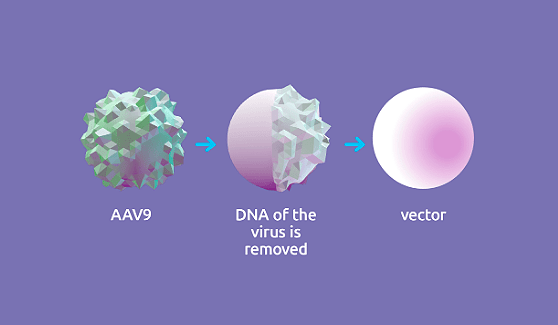
Для создания вектора использовали аденоассоциированный вирус (adeno-associative virus 9, или AAV9). Это представитель семейства парвовирусов, который способен инфицировать клетки человека и других приматов, но при этом не является патогенным. Все это делает AAV9 отличным генетическим вектором. Собственный генетический материал вируса удалили и вместо него поместили функционально полноценный ген SMN1 (рис. 4).
Рисунок 4. Условная схема механизма создания вектора
После того, как ген прибывает в нужную локацию, вектор разрушается и выводится из организма.
СМА-пациенту необходима всего одна инфузия препарата «Золгенсма» в течение жизни, в то время как лечение «Спинразой» требует нескольких доз в год. Отсюда и стоимость «Золгенсмы»: 2 125 000 долл. США. Такая ценовая политика компании-производителя делает данный препарат самым дорогим лекарственным средством на сегодняшний день. Для сравнения, стоимость все той же «Спинразы» составляет 125 тыс. долларов за одну дозу. При этом в первый год лечения нужно шесть инфузий, в последующие периоды — три инфузии ежегодно.
Насколько оправдана такая цена препарата и какова же его себестоимость? «Новартис» не афиширует информацию относительно себестоимости «Золгенсмы», поэтому эксперты оценивают стоимость препарата по двум показателям: качество жизни пациента с учетом прожитых лет (QALY) и добавленные годы жизни (LYG). По данным Института клинико-экономической экспертизы (Institute for Clinical and Economic Review, ICER), исходя из показателя QALY стоимость «Золгенсмы» должна быть в пределах 1,1–1,9 миллионов долл. США; исходя из показателя LYG — 1,2–2,1 миллиона долл. США. Таким образом, можно сказать, что стоимость «Золгенсмы» завышена по отношению к оценкам экспертов [7].
При формировании своей ценовой политики компания «Новартис» отталкивалась от стоимости препарата «Спинраза». По задумке производителя в течение десяти лет на лечение СМА-пациента «Спинразой» необходимо будет потратить более 4 млн долларов, в то время как одна инфузия «Золгенсмы» стоит 2 млн 125 тысяч. Таким образом, в долгосрочной перспективе второй вариант более выгоден [8], [9].
Компания «Новартис» ожидала, что «Золгенсма» станет «блокбастером», то есть принесет более 1 млрд долларов за первый год продаж. Однако скандал, который возник вокруг «Золгенсмы», может не дать осуществиться этим планам. Летом 2019 г. компания «Новартис» сама сообщила FDA о манипуляции с данными при проведении тестирования препарата на животных. Если бы эти данные были известны FDA в мае, то разрешение на использование препарата «Золгенсма» «Новартис» получила бы позже, но сейчас принято решение не отзывать препарат [10].
Сумму в два с лишним миллиона долларов не в состоянии заплатить большинство СМА-семей, поэтому предполагается, что пациенты будут обеспечиваться жизненно важным лечением благодаря государственной поддержке или за счет страховых компаний. Кроме того, производитель «Золгенсмы» предоставляет пятилетнюю рассрочку на оплату генной терапии и дает возможность пациенту не выплачивать оставшуюся сумму, если препарат перестанет действовать [8]. Сегодня препарат «Золгенсма» доступен только для жителей США, так как FDA — это единственная организация, которая его одобрила. Также есть ограничения по возрасту и тяжести заболевания: пока препарат применяется только для пациентов до двух лет с первым типом СМА. В дальнейшем производитель планирует использовать препарат и для других групп людей, страдающих спинально-мышечной атрофией.
Важно также отметить, что «Золгенсма» вводится внутривенно. «Спинраза» же должна попасть в спинномозговую жидкость пациента, что создает ряд дополнительных проблем и рисков.
Побочные эффекты «Золгенсмы»
Кроме высокой стоимости, у «Золгенсмы» есть и другие серьезные недостатки. Возможными побочными эффектами препарата являются:
- рвота;
- повышение уровня аминотрансфераз;
- тромбоцитопения;
- нарушение функций печени, вплоть до острого тяжелого поражения.
Не рекомендуется использование «Золгенсмы» у недоношенных детей до достижения ими полного гестационного возраста.
По данным компании-производителя на момент регистрации «Золгенсма» в рамках клинических исследований была применена для терапии 44 детей в возрасте от 0,3 до 7,9 месяцев с массой тела от 3 до 8,4 кг. Такая небольшая выборка объясняется тем, что СМА является редким заболеванием, поэтому набрать большое количество пациентов за короткий период времени — не такая уж и простая задача.
С другой стороны, небольшая выборка означает, что количество побочных эффектов препарата может быть значительно выше, чем известно на данный момент. Так, производитель уведомляет, что один из СМА-пациентов, который участвовал в клинических исследованиях за пределами США, через 12 дней после инфузии препарата начал страдать от дыхательной недостаточности. Также у него были зафиксированы лейкоэнцефалопатия, приступы гипотензии и судорог примерно через месяц после начала лечения. Через 52 дня наступил летальный исход. Но пока сложно сказать, является ли подобное развитие событий реакцией на введение препарата или же эти симптомы появились бы у СМА-пациента и без использования «Золгенсмы».
Важно также отметить, что долгосрочное влияние препарата на организм человека пока неизвестно. Прежде всего, не ясно, будет ли экспрессия гена SMN1 в организме пациента поддерживаться постоянно или постепенно сойдет на нет. Чтобы ответить на этот вопрос, «Новартис» обязана постоянно собирать данные долговременного наблюдения. В разрезе стоимости это является ключевым риском для плательщиков. Компания-производитель пытается снизить эти риски, предлагая рассрочку на пять лет пациентам, с правом приостановить выплаты, если препарат не будет проявлять своего терапевтического действия. Однако если экспрессия гена прекратится после истечения пятилетнего срока, то никакой финансовой компенсации за это не предусмотрено.
Не проводились исследования на животных по оценке онкогенного и мутагенного действий препарата, хотя есть данные о подобных исследованиях для вектора AAV9. Фактически, «Золгенсма» может оказаться как настоящей панацеей для людей, больных СМА, так и генетической бомбой замедленного действия, эффект которой будет заметен только через годы или десятилетия.
Следующий шаг
Компания-производитель «Золгенсмы» планирует в будущем применять препарат для пациентов разных возрастов со СМА II и III типов. Также «Новартис» работает над регистрацией препарата за пределами США.
Рисунок 5. Рисдиплам — препарат для лечения спинально-мышечной атрофии, который находится на стадии клинических испытаний на людях
Появление «Золгенсмы» на фармакологическом рынке повлияло на продажи «Спинразы», поэтому компания «Биоген» уже проводит клинические исследования, направленные на усиление терапевтической активности «Спинразы» путем увеличения ее дозы [11].
Но «Спинраза» и «Золгенсма», возможно, недолго будут единственными препаратами для лечения спинально-мышечной атрофии. Компания «Рош» (Roche) уже достаточно давно ведет клинические испытания своего лекарственного средства (рисдиплама) и, по всей видимости, в ближайшие пару лет данный препарат также выйдет на фармацевтический рынок (рис. 5).
Рисдиплам, как и нусинерсен («Спинраза»), не влияет на ген SMN1, а модифицирует сплайсинг мРНК гена SMN2. Однако у рисдиплама есть существенное отличие: препарат принимается перорально и не требует введения в спинно-мозговую жидкость. Кроме того, рисдиплам подходит для всех типов СМА и в клинических испытаниях показывает более высокую эффективность, чем нусинерсен [12].
По прогнозам экспертов, цена препарата будет значительно ниже, чем «Спинразы» и «Золгенсмы», поэтому новое средство сможет составить серьезную конкуренцию уже существующим лекарствам [8].
Уже в конце 2019 года компания Roche планирует подать документы на одобрение препарата в FDA и EMA (Европейское медицинское агентство) [13].
Сегодня «Золгенсма» является одним из немногих одобренных генотерапевтических препаратов, и единственный — для лечения СМА. Данная технология является чрезвычайно перспективной и теоретически может подарить шанс СМА-пациентам на продолжительную жизнь высокого качества. Однако возможные побочные эффекты и высокая стоимость препарата пока не позволяют делать поспешных радужных выводов.
- Сокольник В.П. (2012). От молекулярных основ СМА к разработке терапевтической стратегии. «Медицинский журнал». 3, 115–118;
- Генетические основы спинально-мышечной атрофии. «Семьи СМА»;
- Надежда для СМАйликов;
- Есть ли смысл в антисенсах?;
- «Биоген» открывает программу расширенного доступа к препарату «Спинраза» в России. (2019). «Семьи СМА»;
- Novartis enters agreement to acquire AveXis Inc. for USD 8.7 bn to transform care in SMA and expand position as a gene therapy and Neuroscience leader. (2018). Novartis Global;
- SMA: report-at-a-glance. (2019). ICER;
- Фон Ройсс Т. (2019). «Золдженсма»: генная терапия, которая вылечит спинальную мышечную атрофию. Все подробности. «Мосмедпрепараты»;
- Luxner L. (2019). With Zolgensma’s approval, debate shifts to pricing and availability of world’s costliest drug. SMA News Today;
- Marks P. (2019). Statement on data accuracy issues with recently approved gene therapy. FDA;
- Дмитриев Р. (2019). «Байоджен» попытается усилить терапевтическую эффективность «Спинразы». «Мосмедпрепараты»;
- Media release. (2019). Roche;
- Новые данные о планах по регистрации досье на препарат «Рисдиплам» для лечения СМА. (2019). «Семьи СМА»;
- Компания Janssen будет работать над обеспечением доступа российских пациентов к препарату для лечения спинальной мышечной атрофии. (2018). «Семьи СМА».
Нусинерсен
Nusinersen
Фармакологическое действие
Нусинерсен — антисмысловой олигонуклеотид (АСО), разработанный для лечения СМА, вызванной мутациями в хромосоме 5q, приводящими к дефициту белка SMN. В образцах in vitro и исследованиях на трансгенных животных моделях СМА нусинерсен продемонстрировал способность увеличивать включение экзона 7 в транскрипты матричной РНК (мРНК) SMN2 и выработку полноразмерного SMN-белка.
Фармакодинамика
Образцы тканей, взятые при патологоанатомическом вскрытии пациентов (n=3) показали более высокий уровень мРНА SMN2, содержащей экзон 7, в грудном сегменте спинного мозга, по сравнению с младенцами, не получавшими нусинерсен.
Фармакокинетика
Абсорбция
Интратекальное введение нусинерсена в спинномозговую жидкость позволяет ему распространяться из спинномозговой в ткани центральной нервной системы. После интратекального введения остаточные концентрации нусинерсена в плазме были относительно низкими по сравнению с остаточными концентрациями в спинномозговой жидкости. Медианные значения времени достижения максимальной концентрации нусинерсена в плазме составляли от 1,7 до 6,0 часов. Средняя концентрация нусинерсена в плазме AUC (Area Under Curve — площадь под кривой «концентрация-время») увеличивались примерно пропорционально дозам вплоть до дозы 12 мг.
Распределение
Данные патологоанатомических вскрытий пациентов (n=3) показали, что при интратекальном введении нусинерсен распределяется по центральной нервной системе и периферическим тканям, таким как скелетные мышцы, печень и почки.
Элиминация
Нусинерсен метаболизируется через гидролиз экзонуклеазы (3’- и 5’) и не является субстратом, ингибитором или стимулятором цитохромов P450.
Средний конечный период полувыведения нусинерсена оценивается в 135–177 дней в спинномозговой жидкости и от 63 до 87 дней в плазме. Основной путь выведения нусинерсена и его метаболитов с укороченными цепочками — выведение с мочой. Через 24 часа в моче обнаруживалось только 0,5 % введённой дозы нусинерсена.
Показания
Лечение спинальной мышечной атрофии у детей и взрослых.
Беременность и грудное вскармливание
Применение при беременности
Категория действия на плод по FDA — N.
Достаточные данные о рисках нарушений развития плода при приёме нусинерсена беременными женщинами отсутствуют. В исследованиях на животных, где нусинерсен вводился в виде подкожной инъекции беременным мышам и кроликам, никаких нежелательных эффектов для развития эмбриона и плода не наблюдалось.
Применение в период грудного вскармливания
Данные о проникновении нусинерсена в человеческое молоко, по влиянию препарата на ребёнка при кормлении грудью или на выработку молока отсутствуют. Необходимо оценивать преимущества грудного вскармливания для развития и здоровья ребёнка, клиническую потребность матери в приёме нусинерсена и любые потенциальные нежелательные эффекты нусинерсена для грудного ребёнка и от основного заболевания матери.
Способ применения и дозы
Нусинерсен вводится интратекально.
Рекомендуемая доза нусинерсена составляет 12 мг (5 мл) на одно введение. Первые три дозы следует нусинерсена вводить с интервалом в 14 дней. Четвертую нагрузочную дозу следует вводить через 30 дней после третьей дозы. Поддерживающая доза нусинерсена вводится один раз в 4 месяца.
Побочные действия
Побочные реакции, которые имели место, по крайней мере, у 5 % младенцев, принимающих нусинерсен и имели место минимум на 5 % чаще или минимум в 2 раза чаще, чем в группе плацебо: инфекции верхних и нижних дыхательных путей, запор, прорезывание зубов, застойные явления в верхних дыхательных путях, аспирация, отиты, сколиоз.
В открытом клиническом исследовании у одного младенца, получавшего нусинерсен, наблюдалась тяжёлая гипонатриемия, и ему потребовалось дополнительное введение натрия хлорида в течение 14 месяцев.
У некоторых младенцев, получавших нусинерсен, отмечались случаи сыпи. У одного пациента через 8 месяцев после начала лечения появились безболезненные красные пятна на предплечьях, ногах и ступнях, которые держались в течение 8 недель. Затем в течение 4 недель пятна изъязвились и зарубцевались, и через несколько месяцев состояние кожи вернулось в норму. У второго пациента через 10 месяцев после начала лечения нусинерсеном появились красные пятна на щеке и ладони, которые исчезли через 3 месяца. Оба пациента продолжили приём нусинерсена, а сыпь прошла сама по себе.
Наблюдения в контролируемых исследованиях показывают, что нусинерсен может быть причиной задержки роста при введении младенцам. Неизвестно, может ли прекращение приёма препарата привести к компенсации этого явления.
В открытых исследованиях на пациентах с более поздним началом заболевания наиболее распространённые нежелательные явления нусинерсена включали в себя: головные боли (50 %), боли в спине (41 %), а также постпункционный синдром (41 %). Большая часть этих явлений наблюдалась в течение 5 дней после введения. Прочие нежелательные явления у этих пациентов были такими же, как и в контролируемом исследовании.
Особые указания
Тромбоцитопения и нарушения свёртываемости
Нарушения свёртываемости и тромбоцитопения, включая острую тяжёлую тромбоцитопению, наблюдались после введения некоторых антисмысловых олигонуклеотидов.
В клинических испытаниях у 6 из 56 (11 %) пациентов с нормальными или повышенными уровнями тромбоцитов, получавших лечение нусинерсеном, уровень тромбоцитов оказался ниже нормы, в то время как среди 28 плацебо-пациентов такого понижения не наблюдалось.
Ни у одного из пациентов в данном исследовании уровень тромбоцитов не падал ниже 50 000/мкл, и ни у одного пациента не наблюдалось устойчивое снижение уровня тромбоцитов, несмотря на продолжительный приём препарата.
В связи с риском развития тромбоцитопении и нарушений свёртываемости на фоне приёма нусинерсена, возможен повышенный риск осложнений в виде кровотечения. Необходимо оценивать уровень тромбоцитов и показатели свёртываемости до начала лечения, перед каждым введением нусинерсена, а также по клинической необходимости.
Нефротоксичность
Нефротоксичность, включая потенциально летальный гломерулонефрит, наблюдалась после введения некоторых антисмысловых олигонуклеотидов.
Нусинерсен обнаруживается в почках и выводится ими. В клиническом исследовании (средний срок приёма препарата — 7 месяцев) у 17 из 51 (33 %) пациентов, получавших нусинерсен, был повышен белок в моче, в то время как в группе плацебо таких пациентов было 5 из 25 (20 %). В группе пациентов с более поздним началом СМА, средний срок приёма препарата — 34 месяца, белок в моче был повышен у 36 из 52 (69 %). В данных испытаниях не наблюдалось повышений уровней креатинина в сыворотке или цистатина C. Необходимо проводить количественный анализ белка в моче (предпочтительно в образце утренней мочи) до начала лечения и перед каждой дозой нусинерсена. Если концентрация белка в моче превышает 0,2 г/л — необходимо провести повторный анализ и осуществлять дальнейшее наблюдение.
Классификация
-
АТХ
M09AX07
-
Фармакологическая группа
-
Коды МКБ 10
-
Категория при беременности по FDA
N
(не классифицировано FDA)
Информация о действующем веществе Нусинерсен предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Нусинерсен, содержатся в инструкции производителя, прилагаемой к упаковке.