Метиленовый синий и другие красители в микроскопии
Как приготовить образец для изучения в микроскопе?
Для изучения микроорганизмов производят микроскопирование как живых, так и убитых микробов в неокрашенном и окрашенном виде.
Микроскопический препарат готовят на предметном стекле. Предметные стекла должны быть кристально чисты и абсолютно обезжирены. На поверхности обезжиренного стекла вода легко расплывается и не образует капель шаровидной формы.
Новые стекла перед употреблением кипятят в 1%-ном растворе соды 10 минут, промывают водой, слабой соляной кислотой и хорошо прополаскивают в дистиллированной воде.
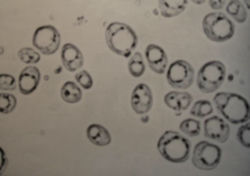
Дочерние и родовые шрамы на поверхности дрожжевых клеток.
Стекла после исследования надо обработать раствором серной кислоты в течение 2 часов, хорошо промыть в воде и прокипятить 10 минут в 4%-ном растворе соды. Ополоснутые затем дистиллированной водой стекла протирают чистой полотняной тканью.
Хранить предметные стекла лучше всего в банке с притертой пробкой, погруженными в смесь спирта с эфиром, взятых в равных объемах. Из банки предметные стекла достают пинцетом.
Покровные стекла — тонкие стеклышки (толщиной 0,15-0,17 мм) размерами обычно 18х18 мм, 20х20 мм, 18х24 мм. Ими накрывают препарат на предметном стекле для изучения.
Как приготовить раствор метиленового синего
Физиологический раствор натрия хлорида с метиленовым синим: метиленовый синий 0,1 г; физиологический раствор натрия хлорида -100,0 мл. Отвешивают указанное выше количество метиленового синего и помещают его в чистую бутылку. Прибавляют физиологический раствор натрия хлорида и тщательно перемешивают до полного растворения кристаллов краски. Для работы фильтруют небольшое количество раствора краски в капельницу.
Техника приготовления краски из сухого порошка. Некоторое количество порошка малахитового зеленого или метиленового синего растирают пестиком в чистой сухой ступке. Отвешивают 3 г порошка краски, насыпают его в бутылку и прибавляют дистиллированную воду, чтобы получилось 100 мл раствора. Для приготовления рабочего раствора наливают 1 мл одного из полученных выше 3%-х водных растворов краски в бутылочку емкостью 250 мл. Прибавляют 100 мл глицерина и 100 мл дистиллированной воды; перед использованием раствор тщательно перемешивают.
Где взять метиленовый синий?
Коврик, скальпель, метиленовый синий.
Если у вас домашний микроскоп, возникает вопрос, где брать препараты?
Всё очень просто: этот препарат продаётся в магазинах, он используется в аквариумистике. Смотрите на фото. Также для приготовления препаратов для микроскопа пригодится скальпель и коврик для резки (безопасный, вы не будете царапать под ним стол, он самовосстанавливающийся).
На фото — коврик для резки, скальпель и бутылочка метиленового синего. Всё приобретено в самом обычном (не специализированном) интернет-магазине.

Метиленовый синий — это ещё и кондиционер для аквариумной воды, стоит он буквально копейки.

Метиленовый синий для аквариумной воды, описание.

Инструкция к скальпелю, от Maped.

Безопасный коврик для резки удобен для работы со скальпелем.
Исследование микроорганизмов в живом виде
Плесневые грибы и дрожжи лучше рассматривать в живом виде в препарате «раздавленная капля». Клетки этих микроорганизмов относительно крупные, обычно при микроскопировании в живом виде хорошо выявляются их форма, размеры, детали внутреннего строения, характер размножения (почкование, деление, спорообразование и т.д.).
Бактерии чаще рассматривают в мертвом виде на фиксированных окрашенных препаратах (из-за их малого размера). При этом мы получаем более ясное представление о форме и размерах клеток, о способности их к спорообразованию.
В живом виде в «раздавленной капле» бактерии рассматривают в том случае, когда выясняют их способность к движению.
При микроскопировании дрожжей в каплю жидкости на стекле добавляют петлей небольшое количество метиленовой сини (до голубого окрашивания) и эту смесь тщательно размешивают. Окраска живых дрожжей метиленовой синью применяется для того, чтобы выявить мертвые клетки, легко окрашивающиеся в синий цвет. Живые клетки остаются неокрашенными, так как не пропускают краску через свою оболочку.
Приготовленный на предметном стекле препарат дрожжей накрывают покровным стеклом и рассматривают с объективом 40Х. В таком препарате обычно хорошо видны прозрачные овальные или круглые клетки дрожжей с ядрами и оболочками, которые хорошо заметны в клетках живых дрожжей. Мертвые клетки, как правило, более мелкие по сравнению с живыми и окрашены в синий цвет.
Окраска дрожжей метиленовым синим
Наибольшее распространение получил метод выявления мертвых клеток с помощью метиленового синего. После попадания в клеточную цитоплазму под действием ферментов редуктаз этот краситель восстанавливается живыми дрожжевыми клетками до бесцветных соединений. Мертвые клетки окрашиваются в синий цвет. Эффективность данного метода зависит не только от состояния клеточной мембраны, но и от активности оксидоредуктаз в клетке.
Окраска клеток метиленовым синим и сафранином
Более полную информацию о физиологическом состоянии дрожжей дает окрашивание фиксированных препаратов метиленовым синим, танином и сафранином. Сафранин применяется для выявления клеточных ядер, которые окрашиваются в красный цвет. Если клетки живые и содержат оксидоредуктазы, расщепляющие метиленовый синий, то окрашенный препарат приобретает красноватый, а не фиолетовой оттенок.
Реактивы: краситель метиленовый синий; краситель сафранин; 5 %-й раствор танина в воде; физиологический раствор (0,9 %-й раствор NaCl).
Нанести каплю суспензии дрожжей на обезжиренное мылом предметное стекло. Оставить высыхать на воздухе при комнатной температуре. После высыхания капли зафиксировать препарат (10 раз провести стеклом в пламени спиртовки). Нагревать несильно, не пережигать. Залить стекло раствором метиленового синего и выдержать в течение 4 минут при комнатной температуре. Смыть краситель теплой водой. Залить стекло свежеприготовленным раствором танина на 2 минуты. Смыть краситель под струей воды. Залить на 16 минут стекло раствором сафронина. Смыть краситель. Микроскопирование следует проводить нефлюоресцирующим маслом при увеличении 400х.
Препарат живых бактерий
Препарат живых бактерий готовится подобно препарату дрожжей, но бактерии можно рассматривать и без добавления краски. Препарат рассматривается с иммерсионным объективом 90 X, лучше всего в затемненном поле (т.е. с прикрытой диафрагмой). Если культура бактерий подвижная, то хорошо видны быстрые разнохарактерные движения отдельных клеток.
Морфология голодных и старых клеток (фотоувеличение 400х).
Для приготовления препарата плесневых грибов очень осторожно (чтобы не разрушить органов спороношения) специальной иглой (можно препаровальной) или ботаническим пинцетом снимают кусочек пленки гриба и переносят его в каплю воды, предварительно нанесенную на предметное стекло. Препарат осторожно, слегка придавливая, накрывают покровным стеклом и рассматривают под микроскопом с объективом 8Х. При этом увеличении хорошо различается строение органов спороношения плесневых грибов. Для подробного изучения отдельных деталей строения (гиф, сумок и т.д.) препарат рассматривают с объективом 40X.
При приготовлении препаратов в раздавленной капле нужно помнить :
1. При опускании покровного стекла на каплю следует прикоснуться его ребром к краю капли и, постепенно наклоняя, опустить стекло.
2. Капля не должна быть большой, чтобы жидкость не переливалась за края и не попадала на верхнюю сторону покровного стекла. Избыток воды снимите фильтровальной бумагой.
3. Одиночные пузырьки воздуха, оставшиеся под покровным стеклом, обычно не мешают наблюдению. Но если их много, препарат лучше приготовить заново.
4. Препарат не должен быть слишком густым, чтобы микроорганизмы не заслоняли друг друга.
5. Приготовленные препараты рассматривают тут же после приготовления (особенно живых бактерий), так как в иначе вода высыхает и клетки бактерий теряют подвижность.
6. Бактериологическую петлю (или иглу) перед каждым очередным пассажем и после него (нанесение капли воды на стекло, снятие культуры с агара и ее размешивание, взятие краски и т.д.) следует обязательно докрасна прокаливать в пламени горелки. После прокаливания петлю быстро охлаждают на воздухе (держат 2-3 секунды, ни к чему не прикасаясь) и приступают к выполнению очередного этапа работы.
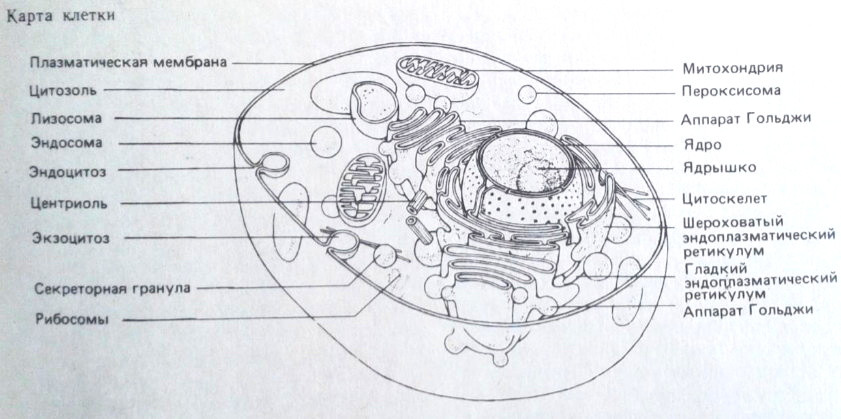
Морфологическая модель клетки.
Простая окраска препаратов
При простой окраске препаратов на фиксированный мазок наливают несколько капель какого-либо красящего раствора (метиленового синего, разведенного фуксина и прочее). Для получения более чистых препаратов рекомендуется красящий раствор наливать на отрезок фильтровальной бумаги, которой покрывают мазок.
Раствор краски в среднем выдерживают на мазке 2-3 минуты (в зависимости от вида краски):
- Фуксин красит интенсивно, причем окрашиваются одинаково хорошо все виды бактерий. Продолжительность окрашивания раствором фуксина вполне достаточна на протяжении 1-2 минут.
- Щелочную метиленовую синь оставляют для окрашивания мазка на 2-3 минуты. Она красит менее сильно, но препарат получается более изящный, к тому же различные бактерии приобретают окраску различной интенсивности. При окраске метиленовой синью у крупных клеток (например, дрожжевых) дифференцируется ядро и цитоплазма.
- Раствор генцианвиолета держат для окраски 3-5 минуты.
Виды красителей для приготовления образцов для микроскопа
Красители в микробиологии являются солями двух типов: 1) кислые красители – у которых ион, придающий окраску (хромофор), является анионом (пример — эозин); 2) основные красители – те, у которых роль хромофора играет катион (пример — метиленовый синий).
Окраска клеток дрожжей иодонитротетразолиум хлоридом.
Кислые красители являются кислыми потому, что хромофор, будучи кислотой, при образовании придающей окраску соли, связывается с основанием (NaOH).
Красители второго типа называются основными потому, что хромофор, будучи основанием, при образовании соли связывается с кислотой (HCl).
Обычно кислые красители связываются более интенсивно с цитоплазменными (основными) компонентами клетки, а основные – с ядерными (кислыми).
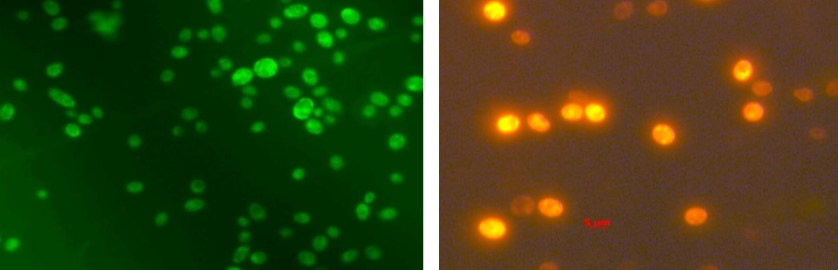
Методы окрашивания основаны либо на микроскопировании в видимом (обычном) свете, либо на флуоресцентной микроскопии. Красителями для светового микроскопа являются метиленовый синий, раствор Люголяи др. Из флуоресцентных красителей применяют магниевую соль 1-анилино-8-нафтален сульфоновой кислоты (Mg-ANS), а также дигидрородамин.
Окраска клеток дигидрородамином в зеленом и красном спектре.
4.1. ПРОСТАЯ ОКРАСКА МИКРООРГАНИЗМОВ
Мазок, т. е. каплю эмульсии микроорганизмов, помещенную на предметное стекло, высушивают и фиксируют над пламенем горелки. Подготовленный препарат заливают 1–2 каплями краски (метиленовой синью Леффлера или фуксином Пфейфера), выдерживают 0,5–1 мин и смывают дистиллированной водой.
4.2. ОКРАСКА СПОР ДРОЖЖЕЙ
4.2.1. МЕТОД ВИРТЦА
Фиксированный на пламени препарат заливают 5%-ным водным раствором малахитового зеленого и 3–4 раза прогревают до появления паров (30–60 с). Окраску можно проводить, выдерживая препарат 3–5 мин в растворе малахитового зеленого, подогретого до 80°С. Затем препарат промывают 30 с в проточной воде и докрашивают 30 с 0,5%-ным водным раствором сафранина.
Зрелые аскоспоры окрашиваются в сине-зеленый, а вегетативные клетки – в красный цвета.
Аскоспоры дрожжей родов Hansenula, Schizosaccharomyces могут удерживать оба красителя.
4.2.2. КАРБОЛ-ФУКСИНОВАЯ ОКРАСКА
Вариант 1. Фиксированный на пламени препарат заливают раствором Циля (10 см3 насыщенного спиртового раствора основного фуксина с 90 см3 5%-ного фенола) и нагревают 2–5 мин до появления паров. Затем проводят обесцвечивание препарата, погружая его в 2%-ный раствор молочной кислоты или в 95%-ный этанол, содержащий 1 мл концентрированной НСl в 100 см3.
Препарат промывают в воде и докрашивают 3–5 мин 1%-ными растворами метиленового синего или нильского голубого.
Зрелые аскоспоры окрашиваются в красный, вегетативные клетки – в синий цвета.
Аскоспоры рода Schizosaccharomyces, а также после набухания аскоспоры дрожжей родов Hansenula и Pichia не обладают кислотоустойчивостью и окрашиваются в синий цвет.
Вариант 2. Фиксированный препарат окрашивают в течение 2–3 мин карболовым фуксином при подогревании над пламенем горелки, затем краску сливают и препарат обесцвечивают соляной кислотой со спиртом (две части 10%-ного раствора соляной кислоты и одна часть 96%-ного спирта) в течение 30 с, промывают водой и окрашивают в течение 1–2 мин метиленовой синью.
Споры окрашиваются в красный цвет, а вегетативные клетки – в синий.
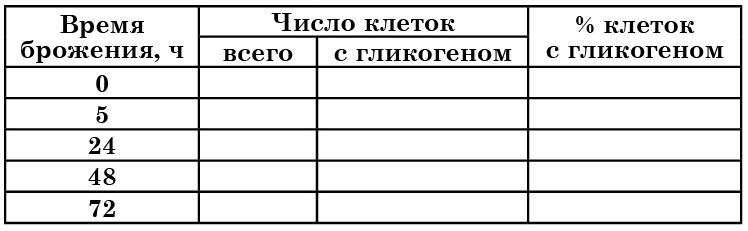
4.3. ОПРЕДЕЛЕНИЕ ГЛИКОГЕНА В КЛЕТКАХ ДРОЖЖЕЙ
Гликоген – одно из резервных веществ дрожжевых клеток. Он накапливается в цитоплазме и окрашивается раствором Люголя в коричневый или красно-бурый цвет. Наблюдения за содержанием гликогена в клетках дрожжей проводят в динамике развития культуры.
Таблица 4
Содержание гликогена в клетках
Готовят препарат «раздавленная капля» в растворе Люголя и в нескольких полях зрения подсчитывают общее количество клеток и количество клеток, содержащих гликоген. Общее число подсчитанных клеток должно быть не менее 100.
Полученные данные можно регистрировать в предлагаемой таблице 4.
Если препарат нагреть до 60°С, окраска гликогена исчезает, а при охлаждении препарата она вновь восстанавливается.
4.4. ОКРАСКА ВОЛЮТИНА
4.4.1. ПО МЕТОДУ ОМЕЛЯНСКОГО
На предметном стекле готовят тонкий мазок из культуры исследуемых дрожжей, высушивают на воздухе и фиксируют на пламени горелки. Мазок окрашивают карболовым фуксином 30–40 с и промывают водой. Далее мазок дифференцируют, погружая его в склянку с 1%-ным раствором серной кислоты на 20–30 с и немедленно промывают водой. Серная кислота обесцвечивает цитоплазму, а зерна волютина остаются окрашенными фуксином. Препарат докрашивают метиленовым синим (1:40) 20–30 с, промывают водой, высушивают на воздухе и микроскопируют, пользуясь объективом МИ-90.
На препарате зерна волютина окрашены в красный цвет, цитоплазма клетки – в голубой.
4.4.2. ПО МЕТОДУ ЛЕФФЛЕРА
Тонкий фиксированный мазок культуры исследуемых дрожжей окрашивают метиленовым синим Леффлера в течение 3 мин. Мазок промывают водой, не высушивая, покрывают его покровным стеклом и микроскопируют, пользуясь объективом ВИ-60.
На препарате зерна волютина окрашены в красновато-фиолетовый цвет, цитоплазма – в голубой.
Для более ясной дифференциации зерен волютина под покровное стекло полоской фильтровальной бумаги протягивают каплю 1%-ного раствора серной кислоты. При этом зерна волютина сохраняют окраску, а цитоплазма обесцвечивается.
Обратный результат можно получить, добавляя под покровное стекло каплю 5%-ного раствора соды. Волютиновые зерна обесцвечиваются, а цитоплазма клетки сохраняет голубой цвет.
4.5. ОКРАСКА МИКРООРГАНИЗМОВ ПО ГРАМУ
Препарат, фиксированный в пламени горелки или обработанный метиловым спиртом, покрывают раствором генцианвиолета на 1–2 мин, затем обрабатывают в течение 1–2 мин раствором Люголя, промывают водой и быстро опускают в 96%-ный этиловый спирт. В спирте препарат держат до тех пор, пока от него не перестанет отходить краска. После этого препарат вновь промывают водой и окрашивают разбавленным фуксином Пфейфера в течение 0,5–1 мин.
Грамположительные бактерии окрашиваются в темно-фиолетовый цвет, грамотрицательные – в красный.
Метод применяется исключительно для окраски бактерий и не эффективен при окрашивании дрожжей, ввиду принципиальных отличий в строении клеточной стенки.
4.6. КРАСКИ
Метиленовый синий (насыщенный спиртовой раствор). К 100 см3 96%-ного этилового спирта прибавляют 10 г метиленового синего (в порошке) и оставляют стоять несколько дней (при этом несколько раз встряхивают), затем раствор фильтруют.
Метиленовый синий 1:40.
Метиленовый синий
(насыщенный спиртовый раствор) 1 см3
Вода дистиллированная…………… 40 см3
Метиленовый синий щелочной (синька Леффлера). В 100 см3 дистиллированной воды растворяют 30 см3 насыщенного спиртового раствора метиленового синего и 1 см3
1%-ного раствора едкого кали.
Разбавленная синька (по Финку). Готовят три раствора: 0,09 г фосфорнокислого натрия (N2HPO4) растворяют в 500 см3 дистиллированной воды; 13,6 г фосфорнокислого калия (KH2PO4) растворяют в 500 см3 дистиллированной воды; 0,1 г метиленового синего растворяют в 500 см3 дистиллированной воды.
Для приготовления рабочего раствора синьки смешивают 0,25 см3 первого раствора с 99,75 см3 второго и 100 см3 раствора синьки, рН раствора должно быть 4,6.
Основной фуксин. 2 г сухой краски и 20 см3 96%-ного этилового спирта встряхивают и оставляют стоять несколько дней, получается насыщенный спиртовой раствор.
Карболовый фуксин (по Цилю). 10 см3 насыщенного спиртового раствора основного фуксина растворяют в 100 см3 5%-ного раствора карболовой кислоты (фенола).
Разбавленный фуксин (по Пфейферу). Для окраски микроорганизмов применяют раствор разбавленного в 10 раз карболового фуксина.
Малахитовый зеленый (водный насыщенный раствор).
Малахитовый зеленый……………. 5 г
Дистиллированная вода…… 100 см3
Для окраски спор лучше брать спиртово-водный раствор.
Малахитовый зеленый……………. 5 г
Спирт этиловый, 96°…………. 20 см3
Дистиллированная вода…….. 80 см3
Сафранин (водный раствор).
2,5%-ный раствор сафранина
в 96%-ном этаноле …………… 10 см3
Вода дистиллированная…… 100 см3
Насыщенный спиртовой раствор генцианвиолета (для окраски по Граму).
1 г сухой краски растворяют в 10 см3 96%-ного спирта и смешивают со 100 см3
5%-ного раствора карболовой кислоты; для достижения прозрачности добавляют несколько капель спирта.
Растворы йода в йодистом калии (по Люголю).
Раствор Люголя для окраски по Граму. Для приготовления раствора Люголя 1 г кристаллического йода растирают в фарфоровой ступке с 2 г йодида калия и порциями (по 5 см3) добавляют дистиллированную воду до полного растворения кристаллического йода в йодиде калия. После полного растворения кристаллов объем доводят до 300 см3. Приготовленный раствор Люголя хранят в посуде из темного стекла (на свету раствор Люголя быстро обесцвечивается).
Раствор Люголя для выявления гранулезы.
Кристаллический йод……………… 1 г
Йодид калия ………………………….. 2 г
Дистиллированная вода…… 100 см3
Гранулеза в клетках окрашивается в темно-синий цвет.
Раствор Люголя для выявления гликогена.
Кристаллический йод……………… 7 г
Йодид калия ………………………… 20 г
Дистиллированная вода…… 100 см3
Гликоген приобретает красно-бурую окраску.
Техника приготовления растворов для выявления гранулезы и гликогена такая же, как раствора Люголя для окраски по Граму.
Раствор туши.
Традиционный метод.
Жидкая натуральная тушь…. 10 см3
Дистиллированная вода…….. 90 см3
Раствор центрифугируют 15–20 мин. Верхний слой отсасывают (пипеткой), переносят в пробирку и автоклавируют 30 мин при 0,05 МПа (температура 110°С).
Можно раствор туши сразу после смешивания автоклавировать 30 мин при давлении 0,05 МПа. После автоклавирования раствор отстаивают две недели, после чего его можно использовать.
Метод Литтмана.
Черная тушь…………………….. 15 см3
Раствор тимерсола
в соотношении 1:1000……….. 30 см3
Твин-80……………………………. 0,1см3
На черном фоне капсулы видны как светлый ореол вокруг клетки.
ДРОЖЖЕЙ
Для
микроскопирования дрожжей следует
приготовить препарат «раздавленная
капля» из чистых культур дрожжей ‑
винных, пекарских и диких. Приготовленные
препараты изучить под микроскопом со
средним увеличением (с объективом х40).
При этом необходимо рассмотреть, прежде
всего, форму клетки и ее строение,
обратить внимание на клеточную оболочку,
цитоплазму, вакуоли и включения запасных
питательных веществ. Цитоплазма при
микроскопировании представляет собой
темную зернистую массу, вакуоли и капли
жира в виде светлых (блестящих) пятнышек,
гликоген ‑ в виде уплотненных зерен.
Необходимо убедиться в неподвижности
дрожжевых клеток.
Затем
изучают способы бесполого размножения
дрожжей. Для этого нужно отыскать в поле
зрения микроскопа почкующиеся клетки.
Все препараты зарисовать при работе с
объективом х40. На рисунках обозначить
анатомическое строение дрожжевых
клеток, почкующиеся клетки. В выводе
указать отличие изученных препаратов
дрожжей по форме.
Определить
относительное количество живых и мертвых
клеток в пекарских дрожжах ‑ старых
и подмоложенных. К капле суспензии
дрожжей на предметном стекле добавить
каплю слабого раствора (1:1000) метиленового
синего, размешать, накрыть покровным
стеклом. Мертвые клетки прокрашиваются
быстрее и ярче вследствие посмертного
повышения проницаемости клеточной
оболочки. Препарат зарисовать в цвете.
Раздел 2.Определение включений в клетках дрожжей
В
процессе
жизнедеятельности микроорганизмов в
цитоплазме клеток могут формироваться
морфологические образования, представляющие
собой либо продукты обмена клетки, либо
запасные питательные вещества. Включения
различны по своей химической природе.
Это могут быть жироподобные вещества,
полисахариды (гликоген, крахмал,
гранулеза), серополифосфаты (волютин),
кристаллы щавелевой кислоты и др. Они
не являются постоянными компонентами
клетки, они образуются в зависимости
от условий культивирования, возраста
культуры и могут использоваться в
метаболизме клетки.
Клеточные
включения могут выявляться цитохимическими
методами.
а).
Определение полисахаридов (гликогена
и гранулезы)
-
На
предметное стекло наносят небольшую
каплю микробной суспензии, добавляют
каплю концентрированного раствора
Люголя и выдерживают 10-15 минут при
комнатной температуре. -
Накрывают
покровным стеклом, удаляют избыток
жидкости и микроскопируют с сухой
системой либо с иммерсией.
Гранулы
крахмалоподобных веществ (гранулеза)
окрашены в синий, а гранулы гликогеноподобных
веществ (крахмал) ‑в красновато-коричневый
цвет.
Окрашивание
гликогена происходит в кислой среде,
поэтому перед выявлением в клетках
гликогена среду, в которой выращивали
микроорганизмы, подкисляют либо на
предметное стекло вместо воды наносят
каплю 0,5%-го раствора HCl
и в ней эмульгируют исследуемую культуру.
б).
Обнаружение жироподобных веществ
Жировые
включения или липидные гранулы в клетках
микроорганизмов могут быть представлены
нейтральными жирами и поли-β-оксимасляной
кислотой. Коэффициент преломления жиров
и гранул, состоящих из нейтральных
жиров, отличается от коэффициента
преломления протоплазмы, поэтому в
препарате «раздавленная капля»
жир виден в клетках в виде блестящих
ярких капелек. Препарат необходимо
рассматривать в затемненном поле зрения,
опустив конденсор и закрыв диафрагму
(объектив х40). Гранулы поли-β-оксимасляной
кислоты выявляют с помощью жирорастворимого
красителя судана III.
-
Наносят
каплю густой микробной взвеси на
предметное стекло. Добавляют каплю
формалина (40%-го), либо 5%-го раствора HCl
и выдерживают 5 минут (формалин убивает
клетку и разрыхляет ее оболочку). -
Добавляют
каплю метиленового синего (1:10 либо
1:40) и выдерживают 10 минут. -
Добавляют
каплю концентрированного раствора
судана (III)
в 90% этаноле и выдерживают 5 минут.
Накрывают покровным стеклом. Микроскопируют
с сухой или иммерсионной системой.
Клетки
окрашены в синий, включения жира — в
розово-оранжевый цвет.
в).
Выявление волютина
Волютин-полиметафосфат,
в клетках чаще содержится в виде зерен
диаметром 0,3 мкм, иногда в дисперсном
состоянии. Волютин встречается в клетках
многих бактерий и большинства дрожжей.
Волютин дает явление метахромазии; на
этом основана его окраска метиленовым
синим. Волютин растворяется в слабых
кислотах и щелочах, но после окраски
становится кислотоустойчивым, на этом
основан метод Омелянского.
Окраска
метиленовым синим:
фиксированный мазок дрожжей окрашивают
метиленовым синим 3-5 мин, промывают,
сушат и микроскопируют в иммерсионной
системе. Зерна волютина выглядят
красно-фиолетовыми на фоне голубой
протоплазмы.
Метод
Омелянского:
фиксированный мазок окрашивают в течение
30 с фуксином Циля, затем обесцвечивают
1% раствором серной кислоты 30 мин. и после
промывания водой докрашивают метиленовым
синим 1 мин.; промывают водой, высушивают
и микроскопируют в иммерсионной системе.
Зерна волютина ‑ ярко-красные,
протоплазма ‑ голубая. Препараты
зарисовать в цвете.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #

Использование микроскопа
подготовка образца
Поскольку клетки подсчитываются только в очень маленьком образце, образец должен быть соответствующий пиву или жидкости, содержащей популяцию дрожжей. Это означает, что весь объем необходимо перемешать очень хорошо, и дрожжевым клеткам нельзя позволять флокулировать. Этот момент очень важен.
Существует два подхода для определения уровня засева, т.е. начальной концентрации клеток в пиве. Клетки можно подсчитать, как только они были засеяны в пиве, и клетки могут быть подсчитаны, пока они находятся в сосуде для размножения. Преимущество первого заключается в том, что он не требует разбавления. Но если засеяно больше клеток, чем было необходимо, то они не могут быть удалены. Следующий способ требует разбавление образца. Если количество сусла, добавленного к дрожжам, составляет около 5% от объема сусла, подлежащего засеву (1 л к 20 л партии) рекомендуется разбавление 1:20.
Для этого добавьте 19 мл воды в пробирку или другую небольшую емкость и затем добавьте 1 мл перемешенной дрожжевой культуры. Хорошо все перемешайте, но не трясите их энергично. Некоторые дрожжевые штаммы, в частности элевые дрожжи, любят скапливаться в пене. Повторно втяните образец в пипетку и вытяните его обратно, чтобы промыть пипетку.
дефлокуляция дрожжей
Плохие флокулянты, такие как пыльные дрожжи и немецкие элевые дрожжи, легки в обращение. Большинство других флокулирующих штаммов нуждаются в некоторой помощи. Вот несколько практических способов для дефлокуляции дрожжей во время подсчета клеток.
свежее сусло
Мальтоза ингибирует флокуляцию, потому как дрожжи размножаются в свежем сусле. Это справедливо и для хороших флокулянтов, таких как английские элевые дрожжи (WLP 002). Просто добавьте свежее сусло к дрожжевому осадку и поместите его на магнитную мешалку в течение нескольких минут. Это очень практичный способ определения количества дрожжей в дрожжевых осадках до засева, так как здоровье дрожжей не затрагивается, а дефлокуляция дрожжей также позволит более равномерно распределиться дрожжам по всей поверхности образца.
серная кислота
Когда образец дрожжей подлежащий подсчету не предназначен для засева, то дрожжи могут стать нефлокулентными с добавлением некоторого количества серной кислоты (H2SO4 ). Однако, серная кислота является очень едкой и с ней необходимо обращаться осторожно.
динатрий ЭДТУ
Более безопасным, чем серная кислота является ЭДТУ. ЭДТУ (этилендиаминтетрауксусная кислота) представляет собой хелатирующий агент, который хелатирует («захватывает») ионы кальция, необходимые для флокуляции. В результате образец дрожжей не флокулирует. Это не влияет на здоровье дрожжей, а окрашивание метиленовым синим можно использовать для оценки жизнеспособности дрожжей.
PWB
Моющее средство PBW (Powdered Brewery Wash) также содержит хелатообразующие агенты и способна предотвращать флокуляцию дрожжей. В то время оно безопасно в использование и легко доступно для многих пивоваров, но оно влияет на здоровье дрожжей, а окрашивание метиленовым синим не может использоваться для оценки жизнеспособности культуры.
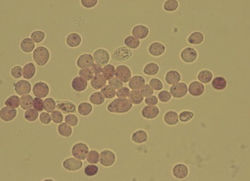
Рисунок 3 — темный гемоцитометр с двумя заполненными счетными сетками. Образец был окрашен метиленовым синем, намного сильнее, чем это необходимо или полезно, чтобы проиллюстрировать, как он всасывается в счетную камеру
подготовка гемоцитометра (счетной камеры)
Подготовьте гемоцитометр в соответствии с инструкциями производителя. В большинстве случаев это означает, что покровное стекло должно находится на счетной сетке (сетках) придерживаясь двумя выступами.
Теперь вытяните образец с помощью пипетки и создайте небольшую каплю на кончике пипетки. Поднесите кончик с каплей прямо рядом с краем покровного стекла, чтобы образец попадал в счетную камеру капелярным способом. Если ваш гемоцитометр имеет две счетные сетки, вытяните еще один образец и повторите процедуру для другой счетной сетки. Образец должен охватывать счетную сетку, избегая переполнения в «канавах» или переполнения по всей поверхности. Слишком много жидкости в канавах может подтолкнуть покровное стекло вверх и изменить объем выше счетной сетки.
Теперь поместите гемоцитометр на предметный столик микроскопа и выберите самое слабое увеличение. С помощью ручки фокусировки подвиньте столик ближе к объективу и, посмотрите в окуляр, сдвиньте столик от объектива до тех пор, пока не увидите счетную сетку. Сфокусируйтесь и перейдите к следующему более высокому уровню увеличения. Повторно сфокусируйте и отрегулируйте положение столика так, чтобы отображалась счетная сетка по центру. Обратите внимание, насколько равномерно распределены клетки. Если они сгруппированы вместе, возможно необходимо будет повторно перемешать образец, или дрожжам потребуется больше времени для дефлокуляции.
Если фокус не нуждается в изменении, его можно оставить как есть, и в следующий раз, когда вы будете считать клетки, вам не потребуется проходить описанную процедуру фокусировки.
подсчет
Измените увеличение на 400-х. Это лучшее увеличение для подсчета дрожжевых клеток. По правилам обычно подсчитываются клетки в 4-х угловых сетках 4×4 и в центральной сетке 4×4 (см. рис. 13 для полной счетной сетки Нойбауэра). Если концентрация дрожжей низкая, возможно, потребуются дополнительные сетки. См. рис. 4, как подсчитывать клетки в одной из сеток 4×4.
При использовании (чаще всего) гемоцитометра с глубиной 0,1 мм концентрация клеток исходного образца в миллионах клеток на мл (или млрд. клеток на литр) составляет:
Рисунок 4 — Когда ведется подсчет количества клеток, то считаются те, которые касаются середины тройных линий сверху и слева от сетки 4×4, но исключаются клетки, касающиеся правой и нижней средней линии. Считайте почкующиеся клетки за две, так как они скоро станут двумя клетками.

Коэффициент разбавления — это соотношение количества образца к объему воды, пошедшей на разбавление, плюс один. Примеры:
- Без разбавления: коэффициент разбавления 0+1=1
- 1 мл образца + 1 мл воды: коэффициент разбавления 1+1=2
- 2 мл образца + 10 мл воды (разбавление 1 : 5+1): значит коэффициент разбавления 6
Формула также обозначает, что подсчет одной строки из 4 маленьких квадратов в неразбавленном образце дает очень грубую оценку плотности клеток.
Количество клеток в культуре в миллиардах можно рассчитать, умножив концентрацию клеток на объем культуры или пива в литрах (1 миллион / мл = 1 миллиард / л). Обратите внимание, что это тот объем, в котором популяция дрожжей в настоящее время приостановлена.
Количество клеток, определенное с помощью гемоцитометра, имеет пределы точности, которые должен понимать каждый пивовар. Ошибка может быть сведена к минимуму если:
- Убедиться, что взятый образец является представителем культуры или пива. Это означает тщательное перемешивание.
- При разбавлении образца его необходимо тщательно перемешать и пипетку необходимо промыть разбавленным образцом.
- Подсчитать достаточное количество клеток. Следует подсчитать не менее 100 клеток, поскольку статистическая ошибка обратно пропорциональна квадратному корню из подсчитанного количества клеток, как показано ниже.
Следующая формула может быть использована для оценки статистической ошибки, основанной на количестве подсчитанных клеток:

В идеале следует брать несколько разных образцов и подсчитывать их отдельно. Если этого не сделано, две счетные камеры должны, по крайней мере, заполняться отдельными пипетками.
Окрашивание метиленовым синим
Окрашивание метиленовым синим позволяет простейшим способом оценить здоровье дрожжевой культуры. Теоретически мертвые клетки окрашиваются в синий цвет, а живые клетки остаются бесцветными. На практике же есть тенденция переоценивать жизнеспособность. Тем не менее, несмотря на свои недостатки, окрашивание метиленовым синим является практически стандартным в пивоваренной промышленности тестом на жизнеспособность благодаря своей простоте и быстрым результатам. Это также удобный тест для домашних пивоваров, поскольку метиленовая синь легко доступна в Интернете и имеет длительный срок хранения.
В окисленной форме метиленовая синь имеет синий цвет. В своей редуцированной форме, называемой лейкометиленовая синь, цвет отсутствует.
Когда метиленовый синий проникает в живые клетки, дыхание клетки (потребление кислорода) быстро редуцирует его до бесцветной лейкообразной формы. Вот почему живые клетки не окрашиваются. В мертвых клетках метиленовая синь может накапливаться в своей окисленной (синей) форме. Но что, если метиленовый синий не сможет попасть в мертвые клетки. Когда клетка стареет она откладывает липиды и сахара в клеточных стенках с целью защиты от окружающей среды. Это предотвращает проникновение метиленовой сини, и когда клетка позже умирает, она не будет окрашиваться в синий. Если свежую дрожжевую культуру подвергнуть тепловой пастеризации, чтобы убить все дрожжевые клетки, то все клетки будут окрашиваться метиленовым синим (рис. 5). С другой стороны, если старая и мертвая культура дрожжей окрашивается, но не все такие клетки становятся темно-синими (рис. 6). Вот почему окрашивание метиленовым синим переоценивает жизнеспособность культуры по сравнению с подсчетами на агарной пластине, где жизнеспособность клеток оценивается путем подсчета клеток, которые способны расти и образовывать колонии.
Из-за переоценки метиленового синего, результаты менее 85-90% следует рассматривать как непригодными к использованию. В практике пивоварения если культура дрожжей показывает жизнеспособность менее 90%, при тестировании с метиленовой синью, ее не следует использовать и выращивать новую культуру. Этого можно добиться размножением небольшого образца старых дрожжей.
Для проведения теста жизнеспособности с метиленовыми синим пивоварами следует следовать этому руководству:
- приготовьте 1% раствор метиленового синего и оставьте его в бутылке с пипеткой. Он будет вам на запас
- при необходимости разведите образец дрожжей
- добавьте 1 каплю на каждые 5 мл разбавленного образца дрожжей. Капля добавляет объем 0,05-0,07 мл и уменьшает количество клеток на ~ 1%, что явно связано с погрешностью подсчета клеток и, следовательно, можно смело игнорировать.
- позвольте окрашенному образцу постоять 1 минуту
- поместите образец через пипетку в гемоцитометр и смотрите под микроскопом при 400 кратном увеличение
Чтобы правильно видеть какие клетки окрашены, возможно, фокус придется слегка отрегулировать вверх или вниз. Подсчитайте бесцветные и светло-синие / зеленые клетки как жизнеспособные и подсчитайте синие клетки как мертвые. Не считайте синие окрашенные почки клеток, если материнские клетки не окрашиваются. Почки заняты растущим метаболизмом и не могут редуцировать краситель.
Жизнеспособность культуры дрожжей с метиленовой синью может быть рассчитана как:

подсчет клеток с использованием ImageJ
Подсчет клеток в микроскопе занимает много времени и довольно утомителен. Альтернативой является съемка(и) и подсчет клеток с помощью программного обеспечения подсчета для рабочего стола, такого как ImageJ . Картинки могут быть сделаны с помощью специальной камеры, установленной на микроскоп или даже с камеры сотового телефона, которая удерживается близко к окуляру. Последнее потребует некоторой практики, но работает достаточно хорошо. При съемке для подсчета клеток также можно взять их при уменьшенном увеличении (100x) и, следовательно, в более широком поле зрения. В этом случае единственное изображение должно быть сделано для каждой сетки гемоцитометра.
ImageJ имеет как автоматические, так и ручные режимы подсчета. Для автоматизированного подсчета клеток, основанного на распознавании частиц на изображении, требуется довольно равномерно освещенное изображение высокого качества, которое я не могу снять с помощью мобильного телефона. Из-за этого я использую счетчик клеток в разделе Plugins-> Analyze-> Cell Counter. После установки изображения выбирается тип клеток, и каждый щелчок на изображении оставляет пометку и увеличивает счетчик для этого типа клетки. Различные типы клеток могут использоваться для разных сеток или подсчета окрашенных и неокрашенных клеток.
Рисунок 8 — Снимок экрана ImageJ и подключаемый модуль счетчика клеток. Изображение, на котором подсчитываются клетки, сделано с сотового телефона при 100-кратном увеличении. Она был увеличена, чтобы показать одну из счетных сеток 4×4
Другие виды использования
оценка состояния здоровья дрожжей
Здоровые дрожжевые клетки должны быть упитанные и круглые, в то время как голодные дрожжевые клетки имеют более вытянутую форму похожую на мяч для американского футбола. На Рис. 6 можно увидеть такую старую культуру дрожжей.
элевые против лагерных дрожжей
Рисунок 9 — Элевые дрожжи, демонстрирующие типичную тенденцию к образованию струнных колоний
В целом, вы не сможете различить разные штаммы дрожжей, хотя у некоторых штаммов больше клеток, чем у других. Но есть одна разница между элевыми и лагерными дрожжами, которую иногда можно наблюдать. Элевые дрожжи, как правило, склеиваются после почкования и заканчивают формирование в небольшие струнные колонии, состоящие из 5-10 клеток (см. Рис. 9). Эти колонии часто присоединяются к пузырькам CO2 и поднимаются в верх при брожение. Лагерные дрожжи отделяются после почкования и формируются в группы только при флокуляции. Эти группы представляют собой скопления клеток, а не цепочки.
определение источника помутнений в пиве
Когда в пиве появляется помутнение, имеет смысл взглянуть на его под микроскопом. Процедура такая же, как и для подсчета клеток, за исключением того, что гемоцитометр следует мыть более тщательно, чем обычно, чтобы избежать попадания частиц, которых нет в пиве. Я также советую заполнить одну из сторон гемоцитометра водой, чтобы вы могли сравнить пиво с водой.
Если это не сильная муть, частицы будут довольно далеко друг от друга. Но вы сможете увидеть, является ли мутность результатом дрожжевых или белковых комплексов. Белковые комплексы намного меньше дрожжей (~ 0,5 мкм по сравнению с дрожжами, которые в 10 раз больше). Если мутность является результатом микробной инфекции, она должна быть заметна по вкусу. Бактерии намного меньше дрожжей и обычно имеют форму стержней. Однако не путайте стержнеобразные кристаллы (возможно, моногидрат оксалата кальция) с бактериями. Эти стержни, которые иногда находятся в осадке, примерно такие же, как дрожжевые клетки (см. Рис. 11).
Дрожжевая муть в конечном итоге прекратится. Белковая муть намного упрямее и займет много месяцев, чтобы осесть или нуждается в лечении с помощью оклеивающего агента, такого как желатин.
Приложение
Галерея разных изображений в микроскопии
Улучшенная сетка подсчета Нойбауэра
Рисунок 13 — улучшенная сетка подсчета Нойбауэра. 5 зеленых квадратов представляют собой сетки 4×4, которые обычно используются для подсчета дрожжевых клеток.
ОПРЕДЕЛЕНИЕ ЖИЗНЕСПОСОБНОСТИ И ФИЗИЧЕСКОЙ АКТИВНОСТИ ДРОЖЖЕВЫХ ГРИБОВ
- Авторы
- Руководители
- Файлы работы
- Наградные документы
Пахомова Н.В. 1
1Школа 197
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке «Файлы работы» в формате PDF
В первую очередь хотелось бы дать определение самой науки о дрожжах – зимологии. Казалось бы, все знают, что такое дрожжи, и этот вопрос весьма простой: без них не приготовить кислого теста, вина, пива. И все же дать научное определение дрожжам и четко очертить границы этой группы микроорганизмов становится все труднее по мере расширения наших знаний об этих микроскопических существах, которые включают в царство Mycota.
С помощью дрожжей получают большой спектр соединений, использующихся в разных областях человеческой деятельности. К ним относятся витамины, различные полисахариды, липиды, которые могут служить заменителями растительных масел, разнообразные ферменты, используемые в пищевой промышленности. Развитие генетической инженерии позволило использовать легко культивируемые дрожжи для получения многих полезных веществ животной и растительной природы, например, инсулина.
Цели: Выявить жизнеспособность и физическую активность дрожжевых грибов торговых сетей: Саф-Левюр, Саф-момент, Preston.
Задачи:
-
Определить физическую активность различных сухих дрожжевых грибов
-
Оценить жизнеспособность разновидностей дрожжевых грибов
-
Сравнить микробиологические качества дрожжей торговых марок: Саф-Левюр, Саф-момент, Preston.
Глава 1 Характеристика дрожжевых грибов
В этой главе речь пойдет о строении, компонентах, способах размножения, жизнедеятельности и физической активности дрожжевых грибов. Нами также будут рассмотрены пути использования дрожжей в промышленности и изучены проблемы их микробиологического качества.
1.1 Дрожжи как объект биологии
Дрожжи являются одноклеточными неподвижными микроорганизмами небольшого размера — 10-15 мкм., которые широко распространены в природе: они встречаются в почве, на листьях, плодах и стеблях растений, в пищевых субстратах растительного и животного происхождения [Пехташева, 2013].
Несмотря на одноклеточное строение, более сходное с крупными бактериями дрожжи по ультраструктурной организации клетки и способам бесполого и полового размножения относятся к грибам, а именно к микроскопическим грибам царства Mycota [Бабьева, Чернов, 2004].
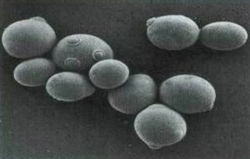
Дрожжевые клетки имеют разную форму: эллипсов, овалов, палочек, шаров (см. Рис. 2). Размерность также бывает разная: часто длина составляет 6-12 мкм, а ширина 2-8 мкм. Это зависит от условий культивирования, питательных компонентов, факторов внешней среды и условий их обитания. Стоит отметить, что «в диком состоянии дрожжи не известны» [Еленевский и др., 2005: 1259]
Во всех дрожжевых клетках содержится около 75% воды, на 50-60% — это связанная внутриклеточная, а остальные 10 — 30% — освобожденная. В сухом веществе клетки в зависимости от возраста и состояния в среднем содержится:
-
азот 45—60 %;
-
сахар 15—40 %;
-
жир 2,5—13 %;
-
минералы 7—11 %
-
помимо этого, клетки включают в себя ряд важных компонентов, необходимых для их метаболизма — ферменты, витамины [Microbac].
Дрожжевые организмы имеют все стандартные компоненты, присущие эукариотическим клеткам, однако, помимо этого, обладают уникальными отличительными свойствами грибов, а именно, сочетанием признаков как растительной, так и животной клеток:
-
стенки ригидны, как у растений;
-
отсутствие хлоропластов и наличие гликогена, как у животных.
Клетки содержат мембраны, цитоплазму, а также такие органоиды, как:
-
ядро;
-
Гольджи аппарат;
-
Митохондрии клеток;
-
рибосомный аппарат;
-
жировые включения, зерна гликогена, а также валютин [Бабьева, Чернов, 2004]. (см. Рис. 3)
Отдельные виды имеют в составе пигменты. У молодых дрожжей цитоплазма является гомогенной. В процессе роста внутри них появляются вакуоли (содержащие органические и минеральные компоненты). В процессе роста наблюдается образование зернистости, происходит увеличение вакуолей. Как правило, оболочки включают нескольких слоев с включенными полисахаридами, жирами и азотосодержащими компонентами. Некоторые из видов имеют ослизнелую оболочку, поэтому часто клетки склеены между собой и в жидкостях образовывают хлопья [Microbac].
Для дыхательных процессов дрожжевым клеткам нужен кислород, но стоит отметить, что многие их виды (факультативно-анаэробные) могут обходиться временно и без него и получать энергию от процессов брожения (бескислородное дыхание), образуя при этом спирты (см. Рис. 4).В этом заключается одно из главных их отличий от бактерий: среди дрожжей нет представителей, способных жить абсолютно без кислорода.«Спектр углеродных соединений, усваиваемых дрожжами за счет аэробного дыхания, значительно шире, чем в случае брожения» и способствует более быстрому росту клеток [Бабьева, Чернов, 2004: 61].
В бескислородных условиях для своего питания дрожжи предпочитают использовать такие углеводы, как гексоза и синтезированные из нее олигосахариды. Но некоторые виды могут усваивать и другие виды углеводов — пентозу, крахмал, инулин. При доступе кислорода они способны к потреблению жировых, углеводородных, спиртовых и других веществ. Многие дрожжи хемоорганогетеротрофны, и для того, чтобы получить энергию для питания и получения энергии используют органические питательные компоненты. К основным минеральным компонентам, необходимым для роста и размножения дрожжей, относятся азот, фосфор, калий, сера и магний, которые составляют основную массу золы [Меледина, Давыденко, Васильева, 2014].
Половое размножение — это сложная цепь событий, которая включает в себя контакт двух гаплоидных клеток, их слияние, образование диплоидной зиготы, ядро которой затем либо делится мейотически с восстановлением гаплоидного состояния, либо дает начало диплоидному поколению клеток (см. Рис. 5) Иными словами, половое размножение связано со сменой ядерных фаз. У дрожжей чередование ядерных фаз проходит вместе с образованием половых гаплоидных спор – аскоспор или базидиоспор. Полный жизненный цикл включает вегетативную стадию, в течение которой клетки размножаются при помощи митотического деления, и половой цикл, включающий мейотическое деление ядра. Отличительной особенностью дрожжевых клеток является их возможность вегетативно размножаться, при сравнении с остальными грибами, что происходит как от почкование спор или, например, зигот клеток (как, например, родов Candida или Pichia). Вегетативное размножение у дрожжей может происходить в любой фазе жизненного цикла. У дрожжей встречаются различные типы полового процесса. У большинства видов в половом процессе у дрожжей участвуют обычные соматические, то есть неспециализированные клетки. Такой тип полового процесса называется соматогамией. Существуют разновидности соматогамии:
-
гологамия — слияние (копуляция) двух морфологически сходных соматических клеток;
-
педогамия — слияние материнской и дочерней клетки-почки;
-
адельфогамия — слияние сестринских клеток-почек;
-
гаметангиогамия — копуляцию специальных клеток мицелия – гаметангиев [Бабьева, 1979].
Процессы роста дрожжевых организмов зависят от таких факторов внешней среды, как температура, влажность, кислотность, осмотическое давление. Большинство дрожжей предпочитают среднюю температуру, среди них практически нет видов-экстремофилов, которые предпочитают чересчур высокую или, напротив, низкую температуру. Известно существование видов, способных переносить неблагоприятные условия окружающей среды [Квасников, Щелокова, 1991].
Часто дрожжи применяются в домашнем хозяйстве или промышленности, например, при приготовлении хлеба и напитков. Они были первыми микроорганизмами, которые человек стал использовать из-за их способности к образованию довольно больших количеств спирта из сахара. Дрожжи также используют в биотехнологических процессах при производстве лекарственных веществ таких, как инсулин, интерферон, гетерологичные белки. Более подробно о хозяйственной ценности дрожжей речь пойдет в следующем параграфе.
1.2 Хозяйственная ценность хлебопекарных дрожжей
Сухие хлебопекарные дрожжи – биологический разрыхлитель теста в виде маленьких гранул серого цвета со специфическим запахом. Такие дрожжи используются при изготовлении хлебобулочных изделий, а также кондитерской продукции. Добавление сухих дрожжей в тесто позволяет в итоге получить сдобную выпечку [Кондитер клуб].
Так как прессованные дрожжи являются скоропортящимся продуктом, их консервируют путем высушивания. Срок годности сухих дрожжей составляет до 2 лет, если хранить их в сухом и прохладном месте. Благодаря такому сроку годности сухие хлебопекарные дрожжи больше подходят для домашнего использования, чем жидкие и прессованные, которые чаще используются в производстве. Сушеные дрожжи подразделяют на два основных типа: сухие высокоактивные и сухие высокоактивные «инстантные». Они отличаются способом подготовки перед внесением в тесто [Красникова, Кострова, 2001: 26].
В хлебопечении используют лишь два вида дрожжей сахаромицетов Sacсharomyces cerevisiae и Saccharomyces minor, более подробно речь о них будет идти во второй главе. Ценными производственными свойствами данных дрожжей являются подъемная сила (время, необходимое для подъема стандартного теста на высоту 70 мм от дна стандартной формочки), мальтазная и зимазная активность (время, затрачиваемое на выделение 10 мл СО2 при сбраживании 1 г мальтозы), осмочувствительность (т. е. «чувствительность к определенной концентрации сахара и хлорида натрия») [Красникова, Кострова, 2001: 15].
Согласно же М. П. Нейману, важнейшими свойствами хлебопекарных дрожжей должны быть: «хорошая сбраживаемость, следовательно — высокое содержание зимазы, определенная способность к размножению, достаточное содержание энзимов для расщепления углеводов и белка, стойкость против высоких температур и прочность» [Нейман, 1935: 152].
В отношении их внешних свойств прежде всего требуют, чтобы у дрожжей были хорошие и здоровые запах и вкус. Запах хороших прессованных дрожжей свеж и приятен, чуть-чуть кисловат; вкус мягкий и чистый. Далее дрожжи должны быть нежной, равномерной, матово-желтой или беловато-желтой окраски. Белый налет на поверхности куска дрожжей может происходить из-за заражения плесневыми дрожжами или же плесневым грибком Oidium. Дрожжи более темной желтой окраски заставляют предположить примесь пивных дрожжей. Белые изломы в ядре могут указывать на примесь различных старых, следовательно — с различной влажностью дрожжей. Голубовато-серая окраска дрожжей происходит из-за железистой воды, но может быть и свойством данной расы. Она не указывает на понижение подъемной силы; но при выпечке из хорошей муки она может оказать влияние на окраску корки [Нейман, 1935].
Консистенция дрожжей тоже играет роль при их внешней оценке. Они должны противостоять нажатию пальцем, должны давать «раковинный» излом и при разминании между пальцами не размазываться. Иначе перед нами будут старые или сильно загрязненные инфекцией дрожжи. Дрожжи, изготовленные воздушным способом, почти всегда остаются прочными; дрожжи, приготовленные по старому способу, часто становятся мягкими, точно также, как слишком рано собранные или слишком хорошо питавшиеся дрожжи [Нейман, 1935].
В следующем параграфе речь пойдет о проблемах микробиологического качества дрожжей и о требованиях к продовольственной и микробиологической безопасности продукции в хлебопекарной промышленности.
1.3 Проблемы микробиологического качества дрожжей, используемых в промышленности
В современных условиях развития хлебопекарной промышленности возросли требованиями к продовольственной и микробиологической безопасности продукции, а соответственно актуальной проблемой стало качество хлебобулочных изделий.
Для решения проблемы качества хлебобулочных изделий в последние годы разработаны новые технологии, в том числе:
-
интенсивная «холодная» технология изготовления хлебобулочных изделий из пшеничной муки, с применением взаимоувязанных элементов — интенсивного замеса теста, ферментативно-активных или активированных дрожжей, комплексных улучшителей, пониженной температуры теста и др. Используется в основном на предприятиях малой мощности (пекарня) и отдельных хлебозаводах с 1 и 2-х сменным режимом работы;
-
технологии на заквасках с направленным культивированием микроорганизмов, в основу которых положены оптимизация микробиологического состава с продуцированием в заквасках витаминов, антибиотиков, органических кислот и других БАД;
-
комплексные технологии изготовления хлебобулочных изделий из муки с пониженными свойствами, пониженным содержанием и качеством клейковины, повышенной или пониженной ферментативной активностью, повышенной микробиологической загрязненностью и др.;
-
технологии изготовления хлебобулочных изделий в зонах экологического неблагополучия, условиях жаркого климата, с удлиненными сроками хранения и др [Мовсарова, 2006].
Эффективность указанных технологий в значительной степени определяется биотехнологическими свойствами используемых хлебопекарных дрожжей [Поландова и др., 2004].
Глава 2 Объекты и методы исследования
В данной главе речь пойдет о дрожжах вида Saccharomy cescerevisiae, а также о методах их исследования.
2.1 Общая характеристика дрожжей вида Saccharomycescerevisiae
Род сахарные грибы, или сахаромицеты (Saccharomyces), объединяет как природные виды, так и «культурные» (производственные), существование которых тесно связано со всей историей бродильной промышленности. Наиболее общим признаком всех дрожжей этого рода является их способность к активному сбраживанию сахаров с образованием наибольшего, по сравнению с другими дрожжами, количества спирта (от 10 до 19% по объему). Сюда входят пивные, винные и пекарские дрожжи [Федоров, 1974].
Родовое название Saccharomyces принято сокращать до Sacch. В настоящее время в пределах названных видов получено большое количество штаммов, обладающих рядом особенностей. Например, получены штаммы, устойчивые к заражению вирусами, штаммы способные к слипанию в конце процесса (флоккулирующие штаммы), штаммы, уничтожающие виды диких дрожжей, которые загрязняют производственный процесс, и т.п [Федоров, 1974].
Морфологически все виды этого рода довольно сходны: они имеют сферические и овальные клетки, размножающиеся вегетативно почкованием. Клетки дрожжей данного вида имеют овальную, округлую, яйцевидную или слегка удлиненную форму размером (5…6) (10…14) мкм. Иногда в цитоплазме встречаются одно-два зернышка полифосфатов. В более зрелых клетках оболочка утолщается, цитоплазма становится зернистой, число и размеры вакуолей увеличиваются. При старении культуры в цитоплазме клеток появляются капли жира в виде круглых, резко преломляющих свет блестящих включений [Красникова, Кострова, 2001].
Клетки Saccharomyces cerevisiae размножаются вегетативным образом при помощи почкования. Сначала появляется вырост на материнской клетке, затем происходит митотическое деление ядра, образование клеточной стенки и отделение клеток друг от друга. На материнской клетке остается шрам от почкования, что позволяет определить её возраст. Обычно материнская клетка может образовывать 20—30 почек [Федоров, 1974].
Saccharomycescerevisiae — один из наиболее изученных модельных организмов, на примере которого происходит исследование клеток эукариотов, они легко выращиваются и не являются патогенными для человеческого организма. По сравнению с кишечной палочкой (Escherichia coli), клетка дрожжей содержит в несколько раз больше ДНК и имеет более сложную организацию, чем бактерии. Клетки сохраняют жизнеспособность даже с множественными генетическими маркерами в своем генотипе, что существенно с точки зрения генной инженерии [Федоров, 1974].
2.2 Методика учета физиологической активности (почкования) методом раздавления капли
Раздавленная капля — это метод приготовления препаратов для микроскопического изучения живых объектов. Применяется при исследовании бактерий, клеток культуры тканей, простейших, ряда водорослей и других мелких организмов. Этот метод мы применяем для выявления подвижности клеток микроорганизмов.
Наибольшее распространение получил метод выявления мертвых клеток с помощью метиленового синего. После попадания в клеточную цитоплазму под действием ферментов редуктаз этот краситель восстанавливается живыми дрожжевыми клетками до бесцветных соединений. Мертвые клетки окрашиваются в синий цвет. Эффективность данного метода зависит не только от состояния клеточной мембраны, но и от активности оксидоредуктаз в клетке.
Приборы и посуда:
микроскоп;
предметные и покровные стекла;
тонкая стеклянная палочка.
Реактивы:
метиленовая синь.
Материалы:
суспензия дрожжей концентрацией около 107 клеток/мл.
2.3 Методика определения жизнеспособности дрожжевых клеток методом витального окрашивания метиленом синим
Витальное окрашивание — метод окрашивания организмов или живых препаратов их тканей для повышения контраста при наблюдении под микроскопом.
Красители, пригодные для прижизненного окрашивания, называются витальными. В отличие от многих других красителей, используемых в микроскопировании, они обладают двумя дополнительными свойствами: имеют низкую токсичность и обладают способностью легко проникать в живые клетки и их структуры через клеточные оболочки и цитоплазматические мембраны.
Метиленовый синий — используется для витального окрашивания простейших, изолированных клеток, культур тканей, тонких плёнок живых тканей. Используется раствор 1:1000 — 1:10 000. В ботанике используется для окраски вакуолей, накапливаясь в клетках, содержащих дубильные вещества. Может использоваться для окраски митохондрий(см. Рис. 7).
Глава 3 Экспериментальная часть
В настоящее время российский рынок сушеных хлебопекарных дрожжей представлен большим числом торговых марок разных стран: Франции, Финляндии, Турции, Швеции, Англии и др.
Для эксперимента нами были выбраны сухие дрожжи трех производителей «Саф-момент» (Франция), «Саф-левюр» (Россия) и «Preston» (Россия).
3.1 Оценка физической активности некоторых хлебопекарных дрожжей разных торговых сетей: Саф-Левюр, Саф-момент, Preston.
Для определения количества мертвых клеток на предметное стекло наносят по одной капле нефильтрованной дрожжевой суспензии и раствора метиленовой сини (1:5000). Каплю закрывают покровным стеклом, излишек жидкости собирают листком фильтровальной бумаги и через 2 мин наблюдают окрашенный препарат с помощью микроскопа. В поле зрения микроскопа считают общее количество дрожжевых клеток, затем только синие, после чего препарат передвигают и подсчет ведут в новом поле зрения. Таким образом подсчитывают общее количество клеток в трех полях зрения.
|
Вариант |
Степень почкования |
|
Саф-Левюр |
|
|
1 |
2 |
|
2 |
1 |
|
3 |
3 |
|
Саф-Момент |
|
|
1 |
3 |
|
2 |
1 |
|
3 |
1 |
|
Preston |
|
|
1 |
1 |
|
2 |
1 |
|
3 |
0 |
1 — мало почкуются, 2 — слабо, 3 – активно, 0 — не почкуются.
Таблица №1
3.2 Определение жизнеспособности дрожжевых клеток в составе хлебопекарных дрожжей разных торговых сетей:Саф-Левюр, Саф-момент, Preston.
Для эксперимента мы сделали три суспензии дрожжей разных производителей (см. Рис. 8). С помощью микробиологического препарата «раздавленная капля» нам удалось определить численность дрожжевых клеток каждого вида в трех полях зрения. Для точности мы так же подсчитали среднее значение трех полей.
|
Вариант |
Общее количество клеток |
Число живых клеток |
Процент |
Средняя оценка |
|
Саф-Левюр |
||||
|
1 |
42 |
18 |
43 |
47 |
|
2 |
40 |
20 |
50 |
|
|
3 |
39 |
19 |
49 |
|
|
Саф-момент |
||||
|
1 |
33 |
10 |
60 |
42 |
|
2 |
35 |
12 |
34 |
|
|
3 |
34 |
11 |
32 |
|
|
Preston |
||||
|
1 |
28 |
7 |
25 |
27 |
|
2 |
25 |
6 |
24 |
|
|
3 |
29 |
9 |
31 |
Таблица №2
Исходя из этих данных, мы видим, что дрожжи «Саф-левюр» в отношении численного состава содержат больше всего дрожжевых клеток.
3.3 Оценка почкованиядрожжевых клеток в составе хлебопекарных дрожжей разных торговых сетей: Саф-Левюр, Саф-момент, Preston.
Диаграмма №1
По данным таблицы, мы видим, что у дрожжей Саф-Левюр (2,0 условных единиц) наибольшая физическая активность в отношении почкования. А у марки Preston (1,0 условных единиц) данные намного ниже.
Выводы
-
В результате наших исследований показано, что наибольшая физическая активность в отношении почкования наблюдается у дрожжей Саф-Левюр (2,0 условных единиц). Гораздо ниже данные с дрожжами марки Preston (1,0 условных единиц).
-
Оценка средней жизнеспособности дрожжевых клеток показало, что наибольший процент жизнеспособности отмечен нами в марке Саф-Левюр(47%) и Саф-момент(42%),по сравнению с маркой Preston(27%).
-
Сравнивая микробиологическую активность и жизнеспособность клетки, можно прийти к выводу, что дрожжевые клетки марок Саф-Левюр и Саф-момент отвечают большему микробиологическому качеству, по сравнению с исследованной нами маркой Preston.
-
Таким образом, наиболее микробиологическим качественными являются дрожжевые клетки марки Саф-Левюр, обладающие значительной процентной долей клеток и наибольшей отзывчивостью к повышению температуры и добавлению сахара в среду (2 из 3 балов). Такие отличия можно объяснить, как индивидуальными особенностями данной марки, так и технологическими условиями их производства.
Список использованной литературы
-
Бабьева И. П., Голубев В. И. Методы выделения и идентификации дрожжей. Справ, пособие. М.: Пищевая промышленность, 1979. 120 с.
-
Бабьева И. П., Чернов И. Ю. Биология дрожжей. М.: Т−во науч. изд. КМК, 2004 г. 221 c.
-
Еленевский А. Г. и др. Учебный справочник школьника // Биология. М.: Дрофа, 2005 г. 1695 c.
-
Квасников Е. И., Щелокова И. Ф. Дрожжи. Биология. Пути использования. Киев: Наукова Думка, 1991 г. 328 c.
-
Кондитер клуб: Энциклопедия кондитера // Дрожжи сухие хлебопекарные. [Электронный ресурс]. URL: http://www.konditer-club.ru/encyclopedia /suhie_hlebopekarnye_drozhzhi.htm (дата обращения: 23.04.2017)
-
Красникова Л. В., Кострова И. Е. Микробиология хлебопекарного, кондитерского и макаронного производств: Учеб. пособие. СПб.: СПбГУНиПТ, 2001. 81 с.
-
Меледина Т. В., Давыденко С. Г., Васильева Л. М. Физиологическое состояние дрожжей: Учеб. пособие. СПб.: НИУ ИТМО; ИХиБТ, 2013. 48 с.
-
Мовсарова З. Х. Повышение качества хлебобулочных изделий на основе регулирования биотехнологических свойств дрожжей: Дис. … к. пед. н. Москва, 2006. 161 с.
-
Нейман М. П. Зерно и хлеб / Под ред. Сарычева Б. Г., Журавлева Н. Н. Ленинград: Снабтехиздат, 1935 г. 556 c.
-
Пехташева Е. Л. Биоповреждения непродовольственных товаров: Учебник для бакалавров / Под ред. проф. А. Н Неверова. М.: Издательско-торговая корпорация «Дашков и К», 2013. 332 с.
-
Поландова Р.Д., Козюкина О.Ю., Еркинбаева Р.К. Технология хлебобулочных изделий с удлиненными сроками // Хлебопечение России №5, 2004. C. 16-17.
-
Федоров А. А. Жизнь растений: в 6—ти томах / Под редакцией А. Л. Тахтаджяна. М.: Просвещение,1974.
-
Microbac: Строение и жизнедеятельность дрожжей. [Электронный ресурс]. URL: http://microbak.ru/obshhaya-xarakteristika-mikrobov /gribi/drozhzhi.html (дата обращения: 22.04.2017)
Приложение
Рис. 1. Разнообразие видов дрожжей: 1 — пекарские (Saccharomyces cerevisiae); 2 — мечниковия прекраснейшая (Metschnikowia pulcherrima); 3 — кандида земляная (Candida humicola); 4 — родоторула клейкая (Rhodotorula glutinis); 5 — родоторула красная (R. rubra); 6 — родоторула золотистая (R. aurantiaca); 7 — дебариомицес Кантарелли (Debaryomyces cantarelli); 8 — криптококк Лавра (Cryptococcus laurentii); 9 — надсония продолговатая (Nadsonia elongata); 10 — спороболомицес розовый (Sporobolomyces roseus); 11 — спороболомицес хольсатикус (S. holsaticus); 12 — родоспоридиум диобоватум (Rhodosporidium diobovatum).
Рис. 2 Строение клетки дрожжей
Рис. 3 Клетки дрожжевых организмов под микроскопом
Рис. 4 Дыхательные процессы дрожжей
Рис. 5 Процессы размножения дрожжей
Рис. 6 Методика учета физиологической активности (почкования) методом раздавления капли
-
Саф-Левюр
-
Саф-момент
-
Preston
*фотография автора
Рис. 7 Методика определения жизнеспособности дрожжевых клеток методом витального окрашивания метиленом синим
*фотография автора
Рис. 8 Хлебопекарные дрожжи разных торговых сетей под микроскопом:
1. Саф-Левюр
2. Саф-момент
3. Preston
*фотография автора
Просмотров работы: 1739