Содержание
-
Структурная формула
-
Русское название
-
Английское название
-
Латинское название
-
Химическое название
-
Брутто формула
-
Фармакологическая группа вещества Оротовая кислота
-
Нозологическая классификация
-
Код CAS
-
Фармакологическое действие
-
Характеристика
-
Фармакология
-
Применение вещества Оротовая кислота
-
Противопоказания
-
Применение при беременности и кормлении грудью
-
Побочные действия вещества Оротовая кислота
-
Взаимодействие
-
Способ применения и дозы
-
Торговые названия с действующим веществом Оротовая кислота
Структурная формула
Русское название
Оротовая кислота
Английское название
Orotic acid
Латинское название
Acidum oroticum (род. Acidi orotici)
Химическое название
1,2,3,6-Тетрагидро-2,6-диоксо-4-пиримидинкарбоновая кислота (и виде кальциевой, калиевой или магниевой соли или моногидрата)
Брутто формула
C5H4N2O4
Фармакологическая группа вещества Оротовая кислота
Нозологическая классификация
Список кодов МКБ-10
-
B19 Вирусный гепатит неуточненный
-
D64.9 Анемия неуточненная
-
E46 Белково-энергетическая недостаточность неуточненная
-
E63 Физические и умственные перегрузки
-
E78.5 Гиперлипидемия неуточненная
-
G71.0 Мышечная дистрофия
-
I20 Стенокардия [грудная жаба]
-
I21 Острый инфаркт миокарда
-
I49.8 Другие уточненные нарушения сердечного ритма
-
I50.0 Застойная сердечная недостаточность
-
I51.5 Дегенерация миокарда
-
I70 Атеросклероз
-
I73.9 Болезнь периферических сосудов неуточненная
-
K71 Токсическое поражение печени
-
K76.9 Болезнь печени неуточненная
-
K83.9 Болезнь желчевыводящих путей неуточненная
-
L30.9 Дерматит неуточненный
Код CAS
65-86-1
Фармакологическое действие
—
анаболическое, стимулирующее регенерацию.
Характеристика
Белый кристаллический порошок без запаха. Очень мало растворим в воде, трудно — в кипящей воде; практически не растворим в этиловом спирте, метиловом спирте, хлороформе; легко растворим в растворе натрия гидроксида.
Фармакология
Обеспечивает синтез пиримидиновых нуклеотидов, входящих в состав нуклеиновых кислот, участвующих в образовании белковых молекул. Всасывание из ЖКТ низкое (10%). Метаболизируется в печени с образованием оротидин-5-фосфата. Выводится почками (30% в виде метаболитов).
Применение вещества Оротовая кислота
В составе комбинированной терапии ИБС (в т.ч. стенокардия, инфаркт миокарда), хронической сердечной недостаточности и нарушениях ритма сердца (в т.ч. магнийзависимая аритмия, мерцательная аритмия); в качестве вспомогательного средства при заболеваниях печени (в т.ч. гепатит, гепатоз) и желчевыводящих путей (вызванных острой и хронической интоксикацией, за исключением органических поражений печени и желчевыводящих путей), алиментарная и алиментарно-инфекционная дистрофия у детей, спастические состояния (в т.ч. ангиоспазм), атеросклероз, гиперлипидемия, миокардиодистрофия, анемия, дерматозы, прогрессирующая мышечная дистрофия, повышенные физические нагрузки.
Противопоказания
Гиперчувствительность, острые и хронические органические поражения печени, в т.ч. цирроз печени с асцитом, нефроуролитиаз, почечная недостаточность.
Применение при беременности и кормлении грудью
С осторожностью при беременности и кормлении грудью.
Побочные действия вещества Оротовая кислота
Диспептические явления, неустойчивый стул, диарея; аллергические реакции (в т.ч. кожная сыпь, аллергический дерматит). При применении в высоких дозах — гепатодистрофия (на фоне малобелковой диеты).
Взаимодействие
Затрудняет усвоение железа, тетрациклинов, натрия фторида (интервал между приемом ЛС — не менее 2–3 ч). Всасывание снижают вяжущие и обволакивающие средства. Пероральные контрацептивы, диуретики, миорелаксанты, глюкокортикоиды, инсулин снижают эффективность оротовой кислоты. Калия оротат снижает токсичность сердечных гликозидов.
Способ применения и дозы
Внутрь, за 1 ч до или через 4 ч после еды. Взрослым — 0,5–1,5 г/сут (по 0,25–0,5 г 2–3 раза в день). Курс лечения — 20–40 дней. При необходимости курс повторяют через 1 мес. Детям — по 10–20 мг/кг/сут (за 2–3 приема) в течение 3–5 дней.
Торговые названия с действующим веществом Оротовая кислота
| Торговое название | Цена за упаковку, руб. |
|---|---|
| Калия оротат |
от 63.00 до 448.00 |
Химическое название
1,2,3,6-Тетрагидро-2,6-диоксо-4-пиримидинкарбоновая кислота. В лекарственных препаратах средство находится в виде кальциевой, магниевой или калиевой соли или моногидрата.
Химические свойства
Оротовая кислота по внешнему виду — это белый порошок, кристаллической структуры без специфического запаха и цвета. Он плохо растворяется в воде, трудно – в кипящей жидкости. Вещество нерастворимо в метиловом, этиловом спирте, хлороформе, хорошо растворяется в р-ре гидроксида натрия. Гетероциклическое соединение разрушает при воздействии яркого света. Молекулярная масса средства = 156,1 грамма на моль.
Это витаминоподобное вещество, которое оказывает влияние на обменные процессы и стимулирует рост живых организмов, но не обладает св-ми витаминов. Кислоту открыли в 1904 году, вещество выделили из коровьего молока. Она была обнаружена в составе человеческого молока и названа витамином B13. К сожалению Оротовая кислота не синтезируется микрофлорой человека (желудка) и поэтому ее относят к витаминоподобным веществам.
Средство находится в пищевых продуктах и поступает в организм с минералами и слаборастворимыми в воде соединениями. Благотворно влияет на работу печени, ЖКТ, сердечной мышцы, белковый обмен, сосудов и мышц. Активно применяется Оротовая кислота в косметологии. Считается, что она симулирует обменные процессы, протекающие в коже, активирует синтез нуклеиновых кислот и белка.
Средство выпускают в виде солей, в таблетках по 100 и 500 мг и гранулах.
Фармакологическое действие
Анаболическое.
Фармакодинамика и фармакокинетика
Витаминоподобное вещество Оротовая кислота принимает активное участие в синтезе пиримидиновых нуклеотидов, составной части нуклеиновых кислот, из которых дальше образуются молекул белка. Вещество оказывает влияние на процессы регенерации клеток печени, снижает риск возникновения ожирения печени, снижает уровень холестерина в крови, благотворно влияет на работу сердца, репродуктивной системы, мышц и сосудов.
Средство, после приема внутрь, всасывается в ЖКТ, но не полностью, в кровь попадает приблизительно десятая доля от принятой дозы. Метаболизируется средство в печени, образуется метаболит оротидин-5-фосфат. Порядка 30% вещества подвергается процессам метаболизма и выводится с помощью почек.
Показания к применению
Лекарство назначают:
- в рамках проведения комплексной терапии при стенокардии, инфаркте миокарда, аритмии (мерцательная, из-за недостатка магния), хронической сердечной недостаточности;
- в качестве дополнительного средства при гепатозе, гепатите и других болезнях печени;
- при лечении заболеваний желчевыводящих путей, при острой и хронической интоксикации;
- для лечения алиментарной и алиментарно-инфекционной дистрофии в детском возрасте;
- при атеросклерозе, ангиоспазме, гиперлипидемии;
- в составе комплексного лечения миокардиодистрофии, дерматозов;
- при прогрессирующей мышечной дистрофии, анемии;
- в качестве общеукрепляющего средства при повышенных физических нагрузках, в период реконвалесценции.
Противопоказания
Оротовая кислота противопоказана к приему:
- при аллергии на действующее вещество;
- пациентам с острыми и хроническими заболеваниями печени, при циррозе с асцитом, нефроуролитиазе;
- при почечной недостаточности.
Побочные действия
Средство обычно хорошо переносится пациентами. Тем не менее иногда, особенно при приеме больших доз Оротовой кислоты могут наблюдаться:
- диарея, несварение желудка, дистрофия печени (при малобелковой диете);
- различные аллергические реакции, высыпания на коже и крапивница.
Оротовая кислота, инструкция по применению (Способ и дозировка)
Лекарство назначают внутрь. За час или спустя 4 часа после приема пищи.
Суточная дозировка для взрослых составляет 0,5-1,5 грамм в сутки. Дозировку разделяют на несколько приемов (2-3). Продолжительность лечения – от 3 недель до 40 дней. Курс можно пройти повторно через один месяц.
Детям назначают от 10 до 20 мг на кг в сутки, за 2-3 раза. Продолжительность приема составляет от 3 до 5 дней.
Передозировка
Нет сведений о передозировке препаратом.
Взаимодействие
Препараты, обволакивающие ЖКТ и обладающие вяжущими свойствами замедляют всасывание данного вещества.
Эффективность средства снижается при сочетанном приеме с пероральными контрацептивами, диуретиками, миорелаксантами, инсулином, глюкокортикостероидами.
Оротат калия (соль оротовой кислоты) снижает токсическое воздействие сердечных гликозидов.
Оротовая кислота при приеме с препаратами железа, тетрациклинами, фторидом натрия (если промежуток между приемами составляет менее 3 часов) замедляет всасывание лек. средств.
Условия продажи
Без рецепта.
Срок годности
Препараты на основе данного вещества хранятся в течение 4 лет.
Особые указания
В настоящее время широкое распространение получила комбинация Оротовой кислоты с препаратами магния для лечения болезней сердечно-сосудистой системы.
Детям
При назначении препарата детям нужно провести коррекцию дозировки.
При беременности и лактации
Лекарство назначают при беременности в период лактации, однако, с осторожностью.
Препараты, в которых содержится (Аналоги)
Магния оротат, Оротат калия, таблетки Оротата калия 0,5 грамм.
Отзывы
Отзывы о применении Оротовой кислоты оставляют в основном спортсмены, которые используют ее в сочетании с прочими препаратами и пациенты с сердечными заболеваниями (вещество назначают в комбинации с магнием). Отзывы в основном положительные. Из побочных реакций, чаще всего жалуются на несварение желудка, жидкий стул. Аллергические реакции возникают редко и не требуют назначения антигистаминных препаратов. После прекращения приема лекарства аллергия проходит самостоятельно.
Цена, где купить
Стоимость таблеток Калия оротат по 0,5 грамм составляет приблизительно 70 рублей за 10 штук.
Фармакологическое действие
Негормональное анаболическое средство. Оказывает общее стимулирующее действие на обменные процессы. Является стимулятором синтеза нуклеиновых кислот, участвующих в синтезе белка, усиливает репаративные и регенеративные процессы в тканях. Оротовая кислота усиливает образование альбуминов в печени (особенно в условиях длительной гипоксии), повышает аппетит, обладает диуретическим, регенерирующим свойствами. Улучшает переносимость сердечных гликозидов.
Фармакокинетика
При приеме внутрь в ЖКТ абсорбируется 10% принятой дозы. Превращается в печени в оротидин-5-фосфат. Выводится почками (30% — в виде различных метаболитов).
Показания активного вещества
ОРОТОВАЯ КИСЛОТА
В качестве вспомогательного средства при заболеваниях печени и желчных путей (вызванных острой и хронической интоксикацией, за исключением органических поражений печени и желчевыводящих путей).
В составе комбинированной терапии хронической сердечной недостаточности и нарушениях ритма сердца, алиментарной и алиментарно-инфекционной гипотрофии у детей, при хроническом физическом перенапряжении.
Режим дозирования
Внутрь. Дозу и схему применения, длительность терапии определяют индивидуально, в зависимости от показаний, клинической ситуации и возраста пациента. Детям дозу устанавливают из расчета на массу тела.
Побочное действие
Возможно: аллергические кожные реакции, тошнота, рвота. При применении в высоких дозах на фоне малобелковой диеты возможно развитие дистрофии печени.
Противопоказания к применению
Повышенная чувствительность к оротовой кислоте; острое и хроническое органическое поражение печени, асцит, нефроуролитиаз, почечная недостаточность; детский возраст до 3 лет.
Применение при беременности и кормлении грудью
Следует применять с осторожностью при беременности и в период грудного вскармливания.
Применение при нарушениях функции печени
Противопоказан к применению при острых и хронических органических поражениях печени, асците.
Применение при нарушениях функции почек
Противопоказан к применению у пациентов с почечной недостаточностью.
Применение у детей
Противопоказано применение у детей в возрасте до 3 лет.
Особые указания
В период применения оротовый кислоты рекомендуют соблюдение диеты (стол № 5).
Эффективность оротовой кислоты повышается при комбинации с препаратами магния.
Лекарственное взаимодействие
При одновременном применении с диуретиками, ГКС, инсулином, миорелаксантами, пероральными контрацептивами уменьшается эффективность оротовой кислоты.
При одновременном применении оротовая кислота нарушает усвоение железа, тетрациклина, натрия фторида.
При одновременном применении оротовая кислота несколько снижает токсичность сердечных гликозидов.
Вяжущие и обволакивающие средства могут несколько снизить всасывание оротовой кислоты.
Оротовая кислота затрудняет усвоение железа, тетрациклина, натрия фторида — интервал между их приемом должен составлять не менее 2-3 ч.

Витаминоподобное вещество улучшает сокращение миокарда, функции печени, стимулирует рост клеток и образование белка. Помимо этого, оротовая кислота снижает уровень холестерина, участвует в выработке метионина, метаболизме цианокобаламина, трансформации фолиевой, пантотеновой кислот, влияет на протекание обменных процессов в организме.
Структурная формула соединения – C5H4N2O4.
Общие сведения
Сегодня выделяют 2 теории появления оротовой кислоты. Согласно первой, витаминоподобное вещество в 1904 году открыли ученые Biscaro и Belloni, а через год соединение было выделено из коровьего молока. На основании второй теории можно утверждать, что впервые новый ростковый фактор появился из отходов винокуренного производства и изначально имел название ДДС. Позднее нутриент переименован в витамин В13.
Содержание:
- Общие сведения
- Значение витамина В13 для организма человека
- Показания и противопоказания
- Инструкция по применению
- Лечебное использование
- Источники оротовой кислоты
- Вывод
В ходе исследований ученые обнаружили вещество в молоке животных и молозиве женщины (до 90 % сывороточных белков), которое выделяется в первые 3-5 дней после рождения малыша.
Оротовая кислота (или 2,6-диоксипиримидин-4-карбоновая-6 или урацил-4-карбоновая) – водорастворимое соединение, которое разрушается под воздействием света, высоких температур и может вырабатываться в кишечнике человека самостоятельно, благодаря деятельности полезных бактерий. Вещество представляет собой производную пиримидиновых оснований.
Молекулярный вес витамина В13 – 156,10 грамм/моль. Температура плавления кристаллов достигает 346 градусов.
Урацил-карбоновая кислота хорошо растворяется в горячей воде (при температуре 60 градусов и более) и в щелочах. При охлаждении жидкости до 18 градусов, в органических растворителях и кислотах, растворимость соединения падает до 0,2 %. В чистом виде порошок не имеет запаха.
Витаминоподобное вещество интенсивно поглощает УФ лучи, имеет выраженные кислотные свойства, образуя соли с металлами.
Учитывая тот факт, что в чистом виде В13 плохо всасывается в организме человека, в медицинских целях принято использовать калия оротат (калиевую соль оротовой кислоты).
Фармакокинетический профиль урацил-карбонового вещества обладает низкими уровнями практически всех показателей. А именно, при пероральном приеме в организме человека адсорбируется 10 % от принятой дозы. При первичном прохождении в печени, витамин подвергается сильнейшим метаболическим изменениям, в результате которых образуется оротидин-5-фосфата и пулы метаболитов. Оротовая кислота секретируется в желчь печенью и выводится через почки с мочой (больше 30 % всосавшегося количества витамина В13).
В урине человека содержание витаминоподобного соединения достигает 76-110 единиц на миллилитр.
Значение витамина В13 для организма человека

- Обменные процессы. Витаминоподобное соединение участвует в синтезе пиримидиновых нуклеотидов в печени. Благоприятное воздействие вещества на активность ферментов, азотистый обмен и трансляцию белка объясняется его участием в обмене нуклеиновых кислот. Помимо этого, витамин В13 связан с синтезом лецитина, фосфолипидов, билирубина, стимулирует выработку ферментов для углеводного обмена.
- Процесс роста. В результате проведенных опытов на животных, ученые пришли к выводу, что соединение усиливает рост клеток. Недостаточность фактора животного белка (так изначально называли оротовую кислоту) в рационе подопытных зверей привело к тому, что самки начали производить неполноценное потомство, особенно второй генерации. Появившиеся на свет молодые особи плохо росли и массово гибли, в частности в период лактации. Добавление витамина В13 в ежедневное меню способствовало нормализации роста животных, а также повышению выживаемости потомства.
- Энзимная активность. С целью определения связи между урацил-карбоновой кислотой и цианокобаламином в конце XX столетия был проведен эксперимент на крысах, который засвидетельствовал, что при дефиците В12 ферментативная активность печени падает (глюкозо-6-фосфатазы, цитохромоксидазы, трансметилазы, ксантиноксидазы) и значительно снижается рост клеток. А при поступлении витамина в организм подопытных, нормализуется выработка белковых молекул. В процессе исследования оротовой кислоты оказалось, что она усиливает энзимную активность аминокислот. Так у крыс, находящихся на диете с высоким содержанием галактозы, выработка органических соединений снижалась более чем в 2 раза.
- Патологическое состояние печени. В результате многочисленных исследований ученый Schwietzer установил, что витаминоподобное вещество В13 тормозит развитие токсического заболевания железы, клиническая картина которого напоминает цирроз. Прогрессирование болезни обусловлено гелиотропином и тиоацетамидом. При введении оротовой кислоты количество пуринов в организме возрастает, что облегчает процесс построения нуклеиновых кислот. Помимо этого, соединение замедляет жировую инфильтрацию печени, усиливает выделение желчи и ускоряет процесс регенерации гепатоцитов.
- Лучевая интоксикация. Чтобы определить, как влияет витамин B13 на живые организмы, группа ученых провела эксперимент на животных. Подопытных зверей разделили на 2 категории. На протяжении 10 дней в рацион первой группы вводили калиевую соль урацил-4-карбоновой кислоты из расчета 100 миллиграмм вещества на килограмм массы тела, вторая – не получала данный нутриент и являлась контрольной группой. После завершения эксперимента животные подвергались интенсивному облучению (2000 грей). В группе, употреблявшей соединение, выживаемость составила 119 часов, в контрольной – 4 часа 20 минут. Таким образом, регулярное употребление оротовой кислоты при лучевой интоксикации в профилактических дозах, удлинило жизнь подопытных на 16 дней. Результаты эксперимента свидетельствуют, что витаминоподобное вещество можно использовать как защитное средство против ионизирующей радиации.
Помимо обозначенных свойств, урацил-4-карбоновая кислота выполняет следующие функции в организме человека:
- предупреждает сужение просвета кровеносных сосудов из-за появления атеросклеротических бляшек и, как следствие, развитие атеросклероза;
- участвует в обменных процессах белков и фосфолипидов;
- участвует в метаболизме цианокобаламина (витамин В12), фолиевой и пантотеновой кислот;
- участвует в синтезе и поддержании резервов аденозинтрифосфата, в синтезе аминокислоты метионина и утилизации глюкозы;
- способствует правильному протеканию анаболических процессов, стимулирует рост мускулатуры (синтез рибонуклеиновой кислоты) и активирует сократительные возможности мышечных тканей;
- улучшает сокращение миокарда;
- стимулирует репродуктивную функцию.
Основное действие оротовой кислоты заключается в участии в синтезе составных частиц ДНК и РНК – пиримидиновых нуклеотидов.
Показания и противопоказания

- мышечная дистрофия;
- анемии;
- нефропатия;
- дерматозы, псориаз, ихтиоз, экземы, нейродермит;
- атеросклероз;
- заболеваний печени (гепатит, гепатоз) – ускоряет регенерацию гепатоцитов (печеночных клеток);
- болезни желчевыводящих путей;
- хроническая сердечная недостаточность, ишемическая болезнь сердца, инфаркт миокарда, стенокардия, миокардиодистрофия, аритмия;
- гиперлипидемия.
Сегодня оротовая кислота используется в лечебной терапии при подагре, поскольку подавляет образование мочевой кислоты.
Показания к дополнительному применению витамина В13:
- склонность к выкидышам;
- авитаминоз;
- скудность рациона на мясные, молочные продукты;
- для стимулирования анаболических процессов;
- послеоперационный период;
- заболевания ЖКТ, в результате чего ухудшается всасывание соединения;
- чрезмерные физические нагрузки;
- период реконвалесценции.
Противопоказания к использованию витаминного соединения:
- гиперчувствительность к веществу (непереносимость);
- острые или хронические поражения печени (цирроз с асцитом);
- почечная недостаточность;
- нефроуролитиаз.
В период беременности и кормления ребенка грудью перед началом приема витамина В13 нужно проконсультироваться с врачом.
Инструкция по применению

- для младенцев до полугода – 0,125 – 0,25 грамм;
- для детей от 6 месяцев до 3 лет – 0,25 – 0,5 грамм;
- для детей от 3 до 8 лет – 0,5 – 1 грамм;
- для взрослого человека – 0,5 – 2 грамма;
- для беременных – 2,8 – 3,2 грамма;
- для кормящих мам – 3 – 3,3 грамма;
- для спортсменов – 5 грамм.
В фармацевтической промышленности витаминоподобное соединение представлено в виде пищевых добавок – оротата калия, оротата магния.
Гиповитаминоз и гипервитаминоз
Нехватка витамина В13 в организме не ведет к необратимым нарушениям биохимических реакций.
Характерные симптомы недостаточности соединения:
- замедление набора веса;
- ухудшение состояния кожи (сыпь, появление дерматитов, псориаза);
- отставание в росте;
- торможение анаболических процессов.
Все признаки дефицита оротовой кислоты в организме до конца еще не определены. На сегодня ученые пришли к выводу, что явные симптомы недостаточности соединения встречаются крайне редко, поскольку в большинстве случаев, наблюдается перестройка метаболических процессов, в результате которых витамины группы В берут на себя функцию В13.
Избыток оротовой кислоты в организме человека появляется из-за неконтролируемого приема лекарственных препаратов, содержащих полезное вещество в большом количестве.
Передозировка витамина В13 (свыше 15 грамм) негативно влияет на жировой обмен печени.
В результате проведенных исследований на экспериментальных животных (крысах), ученые обнаружили, что регулярное употребление большого количества соединения способствует жировой дистрофии печеночных клеток, резкому возрастанию концентрации липидов в тканях печени и одновременному снижению их в плазме крови. Продуцирование фосфолипидов в печени резко падает на фоне роста триглицеридов. При этом окисление жирных кислот в печени остается на прежнем уровне (не снижается). Содержание РНК, общего белка в печени уменьшается, а количество ДНК остается без изменений. Число пиримидинов по отношению к пуринам существенно возрастает.
В результате гипервитаминоза урацил-4-карбоновой кислоты для ее трансформации в оротидин-5-фосфат требуется гораздо больше 5-фосфорибозил-пирофосфата, который выводится из реакции создания никотинамид-содержащих нуклеотидов, пуриновых оснований.
Излишек образующихся пиримидиновых нуклеозидфосфатов ограничивает способность печени к фосфорилированию. Это приводит к тому, что количество АТФ в железе уменьшается, уровень АМФ и АДФ возрастает. Данные процессы аналогичны тем, когда при отсутствии липотропиков и во время голодания происходят реакции, связанные с ожирением печени.
Характерные симптомы передозировки оротовой кислоты:
- аллергические реакции (покраснение кожных покровов, высыпания, зуд);
- расстройство пищеварения;
- тошнота;
- рвота.
В редких случаях высокие дозы урацил-4-карбоновой кислоты способны вызвать дистрофию печени.
Как правило, симптомы исчезают после отмены употребления витаминного соединения.
Лечебное использование

Рассмотрим в каких случаях назначают витамин В13:
- При вскармливании недоношенных детей. После добавления 300 миллиграмм урацил-4-карбоновой кислоты в детское питание, женское молоко прибавка в весе у младенцев ежедневно составляла 1,8 – 28,5 грамм. В то время, как дети, не получавшие полезное соединение с профилактической целью, набирали массу тела медленнее – 1,6 – 13,9 грамм в сутки. На основании полученных данных можно утверждать, что добавление оротовой кислоты в питание недоношенных малышей способствует интенсивному приросту веса младенца (вдвое). Данная функция витаминного соединения объясняется его способностью стимулировать синтез белка.
- При заболеваниях печени. При остром, хроническом гепатите во время введения калиевой соли урацил-4-карбоновой кислоты отмечено положительное влияние соединения на организм человека: исчезает симптоматика заболевания, улучшается состояние больного и некоторые биохимические показатели крови. А именно: белковые фракции сыворотки, билирубин, холестерин, липопротеиды, содержание пировиноградной кислоты, кетонемия. В процессе лечения, после поступления В13 в организм, в 50% случаев витамин увеличивает диурез и сопровождается улучшением самочувствия больного. Для усиления эффекта оротовую кислоту целесообразно комбинировать с витамином Е. Так, при циррозе печени благоприятный эффект получен при сочетании 400 миллиграмм токоферола и 3 грамм В13. Из-за того, что роль соединения еще до конца не изучена, по мнению врачей для лечения заболеваний печени вещество подлежит дальнейшему исследованию.
- При сердечно-сосудистых заболеваниях. Так, в ходе исследований, проводимых в конце 70-х годов, кардиологи Жаров В.С., Лукомский П.Е., Хейнонен И.М. пришли к заключению, что после острого инфаркта миокарда лечение оротовой кислотой в составе стандартной терапии, уменьшает долю смертности, увеличивает сократимость миокарда сердца, содержание АТФ. Таким образом, согласно утверждениям профессора Вильямса, витамин В13 ускоряет приспособление (адаптацию) органа к рабочей нагрузке после перенесенного инфаркта. В комплексном лечении пациентов с симптомами острого инфаркта миокарда оказалось полезным сочетание 100 микрограмм цианокобаламина, 60 миллиграмм фолиевой кислоты, 1,5 грамм оротовой кислоты в сутки.
- При мегалобластических анемиях. Введение урацил-4-карбоновой кислоты в организм больного (от 3 до 6 грамм) улучшает состав крови, функцию головного мозга, повышает активность эритропоэтических факторов, вызывает частичную гематологическую ремиссию.
Лечебная доза витамина В13 зависит от возраста, пола больного и от тяжести проявления симптомов заболевания. Чаще всего она составляет 1,5 – 3 грамма в сутки, а курс терапии 30 – 60 дней.
В виду того, что оротовая кислота благоприятно влияет на кожу (нормализует обменные процессы в эпидермисе и дерме, оказывает противовоспалительное действие, подтягивает и увлажняет увядающую кожу, разглаживает морщины), она часто входит в состав кремов для лица. При этом вещество успешно используется в косметологии.
Источники оротовой кислоты

Если в организме человека не хватает витамина В13, цианокобаламин выполняет его функции и наоборот.
В продуктах питания оротовая кислота часто встречается в виде магниевой, кальциевой, калийной соли. Поступая в организм с едой, они проникают непосредственно в кровь, где из формируется свободная форма витамина В13, который транспортируется в органы, ткани.
Рассмотрим где содержится наибольшее количество урацил-4-карбоновой кислоты:
- Печень (1,6 – 2,1 грамм на 100 грамм продукта).
- Пивные дрожжи (1,1 – 1,6 грамм).
- Овечье молоко (0,32 грамма).
- Коровье молоко (0,105 грамм).
Среди других источников оротовой кислоты (содержание полезного вещества составляет менее 0,08 грамм на 100 граммах продукта) можно выделить:
- творог;
- сметана;
- сливки;
- корнеплоды растений (морковь, свекла);
- жидкая часть кисляка;
- сыворотка;
- кумыс;
- сыр;
- простокваша;
- кефир.
Продукты, богатые на оротовую кислоту важно хранить в темном помещении, поскольку прямые солнечные лучи вызывают разрушение полезного соединения.
Благодаря тому, что витамин В13 имеет высокую температуру плавления (346 градусов) продукты, содержащие вещество можно жарить, тушить, запекать. При этом, потери вещества не будут превышать 5%.
- Коронавирусы: SARS-CoV-2 (COVID-19)
- Антибиотики для профилактики и лечения COVID-19: на сколько эффективны
- Самые распространенные «офисные» болезни
- Убивает ли водка коронавирус
- Как остаться живым на наших дорогах?
Фармацевтическая промышленность выпускает лекарственные средства в форме оротата магния и оротата калия. Однако, в процессе приема вещества помните, что это прежде всего, препараты, которые используются для лечения заболеваний пищеварительного тракта, сосудов, сердца. Неконтролируемый прием витамина В13 может привести к ухудшению самочувствия больного и развитию нежелательных последствий.
В качестве добавки к пище витаминное соединение доступно в виде оротата кальция.
Перед употреблением урацил-4-карбоновой кислоты синтетического происхождения, в целях безопасности, рекомендуется проконсультироваться с врачом.
Вывод
Таким образом, витамин В13 – гетероциклическое вещество, обладающее важнейшими анаболическими, гепатопротекторными свойствами. Хотя роль соединения в организме человека мало изучена, установлено, что систематическое поступление урацил-4-карбоновой кислоты (с продуктами питания или в таблетках) предупреждает преждевременное старение, печеночные заболевания, поддерживает репродуктивную функцию и улучшает усвоение фолатов.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Автор статьи:
Тедеева Мадина Елкановна
Специальность: терапевт, врач-рентгенолог, диетолог.
Общий стаж: 20 лет.
Место работы: ООО “СЛ Медикал Груп” г. Майкоп.
Образование: 1990-1996, Северо-Осетинская государственная медицинская академия.
Введение
В современной эстетической медицине существует много хирургических и аппаратных методик, предполагающих повреждения (нарушения) кожи. Эти методики основаны на предположении о хорошем уровне репаративных возможностей кожи пациента. На практике, однако, наблюдается несколько иная картина. Например, у пожилых пациентов ранозаживление существенно замедлено, более того, его качество оставляет желать лучшего. У пациентов, «увлекающихся» пластической хирургией в молодом и среднем возрасте, попросту не хватает репаративных ресурсов кожи вследствие недостаточных по времени интервалов для ее реабилитации.
В современной эстетической медицине существует много хирургических и аппаратных методик, предполагающих повреждения (нарушения) кожи. Эти методики основаны на предположении о хорошем уровне репаративных возможностей кожи пациента. На практике, однако, наблюдается несколько иная картина. Например, у пожилых пациентов ранозаживление существенно замедлено, более того, его качество оставляет желать лучшего. У пациентов, «увлекающихся» пластической хирургией в молодом и среднем возрасте, попросту не хватает репаративных ресурсов кожи вследствие недостаточных по времени интервалов для ее реабилитации.
Помимо классических «резаных ран» современная эстетическая медицина включает некоторые методики, приводящие к термальным ожогам (лазерный пилинг), химическим ожогам (химический пилинг) и др., что также предъявляет повышенные требования к репаративным возможностям кожи пациента. Поэтому даже при условии выполнения эстетических аппаратных процедур и хирургической пластики на высоком технологическом уровне пациенты нуждаются в адекватном ведении в предоперационном и реабилитационном периодах. Реабилитационный (послеоперационный) период особенно важен, так как в это время высока вероятность развития осложнений (замедленное ранозаживление, формирование грубой рубцовой ткани с последующим изменением окраски кожи, спаечной болезни, инфекционных осложнений ран и др.).
Качественное ранозаживление необходимо каждому пациенту после оперативного вмешательства. В стандартной ранозаживляющей терапии помимо топического воздействия (растворы, спреи, гели, кремы, мази) применяются препараты – стимуляторы ранозаживления, такие как солкосерил (стандартизированный экстракт плазмы крови молодых телят) и др. Актуальность вопроса заключается в том, что, несмотря на несомненные успехи в лечении ран и ожогов, желаемая степень терапевтического и косметического эффекта достигается далеко не всегда. Следовательно, любая возможность ускорения и, особенно, улучшения качества заживления раны заслуживает внимательного рассмотрения.
Очевидно, что ранозаживление – показатель состояния репаративных возможностей соединительной ткани (СТ). СТ составляет около 50% массы тела. С гистологической точки зрения, СТ – это не только фасции и связки, но и вся система клеточного обеспечения целостности всех видов тканей и органов [7]. Иначе говоря, основная функция СТ – это структурная поддержка других тканей, что чрезвычайно важно в процессах ранозаживления [4].
С точки зрения современной молекулярной биологии, СТ состоит из четырех принципиальных компонентов: клеток (фибробластов), гелеобразной среды (или «аморфного вещества», обеспечивающего быструю диффузию питательных веществ и гормонов между кровью и клетками СТ), коллагеновых и эластиновых волокон (механическая поддержка) [12]. Гелеобразная среда формируется протеогликанами – чрезвычайно растянутыми белковыми цепями с многочисленными полисахаридными цепями глюкозаминогликанов, присоединенных посредством ковалентных связей (рис. 1а). Основой гелеобразной среды СТ является биополимер гиалуронан, нити которого скрепляют структуру «полисахаридного геля» в единое целое. Гиалуронан синтезируется посредством магний-зависимых ферментов гиалуронансинтетаз (рис. 1б).
Следует отметить, что эссенциальный биоэлемент магний необходим для обеспечения энергетического метаболизма клеток кожи, полноценного обмена белков, жиров, углеводов, нуклеиновых кислот [2] и оказывает значительное влияние на структуру СТ. Совместное рассмотрение молекулярной биологии внеклеточной матрицы и физиологических механизмов гомеостаза магния [5] позволило сформулировать ряд принципиально важных молекулярных механизмов взаимосвязи между Mg2+ и состоянием СТ:
• стабилизация магнием транспортных РНК, участвующих в синтезе белка;
• активация магнием гиалуронансинтетаз (рис. 1б);
• деактивация матричных металлопротеиназ, избыточная активность которых приводит к разрушению СТ;
• активация эластаз, способствующих формированию гибких эластиновых волокон.
Эти молекулярные механизмы, подробно рассмотренные в работе [5], указывают на фундаментальное значение магния для роста и восстановления СТ и на то, что препараты магния могут быть весьма полезны для оптимизации процессов ранозаживления.
Результаты анализа фундаментальных молекулярных исследований ролей магния в структуре СТ подтверждаются результатами экспериментальных и клинических исследований повреждений кожи. В исследовании Berger с соавт. [7] в группе 16 пациентов с термическими ожогами было установлено, что тяжесть ожога коррелировала с экссудативными потерями магния (r=0,07, р=0,003). В эксперименте Heidarianpour [8] на стрептозацин–индуцированном диабете показано, что пероральный прием сульфата магния снимает спазм с микрососудов кожи, воздействуя на каскад оксида азота. В эксперименте Williams с соавт. (1994) с химическим ожогом фторной кислотой дотация магния (инъекции 160 мг/кг массы тела сульфата магния) уменьшала тяжесть ожога, снижалась смертность. В эксперименте Silva с соавт. [11] добавление в крем для кожи магния аскорбил фосфата способствовало утолщению эпителия кожи с большим объемом клеток в области гранулирования раны.
Ультрафиолет–зависимое старение кожи очень распространено. Классическими защитными средствами являются крем с УФО–фильтрами и пероральное применение ликопина. При лечении угревой сыпи и реабилитации пациентов, перенесших химические и лазерные пилинги, а также пациентов, которым были проведены пластические операции, существует большая вероятность неравномерного окрашивания кожи в районе вмешательства (особенно при его проведении весной и летом).
В то же время магний является независимым и весьма важным протектором, защищающим кожу от УФО–повреждений и нормализующим пигментацию. В эксперименте Kobayashi с соавт. [10] с УФО–облучением крыс с предварительно депилированной шерстью внутрибрюшинное введение магния аскорбил фосфата предотвращало избыточный оксидативный стресс и воспаление кожи. В клиническом исследовании Kameyama с соавт. [9] однократная дотация магния (местное применение крема) 34 пациентам снижала гиперпигментацию кожи при ее УФО–облучении.
Таким образом, использование препаратов органического магния для восстановления структуры СТ является перспективным направлением биомедицинских исследований в области эстетической медицины. В настоящем исследовании проводилось экспериментальное изучение влияния органической формы магния (препарат Магнерот®, оротат магния) на процессы заживления ран и ожогов на стандартных международных моделях ран и ожогов у животных. В качестве препарата сравнения использовался солкосерил, входящий в стандартную терапию.
Оротат магния способствует более активному всасыванию магния в желудочно–кишечный тракт. Кроме того, оротовая кислота принимает участие в обмене белков и фосфолипидов, в превращениях фолиевой и пантотеновой кислот. Препараты оротовой кислоты, в частности оротат калия, применяются в качестве стимуляторов лейкопоэза и регенерации клеток, в том числе клеток СТ. Поэтому использование оротата магния при приеме внутрь является перспективным направлением исследований по улучшению процессов ранозаживления.
Материалы и методы
Эксперимент выполнен в соответствии с этическими стандартами по биомедицинской этике. Все процедуры по уходу за экспериментальными животными осуществляли в соответствии с нормами и правилами обращения с лабораторными животными и с учетом требований Европейской конвенции по защите экспериментальных животных (1973).
Эксперимент проводился на 60 белых крысах–самцах линии Вистар (масса тела – 200–300 г, возраст – 3 мес.). Критериями отбора для участия в эксперименте наряду с полом и массой тела служили общее состояние животных, активное поведение, гладкая блестящая шерсть и чистый кожный покров, отсутствие внешних признаков заболеваний. На основании результатов отбора крысы были рандомизированы и разделены на 6 групп по 10 животных (табл. 1).
I и IV группы являлись контрольными; II и V группы включали препарат сравнения и служили для моделирования стимулированной регенерации. В качестве препарата сравнения использовался широко применяющийся в клинике и в эксперименте препарат солкосерил – стандартизованный депротеинизированный диализат из крови молочных телят, содержащий широкий спектр естественных низкомолекулярных веществ, в т.ч. гликолипиды, нуклеозиды и нуклеотиды, аминокислоты, олигопептиды, микроэлементы. III и VI группы (Магнерот®, модель «Рана», Магнерот®, модель «Ожог») позволили оценить ранозаживляющие эффекты оротата магния.
Для создания травматической модели на коже спины в межлопаточной области после депиляции удалялся полнослойный кожный лоскут размерами 1,5×1,5 см. Ожоги той же локализации воспроизводились после депиляции путем прикладывания к ограниченному деревянным трафаретом круглому участку кожи диаметром 1,5 см тонкостенной резиновой емкости с водой температуры 90С на 30 с. Предварительные испытания показали, что данная методика позволяет воспроизводить стандартный по размеру и глубине ожог III степени. Болезненные манипуляции проводились под хлоралгидратным наркозом (350 мг/кг внутрибрюшинно), в соответствии со стандартными протоколами [3,6].
На всем протяжении эксперимента рана оставалась открытой. Для исключения зализывания раны крысы содержались в индивидуальных клетках. Введение препаратов осуществлялось в одно и то же время 1 раз в cутки 5 дней в неделю. Регулярно проводились планиметрические измерения раны, учитывались сроки завершения эпителизации. На 30–й день под хлоралгидратным наркозом (700 мг/кг внутрибрюшинно) забирался полнослойный участок кожи с рубцом. Кусочки кожи с ран животных фиксировались в нейтральном формалине и обезвоживались в спиртах восходящей концентрации. Парафиновые срезы толщиной 5 мкм готовились в направлении поперек продольной оси межлопаточной области и окрашивались гематоксилин–эозином и резорцин–фуксином по Вейгерту. Морфологические исследования проводились с помощью микроскопа «Биолам Р–5» и анализатора видеоизображений «ВидеоТест–Мастер».
Полученные результаты были подвергнуты математической обработке с помощью компьютерной программы Microsoft Excel. При стандартном анализе определяли среднее арифметическое, стандартное отклонение среднего арифметического, величину доверительных интервалов. Достоверность различий сравниваемых величин определялась при помощи t–критерия Стьюдента и непараметрического U–критерия Уилкоксона–Манна–Уитни. Достоверными различия считались при p<0,05.
Результаты
В результате исследования были установлены достоверные различия в эффективности и скорости ранозаживления и качестве образующегося рубца (по данным гистологического исследования образцов тканей на 30–й день). Внутрижелудочное зондирование суспензией оротата магния способствовало более эффективному и быстрому по сравнению с контролем заживлению моделей ран и ожогов, причем эффект оротата магния был сравним с эффектом внутрибрюшинного введения солкосерила.
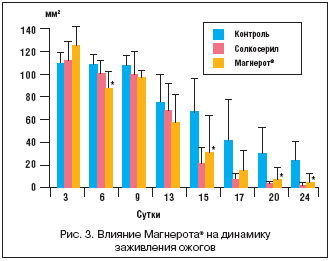
Различия в динамике площади раневой поверхности представлены на рисунке 2. Эффект оротата магния на площадь раны был заметен начиная с 1–го дня исследования, в то время как достоверный эффект солкосерила наблюдался к 14–му дню. К этому сроку произошло практически полное заживление ран в группах II и III. Динамика заживления ожогов была несколько замедлена по сравнению с ранозаживлением – практически полное заживление наблюдалось только к 24–му дню в группах II и III. Статистически достоверное улучшение при приеме оротата магния по сравнению с контролем наблюдалось начиная со 2–й нед. эксперимента. Солкосерил способствовал более эффективному заживлению ожогов (рис. 3), а Магнерот® – более эффективному заживлению ран (рис. 2).
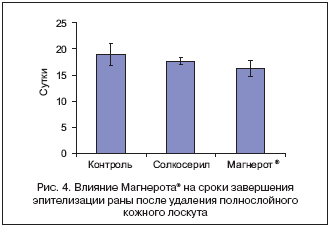
Различия в сроках завершения эпителизации на обеих моделях указаны на рисунке 4. Применение оротата магния достоверно сокращало сроки полного завершения эпителизации ран в среднем на 2,5±1,4 дня по сравнению с группой контроля и на 1,5±1,2 дня при сравнении со стандартной терапией солкосерилом. В случае моделей «Ожог» солкосерил способствовал сокращению времени эпителизации на 6,2±1,9 дня (р=0,0001), а оротат магния – на 1,8±1,6 дня (р=0,05).
Результаты гистоморфологического исследования рубцов
Группа I (модель «Рана», контроль). Эпидермис ровный как по верхнему слою, так и по нижнему. Роговой слой тонкий. Базальный слой кератиноцитов ровный, ядра клеток крупные, округлые, сами клетки слегка вытянуты. Большинство кератиноцитов вакуолизированы. Коллагеновые волокна, имеющие параллельную поверхности регенерата ориентацию, плотно прилегают друг к другу. Между коллагеновыми волокнами располагается множество фибробластов. В фиброзной ткани находится большое количество капилляров. Основное аморфное вещество выражено слабо. Эластические волокна обнаруживаются только в глубине кожного регенерата, ближе к подкожной жировой клетчатке, они короткие и прямые, имеют небольшое количество разветвлений. По всему объему рубца эластические волокна находятся ближе к неповрежденной коже. Микрофотографии рубцовой зоны у крыс группы I представлены на рисунке 5.
Группа II (модель «Рана», контроль – солкосерил). Эпидермис по базальному слою образует небольшое количество выпячиваний – зачатков волосяных фолликулов, а на его поверхности формируется сложный микрорельеф. Роговой слой толстый. Отдельные его клетки вакуолизированы. Базальные кератиноциты плотно сомкнуты между собой, имеют вытянутую форму, ядра четко очерчены. В фиброзной ткани коллагеновые волокна имеют небольшую извитость, фибробластов по сравнению с I группой меньше, хорошо развито микроциркуляторное русло. Эластические волокна сформированы по всему объему рубца ближе к краю регенерата и располагаются вдоль коллагеновых волокон, образуя очень тонкие, едва заметные ответвления. В центральной же части обнаруживаются лишь в отдельных полях зрения, где в виде коротких волокон прилегают к базальному слою эпидермиса, или обнаруживаются только на дне регенерата. Таким образом, при приеме солкосерила можно констатировать формирование более полноценного, чем в контроле, кожного регенерата. Это подтверждает правомерность использования солкосерила в качестве препарата сравнения.
Группа III (модель «Рана», Магнерот®). На поверхности эпидермиса появились небольшие возвышения, но сложный микрорельеф не образуется. Базальный слой эпидермиса имеет выпячивания. Роговой слой толстый, легко отслаивается. Кератоциты вытянутые, тонкие, ядра овальные, вакуолизированы и плотно сомкнуты. Коллагеновые волокна фиброзной ткани слегка извитые. Между ними располагается большое количество фибробластов, но основного аморфного вещества немного. Капилляры многочисленны, находятся как в прилегающей к эпидермису зоне, так и в нижней части рубца. Эластические волокна в основной массе выявляются в нижней и средней зонах рубца, располагаются периваскулярно, а также вдоль коллагеновых волокон. Имеют множество ответвлений. В верхней области рубца встречаются единично по 1–2 в поле зрения, прямые, без ответвлений. Фотографии препаратов кожного регенерата этой группы показаны на рисунке 6.
Таким образом, прием оротата магния у моделей «Рана» соответствовал образованию более плотного слоя клеток при сравнении с контролем. Большее количество фибробластов соответствует более здоровому ранозаживлению и менее выраженному рубцу, на что также указывает отсутствие избыточных коллагеновых волокон.
Группа IV (модель «Ожог», контроль). На 30 сут. после нанесения ожога на месте повреждения сформировалась зрелая фиброзная ткань. Эпидермис утолщен, все слои четко выражены, включают в себя 7–10 рядов клеток. Базальный слой представлен 2–3 рядами клеток с умеренно гиперхромными ядрами, имеющими одно ядрышко. Цитоплазма клеток шиповатого слоя вакуолизирована. Отмечается гиперкератоз. На поверхности эпидермиса начинает формироваться микрорельеф, в то время как по базальному слою граница ровная. Коллагеновые волокна рубца образуют сплошную массу, ориентированы хаотично, между ними включены фибробласты и фиброциты. Интенсивно развито микроциркуляторное русло, имеются открытые концы поперечно срезанных капилляров по 7–8 в поле зрения. Эластические волокна выявляются только на дне регенерата и в подкожно–жировой клетчатке в виде коротких и мелких фрагментов (рис. 7).
Группа V (модель «Ожог», контроль – солкосерил). Эпидермис так же утолщен, как и у крыс контрольной группы. Сформированы все слои клеток, расположенные в 7–9 рядов. Базальный слой эпидермиса образован 2 рядами клеток с четкими контурами и умеренно окрашенными ядрами. Роговой слой тонкий, выпячивания в верхних слоях эпидермиса более выражены, чем в нижних. Фиброзная ткань представлена коллагеновыми волокнами, ориентированными либо параллельно поверхности регенерата, либо беспорядочно. В ней преобладают фибробласты, основного аморфного вещества больше, чем в контрольной группе. Микроциркуляторное русло развито хорошо, продольно срезанные капилляры ориентированы перпендикулярно поверхности рубца. Просветов поперечно срезанных капилляров выявляется по 9–10 в поле зрения. Хорошо развита подкожная жировая клетчатка. Эластические волокна обнаруживаются на дне регенерата. Они многочисленные, но короткие, тонкие, с едва заметными ответвлениями.
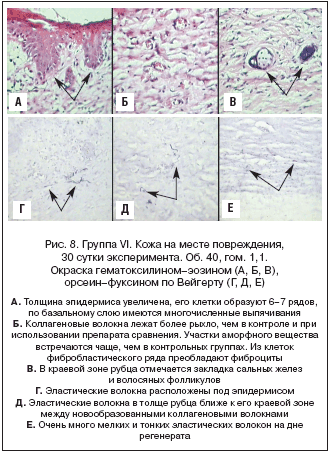
Группа VI (модель «Ожог», Магнерот®). Толщина эпидермиса увеличена, его клетки образуют 6–7 рядов, по базальному слою имеются многочисленные выпячивания. Клетки базального слоя вытянутые, их ядра мелкие, гиперхромные. Ядра клеток шиповатого слоя крупные, имеют 1–2 ядрышка, цитоплазма вакуолизирована. Роговой слой умеренно толстый, в некоторых участках легко отслаивается. Коллагеновые волокна лежат более рыхло, чем в контроле и при использовании препарата сравнения. Участки аморфного вещества встречаются чаще, чем в контрольных группах. Из клеток фибробластического ряда преобладают фиброциты. Просветов поперечно срезанных капилляров по 10–12 в поле зрения. Подкожная жировая клетчатка выражена слабо. В краевой зоне рубца отмечается закладка сальных желез и волосяных фолликулов. Эластические волокна расположены под эпидермисом, а также в толще рубца ближе к его краевой зоне между новообразованными коллагеновыми волокнами. Очень много мелких и тонких эластических волокон на дне регенерата. На рисунке 8 представлены фотографии, иллюстрирующие данное описание.
Таким образом, применение оротата магния при ожогах предотвращает избыточное разрастание коллагеновых фибрилл, способствует росту эластиновых волокон (придающих эластичность рубцу), увеличению числа фибробластов СТ и формированию аморфного вещества (полисахаридного геля). Эти эффекты, соответствующие предложенным ранее молекулярным механизмам воздействия магния на СТ [5], повышают качество рубца при ожогах.
Заключение
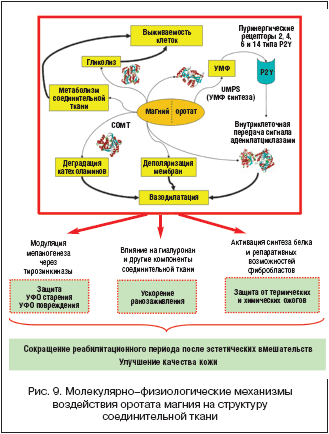
Качество ранозаживления влияет на исход оперативных вмешательств. Повышение качества и скорости заживления ран и ожогов важно для предотвращения осложнений. Усилия специалистов в области эстетической медицины, безукоризненное выполнение операций и аппаратных вмешательств могут быть сведены на нет из–за неполноценного ранозаживления в реабилитационный период. Магний является модулятором роста СТ и может способствовать улучшению процессов ранозаживления (рис. 9).
В настоящей работе было проведено экспериментальное исследование эффектов оротата магния на эпителизацию ран и ожогов. Применение Магнерота® позитивно отразилось на течении восстановительного процесса в коже. Склеротические изменения СТ в зоне повреждения у животных, получавших препарат, на 30–й день оказались выраженными в меньшей степени, чем в контрольной группе. В соответствии с измерениями площади эпителизации солкосерил способствовал более эффективному заживлению ожогов, в то время как препарат Магнерот® – более эффективному заживлению ран, более равномерному прокрашиванию вновь образовавшейся кожи, улучшению ее тургора. Применение оротата магния достоверно сокращало сроки полного завершения эпителизации ран, предотвращало избыточное разрастание коллагеновых фибрилл на фоне стимулирования роста эластиновых волокон, придающих эластичность рубцу, роста числа фибробластов СТ и формирования аморфного вещества. Эти эффекты способствуют повышению качества рубца при ожогах.
Литература
1. Бойчук Н.В., Исламов Р.Р., Кузнецов С.Л., Улумбеков Э.Г., Челышев Ю.А. Гистология, эмбриология, цитология. М.: Гэотар–Мед, 2007. 408 с.
2. Громова О.А. Магний и пиридоксин: основы знаний. М.: ПротоТип, 2006. 236 с.
3. Западнюк И.П., Западнюк В.И., Захария Е.А. Лабораторные животные. Киев: Вища школа, 1983.
4. Нечаева Г.И., Яковлев В.М., Громова О.А., Викторова И.А. с соавт. Дисплазии соединительной ткани у детей и подростков. М.: изд–во Союза педиатров России, 2009, 123 с.
5. Торшин И.Ю., Громова О.А. Возможные молекулярные механизмы воздействия магния на дисплазию соединительных тканей // РМЖ. 2008. № 4. С. 63–69.
6. Хабриев Р.У. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М.: Медицина, 2005. С. 832.
7. Berger M.M., Rothen C., Cavadini C., Chiolero R.L. Exudative mineral losses after serious burns: a clue to the alterations of magnesium and phosphate metabolism // Am J Clin Nutr. 1997 May. Vol. 65 (5). Р. 1473–14781. PubMed PMID: 9129479.
8. Heidarianpour A., Sadeghian E., Gorzi A., Nazem F. The influence of oral magnesium sulfate on skin microvasculature blood flow in diabetic rats // Biol Trace Elem Res. 2011 Oct. Vol. 143 (1). Р. 344–350. Epub 2010 Sep 21. PubMed PMID: 20857343.
9. Kameyama K., Sakai C., Kondoh S., Yonemoto K., Nishiyama S., Tagawa M., Murata T., Ohnuma T., Quigley J., Dorsky A., Bucks D., Blanock K. Inhibitory effect of magnesium L–ascorbyl–2–phosphate (VC–PMG) on melanogenesis in vitro and in vivo // J Am Acad Dermatol. 1996 Jan. Vol. 34 (1). Р. 29–33. PubMed PMID: 8543691.
10. Kobayashi S., Takehana M., Itoh S., Ogata E. Protective effect of magnesium–L–ascorbyl–2 phosphate against skin damage induced by UVB irradiation // Photochem Photobiol. 1996 Jul. Vol. 64 (1). 224–228. PubMed PMID: 8787018.
11. Silva G.M., Maia Campos P.M. Histopathological, morphometric and stereological studies of ascorbic acid and magnesium ascorbyl phosphate in a skin care formulation // Int J Cosmet Sci. 2000 Jun. Vol. 22 (3). Р. 169–179. PubMed PMID: 18503473.
12. Torshin I.Yu., Gromova O.A. Magnesium and pyridoxine: fundamental studies and clinical practice // Nova Science, NY, 2009. ISBN–10: 1–60741–704–9.
13. Williams J.M., Hammad A., Cottington E.C., Harchelroad F.C. Intravenous magnesium in the treatment of hydrofluoric acid burns in rats // Ann Emerg Med. 1994 Mar. Vol. 23 (3). Р. 464–469. PubMed PMID: 8135420.