«Пемолин» относится к психостимуляторам неамфетаминового ряда, но общие свойства с амфетамином имеет. В частности, отмечается наркотическое действие при превышении дозировок и быстрое формирование зависимости при отказе от соблюдения врачебных рекомендаций.
Действие на организм

Является стимулятором ЦНС, применяется для лечения детей с нарушением внимания и взрослых при ухудшении памяти и нарколепсии. Последнее — редко встречающееся расстройство сна, которое сопровождается пароксизмальными приступами засыпания в период активного бодрствования.
Точных сведений о причинах и механизмах формирования патологии нет, но уже подобрана адекватная терапия, позволяющая улучшить состояние, предотвращать обострения и приступы гипнолепсии. Плохое качество ночного сна приводит к снижению работоспособности, рассеянности, ухудшению концентрации внимания, межличностным конфликтам. «Пемолин» позволяет отчасти контролировать процессы и улучшать состояние больных разного возраста.
Препарат обладает накопительными свойствами, максимальный эффект наступает на 3–4 неделе лечения. Форма выпуска — таблетки, в оболочке и жевательные. Последний вариант — адаптация для пациентов детского возраста с синдромом гиперактивности и рассеянности внимания, которым чаще всего и назначается лекарство. В отличие от других психостимуляторов, «Пемолин» не оказывает дополнительную нагрузку на сердечно-сосудистую систему, поэтому считается более щадящим.
Показания
Основное показание к применению — СДВГ. Синдром дефицита внимания с гиперактивностью часто называют гиперкинетическим расстройством. Развивается в дошкольном возрасте, примерно с 5 лет. При этом отсутствует настойчивость в достижении цели, нет способности к произвольному запоминанию и анализу информации, лидирует спонтанное проявление эмоций при отсутствии контроля поведения.

Причины развития расстройств предположительно генетические, поэтому кардинально изменить ситуацию не получится. Можно только поддержать человека, что подразумевает длительный прием лекарственных средств.
Виды СДВГ:
- с преобладанием гиперактивности;
- с превалирующей невнимательностью;
- смешанный тип.
«Пемолин» эффективен при любой форме. Диагностика расстройства затруднена из-за большой вариативности симптомов, поэтому при назначении специалисты ориентируются на такие характерные особенности, как:
- отсутствие усидчивости;
- бессмысленные движения;
- хаотичное перемещение по комнате;
- беспричинное размахивание руками;
- мелкие движения конечностей, включая бесконтрольное шевеление пальцами, неосознанное перебирание предметов, удары ногами, раскачивание на стуле;
- трудности с концентрацией внимания;
- неспособность к планированию;
- быстрая утомляемость при умственных нагрузках.
Рассматривается именно комплекс проблем, мешающих обучению и снижающих качество жизни. Вопрос о назначении лекарства принимается индивидуально для каждого пациента с учетом возраста и уровня расстройства. При нарколепсии «Пемолин» выписывает сомнолог на основании данных обследования.
Противопоказания

Побочные эффекты
«Пемолин» способен вызвать психоз, обладает опасностью в плане развития привыкания и злоупотребления. Есть риск появления хронической бессонницы, расторможенности поведения. У некоторых больных снижается масса тела, пропадает аппетит. У пациентов с признаками анорексии применение «Пемолина» нежелательно.
Также могут наблюдаться:
- раздражение и тревога, сменяющиеся вялостью и апатией;
- чрезмерная чувствительность к внешним сигналам;
- умеренное повышение АД;
- синусовая тахикардия;
- головные боли;
- нарушения работы ЖКТ.
Уровень развития побочных симптомов невысокий, обычно при соблюдении терапевтических дозировок препарат переносится хорошо. При бесконтрольном применении возможен наркотический эффект, но слабый и быстро затухающий. При опьянении появляются бредовые идеи и галлюцинации.
Требуется контроль состояния пациента, поскольку продолжительный курс может спровоцировать привыкание, последствия которого предсказать трудно. Вероятность возникновения патологии зависит от индивидуальных особенностей психики больного.
Передозировка
Проявляется психическим возбуждением, бредом, хаотичными передвижениями, дрожанием рук. Возможны гипертермия, аритмия, припадки. При потере сознания необходимо обеспечить проходимость дыхательных путей и контролировать функции легких, чтобы избежать удушья.
Признаки формирования зависимости

Отмена проводится постепенно под контролем врача. Сильных физиологических недомоганий, как правило, не бывает, тем не менее, вероятно развитие депрессии с суицидальными наклонностями.
Стоит учесть, что злоупотребление медикаментом приводит к возникновению головных болей, снижению уровня усвоения информации и проблемам с памятью. Возможны парадоксальные реакции, такие как отсутствие сна и сильное возбуждение вместо нормализации циклов засыпания и повышения концентрации внимания.
Методы лечения
Если речь идет о зависимости у взрослых, то необходима госпитализация. При отмене «Пемолина» человек теряет способность к критической оценке ситуации, поэтому возможны немотивированные приступы агрессии, эпизоды самоповреждения, прием предельных доз средства в попытке устранить внутренний дискомфорт. Терапия заключается в очищении организма и стабилизации эмоционального состояния психотерапевтическими способами.
Важно не оставлять без внимания причины развития зависимости, проработать их, изменив негативные установки, выработать позитивный вектор мышления. Для этого больному помогают освоить систему самоконтроля, практики релаксации и навыки аналитической оценки своего состояния.
У детей признаки зависимости проявляются крайне редко, при тревожных симптомах пересматривается схема терапии, осуществляется коррекция поведения с психологом. Также применяется лечебное обучение для пациентов детского возраста, которое проводится при участии родителей.
Рекомендуется пересмотреть рацион, убрав из него натуральные стимуляторы, такие как кофе, какао, газированные напитки, шоколад, продукты с красителями и консервантами, увеличив при этом долю овощей, фруктов, злаков, орехов и ягод. Необходимо продолжение врачебного наблюдения для исключения рецидивов.
Литература:
- Марковиц, Джон С./ “Фармакология метилфенидата, энантиомеров амфетамина и пемолина при синдроме дефицита внимания и гиперактивности”. Психофармакология человека: клиническая и экспериментальная. 12 — 1997.
- Авруцкий Г.Я., Недува А.А. Лечение психически больных. // Руководство для врачей. 2-е издание дополненное и переработанное. — Москва. — «Медицина». — 1988
- Машковский М. Д. Лекарственные средства / М. Д. Машковский. — М.: Медицина, 1993 — Часть I.
Пемолин
Pemoline
Фармакологическое действие
Пемолин — психостимулятор неамфетаминового ряда.
Фармакокинетика
Быстро абсорбируется из желудочно-кишечного тракта. Период полувыведения (T½) около 12 часов.
Показания
Синдром нарушения внимания с гиперактивностью, нарколепсия.
Беременность и грудное вскармливание
Применение при беременности
Категория действия на плод по FDA — B.
Адекватных и строго контролируемых клинических исследований безопасности применения пемолина при беременности не проведено. Данные полученные в исследованиях, проведённых на животных выявили признаки увеличения числа мертворождений и снижение послеродовой выживаемости потомства.
В случае наступления беременности, отсутствия менструации или при подозрении на возможную беременность пациентка должна сообщить об этом своему лечащему врачу.
Пемолин противопоказан к применению в период беременности, за исключением случаев отсутствия альтернатив, когда потенциальная польза для матери превышает возможный риск для плода.
Применение в период грудного вскармливания
Специальных исследований по безопасности применения пемолина в период грудного вскармливания не проведено.
Неизвестно, выделяется ли пемолин в грудное молоко. Риск для грудного ребёнка не может быть исключён.
Следует прекратить кормление грудью в случае необходимости применения препарата.
Способ применения и дозы
Дети старше 6 лет и взрослые, внутрь: начальная доза 37,5 мг 1 раз в сутки утром; при необходимости дозу увеличивают на 18,75 мг/сут с интервалом 1 неделю, средняя поддерживающая доза 56,25–75 мг/сут, максимальная доза 112,5 мг/сут (0,5–3 мг/кг/сут).
Особые указания
Внесён в Список III перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации.
Меры предосторожности
У некоторых пациентов пемолин предположительно вызывает поражения печени (так называемая гепатотоксичность), рекомендуется проводить регулярные исследования печени у пациентов принимающих препарат.
Спортивная медицина
Пемолин может стать причиной нарушений антидопинговых правил и положительного результата при проведении допинг-контроля.
Пемолин относится к классу S6 «Стимуляторы» запрещённого списка WADA.
⚠ Запрещённые вещества не следует применять для повышения спортивных результатов, поскольку это представляет собой серьёзный риск для здоровья.
Глоссарий
| Термин | Описание |
|---|---|
| WADA | Всемирное антидопинговое агентство |
Классификация
-
АТХ
N06BA05
-
Фармакологическая группа
-
Категория при беременности по FDA
B
(нет риска в исследованиях, не связанных с человеком)
Информация о действующем веществе Пемолин предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Пемолин, содержатся в инструкции производителя, прилагаемой к упаковке.
Пемелан® (Pemelan)
💊 Состав препарата Пемелан®
✅ Применение препарата Пемелан®
Описание активных компонентов препарата
Пемелан®
(Pemelan)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2020.05.11
Владелец регистрационного удостоверения:
Код ATX:
L01BA04
(Пеметрексед)
Лекарственные формы
| Пемелан® |
Лиофилизат д/пригот. р-ра д/инф. 100 мг: фл. 1 шт. рег. №: ЛП-(000389)-(РГ-RU) |
|
|
Лиофилизат д/пригот. р-ра д/инф. 500 мг: фл. 1 шт. рег. №: ЛП-(000389)-(РГ-RU) |
Форма выпуска, упаковка и состав
препарата Пемелан®
Лиофилизат для приготовления раствора для инфузий от белого до светло-желтого цвета.
Вспомогательные вещества: маннитол, натрия гидроксид или хлористоводородная кислота концентрированная.
Флаконы бесцветного стекла (1) — пачки картонные.
Лиофилизат для приготовления раствора для инфузий от белого до светло-желтого цвета.
Вспомогательные вещества: маннитол, натрия гидроксид или хлористоводородная кислота концентрированная.
Флаконы бесцветного стекла (1) — пачки картонные.
Фармакологическое действие
Противоопухолевое средство, антиметаболит. Является антифолатом, ингибирует тимидилатсинтетазу (TC), дигидрофолатредуктазу (ДГФР), глицинамид-рибонуклеотид-формилтрансферазу (ГАРФТ) — ключевые фолат-зависимые ферменты при биосинтезе тимидиновых и пуриновых нуклеотидов. Пеметрексед поступает в клетки с помощью переносчика восстановленных фолатов и белковых фолат-связывающих транспортных систем. Поступая в клетку, пеметрексед быстро и эффективно превращается в полиглутаматные формы с помощью фермента фолилполиглутаматсинтетазы. Полиглутаматные формы задерживаются в клетках и являются более мощными ингибиторами ТС, ГАРФТ. Полиглутамация — это процесс, зависимый от времени и концентрации, который встречается в опухолевых клетках и, в меньшей степени, в нормальных тканях. У полиглутаминированных метаболитов увеличен T1/2, вследствие этого увеличивается продолжительность действия препарата на опухолевые клетки.
При комбинированном применении пеметрекседа и цисплатина в исследованиях in vitro наблюдался синергизм противоопухолевого действия.
Фармакокинетика
В равновесном состоянии Vd пеметрекседа составляет 16.1 л. Связывание с белками плазмы – около 81%.
Пеметрексед ограниченно подвергается метаболизму в печени.
В первые 24 ч после введения 70-90% выводится почками в неизмененном виде. Общий плазменный клиренс пеметрекседа составляет 92 мл/мин, T1/2 из плазмы составляет 3.5 ч у пациентов с нормальной функцией почек.
При почечной недостаточности тяжелой степени связывание с белками плазмы не изменяется.
Показания активных веществ препарата
Пемелан®
Местно-распространенный или метастатический неплоскоклеточный (несквамозный), немелкоклеточный рак легкого — в комбинации с цисплатином в качестве первой линии терапии.
Местно-распространенный или метастатический неплоскоклеточный (несквамозный), немелкоклеточный рак легкого без прогрессирования заболевания после четырех циклов первой линии химиотерапии на основе препаратов платины — для поддерживающей терапии.
Местно-распространенный или метастатический, неплоскоклеточный, немелкоклеточный рак легкого — в качестве монотерапии для терапии второй линии.
Лечение злокачественной мезотелиомы плевры у пациентов, ранее не получавших химиотерапию, с неоперабельной опухолью или при наличии противопоказаний к хирургической операции.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Вводят в/в в виде инфузии. Режим дозирования индивидуальный, в зависимости от показаний, схемы лечения, функции печени.
Побочное действие
Со стороны системы кроветворения: очень часто — лейкопения, нейтропения, анемия; часто — тромбоцитопения.
Со стороны пищеварительной системы: очень часто — тошнота, рвота, анорексия, стоматит/фарингит, диарея, повышение уровня АЛТ и АСТ; часто — запоры, боль в животе.
Дерматологические реакции: очень часто — сыпь/шелушение; часто — кожный зуд, алопеция; редко — многоформная эритема.
Со стороны периферической нервной системы: часто — сенсорная или моторная невропатия.
Со стороны мочевыделительной системы: часто — повышение уровня креатинина.
Со стороны сердечно-сосудистой системы: редко — суправентрикулярная тахикардия.
Прочие: очень часто — повышенная утомляемость; часто — лихорадка, фебрильная нейтропения, аллергические реакции и присоединение вторичных инфекций без нейтропении.
Противопоказания к применению
Беременность, лактация, повышенная чувствительность к пеметрекседу.
Пеметрексед не предназначен для терапии пациентов с плоскоклеточным немелкоклеточным раком легкого.
Применение при беременности и кормлении грудью
Применение при беременности и в период лактации (грудного вскармливания) противопоказано.
Применение при нарушениях функции печени
Для оценки функции печени необходимо периодически проводить биохимический анализ крови.
Применение при нарушениях функции почек
Для оценки функции почек необходимо периодически проводить биохимический анализ крови.
Применение у детей
Пеметрексед не рекомендуется применять в педиатрии, т.к. безопасность и эффективность применения у детей не установлена.
Особые указания
Перед каждым введением пеметрекседа необходимо проводить общий анализ крови с подсчетом лейкоцитарной формулы и количества тромбоцитов.
Для оценки функции почек и печени необходимо периодически проводить биохимический анализ крови.
Перед началом применения абсолютное количество нейтрофилов должно составлять ≥1500/мкл, тромбоцитов ≥100 000/мкл.
Назначение фолиевой кислоты и витамина В12 снижает токсичность пеметрекседа и необходимость уменьшения дозы при гематологической и негематологической токсичности 3-4 степени, в т.ч. нейтропении, фебрильной нейтропении и инфекции с нейтропенией 3-4 степени.
Больным с клиническими проявлениями асцита и плеврита необходимо дренирование выпота перед началом применения пеметрекседа, т. к. влияние этих состояний на действие пеметрекседа не известно.
Пеметрексед не рекомендуется применять в педиатрии, т.к. безопасность и эффективность применения у детей не установлена.
Лекарственное взаимодействие
Совместное применение с нефротоксичными препаратами и/или веществами, выводящимися почками, может снизить клиренс пеметрекседа.
Результаты исследований in vitro свидетельствуют о том, что пеметрексед минимально взаимодействует с препаратами, которые метаболизируются CYP3A , CYP2D6, CYP2C9, CYP1A2.
Фармакокинетика пеметрекседа не меняется при применении фолиевой кислоты внутрь, витамина В12 в/м и при комбинированном применении c цисплатином. Общий клиренс платины не нарушается при применении пеметрекседа.
Пеметрексед можно применять совместно с ибупрофеном (по 400 мг 4 раза/сут) у больных с нормальной функцией почек (КК≥80 мл/мин). При назначении ибупрофена вместе с пеметрекседом у больных с почечной недостаточностью легкой или средней степени тяжести (КК 45-79 мл/мин) необходимо соблюдать осторожность.
У пациентов с почечной недостаточностью легкой и средней степени тяжести не рекомендуется применение НПВС с коротким T1/2 в течение 2 дней перед применением пеметрекседа, в день применения и в течение 2 дней после применения.
Ввиду отсутствия данных о возможном взаимодействии между пеметрекседом и НПВС с большим T1/2, все пациенты, получающие НПВС, должны прервать их применение минимум за 5 дней до приема пеметрекседа, в день приема и в течение 2 дней после приема. Если требуется совместное назначение НПВС, пациентам необходим строгий мониторинг токсичности, особенно миелосупрессии и токсичности со стороны ЖКТ.
Пеметрексед несовместим с раствором Рингера лактата и раствором Рингера.
Совместное применение пеметрекседа с другими препаратами и растворами не исследовано и поэтому не рекомендуется.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Аналоги препарата
Алимта®
(ELI LILLY VOSTOK, Швейцария)
Антифолат
(ФАРМАСИНТЕЗ-НОРД, Россия)
Веротрексед®
(ВЕРОФАРМ, Россия)
Исполат®
(Laboratorio TUTEUR S.A.C.I.F.I.A., Аргентина)
Пемджем®
(Dr. Reddy`s Laboratories, Индия)
Пеметрексед
(БИОКАД, Россия)
Пеметрексед
(ИНСТИТУТ БИООРГАНИЧЕСКОЙ ХИМИИ НАЦИОНАЛЬНОЙ АКАДЕМИИ НАУК БЕЛАРУСИ, Республика Беларусь)
Пеметрексед Дж
(ДЖОДАС ЭКСПОИМ, Россия)
Пеметрексед Канон
(КАНОНФАРМА ПРОДАКШН, Россия)
Пеметрексед-Деко
(КОМПАНИЯ ДЕКО, Россия)
Все аналоги
Пемелан — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-005190
Торговое наименование:
Пемелан®
Международное непатентованное наименование:
пеметрексед
Лекарственная форма:
лиофилизат для приготовления раствора для инфузий
| Состав на один флакон | 100 мг | 500 мг |
| Действующее вещество: пеметрекседа динатрия гемипентагидрат | 120,8 мг | 604,1 мг |
| в пересчете на пеметрексед | 100 мг | 500 мг |
| Вспомогательные вещества: маннитол, натрия гидроксид или хлористоводородная кислота концентрированная |
Описание:
лиофилизированный порошок от белого до светло-желтого цвета.
Фармакотерапевтическая группа:
противоопухолевое средство, антиметаболит.
Код ATX:
L01BA04
Фармакологическое действие
Фармакодинамика
Пеметрексед является антагонистом фолиевой кислоты, действующим на многие мишени ее метаболизма и ингибирующим in vitro тимидилатсинтазу (TS), дигидрофолатредуктазу (DHFR), глицинамидрибонуклеотидформилтрансферазу (GARFT), которые являются ключевыми фолат-зависимыми ферментами при биосинтезе тимидиновых и пуриновых нуклеотидов. Пеметрексед поступает в клетки с помощью переносчика восстановленных фолатов и белковых фолат-связывающих транспортных систем. Поступая в клетку, пеметрексед быстро и эффективно превращается в поли глутаматные формы с помощью фермента фолилполиглутаматсинтетазы. Полиглутаматные формы задерживаются в клетках и являются более мощными ингибиторами TS и GARFT.
Полиглутаминирование – это процесс, зависимый от времени и концентрации, который встречается в опухолевых клетках и в меньшей степени в нормальных тканях. У полиглутаминированных метаболитов увеличен период полувыведения, вследствие чего увеличивается действие препарата в опухолевых клетках.
При комбинированном применении пеметрекседа и цисплатина в исследованиях in vitro наблюдался синергизм противоопухолевого действия.
Фармакокинетика
Постоянный объем распределения пеметрекседа равен 9 л/м². Около 81% пеметрекседа связывается с белками плазмы. Связывание не нарушается при выраженной почечной недостаточности. Пеметрексед ограниченно подвергается метаболизму в печени.
От 70 до 90% препарата выделяется почками в неизмененном виде в первые 24 часа после введения. Общий плазменный клиренс пеметрекседа составляет 92 мл/мин, и период полувыведения из плазмы составляет 3,5 часа у больных с нормальной функцией почек.
Показания для применения
- местнораспространенный или метастатический неплоскоклеточный немелкоклеточный рак легкого;
- злокачественная мезотелиома плевры.
Противопоказания
- Гиперчувствительность к пеметрекседу или вспомогательным веществам, входящим в состав препарата;
- Миелосупрессия (абсолютное количество нейтрофилов <1500/мкл, тромбоцитов <100000/мкл);
- Выраженная почечная недостаточность (клиренс креатинина (КК) <45 мл/мин);
- Беременность, период грудного вскармливания;
- Детский возраст (отсутствие данных по безопасности и эффективности);
- Одновременное применение с вакциной для профилактики желтой лихорадки.
С осторожностью
- При нарушении функции печени;
- При тяжелых заболеваниях сердечно-сосудистой системы, в том числе инфаркте миокарда и нарушении мозгового кровообращения.
Применение при беременности и в период грудного вскармливания
Применение пеметрекседа противопоказано во время беременности и в период грудного вскармливания.
Способ применения и дозы
Пеметрексед вводится внутривенно капельно в течение 10 минут.
Местнораспространенный или метастатический неплоскоклеточный немелкоклеточный рак легкого
Первая линия терапии. Комбинированное лечение с цисплатином:
Рекомендованная доза препарата Пемелан® – 500 мг/м² в первый день каждого 21-дневного цикла. Цисплатин вводится в дозе 75 мг/м на фоне гидратации (см. инструкцию по применению цисплатина) приблизительно через 30 минут после введения препарата Пемелан® в первый день каждого 21-дневного цикла.
Поддерживающая химиотерапия у пациентов с отсутствием прогрессирования после первой линии терапии на основе производных платины. Монотерапия:
Рекомендованная доза препарата Пемелан® – 500 мг/м² в первый день каждого 21-дневного цикла.
Вторая линия терапии. Монотерапия:
Рекомендованная доза препарата Пемелан® – 500 мг/м² в первый день каждого 21-дневного цикла.
Злокачественная мезотелиома плевры
Комбинированное лечение с цисплатином:
Рекомендованная доза препарата Пемелан® – 500 мг/м² в первый день каждого 21-дневного цикла.
Цисплатин вводится в дозе 75 мг/м² на фоне гидратации (см. инструкцию по применению цисплатина) приблизительно через 30 минут после введения препарата Пемелан® в первый день каждого 21-дневного цикла.
Рекомендации перед началом применения препарата Пемелан®
Назначение дексаметазона (или аналога) в дозе 4 мг 2 раза в день за 1 день до начала лечения пеметрекседом, в день введения и последующий день после введения пеметрекседа снижает частоту и выраженность кожных реакций.
Для уменьшения токсичности препарата пациентам, получающим пеметрексед, должны быть назначены препараты фолиевой кислоты или мультивитамины, содержащие фолиевую кислоту, обеспечивающие её суточную потребность. Фолиевая кислота (от 350 мкг до 1000 мкг, в среднем 400 мкг) должна назначаться как минимум 5 дней в течение 7 дней перед первым введением пеметрекседа, во время всего цикла лечения и в течение 21 дня после последнего введения пеметрекседа.
Пациентам также необходимо однократно ввести витамин В12 в дозе 1000 мкг внутримышечно в период 7 дней перед первым введением пеметрекседа и затем через каждые 3 цикла после начала лечения.
Последующие введения витамина В12 в той же дозе могут проводиться в день введения пеметрекседа.
Наблюдение
Для всех пациентов, получающих пеметрексед, рекомендуется проводить наблюдение перед каждым введением препарата по общему клиническому анализу крови, включая определение лейкоцитарной формулы и числа тромбоцитов. Для оценки почек и печени перед каждым введением пеметрекседа следует проводить биохимический анализ крови. Перед началом каждого цикла химиотерапии абсолютное число нейтрофилов (АЧН) должно составлять ≥1500 клеток/мм³, число тромбоцитов – ≥100000 клеток/мм³, концентрация общего билирубина – ≤1,5 раза от верхней границы нормы (ВГН), щелочной фосфатазы, аспарагиновой и аланиновой аминотрансаминаз ≤3 раз от ВГН или ≤5 раз от ВГН при наличии метастазов в печени.
Рекомендации по снижению дозы
Коррекцию дозы перед повторными циклами следует проводить, основываясь на наиболее низком из гематологических показателей или на максимально выраженной негематологической токсичности в течение предыдущего цикла лечения. Лечение может быть отсрочено с целью восстановления от проявлений токсичности. По мере восстановления лечение следует продолжить в соответствии с рекомендациями, приведенными в Таблицах 1-3, которые относятся к применению препарата Пемелан® в монотерапии или в комбинации с цисплатином.
Таблица 1. Режим дозирования пеметрекседа (при монотерапии ши при комбинированной терапии) и цисплатина
| Гематологическая токсичность | Коррекция дозы (мг/м²) |
| Минимальное содержание нейтрофилов <500/мкл и минимальное содержание тромбоцитов ≥50000/мкл | 75% от предыдущей дозы (пеметрексед и цисплатин) |
| Минимальное содержание тромбоцитов <50000/мкл независимо от минимального содержания нейтрофилов | 75% от предыдущей дозы (пеметрексед и цисплатин) |
| Минимальное содержание тромбоцитов <50000/мкл с кровотечением независимо от минимального содержания нейтрофилов | 50% от предыдущей дозы (пеметрексед и цисплатин) |
* Эти критерии соответствуют определению кровотечения ≥2 степени в соответствии с критериями общей токсичности Национального института рака (NCI-CTC)
При развитии негематологической токсичности (исключая нейротоксичность) ≥3 степени, лечение необходимо отложить до восстановления показателей, соответствующих значению перед началом лечения. Далее терапию необходимо продолжить в соответствии с рекомендациями, приведенными в Таблице 2.
Таблица 2. Режим дозирования пеметрекседа (при монотерапии или при комбинированной терапии) и цисплатина
| Негематологическая токсичность1,2 | Доза пеметрекседа (мг/м²) | Доза цисплатина (мг/м²) |
| Любая токсичность 3 или 4 степени за исключением воспаления слизистой оболочки | 75% от предыдущей дозы | 75% от предыдущей дозы |
| Диарея, требующая госпитализации (независимо от степени) или диарея 3 или 4 степени | 75% от предыдущей дозы | 75% от предыдущей дозы |
| Воспаление слизистой оболочки 3 или 4 степени | 50% от предыдущей дозы | 100% от предыдущей дозы |
1 Согласно критериям NCI СТС
2 Исключая нейротоксичность
В случае нейротоксичности рекомендованная коррекция дозы пеметрекседа и цисплатина представлена в Таблице 3. При нейротоксичности 3 или 4 степени лечение необходимо отменить.
Таблица 3. Режим дозирования пеметрекседа (при монотерапии или при комбинированной терапии) и цисплатина
| Степень нейротоксичности | Доза пеметрекседа (мг/м²) | Доза цисплатина (мг/м²) |
| 0-1 | 100% от предыдущей дозы | 100% от предыдущей дозы |
| 2 | 100% от предыдущей дозы | 50% от предыдущей дозы |
Лечение пеметрекседом следует отменить, если у пациента отмечается гематологическая и негематологическая токсичность 3 или 4 степени после двух снижений доз или немедленно отменить при наличии нейротоксичности 3 или 4 степени.
Особые группы пациентов
Пожилые пациенты: Данные о повышении риска побочных эффектов у пациентов 65 лет и старше отсутствуют. Режим снижения доз соответствует общим рекомендациям.
Пациенты с нарушением функции почек: При показателях КК не менее 45 мл/мин коррекция дозы и режима введения препарата не требуется. Пациентам с КК менее 45 мл/мин, применение пеметрекседа не рекомендуется (в связи с недостаточностью данных по применению препарата у такой категории больных).
Пациенты с нарушением функции печени: Недостаточно данных по применению препарата у пациентов с нарушением функции печени с превышением концентрации билирубина больше, чем в 1,5 раза от верхней границы нормы (ВГН), или превышением активности трансаминаз больше, чем в 3 раза от ВГН (при отсутствии метастазов в печени), или больше, чем в 5 раз от ВГН (при наличии метастазов в печени).
Рекомендации по приготовлению раствора для инфузий
- В качестве растворителя используется только 0,9% раствор натрия хлорида.
- Для препарата дозировкой 100 мг: для получения раствора для инфузий содержимое флакона (100 мг) растворяют в 4,2 мл 0,9% раствора натрия хлорида (без консервантов) до концентрации 25 мг/мл (приблизительно). Каждый флакон аккуратно взбалтывают до полного растворения лиофилизата. Полученный раствор должен быть прозрачным; допустимо изменение цвета раствора от бесцветного до желтоватого или зеленовато-желтого цвета.
Для препарата дозировкой 500 мг: для получения раствора для инфузий содержимое флакона (500 мг) растворяют в 20 мл 0,9% раствора натрия хлорида (без консервантов) до концентрации 25 мг/мл (приблизительно). Каждый флакон аккуратно взбалтывают до полного растворения лиофилизата. Полученный раствор должен быть прозрачным; допустимо изменение цвета раствора от бесцветного до желтоватого или зеленовато-желтого цвета. - Соответствующий объем полученного раствора пеметрекседа нужно дополнительно развести до 100 мл 0,9% раствором натрия хлорида.
- Перед введением раствор препарата необходимо осмотреть на наличие частиц и изменение цвета.
- Раствор для введения необходимо использовать немедленно, так как пеметрексед и рекомендуемый растворитель не содержат антибактериальных консервантов. Неиспользованный раствор подлежит уничтожению.
Побочное действие
Побочные эффекты, наблюдавшиеся при монотерапии пеметрекседом (местнораспространенный или метастатический неплоскоклеточный немелкоклеточный рак легкого) с добавлением фолиевой кислоты и витамина В12, изложены ниже в соответствии со следующей частотой: очень часто (>10%), часто (<10% и >1%), нечасто (<1% и >0,1%), редко (<0,1%):
Со стороны системы кроветворения: очень часто – лейкопения, нейтропения, анемия; часто – тромбоцитопения.
Со стороны органов пищеварения: очень часто – тошнота, рвота, анорексия, стоматит/фарингит, диарея; часто – повышение активности аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (ACT), запор, боли в животе.
Со стороны кожи и кожных придатков: очень часто – сыпь/шелушение; часто – кожный зуд, алопеция, мультиформная эритема.
Со стороны периферической нервной системы: часто – сенсорная или моторная нейропатия.
Со стороны мочевыделительной системы: часто – повышение концентрации сывороточного креатинина.
Со стороны сердечно-сосудистой системы: нечасто – суправентрикулярная аритмия.
Прочие: очень часто – повышенная утомляемость; часто – лихорадка, присоединение вторичных инфекций без нейтропении, фебрильная нейтропения, аллергические реакции.
Побочные эффекты, наблюдавшиеся при применении пеметрекседа в комбинации с цисплатином (местнораспространенный или метастатический неплоскоклеточный немелкоклеточный рак легкого) с добавлением фолиевой кислоты и витамина В12, изложены ниже в соответствии со следующей частотой: очень часто (>10%), часто (<10% и >1%), нечасто (<1% и >0,1%), редко (<0,1%):
Со стороны системы кроветворения: очень часто – лейкопения, нейтропения, анемия, тромбоцитопения.
Со стороны органов пищеварения: очень часто – тошнота, рвота, анорексия, стоматит/фарингит, диарея, запор; часто – диспепсия, изжога, повышение активности АЛТ и ACT; нечасто – повышение активности гаммаглютамилтрансферазы (ГГТ).
Со стороны кожи и кожных придатков: очень часто – алопеция; часто сыпь/шелушение.
Со стороны периферической нервной системы: часто – сенсорная нейропатия, нарушение вкуса; нечасто моторная нейропатия.
Со стороны мочевыделительной системы: очень часто – повышение концентрации сывороточного креатинина; часто – снижение клиренса креатинина, почечная недостаточность.
Со стороны сердечно-сосудистой системы: нечасто аритмия.
Со стороны органов дыхания: нечасто – боли в грудной клетке.
Прочие: очень часто – повышенная утомляемость; часто присоединение вторичных инфекций, конъюнктивит, обезвоживание, фебрильная нейтропения, повышение температуры тела.
Побочные эффекты, наблюдавшиеся при монотерапии пеметрекседом в качестве поддерживающей терапии у пациентов с отсутствием прогрессирования после первой линии (местнораспространенный или метастатический неплоскоклеточный немелкоклеточный рак легкого) с добавлением фолиевой кислоты и витамина В12, изложены ниже в соответствии со следующей частотой: очень часто (>10%), часто (<10% и >1%), нечасто (<1% и >0,1%), редко (<0,1%):
Со стороны системы кроветворения: очень часто – анемия; часто – лейкопения, нейтропения, тромбоцитопения.
Со стороны органов пищеварения: очень часто – тошнота, анорексия; часто – рвота, воспаление слизистых оболочек/стоматит, диарея, запор, повышение активности АЛТ и ACT.
Со стороны кожи и кожных придатков: часто – сыпь/шелушение. алопеция, кожный зуд; нечасто – мультиформная эритема.
Со стороны периферической нервной системы: часто – сенсорная и моторная нейропатия.
Со стороны мочевыделительной системы: часто – повышение концентрации сывороточного креатинина, снижение клубочковой фильтрации, почечная недостаточность.
Со стороны сердечно-сосудистой системы: нечасто – суправентрикулярная аритмия.
Прочие: очень часто – повышенная утомляемость; часто – отеки, болевой синдром, фебрильная нейтропения, присоединение вторичных инфекций, лихорадка без нейтропении, конъюнктивит, повышенное слезоотделение, головокружение; нечасто аллергические реакции, тромбоэмболия легочной артерии.
Побочные эффекты, наблюдавшиеся при применении пеметрекседа в комбинации с цисплатином (злокачественная мезотелиома плевры) с добавлением фолиевой кислоты и витамина В12, изложены ниже в соответствии со следующей частотой: очень часто (>10%), часто (<10% и >1%), нечасто (<1% и >0,1%), редко (<0,1%):
Со стороны системы кроветворения: очень часто – лейкопения, нейтропения, анемия, тромбоцитопения.
Со стороны органов пищеварения: очень часто – тошнота, рвота, анорексия, стоматит/фарингит, диарея, запор; часто – диспепсия, повышение активности АЛТ, ACT и ITT.
Со стороны кожи и кожных придатков: очень часто – сыпь, алопеция.
Со стороны периферической нервной системы: очень часто – сенсорная нейропатия; часто – нарушение вкуса; нечасто – моторная нейропатия.
Со стороны мочевыделительной системы: очень часто – повышение концентрации сывороточного креатинина, снижение клиренса креатинина; часто – почечная недостаточность.
Со стороны сердечно-сосудистой системы: нечасто – аритмия.
Со стороны органов дыхания: часто – боли в грудной клетке.
Прочие: очень часто – повышенная утомляемость; часто – конъюнктивит, обезвоживание, фебрильная нейтропения, присоединение вторичных инфекций, повышение температуры тела, крапивница.
Побочные эффекты, наблюдавшиеся при применении пеметрекседа в других клинических исследованиях:
Серьезные сердечно-сосудистые и цереброваскулярные нежелательные явления, включая инфаркт миокарда, стенокардию, инсульт, преходящее нарушение мозгового кровообращения, наблюдались нечасто при применении пеметрекседа в комбинации с другими противоопухолевыми препаратами; при этом в основном у пациентов с факторами риска сердечно-сосудистых нарушений.
Также нечасто сообщалось о случаях панцитопении, эзофагита/лучевого эзофагита.
В редких случаях отмечалось развитие гепатита, потенциально тяжелой степени. При применении пеметрекседа были зарегистрированы случаи колита (в том числе, кишечные и ректальные кровотечения, иногда с летальным исходом, перфорация стенки кишечника, некроз кишки и воспаление слепой кишки) и интерстициального пневмонита с дыхательной недостаточностью, иногда с летальным исходом (нечасто).
По результатам клинических исследований приблизительно у 1% пациентов отмечалось развитие сепсиса, в некоторых случаях с летальным исходом.
Постмаркетинговые данные:
Нечасто – отеки, ишемия конечностей, в некоторых случаях с развитием некроза, острая почечная недостаточность, лучевой пневмонит; редко – у пациентов, ранее получавших лучевую терапию, отмечались случаи повторного развития кожных реакций, подобных лучевым (анамнестическая реакция на облучение) при последующем назначении пеметрекседа; также были зарегистрированы случаи буллезного дерматита, включающие синдром Стивенса-Джонсона и токсический эпидермальный некролиз, в некоторых случаях с летальным исходом; редко сообщалось о случаях развития гемолитической анемии, анафилактического шока.
Передозировка
Ожидаемые осложнения передозировки включают угнетение функции костного мозга, проявляющееся нейтропенией, тромбоцитопенией и анемией. Также могут наблюдаться присоединение вторичных инфекций, диарея, воспаление слизистых оболочек, сыпь.
В случае подозрения на передозировку препарата следует регулярно контролировать общий анализ крови.
Лечение: симптоматическое, включая немедленное применение кальция фолината или фолиновой кислоты.
Взаимодействие с другими лекарственными средствами
Исследования in vitro продемонстрировали, что пеметрексед активно секретируется посредством ОАТ3 (переносчик органических анионов человека 3 типа).
Совместное применение с нефротоксичными препаратами (такими, как аминогликозиды, «петлевые» диуретики, платиносодержащие препараты, циклоспорин) и/или веществами, выводящимися почками посредством канальцевой секреции (например, пробенецид) может привести к снижению клиренса пеметрекседа. Результаты исследований in vitro свидетельствуют о том, что пеметрексед минимально взаимодействует с препаратами, которые метаболизируются изоферментами CYP3A, CYP2D6, CYP2C9, CYP1A2.
Фармакокинетика пеметрекседа не меняется при применении фолиевой кислоты внутрь, витамина В12 внутримышечно и при комбинированном применении с цисплатином. Общий клиренс производных платины не нарушается при применении пеметрекседа. Применение нестероидных противовоспалительных препаратов (НПВП) в высоких дозах (например, ибупрофена более 1600 мг/сутки или ацетилсалициловой кислоты более 1300 мг/сутки) одновременно с терапией пеметрекседом даже у пациентов с нормальной функцией почек (КК >80 мл/мин) может привести к снижению клиренса пеметрекседа и усилению его побочного действия.
Пациентам с почечной недостаточностью легкой и средней степени тяжести (КК 45-79 мл/мин) не рекомендуется применение НПВП с коротким периодом полувыведения в течение 2-х дней перед применением пеметрекседа, в день применения и на протяжении 2-х дней после применения пеметрекседа.
Ввиду отсутствия данных о возможном взаимодействии между пеметрекседом и НПВП с большим периодом полувыведения (пироксикам, рофекоксиб), пациенты с почечной недостаточностью легкой или умеренной степени выраженности, получающие НПВП, должны прервать их применение минимум за 5 дней до введения пеметрекседа, в день введения и в течение 2-х дней после введения пеметрекседа. Если требуется совместное применение НПВП, пациентам необходим строгий мониторинг токсичности, особенно миелосупрессии и токсичности со стороны желудочно-кишечного тракта (ЖКТ).
Пеметрексед несовместим с раствором Рингера лактата и раствором Рингера. Совместное применение пеметрекседа с другими препаратами и растворами не исследовано, и поэтому не рекомендуется (за исключением 0,9% раствора натрия хлорида).
При одновременном применении с живыми ослабленными вакцинами возможна интенсификация процесса репликации вакцинного вируса, усиление его побочных/неблагоприятных эффектов и/или снижение выработки антител в организме больного в ответ на введение вакцины.
При одновременном применении с пероральными антикоагулянтами следует регулярно контролировать Международное нормализованное отношение (МНО).
Особые указания
Препарат Пемелан® должен применяться под наблюдением врача, имеющего опыт применения противоопухолевых препаратов. Миелосупрессия является дозолимитирующей токсичностью пеметрекседа.
Перед каждым введением пеметрекседа необходимо проводить общий анализ крови с подсчетом лейкоцитарной формулы и количества тромбоцитов.
Для оценки функции почек и печени необходимо периодически проводить биохимический анализ крови.
Перед началом применения препарата абсолютное количество нейтрофилов должно составлять >1500 в мкл, тромбоцитов >100000 в мкл.
Назначение фолиевой кислоты и витамина В12 снижает токсичность пеметрекседа и необходимость редукции дозы при гематологической и негематологической токсичности 3/4 степени, таких как, нейтропения, фебрильная нейтропения и инфекция с нейтропенией 3/4 степени.
Назначение дексаметазона (или его аналога) в дозе 4 мг 2 раза/сутки за 1 день до начала лечения пеметрекседом, в день введения и последующий день после введения пеметрекседа снижает частоту и выраженность дерматологических реакций.
Влияние наличия выпота в серозных полостях (асцита или плеврита) на действие пеметрекседа окончательно не известно. У пациентов с выпотом в серозных полостях, находящихся в стабильном состоянии, не было отмечено различий в концентрациях пеметрекседа в плазме, вводимого в стандартной дозе, или его клиренса по сравнению с пациентами без такового выпота. Таким образом, следует рассмотреть возможность дренирования выпота перед началом лечения пеметрекседом, однако это не является обязательным условием.
Во время терапии пеметрекседом и как минимум в течение 6-ти месяцев после необходимо использовать надежные методы контрацепции.
Влияние на способность управлять транспортными средствами, механизмами
Влияние пеметрекседа на способность управлять транспортными средствами не изучено. Однако пеметрексед может вызывать повышенную утомляемость, поэтому пациентам, у которых наблюдается повышенная утомляемость, не рекомендуется управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Форма выпуска
Лиофилизат для приготовления раствора для инфузий, 100 мг и 500 мг.
По 100 мг или 500 мг пеметрекседа во флаконы бесцветного нейтрального стекла тип I, укупоренные резиновыми пробками и обжатые алюминиевыми колпачками, снабженными пластмассовыми крышечками с надписью «FLIP OFF» или без нее.
1 флакон вместе с инструкцией по применению в пачке из картона.
Условия хранения
Хранить при температуре не выше 25 °С.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять после истечения срока годности, указанного на упаковке.
Условия отпуска
Отпускают по рецепту.
Производитель
АО «Рафарма». Россия
399540, Липецкая область. Тербунский район, поселение Тербунский с/с, с. Тербуны, ул. Дорожная, д. 6А.
Юридическое лицо, на имя которого выдано регистрационное удостоверение, и организация, принимающая претензии потребителей
АО «Рафарма»
399540, Российская Федерация, Липецкая область, Тербунский район, село Тербуны, ул. Дорожная, д. 6А.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
From Wikipedia, the free encyclopedia
 |
|
 |
|
| Clinical data | |
|---|---|
| Trade names | Cylert, others |
| Other names | Pheniminooxazolidinone; Phenylisohydantoin; Phenylpseudohydantoin; Phenilone; 2-Imino-5-phenyl-4-oxazolidinone; 2-Amino-5-phenyl-1,3-oxazol-4(5H)-one |
| AHFS/Drugs.com | Micromedex Detailed Consumer Information |
| Routes of administration |
Oral[1][2] |
| ATC code |
|
| Legal status | |
| Legal status |
|
| Pharmacokinetic data | |
| Protein binding | ≤50%[2][1] |
| Metabolism | Liver[2] |
| Metabolites | Various[2] |
| Elimination half-life | 7–12 hours[1][2] |
| Excretion | Mainly urine[2] |
| Identifiers | |
|
IUPAC name
|
|
| CAS Number |
|
| PubChem CID |
|
| DrugBank |
|
| ChemSpider |
|
| UNII |
|
| KEGG |
|
| ChEBI |
|
| ChEMBL |
|
| CompTox Dashboard (EPA) |
|
| ECHA InfoCard | 100.016.763 |
| Chemical and physical data | |
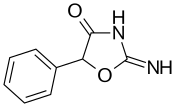
| Formula | C9H8N2O2 |
| Molar mass | 176.175 g·mol−1 |
| 3D model (JSmol) |
|
| Chirality | Racemic mixture |
|
SMILES
|
|
|
InChI
|
|
| |
Pemoline, sold under the brand name Cylert among others, is a stimulant medication which has been used in the treatment of attention-deficit hyperactivity disorder (ADHD) and narcolepsy.[2] It has been discontinued in most countries due to rare but serious problems with liver toxicity.[3][4] The medication was taken by mouth.[2]
Side effects of pemoline include insomnia, decreased appetite, abdominal pain, irritability, and headaches.[1][2] Rarely, the medication can cause serious liver damage, and this can result in liver transplantation or death.[5][6] Pemoline is a psychostimulant and acts as a selective dopamine reuptake inhibitor and releasing agent.[1][7][2] Hence, it functions as an indirect agonist of dopamine receptors.[8] Pemoline has little effect on norepinephrine and hence has minimal or no cardiovascular or sympathomimetic effects, in contrast to many other stimulants.[1][7][2]
Pemoline was synthesized in 1913 but was not discovered to be a stimulant until the 1930s and was not used in the treatment of ADHD until 1975.[9][10][1] It was withdrawn due to liver toxicity in many countries between 1997 and 2005, including the United States.[11][6][12] However, it remains available in Japan for the treatment of narcolepsy at lower doses than used for ADHD.[4] Pemoline is a schedule IV controlled substance in the United States due to its relation to other stimulants and a potential for misuse.[13][14] It seems to have less misuse potential than other stimulants.[1]
Medical uses[edit]
Pemoline has been used in the treatment of ADHD and narcolepsy.[2][1][4] It has also been used in the treatment of excessive daytime sleepiness.[7] The medication was typically used at doses of 18.75 to 112.5 mg once per day in the treatment of ADHD, with the effective dose for most people being in the range of 56.25 to 75 mg.[1][2] The onset of action of pemoline is gradual and therapeutic benefits may not occur until the third or fourth weeks of use.[2][1] This may be due to a cautious low initial starting dose of 37.5 mg and gradual titration in dose upwards over several weeks.[1]
Available forms[edit]
Pemoline was available in the form of 18.75, 37.5, and 75 mg oral immediate-release tablets (Cylert) as well as 37.5 mg oral immediate-release chewable tablets.[1][2] It was provided mainly in the form of the free base but also as the magnesium salt.[15]
Side effects[edit]
Side effects of pemoline include insomnia, decreased appetite, abdominal pain, irritability, and headaches.[1][2] It has minimal cardiovascular or sympathomimetic side effects.[1][2] Pemoline is described as a lower-efficacy/milder stimulant than classical stimulants like amphetamines and methylphenidate and is said to have fewer side effects than them.[16]
Liver toxicity[edit]
Rarely, pemoline is implicated in causing hepatotoxicity.[1][17] Because of this, the FDA recommended that regular liver tests be performed in those treated with it.[18] Since being introduced, it has been linked with at least 21 cases of liver failure, of which 13 resulted in liver replacement or death. Approximately 1–2% of patients taking the drug show elevated levels of liver transaminase enzymes, a marker for liver toxicity, though serious cases are rare. Over 200,000 children with ADHD were prescribed pemoline in the United States and Canada alone during the approximate 25 years that it was available, plus a smaller number of adults prescribed it for other indications (and not including prescriptions in the rest of the world). As such, the number of liver failure cases was statistically not that large. However the reactions proved idiosyncratic and unpredictable, with patients sometimes taking the drug with no issue for months or even years, before suddenly developing severe liver toxicity. There was no clear exposure–toxicity relationship, and no characteristic liver pathology findings. Some patients showed as little as one week between first appearance of jaundice and complete liver failure, and some of the patients that developed liver failure had not showed elevated liver transaminase levels when tested previously.[12] On the other hand, there are no cases of liver failure associated with pemoline in Japan, although it is used at lower doses and is only prescribed for the niche indication of narcolepsy in this country.[4]
Overdose[edit]
Overdose of pemoline may present with choreoathetosis symptoms.[19]
Interactions[edit]
Other stimulants and monoamine oxidase inhibitors are contraindicated with pemoline.
Pharmacology[edit]
Pharmacodynamics[edit]
The pharmacodynamics of pemoline are poorly understood and its precise mechanism of action hasn’t been definitively determined.[1][2] However, pemoline has similar activity and effects to those of other psychostimulants, and in animals the medication appears to act as a dopamine reuptake inhibitor and releasing agent.[1] By increasing dopamine levels in the brain, it functions as an indirect agonist of dopamine receptors.[8] In contrast to most other stimulants, pemoline appears to produce no significant central or peripheral noradrenergic effects.[1] As a result, it has minimal or no cardiovascular or sympathomimetic effects.[1] Pemoline is described as a selective dopamine reuptake inhibitor that only weakly stimulates dopamine release.[7]
While drugs like dextroamphetamine and methylphenidate are classified as schedule II and have considerable misuse potential, pemoline is listed as schedule IV (non-narcotic).[2] In studies conducted on primates, pemoline fails to demonstrate a potential for self-administration.[2] It is thought to have little potential for abuse and dependence.[1] Nonetheless, misuse may theoretically occur owing to its similarity to other psychostimulants.[2]
Pharmacokinetics[edit]
Studies of the pharmacokinetics of pemoline in humans are very limited.[1] The time to peak levels of pemoline is 2 to 4 hours.[2][1] Peak levels have been reported to be in the range of 2 to 4.5 μg/mL.[1] Steady-state levels of pemoline are reached in 2 to 3 days.[2]
Pemoline is variously reported to have no significant plasma protein binding or to have 50% plasma protein binding.[1][2]
Pemoline is metabolized in the liver.[2] Its metabolites include pemoline conjugate, pemoline dione, mandelic acid, and unidentified polar metabolites.[2]
Pemoline is excreted mainly by the kidneys with around 50% excreted in unchanged form and only minor amounts present as metabolites.[2] The elimination half-life of pemoline is 7 to 12 hours.[1][2] The half-life is 7 hours in children but may increase to 11 to 12 hours with age.[1] The relatively long half-life of pemoline allows for once-daily administration.[1]
No differences in the pharmacokinetics of pemoline were found with conventional tablets, chewable tablets swallowed, or chewable tablets chewed.[1]
Chemistry[edit]
Pemoline is a member of the 4-oxazolidinone class and is structurally related to other members of the class including aminorex, 4-methylaminorex, clominorex, cyclazodone, fenozolone, fluminorex, and thozalinone.
The salts of pemoline in use are pemoline magnesium (free base conversion ratio .751), pemoline iron (.578), pemoline copper (.644), pemoline nickel (.578), pemoline rubidium, pemoline calcium, pemoline chromium, and chelates of the above which are identical in weight to the salt mentioned. Pemoline free base and pemoline cobalt, strontium, silver, barium, lithium, sodium, potassium, zinc, manganese, and caesium are research chemicals which can be produced in situ for experiments.[14][20][21] Others such as lanthanide pemoline salts such as pemoline cerium can be prepared; pemoline beryllium would presumably be toxic.
History[edit]
Pemoline was first synthesized in 1913[22][9] but its activity was not discovered until the 1930s.[10] Pemoline was approved for the treatment of ADHD in the United States in 1975.[1][4]
Cases of serious liver toxicity and associated death related to pemoline in children and adolescents were reported to the United States Food and Drug Administration’s MedWatch between 1977 and 1996.[6] Serious liver toxicity with pemoline was first described in the medical literature in 1984 and 1989 letters to the editor.[6] Clinicians were little-aware of liver toxicity with pemoline until the 1990s.[6] Warnings for liver toxicity for pemoline were added to the United States Food and Drug Administration (FDA) label for the medication in December 1996 and a black box warning was added in June 1999 along with requirements for written consent and frequent monitoring of liver enzymes.[11][12][6] These warnings followed a 1995 publication on liver toxicity with pemoline.[6][23] However, findings suggested that clinicians poorly followed the FDA’s directives on use of pemoline.[11] In any case, sales of pemoline in the United States increased until 1997 and declined between 1996 and 1999.[6] Pemoline was withdrawn due to liver toxicity in the United Kingdom in September 1997, in Canada in September 1999, and in the United States in 2005.[11][24][12][6] Abbott Laboratories voluntarily withdraw pemoline from the United States market in May 2005 and the FDA withdrew approval of generic pemoline in November 2005.[11][12] Pemoline remains available in Japan for treatment of narcolepsy as of 2017.[4]
Society and culture[edit]
Names[edit]
Pemoline is the generic name of the drug and its INN, USAN, and BAN.[22][15]
Pemoline was formerly marketed under the brand names Cylert, Betanamin, Ceractiv, Hyperilex, Kethamed, Ronyl, Stimul, Tamilan, Tradon, Tropocer, and Volital.[15][25][22]
Availability[edit]
Pemoline has been marketed in the United States, Canada, the United Kingdom, Belgium, Luxembourg, Spain, Germany, Switzerland, and Argentina.[15] It remains available in Japan for the treatment of narcolepsy as of 2017.[4] However, the medication is said to be rarely used in Japan as narcolepsy is a niche indication and as clinicians are wary of the liver toxicity that it has been associated with.[4][26]
Legal status[edit]
Under the Convention on Psychotropic Substances, it is a schedule IV controlled substance.[13] Pemoline is Schedule IV Non-Narcotic (Stimulant) controlled substance with a DEA ACSCN of 1530 and is not subject to annual manufacturing quotas.[14]
Research[edit]
Fatigue[edit]
Pemoline has been studied in and reported to be effective in the treatment of fatigue due to multiple sclerosis and HIV-related disease.[27]
References[edit]
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad Patrick KS, Markowitz JS (November 1997). «Pharmacology of methylphenidate, amphetamine enantiomers and pemoline in attention-deficit hyperactivity disorder». Human Psychopharmacology: Clinical and Experimental. 12 (6): 527–546. doi:10.1002/(SICI)1099-1077(199711/12)12:6<527::AID-HUP932>3.0.CO;2-U. eISSN 1099-1077. ISSN 0885-6222. S2CID 144548631.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab «Cylert (Pemoline)» (PDF). FDA. December 2002. Archived (PDF) from the original on 4 March 2016. Retrieved 15 February 2014.
- ^ Billiard M (June 2008). «Narcolepsy: current treatment options and future approaches». Neuropsychiatr Dis Treat. 4 (3): 557–66. PMC 2526380. PMID 18830438.
- ^ a b c d e f g h Shader RI (April 2017). «Risk Evaluation and Mitigation Strategies (REMS), Pemoline, and What Is a Signal?». Clin Ther. 39 (4): 665–669. doi:10.1016/j.clinthera.2017.03.008. PMID 28366595.
- ^ Nakamura H, Blumer JL, Reed MD (March 2002). «Pemoline ingestion in children: a report of five cases and review of the literature». J Clin Pharmacol. 42 (3): 275–82. doi:10.1177/00912700222011292. PMID 11865963. S2CID 27024140.
- ^ a b c d e f g h i Safer DJ, Zito JM, Gardner JE (June 2001). «Pemoline hepatotoxicity and postmarketing surveillance». J Am Acad Child Adolesc Psychiatry. 40 (6): 622–9. doi:10.1097/00004583-200106000-00006. PMID 11392339.
- ^ a b c d Nishino S, Mignot E (May 1997). «Pharmacological aspects of human and canine narcolepsy». Prog Neurobiol. 52 (1): 27–78. doi:10.1016/s0301-0082(96)00070-6. PMID 9185233. S2CID 31839355.
- ^ a b Solanto MV (July 1998). «Neuropsychopharmacological mechanisms of stimulant drug action in attention-deficit hyperactivity disorder: a review and integration». Behav Brain Res. 94 (1): 127–52. doi:10.1016/s0166-4328(97)00175-7. PMID 9708845. S2CID 11110885.
- ^ a b Chemische Berichte, 1913, vol.46, p. 2083
- ^ a b Acta Academiae Aboensis, Series B: Mathematica et Physica, 1939, vol. 11, #14 p. 3,7
- ^ a b c d e Zito JM, Derivan AT, Kratochvil CJ, Safer DJ, Fegert JM, Greenhill LL (September 2008). «Off-label psychopharmacologic prescribing for children: history supports close clinical monitoring». Child Adolesc Psychiatry Ment Health. 2 (1): 24. doi:10.1186/1753-2000-2-24. PMC 2566553. PMID 18793403.
- ^ a b c d e Etwel FA, Rieder MJ, Bend JR, Koren G (2008). «A surveillance method for the early identification of idiosyncratic adverse drug reactions». Drug Saf. 31 (2): 169–80. doi:10.2165/00002018-200831020-00006. PMID 18217792. S2CID 19964105.
- ^ a b «List of psychotropic substances under international control» (PDF) (23rd ed.). Viennam, Austria: International Narcotics Control Board. August 2003. Archived from the original (PDF) on 5 December 2005.
Annual Estimates Of Requirements Of Narcotic Drugs, Manufacture Of Synthetic Drugs, Opium Production And Cultivation
- ^ a b c DEA office of Diversion Control site: Federal Register publications of CSA schedules, 2014 Q1
- ^ a b c d Swiss Pharmaceutical Society (2000). Swiss Pharmaceutical Society (ed.). Index Nominum 2000: International Drug Directory. Taylor & Francis. pp. 799–. ISBN 978-3-88763-075-1.
- ^ Nishino S, Kotorii N (2016). «Overview of Management of Narcolepsy». Narcolepsy. Springer International Publishing. pp. 285–305. doi:10.1007/978-3-319-23739-8_21. ISBN 978-3-319-23738-1.
- ^ Marotta PJ, Roberts EA (May 1998). «Pemoline hepatotoxicity in children». J. Pediatr. 132 (5): 894–7. doi:10.1016/S0022-3476(98)70329-4. PMID 9602211.
- ^ Willy ME, Manda B, Shatin D, Drinkard CR, Graham DJ (July 2002). «A study of compliance with FDA recommendations for pemoline (Cylert)». J Am Acad Child Adolesc Psychiatry. 41 (7): 785–90. doi:10.1097/00004583-200207000-00009. PMID 12108802. Archived from the original on 2021-05-31. Retrieved 2020-09-10.
- ^ Stork CM, Cantor R (1997). «Pemoline induced acute choreoathetosis: case report and review of the literature». J. Toxicol. Clin. Toxicol. 35 (1): 105–8. doi:10.3109/15563659709001175. PMID 9022662.
- ^ The A-Z Encyclopaedia of Alcohol and Drug Abuse
- ^ CRC Handbook of Chemistry & Physics
- ^ a b c Elks J, ed. (14 November 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. pp. 70–. ISBN 978-1-4757-2085-3. OCLC 1058412474.
- ^ Berkovitch M, Pope E, Phillips J, Koren G (June 1995). «Pemoline-associated fulminant liver failure: testing the evidence for causation». Clin Pharmacol Ther. 57 (6): 696–8. doi:10.1016/0009-9236(95)90233-3. PMID 7781270. S2CID 37312352.
- ^ Shah RR (September 2006). «Can pharmacogenetics help rescue drugs withdrawn from the market?». Pharmacogenomics. 7 (6): 889–908. doi:10.2217/14622416.7.6.889. PMID 16981848.
- ^ Ashutosh Kar (2005). Medicinal Chemistry. New Age International. pp. 201–. ISBN 9788122415650. OCLC 818800751.
- ^ Takeda T (March 2009). «Psychopharmacology for attention-deficit/hyperactivity disorder in Japan». Current Attention Disorders Reports. 1 (1): 21–28. doi:10.1007/s12618-009-0004-5. eISSN 1943-457X. ISSN 1943-4561. S2CID 3559647.
- ^ Kaminski M, Sjøgren P (2007-02-22). «The use of psychostimulants in palliative and supportive treatment of cancer patients». Advances in Palliative Medicine (in Polish). 6 (1): 23–32. ISSN 1898-3863. Retrieved 2022-05-09.

