В основе любого живого организма лежат белки и аминокислоты. Они входят в состав клеточных оболочек, являются основой гормонов, антител и многих других биологически активных веществ. Их строение и процесс воспроизводства зависит от ДНК. У человека в этой молекуле содержится более 22500 генов, которые кодируют все белки организма. А руководят этим процессом различные сочетания аминокислотных остатков, которые называют пептидами.
Что это такое
Для того чтобы разобраться с определением пептиды, что это такое и какая их функция, нужно немного углубиться в биохимию. Считается, что это любое вещество, в состав которого входят только аминокислотные остатки. От их количества зависит тип пептида и его молекулярная масса. Поэтому исследователи придерживаются такой классификации:
- белки – крупные молекулы, которые состоят из 50 и более аминокислот;
- полипептиды – включают в себя 20–50 фрагментов аминокислот;
- олигопептиды – в них входит 10–20 аминокислотных остатков;
- короткие пептиды – содержат до 10 аминокислот.
Причем последний тип тоже делится на виды. В зависимости от количества компонентов выделяют дипептид, что значит 2 аминокислоты, трипептид – 3, тетрапептид – 4 фрагмента. Именно их считают биологическими регуляторами, включающими нужные гены. Это открытие в 1970 г. сделал русский профессор, геронтолог В. Х. Хавинсон. Он искал эффективный способ замедлить старение и увеличить устойчивость организма к негативным факторам.
Механизм действия
Пептидные биорегуляторы есть в любом организме. Они образуются после естественного распада длинных белковых молекул. Полученные маленькие фрагменты проникают обратно в клетки и присоединяются к своим генам. Причем они образуют связь по принципу «ключ – замок». Это значит, что каждому типу тканей соответствует строго свой пептид. Он активирует спящий участок ДНК. Используя его как лекало, клетка начинает синтезировать разрушенный белок. Но, несмотря на то, что регуляторы возникают в самом организме, с возрастом их физиологический синтез постепенно уменьшается. А неправильный образ жизни, стрессы, алкоголь, плохая экология и накопленные недуги становятся катализаторами и увеличивают масштабы повреждения ДНК. Все это означает, что потребность человека в пептидах растет. Если ее не восполнить, запускаются или усугубляются различные патологические изменения. Поэтому биорегуляторы в таблетках можно начинать принимать всем людям после 30 лет. Так может поддерживаться и улучшаться синтез собственных белков и гормонов, замедляться процессы старения.
Основные особенности
Исследование биорегуляторов продолжается более 40 лет. Ученые смогли подробно изучить, как они работают, и найти отличия от других биологически активных веществ в человеческих тканях. Например, витамины тоже нужны организму, но они действуют по-другому и при избытке вызывают токсические реакции. А синтетические витаминные соединения способны провоцировать аллергические процессы. В отличие от них, пептиды являются натуральными тканевыми компонентами и не наносят вреда. Они не расщепляются ферментами в пищеварительном тракте, переносятся в неизменном виде и легко проникают внутрь клеток. Там запускается восстановление синтеза белка. Если же биорегуляторов уже достаточно, лишние не будут действовать и просто покинут организм естественным путем.
Чем они отличаются от остальных добавок
Биорегуляторы не являются лекарственными средствами, но и простыми пищевыми добавками их считать нельзя. Они безопасны для организма, потому что относятся к натуральным компонентам клеток. Поэтому при их использовании не появится непереносимость или привыкание. При этом пептиды не действуют напрямую, как, например, таблетка обезболивающего или гормонального средства. После применения они запускают в тканях синтез собственных белков и веществ на их основе. Кроме того, механизм действия биорегуляторов и способность влиять на здоровье изучены и подтверждены в многочисленных исследованиях. А профессор В. Х. Хавинсон является обладателем патентов на пептидные соединения различных типов*. Это позволило создать натуральные добавки, предназначенные для приема внутрь. Долгое время их использовали, чтобы поддерживать работу определенного органа. Но оказывается, что для терапии и профилактики патологий больше подходит другой метод.
Для чего объединять пептиды в комплексы
Врачи знают, что недуг обычно не поражает один орган, а вовлекает в патологический процесс целую систему, а иногда и несколько. Например, у людей с проблемами сердца нужно не только улучшать функцию миокарда, но и восстанавливать сосуды, следить за состоянием липидного обмена, который зависит от печени, а при диабете заботиться о сердечно-сосудистой и иммунной системе. Поэтому ученые компании Vitual Laboratories объединили биорегуляторы в пептидные комплексы. В их состав включены 3–5 активных компонентов, которые помогают улучшать функцию сразу нескольких взаимосвязанных между собой органов. Польза от такого сочетания возрастает. К примеру, для улучшения иммунной функции применяют комплекс «Протектор 3 Плюс»**. Он помогает стабилизовать деление клеток костного мозга, нормализовать их дифференцировку в тимусе и поддержать работу эпифиза – регулятора нейроэндокринной системы. Такие комплексы составлены для каждой системы.
Кому можно принимать пептиды
Биорегуляторы можно принимать, чтобы предупредить или снизить риск развития различных патологий. Но некоторые совмещают курс с основной терапией, назначенной врачом. Полезный эффект можно заметить в следующих случаях:
- сниженная работоспособность, чувство нехватки энергии;
- уменьшение полового влечения у женщин и мужчин;
- восстановление после патологии сердечно-сосудистой системы;
- недостаточный иммунитет и склонность к воспалительным процессам;
- проблемы с опорно-двигательным аппаратом;
- ухудшение пищеварения и связанные с этим реакции;
- чувство снижения памяти и внимания, рассеянность;
- частые стрессы, переживания или период повышенных физических нагрузок.
Уже первый курс биорегуляторов помогает улучшить субъективные ощущения, нормализовать здоровье. Причем комплексы подходят мужчинам и женщинам любого возраста. А по описанию добавки и его состава можно легко подобрать средство для решения конкретной проблемы.

Эффекты после использования биорегуляторов
Комплексы компании Vitual Laboratories помогают решать проблемы здоровья и делают это не только во время курса. Достаточно долгое время после него могут сохраняться положительные эффекты. Какие бывают улучшения:
- легче переносятся стрессы, увеличивается устойчивость к ним;
- повышается работоспособность, появляется ощущение прилива энергии;
- нормализуется половая функция;
- восстанавливается пищеварение;
- реже беспокоит насморк или простуда;
- меньше обостряются хронические недуги.
Жителям больших городов, которые часто подвержены нервному перенапряжению, находятся в плохой экологической обстановке, переутомляются, пептидные комплексы могут помочь снизить слияние негативных факторов и предотвратить раннее появление различных патологий. А тем, кто уже приобрел букет заболеваний, регуляторы позволят укрепить здоровье. Следуя простой инструкции к комплексу, это можно сделать за несколько недель.
Заказать натуральные пептидные комплексы компании Vitual Laboratories можно, оставив заявку на сайте. Наш оператор бесплатно перезвонит, ответит на оставшиеся вопросы, поможет подобрать подходящее средство и оформить доставку. Мы отправим заказ в любой регион Российской Федерации.
* https://khavinson.info/patents
** НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ.
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Бабина С.А.
1
Желтышева А.Ю.
1
Шуклин Г.О.
1
Шуклина А.А.
1
Япаров А.Э.
1
1 ФГБОУ ВО «Пермский государственный медицинский университет им. академика Е.А. Вагнера»
Пептиды являются универсальными биорегуляторами, контролирующими большинство биохимических процессов в любом живом организме. Получение лекарственных препаратов на основе пептидов открыло новую эру в фармакологии, и медицине, а именно эру возможностей регулирования любого биохимического процесса в организме человека, путем синтеза аналогов естественных биопептидов и их введения в организм с лечебной или профилактической целью. Лекарственные препараты на основе пептидов обладают высоко избирательным и эффективным действием, и в то же время они относительно безопасными и характеризуются хорошей переносимостью, что обуславливает повышенный интерес к их изучению и разработкам. Рынок пептидных препаратов сегодня переживает настоящий бум, связанный с появлением многочисленных пептидных лекарственных средств. В настоящее время приблизительно 140 пептидных терапевтических средств оцениваются в клинических испытаниях. Учитывая, что самые простые механизмы воздействия пептидов уже используются, необходимо исследовать новые пути воздействия пептидов и возможности их применения. Примерами таких подходов являются многофункциональные и проникающие в клетку пептиды, а также конъюгаты пептидных лекарственных средств. Индивидуализированный подход к лечению больных, который может быть обеспечен с помощью использования пептидных лекарственных средств в будущем может стать нормой для лечения каждого больного.
Пептиды
пептидная терапия
получение пептидных препаратов
1. Padhi, A. et al. (2014) Antimicrobial peptides and proteins in mycobacterial therapy: Current status and future prospects. Tuberculosis 94, 363–73.
2. Buchwald, H. et al. (2014) Effects on GLP-1, PYY, and leptin by direct stimulation of terminal ileum and cecum in humans: implications for ileal transposition. Surg. Obes. Relat. Dis. http://dx.doi.org/10.1016/j.soard.2014.01.032.
3. Дедов, И.И. Новые возможности терапии сахарного диабета 2 типа /И. И. Дедов//.- Сахарный диабет.- 2009, спецвы-пуск.П С.1-3.
4. Giordano, C. et al. (2014) Neuroactive peptides as putative mediators of antiepileptic ketogenic diets. Front. Neurol. 5, 63.
5. Анисимов В.Н., Хавинсон В.Х. Применение пептидных препаратов эпифиза (шишковидной железы) в онкологии: двадцатилетний опыт исследования эпиталамина // Вопр. онкол.—1993.—Т. 39.—С. 131– 142.
6. Kaspar, A.A. and Reichert, J.M. (2013) Future directions for peptide therapeutics development. Drug Discov. Today 18, 807–817.
7. Steidler, L. et al. (2009) Actobiotics as a novel method for cytokine delivery. Ann. N. Y. Acad. Sci. 1182, 135–145.
8. Robinson, S.D. et al. (2014) Diversity of conotoxin gene superfamilies in the venomous snail, Conus victoriae. PLoS ONE 9, e87648.
9. Transparency Market Research (2012) Peptide Therapeutics Market: Global Industry Analysis, Size, Share, Growth, Trends and Forecast 2012–2018, Transparency Market Research.
10. Schulte, I. et al. (2005) Peptides in body fluids and tissues as markers of disease. Expert Rev. Mol. Diagn. 5, 145–157.
11. Delgado, C. et al. (1992) The uses and properties of PEG-linked proteins. Crit. Rev. Ther. Drug Carrier Syst. 9, 249–304.
12. Hamley, I.W. (2007) Peptide fibrillization. Angew. Chem. Int. Ed. Engl. 46, 8128–8147.
13. Riber, D. et al. (2013) A novel glucagon analogue, ZP-GA-1, displays increased chemical and physical stability in liquid formulation. Diabetes 62, A99–A172.
14. Timmerman, P. et al. (2009) Functional reconstruction of structurally complex epitopes using CLIPSTM technology. Open Vaccine J. 2, 56– 67.
15. Pocai, A. (2012) Unraveling oxyntomodulin, GLP1’s enigmatic brother. J. Endocrinol. 215, 335–346.
16. Larsen, B. et al. Zealand Pharma A/S. Pharmacologically active peptide conjugates having a reduced tendency towards enzymatic hydrolysis. US 6,528,486 B1, WO 99/46283.
17. Knudsen, L.B. (2010) Liraglutide: the therapeutic promise from animal models. Int. J. Clin. Pract. XX[LM2], (Suppl.) 4–11.
Цель исследования – изучение преимуществ и недостатков пептидных препаратов, их применения, путей введения, традиционных и новых возможностей в разработке пептидных препаратов.
Материалы и методы: Повествовательный обзор, основанный на поисках литературы в текстовой базе данных медицинских и биологических публикаций PubMed, а также в российской научной электронной библиотеке eLIBRARY до июня 2019 года без ограничений по срокам. Поиск включал такие термины, как «пептиды», «пептидная терапия», «пептидные технологии».
Введение
На сегодняшний день известно более 7000 встречающихся в природе пептидов, многие из которых выполняют важные функции в организме, включая действия в качестве гормонов, нейротрансмиттеров, факторов роста, лигандов ионных каналов или противоинфекционных средств [1]. Пептиды являются селективными сигнальными молекулами, которые связываются со специфическими поверхностными рецепторами клеток, такими как G-белок-связанные рецепторы (GPCR) или ионными каналами, запуская тем самым внутриклеточные реакции. Учитывая их привлекательный фармакологический профиль и другие свойства, такие как безопасность, хорошая переносимость и эффективность, пептиды представляют собой оптимальную основу для разработки новых терапевтических средств. Кроме того, получение пептидов связано с более низкой сложностью производства по сравнению с биофармацевтическими препаратами на основе белков и, следовательно, связанно с более низкими расходами. Однако встречающиеся в природе пептиды часто не подходят для использования в качестве терапевтических средств, так как они имеют ряд недостатков, включая химическую и физическую нестабильность, а также короткий период полураспада в циркулирующей плазме крови. Некоторые из этих недостатков могут быть успешно устранены с помощью методов традиционной конструкции и ряда других разрабатываемых в настоящее время технологий. К таким технологиям относятся многофункциональные и проникающие в клетку пептиды, а также конъюгаты пептидных лекарственных [2,3].
Основная часть
Рынок пептидных препаратов
За последнее десятилетие пептиды нашли широкое применение в медицине и биотехнологии. В настоящее время существует более 60 утвержденных управлением по контролю за продуктами и лекарствами США (FDA) пептидов на рынке, и эта цифра, как ожидается, значительно вырастет, так как приблизительно 140 пептидных препаратов в настоящее время уже проходят клинические испытания, а доклинические — более 500 [4].
Применение пептидов
Основными заболеваниями, при которых в настоящее время используются и активно изучаются пептидные препараты, являются метаболические и онкологические заболевания. Заболевания из первой группы включают в себя ожирение и сахарный диабет 2 типа, характеризующиеся в последнее время эпидемическим ростом, заболевания второй группы характеризуются ростом смертности и необходимости замены химиотерапии, а также поддерживающей терапии. Примером пептидных препаратов для лечения сахарного диабета 2 типа (СД2) является новый класс пептидов — агонистов глюкагоноподобного пептида-1 (GLP-1) [5].
Помимо перечисленных заболеваний в последнее время разрабатываются пептидные препараты для лечения редких заболеваний, например, тедуглутид — агонист рецептора GLP-2, используемый для лечения синдрома короткой кишки, а также пасиреотид — агонист соматостатиновых рецепторов, используемый для лечения синдрома Кушинга. Кроме того, рассматривается возможность применения пептидов при заболеваниях инфекционного и воспалительного характера, при этом несколько пептидов уже проходит клинические испытания [6].
Помимо применения пептидов в качестве лекарственных средств, возможно их использование в качестве биомаркеров с диагностической целью. Наконец, пептиды также нашли применение в качестве вакцин [7].
Пути введения пептидов в организм
В настоящее время большинство пептидных лекарств вводят парентеральным путем, тем не менее, разрабатываются альтернативные формы введения, включая пероральный, интраназальный, и трансдермальный пути, в соответствии с развитием технологий. Одним из примеров альтернативных путей введения пептидов является препарат мидазол, с трансбукальным способом введения. В настоящее время разрабатываются системы трансбуккальной доставки, в которых используются гликонаночастицы золота [8]. Другие разрабатываемые системы могут обеспечить пероральную доставку пептидов, непосредственно экспрессируемых в желудочно-кишечном тракте.
Использование альтернативных форм введения может также обеспечить более широкое использование пептидной терапии при других состояниях, таких как воспаление, где местное введение пептидов может стать эффективным методом лечения [9].
Традиционные технологии конструирования пептидов
С целью избавления от таких недостатков применения природных пептидов как короткий период полувыведения и плохие физико-химические свойства, с которыми связана агрегация и плоха растворимость пептидов, используют ряд технологий
Вначале проводится определение аминокислотной структуры пептида и выявление в ней константных участков и участков возможной замены без изменения свойств. Данный анализ возможно осуществить, например, с помощью аланиновых замен отдельных аминокислот с последующим изучением полученного пептида. Важным в этом процессе, особенно когда необходимо получение жидких лекарственных форм, является определения химически лабильных аминокислот, подверженных таким процессам как изомеризация, гликозилирование или окисление, что является нежелательным [10].
В дальнейшем возможно ограничение ферментативного расщепления пептида путем идентификации возможных сайтов молекулярного расщепления с последующей заменой соответствующих аминокислот. Защита от ферментативного расщепления также может быть достигнута путем усиления вторичной структуры пептидов. Этот подход включает в себя вставку зонда, определяющего новую структуру, вставку лактамных мостиков, сшивание или клипирование пептидных последовательностей, а также циклизацию пептидов. Полиэтиленгликольилирование было использовано для ограничения глобулярной фильтрации и тем самым увеличения периода полувыведения пептидов из плазмы крови. К другим способам стабилизации пептидов относится связывание их с циркулирующим белком альбумином, в качестве носителя, для продления периода полураспада, что приводит к появлению пептидных препаратов пролонгированного действия, которые можно вводить до одного раза в неделю [11].
С целью улучшения физико-химических свойств пептидов, в частности уменьшения агрегации, производят разрушение гидрофобных участков в структуре пептида, что может быть достигнуто с помощью замены или N-метилирования определенных аминокислот. Для улучшения растворимости определенного пептидного препарата, изменяется распределение его зарядов, с помощью вставок или замены аминокислот что приводит к изменению изоэлектрической точки пептида и его стабилизации при рН желаемой рецептуры конечного продукта. Физико-химические свойства пептидов также могут быть улучшены путем введения стабилизирующих структур, таких как α-спираль или лактамные мостики [12].
Считается что пептидные препараты второго поколения, оптимизированные для терапевтического использования с помощью перечисленных технологий, оказались более удобными для применения. Дальнейшее развитие пептидной терапии связывают с быстрым появлением и дальнейшей миниатюризацией специальных устройств, насосов и систем обратной связи с сенсорами, и автоматизированным управлением, что позволило бы осуществить умную доставку пептидов [13].
Новые пептидные технологии
Существует огромное количество природных пептидов, некоторые из которых могут являться хорошей основой для создания новых пептидных препаратов. Большой интерес на сегодняшний день представляют исследования обмена веществ в кишечнике, так как он богат разнообразными микроорганизмами, изучение которых может привести к идентификации новых пептидов из фрагментов микробных белков, продуктов распада или сигнальных молекул. Продолжающиеся исследования микроорганизмов помогут значительно обогатить спектр имеющихся пептидных препаратов и тем самым повысить возможности для пептидной терапии в будущем [14].
Многофункциональные пептиды
Среди новых технологий в этой области — многофункциональные пептиды, имеющие более одного фармакологического действия, например, двойной или даже тройной агонизм. Применение данных препаратов дает возможность осуществления более индивидуализированного подхода к лечению пациентов. Современные многофункциональные пептиды, находятся в стадии разработки, включая антимикробные пептидные препараты, которые имеют дополнительные биологические функции, такие как иммуностимуляция или заживление ран. Двойные агонисты GLP 1-GCG обеспечивают большую потерю веса при избыточной массе тела пациентов с сахарным диабетом 2 типа по сравнению с чистым агонистом GLP-1, благодаря увеличению энергозатрат на основе GCG. Эти примеры иллюстрируют, как добавление дополнительного действия к установленному, может обеспечить более индивидуализированный лечебным подходам с повышенной эффективностью.
Способы получения многофункциональных пептидов могут включать гибридизацию двух пептидов, связываемых вместе как модули либо напрямую, либо через линкер, либо с помощью образования химер, где вторая фармакологическая активность «спроектирована» для уже существующего пептидного остова [15].
Одной из проблем разработки многофункциональных пептидов является возможное несоответствие эффектов нового препарата, полученных in vitro и его воздействия in vivo, при этом в организме могут включится новые пути действия препарата, не связанные с запланированным эффектом. Кроме того, перевод результатов исследований препаратов, полученных от животных моделей на человека, также является проблемой. В целом сложность предсказывания эффектов многофункциональных пептидов в организме резко возрастает, что требует дальнейшего развития аналитического и экспериментального процесса в фармакологии.
Проникающие в клетку пептиды
Способы введения в организм лекарственных средств непрерывно совершенствуются. Возникают новые, более тонкие иглы и приборы, осуществляющие парентеральное введение лекарственных средств, разрабатываются пероральные системы со сложным механизмом высвобождения лекарственных средств, все это направленно на повышение эффективности терапии в результате повышения биодоступности лекарств в области нахождения их мишени.
Одной из важных проблем применения лекарственных средств на основе пептидов является плохая способность нативных пептидов переходить через клеточную мембрану, для воздействия на внутриклеточную мишень, что ранее ограничивало их терапевтическое применение.
В последние годы были изобретены «проникающие в клетку пептиды», использование которых повышает вероятность связывания пептидов с их внутриклеточными мишенями, так как при применении обычных лекарственных средств только часть пептидного препарата достигает цели [16].
Конъюгирование пептидов
К новым пептидным технологиям также можно отнести конъюгирование пептидов, например, с небольшими молекулами, олигорибонуклеотидами или антителами предоставляющее возможность для разработки новых пептидных терапевтических средств с улучшенной эффективностью и безопасностью. Например, в онкологии этот подход вызвал большой интерес, в результате чего более 20 пептидных конъюгатов проходят клинические испытания. Уже был продемонстрирован довольно удачный способ сопряжения пептидного агониста рецептора нейротензина 1 с радиоактивным лигандом для лечения рака поджелудочной железы, при этом первый компонент осуществляет прицельную доставку второго к органу мишени, создавая высокую местную концентрацию химиопрепарата в опухолевом очаге. Данный метод может помочь устранить главную проблему применения химиотерапии, уменьшая системные побочные эффекты и повышая эффективность применения препарата. В конъюгатах пептид-антитело часть антитела может играть роль целевого объекта, тогда как пептид является эффекторной частью [17].
Заключение
Дальнейшая разработка пептидных препаратов будет основываться на встречающихся в природе пептидах с применением традиционных пептидных технологий для улучшения их слабых мест, таких как как их химические и физические свойства, а также короткий период полураспада.
Также ожидается, что новые пептидные технологии, в том числе многофункциональные пептиды, пептиды, проникающие в клетки, и конъюгаты пептидных лекарственных средств, помогут расширить сферу применения пептидов в качестве терапевтических средств.
Пептиды обладают огромным потенциалом в качестве будущих препаратов для успешного решения многих медицинских проблем.
Библиографическая ссылка
Бабина С.А., Желтышева А.Ю., Шуклин Г.О., Шуклина А.А., Япаров А.Э. ЛЕКАРСТВЕННЫЕ СРЕДСТВА НА ОСНОВЕ ПЕПТИДОВ: ПРИМЕНЕНИЕ, ТЕХНОЛОГИИ ПОЛУЧЕНИЯ // Международный студенческий научный вестник. – 2019. – № 3.
;
URL: https://eduherald.ru/ru/article/view?id=19681 (дата обращения: 16.07.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Клиническая фармакология Тимогена®. Глава 2
Долгов Г.В., Куликов С.В., Легеза В.И., Малинин В.В., Морозов В.Г., Смирнов В.С., Сосюкин А.Е.
УДК 61.438.1:577.115.05
Под редакцией проф. В.С. Смирнова.
Авторский коллектив:
- Долгов Г.В. — д.м.н., профессор кафедры акушерства и гинекологии Военно-медицинской академии
- Куликов С.В. — к.м.н., старший научный сотрудник отдела нейрофармакологии Института экспериментальной медицины РАМН
- Легеза В.И.— д.м.н., профессор ведущий научный сотрудник кафедры Военно-полевой терапии Военно-медицинской академии
- Малинин В.В. — д.м.н., начальник отдела Института биорегуляции и геронтологии СЗО РАМН
- Морозов В.Г. — д.м.н., профессор заместитель директора Института биорегуляции и геронтологии СЗО РАМН
- Смирнов В.С. — д.м.н., профессор ведущий научный сотрудник кафедры военно-полевой терапии Военно-медицинской академии
- Сосюкин А.Е. — д.м.н., профессор начальник кафедры военно- полевой терапии Военно-медицинской академии
Опубликовано в СПб, 2003. — 103 с.
2003
Тимоген
Скачать PDF
Введение
Глава 1. Механизмы пептидной регуляции гомеостаза (В.В. Малинин, В.Г. Морозов)
Глава 2. Регуляторные пептиды тимуса (В.С. Смирнов)
Глава 3. Тимоген®: структура, химический синтез, свойства (С.В. Куликов, В.С. Смирнов)
Глава 4. Тимоген® в профилактике и комплексной терапии инфекционных заболеваний (В.С. Смирнов)
Глава 5. Тимоген® в терапии бронхолегочных заболеваний (В.С. Смирнов)
Глава 6. Применение тимогена в комплексной терапии внутренних болезней (В.С. Смирнов, А.Е. Сосюкин)
Глава 7. Тимоген® в дерматологии (В.С. Смирнов)
Глава 8. Применение Тимогена® для профилактики и лечения радиационных поражений (В.И.Легеза, В.С. Смирнов)
Глава 9. Применение Тимоген® в комплексном лечении механических и термических травм (В.С. Смирнов)
Глава 10. Тимоген® в акушерско-гинекологической практике (Г.В. Долгов, В.С. Смирнов)
Глава 11. Особенности применения Тимогена® в педиатрии (В.С. Смирнов)
Заключение
Глава 2. Пептиды тимуса и пептидные тимомиметики
В.С. Смирнов
Среди различных регуляторных структур организма иммунная система по своей сложности и многофункциональности занимает особое место. Значительная дифференциация функций иммунокомпетентных клеток, большое число их субпопуляций, клонов и способов взаимодействия требуют высокоразвитых селективных и неселективных механизмов передачи информации, обеспечивающих скоординированную работу системы в целом. Большинство эффекторных и вспомогательных функций клеток иммунной системы осуществляются при участии особых эндогенных структур внутрисистемных гормонов и медиаторов. Именно эти молекулы обеспечивают созревание и дифференцировку разных типов клеток, служат передатчиками межклеточных регуляторных сигналов, образуя уже упоминавшуюся APUD-систему, осуществляют контроль над интенсивностью и длительностью иммунного ответа.
Экстракты ткани тимуса
Уникальные свойства эндогенных медиаторов давно уже привлекали к себе пристальное внимание в плане разработки средств коррекции тех или иных изменений в работе системы иммунитета. Наибольшие успехи в этом направлении стали возможны после открытия регуляторных пептидов центральных органов иммунитета: тимуса и костного мозга. В 60-70 гг. прошлого столетия в различных лабораториях мира из центральных органов иммунитета было получено около десятка различных пептидов. Использовались различные технологии выделения: экстрагирование изотоническим раствором хлорида натрия, автолиз и последующая экстракция, экструзионная деструкция, кислотный гидролиз, ультрафильтрация, препаративный электрофорез и др. (Никольский, Гриневич, 1989). Одним из самых первых был препарат гомеостатического тимусного гормона, выделенный еще в 1938 году (Coomsa, 1971). В 70-х годах прошлого столетия были получены тимозины, тимический гуморальный фактор, тимопоэтин, тимостерин, тимический полипептидный препарат, растворимый фактор тимуса, тимостимулин, вилозен, тактивин, тималин и др. Дальнейшая судьба этих соединений различна: одни экстракты так и остались объектом экспериментальных исследований, другие были внедрены в медицинскую практику. Некоторые экстракты подвергли аналитическому и препаративному фракционированию, в результате которого были выделены регуляторные пептиды различной длины. Часть этих пептидов обладала иммуномодулирующими и биорегулирующими активностями, присущими нативным экстрактам тимуса. Для российского читателя наибольший интерес представляют три из них: тимозин, тактивин, тималин; два их которых: тактивин и тималин являются официально зарегистрированными в Российской Федерации лекарственными средствами.
Одним из первых полипептидных экстрактов тимуса был тимозин, выделенный А. Гольдстайном и соавторами (Goldstein) в 1966 году. Гомогенная фракция 8 тимозина, представлявшая собой, агрегат полипептидных цепей, включавших 108 аминокислотных остатков, стимулировала образование антител и способствовала дифференцировке клеток костного мозга в антителообразующие клетки. Было высказано предположение о том, что тимозин активирует хелперную функцию Т-лимфоцитов в кооперативном иммунном ответе на тимуснезависимые антигены. Наименее очищенная фракция 3 тимозина уменьшала проявления вастинг-синдрома, увеличивала выживаемость животных, частично восстанавливала структуру лимфоидных тканей и количество циркулирующих лимфоцитов, а также способность к отторжению кожных трансплантатов (Goldstein et al., 1966; Bach et al., 1971).
Фракция 5 тимозина (тимозин Ф5) – гликопептид, состоящий примерно из 30-ти полипептидов с молекулярной массой от 1 до 15 кД. Препарат усиливал реакцию тимоцитов в смешанной культуре и активность в тесте розеткообразования, а также индуцировал цитотоксичность лимфоцитов и их чувствительность к анти-TL и анти-Thy-1 сывороткам (Pahwa et al., 1979). Эта фракция тимозина стимулировала активность гипоталамо-гипофизарно-адреналовой оси и продукцию ИЛ-6 глиальными клетками (Tijerina et al., 1997). Добавление тимозина Ф5 к культуре спленоцитов, сопровождалось активной выработкой ИЛ-6 (Attia, et al. 1993).
Наиболее широко тимозин применяли при бактериальных, вирусных и грибковых инфекциях (Mutchnic, 1991; Serrate et al., 1987; Reddy, Grieco, 1987; Spangelo et al., 1987). М. Мучник и соавторы (Mutchnick et al., 1991) в двойном слепом плацебоконтролируемом опыте показали, что у больных хроническим вирусным гепатитом В курсовое применение тимозина Ф5 или тимозинаα1 дважды в неделю на протяжении 6 месяцев сопровождалось достоверным увеличением содержания CD3 и CD4 лимфоцитов в периферической крови и активацией выработки интерферонаγ. На фоне применения иммуномодулятора достоверно уменьшалась активность аминотрансфераз. Авторы считают, что терапия тимозином Ф5 способствует наступлению ремиссии или даже выздоровлению больных хроническим вирусным гепатитом В.
Неоднократно предпринимались попытки применения Ф5 в терапии злокачественных опухолей (Wada et al., 1996; Ikemoto et al., 1999; Scher et al., 1988 и др.). Однако однозначных выводов о его эффективности не получено. Так, применение тимозина Ф5 у больных с мелкоклеточным раком легкого на фоне радио- и/или химиотерапии не выявило достоверного влияния иммуномодулятора на течение заболевания и эффективность базисного лечения (Scher et al., 1988).
Применение тимозина у крыс и мышей с раком мочевого пузыря, индуцированным бутил-N-(4-гидроксибутил)-нитрозамином, сопровождалось замедлением скорости развития опухоли на фоне сохранения нормальной активности естественных киллеров (Wada, 1966). В другом исследовании на аналогичной опухолевой модели было показано, что тимозин Ф5 потенцирует действие противораковых химиопрепаратов, в частности деокси-5-флюороуридина (Ikemoto et al., 1999). Применение тимозина после лучевой терапии способствовало более быстрому восстановлению иммунологической реактивности (Wara et al., 1978). Таким образом, в онкологической практике тимозин Ф5 показан в качестве иммунокорректора, применяемого в составе комплексной противоопухолевой терапии с целью восстановления подавленной иммунореактивности. На основе полипептидного экстракта тимуса, аналогичного тимозину Ф5, был получен препарат ТР-1, зарегистрированный в качестве лекарственного средства фирмой «Сероно» (Falchetti et al., 1977).
В 1981 году В.Я. Арионом и соавторами из аутолизата тимуса был получен тактивин – комплексный препарат, содержащий пептиды с молекулярной массой от 1,5 до 6 кДа. В экспериментальных исследованиях и клинических наблюдениях тактивин эффективно восстанавливал сниженную или подавленную иммунологическую реактивность. Введение препарата мышам СВА с индуцированной бензолом депрессией иммунитета, восстанавливало количество ЕК-клеток и Т-киллеров до исходного уровня. Под влиянием тактивина повышалось содержание тимического сывороточного фактора, повышалась активность экспрессии дифференцировочных рецепторов лимфоцитов.
За время, прошедшее с момента создания препарата его использовали для лечения широкого круга заболеваний, сопровождавшихся формированием вторичного иммунодефицитного состояния. Наилучшие результаты были получения при применении тактивина в составе комплексной терапии при радиационной иммунодепрессии кроветворения, при первичных иммунодефицитных состояниях (атаксия-телеангиэктазия, врожденные нарушения тимической регуляции), при лечении генерализованных форм герпеса (Арион, 1989). Клинико-иммунологического эффекта удавалось достичь при рассеянном склерозе, острой септической и гнойно-воспалительной патологии, при острых и хронических инфекционных процессах. Во всех этих случаях после курса тактивина отмечена нормализация состояния иммунной системы, сокращение продолжительности заболевания и повышение эффективности специфической терапии.
Близкий по иммунологическим свойствам пептидный препарат тималин получен путем кислотного гидролиза тимуса крупного рогатого скота (Морозов, Хавинсон, 1978). При экспериментальном изучении тималина показана его способность модулировать процессы репопуляции дифференцировочных рецепторов лимфоцитов (Смирнов и др., 1992). В клинических целях тималин применяли при широком круге заболеваний. Так, парентеральные инъекции препарата в дозе 10-20 мг ежедневно в течение 5-20 сут. у больных с хроническими неспецифическими заболеваниями легких способствовали нормализации большинства показателей клеточного иммунитета и неспецифической защиты организма (Яковлев и др., 1992). Одновременно наблюдалось уменьшение или исчезновение воспалительных явлений в легких. Срок лечения больных сокращался в среднем на 21%. Среди других клинических аспектов иммунотерапии тималином заслуживает внимания его эффективность при лечении различных воспалительных заболеваний, сопровождающихся формированием вторичных иммунодефицитных состояний. Чаще всего при этом наблюдается снижение количества лимфоцитов, экспрессирующих CD2+DR+, CD3+, CD4+, CD8+ рецепторы, на фоне достоверного возрастания индекса миграции лейкоцитов периферической крови. Со стороны системы неспецифической защиты отмечается угнетение экспрессии ОКМ1+ рецепторов на макрофагах, снижение содержания катионных белков, фагоцитарного индекса и активности пероксидазы. Применение тималина в составе комплексной терапии по 10 мг ежедневно на протяжении 5-10 сут. сопровождалось восстановлением сниженных показателей иммунной системы, уменьшением интенсивности внутрисосудистого свертывания и сокращением продолжительности воспаления (Морозов, Хавинсон, 1989; Яковлев и др., 1992). Улучшение клинического состояния наблюдалось в 80-93% случаев. Показатель летальности при таком тяжелом состоянии как перитонит на фоне иммуномодулирующей терапии тималином составил 0,08, в то время как у лиц, получавших стандартную терапию, он был почти в 4 раза выше.
Применение тималина при бронхиальной астме, тимомегалии, системной красной волчанке, саркоидозе, острой пневмонии, псориазе, ревматоидном артрите сопровождалось восстановлением содержания основных субпопуляций Т- и В-лимфоцитов, улучшением клинического течения заболевания, сокращением периода реабилитации. При хронических процессах отмечено увеличение продолжительности периодов ремиссии, а в некоторых случаях и полное выздоровление (Яковлев и др., 1992). Профилактическое назначение тималина ликвидаторам аварии на Чернобыльской АЭС позволяло уменьшить риск формирования вторичного иммунодефицитного состояния (Смирнов и др., 1992).
Тималин применяли при лечении инфекционных заболеваний, в частности, вирусных гепатитов. Показано, что у 50% больных вирусным гепатитом В после 2-х курсов тималина исчезали маркеры возбудителя и наступала стойкая ремиссия, продолжавшаяся 3 и более мес. (Векслер и др., 1987).
Сравнительное исследование влияния экстрактов тимуса показало, что независимо от методики их получения все они обладают близкими иммунобиологическими свойствами. Так, например, в тесте репопуляции мембранных рецепторов у Т-лимфоцитов, обработанных трипсином, все исследованные препараты тимуса оказывали идентичное действие на скорость экспрессии рецепторов, определявшуюся по приросту количества «активных» розеткообразующих клеток (табл. 2.1).
Таблица 2.1. Влияние некоторых пептидных экстрактов тимуса на содержание «активных» Т-лимфоцитов (Еа-РОК) ( Яковлев и др., 1992)
|
Препарат |
Еа-РОК, % |
Р |
|
Контроль: I II Тимостимулин Тактивин Тималин Тимунокс |
45,7±3,1 19,3±1,2 31,5±1,6 34,2±2,7 34,7±2,8 31,0±3,3 |
– – <0,05 <0,05 <0,05 <0,05 |
Примечание. В каждом случае n=12. Контроль I – содержание Еа-РОК в исходной суспензии лимфоцитов; контроль II – после инкубации лимфоцитов в растворе трипсина.
Таким образом, можно с достаточным основанием утверждать, что пептидные препараты, выделяемые из вилочковой железы, оказывают одинаковое иммуномодулирующее действие, независимо от методики их выделения. Это обстоятельство свидетельствует о том, что пептидные последовательности, содержащиеся в экстракте, имеют высокую степень гомологии.
Регуляторные пептиды тимуса
Исследования тимозина Ф5 проведенные А. Гольдстайном (A. Goldstein, 1972), показали, что тимозин Ф5 содержит в своем составе большое количество пептидов, разделенных по миграционным свойствам на 3 группы, отличавшихся по изоэлектрической точке. Среди них наиболее активными оказались тимозины α1, β4 и протимозин-α (Han- nappel, Huff, 2003).
Было установлено, что тимозин-α1 представляет собой полипептид с молекулярной массой 3108 Да, состоящий из 28 аминокислотных остатков. Отмечено, что аминокислотная последовательность пептида не имеет видовой специфичности. Тимозин-β4 включает в себя 43 аминокислотных остатка и имеет молекулярную массу 4863 Да. Пептидная цепь протимозина-α состоит из 112 аминокислотных остатков. Ниже приведены аминокислотные последовательности молекул тимозина-α1и тимозина-β4:
Молекула тимозина-α1
Ser-Asp-Ala-Val-Asp-Thr-Ser-Ser-Ile-Thr-Thr-Lys-Asp-Leu-Lys-Glu-Lys-Lys-Glu-Val-Val-Glu-Glu-Ala-Glu- Asn-COOH
Молекула тимозина-β4
Ser-Asp-Lys-Pro-Asp-Met-Ala-Glu-Ile-Glu-Lys-Phe-Asp-Lys-Ser-Lys-Leu-Lys-Thr-Glu-Thr-Gln-Glu-Lys-Asn- Pro-Leu-Pro-Ser-Lys-Glu-Thr-Ile-Glu-Gln-Glu-Lys-Gln-Ala-Glu-Glu-Ser-OH
Отметим, что все эти полипептиды включают в себя большое количество остатков лизина и глутаминовой кислоты. Особенно это заметно в молекуле тимозина-β4, где многократно встречается последовательность Lys-Glu. Данное обстоятельство имеет большое значение и, как будет отмечено далее, послужило основанием для конструирования минимальных молекул тимомиметиков.
Молекула тимозина-α1 увеличивает экспрессию дифференцировочных рецепторов на Т-лимфоцитах, активирует СD4-лимфоциты, усиливает экспрессию Lyt-1+, Lyt-2+, Lyt- 3+ антигена лимфоцитов, а также усиливает зависимый от активности Т-лимфоцитов IgG-, IgM- и IgA-иммунный ответ (Никольский, Гриневич, 1989). Показана способность тимозина-α1 отменять фазу рефрактерности в процессе синтеза эндогенного интерферона (Носик и др., 1985). Эта способность пептида была использована при изучении эффективности биорегулирующей терапии вирусных гепатитов. Во всех случаях применяли комбинированную схему, в состав которой могли включаться препараты интерферона, противовирусные средства и тимозин-α1. В процессе лечения больных активным HBe-позитивным вирусным гепатитом В тимозин-α1 вводили 2 раза в неделю в дозе 1,6 мг подкожно 2 раза в неделю, интерферон-α применяли подкожно в дозе 10 млн. ед. 3 раза в неделю. Продолжительность курса терапии составляла 26 недель. Катамнестическое наблюдение за больными осуществляли в течение 26 недель. Итого, общий срок наблюдения составил 52 недели. Обследование больных проводили на 52-й и 78-й неделях (Saruc et al., 2002). К концу 52-й недели нормализация уровня трансаминаз была отмечена у 87,7% наблюдавшихся больных. У 76,2% больных нормальный уровень трансаминаз и негативная реакция на HBV-ДНК сохранялись на протяжении 78 недель. Близкие по эффективности результаты получены при лечении больных вирусным гепатитом В сочетанием тимозина-α1 с аномальными нуклеозидами (Yuen, Lai, 2001). Положительные результаты, хотя может быть и не столь значительные, отмечены и при комбинированном лечении больных вирусным гепатитом С (Ideo, Bellobuono, 2002; Kullavanuaya et al., 2001). Наконец, также, как и экстракты тимуса, тимозин-α1 применяли на фоне радио- и химиотерапии злокачественных процессов с целью повышения активности иммунной системы, подавленной противоопухолевыми препаратами (Garachi et al., 1995).
Выделенный из β-области тимозина Ф5 тимозин-β4 в отличие от тимозина-α1 индуцировал появление терминальной дезоксинуклеотидилтрансферазы в негативных по этому признаку клетках костного мозга у бестимусных мышей (Hu et al., 1981). Эти данные подтвердили, что тимозины влияют на ранние стадии Т-клеточной дифференцировки, причем это влияние зависит от вида тимозина. Тимозин-β4 ингибирует, а тимозин-α1 усиливает пролиферативный ответ. Отмечено неодинаковое воздействие на экспрессию дифференцировочных рецепторов: тимозин-β4 увеличивал количество клеток с фенотипами CD8+ и CD11+, но не влиял на экспрессию CD3+-, CD6+- и CD9+ – рецепторов (Kokki- nopoulos et al., 1985).
С другой стороны, тимозин-β4 оказывает выраженное действие на процессы регенерации. Установлено, что интраперитонеальное введение пептида сопровождается усилением процессов реэпителизации раны на 4-й день после травмы на 42%, а на 7-й – на 61% относительно контроля. Показано также, что тимозин-β4 существенно увеличивает скорость миграции кератиноцитов в камере Бойдена (Malinda et al., 1999).
Анализ биологических эффектов семейства тимозинов свидетельствует о том, что каждый из пептидов, образующих комплекс тимозин Ф5, активен на определенном этапе дифференцировки лимфоцитов. Так, тимозины β3, β4 индуцируют дифференцировку предшественников Т-лимфоцитов, тимозин-α1 контролирует превращение преТ-клеток в тимоциты, а тимозины α5 и α7 оказывают влияние на дифференцировку и функциональную активность предшественников Т-лимфоцитов в периферических лимфоидных органах (Low, Goldstein, 1985).
Тимусный гуморальный фактор был выделен из диализатов гомогенизированной ткани тимуса (Traini et al., 1979). Он представляет собой термостабильный олигопептид с молекулярной массой около 3000 Да и состоит из 31 аминокислотного остатка. Пептид восстанавливал способность клеток селезенки новорожденных тимэктомированных мышей вызывать реакцию «трансплантат против хозяина», а также увеличивал количество антителобразующих клеток в селезенке у тимэктомированных и облученных животных (Rotter et al., 1973). Применение этого фактора у детей с лимфопролиферативными заболеваниями (лимфогранулематоз, лимфосаркома, лимфома) после курса химиотерапии сопровождалось выраженным иммуномодулирующим эффектом, сходным с таковым у тимозинов (Traini et al., 1979).
Другим хорошо изученным тимическим иммуномодулятором является тимопоэтин, впервые выделенный в 1971 году (Goldstein, Manarano, 1971). Из вводно-солевого экстракта тимуса получены два пептида – тимопоэтин I и тимопоэтин II. Дальнейшее изучение тимопоэтина II показало, что это полипептид с молекулярной массой 5562 Да и изоэлектрической точкой 5,5, состоящий из 49 аминокислотных остатков. Биологическую активность тимопоэтина II связывают с пентапептидом, названным тимопентин (ТП-5), соответствующим 32-36 аминокислотным остаткам нативной молекулы тимопоэтина: Arg- Lys-Asp-Val-Tyr. Вместе с тем было показано, что некоторые проявления активности тимопоэтина сохраняются и у более коротких пептидов, состоящих из 4-х и даже 3-х аминокислотных остатков (Denes и др., 1986).
Основной функцией тимопоэтина является регуляция лимфопоэза. Применение пентапептида в дозе 0,5 мг/кг ежедневно в течение 2-х недель, а затем 3 раза в неделю в течение 10 недель способствовало улучшению клинического состояния и показателей Т- системы иммунитета у ряда больных с первичными иммунодефицитами (Goldstein at al., 1979).
Пептидные тимомиметики
Цитированные выше исследования имели весьма важное значение в развитии проблемы пептидных тимомиметиков. Они подтвердили актуальность пептидного процессинга и показали, что информация, необходимая для реализации иммунорегуляторных эффектов, может содержаться в небольших по размерам олигопептидах, содержащих 5-6 аминокислотных остатков. Примером такого олигопептида является тимогексин (иммунофан), структура которого отличается от тимопентина наличием аминокислотных замен с элонгированием цепи концевым аргинином: Arg-Asp-Lys-Val-Tyr-Arg. Применение препарата способствовало достижению сероконверсии у больных хроническим вирусным гепатитом и оказывало положительное влияние на продукцию специфических антител при хроническом бруцеллезе (Покровский и др., 1992). Позднее было установлено, что тимогексин при патологическом изменении синтеза иммуноглобулинов, вызванном врожденным иммунодефицитом IgA или атопическим дерматитом с гиперпродукцией IgE, оказывает иммунокорригирующее действие на продукцию обоих классов иммуноглобулинов. Механизм этого действия обусловлен межклеточным взаимодействием иммунокомпетентных клеток и реализуется вне зависимости от дополнительного введения ИЛ-4 (Лебедев и др., 1994).
Дальнейшее развитие идеи пептидных тимомиметиков привело к пониманию того факта, что для индукции регуляторного сигнала и системе может быть достаточно минимального пептида, состоящего всего из 2-х аминокислотных остатков.
Если проанализировать аминокислотную последовательность тимозинов, тимопо- этинов и других типических пептидов, а также ряда интерлейкинов можно видеть, что в их структуре часто встречается дипептид, состоящий из остатков лизина и глутаминовой кислоты. Этот факт был использован В.Х Хавинсоном и сотрудниками для создания нового иммуномодулятора Lys-Glu, получившего наименование «Вилон» (Хавинсон и др., 1997). Экспериментальное изучение Вилона показало его способность усиливать реакцию гиперчувствительности замедленного типа у мышей, индуцированную тринитробензо-сульфокислотой (Морозов и др., 2000). Вилон стимулирует образование антителобразующих клеток в селезенке мышей, иммунизированных эритроцитами барана, а также активирует репаративные процессы в тимусе облученных животных.
В клинических наблюдениях, опубликованных В.Г. Морозовым и соавторами (2000), показана способность Вилона стимулировать репаративные процессы при механической травме, остеомиелите, при различных заболеваниях роговицы. У больных кавернозным туберкулезом наблюдали стимулирующее действие Вилона на процессы заживления каверн на фоне увеличения экспрессии CD4+ и уменьшения экспрессии CD8+ рецепторов Т-лимфоцитов. У больных обструктивным бронхитом назначение Вилона способствовало снижению частоты бронхоспазмов, нормализации температуры и улучшению аппетита. Одновременно наблюдалось увеличение количества лимфоцитов в периферической крови и усиление фагоцитарной активности лейкоцитов
Другим дипептидом, обладающим тимомиметическими свойствами, является Glu- Trp, известный под названием «Тимоген». Первоначально дипептид был выделен из тималина методом высокоэффективной жидкостной хроматографии, а затем синтезирован несколькими методами, один из которых подробно описан в 3-й главе данной монографии. Долгое время считалось, что этот дипептид может содержаться в молекуле гормона тимуса. К сожалению, выделить и идентифицировать полную молекулу этого гормона так и не удалось, но в тех ее фрагментах, которые на сегодняшний день известны, такой дипептид не найден, зато его можно обнаружить в молекуле фактора некроза опухоли, некоторых интерлейкинах и пр.
Подробное изучение и опыт более чем 16-летнего опыта клинического применения убедительно показали, что Тимоген® является классическим тимомиметиком, обладающим всей совокупностью иммуномодулирующих реакций. Это обстоятельство имеет важное методическое значение, поскольку показало, что способность регулировать клеточные иммунные реакции не является исключительным свойством тимических пептидов. Аналогичными свойствами могут обладать короткие пептиды иного происхождения. Анализ накопленной информации позволяет определенно утверждать, что фактором, определяющим свойства того или иного пептида, является его структура, а не происхождение. С этих позиций распространенная до настоящего времени точки зрения, согласно которой Тимоген® является синтетическим аналогом пептидного экстракта тимуса – тималина, а, равно как и иных, идентифицированных пептидов тимуса, является ошибочной и не имеет под собой научных оснований. Тимоген® является самостоятельным дипептидом, воспроизводящим некоторые свойства тимозинов, но не имеющим с ними структурных аналогий. С этой точки зрения логично было ожидать появления других коротких пептидов, способных регулировать те или иные реакции иммунной системы. Определенными свойствами, присущими тимическим иммуномодуляторам, обладают некоторые аминокислоты, в частности, глутаминовая кислота, глицин, триптофан и их простые смеси (Белокрылов и др., 1999).
Эти данные лишний раз подчеркивают многокомпонентность регуляторных структур системы иммунитета, которые нельзя втиснуть в прокрустово ложе тимических пептидов. Более того, нет никаких оснований идентифицировать пептидные тимомиметики как фракции или активные центры гормона тимуса. Это самостоятельные соединения, обладающие иммунорегулирующими свойствами, которые могут быть использованы в терапевтической практике. Опыт 15-летнего исследования Тимогена®, обобщенный на страницах данной работы, полностью подтвердил правомерность такого подхода.
Введение
Глава 1. Механизмы пептидной регуляции гомеостаза (В.В. Малинин, В.Г. Морозов)
Глава 2. Регуляторные пептиды тимуса (В.С. Смирнов)
Глава 3. Тимоген®: структура, химический синтез, свойства (С.В. Куликов, В.С. Смирнов)
Глава 4. Тимоген® в профилактике и комплексной терапии инфекционных заболеваний (В.С. Смирнов)
Глава 5. Тимоген® в терапии бронхолегочных заболеваний (В.С. Смирнов)
Глава 6. Применение тимогена в комплексной терапии внутренних болезней (В.С. Смирнов, А.Е. Сосюкин)
Глава 7. Тимоген® в дерматологии (В.С. Смирнов)
Глава 8. Применение Тимогена® для профилактики и лечения радиационных поражений (В.И.Легеза, В.С. Смирнов)
Глава 9. Применение Тимоген® в комплексном лечении механических и термических травм (В.С. Смирнов)
Глава 10. Тимоген® в акушерско-гинекологической практике (Г.В. Долгов, В.С. Смирнов)
Глава 11. Особенности применения Тимогена® в педиатрии (В.С. Смирнов)
Заключение
Скачать PDF
Назад к списку
Пептидный препарат Кортексин, представляющий собой комплекс натуральных низкомолекулярных соединений мозга животных (высокоочищенная вытяжка ядерных белков), продолжает оставаться одним из самых широко обсуждаемых в периодической медицинской печати фармакологических средств. При этом внимание привлекают два аспекта: во-первых, применение Кортексина представителями различных врачебных специальностей (мультидисциплинарность в целевом назначении препарата), а во-вторых, отсутствие возрастных ограничений к его использованию. В современной фармакопее существует не слишком много подобных лекарственных препаратов, не имеющих возрастных противопоказаний и ограничений к применению. Поэтому Кортексин, обосновано называемый «препаратом XXI века», заслуживает более подробного рассмотрения [1].
Категоризация и состав Кортексина
Как известно, Кортексин принадлежит к фармакологической группе 9.7 («Ноотропы (нейрометаболические стимуляторы)»). По АТХ-системе (анатомо-терапевтически-химической) классификации препарат относится к рубрике N06BX («Другие психостимуляторы и ноотропные препараты»). Среди пептидных препаратов х-классов (цитогены, цитамины, цитомедины) Кортексин относится к цитомединам, которые представляют собой высокоочищенную вытяжку ядерных белков (фракции 1–10 кДа) и характеризуются подтвержденным свойством к регуляции иммунологической реактивности [2]. Кортексин — инновационный пептидный препарат; его субстанция и лекарственные формы защищены патентами РФ (РФ № 2104702, 2275924, 2195297) и других стран.
Кортексин — многокомпонентный препарат, состав которого не ограчивается нейропептидными субстанциями. Помимо нейропептидов, ингредиенты Кортексина представлены не менее чем тремя группами веществ: аминокислотами, витаминами и минеральными веществами. Есть основания полагать, что положительные эффекты препарата объясняются не только действием аминокислот и полипептидов, но и нейрохимической активностью макро- и микроэлементов, витаминов [3, 4].
В частности, в составе пептидов Кортексина имеется не менее двух стимулирующих аминокислот — аспарагиновой кислоты (446 нмоль/мг) и глицина (298 нмоль/мг). Помимо вышеназванных аспарагиновой кислоты и глицина, в Кортексине представлены следующие аминокислоты:
-
треонин (212 нмоль/мг);
-
серин (268 нмоль/мг);
-
глутаминовая кислота (581 нмоль/мг);
-
пролин (187 нмоль/мг);
-
аланин (346 нмоль/мг);
-
валин (240 нмоль/мг);
-
изолейцин (356 нмоль/мг);
-
тирозин (109 нмоль/мг);
-
фенилаланин (162 нмоль/мг);
-
гистидин (116 нмоль/мг);
-
лизин (253 нмоль/мг);
-
аргинин и другие аминокислоты (202 нмоль/мг).
Из представленной информации следует, что на долю аспарагиновой кислоты приходится до 12%, а глутаминовой кислоты — около 15% от общего содержания аминокислот в составе пептидов Кортексина. Метионина в препарате не содержится. Кроме того, стабилизатором препарата является свободная аминокислота глицин (12 мг), роль которой в нормализации функций коры головного мозга многократно доказана.
В Кортексине представлен ряд витаминов, в частности, водорастворимые: тиамин (витамин В1) — 0,08 мкг/10 мг, рибофлавин (витамин В2) — 0,03 мкг/10 мг, ниацин (витамин В3, витамин РР, никотиновая кислота) — 0,05 мкг/10 мг; а также жирорастворимые: ретинол (витамин А) — 0,011 мкг/10 мг, альфа-токоферол (витамин Е) — 0,007 мкг/10 мг. Надо признать откровенно, что такой витаминный состав является оптимальным для нейронов головного мозга, так как идеально сбалансирован природой!
Кроме пяти эссенциальных витаминов, в препарате Кортексин содержится немало минеральных веществ (макро- и микроэлементов):
-
медь (Cu): 0,2129 мкг/10 мг;
-
железо (Fe): 2,26 мкг/10 мг;
-
кальций (Ca): 22,93 мкг/10 мг;
-
магний (Mg): 8,5 мкг/10 мг;
-
калий (K): 19,83 мкг/10 мг;
-
натрий (Na): 643,2 мкг/10 мг;
-
сера (S): 152,65 мкг/10 мг;
-
фосфор (P): 91,95 мкг/10 мг;
-
цинк (Zn): 4,73 мкг/10 мг;
-
молибден (Mb): 0,0203 мкг/10 мг;
-
кобальт (Co): 0,0044 мкг/10 мг;
-
марганец (Mn): 0,0061 мкг/10 мг;
-
селен (Se): 0,0745 мкг/10 мг;
-
алюминий (Al): 0,3104 мкг/10 мг;
-
литий (Li): 0,0340 мкг/10 мг [4].
Практически все из перечисленных минеральных веществ, входящих в состав препарата Кортексин, обладают нейромодулирующими и иными функциями.
Традиционные и новые области применения Кортексина
Кортексин применяется не только в Российской Федерации. Он зарегистрирован и используется в таких странах, как Украина, Беларусь, Армения, Узбекистан, Казахстан, Азербайджан, Киргизия, Таджикистан и Молдова (применению Кортексина во всех случаях предшествовала доклиническая и клиническая экспертиза).
Важнейшим свойством Кортексина, определяющим области его использования, считается коррекция когнитивных функций, но когнитивно-модулирующий эффект препарата является далеко не единственным. Описаны ноотропный, нейротрофический, антиконвульсантный, иммуномодулирующий (иммунорегуляторный) и нейропротекторный эффекты препарата, а также его антистрессорное, антиоксидантное и метаболическое действие. В связи с последним хотелось бы особенно отметить способность Кортексина к нормализации обмена нейромедиаторов и регуляции баланса активирующих/тормозных аминокислот.
Поэтому на протяжении последних 10 лет Кортексин активно использовался российскими врачами в различных областях клинической медицины (в неврологии, педиатрии, офтальмологии, геронтологии и т. д.): при черепно-мозговых травмах, нейроинфекциях, детском церебральном параличе (ДЦП), перинатальном поражении нервной системы, нарушениях (задержка) психомоторного и речевого развития, нарушениях мышления, сниженной способности к обучению, невротических расстройствах, синдроме дефицита внимания и гиперактивности (СДВГ), синдроме эмоционального выгорания, вегетативной дисфункции, гипертензивной ангиоретинопатии, глаукоме, диабетической нейропатии, амблиопии и т. д. [1–6].
Следует отметить, что для препарата Кортексин обнаруживаются все новые области применения. Так, Бочкова Л. Г. и Носова О. М. (2008) сообщают об опыте использования Кортексина при лечении натальной цервикальной травмы у новорожденных, Каменских Т. Г. и соавт. (2006) — в терапии частичной атрофии зрительного нерва (ЧАЗН), Утаганова Г. Х. (2010) — в коррекции шейно-спондилогенных поражений у детей раннего возраста [7–9].
Кортексин активно используется в геронтологии (нарушения мозгового кровообращения, астенические состояния, энцефалопатии различного генеза и т. д.) [10]. Достаточно вспомнить, что препарат был впервые внедрен в клиническую практику сотрудниками Военно-Медицинской Академии (на полях сражений в Афганистане [16, 17]), а затем сотрудниками Санкт-Петербургского института биорегуляции и геронтологии СЗО РАМН. По утверждению член-корреспондента РАМН, проф. Хавинсона В. Х., являющегося вице-президентом Геронтологического общества РАН, «использование пептидных препаратов позволяет эффективно проводить профилактику преждевременного старения, а также лечить заболевания, ассоциированные с возрастом…».
Использование Кортексина при мигрени, рекомендуемое Пак Л. А. и соавт. (2005, 2006, 2008), Иззати-Заде К. Ф. и соавт. (2006) и др., уже прочно вошло в практику российских неврологов, занимающихся этой группой первичных цефалгий [11–14]. Указывается, что во время приступа мигрени Кортексин стабилизирует мембраны тромбоцитов, тормозит развитие «серотонинового каскада», подавляет нейрональную корковую депрессию Лео, снижает нейрогенное воспаление сосудов твердой оболочки мозга, подавляет высвобождение нейропептидов боли и воспаления из периваскулярных афферентных волокон тройничного нерва [14].
Предварительные исследования сотрудников НЦЗД РАМН позволяют предположить, что в ближайшем будущем Кортексин будет применяться в качестве средства для коррекции различных форм неврологического дефицита, сопутствующего некоторым разновидностям пищевой непереносимости (целиакия, лактазная недостаточность и др.) в детском возрасте, а впоследствии — у совершеннолетних пациентов. Но, по-видимому, наиболее впечатляющей является возможность применения препарата в лечении эпилепсии.
Кортексин и эпилепсия
Терапия эпилепсии — сравнительно недавнее показание к применению Кортексина. Об использовании Кортексина в комплексном лечении различных форм эпилепсии сообщается в работах Гузевой В. И. и Трубачевой А. Н. (2003), Головкина В. И. (2005, 2006) и Звонковой Н. Г. (2006) [15–18]. Хоршев С. К. и соавт. (2002, 2008) рассматривают Кортексин в качестве корректора нейроиммунной составляющей эпилептогенеза и, основываясь на данных собственных биохимических и нейроиммунофизиологических исследований, рекомендуют этот нейропептидный препарат для профилактического лечения эпилепсии [19, 20]. Эффективности Кортексина в терапии эпилепсии у детей и взрослых посвящены публикации Цыгана В. Н. и соавт. (2008) и Федуновой Г. В. и соавт. (2008) [21, 22]. На необходимость коррекции когнитивных нарушений ноотропными препаратами при эпилепсии указывают Балканская С. В. и соавт. (2007, 2008) и Калинин В. В. и соавт. (2009) [23–25]. Именно Кортексину в этом плане принадлежит немаловажная роль.
Наконец, в апреле 2010 г. на XVII Российском национальном конгрессе «Человек и лекарство» при поддержке компании «Герофарм» был проведен симпозиум «Нейропротекция в терапии эпилепсии» (под председательством проф. Гехт А. Б.). В ходе работы указанного симпозиума докладчики (Калинин В. В., Калачева И. О., Одинцова Г. В.) отразили как теоретические аспекты, так и собственный опыт применения препарата Кортексин в лечении эпилепсии у детей и совершеннолетних пациентов.
В частности, в Институте мозга РАН (Н. Ю. Королева и Г. В. Одинцова) имеется положительный опыт применения Кортексина у 8 000 пациентов, и, как отметила А. Б. Гехт, в это учреждение поступают «далеко не самые легкие больные».
Не исключено, что в дальнейшем Кортексин найдет широкое применение в превентивном лечении фебрильных судорог (ФС), являющихся наиболее частым хроническим нарушением церебральных функций у детей.
Кортексин для детей — новая форма нейропептидного препарата
Новая форма препарата под названием «Кортексин для детей» была зарегистрирована в Российской Федерации 27 апреля 2009 г. [26].
Кортексин для детей — это лиофилизат для приготовления раствора для внутримышечного введения. В 1 флаконе (емкость 3 мл) содержатся 5 мг Кортексина (комплекс водорастворимых полипептидных фракций с молекулярной массой не более 10000 Да) вместо 10 мг, присутствующих в стандартной форме препарата Кортексин, а также глицин 6 мг как стабилизатор.
Фактически, Кортексин для детей — это чуть ли не единственный пример, когда препарат ноотропного действия адресно предназначается для пациентов педиатрического возраста. Предполагается, что новая форма пептидного препарата (Кортексин для детей) окажется востребованной и найдет самое широкое применение как в России, так и за ее пределами.
О чем умалчивает «Формулярная система»
Ранее нами уже неоднократно указывалось, что в «Формулярной системе» России отсутствует даже упоминание о Кортексине [2, 4, 6]. Приходится констатировать, что в XI выпуске (2010 г.) этого ежегодно обновляемого издания информация о Кортексине вновь отсутствует [27]. Это тем более странно, когда даже в интернет-энциклопедии «Википедия» представлены данные об этом «фармакопейном полипептидном биорегуляторе с биологической активностью».
Состав Кортексина в «Регистре лекарственных средств» (2010) представлен следующим образом: «в 1 флаконе Кортексина — 10 мг, глицина — 12 мг» (глицин, присутствующий в препарате, одновременно выполняет роль стабилизатора) [28]. В «Справочнике Видаль» (2010) состав Кортексина описан еще лаконичнее: «комплекс полипептидных фракций, выделенных из коры головного мозга крупного рогатого скота и свиней — 10 мг» [29]. На самом деле, как указывается выше, ингредиенты гораздо более многочисленны.
Мы постараемся представить информацию о препарате Кортексин, использовав форму, подобную обычно применяемой в «Федеральном руководстве по использованию лекарственных средств».
Кортексин (cortexin). Пептидный препарат, представляющий комплекс низкомолекулярных пептидов, выделенных из коры головного мозга крупного рогатого скота (телят) и свиней, не достигших 12-месячного возраста. Для выделения препарата используется метод уксусно-кислой экстракции. С целью получения фракции полипептидов с молекулярной массой, не превышающей 10000 Да (10 кДа), полученный экстракт подвергается многоступенчатой очистке и многократной фильтрации на специальных фильтрах. Очистка активной субстанции Кортексина обеспечивает инфекционную и антигенную безопасность препарата (отсутствие инфекционных агентов, нуклеиновых кислот, амилоидов, функционально активных проонкогенов и других нежелательных примесей).
Кортексин обладает выраженной метаболической активностью: нормализация обмена нейромедиаторов; регуляция баланса тормозных/активирующих аминокислот и уровней серотонина и дофамина; ГАМКергическое действие; антиоксидантный эффект; нормализация биоэлектрической активности (БЭА) мозга. Обладая выраженным тканеспецифическим действием на клетки коры головного мозга, этот нейропептидный препарат оказывает церебропротекторное, ноотропное, нейротрофическое), нейрометаболическое, стимулирующее, антистрессорное, антиоксидантное, противосудорожное и иммунорегуляторное действие.
Показания. Черепно-мозговая травма (ЧМТ), нарушения мозгового кровообращения (НМК — острые и хронические), нейроинфекции (вирусные и бактериальные), астенические состояния, энцефалопатии различного генеза, энцефалит (острый и хронический) и энцефаломиелит, эпилепсия, различные формы ДЦП, критические состояния новорожденных с перинатальным поражением нервной системы (ППНС), нарушения психомоторного и речевого развития, нарушения (снижение) памяти, мышления; нарушения других когнитивных функций (КФ), головные боли различного генеза и т. д.
Противопоказания. Индивидуальная непереносимость препарата, беременность, лактация.
Побочные эффекты. При применении по показаниям побочных эффектов Кортексина не выявлено.
Взаимодействие. Лекарственное взаимодействие препарата Кортексин с другими лекарственными средствами (ЛС) не описано.
Дозы и применение. Препарат назначают во внутримышечных введениях детям с массой тела до 20 кг — в дозе 0,5 мг/кг, а с массой тела более 20 кг — в дозе 10 мг. Продолжительность курса лечения Кортексином обычно составляет 10 дней. При необходимости предусмотрен повторный курс через 1–6 (чаще 3–6) месяцев.
Содержимое 1 флакона растворяют в 1–2 мл 0,5%-го раствора новокаина, воды для инъекций или 0,9%-го изотонического раствора NaCl.
Кортексин. Лиофилизированный порошок (лиофилизат) или пористая масса белого/белого с желтоватым оттенком цвета — для приготовления раствора для внутримышечного введения (флак.), 1 мл (1 мл = 10 мг).
Кортексин для детей. Лиофилизат для приготовления раствора для внутримышечного введения (флак.), 3 мл (5 мг).
* * *
В новом англоязычном научном журнале The Open Neuropsychopharmacology Journal, издаваемом с 2008 г. в Нидерландах, в конце 2009 г. появилась совместная публикация российских и итальянских ученых (Московский государственный университет им. М. В. Ломоносова, компания «Герофарм», L’Istituto Superiore di Sanita, Рим), посвященная применению препарата Кортексин и его влиянию на когнитивные функции и поведенческие реакции (в условиях эксперимента).
В частности, Adriani W. и cоавт. (2009) сообщают о подтвержденном анксиолитическом эффекте Кортексина, одновременно подчеркивая активность препарата при использовании в малых дозах и отсутствие побочных реакций при его применении в лечебных целях [30]. Такие публикации указывают не только на эффективность нейропептидного биорегулятора Кортексин с позиций доказательной медицины, но и на международное признание этого российского препарата.
Тканеспецифичность и высокая биодоступность Кортексина определяют все больший спектр возможностей для применения этого препарата в лечении пациентов, начиная с периода новорожденности и до старческого возраста.
Реальность дел в сегодняшней фармакологии такова, что фактически имеется очень скудный перечень препаратов, разрешенных для применения у детей, и в этом плане высокие терапевтические свойства Кортексина делают его препаратом выбора.
Литература
-
Дьяконов М. М. Кортексин — препарат XXI века. Лечение и профилактика заболеваний головного мозга // Aqua Vitae. 2001. № 3. С. 22–23.
-
Студеникин В. М. Применение препарата кортексин в нейропедиатрии // Мед. вестник. 2006. № 37 (380). С. 14.
-
Шабалов Н. П., Платонова Т. Н., Скоромец А. П. Кортексин в нейропедиатрии. Метод. реком. СПб. 2006. 64 с.
-
Студеникин В. М., Пак Л. А., Шелковский В. И. и др. Применение кортексина в детской неврологии: опыт и перспективы // Фарматека. 2008. № 14. С. 23–29.
-
Гранстрем О. К., Сорокина Е. Г., Сторожевых Т. П. и др. Последние новости о кортексине (нейропротекция на молекулярном уровне) // Terra Medica Nova. 2008. № 5. С. 1–4.
-
Студеникин В. М., Пак Л. А., Шелковский В. И. и др. Об опыте и перспективах применения отечественного нейропептидного препарата в детской неврологии // Леч. Врач. 2009. № 5. С. 42–45.
-
Бочкова Л. Г., Носова О. М. Ноотропная и нейропротекторная терапия новорожденных с натальной цервикальной травмой // Перинатология и педиатрия. 2008. № 1. С. 32–34.
-
Каменских Т. Г., Башкатов А. Н., Тучин В. В. и др. Клинико-экспериментальное обоснование применения препарата «Кортексин» в лечении частичной атрофии зрительного нерва // Русский мед. ж. 2006. № 4. С. 147–150.
-
Утаганова Г. Х. Натальные шейно-спондилогенные поражения у детей раннего возраста (клиника, диагностика, лечение). Автореф. дис. … канд. мед. наук. М., 2010. 28 с.
-
Морозов В. Г., Хавинсон В. Х. Перспективы применения цитомединов в клинической медицине и геронтологии // Клин. геронтология. 2000. Т. 78. № 2. С. 42–45.
-
Пак Л. А., Горюнова А. В., Студеникин В. М. и др. Оценка эффективности терапии первичных головных болей у детей пептидным биорегулятором кортексин // Педиатр. фармакология. 2005. Прилож. С. 121.
-
Пак Л. А., Горюнова А. В., Студеникин В. М. и др. Oпыт клинического применения препаратов топирамат и кортексин в превентивной терапии мигрени у детей // Вопр. совр. педиатрии. 2006. Т. 5. № 1. С. 441.
-
Пак Л. А., Горюнова А. В., Студеникин В. М. и др. Опыт терапии первичной головной боли у детей // Доктор.ру. 2008. № 4. С. 28–30.
-
Иззати-заде К. Ф., Лодочникова Л. Н., Шутов А. А. Мигрень — еще одна мишень для лечения кортексином // Нейроиммунология. 2006. Т. 4. № 3–4. С. 63–70.
-
Гузева В. И., Трубачева А. Н. Применение кортексина в комплексном лечении эпилепсии у детей // Terra Medica. 2003. № 2. C. 19–21.
-
Головкин В. И. Кортексин в лечении эпилепсии. В кн.: Кортексин — пятилетний опыт в отечественной неврологии / Под ред. Скоромца А. А., Дьяконова М. М. СПб.: Наука. 2005. С. 107–113.
-
Головкин В. И. Кортексин в лечении эпилепсии // Медико-фармацевт. вестн. Татарстана. 2006. № 6 (234). С. 15.
-
Звонкова Н. Г. Иммунологические показатели у детей с эпилепсией при использовании традиционных и альтернативных методов терапии. Автореф. дис. … к.м.н. М., 2006. 26 с.
-
Хоршев С. К., Поляков Ю. И., Бессмельцев С. С. Кортексин как корректор нейроиммунной составляющей эпилептогенеза. Мат. XI Всеросс. конф. «Нейроиммунология». СПб. 2002. С. 301–302.
-
Хоршев С. Л., Корсакова Е. А., Столяров И. Д. и др. Профилактическое лечение эпилепсии: возможности кортексина (нейроиммунофизиологическое и биохимическое исследование) // Нейроиммунология. 2008. Т. VI. № 1. С. 22–26.
-
Цыган В. Н., Миролюбов А. В., Богословский М. М. и др. Эффективность Кортексина при лечении эпилепсии // Terra Medica Nova. 2008. № 4. С. 20–24.
-
Федунова Г. В., Сысоева Е. Н. Опыт применения кортексина при симптоматической эпилепсии у детей // Глав. врач. 2008. № 4 (16). С. 32.
-
Балканская С. В., Студеникин В. М., Кузенкова Л. М. и др. Ноотропные препараты в коррекции когнитивных функций у детей с эпилепсией // Вопр. совр. педиатрии. 2007. Т. 6. № 2. С. 92–96.
-
Балканская С. В., Студеникин В. М., Кузенкова Л. М. и др. Когнитивные нарушения и их коррекция у детей с эпилепсией // Практика педиатра. 2008. № 3. С. 24–27.
-
Студеникин В. М. Кортексин для детей — новая форма популярного нейропептидного препарата // Мед. вестник. 2009. № 24. С. 13.
-
Калинин В. В., Железнова Е. В., Соколова Л. В. и др. Когнитивные и психотропные эффекты препарата Кортексин при лечении больных эпилепсией // Психиатрия и психофармакотерапия. 2009. Т. 11. № 3. С. 50–54.
-
Федеральное руководство по использованию лекарственных средств (формулярная система). Вып. XI. М.: Эхо. 2010.
-
Регистр лекарственных средств России «Энциклопедия лекарств». Изд-е 18-е, перераб. и доп. М.: РЛС-2010.
-
Справочник Видаль. Лекарственные препараты в России: Справочник. Изд. 16-е, перераб., исправл. и доп. М.: АстраФармСервис. 2010.
-
Adriani W., Granstrem O., Romano E. et al. Modulatory effects of cortexin and cortagen on locomotor activity and anxiety-related behavior in mice // Open Neuropsychopharmacology Journal. 2009. Vol. 2. P. 22–29.
В. М. Студеникин, доктор медицинских наук, профессор
Л. А. Пак, кандидат медицинских наук
С. Ш. Турсунхужаева
В. И. Шелковский, кандидат медицинских наук
С. В. Балканская, кандидат медицинских наук
НЦЗД РАМН, Москва
Контактная информация об авторах для переписки: studenikin@nczd.ru
Как правильно принимать пептиды Хавинсона
Не смотря на то что инструкция по применению пептидов Хавинсона написана на упаковке. Накопленный опыт специалистов в области биорегуляции говорит нам о том, что иногда, для большей эффективности, некоторые виды пептидных биорегуляторов можно использовать по другому.
В этой статье мы приведём общие рекомендации по тому, как долго, в каких дозировках, с какой периодичностью… лучше всего принимать пептиды Хавинсона. Постараемся коснуться инструкции по применению более подробно наиболее известных пептидов. Расскажем о различных нюансах и тд.
Пептиды Хавинсона и проблема усвояемости
Пептиды на данный момент выпускаются в трех формах: капсулы, лингвал растворы (впитываются через сеть сосудов под языком), а так же наружные растворы (наносят на обратную сторону предплечья). Если растворы усваиваются хорошо, то капсульные пептиды могут иметь с этим проблемы. Это кстати один из главных аргументов противников пептидов, почему они не работают. Однако в действительности, клинические испытания а так же отзывы, полностью опровергли это. Подробнее об этом можно почитать здесь — усвояемость пептидов Хавинсона. Но в целом, можно сказать что действительно часть пептидов (около 10%) может погибнуть в ЖКТ. Есть некоторые приёмы, как максимально снизить это и получить максимальную усвояемость . Рекомендуется:
- Принимать пептиды только с утра на тощак
- Ничего не есть в течение 30 минут после приёма
- Растворять содержимое капсулы в воде и пить (так делать не обязательно)
Соблюдение этих простых условий, позволит повысить усвояемость пептидов чуть ли не до 100%. И отправить в утиль минимум действующего вещества. На коробке пептидов написано, что принимать пептиды после приёма пищи — однако лучшая усвояемость всё-таки после приёма на тощак. По словам специалистов, производитель обязан был так написать, чтобы получить зелёный свет на сертификацию продукции в класс бады.
Пептиды Хавинсона дозировка и продолжительность курса
Стандартная инструкция по применению, написанная на коробке пептидов Хавинсона, так же значительно отличается от реальной. Различие объясняют теже правила сертификации. Ведь для того чтобы «подогнать» пептидные биорегуляторы в класс бадов, нельзя уклоняться от шаблонных требований к определенному классу веществ. Итак рассмотрим, как на практике лучше всего принимать пептиды Хавинсона.
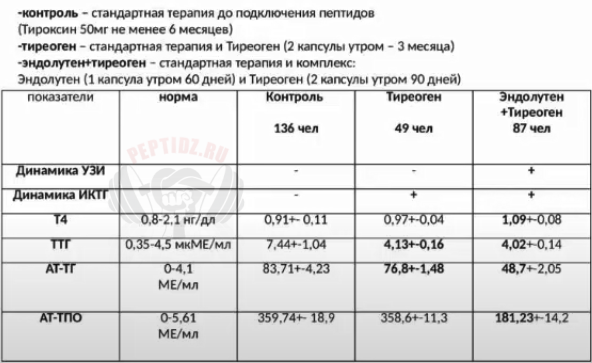
Как принимать Цитомаксы
Это натуральные и самые мощные пептиды Хавинсона. Тяжелая артиллерия среди пептидов. К ним относятся: Сигумир, Женолутен, Тиреоген, Визолутен, Бонотирк, Таксорест, Светинорм и другие пептиды. Полный список здесь. Вот что написано на упаковке:
взрослым по 1-2 капсулы 1-2 раза в день во время еды. Продолжительность приема — 1 месяц.
Более правильная (эффективная) инструкция будет выглядеть так:
взрослым по 2 капсулы 1 раз в день с утра на тощак. Продолжительность курса — 2-3 месяца.
Именно так чаще всего используются пептиды на практике. Цитомаксы достаточно долго разгоняются. И обычно за первый месяц они только набирают обороты. А эффект наступает со второго. Поэтому месячного курса может оказаться не достаточно. Частота повторных курсов — не более 1 раз в пол года. Месячного курса вполне достаточно для профилактики, но чтобы получить лечебно-профилактический эффект, лучше использовать их дольше!
Как принимать Эндолутен
А этот товарищ считается самым дорогим пептидом на рынке, некоторые даже шутя называют его дороже золота. А всё из-за инструкции на коробке препарата:
Взрослым по 1-2 капсулы 1-2 раза в день во время еды. Продолжительность приема — 1 месяц.
Когда как специалисты рекомендуют следующую инструкцию к Эндолутену:
По 1 капсуле с утра на тощак раз в 72 часа. Продолжительность приёма 2-3 месяца.
Таким образом, увеличив длину курса и скорректировав дозировку, получится не только не плохо сэкономить, но и получить эффект ничем не уступающий, а так же снизить вероятность побочных эффектов. И курс Эндолутена уже кажется не таким дорогим. Упаковки 20 капсул хватит на 2 месяца. Эпифиз очень маленькая железа — как рисовое зернышко, поэтому даже 1 капсула каждый день — слишком много для неё.
Как принимать Цитогены
Если цитомаксы являются натуральными пептидами. Они медленно «разгоняются» но «долго едут» и являются самыми дорогими. То Цитогены их полная противоположность. Эти пептиды синтезированные, так как сделаны из растительного белка, действуют практически сразу после принятия, но после окончания курса их действие практически сразу прекращается. При этом Цитогены дешевле. Но и в эффективности уступают примерно на 20% Цитомаксам. Вот стандартная инструкция к Цитогенам :
взрослым по 1-2 капсулы 1-2 раза в день во время еды. Длительность приема 10-30 дней. Целесообразно проводить повторный курс через 4-6 месяцев.
Это инструкция соотвествует действительности, кроме того что принимать лучше всё-таки с утра на тощак. Цитогены из-за мгновенно действия, обычно ставят в самом начале курса, чтобы как можно быстрее получить эффект. И параллельно подключают цитомаксы, чтобы потом «работать в долгую».
Как принимать лингвал пептиды
Этот вид пептидов появился совсем недавно. По заверению специалистов, это теже цитомаксы (самые мощные пептиды), только в жидкой форме. Какие преимущества у лингвал формы? Во первых благодаря жидкой форме без проблем достигается 100% усвояемость. Во вторых там нет доп. компонентов (в частности желатина и лактозы), из-за применения которых в больших количествах могут быть побочные эффекты. Но есть и минусы — курс таких пептидов дороже. Официальная инструкция по применению пептидов лингвал звучит так:
Взрослым рекомендуется принимать под язык за 10–15 минут до еды по 5–6 капель (0,25–0,35 мл) 3–4 раза в день. Продолжительность приема — 1 месяц. Рекомендуется проводить повторный прием через 3–6 месяцев.
Ведущий специалист в области пептидной биорегуляции Д.А. Горгиладзе, делится своим мнением как принимать Лингвал пептиды :
Таким образом нет необходимости придерживаться верхней границы рекомендуемой дозировки. А напротив — оптимальной схемой применения будет 3 разовое применение по 5 капель в сутки. То есть флакон используется весь допустимый срок хранения 13-14 дней. Так же не забываем, что после вскрытия Лингвал пептид должен быть в холодильнике!
Как принимать пептидные комплексы в растворе — ПК
Наиболее бюджетная линейка пептидов. Цена одного флакончика всего лишь 990 рублей, которого вполне может хватить на месяц. Тем не менее, при правильной инструкции по применению эти пептиды вполне рабочие. Производитель советует использовать ПК следующим образом:
нанести 6-8 капель на внутреннюю поверхность предплечья и растереть до полного впитывания. Продолжительность курса – 3 месяца. Одновременно возможно использование до 6 пептидных комплексов.
Это вполне адекватная инструкция! В отдельных случаях рекомендуется продлевать курс до 6 месяцев. Из-за небольшого количество действующего вещества. Клетки достаточно медленно «насыщаются» пептидами и эффект приходится долго ждать, пока действующее вещество накопится. Иногда рекомендуется привязывать дозировку пептидов к весу — 1 капелька на 10 кг. Для усиления эффектна допустимо использовать эти пептиды 2 раза в день : утром и вечером.
Совмещение нескольких пептидов и лекарств на одном курсе
Пептиды не только не мешают работать лекарствам. Но напротив усиливают их действие. Поэтому многие врачи назначают пептидные биорегуляторы вместе с курсом основного лечения. Нам не известно ни 1 лекарственного средства которое бы «конфликтовало» с пептидами. Что касается приёма сразу нескольких пептидов на одном курсе — это только приветствуется.
Результат использования пептидов для щитовидной железы + стандартных лекарств
Как видно из таблицы, результат от приёма пептидов Тиреоген Эндолутен вместе со стандартной терапией, намного эффективнее одной терапии. Это говорит о целесообразности добавления пептидов Хавинсона в курс лечения
Например во время приёма Визолутена (пептид глаз), чтобы усилить его эффект, подключают пептид нервной ткани (Церлутен) и сосудов (Вентфорт), то есть тех тканей которые имеют непосредственную близость к глазу и находятся в нём. Часто к пептидному курсу дополнительно назначают Владоникс (иммунитет), чтобы увеличить скорость общего восстановления организма.
Иногда задают вопрос. Какое количество пептидов можно принимать максимально на одном курсе? Обычно используется не более 3-4 биорегуляторов. Некоторые специалисты считают что можно повышать до 6. Однако если на вашем курсе много пептидов, то начинать приём следует аккуратно с минимальных дозировок и плавно повышать. Так как организм может быть «шокирован» таким количество пептидов из вне. И будет ощущаться недомогание.
Побочные эффекты во время приёма пептидов Хавинсона
Жирный плюс пептидов Хавинсона в том, что они не имеют побочных эффектов. В частности нам приходилось читать статью, где было написано что приём этих пептидов исследовался на 15 млн человек и ни у кого не было побочных эффектов. Однако на практике они все-таки случаются. Правда не на сами пептиды, а на дополнительные компоненты в составе, в частности желатин и лактозу. В очень редких случаях — встречается индивидуальная аллергическая реакция на один из стабилизирующих компонентов в составе препарата. В целом побочные эффекты от пептидов Хавинсона редки и очень незначительны. Но всё равно не будет лишним ознакомиться в составом препарата, если есть аллергия на какие-либо вещества.
Вопрос по хранению пептидов Хавинсона
У пептидов Хавинсона нет никаких проблем с хранением. Капсульные формы наиболее живучие. Только официальный срок годности 5 лет в комнатной температуре. И тот указан с хорошим запасом. Самые уязивимые — лингвал пептиды. После вскрытия должны быть в холодильнике и срок хранения всего 14 суток.
Как правильно составить курс пептидов
На данный момент существуют пептиды практически для всех систем организма. Их отличает происхождение, состав, а так же стоимость. В выборе пептидов нужно ориентироваться на состояние здоровья, бюджет, а так же эффект который нужен — лечебный или профилактический. Если вы никогда не пробовали пептиды, то лучше довериться специалистам при выборе оптимального курса. В этом может помочь специальный раздел готовые курсы пептидов, либо обратитесь к нам за составлением курса.
Как часто нужно повторять курсы пептидов?
Вы закончили курс. И возникает вопрос, а когда можно начать новый приём пептидов? На этот ответ нет однозначного ответа. С одной стороны после курса клетки «насытились» пептидными биорегуляторами и процесс восстановления запущен. В это время нет необходимости продолжать приём пептидов, так как лишние из них просто выйдут из организма. С другой — если проводить приём слишком редко, будет ощущаться нехватка пептидов, что может снизить их полезное действие. В целом, если речь идёт о лечении, то рекомендуется проводить 1 пептидный курс не более раз в 6 месяцев. Если профилактика — не более 1 курса раз в 12 месяцев.
Другие вопросы о пептидах
В этой статье мы постарались ответить на наиболее популярные вопросы от людей использующих пептидные биорегуляторы Хавинсона. Если вам не удалось найти ответа на свой вопрос, то вы можете добавить его в комментарии и мы обновим статью добавив этот вопрос, либо дадим ответ прямо под комментарием. Купить оригинальные пептиды Хавинсона в Москве можно в нашем магазине Peptides. Для заказа откройте прайс . Отправки в регионы.