Pertuzumabum (род. Pertuzumabi)
Рекомбинантные гуманизированные моноклональные антитела к рецепторам эпидермального фактора роста человека 2-го типа (HER2).
Пертузумаб получают по технологии рекомбинантной ДНК в культуре клеток яичников китайского хомячка.
Пертузумаб имеет молекулярную массу приблизительно 148 кДа, и предполагается, что, как и другие моноклональные антитела, не проходит через ГЭБ.
Пертузумаб избирательно взаимодействует с отвечающим за димеризацию внеклеточным субдоменом II HER2. Связывание пертузумаба с субдоменом II блокирует процесс лигандзависимой гетеродимеризации HER2 с другими белками семейства HER, включая рецептор эпидермального фактора роста человека (EGFR), рецепторы эпидермального фактора роста человека 3-го и 4-го типов (HER3 и HER4). Таким образом, пертузумаб ингибирует лигандинициированную передачу внутриклеточных сигналов по двум основным сигнальным путям: путь митогенактивированной протеинкиназы и путь фосфоинозитид-3-киназы. Угнетение данных сигнальных путей способно привести к остановке роста клеток и апоптозу, соответственно. Кроме того, пертузумаб способствует активации антителозависимой клеточной цитотоксичности.
Пертузумаб в виде моноагента ингибирует пролиферацию клеток опухоли человека. Показано усиление противоопухолевой активности пертузумаба на моделях ксенотрансплантатов с гиперэкспрессией HER2 при его применении в комбинации с трастузумабом.
Иммуногенность
Приблизительно у 6,2% больных, получавших терапию трастузумабом в комбинации с доцетакселом, и у 2,8% больных, получавших трастузумаб в комбинации с доцетакселом и пертузумабом, были обнаружены антитела к пертузумабу. Однозначная связь образования антител к пертузумабу с развитием анафилактической реакции/реакции гиперчувствительности не была установлена ни у одного из пациентов.
Фармакокинетика
Фармакокинетика пертузумаба изучалась после в/в введения в дозах от 2 до 25 мг/кг у пациентов с различными видами опухоли.
Клиренс пертузумаба не зависел от дозы и показания.
Фармакокинетические параметры не зависят от возраста, пола и этнической принадлежности.
Начальная концентрация альбумина и величина «тощей» массы тела (величина, характеризующая массу тела за вычетом массы жировой ткани) оказывают незначительное влияние на клиренс пертузумаба, при этом необходимость коррекции дозы пертузумаба в зависимости от начальной концентрации альбумина или массы тела отсутствует.
Всасывание. Пертузумаб вводится в/в. Другие пути введения не изучались.
Распределение. После в/в введения объем распределения в центральной камере (Vc) составляет 3,07 л и приблизительно равен объему плазмы. Значения Vc и VSS свидетельствуют о том, что распределение происходит только в плазме и внеклеточной жидкости.
Метаболизм. Метаболизм пертузумаба не изучался. Как и другие антитела, пертузумаб преимущественно подвергается катаболизму.
Выведение. Клиренс пертузумаба составляет приблизительно 0,239 л/сут, Т1/2 приблизительно равен 17,2 дня.
Фармакокинетика у особых групп пациентов
Пациенты пожилого и старческого возраста. Специальных исследований фармакокинетики пертузумаба у пациентов пожилого (>65 лет) и старческого (>75 лет) возраста не проводилось. По результатам популяционного анализа, возраст не оказывает влияние на фармакокинетические параметры пертузумаба.
Пациенты с нарушением функции почек. Специальных исследований фармакокинетики пертузумаба у пациентов с почечной недостаточностью не проводилось. По результатам популяционного анализа, почечная недостаточность легкой (Cl креатинина 60–90 мл/мин), средней (30–60 мл/мин) и тяжелой степени (<30 мл/мин) не оказывает влияние на экспозицию пертузумаба. Однако данные для пациентов со средней и тяжелой почечной недостаточностью ограничены.
Пациенты с нарушением функции печени. Изучение фармакокинетики пертузумаба у больных с нарушением функции печени не проводилось.
Метастатический или местнорецидивирующий неоперабельный рак молочной железы с опухолевой гиперэкспрессией HER2: в комбинации с трастузумабом и доцетакселом при отсутствии ранее проводимого лечения или при прогрессировании заболевания после проведения адъювантной терапии.
Повышенная чувствительность к пертузумабу, беременность и период грудного вскармливания, детский возраст до 18 лет (эффективность и безопасность применения не установлены), значения фракции выброса левого желудочка сердца (ФВЛЖ) до лечения <50%, застойная сердечная недостаточность в анамнезе, неконтролируемая гипертензия, недавно перенесенный инфаркт миокарда, серьезные нарушения сердечного ритма, требующие лекарственной терапии на момент назначения, за исключением фибрилляции предсердий и пароксизмальной наджелудочковой тахикардии, предшествующее лечение антрациклинами с кумулятивной дозой доксорубицина или эквивалентного препарата >360 мг/м2, нарушения функции печени (эффективность и безопасность применения не изучались).
Снижение ФВЛЖ до уровня <50% на фоне предшествующей адъювантной терапии трастузумабом; предшествующее лечение антрациклинами или предшествующая лучевая терапия на область грудной клетки; состояния, которые способны нарушать функцию левого желудочка; нарушения функции почек.
Категория действия на плод по FDA — D.
Наиболее частыми нежелательными реакциями (наблюдавшимися более чем у 50% пациентов), связанными с применением пертузумаба в комбинации с трастузумабом и доцетакселом, были диарея, алопеция и нейтропения.
Наиболее часто наблюдавшимися (>10%) нежелательными реакциями 3–4-й степени тяжести по классификации Национального института рака (National Cancer Institute Common Terminology Criteria of Adverse Events (NCI-CTCAE), версия 3), были нейтропения, фебрильная нейтропения и лейкопения.
Наиболее тяжелой и клинически значимой нежелательной реакцией, наблюдавшейся с частотой менее 10%, было нарушение функции левого желудочка, в т.ч. симптоматическая систолическая дисфункция левого желудочка (застойная сердечная недостаточность).
Нежелательные реакции, о которых сообщалось при изучении применения пертузумаба в комбинации с трастузумабом и доцетакселом, приведены ниже. Поскольку пертузумаб использовался в комбинации с трастузумабом и доцетакселом, проблематично точно установить причинно-следственную взаимосвязь между нежелательным явлением и конкретным действующим веществом.
Для описания частоты нежелательных реакций используется следующая классификация: очень часто (>1/10); часто (>1/100 и <1/10); нечасто (>1/1000 и <1/100); редко (>1/10000 и <1/1000) и очень редко (<1/10000), включая единичные случаи.
Со стороны крови и лимфатической системы: очень часто — нейтропения, анемия, лейкопения, фебрильная нейтропения (в т.ч. с летальным исходом).
Со стороны иммунной системы: часто — гиперчувствительность.
Со стороны обмена, веществ и нарушения питания: очень часто — снижение аппетита.
Нарушения психики: очень часто — бессонница.
Со стороны нервной системы: очень часто — периферическая нейропатия, головная боль, извращение вкуса, головокружение.
Со стороны органа зрения: очень часто — повышенное слезоотделение.
Со стороны сердца: часто — нарушение функции левого желудочка, в т.ч. застойная сердечная недостаточность.
Со стороны дыхательной системы, органов грудной клетки и средостения: очень часто — одышка; часто — плевральный выпот.
Со стороны ЖКТ: очень часто — диарея, тошнота, рвота, запор, стоматит.
Со стороны кожи и подкожных тканей: очень часто — алопеция, сыпь, патология ногтей, зуд, сухость кожи; часто — паронихия.
Со стороны скелетно-мышечной и соединительной ткани: очень часто — миалгия, артралгия.
Общие расстройства и нарушения в месте введения: очень часто — повышенная утомляемость, астения, периферические отеки, воспаление слизистых оболочек различной локализации, повышение температуры тела, присоединение вторичных инфекций (инфекции верхних дыхательных путей, назофарингит).
После отмены доцетаксела все нежелательные реакции наблюдались с меньшей частотой (<10%, за исключением диареи, инфекций верхних дыхательных путей, сыпи, головной боли и утомляемости (>10%).
Инфузионные реакции, реакции гиперчувствительности/анафилаксия
Любые побочные реакции, развитие которых произошло в процессе инфузии или в день инфузии, были отнесены к инфузионным реакциям. После введения только пертузумаба большинство инфузионных реакций имели легкую или среднюю степень тяжести и наблюдались приблизительно у 20% пациентов. Наиболее частыми инфузионными реакциями (>1,5%) были тошнота, повышение температуры тела, диарея, озноб, утомляемость и головная боль.
После одновременного введения пертузумаба, трастузумаба и доцетаксела, начиная со второго цикла терапии, наиболее частыми (>1,5%) инфузионными реакциями были алопеция, тошнота, снижение аппетита, утомляемость, запор, диарея, стоматит и лекарственная гиперчувствительность.
Общая частота явлений гиперчувствительности/анафилаксии составила 9,1% после одновременного введения трастузумаба и доцетаксела и 10,8% после одновременного введения пертузумаба, трастузумаба и доцетаксела; из данных явлений 2,5 и 2% характеризовались 3-й и 4-й степенью тяжести по классификации NCI-CTCAE, версия 3, соответственно. В общей сложности у 2 пациентов после одновременного введения трастузумаба и доцетаксела и у 4 пациентов после одновременного введения пертузумаба, трастузумаба и доцетаксела развилась анафилаксия.
Большинство реакций гиперчувствительности были легкой или средней степени тяжести и разрешались после соответствующего лечения. По результатам анализа реакций гиперчувствительности при изменении режимов дозирования препаратов, установлено, что явления гиперчувствительности были связаны с инфузиями доцетаксела.
Отклонения от нормы лабораторных показателей
Частота случаев снижения числа нейтрофилов 3–4-й степени тяжести по классификации NCI-CTCAE, версия 3, была приблизительно одинаковой при применении комбинации трастузумаба и доцетаксела одновременно с пертузумабом и без него.
RxList.com
Следующие побочные реакции обсуждены более подробно в других полях:
— дисфункция левого желудочка сердца (см. «Меры предосторожности»);
— эмбрио/фетотоксичность (см. «Меры предосторожности»);
— инфузионные реакции (см. «Меры предосторожности»);
— реакции гиперчувствительности (см. «Меры предосторожности»).
Так как клинические исследования проведены с различным набором условий, частота встречаемости побочных реакций, наблюдаемых в этих исследованиях, не может непосредственно сравниваться с частотой в других исследованиях, и может не отражать частоту побочных эффектов, наблюдавшихся в клинической практике.
Метастатический рак молочной железы (первое исследование)
В первом исследовании, проведенном с участием 804 пациентов с HER2-положительным раком молочной железы, пациенты были рандомизированы по двум группам: первая — получавшие пертузумаб в комбинации с трастузумабом и доцетакселом (N=407), вторая — получавшие плацебо в комбинации с трастузумабом и доцетакселом (N=397). Средняя продолжительность исследования составила 18,1 мес для первой и 11,8 для второй группы пациентов. Корректировка доз пертузумаба и трастузумаба не допускалась. Прекращение лечения в результате побочных действий потребовалось у 6,1% пациентов первой группы и у 5,3% пациентов второй группы. Побочные действия, приводящие к отмене только доцетаксела, наблюдались у 23,6% пациентов, получавших пертузумаб, и у 23,6% пациентов, получавших плацебо. Побочные действия, наблюдавшиеся у ≥10% пациентов, приведены ниже. Первая цифра — число нежелательных реакций, наблюдавшихся у пациентов первой группы всех степеней тяжести, через точку с запятой указана частота осложнений 3–4-й степени (>2%) по NCI-CTCAE, версия 3; в скобках — аналогичные данные для пациентов второй группы, получавших плацебо вместо пертузумаба. Профиль безопасности пертузумаба в первом исследовании оставался неизменным в течение последующих 2,75 лет (медиана продолжительности наблюдений — 50 мес).
Общие расстройства и нарушения в месте введения: повышенная утомляемость — 37,6; 2,2 (36,8; 3,3); астения — 26; 2,5 (30,2; 1,5); периферические отеки — 23,1; 0,5 (30; 0,8); воспаление слизистых оболочек — 27,8; 1,5 (19,9; 1); гипертермия — 18,7; 1,2 (17,9; 0,5).
Со стороны кожи и подкожных тканей: алопеция — 60,9; 0 (60,5; 0,3); сыпь — 33,7; 0,7 (24,2; 0,8); поражения ногтей — 22,9; 1,2 (22,9; 0,3); зуд — 14; 0 (10,1; 0); сухость кожи — 10,6; 0 (4,3; 0).
Со стороны ЖКТ: диарея — 66,8; 7,9 (46,3; 5); тошнота — 42,3; 1,2 (41,6; 0,5); рвота — 24,1; 1,5 (23,9; 1,5); запор — 15; 0 (24,9; 1); стоматит — 18,9; 0,5 (15,4; 0,3).
Со стороны крови и лимфатической системы: нейтропения — 52,8; 48,9 (49,6; 45,8); анемия — 23,1; 2,5 (18,9; 3,5); лейкопения — 18,2; 12,3 (20,4; 14,6); фебрильная нейтропения (в т.ч. связанная с летальным исходом) — 13,8; 13 (7,6; 7,3).
Со стороны нервной системы: периферическая нейропатия — 32,4; 3,2 (33,8; 2); головная боль — 20,9; 1,2 (16,9; 0,5); извращение вкуса — 18,4; 0 (15,6; 0); головокружение — 12,5; 0,5 (12,1; 0).
Со стороны скелетно-мышечной и соединительной ткани: миалгия — 22,9; 1 (23,9; 0,8); артралгия — 15,5; 0,2 (16,1; 0,8).
Инфекции и инвазии: инфекции верхних дыхательных путей — 16,7; 0,7 (13,4; 0); назофарингиты — 11,8; 0 (12,8; 0,3).
Респираторные, торакальные и медиастинальные нарушения: одышка — 14; 1 (15,6; 2).
Со стороны обмена веществ и расстройства питания: снижение аппетита — 29,2; 1,7 (26,4; 1,5).
Со стороны глаз: повышенное слезоотделение — 14; 0 (13,9; 0).
Со стороны психики: бессонница — 13,3; 0 (13,4; 0).
Наиболее часто (>30%), по данным первого исследования, при применении пертузумаба в комбинации с трастузумабом и доцетакселом наблюдались диарея, алопеция, нейтропения, тошнота, повышенная утомляемость, сыпь и периферическая нейропатия. По классификации NCI-CTCAE, версия 3, наиболее частыми побочными реакциями 3–4-й степени (>2%) были нейтропения, фебрильная нейтропения, лейкопения, диарея, периферическая нейропатия, анемия, астения и повышенная утомляемость. Повышение числа случаев фебрильной нейтропении наблюдалось у пациентов азиатской расы по сравнению с представителями других рас и географических регионов. Среди пациентов азиатской расы случаи фебрильной нейтропении наблюдались чаще в группе, получавшей пертузумаб (26%), чем плацебо (12%).
Следующие клинические случаи побочных реакций были зарегистрированы с частотой <10% у пациентов первой группы в первом исследовании (в процентах; в скобках данные для второй группы, получавшей плацебо вместо пертузумаба).
Со стороны кожи и соединительной ткани: паронихия — 7,1 (3,5).
Респираторные, торакальные и медиастинальные нарушения: плевральный выпот — 5,2 (5,8).
Со стороны сердца: дисфункция левого желудочка сердца — 4,4 (8,3), включая симптоматическую систолическую дисфункцию левого желудочка — 1 (1,8).
Со стороны иммунной системы: гиперчувствительность — 10,1 (8,6).
Побочные реакции у пациентов, получавших пертузумаб и трастузумаб после отмены доцетаксела
В первом исследовании сообщалось об уменьшении частоты побочных реакций после отмены лечения доцетакселом. Все побочные реакции при лечении пертузумабом в комбинации с трастузумабом регистрировались с частотой <10%, за исключением диареи — 19,1%, инфекций верхних дыхательный путей — 12,8%, сыпи — 11,7%, головной боли — 11,4% и повышенной утомляемости — 11,1%.
Неоадъювантная терапия рака молочной железы (второе исследование)
Во втором исследовании наиболее частые нежелательные реакции при применении пертузумаба в комбинации с трастузумабом и доцетакселом в течение 4 циклов терапии были аналогичны наблюдавшимся в первом исследовании у группы, получавшей пертузумаб. Наиболее часто (с частотой >30%) регистрировались алопеция, нейтропения, диарея и тошнота, в т.ч. наиболее частыми побочными реакциями 3–4-й степени по классификации NCI-CTCAE, версия 3 (>2%), были нейтропения, фебрильная нейтропения, лейкопения и диарея. В этой группе у одного пациента была отменена неоадъювантная терапия из-за побочного действия. Ниже суммированы данные о побочных реакциях, возникавших с частотой ≥10% при неоадъювантной терапии у пациентов, получавших пертузумаб, во втором исследовании. Данные (в %) приведены в следующем порядке (первая цифра — число нежелательных реакций всех степеней тяжести, в скобках — для осложнений 3–4-й степеней тяжести): пациенты, получавшие трастузумаб + доцетаксел (n=107); пациенты, получавшие пертузумаб + трастузумаб + доцетаксел (n=107); пациенты, получавшие пертузумаб + трастузумаб (n=108) и пациенты, получавшие пертузумаб + доцетаксел (n=108).
Общие расстройства и нарушения в месте введения: повышенная утомляемость — 27,1 (0), 26,2 (0,9), 12 (0) и 25,5 (1,1); астения — 17,8 (0), 20,6 (1,9), 2,8 (0) и 16 (2,1); периферические отеки — 10,3 (0), 2,8 (0), 0,9 (0) и 5,3 (0); воспаление слизистых оболочек — 21,5 (0), 26,2 (1,9), 2,8 (0) и 25,5 (0); гипертермия — 10,3 (0), 16,8 (0), 8,3 (0) и 8,5 (0).
Со стороны кожи и подкожных тканей: алопеция — 66,4 (0), 65,4 (0), 2,8 (0) и 67 (0); сыпь — 21,5 (1,9), 26,2 (0,9), 11,1 (0) и 28,7 (1,1).
Со стороны ЖКТ: диарея — 33,6 (3,7), 45,8 (5,6), 27,8 (0) и 54,3 (4,3); тошнота — 36,4 (0), 39,3 (0), 13,9 (0) и 36,2 (1,1); рвота — 12,1 (0), 13,1 (0), 4,6 (0) и 16 (2,1); стоматит — 7,5 (0), 17,8 (0), 4,6 (0) и 9,6 (0).
Со стороны крови и лимфатической системы: нейтропения — 63,6 (58,9), 50,5 (44,9), 0,9 (0,9) и 64,9 (57,4); лейкопения — 21,5 (11,2), 9,3 (4,7), 0 (0) и 13,8 (8,5).
Со стороны нервной системы: головная боль — 11,2 (0), 11,2 (0), 13,9 (0) и 12,8 (0); извращение вкуса — 10,3 (0), 15 (0), 4,6 (0) и 7,4 (0); периферическая нейропатия — 12,1 (0,9), 8,4 (0,9), 1,9 (0) и 10,6 (0).
Со стороны обмена веществ и расстройства питания: снижение аппетита — 6,5 (0), 14 (0), 1,9 (0) и 14,9 (0).
Со стороны психики: бессонница — 11,2 (0), 8,4 (0), 3,7 (0) и 8,5 (0).
Следующие побочные реакции, зарегистрированные во втором исследовании, встречались с частотой <10% у пациентов, получавших неоадъювантную терапию, но с большей частотой возникали у пациентов в группах, получавших пертузумаб. Данные (в %) приведены для осложнений всех степеней тяжести в том же порядке, что и для побочных реакций, возникавших с частотой >30%, — пациенты, получавшие трастузумаб + доцетаксел; пертузумаб + трастузумаб + доцетаксел; пертузумаб + трастузумаб и пертузумаб + доцетаксел.
Со стороны крови и лимфатической системы: анемия — 6,5; 2,8; 4,6 и 8,5; фебрильная нейтропения — 6,5; 8,4; 0 и 7,4.
Со стороны иммунной системы: гиперчувствительность — 1,9; 5,6; 5,6 и 5,3.
Со стороны нервной системы: головокружение — 3,7; 2,8; 5,6 и 3,2.
Инфекции и инвазии: инфекции верхних дыхательных путей — 2,8; 4,7; 1,9 и 7,4.
Респираторные, торакальные и медиастинальные нарушения: одышка — 3,7; 4,7; 2,8 и 2,1.
Со стороны сердца: дисфункция левого желудочка сердца — 0,9; 2,8; 0 и 1,1, включая симптоматическую систолическую дисфункцию левого желудочка — 0,9; 0; 0 и 0.
Со стороны глаз: повышенное слезоотделение — 1,9; 3,7; 0,9 и 4,3.
Неоадъювантная терапия рака молочной железы (третье исследование)
В третьем исследовании, когда пертузумаб назначали в комбинации с трастузумабом и доцетакселом в течение 3 циклов терапии после 3 циклов терапии комбинацией фторурацил + эпирубицин + циклофосфамид (FEC), наиболее частыми побочными реакциями (>30%) были диарея, тошнота, алопеция, нейтропения, рвота и утомляемость. Наиболее частыми побочными реакциями 3–4-й степени по классификации NCI-CTCAE, версия 3 (>2%) были нейтропения, фебрильная нейтропения, диарея, дисфункция левого желудочка сердца, анемия, одышка, тошнота и рвота.
Аналогично этому, при назначении пертузумаба в комбинации с доцетакселом, карбоплатином и трастузумабом (TCH) в течение 6 циклов терапии наиболее частыми побочными реакциями (>30%) были диарея, алопеция, нейтропения, тошнота, утомляемость, рвота, анемия и тромбоцитопения. Наиболее частыми побочными реакциями 3–4-й степени по классификации NCI-CTCAE, версия 3 (>2%), были нейтропения, фебрильная нейтропения, анемия, лейкопения, диарея, тромбоцитопения, рвота, утомляемость, повышение уровня АЛТ, гипокалиемия и гиперчувствительность.
Отмена какого-нибудь компонента неоадъювантной терапии в результате побочных реакций потребовалась у 6,7% пациентов, получавших пертузумаб в комбинации с трастузумабом и доцетакселом после терапии FEC, и у 7,9% пациентов, получавших пертузумаб в комбинации с TCH.
Ниже суммированы данные о побочных реакциях, возникавших с частотой ≥10% при неоадъювантной терапии у пациентов, получавших пертузумаб, в третьем исследовании. Данные (в %) приведены в следующем порядке (первая цифра — число нежелательных реакций всех степеней тяжести, в скобках — для осложнений 3–4-й степеней тяжести): пациенты, получавшие пертузумаб + трастузумаб + FEC с последующей терапией комбинацией пертузумаб + трастузумаб + доцетаксел (n=72); пациенты, получавшие пертузумаб + трастузумаб + доцетаксел после терапии FEC (n=75) и пациенты, получавшие пертузумаб в комбинации с TCH (n=76).
Общие расстройства и нарушения в месте введения: повышенная утомляемость — 36,1 (0), 36 (0) и 42,1 (3,9); астения — 9,7 (0), 14,7 (1,3) и 13,2 (1,3); периферические отеки — 11,1 (0), 4 (0) и 9,2 (0); воспаление слизистых оболочек — 23,6 (0), 20 (0) и 17,1 (1,3); гипертермия — 16,7 (0), 9,3 (0) и 15,8 (0).
Со стороны кожи и подкожных тканей: алопеция — 48,6 (0), 52 (0) и 55,3 (0); сыпь — 19,4 (0), 10,7 (0) и 21,1 (1,3); сухость кожи — 5,6 (0), 9,3 (0) и 10,5 (0); синдром ладонно-подошвенной эритродизестезии — 6,9 (0), 10,7 (0) и 7,9 (0);
Со стороны ЖКТ: диарея — 61,1 (4,2), 61,3 (5,3) и 72,4 (11,8); диспепсия — 25 (1,4), 8 (0) и 22,4 (0); тошнота — 52,8 (0), 53,3 (2,7) и 44,7 (0); рвота — 40,3 (0), 36 (2,7) и 39,5 (5,3); запор — 18,1 (0), 22,7 (0) и 15,8 (0); стоматит — 13,9 (0), 17,3 (0) и 11,8 (0).
Со стороны крови и лимфатической системы: нейтропения — 51,4 (47,2), 46,7 (42,7) и 48,7 (46,1); анемия — 19,4 (1,4), 9,3 (4) и 38,2 (17,1); лейкопения — 22,2 (19,4), 16 (12) и 17,1 (11,8); фебрильная нейтропения — 18,1 (18,1), 9,3 (9,3) и 17,1 (17,1); тромбоцитопения — 6,9 (0), 1,3 (0) и 30,3 (11,8).
Со стороны иммунной системы: гиперчувствительность — 9,7 (2,8), 1,3 (0) и 11,8 (2,6).
Со стороны нервной системы: периферическая нейропатия — 5,6 (0), 1,3 (0) и 10,5 (0); головная боль — 22,2 (0), 14,7 (0) и 17,1 (0); извращение вкуса — 11,1 (0), 13,3 (0) и 21,1 (0); головокружение — 8,3 (0), 8 (1,3) и 15,8 (0).
Со стороны скелетно-мышечной и соединительной ткани: миалгия — 16,7 (0), 10,7 (1,3) и 10,5 (0); артралгия — 11,1 (0), 12 (0) и 6,6 (0).
Респираторные, торакальные и медиастинальные нарушения: кашель — 9,7 (0), 5,3 (0) и 11,8 (0); одышка — 12,5 (0), 8 (2,7) и 10,5 (1,3); носовое кровотечение — 11,1 (0), 10,7 (0) и 15,8 (1,3); боль в ротоглотке — 8,3 (0), 6,7 (0) и 11,8 (0).
Со стороны обмена веществ и расстройства питания: снижение аппетита — 20,8 (0), 10,7 (0) и 21,1 (0).
Со стороны глаз: повышенное слезоотделение — 12,5 (0), 5,3 (0) и 7,9 (0).
Со стороны психики: бессонница — 11,1 (0), 13,3 (0) и 21,1 (0).
Изменения лабораторных показателей: повышение уровня АЛТ — 6,9 (0), 2,7 (0) и 10,5 (3,9).
Отдельные побочные реакции, возникавшие в третьем исследовании с частотой <10% у пациентов, получавших неоадъювантную терапию, приведены ниже. Данные (в %) приведены для осложнений всех степеней тяжести в том же порядке, что и для побочных реакций, возникавших с частотой ≥10%, — пациенты, получавшие пертузумаб + трастузумаб + FEC с последующей терапией комбинацией пертузумаб + трастузумаб + доцетаксел; пациенты, получавшие пертузумаб + трастузумаб + доцетаксел после терапии FEC и пациенты, получавшие пертузумаб в комбинации с TCH.
Со стороны кожи и подкожных тканей: поражения ногтей — 9,7; 6,7 и 9,2; паронихия — 0; 1,3 и 1,3; зуд — 2,8; 4 и 3,9.
Инфекции и инвазии: инфекции верхних дыхательных путей — 8,3; 4 и 2,6; назофарингиты — 6,9; 6,7 и 7,9.
Респираторные, торакальные и медиастинальные нарушения: плевральный выпот — 1,4; 0 и 0.
Со стороны сердца: дисфункция левого желудочка сердца — 5,6; 4 и 2,6, включая симптоматическую систолическую дисфункцию левого желудочка — 2,7; 0 и 0.
Иммуногенность
Как и другие терапевтические белки, пертузумаб может вызвать иммунный ответ на его введение.
В первом исследовании пациенты были протестированы на наличие антител к пертузумабу в нескольких временных точках. Приблизительно у 2,8% пациентов (11 из 386), получавших пертузумаб, и у 6,2% пациентов (23 из 372) из группы, получавших плацебо, были обнаружены антитела к пертузумабу. Ни у одного из этих 34 пациентов не было обнаружено безусловной связи между возникновением анафилактических реакций или реакций гиперчувствительности с выявлением антитерапевтических антител. Присутствие пертузумаба в сыворотке пациента на ожидаемом в момент забора образцов уровне может служить помехой для определения антител к нему. Кроме того, тестирование может дать результат на антитела к трастузумабу. В результате этого полученные данные не отражают реальной картины развития антител к престузумабу.
Данные по иммуногенности в значительной степени зависят от чувствительности и специфичности применяемых методов тестирования. Кроме того, на получение положительных результатов тестирования могут влиять некоторые факторы, такие как обращение с пробами, время сбора проб, влияние других ЛС, сопутствующее лечение и основное заболевание. По этим причинам сравнение частоты случаев возникновения антител к пертузумабу со случаями возникновения антител к другим ЛС может вводить в заблуждение.
Признаков фармакокинетического взаимодействия между пертузумабом и трастузумабом, доцетакселом, гемцитабином, эрлотинибом, капецитабином не обнаружено.
Совместимость
Пертузумаб несовместим с 5% раствором декстрозы. Разведение в таком растворе приводит к химической и физической нестабильности пертузумаба. Пертузумаб следует разводить только в 0,9% растворе натрия хлорида. Пертузумаб нельзя смешивать или разводить вместе с другими ЛС.
Раствор пертузумаба совместим с инфузионными пакетами, изготовленными из ПВХ, ПЭ и других полиолефинов.
Максимальная переносимая доза пертузумаба не установлена. Однократные дозы, превышающие 25 мг/кг (1727 мг), не изучались.
В случае передозировки необходимо внимательно наблюдать за пациентами с целью обнаружения признаков или симптомов нежелательных реакций и назначения соответствующего симптоматического лечения.
В/в капельно. Вводить препарат в/в струйно или болюсно нельзя. До начала лечения пертузумабом необходимо провести тестирование на опухолевую экспрессию HER2. Обязательным критерием является 3+ балла по результатам иммуногистохимического анализа и/или степень амплификации ≥2.0 по результатам гибридизации in situ.
Режим дозирования
Длительность инфузии при введении первой дозы должна составлять 60 мин. Если первая инфузия переносится хорошо, последующие можно проводить на протяжении 30–60 мин.
Нагрузочная доза составляет 840 мг в виде 60-минутной в/в капельной инфузии. Далее через 3 нед и каждые 3 нед вводится поддерживающая доза 420 мг в виде 30–60-минутной инфузии.
При применении пертузумаба в комбинации с трастузумабом и доцетакселом следует придерживаться режимов и особых указаний по дозированию, изложенных в инструкциях по медицинскому применению соответствующих препаратов.
Лечение пертузумабом следует проводить только под наблюдением онколога.
На фоне применения препаратов, блокирующих активность HER2, включая пертузумаб, наблюдалось снижение ФВЛЖ. Применение пертузумаба в комбинации с трастузумабом и доцетакселом не сопровождалось повышением частоты симптоматической систолической дисфункции левого желудочка или снижения ФВЛЖ по сравнению с применением только трастузумаба и доцетаксела. Однако у пациентов, ранее получавших антрациклины или лучевую терапию на область грудной клетки, риск снижения ФВЛЖ может быть выше.
ФВЛЖ следует оценить перед применением пертузумаба и регулярно (например каждые 3 мес) определять на фоне лечения для того, чтобы убедиться, что ФВЛЖ находится в пределах нормальных значений, установленных в данном учреждении. Если ФВЛЖ составляет менее 40% или 40–45% при снижении на >10% от исходного уровня до лечения, применение пертузумаба и трастузумаба следует приостановить. Если после повторной оценки, проведенной в период приблизительно 3 нед, ФВЛЖ не улучшится или произойдет ее дальнейшее снижение, следует рассмотреть вопрос об отмене пертузумаба и трастузумаба, если только не будет решено, что преимущества их применения для конкретного пациента превышают риск.
Инфузионные реакции и реакции гиперчувствительности. При применении пертузумаба возможно развитие инфузионных реакции и реакций гиперчувствительности. При введении пертузумаба следует тщательно наблюдать за пациентом на протяжении первой инфузии и в течение 60 мин после ее окончания, а также на протяжении последующих инфузий и в течение 30 мин после их окончания. При развитии клинически значимой реакции на инфузию следует замедлить скорость инфузии или прервать ее и провести соответствующие лечебные мероприятия. Тщательное наблюдение за пациентом и оценка его состояния рекомендуются до полного разрешения симптомов. У пациентов с тяжелыми инфузионными реакциями следует оценить необходимость полной отмены пертузумаба с учетом степени тяжести наблюдавшейся реакции и характера ответа на лечение, назначенного в связи с нежелательной реакцией.
Влияние пертузумаба на способность управлять автомобилем и работать с механизмами не изучалось. При развитии некоторых нежелательных реакций, в частности головокружения, следует воздержаться от управления транспортными средствами и механизмами.
RxList.com
Дисфункция левого желудочка сердца
При применении ЛС, блокирующих активность HER2, включая пертузумаб, опубликованы случаи снижения ФВЛЖ. В первом исследовании применение пертузумаба в комбинации с трастузумабом и доцетакселом у пациентов с метастатическим раком молочной железы не ассоциировалось с увеличением числа случаев симптоматической систолической дисфункции левого желудочка или снижения ФВЛЖ по сравнению с плацебо в комбинации с трастузумабом и доцетакселом. Дисфункция левого желудочка сердца возникала у 4,4% пациентов, получавших пертузумаб, и у 8,3% пациентов в группе плацебо. Симптоматическая систолическая дисфункция левого желудочка (хроническая сердечная недостаточность) возникала у 1% пациентов, получавших пертузумаб, и у 1,8% пациентов в группе плацебо (см. «Побочные действия»). Пациенты, которые ранее получали терапию антрациклинами или радиотерапию на область грудной клетки, могут быть подвержены более высокому риску снижения ФВЛЖ.
Во втором исследовании у пациентов, получавших неоадъювантную терапию, частота случаев систолической дисфункции левого желудочка была выше в группе получавших пертузумаб по сравнению с группой леченных трастузумабом и доцетакселом. У пациентов, получавших пертузумаб в комбинации с трастузумабом и доцетакселом, наблюдалось возрастание числа случаев снижения ФВЛЖ. За весь период лечения снижение ФВЛЖ >10% и падение до уровня менее чем 50% от исходного происходило у 1,9% пациентов, получавших неоадъювантную терапию трастузумабом и доцетакселом, по сравнению с 8,4% пациентов с неоадъювантной терапией пертузумабом в комбинации с трастузумабом и доцетакселом. Симптоматическая систолическая дисфункция левого желудочка возникала у 0,9% пациентов, получавших неоадъювантную терапию пертузумабом в комбинации с трастузумабом и не отмечалась ни у одного пациента в трех других контрольных группах. ФВЛЖ восстанавливалась до уровня ≥50% у всех пациентов.
В третьем исследовании среди пациентов, получавших неоадъювантную терапию пертузумабом, за весь период лечения снижение ФВЛЖ >10% и падение до уровня менее чем 50% от исходного происходило у 6,9% пациентов, получавших пертузумаб + трастузумаб + FEC с последующей терапией комбинацией пертузумаб + трастузумаб + доцетаксел, у 16% пациентов, получавших пертузумаб + трастузумаб + доцетаксел после терапии FEC и у 10,5% пациентов, получавших пертузумаб в комбинации с TCH. Симптоматическая систолическая дисфункция левого желудочка возникала у 4% пациентов, получавших пертузумаб + трастузумаб + доцетаксел после терапии FEC, у 1,3% пациентов, получавших пертузумаб в комбинации с TCH, и не возникала ни у одного из пациентов, получавших пертузумаб + трастузумаб + FEC с последующей терапией комбинацией пертузумаб + трастузумаб + доцетаксел. ФВЛЖ восстанавливалась до уровня ≥50% у всех, за исключением одного, пациентов.
Применение пертузумаба не изучалось у пациентов со значением ФВЛЖ ≤50% до лечения, у пациентов с хронической сердечной недостаточностью в анамнезе со снижением ФВЛЖ до уровня <50% от исходного в течение предыдущей терапии трастузумабом, у пациентов с факторами риска снижения левожелудочковой функции, такими как неконтролируемая гипертензия, недавно перенесенный инфаркт миокарда, тяжелая сердечная аритмия, требующая лечения, или у пациентов, получавших ранее лечение антрациклинами с кумулятивной дозой доксорубицина или эквивалентного препарата >360 г/м2.
До начала лечения пертузумабом и через регулярные промежутки времени в период лечения (например каждые 3 мес при наличии метастазов и каждые 6 нед в случае неоадъювантной терапии) следует убедиться, что ФВЛЖ находится в границах нормы. Если значение ФВЛЖ <45% или в пределах 45–49% от исходного при абсолютном снижении на ≥10% по сравнению с наблюдавшимся до лечения, применение пертузумаба и трастузумаба следует приостановить и повторить оценку ФВЛЖ в течение приблизительно 3 нед. Если ФВЛЖ не повышается или имеет тенденцию к дальнейшему снижению, следует прекратить лечение пертузумабом и трастузумабом, даже если успех лечения конкретного пациента превышает риски.
Эмбрио/фетотоксичность
Пертузумаб может вызывать повреждение плода при применении у беременных женщин. Лечение беременных яванских макак пертузумабом приводило к уменьшению количества околоплодных вод ниже нормы, задержке развития почек плода и смерти плода. При применении пертузумаба в период беременности или при наступлении беременности во время получения пертузумаба или в течение 7 мес после получения последней дозы пертузумаба в комбинации с трастузумабом, пациент должен быть предупрежден о потенциальной опасности для плода.
Инфузионные реакции
Применение пертузумаба может быть связано с инфузионными реакциями (см. «Побочные действия»). В первом исследовании инфузионная реакция была определена как любой случай, описываемый в виде реакции гиперчувствительности, анафилактической реакции, острой инфузионной реакции или синдрома высвобождения цитокинов, возникающий во время инфузии или в день проведения инфузии.
Для проверки на инфузионные реакции, связанные с применением пертузумаба, начальную дозу пертузумаба вводили за день до применения трастузумаба и доцетаксела. В первый день, когда применялся только пертузумаб, общая частота инфузионных реакций составила 13% по сравнению с 9,8% в группе плацебо. Менее 1% этих реакций были 3-й или 4-й степени тяжести. Наиболее частыми инфузионными реакциями (≥1%) были гипертермия, озноб, утомляемость, головная боль, астения, гиперчувствительность и рвота.
Во втором цикле проверки, когда все ЛС применялись в один и тот же день, наиболее частыми инфузионными реакциями в группе, получавшей пертузумаб (≥1%), были утомляемость, извращение вкуса, гиперчувствительность, миалгия и рвота.
Во втором и третьем исследовании пертузумаб применяли в тот же день, что и другие ЛС, участвующие в этих исследованиях. Профиль инфузионных реакций был схожим с наблюдавшимся в первом исследовании, а степень их тяжести соответствовала оценкам 1–2 по классификации NCI-CTCAE, версия 3.0
Следует наблюдать пациентов в течение 60 мин после первой инфузии и в течение 30 мин после каждой последующей инфузии пертузумаба. При возникновении серьезной реакции, связанной с инфузией, следует уменьшить скорость или прервать инфузию и назначить соответсвующую медикаментозную терапию. До разрешения признаков и симптомов инфузионной реакции необходимо осуществлять тщательное наблюдение за пациентами.
Реакции гиперчувствительности/анафилаксия
В первом исследовании общая частота реакций гиперчувствительности/анафилаксии составила 10,8% в группе, получавшей пертузумаб, и 9,1% в группе плацебо. Частота подобных случаев 3–4 степеней тяжести по классификации NCI-CTCAE, версия 3.0 составила 2 и 2,5% соответственно. Случаи анафилаксии наблюдались в общем у 4 пациентов в группе получавших пертузумаб, и у 2 пациентов в группе плацебо.
Во втором и третьем исследовании профиль реакций гиперчувствительности/анафилаксии был схожим с наблюдавшимся в первом исследовании. Во втором исследовании зарегистрировано 2 случая анафилаксии у пациентов, получавших пертузумаб и доцетаксел. В третьем исследовании общая частота случаев реакций гиперчувствительности/анафилаксии была выше в группе, получавшей пертузумаб + TCH (13,2%), из которых 2,6% случаев относились к степени тяжести 3–4 по классификации NCI-CTCAE, версия 3.0.
Следует проводить тщательное наблюдение за развитием реакций гиперчувствительности у пациентов. В клинических испытаниях с применением пертузумаба наблюдались случаи тяжелой гиперчувствительности, включая анафилаксию. Необходимо наличие ЛС и соответствующего оборудования для скорой помощи в таких случаях. Пертузумаб противопоказан у пациентов с известной гиперчувствительностью к нему или к любому из вспомогательных веществ, используемых при применении пертузумаба.
Обобщенные материалы www.grls.rosminzdrav.ru, 2015 и www.rxlist.com, 2015.
Пертузумаб — это инновационный препарат для лечения HER2-положительного рака молочной железы (РМЖ), не отвечающего на терапию трастузумабом.
До того, как появилась таргетная терапия, HER2-позитивный РМЖ бы наиболее неблагоприятным вариантом опухоли в плане лечения и прогноза выживаемости. Ситуация кардинально изменилась с разработкой и внедрением в практику моноклональных антител против данного рецептора. Сегодня это считается одним из наиболее благоприятных и перспективных в плане лечения видов рака молочной железы. Однако не все пациенты с таким типом опухоли в полной мере отвечают на трастузумаб-содержащую терапию. У некоторых была первичная резистентность, когда опухоль была устойчива к проводимому лечению на этапе терапии первой линии. У других пациентов в течением времени развивалась вторичная резистентность . Поэтому поиски методов лечения продолжались, и одним из вариантов стало применение комбинации трастузумаба, пертузумаба и доцетаксела.
Фармакологическое действие пертузумаба
Действующее вещество пертузумаба представляет собой гуманизированное моноклональное антитело, которое связывается с внеклеточным доменом рецептора HER-2 и блокирует его соединение с другими рецепторами. Разберем как это работает.
Существует семейство рецепторов эпидермального фактора роста, которые запускают каскад реакций, обеспечивающих рост и размножение клеток. Если количество этих рецепторов значительно выше нормы, как это бывает в раковых клетках, они начинают бесконтрольно делиться и размножаться. В состав данного семейства входят 4 рецептора:
- HER-1.
- HER-2.
- HER-3.
- HER-4.
Все они, кроме HER-2, начинают работать после связывания с лигандами. Активность рецепторов проявляется только тогда, когда они связаны с другими рецепторами своего семейства. Такое состояние называется димеризация. Это могут быть гомодимеры, когда связывается два одинаковых рецептора, например HER-2/HER-2, или гетеродимеры, когда связываются неодинаковые рецепторы, например HER-2/HER-3.
Внеклеточная часть HER-2 имеет 4 части (субдомена), каждая из которых имеет свои функции. Трастузумаб блокирует действие четвертой части, а пертузумаб — второй, которая отвечает а димеризацию с другими рецепторами. Считается, что именно образование димера HER-2/HER-3 приводит к резистентности к трастузумабу. Для полноты противоопухолевого действия необходимо чтобы блокировались одновременно 2 субдомена, поэтому назначается одновременно 2 таргетных препарата — трастузумаб и пертузумаб.
Состав
Пертузумаб выпускается в виде концентрата, который подлежит растворению перед инфузионным введением.
Концентрат имеет вид прозрачной, опалесцирующей бесцветной жидкости. Допускается слегка коричневатый цвет. В 1 мл концентрата содержится 30 мг действующего вещества, в одном флаконе — 420 мг.
Препарат расфасован в бесцветные прозрачные стеклянные флаконы объемом 14 мл. Каждый флакон упакован в картонную коробку.
В качестве вспомогательных веществ применяются L-гистидин, уксусная кислота, сахароза, полисорбат и деионизированная вода.
Фармакологическое действие пертузумаба
Препарат оказывает противоопухолевое действие, блокируя гетеродимеризацию рецептора HER-2, тем самым подавляя инициацию процессов, необходимых для роста и размножения раковых клеток. Это в конечном итоге приводит к апоптозу.
Следует учитывать, что из-за высокой молекулярной массы основного действующего вещества, пертузумаб не может проникать через гематоэнцефалический барьер и поэтому неэффективен в отношении метастазов головного мозга.
Фармакокинетика
Проводилось изучение фармакокинетики пертузумаба только после его внутривенного введения. При этом использовались различные дозировки у больных с разными видами новообразования. Результаты показали, что фармакокинетических различий между начальными и последними стадиями рака груди нет.
Всасывание
Препарат вводится внутривенно. Изучение иных способов применения не проводилось.
Распределение
Пертузумаб распределяется в плазме и внеклеточной жидкости.
Метаболизм
Отдельного изучения особенностей метаболизма пертузумаба не проводилось. Предполагается, что как и все моноклональные антитела, он подвергается катаболическим процессам — окислению или распаду до более простых веществ.
Выведение
Период полувыведения 17,2-18,0 суток. Клиренс 0.235 л/сут.
Особые случаи
Не обнаружено изменения фармакокинетики пертузумаба в зависимости от половой принадлежности и этноса.
Наблюдались незначительные изменения клиренса пертузумаба, в зависимости от истинной массы тела (вес тела без учета жировой ткани) и уровня сывороточного альбумина. Но коррекции дозировки при изменении данных показателей не требовалось.
Фармакокинетические особенности пертузумаба у пожилых не исследовались. Но данные популяционных наблюдений свидетельствуют о том, что существенных различий нет.
Отдельных исследований, которые бы изучали особенности фармакокинетики пертузумаба у пациентов с почечной недостаточностью, не проводилось. Есть популяционные данные о том, что почечная недостаточность, в том числе тяжелой степени, не влияет на фармакокинетику препарата. Тем не менее, пока их нельзя назвать убедительными. Исследования при печеночной недостаточности не проводились.
Показания к применению
Пертузумаб применяют для лечения HER-2 позитивного РМЖ. Предварительно требуется проведение валидированных методов исследования на уровень экспрессии данного рецептора. К таким методам относят иммуногистохимический анализ (ИГХ) и гибридизацию in situ, в частности флуоресцентную гибридизацию (FISH). Критерием назначения таргетной терапии является 3 балла по ИГХ или амплификация гена по данным FISH.
Комбинация трастузумаба, пертузумаба и доцетаксела назначается в следующих случаях:
- Лечение РМЖ с отдаленными метастазами.
- Местно рецидивирующие опухоли РМЖ.
- Неоперабельный рак груди.
Условием назначение данной схемы является отсутствие в анамнезе ранее проводимого таргетного лечения и химиотерапии.
Комбинация пертузумаба, трастузумаба и цитостатиков (не таксанов) назначается при лечении РМЖ без отдаленных метастазов в следующих случаях:
- Предоперационная терапия раннего местно распространенного HER2+ РМЖ.
- Послеоперационное лечение раннего HER2+ РМЖ, когда опухоль превышает в размерах 2 см или уже дала регионарные метастазы.
Режим дозирования
Пертузумаб должен применяться как в условиях стационара, так и амбулаторно. Вводится он исключительно внутривенно капельно. Струйное или болюсное введение категорически запрещено.
Для приготовления готового препарата используется изотонический раствор NaCl. Применение для растворения декстрозы не рекомендуется, поскольку это приводит к химической и физической нестабильности.
Препарат разводят в асептических условиях. Учитывая то, что в его составе отсутствуют антимикробные консерванты, необходимо тщательно соблюдать условия стерильности. После разведения отбирают 14 мл приготовленного концентрированного раствора и вводят его в инфузионный пакет с изотоническим раствором NaCl (его объем должен составлять 250 мл). Допускается использование инфузионных пакетов на основе поливинилхлорида, полиэтилена или полиолефина.
Для равномерного перемешивания инфузионный пакет осторожно переворачивают несколько раз. После этого проверяют полученный раствор на предмет образования примесей или изменения цвета. Готовый раствор необходимо использовать немедленно. В крайних случаях допускается его хранение в течение суток в условиях холодильника. При этом необходимо удостовериться, что приготовление раствора было осуществлено по всем правилам асептики с соблюдением стерильности. Ответственность за качество раствора лежит на специалисте, который его приготовил.
Также пертузумаб нельзя смешивать с другими лекарственными препаратами. При комплексном применении необходимо последовательное введение лекарственных средств.
Во время первого введения дается нагрузочная доза, которая составляет 840 мг пертузумаба. Продолжительность инфузии должна составлять час. Далее препарат вводится каждые три недели в поддерживающей дозировке. Если последующее введение переносится хорошо, время инфузии можно сокращать. Максимально короткое время — 30 минут. После окончания процедуры пациентка остается под наблюдением в течение 30-60 минут.
Особенности применение в комплексной терапии
Трастузумаб
Таргетные препараты применяются последовательно. Последовательность может быть любая.
При первичном введении трастузумаба дается нагрузочная доза, которая составляет 8 мг/кг. Введение осуществляется в виде внутрикапельной инфузии в течение полутора часов. Поддерживающая доза составляет 6 мг/кг и применяется раз в три недели посредством 30-90-минутной капельницы. Время определяется переносимостью препарата у конкретной пациентки.
Вторым вариантом применения трастузумаба является введение фиксированной дозы, которая составляет 600 мг, независимот от массы тела пациентки. Режим введения такой же — раз в три недели в виде внутрикапельных 30-90 минутных инфузий. Нагрузочной дозы не требуется.
Лечение таксанами (доцетаксел)
Таксаны вводятся после таргетных препаратов. Дозировка при первом введении составляет 75 мг/м2. После этого инфузии проводят с интервалом 3 недели. Если все хорошо, дозировку увеличивают до 100 мг/м2 (если схема лечения не подразумевает применения карбоплатина).
Особенности терапии РМЖ 4 стадии
применяется таргетная терапия трастузумабом и пертузумабом совместно с доцетакселом. При этом доцетаксел используется в первых 6 циклах терапии, если нет признаков прогрессирования опухоли или явлений непереносимости. Необходимость его дальнейшего применения определяется врачом. Если доцетаксел отменяют, лечение продолжают только таргетными препаратами.
Особенности применения пертузумаба с паклитакселом
При комбинированном применении паклитаксела и пертузумаба, дозировка первого препарата должна составлять 80 мг/м2. Вводится он внутривенно инфузионно еженедельно.
Особенности адъювантной таргетной терапии пертузумабом и трастузумабом
Пациенты, которые получили комбинированное лечение на дооперационном этапе, могут продолжать принимать таргетную терапию в течение года после операции. Условием отмены лечения является потеря эффективности, о чем свидетельствует прогрессирование опухоли, или развитие тяжелых осложнений.
Если лечение проводилось в рамках послеоперационной терапии, ее также проводят в течение года (максимум 18 циклов), либо до прекращения эффекта или развития тяжелых осложнений.
Пропуск в применении препаратов
Если время между инфузиями составляет менее 6 недель, необходимо как можно скорее ввести препараты в поддерживающих дозировках.
Если прошло более 6 недель, терапию начинают заново с введения нагрузочных доз — 840 мг пертузумаба в виде часовой капельницы и 8 мг/кг трастузумаба в виде полуторачасовой капельницы. Затем лечение продолжают по поддерживающей схеме.
Коррекция дозы
Снижать дозировку таргетных препаратов не рекомендуется. При развитии токсических осложнений, лечение прекращают и возобновляют после нормализации состояния пациента. Если возникла необходимость в отмене трастузумаба, отменяют и пертузумаб.
Если на фоне химиотерапии развилось угнетение костного мозга, лечение продолжают, но необходимо контролировать развитие осложнений, которые связаны с миелосупрессией и нейтропенией в частности (инфекционные осложнения).
При развитии инфузионных реакций, уменьшают скорость введения препарата или на время прекращают процедуру.
При развитии анафилаксии, лечение немедленно прекращают и поднимают вопрос о его отмене.
Передозировка
Не проводилось изучения максимальной переносимой дозы и действия в дозировках, превышающих 25 мг/кг. В случаях подозрения на передозировки, необходимо установить контроль за состоянием пациента и, при необходимости, назначать симптоматическую терапию.
Побочные действия
Поскольку пертузумаб используется только в комбинации с другими препаратами, сложно установить влияние каждого отдельного препарата на развитие того или иного осложнения. Тем не менее, таковые имели место быть.
Наиболее частые осложнения, которые развивались более чем у 30% больных:
- Диарея.
- Выпадение волос.
- Тошнота.
- Упадок сил.
- Рвота.
- Снижение количества лейкоцитов.
- Тяжелая нейтропения с повышением температуры наблюдалась у 10% пациенток. Были даже зафиксированы летальные случаи.
Очень частые осложнения, которые встречались более чем в 1/10 случаев:
- Анемии.
- Инфузионные реакции.
- Нарушение аппетита, искажение вкусового восприятия.
- Бессонница.
- Головная боль, головокружение.
- Парестезии и периферические нейропатии.
- Слезоточивость.
- Кровотечения (в основном носовые).
- Кашель.
- Одышка.
- Стоматиты.
- Запоры.
- Сыпь.
- Кожный зуд.
- Поражение ногтей.
- Вагиниты.
- Риниты.
- Отеки.
- Боли различной локализации, в том числе мышцах и суставах.
Частые осложнения, которые развивались менее чем в 1/10 случаев и более чем в 1/100 случаев:
- Реакции гиперчувствительности.
- Нарушение функции левого желудочка.
- Паронихии.
- Инфекции ВДП (верхних дыхательных путей).
- Озноб.
Нечастые осложнения, которые развивались менее чем в 1/100 и более чем 1/1000 случаев:
- Застойная сердечная недостаточность.
- Развитие плеврального выпота.
- Развитие интерстициальной болезни легких.
Редкие осложнения, которые развивались менее чем в 1/1000 случаев:
- Анафилактический шок.
- Синдром высвобождения цитокинов.
- Синдром лизиса опухоли.
Противопоказания к применению
- Непереносимость схемы лечения.
- Необходимость отмены трастузумаба.
- ФВЛЖ ниже 50% (фракция выброса левого желудочка).
- Наличие в анамнезе застойной сердечной недостаточности.
- Артериальная гипертензия, которая не поддается контролю рекомендованными схемами лечения.
- Восстановление после инфаркта миокарда.
- Аритмии, требующие медикаментозной коррекции во время прима пертузумаба.
- Печеночная недостаточность.
- Беременность и кормление грудью.
- Возраст до совершеннолетия.
Лечение антрациклинами в кумулятивной дозировке превышающей 360 мг/м2.
Использование во время беременности и кормления грудью
Запрещено применение пертузумаба у беременных пациенток, поскольку есть риск развития порока почек, маловодия и даже гибели плода (данные получены во время исследований, проводимых на животных). Если необходимо лечение кормящей матери, рекомендуется отказаться от грудного вскармливания.
Также женщины, которые принимают данный препарат, должны использовать надежную контрацепцию на весь период лечения и в течение 6 месяцев после него.
Влияние препарата на фертильность человека не изучалось, но по данным исследований на животных, влияния на репродуктивную систему не наблюдалось.
Особые указания
Препарат применяется только после лабораторного подтверждения гиперэкспрессии HER-2.
В медицинских документах больного необходимо указывать торговое наименование препарата и его серийный номер.
Инфузия должна осуществляться при наличии доступа к набору оказания экстренной помощи и врача, имеющего опыт химиотерапевтического лечения.
Необходима осторожность при применении пертузумаба у пациентов с нарушением ФВЛЖ. До начала терапии им проводят исследование функции ФВЛЖ, а затем ее регулярный мониторинг. При ухудшении состояния, лечение отменяют до стабилизации.
Инфузионные реакции
В эту группу реакций было отнесено повышение температуры тела, озноб, упадок сил, рвота, головная боль. При развитии таких реакций, необходимо уменьшить скорость введения препарата и даже прервать его, если потребуется. Наблюдение за пациенткой устанавливается до устранения симптомов. При хорошей переносимости препаратов, пациентка должна находиться под наблюдением медперсонала на протяжении всей инфузии и в течение часа (в случае первого введения препарата) или получаса (при повторных кусах).
При развитии тяжелых инфузионных реакций рассматривается вопрос об отмене данного вида противоопухолевого лечения.
Реакции гиперчувствительности и анафилаксии
Наблюдались случаи летального исхода после анафилактической реакции на пертузумаб. В этой связи препарат вводится только при доступности аптечки экстренной помощи. При развитии анафилаксии, помощь необходимо начать оказывать немедленно. Дальнейшее лечение пертузумабом противопоказано.
Фебрильные нейтропении
Фебрильная нейтропения может развиться у пациентов, принимающих таргетную терапию совместно с доцетакселом. Наиболее высокие риски в течение первых 3 курсов. Чаще всего данное осложнение развивалось у больных на фоне диареи и мукозита. В этой связи рекомендуется симптоматическое лечение данных явлений.
Сроки годности и условия хранения
Пертузумаб должен храниться в условиях холодильника. Срок хранения — 2 года с момента изготовления. Утилизация неиспользованного препарата должна осуществляться согласно региональным нормативным актам. По мере возможности, пертузумаб не должен попадать в окружающую среду. Запрещается его утилизация посредством выливания в канализацию.
Фармакологическое действие
Противоопухолевое средство. Пертузумаб представляет собой рекомбинантные гуманизированные моноклональные антитела, которые избирательно взаимодействуют с отвечающим за димеризацию внеклеточным субдоменом II HER2 (рецептора эпидермального фактора роста человека 2 типа). Связывание пертузумаба с субдоменом II блокирует процесс лиганд-зависимой гетеродимеризации HER2 с другими белками семейства HER, включая EGFR (рецептор эпидермального фактора роста человека), HER3 (рецептора эпидермального фактора роста человека 3 типа) и HER4 (рецептора эпидермального фактора роста человека 4 типа). Таким образом, пертузумаб ингибирует лиганд-инициированную передачу внутриклеточных сигналов по двум основным сигнальным путям: путь митоген-активированной протеинкиназы (MAP) и путь фосфоинозитид-3-киназы (PI3K). Угнетение данных сигнальных путей способно привести к остановке роста клеток и апоптозу, соответственно. Кроме того, пертузумаб способствует активации антитело-зависимой клеточной цитотоксичности (АЗКЦ).
Молекулярная масса пертузумаба составляет около 148 кДа, и ожидается, что, как и другие моноклональные антитела, пертузумаб практически не проникает через ГЭБ.
Пертузумаб в виде моноагента ингибирует пролиферацию клеток опухоли человека. Показано усиление противоопухолевой активности пертузумаба на моделях ксенотрансплантатов с гиперэкспрессией HER2 при его применении в комбинации с трастузумабом.
Фармакокинетика
После в/в введения Vd в центральной камере составляет 3.07 л и приблизительно равен объему плазмы. Значения Vd в равновесном состоянии свидетельствуют о том, что распределение происходит только в плазме и внеклеточной жидкости.
Метаболизм пертузумаба не изучался. Как и другие антитела, пертузумаб преимущественно подвергается катаболизму.
T1/2 приблизительно равен 17.2 сут. Клиренс пертузумаба составляет приблизительно 0.239 л/сут и не зависел от дозы и показания.
Показания активного вещества
ПЕРТУЗУМАБ
Метастатический или местно-рецидивирующий, неоперабельный рак молочной железы с опухолевой гиперэкспрессией HER2: в комбинации с трастузумабом и доцетакселом при отсутствии ранее проводимого лечения или при прогрессировании заболевания после проведения адъювантной терапии.
Режим дозирования
До начала лечения пертузумабом необходимо провести тестирование на опухолевую экспрессию HER2. Обязательным критерием является 3+ балла по результатам иммуногистохимического анализа и/или степень амплификации ≥2.0 по результатам гибридизации in situ (ISH). Следует использовать точные и валидированные методы тестирования.
Вводят только в/в капельно.
Длительность инфузии при введении первой дозы составляет 60 мин. Если первая инфузия переносится хорошо, последующие можно проводить на протяжении 30-60 мин.
Применяют в комбинации с трастузумабом и доцетакселом.
Нагрузочная доза пертузумаба — 840 мг в виде в/в капельной инфузии в течение 60 мин. Далее через 3 недели и каждые 3 недели пертузумаб вводят в поддерживающей дозе 420 мг в виде в/в капельной инфузии в течение 30-60 мин.
При появлении признаков прогрессирования заболевания или неприемлемой токсичности лечение пертузумабом следует прекратить.
Снижение дозы пертузумаба не рекомендуется.
Пертузумаб следует отменить в случае, если отменено лечение трастузумабом. При отмене доцетаксела лечение пертузумабом и трастузумабом можно продолжать до прогрессирования заболевания или развития неприемлемой токсичности. Снижение дозы трастузумаба не рекомендуется.
Побочное действие
Со стороны системы кроветворения: очень часто — нейтропения, анемия, лейкопения, фебрильная нейтропения (в т.ч. с летальным исходом).
Со стороны иммунной системы: часто — гиперчувствительность.
Со стороны нервной системы: очень часто — периферическая невропатия, головная боль, головокружение, бессонница.
Со стороны органа зрения: очень часто — повышенное слезоотделение.
Со стороны сердечно-сосудистой системы: часто — нарушение функции левого желудочка, в т.ч. застойная сердечная недостаточность.
Со стороны дыхательной системы: очень часто — одышка; часто — плевральный выпот.
Со стороны пищеварительной системы: очень часто — снижение аппетита, извращение вкуса, диарея, тошнота, рвота, запор, стоматит.
Со стороны кожи и подкожных тканей: очень часто — алопеция, сыпь, патология ногтей, зуд, сухость кожи; часто — паронихий.
Со стороны костно-мышечной системы: очень часто — миалгия, артралгия.
Общие реакции: очень часто — повышенная утомляемость, астения, периферические отеки, воспаление слизистых оболочек различной локализации, повышение температуры тела, присоединение вторичных инфекций (инфекции верхних дыхательных путей, назофарингит).
Противопоказания к применению
Значения фракции выброса левого желудочка сердца (ФВЛЖ) до лечения ≤50%; застойная сердечная недостаточность в анамнезе; неконтролируемая артериальная гипертензия; недавно перенесенный инфаркт миокарда; серьезные нарушения сердечного ритма, требующие лекарственной терапии на момент необходимости применения пертузумаба, за исключением фибрилляции предсердий и пароксизмальной наджелудочковой тахикардии; предшествующее лечение антрациклинами с кумулятивной дозой доксорубицина или эквивалентного препарата >360 мг/м2; нарушения функции печени; беременность, период лактации (грудного вскармливания); возраст до 18 лет; повышенная чувствительность к пертузумабу.
Применение при беременности и кормлении грудью
Применение при беременности и в период лактации (грудного вскармливания) противопоказано.
Женщины, обладающие репродуктивным потенциалом, и женщины детородного возраста, являющиеся половыми партнерами пациентов, получающих пертузумаб, на фоне применения пертузумаба и в течение 6 месяцев после введения последней дозы, должны использовать эффективные методы контрацепции.
Применение у детей
Препарат противопоказан для применения у детей и подростков в возрасте до 18 лет
Особые указания
Требуется осторожность при снижении ФВЛЖ до уровня <50% на фоне предшествующей адъювантной терапии трастузумабом; предшествующем лечении антрациклинами или предшествующей лучевой терапии на область грудной клетки; состояниях, которые способны нарушать функцию левого желудочка; при нарушениях функции почек.
ФВЛЖ следует оценить перед применением пертузумаба и регулярно (например, каждые 3 месяца) определять на фоне лечения для того, чтобы убедиться, что ФВЛЖ находится в пределах нормальных значений, установленных в данном учреждении. Если ФВЛЖ составляет менее 40% или 40-45% при снижении на ≥10% от исходного уровня до лечения, применение пертузумаба и трастузумаба следует приостановить. Если после повторной оценки, проведенной в период приблизительно 3 недель, ФВЛЖ не улучшится или произойдет ее дальнейшее снижение, следует рассмотреть вопрос об отмене пертузумаба и трастузумаба, если только не будет решено, что преимущества их применения для конкретного пациента превосходят риск.
При введении пертузумаба следует тщательно наблюдать за пациентом на протяжении первой инфузии и в течение 60 мин после ее окончания, а также на протяжении последующих инфузий и в течение 30 мин после их окончания. При развитии клинически значимой реакции на инфузию следует замедлить скорость инфузии или прервать ее и провести соответствующие лечебные мероприятия. Тщательное наблюдение за пациентом и оценка его состояния рекомендуются до полного разрешения симптомов. У пациентов с тяжелыми инфузионными реакциями следует оценить необходимость полной отмены пертузумаба, с учетом степени тяжести наблюдавшейся реакции и характера ответа на лечение, назначенного в связи с нежелательной реакцией.
Проанализирован клинический случай длительного эффективного применения комбинации «пертузумаб + трастузумаб + доцетаксел» у пациентки c HER2-положительным метастатическим раком молочной железы (РМЖ) (клиническое исследование WO20698 CLEOPATRA). На фоне указанной терапии наблюдался регресс метастазов в печени на 62%. Продолжительность терапии составила 79 месяцев без признаков прогрессирования и с хорошим качеством жизни. Выживаемость без прогрессирования увеличилась на 6,1 месяца (относительный риск (ОР) 0,62; 95%-ный доверительный интервал (ДИ) 0,51–0,75; p < 0,001). Достигнут рекордный выигрыш в общей выживаемости – 15,7 месяца (ОР 0,68; 95% ДИ 0,56–0,84; р = 0,0002). Режим «пертузумаб + трастузумаб + доцетаксел» рекомендован для первой линии терапии HER2-положительного метастатического или местно-распространенного неоперабельного РМЖ.
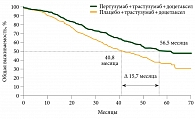
Рис. 1. Медиана общей выживаемости (при медиане наблюдения 50 месяцев)
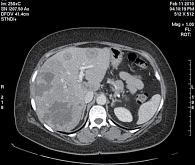
Рис. 2. Множественные метастазы в печени (компьютерная томография, февраль 2010 г.)
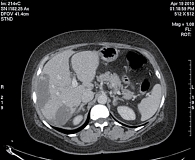
Рис. 3. Уменьшение размеров метастазов в печени (компьютерная томография, апрель 2010 г., через девять недель после начала терапии)
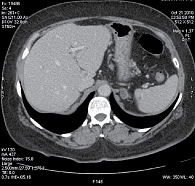
Рис. 4. Максимальное уменьшение размеров метастазов в печени (компьютерная томография, октябрь 2010 г., через 36 недель после начала терапии)
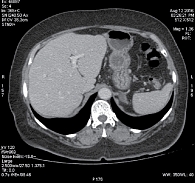
Рис. 5. Эффект терапии сохраняется (компьютерная томография, август 2016 г., через 338 недель после начала терапии)
Введение
В течение последних десятилетий терапия рака молочной железы (РМЖ) претерпела существенные изменения. Определение уровня экспрессии в опухоли рецепторов эстрогенов, рецепторов прогестерона и рецептора HER2 стало рутинной практикой во всех российских онкологических центрах. Гиперэкспрессия HER2 в опухоли выявляется у 20–25% больных РМЖ. Планирование противоопухолевого лечения начинается с определения подтипа РМЖ.
До начала эры таргетной терапии больные HER2-положительным метастатическим РМЖ составляли группу крайне неблагоприятного прогноза. Появление сначала таргетного препарата трастузумаба, затем лапатиниба, а главное – возможность использования этих препаратов в рутинной практике коренным образом изменили судьбу больных HER2-положительным РМЖ [1–3]. Добавление к химиотерапии первой линии трастузумаба позволило значительно увеличить выживаемость без прогрессирования и общую выживаемость при метастатическом HER2-положительном РМЖ [4]. Теперь пациентки с метастатическим РМЖ могут успешно получать одну линию терапии в течение нескольких лет.
К сожалению, часть больных не отвечает на терапию трастузумабом или перестает отвечать на нее спустя время после начала терапии. Примерно у 15% больных HER2-положительным РМЖ отмечается первичная или приобретенная резистентность к трастузумабу [5]. Научный поиск в этой области привел к разработке еще одного анти-HER2-препарата – пертузумаба.
Пертузумаб является гуманизированным моноклональным антителом, связывается с внеклеточным доменом II рецептора HER2 опухоли и препятствует димеризации (образованию пар) рецепторов. Пертузумаб и трастузумаб имеют разные точки приложения на рецепторе HER2.
Семейство рецепторов эпидермального фактора роста хорошо изучено. В него входят четыре трансмембранных тирозинкиназных рецептора: EGFR (erB1), HER2 (erB2), HER3 (erB3) и HER4 (erB4). HER2 отличается от других рецепторов семейства тем, что для его активации не требуется соединения с лигандом. Во внеклеточном домене рецептора HER2 различают четыре части с различными функциями. Пертузумаб блокирует субдомен II, который необходим для димеризации с другими рецепторами семейства erB, а трастузумаб блокирует субдомен IV. Все рецепторы эпидермального фактора роста активны только в виде димеров, причем могут образовываться не только гомодимеры (например, HER2/HER2), но и более активные гетеродимеры. Наиболее активным гетеродимером является HER2/HER3. Считается, что именно образование таких пар рецепторов способствует развитию резистентности к трастузумабу.
Исследования трастузумаба и пертузумаба
В исследовании второй фазы монотерапия пертузумабом при метастатическом РМЖ оказалась эффективной после прогрессирования на фоне трастузумаба [6]. Понимание механизма действия пертузумаба позволяет предположить, что пертузумаб и трастузумаб должны использоваться одновременно для блокирования различных субдоменов рецептора HER2 и прерывания нескольких сигнальных путей. В исследовании второй фазы больные метастатическим РМЖ после прогрессирования на фоне трастузумаба получали комбинацию пертузумаба и трастузумаба. Новая комбинация продемонстрировала высокую эффективность и благоприятный профиль токсичности [7].
Эффективность комбинации пертузумаба и трастузумаба изучали в международном двойном слепом плацебоконтролируемом исследовании III фазы WO20698 CLEOPATRA [8]. Эффективность терапии первой линии HER2-положительного метастатического РМЖ в режиме «пертузумаб + трастузумаб + доцетаксел» сравнивали с таковой комбинации «трастузумаб + доцетаксел». В исследовании участвовали 808 пациенток с HER2-положительным метастатическим РМЖ, ранее не получавших лечения по поводу метастатической болезни. Первичной целью исследования стала выживаемость без прогрессирования по независимой оценке экспертов, дополнительными целями – общая выживаемость и профиль безопасности. Средний возраст больных составил 54 года (27–89 лет). У 48% пациенток опухоль была эстроген- и/или прогестерон-положительной. Неоадъювантную или адъювантную терапию ранее получили 47% больных. Следует отметить, что лишь 10,5% пациенток ранее получили адъювантные режимы, содержавшие трастузумаб. С того момента прошло более 12 месяцев. У 78% больных имели место висцеральные метастазы.
Пертузумаб назначали в нагрузочной дозе 840 мг, затем по 420 мг один раз в три недели, трастузумаб – в стандартном режиме: нагрузочная доза 8 мг/кг, затем по 6 мг/кг один раз в три недели. Доцетаксел в дозе 75 мг/м2 вводили также один раз в три недели. Была предусмотрена эскалация дозы доцетаксела до 100 мг/м2 при отсутствии выраженной гематологической токсичности. После минимум шести (или более до достижения максимального ответа) циклов доцетаксела в отсутствие прогрессирования пациентки продолжали получать только таргетную терапию в режиме «пертузумаб + трастузумаб» или «плацебо + трастузумаб». Уже первый промежуточный анализ при медиане наблюдения 19,3 месяца продемонстрировал высокую эффективность новой комбинации. Объективный ответ (полный + частичный) был достигнут у 80,2% больных в группе двух анти-HER2-препаратов и у 69,3% больных группы «плацебо + трастузумаб» (p = 0,001). По оценке независимых экспертов, медиана выживаемости без прогрессирования в группе больных, получавших комбинацию «пертузумаб + трастузумаб + доцетаксел», достигла 18,5 месяца. В группе трастузумаба и доцетаксела аналогичный показатель составил 12,4 месяца (относительный риск (ОР) 0,62; 95%-ный доверительный интервал (ДИ) 0,51–0,75; p < 0,001). Таким образом, первичная цель исследования была достигнута. В подгруппе больных, которые ранее не получали трастузумаб, различие в показателях медианы выживаемости без прогрессирования было еще значительнее – 21,6 и 12,6 месяца соответственно (ОР 0,6; 95% ДИ 0,43–0,83).
Второй промежуточный анализ был проведен при медиане наблюдения 29,7 месяца в основной группе и 30,1 месяца – в контрольной [9]. Второй промежуточный анализ продемонстрировал впечатляющее преимущество нового режима. Отношение рисков смерти от прогрессирования РМЖ составило 0,66 (р = 0,0008). В связи с этим был проведен кроссовер и больных группы плацебо перевели на более эффективную терапию комбинацией пертузумаба и трастузумаба.
В 2014 г. был представлен финальный анализ данных об общей выживаемости при медиане наблюдения 50 месяцев [10]. Медиана общей выживаемости в группе пертузумаба, трастузумаба и доцетаксела составила 56,5 месяца, в группе плацебо, трастузумаба и доцетаксела – 40,8 месяца (ОР 0,68; 95% ДИ 0,56–0,84; p = 0,0002) (рис. 1). На основании данных исследования CLEOPATRA комбинация «трастузумаб + пертузумаб + доцетаксел» была рекомендована в качестве первой линии терапии метастатического HER2-положительного РМЖ. Наиболее частыми (частота свыше 25% или разница между группами, превышающая 5%) нежелательными явлениями, зарегистрированными в группе пертузумаба, были диарея, сыпь, воспаление слизистых оболочек, головная боль, инфекции верхних дыхательных путей, зуд, фебрильная нейтропения, сухость кожи, мышечные спазмы.
Был проведен подгрупповой анализ в зависимости от возраста пациенток (< 65 лет и > 65 лет) [11]. Интересно, что в подгруппе больных в возрасте 65 лет и старше, которых в исследовании было 15,7%, отмечалась очень высокая эффективность исследуемой комбинации. Более пожилые больные получили в среднем шесть циклов терапии доцетакселом против восьми циклов у больных моложе 65 лет. Объективный ответ у пациенток в возрасте 65 лет и старше зафиксирован в 84% случаев в группе пертузумаба и 75,9% случаев в группе плацебо. Объективный ответ у пациенток моложе 65 лет имел место в 79,5% случаев в группе пертузумаба и 68% случаев в группе плацебо. Медиана выживаемости без прогрессирования для больных в возрасте 65 лет и старше составила 21,6 месяца в группе пертузумаба и 10,4 месяца в группе плацебо (ОР 0,52; 95% ДИ 0,31–0,86). У пациенток моложе 65 лет аналогичный показатель достиг 17,2 месяца в группе пертузумаба и 12,5 месяца в группе плацебо (ОР 0,65; 95% ДИ 0,53–0,80). Интерпретировать полученные данные следует осторожно, поскольку подгруппа пожилых больных была относительно невелика, у них реже отмечались висцеральные метастазы, не так много больных ранее получали трастузумаб. Тем не менее для клинической практики важно, что проведение шести циклов с использованием комбинации «пертузумаб + трастузумаб + доцетаксел» оказалось высокоэффективным. Частота развития нежелательных явлений у пожилых пациенток была несколько выше, чаще развивались диарея, периферическая нейропатия. В то же время влияния на функцию сердечной мышцы не зарегистрировано.
Данные исследования CLEOPATRA показывают, что комбинация «пертузумаб + трастузумаб + доцетаксел» наиболее эффективна в первой линии терапии HER2-положительного метастатического РМЖ.
Клинический случай
Больная Б. 1952 г. р.
Диагноз: рак левой молочной железы T4bN1M0, состояние после комплексного лечения в 2008 г. Прогрессирование в 2009 г. Метастатическое поражение костей и печени (IV клиническая группа).
В марте 2008 г. выявлен рак левой молочной железы T4bN1M0. Гистологическое заключение (трепан-биопсия) – инфильтрирующий рак молочной железы. При иммуногистохимическом исследовании рецепторы эстрогенов – 7, рецепторы прогестерона – 4, HER2-«3+». Было проведено комплексное лечение: четыре цикла неоадъювантной химиотерапии по схеме FAC (фторурацил, доксорубицин, циклофосфамид), радикальная мастэктомия по Маддену слева, послеоперационная лучевая терапия (40–46 Гр), четыре цикла адъювантной химиотерапии по схеме FAC (суммарная доза доксорубицина – 326 мг/м2). Гистологическое исследование послеоперационного материала: инфильтрирующий протоковый рак, первая степень лечебного патоморфоза. Метастаз в одном из 16 лимфоузлов. Адъювантная химиотерапия завершена в ноябре 2008 г. В декабре 2008 г. пациентка начала получать тамоксифен 20 мг/сут.
Прогрессирование заболевания в декабре 2009 г. Выявлен метастаз в правом тазобедренном суставе. Проведена лучевая терапия 25 Гр (по 5 Гр) на эту область. В январе 2010 г. обнаружены метастазы в печени. В феврале 2010 г., по данным компьютерной томографии органов грудной клетки, брюшной полости и малого таза с внутривенным контрастированием, в печени (рис. 2) определены множественные метастатические очаги. Наибольшие из них в S7 – 7 × 6 см, S5/S8 – 6,5 × 4,2 см, S8 – 3,7 × 2,9 см, S3 – 3,1 × 2,2 см, S1 – 4 × 2,3 см. Кроме того, были обнаружены множественные метастазы в костях таза.
С февраля 2010 г. больная стала участницей исследования CLEOPATRA. Пациентке проведено шесть циклов химиотерапии в сочетании с таргетной терапией: пертузумаб назначали в нагрузочной дозе 840 мг, затем по 420 мг один раз в три недели, трастузумаб в нагрузочной дозе 8 мг/кг, затем по 6 мг/кг один раз в три недели, доцетаксел в дозе 75 мг/м2 один раз в три недели. Эскалация дозы доцетаксела не проводилась. При первой оценке через девять недель от начала терапии (после трех циклов) отмечался частичный ответ очагов в печени, очаги уменьшились на 31,6% по критериям RECIST (рис. 3). При оценке ответа на терапию через 18 недель от ее начала эффект продолжал нарастать и регресс измеряемых очагов печени составил 40,3% по сравнению с размерами очагов до лечения. После проведения шести циклов, с июня 2010 г., больная перестала получать доцетаксел и получала только таргетную терапию «пертузумаб + трастузумаб» один раз в три недели. Размеры метастатических очагов печени продолжали уменьшаться. Через 27 недель от начала терапии регресс составил 51%. При проведении компьютерной томографии через 36 недель от начала лечения регресс очагов составил 62,9%: в S7 – 2,9 × 1,6 см, S5/S8 – 5,2 × 2,9 см, S8 – 0,9 × 0,5 см. Очаги в S3 и S1 перестали определяться (рис. 4). В костях таза сохранялась стабилизация. При этом полностью отсутствовал болевой синдром.
Достигнутый в октябре 2010 г. частичный ответ сохраняется по настоящее время (рис. 5). Длительность первой линии терапии на данный момент составляет 79 месяцев. Состояние пациентки в течение терапии удовлетворительное (ECOG 1). Нежелательные явления были связаны только с терапией доцетакселом – нейтропения 3–4-й степени, тошнота 2-й степени, алопеция 2-й степени. С момента окончания терапии доцетакселом нежелательных явлений, связанных с применением трастузумаба или пертузумаба, не зарегистрировано. Гематологической и негематологической токсичности не зафиксировано. Масса тела пациентки остается стабильной. Больная ведет активный образ жизни. Показатели качества жизни, оцениваемые по опроснику FACT-B, стабильны в течение шести лет.
Обсуждение
Рассмотренный клинический случай иллюстрирует высокую эффективность комбинации «пертузумаб + трастузумаб + доцетаксел» в первой линии терапии метастатического HER2-положительного РМЖ. У пациентки имели место множественные висцеральные метастазы, распространенность метастатического процесса послужила показанием к проведению агрессивной химиотерапии в сочетании с таргетной терапией. У больной был определен суррогатный подтип опухоли – люминальный В (HER2-положительный). Стандартной терапией на момент включения пациентки в исследование считалась комбинация таксанов и трастузумаба. Добавление трастузумаба к доцетакселу в исследовании M77001 позволило добиться увеличения частоты общего ответа до 61% по сравнению с 34% в группе монотерапии доцетакселом (p = 0,0002) [4]. Статистически значимым стал выигрыш медианы времени до прогрессирования заболевания: 11,7 месяца в группе трастузумаба и доцетаксела по сравнению с 6,1 месяца в группе доцетаксела (p = 0,0001). Медиана общей выживаемости в группе трастузумаба и доцетаксела составила 31,2 месяца против 22,7 месяца в группе доцетаксела (p = 0,0325). Причем в случае прогрессирования процесса больным группы монотерапии доцетакселом назначали трастузумаб. Из 92 больных, получавших трастузумаб и доцетаксел, общий объективный эффект наблюдался у 62% больных с общей выживаемостью 31,2 месяца. Трехлетний рубеж пережили 30,4% пациенток.
Первичной целью исследования CLEOPATRA была выживаемость без прогрессирования по оценке независимых экспертов. Результаты исследования продемонстрировали cтатистически значимый выигрыш в выживаемости без прогрессирования. Медиана выживаемости без прогрессирования в группе пертузумаба была на 6,1 месяца больше, чем в группе плацебо, – 18,5 и 12,4 месяца соответственно (ОР 0,62; 95% ДИ 0,51–0,75; p < 0,001). Что касается рассмотренного клинического случая, выживаемость без прогрессирования или продолжительность первой линии терапии составила уже 79 месяцев, то есть метастатический РМЖ с висцеральными метастазами стал действительно хроническим заболеванием.
Возраст больной на момент начала терапии составлял 57 лет, у нее не было выявлено каких-либо противопоказаний к проведению химиотерапии. Пациентка относилась к группе больных моложе 65 лет. Частота объективного ответа при назначении пертузумаба у таких больных достигала 79,5%. Частота достижения объективного ответа у больных моложе 65 лет контрольной группы (трастузумаб и доцетаксел) также была достаточно высокой – 68%. Комбинация продемонстрировала высочайшую частоту объективного ответа. Он был получен у каждых четырех из пяти больных. В момент, когда пациентка получила шесть циклов комбинации «пертузумаб + трастузумаб + доцетаксел», регресс измеряемых метастатических очагов в печени по критериям RECIST составил 40,3%. Такую выраженную регрессию исследователи расценили как максимально возможную. При последующих оценках степень выраженности клинического ответа возрастала после того, как химиотерапия доцетакселом была завершена и больная продолжала получать только таргетную терапию. Максимальное уменьшение очагов было достигнуто через 36 недель от начала терапии и составило 62%.
Ряд режимов химиотерапии при метастатическом РМЖ позволяет добиться высокого уровня объективного ответа и увеличения выживаемости без прогрессирования. Но увеличение частоты объективного ответа и выживаемости без прогрессирования зачастую не приводит к увеличению общей выживаемости. В исследовании CLEOPATRA медиана общей выживаемости составила 56,5 месяца. Был получен уникальный рекордный выигрыш в медиане общей выживаемости – 15,7 месяца (p = 0,0002). Профиль токсичности режима «пертузумаб + трастузумаб + доцетаксел» удовлетворительный. Уникальность, несомненно, заключается в том, что после минимум шести циклов с доцетакселом больная переходит на терапию двумя таргетными препаратами, которые не вызывают тяжелой гематологической токсичности, тошноты, алопеции. Режим терапии позволяет больным длительно вести привычный образ жизни, качество жизни не снижается.
Данные исследования CLEOPATRA послужили основанием для регистрации комбинации пертузумаба, трастузумаба и доцетаксела в США, Европе и России в качестве режима первой линии терапии метастатического или местно-распространенного неоперабельного HER2-положительного РМЖ. В России комбинация из двух препаратов пертузумаба и трастузумаба зарегистрирована под названием Бейодайм.
Заключение
На фоне применения комбинации «пертузумаб + трастузумаб + доцетаксел» в исследовании CLEOPATRA были достигнуты рекордная выживаемость без прогрессирования и общая выживаемость. Продолжительность жизни пациентки с момента начала лечения составила 79 месяцев без признаков прогрессирования заболевания. Удовлетворительная переносимость, отсутствие серьезных нежелательных явлений, хорошее качество жизни позволяют проводить длительную непрерывную терапию.
Применение режима «пертузумаб + трастузумаб + доцетаксел» делает HER2-положительный метастатический РМЖ действительно хроническим заболеванием.
Инструкция по применению Перьета
- Состав
- Показания к применению
- Противопоказания к применению
- Рекомендации по применению
- Применение при беременности и кормлении грудью
- Фармакологическое действие
- Побочные действия
- Особые указания
- Передозировка
- Условия хранения
- Условия отпуска
Состав
Активное вещество: пертузумаб 420 мг;
Вспомогательные вещества: L-гистидин — 43.5 мг, уксусная кислота ледяная — 9.2 мг, сахароза — 575.1 мг, полисорбат 20 — 2.8 мг, вода д/и — до 14 мл.
Показания к применению Перьета
Метастатический или местно-рецидивирующий, неоперабельный рак молочной железы с опухолевой гиперэкспрессией HER2: в комбинации с трастузумабом и доцетакселом при отсутствии ранее проводимого лечения или при прогрессировании заболевания после проведения адъювантной терапии.
Противопоказания к применению Перьета
- повышенная чувствительность к пертузумабу и к другим компонентам препарата;
- значения фракции выброса левого желудочка сердца (ФВЛЖ) до лечения ≤50%;
- застойная сердечная недостаточность в анамнезе;
- неконтролируемая артериальная гипертензия;
- недавно перенесенный инфаркт миокарда;
- серьезные нарушения сердечного ритма, требующие лекарственной терапии на момент назначения препарата Перьета™, за исключением фибрилляции предсердий и пароксизмальной наджелудочковой тахикардии;
- предшествующее лечение антрациклинами с кумулятивной дозой доксорубицина или эквивалентного препарата >360 мг/м2;
- нарушения функции печени (эффективность и безопасность применения не изучались);
- беременность;
- период грудного вскармливания;
- детский и подростковый возраст до 18 лет (эффективность и безопасность применения не установлены).
С осторожностью: снижение ФВЛЖ до уровня <50% на фоне предшествующей адъювантной терапии трастузумабом; предшествующее лечение антрациклинами или предшествующая лучевая терапия на область грудной клетки; состояния, которые способны нарушать функцию левого желудочка; при нарушениях функции почек.
Рекомендации по применению
До начала лечения препаратом Перьета™ необходимо провести тестирование на опухолевую экспрессию HER2. Обязательным критерием является 3+ балла по результатам иммуногистохимического анализа и/или степень амплификации ≥2.0 по результатам гибридизации in situ (ISH). Следует использовать точные и валидированные методы тестирования.
Препарат Перьета™ вводят только в/в капельно. Вводить препарат в/в струйно или болюсно нельзя.
Длительность инфузии при введении первой дозы составляет 60 мин. Если первая инфузия переносится хорошо, последующие можно проводить на протяжении 30-60 мин.
Перьета™: нагрузочная доза — 840 мг в виде в/в капельной инфузии в течение 60 мин. Далее через 3 недели и каждые 3 недели препарат вводят в поддерживающей дозе 420 мг в виде в/в капельной инфузии в течение 30-60 мин.
Трастузумаб: при применении в комбинации с препаратом Перьета™ нагрузочная доза трастузумаба — 8 мг/кг массы тела в виде в/в капельной инфузии в течение 90 мин; поддерживающая доза — 6 мг/кг массы тела каждые 3 недели в виде в/в капельной инфузии в течение 30-90 мин. Поддерживающую дозу вводят через 3 недели после нагрузочной.
Доцетаксел: при применении в комбинации с препаратом Перьета™ рекомендуемая начальная доза доцетаксела составляет 75 мг/м2 в виде в/в инфузии, после этого препарат следует вводить в той же дозе каждые 3 недели. При хорошей переносимости в первом цикле доза доцетаксела может быть увеличена до 100 мг/м2 в последующих циклах.
При появлении признаков прогрессирования заболевания или неприемлемой токсичности лечение препаратом Перьета™ следует прекратить.
Если пропуск в плановом введении пертузумаба составил менее 6 недель, следует как можно быстрее ввести препарат в дозе 420 мг в виде 30-60 минутной внутривенной капельной инфузии, не ожидая следующего планового введения.
Если перерыв во введении пертузумаба составил 6 недель и более, следует ввести препарат в начальной дозе 840 мг в виде 60 минутной внутривенной капельной инфузии. Затем продолжить введение препарата в дозе 420 мг каждые 3 недели в виде 30-60 минутной внутривенной инфузии.
Коррекция доз
Снижение дозы препарата Перьета™ не рекомендуется.
Препарат Перьета™ следует отменить в случае, если отменено лечение трастузумабом. При отмене доцетаксела лечение препаратом Перьета™ и трастузумабом можно продолжать до прогрессирования заболевания или развития неприемлемой токсичности. Снижение дозы трастузумаба не рекомендуется.
Указания по модификации дозы доцетаксела представлены в инструкции по медицинскому применению доцетаксела.
Нарушение функции левого желудочка
Введение препарата Перьета™ и трастузумаба должно быть приостановлено как минимум на 3 недели в следующих случаях:
— снижение ФВЛЖ до уровня ниже 40%;
— значения ФВЛЖ 40-45% при снижении ФВЛЖ на >10% по отношению к значениям, наблюдавшимся до лечения.
Возобновить лечение препаратом Перьета™ и трастузумабом можно в том случае, если ФВЛЖ восстановится до уровня >45% или 40-45% при снижении на <10% по отношению к значениям, наблюдавшимся до лечения.
Если по данным повторной оценки через 3 недели ФВЛЖ не увеличится или произойдет ее дальнейшее снижение, лечение препаратом Перьета™ и трастузумабом следует отменить, если только польза от их применения в каждом конкретном случае не превосходит риск.
Инфузионные реакции
Следует уменьшить скорость инфузии или на время прекратить введение препарата при развитии инфузионной реакции. Инфузию следует прервать немедленно при развитии серьезной реакции гиперчувствительности.
Особые указания по дозированию
Коррекция дозы у пациентов пожилого и старческого возраста не требуется.
Эффективность и безопасность препарата Перьета™ у пациентов с нарушением функции почек не изучались.
Эффективность и безопасность препарата Перьета™ у пациентов с нарушением функции печени не изучались.
Эффективность и безопасность препарата Перьета™ у детей и подростков в возрасте до 18 лет не установлены.
Приготовление раствора для инфузий
Препарат Перьета™ несовместим с 5% раствором декстрозы. Разведение в таком растворе приводит к химической и физической нестабильности препарата Перьета™. Препарат Перьета™ следует разводить только в 0.9% растворе натрия хлорида. Препарат Перьета™ нельзя смешивать или разводить вместе с другими лекарственными препаратами.
Раствор препарата Перьета™ совместим с инфузионными пакетами, изготовленными из поливинилхлорида, полиэтилена и полиолефина.
Подготовка препарата к введению должна проводиться в асептических условиях. Препарат Перьета™ не содержит антимикробных консервантов. В связи с этим необходимо принять меры предосторожности для сохранения стерильности приготовленного раствора для инфузий.
Из флакона (флаконов) следует отобрать весь жидкий концентрат и ввести его в инфузионный пакет с 250 мл 0.9% раствора натрия хлорида. Концентрация готового раствора составляет приблизительно 3.36 мг/мл (840 мг/250 мл) для нагрузочной и 1.68 мг/мл (420 мг/250 мл) для поддерживающей дозы.
Затем инфузионный пакет необходимо осторожно перевернуть для перемешивания раствора, избегая пенообразования. Перед введением препарат следует проверить (визуально) на предмет отсутствия механических примесей и изменения окраски. Раствор для инфузий вводят тотчас после его приготовления.
В исключительных случаях приготовленный раствор может храниться не более 24 ч при температуре 2-8°С, если приготовление раствора для инфузий происходило в контролированных и валидированных асептических условиях. При этом за условия хранения (правила хранения и продолжительность) отвечает специалист, готовивший раствор.
Применение Перьета при беременности и кормлении грудью
Применение препарата при беременности и в период лактации (грудного вскармливания) противопоказано.
Фармакологическое действие
Противоопухолевый препарат. Пертузумаб представляет собой рекомбинантные гуманизированные моноклональные антитела, которые избирательно взаимодействуют с отвечающим за димеризацию внеклеточным субдоменом II HER2 (рецептора эпидермального фактора роста человека 2 типа). Связывание пертузумаба с субдоменом II блокирует процесс лиганд-зависимой гетеродимеризации HER2 с другими белками семейства HER, включая EGFR (рецептор эпидермального фактора роста человека), HER3 (рецептора эпидермального фактора роста человека 3 типа) и HER4 (рецептора эпидермального фактора роста человека 4 типа). Таким образом, пертузумаб ингибирует лиганд-инициированную передачу внутриклеточных сигналов по двум основным сигнальным путям: путь митоген-активированной протеинкиназы (MAP) и путь фосфоинозитид-3-киназы (PI3K). Угнетение данных сигнальных путей способно привести к остановке роста клеток и апоптозу, соответственно. Кроме того, пертузумаб способствует активации антитело-зависимой клеточной цитотоксичности (АЗКЦ).
Молекулярная масса пертузумаба составляет около 148 кДа, и ожидается, что, как и другие моноклональные антитела, пертузумаб практически не проникает через ГЭБ.
Пертузумаб в виде моноагента ингибирует пролиферацию клеток опухоли человека. Показано усиление противоопухолевой активности пертузумаба на моделях ксенотрансплантатов с гиперэкспрессией HER2 при его применении в комбинации с трастузумабом.
Иммуногенность
Приблизительно у 6.2% больных, получавших терапию трастузумабом в комбинации с доцетакселом, и у 2.8% больных, получавших трастузумаб в комбинации с доцетакселом и пертузумабом, были обнаружены антимоноклональные антитела (АТА). Однозначная связь образования антител к пертузумабу с развитием анафилактической реакции/реакции гиперчувствительности не была установлена ни у одного из пациентов.
Результаты анализа иммуногенности в значительной степени зависят от различных факторов, таких как чувствительность и специфичность анализа, методология проведения анализа, манипуляции с забранными образцами, время забора образцов, сопутствующие препараты и характер основного заболевания. Исходя из этих соображений, сравнение частоты обнаружения антител к пертузумабу и частоты обнаружения антител к другим биологическим препаратам может оказаться неинформативным.
Фармакокинетика
Изучалась фармакокинетика пертузумаба после в/в введения в различных дозах (от 2 до 25 мг/кг) у пациентов с различными видами опухоли.
Всасывание
Пертузумаб вводится в/в. Другие пути введения препарата не изучались.
Распределение
После в/в введения объем распределения в центральной камере (Vc) составляет 3.07 л и приблизительно равен объему плазмы. Значения Vc и Vd в равновесном состоянии свидетельствуют о том, что распределение происходит только в плазме и внеклеточной жидкости.
Метаболизм
Метаболизм пертузумаба не изучался. Как и другие антитела, пертузумаб преимущественно подвергается катаболизму.
Выведение
T1/2 приблизительно равен 17.2 сут. Клиренс пертузумаба составляет приблизительно 0.239 л/сут и не зависел от дозы и показания.
Фармакокинетика в особых клинических случаях
Фармакокинетические параметры не зависят от возраста, пола и этнической принадлежности (японская и другие этнические группы).
Начальная концентрация альбумина и величина истиной массы тела (величина, характеризующая массу тела за вычетом массы жировой ткани) оказывают незначительное влияние на клиренс пертузумаба, при этом необходимость коррекции дозы пертузумаба в зависимости от начальной концентрации альбумина или массы тела отсутствует.
Специальных исследований фармакокинетики пертузумаба у пациентов пожилого (≥65 лет) и старческого (≥75 лет) возраста не проводилось. По результатам популяционного анализа, возраст не оказывает влияния на фармакокинетические параметры пертузумаба.
Специальных исследований фармакокинетики пертузумаба у пациентов с почечной недостаточностью не проводилось. По результатам популяционного анализа, почечная недостаточность легкой (КК 60-90 мл/мин), средней (КК 30-60 мл/мин) и тяжелой степени (КК<30 мл/мин) не оказывает влияния на экспозицию пертузумаба. Однако данные для пациентов почечной недостаточностью средней и тяжелой степени ограничены.
Изучение фармакокинетики пертузумаба у пациентов с нарушением функции печени не проводилось.
Побочные действия Перьета
Со стороны системы кроветворения: очень часто — нейтропения, анемия, лейкопения, фебрильная нейтропения (в т.ч. с летальным исходом).
Со стороны иммунной системы: часто — гиперчувствительность.
Со стороны обмена веществ и питания: очень часто — снижение аппетита.
Нарушения психики: очень часто — бессонница.
Со стороны нервной системы: очень часто — периферическая невропатия, головная боль, извращение вкуса, головокружение.
Со стороны органа зрения: очень часто — повышенное слезоотделение.
Со стороны сердечно-сосудистой системы: часто — нарушение функции левого желудочка, в т.ч. застойная сердечная недостаточность.
Со стороны дыхательной системы: очень часто — одышка; часто — плевральный выпот.
Со стороны пищеварительной системы: очень часто — диарея, тошнота, рвота, запор, стоматит.
Со стороны кожи и подкожных тканей: очень часто — алопеция, сыпь, патология ногтей, зуд, сухость кожи; часто — паронихий.
Со стороны костно-мышечной системы: очень часто — миалгия, артралгия.
Общие реакции: очень часто — повышенная утомляемость, астения, периферические отеки, воспаление слизистых оболочек различной локализации, повышение температуры тела, присоединение вторичных инфекций (инфекции верхних дыхательных путей, назофарингит).
Особые указания
Лечение препаратом Перьета™ следует проводить только под наблюдением онколога. На фоне применения препаратов, блокирующих активность HER2, включая препарат Перьета™, наблюдалось снижение ФВЛЖ. Применение препарата Перьета™ в комбинации с трастузумабом и доцетакселом не сопровождалось повышением частоты симптоматической систолической дисфункции левого желудочка или снижения ФВЛЖ, по сравнению с применением только трастузумаба и доцетаксела. Однако у пациентов, ранее получавших антрациклины или лучевую терапию на область грудной клетки, риск снижения ФВЛЖ может быть выше.
ФВЛЖ следует оценить перед применением препарата Перьета™ и регулярно (например, каждые 3 месяца) определять на фоне лечения для того, чтобы убедиться, что ФВЛЖ находится в пределах нормальных значений, установленных в данном учреждении. Если ФВЛЖ составляет менее 40% или 40-45% при снижении на ≥10% от исходного уровня до лечения, применение препарата Перьета™ и трастузумаба следует приостановить. Если после повторной оценки, проведенной в период приблизительно 3 недель, ФВЛЖ не улучшится или произойдет ее дальнейшее снижение, следует рассмотреть вопрос об отмене препарата Перьета™ и трастузумаба, если только не будет решено, что преимущества их применения для конкретного пациента превосходят риск.
При применении препарата Перьета™ возможно развитие инфузионных реакций и реакций гиперчувствительности. При введении препарата Перьета™ следует тщательно наблюдать за пациентом на протяжении первой инфузии и в течение 60 мин после ее окончания, а также на протяжении последующих инфузий и в течение 30 мин после их окончания. При развитии клинически значимой реакции на инфузию следует замедлить скорость инфузии или прервать ее и провести соответствующие лечебные мероприятия. Тщательное наблюдение за пациентом и оценка его состояния рекомендуются до полного разрешения симптомов. У пациентов с тяжелыми инфузионными реакциями следует оценить необходимость полной отмены препарата, с учетом степени тяжести наблюдавшейся реакции и характера ответа на лечение, назначенного в связи с нежелательной реакцией.
Уничтожение неиспользованного препарата или препарата с истекшим сроком годности проводится в соответствии с требованиями лечебного учреждения.
Влияние на способность к вождению автотранспорта и управлению механизмами
Влияние препарата на способность к управлению автотранспортом и работе с механизмами не изучалось. При развитии некоторых побочных реакций, в частности, головокружения, следует воздержаться от управления транспортными средствами и механизмами.
Передозировка
Максимальная переносимая доза препарата Перьета™ не установлена. Однократные дозы, превышающие 25 мг/кг (1727 мг), не изучались.
Лечение: в случае передозировки необходимо внимательно наблюдать за пациентами с целью обнаружения признаков или симптомов побочных реакций и назначения соответствующего симптоматического лечения.
Условия хранения
Хранить в недоступном для детей, защищенном от света месте при температуре от 2° до 8°C. Срок годности: 2 года.
Условия отпуска
Отпускается по рецепту



