Плеконарил
Pleconaril
Фармакологическое действие
Плеконарил — противовирусный препарат из класса ингибиторов вирусного капсида. Плеконарил связывается с гидрофобным карманом вирусного белка 1, основного белка, который составляет капсид (оболочку) пикорнавирусов. Это делает вирусный капсид жёстким и сжатым и предотвращает разрушение РНК. В результате вирус не может присоединиться к клетке-хозяину и вызвать инфекцию.
Показания
Для предотвращения обострений острой астмы и симптомов простуды у пациентов с астмой, подвергшихся воздействию пикорнавируса.
Способ применения и дозы
Перорально или интраназально.
Побочные действия
Головная боль от лёгкой до умеренной степени, диарея и тошнота.
Классификация
-
АТХ
J05AX06
-
Фармакологическая группа
Информация о действующем веществе Плеконарил предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Плеконарил, содержатся в инструкции производителя, прилагаемой к упаковке.
Острые респираторные вирусные инфекции (ОРВИ) в настоящее время являются, пожалуй, самыми распространенными и социально значимыми заболеваниями. Считается, что едва ли не каждый человек ежегодно переносит ОРВИ. Столь высокая заболеваемость ассоциируется со значительными экономическими потерями, прежде всего за счет большого числа нетрудоспособных пациентов. Другой проблемой является тот факт, что практически любой человек считает себя знатоком лечения ОРВИ, что в конечном итоге приводит к огромному числу ошибок и нежелательных явлений, сопровождающих терапию. До настоящего времени не существует каких-либо четких рекомендаций, касающихся фармакотерапии ОРВИ, и для лечения данного заболевания используются, как минимум, сотни препаратов из различных фармакологических групп. В связи с этим целью данной публикации явилась критическая оценка ряда лекарственных средств, применяемых для лечения ОРВИ с позиций доказательной медицины.
Заболевание вызывают различные респираторные вирусы, в первую очередь, это риновирусы, обуславливающие до 30–50% случаев во всех возрастных группах. Вирусы гриппа вызывают 5–15% случаев респираторных инфекций, коронаровирусы «забирают» до 15%, респираторно-синцитиальный вирус (РСВ), вирусы парагриппа, аденовирусы и энтеровирусы встречаются значительно реже (<5%). У 5% пациентов выявляется более двух респираторных вирусов, а в 20–30% случаев идентифицировать возбудителя не удается.
До настоящего времени клиническая практика располагает всего лишь двумя группами препаратов, активных в отношении гриппозной инфекции (блокаторы М2-каналов, ингибиторы нейроминидазы) и одним средством против РСВ. Препараты, активные в отношении риновирусов и коронаровирусов, находятся в стадии разработки или на этапе клинических исследований (плеконарил).
Из блокаторов М2-каналов наибольшее распространение получил римантадин, активный в отношении вируса гриппа А. Препарат позволяет предотвратить до 70% случаев гриппозной инфекции и до 25% случаев гриппоподобных заболеваний. С лечебной целью римантадин назначается не позднее 48 часов от появления первых симптомов заболевания у пациентов старше 14 лет по 100 мг по 2 раза в сутки; у лиц старше 65 лет по 100 мг в сутки. Рекомендуемая длительность терапии составляет 3–5 дней. Прием римантадина в ряде случаев сопровождается нежелательными явлениями: тошнота, снижение аппетита, раздражительность, нарушение концентрации внимания, бессонница.
Обеспокоенность вызывает развитие высокой резистентности к Римантадину, достигающей в некоторых странах (США, Канада) 90%. Однако в России по данным 2005 года резистентность к Римантадину составляла порядка 18%. В этой связи можно предполагать, что резистентность к блокаторам М2-каналов в нашей стране не достигает катастрофических значений, что связано в первую очередь с низким уровнем потребления противовирусных препаратов для лечения и профилактики ОРВИ. Напомним читателю, что в настоящее время наиболее часто используемым средством для лечения вирусных инфекций в России является Арбидол (индуктор эндогенного интерферона), «перспективы» использования которого будут рассмотрены нами ниже.
Новые противовирусные препараты— ингибиторы нейроминидазы (осельтамивир и занамивир) активны не только в отношении вируса гриппаА, но и B. Наибольшее распространение получил осельтамивир, доступный для перорального применения в форме капсул, обладающий высокой безопасностью терапии, что позволяет использовать его у детей с 1 года. Осельтамивир в терапевтических дозах (150 мг и 75 мг в сутки) способен сокращать частоту осложнений гриппа, продолжительность клинических симптомов и тяжесть течения заболевания. По некоторым данным, его применение сопровождается снижением частоты летальных исходов у пациентов с постгриппозной пневмонией. Профилактический прием осельтамивира в дозах 75 мг/сутки и 150 мг/сутки позволяет предотвратить до 61% и 73% случаев гриппа соответственно (действия на заболеваемость гриппоподобными инфекциями не зарегистрировано). Осельтамивир является одним из наиболее безопасных противовирусных препаратов, достаточно редко его прием сопровождает тошнота, рвота, редко головные боли, головокружение, слабость и бессонница, не требующие отмены терапии. Для лечения гриппа у пациентов старше 13 лет осельтамивир назначается по 75 мг два раза в сутки, у детей от 1 года до 12 лет доза зависит от массы тела (≤15 кг— 30 мг 2 раза в сутки; 16–23 кг— 45 мг 2 раза в сутки; 24–40 кг— 30 мг 2 раза в сутки; ≥40 кг— 75 мг 2 раза в сутки). Рекомендуемая продолжительность терапии составляет 5 дней. У пациентов с клиренсом креатинина менее 30 мл/мин доза снижается в два раза.
Другой представитель группы ингибиторов нейроминидазы— занамивир, обладает низкой биодоступностью, вследствие чего используется только в ингаляционной форме. Препарат позволяет сократить продолжительность симптомов заболевания и частоту осложнений гриппа; при профилактическом использовании занамивир способен предупредить развитие гриппа в 62% случаев. К числу нежелательных явлений, сопровождающих его прием, относят першение в горле, редко бронхоспазм, головные боли, головокружение. Занамивир рекомендуется для лечения гриппа у лиц старше 7 лет при сроке появления клинических симптомов не более 36 часов в дозе 10 мг 2 раза в сутки в течение 5 дней.
К сожалению, применение препаратов данной группы также характеризуется развитием высокой резистентности к ним вирусов гриппа. Если ранее (2001) частота резистентных штаммов вируса гриппа А к осельтамивиру не превышала 0,32% у взрослых и 4,1% у детей, то в сезонах 2007–2008 гг. эксперты подразделения ВОЗ (WHO Collaborating Center for Reference and Research on Influenza at CDC) предупреждают о развившейся резистентности к осельтамивиру и занамивиру до 64% в различных странах мира. Другой проблемой является экономический фактор— например, стоимость осельтавимивира составляет 1400–1600 рублей, в то время как терапия римантадином (30–70 рублей) признается наиболее рентабельной.
Рибавирин, активный в отношении РСВ-инфекции (тяжелая пневмония и бронхиолит у новорожденных и детей раннего возраста), применяется только в режиме небулайзерной терапии и только в случае положительного результата серологической диагностики, подтверждающей наличие РСВ. Рибавирин— высокотоксичный препарат, при его использовании отмечаются бронхоспазм, сыпь, раздражение глаз, причем не только у пациентов, но и у медперсонала; бессонница, раздражительность; возможно развитие лейкопении.
Упомянутый нами ранее плеконарил, активный против основного возбудителя ОРВИ— риновирусов, в настоящее время прошел этап клинических исследований, доказавший его эффективность (снижение длительности заболевания на 1 сутки), однако комитет по антивирусным препаратам Управления по контролю за пищевыми продуктами и лекарственными препаратами США (FDA) по ряду причин (нежелательные явления, высокая резистентность к препарату) отклонил санкцию на его применение в клинической практике.
Использование антибиотиков для лечения вирусной инфекции является грубой ошибкой, к сожалению, часто встречающейся в реальной практике. Единственным показанием к применению антибактериальной терапии является развитие бактериальных осложнений вирусной инфекции (острый средний отит, острый синусит, постгриппозная пневмония и пр.) и то только в четко определенных клинических ситуациях.
В настоящее время существуют данные плацебо-контролируемых исследований, доказавших эффективность интраназального применения интерферона для профилактики ОРВИ. При этом доказательств какой-либо действенности препарата для лечения респираторных инфекций не получено. Основным недостатком интраназальных интерферонов являются нежелательные реакции, в числе которых появление кровянистых выделений из носа, гриппоподобные симптомы, сонливость, аллергические реакции. Существует ряд лекарственных форм экзогенного интерферона в свечах, однако эффективность его не доказана в рамках контролируемых клинических испытаний.
Перспективным направлением профилактики ОРВИ является использование средств для активизации неспецифической резистентности организма. С этой целью в российской клинической практике широко используются индукторы эндогенных интерферонов— Тилорон, Арбидол, Циклоферон. К сожалению, их клиническое значение в лечении и профилактике респираторных вирусных инфекций до настоящего времени не определено ввиду непостоянства эффекта в плацебо-контролируемых исследованиях. По-видимому, их применение наиболее актуально у невакцинированных лиц в предэпидемический период, как дополнение к химиопрофилактике Римантадином, ингибиторами нейроминидазы (либо при их непереносимости) у пациентов с факторами риска развития осложнений (иммуносупрессии, сахарный диабет, сердечно-сосудистые и хронические легочные заболевания).
Для купирования лихорадки, головной боли и миалгии при ОРВИ широко применяются представители группы нестероидных противовоспалительных препаратов (НПВП), которые наряду с жаропонижающим действием обладают анальгетическим эффектом. Наиболее безопасным и рекомендуемым препаратом является парацетамол, реже (в случае выраженной головной боли или миалгии) может использоваться ибупрофен. Применение ацетилсалициловой кислоты (Аспирин) должно быть ограничено, а у пациентов младше 18 лет и вовсе исключено с целью минимизации риска развития синдрома Рея. Применение нимесулида в рамках лечения ОРВИ также не рекомендовано, а в педиатрической практике запрещено.
С целью устранения назальной блокады и ринореи применяются сосудосуживающие средства— деконгестанты. К местным деконгестантам относятся: нафазолин (Нафтизин), ксилометазолин (Галазолин), оксиметазолин (Називин). По продолжительности сосудосуживающего действия наиболее эффективным является оксиметазолин (до 12 часов), чуть короче эффект у ксилометазолина (8–10 часов), для нафазолина и других представителей данной группы (тетризолин и инданазолин) характерен самый непродолжительный эффект (не более 4–6 часов). Среди всех местных деконгестантов оксиметазолин является одним из самых безопасных, напротив, препараты короткого действия (нафазолина нитрат) характеризуются наибольшим токсическим действием на клетки реснитчатого эпителия слизистой носа. В настоящее время оксиметазолин является единственным топическим деконгестантом, разрешенным МЗ РФ к применению у новорожденных и детей грудного возраста. Все топические деконгестанты нельзя использовать более 5 дней из-за опасности развития медикаментозного ринита, для препаратов короткого действия оптимальным сроком лечения является 3 дня. При длительном и бесконтрольном использовании возможно развитие атрофии слизистой носа. К основным правилам применения местных деконгестантов относятся следующие мероприятия: туалет носовой полости, затем, запрокинув голову, провести инстилляцию (порядка 5 капель препарата в каждую половину носа) и оставаться в такой позе в течение 2–3 мин после процедуры.
Из системных деконгестантов рекомендован к клиническому применению только один— фенилэфрин, однако его применение в ряде случаев сопряжено с развитием головной боли, головокружения, раздражительности; также при приеме фенилэфрина отмечается артериальная гипертензия, боли в области сердца и аритмия. Таким образом, назначение препаратов, содержащих фенилэфрин, пациентам с патологией сердечно-сосудистой системы должно быть ограничено. У детей фенилэфрин разрешен к применению только с 15-летнего возраста.
Для купирования насморка также используются антигистаминные препараты I поколения, обуславливающие свой эффект за счет побочного антихолинергического действия. К серьезным недостаткам данной группы препаратов относят выраженный седативный эффект, что не позволяет их использовать у социальноактивных пациентов (в числе противопоказаний— недопустимость вождения автомобиля и выполнение работ, требующих концентрации внимания).
Необходимо отметить, что препараты, содержащие кодеин и декстрометорфан, малоэффективны для лечения острого кашля, возникшего на фоне ОРВИ. Более того, их применение не рекомендовано при гриппе, особенно на ранних стадиях заболевания. Муколитики (ацетилцистеин, амброксол) показаны только при кашле с отхождением вязкой мокроты. Некоторые препараты— фенирамин и хлорфенирамин— H1-гистаминоблокаторы, кроме антигистаминного, оказывают также противокашлевое действие, в основе которого лежит угнетение кашлевого центра. Данные средства обладают выраженным седативным эффектом, поэтому их применение должно быть ограничено у определенных категорий заболевших (автолюбители).
Перечень клинических проявлений ОРВИ разнообразен и может проявляться как общетоксическим синдромом, так и катаральным с поражением различных уровней респираторного тракта. Для купирования симптомов болезни могут вполне оправданно применяться несколько классов лекарственных препаратов. Столь широкий перечень средств, необходимых для лечения, является попросту неудобным для пациента, тем более ведущего активный образ жизни. Решением данной проблемы явилось создание комбинированных/мультисимптомных средств, позволяющих воздействовать на основные симптомы вирусной инфекции. Кроме удобства применения, комбинированные препараты обладают более низкой стоимостью, чем набор различных лекарственных средств.
В подавляющем числе случаев рецептура комбинированных средств стандартная, содержащая жаропонижающий компонент— НПВП, системный деконгестант, антигистаминные препараты, аскорбиновую кислоту. Некоторые препараты содержат также противокашлевые средства (терпингидрат, гвайфеназин). При этом основным недостатком комбинированных препаратов является отсутствие у них противовирусного действия. В этом отношении привлекательным является использование препарата, способного оказывать как этиотропное (в отношении вируса гриппа А), так и симптоматическое действие— Антигриппина-максимум. Противовирусный эффект данного комбинированного средства обусловлен наличием в рецептуре блокатора М2-каналов— римантадина.
К сожалению, многообразие серотипов риновируса делает маловероятной перспективу создания эффективной вакцины. В настоящее время практическому здравоохранению доступна лишь противогриппозная вакцина. Разработанные недавно РСВ и парагриппозная вакцины проходят клинические испытания.
А. А. Зайцев, кандидат медицинских наук
ГИУВ МО РФ, Москва
Энтеровирусная инфекция у детей: современное состояние проблемы
Статьи
Опубликовано в журнале:
«Практика педиатра» №4, 2020
О.Н. Солодовникова, канд. мед. наук, Л.А. Харитонова, д-р мед. наук, профессор, кафедра педиатрии с инфекционными болезнями у детей факультета дополнительного профессионального образования ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, г. Москва
Ключевые слова: энтеровирусная инфекция, энтеровирусы, вирусоносительство, бессимптомные формы, полиомиелитоподобные формы, серозный менингит, энерготропная терапия, L-карнитин, Элькар®
Keywords: enterovirus infection, enteroviruses, carriage of viruses, asymptomatic forms, poliomyelitis-like forms, serous meningitis, energotropic therapy, L-carnitine, Elkar®
Резюме. Энтеровирусы являются одними из наиболее распространенных патогенов человека. Во всем мире они ежегодно вызывают почти миллиард инфекций у людей. Энтеровирусная инфекция (ЭВИ) в основном протекает бессимптомно или с неспецифическими симптомами, но может иметь и тяжелое течение со смертельным исходом. Клинический полиморфизм, распространенность бессимптомных форм ЭВИ, на долю которых приходится до 75% всех случаев заболевания, а также высокая контагиозность позволяют отнести данное заболевание к группе «высокого риска». Повсеместная распространенность ЭВИ и отсутствие специфических средств ее лечения и профилактики постоянно поддерживают высокий уровень инфицированности населения во всем мире.
В Российской Федерации, помимо программы Всемирной организации здравоохранения, направленной на ликвидацию полиомиелита, осуществляется постоянный эпидемиологический надзор за циркуляцией энтеровирусов и заболеваемостью энтеровирусными инфекциями. Высокая восприимчивость людей к ЭВИ с возможностью длительного вирусоносительства при отсутствии видимых проявлений ведет к формированию механизмов аутоиммунных процессов, что является стимулом для разработки рекомендаций по реабилитации пациентов.
Summary. Enteroviruses are one of the most common human pathogens. Worldwide, they cause almost a billion infections in people every year. Enterovirus infection (EVI) is mostly asymptomatic and is limited to viral symptoms, but can also cause severe diseases with fatal outcomes. Clinical polymorphism, the prevalence of asymptomatic forms of EVI, accounting for up to 75% of all cases of the disease, and high contagiousness are factors that make it possible to classify this disease as a «high risk» group. The ubiquity of EVI and the lack of specific treatment and prevention tools constantly maintain a high level of infection in the world’s population.
In the Russian Federation, in addition to the World Health Organization programmes, there is ongoing epidemiological surveillance of the circulation of enteroviruses and the incidence of enterovirus infections. High susceptibility of people to EVI with the possibility of long-term viral transmission in the absence of visible manifestations contributes to the formation of mechanisms of autoimmune processes, which is a trigger for the development of recommendations for its rehabilitation.
Введение
Актуальность энтеровирусной инфекции (ЭВИ) связана с ее клиническим полиморфизмом, повсеместной распространенностью, широтой и массовостью поражения энтеровирусами (ЭВ) населения, склонностью к вспышечному характеру заболевания.
Особенностью ЭВИ является поражение центральной нервной системы (ЦНС) с развитием полиомиелитоподобных форм. Установлено, что от 18 до 31% случаев поражения ЦНС у детей раннего возраста связано с внутриутробным инфицированием ЭВ [1]. Способность ЭВ к персистенции с формированием аутоиммунного процесса может приводить к гибели плода, самопроизвольным выкидышам и заболеваниям новорожденных.
Для ЭВИ характерна высокая генетическая изменчивость с образованием новых высокопатогенных штаммов и отсутствием стойкого иммунитета. Не менее важным фактором считается способность ЭВ запускать аутоиммунные механизмы с поражением паренхиматозных органов, что зачастую приводит к хронизации процесса [2, 3].
Отсутствие этиотропной терапии ЭВИ и вакцинопрофилактики этой инфекции побуждает к поискам методов патогенетической терапии и ее обоснованию.
Эпидемиология
Энтеровирусы являются одними из самых распространенных патогенов человека. Во всем мире они ежегодно вызывают почти миллиард инфекций у людей [1]. В то же время продолжают появляться все новые серотипы ЭВ, некоторые из которых, как полагают ученые, получены людьми от других приматов [4]. Вследствие высокой генетической изменчивости ЭВ в последние годы обнаружены их новые высокопатогенные штаммы (А71 и D68) [4, 5], вызываемая ими инфекция протекает с респираторными и неврологическими симптомами и характеризуется тенденцией к вспышкам и высокой летальности [1, 4, 6].
С 2006 г. в Российской Федерации была реализована Программа эпидемиологического надзора и профилактики энтеровирусной (неполио) инфекции. В рамках этой Программы проведено множество организационных и практических мероприятий и научно-исследовательских работ, разработан ряд нормативных и методических документов, в том числе СП 3.1.2950-1 «Профилактика энтеровирусной (неполио) инфекции», и значительно укреплена материально-техническая база тех лабораторий, которые осуществляют исследования на наличие ЭВ в биологических образцах людей и объектах окружающей среды [5].
По данным литературы, заболеваемость ЭВ типа A71 связана со вспышками hand, foot and mouth disease и редкими поражениями ЦНС в виде энцефалита с поражением ствола мозга. Данные вспышки регистрировались главным образом в Азиатско-Тихоокеанском регионе. В странах Азии также наблюдалась значительная распространенность ЭВ, а именно Коксаки А16 [7]. Выявление ЭВ серотипа D68 связано с развитием респираторных проявлений и дебютом острых вялых параличей в Северной Америке, Европе и Азии в последние 5 лет [8, 9]. В последние годы тяжелые формы заболеваний, вызванных ЭВ типов A71 и D68, регистрировались и в ряде европейских стран [10].
Высока заболеваемость ЭВИ и в Российской Федерации. По данным литературы, выявление циркуляции возбудителей ЭВИ на территории РФ значительно улучшилось в рамках реализации Программы «Эпидемиологический надзор и профилактика энтеровирусной (неполио) инфекции на 2015-2017 гг.», но при росте заболеваемости ЭВИ и выявлении новых клинических форм болезни практически отсутствуют данные о профилактике ЭВИ и патогенетической терапии.
На рисунке представлены данные о заболеваемости детей ЭВИ в целом и заболеваемости серозным менингитом как одной из форм ЭВИ у детей в РФ. Согласно этим данным рост заболеваемости детей ЭВИ не имеет тенденции к снижению. Наоборот, за последние годы, а именно с 2015 по 2019 г., заболеваемость ЭВИ увеличилась почти в 2 раза. Заболеваемость серозным менингитом энтеровирусной этиологии также остается на стабильно высоком уровне.
По эпидемиологическим данным, ЭВИ имеет летне-осеннюю сезонность, хотя спорадические случаи в отдельных регионах России встречаются круглогодично, а максимальная заболеваемость данной инфекцией чаще регистрируется в августе-сентябре [2].

Этиологическая характеристика энтеровирусов
ЭВ представляют собой род вирусов из семейства пикорнавирусов (Picornaviridae), порядок Picornavirales.
Согласно современной таксономии, основанной на геномных и биологических свойствах вирусов, ЭВ делятся на 15 видов, из которых ЭВ видов А-D и риновирусы видов A-C заражают человека [3, 5]. Это одна из самых многочисленных групп вирусов, включающая полиовирус, неполиомиелитные энтеровирусы, вирус гепатита А и риновирусы A, B, C.
Семейство характеризуется икосаэдрической симметрией капсида и одноцепочечной + РНК как носителя наследственной информации [1, 5]. Название ЭВ связано с их репродукцией в желудочно-кишечном тракте, однако энтерит они вызывают редко.
Клиническая картина
В классификации ЭВИ выделяют типичные и атипичные формы. Клиническая классификация представлена в таблице.
Клиническая классификация форм энтеровирусной инфекции
| Типичные формы | Атипичные формы |
| Герпангина | Инапарантная форма (субклиническая) |
| Эпидемическая миалгия, или болезнь Борнхольма (плевродиния) | Катаральная форма |
| Бостонская лихорадка (экзантема) | Энцефалитическая форма |
| Асептический серозный менингит | «Летний грипп», или трехдневная лихорадка |
| Мезаденит | Энцефаломиокардит новорожденных |
| Гастроэнтерит | Полиомиелитоподобная форма |
| Миокардит, перикардит | Эпидемический геморрагический конъюнктивит (болезнь АНС, болезнь «Аполло-11») |
| Геморрагический конъюнктивит | |
| Увеит | |
| Нефрит | |
| Гепатит | |
| Панкреатит |
Клиническая картина ЭВИ характеризуется полиморфизмом симптомов – от 3- и 5-дневной лихорадки, респираторных поражений дыхательной системы, экзантемных форм до более грозных проявлений, паралитических полиомиелитоподобных форм. Инкубационный период длится от 2 до 35 дней, в среднем 7-10 дней.
ЭВИ может протекать в виде поражения дыхательной системы – герпангины, ринита, фарингита, бронхита, бронхиолита, пневмонии, вплоть до отека легких. Эти клинические формы составляют до 30% всех случаев ЭВИ у детей [4]. Экзантемные формы, варианты с формированием серозного менингита и паралитические полиомиелитоподобные формы ЭВИ встречаются значительно реже.
Тем не менее дети младше 5 лет подвержены тяжелым формам с развитием неврологических осложнений, таких как асептический мозжечковый менингит, мозжечковый энцефалит, острый вялый паралич. Развитие данных неврологических и респираторных форм чаще вызвано ЭВ типа A71 и D68.
Одна из форм ЭВИ – серозно-вирусный менингит. В большинстве случаев асептический серозный менингит протекает классически и характеризуется острым началом, выраженной головной болью, рвотой и симптомами интоксикации. Менингеальный синдром носит непостоянный характер и отличается диссоциацией менингеальных симптомов.
Лихорадка держится 3-4 дня, реже до 6 дней, в 25% случаев температурная кривая имеет «двухволновый» характер. Гипертензионно-гидроцефальный синдром является ведущим в патогенезе серозного менингита. Может наблюдаться также полиорганность поражения: экзантема, герпангина, миалгия, желудочно-кишечные расстройства, абдоминальный синдром, полиаденопатия, гепатомегалия, реже спленомегалия.
У новорожденных и детей грудного возраста асептический серозный менингит развивается как составляющая тяжелого системного поражения, включающего некроз печени, миокардит, некротизирующий энтероколит, внутрисосудистую коагуляцию. Менингеальные симптомы могут быть стертыми. Летальный исход у детей этого возраста является не следствием поражения ЦНС, а результатом острой печеночной недостаточности (вирусы ЕСНО) или миокардита (вирусы Коксаки).
После воспалительных форм ЦНС формируются резидуальные явления. Данные изменения наблюдаются в подростковом периоде и характеризуются проявлением таких форм, как цереброастенический синдром, неврозоподобные расстройства, гипертензионный синдром.
Клинический полиморфизм, распространенность бессимптомных форм ЭВИ, которые составляют до 75% всех случаев заболевания, высокая контагиозность позволяют отнести данное заболевание к группе «высокого риска» [9].
В отечественной литературе практически отсутствуют сведения о редких проявлениях ЭВИ, поражении ЭВ сердечно-сосудистой системы, желчного пузыря и почек.
В 50% случаев выявлена взаимосвязь с тропностью ЭВ к кардиомиоцитам и развитием дилатационной кардиомиопатии у детей [8]. Данная инфекция способствуют развитию кардиомиопатии двумя различными способами. При первом типе поражения ЭВ могут непосредственно инфицировать и индуцировать гибель клеток кардиомиоцитов. Во втором же случае ЭВ вызывают аутоиммунный ответ, при котором собственная иммунная система хозяина разрушает кардиомиоциты (стадия апоптоза) и приводит к формированию кардиомиопатии.
Изучая данные литературы, мы также обнаружили связь ЭВ Коксаки B4 с развитием сахарного диабета I типа. Вирус Коксаки В4 выступает триггером в развитии патологического процесса в поджелудочной железе [4, 8], вызывая апоптоз ^-клеток и гипогликемию в экспериментальных исследованиях. Таким образом, подтверждается тот факт, что ЭВ могут вызывать поражение поджелудочной железы с последующим развитием гипо- или гипергликемии.
Вопросы диагностики и терапии
Лабораторная диагностика ЭВИ осложняется большим количеством серотипов возбудителей, поэтому наряду с классическими вирусологическими методами в диагностике используют молекулярно-биологические методы, позволяющие секвенировать геном возбудителя и определить филогенетические связи между различными штаммами ЭВ [2]. Тип ЭВ может быть определен с использованием молекулярного типирования (генотипирования), которое основано на определении нуклеотидной последовательности области генома, кодирующей капсидный белок VP1. Полипептид VP1 содержит аминокислотные последовательности, определяющие серотип вируса, и является главным рецепторным локусом вириона. Определение типа ЭВ проводят путем секвенирования фрагментов области генома, кодирующей белки капсида VP3 и VP1. Молекулярное типирование ЭВ с использованием амплификации и секвенирования нуклеотидных последовательностей региона VP1 является прямым методом идентификации, обладает высокими показателями специфичности [11].
Диагноз ЭВИ и ее форм базируется в основном на клинической симптоматике и эпидемиологических данных.
Этиотропной терапии ЭВИ в настоящее время в России не существует. Препараты плеконарил (США) и вапендавир (США), действующие непосредственно на вирусный капсид и тем самым ингибирующие инфекцию, вызванную только ЭВ типа A71 и D68, в России пока не зарегистрированы.
Патогенетическая и симптоматическая терапия ЭВИ проводится с учетом клинической формы и основана на восстановлении метаболизма и энергетического потенциала поврежденных клеток. На этом фоне при развитии неврологической симптоматики в периоде реконвалесценции, особенно после серозно-вирусного менингита, может быть рекомендована метаболическая терапия [12], коррекция вегетативных расстройств, ассоциированных с синдромом вегетативной дистонии.
В основе патогенеза синдрома вегетативной дистонии лежит дезинтеграция высших вегетативных центров, нарушение равновесия между симпатическим и парасимпатическими отделами, расстройство взаимодействия различных органов и систем организма, метаболических процессов, что отражается на развитии адаптационно-компенсаторных реакций, формировании энергетического обмена [13].
В многочисленных исследованиях было показано, что нарушения энергетического обмена выявлены у детей с перинатальной патологией, урологическими и нефрологическими заболеваниями, острыми респираторными инфекциями [12, 14-17]. При всех отмеченных патологических состояниях целесообразно применение энерготропных препаратов.
В современной литературе имеются данные об использовании препаратов L-карнитина у детей и подростков при вегетативных расстройствах [13] и при всех указанных выше патологических состояниях и заболеваниях.
Таким препаратом L-карнитина с выраженным метаболическим действием является Элькар® (левокарнитин) отечественной компании «ПИК-ФАРМА». Фармакологическое действие L-карнитина обусловлено его участием в процессах обмена веществ в качестве переносчика длинноцепочечных жирных кислот (пальмитиновой и др.) из цитоплазмы в митохондрии, где эти кислоты подвергаются процессу β-окисления с образованием аденозинтрифосфорной кислоты и ацетил-КоА.
Карнитин улучшает белковый и жировой обмен, повышает секрецию и ферментативную активность желудочного и кишечного соков, способствует усвоению пищи, снижает избыточную массу тела. Участвует в транспорте ксенобиотиков и органических кислот из клетки, усиливает процесс детоксикации, позволяя устранить последствия интоксикации организма.
Элькар® улучшает обмен веществ, непосредственно влияет на обеспечение клеток организма энергией, тем самым способствуя нормализации клеточного энергообмена, коррекции метаболических нарушений.
Важным направлением реабилитации детей после перенесенных вирусных инфекций является назначение препаратов на основе L-карнитина в связи с уникальностью его воздействия на клеточный метаболизм [18, 19]. Необходимость включения Элькара в патогенетическую терапию при инфекционных заболеваниях у детей отмечена в исследовании Т.А. Руженцовой [17]: вирусные агенты, в том числе и ЭВ [8], способны не только длительно персистировать в организме, находясь в латентном состоянии, и активизироваться на фоне ослабления иммунитета при присоединении интеркуррентной инфекции, но и вызывать поражение миокарда, что зачастую бывает сложно связать с первоначальным этиологическим фактором [17].
В работах О.В. Гончаровой показано, что включение в реабилитацию детей с острыми респираторными инфекциями препарата Элькар® в возрастных дозах курсами длительностью 1-1,5 мес предупреждает развитие повторных эпизодов острых респираторных инфекций у детей и сокращает длительность их течения, восстанавливая активность иммунных клеток [14]. Кроме того, в литературе представлены данные об эффективности применения Элькара в дозе 30-50 мг/кг/сут в 2-3 приема курсами 1-1,5 мес при гипоксических состояниях у детей с перинатальной патологией [12]. Такая коррекция патологических процессов возможна и в периоде реконвалесценции серозных менингитов. Курсы необходимо повторять 2 раза в год в течение 3 лет.
Изучая отечественную литературу, мы нашли сообщения о том, что лечение левокарнитином позволяет существенно улучшить состояние здоровья детей с вегетативными дисфункциями, нормализуя механизмы вегетативной регуляции, стабилизируя клеточный энергообмен, что, в свою очередь, способствует возрастанию физической активности детей и повышению иммунитета [16]. Эти изменения крайне необходимы и в реабилитационной терапии как ЭВИ в целом, так и ее неврологических форм.
Элькар® незаменим для восстановления детей после болезни. Он улучшает энергообеспечение органов и тканей, повышает аппетит и усвоение белков, помогает организму работать на полную мощность, являясь естественным эндогенным метаболитом живого организма, принимая участие во всех видах обмена веществ, в регуляции энергетических и пластических процессов.
Элькар® эффективно восполняет потребность организма в L-карнитине, когда организму необходима энергетическая поддержка.
Заключение
Значительный полиморфизм клинических проявлений ЭВИ с отсутствием четкой зависимости от серологического типа возбудителя, большая частота бессимптомных форм, длительное вирусоносительство, отсутствие специфических методов профилактики делают ЭВИ неуправляемой болезнью. Глубокое знание клинической симптоматики, своевременность постановки диагноза, а также принятые меры профилактики способствуют снижению частоты осложненных и тяжелых форм ЭВИ.
Энтеровирусы ассоциируются со многими заболеваниями, этиология которых ранее не связывалась с инфекционными факторами, – это кардиомиопатии, нефриты, сахарный диабет, васкулиты, бесплодие.
Трудности проведения диагностики требуют разработки новых высокоэффективных, в том числе «экспресс», методов диагностики для раннего выявления инфекции, а обоснование применения патогенетических метаболических препаратов (Элькар®) позволит эффективно корректировать патологические состояния, вызываемые ЭВ. При изучении катамнеза ЭВИ возрастает необходимость в разработке рекомендаций по реабилитации детей, перенесших тяжелые формы ЭВИ.
Таким образом, хотя большинство энтеровирусных инфекций и являются бессимптомными (90% случаев), эти энтеровирусы ответственны за различные инфекционные синдромы. Прогноз их развития зависит от инфекционной дозы, органа-мишени, возраста, пола, иммунного статуса пациента, проводимой патогенетической терапии и реабилитации.
Литература
- Домашенко О.Н., Гридасов В.А. Энтеровирусная инфекция: новая классификация вирусов, клинические формы, перспективы исследования // Университетская клиника. 2018. № 2(27). С. 75-81.
- Протасеня, И.И. Энтеровирусная инфекция у детей. LAP Lambert Akademic Publishing, 2015. 274 с.
- Toczylowski K., Wieczorek M., Bojkiewicz E. et al. Children’s enterovirus infections of the central nervous system in Bialystok, Poland: epidemiology, viral types and seasonal factors // Viruses. 2020. Vol. 12. No. 8. P. 893.
- Zell R., Delwart E., Gorbalenya A.E. et al. ICTV Virus taxonomy profile: Picornaviridae // The Journal of General Virology. 2017. Vol. 98. No. 10. P. 2421-2422.
- Программа «Эпидемиологический надзор и профилактика энтеровирусной (неполио) инфекции на 2015-2017 гг.». rospotrebnadzor.ru/deyatelnost/epidemiological-sur…
- Messacar K., Asturias E.J, Hixon A.M et al. Enterovirus D68 and acute flaccid myelitis-evaluating the evidence for causality // The Lancet. Infectious Diseases. 2018. Vol. 18. No. 8. P. 239-247.
- Hassel С., Mirand А., Farkas А. et al. Phylogeography of coxsackievirus A16 reveals global transmission pathways and recent emergence and spread of a recombinant genogroup // Journal of Virology. 2017. Vol. 91. No. 18.
- Midgley C.M., Watson J.T., Nix W.A. et al. Severe respiratory illness associated with a nationwide outbreak of enterovirus D68 in the USA (2014): a descriptive epidemiological investigation // The Lancet. Respiratory Medicine. 2015. Vol. 3. No. 11. P. 879-887.
- Dyrdak R., Grabbe M., Hammas В. Outbreak of enterovirus D68 of the new B3 lineage in Stockholm, Sweden, August to September 2016 // Euro Surveillance. 2016. Vol. 21. No. 46. P. 30403.
- Enteroviruses detections with severe neurological symptoms among children and adults in European countries // Communicable disease threats report CDTR Week 46, 13-19 November 2016.
- Молекулярно-генетические исследования при мониторинге энтеровирусной инфекции. Методические рекомендации МР 4.4.0136-18. М., 2019.
- Неудахин Е.В. Роль левокарнитина в реабилитации детей с перинатальной патологией // Consilium Medicum. 2019. № 3. С. 115-121.
- Неудахин Е.В. О целесообразности использования препаратов карнитина при лечении синдрома вегетативной дистонии у детей // Практика педиатра. 2017. № 1. С. 52-59.
- Гончарова О.В. Реабилитация детей с острыми респираторными инфекциями // Вопросы практической педиатрии. 2018. Т. 13. № 5. С. 84-90.
- Османов И.М., Бекмурзаева Г.Б., Мумладзе Э.Б., Тамбиева Е.В. Место энерготропной терапии в лечении инфекции мочевой системы // Практика педиатра. 2019. № 2. С. 42-48.
- Морозов С.Л. Часто болеющие дети. Современный взгляд педиатра // РМЖ. Медицинское обозрение. 2019. № 8. С. 7-9.
- Руженцова Т.А., Горелов А.В., Смирнова Т.В., Счастных Л.А. Диагностика и лечение инфекционных поражений миокарда у детей // Детская больница. 2012. № 2. С. 62-66.
- Хорошилов И.Е. Карнитин: Роль в организме человека и возможности терапевтического применения при различных заболеваниях. Врач. 2017. № 3. С. 2-6.
- Брин И.Л., Дунайкин М.Л., Лисицина С.В. Проблемы дозирования препаратов карнитина в детском возрасте // Российский вестник перинатологии и педиатрии. 2014. Т. 59. № 4. С. 16-22.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
From Wikipedia, the free encyclopedia
 |
|
 |
|
| Clinical data | |
|---|---|
| Routes of administration |
Oral, intranasal |
| ATC code |
|
| Legal status | |
| Legal status |
|
| Pharmacokinetic data | |
| Bioavailability | 70% (oral) |
| Protein binding | >99% |
| Metabolism | Hepatic |
| Excretion | <1% excreted unchanged in urine |
| Identifiers | |
|
IUPAC name
|
|
| CAS Number |
|
| PubChem CID |
|
| DrugBank |
|
| ChemSpider |
|
| UNII |
|
| ChEMBL |
|
| PDB ligand |
|
| CompTox Dashboard (EPA) |
|
| ECHA InfoCard | 100.208.947 |
| Chemical and physical data | |
| Formula | C18H18F3N3O3 |
| Molar mass | 381.355 g·mol−1 |
| 3D model (JSmol) |
|
|
SMILES
|
|
|
InChI
|
|
| |
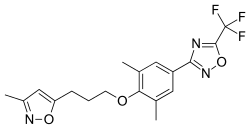
Pleconaril (Picovir[1]) is an antiviral drug that was being developed by Schering-Plough for prevention of asthma exacerbations and common cold symptoms in patients exposed to picornavirus respiratory infections.[2] Pleconaril, administered either orally or intranasally, is active against viruses in the Picornaviridae family, including Enterovirus[3] and Rhinovirus.[4] It has shown useful activity against the dangerous enterovirus D68.[5]
History[edit]
Pleconaril was originally developed by Sanofi-Aventis, and licensed to ViroPharma in 1997. ViroPharma developed it further, and submitted a New Drug Application to the United States Food and Drug Administration (FDA) in 2001. The application was rejected, citing safety concerns; and ViroPharma re-licensed it to Schering-Plough in 2003. The Phase II clinical trial was completed in 2007.[2] A pleconaril intranasal spray had reached phase II clinical trial for the treatment of the common cold symptoms and asthma complications. However, the results have yet to be reported.[6]
Mechanism of action[edit]
In enteroviruses, Pleconaril prevents the virus from exposing its RNA, and in rhinoviruses Pleconaril prevents the virus from attaching itself to the host cell.[7]
Human rhinoviruses (HRVs) contain four structural proteins labeled VP1-VP4. Proteins VP1, VP2 and VP3 are eight stranded anti-parallel β-barrels. VP4 is an extended polypeptide chain on the viral capsid inner surface.[8] Pleconaril binds to a hydrophobic pocket in the VP1 protein. Pleconaril has been shown in viral assembly to associate with viral particles.[9] Through noncovalent, hydrophobic interactions compounds can bind to the hydrophobic pocket.[10] Amino acids in positions Tyr152 and Val191 are a part of the VP1 drug binding pocket.[8]
In Coxsackievirus, Pleconaril efficiency correlates to the susceptibility of CVB3 with the amino acid at position 1092 in the hydrophobic pocket.[11] Amino acid 1092 is in close proximity to the central ring of capsid binders.[12] The binding of pleconaril in the hydrophobic pocket creates conformational changes, which increases the rigidity of the virion and decreases the virions’ ability to interact with its receptor.[13] Drugs bind with the methylisoxazole ring close to the entrance pocket in VP1, the 3-fluromethyl oxadiazole ring at the end of the pocket and the phenyl ring in the center of the pocket.[6]
Clinical trials[edit]
The results of two randomized, double blind, placebo studies found Pleconaril treatment could benefit patients with colds due to picornaviruses.[14] Participants in the studies were healthy adults from Canada and the United States, with self-diagnosed colds that had occurred within 24 hours of trial enrollment. Participants were randomly given a placebo or two 200 mg tablets to take three times daily for five days. To increase absorption it was recommended to be taken after a meal.[14] To monitor the effectiveness of Pleconaril, participants recorded the severity of their symptoms and nasal mucosal samples were obtained at enrollment, day 3, day 6 and day 18. The two studies had a total of 2096 participants and more than 90% (1945) completed the trial. The most common reason for a participant not finishing the trial was an adverse event. Pleconaril treatment showed a reduction in nose blowing, sleep disturbance, and less cold medication used.[14]
Another study showed over 87% of virus isolates in cell culture were inhibited by pleconaril.[9] Virus variants were detected in 0.7% of the placebo group and 10.7% of the pleconaril group. Of the two isolates a subject from the placebo group had a resistant virus in cell culture to pleconaril. The other strain was susceptible to the drug. The pleconaril group had 21 virus strains, which remained susceptible. Resistance strains were found in 7 pleconaril patients.[9]
A Phase II study that used an intranasal formulation of pleconaril failed to show a statistically significant result for either of its two primary efficacy endpoints, percentage of participants with rhinovirus PCR-positive colds and percentage of participants with asthma exacerbations together with rhinovirus-positive PCR.[15]
Resistance[edit]
In human rhinoviruses mutations in amino acids at positions 152 and 191 decrease the efficiency of pleconaril. The resistant HRV have phenylalanine at position 152 and leucine at position 191. In vitro studies have shown resistance to pleconaril may emerge. The wild type resistance frequency to pleconaril was about 5×10−5. Coxsackievirus B3(CVB3) strain Nancy and other mutants carry amino acid substitutions at position 1092 of Ile1092->Leu1092 or Ile1092->Met in VP1. The Ile->Leu mutation causes complete resistance to pleconaril. The study found resistance of CVB3 to pleconaril can be overcome by substitution of the central phenyl group. Methyl and bromine substitutions created an increase of pleconaril activity towards sensitive and resistant strains. Amino acid substitutions in the hydrophobic pocket and receptor binding region of viral capsid proteins were shown to have an effect against the sensitivity of capsid binding antivirals.[6]
Side effects of pleconaril[edit]
The U.S. Food and Drug Administration rejected pleconaril in 2002 due to the side effects. The most commonly reported side effects were mild to moderate headache, diarrhea, and nausea.[14] Some women were having symptoms of spotting in between periods. Menstrual irregularities were reported by 3.5% of the 320 pleconaril treated women using oral contraceptives and by none of the 291 placebo treated women.[14] In the clinical trial two women became pregnant due to the drug interfering with hormonal birth control by activation of cytochrome P-450 3A enzymes. Other patients have described painful nasal inflammation.[16]
References[edit]
- ^ «Pharma News — Latest Pharma & Pharmaceutical news & updates».
- ^ a b «Effects of Pleconaril Nasal Spray on Common Cold Symptoms and Asthma Exacerbations Following Rhinovirus Exposure (Study P04295AM2)». ClinicalTrials.gov. U.S. National Institutes of Health. March 2007. Retrieved 2007-04-10.
- ^ Pevear D, Tull T, Seipel M, Groarke J (1999). «Activity of pleconaril against enteroviruses». Antimicrob Agents Chemother. 43 (9): 2109–15. doi:10.1128/AAC.43.9.2109. PMC 89431. PMID 10471549.
- ^ Ronald B. Turner; J. Owen Hendley (2005). «Virucidal hand treatments for prevention of rhinovirus infection». J Antimicrob Chemother. 56 (5): 805–807. doi:10.1093/jac/dki329. PMID 16159927.
- ^ Liu, Y; et al. (2015). «Structure and inhibition of EV-D68, a virus that causes respiratory illness in children». Science. 347 (6217): 71–74. Bibcode:2015Sci…347…71L. doi:10.1126/science.1261962. PMC 4307789. PMID 25554786.
- ^ a b c Schmidtke, Michaela; Wutzler, Peter; Zieger, Romy; Riabova, Olga B.; Makarov, Vadim A. (2009). «New pleconaril and [(biphenyloxy)propyl]isoxazole derivatives with substitutions in the central ring exhibit antiviral activity against pleconaril-resistant coxsackievirus B3». Antiviral Research. 81 (1): 56–63. doi:10.1016/J.ANTIVIRAL.2008.09.002. PMID 18840470.
- ^ Florea N, Maglio D, Nicolau D (2003). «Pleconaril, a novel antipicornaviral agent». Pharmacotherapy. 23 (3): 339–48. doi:10.1592/phco.23.3.339.32099. PMC 7168037. PMID 12627933. Free full text with registration
- ^ a b Ledford, Rebecca M.; Collett, Marc S.; Pevear, Daniel C. (1 December 2005). «Insights into the genetic basis for natural phenotypic resistance of human rhinoviruses to pleconaril». Antiviral Research. 68 (3): 135–138. doi:10.1016/j.antiviral.2005.08.003. PMID 16199099.
- ^ a b c Pevear, D. C.; Hayden, F. G.; Demenczuk, T. M.; Barone, L. R.; McKinlay, M. A.; Collett, M. S. (26 October 2005). «Relationship of Pleconaril Susceptibility and Clinical Outcomes in Treatment of Common Colds Caused by Rhinoviruses». Antimicrobial Agents and Chemotherapy. 49 (11): 4492–4499. doi:10.1128/AAC.49.11.4492-4499.2005. PMC 1280128. PMID 16251287.
- ^ Rotbart, HA (February 2002). «Treatment of picornavirus infections». Antiviral Research. 53 (2): 83–98. doi:10.1016/s0166-3542(01)00206-6. PMID 11750935.
- ^ Braun, Heike; Makarov, Vadim A.; Riabova, Olga B.; Wutzler, Peter; Schmidtke, Michaela (2011). «Amino Acid Substitutions At Residue 207 of Viral Capsid Protein 1 (VP1) Confer Pleconaril Resistance in Coxsackievirus B3 (CVB3)». Antiviral Research. 90 (2): A54–A55. doi:10.1016/j.antiviral.2011.03.100.
- ^ Schmidtke, Michaela; Wutzler, Peter; Zieger, Romy; Riabova, Olga B.; Makarov, Vadim A. (2009). «New pleconaril and [(biphenyloxy)propyl]isoxazole derivatives with substitutions in the central ring exhibit antiviral activity against pleconaril-resistant coxsackievirus B3». Antiviral Research. 81 (1): 56–63. doi:10.1016/j.antiviral.2008.09.002. PMID 18840470.
- ^ Thibaut, Hendrik Jan; De Palma, Armando M.; Neyts, Johan (2012). «Combating enterovirus replication: State-of-the-art on antiviral research». Biochemical Pharmacology. 83 (2): 185–192. doi:10.1016/j.bcp.2011.08.016. PMID 21889497.
- ^ a b c d e Hayden, F.G.; Herrington, D.T.; Coats, T.L.; Kim, K.; Cooper, E.C.; Villano, S.A.; Liu, S.; Hudson, S.; Pevear, D.C.; Collett, M.; McKinlay, M. (Jun 15, 2003). «Efficacy and safety of oral pleconaril for treatment of colds due to picornaviruses in adults: results of 2 double-blind, randomized, placebo-controlled trials». Pleconaril Respiratory Infection Study, Group. Clinical Infectious Diseases. 36 (12): 1523–32. doi:10.1086/375069. PMC 7199898. PMID 12802751.
- ^ National Institutes of Health. Effects of Pleconaril Nasal Spray on Common Cold Symptoms and Asthma Exacerbations Following Rhinovirus Exposure (Study P04295AM2). Clinical Trials.gov. Available at http://www.clinicaltrials.gov/ct/gui/show/NCT00394914. Accessed: July 20, 2015
- ^ Greenwood, Veronique (2011). «Curing the Common Cold». Scientific American. 304 (1): 30–1. Bibcode:2011SciAm.304a..30G. doi:10.1038/scientificamerican0111-30. PMID 21265321. Retrieved 2013-03-25.
Форма выпуска, упаковка и состав
препарата Коаплекс
Лиофилизат для приготовления раствора для в/в введения в виде порошка или аморфной массы белого или почти белого цвета; восстановленный раствор — прозрачная или слегка опалесцирующая жидкость от бесцветного до светло-желтого цвета; растворитель — прозрачная бесцветная жидкость.
Вспомогательные вещества: гепарин натрия (в пересчете на гепарин) — 4-20 МЕ (0.4-2 МЕ/мл**), антитромбин III человека — 2-15 МЕ (0.2-1.5 МЕ/мл**), альбумин человека — 20-40 мг (2-4 мг/мл**), натрия хлорид — 30-60 мг (3-6 мг/мл**), натрия цитрата дигидрат (в пересчете на натрия цитрат) — 20-40 мг (2-4 МЕ/мл**), натрия гидроксид или хлористоводородная кислота — q.s. для доведения pH.
Растворитель: вода д/и — 10 мл.
250 ME — флаконы бесцветного стекла (1) в комплекте с растворителем (фл. 10 мл 1 шт.) и блистером с устройством для добавления растворителя со встроенным фильтром 15 мкм — пачки картонные.
* удельная активность фактора свертывания крови IX равна 2.5 ME/мг общего белка;
** содержание в восстановленном растворе.
Общая концентрация белка после растворения составляет 6-14 мг/мл восстановленного раствора.
Активность факторов свертывания крови II, VII, IX, X, протеина С и S была определена в соответствии с действующими стандартами ВОЗ.
Фармакологическое действие
Препарат протромбинового комплекса.
Факторы свертывания крови II, VII, IX и X синтезируются в печени с помощью витамина К, и их комбинацию часто называют протромбиновым комплексом. Протеины С и S являются витамин К-зависимыми ингибиторами свертывания.
Фактор свертывания крови VII — это предшественник активной сериновой протеазы фактора свертывания крови VIIa, которая запускает внешний путь активации свертывания крови. Комплекс фактора свертывания крови VIIa с тканевым тромбопластином активирует факторы свертывания крови IX и X, в результате чего образуются активированные факторы свертывания крови — IXa и Ха. При дальнейшей активации коагуляционного каскада происходит активация протромбина (фактора свертывания крови II), из которого образуется тромбин. Под влиянием тромбина фибриноген превращается в фибрин, который формирует сгусток. Нормальное формирование тромбина также имеет критическое значение для функций тромбоцитов как компонентов первичного свертывания крови.
Изолированный тяжелый дефицит фактора свертывания крови VII приводит к снижению формирования тромбина и тенденции к кровотечению из-за нарушения формирования фибрина и нарушения первичного свертывания крови.
Изолированный дефицит фактора свертывания крови IX является примером классической гемофилии (гемофилия В).
Изолированный дефицит факторов свертывания крови II или X встречается очень редко, но в тяжелой форме может сопровождаться такой же тенденцией к кровотечению, как и при классической гемофилии.
Ингибиторы свертывания протеины С и S также синтезируются в печени. Протеин S является ко-фактором, усиливающим биологическую активность протеина С.
Активированный протеин С угнетает свертывание крови путем инактивации факторов свертывания крови Va и VIlla. Протеин S как ко-фактор протеина С поддерживает инактивацию свертывания. Дефицит протеина С сопровождается повышенным риском тромбоза.
Приобретенный дефицит витамин К-зависимых факторов свертывания может развиваться при применении антагонистов витамина К. Если дефицит становится тяжелым, то развивается тенденция к тяжелым кровотечениям, чаще в забрюшинное пространство и головной мозг, чем в мышцы и суставы. Тяжелая печеночная недостаточность тоже приводит к значительному снижению уровня витамин К-зависимых факторов свертывания и клинически значимой тенденции к кровотечениям. Однако это явление часто имеет сложную природу из-за одновременно протекающего незначительного внутрисосудистого свертывания, низкого содержания тромбоцитов, дефицита ингибиторов свертывания и нарушения фибринолиза.
Введение протромбинового комплекса человека приводит к повышению уровня витамин К-зависимых факторов свертывания в плазме крови и может временно устранять нарушение свертывания крови у пациентов с дефицитом одного или нескольких из этих факторов.
Фармакокинетика
Данные по фармакокинетике и данные об уровне восстановления факторов свертывания in vivo были получены путем проведения исследования с участием здоровых добровольцев, а также в двух исследованиях по отмене антагониста витамина К при лечении острых массивных кровотечений или периоперационной профилактике кровотечений.
При в/в введении компоненты сразу поступают в системный кровоток, и биодоступность пропорциональна введенной дозе.
После введения в дозе 50 МЕ/кг максимальные концентрации всех компонентов были достигнуты в течение 3 ч. Средний прирост уровня восстановления in vivo (IVR) находился в диапазоне от 0.016 МЕ/мл для фактора свертывания крови IX и до 0.028 МЕ/мл для протеина С.
Введение лекарственного средства в дозе 1 МЕ/кг приводило к увеличению уровня витамин К-зависимых факторов свертывания крови в плазме в пределах от 0.013 МЕ/мл до 0.023 МЕ/мл.
Факторы свертывания крови после введения данного лекарственного средства распределяются и метаболизируются в организме так же, как и эндогенные факторы свертывания II, VII, IX и X.
Показания активных веществ препарата
Коаплекс
Лечение и периоперационная профилактика кровотечений при приобретенном дефиците факторов свертывания крови, входящих в протромбиновый комплекс, в т.ч. при дефиците, вызванном терапевтическим применением или передозировкой антагонистов витамина К, когда требуется быстрое устранение дефицита; лечение и периоперационная профилактика кровотечений при врожденном дефиците любого витамин К-зависимого фактора свертывания крови, когда препарат очищенного специфического фактора свертывания крови недоступен.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Лечение следует начинать под наблюдением врача, имеющего опыт лечения нарушений свертывания крови. Доза и длительность лечения зависят от показания для применения, тяжести заболевания, локализации и степени кровотечения и от клинического состояния пациента.
Дозу и кратность введения следует рассчитывать индивидуально для каждого пациента. Интервал между дозами следует выбирать с учетом разных периодов полувыведения в крови факторов свертывания, входящих в протромбиновый комплекс .
Дозу для каждого пациента можно установить только на основании регулярного измерения активности соответствующих факторов свертывания в плазме крови или путем общей оценки активности протромбинового комплекса (МНО, тест Квика) в сочетании с непрерывным контролем клинического состояния пациента.
Побочное действие
Со стороны сосудов: часто — тромбоэмболические реакции (в т.ч. с летальным исходом).
Со стороны крови и лимфатической системы: неизвестно — ДВС-синдром.
Со стороны иммунной системы: нечасто — гиперчувствительность или аллергические реакции; неизвестно — анафилактические реакции у пациентов с антителами к факторам свертывания, которые являются компонентами комбинации, анафилактический шок, формирование антител к одному или нескольким факторам свертывания, входящим в протромбиновый комплекс, при заместительной терапии (это проявляется снижением клинического эффекта).
Со стороны нервной системы: часто — головная боль.
Общие реакции: часто — повышение температуры тела.
Противопоказания к применению
Наличие в анамнезе тромбоцитопении, индуцированной применением гепарина; повышенная чувствительность к активным веществам.
При ДВС-синдроме можно применять только после угасания острой фазы заболевания.
Применение при беременности и кормлении грудью
Безопасность применения у женщин при беременности и в период грудного вскармливания не установлена. Применение возможно только в случае доказанной необходимости.
Применение у детей
Препарат противопоказан для применения у детей и подростков в возрасте до 18 лет
Применение у пожилых пациентов
Препарат разрешен для применения у пожилых пациентов
Особые указания
Из-за риска тромбоэмболических осложнений препарат с осторожностью следует применять у пациентов, имеющих в анамнезе ИБС, инфаркт миокарда, заболевания печени, у пациентов во время и после операций, у новорожденных, у пациентов, имеющих повышенный риск развития тромбоэмболических осложнений и ДВС-синдрома или одновременного дефицита ингибиторов свертывания. В этих случаях ожидаемую пользу от применения данного лекарственного средства следует соотносить с возможным риском развития осложнений.
При обширных хирургических вмешательствах необходим точный контроль эффективности заместительной терапии путем анализа отдельных факторов свертывания и/или общей оценки активности протромбинового комплекса.
При необходимости применения данного лекарственного средства следует проконсультироваться со специалистом, имеющим опыт лечения нарушений коагуляции.
У пациентов с приобретенным дефицитом витамин К-зависимых факторов свертывания (например, вызванным применением антагонистов витамина К) применять только при необходимости быстрой коррекции активности протромбинового комплекса, например, при массивном кровотечении или экстренных хирургических вмешательствах. В остальных случаях обычно бывает достаточно снизить дозу антагониста витамина К и/или назначить витамин К.
Пациенты, получающие антагонист витамина К, могут иметь повышенную свертываемость крови как основное заболевание, и введение протромбинового комплекса может усиливать это состояние.
Приостановка лечения антагонистами витамина К сопряжена с риском тромбоэмболических реакций, связанных с основным заболеванием. Поэтому необходимо тщательно рассмотреть как можно более раннее возобновление антикоагуляционного лечения.
При врожденном дефиците любого витамин К-зависимого фактора свертывания следует по возможности применять препарат именно этого фактора.
При применении протромбинового комплекса человека у пациентов с врожденным или приобретенным дефицитом факторов свертывания существует риск тромбоза или развития ДВС-синдрома, особенно при многократном введении препарата. Этот риск может быть повышен при лечении изолированного дефицита фактора свертывания VII, т.к. другие витамин К-зависимые факторы свертывания, имеющие более длительный T1/2, могут накапливаться до уровней, значительно превышающих нормальный. При применении протромбинового комплекса человека следует тщательно контролировать у пациента появление симптомов ДВС-синдрома или тромбоза.
Пациентам с ДВС-синдромом может в некоторых случаях потребоваться восполнение факторов свертывания, входящих в протромбиновый комплекс. Такое лечение, однако, можно проводить только после купирования острой фазы (например, путем лечения основного заболевания или нормализации уровня антитромбина III).
При применении препаратов, содержащих гепарин, возможно развитие вызванной гепарином тромбоцитопении 2 типа (ГТ-2). Характерными признаками ГТ являются падение содержания тромбоцитов на > 50% и/или развитие новых или необъяснимых тромбоэмболических осложнений при применении гепарина. Обычно такие явления появляются через 4-14 дней после начала применения гепарина, но могут развиваться и в течение 10 ч (у пациентов, получавших гепарин в предыдущие 100 дней).
При применении препаратов, содержащих фактор свертывания крови IX, зарегистрированы единичные случаи развития нефротического синдрома после попытки проведения индукции иммунной толерантности к фактору свертывания крови IX у пациентов с ингибиторной формой гемофилии В и.аллергической реакцией в анамнезе.
Следует учитывать, что при применении препаратов, полученных из крови или плазмы человека, нельзя полностью исключить возможность передачи возбудителей инфекционных заболеваний. Это положение также применимо в отношении неизвестных или недавно открытых вирусов и других инфекционных агентов. Предпринимаемые меры считаются эффективными для вирусов, имеющих оболочку, таких как вирус иммунодефицита человека, вирусы гепатита В и С, а также для безоболочечных вирусов, таких как вирус гепатита А и парвовирус В19.
Пациентам, регулярно или повторно получающим препараты протромбинового комплекса, произведенные из плазмы человека, следует рассмотреть возможность проведения вакцинации против гепатитов А и В.
Использование в педиатрии
Безопасность и эффективность применения у детей и подростков не исследовалась.
Лекарственное взаимодействие
Препарат протромбинового комплекса человека нейтрализует действие антагонистов витамина К, но взаимодействие с другими лекарственными препаратами неизвестно.
При проведении чувствительного к наличию гепарина анализа свертываемости крови у пациентов, получающих высокие дозы протромбинового комплекса человека, следует учитывать наличие гепарина в применяемом препарате.
Не следует смешивать с другими лекарственными препаратами и растворителями.

