Фармакологическое действие
Человеческое моноклональное антитело, специфически связывающее рецептор программируемой клеточной смерти PD-1 и блокирующее его взаимодействие с лигандами PD-L1 и PD-L2. Пролголимаб является иммуноглобулином изотипа IgG1 гибрид лямбда-каппа с молекулярной массой около 149 кДа. Fc-фрагмент пролголимаба модифицирован с целью предотвращения цитотоксического действия на клетки-мишени, экспрессирующие PD-1. В результате ингибирования связывания рецептора PD-1 с его лигандами пролголимаб реактивирует опухоль-специфичные цитотоксические Т-лимфоциты и, таким образом, реактивирует противоопухолевый иммунитет.
Фармакокинетика
Вводят в/в, поэтому пролголимаб немедленно и полностью становится биодоступным. После первого введения Cmax в режиме дозирования 1 мг/кг каждые 2 недели, в среднем, составляла 35078 нг/мл, AUC0-336ч — 5306962 нг/мл. Перед вторым введением Cmin в режиме дозирования 1 мг/кг каждые 2 недели, в среднем, составляла 9011 нг/мл. После первого введения Cmax в режиме дозирования 3 мг/кг каждые 3 недели, в среднем, составляла 82924 нг/мл. AUC0-504ч — 14952949 нг/мл. Перед вторым введением Cmin в режиме дозирования 3 мг/кг каждые 3 недели, в среднем, составляла 24411 нг/мл. При многократном введении пролголимаба как в дозе 1 мг/кг, так и в дозе 3 мг/кг Cmin не снижаются.
В соответствии с ограниченным внесосудистым распределением Vd пролголимаба в равновесном состоянии незначительный (примерно 3.9 л; коэффициент вариации 88%). Как и другие антитела, пролголимаб не связывается с белками плазмы специфичным путем. Пролголимаб подвергается катаболизму неспецифичными путями, метаболизм препарата не отражается на его клиренсе. Системный клиренс пролголимаба составляет примерно 0.5 л/сут (коэффициент вариации 67%); конечный Т1/2 составляет примерно 14 дней (коэффициент вариации 96%). Характеристики выведения пролголимаба не имеют признаков дозозависимости и являются типичными для препаратов на основе моноклональных антител.
Показания активного вещества
ПРОЛГОЛИМАБ
Лечение взрослых пациентов с неоперабельной или метастатической меланомой.
Режим дозирования
Вводят в/в в виде инфузии. Рекомендуемая доза составляет 1 мг/кг каждые 2 недели. Лечение проводят до прогрессирования заболевания или развития непереносимой токсичности.
Побочное действие
Наиболее часто встречающимися, связанными с проводимой терапией, нежелательными реакциями были отклонения показателей в общем анализе крови (лимфопения, анемия), нарушения со стороны щитовидной железы (гипотиреоз или гипертиреоз, тиреоидит) и кожи (сыпь, зуд).
Со стороны системы кроветворения: часто — анемия, лимфопения, нейтропения, лимфоцитоз, тромбоцитопения;
Инфекционные и паразитарные заболевания: нечасто — пневмония.
Со стороны эндокринной системы: очень часто — тиреоидит; часто — гипертиреоз, гипотиреоз, повышение уровня ТТГ; нечасто — снижение уровня ТТГ.
Со стороны нервной системы: нечасто — снижение памяти, головная боль.
Со стороны органов зрения: нечасто — увеит.
Со стороны сердечно-сосудистой системы: часто — повышение АД; нечасто — тахикардия, нарушение сердечного ритма, кровотечение из опухолевого узла.
Со стороны дыхательной системы: часто — пневмонит.
Со стороны пищеварительной системы: нечасто — снижение аппетита, тошнота, сухость во рту.
Со стороны кожи и подкожно-жировой клетчатки: часто — сыпь, зуд.
Со стороны костно-мышечной системы: нечасто — миалгия, миозит.
Прочие: часто — слабость, лихорадка; нечасто — отек, озноб, субфебрилитет, потливость, гриппоподобный синдром.
Со стороны обмена веществ: нечасто — гипергликемия.
Данные лабораторных и инструментальных исследований: часто — повышение активности ЩФ; нечасто — повышение активности ACT.
Противопоказания к применению
Повышенная чувствительность к пролголимабу; почечная недостаточность; печеночная недостаточность; беременность, период грудного вскармливания; возраст до 18 лет.
С осторожностью: тяжелые аутоиммунные заболевания в активной стадии, при которых дальнейшая активация иммунной системы может представлять потенциальную угрозу жизни.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период грудного вскармливания.
Применение при нарушениях функции печени
Противопоказано применение при печеночной недостаточности.
Применение при нарушениях функции почек
Противопоказано применение при почечной недостаточности.
Применение у детей
Противопоказано применение в возрасте до 18 лет.
Применение у пожилых пациентов
Коррекция дозы у пациентов пожилого возраста не требуется.
Особые указания
У пациентов, получавших пролголимаб, отмечались иммуноопосредованные нежелательные реакции. Большинство иммуноопосредованных нежелательных реакций, наблюдавшихся в клинических исследованиях, были обратимы и контролировались посредством временной отменой пролголимаба, применением ГКС и/или симптоматической терапией. Иммуноопосредованные нежелательные реакции, затрагивающие более одной системы организма, могут развиваться одновременно. При подозрении на иммуноопосредованные нежелательные реакции требуется провести тщательную оценку с целью подтвердить этиологию и исключить другие возможные причины.
У пациентов, получавших пролголимаб, сообщалось о случаях развития пневмонита. Необходимо проводить активное наблюдение за пациентами в отношении признаков и симптомов пневмонита. При подозрении на пневмонит необходимо провести рентгенологическое исследование для исключения других причин. Терапию ГКС назначают при пневмоните 2 степени тяжести или выше. Временно отменяют пролголимаб при пневмоните 2 (умеренной) степени тяжести и полностью отменяют — при 3 (тяжелой) или 4 (жизнеугрожающей) степени тяжести пневмонита или рецидиве пневмонита 2 (умеренной) степени тяжести.
Известно о случаях развития колита при применении других препаратов моноклональных антител против PD-1. Учитывая схожий механизм действия, возможно развитие данной нежелательной реакции при применении пролголимаба. Необходимо проводить активное наблюдение за пациентами в отношении признаков и симптомов колита и исключить другие причины его развития. Терапию ГКС назначают при 2 степени тяжести или выше. Временно отменяют пролголимаб при 2 (умеренной) или 3 (тяжелой) степени тяжести колита и полностью отменяют — при колите 4 (жизнеугрожающей) степени тяжести.
Известно о случаях развития гепатита при применении других препаратов моноклональных антител против PD-1. Учитывая схожий механизм действия, возможно развитие данной нежелательной реакции при применении пролголимаба. Необходимо проводить наблюдение за пациентами в отношении динамики функциональных показателей печени (в начале лечения, периодически на протяжении терапии, а также на основании клинической оценки) и симптомов гепатита и исключить другие причины. Терапию ГКС назначают при гепатите 2 степени тяжести и при гепатите 3 степени тяжести или выше. Временно или полностью отменяют пролголимаб в соответствии с уровнем повышения активности ферментов печени.
Сообщалось о случаях развития нефрита при применении других препаратов моноклональных антител против PD-1. Учитывая схожий механизм действия, возможно развитие данной нежелательной реакции при применении пролголимаба. Необходимо проводить наблюдение за пациентами в отношении изменения функции почек и исключить другие причины. Терапию ГКС назначают при развитии нежелательных явлений 2 степени тяжести и выше. Временно отменяют пролголимаб в случае развития 2 (умеренной) степени тяжести нефрита и полностью отменяют — при 3 (тяжелой) или 4 (жизнеугрожающей) степени тяжести нефрита.
Известно о случаях развития гипофизита при применении других препаратов моноклональных антител против PD-1. Учитывая схожий механизм действия, возможно развитие данной нежелательной реакции при применении пролголимаба. Необходимо проводить наблюдение за пациентами в отношении признаков и симптомов гипофизита (включая гипопитуитаризм и вторичную надпочечниковую недостаточность) и исключить другие причины. В случае проявления вторичной надпочечниковой недостаточности назначают терапию ГКС или другую заместительную гормональную терапию в соответствии с клинической оценкой. Временно отменяют прием пролголимаба в случае 2 (умеренной) степени тяжести гипофизита, полностью отменяют пролголимаб при 3 (тяжелой) или 4 (жизнеугрожающей) степени тяжести гипофизита.
Сообщалось о случаях развития сахарного диабета 1 типа, включая случаи развития диабетического кетоацидоза, при применении других препаратов моноклональных антител против PD-1. Учитывая схожий механизм действия, возможно развитие данной нежелательной реакции при применении пролголимаба. Необходимо проводить наблюдение за пациентами в отношении гипергликемии или других признаков и симптомов сахарного диабета. При сахарном диабете 1 типа назначают инсулин, а в случаях тяжелой гипергликемии прием пролголимаба временно отменяют до достижения контроля метаболизма.
У пациентов, получавших пролголимаб, сообщалось о нарушениях со стороны щитовидной железы, они могут развиться в любой момент времени на протяжении лечения. Требуется наблюдение за пациентами в отношении изменения функции щитовидной железы (в начале лечения, периодически на протяжении терапии, а также на основании клинической оценки) и клинических признаков и симптомов нарушений функции щитовидной железы. Лечение гипотиреоза может осуществляться посредством заместительной терапии без прерывания лечения и без применения ГКС. При гипертиреозе возможно симптоматическое лечение. Временно или полностью отменяют пролголимаб при 3 (тяжелой) или 4 (жизнеугрожающей) степени тяжести гипертиреоза. У пациентов с 3 (тяжелой) или 4 (жизнеугрожающей) степенью тяжести эндокринопатии при улучшении до 2 степени тяжести или ниже и контроле посредством заместительной гормонотерапии может рассматриваться продолжение применения пролголимаба.
У пациентов, получавших пролголимаб, отмечались тяжелые формы сыпи и зуда. Применение пролголимаба следует приостановить при кожных реакциях 3 степени тяжести и отменить без восстановления при 4 степени тяжести. При кожных реакциях тяжелой степени назначается лечение ГКС с последующим постепенным уменьшением дозы. Пролголимаб следует назначать с осторожностью у пациентов, у которых ранее отмечались тяжелые или жизнеугрожающие нежелательные кожные реакции при лечении иными иммуностимулирующими противоопухолевыми препаратами.
Известно о случаях развития тяжелых инфузионных реакций при применении других препаратов моноклональных антител против PD-1. Учитывая схожий механизм действия, возможно развитие данной нежелательной реакции при применении пролголимаба. При инфузионной реакции тяжелой степени необходимо прервать инфузию и полностью прекратить прием пролголимаба. У пациентов с легкой или умеренной степенью тяжести инфузионных реакций может рассматриваться возможность продолжения приема пролголимаба под тщательным наблюдением врача-онколога при проведении премедикации в соответствии со стандартами профилактики инфузионных реакций.
Влияние на способность к управлению транспортными средствами и механизмами
Пролголимаб может оказывать незначительное влияние на способность управлять автомобилем и работать с механизмами. Сообщалось об утомляемости после введения пролголимаба.
Лекарственное взаимодействие
Следует избегать назначения ГКС для системного применения или иммунодепрессантов до начала терапии в связи с возможным влиянием этих средств на фармакодинамическую активность и эффективность пролголимаба. Тем не менее, ГКС для системного применения или другие иммунодепрессанты можно использовать после начала лечения пролголимабом для терапии иммуноопосредованных нежелательных реакций.
Фортека — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-006173
Торговое наименование:
ФОРТЕКА®
Международное непатентованное наименование или группировочное наименование:
пролголимаб
Лекарственная форма:
концентрат для приготовления раствора для инфузий
Состав
1 мл концентрата содержит:
действующее вещество: пролголимаб – 20 мг:
вспомогательные вещества: натрия ацетата тригидрат – 1,742 мг, трегалозы дигидрат – 100 мг, кислота уксусная ледяная до pH 5,0, вода для инъекций до 1,0 мл.
Описание
Прозрачная или слегка опалесцирующая жидкость от бесцветного до светло-желтого цвета.
Фармакотерапевтическая группа
Противоопухолевое средство – антитела моноклональные.
Код АТХ:
L01ХС
Фармакологические свойства
Пролголимаб представляет собой человеческое моноклональное антитело, специфически связывающее рецептор программируемой клеточной смерти PD-1 и блокирующее его взаимодействие с лигандами PD-L1 и PD-L2. Пролголимаб является иммуноглобулином изотипа IgG1 гибрид лямбда-каппа с молекулярной массой около 149 кДа. Fc-фрагмент пролголимаба модифицирован с целью предотвращения цитотоксического действия на клетки-мишени, экспрессирующие PD-1.
Фармакодинамика
PD-1 – это белковый рецептор – контрольная точка иммунного ответа, который ограничивает активность Т-лимфоцитов. Опухолевые клетки могут использовать сигнальный путь PD-1 для ингибирования Т-клеточного иммунного ответа. Пролголимаб представляет собой высокоаффинное антитело к PD-1 рецептору, при ингибировании которого осуществляется двойная блокада сигнального пути PD-1, включающего лиганды PD-L1 и PD-L2 на опухолевых или иммунных клетках. В результате ингибирования связывания рецептора PD-1 с его лигандами пролголимаб реактивирует опухоль-специфичные цитотоксические Т-лимфоциты и, таким образом, реактивирует противоопухолевый иммунитет.
Фармакокинетика
Фармакокинетику пролголимаба изучали в клиническом исследовании MIRACULUM у пациентов с метастатической или неоперабельной меланомой, получавших препарат в дозировках 1 мг/кг каждые 2 недели или 3 мг/кг каждые 3 недели.
Всасывание
Препарат Фортека® вводится внутривенно, поэтому пролголимаб немедленно и полностью становится биодоступным.
Распределение
В соответствии с ограниченным внесосудистым распределением, объем распределения пролголимаба в равновесном состоянии незначительный (примерно 3,9 л; коэффициент вариации (CV): 88%). Как и другие антитела, пролголимаб не связывается с белками плазмы специфичным путем.
Метаболизм
Пролголимаб подвергается катаболизму неспецифичными путями, метаболизм препарата не отражается на его клиренсе.
Выведение
Системный клиренс пролголимаба составляет примерно 0,5 л/сутки (CV: 67%); конечный период полувыведения (Т1/2) составляет примерно 14 дней (CV: 96%).
Характеристики выведения пролголимаба не имеют признаков дозозависимости и являются типичными для препаратов на основе моноклональных антител. Минимальные концентрации (Cmin) препарата как в дозе 1 мг/кг, так и в дозе 3 мг/кг на протяжении многократных введений препарат а не снижаются.
После первого введения максимальная концентрация препарата (Сmax) в режиме дозирования 1 мг/кг каждые 2 недели, в среднем, составляла 35078 нг/мл, площадь под кривой (AUC0-336ч) – 5306962 нг/мл. Перед вторым введением минимальная концентрация препарата (Cmin) в режиме дозирования 1 мг/кг каждые 2 недели, в среднем, составляла 9011 нг/мл.
После первого введения максимальная концентрация препарата (Сmax) в режиме дозирования 3 мг/кг каждые 3 недели, в среднем, составляла 82924 нг/мл, площадь под кривой (AUC0-504ч) – 14952949 нг/мл. Перед вторым введением минимальная концентрация препарата (Cmin) в режиме дозирования 3 мг/кг каждые 3 недели, в среднем, составляла 24411 нг/мл.
Показания к применению
Меланома
Препарат Фортека® показан для лечения взрослых пациентов с неоперабельной или метастатической меланомой.
Противопоказания
- Повышенная чувствительность к любому компоненту препарата.
- Возраст до 18 лет (в связи с отсутствием данных по эффективности и безопасности).
- Беременность и период грудного вскармливания.
- Почечная недостаточность.
- Печеночная недостаточность.
С осторожностью
- Тяжелые аутоиммунные заболевания в активной стадии, при которых дальнейшая активация иммунной системы может представлять потенциальную угрозу жизни.
Применение при беременности и в период грудного вскармливания
Беременность
Данные о применении препарата Фортека® у беременных женщин отсутствуют. Специальные исследования по изучению влияния препарата Фортека® на репродуктивную функцию у животных не проводились, тем не менее, в моделях беременности мышей было показано, что блокада сигнальной системы PD-L1 приводит к снижению толерантности матери к плоду и повышению угрозы гибели плода. Эти результаты указывают на возможный риск (на основании механизма действия) негативного воздействия на плод, включая повышение частоты выкидышей или мертворождений, при применении пролголимаба во время беременности. Известно, что человеческий IgG1 (иммуноглобулин) проходит через плацентарный барьер, следовательно, пролголимаб может проникать через плаценту от матери к плоду. Женщины детородного возраста должны использовать надежные методы контрацепции во время лечения пролголимабом и в течение не менее 3 месяцев после введения последней инфузии пролголимаба.
Период грудного вскармливания
Нет данных о секреции пролголимаба в грудное молоко. Препарат Фортека® противопоказан в период грудного вскармливания.
Влияние на фертильность
Клинические данные о возможном влиянии препарата Фортека® на репродуктивную функцию отсутствуют. Несмотря на то, что отдельные исследования токсического действия пролголимаба на репродуктивную функцию и внутриутробное развитие не проводились, заметного влияния препаратов моноклональных антител против PD-1 на репродуктивные органы самцов и самок обезьян в одномесячном и шестимесячном исследованиях токсичности при многократном введении выявлено не было.
Способ применении и дозы
Лечение следует начинать и проводить под контролем квалифицированных и опытных врачей-онкологов.
Препарат Фортека® следует вводить внутривенно (в/в) в виде инфузии длительностью 60 минут, при хорошей переносимости длительность инфузии может быть сокращена до 30 минут.
Рекомендованная доза препарата Фортека® составляет:
- 1 мг/кг каждые 2 недели для пациентов с неоперабельной или метастатической меланомой
Лечение препаратом Фортека® должно проводиться до прогрессирования заболевания или развития непереносимой токсичности. Наблюдались атипичные ответы (т.е. первоначальное кратковременное увеличение размера опухоли или небольшие новые очаги в течение первых нескольких месяцев с последующим уменьшением размера опухоли). Рекомендуется продолжать лечение клинически стабильных пациентов с начальными признаками прогрессирования заболевания до момента подтверждения прогрессирования заболевания.
Временная или полная отмена лечения
Рекомендации по временной или полной отмене лечения препаратом пролголимаб описаны далее (см. также «Особые указания»).
Таблица 1. Рекомендации по модификации введения препарата Фортека®
| Нежелательная реакция | Степень тяжести по NCI СТСАЕ 4.03 | Модификация введения |
| Иммуно-опосредованный пневмонит | 2 степень тяжести пневмонита | Прекратить прием препарата до исчезновения симптомов, положительной рентгенологической динамики и купирования нежелательных реакций глюкокортикостероидами |
| • 3 или 4 степени тяжести пневмонита • рецидивирующий пневмонит 2 степени тяжести |
Отмена препарата без возобновления | |
| Иммуно-опосредованный колит | 2 или 3 степень тяжести диареи или колита | Прекратить прием препарата до исчезновения симптомов и купирования нежелательных реакций глюкокортикостероидами |
| 4 степень тяжести диареи или колита | Отмена препарат без возобновления | |
| Иммуно-опосредованный гепатит | • увеличение активности ACT или АЛТ до 2 степени (от 3 до 5 раз выше ВГН) • увеличение концентрации общего билирубина до 2 степени (от 1,5 до 3 раз выше ВГН) |
Прекратить прием препарата до возвращения лабораторных показателей к исходному уровню и купирования нежелательных реакций глюкокортикостероидами |
| • увеличение активности ACT или АЛТ≥ 3 степени (> 5 раз выше ВГН) или концентрации ОБ (> 3 раз выше ВГН) • у пациентов с метастазами в печень, начавших лечение с умеренной (2) степенью повышения АЛТ или ACT, если повышение АЛТ или ACT > 50% относительно исходных значений сохраняется более 1 недели |
Отмена препарата без возобновления | |
| Иммуно-опосредованные нефрит и почечная дисфункция | 2 степень тяжести повышения уровня креатинина (креатинин сыворотки >1,5 до ≤3 раз превышает ВГН) | Прекратить прием препарата до возвращения уровня креатинина к исходному уровню и купирования нежелательных реакций глюко¬кортикостероидами |
| ≥3 степень тяжести повышения уровня креатинина (креатинин сыворотки > 3 раз превышает ВГН) | Отмена препарата без возобновления | |
| Иммуно-опосредованная эндокринопатия | • Симптоматические гипотиреоз, гипертиреоз, гипофизит 2 или 3 степени • Недостаточность коры надпочечников 2 степени • Сахарный диабет с гипергликемией 3 степени |
Прекратить прием препарата до исчезновения симптомов и купирования нежелательных реакций глюкокортикостероидами (в случае необходимости снятия симптомов острого воспаления). Прием препарата должен быть продолжен в случае проведения гормонозаместительной терапии вплоть до тех пор, пока есть симптомы |
| • Гипотиреоз, гипертиреоз, гипофизит 4 степени тяжести • Недостаточность коры надпочечников 3 или 4 степени тяжести • Сахарный диабет с гипергликемией 4 степени тяжести (уровень глюкозы >250 мг/дл или >13,9 ммоль/л) или с кетоацидозом |
Отмена препарата без возобновления | |
| Иммуно-опосредованная сыпь | Сыпь 3 степени тяжести | Прекратить прием препарата до исчезновения симптомов и купирования нежелательных реакций глюкокортикостероидами |
| Сыпь 4 степени тяжести или подтвержденный синдром Стивенса-Джонса или токсический эпидермальный некролиз | Отмена препарата без возобновления | |
| Инфузионные реакции | Реакции 3-4 степени тяжести | Отмена препарата без возобновления |
| Прочие иммуно-опосредованные нежелательные реакции | 3 степень тяжести (впервые возникшая) | Прекратить прием препарата до исчезновения симптомов и купирования нежелательных реакций глюкокортикостероидами |
| • 4 степень тяжести • Повторяющаяся 3-я степень тяжести • Иммуно-ассоциированный энцефалит • Миокардит 3 степени тяжести • 2 или 3 степень тяжести при сохранении реакций несмотря на приостановку лечения или при невозможности снизить суточную дозу глюкокортикостероидов до эквивалентной 10 мг преднизолона. |
Отмена препарата без возобновления |
Примечание: степень токсичности соответствует классификации Национального онкологического института США (NCI-CTCAЕ, версия 4).
Особые группы пациентов
Пожилые пациенты (≥65 лет)
Не сообщалось о различиях в безопасности или эффективности между пожилыми пациентами (≥65 лет) и более молодыми пациентами (<65 лет). Коррекция дозы у пациентов пожилого возраста не требуется.
Пациенты с нарушением функции почек
Лечение препаратом Фортека® у пациентов с почечной недостаточностью не изучалось.
Пациенты с нарушением функции печени
Лечение препаратом Фортека® у пациентов с печеночной недостаточностью не изучалось.
Меланома глаза
Не сообщалось о различиях в безопасности или эффективности у пациентов с меланомой глаза.
Дети
Эффективность и безопасность препарата Фортека® у детей младше 18 лет не установлена. Данные отсутствуют.
Приготовление и введение
Подготовка препарата к введению должна проводиться в асептических условиях.
Перед введением концентрат во флаконе следует проверить (визуально) на предмет отсутствия механических примесей и изменения окраски.
Препарат Фортека® используют после разведения. Для этого необходимое количество препарата из флакона переносят в ёмкость для инфузий, содержащую стерильный 0,9% раствор натрия хлорида или стерильный 5% раствор декстрозы. Концентрация препарата Фортека® в приготовленном растворе должна составлять от 0,5 до 10 мг/мл. Приготовленный раствор перемешивают путем осторожного переворачивания емкости для инфузий во избежание пенообразования. Препарат Фортека® не содержит консерванты. Приготовленный инфузионный раствор необходимо использовать немедленно.
Препарат не должен вводиться параллельно с другими растворами и препаратами. Если перед введением препарата пациенту проводилась другая инфузия, для введения препарата Фортека® должна быть приготовлена отдельная инфузионная система.
Начальную дозу препарата вводят в течение 60 минут в виде внутривенной инфузии. Если первая инфузия хорошо переносится, то вторую и все последующие инфузии можно проводить в течение 30 минут.
Побочное действие
Безопасность препарата Фортека® изучалась у 126 пациентов в клиническом исследовании MIRACULUM. Период наблюдения составил ≥6 месяцев. Ни у одного из пациентов в течение первых 6 месяцев терапии препаратом Фортека® не было произведено отмены терапии, обусловленной развитием у пациента иммуноопосредованных нежелательных реакций, связанных с лечением. У пациентов, получавших препарат Фортека®, отсутствовали серьезные нежелательные реакции (СНР). Наиболее часто встречающимися, связанными с проводимой терапией, нежелательными реакциями были отклонения показателей в общем анализе крови (лимфопения, анемия и др.), нарушения со стороны щитовидной железы (гипо/гипергиреоз, тиреоидит) и кожи (сыпь, зуд).
Ниже приведены нежелательные реакции, отмечавшиеся у пациентов, получающих терапию препаратом Фортека®. Нежелательные реакции представлены по частоте их регистрации: очень частые (≥10%), частые (≥1%, <10%), нечастые (≥0,1%, <1%), редкие (≥0,01%, <0,1%), очень редкие (≥0,001%, <0,01%).
Нарушения со стороны крови и лимфатической системы
Частые: анемия, лимфопения, нейтропения, лимфоцитоз, тромбоцитопения:
Инфекционные и паразитарные заболевания
Нечастые: пневмония;
Нарушения со стороны эндокринной системы
Очень частые: тиреоидит;
Частые: гипертиреоз, гипотиреоз, повышение уровня ТТГ;
Нечастые: снижение уровня ТТГ;
Нарушения со стороны нервной системы
Нечастые: снижение памяти, головная боль;
Нарушения со стороны органов зрения
Нечастые: увеит;
Нарушения со стороны сердечно-сосудистой системы
Частые: повышение артериального давления;
Нечастые: тахикардия, нарушение сердечного ритма, кровотечение из опухолевого узла;
Нарушения со стороны органов дыхательной системы, грудной клетки и средостения
Частые: пневмонит;
Нарушения со стороны желудочно-кишечного тракта
Нечастые: тошнота, сухость во рту;
Нарушения со стороны кожи и подкожных тканей
Частые: сыпь, зуд;
Нарушения со стороны скелетно-мышечной системы и соединительной ткани
Нечастые: миалгия, миозит;
Общие расстройства и нарушения в месте введения
Частые: слабость, лихорадка;
Нечастые: отек, озноб, субфебрилитет, потливость, гриппоподобный синдром;
Нарушения со стороны обмена веществ и питания (метаболические)
Нечастые: снижение аппетита, гипергликемия;
Лабораторные отклонения
Частые: повышение активности щелочной фосфатазы;
Нечастые: повышение активности ACT.
Ниже приведены нежелательные реакции, которые не отмечались у пациентов, получающих терапию препаратом Фортека®, но отмечались при терапии другими препаратами того же класса, моноклональными антителами против PD-1 – пембролизумабом и ниволумабом. Учитывая одинаковый механизм действия, возможно возникновение описанных нежелательных реакций у пациентов, получающих терапию препаратом Фортека®.
Нарушения со стороны крови и лимфатической системы
Нечастые: эозинофилия;
Нарушения со стороны эндокринной системы
Нечастые: гипофизит, недостаточность функции надпочечников;
Нарушения со стороны нервной системы
Частые: периферическая нейропатия, головокружение;
Редкие: синдром Гийена-Барре, миастенический синдром, энцефалит;
Нарушения со стороны органов зрения
Нечастые: сухость глаз;
Нарушения со стороны сердечно-сосудистой системы
Нечастые: миокардит;
Нарушения со стороны органов дыхательной системы, грудной клетки и средостения
Частые: одышка, кашель;
Нарушения со стороны желудочно-кишечного тракта
Очень частые: диарея;
Частые: колит, стоматит, рвота, боль в животе, запор;
Нечастые: панкреатит;
Нарушения со стороны печени и желчевыводящих путей
Нечастые: гепатит;
Нарушения со стороны иммунной системы
Частые: инфузионные реакции;
Редкие: отторжение трансплантата солидного органа:
Нарушения со стороны кожи и подкожных тканей
Частые: тяжелые кожные реакции, витилиго, сухость кожи, эритема, алопеция:
Нечастые: многоформная эритема, псориаз, дерматит, акнеморфный дерматит, экзема;
Редкие: токсический эпидермальный некролиз1, синдром Стивена-Джонсона1;
Нарушения со стороны скелетно-мышечной системы и соединительной ткани
Частые: артралгия, скелетно-мышечная боль, артрит;
Нарушения со стороны ночек и мочевыводящих путей
Нечастые: нефрит;
Общие расстройства и нарушения в месте введения
Очень частые: утомляемость;
Лабораторные отклонения
Очень частые: повышение активности АЛТ, повышение активности амилазы, гипокальциемия, повышение креатинина, гиперкальциемия:
Примечание
1 – Включая побочные реакции с летальным исходом
Иммуногенность
В клиническом исследовании MIRACULUM пациенты получали лечение препаратом Фортека® в следующих дозировках: 3 мг/кг каждые 3 недели, 1 мг/кг каждые 2 недели. Исследование иммуногенности не выявило образования связывающих антител к препарату Фортека® ни у одного из пациентов.
Передозировка
Информация о передозировке препаратом Фортека® отсутствует. Максимально переносимая доза для препарата Фортека® не установлена. В клинических исследованиях у пациентов, получавших пролголимаб в дозе до 3 мг/кг каждые 3 недели, профиль безопасности был сопоставим с таковым у пациентов, получавших пролголимаб в дозе 1 мг/кг каждые 2 недели. В случае передозировки необходимо проводить тщательный мониторинг пациентов в отношении признаков и симптомов нежелательных реакций и назначить соответствующее симптоматическое лечение.
Взаимодействие с другими лекарственными средствами
Специальных исследований фармакокинетического взаимодействия препарата Фортека® с другими лекарственным и препаратами не проводили. Поскольку Фортека® выводится из кровообращения за счет катаболизма, то не следует ожидать метаболических лекарственных взаимодействий.
Следует избегать применения системных глюкокортикостероидов или иммунодепрессантов до начала терапии препаратом Фортека®, учитывая их возможное влияние на фармакодинамическую активность и эффективность препарата Фортека®. Тем не менее, системные глюкокортикостероиды или другие иммунодепрессанты можно использовать после начала лечения пролголимабом для терапии иммуноопосредованных нежелательных реакций (см. «Особые указания»).
Особые указания
Иммуноопосредованные нежелательные реакции
У пациентов, получавших препарат Фортека®, отмечались иммуноопосредованные нежелательные реакции. Большинство иммуноопосредованных нежелательных реакций, наблюдавшихся в клинических исследованиях, были обратимы и контролировались посредством временной отмены приема препарата Фортека®, применения глюкокортикостероидов и/или симптоматической терапии. Иммуноопосредованные нежелательные реакции, затрагивающие более одной системы организма, могут развиваться одновременно.
При подозрении на иммуноопосредованные нежелательные реакции требуется провести тщательную оценку с целью подтвердить этиологию и исключить другие возможные причины. Основываясь на тяжести нежелательной реакции, необходимо временно отменить прием препарата Фортека® и назначить глюкокортикостероиды (см. ниже). С момента улучшения до 1 степени тяжести или менее начать постепенное уменьшение дозы глюкокортикостероидов и продолжить постепенное снижение в течение, по меньшей мере, 1 месяца. У пациентов, у которых иммуноопосредованные нежелательные реакции не поддаются контролю посредством применения глюкокортикостероидов, может быть рассмотрена возможность назначения других системных иммуносупрессантов.
Возобновление приема препарата Фортека® возможно в случае, если выраженность нежелательной реакции остается 1 степени тяжести или менее после постепенного уменьшения дозы глюкокортикостероидов. При возникновении другого эпизода нежелательной реакции тяжелой степени необходимо полностью прекратить применение препарата Фортека® (см. «Способ применения и дозы» и «Побочное действие»).
Иммуноопосредованный пневмонит
У пациентов, получавших препарат Фортека®, сообщалось о случаях развития пневмонита. Необходимо проводить активное наблюдение за пациентами в отношении признаков и симптомов пневмонита. При подозрении на пневмонит необходимо провести рентгенологическое исследование для исключения других причин. Терапию глюкокортикостероидами назначают при пневмоните 2 степени тяжести или выше (начальная доза 1-2 мг/кг/сутки преднизона (или аналогичная) с последующим постепенным уменьшением дозы). Временно отменяют прием препарата Фортека® при пневмоните 2 (умеренной) степени тяжести и полностью отменяют прием препарата Фортека® при 3 (тяжелой) или 4 (жизнеугрожающей) степени тяжести пневмонита или рецидиве пневмонита 2 (умеренной) степени тяжести (см. «Способ применения и дозы»).
Иммуноопосредованный колит
У пациентов, получавших препарат Фортека®, не сообщалось о случаях развития колита. При этом известно о случаях развития колита при применении других препаратов моноклональных антител против PD-1. Учитывая схожий механизм действия, возможно развитие данной нежелательной реакции при применении препарата Фортека®. Необходимо проводить активное наблюдение за пациентами в отношении признаков и симптомов колита и исключить другие причины его развития. Терапию глюкокортикостероидами назначают при 2 степени тяжести или выше (начальная доза 1-2 мг/кг/сутки преднизона (или аналогичная) с последующим постепенным уменьшением дозы). Временно отменяют прием препарата Фортека® при 2 (умеренной) или 3 (тяжелой) степени тяжести колита и прием препарата Фортека® полностью отменяют при колите 4 (жизнеугрожающей) степени тяжести (см. «Способ применения и дозы»).
Иммуноопосредованный гепатит
У пациентов, получавших препарат Фортека®, не сообщалось о случаях развития гепатита. При этом известно о случаях развития гепатита при применении других препаратов моноклональных антител против PD-1. Учитывая схожий механизм действия, возможно развитие данной нежелательной реакции при применении препарата Фортека®. Необходимо проводить наблюдение за пациентами в отношении динамики функциональных показателей печени (в начале лечения, периодически на протяжении терапии, а также на основании клинической оценки) и симптомов гепатита и исключить другие причины. Терапию глюкокортикостероидами назначают при гепатите 2 степени тяжести (начальная доза 0,5-1 мг/кг/сутки преднизона (или аналогичная) с последующим постепенным уменьшением дозы) и при гепатите 3 степени тяжести или выше (1-2 мг/кг/сутки преднизона или аналога с последующим постепенным уменьшением дозы). Временно или полностью отменяют прием препарат Фортека® в соответствии с уровнем повышения активности ферментов печени (см. «Способ применения и дозы»).
Иммуноопосредованный нефрит
У пациентов, получавших препарат Фортека®, не сообщалось о случаях развития нефрита. При этом известно о случаях развития нефрита при применении других препаратов моноклональных антител против PD-1. Учитывая схожий механизм действия, возможно развитие данной нежелательной реакции при применении препарата Фортека®. Необходимо проводить наблюдение за пациентами в отношении изменения функции почек и исключить другие причины. Терапию глюкокортикостероидами назначают при развитии нежелательных явлений 2 степени тяжести и выше (начальная доза 1-2 мг/кг/сутки преднизона (или аналогичная) с последующим постепенным уменьшением дозы). Временно отменяют прием препарата Фортека® в случае развития 2 (умеренной) степени тяжести нефрита и полностью отменяют прием препарата Фортека® при 3 (тяжелой) или 4 (жизнеугрожающей) степени тяжести нефрита (см. «Способ применения и дозы»).
Иммуноопосредованные эндокринопатии
У пациентов, получавших препарат Фортека®, не сообщалось о случаях развития гипофизита. При этом известно о случаях развития гипофизита при применении других препаратов моноклональных антител против PD-1. Учитывая схожий механизм действия, возможно развитие данной нежелательной реакции при применении препарата Фортека®. Необходимо проводить наблюдение за пациентами в отношении признаков и симптомов гипофизита (включая гипопитуитаризм и вторичную надпочечниковую недостаточность) и исключить другие причины. В случае проявления вторичной надпочечниковой недостаточности назначают терапию глюкокортикостероидами или другую заместительную гормональную терапию в соответствии с клинической оценкой. Временно отменяют прием препарата Фортека® в случае 2 (умеренной) степени тяжести гипофизита, полностью отменяют прием препарат Фортека® при 3 (тяжелой) или 4 (жизнеугрожающей) степени тяжести гипофизита (см. «Способ применения и дозы»).
У пациентов, получавших препарат Фортека®, не сообщалось о случаях развития сахарного диабета 1 типа, включая случаи развития диабетического кетоацидоза. При этом известно о случаях развития сахарного диабета 1 типа, включая случаи развития диабетического кетоацидоза, при применении других препаратов моноклональных антител против PD-1. Учитывая схожий механизм действия, возможно развитие данной нежелательной реакции при применении препарата Фортека®. Необходимо проводить наблюдение за пациентами в отношении гипергликемии или других признаков и симптомов сахарного диабета. При сахарном диабете 1 типа назначают инсулин, а в случаях тяжелой гипергликемии прием препарата Фортека® временно отменяют до достижения контроля над метаболизмом.
У пациентов, получавших препарат Фортека®, сообщалось о нарушениях со стороны щитовидной железы, они могут развиться в любой момент времени на протяжении лечения. Исходя из злого, требуется наблюдение за пациентами в отношении изменения функции щитовидной железы (в начале лечения, периодически на протяжении терапии, а также на основании клинической оценки) и клинических признаков и симптомов нарушений функции щитовидной железы. Лечение гипотиреоза может осуществляться посредством заместительной терапии без прерывания лечения и без применения глюкокортикостероидов. При гипертиреозе возможно симптоматическое лечение. Временно или полностью отменяют прием препарата Фортека® при 3 (тяжелой) или 4 (жизнеугрожающей) степени тяжести гипертиреоза (см. «Способ применения и дозы»). У пациентов с 3 (тяжелой) или 4 (жизнеугрожающей) степенью тяжести эндокринопатий при улучшении до 2 степени тяжести или ниже и контроле посредством заместительной гормонотерапии может рассматриваться продолжение применения препарата Фортека®.
Иммуноопосредованные кожные реакции
У пациентов, получавших препарат Фортека®, отмечались тяжелые формы сыпи и зуда. Применение препарата Фортека® следует приостановить при кожных реакциях 3 степени тяжести и отменить без восстановления при 4 степени тяжести. При кожных реакциях тяжелой степени назначается лечение глюкокортикостероидами в дозе 1-2 мг/кг/сутки преднизона (или аналогичная) с последующим постепенным уменьшением дозы.
Препарат Фортека® следует назначать с осторожностью у пациентов, у которых ранее отмечались тяжелые или жизнеугрожающие нежелательные кожные реакции при лечении иными иммуностимулирующими противоопухолевыми препаратами.
Инфузионные реакции
В рамках клинического исследования MIRACULUM у пациентов с меланомой не сообщалось о развитии тяжелых инфузионных реакций. При этом известно о случаях развития тяжелых инфузионных реакций при применении других препаратов моноклональных антител против PD-1. Учитывая схожий механизм действия, возможно развитие данной нежелательной реакции при применении препарата Фортека®. При инфузионной реакции тяжелой степени необходимо прервать инфузию и полностью прекратить прием препарата Фортека® (см. «Способ применения и дозы»). У пациентов с легкой или умеренной степенью тяжести инфузионных реакций может рассматриваться возможность продолжения приема препарата Фортека® под тщательным наблюдением врача-онколога при проведении премедикации в соответствии со стандартами профилактики инфузионных реакций.
Влияние на способность управлять транспортными средствами, механизмами
Препарат Фортека® может оказывать незначительное влияние на способность управлять автомобилем и работать с механизмами. Сообщалось об утомляемости после введения препарата Фортека® (см. «Побочное действие»)
Форма выпуска
Концентрат для приготовления раствора для инфузий. 20 мг/мл.
По 5,0 мл препарата помещают во флаконы бесцветного нейтрального стекла I гидролитического класса, укупоренные бромбутиловыми резиновыми пробками с фторполимерным покрытием, обжатые алюминиевыми колпачками с пластиковой крышкой типа «flip-off». На каждый флакон наклеивают самоклеящуюся этикетку.
По 1 флакону с препаратом вместе с инструкцией по применению помещают в пачку из картона.
Условия хранения
В защищенном от света месте при температуре от 2 до 8 °С. Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска
Отпускают по рецепту.
Владелец регистрационного удостоверения
ЗАО «БИОКАД», Россия. 198515, г. Санкт-Петербург, Петродворцовый р-н, пос. Стрельна, ул. Связи, д. 34, лит. А.
Производитель
ЗАО «БИОКАД», Россия, 143422, Московская обл.. Красногорский р-н, е. Петрово-Дальнее. Организация, принимающая претензии
ЗАО «БИОКАД», Россия. 198515, г. Санкт-Петербург, Петродворцовый р-н, пос. Стрельна, ул. Связи, д. 34, лит. А.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Меланома кожи – одно из наиболее агрессивных злокачественных новообразований. Подходы к терапии метастатической меланомы кожи динамично развиваются на протяжении последнего десятилетия. В России разработан первый оригинальный PD-1-ингибитор изотипа IgG1 с модифицированным Fc-фрагментом, содержащим LALA-мутацию. Данная статья демонстрирует собственный опыт применения отечественного PD-1-ингибитора пролголимаба в клинической практике.
Введение
Пролголимаб – первый оригинальный PD-1-ингибитор изотипа IgG1 с модифицированным Fc-фрагментом.
В структуре препарата произведена замена двух аминокислот: лейцина на аланин (Leu234Ala/Leu235Ala). Благодаря LALA-мутации пролголимаб не связывается с FcyR-рецепторами макрофагов, что позволяет защищать популяцию активированных Т-лимфоцитов от возможного антителозависимого фагоцитоза макрофагами и тем самым максимизировать противоопухолевый эффект. Уникальный эпитоп связывания пролголимаба обеспечивает высокую насыщенность PD-1-рецепторов в минимальной концентрации [1].
В апреле 2020 г. пролголимаб впервые одобрен и зарегистрирован в РФ в качестве 1-й линии лекарственной терапии метастатической и местнораспространенной меланомы кожи (МК). Одобрение пролголимаба было основано на положительных результатах 2-й фазы открытого рандомизированного исследования MIRACULUM.
MIRACULUM (NCT03269565) – международное многоцентровое открытое рандомизированное исследование эффективности, фармакокинетических свойств, безопасности и иммуногенности препарата пролголимаб в монотерапии пациентов с нерезектабельной или метастатической меланомой. Исследование показало, что полный или частичный ответ наблюдался от 48% пациентов с МК, которые получали пролголимаб в качестве 1-й линии терапии, причем у большинства пациентов ответ на лекарственную терапию сохранялся длительное время. Двухлетняя общая выживаемость составила 57,1%, двухлетняя выживаемость без прогрессирования – 33,3%. Также отмечено, что новый препарат обладает благоприятным профилем безопасности с низкой частотой (12,7%) отмены терапии из-за нежелательных явлений [2].
В большинстве случаев ранняя диагностика онкологических заболеваний увеличивает безрецидивную и общую выживаемость. При местнораспространенных формах МК существует возможность улучшить показатели резектабельности, снизить частоту послеоперационных осложнений и улучшить отдаленные результаты лечения за счет использования предоперационной терапии.
За последние несколько лет значительно вырос научно-практический интерес к неоадъювантной иммунотерапии. Первоначальные результаты клинических исследований неоадъювантной иммунотерапии МК III стадии показали впечатляющие результаты по частоте объективного и патоморфологического ответов. Одно из таких исследований – OpACIN Trial (I фаза): применение комбинированной иммунотерапии в отношении пациентов с местнораспространенными формами МК. Его целью стало определение оптимальной дозировки комбинированной иммунотерапии. Однако высокая частота объективных ответов и низкая частота послеоперационных осложнений показали значительную перспективу данного научно-практического направления, несмотря на малую выборку пациентов [3].
OpACIN-neo (II фаза) – многоцентровое исследование, в котором исследовались пациенты той же когорты, но с уже установленным режимом терапии. После двух введений комбинированной иммунотерапии пациентам выполнялась лимфодиссекция таргетного лимфатического узла с последующей оценкой патоморфологического ответа. Его частота составила 70–80%, причем ни у одного из пациентов с достигнутым ответом рецидива заболевания не возникло [3, 4].
В подобном исследовании II фазы PRADO также проводилась комбинированная неоадъюватная иммунотерапия с последующим оперативным вмешательством. Назначение последующей адьювантной терапии основывалось на патоморфологическом ответе в удаленном лимфоузле. Пациенты с полным патоморфологическим ответом или близким к полному (≤10% жизнеспособных опухолевых клеток) не подвергались дальнейшему хирургическому вмешательству (тотальной лимфодиссекции) и оставались под динамическим наблюдением.
Пациентам с частичным патоморфологическим ответом (от 10 до 50% опухолевых клеток оставались жизнеспособны) выполнялась тотальная лимфодиссекция с последующим назначением адъювантной терапии в зависимости от статуса BRAF-мутации: либо ниволумабом, либо комбинацией BRAF/MEK ингибиторов (дабрафениб+траметиниб).
Во всей популяции исследования патоморфологический ответ на комбинированную иммунотерапию наблюдался у 70 пациентов, включая 60 пациентов с полным или близким к полному патоморфологическому ответу и 10 пациентов с частичным патоморфологическим ответом. При использовании неоадъювантной иммунотерапии удалось избежать выполнения тотальной лимфодиссекции 59 из 99 пациентам. Частота послеоперационных осложнений у пациентов, которым выполнялось только удаление таргетного лимфатического узла после неоадьювантной иммунотерапии, была на 40% ниже по сравнению с группой пациентов с выполненной тотальной лимфаденэктомией [5].
Первоначальные данные исследований II фазы многообещающи, однако необходимо проведение большего числа рандомизированных клинических исследований, способных продемонстрировать преимущество в общей выживаемости, прежде чем использовать неоадъювантный режим терапии в рутинной клинической практике.
В НМИЦ онкологии им. Н.Н. Петрова с сентября 2020 г. проводится проспективное контролируемое моноцентровое открытое нерандомизированное клиническое исследование по изучению эффективности применения отечественного PD-1-ингибитора пролголимаба пациентами с МК III стадии в неоадьювантном режиме. Исследование одобрено Локальным этическим комитетом при ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава РФ. Пациенты с местнораспространенными формами МК III стадии до начала оперативного лечения рассматриваются в качестве кандидатов для участия в данном исследовании.
Критерии включения:
1. Возраст ≥18 лет на время подписания формы информированного согласия.
2. Подписанная форма информированного согласия.
3. Морфологически верифицированный диагноз «меланома кожи».
4. Стадия опухолевого процесса – III (TNM 8-я пересмотренная редакция).
5. Отсутствие в анамнезе ранее проведенной иммунотерапии (анти PD-1-терапии).
6. Оценка по шкале Восточной объединенной онкологической группы (ECOG) 0 или 1.
7. Ожидаемая продолжительность жизни более 3 месяцев.
8. Соответствующая гематологическая функция и функция печени, определяемые с использованием результатов лабораторных исследований, полученных в течение 14 дней от начала включения в исследование.
В качестве неоадъювантой иммунотерапии используется препарат пролголимаб в дозе 1 мг/кг внутривенно капельно с частотой 1 раз в 2 недели. Всего планируется четыре введения препарата. Далее выполняется оперативное вмешательство (при возможности) с последующей оценкой патоморфологического ответа в опухолевом материале. Дальнейшая лечебная тактика – по выбору врача исследователя.
В рамках исследования проводится поиск предиктивных и прогностических иммуноонкологических факторов: оценка уровня циркулирующих опухолевых ДНК до начала терапии и по ее завершении, определение мутационной опухолевой нагрузки, другие иммунологические обследования.Первоначальные результаты исследования планируется опубликовать после анализа данных 20 пациентов, в т.ч. анализа биомаркеров и безрецидивной выживаемости.
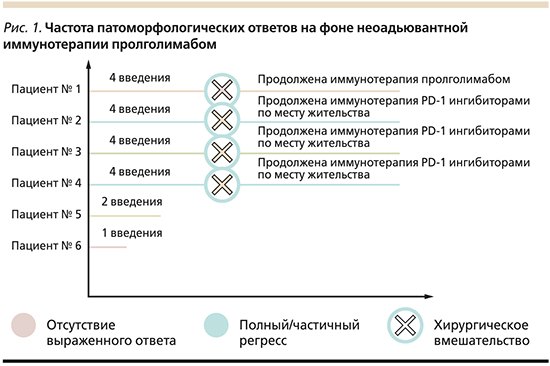
В настоящее время в исследование включены 6 пациентов. Данные о пациентах представлены на рис. 1.
Четырем пациентам проведено четыре введения препарата пролголимаб с последующим циторедуктивным оперативным вмешательством. С учетом выраженного патоморфологического ответа на терапию иммунотерапия одному из четрых пациентов продолжена в прежнем режиме, трое других пациентов направлены в онкологические диспансеры по месту жительства для проведения иммунотерапии стандартными PD-1-ингибиторами. Двум больным начата предоперационная иммунотерапия пролголимабом. По завершении также планируется проведение циторедуктивного оперативного вмешательства. Отмечается удовлетворительная переносимость всеми пациентами без выраженных иммуноопосредованных нежелательных явлений.
Клинический случай
В качестве примера представляется клинический случай пациента 56 лет с клиническим диагнозом «меланома кожи правой голени с метастазами в правом паховом лимфатическом узле и транзитным метастазом в мягких тканях правой голени (р)Т4bN2сM0 (BRAF отр.)».
В июле 2020 г. выполнено иссечение опухоли кожи правой голени с биопсией сигнальных лимфатических узлов правой паховой области. По данным гистологического исследования определена изъязвленная поверхностно-распространяющаяся узловая эпителиоидноклеточная МК со слабой лимфоидной инфильтрацией, небольшим количеством пигмента, высокой митотической активностью (8 митозов на 1 мм2 опухоли). Уровень инвазии по Кларку – V, толщина по Бреслоу – 1,7 см. Края резекции вне опухоли. Метастаз в бедренном лимфоузле – 1,4 см в наибольшем измерении без выхода за пределы капсулы. Наличия мутации в гене BRAF не выявлено.
В августе 2020 г. отмечено появление опухолевого образования на коже правой голени, выявлено поражение паховых лимфатических узлов. Под ультразвуковой навигацией выполнена биопсия образования. По данным гистологического исследования: метастаз эпителиоидноклеточной пигментной меланомы с высокой митотической активностью.
В октябре 2020 г. после подписания информированного согласия начата иммунотерапия пролголимабом в неоадьювантном режиме. Осложнений лечения не отмечено. При контрольном обследовании после четырех введений препарата в декабре 2020 г. выявлены очаги в крестце и левой подвздошной кости. Ретроспективный анализ данных магнитно-резонансной томографии (МРТ) подтвердил наличие очагов в костях ранее – в сентябре 2020 г., однако природа их оставалась сомнительной. Эффект иммунотерапии расценен как стабилизация опухолевого процесса. С учетом наличия очагов в костях и невозможности радикального выполнения оперативного вмешательства принято решение о продолжении лечения. Иммунотерапия продолжена в прежнем режиме.
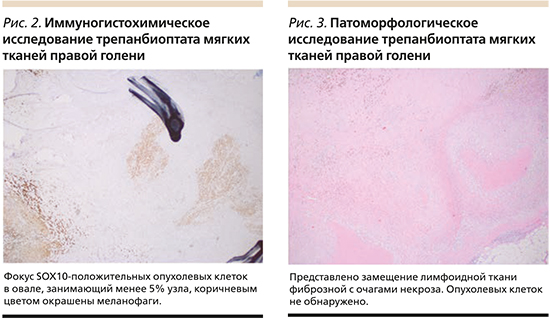
После семи введений пролголимаба выполнена биопсия образования кожи голени с целью оценки патоморфологического ответа. По данным гистологического исследования: выявлено менее 5% живых опухолевых клеток; узел с некрозами и инфильтратом, состоящим из гистиоцитов, меланофагов и пенистых макрофагов (рис. 2). Инфильтрат – 1,3 см в наибольшем измерении, распространяется за пределы капсулы лимфатического узла. Субтотальное замещение предсуществующего метастаза эпителиоидноклеточной меланомы участками некроза, фиброза и скоплениями гистиоцитов показано на рис. 3.
По результатам объективного обследования, включая МРТ органов малого таза, достигнут частичный регресс опухолевого процесса. Иммунотерапия пролголимабом продолжена.
Обсуждение
Наш опыт применения пролголимаба в терапии метастатических форм МК основан на позитивных результатах клинического исследования II фазы MIRACULUM.
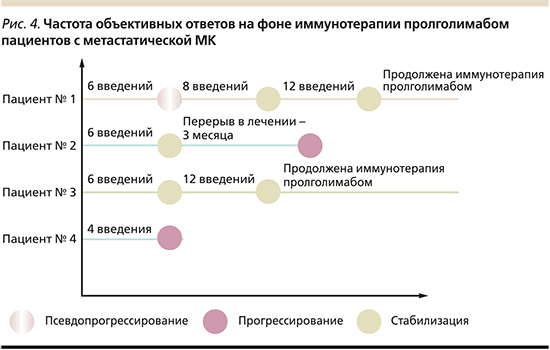
В настоящее время в НМИЦ онкологии им. Н.Н. Петрова проводится терапия метастатических форм МК в рамках пострегистрационного исследования. Данные о пациентах представлены на рис. 4.
Проанализированы результаты лечения четырех пациентов с метастатическими формами МК. Стабилизации процесса удалось достичь троим пациентов, у одного из них зафиксирован один случай псевдопрогрессирования. После достижения стабилизации иммунотерапия пролголимабом одному пациенту была прервана на 3 месяца в связи лечением новой коронавирусной инфекции. К сожалению, в последующем у пациента при обследовании выявлено прогрессирование опухолевого процесса. У одного из четырех пациентов объективного ответа по данным радиологического обследования достигнуто не было и дальнейшего лечения не проводилось в связи с прогрессированием заболевания. В настоящее время иммунотерапию пролголимабом по поводу метастатической МК продолжают получать два пациента. Длительность терапии составляет более 6 месяцев при удовлетворительной переносимости и отсутствии серьезных нежелательных явлений.
Согласно результатам проведенных клинических исследований, эффективность неоадьювантной иммунотерапии значительно превосходит таковую терапии метастатических форм МК. Это может быть связано с более высокой ролью контрольной точки PD-1 у пациентов с локальными формами заболевания, поскольку на более поздних этапах развития опухолевого процесса все большее число различных факторов онкогенеза значительно влияет на резистентность опухоли к терапии. Кроме того, по данным многих исследователей, неоадьювантная иммунотерапия повышает число опухоль специфичных CD8 T-клеток как в периферической крови, так и в других органах, причем они определяются по прошествии 170 дней от завершения терапии. При проведении адьювантной терапии таких результатов получено не было, что может свидетельствовать о позитивном влиянии наличия большого пула опухолевых клеток на выработку иммунного ответа при проведении иммунотерапии [6].
Немаловажным фактом является низкий уровень Т-клеток после лечения пациентов с ранним прогрессированием, как и низкий уровень PD-L1-экспрессии, что также может свидетельствовать о большей роли контрольных точек в неоадьювантном лечении [7].
Результаты, полученные в исследованиях PRADO и OPAcinNeo, также свидетельствуют о том, что наибольшую пользу от проведения иммунотерапии получают пациенты с высоким уровнем PD-L1-экспрессии и высокой мутационной нагрузкой. Данные биомаркеры могут обладать высокой предиктивной значимостью в перспективе, однако они требуют дальнейшего изучения.
Заключение
Опыт применения пролголимаба в реальной клинической практике незначительно отличается от результатов регистрационного клинического исследования. Пролголимаб показал хорошие результаты в лечении больных МК, управляемый профиль токсичности и ее низкую частоту.
Роль неоадьювантной иммунотерапии в мире неуклонно возрастает. Она улучшает отдаленные результаты лечения, позитивно влияет на общую выживаемость больных МК, что подтверждено результатами рандомизированных клинических исследований.
Несмотря на малую группу пациентов, включенных в исследование, уже сейчас можно сказать о позитивном опыте применения пролголимаба в неоадъювантной терапии больных местнораспространенной МК. В будущем нами будет представлен анализ большей группы больных с оценкой влияния данной терапии на общую и безрецидивную выживаемость, а также анализ предиктивных и прогностических биомаркеров.
Автор для связи: Д.О. Юрлов, врач-онколог, аспирант научного отдела инновационных методов терапевтической онкологии и реабилитации, НМИЦ онкологии им. Н.Н. Петрова, Санкт-Петербург, Россия
Адрес: 197758, Россия, Санкт-Петербург, пос. Песочный, ул. Ленинградская, 68
Состав
1 шприц (1 мл) включает 60 мг деносумаба.
Дополнительно: 47 мг сорбитола, 0.1 мг полисорбата 20, 1 мг ледяной уксусной кислоты, до 1 мл воды д/ин, до рН 5.0-5.5 гидроксида натрия.
Форма выпуска
Пролиа выпускается в форме инъекционного раствора для п/к (подкожного) введения, в шприцах по 1мл №1 во вторичной упаковке.
Фармакологическое действие
Ингибирующее (угнетающее) костную резорбцию.
Фармакодинамика и фармакокинетика
Активный ингредиент препарата Пролиа – деносумаб – полностью является моноклональным антителом человека и принадлежит к иммуноглобулиновому подклассу IgG2. Данное вещество характеризуется высокой специфичностью и сродством к рецепторному лиганду κВ (RANKL) – активатору нуклеарного фактора и, связываясь с ним, блокирует активизацию единственного находящегося на поверхности остеокластов, а также их предшественников RANK-рецептора – активатора нуклеарного фактора κВ (RANK). Вследствие этого, взаимодействия RANKL/RANK не происходит, что приводит к подавлению образования, активизации и продолжительности функционирования остеокластов и в свою очередь снижает костную резорбцию (разрушение), а также увеличивает прочность и массу трабекулярного и кортикального слоев кости.
При подкожном (п/к) введении 60 мг деносумаба наблюдалось быстрое снижение плазменных концентраций 1С-телопептида (СТХ), являющегося маркером резорбции костной ткани, примерно на 70% на протяжении 6-ти часов после инъекции и на 85% в течение следующих 3-х суток. Стабильно пониженный уровень СТХ сохранялся на протяжении полугода. При снижении плазменной концентрации деносумаба скорость понижения сывороточного содержания СТХ в некоторой степени уменьшалась, что свидетельствует об обратимости воздействия деносумаба на костное ремоделирование. Такие эффекты отмечались в течение всего терапевтического курса.
В процессе ремоделирования костной ткани в соответствии с физиологической взаимосвязью между ее образованием и резорбцией, после первой инъекции деносумаба в течение первого месяца отмечалось снижение количества маркеров костного образования (например, P1NP и костноспецифической ЩФ). Маркеры костного ремоделирования (образования кости и ее резорбции) обычно приходили к уровню, наблюдаемому до начала терапии, по прошествии не более 9-ти месяцев после введения последней дозы деносумаба. При возобновлении введения деносумаба уровень снижения СТХ соответствовал таковому в начале лечебного курса.
В проведенных исследованиях замены терапии с приема алендроновой кислоты (продолжительность лечения в среднем – 3 года) на введение деносумаба, проходившие с привлечением женщин с малой костной массой в постменопаузе доказали дополнительное уменьшение сывороточного уровня СТХ при применении деносумаба в сравнении с приемом алендроновой кислоты. При этом плазменные концентрации кальция в обеих исследуемых группах были аналогичными.
Также при проведении данных исследований, подавление взаимодействия RANK/RANKL параллельно со связыванием Fc-фрагмента (OPG-Fc) с остеопротегерином приводило к торможению костного роста и замедлению прорезывания зубов. Вследствие этого применение деносумаба у детей может негативно влиять на прорезывание зубов и развитие костей, обладающих открытыми ростовыми зонами.
В связи с тем, что деносумаб является человеческим моноклональным антителом, его применение, как и прочих препаратов белковой природы, теоретически может привести к иммуногенности. Используя иммунологический анализ в сочетании с методом чувствительной электрохемилюминесценции, были произведены обследования более 13000 больных на предмет формирования у них связывающих антител. Менее чем в 1% случаев применение деносумаба на протяжении 5-ти лет приводило к определению антител (включая растущие, транзиторные и существовавшие ранее). Серопозитивные пациенты в дальнейшем прошли обследования с целью выявления нейтрализующих антител. В культуре клеток in vitro методом хемилюминисцентного анализа таких антител обнаружено не было. Также не наблюдалось изменений клинического ответа, фармакокинетического и токсического профиля, зависимых от образования антител.
У женщин с диагностированным постменопаузальным остеопорозом применение Пролиа усиливало минеральную костную плотность, тем самым снижая частоту невертебральных и вертебральных переломов, а также переломов шейки бедра. Профили безопасности и эффективности деносумаба при терапии постменопаузального остеопороза полностью доказаны в ходе исследований, проведенных на протяжении 3-х лет. По результатам данных исследований применение Пролиа по сравнению с введением «плацебо» существенно снижает риск любых переломов, возникающих в постменопаузе у женщин с остеопорозом. В исследовании принимали участие 7808 женщин, у 23,6% из них ранее часто отмечались переломы позвонков. Все три заключительные точки эффективности касательно переломов приходили к статистически значимым показателям, которые оценивали по предварительно разработанному последовательному плану тестирования.
Применение Пролиа на протяжении более 3-х лет показало значимое и стабильное уменьшение риска появления вертебральных переломов. Снижение такого риска наблюдалось в независимости от 10-летней вероятности образования остеопоротических крупных переломов, ранее происходящих частых переломов позвонков, возраста пациентов, невертебральных переломов, минеральной плотности костей, степени костного ремоделирования и предыдущего лечения остеопороза.
У пациенток в постменопаузе в возрасте 75-ти лет и старше применение Пролиа приводило к снижению частоты новых эпизодов вертебральных переломов, а также по данным проведения post hoc анализа сокращало частоту случаев переломов бедренной шейки.
Снижение частоты появления невертебральных переломов также не зависело от 10-летней вероятности образования остеопоротических крупных переломов. Лекарство Пролиа в сравнении с применением «плацебо» существенно повышало минеральную костную плотность, определяемую каждый год проведения 3-х летнего лечения во всех без исключения анатомических областях. Схожее воздействие препарата на минерализацию костей было выявлено в поясничном районе позвоночника и не зависело от расовой принадлежности пациента, его возраста, ИМТ (индекс массы тела), значений минеральной костной плотности и ремоделирования кости. Проведенные гистологические исследования доказали нормальную структуру костей и, в сравнении с «плацебо«, понижение их ремоделирования. Патологических изменений, в том числе остеомаляции, фиброза и нарушений костной структуры отмечено не было.
Безопасность и эффективность препарата Пролиа, назначаемого для терапии снижения костной массы по причине уменьшения содержания андрогенов, также были обоснованы в ходе 3-х летнего исследования с привлечением 1468 больных, страдающих неметастатическим раком простаты. Значимое повышение костной минеральной плотности выявляли в поясничном отделе, бедренной кости ее вертеле и шейке спустя 30 суток после первой инъекции препарата. Увеличение минеральной костной плотности в поясничном отделе возникало в независимости от расовой принадлежности, возраста, ИМТ, географического региона, начальных показателей минеральной костной плотности и костного ремоделирования, а также наличия предшествующих вертебральных переломов и длительности гормондепривационной терапии.
На протяжении 3-х летнего применения Пролиа наблюдалось существенное уменьшение риска образования свежих вертебральных переломов, оцениваемое через 12 и 24 месяца после назначения препарата. Также введение Пролиа уменьшало риск появления свыше одного перелома остеопоротического характера любой локализации.
Безопасность и эффективность Пролиа при терапии потери костной массы, по причине проведения адъювантной терапии с использованием ингибитора ароматазы, определялась в ходе 2-х летнего исследовании с привлечением 252 женщин с диагностированным раком молочной железы (неметастатическим). Применение Пролиа, в сравнении с введением «плацебо«, значительно повышало минеральную костную плотность во всех исследуемых анатомических областях на протяжении 2-х лет. В поясничном отделе наращивание минеральной костной плотности было отмечено спустя 30 суток после введения первой дозы и сохранялось на протяжении всего лечения независимо от возраста пациентки, ИМТ, продолжительности применения ингибитора ароматазы, предыдущей химиотерапии и применения СМРЭ, а также времени, прошедшего от наступления менопаузы.
Фармакокинетика деносумаба при его п/к введении нелинейная и дозозависимая в широком дозировочном диапазоне, характеризующаяся повышением экспозиции препарата в дозировках 60 мг (или 1 мг/кг) и более. При введении 60 мг препарата через 10 суток (с вариабельностью 2-28 дней) его биодоступность была 61%, плазменная Cmax составляла 6 мкг/мл (с вариабельностью 1-17 мкг/мл). По достижению Cmax сывороточная концентрация уменьшалась с T1/2 26 суток (с вариабельностью 6-52 дня) и в дальнейшем на протяжении 3-х месяцев (с вариабельностью 1,5-4,5 месяца). Через 6 месяцев после введения последней дозы Пролиа у 53% пациентов деносумаба в плазме уже не обнаруживалось. При многократном введении 60 мг деносумаба через каждые полгода не отмечалось его кумуляции и изменений фармакокинетики.
Как и обыкновенный иммуноглобулин, деносумаб состоит из углеводов и аминокислот. По результатам проведенных доклинических исследований предполагается, что его метаболические преобразования и дальнейшее выведение будут проходить по пути обычного клиренса и выведения иммуноглобулинов, с распадом на отдельные аминокислоты и короткие пептидные цепи.
Фармакокинетика деносумаба при его применении пациентами в возрасте 28-87 лет не подвергается значимым изменениям. Расовая принадлежность больных также не влияет на фармакокинетику препарата.
Наличие у пациентов патологий почек, по данным исследований с привлечением 55-ти больных с различной степенью тяжести почечной недостаточности, в том числе находящихся на гемодиализе, не приводило к изменениям фармакодинамики и фармакокинетики деносумаба, что говорит об отсутствии необходимости корректировки дозировочного режима.
Влияние печеночных патологий на фармакокинетические параметры деносумаба не изучалось.
Показания к применению
Назначение Пролиа показано для терапии постменопаузального остеопороза, а также потери массы костной ткани у женщин с раком молочной железы, проходящих лечение с применением ингибиторов ароматазы и у мужчин с раком простаты, находящихся на гормондепривационной терапии.
Противопоказания
Применение Пролиа противопоказано при наличествующей гипокальциемии и персональной гиперчувствительности к деносумабу и/или прочим ингредиентам ЛС.
Побочные действия
При проведении контролируемых клинических исследований наблюдали следующие негативные реакции: часто – формирование катаракты у пациентов мужского пола с раком простаты, проходящих андрогендепривационную терапию, болевые ощущения в конечностях; нечасто – развитие экзем (в том числе, включая аллергические, контактные и атопические дерматиты), воспалительные процессы в подкожной клетчатке; редко – челюстной остеонекроз; эпизодически – возникновение гипокальциемии.
Пролиа, инструкция по применению (Способ и дозировка)
Проведение п/к инъекций препаратом Пролиа рекомендуют проводить дважды в год (1 раз в 6 месяцев) в дозе 60 мг. На протяжении всего курса лечения советуют параллельно принимать витамин D и препараты кальция.
К самостоятельному введению Пролиа можно приступить только после предварительной консультации у лечащего врача, в ходе которой он должен подробно объяснить пациенту все нюансы техники проведения инъекций.
С целью снижения риска случайных уколов каждый уже заполненный шприц оснащен защитным предохранителем для иглы, активирующимся автоматически для ее закрытия сразу после выполнения инъекции.
Не следует пытаться разобрать шприц или активизировать защитный предохранитель. Нельзя использовать шприцы с отсутствующим колпачком или активизированным предохранителем иглы.
Для проведения инъекции препаратом Пролиа самостоятельно вам понадобится новый заполненный шприц и спиртовые салфетки.
Непосредственно перед самим введением следует достать из холодильника шприц, при этом, не беря его за защитный колпачок или поршень, так как это может привести к повреждению устройства.
Для комфортного введения необходимо оставить на некоторое время шприц при комнатной температуре, но не под воздействием солнечных лучей (не следует подогревать шприц в горячей воде, микроволновой печи и т.д.). Не нужно встряхивать шприц и удалять защитный колпачок до начала инъекции.
Далее необходимо убедиться в соответствии срока годности препарата Пролиа, указанного на упаковке, и визуально проверить инъекционный раствор на посторонние включения и изменения цвета (допускается введение только прозрачного, бесцветного или светло-желтого раствора). Разрешено введение раствора с небольшими пузырьками воздуха.
Выбрать хорошо освещенное, комфортное место с близко расположенной чистой поверхностью, на которой разместить необходимые для инъекции материалы и тщательно вымыть руки.
Инъекции лучше всего проводить в верхнюю область бедра или живота. В случае проведения процедуры другим лицом может быть использована тыльная поверхность рук. При отечности или покраснении предполагаемой области введения следует выбрать иное место для инъекции.
Продезинфицировать выбранное место спиртовой салфеткой.
Аккуратно снять защитный колпачок, не вращая его, а просто потянув вверх. Следует избегать касания к игле и нажима на поршень.
Взять шприц в удобную руку и, не сдавливая, зажать кожу между указательным и большим пальцами другой руки. Ввести иглу в основание складки кожи под углом 45° на глубину около 15 мм.
Удерживая кожную складку плавно и медленно, надавить на поршень до полного введения раствора. Защитный предохранитель иглы закроется только тогда, когда шприц полностью опустеет.
Не меняя давления на поршень, следует удалить иглу из кожной складки, после чего отпустить поршень и позволить защитному предохранителю целиком закрыть иглу.
В случае несрабатывания предохранителя возможно неполное введение дозы препарата, что потребует дополнительной консультации у врача.
При появлении крови в месте введения нужно аккуратно удалить ее ватной салфеткой. Не следует растирать кожу в районе инъекции. Место прокола можно заклеить пластырем.
Один шприц предназначен для проведения только одной инъекции. Оставшийся препарат повторно применять запрещено.
Использованный шприц закрывать колпачком не следует. Утилизировать все его части нужно в соответствии с рекомендуемыми врачом правилами.
Передозировка
В ходе проведенных клинических исследований введение ежемесячной дозы Пролиа 180 мг на протяжении полугода (в сумме 1080 мг за 6 месяцев) не выявило каких-либо негативных симптомов.
Взаимодействие
Направленных изысканий взаимодействия деносумаба с прочими ЛС не проводилось. Не стоит смешивать препарат с другими растворами.
Условия продажи
Купить Пролиа возможно только по рецепту.
Условия хранения
Длительная сохранность препарата требует температуры 2-8°С. Хранить шприцы следует в упаковке завода-производителя, в холодильнике, не замораживая. После изъятия Пролиа из холодильника срок его хранения при температуре до 25°С ограничен 30-ю сутками.
Срок годности
При условии соблюдения температуры 2-8°С препарат можно использовать на протяжении 3-х лет.
Особые указания
Пожилые пациенты и больные с патологиями почек не требуют корректировки дозировочного режима деносумаба.
Влияние патологий печени на безопасность и эффективность Пролиа не изучалось.
Во время терапии препаратом Пролиа рекомендуют параллельно принимать витамин D и препараты кальция, в особенности пациентам с патологиями почек.
Перед началом лечения корректировка наличествующей гипокальциемии может быть произведена приемом адекватных доз витамина D и препаратов кальция. У пациентов с повышенным риском формирования гипокальциемии следует следить за содержанием кальция.
В некоторых случаях применение Пролиа приводило к развитию кожных инфекций и ее придатков (как правило, наблюдаются воспалительные процессы в подкожной клетчатке), которые иногда могут потребовать госпитализации. В проведенных исследованиях возникновение таких реакций чаще наблюдалось в группе применения деносумаба (0,4%) в сравнении с группой введения «плацебо» (0,1%). В случае возникновения кожных инфекций пациенты должны незамедлительно сообщить об этом своему врачу.
У больных с распространенным раком, которые проходили лечение с ежемесячным введением 120 мг деносумаба, изредка наблюдали развитие остеонекроза челюсти. Также существуют отдельные сообщения о формировании данной патологии при применении схемы терапии деносумабом – 60 мг дважды в 12 месяцев.
При наличии у пациента аллергии на латекс следует избегать касаний к колпачку иглы.
Аналоги
Совпадения по коду АТХ 4-го уровня:
Аналоги Пролиа представлены препаратами: Бивалос, Остеохель С, Остеогенон, Стромос, Остеокеа, Остеолат.
Детям
Безопасность и эффективность Пролиа в педиатрии не изучались, в связи с чем его не назначают в детской возрастной группе.
При беременности и лактации
Каких-либо достоверных данных о применении Пролиа во время беременности не существует, из-за чего его назначение в этот период не рекомендуется.
Возможность проникновения деносумаба в молоко кормящей матери до конца не изучено, однако есть свидетельства его негативного влияния на грудных детей. По этой причине при кормлении грудью применять препарат Пролиа не рекомендуют.
Отзывы
Отзывы о Пролиа относительно эффективности укрепления и наращивания плотности костной ткани при остеопорозе немногочисленные и неоднозначные. Некоторые пациенты, все-таки решившиеся приобрести этот препарат и прошедшие всего одну инъекцию, уже через полгода на очередной денситометрии отмечали положительную динамику своего болезненного состояния, при этом все они строго придерживались предписаний врача на протяжении этого времени и дополнительно принимали витамин D и препараты кальция. Другие больные не ощутили у себя положительных изменений или остались недовольны их значимостью.
Сами врачи, ссылаясь на результаты исследований деносумаба, рекомендуют Пролиа к применению, но предупреждают, что абсолютной гарантии значимого положительного эффекта по отношению ко всем пациентам быть не может. Несмотря на это стоит заметить, что объективно отрицательных отзывов о препарате Пролиа у применявших его пациентов, кроме его стоимости, очень немного.
Цена, где купить
Цена на Пролиа 60 мг/1 мл №1 варьируется в районе 21000-23000 рублей.
- Интернет-аптеки РоссииРоссия
Аптека Диалог
-
Пролиа (р-р д/под/введ, 60 мг/мл,шприц с защ.устр.1 мл №1)Amgen Europe/Добролек
показать еще
Международное непатентованное название
Пролголимаб
Состав Фортека концентрат для приготовления инъекционного раствора 20мг/мл 5мл
Действующее вещество: пролголимаб — 20 мг. Вспомогательные вещества: натрия ацетата тригидрат — 1.742 мг, трегалозы дигидрат — 100 мг, кислота уксусная ледяная до pH 5.0, вода для инъекций до 1.0 мл.
Группа
Противоопухолевые средства — антитела моноклональные
Производители
Биокад(Россия)
Показания к применению Фортека концентрат для приготовления инъекционного раствора 20мг/мл 5мл
Меланома: препарат показан для лечения взрослых пациентов с неоперабельной или метастатической меланомой.
Способ применения и дозировка Фортека концентрат для приготовления инъекционного раствора 20мг/мл 5мл
Лечение следует начинать и проводить под контролем квалифицированных и опытных врачей-онкологов.Препарат следует вводить внутривенно (в/в) в виде инфузии длительностью 60 минут, при хорошей переносимости длительность инфузии может быть сокращена до 30 минут.Рекомендованная доза препарата составляет: 1 мг/кг каждые 2 недели для пациентов с неоперабельной или метастатической меланомой. Лечение препаратом должно проводиться до прогрессирования заболевания или развития непереносимой токсичности. Наблюдались атипичные ответы (т.е. первоначальное кратковременное увеличение размера опухоли или небольшие новые очаг и в течение первых нескольких месяцев с последующим уменьшением размера опухоли). Рекомендуется продолжать лечение клинически стабильных пациентов с начальными признаками прогрессирования заболевания до момента подтверждения прогрессирования заболевания. Временная или полная отмена лечения Рекомендации по временной или полной отмене лечения препаратом пролголимаб описаны далее. Иммуноопосредованный пневмонит: 2 степень тяжести пневмонита — прекратить прием препарата до исчезновения симптомов, положительной рентгенологической динамики и купирования нежелательных реакций глюкокортикостероидами; 3 или 4 степени тяжести пневмонита, рецидивирующий пневмонит 2 степени тяжести — отмена препарата без возобновления. Иммуноопосредованный колит: 2 или 3 степень тяжести диареи или колита — прекратить прием препарата до исчезновения симптомов и купирования нежелательных реакций глюкокортикостероидами; 4 степень тяжести диареи или колита — отмена препарата без возобновления. Иммуноопосредованный гепатит: увеличение активности ACT или АЛТ до 2 степени (от 3 до 5 раз выше ВГН), увеличение концентрации общего билирубина до 2 степени (от 1,5 до 3 раз выше ВГН) — прекратить прием препарата до возвращения лабораторных показателей к исходному уровню и купирования нежелательных реакций глюкокортикостероидами; увеличение активности ACT или АЛТ >/= 3 степени (> 5 раз выше ВГН) или концентрации ОБ (> 3 раз выше ВГН), у пациентов с метастазами в печень, начавших лечение с умеренной (2) степенью повышения АЛТ или ACT, если повышение АЛТ или ACT > 50% относительно исходных значений сохраняется более 1 недели — отмена препарата без возобновления. Иммуноопосредованные нефрит и почечная дисфункция: 2 степень тяжести повышения уровня креатинина (креатинин сыворотки >1,5 до </= 3 раз превышает ВГН) — прекратить прием препарата до возвращения уровня креатинина к исходному уровню и купирования нежелательных реакций глюкокортикостероидами; >/= 3 степень тяжести повышения уровня креатинина (креатинин сыворотки > 3 раз превышает ВГН) — отмена препарата без возобновления. Иммуноопосредованная эндокринопатия: симптоматические гипотиреоз, гипертиреоз. гипофизит 2 или 3 степени, недостаточность коры надпочечников 2 степени, сахарный диабет с гипергликемией 3 степени — прекратить прием препарата до исчезновения симптомов и купирования нежелательных реакций глюкокортикостероидами (в случае необходимости снятия симптомов острого воспаления). Прием препарата должен быть продолжен в случае проведения гормонозаместительной терапии вплоть до тех пор, пока есть симптомы; гипотиреоз, гипертиреоз, гипофизит 4 степени тяжести, недостаточность коры надпочечников 3 или 4 степени тяжести, сахарный диабет с гипергликемией 4 степени тяжести (уровень глюкозы >250 мг/дл или >13,9 ммоль/л) или с кетоацидозом — отмена препарата без возобновления. Иммуноопосредованная сыпь: сыпь 3 степени тяжести — прекратить прием препарата до исчезновения симптомов и купирования нежелательных реакций глюкокортикостероидами; сыпь 4 степени тяжести или подтвержденный синдром Стивенса-Джонса или токсический эпидермальный некролиз — отмена препарата без возобновления. Инфузионные реакции: реакции 3-4 степени тяжести — отмена препарата без возобновления. Прочие иммуноопосредованные нежелательные реакции: 3 степень тяжести (впервые возникшая) — прекратить прием препарата до исчезновения симптомов и купирования нежелательных реакций глюкокортикостероидами; 4 степень тяжести, повторяющаяся 3-я степень тяжести, иммуно-ассоциированный энцефалит, миокардит 3 степени тяжести, 2 или 3 степень тяжести при сохранении реакций несмотря на приостановку лечения или при невозможности снизить суточную дозу глюкокортикостероидов до эквивалентной 10 мг преднизолона — отмена препарата без возобновления. Не сообщалось о различиях в безопасности или эффективности между пожилыми пациентами (>/=65 лет) и более молодыми пациентами (<65 лет). Коррекция дозы у пациентов пожилого возраста не требуется.Лечение препаратом у пациентов с почечной недостаточностью не изучалось. Лечение препаратом у пациентов с печеночной недостаточностью не изучалось. Не сообщаюсь о различиях в безопасности или эффективности у пациентов с меланомой глаза.Эффективность и безопасность препарата у детей младше 18 лег не установлена. Данные отсутствуют.Подготовка препарата к введению должна проводиться в асептических условиях.Перед введением концентрат во флаконе следует проверить (визуально) на предмет отсутствия механических примесей и изменения окраски.Препарат используют после разведения. Для этого необходимое количество препарата из флакона переносят в ёмкость для инфузий, содержащую стерильный 0,9% раствор натрия хлорида или стерильный 5% раствор декстрозы. Концентрация препарата в приготовленном растворе должна составлять от 0.5 до 10 мг/мл. Приготовленный раствор перемешивают путем осторожного переворачивания емкости для инфузий во избежание пенообразования. Препарат не содержит консерванты. Приготовленный инфузионный раствор необходимо использовать немедленно.Препарат не должен вводиться параллельно с другими растворами и препаратами. Если перед введением препарата пациенту проводилась другая инфузия, для введения препарата должна быть приготовлена отдельная инфузионная система.Начальную дозу препарата вводят в течение 60 минут в виде внутривенной инфузии. Если первая инфузия хорошо переносится, то вторую и все последующие инфузии можно проводить в течение 30 минут.
Противопоказания Фортека концентрат для приготовления инъекционного раствора 20мг/мл 5мл
Повышенная чувствительность к любому компоненту препарата. Возраст до 18 лет (в связи с отсутствием данных по эффективности и безопасности). Беременность и период грудного вскармливания. Почечная недостаточность. Печеночная недостаточность.
Фармакологическое действие
Фармакологические свойства: пролголимаб представляет собой человеческое моноклональное антитело, специфически связывающее рецептор программируемой клеточной смерти PD-1 и блокирующее его взаимодействие с лигандами PD-L1 и PD-L2. Пролголимаб является иммуноглобулином изотипа IgGl гибрид лямбда-каппа е молекулярной массой около 149 кДа. Fc-фрагмент пролголимаба модифицирован с целью предотвращения цитотоксического действия на клетки-мишени, экспрессирующие PD-1.Фармакодинамика PD-1 — это белковый рецептор — контрольная точка иммунного ответа, который ограничивает активность Т-лимфоци гов. Опухолевые клетки могут использовать сигнальный путь PD-1 для ингибирования Т-клеточного иммунного ответа. Пролголимаб представляет собой высокоаффинное антитело к PD-1 рецептору, при ингибировании которого осуществляется двойная блокада сигнального пути PD-1, включающего лиганды PD-L1 и PD-L2 на опухолевых или иммунных клетках. В результате ингибирования связывания рецептора PD-1 с его лигандами пролголимаб реактивирует опухоль-специфичные цитотоксические Т-лимфоциты и. таким образом, реактивирует противоопухолевый иммунитет. Фармакокинетика: фармакокинетику пролголимаба изучали в клиническом исследовании MIRACULUM у пациентов с метастатической или неоперабельной меланомой, получавших препарат в дозировках 1 мг/кг каждые 2 недели или 3 мг/кг каждые 3 недели.Препарат вводится внутривенно, поэтому пролголимаб немедленно и полностью становится биодоступным.В соответствии с ограниченным внесосудистым распределением, объем распределения пролголимаба в равновесном состоянии незначительный (примерно 3,9 л; коэффициент вариации (CV): 88 %). Как и другие антитела, пролголимаб не связывается с белками плазмы специфичным путем.Пролголимаб подвергается катаболизму неспецифичными путями, метаболизм препарата не отражается на его клиренсе.Системный клиренс пролголимаба составляет примерно 0,5 л/сутки (CV: 67%); конечный период полувыведения (Т1/2) составляет примерно 14 дней (CV: 96%).Характеристики выведения пролголимаба ие имеют признаков дозозависимости и являются типичными для препаратов на основе моноклональных антител. Минимальные концентрации (Cмин) препарата как в дозе 1 мг/кг, так и в дозе 3 мг/кг на протяжении многократных введений препарата нс снижаются.После первого введения максимальная концентрация препарата (Смах) в режиме дозирования 1 мг/кг каждые 2 недели, в среднем, составляла 35078 нг/мл, площадь под кривой (AUC0-336ч) — 5306962 нг/мл. Перед вторым введением минимальная концентрация препарата (Cмин) в режиме дозирования 1 мг/кг каждые 2 недели, в среднем, составляла 9011 нг/мл.После первого введения максимальная концентрация препарата (Смах) в режиме дозирования 3 мг/кг каждые 3 недели, в среднем, составляла 82924 нг/мл. площадь под кривой (AUC0-5044) — 14952949 нг/мл. Перед вторым введением минимальная концентрация препарата (Cмин) в режиме дозирования 3 мг/кг каждые 3 недели, в среднем, составляла 24411 нг/мл.
Побочное действие Фортека концентрат для приготовления инъекционного раствора 20мг/мл 5мл
Безопасность препарата изучалась у 126 пациентов в клиническом исследовании MIRACULUM. Период наблюдения составил > 6 месяцев. Ни у одного из пациентов в течение первых 6 месяцев терапии препаратом не было произведено отмены терапии, обусловленной развитием у пациента иммуноопосредованных нежелательных реакций, связанных с лечением. У пациентов, получавших препарат Фортека», отсутствовали серьезные нежелательные реакции (СНР). Наиболее часто встречающимися, связанными с проводимой терапией, нежелательными реакциями были отклонения показателей в общем анализе крови (лимфопения, анемия и др.). нарушения со стороны щитовидной железы (гипо/гипертиреоз, тиреоидит) и кожи (сыпь, зуд).Ниже приведены нежелательные реакции, отмечавшиеся у пациентов, получающих терапию препаратом Фортека». Нежелательные реакции представлены по частоте их регистрации: очень частые (>/=10%), частые (>/=1%, < 10%), нечастые (>/=0,1 %, < 1 %). редкие (>/=0.01 %, < 0.1 %), очень редкие (>/=0.001%, < 0.01%).Нарушении со стороны кроен и лимфатической системы: частые — анемия, лимфопения, нейтропения, лимфоцитоз, тромбоцитопения. Инфекционные и паразитарные заболевания: нечастые — пневмония. Нарушения со стороны эндокринной системы: очень частые — тиреоидит; частые — гипертиреоз, гипотиреоз, повышение уровня ТГГ; нечастые — снижение уровня ТТГ. Нарушения со стороны нервной системы: нечастые — снижение памяти, головная боль. Нарушения со стороны органов зрения: нечастые — увеит. Нарушения со стороны сердечно-сосудистой системы: частые — повышение артериального давления; нечастые — тахикардия, нарушение сердечного ритма, кровотечение из опухолевого узла. Нарушении со стороны органов дыхательной системы, грудной клетки и средостения: частые — пневмонит. Нарушения со стороны желудочно-кишечного тракта: нечастые — тошнота, сухость во рту. Нарушении со стороны кожи и подкожных тканей: частые — сыпь, зуд. Нарушения со стороны скелетно-мышечной системы и соединительной ткани: нечастые: миалгия, миозит.Общие расстройства и нарушении в месте введении: частые: слабость, лихорадка; нечастые — отек, озноб, субфебрилитет, потливость, гриппоподобный синдром; Нарушения со стороны обмена веществ н питании (метаболические): нечастые: снижение аппетита, гипергликемия. Лабораторные отклонения: частые — повышение активности щелочной фосфатазы; нечастые — повышение активности ACT.Ниже приведены нежелательные реакции, которые не отмечались у пациентов, получающих терапию препаратом, но отмечались при терапии другими препаратами того же класса, моноклональными антителами против PD-1 — пембролизумабом и ниволумабом. Учитывая одинаковый механизм действия, возможно возникновение описанных нежелательных реакций у пациентов, получающих терапию препаратом. Нарушения со стороны крови и лимфатической системы: нечастые — эозинофилия. Нарушении со стороны эндокринной системы: нечастые — гипофизит, недостаточность функции надпочечников. Нарушения со стороны нервной системы: чистые — периферическая нейропатия, головокружение; редкие — синдром Гийена-Барре, миастенический синдром, энцефалит. Нарушения со стороны органов зрения Нечастые: сухость глаз; Нарушения со стороны сердечно-сосудистой системы Нечастые: миокардит; Нарушения со стороны органов дыхательной системы, грудной клетки и средостения Частые: одышка, кашель; Нарушения со стороны желудочно-кишечного тракта: очень частые — диарея; частые — колит, стоматит, рвота, боль в животе, запор; нечастые — панкреатит. Нарушения со стороны печени и желчевыводящих путей: нечастые — гепатит. Нарушения со стороны иммунной системы: частые — инфузионные реакции; редкие: отторжение трансплантата солидного органа. Нарушения со стороны кожи и подкожных тканей: частые — тяжелые кожные реакции, витилиго. сухость кожи, эритема, алопеция; нечастые — многоформная эритема, псориаз, дерматит, акнеморфный дерматит, экзема; редкие — токсический эпидермальный некролиз, синдром Стивена-Джонсона; Нарушения со стороны скелетно-мышечной системы и соединительной ткани: частые — артралгия, скелетно-мышечная боль, артрит. Нарушения со стороны почек и мочевыводящих путей: нечастые — нефрит. Общие расстройства и нарушения в месте введения: очень частые — утомляемость. Лабораторные отклонения: очень частые — повышение активности АЛТ, повышение активности амилазы, гипокальциемия, повышение креатинина, гиперкальциемия. Иммуногенность: клиническом исследовании MIRACULUM пациенты получали лечение препаратом в следующих дозировках: 3 мг/кг каждые 3 недели, 1 мг/кг каждые 2 недели. Исследование иммуногенности не выявило образования связывающих антител к препарату ни у одного из пациентов.
Передозировка
Информация о передозировке препаратом отсутствует. Максимально переносимая доза для препарата не установлена. В клинических исследованиях у пациентов, получавших пролголимаб в дозе до 3 мг/кг каждые 3 недели, профиль безопасности был сопоставим с таковым у пациентов, получавших пролголимаб в дозе 1 мг/кг каждые 2 недели. В случае передозировки необходимо проводить тщательный мониторинг пациентов в отношении признаков и симптомов нежелательных реакций и назначить соответствующее симптоматическое лечение.
Взаимодействие Фортека концентрат для приготовления инъекционного раствора 20мг/мл 5мл
Специальных исследований фармакокинетического взаимодействия препарата с другими лекарственным и препаратами не проводили. Поскольку препарат выводится из кровообращения за счет катаболизма, то не следует ожидать метаболических лекарственных взаимодействий.Следует избегать применения системных глюкокортикостероидов или иммунодепрессантов до начала терапии. учитывая их возможное влияние на фармакодинамическую активность и эффективность препарата. Тем не менее, системные глюкокортикостероиды или другие иммунодепрессанты можно использовать после начала лечения пролголимабом для терапии иммуноопосредованных нежелательных реакций.
Особые указания
С осторожностью: тяжелые аутоиммунные заболевания в активной стадии, при которых дальнейшая активация иммунной системы может представлять потенциальную угрозу жизни.Данные о применении препарата у беременных женщин отсутствуют. Специальные исследования по изучению влияния препарата на репродуктивную функцию у животных не проводились, тем не менее, в моделях беременности мышей было показано, что блокада сигнальной системы PD-L1 приводит к снижению толерантности матери к плоду и повышению угрозы гибели плода. Эти результаты указывают на возможный риск (на основании механизма действия) негативного воздействия на плод, включая повышение частоты выкидышей или мертворождений, при применении пролголимаба во время беременности. Известно, что человеческий IgGl (иммуноглобулин) проходит через плацентарный барьер, следовательно, пролголимаб может проникать через плаценту от матери к плоду. Женщины детородного возраста должны использовать надежные методы контрацепции во время лечения пролголимабом и в течение не менее 3 месяцев после введения последней инфузии пролголимаба.Нет данных о секреции пролголимаба в грудное молоко. Препарат противопоказан в период грудного вскармливания.Клинические данные о возможном влиянии препарата на репродуктивную функцию отсутствуют. Несмотря на то, что отдельные исследования токсического действия пролголимаба на репродуктивную функцию и внутриутробное развитие не проводились, заметного влияния препаратов моноклональных антител против PD-1 на репродуктивные органы самцов и самок обезьян в одномесячном и шестимесячном исследованиях токсичности при многократном введении выявлено не было. У пациентов, получавших препарат, отмечались иммуноопосредованпые нежелательные реакции. Большинство иммуноопосредованных нежелательных реакций, наблюдавшихся в клинических исследованиях, были обратимы и контролировались посредством временной отмены приема препарата, применения глюкокортикостероидов и/или симптоматической терапии. Иммуноопосредоваиные нежелательные реакции, затрагивающие более одной системы организма, могут развиваться одновременно.При подозрении на иммуноопосредованные нежелательные реакции требуетея провести тщательную оценку с целью подтвердить этиологию и исключить другие возможные причины. Основываясь на тяжести нежелательной реакции, необходимо временно отменить прием препарата и назначить глюкокортикостероиды (см. ниже). С момента улучшения до 1 степени тяжести или менее начать постепенное уменьшение дозы глюкокортикостероидов и продолжить постепенное снижение в течение, по меньшей мере, 1 месяца. У пациентов, у которых иммуноопосредованные нежелательные реакции не поддаются контролю посредством применения глюкокортикостероидов, может быть рассмотрена возможность назначения других системных иммуносупрессантов.Возобновление приема препарата возможно в случае, если выраженность нежелательной реакции остается 1 степени тяжести или менее после постепенного уменьшения дозы глюкокортикостероидов. При возникновении другого эпизода нежелательной реакции тяжелой степени необходимо полностью прекратить применение препарата. У пациентов, получавших препарат, сообщалось о случаях развития пневмонита. Необходимо проводить активное наблюдение за пациентами в отношении признаков и симптомов пневмонита. При подозрении на пневмонит необходимо провести рентгенологическое исследование для исключения других причин. Терапию глюкокортикостероидами назначают при пневмоните 2 степени тяжести или выше (начальная доза 1-2 мг/кг/сутки преднизона (или аналогичная) с последующим постепенным уменьшением дозы). Временно отменяют прием препарата при пневмоните 2 (умеренной) степени тяжести и полностью отменяют прием препарата при 3 (тяжелой) или 4 (жизнеугрожающей) степени тяжести пневмонита или рецидиве пневмонита 2 (умеренной) степени тяжести.У пациентов, получавших препарат, не сообщалось о случаях развития колита. При этом известно о случаях развития коли та при применении других препаратов моноклональных антител против PD-1. Учитывая схожий механизм действия, возможно развитие данной нежелательной реакции при применении препарата. Необходимо проводить активное наблюдение за пациентами в отношении признаков и симптомов колита и исключить другие причины его развития. Терапию глюкокортикостероидами назначают при 2 степени тяжести или выше (начальная доза 1-2 мг/кг/сутки преднизона (или аналогичная) с последующим постепенным уменьшением дозы). Временно отменяют прием препарата при 2 (умеренной) или 3 (тяжелой) степени тяжести колита и прием препарата полностью отменяют при колите 4 (жизнеугрожающей) степени тяжести.У пациентов, получавших препарат, не сообщалось о случаях развития гепатита. При этом известно о случаях развития гепатита при применении других препаратов моноклональных антител против PD-1. Учитывая схожий механизм действия, возможно развитие данной нежелательной реакции при применении препарата. Необходимо проводить наблюдение за пациентами в отношении динамики функциональных показателей печени (в начале лечения, периодически на протяжении терапии, а также на основании клинической оценки) и симптомов гепатита и исключить другие причины. Терапию глюкокортикостероидами назначают при гепатите 2 степени тяжести (начальная доза 0,5-1 мг/кг/сутки преднизона (или аналогичная) с последующим постепенным уменьшением дозы) и при гепатите 3 степени тяжести или выше (1-2 мг/кг/сутки преднизона или аналога с последующим постепенным уменьшением дозы). Временно или полностью отменяют прием препарата в соответствии с уровнем повышения активности ферментов печени.У пациентов, получавших препарат, не сообщалось о случаях развития нефрита. При этом известно о случаях развития нефрита при применении других препаратов моноклональных антител против PD-1. Учитывая схожий механизм действия, возможно развитие данной нежелательной реакции при применении препарата. Необходимо проводить наблюдение за пациентами в отношении изменения функции почек и исключить другие причины. Терапию глюкокортикостероидами назначают при развитии нежелательных явлений 2 степени тяжести и выше (начальная доза 1-2 мг/кг/сутки преднизона (или аналогичная) с последующим постепенным уменьшением дозы). Временно отменяют прием препарата в случае развития 2 (умеренной) степени тяжести нефрита и полностью отменяют прием препарата при 3 (тяжелой) или 4 (жизнеугрожающей) степени тяжести нефрита.У пациентов, получавших препарат, не сообщалось о случаях развития гипофизита. При этом известно о случаях развития гипофизита при применении других препаратов моноклональных антител против PD-1. Учитывая схожий механизм действия, возможно развитие данной нежелательной реакции при применении препарата. Необходимо проводить наблюдение за пациентами в отношении признаков и симптомов гипофизита (включая гипопитуитаризм и вторичную надпочечниковую недостаточность) и исключить другие причины. В случае проявления вторичной надпочечниковой недостаточности назначают терапию глюкокортикостероидами или другую заместительную гормональную терапию в соответствии с клинической оценкой. Временно отменяют прием препарата в случае 2 (умеренной) степени тяжести гипофизита. полностью отменяют прием препарата при 3 (тяжелой) или 4 (жизнеугрожающей) степени тяжести гипофизита.У пациентов, получавших препарат, не сообщалось о случаях развития сахарного диабета 1 типа, включая случаи развития диабетического кетоацидоза. При этом известно о случаях развития сахарного диабета 1 типа, включая случаи развития диабетического кетоацидоза, при применении других препаратов моноклональных антител против PD-1. Учитывая схожий механизм действия, возможно разви тие данной нежелательной реакции при применении препарата. Необходимо проводить наблюдение за пациентами в отношении гипергликемии или других признаков и симптомов сахарного диабета. При сахарном диабете 1 типа назначают инсулин, а в случаях тяжелой гипергликемии прием препарата временно отменяют до достижения контроля над метаболизмом.У пациентов, получавших препарат, сообщалось о нарушениях со стороны щитовидной железы, они могут развиться в любой момент времени на протяжении лечения. Исходя из этого, требуется наблюдение за пациентами в отношении изменения функции щитовидной железы (в начале лечения, периодически на протяжении терапии, а также на основании клинической оценки) и клинических признаков и симптомов нарушений функции щитовидной железы. Лечение гипотиреоза может осуществляться посредством заместительной терапии без прерывания лечения и без применения глюкокортикостероидов. При гипертиреозе возможно симптоматическое лечение. Временно или полностью отменяют прием препарата при 3 (тяжелой) или 4 (жизнеугрожающей) степени тяжести гипертиреоза. У пациентов с 3 (тяжелой) или 4 (жизнеугрожающей) степенью тяжести эндокринопатии при улучшении до 2 степени тяжести или ниже и контроле посредством заместительной гормонотерапии может рассматриваться продолжение применения препарата.У пациентов, получавших препарат отмечались тяжелые формы сыпи и зуда. Применение препарата следует приостановить при кожных реакциях 3 степени тяжести и отменить без восстановления при 4 степени тяжести. При кожных реакциях тяжелой степени назначается лечение глюкокортикостероидами в дозе 1-2 мг/кг/сутки прсднизона (или аналогичная) с последующим постепенным уменьшением дозы.Препарат следует назначать с осторожностью у пациентов, у которых ранее отмечались тяжелые или жизнеугрожающие нежелательные кожные реакции при лечении иными иммуностимулирующими противоопухолевыми препаратами.В рамках клинического исследования MIRACULUM у пациентов с меланомой не сообщалось о развитии тяжелых инфузионных реакций. При этом известно о случаях развития тяжелых инфузионных реакций при применении других препаратов моноклональных антител против PD-1. Учитывая схожий механизм действия, возможно развитие данной нежелательной реакции при применении препарата при инфузионной реакции тяжелой степени необходимо прервать инфузию и полностью прекратить прием препарата. У пациентов с легкой или умеренной степенью тяжести инфузионных реакций может рассматриваться возможность продолжения приема препарата под тщательным наблюдением врача-онколога при проведении премедикации в соответствии со стандартами профилактики инфузионных реакций.Препарат может оказывать незначительное влияние на способность управлять автомобилем и работать с механизмами. Сообщалось об утомляемости после введения препарата.
Условия хранения
Хранить в недоступном для детей, защищенном от света месте при температуре от 2 до 8 °С. Не замораживать.
Препарат показан для лечения взрослых пациентов с неоперабельной или метастатической меланомой.
Действующее вещество: пролголимаб — 20 мг. Вспомогательные вещества: натрия ацетата тригидрат — 1.742 мг, трегалозы дигидрат — 100 мг, кислота уксусная ледяная до pH 5.0, вода для инъекций до 1.0 мл.
Повышенная чувствительность к любому компоненту препарата. Возраст до 18 лет (в связи с отсутствием данных по эффективности и безопасности). Беременность и период грудного вскармливания. Почечная недостаточность. Печеночная недостаточность.