Данный лекарственный препарат относится к группе иммунодепрессантов, активно применяемых в трансплантологии.
Его основное действующее вещество – рапамицин (Sirolimusum). Относится к иммунодепрессивным лекарственным средствам. Механизм действия рапамицина принципиально отличен от других препаратов той же группы. В частности, он обладает способностью подавлять активность клеток типа T, благодаря блокировке двух типов передачи сигналов (опосредованной и внутриклеточной).
Связываясь с иммунофилином, рапамицин производит подавление активации клетки-мишени киназы (mTOR). Благодаря данному процессу ингибирования mTOR, происходит блокада группы путей, отвечающих за передачу и процесс преобразования сигнала, что, в результате, вызывает снижение иммунного ответа вследствие подавления активации лимфоцитов.
Как следствие, происходит подавление возможного отторжения трансплантата.
Состав и форма выпуска
Основное действующее вещество – рапамицин.
Препарат поступает в продажу в таблетированной форме, в дозировке по 0,5, а также по 1 и по 2 мг рапамицина в 1 таблетке.
Также выпускается в форме перорального р-ра, в дозировке 1 мг рапамицина на 1 мл препарата.
Показания
Фармацевтическое средство Рапамицин применяют для подавления возможного риска отторжения трансплантата при пересадке органов.
Может применяться в комбинации с терапией глюкокортикостероидами и циклоспоринами.
Противопоказания
Рассматриваемое лекарственное средство противопоказано применять в случаях, когда у пациента имеется выраженная гиперчувствительность (аллергия) к основному или к одному из вспомогательных компонентов.
Не применяется в педиатрии.
Применение при беременности и кормлении грудью
В случае беременности назначение данного препарата противопоказано.
При необходимости применения данного препарата лактацию следует приостановить.
Способ применения и дозы
Препарат Рапамицин применяется перорально.
Рекомендации по дозировке препарата и схемам приема:
— начальная терапия (длится 2-3 месяца сразу после пересадки) – нагрузочная доза первые 48 часов, 6 мг;
— поддерживающая терапия – 2 мг в день;
— при комбинации с циклоспорином (если попытка его отмены была неудачной) – лечение длится не более 3 месяцев, затем рапамицин отменяют.
При заболеваниях почек или печени (при средней и легкой степени тяжести), в пожилом возрасте коррекция дозировки не является необходимой.
Точную дозировку, корректировку и длительность лечения определяет опытный лечащий врач, в зависимости от состояния пациента, реакции его организма на препарат.
Передозировка
При передозировке могут усилиться побочные эффекты.
В случае передозировки прием препарата следует остановить и обратиться к врачу. Провести симптоматическое лечение.
Специфический антидот отсутствует.
Побочные эффекты
При лечении данным препаратом (в особенности при комбинации лечения с циклоспорином и глюкокортикостероидами) могут возникнуть побочные эффекты в виде:
— легочной токсичности, или осложнения, которое может возникнуть при пересадке легкого;
— сахарного диабета;
— опасности развития инфекционных заболеваний, в том числе нижних дыхательных путей, поскольку подавление иммунитета может вызвать повышенную восприимчивость организма к инфекциям;
— лимфоцеле;
— торможения заживления ран;
— отеков;
— развития микозных, вирусных, бактериальных заболеваний;
— гепатотоксичности, в том числе с редкими случаями фатального некроза печени.
Условия и сроки хранения
Срок годности – 3 года от даты производства, указанной на упаковке.
Температура хранения – 25°С.
Introduction
Atherosclerosis (AS), which is a chronic inflammatory disease, is a major cause of death and a huge economic burden worldwide (Benjamin et al., 2017). AS commonly affects medium-to-large vessels, such as the carotid, coronary and lower extremity arteries. It causes luminal stenosis or obstruction, which can lead to ischemic stroke, acute coronary syndrome, and inferior limb ischemia. The atherogenic mechanism is incompletely understood, but impaired lipid metabolism and an unresolved inflammatory and immune-response state have been implicated (Tall and Yvan-Charvet, 2015). AS is initially characterized by a series of events: Circulating monocytes are recruited into the subendothelial layer in response to various stimuli and differentiate into macrophages. The macrophages ingest excessive amounts of modified LDL to form foam cells (Tabas and Lichtman, 2017). At the advanced stage, the main pathological feature of AS is unresolved immune-inflammation and imbalance between apoptotic-cell formation and phagocytosis (Tabas and Bornfeldt, 2016). Finally, atherosclerotic plaque can be vulnerable, with a necrotic lipid core encompassing recruited inflammatory cells, cellular necrosis and a thin fibrous cap with few VSMCs and secreted extracellular matrix. Thrombosis, a devastating event of AS, then is induced (Niccoli et al., 2014). These activities are carried out by various cell types in the vascular system: VSMCs, macrophages, endothelial cells and T-cells are the main cell types implicated (Deanfield et al., 2007; Lacolley et al., 2017; Tabas and Lichtman, 2017). Therefore, exploration of pharmaceutical methods to target the aberrant action of cellular components in atherosclerotic plaque formation is imperative. However, the main therapeutic medications, i.e., lipid-lowering and anti-platelet agents and thrombolytics, have undesirable side effects. Moreover, these “gold standard” drugs, which have the desirable effect of preventing the end-point events of advanced AS, such as acute thrombosis, do not reverse AS or correct the aberrant cellular activities. In recent years, some new compounds have been explored as potential sources of anti-AS medicines. For example, plant constituents, such as flavonoids, have been demonstrated to confer therapeutic effects on AS (Luo Y. et al., 2017). However, lack of clinical trials designed to examine the clinical effects of such natural products limited their use. On the other hand, there is a growing awareness of the role of Chinese herbal medicine in the treatment of AS, targeting multiple cellular mechanisms (Liu and Huang, 2016). However, compounds included in one herb, even in an extract of one herb, are very complicated; thus, identifying the mechanism of herbs in treating is difficult.
Rapamycin (RAPA), also known as sirolimus, is a fermentation product derived from Streptomyces hygroscopicus, which was isolated from a soil sample collected on Easter Island in 1976 (Abraham and Wiederrecht, 1996). The product was initially used in treating carcinoma or organ transplant rejection as an anti-proliferation, immunosuppressive agent (Garcia and Rini, 2007; Chih et al., 2016). Since 2003, SES have been used to treat de novo AS and in-stent or graft restenosis through the drug’s anti-AS effects. Also, through in vitro and in vivo studies, RAPA has demonstrated pleiotropic effects on cell types involved in AS through multiple signaling pathways that mediate anti-inflammatory, anti-proliferation, immunoregulation and lipid-regulatory processes. Above all, RAPA, as an autophagy stimulator, can modulate cellular autophagy, thereby modifying the balance of cellular proliferation and survival (Sanchez-Plumed et al., 2006). An imbalance in these activities is considered a crucial component in the pathogenesis of AS. Therefore, this natural product is a potential candidate for the prevention or treatment of AS.
Rapamycin
RAPA (C51H79NO13) was initially found as a lipophilic macrolide antibiotic that inhibits the growth of filamentous fungi (Sehgal et al., 1975). Although it does not have powerful antibiotic effects, RAPA has been used as a potent immunosuppressant agent to suppress allograft rejection in heart (Keogh et al., 2004), liver (Trotter et al., 2001), lung (Shitrit et al., 2005), and kidney (Kahan et al., 1998; Cowan and Heizer, 2000; Kahan, 2000) transplantation. RAPA interferes with crucial signal transduction pathways through binding with FK506-binding-protein. It then inhibits the CKI p27kipl, thereby retarding cell-cycle progression at the G1/S transition (Abraham and Wiederrecht, 1996).
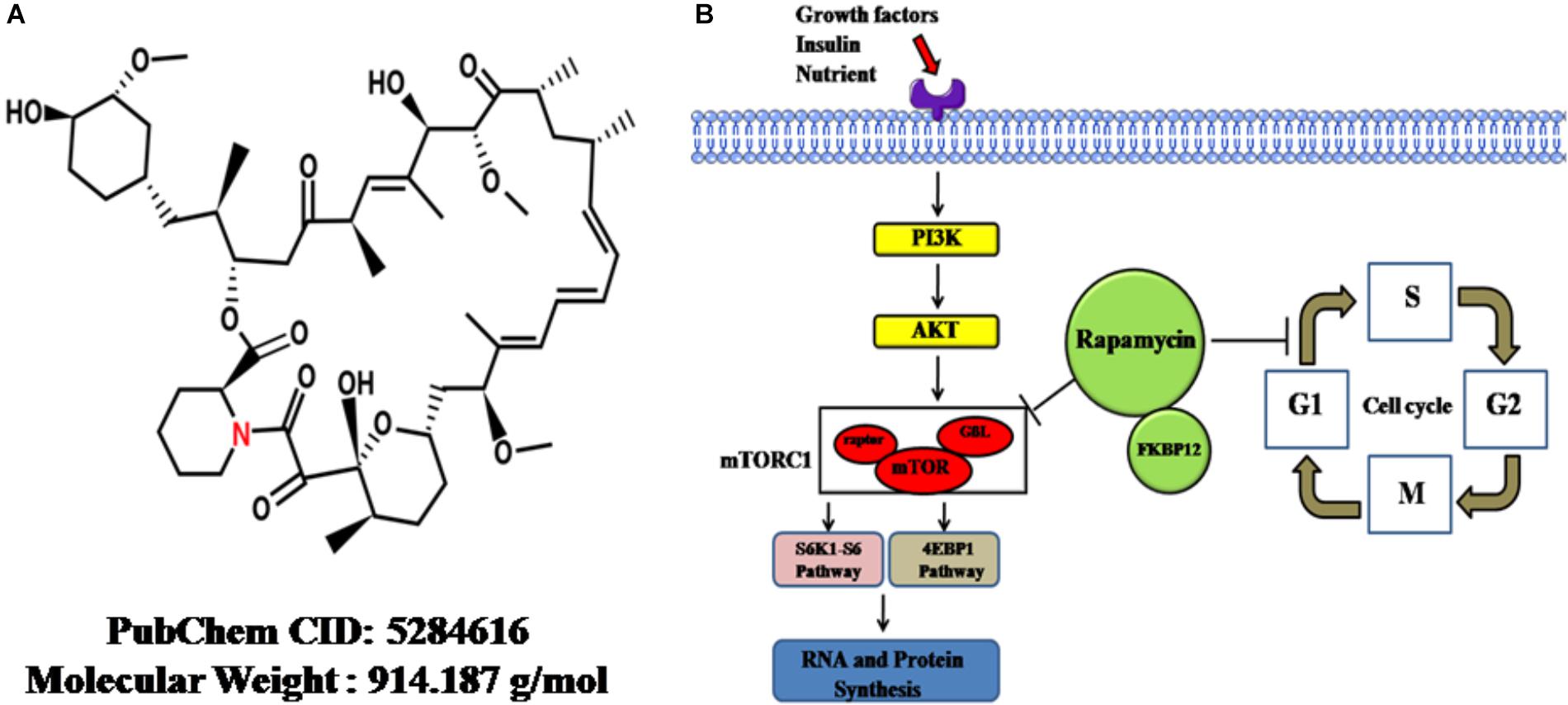
On the other hand, the mTOR, a serine/threonine protein kinase, forms two complexes with distinct proteins: mTORC1 and mTORC2. These proteins are direct targets of RAPA and regulate protein synthesis; cellular proliferation, differentiation and survival; and lipid metabolism (Soltani et al., 2018). The mTORC1 composite consists mainly of mTOR, raptor, and G-protein β-subunit protein (GßL). The ribosomal protein S6K1-ribosomal protein S6 pathway and eukaryotic initiation factor 4EBP-1, as two direct targets of mTORC1, are phosphorylated by mTORC1 after stimulation with growth factors or other factors, thereby stimulating RNA and protein synthesis, cell growth and cell survival (Nemchenko et al., 2011). RAPA inhibits the kinase activity of mTORC1 through binding to the FKBP (FK-binding-protein) 12–rapamycin-binding domain; through this mechanism, cells are differentiated and less proliferative (Tarantino and Capone, 2013). The chemical structure and mechanism of actions were summarized in Figure 1.
Figure 1. The cellular functions and mechanisms of rapamycin. (A) The chemical structure of rapamycin obtained from PubChem database. (B) Rapamycin-induced cellular functional changes and mechanisms. Upon reaction with stimulators, such as growth factors, insulin, or adequate nutrients, the PI3K-AKT pathway is driven, followed by the activation of mTORC1. Then, S6K1-S6 and 4EBP-1 pathways, two direct targets of mTORC1, are phosphorylated by activated mTORC1, thereby promoting RNA and protein synthesis. Rapamycin can inhibit the kinase activity of mTORC1, thereby inhibiting synthesis. On the other hand, rapamycin can retard cell-cycle progression at the G1/S transition. mTOR, mammalian target of rapamycin; GβL, G-protein β-subunit like protein; mTORC1, mTOR complex 1; S6K1-S6, ribosomal protein S6 kinase 1-ribosomal protein S6; 4EBP-1, eukaryotic initiation factor 4E–binding protein 1; Atg1, autophagy-related genes; FKBP12, FK-binding-protein-12.
Early Atherosclerosis
Early AS formation is characterized by endothelial-monocyte interaction, foam cell formation and the de-differentiation of VSMCs. In its initial stage of AS, the loss of integrity of the endothelial layer is a requisite for the formation and development of the lesion (Roth et al., 2015). Normal vasoconstriction and relaxation of endothelial cells are requisites for maintaining vascular homeostasis. These activities are largely determined by NO, produced by activation of eNOS (Mineo and Shaul, 2013). Decreased production of NO in endothelial cells, causing excessive vasoconstriction, can contribute to the initiation of AS and in-stent restenosis. Meanwhile, driven by factors such as shear stress, oxidative stress or high glucose concentrations, vascular adhesion molecules, including VCAM-1, ICAM-1, and E-selectin, are induced. Circulating monocytes then are incorporated into the subendothelial layer, where they engulf oxidized lipid and help promote AS (Schmitt et al., 2014; Khodabandehlou et al., 2017). In turn, deposited OX-LDL can increase the expression of adhesion molecules, leading to recruitment of more inflammatory cells.
After being enrolled into the subendothelial layer, monocyte-derived macrophages engorge cholesterol and form foam cells. Accumulation of foam cells results from discrepancy between uncontrolled modified lipid uptake and insufficient efflux (Randolph, 2014). Depending on SRs, including SR-A, SR-BII, CD36, and LOX-1, infiltrated macrophages engulf OX-LDL and form foam cells (Tall and Yvan-Charvet, 2015). On the other hand, the ABCA1 and G1 (ABCG1) modulate cholesterol efflux and retard foam cell formation. This process is mainly regulated by two main nuclear hormone receptors: PPAR-γ and its downstream target, LXRα. OX-LDL can then be absorbed by endothelial cells and macrophages through scavenger or LOX-1 receptors (Kume and Kita, 2004; Akhmedov et al., 2014). Therefore, targeting lipid-laden macrophages and endothelial cells by inhibiting lipid uptake and enhancing cholesterol efflux is an effective method for inhibiting AS formation.
Following the endothelial activation and monocyte recruitment, VSMCs contribute to AS formation. Normally, VSMCs are located in vessel media, with a well-recognized phenotype (“contractile”), functioning as a relaxation and constriction mediator. In pathological conditions, when atherogenic stimuli such as OX-LDL are present, VSMCs take on synthetic, dedifferentiated phenotype. Their migratory and proliferative abilities are activated, i.e., VSMC migration into the intima and hyperplasia and secretion of extracellular matrix, resulting in thickening and stiffness of vessel intima (Farb et al., 2004; Bennett et al., 2016). Suppression of VSMC phenotypic transformation, therefore, may be an effective strategy for retarding AS formation.
Advanced Atherosclerosis
Advanced AS is characterized by unresolved inflammatory response and excessive cellular apoptosis and death. The inflammatory immune responses, which are dominated by macrophages, are the major contributors to the unresolved inflammation in AS (Tabas and Bornfeldt, 2016). The innate inflammatory response is mainly regulated by TLR4, an immune receptor for detecting damage-associated molecular patterns. On the other hand, the adaptive immune response is mainly mediated by T cells and is modulated principally by mechanisms that, in AS, affect the balance between regulatory and effector T cells. Mechanistically, a skew toward effector T cells other than Treg cells promotes AS, and Treg cells are decreased in AS (Tabas and Lichtman, 2017). Treg cells have anti-inflammatory properties and release TGF-β. In brief, the inflammatory elements in vessels can drive the oxidation of LDL, leading to further formation of foam cells, thus creating a vicious cycle to promote the development of AS. Therefore, decreasing innate and adaptive immune response may be an effective strategy for retarding AS development.
In advanced AS lesions, excessive macrophage or VSMCs-derived foam-cell populations can induce increased inflammatory response and extracellular matrix metalloproteinase and ROS, which cause cellular apoptosis and cell death (Allahverdian et al., 2014). During the process, where excessive stress (oxidative, metabolic, or inflammatory) exists, autophagy becomes impaired, which makes macrophages and VSMCs vulnerable to apoptotic stimuli, resulting in plaque instability (De Meyer et al., 2015). Therefore, the strategy of inhibiting cellular apoptosis and death via enhancing autophagy is logical for preventing plaque formation. Addtionally, senescent VSMCs, which are commonly present in unstable human carotid plaque, have been reported to have impaired self-repairing capacity, which lessens the protective components in plaque (Gardner et al., 2015). Hence, inhibiting cellular senescence is a potent method for maintaining plaque stability.
Anti-Atherosclerotic Effects of Rapamycin
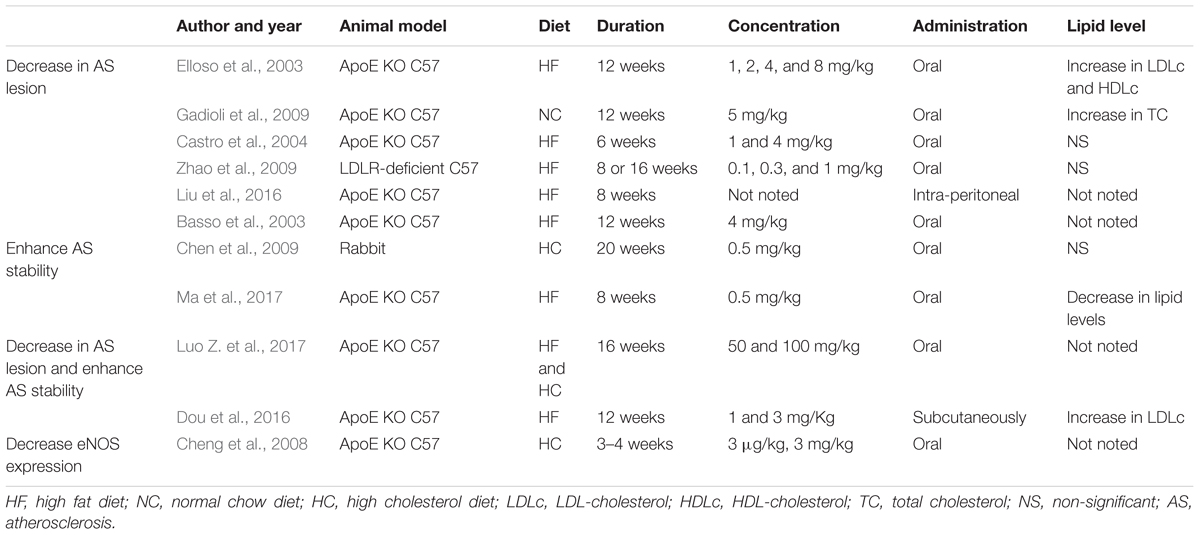
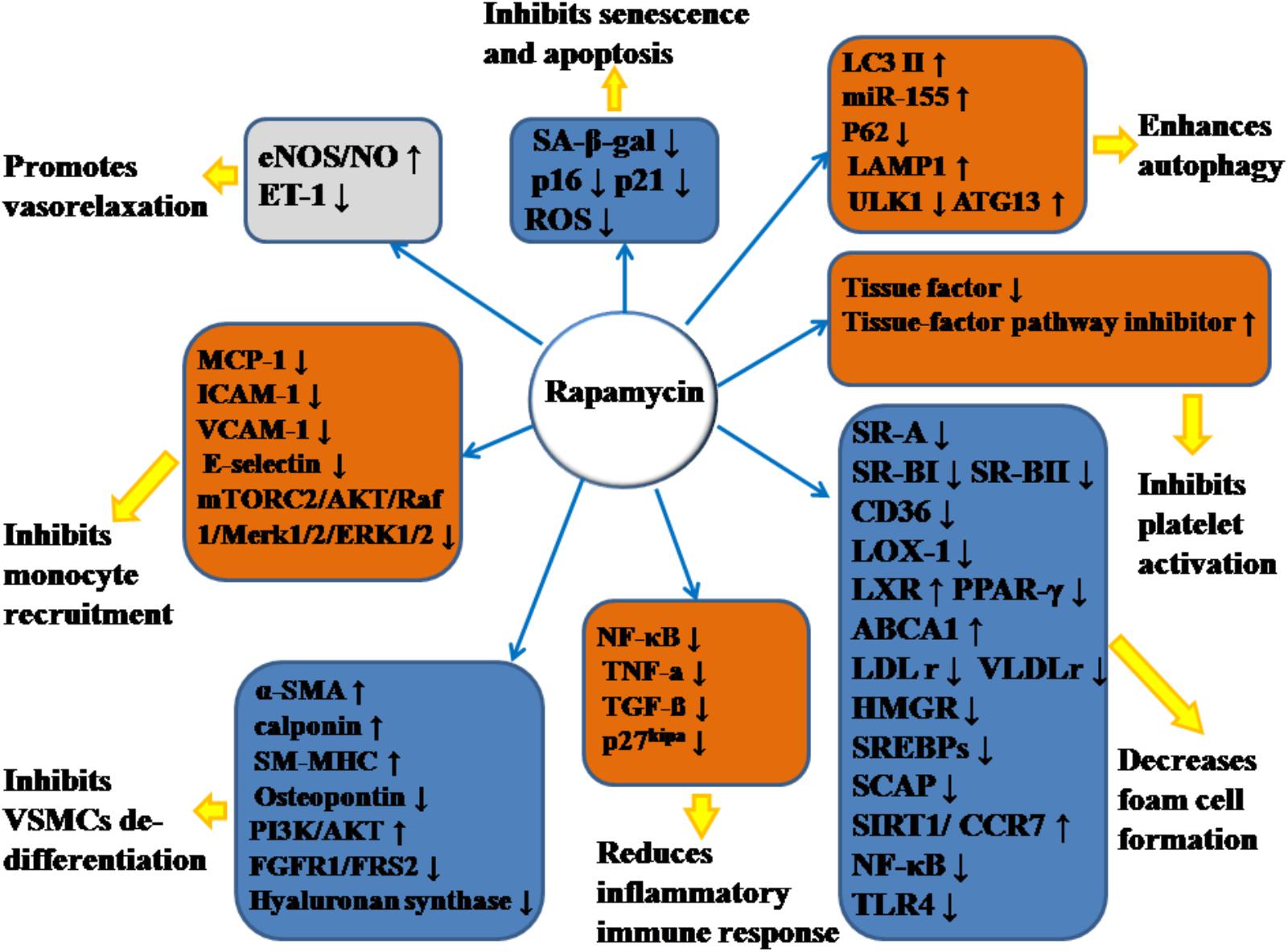
Emerging evidence has demonstrated that RAPA has pleiotropic protective function against AS and therefore may have therapeutic value. In animal models, RAPA decreased plaque burden (Elloso et al., 2003; Castro et al., 2004; Pakala et al., 2005; Gadioli et al., 2009; Zhao et al., 2009; Liu et al., 2016; Ma et al., 2017; Zhang et al., 2017). It also enhanced the stability of plaque (Chen et al., 2009; Luo Z. et al., 2017; Ma et al., 2017), which was characterized by increased fibrous cap content, decreased necrotic core, and attenuated inflammation of plaque (summarized in Table 1). The anti-AS mechanisms of RAPA are elaborated through anti-inflammatory immune, lipid-modulatory, apoptosis and autophagy, and anti-thrombotic effects in multiple cellular models that simulate early and advanced AS formation. Anti-AS effects of RAPA and its molecular targets are summarized in Figure 2.
Table 1. Details of animal experiments investigating the effects of rapamycin (RAPA) in atherosclerosis (AS).
Figure 2. Anti-atherosclerotic effects of rapamycin and its molecular targets. Rapamycin inhibits the formation and development of atherosclerosis (AS) by promoting vasorelaxation, inhibiting monocyte recruitment, inhibiting VSMCs de-differentiation, reducing inflammatory immune response, decreasing foam cell formation, inhibiting platelet activation, enhancing autophagy, and inhibiting senescence and apoptosis. The notation ↑ indicates increase or activation, and ↓indicates decrease or suppression. LOX-1, lectin-like oxidized low-density lipoprotein-1; SR-A, scavenger receptor, class A; SR-BI, scavenger receptor, class B, type I; SR-BII, scavenger receptor, class B, type II; LAMP1, lysosome-associated membrane protein 1; LC3, light chain 3; eNOS, endothelial nitric oxide synthase; NO, nitric oxide; ET-1, endothelin-1; MCP-1, monocyte chemotactic protein-1; LXRa, liver-X-receptor alpha; PPAR-γ, peroxisome proliferator activated receptor gamma; ABCA1, ATP-binding cassette transporter A1; TLR4, toll-like receptor 4; ROS, reactive oxygen species; SM-MHC, smooth muscle myosin heavy chain; FGFR1, fibroblast growth factor receptor-1; FRS2, fibroblast growth factor receptor substrate 2; SA-β-gal, senescence-associated galactosidase; ATG13, autophagy-related protein-13; LDLr, low-density lipoprotein receptor; VLDLr, very low-density lipoprotein receptors; HMGR, 3-hydroxy-3-methylglutaryl coenzyme A reductase; SREBPs, sterol regulatory element-binding proteins; SCAP, SREBP cleavage-activating protein; TGF-β, transforming growth factor-β; ICAM-1, intercellular adhesion molecule-1; VCAM-1, vascular cell adhesion molecule-1; NF-κB, nuclear factor-kappa B; miR-155, microRNA-155; SIRT1, sirtuin 1; ULK1, Unc-51 like autophagy activating kinase 1; α-SMA, α-smooth muscle actin; CCR7, C-C chemokine receptor type 7; CD36, cluster of differentiation; TNF-α, tumor necrosis factor-α; mTORC2, mTOR complex 2.
Ameliorating Endothelial Function and Inhibiting Monocyte Recruitment
Endothelial cells, as the components that are directly in contact with circulating blood, are important in maintaining vascular homeostasis. Impaired endothelial function is an initiating event in the formation of AS (Roth et al., 2015). RAPA can improve endothelial function through regulating NO expression. Shear stress can affect the production of NO via the shear stress-responsive eNOS promoter, and low-stress regions are prone to AS (Cheng et al., 2008). In carotid arteries of mice fed normal- or high-cholesterol diet, RAPA modulates shear stress-induced NO production. RAPA can upregulate intracellular eNOS expression at low and normalshear-stress levels induced by carotid cast placement, an observation that indicates that the administration of RAPA can retard the onset of AS at AS-prone sites through increasing NO production (Cheng et al., 2008). Additionally, Trapp and Weis (2005) have reported that RAPA increased the production of NO in endothelial cells dose-dependently in vitro. Even in hypoxia, when NO production is greatly reduced, RAPA can increase the production of NO in endothelial cells. On the other hand, endothelin-1 is released by endothelial cells, which promotes vasoconstriction and enhances the adhesion of immune cells to endothelial cells. RAPA can decrease the production of endothelin-1 dose-dependently, thereby inhibiting the vasoconstriction of endothelial cells (Guo et al., 2014). Thus, RAPA can promote vasorelaxation through increasing NO production and inhibiting vasoconstriction of endothelial cells through targeting cytokine secretion.
In addition to endothelial impairment, monocyte recruitment is the hallmark of early AS. Recent evidence has also demonstrated that RAPA reduces adhesion of monocytes to endothelial cells. The migration of monocytes is increased after exposure of stromal cell-derived factor-1, a chemoattractant for monocyte recruitment. Pretreatment of monocytes with RAPA can inhibit this chemotaxis dose-dependently. This activity of RAPA is consistent with the results of an in vivo study in which macrophage numbers in plaque were decreased in RAPA-fed atherogenic mice (Pakala et al., 2005). Monocyte chemotactic protein-1 also participates in recruiting monocytes. RAPA has been found to attenuate monocyte chemotactic protein-1 expression in the aortic arch of apoE-deficient mice fed an atherogenic diet, a finding that illustrates that RAPA has anti-migratory effects on macrophages (Castro et al., 2004). Additionally, RAPA can dose-dependently decrease the ox-LDL-induced expression of ICAM-1 and E-selectin and inhibit the adhesion of monocytes to human umbilical vein-endothelial cells through suppressing the activation of MTORC2, and then inhibiting PKC phosphorylation and c-fos expression (Sun et al., 2017). Moreover, TNF-α, an inflammatory cytokine, can drive adhesion molecule expression through activating the Raf-1-Merk1/2-ERK1/2 pathway (Roberts and Der, 2007). It has been reported that RAPA can reduce increased TNF-a-induced expression of VCAM-1 by inhibiting the mTORC2-AKT-Raf-1-Merk1/2-ERK1/2 pathway in human umbilical vein-endothelial cells (Wang et al., 2014). However, RAPA had no effect on adhesion molecules expressed in human macrovascular and microvascular endothelial cells, which seems to contradict results of the above phenomenon (Lehle et al., 2008); the inconsistent results might be due to variations in physiological properties of the above three types of endothelial cells.
Modulating the Phenotypic Switch of Vascular Smooth Muscle Cells
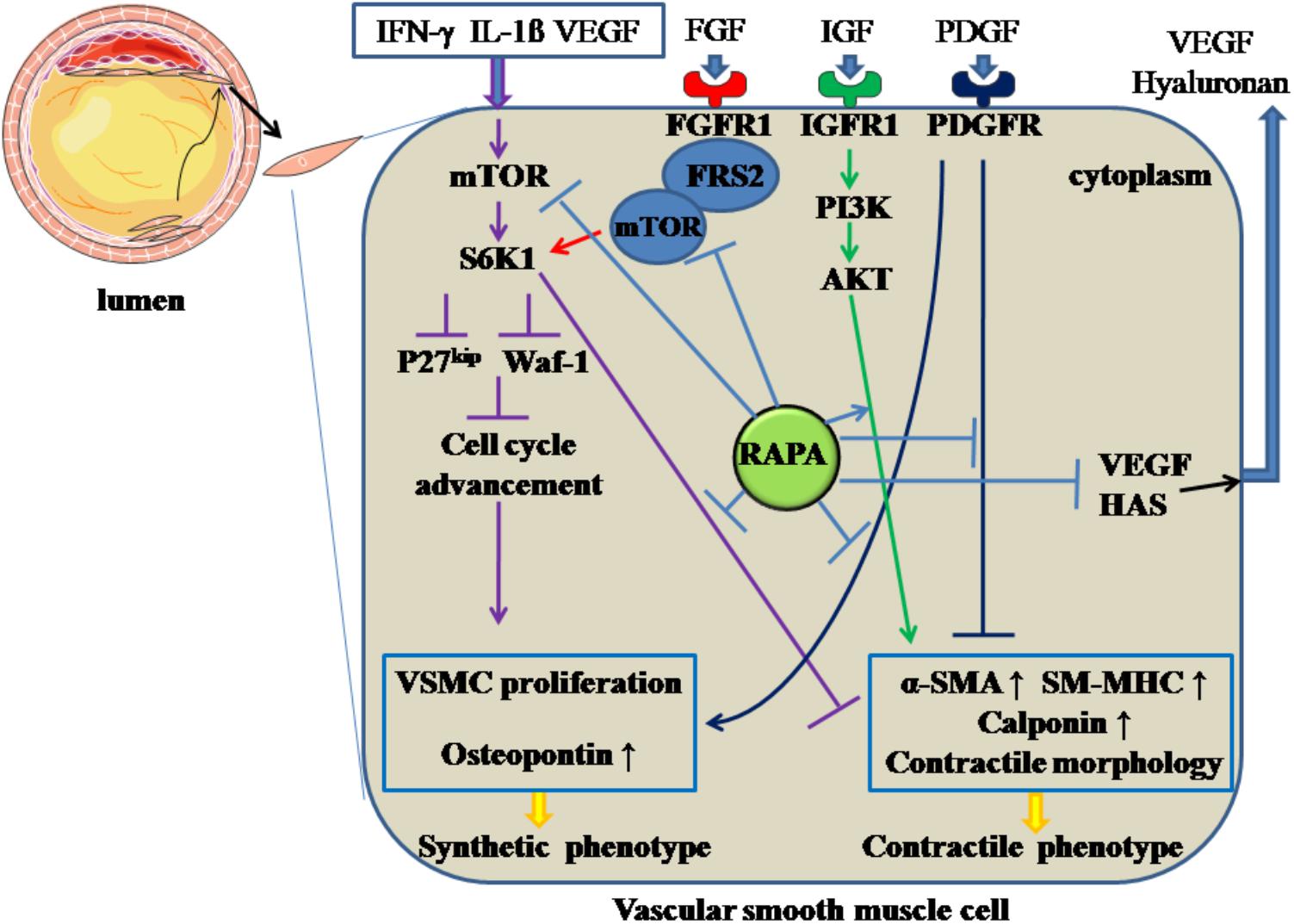
Following the endothelial injury, VSMCs carry out a phenotypic transition from differentiation to de-differentiation and migrate to the sub-endothelial layer, where they and proliferate quickly, forming neointima. RAPA inhibits the de-differentiation of VSMCs through inhibiting mTOR and S6K1, resulting in changes in cellular contractile morphology and increased waf-1 and p27kip, a reaction that results in cell-cycle withdrawal (Ma et al., 2007). In a relevant in vitro study (Martin et al., 2004), RAPA prompted VSMCs to assume a contractile phenotype by inducing α-smooth muscle actin (α-SMA), calponin, and SM-MHC at the mRNA and protein levels through targeting S6K1. Also, in freshly excised swine femoral arteries, the contractile protein series, previously down-regulated by normal organ culture, was reversed after treatment with RAPA (Ding et al., 2011). Additionally, during the phenotypic transition of VSMCs, various growth factors or receptors, such as PDGF, IGF, and FGFR, are involved. When VSMCs are incubated with PDGF (Pan et al., 2017), RAPA can inhibit the proliferation and migratory effects of VSMCs together with increasing α-SMA and calponin and downregulating osteopontin protein; IGF is universally distributed in the blood serum, and the IGF-I receptor can be expressed in insulin-sensitive tissue and VSMCs. After binding with IGF, the IGF-I receptor can activate the PI3K-Akt pathway, which is a critical mechanism for maintaining the contractile phenotype of VSMCs (Ohkawa et al., 2003). RAPA can enhance the contractile protein expression via the IGF-I-PI3K-AKT pathway. FGFR1, as the major form of FGFR with its downstream signaling pathway, participates in VSMCs phenotypic switching through modulating contractile marker gene expression. FRS2 acts as a downstream modulator of the FGFR-1 pathway and, after FGFR-1 binds with FGF, FGFR-1 combines with FRS2 to form FGFR-1/FRS2 complex. The complex combines with mTOR to form multi-protein composites, followed by the activation of mTOR, and inhibits the contractile marker expression. RAPA can reverse FGFR-1/FRS2/mTOR complex-mediated downregulated expression of the contractile marker gene (Chen and Friesel, 2009).
Hyaluronan, a major element of extracellular matrix, can modulate local inflammatory responses, monocyte-VSMC adhesion, and proliferation and migration of VSMCs (Chung et al., 2002). RAPA can decrease the amount of hyaluronan secreted by VSMCs without accelerating the degradation rate of hyaluronan by decreasing the expression of hyaluronan synthase 1, 2 and 3 (Goueffic et al., 2007). In addition, RAPA-reduced hyaluronan synthesis may abolish the recruitment and retention of circulating monocytes after angioplasty, as hyaluronan can attract monocytes into inflamed tissues and promote differentiation of the cells. On the other hand, the increased proliferation of VSMCs can promote intimal hyperplasia and restenosis. The inflammatory mediator interferon (IFN)-γ has pro-AS effects, partly through promoting intimal hypertrophy and proliferation of VSMCs (Koh et al., 2004). The responsible mechanism may be induction of S6K1 phosphorylation by IFN-γ through activation of PI3K (Wang et al., 2007). RAPA can inhibit IFN-γ-mediated neointimal formation and proliferation of VSMCs by diminishing the phosphorylation of S6K1 (Wang et al., 2007). Also, VEGF can induce the proliferation of VSMCs, which have a pro-AS effect (Wang et al., 2007). RAPA has attenuated secretion of VEGF in VSMCs, thereby inhibiting the VSMC proliferation (Dichtl et al., 2006). All the above effects facilitate RAPA-mediated anti-proliferative effects in VSMCs. The above mechanisms are summarized in Figure 3.
Figure 3. Rapamycin inhibits the de-differentiation of vascular smooth muscle cells. Rapamycin suppresses the de-differentiation of vascular smooth muscle cells by inhibiting the activation of mTOR and S6K1, activating PI3K/AKT pathways, inhibiting PDGF pathway and the formation of FGFR-1/FRS2/mTOR complex. In addition, rapamycin inhibits the synthesis of hyaluronan through decreasing HAS and the secretion of VEGF. The solid lines with arrow and notation ↑ indicate increase or activation, and lines without arrows indicate decrease or suppression. VSMC, vascular smooth muscle cell; S6K1, ribosomal protein S6 kinase 1; mTOR, mammalian target of rapamycin; IFN-γ, interferon-γ; IL-1β, interleukin-1β; VEGF, vascular endothelial growth factor; RAPA, rapamycin; HAS, hyaluronan synthase; α-SMA, α-smooth muscle actin; SM-MHC, smooth muscle-myosin heavy chain; FGFR1, fibroblast growth factor receptor 1; FRS2, fibroblast growth factor receptor substrate 2; FGF, fibroblast growth factor; IGF, insulin-like growth factor; PDGF, platelet-derived growth factor.
Modulating Lipid Metabolism
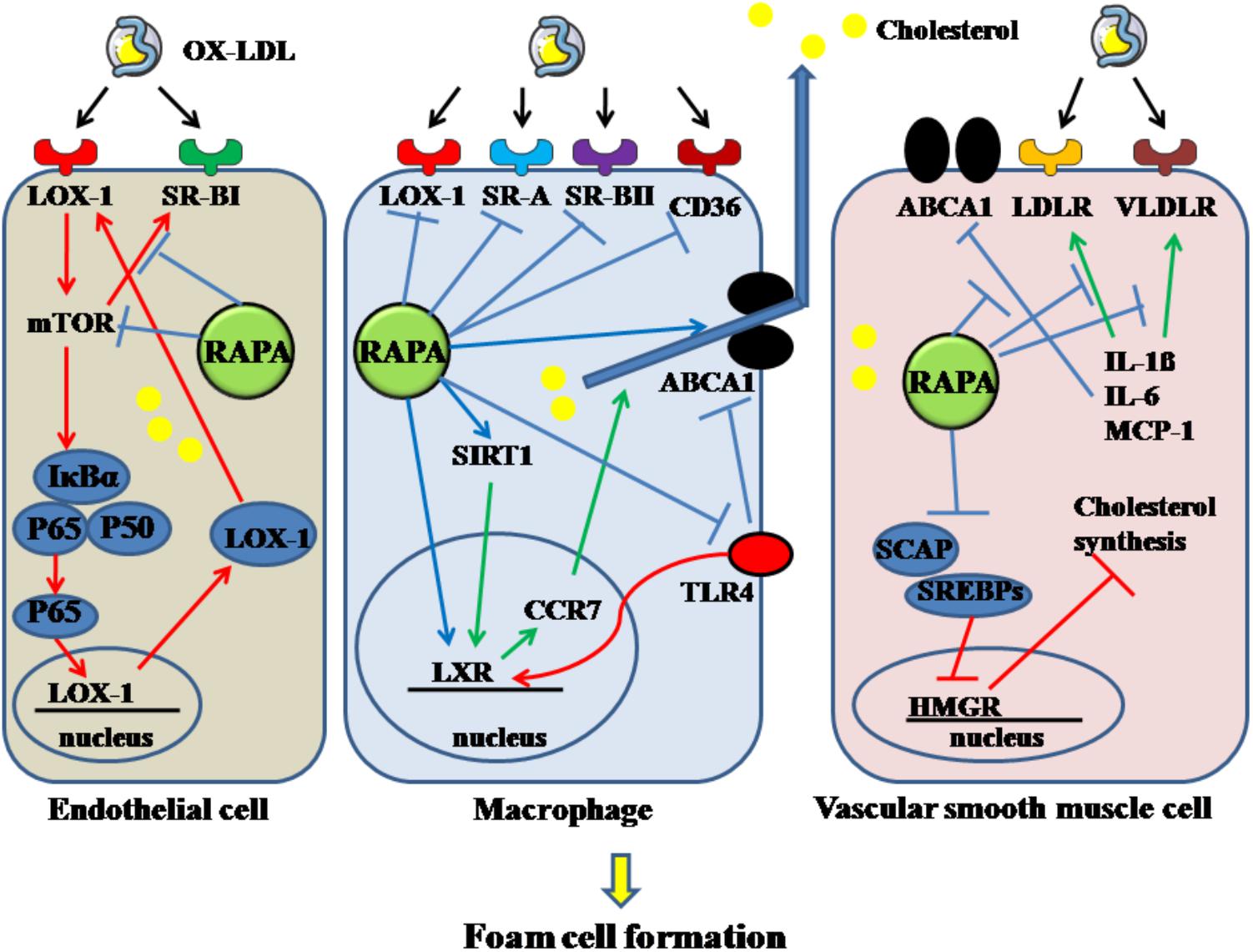
Foam cells, the typical pathological feature in AS, are derived from endothelial cells, macrophages and VSMCs. Decreasing the uptake, enhancing the degradation of ox-LDL in these cellular types is a potent mechanism for inhibiting the development of AS. In endothelial cells, 70% of ox-LDL uptake was found regulated by LOX-1. OX-LDL can induce the expression of LOX-1 through activating the NF-κB pathway and enhancing the engulfment of OX-LDL in endothelial cells (Ling et al., 1997). These effects can be reversed by RAPA, as RAPA can reduce the endocytosis of OX-LDL in endothelial cells through inhibiting mTOR phosphorylation and then decreasing IκBα phosphorylation and cellular-nuclear accumulation of P65, thereby suppressing the expression of LOX-1 (Zhou et al., 2016). RAPA can also down-regulate the expression of SR-BI, which is also required for endothelial cell-mediated OX-LDL and HDL uptake, through inhibiting mTORC1 activity (Fruhwurth et al., 2014).
On the other hand, RAPA can also modulate the processes of cholesterol uptake and efflux in macrophage. In the THP-1 cell line, SR-A and SR-BII were down-regulated in a dose-dependent manner by RAPA at the mRNA level, regardless of the duration of stimulation. CD36 and LOX-1 are especially down-regulated by high-dose RAPA stimulation over an extended period, but not in a dose- or time-dependent manner. Moreover, low-dose RAPA can increase the transcriptional level of LXRα time-dependently. High-dose RAPA can decrease PPAR-γ expression; however, this effect is attenuated over an extended time. ABCA1 expression was enhanced by a low dose of RAPA at all time periods; however, a high dose of RAPA over a long time resulted in an undetectable level of ABCA1 (Mathis et al., 2007). Also, activation of LXRα can partly induce expression of CCR7, which is needed during transport of cholesterol out of atherosclerotic plaque (Feig et al., 2010). SIRT1 can activate LXR and inhibit the NF-κB pathway, thereby performing its anti-atherogenic role (Zeng et al., 2013). RAPA can activate the SIRT1/LXR/CCR7 pathway in the U937 cell line, thereby inhibiting foam-cell formation and promoting foam-cell egress. Furthermore, by increasing SIRT1, which can inhibit activation of NF-κB, RAPA can decrease the activity of NF-κB. Activation of NF-κB decreases ABCA1 and LXRα expression, which contributes to accumulation of lipid in macrophages (Zheng et al., 2017). Moreover, the TLR4-mediated pathway can promote the formation of macrophage-derived foam cells by inhibiting the LXR pathway and ABCA1. After treating THP-1 with OX-LDL, the expression of TLR4 was markedly enhanced, mediated by the phosphorylation of mTOR and elevated p70-S6K levels in foam cells. RAPA can block the increased TLR4 induced by OX-LDL and reverse the decreased ABCA1 induced by TLR4 when its ligands are bound, thereby enhancing cholesterol efflux (Yu et al., 2011).
Rapamycin can inhibit the formation of VSMCs-derived foam cells. Their lipid content can be increased through increased LDL receptor-guided LDL uptake or reduced ABCA1-guided cholesterol efflux, induced by inflammatory cytokines. RAPA can decrease the increased expression of LDL and VLDL receptors, increased by IL-1β, resulting in a reduction of intracellular lipid contents in VSMCs. In addition, RAPA enhanced cholesterol efflux and reversed decreased cholesterol efflux in the inflammatory environment caused by IL-1β via elevating ABCA1 and ABCG1 expression (Ma et al., 2007). Moreover, RAPA can attenuate the expression of IL-6, IL-8, monocyte chemotactic protein-1, which can promote foam-cell formation (Ma et al., 2007). RAPA cannot only decrease the uptake of LDL by VSMCs, it can inhibit cellular cholesterol synthesis, which is enhanced by inflammatory stress. Cholesterol synthesis is limited by a key enzyme, HMGR. When synthesis is demanded, SREBPs are transported via SCAP from the endoplasmic reticulum to the Golgi and activated by SCAP in the Golgi, followed by translocation into the nucleus and binding with the promoter of HMGR. In this circumstance, cholesterol synthesis is activated. When cholesterol is overloaded in cells, the insulin-induced gene, a membrane protein located in the endoplasmic reticulum, connects with SCAP to inhibit the activation of SREBPs, which form a feedback loop for cholesterol homeostasis. In addition, the insulin-induced gene mediates HMGR degradation via the ubiquitin-proteasome pathway. Normal function of the feedback loop is essential for inhibiting foam-cell formation. With inflammatory stimulation, such as with IL-1β, the feedback loop is disrupted and cholesterol synthesis in VSMCs is increased. In the presence or absence of IL-1β, RAPA can inhibit cholesterol synthesis in VSMCs through sequentially downregulating the expression of SCAP, SREBP-2, and HMGR, upregulating Insigs, and decreasing nuclear translocation of SREBP-2/SCAP composite (Ma et al., 2010). Thus, foam cells derived from VSMCs can be inhibited by RAPA through targeting cholesterol uptake, efflux and synthesis. The above mechanisms are summarized in Figure 4.
Figure 4. Rapamycin inhibits the formation of foam cells derived from endothelial cell, macrophage and VSMC. Rapamycin suppresses the foam cells by inhibiting the activation of mTOR, SR-BI in endothelial cells. It decreases macrophage-derived foam cells by inhibiting LOX-1, SR-A, SR-BII, CD36, TLR4 and enhancing the expression of LXR, SIRT1, and ABCA1. In addition, it decreases VSMC-derived foam cells by elevating the decreased ABCA1 induced by IL-1β, IL-6, MCP-1, and downregulating the increased LDLR and VLDLR. And rapamycin can also decrease cholesterol synthesis. The solid lines with arrow indicate increase or activation, and lines without arrows indicate decrease or suppression. OX-LDL, oxidized low-density lipoprotein; LOX-1, lectin-like oxidized low-density lipoprotein-1; SR-A, scavenger receptor, class A; SR-BI, scavenger receptor, class B, type I; SR-BII, scavenger receptor, class B, type II; CD36, cluster of differentiation 36; RAPA, rapamycin; ABCA1, ATP-binding cassette transporter A1; TLR4, toll-like receptor 4; VLDLR, very low-density lipoprotein receptor; LDLR, low-density lipoprotein receptor; mTOR, mammalian target of rapamycin; SIRT1, sirtuin 1; CCR7, C-C chemokine receptor type 7; LXR, liver-X-receptor; HMGR, 3-hydroxy-3-methylglutaryl coenzyme A reductase; SREBPs, sterol regulatory element-binding proteins; SCAP, SREBP cleavage-activating protein; IL-1β, interleukin-1β; MCP-1, monocyte chemotactic protein-1.
Inhibiting Inflammatory Immune Response
In advanced lesions, inflammatory immune responses, including innate and adaptive reactions, exacerbate cellular apoptosis and death, thereby decreasing plaque stability. RAPA can ameliorate cellular innate inflammatory responses. Pathogen-associated molecules derived from bacteria, viruses or fungi, can bind with TLR4, leading to triggering of the inflammation cascade. RAPA can down-regulate inflammatory cytokines, such as IL-6 and TNF-a, in THP-1 macrophages treated with LPS (Varghese et al., 2005). Additionally, in the proinflammatory pathway, NF-κB, a transcription factor, is a main mediator of cytokine secretion to promote inflammation and recruit other immune cells in AS. RAPA can decrease NF-κB activity, possibly through increasing SIRT1, which is characterized by decreased levels of NF-κB in the nucleus and its downstream target, TNF-α (Zheng et al., 2017). On the other hand, RAPA can suppress the proliferation of T-cells that may contribute to AS, and both T helper type 1 and T helper type 2 cytokine production are decreased by treatment with RAPA. Moreover, RAPA can increase mRNA expression of TGF-β, which retards the proliferation of T cells (Dumont and Su, 1996). Mechanistically, RAPA attenuates cell-cycle advancement through inhibitory regulation of the CKI p27kipa. In another study, RAPA has been demonstrated to increase the expansion of Treg cells, a finding that indicates that RAPA can modulate the adaptive immune response to inhibit AS (Potekhina et al., 2011).
Inhibiting Cellular Senescence and Apoptosis
Cellular senescence and apoptosis have been commonly observed in advanced lesions and can increase plaque vulnerability. It is well established that senescent VSMCs have impaired self-repairing ability, which reduces fibrous cap content (Luo Z. et al., 2017). OX-LDL can induce the senescence of VSMCs, and SA-β-gal, p16 and p21 have been found increased in senescence VSMCs. RAPA decreased SA-β-gal, p16 and p21 expression in VSMCs, an activity that indicates that RAPA attenuates cellular senescence increased by OX-LDL (Luo Z. et al., 2017).
The apoptosis of macrophage and VSMCs induces plaque vulnerability in advanced plaque (Clarke et al., 2006). The apoptosis rate of macrophage-derived foam cells varies with cellular stage, which is determined by the duration of stimulation with OX-LDL. In THP-1 treated with OX-LDL, foam-cell assay was performed at 6 and 48 h, which represent early and late stages of foam-cell formation (Liu et al., 2016). At both times, the intracellular lipid content was significantly increased, and the transformation of LC3I to LC3II was upregulated. Foam cells at late stage are prone to apoptosis because of increased oxidative stress, but upon treatment with RAPA, the viability of late-stage cells is increased (Liu et al., 2016). Also, in the same paper, after feeding mice with a RAPA-included western diet for 16 weeks, aortic lesions had a lower apoptotic cell profile than that did controls, and the predominant cell type that colocalized with autophagy markers was macrophage (Liu et al., 2016). These results indicate that RAPA can prevent plaque advancement of AS and enhance plaque stability through repressing the apoptosis rate of foam cells at various stages. Mechanistically, RAPA decreases apoptosis through suppressing the production of ROS, which promote cellular apoptosis, thereby inhibiting creation of mitochondria-derived superoxide.
Stimulating Autophagy
Autophagy is a cellular protective process, in which damaged intracellular elements, such as dysfunctional mitochondria, proteins, and lipid droplets, are eliminated, a process that contributes to cellular balance and self-adaptation (Yang and Klionsky, 2010). Autophagy has been classified into three categories: Microautophagy, macroautophagy, and chaperone-mediated autophagy (De Meyer et al., 2015). The main steps of macroautophagy are autophagosome formation, cargo segregation, and, finally, lysosomal fusion/degradation. Impaired macroautophagy can lead to inflammatory diseases, such as AS (Levine et al., 2011). In advanced AS, dysfunctional macroautophagy can make cells vulnerable to apoptotic stimuli and impaired clearance of apoptotic cells, which accelerates plaque progression (De Meyer et al., 2015; Grootaert et al., 2018). Therefore, interest in agents that can stimulate autophagy has increased, and RAPA has been found to have macroautophagy-stimulating effects (Adelman, 2010). In the constricted carotid artery of ApoE-/- mice, created by collar surgery, oral administration of RAPA increased the formation of autophagosomes and activated autophagy, thereby diminishing plaque development; the responsible mechanism is: RAPA increases miRNA-155 expression, thereby promoting the activation of autophagy, which retards the development of atherosclerotic plaques (Ma et al., 2017). Moreover, low-dose RAPA, as a moderate stimulator of autophagy, can reverse the decreased VSMC autophagy induced by OX-LDL through inducing increased autophagosome and elevated expressions of LC3II. In this process, activated mTORC1 can induce the phosphorylation of Unc-51-like autophagy, thus activating kinase 1 (ULK1) and repressing ULK1 and ATG13 expression; through these actions, ULK1/ATG13 complex-induced autophagy is inhibited. After RAPA treatment, MTORC1, ULK1 total content, and phosphorylated ULK1 were decreased, and ATG13 was upregulated, whereby VSMCs autophagy survival was enhanced (Luo Z. et al., 2017). Intriguingly, with increased doses of RAPA, its anti-AS effects were not increased, which implies that moderate autophagy induced by low-dose RAPA – without inducing excessive autophagy – may be optimal for treatment of AS.
On the other hand, induced by OX-LDL, autophagy in endothelial cells is increased, and autophagosomes and autolysosomes are formed, followed by an infusion with lysosome, by which OX-LDL is degraded. RAPA can enhance the elevated autophagy level induced by OX-LDL and decrease the accumulation of OX-LDL in endothelial cells within a certain period, thereby protecting cells against apoptosis and other damage induced by OX-LDL (Zhang et al., 2010). An in vitro study has also demonstrated that RAPA increased the co-localization of OX-LDL and autophagy-related proteins, such as LC3 and LAMP1. Also, p62 expression can be down-regulated by RAPA, an action that indicates that RAPA drives autophagic flux. Simultaneously, LAMP1 protein is up-regulated by RAPA, an action that implies fusing of lysosomes with autophagic vacuoles (Zhang et al., 2015). In summary, RAPA can activate the autophagy-lysosome pathway to accelerate the degradation of OX-LDL in endothelial cells. However, after continual stimulation with OX-LDL, RAPA does not affect the endothelial content of OX-LDL, possibly because excessive OX-LDL can damage the autophagic degradation of itself (through interfering with the fusion between lysosomes and autophagosomes).
Inhibiting Platelet Activation
Platelet activation and the ensuing thrombosis are responsible for undesirable outcomes, such as acute myocardial infarction or stroke, in advanced AS. In advanced atherosclerotic plaque, where rupture of the plaque and thrombosis often occur, macrophages can express tissue factor, a procoagulant molecule that triggers thrombosis and is increased by inflammatory-related stimulation (Ollivier et al., 2005). RAPA has anti-coagulant activities. Treating THP-1 and human circulating monocytes under LPS stimulation with RAPA can lead to a significant decrease in transcriptional level of tissue factor, thereby inhibiting tissue factor-antigen content and cell-surface-derived or total-tissue-generated procoagulant activity. RAPA inhibited LPS-induced nuclear translocation of the two complexes, p50/p65 and c-Rel/p65, to the tissue factor promoter site, thereby inhibiting tissue-factor activity. On the other hand, enhanced secretion of the tissue-factor pathway inhibitor induced by LPS in THP-1 cells was moderately inhibited by RAPA (Ollivier et al., 2005). The above effects lead to the reduction of platelet activation by RAPA.
Clinical Application of Rapamycin in Atherosclerosis
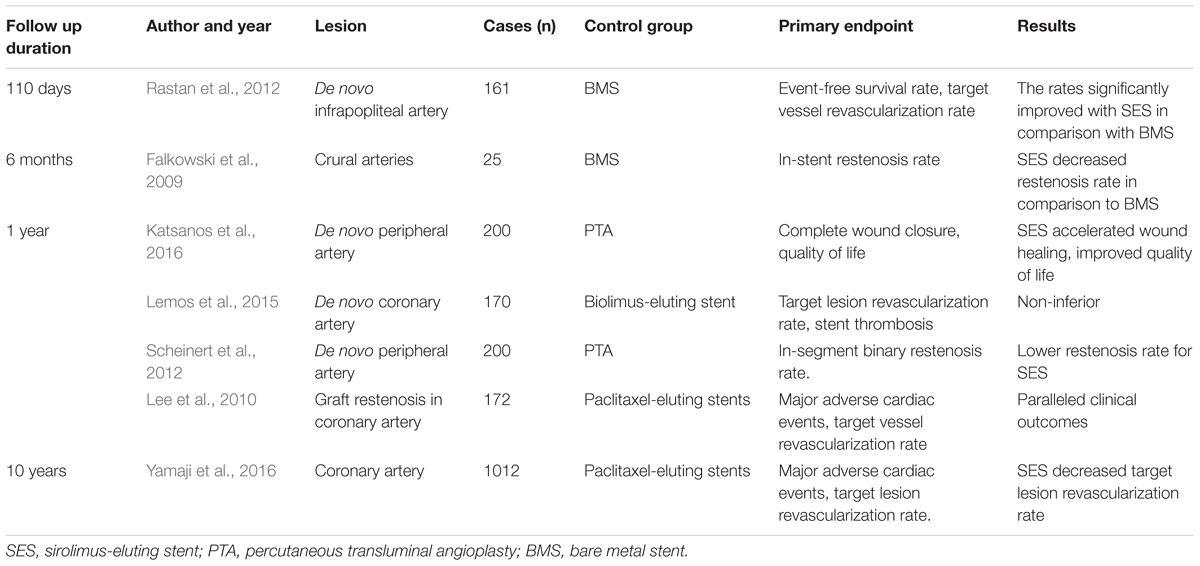
Sirolimus-eluting stents, the first drug-eluting stent approved by the United States Food and Drug Administration, were widely used in treating AS lesions at coronary and other peripheral arteries. The stents were used in the treatment of de novo AS lesions, graft stenosis, and in-stent restenosis, and they had better outcomes than did PTA or other stents. The randomized controlled clinical trials comparing SES and other stents or PTA are tabulated in Table 2.
Table 2. Randomized controlled clinical trials comparing SES and other stents or PTA in the past 10 years.
Rapamycin in de novo Lesions
Sirolimus-eluting stents have advantages over PTA, standard stent or other drug-eluting stents for treatment of de novo lesions. For coronary lesions, it has been reported in a randomized controlled study (Morice et al., 2002) that, in-stent restenosis, repeated revascularization rates and long-term lumen loss were lower in patients who underwent interposition of SES than in those who were treated with standard stents. On the other hand, in below-the-knee atherosclerotic lesions, application of SES can contribute more to lower in-stent restenosis and target-lesion revascularization than do standard stents or PTA in randomized controlled studies (Falkowski et al., 2009; Rastan et al., 2011; Katsanos et al., 2016). Another randomized, multicenter study also demonstrates that at a mean follow-up of 33 months, compared to bare metal stents, SES improved Rutherford-Becker class, long-term event-free survival and amputation rates, but they did not significantly change target-lesion revascularization after being used to treat focal below-the-knee AS (Rastan et al., 2012). Moreover, in another randomized study (Scheinert et al., 2012), a 12-month follow-up found lower in-stent restenosis and greater vessel patency but no significant change in target-lesion revascularization, limb amputation rate, or Rutherford class level with SES versus PTA for symptomatic infrapopliteal lesions. That study also found that event-free survival was significantly higher with SES than with PTA, and SES-treated patients had a better rate of wound healing, health-associated quality-of-life scores, and quality-adjusted life-years at 12 months. Also, a 5-year retrospective analysis of SES -treated chronic below-the-knee lesions (Rutherford categories 3–6) found that although Rutherford classification and vascular patency had decreased significantly at follow-up, the patency rate was 83.8% and Rutherford class level had improved in 92% of the patients with critical limb ischemia. These results have encouraged longer follow-up with SES treatment of critical limb ischemia in patients with below-the-knee lesions (Werner et al., 2012). However, for superficial femoral artery lesions, a randomized, double-blinded, multi-center study demonstrated that at 6 and 24 months’ follow-up, SES had no significant advantage over bare metal stents in relief of symptoms, rates of restenosis, ankle-brachial indices and target-lesion revascularization rate (Duda et al., 2002, 2006). These findings indicated that the effects of SES vary among vessel segments, although these stents had favorable results after intermediate or long duration.
Sirolimus-eluting stents have advantages over other drug-eluting stents, with less in-stent restenosis and target-lesion revascularization. The commonly used agents for coating stents include sirolimus and paclitaxel. A multi-center trial found that SES and paclitaxel have similar target-lesion revascularization. At 12-month follow-up, there was no significant difference in major adverse cardiac events or stent thrombosis between the two groups (Lee et al., 2010). In another randomized controlled comparison of SES and paclitaxel in treating coronary lesions, in a follow-up of 10 years, SES had a lower rate of in-stent restenosis and target-lesion revascularization than did paclitaxel (Yamaji et al., 2016). The inconsistent results may be attributed to variation in patient or lesion characteristics. Therefore, updated meta-analysis studies should be performed to determine the long-term outcome of SES treatment compared with control treatment.
Rapamycin in Restenosis Lesions
Saphenous vein graft interposition is commonly performed with coronary artery bypass grafting. However, the incidence of graft restenosis is significant, and restenosis often necessitates repeated revascularization (Goldman et al., 2004). Endovascular procedures with stent implantation can also be accompanied by a significant rate of restenosis. SES can be used in graft or in-stent restenosis. It has been reported that bare metal stents or PTA have a high restenosis rate compared with that of SES in treating saphenous vein graft lesions (Brilakis et al., 2009). Moreover, in a cohort of 273 patients with 364 coronary lesions, including graft or in-stent restenosis, SES were used, and the mean 24-month follow-up revealed rates of binary restenosis, target-lesion revascularization and stent thrombosis of 5.5, 4.7, and 0.3%, respectively, which are lower than those reported with bare metal stents (Ino et al., 2009).
The Main Challenge to the Application of Rapamycin
The clinical application of RAPA can be accompanied by side effects that limit the routine application of RAPA in patients with AS. The most frequent complication is hyperlipidemia, which may develop in transplant patients treated with RAPA (Kniepeiss et al., 2004). The elevated lipid profiles caused by RAPA may accelerate the formation of AS. The explanation for the hyperlipidemia may be that RAPA suppresses LDL receptor expression in the liver, thereby elevating blood cholesterol and apoproteins concentration and promoting hepatic secretion of triglycerides (Andres et al., 2006). Another study (Otsuka et al., 2015) demonstrated dose-dependent hyperlipidemia induced by RAPA, which could be managed well with postoperative statin therapy. Therefore, a lipid-lowering regimen and lower dosage of RAPA may be needed for patients being treated with RAPA. Other unwanted effects of RAPA are: (1) Inhibitory effects of endothelial progenitor cell-induced re-endothelization, which may cause late stent thrombosis and sudden death. Endothelial progenitor cells, differentiated from circulating MNCs, can repair damaged endothelial cells, thereby promoting re-endothelization (Kalka et al., 2000). RAPA inhibits the differentiation of MNCs into endothelial progenitor cells and promotes the senescence of these cells through suppressing telomerase activity. Several clinical studies have indicated that the use of SES may moderately increase the rate of late stent thrombosis (Daemen et al., 2007; Stone et al., 2007). (2) Delayed re-endothelization via inhibition of VEGF expression and the proliferation of resident endothelial cells (Imanishi et al., 2006), promotes acute stent thrombosis, which is a common early adverse event in stent angioplasty. (3) Vasoconstriction at juxta-SES-implanted coronary segments, which results in the formation of AS in non-target vessels. In evaluating the endothelial function influenced by SES or bare metal stents, vasoconstriction induced by acetylcholine provocation test, as a hallmark of endothelial dysfunction, is elevated at juxta-SES-implanted coronary segments compared with that in the juxta-bare metal stents coronary segment in patients with multiple lesions (Mischie et al., 2013). This finding implies that RAPA may trigger the AS cascade, as impaired endothelial cell function initiates the formation of AS adjacent to the stented vascular segments (Bonetti et al., 2003), with more in-stent restenosis at the edge of SES. This result rules out individual variation because the vasoconstrictive effect occurs at different vascular segments in the same patient. Overall, these adverse effects can offset the promising advantages of RAPA in treating AS lesions.
In advanced atherosclerotic plaque, overactivation of autophagy commonly occurs, which results in elevated cell death or apoptosis. Excessive autophagy stimulation or defective autophagy is a deterrent to treating AS because it can have unexpected adverse events. Additionally, several studies have demonstrated that the vulnerability of various cells to external injury is increased under the above-mentioned autophagy conditions (Jung et al., 2008; Liao et al., 2012). Therefore, the adequate dosage of RAPA used to prevent AS formation or in-stent or graft restenosis should be determined with pharmacological dynamic studies of the optimal blood RAPA concentration achieved with various delivery methods and dosages of the drug. Moreover, although in vitro and in vivo studies have suggested the optimal dosage and stimulation period of RAPA for decreasing the expression of various AS-inducing genes, this information has not been translated into RAPA administration methods in clinical application. There has been much variation in animal models used, such as treatment with angioplasty, variation in vessel grafts, different genetic deficiencies, and differences in cell lines and stimuli. Therefore, determining the optimal concentration and administration period of RAPA is imperative before considering this agent as an anti-AS agent.
Novel methods for achieving safer and more effective administration of RAPA than by systemic administration are being explored. Various types of delivery systems have been developed to reduce systemic side effects in AS, including a liposomal delivery system, a nanoparticle system, and drug-loaded microbubbles (Kilroy et al., 2015; Miao et al., 2015; Dou et al., 2016). (1) RAPA-containing liposomes have been prepared in vitro through an ethanol injection method. The results demonstrated high encapsulation rate of RAPA in the prepared liposomes and a sustained-release effect of the in vitro release of RAPA (Miao et al., 2015). (2) RAPA-loaded nanoparticles, based on various acetalated β-cyclodextrin materials, have been prepared. A sustained-release effect and enhanced anti-AS activity had also been observed in an atherogenic mouse model treated with RAPA nanotherapy (Dou et al., 2016). (3) A new platform that combines intravascular ultrasound (IVUS) and drug-loaded microbubbles has been used in a swine model. Microbubble is an ultrasound contrast agent and can be loaded with RAPA; it reduced neointima formation after balloon injury in swine artery and achieved a comparable blood concentration of RAPA to a commercial SES (Kilroy et al., 2015). Although the above systems lay a foundation for a local delivery system for RAPA targeting the cellular components of atherosclerotic plaques, they have been not been used in clinical practice and need further investigation. Intriguingly, drug-eluting embolic microspheres or beads containing RAPA have been developed in transarterial chemoembolization (Fuchs et al., 2017); the effects of the system in AS remain to be elucidated.
Conclusion
Rapamycin is a promising naturally derived compound that possesses multifaceted anti-AS mechanisms, including anti-inflammatory, lipid-modulatory, immunoregulatory, and autophagy survival effects in early and advanced AS. However, application of RAPA can have side effects, including abnormal lipid profiles, stent thrombosis, and endothelial-cell injuries. The optimal blood concentration and duration of RAPA administration for reaching and integrating the best anti-AS effects of various cell types are not known. Despite reservations about RAPA, it remains an attractive natural agent for the prevention and treatment of AS.
Author Contributions
YL drafted the manuscript. FY and SZ searched the literature. LQ presented the topic, evaluated the literature, and checked up the manuscript.
Funding
This work was supported by the Specifically Invited Professor of Oriental Scholar of Shanghai Colleges and Universities Tracking Program (GZ2016008), and grants from the National Natural Science Foundation of China (8157020854, 81570440, and 81700408).
Conflict of Interest Statement
The authors declare that the research was conducted in the absence of any commercial or financial relationships that could be construed as a potential conflict of interest.
Abbreviations
α-SMA, α-smooth muscle actin; 4EBP-1, 4E–binding protein 1; ABCA1, ATP-binding cassette transporters A1; ABCG1, ATP-binding cassette transporters G1; AS, atherosclerosis; ATG13, autophagy-related protein-13; CCR7, C-C chemokine receptor type 7; CD36, cluster of differentiation 36; CKI, cyclin-dependent kinase inhibitor; eNOS, endothelial nitric oxide synthase; FGF, fibroblast growth factor; FGFR, fibroblast growth factor receptor; FKBP, FK-binding-protein; FRS2, fibroblast growth factor receptor substrate 2; GβL, G-protein β-subunit protein; HDL, high-density lipoprotein; HMGR, 3-hydroxy-3-methylglutaryl coenzyme A reductase; ICAM-1, intercellular adhesion molecule-1; IFN-γ, interferon-γ; IGF, insulin-like growth factor; IL, interleukin; LAMP1, lysosome-associated membrane protein 1; LC3, light chain 3; LDL, low-density lipoprotein; LOX-1, lectin-like oxidized low-density lipoprotein-1; LPS, lipopolysaccharide; LXRα, liver-X-receptor alpha; MNCs, mononuclear cells; mTOR, mammalian target of rapamycin; mTORC1, mTOR complex 1; mTORC2, mTOR complex 2; NF-κB, nuclear factor-k-gene binding; NO, nitric oxide; OX-LDL, oxidized low-density lipoprotein; PDGF, platelet-derived growth factor; PPAR-γ, peroxisome proliferator activated receptor gamma; PTA, percutaneous transluminal angioplasty; RAPA, rapamycin; ROS, reactive oxygen species; S6K1, S6 kinase 1; SA-β-gal, senescence-associated galactosidase; SCAP, SREBP cleavage-activating protein; SES, sirolimus-eluting stents; SIRT1, sirtuin 1; SM-MHC, smooth muscle-myosin heavy chain; SR-A, scavenger receptor-A; SR-BI, scavenger receptor-BI; SR-BII, scavenger receptor- BII; SREBPs, sterol regulatory element-binding proteins; SRs, scavenger receptors; TGF-β, transforming growth factor-β; TLR4, toll-like receptor 4; TNF-α, tumor necrosis factor-α; Treg, regulatory T; ULK1, Unc-51 like autophagy activating kinase 1; VCAM-1, vascular cell adhesion molecule-1; VEGF, vascular endothelial growth factor; VLDL, very low-density lipoprotein; VSMCs, vascular smooth muscle cells.
References
Abraham, R. T., and Wiederrecht, G. J. (1996). Immunopharmacology of rapamycin. Annu. Rev. Immunol. 14, 483–510. doi: 10.1146/annurev.immunol.14.1.483
CrossRef Full Text | Google Scholar
Adelman, S. J. (2010). Sirolimusand its analogs and its effects on vascular diseases. Curr. Pharm. Des. 16, 4002–4011. doi: 10.2174/138161210794454923
CrossRef Full Text | Google Scholar
Akhmedov, A., Rozenberg, I., Paneni, F., Camici, G. G., Shi, Y., Doerries, C., et al. (2014). Endothelial overexpression of LOX-1 increases plaque formation and promotes atherosclerosis in vivo. Eur. Heart J. 35, 2839–2848. doi: 10.1093/eurheartj/eht532
PubMed Abstract | CrossRef Full Text | Google Scholar
Allahverdian, S., Chehroudi, A. C., McManus, B. M., Abraham, T., and Francis, G. A. (2014). Contribution of intimal smooth muscle cells to cholesterol accumulation and macrophage-like cells in human atherosclerosis. Circulation 129, 1551–1559. doi: 10.1161/CIRCULATIONAHA.113.005015
PubMed Abstract | CrossRef Full Text | Google Scholar
Andres, V., Castro, C., and Campistol, J. M. (2006). Potential role of proliferation signal inhibitors on atherosclerosis in renal transplant patients. Nephrol. Dial. Transplant. 21(Suppl. 3), iii14–iii17. doi: 10.1093/ndt/gfl296
PubMed Abstract | CrossRef Full Text | Google Scholar
Basso, M. D., Nambi, P., and Adelman, S. J. (2003). Effect of sirolimus on the cholesterol content of aortic arch in ApoE knockout mice. Transplant. Proc. 35, 3136–3138. doi: 10.1016/j.transproceed.2003.10.050
PubMed Abstract | CrossRef Full Text | Google Scholar
Benjamin, E. J., Blaha, M. J., Chiuve, S. E., Cushman, M., Das, S. R., Deo, R., et al. (2017). Heart disease and stroke statistics-2017 update: a report from the American heart association. Circulation 135, e146–e603. doi: 10.1161/CIR.0000000000000485
PubMed Abstract | CrossRef Full Text | Google Scholar
Bonetti, P. O., Lerman, L. O., and Lerman, A. (2003). Endothelial dysfunction: a marker of atherosclerotic risk. Arterioscler. Thromb. Vasc. Biol. 23, 168–175. doi: 10.1161/01.ATV.0000051384.43104.FC
CrossRef Full Text | Google Scholar
Brilakis, E. S., Lichtenwalter, C., de Lemos, J. A., Roesle, M., Obel, O., Haagen, D., et al. (2009). A randomized controlled trial of a paclitaxel-eluting stent versus a similar bare-metal stent in saphenous vein graft lesions the SOS (stenting of saphenous vein grafts) trial. J. Am. Coll. Cardiol. 53, 919–928. doi: 10.1016/j.jacc.2008.11.029
PubMed Abstract | CrossRef Full Text | Google Scholar
Castro, C., Campistol, J. M., Sancho, D., Sanchez-Madrid, F., Casals, E., and Andres, V. (2004). Rapamycin attenuates atherosclerosis induced by dietary cholesterol in apolipoprotein-deficient mice through a P27 Kip1 -independent pathway. Atherosclerosis 172, 31–38. doi: 10.1016/j.atherosclerosis.2003.09.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, P. Y., and Friesel, R. (2009). FGFR1 forms an FRS2-dependent complex with mTOR to regulate smooth muscle marker gene expression. Biochem. Biophys. Res. Commun. 382, 424–429. doi: 10.1016/j.bbrc.2009.03.040
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, W. Q., Zhong, L., Zhang, L., Ji, X. P., Zhang, M., Zhao, Y. X., et al. (2009). Oral rapamycin attenuates inflammation and enhances stability of atherosclerotic plaques in rabbits independent of serum lipid levels. Br. J. Pharmacol. 156, 941–951. doi: 10.1111/j.1476-5381.2008.00102.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Cheng, C., Tempel, D., Oostlander, A., Helderman, F., Gijsen, F., Wentzel, J., et al. (2008). Rapamycin modulates the enos vs. Shear stress relationship. Cardiovasc. Res. 78, 123–129. doi: 10.1093/cvr/cvm103
PubMed Abstract | CrossRef Full Text | Google Scholar
Chih, S., Chong, A. Y., Mielniczuk, L. M., Bhatt, D. L., and Beanlands, R. S. (2016). Allograft vasculopathy: the achilles’ heel of heart transplantation. J. Am. Coll. Cardiol. 68, 80–91. doi: 10.1016/j.jacc.2016.04.033
PubMed Abstract | CrossRef Full Text | Google Scholar
Chung, I. M., Gold, H. K., Schwartz, S. M., Ikari, Y., Reidy, M. A., and Wight, T. N. (2002). Enhanced extracellular matrix accumulation in restenosis of coronary arteries after stent deployment. J. Am. Coll. Cardiol. 40, 2072–2081. doi: 10.1016/S0735-1097(02)02598-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Clarke, M. C., Figg, N., Maguire, J. J., Davenport, A. P., Goddard, M., Littlewood, T. D., et al. (2006). Apoptosis of vascular smooth muscle cells induces features of plaque vulnerability in atherosclerosis. Nat. Med. 12, 1075–1080. doi: 10.1038/nm1459
PubMed Abstract | CrossRef Full Text | Google Scholar
Cowan, P. A., and Heizer, K. E. (2000). Sirolimus: mammalian target of rapamycin inhibitor to prevent kidney rejection. Nephrol. Nurs. J. 27, 623–625.
Google Scholar
Daemen, J., Wenaweser, P., Tsuchida, K., Abrecht, L., Vaina, S., Morger, C., et al. (2007). Early and late coronary stent thrombosis of sirolimus-eluting and paclitaxel-eluting stents in routine clinical practice: data from a large two-institutional cohort study. Lancet 369, 667–678. doi: 10.1016/S0140-6736(07)60314-6
PubMed Abstract | CrossRef Full Text | Google Scholar
De Meyer, G. R., Grootaert, M. O., Michiels, C. F., Kurdi, A., Schrijvers, D. M., and Martinet, W. (2015). Autophagy in vascular disease. Circ. Res. 116, 468–479. doi: 10.1161/CIRCRESAHA.116.303804
PubMed Abstract | CrossRef Full Text | Google Scholar
Deanfield, J. E., Halcox, J. P., and Rabelink, T. J. (2007). Endothelial function and dysfunction: testing and clinical relevance. Circulation 115, 1285–1295. doi: 10.1161/CIRCULATIONAHA.106.652859
PubMed Abstract | CrossRef Full Text | Google Scholar
Dichtl, W., Stocker, E. M., Mistlberger, K., Debbage, P., Yan, Z. Q., Alber, H. F., et al. (2006). Countervailing effects of rapamycin (sirolimus) on nuclear factor-kappa b activities in neointimal and medial smooth muscle cells. Atherosclerosis 186, 321–330. doi: 10.1016/j.atherosclerosis.2005.08.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Ding, M., Xie, Y., Wagner, R. J., Jin, Y., Carrao, A. C., Liu, L. S., et al. (2011). Adiponectin induces vascular smooth muscle cell differentiation via repression of mammalian target of rapamycin complex 1 and FOXO4. Arterioscler. Thromb. Vasc. Biol. 31, 1403–1410. doi: 10.1161/ATVBAHA.110.216804
PubMed Abstract | CrossRef Full Text | Google Scholar
Dou, Y., Guo, J., Chen, Y., Han, S., Xu, X., Shi, Q., et al. (2016). Sustained delivery by a cyclodextrin material-based nanocarrier potentiates antiatherosclerotic activity of rapamycin via selectively inhibiting mTORC1 in mice. J. Control. Release 235, 48–62. doi: 10.1016/j.jconrel.2016.05.049
PubMed Abstract | CrossRef Full Text | Google Scholar
Duda, S. H., Bosiers, M., Lammer, J., Scheinert, D., Zeller, T., Oliva, V., et al. (2006). Drug-eluting and bare nitinol stents for the treatment of atherosclerotic lesions in the superficial femoral artery: long-term results from the sirocco trial. J. Endovasc. Ther. 13, 701–710. doi: 10.1583/05-1704.1
PubMed Abstract | CrossRef Full Text | Google Scholar
Duda, S. H., Pusich, B., Richter, G., Landwehr, P., Oliva, V. L., Tielbeek, A., et al. (2002). Sirolimus-eluting stents for the treatment of obstructive superficial femoral artery disease: six-month results. Circulation 106, 1505–1509. doi: 10.1161/01.CIR.0000029746.10018.36
CrossRef Full Text | Google Scholar
Dumont, F. J., and Su, Q. (1996). Mechanism of action of the immunosuppressant rapamycin. Life Sci. 58, 373–395. doi: 10.1016/0024-3205(95)02233-3
CrossRef Full Text | Google Scholar
Elloso, M. M., Azrolan, N., Sehgal, S. N., Hsu, P. L., Phiel, K. L., Kopec, C. A., et al. (2003). Protective effect of the immunosuppressant sirolimus against aortic atherosclerosis in APO E-deficient mice. Am. J. Transplant. 3, 562–569. doi: 10.1034/j.1600-6143.2003.00094.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Falkowski, A., Poncyljusz, W., Wilk, G., and Szczerbo-Trojanowska, M. (2009). The evaluation of primary stenting of sirolimus-eluting versus bare-metal stents in the treatment of atherosclerotic lesions of crural arteries. Eur. Radiol. 19, 966–974. doi: 10.1007/s00330-008-1225-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Farb, A., Kolodgie, F. D., Hwang, J. Y., Burke, A. P., Tefera, K., Weber, D. K., et al. (2004). Extracellular matrix changes in stented human coronary arteries. Circulation 110, 940–947. doi: 10.1161/01.CIR.0000139337.56084.30
PubMed Abstract | CrossRef Full Text | Google Scholar
Feig, J. E., Pineda-Torra, I., Sanson, M., Bradley, M. N., Vengrenyuk, Y., Bogunovic, D., et al. (2010). LXR promotes the maximal egress of monocyte-derived cells from mouse aortic plaques during atherosclerosis regression. J. Clin. Invest. 120, 4415–4424. doi: 10.1172/JCI38911
PubMed Abstract | CrossRef Full Text | Google Scholar
Fruhwurth, S., Krieger, S., Winter, K., Rosner, M., Mikula, M., Weichhart, T., et al. (2014). Inhibition of mtor down-regulates scavenger receptor, class b, type I (SR-BI) expression, reduces endothelial cell migration and impairs nitric oxide production. Biochim. Biophys. Acta 1841, 944–953. doi: 10.1016/j.bbalip.2014.03.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Fuchs, K., Duran, R., Denys, A., Bize, P. E., Borchard, G., and Jordan, O. (2017). Drug-eluting embolic microspheres for local drug delivery — state of the art. J. Control. Release 262, 127–138. doi: 10.1016/j.jconrel.2017.07.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Gadioli, A. L., Nogueira, B. V., Arruda, R. M., Pereira, R. B., Meyrelles, S. S., Arruda, J. A., et al. (2009). Oral rapamycin attenuates atherosclerosis without affecting the arterial responsiveness of resistance vessels in apolipoprotein E-deficient mice. Braz. J. Med. Biol. Res. 42, 1191–1195. doi: 10.1590/S0100-879X2009005000036
PubMed Abstract | CrossRef Full Text | Google Scholar
Garcia, J. A., and Rini, B. I. (2007). Recent progress in the management of advanced renal cell carcinoma. CA Cancer J. Clin. 57, 112–125. doi: 10.3322/canjclin.57.2.112
CrossRef Full Text | Google Scholar
Gardner, S. E., Humphry, M., Bennett, M. R., and Clarke, M. C. (2015). Senescent vascular smooth muscle cells drive inflammation through an interleukin-1alpha-dependent senescence-associated secretory phenotype. Arterioscler. Thromb. Vasc. Biol. 35, 1963–1974. doi: 10.1161/ATVBAHA.115.305896
PubMed Abstract | CrossRef Full Text | Google Scholar
Goldman, S., Zadina, K., Moritz, T., Ovitt, T., Sethi, G., Copeland, J. G., et al. (2004). Long-term patency of saphenous vein and left internal mammary artery grafts after coronary artery bypass surgery: results from a department of veterans affairs cooperative study. J. Am. Coll. Cardiol. 44, 2149–2156. doi: 10.1016/j.jacc.2004.08.064
PubMed Abstract | CrossRef Full Text | Google Scholar
Goueffic, Y., Potter-Perigo, S., Chan, C. K., Johnson, P. Y., Braun, K., Evanko, S. P., et al. (2007). Sirolimus blocks the accumulation of hyaluronan (HA) by arterial smooth muscle cells and reduces monocyte adhesion to the ECM. Atherosclerosis 195, 23–30. doi: 10.1016/j.atherosclerosis.2006.11.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Grootaert, M. O. J., Roth, L., Schrijvers, D. M., De Meyer, G. R. Y., and Martinet, W. (2018). Defective autophagy in atherosclerosis: to die or to senesce? Oxid. Med. Cell. Longev. 2018:7687083. doi: 10.1155/2018/7687083
PubMed Abstract | CrossRef Full Text | Google Scholar
Guo, F., Li, X., Peng, J., Tang, Y., Yang, Q., Liu, L., et al. (2014). Autophagy regulates vascular endothelial cell enos and ET-1 expression induced by laminar shear stress in an ex vivo perfused system. Ann. Biomed. Eng. 42, 1978–1988. doi: 10.1007/s10439-014-1033-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Imanishi, T., Kobayashi, K., Kuki, S., Takahashi, C., and Akasaka, T. (2006). Sirolimus accelerates senescence of endothelial progenitor cells through telomerase inactivation. Atherosclerosis 189, 288–296. doi: 10.1016/j.atherosclerosis.2005.12.031
PubMed Abstract | CrossRef Full Text | Google Scholar
Ino, Y., Toyoda, Y., Tanaka, A., Ishii, S., Kusuyama, Y., Kubo, T., et al. (2009). Predictors and prognosis of stent fracture after sirolimus-eluting stent implantation. Circ. J. 73, 2036–2041. doi: 10.1253/circj.CJ-09-0343
CrossRef Full Text | Google Scholar
Jung, H. S., Chung, K. W., Won Kim, J., Kim, J., Komatsu, M., Tanaka, K., et al. (2008). Loss of autophagy diminishes pancreatic beta cell mass and function with resultant hyperglycemia. Cell. Metab. 8, 318–324. doi: 10.1016/j.cmet.2008.08.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Kahan, B. D. (2000). Efficacy of sirolimus compared with azathioprine for reduction of acute renal allograft rejection: a randomised multicentre study. The rapamune us study group. Lancet 356, 194–202. doi: 10.1016/S0140-6736(00)02480-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Kahan, B. D., Podbielski, J., Napoli, K. L., Katz, S. M., Meier-Kriesche, H. U., and Van Buren, C. T. (1998). Immunosuppressive effects and safety of a sirolimus/cyclosporine combination regimen for renal transplantation. Transplantation 66, 1040–1046. doi: 10.1097/00007890-199810270-00013
PubMed Abstract | CrossRef Full Text | Google Scholar
Kalka, C., Masuda, H., Takahashi, T., Kalka-Moll, W. M., Silver, M., Kearney, M., et al. (2000). Transplantation of ex vivo expanded endothelial progenitor cells for therapeutic neovascularization. Proc. Natl. Acad. Sci. U.S.A. 97, 3422–3427. doi: 10.1073/pnas.070046397
PubMed Abstract | CrossRef Full Text | Google Scholar
Katsanos, K., Spiliopoulos, S., Diamantopoulos, A., Siablis, D., Karnabatidis, D., Scheinert, D., et al. (2016). Wound healing outcomes and health-related quality-of-life changes in the achilles trial: 1-year results from a prospective randomized controlled trial of infrapopliteal balloon angioplasty versus sirolimus-eluting stenting in patients with ischemic peripheral arterial disease. JACC Cardiovasc. Interv. 9, 259–267. doi: 10.1016/j.jcin.2015.10.038
PubMed Abstract | CrossRef Full Text | Google Scholar
Keogh, A., Richardson, M., Ruygrok, P., Spratt, P., Galbraith, A., O’Driscoll, G., et al. (2004). Sirolimus in de novo heart transplant recipients reduces acute rejection and prevents coronary artery disease at 2 years: a randomized clinical trial. Circulation 110, 2694–2700. doi: 10.1161/01.CIR.0000136812.90177.94
PubMed Abstract | CrossRef Full Text | Google Scholar
Khodabandehlou, K., Masehi-Lano, J. J., Poon, C., Wang, J., and Chung, E. J. (2017). Targeting cell adhesion molecules with nanoparticles using in vivo and flow-based in vitro models of atherosclerosis. Exp. Biol. Med. 242, 799–812. doi: 10.1177/1535370217693116
PubMed Abstract | CrossRef Full Text | Google Scholar
Kilroy, J. P., Dhanaliwala, A. H., Klibanov, A. L., Bowles, D. K., Wamhoff, B. R., and Hossack, J. A. (2015). Reducing neointima formation in a swine model with IVUS and sirolimus microbubbles. Ann. Biomed. Eng. 43, 2642–2651. doi: 10.1007/s10439-015-1315-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Kniepeiss, D., Iberer, F., Schaffellner, S., Jakoby, E., Duller, D., and Tscheliessnigg, K. (2004). Dyslipidemia during sirolimus therapy in patients after liver transplantation. Clin. Transplant. 18, 642–646. doi: 10.1111/j.1399-0012.2004.00253.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Koh, K. P., Wang, Y., Yi, T., Shiao, S. L., Lorber, M. I., Sessa, W. C., et al. (2004). T cell-mediated vascular dysfunction of human allografts results from IFN-gamma dysregulation of no synthase. J. Clin. Invest. 114, 846–856. doi: 10.1172/JCI21767
PubMed Abstract | CrossRef Full Text | Google Scholar
Kume, N., and Kita, T. (2004). Apoptosis of vascular cells by oxidized LDL: Involvement of caspases and LOX-1 and its implication in atherosclerotic plaque rupture. Circ. Res. 94, 269–270. doi: 10.1161/01.RES.0000119804.92239.97
PubMed Abstract | CrossRef Full Text | Google Scholar
Lacolley, P., Regnault, V., Segers, P., and Laurent, S. (2017). Vascular smooth muscle cells and arterial stiffening: relevance in development, aging, and disease. Physiol. Rev. 97, 1555–1617. doi: 10.1152/physrev.00003.2017
PubMed Abstract | CrossRef Full Text | Google Scholar
Lee, M. S., Hu, P. P., Aragon, J., Shah, A. P., Oyama, J., Dhoot, J., et al. (2010). Comparison of sirolimus-eluting stents with paclitaxel-eluting stents in saphenous vein graft intervention (from a multicenter southern California registry). Am. J. Cardiol. 106, 337–341. doi: 10.1016/j.amjcard.2010.03.030
PubMed Abstract | CrossRef Full Text | Google Scholar
Lehle, K., Schreml, S., Kunz-Schughart, L. A., Rupprecht, L., Birnbaum, D. E., Schmid, C., et al. (2008). Mtor inhibitors and calcineurin inhibitors do not affect adhesion molecule expression of human macro- and microvascular endothelial cells. J. Vasc. Res. 45, 333–342. doi: 10.1159/000119199
PubMed Abstract | CrossRef Full Text | Google Scholar
Lemos, P. A., Abizaid, A. A., Meireles, G. C., Sarmento-Leite, R., Prudente, M., Cantarelli, M., et al. (2015). Metallic limus-eluting stents abluminally coated with biodegradable polymers: angiographic and clinical comparison of a novel ultra-thin sirolimus stent versus biolimus stent in the destiny randomized trial. Cardiovasc. Ther. 33, 367–371. doi: 10.1111/1755-5922.12159
PubMed Abstract | CrossRef Full Text | Google Scholar
Liao, X., Sluimer, J. C., Wang, Y., Subramanian, M., Brown, K., Pattison, J. S., et al. (2012). Macrophage autophagy plays a protective role in advanced atherosclerosis. Cell Metab. 15, 545–553. doi: 10.1016/j.cmet.2012.01.022
PubMed Abstract | CrossRef Full Text | Google Scholar
Ling, W., Lougheed, M., Suzuki, H., Buchan, A., Kodama, T., and Steinbrecher, U. P. (1997). Oxidized or acetylated low density lipoproteins are rapidly cleared by the liver in mice with disruption of the scavenger receptor class a type I/II gene. J. Clin. Invest. 100, 244–252. doi: 10.1172/JCI119528
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, C., and Huang, Y. (2016). Chinese herbal medicine on cardiovascular diseases and the mechanisms of action. Front. Pharmacol. 7:469. doi: 10.3389/fphar.2016.00469
CrossRef Full Text | Google Scholar
Liu, X., Tang, Y., Cui, Y., Zhang, H., and Zhang, D. (2016). Autophagy is associated with cell fate in the process of macrophage-derived foam cells formation and progress. J. Biomed. Sci. 23:57. doi: 10.1186/s12929-016-0274-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Luo, Y., Shang, P., and Li, D. (2017). Luteolin: a flavonoid that has multiple cardio-protective effects and its molecular mechanisms. Front. Pharmacol. 8:692. doi: 10.3389/fphar.2017.00692
PubMed Abstract | CrossRef Full Text | Google Scholar
Luo, Z., Xu, W., Ma, S., Qiao, H., Gao, L., Zhang, R., et al. (2017). Moderate autophagy inhibits vascular smooth muscle cell senescence to stabilize progressed atherosclerotic plaque via the mtorc1/ULK1/Atg13 signal pathway. Oxid. Med. Cell. Longev. 2017:3018190. doi: 10.1155/2017/3018190
PubMed Abstract | CrossRef Full Text | Google Scholar
Ma, J., Yang, S., Ma, A., Pan, X., Wang, H., Li, N., et al. (2017). Expression of miRNA-155 in carotid atherosclerotic plaques of apolipoprotein E knockout (APoE(-/-)) mice and the interventional effect of rapamycin. Int. Immunopharmacol. 46, 70–74. doi: 10.1016/j.intimp.2017.02.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Ma, K. L., Ruan, X. Z., Powis, S. H., Moorhead, J. F., and Varghese, Z. (2007). Anti-atherosclerotic effects of sirolimus on human vascular smooth muscle cells. Am. J. Physiol. Heart. Circ. Physiol. 292, H2721–H2728. doi: 10.1152/ajpheart.01174.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
Ma, K. L., Varghese, Z., Ku, Y., Powis, S. H., Chen, Y., Moorhead, J. F., et al. (2010). Sirolimus inhibits endogenous cholesterol synthesis induced by inflammatory stress in human vascular smooth muscle cells. Am. J. Physiol. Heart. Circ. Physiol. 298, H1646–H1651. doi: 10.1152/ajpheart.00492.2009
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, K. A., Rzucidlo, E. M., Merenick, B. L., Fingar, D. C., Brown, D. J., Wagner, R. J., et al. (2004). The mtor/p70 S6K1 pathway regulates vascular smooth muscle cell differentiation. Am. J. Physiol. Cell. Physiol. 286, C507–C517. doi: 10.1152/ajpcell.00201.2003
PubMed Abstract | CrossRef Full Text | Google Scholar
Mathis, A. S., Jin, S., Friedman, G. S., Peng, F., Carl, S. M., and Knipp, G. T. (2007). The pharmacodynamic effects of sirolimus and sirolimus-calcineurin inhibitor combinations on macrophage scavenger and nuclear hormone receptors. J. Pharm. Sci. 96, 209–222. doi: 10.1002/jps.20751
PubMed Abstract | CrossRef Full Text | Google Scholar
Miao, Z. L., Deng, Y. J., Du, H. Y., Suo, X. B., Wang, X. Y., Wang, X., et al. (2015). Preparation of a liposomal delivery system and its in vitro release of rapamycin. Exp. Ther. Med. 9, 941–946. doi: 10.3892/etm.2015.2201
PubMed Abstract | CrossRef Full Text | Google Scholar
Mischie, A. N., Nazzaro, M. S., Fiorilli, R., De Felice, F., Musto, C., Confessore, P., et al. (2013). Head-to-head comparison of sirolimus-eluting stent versus bare metal stent evaluation of the coronary endothelial dysfunction in the same patient presenting with multiple coronary artery lesions: the credential study. Catheter. Cardiovasc. Interv. 82, E184–E191. doi: 10.1002/ccd.24844
PubMed Abstract | CrossRef Full Text | Google Scholar
Morice, M. C., Serruys, P. W., Sousa, J. E., Fajadet, J., Ban Hayashi, E., Perin, M., et al. (2002). A randomized comparison of a sirolimus-eluting stent with a standard stent for coronary revascularization. N. Engl. J. Med. 346, 1773–1780. doi: 10.1056/NEJMoa012843
PubMed Abstract | CrossRef Full Text | Google Scholar
Nemchenko, A., Chiong, M., Turer, A., Lavandero, S., and Hill, J. A. (2011). Autophagy as a therapeutic target in cardiovascular disease. J. Mol. Cell. Cardiol. 51, 584–593. doi: 10.1016/j.yjmcc.2011.06.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Niccoli, G., Liuzzo, G., Montone, R. A., and Crea, F. (2014). Advances in mechanisms, imaging and management of the unstable plaque. Atherosclerosis 233, 467–477. doi: 10.1016/j.atherosclerosis.2014.01.036
PubMed Abstract | CrossRef Full Text | Google Scholar
Ohkawa, Y., Hayashi, K., and Sobue, K. (2003). Calcineurin-mediated pathway involved in the differentiated phenotype of smooth muscle cells. Biochem. Biophys. Res. Commun. 301, 78–83. doi: 10.1016/S0006-291X(02)02965-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Ollivier, V., Hammal, S., Ameziane, N., Labro, M. T., and de Prost, D. (2005). Modulation of tissue factor expression by rapamycin and FK-506 in lipopolysaccharide-stimulated human mononuclear cells and serum-stimulated aortic smooth muscle cells. Thromb. Haemost. 94, 46–52. doi: 10.1160/TH04-10-0661
PubMed Abstract | CrossRef Full Text | Google Scholar
Otsuka, F., Byrne, R. A., Yahagi, K., Mori, H., Ladich, E., Fowler, D. R., et al. (2015). Neoatherosclerosis: overview of histopathologic findings and implications for intravascular imaging assessment. Eur. Heart J. 36, 2147–2159. doi: 10.1093/eurheartj/ehv205
PubMed Abstract | CrossRef Full Text | Google Scholar
Pakala, R., Stabile, E., Jang, G. J., Clavijo, L., and Waksman, R. (2005). Rapamycin attenuates atherosclerotic plaque progression in apolipoprotein E knockout mice: inhibitory effect on monocyte chemotaxis. J. Cardiovasc. Pharmacol. 46, 481–486. doi: 10.1097/01.fjc.0000177985.14305.15
PubMed Abstract | CrossRef Full Text | Google Scholar
Pan, S., Lin, H., Luo, H., Gao, F., Meng, L., Zhou, C., et al. (2017). Folic acid inhibits dedifferentiation of PDGF-BB-induced vascular smooth muscle cells by suppressing mTOR/P70S6K signaling. Am. J. Transl. Res. 9, 1307–1316.
PubMed Abstract | Google Scholar
Potekhina, A. V., Provatorov, S. I., Sokolov, V. O., Pylaeva, E. A., Masenko, V. P., Noeva, E. A., et al. (2011). CD4(+)CD25(high)CD127(low) regulatory T cells in patients with stable angina and their dynamics after intracoronary sirolimus-eluting stent implantation. Hum. Immunol. 72, 553–557. doi: 10.1016/j.humimm.2011.03.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Rastan, A., Brechtel, K., Krankenberg, H., Zahorsky, R., Tepe, G., Noory, E., et al. (2012). Sirolimus-eluting stents for treatment of infrapopliteal arteries reduce clinical event rate compared to bare-metal stents: long-term results from a randomized trial. J. Am. Coll. Cardiol. 60, 587–591. doi: 10.1016/j.jacc.2012.04.035
PubMed Abstract | CrossRef Full Text | Google Scholar
Rastan, A., Tepe, G., Krankenberg, H., Zahorsky, R., Beschorner, U., Noory, E., et al. (2011). Sirolimus-eluting stents vs. Bare-metal stents for treatment of focal lesions in infrapopliteal arteries: a double-blind, multi-centre, randomized clinical trial. Eur. Heart J. 32, 2274–2281. doi: 10.1093/eurheartj/ehr144
PubMed Abstract | CrossRef Full Text | Google Scholar
Roberts, P. J., and Der, C. J. (2007). Targeting the Raf-MEK-ERK mitogen-activated protein kinase cascade for the treatment of cancer. Oncogene 26, 3291–3310. doi: 10.1038/sj.onc.1210422
PubMed Abstract | CrossRef Full Text | Google Scholar
Roth, R. J., Skoura, A., Matevossian, A., Danai, L. V., Zheng, W., Cortes, C., et al. (2015). Endothelial protein kinase MAP4K4 promotes vascular inflammation and atherosclerosis. Nat. Commun. 6:8995. doi: 10.1038/ncomms9995
PubMed Abstract | CrossRef Full Text | Google Scholar
Sanchez-Plumed, J. A., Gonzalez, M., Alonso, A., and Arias, M. (2006). Sirolimus, the first mtor inhibitor. Nefrologia 26(Suppl. 2), 21–32.
Google Scholar
Scheinert, D., Katsanos, K., Zeller, T., Koppensteiner, R., Commeau, P., Bosiers, M., et al. (2012). A prospective randomized multicenter comparison of balloon angioplasty and infrapopliteal stenting with the sirolimus-eluting stent in patients with ischemic peripheral arterial disease: 1-year results from the achilles trial. J. Am. Coll. Cardiol. 60, 2290–2295. doi: 10.1016/j.jacc.2012.08.989
PubMed Abstract | CrossRef Full Text | Google Scholar
Schmitt, M. M., Megens, R. T., Zernecke, A., Bidzhekov, K., van den Akker, N. M., Rademakers, T., et al. (2014). Endothelial junctional adhesion molecule-A guides monocytes into flow-dependent predilection sites of atherosclerosis. Circulation 129, 66–76. doi: 10.1161/CIRCULATIONAHA.113.004149
PubMed Abstract | CrossRef Full Text
Sehgal, S. N., Baker, H., and Vezina, C. (1975). Rapamycin (ay-22,989), a new antifungal antibiotic. II. Fermentation, isolation and characterization. J. Antibiot. 28, 727–732. doi: 10.7164/antibiotics.28.727
PubMed Abstract | CrossRef Full Text | Google Scholar
Shitrit, D., Rahamimov, R., Gidon, S., Bakal, I., Bargil-Shitrit, A., Milton, S., et al. (2005). Use of sirolimus and low-dose calcineurin inhibitor in lung transplant recipients with renal impairment: results of a controlled pilot study. Kidney Int. 67, 1471–1475. doi: 10.1111/j.1523-1755.2005.00224.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Soltani, A., Bahreyni, A., Boroumand, N., Roshan, M. K., Khazaei, M., Ryzhikov, M., et al. (2018). Therapeutic potency of mtor signaling pharmacological inhibitors in the treatment of proinflammatory diseases, current status, and perspectives. J. Cell. Physiol. 233, 4783–4790. doi: 10.1002/jcp.26276
PubMed Abstract | CrossRef Full Text | Google Scholar
Stone, G. W., Moses, J. W., Ellis, S. G., Schofer, J., Dawkins, K. D., Morice, M. C., et al. (2007). Safety and efficacy of sirolimus- and paclitaxel-eluting coronary stents. N. Engl. J. Med. 356, 998–1008. doi: 10.1056/NEJMoa067193
PubMed Abstract | CrossRef Full Text | Google Scholar
Sun, J. J., Yin, X. W., Liu, H. H., Du, W. X., Shi, L. Y., Huang, Y. B., et al. (2017). Rapamycin inhibits ox-LDL-induced inflammation in human endothelial cells in vitro by inhibiting the mTORC2/PKC/c-Fos pathway. Acta Pharmacol. Sin. 39, 336–344. doi: 10.1038/aps.2017.102
PubMed Abstract | CrossRef Full Text | Google Scholar
Tarantino, G., and Capone, D. (2013). Inhibition of the mtor pathway: a possible protective role in coronary artery disease. Ann. Med. 45, 348–356. doi: 10.3109/07853890.2013.770333
PubMed Abstract | CrossRef Full Text | Google Scholar
Trapp, A., and Weis, M. (2005). The impact of immunosuppression on endothelial function. J. Cardiovasc. Pharmacol. 45, 81–87. doi: 10.1097/00005344-200501000-00014
CrossRef Full Text | Google Scholar
Trotter, J. F., Wachs, M., Bak, T., Trouillot, T., Stolpman, N., Everson, G. T., et al. (2001). Liver transplantation using sirolimus and minimal corticosteroids (3-day taper). Liver Transpl. 7, 343–351. doi: 10.1053/jlts.2001.23012
PubMed Abstract | CrossRef Full Text | Google Scholar
Varghese, Z., Fernando, R., Moorhead, J. F., Powis, S. H., and Ruan, X. Z. (2005). Effects of sirolimus on mesangial cell cholesterol homeostasis: a novel mechanism for its action against lipid-mediated injury in renal allografts. Am. J. Physiol. Renal. Physiol. 289, F43–F48. doi: 10.1152/ajprenal.00181.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, C., Qin, L., Manes, T. D., Kirkiles-Smith, N. C., Tellides, G., and Pober, J. S. (2014). Rapamycin antagonizes TNF induction of VCAM-1 on endothelial cells by inhibiting mTORC2. J. Exp. Med. 211, 395–404. doi: 10.1084/jem.20131125
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, Y., Bai, Y., Qin, L., Zhang, P., Yi, T., Teesdale, S. A., et al. (2007). Interferon-gamma induces human vascular smooth muscle cell proliferation and intimal expansion by phosphatidylinositol 3-kinase dependent mammalian target of rapamycin raptor complex 1 activation. Circ. Res. 101, 560–569. doi: 10.1161/CIRCRESAHA.107.151068
PubMed Abstract | CrossRef Full Text | Google Scholar
Werner, M., Schmidt, A., Freyer, M., Bausback, Y., Braunlich, S., Friedenberger, J., et al. (2012). Sirolimus-eluting stents for the treatment of infrapopliteal arteries in chronic limb ischemia: long-term clinical and angiographic follow-up. J. Endovasc. Ther. 19, 12–19. doi: 10.1583/11-3665.1
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamaji, K., Raber, L., Zanchin, T., Spitzer, E., Zanchin, C., Pilgrim, T., et al. (2016). Ten-year clinical outcomes of first-generation drug-eluting stents: the sirolimus-eluting vs. Paclitaxel-eluting stents for coronary revascularization (SIRTAX) very late trial. Eur. Heart J. 37, 3386–3395. doi: 10.1093/eurheartj/ehw343
PubMed Abstract | CrossRef Full Text | Google Scholar
Yu, M., Kang, X., Xue, H., and Yin, H. (2011). Toll-like receptor 4 is up-regulated by mTOR activation during THP-1 macrophage foam cells formation. Acta Biochim. Biophys. Sin. 43, 940–947. doi: 10.1093/abbs/gmr093
PubMed Abstract | CrossRef Full Text | Google Scholar
Zeng, H. T., Fu, Y. C., Yu, W., Lin, J. M., Zhou, L., Liu, L., et al. (2013). SIRT1 prevents atherosclerosis via liver-X-receptor and NF-kappab signaling in a U937 cell model. Mol. Med. Rep. 8, 23–28. doi: 10.3892/mmr.2013.1460
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, M., Zhu, H., Ding, Y., Liu, Z., Cai, Z., and Zou, M. H. (2017). AMP-activated protein kinase alpha1 promotes atherogenesis by increasing monocyte-to-macrophage differentiation. J. Biol. Chem. 292, 7888–7903. doi: 10.1074/jbc.M117.779447
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, Y., Han, Q., You, S., Cao, Y., Zhang, X., Liu, H., et al. (2015). Rapamycin promotes the autophagic degradation of oxidized low-density lipoprotein in human umbilical vein endothelial cells. J. Vasc. Res. 52, 210–219. doi: 10.1159/000441143
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, Y. L., Cao, Y. J., Zhang, X., Liu, H. H., Tong, T., Xiao, G. D., et al. (2010). The autophagy-lysosome pathway: a novel mechanism involved in the processing of oxidized LDL in human vascular endothelial cells. Biochem. Biophys. Res. Commun. 394, 377–382. doi: 10.1016/j.bbrc.2010.03.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhao, L., Ding, T., Cyrus, T., Cheng, Y., Tian, H., Ma, M., et al. (2009). Low-dose oral sirolimus reduces atherogenesis, vascular inflammation and modulates plaque composition in mice lacking the LDL receptor. Br. J. Pharmacol. 156, 774–785. doi: 10.1111/j.1476-5381.2008.00080.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Zheng, H., Fu, Y., Huang, Y., Zheng, X., Yu, W., and Wang, W. (2017). mTOR signaling promotes foam cell formation and inhibits foam cell egress through suppressing the SIRT1 signaling pathway. Mol. Med. Rep. 16, 3315–3323. doi: 10.3892/mmr.2017.7032
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, Y. D., Cao, X. Q., Liu, Z. H., Cao, Y. J., Liu, C. F., Zhang, Y. L., et al. (2016). Rapamycin inhibits oxidized low density lipoprotein uptake in human umbilical vein endothelial cells via mTOR/NF-kappab/lox-1 pathway. PLoS One 11:e0146777. doi: 10.1371/journal.pone.0146777
PubMed Abstract | CrossRef Full Text | Google Scholar
Луиcу 27, он работает на сборочном конвейере в Три Риверс (Three Rivers) в штате Мичиган. А Чарльз — обычный 50-летний семьянин со средним уровнем заработка из Атланты. Вэну 72, и он пенсионер. Что объединяет этих троих, кроме их американского гражданства? Они все не хотят умирать и употребляют препарат рапамицин, который, как они верят, замедлит их старение. В России биохакеры рапамицин почти не употребляют — но не потому, что не хотят, а потому что он, мягко скажем, дороговат — от 450 рублей за таблетку. Но можно предположить, что в будущем он станет дешевле, и тогда…
Впервые лекарство от старения начали искать тысячи лет назад. Ещё Гильгамеш пытался найти способ жить вечно. (Парень обратился к пережившему потоп бессмертному старцу и был послан им… на дно морское искать определённый тип коралла. Поиски закончились не то чтобы особенно успешно — Гильгамеш давно не с нами). Далее — античный историк Геродот писал про дарующий долгожительство фонтан, а в Средние века вечную жизнь сулил отважным рыцарям Святой Грааль. С тех эпических времён пор много воды утекло, но несмотря на то, что мы далеко продвинулись в понимании мира в сравнении хоть с Гильшамешем, хоть с людьми Средневековья, рецепт бессмертия так и не найден.
Сейчас популярен активизм по радикальному продлению жизни. Приверженцы идеи хотят продлить здоровую жизнь человека методами классической медицины. Они выступают за скорейшее начало испытаний препаратов от старости на людях, поэтому лоббируют признание старения отдельным заболеванием. Биохакеры, вслед за ними, начинают экспериментировать на себе с препаратами, показавшими на модельных животных эффективность в борьбе со старостью. Таким образом биохакеры пытаются заполнить пробел, обусловленный отсутствием клинических испытаний, и предоставить в распоряжение науки хотя бы одиночные примеры продолжительного действия тех или иных препаратов (ну и, конечно, продлить себе жизнь!).
Один из таких многообещающих препаратов, полюбившихся биохакерам, — рапамицин. И хотя в арсенале врача он появился на рубеже прошедшего и нынешнего веков, его история как потенциального лекарства от старости началась несколько позже…
Как ходить босиком и не подхватить столбняк
История рапамицина начинается в 1965 году. Доктор Стэнли Скорына (Stanley Skoryna) из Университета Макгилла в Монреале (McGill University, Montreal) тогда убедил ВОЗ предоставить финансирование для пилотного проекта по изучению взаимосвязи между наследственностью, болезнями и природой острова Пасхи. В результате была организована канадская исследовательская экспедиция на этот остров. В её ходе было замечено, что хотя аборигены ходили босиком, они не подхватывали столбнячную палочку и грибки. Учёные решили, что в земле острова содержится что-то особенное, и, собрав её образцы, оставили их на хранение в университетской лаборатории.
В 1975 году при поддержке компании Ayerst (Ayerst, McKenna and Harrison, Ltd.) Сурендра Натх Сегал (Surendra Nath Sehgal) и коллеги вернулись к этим образцам и попытались найти в них бактерии, выделяющие противогрибковые вещества (бактерии, к слову, могут храниться замороженными много лет). Эксперимент прошёл успешно, и они наткнулись на Streptomyces hygroscopicus (потом переименованную в S. rapamycinicus), выделяющую в процессе жизнедеятельности антибиотик из класса макролидов с противогрибковым действием. Вещество было названо рапамицином в честь названия острова на языке местного населения — Rapa Nui. Но в дальнейших исследованиях выяснилось, что вещество обладает нежелательным побочным действием — оно подавляет иммунитет! (Когда вы лечитесь от грибковых инфекций, иммунодепрессия — это не то, чего вы хотите). В итоге о нём забыли, а лаборатория компании переехала из Канады в Принстон (Princeton University), Нью Джерси. Но заинтересованность Сурендры Натха Сегала в рапамицине была настолько велика, что он перед переездом заготовил вещество в большом количестве, зная, что на новом месте у него не будет компонентов и условий, и привёз с собой.
В 1987-м, когда иммунодепрессанты стали использовать для подавления иммунного ответа при пересадке органов, исследователи из канадской компании вернулись к рапамицину. Их ждал сюрприз — в клинических испытаниях он оказался более мощным (до 100 раз) и менее токсичным в качестве иммунодепрессанта, чем использовавшийся на тот момент циклоспорин А. Это породило целое направление исследований. К 1999 году было доказано, что его безопасно применять на людях, и FDA одобрило это вещество. Согласно патенту Pfizer, лекарство выпускалось под названием рапамун, а действующему веществу дали второе название, принятое Советом США по принятию наименований (The United States Adopted Names Council), — сиролимус.
Но было и другое направление исследований. Ещё в 1990-х годах Майкл Холл (Michael Nip Hall) и его коллеги из Университета Базеля (Universität Basel) взялись за проект описания на клеточном уровне фунгицидного действия вещества. Джо Хайтман (Joe Heitmann), постдок в университете Базеля, вырастил обычную культуру дрожжей и поместил их в чашку Петри, на которую предварительно был нанесён рапамицин. Большинство дрожжей умерли, но некоторые мутировавшие дрожжевые клетки выжили. Хайтман суммарно выделил примерно 20 разных мутаций, дающих резистентность к рапамицину. Все эти мутации приходились на три разных гена, кодирующих белки FKBP и два других из класса киназ, позднее названных TOR1 и TOR2 и объединённых под названием TOR (от Target of Rapamicyn, цель связывания рапамицина). Подробнее про клеточную химию рапамицина можно посмотреть лекцию по ссылке.
Наблюдая за процессами, в которые вовлечён белок, исследователи заметили, что мушки-дрозофилы с пониженной активностью TOR, как и особи других видов с такой особенностью, по размеру меньше, чем их собратья без мутаций. Сначала большая часть работавших над темой склонны были считать, что у этих животных просто меньше клеток и что TOR влияет на процессы клеточного деления. То есть, мутация гена и ослабление активности белка, по их мнению, должны были оказывать цитостатическое (останавливающее рост количества клеток) действие. Но точного ответа не было, поэтому Томас Нойфельд (Тhomas Neufeld) в один прекрасный момент задался целью прояснить, за что отвечает TOR: за размер клетки или за количество клеточных делений. Для этого он посчитал количество клеток в отдельно взятых участках крыльев мушек с мутацией и без мутации и далее экстраполировал эту пропорцию на всё тело мушки. Число клеток двух мух, большой и маленькой, оказалось одинаковым! Поэтому он сделал вывод, что разница в размерах нормальной и мутантной мухи определяется именно размером клеток, а не их числом. То есть, белок TOR контролирует рост клетки, хотя раньше считалось, что его ничто не контролирует и он происходит спонтанно.
Далее начались эксперименты для дальнейшего выяснения механизмов TOR на мышах и даже на культурах человеческих клеток. Вскоре был обнаружен и одноимённый сигнальный путь mTOR (mammalian TOR, белок TOR у млекопитающих), даже два, mTORC1 и mTORC2 (C в данных аббревиатурах отвечает за слово complex, комплекс), причём только первый оказался чувствителен к рапамицину. И несмотря на то, что оба контролируются фактором роста, mTORC1 также реагирует на уровень питательных веществ, аминокислот, на уровни энергии и кислорода.
Сделать больше, сделать лучше!
Исследования, связанные с рапамицином, не прекращались с 1990-х годов, а с 2012-го года их стало ещё больше — из-за того, что истёк срок патента Pfizer и многие компании оказались заинтересованы в производстве лекарства. Какие были направления исследований? Во-первых, искали новые бактерии, которые производили бы больше вещества. Пример такого исследования: в 1995-м году учёные из Японии, префектуры Шизука, нашли новую бактерию, Actinoplanes sp., которая производила в десять раз больше рапамицина, чем S. rapamycinicus. Исследования также ведутся в области генетики: какие кластеры генов у каких бактерий отвечают за большее или меньшее производство рапамицина.
Во-вторых, идёт поиск эффективного способа производить рапамицин, так как сейчас это очень дорогой и трудоёмкий процесс, что значительно повышает его цену. Учёные исследуют, чем «кормить» бактерию, при какой температуре и кислотности содержать, чтобы «надоить» из неё больше вещества. Например, если поместить её в среду, богатую фруктозой, удастся добыть довольно много рапамицина, но не максимально возможное количество. При этом, создать благоприятную среду в биореакторе должно быть не слишком сложно. Кстати, недавно для изучения влияния питательных веществ на производство рапамицина совместно с другой методологией были использованы нейронные сети, которые помогли исследователям понять, что аппетит бактерии отлично удовлетворяют манноза, L-лизин и соевый шрот, представленные в определённой концентрации. В результате выработка рапамицина бактерией S. hygroscopicus достигла 320,89 мг/л. Подробнее про текущие способы биосинтеза рапамицина можно почитать по ссылке.
Ищут учёные и новые функциональные аналоги рапамицина, т.н. рапалоги, которые, подобно рапамицину, ингибируют работу mTOR. Многие новые рапалоги были получены с помощью биологических модификаций. Компания Novartis рассмотрела 28 бактерий и 72 грибка, известных способностью к биотрансформациям, и нашла таким образом несколько рапалогов (39-O-demethylrapamycin, 27-O-demethylrapamycin, 16-O-demethylrapamycin). Разные рапалоги могут воздействовать более таргетированно на то или иное заболевание, например, на разные виды злокачественных опухолей, или лучше усваиваются. Например, эмсиролимус лучше усваивается, чем оригинальный рапамицин.
Рапамицин в продлении жизни
Первые попытки изучить, как сигнальный путь mTOR, а соответственно и рапамицин, связаны с продолжительностью жизни, относятся к 2000-м. Ранние эксперименты такого рода были проведены на пивных дрожжах, а также на беспозвоночных — червях и мушках-дрозофилах. Тогда было обнаружено, что мутации в гене TOR продлевают продолжительность жизни этих модельных животных. Следующим важным шагом было продемонстрировать такой эффект у млекопитающих.
В 2009 году Дэвид Харрисон (David Harrison) и коллеги из разных исследовательских университетов США стали экспериментировать на лабораторных мышах. Планировалось, что это будут животные «средних лет», но в связи с трудностями с формулированием протокола кормления эксперимент начали довольно поздно для мышиной жизни — когда мышам было 20 месяцев от роду, что примерно эквивалентно 60 годам у людей. Каждая вовлечённая в исследование лаборатория, а их было три, проводила эксперименты параллельно по одному и тому же протоколу. Суммарно в исследовании приняли участие 2000 мышей. Учёные позаботились о том, чтобы мыши были генетически разнообразные, чтобы избежать эффекта, когда все они случайно окажутся более восприимчивы к препарату, чем в среднем по популяции (такое возможно с генетически гомогенными лабораторными животными). Грызунам вместе с едой давали в качестве добавки рапамицин в дозировке 2,24 мг на один килограмм веса (если принять, что стандартный вес средней лабораторной мыши — 20 граммов, то каждой особи давали по 0,0446 мг вещества). В итоге, продолжительность жизни мышей удалось продлить на 14% по сравнению с контрольной группой. Такое было ранее возможно только с помощью диеты с ограничением калорий. Именно тогда впервые было выдвинуто предположение, что ограничение калорий, известное способностью продлевать жизнь модельных животных, и рапамицин работают одинаково — задействуя сигнальный путь mTOR. Но были и сомнения — на протоколе с голоданием мыши обычно теряли вес, да и работал он только если мышей сажали на диету с самого начала жизни. Лишь значительно позже выяснили, что активность TOR регулируется количеством доступных питательных веществ.
Есть и свидетельства, хоть и пока только косвенные, в пользу того, что рапамицин способен продлять и человеческую жизнь. Начнём с того, что если описывать потенциальные и зарегистрированные клинические применения рапамицина и рапалогов, то придётся вспомнить целый ряд заболеваний. У него есть следующие потенциальные применения:
- В борьбе и профилактике нейродегенеративных заболеваний, таких как болезни Альцгеймера и Паркинсона (исследования находятся на стадии доклинических испытаний), он потенциально применим как нейропротектор;
- В профилактике и лечении некоторых видов рака, таких как опухоли кишечника, почек, мозга, лимфоузлов. Рапамицин считается полезным, так как при некоторых видах опухолей наблюдается повышенная активность mTORC1. Также он показал пользу во многих доклинических испытаниях, и сейчас ведётся ряд клинических испытаний на I и II стадии;
- В терапии сердечно-сосудистых заболеваний — для профилактики инфаркта, фиброза и повторного стеноза артерий. Потенциально снижает кардиотоксичность антиретровирусных препаратов, применяемых, например, при терапии ВИЧ. Большая часть исследований находится в доклинической фазе;
- Как противовоспалительный агент при ревматоидном артрите (когда другие НПВС не оказывают достаточного болеутоляющего эффекта), он снижает воспаление при красной волчанке. Данные для аутоиммунных заболеваний основаны на наблюдении пациентов, принимающих препарат с целью иммунодепрессии, и сравнении их результатов с таковыми в целом по популяции;
- Для омоложения кожи (в виде омолаживающего крема для кожи, находится в стадии клинических испытаний), зубов (испытания на мышах);
- Рапамицин может помочь в борьбе с ожирением (доклиническая фаза).
Многие из перечисленных заболеваний связаны со старостью. Чем старше мы, тем выше вероятность инфаркта, стеноза, злокачественных опухолей, Альцгеймера и Паркинсона. «Может быть, если этот препарат продлевает жизнь лабораторных животных и противодействует болезням, связанным со старостью, он и является лекарством от старости? — Примерно такое можно услышать от энтузиастов радикального продления жизни, — Эффект достигается из-за того, что рапамицин замедляет клеточный цикл». Михаил Благосклонный (Michael Blagosklonny), онколог и геронтолог из Комплексного онкологического центра Розуэлл-парка (Roswell Park Comprehensive Cancer Center) и энтузиаст рапамицина, в своей статье даже заявляет, что решение не принимать рапамицин скажется на продолжительности жизни так же, как решение продолжать курить! Но серьёзных клинических доказательств таким утверждениям нет.
В 2014 году был начат проект The Dog Ageing Project — массовое испытание воздействия рапамицина на продолжительность жизни домашних собак. В проекте могут участвовать как молодые, так и старые собаки разных пород. Как только исследование будет завершено, у нас будет больше оснований считать, что у рапамицина есть шанс продлить здоровую жизнь человека. Или нет.
Коварство рапамицина
Рапамицин как в общем и целом безопасный для применения у людей был зарегистрирован FDA ещё в 1999 году. Нет ни одного зарегистрированного случая смерти от передозировки рапамицином — даже в неудачной попытке самоубийства, когда 18-летняя девушка приняла 103 таблетки рапамицина по 1 мг, единственным обнаруженным эффектом было повышение общего холестерина в крови.
Но когда препарат регистрировали в FDA, регистрация сопровождалась предупреждением, что все препараты-иммунодепрессанты «из-за того, что подавляют иммунитет, могут повышать склонность человека к инфекциям, могут способствовать развитию опухолей, таких как лимфома и рак кожи». В принципе, всё логично: чем хуже иммунитет — тем хуже он атакует мутантные, например, раковые, клетки. Но клиническая практика опровергает такую логику. Михаил Благосклонный утверждает, что ярлык иммунодепрессанта надолго оттолкнул публичный интерес от препарата.
Это правда, что рапамицин может увеличивать тяжесть бактериальных инфекций, так как ингибирует функцию нейтрофилов, а также вызывает легкую тромбоцитопению, анемию и лейкопению (низкое количество тромбоцитов, красных кровяных телец и лейкоцитов соответственно). Он замедляет процессы клеточного деления, следовательно и кровяных клеток в организме оказывается меньше.
Среди других неприятных побочных эффектов — стоматит и микозит (изъязвление слизистых оболочек рта и пищеварительного тракта). Редким побочным эффектом рапамицина является неинфекционная интерстициальная пневмония. Но эти побочные эффекты имеют обратимый характер, и, если они не мешают жить, то сторонники долголетия утверждают, что «ничего страшного» и польза превышает вред, а если мешают — «можно просто снизить дозу». В целях предотвращения старения, согласно Благосклонному, рапамицин может использоваться либо периодически (например, один раз в неделю), либо в низких суточных дозах, и может быть отменён, если возникнут какие-либо неприятные «побочки».
Много споров было вокруг такого побочного эффекта как развитие временного диабета. Здесь можно вспомнить, что голодная диета, которая имеет схожее с рапамицином влияние на процессы старения, также вызывает инсулинорезистентность и у мышей, и у людей. Обе эти интервенции работают схожим путём: обычно mTOR активируется тем больше, чем больше питательных веществ в среде. Логика за этим такая: во время длительного голодания использование глюкозы не связанными с мозгом тканями должно быть подавлено, чтобы обеспечить адекватное снабжение мозга энергией. Голодная диета хоть и вызывает диабет, но не считается вредной, поэтому и диабет, вызванный рапамицином не должен считаться вредным. В конце концов, можно просто дополнить рапамицин метформином, ещё одним потенциальным геропротектором, и убрать симптомы диабета — примерно так говорит в своей статье Михаил Благосклонный. (Позиция редакции не обязательно совпадает с такой точкой зрения).
Заключение
В настоящее время нет однозначного заключения учёных, подходит рапамицин или нет на роль эликсира молодости. Кто-то спешит провозгласить его практически панацеей, кто-то предупреждает: «Но ведь побочные эффекты, как и сам эффект, ещё не до конца изучены!» Скорее всего правда где-то посредине: с одной стороны, мы знаем о веществе довольно много, в том числе и из клинической практики. С другой стороны, нет гарантии, что рапамицин сработает на людях так же, как и на мышах или собаках.
В данный момент ведётся масса испытаний на людях, которые помогут ответить на множество вопросов про этот препарат. Но все эти исследования касаются лишь определённых заболеваний, и в большинстве не касаются проблемы собственно старения. Поэтому лучшее, что можно сделать сейчас — это лоббировать признание старения заболеванием и таким образом дозволения клинических испытаний рапамицина и других препаратов от старения на людях.
Пока у нас нет таких испытаний, мы будем довольствоваться примерами единичных смельчаков, таких как Вэн, Чарльз и Луис, а также практикующий врач Алан Грин (dr. Alan Green) из США, который назначает своим пациентам рапамицин для лечения старости и принимает его сам.
Литература
Yoo, Y.J., Kim, H., Park, S.R. et al. An overview of rapamycin: from discovery to future perspectives. J Ind Microbiol Biotechnol 44, 537—553 (2017). https://doi.org/10.1007/s10295-016-1834-7
Patel, G.K., Goyal, R. and Waheed, S.M., 2019. Current Update on Rapamycin Production and its Potential Clinical Implications. High Value Fermentation Products, Volume 1: Human Health, p.145.
Рапамун® (Rapamune) инструкция по применению
📜 Инструкция по применению Рапамун®
💊 Состав препарата Рапамун®
✅ Применение препарата Рапамун®
📅 Условия хранения Рапамун®
⏳ Срок годности Рапамун®
Описание лекарственного препарата
Рапамун®
(Rapamune)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для электронного издания справочника Видаль 2011
года, дата обновления: 2022.08.15
Лекарственная форма
| Рапамун® |
Таб., покр. оболочкой, 1 мг: 30 или 100 шт. рег. №: ЛСР-002186/09 |
Форма выпуска, упаковка и состав
препарата Рапамун®
Таблетки, покрытые оболочкой белого цвета, треугольной формы, с маркировкой красного цвета «RAPAMUNE 1 mg».
1 таблетка, покрытая оболочкой, содержит: сиролимуса наносистему дисперсную 150 мг/1 г (сиролимус 100% (активное вещество) — 1.02 мг, полоксамер 188 — 0.51 мг).
Вспомогательные вещества: лактозы моногидрат, макрогол 8000, магния стеарат, тальк, макрогол 20000, глицерил моноолеат (60%), глазурь фармацевтическая (шеллака раствор №4), кальция сульфат, целлюлоза микрокристаллическая, сахароза, титана диоксид, повидон K29-32, α-токоферола ацетат, воск карнаубский, чернила красные — опакод S-1-15095 (шеллака раствор около 45% (содержит 20% сложных эфиров) в этаноле, краситель железа оксид красный (E172), изопропанол, бутанол, пропиленгликоль, аммиак водный, симетикон).
10 шт. — блистеры (3) — пачки картонные.
10 шт. — блистеры (10) — пачки картонные.
Фармакологическое действие
Иммунодепрессант. Сиролимус ингибирует активацию Т-лимфоцитов за счет блокирования кальций-опосредованной и кальцийнезависимой внутриклеточной передачи сигнала. Данные исследований свидетельствуют о том, что механизм действия сиролимуса отличается от механизма действия циклоспорина, такролимуса и других иммунодепрессантов. Согласно экспериментальным данным, сиролимус связывается со специфическим цитозольным белком иммунофилином, FK-связывающим белком-12 (FKPB-12), и комплекс FKPB-12-сиролимус подавляет активацию фермента — киназы, который является мишенью для рапамицина в организме млекопитающих (mTOR — mammalian Target of Rapamycin) и имеет принципиально важное значение для развития клеточного цикла. Ингибирование mTOR приводит к блокировке нескольких специфичных путей, по которым происходит передача сигнала. В конечном итоге ингибируется активация лимфоцитов, приводящая к иммуносупрессии.
Режим поддерживающей терапии сиролимусом, без циклоспорина, был изучен у пациентов с низким и умеренным иммунологическим риском потери трансплантата. В исследовании участвовали пациенты с аллогенным трансплантатом почки умершего или почки живого донора. Кроме того, в исследования были включены реципиенты с повторно пересаженными трансплантатами, у которых предыдущие трансплантаты выжили в течение, по крайней мере, 6 месяцев после трансплантации. Циклоспорин не отменяли у пациентов, перенесших острые отторжения трансплантата 3 степени по шкале Banff, или находившихся на диализе, или с содержанием сывороточного креатинина >400 мкмоль/л, или с почечной недостаточностью, не позволявшей отменить циклоспорин. Действие препарата у пациентов с высоким иммунологическим риском потери трансплантата не было достаточно изучено в данном исследовании, что не позволяет рекомендовать приведенную схему лечения для этой группы пациентов.
Фармакокинетика
После приема внутрь Рапамун (сиролимус) быстро всасывается, при этом Cmax достигается приблизительно через 1 ч после однократного приема здоровыми людьми, и приблизительно через 2 ч после повторного приема внутрь пациентами в стабильном состоянии после аллогенной трансплантации почки. Системная биодоступность Рапамуна при одновременном приеме с циклоспорином составляет около 14%. При последующем приеме средняя концентрация сиролимуса в крови увеличивается приблизительно в 3 раза.
T1/2 при повторном пероральном приеме препарата больными в стабильном состоянии после пересадки почки составил 62±16 ч, а средняя Css достигалась через 5-7 дней. Коэффициент, отражающий соотношение концентрации в крови к концентрации в плазме, равняется 36. Это свидетельствует о том, что сиролимус в значительной степени накапливается в форменных элементах крови.
Сиролимус является субстратом как для изофермента CYP3A4, так и для Р-гликопротеина. Сиролимус подвергается экстенсивному метаболизму посредством O-деметилирования и/или гидроксилирования. В крови определяются 7 основных метаболитов, включая гидроксил-, диметил-, и гидроксидиметил-производные. Тем не менее, в крови человека сиролимус является основным компонентом препарата, который более чем на 90% определяет иммунодепрессивное действие Рапамуна. После однократного приема [14С]-сиролимуса здоровыми добровольцами основная часть (91.1%) препарата, меченного радиоизотопом, была обнаружена в кале, и лишь небольшая часть (2.2%) экскретировалась с мочой.
У находящихся на диализе детей (со снижением скорости клубочковой фильтрации на 30-50%) 5-11 лет и 12-18 лет было отмечено, что среднее, нормализованное по массе тела, отношение клиренса к фильтрации (CL/F) выше в младшей возрастной группе (580 мл/ч/кг), по сравнению со старшей возрастной группой (450 мл/ч/кг), тогда как у взрослых соответствующее значение составляет 287 мл/ч/кг. В пределах каждой возрастной группы отмечается изменчивость данного показателя в широких пределах.
У пациентов с нарушением функции печени от легкой до умеренной степени тяжести (классы А или В по шкале Чайлд-Пью) средние значения AUC и T1/2 сиролимуса были повышены соответственно на 61% и 43%, а среднее значение CL/F снижено на 33% по сравнению со здоровыми испытуемыми.
У пациентов с выраженным нарушением функции печени (класс С по шкале Чайлд-Пью) средние значения AUC и T1/2 сиролимуса были повышены, соответственно, на 210% и 170%, а среднее значение CL/F снижено на 67% по сравнению со здоровыми испытуемыми. Более длительный T1/2 сиролимуса в результате нарушения функции печени приводил к замедлению достижения его равновесного состояния в организме.
В группе пациентов с различной функцией почек — от нормальной до полностью отсутствующей (пациенты на гемодиализе) — фармакокинетические параметры сиролимуса были сходными.
У здоровых добровольцев после приема препарата в однократной дозе в форме таблеток средняя величина биодоступности сиролимуса приблизительно на 27% выше соответствующего показателя после приема раствора; средняя Cmax на 35% ниже, а среднее Tmax в плазме крови на 82% выше. После достижения равновесного состояния сиролимуса у реципиентов почечных трансплантатов различие в биодоступности было менее выраженным. В рандомизированном исследовании с участием 477 пациентов была продемонстрирована терапевтическая эквивалентность двух лекарственных форм. При переводе пациентов с раствора для приема внутрь на таблетки рекомендуется назначать прежнюю дозу и контролировать минимальную концентрацию сиролимуса в крови через 1-2 недели, чтобы убедиться, что она остается в рекомендуемых пределах.
У 24 здоровых добровольцев, получавших под наблюдением таблетки Рапамуна вместе с пищей с высоким содержанием жира, отмечалось повышение Cmax, Tmax и AUC соответственно на 65%, 32% и 23%. Чтобы минимизировать колебания, таблетки Рапамуна следует принимать всегда либо вместе с пищей, либо без пищи. Не следует употреблять грейпфрутовый сок, который влияет на CYP3A4-опосредованный метаболизм сиролимуса.
Начальная терапия (в течение 2-3 месяцев после трансплантации): у большинства пациентов, у которых лечение таблетками Рапамуна начинают с дозы насыщения (6 мг) с последующим переходом на поддерживающую дозу 2 мг 1 раз/сут, Cmin сиролимуса в крови быстро достигают Css, соответствующих заданному интервалу (от 4 до 12 нг/мл по данным хроматографического анализа).
По данным мониторинга всех пациентов, получающих циклоспорина в качестве сопутствующей терапии, средняя концентрация сиролимуса в крови (хроматографический метод), составляла 8.6±3 нг/мл при величине суточной дозы 2.1±0.7 мг.
Поддерживающая терапия: через 3-12 месяцев после отмены циклоспорина минимальная концентрация сиролимуса в крови (хроматографический метод) составляла 19±4.1 нг/мл на фоне приема суточных доз 8.2±4.2 мг. Таким образом, доза сиролимуса была приблизительно в 4 раза выше расчетной.
Показания препарата
Рапамун®
- профилактика отторжения трансплантата у взрослых пациентов с низким или умеренным иммунологическим риском после трансплантации почки. Рекомендуется назначать Рапамун изначально в комбинации с ГКС и микроэмульсией циклоспорина в течение первых 2-3 мес после трансплантации. Терапия Рапамуном может быть продолжена в виде поддерживающей терапии совместно с ГКС только, если циклоспорин будет постепенно отменен.
Режим дозирования
Препарат назначают только для приема внутрь.
Рапамун следует постоянно принимать либо одновременно с приемом пищи, либо между приемами пищи. Не рекомендуется нарушать целостность таблеток перед их проглатыванием в связи с тем, что биодоступность препарата после раздавливания, разжевывания или разламывания таблеток не изучалась.
Терапию следует проводить под наблюдением врача-трансплантолога.
Начальная терапия (в течение 2-3 месяцев после трансплантации): при обычном режиме приема, как можно скорее после трансплантации, внутрь однократно назначают ударную дозу 6 мг, с последующим назначением 2 мг 1 раз/сут. Впоследствии дозу Рапамуна подбирают индивидуально таким образом, чтобы минимальная концентрация сиролимуса в крови составляла от 4 нг/мл до 12 нг/мл (хроматографический метод). Лечение Рапамуном продолжают на фоне одновременного постепенного снижения дозы ГКС и микроэмульсии циклоспорина.
В течение первых 2-3 месяцев после трансплантации минимальные концентрации циклоспорина рекомендуется поддерживать в пределах 150-400 нг/мл (иммунный метод определения концентрации).
Поддерживающая терапия: через 4-8 недель после начала лечения циклоспорином его дозу следует постепенно снижать вплоть до полной отмены препарата, а дозу Рапамуна подбирать таким образом, чтобы минимальные концентрации в крови составляли от 12 нг/мл до 20 нг/мл (хроматографический метод). Рапамун следует принимать вместе с ГКС. Пациентам, у которых отмена циклоспорина оказалась неудачной, либо невозможна длительность совместной терапии циклоспорином и Рапамуном составляет не более 3 месяцев. В клинически оправданных ситуациях таким пациентам следует отменить Рапамун и назначить альтернативный режим терапии иммунодепрессантами.
Данных для применения сиролимуса у пациентов негроидной расы недостаточно.
У пациентов пожилого возраста (старше 65 лет) опыт применения препарата Рапамун недостаточен, чтобы определить, существуют ли различия в ответе на терапию между пациентами данной возрастной группы и более молодыми. У 35 пациентов старше 65 лет после пересадки почки минимальные концентрации сиролимуса не отличались от соответствующих концентраций у 822 пациентов от 18 до 65 лет. Результаты, полученные при назначении таблеток Рапамуна 12 пациентам в возрасте старше 65 лет после трансплантации почек, также соответствовали результатам, полученным для взрослых пациентов (n=167) в возрасте от 18 до 65 лет.
У пациентов с нарушениями функции почек коррекция дозы не требуется.
У пациентов с выраженным нарушением функции печени поддерживающую дозу Рапамуна рекомендуется уменьшить примерно в 2 раза в связи с замедленным клиренсом сиролимуса. Ударную дозу изменять не следует.
Мониторинг терапевтической концентрации сиролимуса
У большинства пациентов, получавших Рапамун в дозе 2 мг через 4 ч после циклоспорина, минимальные концентрации сиролимуса в крови соответствовали заданному интервалу от 4 нг/мл до 12 нг/мл (по данным хроматографического анализа).
Для оптимизации терапии требуется мониторинг терапевтической концентрации сиролимуса у всех пациентов. Концентрацию сиролимуса в крови необходимо контролировать особенно тщательно у следующих групп пациентов: (1) пациенты с нарушением функции печени; (2) в период одновременного назначения индукторов или ингибиторов системы цитохрома CYP3A4, а также после окончания их приема; (3) в случае резкого снижения дозы или отмены циклоспорина, поскольку для этих групп пациентов с наибольшей вероятностью потребуется модификация дозы.
Чтобы минимизировать колебания концентрации сиролимуса Рапамун следует принимать через постоянные интервалы по отношению к циклоспорину, а именно через 4 ч после приема циклоспорина. В оптимальном случае подбор дозы Рапамуна должен быть основан на более чем однократном измерении минимальной концентрации, выполненном не ранее, чем через 5 дней после последнего изменения дозы.
После начала лечения раствором Рапамуна пациент может продолжить терапию Рапамуном в таблетках при точном сохранении дозы. После перевода пациента на другую лекарственную форму или другой режим дозирования рекомендуется измерять минимальную концентрацию сиролимуса в течение 1-2 недель
После отмены циклоспорина рекомендуется поддерживать минимальную концентрацию сиролимуса в крови на уровне 12-20 нг/мл (хроматографический метод). Циклоспорин ингибирует метаболизм сиролимуса, поэтому если доза Рапамуна не будет увеличена, то концентрация сиролимуса после отмены циклоспорина уменьшится. В среднем, доза Рапамуна должна быть в 4 раза выше с учетом отсутствия фармакокинетического взаимодействия (2-кратное повышение) и повышенной потребности в иммунодепрессивном действии в отсутствие циклоспорина (2-кратное повышение). Скорость повышения дозы Рапамуна должна соответствовать скорости отмены циклоспорина.
При необходимости коррекции дозы при поддерживающей терапии (после отмены циклоспорина), ее можно провести у большинства пациентов по следующей формуле: новая доза Рапамуна = текущая доза х (желаемая концентрация/текущая концентрация). Ударную дозу следует применять в дополнение к поддерживающей дозе, если требуется значительно увеличить минимальную концентрацию сиролимуса: ударная доза Рапамуна = 3 х (новая поддерживающая доза — текущая поддерживающая доза). Максимальная суточная доза Рапамуна составляет 40 мг. Если рассчитанная суточная доза превышает 40 мг из-за ударной дозы, то ударную дозу следует разделить на 2 дня. Мониторинг минимальной концентрации сиролимуса рекомендуется, по крайней мере, в течение 3-4 дней после назначения ударной дозы.
После изменения дозы или приема ударной дозы Рапамуна у пациентов с тяжелой печеночной недостаточностью в связи с замедлением достижения равновесного состояния контроль концентрации сиролимуса в крови необходимо проводить каждые 5-7 дней до тех пор, пока 3 последовательные определения концентрации сиролимуса не подтвердят достижение Css.
Расчет 24-часовой минимальной концентрации сиролимуса основан на результатах хроматографических методов. Для измерения концентрации сиролимуса в крови использовали различные подходы. В настоящее время концентрации сиролимуса в крови измеряются как хроматографическими, так и иммуноферментными методами. Величины концентраций, полученные этими методами, не взаимозаменяемы. Используя иммуноферментные системы, следует всегда следовать рекомендациям производителя, чтобы скоррелировать полученные значения с таковыми, полученными стандартными хроматографическими методами. Все концентрации сиролимуса, приведенные в данном документе, были измерены хроматографическими методами или пересчитаны в соответствующие эквивалентные величины. Для определения желаемой минимальной концентрации сиролимуса следует проводить коррекцию в соответствии с используемыми методами.
При подборе дозы препарата Рапамун следует ориентироваться не только на результаты мониторинга терапевтических концентраций, но и уделять особое внимание клиническим симптомам, результатам гистологического исследования и лабораторным данным.
Побочное действие
Наиболее часто (>10%): тромбоцитопения, анемия, гипокалиемия, гипофосфатемия, инфекции мочевыводящего тракта, гиперхолестеринемия, гипергликемия, гипертриглицеридемия, боли в животе, лимфоцеле, периферические отеки, артралгия, акне, диарея и повышение уровня ЛДГ.
Частота проявления любого побочного эффекта может повышаться при увеличении минимальной концентрации сиролимуса в крови. В приведенной ниже таблице указаны побочные явления, выявленные в ходе клинических исследований, а также зарегистрированные после выхода препарата на рынок. Перечисленные побочные явления разделены в соответствии с органной принадлежностью и частотой проявления и представлены в таблице в порядке уменьшения серьезности заболевания. В этот список включены лишь те побочные явления, которые, по крайней мере, предположительно могут иметь причинную взаимосвязь с терапией препаратом Рапамун.
Большинство пациентов получали комбинированную иммунодепрессивную терапию, в состав которой входил Рапамун и другие иммунодепрессанты.
Иммунодепрессия повышает риск развития лимфомы и других злокачественных новообразований кожи.
Имеются сообщения о гепатотоксичности Рапамуна, риск которой может возрастать по мере повышения минимальной концентрации сиролимуса в крови. Имеются сообщения о редких случаях некроза печени со смертельным исходом при превышении минимальной концентрации сиролимуса в крови.
Отмечались случаи интерстициальных заболеваний легких (в т.ч. пневмонит и иногда облитерирующий бронхиолит с организующейся пневмонией и фиброз легких), в некоторых случаях с летальным исходом при неидентифицированном возбудителе, у пациентов, получавших иммунодепрессивную терапию, включая Рапамун. В некоторых случаях отмена Рапамуна или снижение дозы приводили к устранению интерстициального легочного процесса. Риск заболевания может возрастать по мере повышения минимальной концентрации сиролимуса в крови.
Описаны случаи замедленного заживления ран после трансплантации, включая расхождение фасций, послеоперационные грыжи и разрыв анастомозов.
У некоторых больных на фоне лечения Рапамуном наблюдалось обратимое нарушение функциональной активности спермы.
У пациентов с замедленной функцией трансплантата прием сиролимуса может привести к замедлению восстановления функции почек.
В подгруппе больных с исходно сниженной скоростью клубочковой фильтрации (<40 мл/мин) частота серьезных нежелательных явлений на фоне приема Рапамуна была выше (включая пневмонию, реакцию острого отторжения трансплантата, гибель трансплантата и летальный исход).
Противопоказания к применению
- детский возраст (недостаточно опыта применения, имеются только ограниченные данные);
- повышенная чувствительность к компонентам препарата.
Применение при беременности и кормлении грудью
Данные о применении Рапамуна у беременных женщин отсутствуют. При беременности Рапамун следует применять лишь в тех случаях, когда предполагаемая польза для матери превышает возможный риск для плода.
Эффективную контрацепцию необходимо начинать до лечения Рапамуном и продолжать в период лечения, а также в течение 12 недель после его окончания.
Неизвестно, выделяется ли сиролимус с грудным молоком у человека. Учитывая потенциальный риск для ребенка, во время лечения Рапамуном грудное вскармливание следует прекратить.
Применение при нарушениях функции печени
У пациентов с выраженным нарушением функции печени поддерживающую дозу Рапамуна рекомендуется уменьшить примерно в 2 раза в связи с замедленным клиренсом сиролимуса. Ударную дозу изменять не следует.
Применение при нарушениях функции почек
У пациентов с нарушениями функции почек коррекция дозы не требуется.
Применение у детей
Противопоказано: детский возраст (недостаточно опыта применения, имеются только ограниченные данные);
Применение у пожилых пациентов
У пациентов пожилого возраста (старше 65 лет) опыт применения препарата Рапамун недостаточен, чтобы определить, существуют ли различия в ответе на терапию между пациентами данной возрастной группы и более молодыми. У 35 пациентов старше 65 лет после пересадки почки минимальные концентрации сиролимуса не отличались от соответствующих концентраций у 822 пациентов от 18 до 65 лет. Результаты, полученные при назначении таблеток Рапамуна 12 пациентам в возрасте старше 65 лет после трансплантации почек, также соответствовали результатам, полученным для взрослых пациентов (n=167) в возрасте от 18 до 65 лет.
Особые указания
К настоящему времени не получено достаточно данных о применении Рапамуна у больных с высоким иммунологическим риском.
Имеется исследовательский опыт по назначению сиролимуса совместно со следующими лекарственными средствами: циклоспорином, азатиоприном, микофенолатом мофетила, ГКС и цитотоксическими антителами. Комбинации Рапамуна с другими иммунодепрессивными препаратами изучены недостаточно.
Применение сиролимуса, микофенолата мофетила и ГКС в комбинации с антителами к рецепторам интерлейкина-2 не рекомендуется при пересадке почечного трансплантата de novo.
У пациентов с нарушением функции печени следует тщательно контролировать уровень минимальной концентрации сиролимуса в крови. Учитывая удлиненный T1/2 препарата у этой категории больных после изменения дозы или приема ударной дозы Рапамуна контроль концентрации препарата в крови необходимо проводить до достижения ее стабильного уровня
Снижение устойчивости к инфекциям и предрасположенность к развитию лимфомы и других злокачественных заболеваний, особенно кожи, может быть следствием угнетения иммунной системы. Необходимо принимать меры предосторожности, обычные для пациентов с повышенным риском рака кожи: ограничивать воздействие солнечного и ультрафиолетового излучения с помощью защитной одежды и использования кремов с высоким солнцезащитным эффектом.
В результате чрезмерного угнетения иммунной системы возможно повышение восприимчивости к инфекциям, в т.ч. к инфекциям, вызываемым условно патогенными микроорганизмами, вероятными последствиями являются сепсис и летальный исход.
Поскольку не установлена безопасность и эффективность Рапамуна в качестве иммунодепрессивной терапии пациентов с печеночными и легочными трансплантатами, препарат не рекомендуется применять у данных групп пациентов.
В двух клинических исследованиях с участием пациентов с трансплантатом печени de novo применение сиролимуса совместно с циклоспорином или такролимусом сопровождалось повышением частоты тромбоза печеночной артерии, в большинстве случаев приводившего к потере трансплантата или летальному исходу.
Сообщалось о нарушении или замедлении заживления ран у больных на фоне приема Рапамуна, особенно часто у пациентов, индекс массы тела которых превышает 30 кг/м2 (лимфоцеле, расхождение краев раны).
Имеются сообщения о расхождении краев бронхиального анастомоза у пациентов с легочным трансплантатом de novo, в большинстве случаев с летальным исходом, при применении сиролимуса в составе иммунодепрессивной терапии.
У пациентов, получавших Рапамун, описаны случаи задержки жидкости, в частности, периферические отеки, застой лимфы, плевральный выпот и экссудативный перикардит (включая гемодинамически значимые выпоты у детей и взрослых).
При применении сиролимуса отмечались аллергические реакции, такие как анафилактические/анафилактоидные реакции, эксфолиативный дерматит, ангионевротический отек и васкулит.
Имеются сообщения о случаях пневмонии, вызванной Pneumocystis carinii у пациентов, не получавших антимикробную профилактику. В связи с этим, в течение первых 12 месяцев после трансплантации необходимо проводить антимикробную профилактику, направленную против Pneumocystis carinii.
В течение 3 месяцев после трансплантации целесообразна профилактика цитомегаловирусной инфекции.
Применение Рапамуна у больных после пересадки почки сопровождалось повышением уровня холестерина и триглицеридов в сыворотке, в некоторых случаях требовавшим медикаментозной коррекции. Пациенты, получающие Рапамун, нуждаются в контроле с целью выявления возможной гиперлипидемии. В случае, если гиперлипидемия установлена, следует принять соответствующие меры, включающие диету, физические упражнения и прием препаратов, снижающих уровень холестерина. Перед назначением иммунодепрессантов, включая Рапамун, а также при решении вопроса о продолжении лечения Рапамуном пациентов с тяжелой стойкой гиперлипидемией необходимо оценить соотношение риска и пользы данного вида терапии.
Отмечена хорошая переносимость Рапамуна в сочетании с ингибиторами ГМГ-КоА редуктазы и/или фибратами. В период лечения Рапамуном в комбинации с ингибиторами ГМГ-КоА редуктазы или фибратами необходимо наблюдать за пациентами в связи с возможным развитием рабдомиолиза и других побочных эффектов, описанных в инструкциях по медицинскому применению этих лекарственных средств.
При совместном назначении Рапамуна и циклоспорина необходим мониторинг функции почек. Следует иметь в виду, что для пациентов с повышенным уровнем креатинина в сыворотке потребуется коррекция схемы лечения иммунодепрессантами. Необходимо соблюдать осторожность при одновременном назначении с другими лекарственными средствами, неблагоприятно влияющими на функцию почек.
У пациентов, получавших терапию Рапамуном и циклоспорином более 3 месяцев, отмечались более высокие концентрации креатинина в сыворотке и более низкий уровень клубочковой фильтрации, по сравнению с пациентами контрольной группы, получавшими циклоспорин и плацебо или циклоспорин и азатиоприн. У пациентов после успешной отмены циклоспорина отмечался более низкий уровень креатинина в сыворотке и более высокий уровень клубочковой фильтрации по сравнению с пациентами, продолжавшими получать циклоспорин. До получения дополнительных клинических данных не рекомендуется совместное назначение циклоспорина и Рапамуна в качестве поддерживающей терапии.
Безопасность и эффективность перевода пациентов с ингибиторов кальциневрина на Рапамун не изучена.
Рекомендуется осуществлять периодический контроль уровня экскреции белков в моче.
Иммунодепрессанты могут оказывать влияние на эффективность вакцинации. Во время лечения иммунодепрессантами, включая Рапамун, вакцинация может быть менее эффективна. В период лечения Рапамуном следует избегать применения живых вакцин.
Рапамун в форме таблеток, покрытых оболочкой, содержит сахарозу и лактозу. Перед назначением препарата пациентам, у которых в анамнезе отмечается недостаточность сахаразы, лактазы и изомальтазы, непереносимость фруктозы, мальабсорбция глюкозы и галактозы, непереносимость галактозы (например, галактоземия), следует оценить соотношение риск/польза и, при необходимости, заменить Рапамун таблетки на Рапамун раствор для приема внутрь.
Влияние на способность к управлению транспортными средствами и механизмами
Исследования по изучению влияния на способность к управлению транспортными средствами и работе с механизмами не проводились.
Передозировка
В настоящее время информация о случаях передозировки минимальна.
Симптомы в основном совпадают с побочными реакциями. У одного пациента, принявшего Рапамун в дозе 150 мг, наблюдалась фибрилляция предсердий.
Лечение: проведение симптоматической терапии. Учитывая малую растворимость сиролимуса в воде и высокий уровень связывания с эритроцитами, предполагается, что сиролимус не может быть в существенных количествах удален из организма с помощью диализа.
Лекарственное взаимодействие
В стенке кишечника и печени сиролимус подвергается экстенсивному метаболизму под действием изофермента CYP3A4. Кроме того, сиролимус является субстратом для локализующегося в тонком кишечнике Р-гликопротеина, при участии которого осуществляется выведение многих лекарственных средств. Поэтому вещества, воздействующие на эти белки, способны влиять на всасывание сиролимуса и его последующее выведение. Ингибиторы CYP3A4 (кетоконазол, вориконазол, итраконазол, телитромицин или кларитромицин) снижают метаболизм сиролимуса, что приводит к повышению его концентрации. Индукторы изофермента CYP3A4 (рифампицин или рифабутин) усиливают метаболизм сиролимуса, снижая его концентрацию. Не рекомендуется назначать сиролимус одновременно с мощными индукторами или ингибиторами CYP3A4.
Циклоспорин (субстрат CYP3A4) значительно повышает скорость и степень всасывания сиролимуса. Одновременный прием Рапамуна в дозе 5 мг, затем 5 мг через 2 ч и 10 мг через 4 ч после назначения циклоспорина А в дозе 300 мг в форме микроэмульсии приводил к увеличению AUC сиролимуса приблизительно до 183%, 141% и 80% соответственно. Результат действия циклоспорина А проявлялся и в увеличении Cmax и Tmax сиролимуса в крови. При применении сиролимуса за 2 ч до приема микроэмульсии циклоспорина А не отмечалось никакого влияния на AUC и Cmax сиролимуса в крови. У здоровых добровольцев, получавших сиролимус в однократной дозе одновременно с циклоспорином в форме микроэмульсии, или с 4-часовым интервалом, фармакокинетика циклоспорина А не изменялась. Рекомендуется назначать Рапамун через 4 ч после приема микроэмульсии циклоспорина.
При многократном приеме рифампицина (индуктор CYP3A4) наблюдалось снижение концентрации сиролимуса в крови после однократного приема Рапамуна в дозе 10 мг в форме раствора для приема внутрь. Рифампицин увеличивал клиренс сиролимуса приблизительно в 5.5 раз и уменьшал AUC сиролимуса и Cmax приблизительно на 82% и 71% соответственно. Не рекомендуется назначать сиролимус одновременно с рифампицином.
Повторный прием кетоконазола (ингибитор CYP3A4) значительно изменял скорость, степень всасывания и биодоступность сиролимуса, о чем свидетельствовало 4.4-, 1.4- и 10.9-кратное увеличение соответственно Cmax, Tmax и AUC . Не рекомендуется назначать сиролимус одновременно с кетоконазолом.
При совместном применении у здоровых добровольцев сиролимуса в дозе 2 мг однократно и вориконазола (ингибитор CYP3A4) внутрь по 400 мг каждые 12 часов в 1 день, затем по 100 мг каждые 12 ч в течение 8 дней, отмечалось в среднем 7-кратное повышение Cmax и 11-кратное увеличение AUC сиролимуса. Не рекомендуется назначать сиролимус одновременно с вориконазолом.
При одновременном приеме Рапамуна в дозе 10 мг в форме раствора для приема внутрь и дилтиазема в дозе 120 мг биодоступность сиролимуса значительно изменялась. Cmax, Tmax и AUC сиролимуса увеличивались соответственно в 1.4, 1.3 и 1.6 раз. Сиролимус не изменял фармакокинетику дилтиазема и его метаболитов дезацетилдилтиазема и дезметилдилтиазема. При назначении дилтиазема необходимо контролировать концентрацию сиролимуса в крови и при необходимости корректировать дозу препарата.
При назначении верапамила (ингибитор CYP3A4) в многократных дозах и сиролимуса в форме раствора для приема внутрь скорость и степень всасывания обоих соединений значительно изменялась. Cmax, Tmax и AUC сиролимуса в цельной крови увеличивались соответственно в 2.3, 1.1 и 2.2 раза. Значения Cmax и AUC S-(-)верапамила в плазме увеличивались в 1.5 раза, a Tmax уменьшалось на 24%. Следует контролировать концентрацию сиролимуса в крови и, при необходимости, снижать дозы обоих лекарственных средств.
При назначении эритромицина (ингибитор CYP3A4) в многократных дозах и сиролимуса в форме раствора для приема внутрь скорость и степень всасывания обоих соединений значительно увеличивалась. Cmax, Tmax и AUC сиролимуса в цельной крови увеличивались соответственно в 4.4, 1.4 и 4.2 раза. Cmax, Tmax и AUC эритромицина в плазме увеличивались соответственно в 1.6, 1.3 и 1.7 раза. Следует контролировать концентрацию сиролимуса и, при необходимости, снижать дозы обоих препаратов.
Не наблюдалось клинически значимого фармакокинетического взаимодействия между сиролимусом и пероральным контрацептивом, содержащим 300 мкг норгестрела/30 мкг этинилэстрадиола. Хотя результаты исследования взаимодействия Рапамуна в однократной дозе и перорального контрацептива свидетельствуют об отсутствии фармакокинетического взаимодействия, при длительном лечении Рапамуном нельзя исключить возможных изменений фармакокинетики, которые могут отразиться на эффективности перорального контрацептива.
Умеренные и слабые ингибиторы CYP3A4 способны замедлять метаболизм сиролимуса и повышать концентрацию сиролимуса в крови, например, блокаторы кальциевых каналов (никардипин), противогрибковые средства (клотримазол, флуконазол), антибиотики (тролеандомицин), а также бромокриптин, циметидин, даназол, ингибиторы протеаз.
Индукторы CYP3A4 способны ускорять метаболизм сиролимуса и снижать концентрацию сиролимуса в крови (например, зверобой продырявленный, противосудорожные средства — карбамазепин, фенобарбитал, фенитоин).
Хотя in vitro сиролимус ингибирует активность изоферментов микросомальной системы цитохрома Р450 у человека (CYP2C9, CYP2C19, CYP2D6, CYP3A4/5), подавление активности этих изоферментов in vivo маловероятно, поскольку для этого концентрации сиролимуса должны быть значительно выше, чем у пациентов, получающих препарат в терапевтических дозах. Ингибиторы P-гликопротеина могут уменьшать высвобождение сиролимуса из клеток кишечника и способствовать повышению его концентрации в крови.
Грейпфрутовый сок влияет на CYP3A4 опосредованный метаболизм, поэтому его не следует употреблять во время приема Рапамуна.
Фармакокинетическое взаимодействие может наблюдаться с желудочно-кишечными прокинетическими средствами, такими как цизаприд, метоклопрамид.
Не наблюдалось клинически значимого фармакокинетического взаимодействия сиролимуса с ацикловиром, аторвастатином, дигоксином, глибенкламидом, метилпреднизолоном, нифедипином, преднизолоном и триметопримом/сульфаметоксазолом.
При одновременном применении Рапамуна с ингибиторами кальциневрина возможно повышение риска гемолитико-уремического синдрома/тромботической тромбоцитопенической пурпуры/тромботической микроангиопатии, индуцируемых ингибиторами кальциневрина.
В редких случаях совместное применение сиролимуса и ингибиторов АПФ приводило к развитию ангионевротического отека.
Условия хранения препарата Рапамун®
Препарат следует хранить в недоступном для детей, защищенном от света месте при температуре не выше 25°С.
Срок годности препарата Рапамун®
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
ПФАЙЗЕР ИННОВАЦИИ ООО
(Россия)
|
123112 Москва, Пресненская наб. 10 |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Взаимодействие с другими препаратами
Венклекста
(ЭббВи, Россия)
Дифенин
(УСОЛЬЕ-СИБИРСКИЙ ХИМФАРМЗАВОД, Россия)
Интеленс®
(ДЖОНСОН & ДЖОНСОН, Россия)
Кемерувир
(ФАРМАСИНТЕЗ, Россия)
Липертанс®
(Les Laboratoires Servier, Франция)
Ноксафил®
(SCHERING-PLOUGH S.A., Франция)
Саквинавир-ТЛ
(ТЕХНОЛОГИЯ ЛЕКАРСТВ, Россия)
Тарка®
(ABBOTT LABORATORIES, Германия)
Филахромин®
(НАТИВА, Россия)
Эритромицин-ЛекТ
(ТЮМЕНСКИЙ ХИМИКО — ФАРМАЦЕВТИЧЕСКИЙ ЗАВОД, Россия)
Все взаимодействия
Человечество продолжает поиски “таблетки от старости” и в процессе открывает антивозрастные свойства давно известных препаратов. Например, рапамицина.
Первоначально разработанный как иммунодепрессант для пациентов с трансплантацией органов, он нашел новую жизнь в качестве потенциального лекарства против старения. Рапамицин не был одобрен для такого применения у людей, но многие геронтологи считают его — или аналогичные средства — лучшей надеждой на фармакологическое замедление процесса старения.

Бесплатные вебинары по антивозрастной медицине
Узнайте об особенностях Международной школы Anti-Age Expert, а также о возможностях для совершенствования врачебной практики изо дня в день. Также в программе вебинаров — увлекательные обзоры инноваций в антивозрастной медицине и разборы сложнейших клинических случаев с рекомендациями, которые действительно работают
Узнать подробнее
Что такое рапамицин

Рапамицин представляет собой иммунодепрессант, который назначают перенесшим трансплантацию органов пациентам. Он тормозит действие одного из наших белков — внутриклеточный протеин mTOR.
Рапамицин был выделен в 1972 году из бактерии, обнаруженной на острове Пасхи Рапа Нуи — отсюда и название. В течение многих лет он был малоизвестным препаратом, но в начале 2000-х было обнаружено, что он значительно продлевает жизнь червям, дрожжам, мухам и мышам.
В одном эксперименте исследователи дали рапамицин группе 20-месячных мышей, что эквивалентно людям пенсионного возраста. Они кормили животных небольшими дозами в течение трех месяцев, затем прекратили давать препарат и подождали, пока они умрут. Мыши обычно умирают в возрасте около 30 месяцев, но грызуны, которые употребляли рапамицин, жили в среднем еще 2 месяца. Последний выживший умер более чем через два года после начала эксперимента, в преклонном возрасте 3 года и 8 месяцев — что эквивалентно примерно 140 человеческим годам.
Рапамицин не тестировался таким образом на людях, но, учитывая сходство между биологией мыши и человека, ученые предполагают, что он также способен продлить нашу жизнь.
Рапамицин в продлении жизни

Лекарства, которые назначают для лечение возраст-ассоциированных заболеваний — таких как гипертония, диабет, рак простаты, похожи на антивозрастные вещества своим ингибирующим действием на гиперфункцию клеток, запускаемую с помощью mTOR.
Так, метформин, который выписывают диабетикам, продлевает жизнь мышей и червей. Аспирин снижает риск тромбоза и рака пищеварительной системы.
Считается, что рапамицин проявляет свои свойства продления жизни, имитируя эффект ограничения калорийности, один из самых надежных способов продления жизни у животных. Он нацелен на сигнальную молекулу mTOR, которая является важным узлом в путях восприятия питательных веществ. Отсутствие еды выключает mTOR и активирует аварийные системы, которые позволяют нам пережить периоды голода.
Эти пути запускают аутофагию, процесс, с помощью которого клетки поглощают дисфункциональные органеллы и молекулы для получения энергии. Это уменьшает накопление мертвого органического материала, который обычно забивает наши ткани по мере того, как мы стареем, и, следовательно, замедляет или даже обращает вспять процесс старения.

Онлайн обучение
Anti-Age медицине
Изучайте тонкости антивозрастной медицины из любой точки мира. Для удобства врачей мы создали обучающую онлайн-платформу Anti-Age Expert: Здесь последовательно выкладываются лекции наших образовательных программ, к которым открыт доступ 24/7. Врачи могут изучать материалы необходимое количество раз, задавать вопросы и обсуждать интересные клинические случаи с коллегами в специальных чатах
Узнать подробнее
Считается, что проведение клинических испытаний рапамицина на людях практически невозможно — для выявления каких-либо эффектов долголетия потребуются десятилетия.
К сожалению, лекарство, подобное рапамицину, предназначенное для предотвращения респираторных заболеваний у пожилых пациентов, не прошло клинические испытания. Препарат рано показал себя многообещающим, и считалось, что он действует, замедляя иммунное старение или возрастное снижение иммунной системы. Однако многие другие ингибиторы mTOR находятся в стадии разработки.
Рапамицин и молодость кожи

Исследование, проведенное командой Медицинского колледжа Дрексельского университета в Филадельфии (США), показало, что иммуносупрессор рапамицин также оказывает антивозрастное действие на кожу человека.
В клиническом испытании участвовали 13 добровольцев старше 40 лет. Они наносили крем с рапамицином на тыльную сторону одной руки и крем с плацебо на тыльную сторону другой руки каждые 1-2 дня перед сном.
Участники эксперимента посещали оценочные визиты каждые 2 месяца в течение 8 месяцев. Во время визитов исследователи фотографировали их руки, чтобы оценить морщины на коже и общий вид.
Выяснилось, что регулярное нанесение рапамицина на тыльную сторону рук сокращает морщины и уменьшает дряблость, а также улучшает тон кожи.
По истечении 8 месяцев на руках большинства участников, получавших лечение рапамицином, наблюдалось увеличение коллагена и снижение белка p16, показателя клеточного старения. Кожа с большим количеством таких клеток становится более морщинистой и медленнее заживает.
Через 8 месяцев большинство рук, получавших лечение рапамицином, показало увеличение коллагена и более низкие уровни маркера старения в клетках кожи по сравнению с теми, кто использовал плацебо.
В этом случае лечение рапамицином продемонстрировало явное влияние на старение кожи как на молекулярном, так и на клиническом уровнях.
Однако ученые отмечают, что эти результаты — всего лишь ранняя стадия их исследований, и им нужно сделать гораздо больше, прежде чем они смогут сказать, как лучше всего применять рапамицин для замедления старения.

Семинары по антивозрастной медицине
Получайте знания, основанные на доказательной медицине из первых уст ведущих мировых специалистов. В рамках Модульной Школы Anti-Age Expert каждый месяц проходят очные двухдневные семинары, где раскрываются тонкости anti-age медицины для врачей более 25 специальностей
Узнать подробнее
Краткие выводы

-
У иммунодепрессанта рапамицина, вероятно, есть антивозрастные свойства;
-
В экспериментах на мышах препарат показал увеличение продолжительности их жизни;
-
Также рапамицин продемонстрировал омолаживающее действие на кожу человека;
-
Однако для того, чтобы начать применять его как anti-age препарат, необходимы дополнительные наблюдения, чтобы исключить и минимизировать возможные риски.
Список использованной литературы
-
Rapamycin’s secrets unearthed. C&EN Global Enterprise. 2016;94(29):26–30. doi:https://doi.org/10.1021/cen-09429-cover.
-
Heitman J, Movva NR, Hall MN. Targets for cell cycle arrest by the immunosuppressant rapamycin in yeast. Science. 1991;253(5022):905–9.
-
Brown EJ, Albers MW, Bum Shin T, ichikawa K, Keith CT, Lane WS et al. A mammalian protein targeted by G1-arresting rapamycin–receptor complex. Nature. 1994;369(6483):756–758. doi:https://doi.org/10.1038/369756a0.