Со стороны пищеварительной системы: тошнота, рвота, диарея, диспепсия, анорексия, боли в животе, повышение активности ЛДГ, нарушение вкусовых ощущений; в единичных случаях — небольшое транзиторное повышение показателей функциональных печеночных проб.
Со стороны нервной системы: слабость, головная боль, головокружение, тревога, депрессия, парестезии, гиперестезии, возбуждение, бессонница, нервозность, сонливость, неврит, нарушения слезоотделения, боли в ушах.
Со стороны сердечно-сосудистой системы: транзиторная артериальная гипотензия, артериальная гипертензия, брадикардия, тахикардия, ортостатическая гипотензия, вазодилатация, приливы, аритмия, обострение имевшихся раньше заболеваний сердца (в т.ч. стенокардии, хронической сердечной недостаточности), периферические отеки, отеки лица.
Со стороны системы кроветворения: тяжелая тромбоцитопения, тяжелая нейтропения, тяжелая анемия, лейкопения, лимфаденопатия.
Со стороны обмена веществ: гипергликемия, снижение массы тела, гипокальциемия, гиперкальциемия.
Со стороны костно-мышечной системы: артралгии, миалгии, боли в костях, боли в пояснице, боли в грудной клетке, боли в области шеи, мышечный гипертонус; редко — повышение активности КФК, спонтанные переломы.
Со стороны мочевыделительной системы: дизурия, гематурия, гиперурикемия.
Дерматологические реакции: повышенное потоотделение (в т.ч. ночью), сухость кожи.
Аллергические реакции: крапивница, зуд, бронхоспазм, одышка, отек языка или глотки, (ангионевротический отек), ринит, усиление кашля, бронхиальная астма, псевдоларингит; в единичных случаях — облитерирующий бронхиолит.
Прочие: возможны лихорадка и озноб (развиваются преимущественно при первой инфузии обычно в первые 2 ч), боли в месте локализации опухоли, общее недомогание, увеличение живота, боли в месте инфузии; редко — нарушения свертывания крови, увеличение частоты развития инфекционных заболеваний, рецидивы имевшихся ранее опухолей кожи.
Связь развития указанных побочных реакций с применением ритуксимаба точно не установлена.
Химические свойства
Ритуксимаб – синтетические, химерные моноклональные, выведенные с помощью генной инженерии антитела мыши/человека. Вещество по своему структурному строению относится к иммуноглобулину IgG1 каппа. Основа молекулы – постоянный человеческий сегмент, на который нарастили вариабельные фрагменты тяжелых и легких цепей мышиных антител.
Средство состоит из 2 тяжелых (451 аминокислота) и 2 легких (213 аминокислот) цепей, его молекулярная масса = 145 кД.
Фармакологическое действие
Противоопухолевое.
Фармакодинамика и фармакокинетика
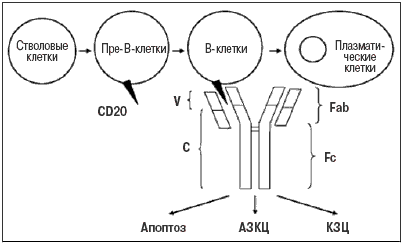
Вещество специфически связывается с антигеном CD20, который расположен на поверхности зрелых и пре-В-лимфоцитов. Такого рода антиген отсутствует на про-В-клетках, здоровых клетках различных тканей, стволовых гемопоэтических и нормальных плазматических клетках. DC20 активно участвует во всех стадиях созревания В-лимфоцитов, является регулятором тока ионов кальция через полунепроницаемую клеточную мембрану. После того, как молекула антигена связалась с действующим веществом, образовавшееся соединение не сбрасывается во внеклеточное пространство, не существует в крови в свободном виде и не интернелизуется.
Антинеопластическое действие соединения основано на его способности связываться с антигеном CD-20 на поверхности лимфоцитов и индуцировать иммунологические реакции, которые приводят к лизису В-клеток. Клеточный лизис происходит по двум механизмам: АЗЦТ и КЗЦТ. Дополнительно Ритуксимаб приводит к апоптозу клеток человеческой В-клеточной лимфомы на линии DHL-4.
Вещество оказывает влияние на лимфоидные клетки тимуса, периферической крови, селезенки (белая пульпа), лимфатические узлы.
Медиана числа В-клеток восстанавливается до первоначального уровня через год, после отмены лекарственного средства. Антихимерные антитела человека обнаружили у 1% пациентов, проходивших лечение Ритуксимабом. У 3 из 356 человек можно было пронаблюдать объективный клинический ответ на терапию.
После внутривенной инфузии лекарственного средства наблюдается пропорциональный рост максимальной концентрации и периода полувыведения от дозировки. Отмечается отрицательная корреляция сывороточных уровней соединения с величиной опухоли. Ритуксимаб накапливается в организме, его можно обнаружить в организме в течение 3-6 месяцев после того, как была введена последняя доза.
Были проведены клинические исследования, в которых участвовали пациенты с различной степенью тяжести неходжкинской лимфомы и использовались разные схемы лечения.
При проведении начальной терапии, по 4 инъекции в неделю у 42 % пациентов наступила частичная ремиссия, у 6% — полная. Организм начинал отвечать на лечение в среднем на 50 день, после начала использования препарата. Заболевание начинало прогрессировать через 11,2 месяца. У 23% больных в начале эксперимента присутствовали признаки и симптомы заболевания, и у 64% их них они исчезали.
При начальной терапии и использовании схемы лечения на 8 уколов каждую неделю, наблюдались следующие показатели: частичная ремиссия – 43%, полная ремиссия – 14%, прогрессирование болезни – через 13,4 месяца. Однако, если опухолевая масса была размером более 10 см или проводилось повторное лечение, то данные показатели были несколько ниже.
У пациентов, находящихся в преклонном возрасте не наблюдалось каких либо изменений в частоте и тяжести проявления побочных эффектов, частоте возникновения ремиссии и рецидива.
Показания к применению
Применение Ритуксимаба:
- для лечения фолликулярных или низкой степени злокачественности В-клеточных неходжиновских лимфом;
- при рецидивирующей или химиоустойчивой В-клеточной лимфоме;
- для лечения прочих видов лимфомы в составе комплексной терапии;
- в активной форме ревматоидного артрита, если другие методы лечения оказались недостаточно эффективными.
Противопоказания
Лекарственное средство не рекомендуется использовать у пациентов с аллергией на Ритуксимаб или белок мыши.
Побочные действия
В промежутке времени от 12 часов до суток после первой инфузии препарата могут развиться симптомы, характерные для синдрома лизиса опухоли: гиперкалиемия, гиперурикемия, сбои в работе почек, гипокальциемия, гиперфосфатемия.
Также во время лечения веществом наблюдались тяжелые реакции со стороны слизистых оболочек и кожи: перанеопластическая пузырчатка, дерматиты, синдром Стивенса-Джонсона, токсический эпидермальный некролиз.
Есть сообщения о развитии фатальных инфузионных реакций во время введения первой инъекции. Летальный исход был инициирован гипоксией, инфильтрацией легких, острым респираторным дистресс-синдромом, кардиогенным шоком и инфарктом миокарда. Большинство фатальных реакций происходили после первой инфузии.
Также сообщалось о случаях развития острой почечной недостаточности, которая требовала проведения диализа, нередко побочные реакции такого рода приводили к смерти пациента.
Ритуксимаб не рекомендуется сочетать с цисплатином. При такой комбинации лекарств значительно повышается риск развития тяжелой почечной недостаточности.
Могут проявиться следующие побочные реакции (наблюдались во время проведения монотерапии препаратом):
- лихорадка, развитие вторичных инфекций, головная боль, боли в спине, озноб, астения;
- приливы крови, повышение или понижение АД;
- рвота, запор, диарея, тошнота;
- анемия, лейкопения, тромбоцитопения;
- нейтропения, лимфопения, гипергликемия;
- отеки по периферии, артралгия, миалгия;
- тревожность, головокружение, ринит и кашель;
- диспноэ, потливость, крапивница, зуд на коже;
- ангиодэма, бронхоспазм, повышение активности ферментов печени.
Доказано, что введение 8 доз лекарства в неделю повышает вероятность возникновения побочных реакций.
Во время первой инъекции чаще всего возникают:
- лихорадка, озноб, дрожь по телу;
- зуд, тошнота, астения, головная боль, снижение АД;
- першение в горле, насморк, рвота, гипертензия, крапивница.
Перечисленные выше симптомы наблюдаются уже через 30 минут – 2 часа после внутривенного введения и проходят после прерывания инфузии. В тяжелых случаях показано проведение симптоматической терапии, внутривенное введение физ. раствора, парацетамола и дифенгидрамина.
Во время проведения монотерапии могут также возникнуть гематологические нежелательные явления: гипоплазия костного мозга, поздняя нейтропения, пролонгированная панцитопения.
Лекарственное средство приводит к снижению иммунитета, истощению В-клеток, уменьшению уровня иммуноглобулина, лимфопении. У 31% пациентов лечение препаратом вызвало развитие бактериальных инфекций, грибковых и вирусных заболеваний.
У лиц, склонных к возникновению аритмий или со стенокардией во время введения препарата следует внимательно следить за работой сердечной мышцы.
Зарегистрированы случаи реактивации гепатита В, после окончания лечения средством. Заболевание обнаруживалось в течение 4 месяцев после первой инфузии или 1 месяца после введения последней дозы Ритуксимаба.
Сообщалось в развитии увеита, зрительного нефрита, системного васкулита, плеврита, сывороточной болезни, артрита.
Во время постмаркетингового исследования был зарегистрирован случай возникновения прогрессирующей мультифокальной лейкоэнцефалопатии.
Ритуксимаб, инструкция по применению (Способ и дозировка)
Схему лечения назначает лечащий врач в зависимости от стадии заболевания и вида опухоли.
Лечение Ритуксимабом
Препарат вводят внутривенно, капельно.
Перед использованием вещества его необходимо развести в инфузионном пакете или флаконе р-ом хлорида натрия 9% или водным 5% р-ом глюкозы до концентрации от 1 до 4 мг на один мл.
Вводят лекарственное средство капельно из расчета 375 мг на квадратный метр поверхности тела. Раствор можно вводить от 1 до 8 раз в неделю. При проведении одной инфузии в 7 дней курс лечения составляет один месяц.
Скорость инфузии – 50 мг в час при первом введении. Затем скорость можно постепенно увеличивать на 50 мг в час, каждые 30 минут. Максимальная скорость – 400 мг в час. При после дующих инфузиях начальная скорость введения = 100 мг в час.
Передозировка
В клинических условиях передозировка средством не наблюдалась. Максимальное количество вещества, которое вводили пациенту за один раз, не превышало 500 мг на квадратный метр поверхности тела.
Взаимодействие
Препарат Ритуксимаб нельзя сочетать с другими моноклональными антителами, это может вызвать тяжелые аллергические реакции.
Лекарства, угнетающие функцию кроветворения костного мозга, увеличивают риск развития миелосупрессии.
Средство можно сочетать с доксорубицином, преднизолоном, циклофосфамидом, винкристином.
Условия продажи
Нужен рецепт.
Условия хранения
Вещество хранят в защищенном от доступа прямых солнечных лучей месте, с температурным режимом от 2 до 8 градусов Цельсия. Нельзя допускать замораживания препарата.
Срок годности
30 месяцев.
Особые указания
Эффективность и последствия проведения иммунизации во время проведения терапии Ритуксимабом не изучались.
Инфузии следует производить в условиях стационара под наблюдением гематологов или онкологов, которые ранее имели опыт обращения с данным средством. Во время проведения терапии, особенно при первом введении, необходимо держать оборудования для реанимации. За 12 часов до начала проведения терапии следует прекратить прием антигипертензивных препаратов.
За пол часа перед инъекцией показана премедикация: обезболивающие, жаропонижающие, антигистаминные средства, кортикостероиды по показаниям.
Лекарство нельзя вводить внутривенно струйно или болюсно.
Если во время введения вещества наблюдаются легкие или умеренные побочные реакции, то скорость введения необходимо снизить.
Если размер опухоли превышает 10 см или число циркулирующих злокачественных клеток более 25000 на мм3, то во время лечения следует соблюдать особую осторожность, может возникнуть синдром лизиса опухоли. Синдром может привести к летальному исходу. В качестве мер осторожности рекомендуется тщательно наблюдать за состоянием больного, проводить лабораторный мониторинг, контроль функции почек и уровня электролитов в крови.
Препараты, в которых содержится (Аналоги)
Совпадения по коду АТХ 4-го уровня:
Лекарства, активным действующим веществом которых является Ритуксимаб: Мабтера, Ацеллбия, Ритуксимаб.
Отзывы о Ритуксимабе
Лечение данным веществом чаще всего плохо переносится пациентами, неизбежно проявления побочных реакций, особенно со стороны кроветворения и сердечно-сосудистой системы. Говорить об эффективности лекарственного средства сложно, все зависит от степени тяжести заболевания, схемы лечения и сопутствующих болезней. Нередко после прохождения курса препарата у пациента развивается устойчивая ремиссия.
Цена Ритуксимаба, где купить
Купить Ритуксимаб в составе препарата Мабтера можно за 12000-20000 рублей, 2 флакона, дозировкой по 100 мг на 10 мл.
Перспективы применения ритуксимаба при аутоиммунных заболеваниях человека
Статьи
Опубликовано в журнале:
« Русский Медицинский Журнал», 2007, Том 15, № 26, С. 1-6
Академик РАМН, профессор Е.Л. Насонов
ГУ Институт ревматологии РАМН, Москва
Аутоиммунные заболевания включают более 80 нозологических форм и относятся к числу наиболее распространенных и тяжелых болезней человека, частота которых в популяции составляет 5–8%. Для лечения аутоиммунных заболеваний используется широкий спектр препаратов, обладающих противовоспалительной (глюкокортикоиды – ГК), цитотоксической или иммуносупрессивной (в низких дозах) активностью, большая часть из которых создавалась для лечения злокачественных новообразований или подавления отторжения трансплантата. Рациональное применение этих препаратов на ранних этапах болезни, в сочетании с экстракорпоральными методами очищения крови в период обострения, позволило существенно улучшить непосредственный и отдаленный прогноз, однако во многих случаях не позволяет контролировать прогрессирование заболевания, развитие угрожающих для жизни осложнений или ассоциируется с тяжелыми побочными эффектами.
Среди разнообразных иммунных нарушений, лежащих в основе развития аутоиммунных заболеваний, изучение дефектов В–клеточной регуляции вызывает особый интерес, в том числе и с точки зрения разработки новых патогенетически обоснованных подходов к лечению [1]. Напомним, что В–лимфоциты – клетки иммунной системы, участвующие в развитии и поддержании адаптивного иммунитета, образуются из гемопоэтических предшественников в костном мозге в течение всей жизни человека, участвуют в поддержании иммунологической толерантности к собственным антигенам (ауто-антигенам). Дефект В–клеточной толерантности приводит к синтезу аутоантител, которые, активируя эффекторные звенья иммунного ответа, индуцируют развитие воспаления и деструкции тканей организма человека. Однако значение В–клеток в развитии аутоиммунных заболеваний не исчерпывается только синтезом «патогенных» аутоантител. Установлено, что нарушение В–клеточной ко-стимуляции Т–лимфоцитов играет фундаментальную роль в развитии аутоиммунных реакций и может развиваться на самых ранних стадиях патологического процесса до клинической манифестации и заболевания [2]. Кроме того, по данным клинических и эпидемиологических исследований, у пациентов с аутоиммунными ревматическими заболеваниями наблюдается увеличение риска развития В–клеточных неходжскинских лимфом [3]. Все это вместе взятое делает В–клетки перспективными терапевтическими «мишенями» при аутоиммунных заболеваниях [4–7].
Первым и пока единственным анти–В–клеточным препаратом, разрешенным к применению в клинической практике, является ритуксимаб (Rituximab, МабТера «Ф. Хоффман–Ля Рош Лтд.») – химерные моноклональные антитела к CD20 антигену В–лимфоцитов [8]. Препарат применяется в медицине с 1997 года для лечения В–клеточных неходжскинских лимфом, а в последние годы – широкого круга аутоиммунных заболеваний [9].
Выбор CD20 молекулы в качестве мишени для моноклональных антител связан с особенностями дифференцировки В–клеток, которые в процессе созревания от стволовых клеток в плазматические клетки проходят несколько последовательных стадий, для каждой из которых характерна экспрессия определенных мембранных молекул (рис. 1). Экспрессия CD20 наблюдается на мембране «ранних» и зрелых В–лимфоцитов, но не стволовых, «ранних» пре–В, дендритных и плазматических клеток. Поэтому их истощение не отменяет регенерацию пула В–лимфоцитов и не влияет на синтез иммуноглобулинов плазматическими клетками. Кроме того, CD20 не высвобождается с мембраны В–лимфоцитов в кровяное русло и поэтому не блокирует взаимодействие ритуксимаба с В–клетками, что увеличивает эффективность терапии. Полагают, что способность ритуксимаба элиминировать В–клетки реализуется за счет нескольких механизмов, в том числе комплемент–зависимой и антитело–зависимой клеточной цитотоксичности, а также индукции апоптоза [10]. В свою очередь истощение В–клеток может оказывать существенное влияние на основные механизмы развития аутоиммунных заболеваний человека и имеет серьезное патогенетическое обоснование:
- ослабление антиген–презентирующей функции В–клеток в отношении индукции пролиферации и синтеза цитокинов CD4+ Т–клетками;
- деструкция аберрантных ростковых центров, что приводит к снижению образования аутоантиген–специфичных В–клеток памяти, плазматических клеток и синтеза антител;
- истощение предшественников плазматических клеток, что приводит к подавлению синтеза антител и образования иммунных комплексов;
- модуляция активности других аутореактивных кле ток за счет нарушения функции Т–клеток;
- активация Т–регуляторных клеток (CD4+ CD25+).
Рис.1 Механизмы действия ритуксимаба
В настоящее время возможность эффективного контроля аутоиммунных патологических состояний путем истощения (и/или модуляции функции) В–клеток доказана в клинических исследованиях. Об этом свидетельствует высокая эффективность ритуксимаба при наиболее распространенном и тяжелом аутоиммунном ревматическом заболевании – ревматоидном артрите (РА), что послужило основанием для регистрации препарата для лечения этого заболевания. Детальный анализ результатов клинических исследований ритуксимаба при РА представлен в предыдущих публикациях [7,11,12].
В последние годы очень быстро накапливается клинический опыт применения ритуксимаба для лечения других аутоиммунных заболеваний человека [13–15].
Следует особо подчеркнуть, что в большинстве случаев ритуксимаб назначали пациентам с очень тяжелым течением болезней, которые были резистентны к стандартной глюкокортикоидной и цитотоксической терапии, внутривенному иммуноглобулину, экстракорпоральным методам очищения крови, нередко по жизненным показаниям.
Системная красная волчанка
Системная красная волчанка (СКВ) – аутоиммунное ревматическое заболевание, в основе патогенеза которого лежат дефекты иммунорегуляции, приводящие к неконтролируемой гиперпродукции аутоантител к компонентам собственных тканей и развитию хронического воспаления, затрагивающего многие органы и системы. При этом В–лимфоциты играют ключевую роль в развитии иммунопатологических процессов при этом заболевании [16].
В настоящее время имеются данные о применении ритуксимаба более чем у 100 пациентов с СКВ, как взрослых, так и детей, результаты которых суммированы в обзоре [17]. Результаты проведенных исследований позволяют сделать следующие основные выводы:
- В целом лечение ритуксимабом ассоциировалось с достоверным снижением активности заболевания более чем у 80% пациентов.
- Назначение ритуксимаба высокоэффективно у больных СКВ с активными внепочечными проявлениями болезни (серозит, полиартрит, поражение кожи, стоматит, лихорадка, анемия), с прогрессирующим волчаночным нефритом (III–IV морфологический тип по классификации ВОЗ).
- Ритуксимаб может быть препаратом выбора у больных с «критическим» течением СКВ, обусловленным тяжелым поражением ЦНС (коматозное состояние, судороги, психоз), а также мультиорганным тромбозом, связанным с катастрофическим антифосфолипидным синдромом.
- Предварительные результаты свидетельствуют о высокой эффективности повторных курсов терапии ритуксимабом в случае развития обострения.
Синдром Шегрена
Синдром Шегрена (СШ) – системное аутоиммунное заболевание, поражающее экзокринные железы и проявляющееся персистирующей сухостью рта и глаз, связанное с нарушением функции слюнных и слезных желез [18]. СШ весьма распространен в популяции, встречается с частотой 0,6%–3,3% или 4 новых случая на 100 000 населения в год. СШ чаще развивается у женщин среднего возраста, соотношение женщин к мужчинам колеблется от 14:1 до 24:1. Выделяют первичный синдром (болезнь) Шегрена и вторичный СШ, развивающийся у больных РА и другими аутоиммунными ревматическими и неревматическими заболеваниями.
СШ – потенциально тяжелое заболевание, характеризующееся развитием широкого спектра экстрагландулярных (системных) проявлений и высоким риском лимфом, что отражает фундаментальную роль В–клеточной гиперреактивности в иммунопатогенезе болезни [3]. Полагают, что первичный СШ представляет собой уникальную модель для изучения процессов, лежащих в основе трансформации поликлональной В–клеточной активации в олиго– (моно–) клональную пролиферацию В–клеток, приводящую, в конечном счете, к развитию злокачественных В–клеточных лимфопролиферативных заболеваний. В настоящее время патогенетически обоснованная терапия СШ практически не разработана и сводится к симптоматическому лечению сухого кератоконъюнктивита и ксеростомии и применению ГК и цитостатиков у пациентов с тяжелыми системными проявлениями болезни. Попытки назначения ингибиторов ФНО–α дали противоречивые результаты и патогенетически недостаточно обоснованы. Данные, касающиеся эффективности ритуксимаба при СШ, суммированы в таблице 1.
Таблица 1. Результаты применения ритуксимаба при первичном синдроме Шегрена
| Авторы | Число и характеристика больных | Тип исследования | Результаты |
| J.E. Gottenberg et al. [20] | n=6; лимфома (2); системные проявления (4) | Ретроспективное | Эффективен |
| J. Pijpe et al. [21] | n=15; активное заболевание длительность (< 4 лет), MALT–лимфома (7) | Открытое (фаза III) | Эффективен |
| R. Seror et al. [22] | n=16; лимфома (5); системные проявления (11), в том числе криоглобулинемия (5), поражение легких (2), артрит (4), тромбоцитопения (1), множественный мононеврит (1) |
Ретроспективное | Эффективен |
| V. Davauchelle– Pensek et al. [23] | n=16; активное заболевание | Открытое | Эффективен |
Влияние лечения ритуксимабом на проявления сухого кератоконъюнктивита и ксеростомии анализировалось в 3–х исследованиях. По данным J.E. Gottenberg и соавт. [20], у 3 пациентов наблюдалось существенное улучшение, а у 2 – стабилизация клинической симптоматики. Сходные результаты получены J. Pijpe и соавт. [21]. В то же время R. Seror и соавт. [22] не выявили существенного влияния лечения на проявления сухого синдрома. В исследовании V. Davauchelle–Pensec и соавт. [23] установлена эффективность ритуксимаба в отношении таких проявлений заболевания, как слабость, сухость во рту, поражение суставов, общее состояние (SF–36), функционального состояния легких (1 пациент).
Особенно выраженный эффект отмечен в отношении системных проявлений заболевания. По данным J.E. Gottenberg и соавт. [20], существенная положительная динамика обнаружена у 5 из 6 пациентов, что позволило существенно снизить дозу ГК. R. Seror и соавт. [22] продемонстрировали высокую эффективность ритукси-маба в отношении системных проявлений у 9 из 11 больных.
Несомненный интерес представляют материалы, касающиеся эффективности ритуксимаба у пациентов с СШ и лимфомами. В исследовании J.E. Gottenberg и соавт. [209] полная ремиссия отмечена у 1 пациента, а по данным J. Pijpe и соавт. [21], полная ремиссия достигнута у 3, а частичная – у 2–х пациентов. Прогрессирование болезни имело место только у 1 больного. По данным R. Seror и соавт. [22], развитие ремиссии имело место у 4 из 5 пациентов с лимфомой. Кроме того, имеются данные о высокой эффективности ритуксимаба в качестве адъювантной терапии при агрессивных В–клеточных лимфомах. M. Vougarelis и соавт. [24] представили результаты о длительной ремиссии агрессивной диффузной В–клеточной лимфомы у 6 пациентов с пер вичным СШ, получавших комбинированную терапию циклофосфамидом, доксорубицином, винкристином, преднизолоном (CHOP) и ритуксимабом. В целом эффективность терапии была выше, чем в группе сравнений, у пациентов, получавших только цитотоксическую терапию без ритуксимаба.
Идиопатические воспалительные миопатии (ИВМ)
Идиопатические воспалительные миопатии (ИВМ) – группа аутоиммунных ревматических заболеваний, которые могут встречаться как в виде самостоятельных нозологических форм, так и в качестве синдрома при различных ревматических заболеваниях [25]. Наиболее частыми формами ИВМ являются полимиозит (ПМ) и дерматомиозит (ДМ). В основе патогенеза ИВМ лежит аутоиммунное поражение мышц, которое имеет свои особенности при ПМ и ДМ. При ПМ в клеточном инфильтрате преобладают CD 8+ Т–лимфоциты и макрофаги, а при ДМ – CD 4+ Т–лимфоциты. Развитие ИВМ может сопровождаться синтезом широкого спектра аутоантител, которые получили название миозит–специфических. Лечение ПМ/ДМ в значительной степени остается эмпирическим и обычно состоит из сочетания ГК и иммуносупрессивной терапии, однако у многих пациентов лечение недостаточно эффективно. Поэтому опыт применения ритуксимаба при ИВМ представляет несомненный интерес (табл. 2).
Таблица 2. Эффективность ритуксимаба при идиопатических воспалительных миопатиях
| Авторы | Диагноз/ число больных | Предшествующая терапия | Эффективность |
| T.D. Levine [26] | ДМ–7 | ГК, ЦсА, МТ, ВИГ | Увеличение мышечной силы (36%–113%); снижение КФК; купирование кожных проявлений, улучшение функции легких |
| E. Noss et al. [27] | ДМ–1 ПМ–2 | ГК, МТ, МФМ | Увеличение мышечной силы (нормализация – у 2–х), нормализация КФК, снижение дозы ГК |
| O. Lambotte et al. [28] | Антисинтетазный синдром – 1 | ГК, МТ, азатиоприн, ВИГ | Увеличение мышечной силы, нормализация КФК, улучшение функции легких |
| L. Brulhart [29] | Антисинтетазный синдром – 1 | ГК, МТ | Увеличение мышечной силы, нормализация КФК, купирование альвеолита |
| M.A. Cooper et al. [30] | Ювенильный ДМ – 4 | ГК, МТ, ВИГ | Увеличение мышечной силы, нормализация КФК, купирование кожных проявлений |
| C.C. Mok et al. [31] | ПМ – 4 | ГК (4), пульс МП (2), аза (4), МТ (1), МФМ (4), ЦсА (3), такролимус (1), ВИГ (1) | Нормализация мышечной силы и КФК – 2 Нормализация КФК, умеренное увеличение мышечной силы – 2 |
Примечание: МТ – метотрексат, ЦсА – циклоспорин А, ВИГ – внутривенный иммуноглобулин, АЗА – азатиоприн; МФМ – микофенолата мофетил; МП – метилпреднизолон
Как видно из таблицы, лечение ритуксимабом было эффективным у большинства больных, что проявлялось в нормализации (или существенном увеличении) мышечной силы и снижении концентрации КФК. У больных с ДМ во всех случаях отмечено купирование кожных проявлений. У пациентов с антисистетазным синдромом отмечена нормализация функции легких.
Cистемные васкулиты
Системные васкулиты, ассоциирующиеся с синтезом антинейтрофильных цитоплазматических антител (АНЦА), – группа системных аутоиммунных заболеваний, характеризующихся преимущественно васкулитом мелких сосудов и синтезом АНЦА [32]. Выделяют 2 основные формы этих васкулитов: гранулематоз Вегенера (ГВ), для которого характерно образование гранулем и деструктивное поражение верхних дыхательных путей, и микроскопический полиангиит (МПА), при котором эти проявления, как правило, не наблюдаются.
Применение ритуксимаба при АНЦА–ассоциированных системных васкулитах теоретически оправдано и определяется важной патогенетической ролью АНЦА (антитела к протеиназе 3 и антитела к миелопероксидазе) в развитии системного поражения сосудов. Кроме того, В–клетки участвуют в образовании гранулем при ГВ, а увеличение их уровня в периферической крови ассоциируется с активностью заболевания.
В настоящее время проведено очень большое число клинических исследований, свидетельствующих об эффективности ритуксимаба при ГВ и МПА (табл. 3).
Таблица 3. Эффективность ритуксимаба при АНЦА–ассоциированных системных васкулитах
| Авторы | Характеристика | Эффективность | Обострение |
| O. Flossman et al. [33] | Проспективное n=11 (5 ГВ, 5 МПА, 1 синдром Чарга–Стросса) | Полная ремиссия – 9 Частичная ремиссия – 1 Отсутствие эффекта – 1 |
У 6 (в среднем через 16,5 мес.) |
| K.A. Keogh et al. [34] | Проспективное n=10 (ГВ) | Полная ремиссия – 10 | 1 (9 мес.) |
| P.M. Aries et al. [35] | Проспективное n=7 | Полная ремиссия – 1 Частичная ремиссия – 1 Отсутствие эффекта – 5 |
Нет данных |
| K.A. Keogh et al. [36] | Ретроспективное n=11 (10 ГВ, МПА – 1) | Полная ремиссия – 11 | 2 (7 и 12 мес.) |
| P. Eriksson et al. [37] | Ретроспективное n=9 (2 ГВ, 5 МПА) | Полная ремиссия – 1 Частичная ремиссия – 2 |
2 (2 и 13 мес.) |
| R. Omdal et al. [38] | Ретроспективное n=3 (ГВ) | Полная ремиссия – 3 | 3 (8, 12 и 27 мес.) |
| J–E Gottenberg [20] | Ретроспективное n=2 (ГВ) | Полная ремиссия – 1 Частичная ремиссия – 1 |
Нет данных |
Примечание: ГВ – гранулематоз Вегенера; МПА – микроскопический полиангиит
В целом выраженный клинически эффект в отношении основных клинических проявлений болезни отмечен более чем у 90% пациентов. При этом более чем у 80% пациентов была достигнута полная ремиссия, а обострение заболевание хорошо контролировалось повторными курсами терапии (в среднем через 9–12 мес.). Примечательно, что обострение ассоциировалось с нормализацией уровня В–клеток и увеличением титров АНЦА. Однако у многих больных ремиссия сохранялась в отсутствии лечения или на фоне приема небольших доз ГК, несмотря на нормализацию уровня В–клеток и увеличение титров АНЦА. Следует обратить внимание на то, что некоторые проявления ГВ, в частности ретроорбитальная гранулема, менее «чувствительна» к ритуксимабу, чем гранулематозное поражение легких. У некоторых пациентов ритуксимаб назначали в комбинации с другими иммуносупрессивными препаратами, включая циклофосфамид, метотрексат, азатиоприн и микофенолата мофетил, в то время как у других – в виде монотерапии в сочетании только с ГК. Следует обратить внимание на то, что полный клинический эффект на фоне лечения ритуксимабом развивается к концу третьего месяца, что диктует необходимость дальнейшего изучения оптимальных схем комбинированной терапии.
Криоглобулинемический васкулит
Смешанная криоглобулинемия (СК) – системный васкулит, связанный с пролиферацией клонов В–клеток, синтезирующих «патогенный» IgM, обладающий активностью ревматоидного фактора (РФ) [32]. СК ведет к развитию широкого спектра клинических проявлений, выраженность которых варьирует от умеренно выраженного кожного васкулита по типу пурпуры, артралгий и астении (синдром СК) до тяжелых неврологических нарушений и поражения почек. В настоящее время убедительно доказана роль вируса гепатита С (ВГС) в развитии СК, который выявляется у 60–90% пациентов, а у 36–55% пациентов, инфицированных ВГС, развивается криоглобулинемия. При этом у 15–20% пациентов с СК, ассоциированной с ВГС, развивается тяжелых васкулит, который в отсутствие эффективного лечения может привести к летальному исходу у 15–20% с КВ, связанным с ВГС, и у 50% с ЕСК.
Лечение СК практически не разработано. У пациентов с инфекцией ВГС монотерапия интерфероном (ИФН)–α недостаточно эффективна и часто сопровождается развитием обострений. Более эффективна комбинированная терапия ИФН–α и рибавирином, на фоне которой почти у 80% пациентов развивается ремиссия, однако у некоторых пациентов имеют место тяжелые побочные эффекты. Применение ГК, циклофосфамида и плазмафереза у пациентов, резистентных к противовирусной терапии, также имеет ограниченную эффективность и сопровождается тяжелыми побочными эффектами.
В настоящее время проведена серия исследований (всего 57 пациентов), которые суммированы в обзоре P. Cocoub и соавт. [39], свидетельствующих о высокой эффективности ритуксимаба при КВ (табл. 4).
Таблица 4. Эффективность ритуксимаба при криоглобулинемическом васкулите [39]
| ВГС (+) n=43 | ВГС (-) n=14 | |||
| n | % | n | % | |
| Поражение кожи • Полная/частичная ремиссия |
33 27 |
81,8 | 5 3 |
60 |
| Артралгии • Полная/частичная ремиссия |
30 24 |
80 | 4 3 |
75 |
| Нейропатия • Полная/частичная ремиссия |
25 23 |
92 | 4 4 |
100 |
| Криоглобулинемия • Полная/частичная ремиссия |
15 13 |
86,6 | 7 5 |
71,4 |
У двух третей больных был КВ, связанный с инфекцией ВГБ, а у остальных – ессенциальная смешанная криоглобулинемия (ЕСК). Основными клиническими проявлениями КВ были поражение кожи (84%), артралгии (61,4%), периферическая нейропатия (54,4%), гломерулонефрит (31,6%), которые были рефрактерны у противовирусной (более чем у половины больных) и иммуносупрессивной терапии у остальных. Как видно из таблицы 4, ритуксимаб был эффективен в отношении основных клинических проявлений КВ, причем у 80–93% пациентов развилась полная (или частичная) ремиссия. Однако у 39% больных развилось обострение в среднем через 6,7 мес. после последней инфузии. При этом у 8 из 14 удалось достигнуть ремиссии на фоне повторного курса терапии. Примечательно, что ритуксимаб был одинаково эффективен как у пациентов с ЕСК, так и с КВ, связанным с ВГС.
Идиопатическая тромбоцитопеническая пурпура
Идиопатическая тромбоцитопеническая пурпура (ИТП) – частое гематологическое аутоиммунное заболевание, связанное с синтезом антитромбоцитарных антител, характеризующееся тромбоцитопенией и риском кровотечений. В настоящее время проведено 19 исследований (всего 313 пациентов), в которых изучалась эффективность ритуксимаба, и 29 исследований (306 пациентов), посвященных безопасности терапии, результаты которых обобщены в недавно опубликованном систематическом обзоре [40]. Проведенный анализ продемонстрировал очень высокую эффективность ритуксимаба (62,5%) в отношении нормализации концентрации тромбоцитов (табл. 5).
Таблица 5. Эффективность ритуксимаба при ИТП [41]
| Число тромбоцитов х109 | Эффективность, % |
| Всего (>50) | 62,5 |
| Полный ответ (>150) | 46,3 |
| Частичный ответ (50–150) | 24,0 |
Длительность эффекта в среднем составила 10,5 мес. У большинства пациентов применялась стандартная схема лечения, состоящая из 4 еженедельных инфузий препарата в дозе 375 мг/м2. Примерно у половины пациентов до назначения ритуксимаба была проведена спленэктомия, которая была неэффективна.
Пузырчатка
Пузырчатка – потенциально смертельное аутоиммунное заболевание, проявляющееся тяжелым поражением кожи и слизистых оболочек [41]. В основе развития заболевания лежит синтез аутоантител, реагирующих с десмоглеином 1 и 3 и молекулами адгезии эпидермиса, обеспечивающими сцепление между кератиноцитами соответственно в коже и слизистых [42]. Недавно появились сообщения об успешном применении ритуксимаба у пациентов с тяжелой пузырчаткой, рефрактерной к стандартной терапии, включающей высокие дозы ГК, цитостатиков, плазмаферез и внутривенный иммуноглобулин [43]. В исследовании P. Joly и соавт. [44], в которое вошел 21 пациент, лечение ритуксимабом (375 мг/кг в течение 4 недель) привело к полной ремиссии у 18 (86%) пациентов. Длительность ремиссии составила в среднем 35 месяцев, причем у 8 пациентов удалось полностью отменить ГК, а у остальных – существенно снизить поддерживающую дозу препарата. Сходные данные ранее получены другими авторами, которые сообщают о полной ремиссии у 9 из 11 больных с фатальным течением заболевания, однако состояние ремиссии поддерживалось инфузиями внутривенного иммуноглобулина [45].
Заболевания почек
Как уже отмечалось, ритуксимаб зарекомендовал себя как эффективный препарат для лечения волчаночного нефрита. Поэтому представляют особый интерес результаты применения ритуксимаба при других формах почечной патологии.
Мембранозная нефропатия (МН) – наиболее частая причина (20%) идиопатического нефротического синдрома (ИНС) [46]. Несмотря на то что у трети пациентов могут развиваться спонтанные ремиссии, почти в 40% случаев процесс прогрессирует, приводя к развитию хронической почечной недостаточности в течение 10 лет после начала болезни, даже несмотря на проводимую иммуносупрессивную терапию [47,48].
Характерной особенностью поражения почек при МН является накопление иммунных депозитов на внешней стороне базальной мембраны клубочков почек. Иммунные депозиты состоят из IgG (часто IgG4), мембрано–атакующего комплекса комплемента (C5b–C9), а также плохо охарактеризованных белковых молекул, которые, как предполагают, могут выступать в роли аутоантигенов. Таким образом, МН может быть своеобразной формой аутоиммунного заболевания, развитие которого связано с синтезом «нефритогенных» аутоантител. В процессе изучения экспериментальной модели МН, Хеймановского нефрита, было показано, что одним из вероятных аутоантигенов является мембранный белок подоцитов почки, который получил название мегалин. Его аналогом при МН у человека может быть нейтральная эндопептидаза – фермент, присутствующий на мембране подоцитов и других компонентов почечной ткани [49].
По данным P. Ruggenenti и соавт. [50], лечение ритуксимабом ассоциируется с достоверным снижением протеинурии, увеличением концентрации сывороточного альбумина у пациентов с ИНС, резистентным к длительной терапии ингибиторами ангиотензинпревращающего фермента (АПФ). Отмечена связь между эффективностью терапии ритуксимабом и тяжестью интерстициального фиброза и атрофии канальцев, по данным морфологического исследования в динамике [51].
Кроме того, предварительные результаты свидетельствуют о высокой эффективности ритуксимаба у детей с стероидрезистентным нефротическим синдромом [52] и очаговым сегментарным гломерулосклерозом, нередко развивающимся после пересадки почки [53]. Эти данные свидетельствуют о перспективах применения ритуксимаба в нефрологии и трансплантологии [54].
Таким образом, ритуксимаб является чрезвычайно эффективным и относительно безопасным препаратом для лечения РА и других тяжелых аутоиммунных заболеваний. Его внедрение в клиническую практику по праву можно считать крупным достижением медицины начала XXI века, которое имеет не только важное клиническое, но и теоретическое значение, поскольку способствует расшифровке фундаментальных звеньев патогенеза аутоиммунных заболеваний человека.
Фактически ритуксимаб является родоначальником нового направления в лечении аутоиммунных заболеваний человека, в основе которого лежит модуляция В–клеточного звена иммунитета.
Однако изучение места ритуксимаба в клинической медицине только начинается. Поскольку, как уже отмечалось, в большинстве случаев препарат назначали пациентам с очень тяжелым течением болезней, нередко по жизненным показаниям, неудивительно, что контролируемых исследований его эффективности и безопасности при большинстве аутоиммунных заболеваний (за исключением РА) до сих пор не проводилось. Тем не менее, хотя представленные выше оптимистические результаты основываются главным образом на материалах открытых «пилотных» исследований или ретро спективном анализе исходов терапии в небольших группах больных, они создают хорошие предпосылки для более широкого внедрения ритуксимаба в клинической практике и должны стимулировать организацию широкомасштабных контролируемых испытаний, необходимых для расширения официальных показаний к его применению.
ЛИТЕРАТУРА
1. Browning JL. B cell move to centre stage: novel opportunities for autoimmune disease treatment. Nature Rev. 2006; 5: 564–576
2. Bizzaro N, Tozzoli R, Shoenfeld Y. Are we at stage to predict autoimmune rheumatic diseases? Arthritis Rheum 2007; 56: 1736–1744
3. Hansen A, Lipsky PE, Dorner T. B cell lymphoproliferation in chronic inflammatory rheumatic diseases. Nature Clin Pracr Rheumatol 2007; 3: 561–
4. Edwards JCW, Cambridge G. Rheumatoid arthritis: the predictable effect of small immune complexes in which antibody is also antigen. Br J Rheumatol. 1998; 37:126–130.
5. Youinou P, Jamin C, Saraux A. B–cell: a logical target for treatment of rheumatoid arthritis. Clin Exp Rheumatol 2007; 25: 318–328
6. Driver CB, Ishimori M, Weisman WH. The B cell in systemic lupus erythematosus: a rational target for more effective therapy. Ann Rheum Dis 2007; August 24 on line
7. Edwards JCW, Cambridge G, Leandro MJ. B cell depletion therapy in rheumatic disease Best Pract Res Clin Rheumatol 2006; 20: 915–928
8. Reff ME, Carner K, Chambers KS, et al. Depletion of B cells in vivo by a chimeric mouse human antibody to CD20. Blood. 1994; 83:435–445.
9. Boye J, Elter T, Engert A. An overview of the current clinical use of the anti–CD20 monoclonal antibody rituximab. Ann Oncol 2003; 14: 520–535
10. Johnson P, Glennie M. The mechanism of action of rituximab in the elimination of tumor cells. Semin Oncol 2003 (Supp 2); 30:3–8.
11. Насонов ЕЛ. Перспективы применения моноклональных антител к В–лимфоцитам (ритук-симаб) при ревматоидном артрите. Клин. Фармакол. терапия 2006; 1–5:55–58
12. Насонов Е.Л. Новые направления терапии ревматоидного артрита: перспективы применения моноклональных антител к В–лимфоцитам (ритуксимаб). РМЖ 2006; 25: 1778–1782
13. Соловьев С.К., Котовская М.А., Насонов Е.Л. Ритуксимаб в лечении системной красной волчанки. РМЖ 2005; 13: 1731–1735
14. Nielsen CH, Fassi DE, Hasselbalch HC, et al. B cell depletion with rituximab in the treatment of autoimmune disrases. Expert Opin Biol Ther 2007; 7: 1061–1078
15. Schmidt E, Hunzelman N, Zillikens D, et al. Rituximab in refractory autoimmune diseases Clin Exp Dermatol 2006; 31: 503–508
16. Lipsky PE. Systemic lupus erythematosus: an autoimmune disease of B cell hyperactivity. Nat Immunol. 2001; 2:764–766.
17. Соловьев СК, Торгашина А, Асеева Е, Насонов Е.Л. Ритуксимаб. Анти–В–клеточная терапия системной красной волчанки. ГУ Институт ревматологии РАМН, Москва, 2007, 20 стр.
18. Moutsopoulos HM, Chused TM, Mann DL, et al. Sjogrens`s syndrome (sicca syndrome): current issues. Ann Intern Med 1980; 92: 212–226
19. Ramos–Casals M, Brito–Zeron P. Emerging biological therapy in primary Sjogren`s syndrome. Rheumatology 2007, June 22, on line.
20. Gottenberg J–E, Guillevin L, Lambotte O, et al. Tolerance and short term efficacy of rituximab in 43 patients with systemic autoimmune disease. Ann Rheum Dis 2005;64: 913–920.
21. Pijpe J, van Imhoff GW, Spijkervet FK, et al. Rituximab treatment in patients with primary Sjogren`s syndrome: an open–label phase II study. Arthritis Rheum 2005; 64: 913–920
22. Seror R, Sorbet C, Guilleven L, et al. Tolerance and efficacy of rituximab and changed in serum biomarkers in patients with systemic complications of primary Sjogren`s syndrome. Ann Rheum Dis 2006; Sept 1 on lime
23. Davauchelle–Pensec V, Pennec Y, Morvan J, et al. Improvement of Sjogren`s syndrome after two infusions of rituximab (Anti–CD20). Arthritis Care Res 2007; 57: 310–317
24. Voulgarelis M, Giannouli S, Anagnostou D, Tzioufas AG, Combined therapy with rituximab plus cyclophosphamide/doxorubicin/vincristin/prednisolon (CHOP) for Sjogren`s syndrome associated B–cell aggressive B cell aggressive non–Hodgkin`s lymphoma. Rheumatology (Oxford) 2004; 43: 1050–1053
25. Dalakas MC, Hohlfeld R. Polymyositis and dermatomyositis. Lancet 2003; 362: 971–982.
26. Levin T.D. Rituximab in the treatment of dermatomyositis. Arthritis Rheum 2005; 52: 601–607.
27. Noss EH, Hausner–Sypek DL, Weinblatt ME. Rituximab as the therapy for refractory polymyosi-tis and dermatomyositis. J Rheumatol 2006; 33: 1021–1026.
28. Lambotte O, R Kotb, G Maigne et al. Efficacy of Rituximab in refractory polymyositis.J Rheumatology 2005;32:1369–70.
29. Brulhart L, Waldburger J–M, Gabay C. Rituximab in the treatment of antisynthetase syndrom. Ann Rheum Dis 2006; 65: 974–975
30. Cooper MA, Willingham DL, Brown DE, et al. Rituximab for the treatment of juvenile dermato-myositis. Arthritis Rheum 2007; 56: 3107–3111
31. Mok CC, Ho LY, To CH. Rituximab for refractory polymyositis: an open–label prospective study. J Rheumatol 2007; 34: 1864–1868
32. Насонов Е.Л., Баранов А.А., Шилкина Н.П. Васкулиты и васкулопатии. Ярославль. Издательство «Волга», 1999., 612 стр.
33. Flossman O, Jones RB, Jayne DRW, Luqmani RA. Should rituximab be used to treat antineu-trophil cytoplasmic antibody associated vasculitis? Ann Rheum Dis 2006;15 June on line.
34. Keogh KA, Ytterberg SR, Fervenza FC, Carlson KA, Schroeder DR, Specks U. Rituximab for refractory Wegener’s granulomatosis: report of a prospective, open–label pilot trial. Am J Respir Crit Care Med 2006;173:180–7
35. Aries PM, Hellmich B, Voswinkel J, Both M, N lle B, Holl–Ulrich K, et al. Lack of efficacy of ritu-ximab in Wegener’s granulomatosis with refractory granulomatous manifestations. Ann Rheum Dis 2006;65:853–8.
36. Keogh KA, Wylam ME, Stone JH, Specks U. Induction of remission by B lymphocyte depletion in eleven patients with refractory antineutrophil cytoplasmic antibody–associated vasculitis. Arthritis Rheum 2005;52:262–8
37. Eriksson P. Nine patients with anti–neutrophil cytoplasmic antibody–positive vasculitis successfully treated with rituximab. J Intern Med 2005;257:540–8.
38. Omdal R, Wildhagen K, Hansen T, Gunnarsson R, Kristoffersen G. Anti–CD20 therapy of treatment–resistant Wegener’s granulomatosis: favourable but temporary response. Scand J Rheumatol 2005;34:229–32
39. Cocoub P, Delluc A, Saadoun D, et al. Anti–CD20 monoclonal antibody (rituximab) treatment for cryoglobulinemia vasculitis? Where do we stand? Ann Rheum Dis 2007; 20 June on line.
40. Arnold DA, Dentali F, Crowther MA, et al. Systemic review: efficacy and safety of rituximab for adults with idiopathic thrombocytopenic purpura. Ann Intern Med 2007; 146: 25–33
41. Anhalt GJ, Diaz LA. Research advances in pemphigus. JAMA 2001; 285:652–654
42. Kottke MD, Delva E, Kowalczyk. The desmosome; cell science lessons from human diseases. J Cell Sci 2006; 119: 797–806
43. Schmidt E, Hunzelman N, Zillikens D, et al. Rituximab in refractory autoimmune bullous diseases. Clin Exp Dermatol 2006; 31: 503–508
44. Joly P, Mouquet H, Roujeau J–C, et al. A single cycle of rituximab for the treatment of severe pemphigus. New Engl J Med 2007; 357: 545–552
45. Ahmed AR, Spigelman Z, Cavacini LA, Posner MR. Treatment of pemphigus vulgaris with rituxi-mab and intravenous immune globulin. New Engl J Med 2006; 355: 1772–1779
46. Glassoks RJ. Diagnosis and natural course of membranous nephropathy. Semin Nephrol 2003; 23: 324–332.
47. Glassock RJ. The treatment of idiopathic membranous nephropathy; a dilemma or a conundrum? Am J Kidney Dis 2004; 44: 562–566
48. Perna A, Schieppati A, Zamora J, et al. Immunosupressive treatment for idiopathic membranous nephropathy: a systemic review. Am J Kidney Dis 2004; 44: 385–401
49. Ronco P, Debiec H. Molecular dissection of target antigens and nephritogenic antibodies in membranous nephropathy; towards epitope–driven therapies. J Am Soc Nephrol 2006; 17: 1772–1774
50. Ruggenenti P, Chiurchiu C, Brusegan V, et al. Rituximab in idiopathic membranous nephropat-hy; a one–year prospective study. J Amer Soc Nephrol 2003;14:1851–1857
51. Ruggenenti P, Chiurchiu C, Abbate M, et al. Rituximab for idiopathic membranous nephropathy; who can benefit? Clin J Am Soc Nephrol 2006; 1: 738–748
52. Bagga A, Sinha A, Moudgil A. Rituximab in patients with steroid–resistant nephrotic syndrome. New Engl J Med 2007; 356: 2751–2752
53. Pescovitz MD, Book BK, Sidner RA. Resolution of recurrent focal segmental glomerulosclerosis proteinuria after rituximab treatment. N Engl J Med 2006; 35: 1961–1963
54. Salama AD, Pusey CD. Rituximab in renal disease and transplantation Nature Clin Pract Nephrol 2005; 2: 221–230.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Ритуксимаб — революционер в химиотерапии некоторых злокачественных лимфом, к тому же произведенный с помощью генной инженерии.
- Химические свойства и состав
- Фармакологическое действие
- Фармакодинамика и фармакокинетика
- Показания к применению
- Противопоказания
- Побочные действия
- Особые указания
- Передозировка
- Взаимодействие
- Фертильность, беременность и лактация
- Срок годности
- Аналоги
Химические свойства и состав
Ритуксимаб относится к биологическим лекарственным препаратам, а конкретно — к моноклональным антителам или коротко МАБ.
Это иммуноглобулин, то есть синтезируемый иммунными клетками крупный белок.
По функционалу – антитело, которому в организме человека надлежит связаться с определенного вида антигеном – чужеродным белком, бактериальным продуктом или определенного рода клеточным субстратом. Ритуксимабу необходимо связаться с рецептором на поверхности нездоровой клетки крови.
Это моноклональное антитело, поскольку производится не всеми подряд клетками крови, а определенной группой или клоном.
Белок состоит из трёх разной длины цепочек аминокислот, синтезированных клетками мышей и человеческими, поэтому антитело называется химерным, то есть смешанным из животных и человеческих белков – для уменьшения токсичности лекарства.
Фармакологическое действие
В организме человека ритуксимаб ищет специальный антиген CD20, который существует на поверхности большинства злокачественных клеток, составляющих В-лимфомы, и на обычных В-лимфоцитах. На других клетках крови подобного антигена быть не должно и в плазме крови он не плавает.
Связавшись с антигеном, ритуксимаб обрывает жизненно необходимую цепочку клеточных биохимических реакций, и как результат – клетка включает программу самоубийства или апоптоза. Кроме того, препарат усиливает повреждающее действие других цитостатиков, поэтому его включают в схемы химиотерапии при лимфомах и лимфолейкозе.
Поскольку МАБ убивает и нормальные В-лимфоциты, обладающие CD20, то они тоже погибают. Как видим, избирательность действия лекарственного препарата заключается не в способности найти и уничтожить опухолевую клетку, а в убийстве обладающих антигеном клеток. У одного из сотни больных лимфомой организм вырабатывает антитела, нейтрализующие химерные белки, что делает использование препарата бесполезным.
Фармакодинамика и фармакокинетика
Практически весь введенный ритуксимаб с кровью доходит до места приложения силы, что обозначается как 100% биодоступность. Концентрация препарата в крови возрастает с каждым введением, к четвёртой капельнице количество активного вещества вдвое больше начального, а к восьмой капельнице достигается максимум. На этом процессе не отражается ни возраст пациента, ни его пол, ни национальность.
На выведение из организма половины дозы лекарственного средства потребуется более трёх недель, но следы находят и через полгода после завершения лечения. Выведение ритуксимаба возложено на макрофаги, также заглатывающие бактерии, вирусы и всё чужеродное для человека, но это только предположение. Почки и печень, по-видимому, в процессе удаления препарата не участвуют, во всяком случае у пациентов с недостаточностью их функции нет необходимости изменять дозировку.
Показания к применению
К ритуксимабу чувствительны только клеточные колонии, содержащие на поверхности рецепторы СD20, и сегодня такие лимфопролиферативные процессы специально выявляются анализами. Как правило, хорошо реагируют на терапию неходжкинские В-крупноклеточные лимфомы и низкой агрессивности фолликулярные лимфомы. Препарат используется как в самом начале и для поддерживающего лечения, так и при прогрессировании заболевания на других схемах, и при появлении рецидивов.
Второе показание – хронический лимфолейкоз, используется в первой линии, при неэффективности предшествующей химиотерапии или рецидиве, как правило, в комплексе с другими цитостатиками.
Противопоказания
Исключено применение ритуксимаба при аллергии на него.
Нельзя использовать у пациентов с иммунным дефицитом, поскольку препарат уничтожает и без того недостаточные В-лимфоциты.
При острых воспалительных и инфекционных процессах на лечение накладывается временное табу, так как подавление иммунитета может привести к генерализации инфекции.
Очень осторожно используется лекарство при сниженных показателях лейкоцитов – нейтрофилов и тромбоцитов, что обычно для последствий химиотерапии.
Введение препарата часто осложняется одышкой и отеком легочной ткани, поэтому у пациентов с легочными метастазами или дыхательной недостаточностью могут быть очень неприятные для здоровья последствия. Тем не менее, это не считается абсолютным противопоказанием, просто надо проводить лечение с известной долей предусмотрительности.
Клинические исследования у несовершеннолетних не проводятся, поэтому неизвестны «подводные камни» терапии, оттого препарат не лицензирован для этой возрастной категории. Исключено применение у беременных и кормящих мам.
Побочные действия
Любое противоопухолевое лечение чревато осложнениями и ритуксимаб не исключение, спектр осложнений достаточно широк, некоторые побочные реакции встречаются часто, некоторые не минует большинство пациентов. При комбинированной химиотерапии на токсичность ритуксимаба накладываются побочные реакции от других препаратов схемы.
Очень часто на фоне лечения ритуксимабом развивается:
- локальная отечность кожи – ангионевротический отек, когда участок «подушкой» поднимается рядом с совершенно неизменными тканями;
- развитие инфекции сопряжено с механизмом действия и главной силой препарата – уничтожением лимфоцитов;
- разнообразные сыпи с зудом;
- головные боли и нередко с повышением температуры;
- тошнота.
После курса в анализе крови снижаются показатели и G-иммуноглобулин, но 4 степень падения уровня отмечается едва ли у 1-2%. Уменьшение численности В-лимфоцитов не фатально, но очень продолжительно — до года.
При очень высокой чувствительности к ритуксимабу и массированным распадом опухолевых узлов возможно развитие синдрома опухолевого лизиса, который необходимо заблаговременно спрогнозировать и провести профилактические мероприятия.
Особые указания
У каждого второго во время капельницы, особенно при первых введениях, развивается неприятное состояние – инфузионная реакция, когда пациент ощущает резко нахлынувшую слабость до «трясучки», с тошнотой и головной болью, в некоторых местах начинает зудеть кожа и может быстро появиться сыпь, из-за спастического сокращения дыхательных путей трудно дышать.
Если, несмотря на предварительное введение лекарственных средств – премедикацию, развилась тяжелая инфузионная реакция, то на время прекращается введение ритуксимаба, дополнительно внутривенно вводятся вспомогательные препараты, и при нормализации состояния продолжают капельное введение ритуксимаба, но скорость падения капель уменьшаю вдвое.
Как правило, к следующей капельнице интенсивность реакции снижается, а последнюю 8-ую капельницу 99% пациентов переносят без реакции. Тем не менее, всегда перед введением ритуксимаба профилактически вводятся препараты, предотвращающие аллергические проявления, болевой синдром и повышение температуры.
Передозировка
В инструкции к препарату производители указывают отсутствие сведений о передозировке – превышению разрешенной для использования дозы. Передозировка при химиотерапии невозможна, поскольку лекарство вводится в стандартной дозе, рассчитываемой на поверхность тела больного. Плохая переносимость не имеет отношения к передозировке, так как побочные реакции обусловлены механизмом действия лекарственного средства и индивидуальной чувствительностью тканей пациента.
Взаимодействие
Ритуксимаб входит в множество лекарственных комбинаций, которые изучаются в клинических исследованиях не только на эффективность, но и безопасность для пациентов. Для лечения онкогематологических процессов рекомендуются определенные – стандартные комбинации, в которых минимально совпадает токсичность при максимальной результативности каждого препарата в отдельности.
Для капельного введения ритуксимаба используются специальные системы, поскольку молекулы лекарства соединяются с материалом обычных капельниц.
Фертильность, беременность и лактация
На беременных и кормящих, как и на детях, противоопухолевые лекарства не изучаются. В доклинических исследованиях, конечно, могут проводиться эксперименты с беременными животными, но совпадение реакций у животных и человека абсолютно не гарантируется.
Иммуноглобулины G способны проходить в грудное молоко и плод, у случайно забеременевших на фоне лечения МАБ анализы крови новорожденных демонстрировали снижение числа В-лимфоцитов.
Женщинам репродуктивного возраста настоятельно рекомендуется предохранение во время терапии и не менее года после её завершения.
Срок годности
После выпуска препарат разрешается использовать два с половиной года.
Аналоги
Ритуксимаб – биологический препарат, состоящий из 1200 аминокислот, часть которых довольно постоянна. Точное копирование его структуры совершенно невозможно, поскольку производство базируется на генной инженерии. Все производители ритуксимаба стараются сделать идентичный оригиналу препарат, но отличаются лабораторные мыши, белковые структуры которых идут на изготовление лекарства.
Клинические исследования, как правило, проводятся только с первым — оригинальным средством, остальные — только копии с неизвестной долей отличий, поэтому эффективность с токсичностью препаратов от разных производителей могут отличаться.
Ритуксимаб – это международное наименование, каждый производитель дает лекарству свое имя — торговое, первым была Мабтера. После окончания патентной защиты появилась ацеллбия, реддитукс и другие.
Вам не надо думать, какое лекарственное средство для вас лучше и где его купить – это наша забота, вы просто должны быть уверенными, что получите только оригинальный препарат, имеющий достоверные доказательства клинической эффективности и безопасности.
Список литературы
- Ardeshna K., Qian W., Smith P. et al. /An Intergroup Randomised Trial of Rituximab Versus a Watch and Wait Strategy In Patients with Stage II, III, IV, Asymptomatic, Non-Bulky Follicular Lymphoma (Grades 1, 2 and 3a). A Preliminary Analysis// Blood (ASH Annual Meeting Abstracts). 2010;116
- Kahl B.S., Hong F., Williams M. et al./ Results of Eastern Cooperative Oncology Group Protocol E4402 (RESORT): A Randomized Phase III Study Comparing Two Different Rituximab Dosing Strategies for Low Tumor Burden Follicular Lymphoma// Blood (ASH Annual Meeting Abstracts). 118(21):LBA-6.
- Hallek M, Fischer K, Fingerle-Rowson G. et al./ Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: a randomised, open-label, phase 3 trial// Lancet. 2010; 376(9747).
- Fischer K, Cramer P, Busch R, et al. / Bendamustine in combination with rituximab for previously untreated patients with chronic lymphocytic leukemia: A multicenter Phase II study of the German Chronic Lymphocytic Leukemia Study Group //J Clin Oncol 2012: 30.
Актуальность
Ритуксимаб – препарат, широко используемый в лечении аутоиммунных заболеваний, однако не лишенный серьезных побочных эффектов.
Представляем Вашему вниманию результаты исследования, в котором оценили частоту серьезных инфекционных событий на фоне терапии ритуксимабом и факторы риска.
Дизайн исследования
Французские исследователи ретроспективно проанализировали данные пациентов из когортного одноцентрового исследования (2005-2016 гг.).
Речь шла о пациентах с аутоиммунными заболеваниями, получивших как минимум 1 курс ритуксимаба (полностью законченный курс терапии). Частота серьезных инфекционных явлений и частота назначения иммуноглобулин заместительной терапии оценивали в течение 24 месяцев после начала терапии ритуксимабом.
Результаты
- В исследование включили 221 пациента, которые в общей сложности получили 276 курсов терапии ритуксимабом.
- Показанием к назначению ритуксимаба являлись заболевания соединительной ткани (38%), системный васкулит (36%) и аутоиммунная цитопения (22%).
- Частота развития серьезных инфекционных нежелательных явлений на 1 году составила 17,3 (95% доверительный интервал (ДИ) 12,0-22,5) на 100 человеко-лет и на втором году 11,3 (95% ДИ 8,1-14,5) на 100 человеко-лет.
- За период наблюдения произошли 47 серьезных инфекционных нежелательных явления, в частности пневмонии (45%) и бактериемии (21%).
- Наиболее частыми возбудителями инфекции являлись бактерии (55%) и грибы (12%).
- Факторами риска инфекционных нежелательных явлений были возраст, указание в анамнезе на диабет, онкологические заболевания, сопутствующая терапия стероидами и низкий уровень CD4 лимфоцитов до начала терапии ритуксимабом.
- Иммуноглобулин заместительная терапия была начата в 22 курсах ритуксимаба (8%).
Заключение
У пациентов с аутоиммунными заболеваниями, которые начали терапию ритуксимабом, частота серьезных инфекционных нежелательных явлений составляет 17,3 на 100 человеко-лет в первый год и 11,3 во второй год. Коморбидные заболевания, возраст и сопутствующая терапия являются важными факторами риска инфекционных побочных эффектов.
Источник: Sarah Stabler, Jonathan Giovannelli, David Launay, et al. Serious infectious events and immunoglobulin replacement therapy in patients with autoimmune diseases receiving rituximab: a retrospective cohort study, Clinical Infectious Diseases. 2020: ciaa127.