РотаТек — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер
ЛП-001865
Торговое наименование препарата
РотаТек®
Международное непатентованное наименование
Вакцина для профилактики ротавирусной инфекции, пентавалентная, живая
Лекарственная форма
раствор для приема внутрь
Состав
Одна доза (2 мл) содержит:
Действующие вещества
Живые реассортанты человеческого и бычьего ротавирусов, выращенные на культуре клеток Веро:
Ротавирус типа G1 не менее 2,2×106 ИЕ*
Ротавирус типа G2 не менее 2,8×106 ИЕ*
Ротавирус типа G3 не менее 2,2×106 ИЕ*
Ротавирус типа G4 не менее 2,0×106 ИЕ*
Ротавирус типа Р1А[8] не менее 2,3×106 ИЕ*
* ИЕ — инфекционная единица
Вспомогательные вещества
Сахароза 1080 мг, натрия гидроксид 2,75 мг, натрия цитрата дигидрат 127 мг, натрия дигидрофосфата моногидрат 29,8 мг, полисорбат-80 от 0,17 до 0,86 мг, ротавирусный растворитель. Суммарный объем пяти растворов вирусных балков и ротавирусного растворителя составляет 15 % от общего объема вакцины.
Описание
Прозрачная жидкость бледно-желтого цвета: допустимо наличие розового оттенка.
Фармакотерапевтическая группа
МИБП-вакцина
Код АТХ
J07BH
Фармакодинамика:
РотаТек®- это живая пероральная пентавалентная вакцина, содержащая пять живых реассортантных штаммов ротавируса. Ротавирусные родительские штаммы реассортантов были изолированы из организмов человека и быка. Четыре вакцинных реассортанта ротавируса экспрессируют один из наружных капсидных белков VP7 (серотипы G1, G2, G3 или G4) человеческого родительского штамма ротавируса и белок VP4 (серотип Р7[5]) бычьего родительского штамма ротавируса (белок VP4 отвечает за прикрепление ротавируса к поверхности клеток). На поверхности пятого реассортанта вируса экспрессирован белок VP4 (серотип Р1 А[8]) человеческого родительского штамма ротавируса и наружный капсидный белок VP7 (серотип G6) бычьего родительского штамма ротавируса.
Каждый из реассортантов выращен по отдельности на культуре клеток Веро стандартными культуральными методами без использования противогрибковых препаратов. Затем реассортанты все вместе помещены в буферный стабилизирующий раствор.
Так как в производстве реассортантов. входящих в состав вакцины РотаТек®, используется биологический материал животного происхождения, в вакцине обнаружены малые фрагменты ДНК ЦВС-1 и ЦВС-2 (цирковирус свиней 1 и 2 типов), при этом сами вирусные частицы ЦВС-1 и/или ЦВС-2 в вакцине отсутствуют. В настоящее время неизвестны случаи заболевания человека, вызванные ЦВС-1 и/или ЦВС-2.
Вакцина РотаТек® не содержит тиомерсала и других консервантов.
Фармакокинетика:
ИММУНОБИОЛОГИЧЕСКИЕ СВОЙСТВА
В умеренной климатической зоне ротавирусный гастроэнтерит является сезонным заболеванием с увеличением заболеваемости (эпидемиями) в зимние месяцы. При отсутствии лечения ротавирусный гастроэнтерит может привести к летальной дегидратации.
Эффективность
По данным клинических исследований эффективность вакцины РотаТек® была продемонстрирована в отношении гастроэнтерита, вызванного ротавирусами генотипов G1 Р[8], G2P[4], G3P[8], G4P[8] и G9P[8].
Эффективность вакцины РотаТек® изучалась по 2 параметрам в плацебо-контролируемом исследовании эффективности и безопасности (REST):
1. У 5673 вакцинированных детей (2834 ребенка в группе вакцины) эффективность измерялась как уменьшение числа случаев ротавирусного гастроэнтерита, вызванного генотипами G, входящими в вакцину (G1-G4), который развивался через 14 дней после получения третьей дозы вакцины и на протяжении первого полного ротавирусного сезона после вакцинации.
2. У 68038 вакцинированных детей (34035 детей в группе вакцины) эффективность защиты измерялась как уменьшение числа случаев госпитализаций и обращений за неотложной помощью по поводу ротавирусного гастроэнтерита, начиная с 14-го дня после получения третьей дозы вакцины.
Результаты данных исследований представлены в таблицах.
|
Уменьшение числа случаев ротавирусного гастроэнтерита на протяжении одного полного сезона после вакцинации (группа вакцины РотаТек® n=2834) (% [95% доверительный интервал (ДИ)]) |
||||||
|
Эффективность против ротавирусного гастроэнтерита любой степени тяжести в зависимости от генотипа |
||||||
|
Тяжелая* степень заболевания (G1-G4) |
Любая степень тяжести (G1-G4) |
G1 |
G2 |
G3 |
G4 |
G9 |
|
98,0% [88.3; 100,0] ţ |
74,0% [66.8; 79,9] ţ |
74,9% [67,3; 80,9] ţ |
63,4% [2,6; 88,2] ţ |
82,7% [<0; 99,6] |
48,1% [<0; 91,6] |
65,4% [<0; 99,3] |
* Тяжелая степень определялась как результат «больше 6 из 24» по валидированной клинической системе подсчета, основанной на интенсивности и продолжительности симптомов (лихорадки, рвоты, диареи, изменений поведения).
ţ Статистически значимо.
|
Уменьшение числа госпитализаций и обращений за неотложной помощью по поводу ротавирусного гастроэнтерита на протяжении 2 лет после вакцинации (группа вакцины РотаТек ® n=34035) (% [95% [ДИ]) |
|||||
|
G1-G4 |
G1 |
G2 |
G3 |
G4 |
G9 |
|
94,5% [91,2; 96.6] ţ |
95,1% [91,6; 97,1] ţ |
87,6% [<0; 98,5] |
93,4% [49,4; 99,1] ţ |
89,1% [52,0; 97,5] ţ |
100% [69,6; 100,0] ţ |
ţ Статистически значимо.
Уменьшение числа случаев ротавирусного гастроэнтерита, вызванного генотипами G1-G4 во время второго ротавирусного сезона после вакцинации, составило 88.0% [95% ДИ: 49,4; 98,7] для тяжелой степени заболевания и 62,6% [95% ДИ: 44,3; 75,4] для заболевания любой степени тяжести.
Эффективность против ротавируса генотипов G2P[4], G3P[8], G4P[8] и G9P[8] была рассчитана для меньшего числа случаев, чем для G1. Эффективность против генотипов G2P[4], скорее всего, связана с наличием реассортанта G2 в составе вакцины.
В комбинированном ретроспективном анализе исследования REST и другого исследования фазы 3 эффективность вакцины против ротавирусного гастроэнтерита (любой степени тяжести), вызванного G1-, G2-, G3- и С4-серотипами, составила 61,5% [95% ДИ: 14,2; 84,2] среди детей, получивших третью дозу препарата в возрасте от 26 до 32 (включительно) недель.
В Финляндии было проведено дополнительное исследование в рамках исследования REST. В финском дополнительном исследовании (FES) наблюдали группу из 20736 детей, ранее участвовавших в исследовании REST. В исследовании FES детей наблюдали в течение до 3 лет после вакцинации.
В исследовании REST было сообщено о 403 случаях ротавирусного гастроэнтерита, связанного с генотипами G1-G4 и G9 (20 случаев в группе вакцины и 383 в группе плацебо). В исследовании FES было отмечено дополнительно 136 случаев (9 в группе вакцины и 127 в группе плацебо). Число случаев для каждой группы в исследовании FES составляло 31% и 25% от суммы случаев для соответствующих групп в двух исследованиях.
На основе объединенных данных REST и FES уменьшение числа случаев госпитализаций и обращений за неотложной помощью по поводу ротавирусного гастроэнтерита в течение 3 лет после вакцинации составило 94,4% (95% ДИ: 91,6; 96,2) для генотипов G1-G4. 95,5% (95% ДИ: 92,8; 97,2) для генотипа GI, 81,9% (95% ДИ: 16,1; 98,0) для генотипа G2, 89,0% (95% ДИ: 53,3; 98,7) для генотипа G3, 83,4% (95% ДИ: 51,2; 95,8) для генотипа G4 и 94,2% (95% ДИ: 62,2; 99,9) для генотипа G9. В течение третьего года в группе вакцины (3112 детей) обращений за медицинской помощью по поводу ротавирусного гастроэнтерита зафиксировано не было, а в группе плацебо (3126 детей) был отмечен 1 (нетипируемый) случай.
В клинических исследованиях было подтверждено, что для достижения необходимого уровня и длительности защиты против ротавирусного гастроэнтерита следует проводить полный курс вакцинации с введением 3 доз (см. СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ). Однако ретроспективный анализ данных показал, что даже до завершения полного курса вакцинации число случаев ротавирусного гастроэнтерита с такой степенью тяжести, которая потребовала бы госпитализацию или обращение за неотложной помощью, уменьшалось (через примерно 14 дней после введения первой дозы).
Эффективность у недоношенных детей
В исследовании REST вакцину РотаТек® ввели примерно 1000 детям, родившимся при сроке беременности от 25 до 36 недель. Эффективность вакцины РотаТек® у данной подгруппы не отличалась от подгруппы детей, родившихся в срок.
Пострегистрационное наблюдательное исследование по безопасности
В крупном проспективном пострегистрационном наблюдательном исследовании, проводившемся в США, был проанализирован риск болезни Кавасаки у 85150 детей, получивших одну или более доз вакцины РотаТек® (17433 пациенто-лет наблюдения).
В течение 0-30 дней после введения вакцины не было статистически значимой разницы в частоте развития болезни Кавасаки по сравнению с частотой в общей популяции. Кроме того, не было статистически значимого повышения риска появления данного побочного эффекта при наблюдении в течение 30 дней после введения вакцины РотаТек® по сравнению с контрольной группой детей, получавших только вакцину АКДС (62617 детей, 12399 пациенто-лет наблюдений). Один подтвержденный случай был зарегистрирован у детей, получавших вакцину РотаТек®, в сравнении с одним случаем у детей, получавших АКДС (относительный риск 0,7; 95% ДИ: 0,01; 55,56). Таким образом, никакого дополнительного риска, связанного с безопасностью, относительно общего профиля безопасности зафиксировано не было.
Данные исследовании по эффективности
Пострегистрационные исследования, подтверждающие эффективность предотвращения ротавирусного гастроэнтерита.
|
Дизайн исследования (страна) |
Исследуемая популяция |
Конечные точки |
Эффективность в % [95% ДИ] |
Сезоны заболеваемости ротавирусом |
| База данных обращений (США) | 33140 вакцинированных 26167 невакцинированных Возраст ≥7 месяцев Получено 3 дозы |
Госпитализации и обращения за неотложной помощью по поводу ротавирусного гастроэнтерита |
100% [87; 100] |
2007-2008 |
| Амбулаторные обращения по поводу ротавирусного гастроэнтерита |
96% [76; 100] |
|||
|
Госпитализации и обращения за неотложной помощью по поводу всех видов гастроэнтерита |
59% [47;68] |
|||
| Когортное исследование (Франция) | 1895 вакцинированных 3 дозами 2102 невакцинированных Возраст <2 лет |
Госпитализации поводу ротавирусного гастроэнтерита |
98% [83; 100] |
2007-2008 2008-2009 |
|
Исследование случай-контроль (США) |
402 случаев 2559 контролей* Возраст <8 лет Получено 3 дозы |
Госпитализации и обращения за неотложной помощью по поводу ротавирусного гастроэнтерита |
80% [74:84] |
2011-2012 2012-2013 |
|
Специфично по штаммам |
||||
|
— G1Р[8] |
89% [55;97] |
|||
|
— G2P[4] |
87% [65;95] |
|||
|
— G3P[8] |
80% [64:89] |
|||
|
— G12P[8] |
78% [71:84] |
|||
|
Специфично по возрасту |
||||
|
— 1-й год жизни |
91% [78:96] |
|||
|
— 2-й г од жизни |
82% [69:89] |
|||
|
— 3-й год жизни |
88% [78:93] |
|||
|
— 4-й год жизни |
76% [51:88] |
|||
|
— 5-й год жизни |
60% [16:81] |
|||
|
— 6-й -7-й годы жизни |
69% [43:84] |
*Контроли — ротавирус-отрицательные случаи острого гасторэнтерита.
Иммуногенность
Механизм иммунной защиты организма вакциной РотаТек® от ротавирусного гастроэнтерита до конца не изучен. Взаимосвязь между содержанием антител к ротавирусам после вакцинации ротавирусными вакцинами и степенью защиты против ротавирусного гастроэнтерита не установлена. 11о данным клинических исследований фазы 3 после проведения полного курса вакцинации, состоящего из трех доз препарата РотаТек®, у 92,5-100% вакцинированных в сыворотке наблюдалось значительное повышение уровня анти-ротавирусного IgA. Вакцина вызывает иммунный ответ, т.е. образование сывороточных нейтрализующих антител к пяти белкам ротавирусов человека, экспрессированных на реассортангах вакцины (G1, G2, G3, G4 и Р1А[8]).
Показания:
Активная иммунизация детей в возрасте от 6 до 32 недель с целью профилактики гастроэнтерита, вызываемого ротавирусами серотипов G1, G2, G3, G4 и серотипов G, содержащих Р1 A[8J (например, G9).
Противопоказания:
— Повышенная чувствительность к любому компоненту вакцины РотаТек®, а также на введение вакцины РотаТек® в анамнезе.
— Инвагинация кишечника в анамнезе.
— Врожденные пороки развития желудочно-кишечного тракта, предрасполагающие к инвагинации кишечника.
— Иммунодефицит, подозрение на иммунодефицит (см. ОСОБЫЕ УКАЗАНИЯ и ПОБОЧНОЕ ДЕЙСТВИЕ).
— Острые инфекционные и неинфекционные заболевания, обострение хронических заболеваний являются временными противопоказаниями для проведения прививок. Плановые прививки проводят через 2-4 недели после выздоровления или в период реконвалесценции или ремиссии. При нетяжелых острых вирусных респираторных инфекциях, острых кишечных заболеваниях и других заболеваниях прививки проводятся сразу после нормализации температуры.
— Острая форма диареи или рвоты (в этих случаях вакцинацию проводят на стадии ремиссии).
— Непереносимость фруктозы, нарушение всасывания глюкозо-галактозного комплекса, недостаточность ферментов сахаразы и/или изомальтазы.
С осторожностью:
— При активных заболеваниях желудочно-кишечного тракта, включая хроническую диарею (отсутствие клинических данных).
— При задержке развития (отсутствие клинических данных).
— При иммунокомпрометированном состоянии (например, в результате злокачественных новообразований или иммунодепрессивной терапии).
— При близком контакте с лицами с иммунодефицитом (например, с лицами со злокачественными новообразованиями или с лицами. получающими иммуносупрессивную терапию).
— При трансфузии крови или продуктов крови, включая иммуноглобулины, менее чем за 42 дня до намеченной вакцинации.
Особые группы пациентов
Дети
Вакцина РотаТек® обычно хорошо переносится и обладает высокой эффективностью по предотвращению ротавирусного гастроэнтерита при применении у детей в возрасте от 6 до 32 недель.
Эффективность и безопасность не были установлены у детей в возрасте младше 6 недель.
Беременность и лактация:
Вакцина РотаТек® предназначена только для детей. Данных по применению вакцины при беременности и/или в период грудного вскармливания нет.
Способ применения и дозы:
Способ введения
ТОЛЬКО ДЛЯ ПРИЕМА ВНУТРЬ. НЕ ДЛЯ ИНЪЕКЦИЙ!
Вакцина РотаТек® представляет собой готовую к применению жидкость.
Вакцина РотаТек® может вводиться вне зависимости от времени приема пищи или любой жидкости, включая грудное молоко.
Вакцину РотаТек® нельзя смешивать с другими растворами и вакцинами в одной емкости. Вакцину РотаТек® нельзя растворять или разводить. Не использовать, если обнаружены внешние повреждения тубы и/или содержимое тубы выглядит иначе, чем указано в разделе «ОПИСАНИЕ» данной инструкции.
Схема вакцинации
Курс вакцинации состоит из трех доз препарата РотаТек®.
Первая доза препарата РотаТек® вводится детям в возрасте от 6 до 12 недель. Последующие дозы вводятся с интервалом между введениями от 4 до 10 недель.
Все три дозы рекомендуется ввести до достижения ребенком возраста 32 недель.
При введении неполной дозы (например, ребенок выплюнул или срыгнул часть дозы) не рекомендуется вводить дополнительную дозу, так как данный режим дозирования не изучался в клинических исследованиях. Оставшиеся дозы следует вводить согласно схеме вакцинации.
Недоношенные дети
Вакцину РотаТек® можно применять у недоношенных детей, родившихся при сроке беременности не менее 25 недель. Вакцину следует вводить таким детям не ранее чем через 6 недель после рождения.
Рекомендации по подготовке и проведению вакцинации препаратом РотаТек®:
Побочные эффекты:
Вакцина обычно хорошо переносится.
У детей, участвовавших в трех плацебо-контролируемых клинических исследованиях (6130 детей в группе вакцины РотаТек®, 5560 детей в группе плацебо), были оценены побочные эффекты препарата РотаТек® в течение 42 дней после вакцинации с или без совместного использования других вакцин для детей. В целом нежелательные реакции были отмечены у 47% детей, получавших вакцину РотаТек®, но сравнению с 45.8% в группе плацебо. Наиболее частыми нежелательными явлениями были гипертермия (повышение температуры выше 38°С) (20,9%), диарея (17,6%) и рвота (10,1%).
Серьезные нежелательные реакции были оценены у всех участников (36150 детей в группе вакцины РотаТек®, 35536 детей в группе плацебо) в 3 клинических исследованиях в течение 42 дней после приема каждой дозы. В целом частота серьезных нежелательных реакций составляла 0,1% в группе вакцины РотаТек® и 0,2% в группе плацебо. Нежелательные реакции в группе вакцины приведены ниже в соответствии с системой органов/классов. На основании объединенных данных 3 клинических исследований (6130 детей в группе вакцины РотаТек®, 5560 детей в группе плацебо) перечислены нежелательные реакции, частота которых в группе вакцины РотаТек® превосходила частоту в группе плацебо на 0,2-2,5%.
Нежелательные реакции, выделенные курсивом, наблюдались в пострегистрационном периоде.
Частота нежелательных реакций определялась следующим образом:
очень часто (≥1/10), часто (≥1/100, но <1/10), нечасто (≥1/1000, но <1/100), редко (≥1/10000, но <1/1000), очень редко (<1/10000), неизвестно (частоту данных нежелательных реакций невозможно установить из имеющихся данных).
Инфекционные и паразитарные заболевания
Часто: инфекции верхних дыхательных путей
Нечасто: назофарингит, средний отит
Нарушения со стороны иммунной системы
Неизвестно: анафилактическая реакция ŧ
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Редко: бронхоспазм
Нарушения со стороны желудочно-кишечного тракта
Очень часто: диарея, рвота
Нечасто: гематохезия ţ, боль в верхних отделах живота
Редко: инвагинация кишечника ţ, *
Нарушения со стороны кожи и подкожных тканей
Нечасто: сыпь
Редко: крапивница ţ
Неизвестно: ангиоэдема ŧ
Общие расстройства и нарушения в месте введения
Очень часто: гипертермия
Неизвестно: раздражительность ŧ
ţ Данные нежелательные реакции были установлены в ходе пострегистрационного наблюдения. Частота данных нежелательных реакций оценивалась на основании соответствующих клинических исследований.
* см. ОСОБЫЕ УКАЗАНИЯ.
ŧ Нежелательные реакции, которые наблюдались при пострегистрационном применении вакцины; их частоту невозможно установить из имеющихся данных.
Дополнительная информация по некоторым нежелательным реакциям
Болезнь Кавасаки наблюдалась у 5 из 36150 детей в группе вакцины (<0.,1 %) и 1 из 35536 в группе плацебо (0,1%) с относительным риском 4,9 [95%ДИ:0.6: 239,1] (статистически незначимо). Данные крупного пострегистрационного наблюдательного исследования безопасности не подтверждают повышения риска возникновения болезни Кавасаки после вакцинации препаратом РотаТек® (см. ИММУНОЛОГИЧЕСКИЕ СВОЙСТВА).
Инвагинация кишечника
Данные наблюдательных исследований безопасности, проведённых в нескольких странах, свидетельствуют о том, что применение вакцины для профилактики ротавирусной инфекции может увеличить риск возникновения инвагинации кишечника в течение 7 дней после вакцинации на 6 случаев на 100000 детей при сравнении с ожидаемым фоновым уровнем возникновения инвагинации. Существуют ограниченные данные, подтверждающие меньшее увеличение риска возникновения инвагинации кишечника после приема второй дозы. Фоновая частота случаев инвагинации кишечника у не вакцинированных ротавирусной вакциной детей младше 1 года в этих странах варьирует от 33 до 101 на 100000 детей в год. Неизвестно, связана ли регистрация более высокого числа случаев инвагинации кишечника с более длительным периодом наблюдения за детьми, которым вводили вакцину для профилактики ротавирусной инфекции (см. ОСОБЫЕ УКАЗАНИЯ).
Особые группы пациентов
Существует риск развития апноэ у недоношенных детей (рожденных на сроке беременности до 28 недель включительно) (см. ОСОБЫЕ УКАЗАНИЯ).
В ходе пострегистрационного наблюдения детей с тяжелым комбинированным иммунодефицитом были отмечены случаи гастроэнтерита, сопровождающегося выделением с калом штаммов ротавируса, входящих в состав вакцины.
Передозировка:
Имеются сообщения о нескольких случаях передозировки вакциной РотаТек®. Отличий в профиле нежелательных явлений по сравнению с применением препарата в рекомендованных дозах нет.
Взаимодействие:
Применение с другими вакцинами
Препарат РотаТек® можно вводить детям одновременно с любыми следующими антигенами, входящими в состав как моновалентных, так и комбинированных вакцин: дифтерийным анатоксином, столбнячным анатоксином, бесклеточной коклюшной вакциной, конъюгированной вакциной против Haemophilusinfluenzae тип b, инактивированной полиомиелитной вакциной, вакциной против вирусного гепатита В, гексавалентной вакциной (содержащей вышеперечисленные компоненты), конъюгированной пневмококковой вакциной, конъюгированной менингококковой вакциной серогруппы С. Не было отмечено снижения иммунного ответа при одновременном введении нескольких вакцин и вакцины РотаТек®.
Одновременное введение пероральной полиовакцины (ОПВ) и вакцины РотаТек® не влияло на иммунный ответ, вызываемый ОПВ, но несколько снижало иммунный ответ на вакцину РотаТек®, однако нет данных, подтверждающих снижение степени защиты от тяжелых форм ротавирусного гастроэнтерита. Иммунный ответ на вакцину РотаТек® не изменялся при введении ОПВ через две недели после введения вакцины РотаТек®.
Особые указания:
Во время проведения вакцинации должны быть доступны все необходимые лекарственные препараты, включая адреналин (1:1000), на случай возникновения анафилактической реакции (см. ПОБОЧНОЕ ДЕЙСТВИЕ).
Данные по эффективности и безопасности применения вакцины РотаТек® у детей с компрометированным иммунитетом, детей с бессимптомной ВИЧ-инфекцией или детей, которым было сделано переливание крови или введены иммуноглобулины не более чем за 42 дня до введения вакцины, отсутствуют. Маловероятно, что бессимптомная ВИЧ-инфекция (ВИЧ-носительство) будет влиять на безопасность и эффективность вакцины РотаТек®. Тем не менее в связи с недостаточностью клинических данных не рекомендуется назначение вакцины РотаТек® при бессимптомной ВИЧ-инфекции.
У детей с тяжелым комбинированным иммунодефицитом были отмечены случаи гастроэнтерита, вызванного штаммами ротавируса, входящими в вакцину (см. ПРОТИВОПОКАЗАНИЯ).
По данным клинических исследований вакцинный вирус обнаруживался в кале у 8,9% вакцинированных детей только в течение 1 недели после введения первой дозы вакцины и только у 0,3% детей (1 случай) после введения 3-ей дозы. Пик выделения вакцинного вируса приходится на 7-й день после вакцинации. Согласно пострегистрационным данным возможна передача вакцинного вируса невакцинированным лицам. Вакцина РотаТек® должна с осторожностью назначаться детям, находящимся в тесном контакте с лицами с иммунодефицитом (в том числе, при контакте с лицами с онкологическими заболеваниями, иммунокомпрометированными или лицами, получающими иммуносупрессивную терапию). Следует соблюдать особые гигиенические правила при контакте с калом вакцинированного ребенка.
В клиническом исследовании вакцину РотаТек® применяли примерно у 1000 детей, рожденных при сроке гестации от 25 до 36 недель. Первую дозу вводили на 6-ой неделе после рождения. Безопасность и эффективность вакцины РотаТек® была сопоставима у данной подгруппы детей и у подгруппы детей, родившихся в срок. Однако среди этих 1000 детей, 19 детей родилось в срок от 25 до 28 недель гестации, 55 — от 29 до 31 недель, а остальные — от 32 до 36 недель (см. ИММУНОЛОГИЧЕСКИЕ СВОЙСТВА и СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ).
Инвагинация
Поскольку данные наблюдательных исследований свидетельствуют о повышенном риске возникновения инвагинации кишечника после применения вакцины для профилактики ротавирусной инфекции в течение 7 дней после вакцинации (см. ПОБОЧНОЕ ДЕЙСТВИЕ), в качестве меры предосторожности врачу необходимо отслеживать любые симптомы, указывающие на возникновение этого заболевания (острая боль в животе, неукротимая рвота, наличие крови в кале, вздутие живота и/или высокая температура). Родители/опекуны должны быть проинформированы о необходимости безотлагательно обращаться за медицинской помощью в случае возникновения таких симптомов.
В случае наличия предрасположенности к возникновению инвагинации кишечника см. раздел ПРОТИВОПОКАЗАНИЯ.
В настоящее время отсутствуют данные о безопасности и эффективности применения вакцины РотаТек® у новорожденных с желудочно-кишечными заболеваниями (включая хроническую диарею) и при задержке развития. Применение вакцины РотаТек® следует осуществлять с осторожностью у таких новорожденных, а также в том случае, когда, по мнению врача, отказ от вакцинации этой группы детей представляет больший риск, чем ее проведение.
Указанный уровень защиты после вакцинации препаратом РотаТек® обеспечивается при завершенном курсе вакцинации, состоящем из 3 доз. Как и любая другая вакцина, РотаТек® не может обеспечить полную защиту всех вакцинированных. Вакцина РотаТек® эффективна только против ротавирусной инфекции и не защищает от гастроэнтерита, вызванного другими патогенными микроорганизмами.
Клинические исследования эффективности защиты против ротавирусного гастроэнтерита проводились в Европе. США, странах Латинской Америки и Азии. Во время проведения данных клинических исследований наиболее распространенным генотипом ротавируса был G1P[8J. в то время как остальные генотипы G2Р[4], G3P[8], G4P[8] и G9P[8] обнаруживались реже. Уровень защиты, который обеспечивает вакцина РотаТек® против ротавирусов других типов и в других популяциях, неизвестен.
Данные клинических исследований по применению вакцины РотаТек® для профилактики после контакта с пациентом с ротавирусным гастроэнтеритом отсутствуют.
При решении о вакцинации ребенка с тяжелой степенью недоношенности (беременность ≤ 28 недель, но не менее 25 недель), особенно имеющего в анамнезе незрелость органов дыхания, необходимо учитывать тот факт, что польза иммунизации против ротавирусной инфекции у данной группы пациентов высока. Вследствие этого не следует ни отказываться от вакцинации, ни переносить ее сроки. Однако учитывая потенциальный риск апноэ, первую вакцинацию недоношенного младенца предпочтительно проводить в условиях стационара с возможностью врачебного наблюдения за состоянием такого пациента в течение 48-72 ч.
ВАКЦИНУ РотаТек® ЗАПРЕЩЕНО ВВОДИТЬ ИНЪЕКЦИОННО!
Вакцину РотаТек® следует вводить как можно быстрее после извлечения из холодильника.
В случае если вакцину не использовали, она подлежит утилизации в контейнерах для биоотходов в соответствии с утвержденными правилами.
Влияние на способность управлять транспортными средствами и механизмами:
Неприменимо.
Форма выпуска/дозировка:
Раствор для приема внутрь.
Упаковка:
В тубе содержится одна прививочная доза.
По 2 мл в тубы объемом 4 мл из полиэтилена низкой плотности с отвинчивающейся крышкой из полиэтилена высокой плотности.
На корпусе тубы на английском языке нанесено: с одной стороны — «Rotavirus», «Vaccine» и логотип фирмы в виде графического символа, с другой — «Rotavirus», «Vaccine» и логотип фирмы в виде аббревиатуры «MSD».
Туба помещена в индивидуальную упаковку из фольги алюминиевой.
Упаковка для отпуска из аптек
По 1 тубе в упаковке из фольги алюминиевой вместе с инструкцией по применению в картонной пачке.
Упаковка для лечебно-профилактических учреждений
По 10 туб, каждая в индивидуальной упаковке из фольги алюминиевой, вместе с инструкцией по применению в картонной пачке.
УСЛОВИЯ ОТПУСКА
Упаковка с 1 тубой — «Отпускают по рецепту».
Упаковка с 10 тубами — «Для лечебно-профилактических учреждений».
Условия хранения:
Хранить при температуре от 2 до 8°С в защищенном от света месте.
Хранить в недоступном для детей месте.
Срок годности:
2 года.
Не использовать после истечения срока годности, указанного на упаковке.
Условия отпуска
По рецепту
Производитель
Мерк Шарп и Доум Б.В., Waarderweg 39, 2031 BN, Haarlem, the Netherlands, Нидерланды
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
Мерк Шарп и Доум Корп.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Владелец регистрационного удостоверения:
Производитель: Мерк Шарп и Доум Корп. США
Торговое наименование лекарственного препарата: РотаТек®
Международное непатентованное или группировочное или химическое наименование: Вакцина для профилактики ротавирусной инфекции, пентавалентная, живая
Лекарственная форма
РотаТек® — раствор для приема внутрь
Описание лекарственной формы. Прозрачная жидкость бледно-желтого цвета; допустимо наличие розового оттенка.
Форма выпуска, состав, упаковка, характеристика
Раствор для приема внутрь.
В тубе содержится одна прививочная лоза.
По 2 мл в тубы объемом 4 мл из полиэтилена низкой плотности с отвинчивающейся крышкой из полиэтилена высокой плотности.
На корпусе тубы на английском языке нанесено: с одной стороны – «Rotavirus», «Vaccine» и логотип фирмы в виде графического символа, с другой – «Rotavirus», «Vaccine» и логотип фирмы в виде аббревиатуры «MSD».
Туба помещена в индивидуальную упаковку из фольги алюминиевой.
Упаковка для отпуска из аптек
По 1 тубе в упаковке из фольги алюминиевой вместе с инструкцией по применению в картонной пачке.
Упаковка для лечебно-профилактических учреждений
По 10 туб, каждая в индивидуальной упаковке из фольги алюминиевой, вместе с инструкцией по применению в картонной пачке.
Состав
Одна доза (2 мл) содержит:
Действующие вещества
Живые реассортанты человеческого и бычьего ротавирусов, выращенные на культуре клеток Веро:
Ротавирус типа G1 – не менее 2,2×106 ИЕ*
Ротавирус типа G2 – не менее 2,8×106 ИЕ*
Ротавирус типа G3 – не менее 2,2×106 ИЕ*
Ротавирус типа G4 – не менее 2,0×106 ИЕ*
Ротавирус типа Р1А[8] – не менее 2,3×106 ИЕ*
*ИЕ – инфекционная единица
Вспомогательные вещества
Сахароза 1080 мг, натрия гидроксид 2,75 мг, натрия цитрата дигидрат 127 мг, натрия дигидрофосфата моногидрат 29,8 мг, полисорбат-80 от 0,17 до 0,86 мг, ротавирусный растворитель. Суммарный объем пяти растворов вирусных белков и ротавирусного растворителя составляет 15% от общего объема вакцины.
Упаковки
- раствор для приема внутрь туба 2 мл — фольга алюминиевая — пачка картонная; код EAN 4602210002636;
- раствор для приема внутрь №10 — туба 2 мл — фольга алюминиевая (10) — пачка картонная.
Характеристика
РотаТек® – это живая пероральная пентавалентная вакцина, содержащая пять живых реассортантных штаммов ротавируса. Ротавирусные родительские штаммы реассортантов были изолированы из организмов человека и быка. Четыре вакцинных реассортанта ротавируса экспрессируют один из наружных капсидных белков VP7 (серотипы G1, G2, G3 или G4) человеческого родительского штамма ротавируса и белок VP4 (серотип Р7[5]) бычьего родительского штамма ротавируса (белок VP4 отвечает за прикрепление ротавируса к поверхности клеток). На поверхности пятого реассортанта вируса экспрессирован белок VP4 (серотип Р1А[8]) человеческого родительского штамма ротавируса и наружный капсидный белок VP7 (серотип G6) бычьего родительского штамма ротавируса.
Каждый из реассортантов выращен по отдельности на культуре клеток Веро стандартными культуральными методами без использования противогрибковых препаратов. Затем реассортанты все вместе помещены в буферный стабилизирующий раствор.
Так как в производстве реассортантов, входящих в состав вакцины РотаТек®, пользуется биологический материал животного происхождения, в вакцине обнаружены малые фрагменты ДНК ЦВС-1 и ЦВС-2 (цирковирус свиней 1 и 2 типов), при этом сами вирусные частицы ЦВС-1 и/или ЦВС-2 в вакцине отсутствуют. В настоящее время неизвестны случаи заболевания человека, вызванные ЦВС-1 и/или ЦВС-2.
Вакцина РотаТек® не содержит тиомерсала и других консервантов.
Фармакологическая группа
Показания
Активная иммунизация детей в возрасте от 6 до 32 недель с целью профилактики гастроэнтерита, вызываемого ротавирусами серотипов G1, G2, G3, G4 и серотипов G, содержащих Р1А[8] (например, G9).
Способ применения и дозы
Способ введения
ТОЛЬКО ДЛЯ ПРИЕМА ВНУТРЬ. НЕ ДЛЯ ИНЪЕКЦИЙ!
Вакцина РотаТек® представляет собой готовую к применению жидкость.
Вакцина РотаТек® может вводиться вне зависимости от времени приема пищи или любой жидкости, включая грудное молоко.
Вакцину РотаТек® нельзя смешивать с другими растворами и вакцинами в одной емкости. Вакцину РотаТек® нельзя растворять или разводить. Не использовать, если обнаружены внешние повреждения тубы и/или содержимое тубы выглядит иначе, чем указано в разделе «Описание» данной инструкции.
Схема вакцинации
Курс вакцинации состоит из трех доз препарата РотаТек®.
Первая доза препарата РотаТек® вводится детям в возрасте от 6 до 12 недель.
Последующие дозы вводятся с интервалом между введениями от 4 до 10 недель.
Все три дозы рекомендуется ввести до достижения ребенком возраста 32 недель.
При введении неполной дозы (например, ребенок выплюнул или срыгнул часть дозы) не рекомендуется вводить дополнительную дозу, так как данный режим дозирования не изучался в клинических исследованиях. Оставшиеся дозы следует вводить согласно схеме вакцинации.
Недоношенные дети
Вакцину РотаТек® можно применять у недоношенных детей, родившихся при сроке беременности не менее 25 недель. Вакцину следует вводить таким детям не ранее чем через 6 недель после рождения.
Рекомендации по подготовке и проведению вакцинации препаратом РотаТек®:
|
Выньте одну упаковку из холодильника, разорвите ее и достаньте пластиковую тубу. |
|
Держа тубу вертикально, колпачком кверху, постучите по колпачку, чтобы удалить жидкость из дозирующего наконечника. |
|
Откройте тубу двумя простыми движениями: |
|
2. Поверните колпачок против часовой стрелки и снимите его. |
|
Введите дозу, осторожно выжимая жидкость в рот ребенка в направлении внутренней стороны щеки, пока туба не опустеет (в наконечнике тубы может остаться капля жидкости). |
|
Пустые тубы и наконечник подлежат утилизации в контейнерах для биоотходов в соответствии с утвержденными правилами. |
Побочное действие
Вакцина обычно хорошо переносится.
У детей, участвовавших в трех плацебо-контролируемых клинических исследованиях (6130 детей в группе вакцины РотаТек®, 5560 детей в группе плацебо), были оценены побочные эффекты препарата РотаТек® в течение 42 дней после вакцинации с или без совместного использования других вакцин для детей. В целом нежелательные реакции были отмечены у 47% детей, получавших вакцину РотаТек®, по сравнению с 45,8% в группе плацебо. Наиболее частыми нежелательными явлениями были гипертермия (повышение температуры выше 38°С) (20,9%), диарея (17,6%) и рвота (10,1%).
Серьезные нежелательные реакции были оценены у всех участников (36150 детей в группе вакцины РотаТек®, 35536 детей в группе плацебо) в 3 клинических исследованиях в течение 42 дней после приема каждой дозы. В целом частота серьезных нежелательных реакции составляла 0,1% в группе вакцины РотаТек® и 0,2% в группе плацебо.
Нежелательные реакции в группе вакцины приведены ниже в соответствии с системой органов/классов. На основании объединенных данных 3 клинических исследований (6130 детей в группе вакцины РотаТек®, 5560 детей в группе плацебо) перечислены нежелательные реакции, частота которых в группе вакцины РотаТек® превосходила частоту в группе плацебо на 0,2-2,5%.
Нежелательные реакции, выделенные курсивом, наблюдались в пострегистрационном периоде.
Частота нежелательных реакций определялась следующим образом: очень часто (≥1/10), часто (≥1/100, по <1/10), нечасто (≥1/1000, но <1/100), редко (≥1/10000, но <1/1000), очень редко (<1/10000), неизвестно (частоту данных нежелательных реакций невозможно установить из имеющихся данных).
- Инфекционные и паразитарные заболевания
Часто: инфекции верхних дыхательных путей
Нечасто: назофарингит, средний отит - Нарушения со стороны иммунной системы
Неизвестно: анафилактическая реакция‡ - Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Редко: бронхоспазм - Нарушения со стороны желудочно-кишечного тракта
Очень часто: диарея, рвота
Нечасто: гематохезия†, боль в верхних отделах живота
Редко: инвагинация кишечника†* - Нарушения со стороны кожи и подкожных тканей
Нечасто: сыпь
Редко: крапивница†
Неизвестно: ангиоэдема‡ - Общие расстройства и нарушения в месте введения
Очень часто: гипертермия
Неизвестно: раздражительность‡
† Данные нежелательные реакции были установлены в ходе пострегистрационного наблюдения.
а Частота данных нежелательных реакций оценивалась на основании соответствующих клинических исследований.
* см. «Особые указания».
‡ Нежелательные реакции, которые наблюдались при пострегистрационном применении вакцины; их частоту невозможно установить из имеющихся данных.
Дополнительная информация по некоторым нежелательным реакциям
Болезнь Кавасаки наблюдалась у 5 из 36150 детей в группе вакцины (<0,1%) и 1 из 35536 в группе плацебо (<0,1%) с относительным риском 4,9 [95% ДИ: 0,6; 239,1] (статистически незначимо). Данные крупного пострегистрационного наблюдательного исследования безопасности не подтверждают повышения риска возникновения болезни Кавасаки после вакцинации препаратом РотаТек® (см. «Иммунологические свойства»).
Инвагинация кишечника
Данные наблюдательных исследований безопасности, проведенных в нескольких странах, свидетельствуют о том, что применение вакцины для профилактики ротавирусной инфекции может увеличить риск возникновения инвагинации кишечника в течение 7 дней после вакцинации на 6 случаев на 100000 детей при сравнении с ожидаемым фоновым уровнем возникновения инвагинации. Существуют ограниченные данные, подтверждающие меньшее увеличение риска возникновения инвагинации кишечника после приема второй дозы. Фоновая частота случаев инвагинации кишечника у не вакцинированных ротавирусной вакциной детей младше 1 года в этих странах варьирует от 33 до 101 на 100000 детей в год. Неизвестно, связана ли регистрация более высокого числа случаев инвагинации кишечника с более длительным периодом наблюдения за детьми, которым вводили вакцину для профилактики ротавирусной инфекции (см. «Особые указания»).
Особые группы пациентов
Существует риск развития апноэ у недоношенных детей (рожденных на сроке беременности до 28 недель включительно) (см. «Особые указания»).
В ходе пострегистрационного наблюдения детей с тяжелым комбинированным иммунодефицитом были отмечены случаи гастроэнтерита, сопровождающегося выделением с калом штаммов ротавируса, входящих в состав вакцины.
Передозировка
Имеются сообщения о нескольких случаях передозировки вакциной РотаТек®. Отличий в профиле нежелательных явлении по сравнению с применением препарата в рекомендованных дозах нет.
Противопоказания к применению
Повышенная чувствительность к любому компоненту вакцины РотаТек®, а также на введение вакцины РотаТек® в анамнезе.
- Инвагинация кишечника в анамнезе.
- Врожденные пороки развития желудочно-кишечного тракта, предрасполагающие к инвагинации кишечника.
- Иммунодефицит, подозрение па иммунодефицит (см. «Особые указания и побочное действие»).
- Острые инфекционные и неинфекционные заболевания, обострение хронических заболеваний являются временными противопоказаниями для проведения прививок. Плановые прививки проводят через 2-4 недели после выздоровления или в период реконвалесценции или ремиссии. При нетяжелых острых вирусных респираторных инфекциях, острых кишечных заболеваниях и других заболеваниях прививки проводятся сразу после нормализации температуры.
- Острая форма диареи или рвоты (в этих случаях вакцинацию проводят на стадии ремиссии).
- Непереносимость фруктозы, нарушение всасывания глюкозо-галактозного комплекса, недостаточность ферментов сахаразы и/или изомальтазы.
С осторожностью
- При активных заболеваниях желудочно-кишечного тракта, включая хроническую диарею (отсутствие клинических данных).
- При задержке развития (отсутствие клинических данных).
- При иммунокомпрометированном состоянии (например, в результате злокачественных новообразований или иммунодепрессивной терапии).
- При близком контакте с лицами с иммунодефицитом (например, с лицами со злокачественными новообразованиями или с лицами, получающими иммуносупрессивную терапию).
· При трансфузии крови или продуктов крови, включая иммуноглобулины, менее чем за 42 дня до намеченной вакцинации.
Применение при беременности и кормлении грудью
Вакцина РотаТек® предназначена только для детей. Данных по применению вакцины при беременности и/или в период грудного вскармливания нет.
Особые группы пациентов
Дети
Вакцина РотаТек® обычно хорошо переносится и обладает высокой эффективностью по предотвращению ротавирусного гастроэнтерита при применении у детей в возрасте от 6 до 32 недель.
Эффективность и безопасность не были установлены у детей в возрасте младше 6 недель.
Лекарственное взаимодействие
Применение с другими вакцинами
Препарат РотаТек® можно вводить детям одновременно с любыми следующими антигенами, входящими в состав как моновалентных, так и комбинированных вакцин: дифтерийным анатоксином, столбнячным анатоксином, бесклеточной коклюшной вакциной, конъюгированной вакциной против Haemophilus influenzae тип b, инактивированной полиомиелитной вакциной, вакциной против вирусного гепатита В, гексавалентной вакциной (содержащей вышеперечисленные компоненты), конъюгированной пневмококковой вакциной, конъюгированной менингококковой вакциной серогруппы С. Не было отмечено снижения иммунного ответа при одновременном введении нескольких вакцин и вакцины РотаТек®.
Одновременное введение пероральной полиовакцины (ОПВ) и вакцины РотаТек® не влияло на иммунный ответ, вызываемый ОПВ, но несколько снижало иммунный ответ на вакцину РотаТек®, однако нет данных, подтверждающих снижение степени защиты от тяжелых форм ротавирусного гастроэнтерита. Иммунный ответ на вакцину РотаТек®не изменялся при введении ОПВ через две недели после введения вакцины РотаТек®.
Особые указания
Во время проведения вакцинации должны быть доступны все необходимые лекарственные препараты, включая адреналин (1:1000), на случай возникновения анафилактической реакции (см. «Побочное действие»).
Данные по эффективности и безопасности применения вакцины РотаТек® у детей с компрометированным иммунитетом, детей с бессимптомной ВИЧ-инфекцией или детей, которым было сделано переливание крови или введены иммуноглобулины не более чем за 42 дня до введения вакцины, отсутствуют. Маловероятно, что бессимптомная ВИЧ-инфекция (ВИЧ-носительство) будет влиять на безопасность и эффективность вакцины РотаТек®. Тем не менее в связи с недостаточностью клинических данных не рекомендуется назначение вакцины РотаТек® при бессимптомной ВИЧ-инфекции.
У детей с тяжелым комбинированным иммунодефицитом были отмечены случаи гастроэнтерита, вызванного штаммами ротавируса, входящими в вакцину (см. «Противопоказания»).
По данным клинических исследований вакцинный вирус обнаруживался в кале у 8,9% вакцинированных детей только в течение 1 недели после введения первой дозы вакцины и только у 0,3% детей (1 случай) после введения 3-ей дозы. Пик выделения вакцинного вируса приходится на 7-й день после вакцинации. Согласно пострегистрационным данным возможна передача вакцинного вируса невакцинированным лицам. Вакцина РотаТек® должна с осторожностью назначаться детям, находящимся в тесном контакте с лицами с иммунодефицитом (в том числе, при контакте с лицами с онкологическими заболеваниями, иммунокомпрометированными или лицами, получающими иммуносупрессивную терапию). Следует соблюдать особые гигиенические правила при контакте с калом вакцинированного ребенка.
В клиническом исследовании вакцину РотаТек® применяли примерно у 1000 детей, рожденных при сроке гестации от 25 до 36 недель. Первую дозу вводили на 6-ой неделе после рождения. Безопасность и эффективность вакцины РотаТек® была сопоставима у данной подгруппы детей и у подгруппы детей, родившихся в срок. Однако среди этих 1000 детей, 19 детей родилось в срок от 25 до 28 недель гестации, 55 – от 29 до 31 недель, а остальные – от 32 до 36 недель (см. «Иммунологические свойства» и «Способ применения и дозы»).
Инвагинация
Поскольку данные наблюдательных исследований свидетельствуют о повышенном риске возникновения инвагинации кишечника после применения вакцины для профилактики ротавирусной инфекции в течение 7 дней после вакцинации (см. «Побочное действие»), в качестве меры предосторожности врачу необходимо отслеживать любые симптомы, указывающие на возникновение этого заболевания (острая боль в животе, неукротимая рвота, наличие крови в кале, вздутие живота и/или высокая температура).
Родители/опекуны должны быть проинформированы о необходимости безотлагательно обращаться за медицинской помощью в случае возникновения таких симптомов.
В случае наличия предрасположенности к возникновению инвагинации кишечника см. раздел «Противопоказания».
В настоящее время отсутствуют данные о безопасности и эффективности применения вакцины РотаТек® у новорожденных с желудочно-кишечными заболеваниями (включая хроническую диарею) и при задержке развития. Применение вакцины РотаТек®следует осуществлять с осторожностью у таких новорожденных, а также том случае, когда, по мнению врача, отказ от вакцинации этой группы детей представляет больший риск, чем ее проведение.
Указанный уровень защиты после вакцинации препаратом РотаТек® обеспечивается при завершенном курсе вакцинации, состоящем из 3 доз. Как и любая другая вакцина, РотаТек® не может обеспечить полную защиту всех вакцинированных. Вакцина РотаТек® эффективна только против ротавирусной инфекции и не защищает от гастроэнтерита, вызванного другими патогенными микроорганизмами.
Клинические исследования эффективности защиты против ротавирусного гастроэнтерита проводились в Европе, США, странах Латинской Америки и Азии. Во время проведения данных клинических исследований наиболее распространенным генотипом ротавируса был G1P[8], в то время как остальные генотипы G2P[4], G3P[8], G4P[8] и G9P[8] обнаруживались реже. Уровень защиты, который обеспечивает вакцина РотаТек® против ротавирусов других типов и в других популяциях, неизвестен.
Данные клинических исследований по применению вакцины РотаТек® для профилактики после контакта с пациентом с ротавирусным гастроэнтеритом отсутствуют.
При решении о вакцинации ребенка с тяжелой степенью недоношенности (беременность ≤ 28 недель, но не менее 25 недель), особенно имеющего в анамнезе незрелость органов дыхания, необходимо учитывать тот факт, что польза иммунизации против ротавирусной инфекции у данной группы пациентов высока. Вследствие этого не следует ни отказываться от вакцинации, ни переносить ее сроки. Однако учитывая потенциальный риск апноэ, первую вакцинацию недоношенного младенца предпочтительно проводить в условиях стационара с возможностью врачебного наблюдения за состоянием такого пациента в течение 48-72 ч.
ВАКЦИНУ РотаТек® ЗАПРЕЩЕНО ВВОДИТЬ ИНЪЕКЦИОННО!
Вакцину РотаТек® следует вводить как можно быстрее после извлечения из холодильника.
В случае если вакцину не использовали до окончания срока годности, она подлежит утилизации в контейнерах для биоотходов в соответствии с утвержденными правилами.
Влияние на способность управлять транспортными средствами и работать с механизмами
Не применимо.
Условия и сроки хранения
Хранить при температуре от 2 до 8°С в защищенном от света месте.
Хранить в недоступном для детей месте.
Не замораживать!
Срок годности 2 года.
Не использовать после истечения срока годности, указанного на упаковке.
Условия отпуска из аптек
Упаковка с 1 тубой – «Отпускают по рецепту».
Упаковка с 10 тубами – «Для лечебно-профилактических учреждений».
Ротатек® (Rotateq)
💊 Состав препарата Ротатек®
✅ Применение препарата Ротатек®
Описание активных компонентов препарата
Ротатек®
(Rotateq)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2022.06.01
Владелец регистрационного удостоверения:
Код ATX:
J07BH02
(Ротавирус пятивалентный живой пересортированный)
Лекарственная форма
| Ротатек® |
Р-р д/приема внутрь 1 доза: тубы 2 мл 1 или 10 шт. рег. №: ЛП-001865 |
Форма выпуска, упаковка и состав
препарата Ротатек®
Раствор для приема внутрь в виде прозрачной жидкости бледно-желтого цвета, допустимо наличие розового оттенка.
* ИЕ — инфекционная единица
Вспомогательные вещества: сахароза — 1080 мг, натрия гидроксид — 2.75 мг, натрия цитрата дигидрат — 127 мг, натрия дигидрофосфата дигидрат — 29.8 мг, полисорбат 80 — от 0.17 до 0.86 мг, культуральная среда — 15% (в объемном отношении).
2 мл — тубы из полиэтилена низкой плотности объемом 4 мл (1) — пачки картонные
2 мл — тубы из полиэтилена низкой плотности объемом 4 мл (10) — пачки картонные.
2 мл — тубы из полиэтилена низкой плотности объемом 4 мл (1) — упаковки индивидуальные из фольги алюминиевой (1) — пачки картонные.
2 мл — тубы из полиэтилена низкой плотности объемом 4 мл (1) — упаковки индивидуальные из фольги алюминиевой (10) — пачки картонные.
Фармакологическое действие
Живая пероральная пентавалентная вакцина, содержащая пять живых реассортантных штаммов ротавируса (бычьих и человеческих). На поверхности четырех вакцинных реассортантов ротавируса экспрессированы один из наружных капсидных белков VP7 (серотипы G1, G2, G3, или G4) человеческого родительского штамма ротавируса и белок VP4 (серотип Р7[5]) бычьего родительского штамма ротавируса (белок VP4 отвечает за прикрепление ротавируса к поверхности клеток). На поверхности пятого реассортанта вируса экспрессирован белок VP4 (серотип Р1А[8]) человеческого родительского штамма ротавируса и наружный капсидный белок VP7 (серотип G6) бычьего родительского штамма ротавируса.
Механизм иммунной защиты организма вакциной от гастроэнтерита, вызванного ротавирусами, до конца не изучен. Взаимосвязь между содержанием антител к ротавирусам после вакцинации ротавирусными вакцинами и степенью защиты против ротавирусного гастроэнтерита не установлена. Вакцина вызывает иммунный ответ, т.е. образование сывороточных нейтрализующих антител, к пяти капсидным белкам ротавирусов человека, содержащихся в реассортантах вакцины (G1, G 2, G,3, G 4 и Р1А[8]).
Показания активных веществ препарата
Ротатек®
Активная иммунизация детей в возрасте от 6 до 32 недель с целью профилактики гастроэнтерита, вызываемого ротавирусами серотипов G1 , G2, G3, G4 и серотипов G, содержащих Р1А[8] (например, G9).
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Внутрь.
Побочное действие
Инфекционные и паразитарные заболевания: инфекции верхних дыхательных путей; назофарингит, средний отит.
Со стороны пищеварительной системы: диарея, рвота; боль в верхних отделах живота, гематохезия; инвагинация кишечника.
Со стороны кожи и подкожных тканей: сыпь; крапивница.
Со стороны дыхательной системы: бронхоспазм.
Общие расстройства: гипертермия.
Противопоказания к применению
Инвагинация кишечника в анамнезе; врожденные пороки развития желудочно-кишечного тракта, предрасполагающие к инвагинации кишечника; иммунодефицит, подозрение на иммунодефицит или ВИЧ-носительство; острые воспалительные процессы, сопровождающиеся высокой температурой (в этих случаях вакцинацию проводят после выздоровления или в стадии ремиссии). Инфекционное заболевание легкой степени тяжести не должно служить причиной отказа от вакцинации; острая форма диареи или рвоты (в этих случаях вакцинацию проводят на стадии ремиссии); повышенная чувствительность к любому компоненту вакцины, введение вакцины в анамнезе.
С осторожностью
При активных заболеваниях ЖКТ, включая хроническую диарею (отсутствие клинических данных); при задержке развития (отсутствие клинических данных); при иммунокомпрометированном состоянии (например, в результате злокачественных новообразований или иммунодепрессивной терапии); при трансфузии крови или продуктов крови, включая иммуноглобулины, менее чем за 42 дня до намеченной вакцинации.
Применение у детей
Хорошо переносится и обладает высокой эффективностью по предотвращению ротавирусного гастроэнтерита при применении у детей в возрасте от 6 до 32 недель.
Эффективность и безопасность не были установлены у детей в возрасте младше 6 недель.
Особые указания
По данным клинических исследований вакцинный вирус обнаруживался в кале у 8.9% вакцинированных детей только в течение 1 недели после введения первой дозы вакцины и только у 0.3% детей (1 случай) после введения 3-й дозы. Согласно пострегистрационным данным возможна передача вакцинного вируса невакцинированным лицам. Вакцина должна с осторожностью назначаться детям, находящимся в тесном контакте с людьми с иммунодефицитом (в т.ч. с онкологическими заболеваниями, иммунокомпрометированными или людьми, получающими иммуносупрессивную терапию). Следует соблюдать особые гигиенические правила при контакте с калом вакцинированного ребенка.
В связи с недостаточностью клинических данных не рекомендуется назначение вакцины при бессимптомной ВИЧ-инфекции.
У детей с тяжелым комбинированным иммунодефицитом были отмечены случаи гастроэнтерита, вызванного штаммами ротавируса, входящими в вакцину.
Как и любая другая вакцина, не может обеспечить полную защиту всех вакцинированных. Эффективна только против ротавирусной инфекции и не защищает от гастроэнтерита, вызванного другими патогенными микроорганизмами.
При решении о вакцинации ребенка с тяжелой степенью недоношенности (беременность ≤28 недель, но не менее 25 недель), особенно имеющего в анамнезе незрелость органов дыхания, необходимо учитывать тот факт, что польза иммунизации против ротавирусной инфекции у данной группы пациентов высока, и не следует ни отказываться от вакцинации, ни переносить ее сроки. Однако учитывая потенциальный риск апноэ, проведение первой вакцинации недоношенного младенца предпочтительно делать в условиях стационара с возможностью, врачебного наблюдения за состоянием такого пациента в течение 48-72 ч.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
РотаТек, ротавирусная вакцина живая, оральная, пентавалентная
Производитель: Мерк Шарп и Доум Корп.
Анатомо-терапевтическо-химическая классификация: Ротавирус, пентавалентный, живой, реассортированный
Номер регистрации в РК:
№ РК-БП-5№016219
Информация о регистрации в РК:
27.05.2020 — бессрочно
- Скачать инструкцию медикамента
Торговое название
РотаТек
Ротавирусная вакцина живая, оральная, пентавалентная
Международное непатентованное название
Нет
Лекарственная форма
Раствор для приема внутрь
Состав
Одна доза (2 мл) содержит
активные вещества:
G1 Реассортант* не менее 2.21 106 ИЕ**/доза
G2 Реассортант* не менее 2.84 106 ИЕ**/доза
G3 Реассортант* не менее 2.22 106 ИЕ**/доза
G4 Реассортант* не менее 2.04 106 ИЕ**/доза
Р1 A [8] Реассортант не менее 2.29 106 ИЕ**/доза
* человеческий и бычий ротавирусный реассортант (активное вещество), выращенный на клетках Vero
** инфицирующих единиц
вспомогательные вещества: сахароза, натрия цитрат дигидрат, натрия фосфат однозамещенный, моногидрат, натрия гидроксид, полисорбат 80, растворитель для ротавируса, питательная среда LKPM-3.
Описание
Прозрачный раствор от бледно-желтого до бледно-желтого с розовым оттенком цвета.
Фармакотерапевтическая группа
Вакцины. Противовирусные вакцины. Вакцины против ротавирусной диареи. Ротавирус, пентавалентный, живой, реассортированный.
Код АТХ J07ВН02
Фармакологические свойства
Фармакокинетика
Поскольку РотаТек является вакциной, фармакокинетические исследования не проводились.
Фармакодинамика
Эффективность. Клинические исследования установили, что вакцина эффективна против гастроэнтерита, вызванного генотипами ротавируса G1P (8), G2P(4), G3P(8), G4P(8) и G9P(8). Плацебо-контролируемые клинические исследования (REST) установили защитную эффективность вакцинации. В первом исследовании критерием защитной эффективности вакцины явилось снижение уровня заболеваемости ротавирусным гастроэнтеритом, вызванным вакцинными генотипами G (G1- G4) и развившимся в течение 14 дней после завершения вакцинации третьей дозой вакцины в течение одного полного ротавирусного сезона (n=5 673, из них РотаТек n=2 834). Во втором исследовании критерием защитной эффективности вакцины явилось снижение уровня госпитализаций и обращений в отделения скорой помощи по поводу ротавирусного гастроэнтерита (n=68 038, из них РотаТек n=34 035). Результаты исследований приведены в таблицах 1 и 2.
Таблица 1. Снижение уровня заболеваемости ротавирусным гастроэнтеритом в течение одного полного ротавирусного сезона после вакцинации вакциной РотаТек (n=2 834, 95 % ДИ)
|
Эффективность при всех степенях тяжести в зависимости от генотипа ротавируса |
||||||
|
Тяжелая степень тяжести* (G1-G4) |
Любые степени тяжести (G1-G4) |
G1 |
G2 |
G3 |
G4 |
G9 |
|
98.0 % (88.3, 100.0)** |
74.0 % (66.8, 79.9)** |
74.9 % (67.3, 80.9) ** |
63.4% (2.6, 88.2)** |
82.7 % (<0, 99.6) |
48.1 % (<0, 91.6) |
65.4% (<0, 99.3) |
|
* Тяжелая степень тяжести определялась по шкале интенсивности и продолжительности таких клинических симптомов, как жар, рвота, диарея и изменение поведения, где >16/24 означало тяжелую степень тяжести. ** Статистически значимые. |
Таблица 2. Снижение уровня госпитализаций и посещений отделений неотложной помощи по поводу ротавирусного гастроэнтерита, в течение 2 лет после вакцинации РотаТеком (n=34 035, 95 % ДИ)
|
Генотипы |
|||||
|
G1-G4 |
G1 |
G2 |
G3 |
G4 |
G9 |
|
94.5 % |
95.1 % |
87.6 % |
93.4 % |
89.1 % |
100 % |
|
(91.2, 96.6)* |
(91.6, 97.1) * |
(<0, 98.5) |
(49.4, 99.1)* |
(52.0, 97.5)* |
(69.6, 100)* |
|
*Были статистически значимыми. |
Снижение заболеваемости ротавирусным гастроэнтеритом, вызванным генотипами G1-G4 во время второго ротавирусного сезона после вакцинации, составило 88.0 % (95 % ДИ 49.4, 98.7) при тяжелой степени заболевания и 62.6 % (95 % ДИ 44.3, 75.4) при всех степенях тяжести.
При оценке эффективности вакцинации необходимо учитывать, что генотипы ротавируса G2P(4), G3P(8), G4P(8) и G9P(8) встречались реже, чем генотип G1. Эффективность вакцинации при генотипе G2P(4), связана с наличием в вакцине компонента G2.
В повторном анализе комбинированных данных исследования REST и клинического исследования III фазы, эффективность вакцины против ротавирусного гастроэнтерита, вызванного серотипами G1, G2, G3 и G4 (любой степени тяжести) составила 61.5 % (95 % ДИ 14.2, 84.2) у детей в возрасте от 26 до 32 недель при введении 3-х доз вакцины.
В Финляндии проводилось расширение исследования REST. Финское расширенное исследование (FES) продолжалось в течение 3 лет после завершения вакцинации и включало 20 736 пациентов, которые ранее приняли участие в исследовании REST.
В ходе исследования REST зарегистрировано 403 визита в организации здравоохранения (n=20 вакцина, n=383 плацебо) пациентов с ротавирусным гастроэнтеритом генотипов G1-G4 и G9 в общей совокупности. Дополнительные данные, полученные в ходе исследования FES, увеличили число посещений на 136 (n=9 вакцина, n=127 плацебо), из них 31 % и 25 % посещений, соответственно, зарегистрированы в ходе исследования FES.
Обобщенные данные исследований REST и FES установили снижение уровня госпитализаций и посещений отделений скорой помощи в течение 3 лет после вакцинации у пациентов, с диагностированным ротавирусным гастроэнтеритом на 94.4 % (95 % ДИ 91.6, 96.2) при генотипах G1-G4, 95.5 % (95 % ДИ 92.8, 97.2) при генотипе G1, 81.9 % (95 % ДИ 16.1, 98.0) при генотипе G2, 89.0 % (95 % ДИ 53.3, 98.7) при генотипе G3, 83.4 % (95 % ДИ 51.2, 95.8) при генотипе G4 и 94.2 % (95 % ДИ 62.2, 99.9) при генотипе G9. В течение 3 лет не было обращений за медицинской помощью по причине ротавирусного гастроэнтерита в группе провакцинированных пациентов (n=3 112) и только одно обращение (нетипируемое) в группе плацебо (n=3 126).
Для обеспечения эффективности и продолжительности защиты против ротавирусного гастроэнтерита, наблюдавшихся в ходе клинических исследований, необходимо завершить вакцинацию РотаТеком по 3-дозовой схеме. Однако, положительный эффект от вакцинации, который проявляется в снижении уровня госпитализаций и посещений отделений скорой помощи, отмечается и до завершения полного курса вакцинации (начиная примерно с 14 дня после введения первой дозы).
Эффективность у недоношенных младенцев. В ходе исследования REST вакцина РотаТек была введена примерно 1 000 младенцев, родившихся на 25-36 неделе беременности. Эффективность вакцинации РотаТеком между недоношенными и доношенными младенцами была сопоставима.
Постмаркетинговое обсервационное мониторинговое исследование безопасности. В США было проведено клиническое исследование у 85 150 младенцев, получивших одну или более доз вакцины РотаТек (17 433 человеко-лет наблюдения), которое не выявило увеличения риска развития кишечной непроходимости и синдрома Кавасаки по сравнению с ожидаемой исходной частотой (на 30 день после получения вакцины). Кроме того, не выявлено статистически значимого увеличения риска развития побочных эффектов по сравнению с АбКДС (на 30 день после получения вакцины, n=62 617, 12 339 человеко-лет наблюдения). Зарегистрировано 6 случаев кишечной непроходимости после вакцинации РотаТеком и 5 случаев кишечной непроходимости после вакцинации АбКДС (относительный риск ОР= 0.8, 95% ДИ 0.22-3.52). Один таблично-подтвержденный случай был зарегистрирован среди младенцев, привитых РотаТек, в сравнении с одним таблично-подтвержденным случаем среди параллельных контрольных пациентов, привитых АбКДС (ОР = 0.7, 95 % ДИ 0.01-55.56). В общем анализе безопасности никаких специфичных факторов риска для безопасности не установлено.
Данные исследования эффективности. В США было проведено постмаркетинговое обсервационное исследование эффективности вакцины РотаТек в отношении снижения уровня госпитализации, посещений отделений скорой помощи и обращений за амбулаторной медицинской помощью у пациентов, с диагностированным ротавирусным гастроэнтеритом с использованием большой национальной базы данных. Данное исследование оценивало эффективность вакцинации без активного наблюдения за детьми и не собиралось непосредственно у родителей или младенцев. Все случаи ратавирусного гастроэнтерита отслеживались по кодировке базы данных (33 140 детей получили 3 дозы РотаТек, 26 167 детей получили АбКДС). Последующий мониторинг проводился в течение 2 ротавирусных сезонов и начинался через 14 дней после получения третьей дозы в обеих группах или в начале каждого сезона, а запланированное наблюдение продолжалось до конца каждого сезона. Эффективность вакцины против ротавирусного гастроэнтерита составила 100 % (95 % ДИ 87, 100) при госпитализации и посещениях отделений скорой помощи и 96 % (95 % ДИ 76, 100) при обращениях за амбулаторной медицинской помощью. Эффективность вакцины (госпитализация и посещения отделений скорой помощи) против гастроэнтерита любого вида (ротавирусного и вызванного другими причинами) составила 59 % (95 % ДИ 47, 68).
В другом французском обсервационном исследовании у детей младше 2 лет, 4 684 детей получили хотя бы одну дозу вакцины РотаТек и 47.1 % завершили полный 3-х дозовый курс вакцинации. Из 1895 привитых детей, включенных в исследование с симптомами гастроэнтерита, только у одного ребенка диагноз ротавирусного гастроэнтерита был подтвержден по сравнению с 47 случаями ротавирусного гастроэнтерита, диагностированного у 2102 подходящих по возрасту детей. Эффективность вакцинации РотаТеком в отношении снижения госпитализации среди детей младше 2 лет составила 98 % (95 % ДИ 83, 100).
Иммуногенность. Иммунологический механизм, с помощью которого РотаТек защищает против ротавирусного гастроэнтерита, не до конца изучен. В настоящее время защитный уровень не установлен. В клиническом исследовании III фазы у 92.5 — 100 % привитых пациентов было зафиксировано значительное повышение сывороточного анти-ротавирусного иммуноглобулина A после введения трех доз. Вакцина вызывает иммунный ответ, стимулируя выработку специфических антител к пяти человеческим ротавирусным серотипам G1, G2, G3, G4 и P(8).
Показания к применению
-
профилактика гастроэнтерита, вызванного ротавирусной инфекцией серотипов G1, G2, G3, G4 и P1 у детей от 6 до 32 недель
Вакцина РотаТек должна назначаться согласно официальным рекомендациям.
Способ применения и дозы
Только для перорального применения. Не для инъекций!
Схема вакцинации
Дети с периода новорожденности до 6 недель. Вакцина РотаТек не показана для применения в данной возрастной группе. Безопасность и эффективность вакцины РотаТек в данной возрастной группе не установлена.
Дети в возрасте от 6 до 32 недель. Рекомендуется вакцинация по 3-х дозовой схеме, первую дозу вакцины рекомендуется вводить в возрасте с 6 до 12 недель.
РотаТек может назначаться недоношенным детям, если гестационный период составил не менее 25 недель. Такие дети должны получить первую дозу как минимум в 6 недель (см. разделы Особые Указания и Фармакодинамика).
Необходимо соблюдать интервал между введением доз как минимум 4 недели.
Рекомендуется завершить введение 3 доз вакцины до 20-22 недель. В случае необходимости 3-я (последняя) доза может вводиться до 32 недель (см. раздел Фармакодинамика).
В настоящее время нет данных относительно заменимости вакцины РотаТек другой вакциной против ротавирусной инфекции. Детям, получившим РотаТек при первой иммунизации против ротавирусной инфекции, следует вводить ту же вакцину в последующих дозах.
Если по какой-либо причине была введена неполная доза (например, ребенок проглотил только часть или срыгнул вакцину), разовую замещающую дозу можно ввести в то же посещение, однако, это не изучалось в клинических исследованиях. Если данная проблема повторяется, дополнительную замещающую дозу вводить не следует. После завершения курса вакцинации, состоящего из 3-х доз, введение дальнейших доз не рекомендовано (см. разделы Особые Указания и Фармакодинамика).
Дети в возрасте с 33 недель до 18 лет. Препарат РотаТек не назначается в этой возрастной группе.
Способ введения
Нет ограничений по приему пищи или жидкости, включая грудное молоко, при совместном введении с вакциной РотаТек.
Вакцину следует вводить перорально, не смешивая ее с другими вакцинами или растворами. Не разбавлять.
Правила введения вакцины РотаТек
| 975739661477976406_ru.doc | 195 кб |
| 284819951477977612_kz.doc | 201.5 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
Регистрационный номер
ЛП-001865
Торговое наименование
РотаТек®
Группировочное наименование
вакцина для профилактики ротавирусной инфекции, пентавалентная, живая
Лекарственная форма
раствор для приема внутрь
Состав
Одна доза (2 мл) содержит:
Действующие вещества
Живые реассортанты человеческого и бычьего ротавирусов, выращенные на культуре клеток Веро:
Ротавирус типа G1 – не менее 2,2х106 ИЕ*
Ротавирус типа G2 – не менее 2,8х106 ИЕ*
Ротавирус типа G3 – не менее 2,2х106 ИЕ*
Ротавирус типа G4 – не менее 2,0х106 ИЕ*
Ротавирус типа P1A[8] – не менее 2,3х106 ИЕ*
* ИЕ – инфекционная единица
Вспомогательные вещества
Сахароза 1080 мг, натрия гидроксид 2,75 мг, натрия цитрата дигидрат 127 мг, натрия дигидрофосфата моногидрат 29,8 мг, полисорбат‑80 от 0,17 до 0,86 мг, ротавирусный растворитель и среда LPKM-3. Суммарный объем культуральной среды LPKM-3 из вирусных балков и ротавирусного растворителя составляет 15% от общего объема вакцины.
Описание
Прозрачная жидкость бледно-желтого цвета; допустимо наличие розового оттенка.
Характеристика
РотаТек® – это живая пероральная пентавалентная вакцина, содержащая пять живых реассортантных штаммов ротавируса. Ротавирусные родительские штаммы реассортантов были изолированы из организмов человека и быка. Четыре вакцинных реассортанта ротавируса экспрессируют один из наружных капсидных белков VP7 (серотипы G1, G2, G3 или G4) человеческого родительского штамма ротавируса и белок VP4 (серотип P7[5]) бычьего родительского штамма ротавируса (белок VP4 отвечает за прикрепление ротавируса к поверхности клеток). На поверхности пятого реассортанта вируса экспрессирован белок VP4 (серотип P1A[8]) человеческого родительского штамма ротавируса и наружный капсидный белок VP7 (серотип G6) бычьего родительского штамма ротавируса.
Каждый из реассортантов выращен по отдельности на культуре клеток Веро стандартными культуральными методами без использования противогрибковых препаратов. Затем реассортанты все вместе помещены в буферный стабилизирующий раствор.
Так как в производстве реассортантов, входящих в состав вакцины РотаТек®, используется биологический материал животного происхождения, в вакцине обнаружены малые фрагменты ДНК ЦВС‑1 и ЦВС‑2 (цирковирус свиней 1 и 2 типов), при этом сами вирусные частицы ЦВС‑1 и/или ЦВС‑2 в вакцине отсутствуют. В настоящее время неизвестны случаи заболевания человека, вызванные ЦВС‑1 и/или ЦВС‑2.
Вакцина РотаТек® не содержит тиомерсала и других консервантов.
Фармакотерапевтическая группа
МИБП‑вакцина
Код АТХ
J07BH02
Иммунобиологические свойства
В умеренной климатической зоне ротавирусный гастроэнтерит является сезонным заболеванием с увеличением заболеваемости (эпидемиями) в зимние месяцы. При отсутствии лечения ротавирусный гастроэнтерит может привести к летальной дегидратации.
Эффективность
По данным клинических исследований эффективность вакцины РотаТек® была продемонстрирована в отношении гастроэнтерита, вызванного ротавирусами генотипов G1P[8], G2P[4], G3P[8], G4P[8] и G9P[8].
Эффективность вакцины РотаТек® изучалась по 2 параметрам в плацебо-контролируемом исследовании эффективности и безопасности (REST):
- У 5673 вакцинированных детей (2834 ребенка в группе вакцины) эффективность измерялась как уменьшение числа случаев ротавирусного гастроэнтерита, вызванного генотипами G, входящими в вакцину (G1‑G4), который развивался через 14 дней после получения третьей дозы вакцины и на протяжении первого полного ротавирусного сезона после вакцинации.
- У 68038 вакцинированных детей (34035 детей в группе вакцины) эффективность защиты измерялась как уменьшение числа случаев госпитализаций и обращений за неотложной помощью по поводу ротавирусного гастроэнтерита, начиная с 14‑го дня после получения третьей дозы вакцины.
Результаты данных исследований представлены в таблицах.
| Уменьшение числа случаев ротавирусного гастроэнтерита на протяжении одного полного сезона после вакцинации (группа вакцины РотаТек® n=2834) (% [95% доверительный интервал (ДИ)]) | ||||||
| Эффективность против ротавирусного гастроэнтерита любой степени тяжести в зависимости от генотипа | ||||||
|
Тяжелая* степень заболевания (G1‑G4) |
Любая степень тяжести (G1‑G4) |
G1 | G2 | G3 | G4 | G9 |
|
98,0% [88,3; 100,0]† |
74,0% [66,8; 79,9]† |
74,9% [67,3; 80,9]† |
63,4% [2,6; 88,2]† |
82,7% [<0; 99,6] |
48,1% [<0; 91,6] |
65,4% [<0; 99,3] |
* Тяжелая степень определялась как результат «больше 16 из 24» по валидированной клинической системе подсчета, основанной на интенсивности и продолжительности симптомов (лихорадки, рвоты, диареи, изменений поведения).
† Статистически значимо.
|
Уменьшение числа госпитализаций и обращений за неотложной помощью по поводу ротавирусного гастроэнтерита на протяжении 2 лет после вакцинации (группа вакцины РотаТек® n=34035) (% [95% ДИ]) |
|||||
| G1‑G4 | G1 | G2 | G3 | G4 | G9 |
|
94,5% [91,2; 96,6]† |
95,1% [91,6; 97,1]† |
87,6% [<0; 98,5] |
93,4% [49,4; 99,1]† |
89,1% [52,0; 97,5]† |
100% [69,6; 100,0]† |
† Статистически значимо.
Уменьшение числа случаев ротавирусного гастроэнтерита, вызванного генотипами G1‑G4 во время второго ротавирусного сезона после вакцинации, составило 88,0% [95% ДИ: 49,4; 98,7] для тяжелой степени заболевания и 62,6% [95% ДИ: 44,3; 75,4] для заболевания любой степени тяжести.
Эффективность против ротавируса генотипов G2P[4], G3P[8], G4P[8] и G9P[8] была рассчитана для меньшего числа случаев, чем для G1. Эффективность против генотипов G2P[4], скорее всего, связана c наличием реассортанта G2 в составе вакцины.
В комбинированном ретроспективном анализе исследования REST и другого исследования фазы 3 эффективность вакцины против ротавирусного гастроэнтерита (любой степени тяжести), вызванного G1-, G2-, G3- и G4‑серотипами, составила 61,5% [95% ДИ: 14,2; 84,2] среди детей, получивших третью дозу препарата в возрасте от 26 до 32 (включительно) недель.
В Финляндии было проведено дополнительное исследование в рамках исследования REST. В финском дополнительном исследовании (FES) наблюдали группу из 20736 детей, ранее участвовавших в исследовании REST. В исследовании FES детей наблюдали в течение до 3 лет после вакцинации.
В исследовании REST было сообщено о 403 случаях ротавирусного гастроэнтерита, связанного с генотипами G1‑G4 и G9 (20 случаев в группе вакцины и 383 в группе плацебо). В исследовании FES было отмечено дополнительно 136 случаев (9 в группе вакцины и 127 в группе плацебо). Число случаев для каждой группы в исследовании FES составляло 31% и 25% от суммы случаев для соответствующих групп в двух исследованиях.
На основе объединенных данных REST и FES уменьшение числа случаев госпитализаций и обращений за неотложной помощью по поводу ротавирусного гастроэнтерита в течение 3 лет после вакцинации составило 94,4% (95% ДИ: 91,6; 96,2) для генотипов G1‑G4, 95,5% (95% ДИ: 92,8; 97,2) для генотипа G1, 81,9% (95% ДИ: 16,1; 98,0) для генотипа G2, 89,0% (95% ДИ: 53,3; 98,7) для генотипа G3, 83,4% (95% ДИ: 51,2; 95,8) для генотипа G4 и 94,2% (95% ДИ: 62,2; 99,9) для генотипа G9. В течение третьего года в группе вакцины (3112 детей) обращений за медицинской помощью по поводу ротавирусного гастроэнтерита зафиксировано не было, а в группе плацебо (3126 детей) был отмечен 1 (нетипируемый) случай.
В клинических исследованиях было подтверждено, что для достижения необходимого уровня и длительности защиты против ротавирусного гастроэнтерита следует проводить полный курс вакцинации с введением 3 доз (см. СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ). Однако ретроспективный анализ данных показал, что даже до завершения полного курса вакцинации число случаев ротавирусного гастроэнтерита с такой степенью тяжести, которая потребовала бы госпитализацию или обращение за неотложной помощью, уменьшалось (через примерно 14 дней после введения первой дозы).
Эффективность у недоношенных детей
В исследовании REST вакцину РотаТек® ввели примерно 1000 детям, родившимся при сроке беременности от 25 до 36 недель. Эффективность вакцины РотаТек® у данной подгруппы не отличалась от подгруппы детей, родившихся в срок.
Пострегистрационное наблюдательное исследование по безопасности
В крупном проспективном пострегистрационном наблюдательном исследовании, проводившемся в США, был проанализирован риск болезни Кавасаки у 85150 детей, получивших одну или более доз вакцины РотаТек® (17433 пациенто‑лет наблюдения).
В течение 0–30 дней после введения вакцины не было статистически значимой разницы в частоте развития болезни Кавасаки по сравнению c частотой в общей популяции. Кроме того, не было статистически значимого повышения риска появления данного побочного эффекта при наблюдении в течение 30 дней после введения вакцины РотаТек® по сравнению с контрольной группой детей, получавших только вакцину АКДС (62617 детей, 12399 пациенто‑лет наблюдений). Один подтвержденный случай был зарегистрирован у детей, получавших вакцину РотаТек®, в сравнении с одним случаем у детей, получавших АКДС (относительный риск 0,7; 95% ДИ: 0,01; 55,56). Таким образом, никакого дополнительного риска, связанного с безопасностью, относительно общего профиля безопасности зафиксировано не было.
Данные исследований по эффективности
Пострегистрационные исследования, подтверждающие эффективность предотвращения ротавирусного гастроэнтерита.
| Дизайн исследования (страна) | Исследуемая популяция | Конечные точки | Эффективность в % [95% ДИ] | Сезоны заболеваемости ротавирусом |
| База данных обращений (США) |
33140 вакцинированных 26167 невакцинированных Возраст ≥7 месяцев Получено 3 дозы |
Госпитализации и обращения за неотложной помощью по поводу ротавирусного гастроэнтерита | 100% [87;100] | 2007-2008 |
| Амбулаторные обращения по поводу ротавирусного гастроэнтерита | 96% [76;100] | |||
| Госпитализации и обращения за неотложной помощью по поводу всех видов гастроэнтерита | 59% [47;68] | |||
|
Когортное исследование (Франция) |
1895 вакцинированных 3 дозами 2102 невакцинированных Возраст <2 лет |
Госпитализации по поводу ротавирусного гастроэнтерита | 98% [83;100] |
2007-2008 2008-2009 |
| Исследование случай-контроль (США) |
402 случаев 2559 контролей* Возраст <8 лет Получено 3 дозы |
Госпитализации и обращения за неотложной помощью по поводу ротавирусного гастроэнтерита | 80% [74;84] |
2011-2012 2012-2013 |
| Специфично по штаммам | ||||
| — G1P[8] | 89% [55;97] | |||
| — G2P[4] | 87% [65;95] | |||
| — G3P[8] | 80% [64;89] | |||
| — G12P[8] | 78% [71;84] | |||
| Специфично по возрасту | ||||
| — 1‑й год жизни | 91% [78;96] | |||
| — 2‑й год жизни | 82% [69;89] | |||
| — 3‑й год жизни | 88% [78;93] | |||
| — 4‑й год жизни | 76% [51;88] | |||
| — 5‑й год жизни | 60% [16;81] | |||
| — 6‑й — 7‑й годы жизни | 69% [43;84] |
*Контроли — ротавирус-отрицательные случаи острого гастроэнтерита.
Иммуногенность
Механизм иммунной защиты организма вакциной РотаТек® от ротавирусного гастроэнтерита до конца не изучен. Взаимосвязь между содержанием антител к ротавирусам после вакцинации ротавирусными вакцинами и степенью защиты против ротавирусного гастроэнтерита не установлена. По данным клинических исследований фазы 3 после проведения полного курса вакцинации, состоящего из трех доз препарата РотаТек®, у 92,5–100% вакцинированных в сыворотке наблюдалось значительное повышение уровня анти‑ротавирусного IgA. Вакцина вызывает иммунный ответ, т.е. образование сывороточных нейтрализующих антител к пяти белкам ротавирусов человека, экспрессированных на реассортантах вакцины (G1, G2, G3, G4 и Р1А[8]).
Показания к применению
Активная иммунизация детей в возрасте от 6 до 32 недель с целью профилактики гастроэнтерита, вызываемого ротавирусами серотипов G1, G2, G3, G4 и серотипов G, содержащих Р1А[8] (например, G9).
Противопоказания
- Повышенная чувствительность к любому компоненту вакцины РотаТек®, а также на введение вакцины РотаТек® в анамнезе.
- Инвагинация кишечника в анамнезе.
- Врожденные пороки развития желудочно-кишечного тракта, предрасполагающие к инвагинации кишечника.
- Иммунодефицит, подозрение на иммунодефицит (см. ОСОБЫЕ УКАЗАНИЯ И ПОБОЧНОЕ ДЕЙСТВИЕ).
- Острые инфекционные и неинфекционные заболевания, обострение хронических заболеваний являются временными противопоказаниями для проведения прививок. Плановые прививки проводят через 2–4 недели после выздоровления или в период реконвалесценции или ремиссии. При нетяжелых острых вирусных респираторных инфекциях, острых кишечных заболеваниях и других заболеваниях прививки проводятся сразу после нормализации температуры.
- Острая форма диареи или рвоты (в этих случаях вакцинацию проводят на стадии ремиссии).
- Непереносимость фруктозы, нарушение всасывания глюкозо-галактозного комплекса, недостаточность ферментов сахаразы и/или изомальтазы.
С осторожностью
- При активных заболеваниях желудочно-кишечного тракта, включая хроническую диарею (отсутствие клинических данных).
- При задержке развития (отсутствие клинических данных).
- При иммунокомпрометированном состоянии (например, в результате злокачественных новообразований или иммунодепрессивной терапии).
- При близком контакте с лицами с иммунодефицитом (например, с лицами со злокачественными новообразованиями или с лицами, получающими иммуносупрессивную терапию).
- При трансфузии крови или продуктов крови, включая иммуноглобулины, менее чем за 42 дня до намеченной вакцинации.
Применение при беременности и в период грудного вскармливания
Вакцина РотаТек® предназначена только для детей. Данных по применению вакцины при беременности и/или в период грудного вскармливания нет.
Особые группы пациентов
Дети
Вакцина РотаТек® обычно хорошо переносится и обладает высокой эффективностью по предотвращению ротавирусного гастроэнтерита при применении у детей в возрасте от 6 до 32 недель.
Эффективность и безопасность не были установлены у детей в возрасте младше 6 недель.
Способ применения и дозы
Способ введения
ТОЛЬКО ДЛЯ ПРИЕМА ВНУТРЬ. НЕ ДЛЯ ИНЪЕКЦИЙ!
Вакцина РотаТек® представляет собой готовую к применению жидкость.
Вакцина РотаТек® может вводиться вне зависимости от времени приема пищи или любой жидкости, включая грудное молоко.
Вакцину РотаТек® нельзя смешивать с другими растворами и вакцинами в одной емкости. Вакцину РотаТек® нельзя растворять или разводить. Не использовать, если обнаружены внешние повреждения тубы и/или содержимое тубы выглядит иначе, чем указано в разделе «ОПИСАНИЕ» данной инструкции.
Схема вакцинации
Курс вакцинации состоит из трех доз препарата РотаТек®.
Первая доза препарата РотаТек® вводится детям в возрасте от 6 до 12 недель.
Последующие дозы вводятся с интервалом между введениями от 4 до 10 недель.
Все три дозы рекомендуется ввести до достижения ребенком возраста 32 недель.
При введении неполной дозы (например, ребенок выплюнул или срыгнул часть дозы) не рекомендуется вводить дополнительную дозу, так как данный режим дозирования не изучался в клинических исследованиях. Оставшиеся дозы следует вводить согласно схеме вакцинации.
Недоношенные дети
Вакцину РотаТек® можно применять у недоношенных детей, родившихся при сроке беременности не менее 25 недель. Вакцину следует вводить таким детям не ранее чем через 6 недель после рождения.
Рекомендации по подготовке и проведению вакцинации препаратом РотаТек®:
 |
Выньте одну упаковку из холодильника, разорвите ее и достаньте пластиковую тубу. |
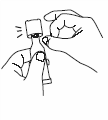 |
Держа тубу вертикально, колпачком кверху, постучите по колпачку, чтобы удалить жидкость из дозирующего наконечника. |
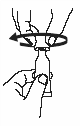 |
Откройте тубу двумя простыми движениями: 1. Проколите дозирующий наконечник, повернув завинчивающийся колпачок до упора по часовой стрелке. |
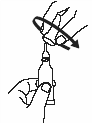 |
2. Поверните колпачок против часовой стрелки и снимите его. |
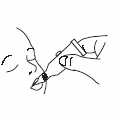 |
Введите дозу, осторожно выжимая жидкость в рот ребенка в направлении внутренней стороны щеки, пока туба не опустеет (в наконечнике тубы может остаться капля жидкости). |
| Пустые тубы и наконечник подлежат утилизации в контейнерах для биоотходов в соответствии с утвержденными правилами. |
Побочное действие
Вакцина обычно хорошо переносится.
У детей, участвовавших в трех плацебо-контролируемых клинических исследованиях (6130 детей в группе вакцины РотаТек®, 5560 детей в группе плацебо), были оценены побочные эффекты препарата РотаТек® в течение 42 дней после вакцинации с или без совместного использования других вакцин для детей. В целом нежелательные реакции были отмечены у 47% детей, получавших вакцину РотаТек®, по сравнению с 45,8% в группе плацебо. Наиболее частыми нежелательными явлениями были гипертермия (повышение температуры выше 38°С) (20,9%), диарея (17,6%) и рвота (10,1%).
Серьезные нежелательные реакции были оценены у всех участников (36150 детей в группе вакцины РотаТек®, 35536 детей в группе плацебо) в 3 клинических исследованиях в течение 42 дней после приема каждой дозы. В целом частота серьезных нежелательных реакций составляла 0,1% в группе вакцины РотаТек® и 0,2% в группе плацебо.
Нежелательные реакции в группе вакцины приведены ниже в соответствии с системой органов/классов. На основании объединенных данных 3 клинических исследований (6130 детей в группе вакцины РотаТек®, 5560 детей в группе плацебо) перечислены нежелательные реакции, частота которых в группе вакцины РотаТек® превосходила частоту в группе плацебо на 0,2–2,5%.
Нежелательные реакции, выделенные курсивом, наблюдались в пострегистрационном периоде.
Частота нежелательных реакций определялась следующим образом:
очень часто (≥1/10), часто (≥1/100, но <1/10), нечасто (≥1/1000, но <1/100), редко (≥1/10000, но <1/1000), очень редко (<1/10000), неизвестно (частоту данных нежелательных реакций невозможно установить из имеющихся данных).
— Инфекционные и паразитарные заболевания
Часто: инфекции верхних дыхательных путей
Нечасто: назофарингит, средний отит
— Нарушения со стороны иммунной системы
Неизвестно: анафилактическая реакция‡
— Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Редко: бронхоспазм
— Нарушения со стороны желудочно-кишечного тракта
Очень часто: диарея, рвота
Нечасто: гематохезия†, боль в верхних отделах живота
Редко: инвагинация кишечника†,*
— Нарушения со стороны кожи и подкожных тканей
Нечасто: сыпь
Редко: крапивница†
Неизвестно: ангиоэдема‡
— Общие расстройства и нарушения в месте введения
Очень часто: гипертермия
Неизвестно: раздражительность‡
† Данные нежелательные реакции были установлены в ходе пострегистрационного наблюдения. Частота данных нежелательных реакций оценивалась на основании соответствующих клинических исследований.
* см. ОСОБЫЕ УКАЗАНИЯ.
‡ Нежелательные реакции, которые наблюдались при пострегистрационном применении вакцины; их частоту невозможно установить из имеющихся данных.
Дополнительная информация по некоторым нежелательным реакциям
Болезнь Кавасаки наблюдалась у 5 из 36150 детей в группе вакцины (<0,1%) и 1 из 35536 в группе плацебо (<0,1%) с относительным риском 4,9 [95% ДИ: 0,6; 239,1] (статистически незначимо). Данные крупного пострегистрационного наблюдательного исследования безопасности не подтверждают повышения риска возникновения болезни Кавасаки после вакцинации препаратом РотаТек® (см. ИММУНОЛОГИЧЕСКИЕ СВОЙСТВА).
Инвагинация кишечника
Данные наблюдательных исследований безопасности, проведённых в нескольких странах, свидетельствуют о том, что применение вакцины для профилактики ротавирусной инфекции может увеличить риск возникновения инвагинации кишечника в течение 7 дней после вакцинации на 6 случаев на 100000 детей при сравнении с ожидаемым фоновым уровнем возникновения инвагинации. Существуют ограниченные данные, подтверждающие меньшее увеличение риска возникновения инвагинации кишечника после приема второй дозы. Фоновая частота случаев инвагинации кишечника у не вакцинированных ротавирусной вакциной детей младше 1 года в этих странах варьирует от 33 до 101 на 100000 детей в год. Неизвестно, связана ли регистрация более высокого числа случаев инвагинации кишечника с более длительным периодом наблюдения за детьми, которым вводили вакцину для профилактики ротавирусной инфекции (см. ОСОБЫЕ УКАЗАНИЯ).
Особые группы пациентов
Существует риск развития апноэ у недоношенных детей (рожденных на сроке беременности до 28 недель включительно) (см. ОСОБЫЕ УКАЗАНИЯ).
В ходе пострегистрационного наблюдения детей с тяжелым комбинированным иммунодефицитом были отмечены случаи гастроэнтерита, сопровождающегося выделением с калом штаммов ротавируса, входящих в состав вакцины.
Передозировка
Имеются сообщения о нескольких случаях передозировки вакциной РотаТек®. Отличий в профиле нежелательных явлений по сравнению с применением препарата в рекомендованных дозах нет.
Взаимодействие с другими лекарственными препаратами
Применение с другими вакцинами
Препарат РотаТек® можно вводить детям одновременно с любыми следующими антигенами, входящими в состав как моновалентных, так и комбинированных вакцин: дифтерийным анатоксином, столбнячным анатоксином, коклюшной вакциной, конъюгированной вакциной против Haemophilus influenzae тип b, инактивированной полиомиелитной вакциной, вакциной против вирусного гепатита B, гексавалентной вакциной (содержащей вышеперечисленные компоненты), конъюгированной пневмококковой вакциной, конъюгированной менингококковой вакциной серогруппы С. Не было отмечено снижения иммунного ответа при одновременном введении нескольких вакцин и вакцины РотаТек®.
Одновременное введение пероральной полиовакцины (ОПВ) и вакцины РотаТек® не влияло на иммунный ответ, вызываемый ОПВ, но несколько снижало иммунный ответ на вакцину РотаТек®, однако нет данных, подтверждающих снижение степени защиты от тяжелых форм ротавирусного гастроэнтерита. Иммунный ответ на вакцину РотаТек® не изменялся при введении ОПВ через две недели после введения вакцины РотаТек®.
Особые указания
Во время проведения вакцинации должны быть доступны все необходимые лекарственные препараты, включая адреналин (1:1000), на случай возникновения анафилактической реакции (см. ПОБОЧНОЕ ДЕЙСТВИЕ).
Данные по эффективности и безопасности применения вакцины РотаТек® у детей с компрометированным иммунитетом, детей с бессимптомной ВИЧ‑инфекцией или детей, которым было сделано переливание крови или введены иммуноглобулины не более чем за 42 дня до введения вакцины, отсутствуют. Маловероятно, что бессимптомная ВИЧ‑инфекция (ВИЧ‑носительство) будет влиять на безопасность и эффективность вакцины РотаТек®. Тем не менее в связи с недостаточностью клинических данных не рекомендуется назначение вакцины РотаТек® при бессимптомной ВИЧ‑инфекции.
У детей с тяжелым комбинированным иммунодефицитом были отмечены случаи гастроэнтерита, вызванного штаммами ротавируса, входящими в вакцину (см. ПРОТИВОПОКАЗАНИЯ).
По данным клинических исследований вакцинный вирус обнаруживался в кале у 8,9% вакцинированных детей только в течение 1 недели после введения первой дозы вакцины и только у 0,3% детей (1 случай) после введения 3‑ей дозы. Пик выделения вакцинного вируса приходится на 7‑й день после вакцинации. Согласно пострегистрационным данным возможна передача вакцинного вируса невакцинированным лицам. Вакцина РотаТек® должна с осторожностью назначаться детям, находящимся в тесном контакте с лицами с иммунодефицитом (в том числе, при контакте с лицами с онкологическими заболеваниями, иммунокомпрометированными или лицами, получающими иммуносупрессивную терапию). Следует соблюдать особые гигиенические правила при контакте с калом вакцинированного ребенка.
В клиническом исследовании вакцину РотаТек® применяли примерно у 1000 детей, рожденных при сроке гестации от 25 до 36 недель. Первую дозу вводили на 6‑ой неделе после рождения. Безопасность и эффективность вакцины РотаТек® была сопоставима у данной подгруппы детей и у подгруппы детей, родившихся в срок. Однако среди этих 1000 детей, 19 детей родилось в срок от 25 до 28 недель гестации, 55 – от 29 до 31 недель, а остальные – от 32 до 36 недель (см. ИММУНОЛОГИЧЕСКИЕ СВОЙСТВА И СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ).
Инвагинация
Поскольку данные наблюдательных исследований свидетельствуют о повышенном риске возникновения инвагинации кишечника после применения вакцины для профилактики ротавирусной инфекции в течение 7 дней после вакцинации (см. ПОБОЧНОЕ ДЕЙСТВИЕ), в качестве меры предосторожности врачу необходимо отслеживать любые симптомы, указывающие на возникновение этого заболевания (острая боль в животе, неукротимая рвота, наличие крови в кале, вздутие живота и/или высокая температура).
Родители/опекуны должны быть проинформированы о необходимости безотлагательно обращаться за медицинской помощью в случае возникновения таких симптомов.
В случае наличия предрасположенности к возникновению инвагинации кишечника см. раздел ПРОТИВОПОКАЗАНИЯ.
В настоящее время отсутствуют данные о безопасности и эффективности применения вакцины РотаТек® у новорожденных с желудочно-кишечными заболеваниями (включая хроническую диарею) и при задержке развития. Применение вакцины РотаТек® следует осуществлять с осторожностью у таких новорожденных, а также в том случае, когда, по мнению врача, отказ от вакцинации этой группы детей представляет больший риск, чем ее проведение.
Указанный уровень защиты после вакцинации препаратом РотаТек® обеспечивается при завершенном курсе вакцинации, состоящем из 3 доз. Как и любая другая вакцина, РотаТек® не может обеспечить полную защиту всех вакцинированных. Вакцина РотаТек® эффективна только против ротавирусной инфекции и не защищает от гастроэнтерита, вызванного другими патогенными микроорганизмами.
Клинические исследования эффективности защиты против ротавирусного гастроэнтерита проводились в Европе, США, странах Латинской Америки и Азии. Во время проведения данных клинических исследований наиболее распространенным генотипом ротавируса был G1P[8], в то время как остальные генотипы G2P[4], G3P[8], G4P[8] и G9P[8] обнаруживались реже. Уровень защиты, который обеспечивает вакцина РотаТек® против ротавирусов других типов и в других популяциях, неизвестен.
Данные клинических исследований по применению вакцины РотаТек® для профилактики после контакта с пациентом с ротавирусным гастроэнтеритом отсутствуют.
При решении о вакцинации ребенка с тяжелой степенью недоношенности (беременность ≤28 недель, но не менее 25 недель), особенно имеющего в анамнезе незрелость органов дыхания, необходимо учитывать тот факт, что польза иммунизации против ротавирусной инфекции у данной группы пациентов высока. Вследствие этого не следует ни отказываться от вакцинации, ни переносить ее сроки. Однако учитывая потенциальный риск апноэ, первую вакцинацию недоношенного младенца предпочтительно проводить в условиях стационара с возможностью врачебного наблюдения за состоянием такого пациента в течение 48–72 ч.
ВАКЦИНУ РотаТек® ЗАПРЕЩЕНО ВВОДИТЬ ИНЪЕКЦИОННО!
Вакцину РотаТек® следует вводить как можно быстрее после извлечения из холодильника.
В случае если вакцину не использовали, она подлежит утилизации в контейнерах для биоотходов в соответствии с утвержденными правилами.
Влияние на способность управлять транспортными средствами и работать с механизмами
Неприменимо.
Форма выпуска
Раствор для приема внутрь.
В тубе содержится одна прививочная доза.
По 2 мл в тубы из полиэтилена низкой плотности с отвинчивающейся крышкой из полиэтилена высокой плотности.
На корпусе тубы на английском языке нанесено: с одной стороны – «Rotavirus», «Vaccine» и логотип фирмы в виде графического символа, с другой – «Rotavirus», «Vaccine» и логотип фирмы в виде аббревиатуры «MSD».
Туба помещена в индивидуальную упаковку из фольги алюминиевой.
Упаковка для отпуска из аптек
По 1 тубе в упаковке из фольги алюминиевой вместе с инструкцией по применению в картонной пачке. Может присутствовать контроль вскрытия упаковки.
Упаковка для лечебно-профилактических учреждений
По 10 туб, каждая в индивидуальной упаковке из фольги алюминиевой, вместе с инструкцией по применению в картонной пачке. Может присутствовать контроль вскрытия упаковки.
Условия хранения
Хранить при температуре от 2 до 8°С в защищенном от света месте.
Хранить в недоступном для детей месте.
Срок годности
2 года. Не использовать после истечения срока годности, указанного на упаковке.
Условия отпуска
Упаковка с 1 тубой – «Отпускают по рецепту».
Упаковка с 10 тубами – «Для лечебно-профилактических учреждений».
Юридическое лицо, на имя которого выдано регистрационное удостоверение
ООО «МСД Фармасьютикалс», Россия
Производитель
Произведено:
Мерк Шарп и Доум ЛЛС, США
Merck Sharp & Dohme LLC, 770 Sumneytown Pike, West Point, PA 19486, USA
Выпускающий контроль качества:
Мерк Шарп и Доум Б.В., Нидерланды
Merck Sharp & Dohme B.V., Waarderweg 39, 2031 BN Haarlem, the Netherlands
или
Мерк Шарп и Доум ЛЛС, США
Merck Sharp & Dohme LLC, 770 Sumneytown Pike, West Point, PA 19486, USA
Претензии потребителей направлять по адресу
ООО «МСД Фармасьютикалс»
ул. Тимура Фрунзе, д. 11, стр. 1,
г. Москва, Россия, 119021
тел.: (495) 916-71-00;
факс: (495) 916-70-94
RU-NON-01045-02-23


