Скайризи — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-006460
Торговое наименование:
Скайризи
Международное непатентованное или группировочное наименование
Рисанкизумаб
Лекарственная форма
Раствор для подкожного введения
Состав
В 1 шприце 0,83 мл содержится:
действующее вещество: рисанкизумаб – 75,0 мг;
вспомогательные вещества: сорбитол, натрия сукцинат гексагидрат, янтарная кислота, полисорбат 20, вода для инъекций.
Описание
Прозрачный или слегка опалесцирующий, бесцветный или слегка желтоватый раствор. Допускается наличие небольших полупрозрачных аморфных белковых включений.
Фармакотерапевтическая группа
Иммунодепрессанты, интерлейкина ингибиторы
Код АТХ
L04AC18
Фармакологические свойства
Механизм действия
Рисанкизумаб – это гуманизированное моноклональное антитело иммуноглобулина G1 (IgGl), которое селективно и с высокой аффинностью связывается с субъединицей р19 цитокина интерлейкина-23 (ИЛ-23) человека и ингибирует его взаимодействие с рецептором ИЛ-23. ИЛ-23 – это естественный цитокин, участвующий в воспалительном и иммунном ответе. ИЛ-23 способствует образованию, поддержанию числа и активации Th17-лимфоцитов, которые вырабатывают ИЛ-17-А, ИЛ-17F и ИЛ-22, а также другие провоспалительные цитокины и играют важную роль в патогенезе аутоиммунных заболеваний, в частности, псориаза. У пациентов с бляшечным псориазом уровень ИЛ-23 повышен в пораженной заболеванием коже. Предотвращая связывание ИЛ-23 с его рецептором, рисанкизумаб ингибирует сигнальный путь и высвобождение провоспалительных цитокинов.
Рисанкизумаб не связывается с человеческим ИЛ-12, который имеет общую с ИЛ-23 субъединицу р40.
Фармакодинамика
Согласно данным исследования, однократное введение рисанкизумаба пациентам с псориазом приводит к снижению в коже экспрессии генов, связанных с иммунной осью ИЛ-23/ИЛ-17. В псориатических поражениях также наблюдалось уменьшение толщины эпидермиса, воспалительной инфильтрации и экспрессии маркеров псориаза.
Фармакокинетика
Всасывание
Рисанкизумаб характеризуется линейной фармакокинетикой с дозозависимым повышением экспозиции в диапазоне доз от 18 до 300 мг и от 0,25 до 1 мг/кг при подкожном введении, а также от 200 до 1200 мг и от 0,01 до 5 мг/кг при внутривенном введении.
После подкожного введения рисанкизумаба максимальная концентрация в плазме была достигнута через 3-14 дней, предполагаемая абсолютная биодоступность составила 89%. Подсчитано, что средняя максимальная концентрация в состоянии равновесия и остаточная концентрация препарата в плазме крови составляют 12 и 2 пг/мл соответственно при следующем режиме введения пациентам с псориазом: 150 мг на неделе 0, 4 и каждые 12 недель после этого.
Распределение
У типичного пациента с псориазом и массой тела 90 кг объем распределения в равновесном состоянии (Vss) составляет 11,2 л, что указывает на то, что распределение рисанкизумаба в основном ограничивается сосудистым и интерстициальным пространством.
Метаболизм
Терапевтические моноклональные антитела IgG обычно разлагаются на мелкие пептиды и аминокислоты в результате катаболизма подобно эндогенным IgG. Рисанкизумаб не метаболизируется ферментами цитохрома Р450.
Выведение
Для типичного пациента с псориазом и массой тела 90 кг, системный клиренс (CL) рисанкизумаба составляет 0,31 л/день, а терминальный период полувыведения – 28 дней. Не предполагается, что рисанкизумаб подвергается клубочковой фильтрации или выделяется с мочой в виде интактной молекулы.
Взаимодействие с другими лекарственными средствами
Исследование лекарственных взаимодействий проводилось у пациентов с бляшечным псориазом для оценки влияния многократного введения рисанкизумаба на фармакокинетику маркерных субстратов, чувствительных к цитохрому Р450 (CYP). Экспозиция кофеина (субстрат CYP1A2), варфарина (субстрат CYP2C9), омепразола (субстрат CYP2C19), метопролола (субстрат CYP2D6) и мидазолама (субстрат CYP3A) при введении рисанкизумаба было сопоставимо с их экспозицией до введения рисанкизумаба. Это указывает на отсутствие клинически значимых лекарственных взаимодействий с помощью данных ферментов.
Результаты популяционного фармакокинетического анализа показали, что на экспозицию рисанкизумаба не влияли сопутствующие препараты (метформин, аторвастатин, лизиноприл, амлодипин, ибупрофен, ацетилсалицилат и левотироксин), которые использовали некоторые пациенты с бляшечным псориазом во время клинических исследований (см. раздел «Взаимодействие с другими лекарственными средствами»).
Особые группы пациентов
Дети
Фармакокинетика рисанкизумаба у детей не изучалась.
Пожилые пациенты
Из 2234 пациентов с бляшечным псориазом, получавших терапию препаратом Скайризи, 243 пациента были старше 65 лет, а 24 пациента – старше 75 лет. В целом не было выявлено различий в безопасности и эффективности терапии препаратом Скайризи между пациентами более старшего и более молодого возраста (см. раздел «Способ применения и дозы»).
Пациенты с нарушением функции почек или печени
Специальные исследования для определения влияния почечной или печеночной недостаточности на фармакокинетику рисанкизумаба не проводились. Согласно данным популяционного фармакокинетического анализа, уровни креатинина в сыворотке крови, клиренс креатинина или маркеры функции печени (АЛТ/АСТ/билирубин) не оказывали значимого влияния на клиренс рисанкизумаба у пациентов с псориазом.
Поскольку рисанкизумаб является моноклональным антителом IgGl, в основном он выводится при внутриклеточном катаболизме. Ожидается, что рисанкизумаб не подвергается метаболизму с помощью ферментов цитохрома Р450 или элиминации почками (см. раздел «Способ применения и дозы»).
Масса тела
Клиренс рисанкизумаба и объем его распределения увеличиваются с зависимости от увеличения массы тела. Однако клинически значимые изменения параметров эффективности и безопасности рисанкизумаба при увеличении массы тела не наблюдались, поэтому коррекция дозы на основании массы тела не требуется.
Пол, раса
Пол, раса не оказывали клинически значимого влияния на клиренс рисанкизумаба у взрослых пациентов с бляшечный псориазом. Согласно данным клинического исследования по изучению фармакокинетики, у пациентов из Китая и Японии, не наблюдались клинически значимые различия концентраций рисанкизумаба в плазме крови по сравнению с пациентами европеоидной расы.
Краткая информация о клинических исследованиях
Эффективность и безопасность препарата Скайризи изучалась у 2109 пациентов со среднетяжелым и тяжелым псориазом (статичная общая оценка врачом sPGA ≥3 и индекс тяжести и площади поражения PASI ≥12) в 4-х многоцентровых, рандомизированных, двойных слепых исследованиях (ULTIMMA-1, ULTIMMA-2, IMMHANCE, and IMMVENT).
У 9,8% пациентов отмечался сопутствующий псориатический артрит в анамнезе, 42,1% – до включения в исследование получали лечение другим биологическим препаратом. В исследованиях ULTIMMA-1 и ULTIMMA-2 по всем первичным и вторичным конечным точкам [статичная общая оценка врачом «чисто» или «почти чисто» (sPGA 0/1), статичная общая оценка врачом «чисто» (sPGA 0), PASI 75, PASI 90 и PASI 100] отмечалось статистически достоверное преимущество препарата Скайризи по сравнению с плацебо и устекинумабом на неделях 16 и 52. Улучшение на фоне лечения препаратом Скайризи также наблюдалось со стороны псориаза волосистой части головы, ногтей, ладоней и стоп.
Среди пациентов, достигших sPGA 0/1 на неделе 28 в исследовании IMMHANCE, 87,4% поддерживали ответ к неделе 52 при непрерывной терапии препаратом Скайризи по сравнению с 61,3%, кто получил последнюю дозу препарата на неделе 16 (ре-рандомизация на неделе 28).
В исследовании IMMVENT по конечным точкам sPGA 0/1, PASI 75, PASI 90 и PASI 100 отмечалось статистически достоверное преимущество препарата Скайризи по сравнению с адалимумабом на неделе 16. У пациентов с недостаточным ответом на адалимумаб на неделе 16 (PASI 50 – <PASI 90) переключение на лечение препаратом Скайризи позволило достигнуть достоверно лучших результатов по параметрам sPGA 0, sPGA 0/1, PASI 90 и PASI 100 на неделе 44 по сравнению с продолжением терапии адалимумабом.
Показания для применения
- Препарат Скайризи показан для лечения бляшечного псориаза среднетяжелой и тяжелой степени у взрослых пациентов.
- Препарат Скайризи показан в качестве монотерапии или в комбинации с базисными противовоспалительными препаратами (БПВП) для лечения активного псориатического артрита у взрослых пациентов.
Противопоказания
- Тяжелые реакции гиперчувствительности к рисанкизумабу или к другим вспомогательным веществам препарата;
- Активная форма туберкулеза;
- Детский возраст до 18 лет (эффективность и безопасность не изучены).
С осторожностью
- Необходимо соблюдать осторожность при применении препарата Скайризи у пациентов с хроническими инфекциями или с наличием в анамнезе рецидивирующей инфекции.
- Не следует проводить вакцинацию живыми вакцинами на фоне терапии препаратом Скайризи. Отсутствуют данные об иммунном ответе на живые или инактивированные вакцины.
Применение при беременности и в период грудного вскармливания
Беременность
Данные о применении препарата Скайризи у беременных женщин ограничены. Полученных данных недостаточно для информирования о рисках, связанных с применением данного лекарственного препарата.
Данные, полученные в ходе исследований на животных
Проводилось расширенное исследование токсического воздействия на пре- и постнатальное развитие на яванских макаках. Каждую неделю с 20-го дня беременности до момента родоразрешения яванским макакам вводили подкожные инъекции рисанкизумаба в дозах 5 или 50 мг/кг. Дальнейшее наблюдение за самками и детенышами продолжалось в течение 6 месяцев (180 дней) после родоразрешения. Указанные дозы приводили к экспозиции, приблизительно в 70 раз превышающей клиническое воздействие при максимально рекомендуемой для человека дозе (МРДЧ). Не наблюдалось связанных с применением препарата случаев смерти и/или пороков развития плода/новорожденного. Влияние на рост и развитие новорожденного отсутствовало, оценка которого включала внешние, висцеральные, скелетные и нейроповеденческие параметры и конечные точки токсического воздействия на иммунную систему. У детенышей отмечалось дозозависимое повышение средней концентрации препарата в сыворотке крови, которая составляла около 20-90% от средней концентрации в организме самки. После родоразрешения у большинства взрослых самок яванских макак и всех детенышей в группах применения рисанкизумаба отмечалась определяемая концентрация рисанкизумаба в сыворотке крови в течение периода до 91 дня. Через 180 дней после родоразрешения концентрация рисанкизумаба в сыворотке крови была ниже определяемого уровня.
Период грудного вскармливания
Нет данных о проникновении рисанкизумаба в грудное молоко, о воздействии препарата на ребенка в период грудного вскармливания или на выработку молока. Учитывая то, что человеческий IgG выделяется в грудное молоко, опубликованные данные свидетельствуют о том, что антитела в грудном молоке не попадают в кровоток ребенка в значимых количествах.
Способ применения и дозы
Для подкожного введения.
Пациенты могут самостоятельно вводить препарат Скайризи после соответствующего обучения технике подкожных инъекций.
Пациентов следует проинформировать о том, что необходимо ввести 2 предварительно заполненных шприца для достижения дозы 150 мг и ознакомиться с инструкцией по применению перед введением препарата. Каждый предварительно заполненный шприц предназначен только для одноразового использования.
Инъекция каждой дозы должна производиться в разные анатомические участки (в область бедер или живота). Следует избегать чувствительных, поврежденных, эритематозных и уплотненных участков, а также участков, пораженных псориазом. Введение препарата Скайризи в верхнюю часть наружной поверхности плеча должно выполняться только лицом, осуществляющим уход за пациентом, или медицинским работником.
Перед проведением инъекции необходимо достать упаковку препарата Скайризи из холодильника и довести ее до комнатной температуры в течение 15-30 минут, избегая прямых солнечных лучей, не вынимая шприцы из коробки.
Любые неиспользованные лекарственные средства или отходы должны быть утилизированы в соответствии с местными требованиями.
Рекомендуемая доза
Рекомендуемая доза препарата Скайризи – 150 мг (в виде двух подкожных инъекций по 75 мг единовременно) на неделе 0, неделе 4 и далее каждые 12 недель.
Пропуск дозы
В случае пропуска дозы препарата Скайризи необходимо ввести дозу как можно скорее. Затем следует возобновить введение доз согласно установленному графику.
Особые группы пациентов
Дети
Отсутствуют данные по безопасности и эффективности применения препарата Скайризи у детей в возрасте до 18 лет.
Пациенты пожилого возраста
Коррекция дозы не требуется (см. раздел «Фармакологические свойства»).
Пациенты с нарушением функции почек ши печени
Не было проведено специальных исследований для определения влияния почечной или печеночной недостаточности на фармакокинетику препарата Скайризи. Данные состояния, как правило, не должны оказывать существенного влияния на фармакокинетику моноклональных антител. Коррекция дозы не требуется (см. раздел «Фармакологические свойства»).
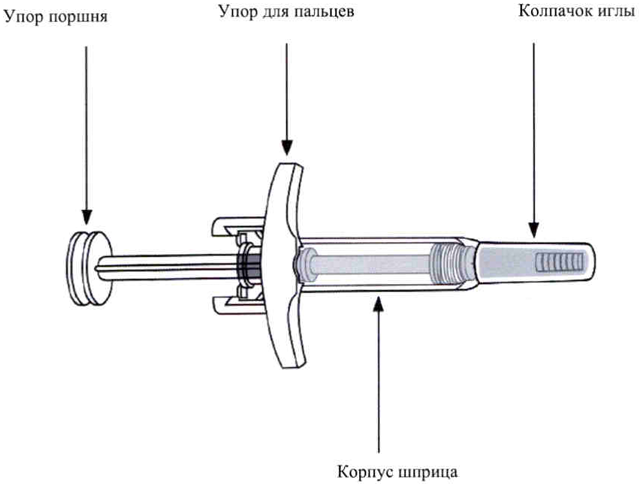
Инструкция по подготовке и проведению инъекции препарата Скайризи в однодозовом шприце

- Прежде чем проводить инъекцию, необходимо пройти обучение по введению препарата Скайризи. Для этого необходимо обратиться к лечащему врачу.
- Рекомендуется отмечать в своем календаре, когда Вам нужно вводить препарат Скайризи.
- До момента использования препарат Скайризи необходимо хранить в оригинальной упаковке в защищенном от света месте.
- Нельзя использовать препарат в случае:
— если раствор мутный и содержит крупные хлопья или частицы (раствор должен быть прозрачным или слегка желтоватым и может содержать небольшие полупрозрачные частицы); истечения срока годности;
— если препарат был заморожен (даже если впоследствии он был разморожен);
— падения или повреждения шприца;
— если защитная пленка блистера, где находятся шприцы, повреждена или отсутствует. - Не снимайте колпачок иглы до непосредственного введения инъекции.
- Перед проведением инъекции необходимо достать упаковку препарата Скайризи из холодильника и довести ее до комнатной температуры, для этого необходимо оставить шприц при комнатной температуре в течение 15-30 минут, избегая прямых солнечных лучей. Не вынимайте шприцы из картонной пачки до тех пор, пока не будете готовы выполнить инъекцию. Не нагревайте препарат Скайризи любым другим способом, например, в микроволновой печи или в горячей воде.
- Следуйте инструкциям, изложенным ниже, каждый раз, когда используете препарат Скайризи.
ШАГ 1

- 2 одноразовых шприца и 2 спиртовые салфетки;
- 2 ватных тампона или 2 марлевые салфетки;
- специальный контейнер для утилизации.
Вымойте и вытрите руки.
Начните с одного шприца для первой инъекции.
Для введения полной дозы требуется 2 инъекции, выполненные поочередно.
ШАГ 2

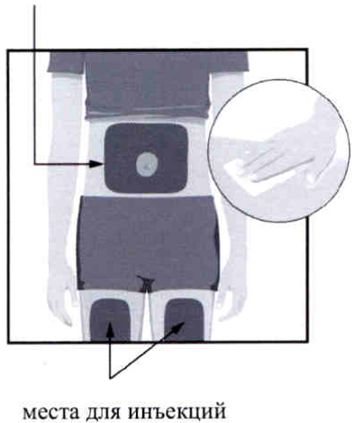
- передняя часть левого бедра;
- передняя часть правого бедра;
- нижняя часть живота, за исключением области вокруг пупка диаметром 5 см.
При выполнении второй инъекции следует отступать не менее чем на 3 см от области предыдущей инъекции.
НЕ вводите препарат в то же место.
Перед каждой инъекцией необходимо протирать место инъекции спиртовой салфеткой круговыми движениями.
- НЕ вводите препарат через одежду.
- НЕ вводите препарат в воспаленную, поврежденную кожу, в места с покраснениями и уплотнениями, а также в шрамы или растяжки.
- НЕ вводите препарат в места, пораженные псориазом.
ШАГ 3

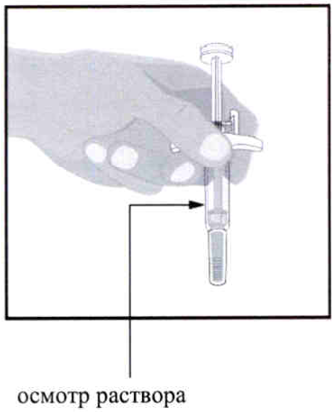
Осмотрите раствор в шприце.
- Наличие пузырьков в шприце является нормой.
- Раствор должен быть прозрачным или слегка желтым и может содержать мелкие белые или прозрачные частицы.
- НЕ вводите препарат, если раствор мутный и содержит крупные хлопья или частицы.
ШАГ 4

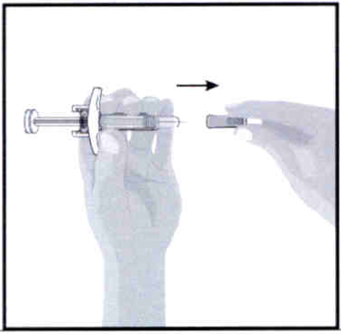
- Держите шприц в одной руке.
- Другой рукой аккуратно снимите колпачок иглы.
- Возможно на конце иглы появится капля жидкости. Это нормально.
- Выбросьте колпачок иглы.
- НЕ прикасайтесь к игле пальцами и не допускайте соприкосновения кончика иглы с какой-либо поверхностью.
ШАГ 5

Слегка сожмите подготовленное место инъекции другой рукой и крепко удерживайте его.
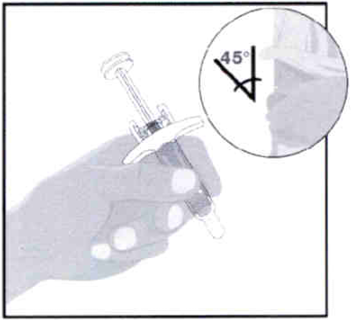
Быстрым движением полностью введите иглу в кожу под углом примерно 45°.
Удерживайте положение шприца под тем же углом.
ШАГ 6

Извлеките иглу из кожи под тем же углом, под которым производилось введение.
Медленно отведите большой палец от поршня. Игла закроется защитным колпачком.
- Защитный колпачок иглы не активируется, пока не будет введена вся жидкость
- Обратитесь к своему лечащему врачу, если считаете, что не ввели полную дозу
Прижмите ватный тампон или марлевую салфетку к месту инъекции в течение 10 секунд.
Не растирайте место введения после завершения инъекции. Может возникнуть небольшое кровотечение из места инъекции. Это нормально.
ШАГ 7

- Повторите шаги 2-6 со при введении второй инъекции
- После первой инъекции необходимо сразу сделать инъекцию вторым шприцом
ШАГ 8

- Не выбрасывайте использованные шприцы вместе с бытовыми отходами
- Ваш врач или медсестра расскажут вам, как вернуть специальный контейнер для полной утилизации.
Побочное действие
Опыт клинических исследований
В клинических исследованиях принимало участие 2234 пациентов с бляшечным псориазом, которым вводили препарат Скайризи (2167 пациенто-лет применения). Из всех участников 1208 пациентов с псориазом получали терапию препаратом Скайризи в течение не менее одного года.
Данные плацебо-контролируемых исследований и исследований с активным контролем были объединены для оценки безопасности применения препарата Скайризи в течение 16 недель. Всего были оценены результаты терапии 1306 пациентов в группе применения препарата Скайризи в дозе 150 мг. Серьезные нежелательные реакции были отмечены у 2,4% в группе применения препарата Скайризи (9,9 явлений на 100 пациенто-лет) по сравнению с 4,0% в группе плацебо (17,4 явления на 100 пациенто-лет), 5,0% в группе применения устекинумаба (18,4 явления на 100 пациенто-лет) и 3,0% для группы адалимумаба (14,7 явления на 100 пациенто-лет).
В таблице 1 приведены нежелательные реакции, отмеченные во время проведения клинических исследований с применением препарата Скайризи, которые были классифицированы в соответствии с классами систем органов MedDRA. Для оценки частоты использованы следующие критерии: очень часто (≥1/10); часто (≥1/100 до <1/10); нечасто (≥1/1000 до 1/100); редко (≥1/10000 до 1/1000); очень редко (<1/10000).
Таблица 1. Список нежелательных реакций, отмеченных в клинических исследованиях
| Класс систем органов | Частота развития | Нежелательные реакции |
| Инфекционные и паразитарные заболевания | Очень часто | Инфекции верхних дыхательных путейa |
| Часто | Дерматомикозb | |
| Нечасто | Фолликулит | |
| Нарушения со стороны нервной системы | Часто | Головная больc |
| Общие нарушения и реакции в месте введения | Часто | Утомляемостьd Реакция в месте введенияe |
| a Включает: инфекцию дыхательных путей (вирусная, бактериальная или неуточненная), синусит (в том числе острый), ринит, назофарингит, фарингит (в том числе вирусный), тонзиллит. b Включает: грибковое поражение кожи стоп, трихофитию промежности, дерматофитию туловища, отрубевидный лишай, грибковую инфекцию рук c Включает: головную боль, головную боль напряжения, синусовую головную боль d Включает: утомляемость, общую слабость. e Включает: синяк в месте инъекции, эритему, гематому, кровоизлияние, инфекцию, воспаление, раздражение, боль, зуд, кожную реакцию, отек |
Описание отдельных нежелательных реакций
Инфекции
Инфекции наблюдались у 22,1% пациентов, принимавших препарат Скайризи (90,8 случаев на 100 пациенто-лет), по сравнению с 14,7% в группе плацебо (56,5 случаев на 100 пациенто-лет), 20,9% в группе устекинумаба (87,0 случаев на 100 пациенто-лет) и 24,3% в группе адалимумаба (104,2 случаев на 100 пациенто-лет). Большинство нежелательных реакций были несерьезными, легкой или средней степени тяжести и не приводили к прекращению введения препарата Скайризи.
На протяжении всей программы исследований применения препарата при псориазе, учитывая длительное воздействие препарата Скайризи, частота инфекций (75,5 случаев на 100 пациенто-лет) была аналогична наблюдаемой в течение первых 16 недель терапии.
Профиль безопасности препарата Скайризи при длительном применении
На 52-й неделе терапии частота развития нежелательных реакций была аналогична профилю безопасности, наблюдаемому в течение первых 16 недель терапии. В течение 52 недель, скорректированная по объему применения частота развития серьезных нежелательных явлений на 100 пациенто-лет составляла 9,4 для пациентов, получавших препарат Скайризи, и 10,9 для пациентов, получавших устекинумаб. У пациентов, получавших терапию препаратом Скайризи в течение наиболее продолжительного периода времени (77 недель), не было выявлено новых нежелательных реакций по сравнению с первыми 16 неделями терапии.
Иммуногенность
Как и для всех терапевтических белков, введение рисанкизумаба может вызвать развитие иммуногенности. Обнаружение антител в значительной степени зависит от чувствительности и специфичности метода анализа. Кроме того, частота положительного результата на обнаружение антител (включая нейтрализующие антитела) может быть обусловлена влиянием нескольких факторов, таких как методология метода анализа, обработка образцов проб, время сбора проб, сопутствующая лекарственная терапия и сопутствующие заболевания. По этим причинам сравнение частоты выявления антител к рисанкизумабу с таковой в исследованиях других лекарственных препаратов может вводить в заблуждение.
В рамках клинических исследований применения препарата при псориазе было выявлено, что доля пациентов, получавших терапию в рекомендуемой клинической дозе в течение 52 недель и выработавших к препарату антитела и нейтрализующие антитела составила 24% (263/1079) и 14% (150/1079) соответственно.
Присутствие антител к рисанкизумабу, а также нейтрализующих антител не было связано с изменениями клинического ответа или безопасности применения препарата.
Передозировка
В случае передозировки рекомендуется наблюдение за пациентами на предмет выявления признаков и симптомов нежелательных реакций. При необходимости следует незамедлительно провести симптоматическую терапию.
Взаимодействие с другими лекарственными средствами
Препарат Скайризи не подвергается почечной элиминации или метаболизму печеночными ферментами. Не выявлено лекарственного взаимодействия между препаратом Скайризи и ингибиторами/индукторами ферментов, матаболизирующих препарат.
Согласно результатам исследования лекарственных взаимодействий у пациентов с бляшечный псориазом и результатам популяционного фармакокинетического анализа рисанкизумаб не вызывал лекарственных взаимодействий или не подвергался им (см. раздел «Фармакологические свойства»).
При одновременном введении рисанкизумаба и субстратов цитохрома Р450 коррекция дозы не требуется.
Особые указания
Инфекции
Применение препарата Скайризи может повышать риск развития инфекций.
Следует соблюдать осторожность при применении препарата Скайризи у пациентов с хроническими инфекциями или с наличием в анамнезе рецидивирующей инфекции.
Пациенты должны быть проинформированы о необходимости обращения к врачу в случае появления признаков и симптомов, предполагающих развитие инфекции. Необходимо тщательно контролировать состояние пациента, у которого развивается инфекция или который не отвечает на стандартную терапию. Терапию препаратом Скайризи не следует проводить до тех пор, пока не исчезнут клинические симптомы инфекционного заболевания.
Туберкулез
На протяжении клинических исследований III фазы 72-ум пациентам с псориазом и латентной формой туберкулеза одновременно проводилась терапия препаратом Скайризи и была назначена соответствующая профилактическая терапия туберкулеза, при этом, в течение среднего периода наблюдения (61 неделя) ни у одного пациента не развился активный туберкулез. Пациентам с латентным туберкулезом следует провести противотуберкулезную терапию до начала терапии препаратом Скайризи.
Не следует назначать терапию препаратом Скайризи пациентам с активной формой туберкулеза.
Вакцинация
Перед началом терапии препаратом Скайризи необходимо провести соответствующую возрасту вакцинацию согласно действующим рекомендациям по иммунопрофилактике. Не следует проводить иммунизацию живыми вакцинами в ходе лечения препаратом Скайризи. Отсутствуют данные об иммунном ответе на живые или инактивированные вакцины.
Влияние на способность управлять транспортными средствами, механизмами
Препарат Скайризи не оказывает влияния или оказывает незначительное влияние на способность к вождению транспортных средств и управлению механизмами.
Форма выпуска
Раствор для подкожного введения 75 мг/0,83 мл.
По 0,83 мл в однодозовые шприцы из бесцветного стекла типа I.
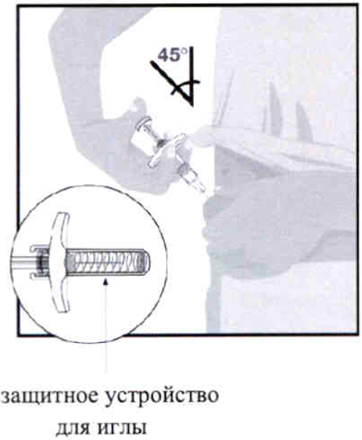
Шприцы оснащены защитным устройством для иглы.
По 1 шприцу в блистере из пластика и бумаги.
По 2 блистера и 2 салфетки, пропитанные изопропиловым спиртом, вместе с инструкцией по применению в пачке картонной или по 2 блистера вместе с инструкцией по применению в пачке картонной.
Срок годности
2 года.
Не применять после истечения срока годности, указанного на упаковке.
Условия хранения
При температуре от 2 до 8 °С в оригинальной упаковке для защиты от света.
Не замораживать.
Хранить в местах, недоступных для детей.
Условия отпуска
Отпускают по рецепту.
Производитель
Производитель готовой лекарственной формы, фасовщик (первичная упаковка)
Берингер Ингельхайм Фарма ГмбХ и Ко.КГ / Boehringer Ingelheim Pharma Gmbh & Co.KG
Биркендорфер Штрассе 65, 88397 Биберах-на-Риссе, Германия / Birkendorfer Str. 65, 88397 Biberach a.d.R, Germany
Упаковщик (вторичная упаковка), выпускающий контроль качества
ЭббВи С.Р.Л./ Abb Vie S.R.L.
С.Р. 148 Понтина 52 км с.н.к. – 04011 Камповерде ди Априлиа (ЛТ), Италия / S.R. 148 Pontina 52 km s.n.c. – 04011 Campoverde di Aprilia (LT), Italy
Владелец регистрационного удостоверения / Организация, принимающая претензии от потребителей:
ООО «ЭббВи», Россия
125196, г. Москва, ул. Лесная, д.7, БЦ «Белые Сады», здание «А»
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Описание препарата Скайризи (раствор для подкожного введения, 75 мг/0.83 мл) основано на официальной инструкции, утверждено компанией-производителем в 2022 году
Дата согласования: 18.04.2022
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Отзывы
Фотографии упаковок

18.04.2022
Действующее вещество
ATX
Фармакологическая группа
Состав
| Раствор для п/к введения | 0,83 мл |
| действующее вещество: | |
| рисанкизумаб | 75 мг |
| вспомогательные вещества: сорбитол; натрия сукцинат гексагидрат; янтарная кислота; полисорбат 20; вода для инъекций |
Описание лекарственной формы
Раствор для п/к введения: прозрачный или слегка опалесцирующий, бесцветный или слегка желтоватый. Допускается наличие небольших полупрозрачных аморфных белковых включений.
Фармакологическое действие
Фармакологическое действие
—
иммунодепрессивное, противовоспалительное.
Фармакодинамика
Механизм действия
Рисанкизумаб — это гуманизированное моноклональное антитело IgG1, которое селективно и с высокой аффинностью связывается с субъединицей p19 цитокина ИЛ-23 человека и ингибирует его взаимодействие с рецептором ИЛ-23. ИЛ-23 — это естественный цитокин, участвующий в воспалительном и иммунном ответе. ИЛ-23 способствует образованию, поддержанию числа и активации Th17-лимфоцитов, которые вырабатывают ИЛ-17A, ИЛ-17F и ИЛ-22, а также другие провоспалительные цитокины и играют важную роль в патогенезе аутоиммунных заболеваний, в частности псориаза. У пациентов с бляшечным псориазом уровень ИЛ-23 повышен в пораженной заболеванием коже. Предотвращая связывание ИЛ-23 с его рецептором, рисанкизумаб ингибирует сигнальный путь и высвобождение провоспалительных цитокинов.
Рисанкизумаб не связывается с человеческим ИЛ-12, который имеет общую с ИЛ-23 субъединицу p40.
Согласно данным исследования, однократное введение рисанкизумаба пациентам с псориазом приводит к снижению в коже экспрессии генов, связанных с иммунной осью ИЛ-23/ИЛ-17. В псориатических поражениях также наблюдалось уменьшение толщины эпидермиса, воспалительной инфильтрации и экспрессии маркеров псориаза.
В исследовании с участием пациентов с псориатическим артритом после терапии рисанкизумабом в дозе 150 мг п/к (на неделе 0, неделе 4 и затем каждые 12 нед) на 24 нед наблюдалось статистически и клинически значимое снижение уровня биомаркеров, связанных с ИЛ-23 и ИЛ-17, включая сывороточные ИЛ-17А, ИЛ-17Р и ИЛ-22, по сравнению с исходным уровнем.
Краткая информация о клинических исследованиях
Бляшечный псориаз. Эффективность и безопасность препарата Скайризи изучалась у 2109 пациентов со среднетяжелым и тяжелым псориазом (статичная общая оценка врачом sPGA≥3 и индекс тяжести и площади поражения PASI≥12) в 4 многоцентровых рандомизированных двойных слепых исследованиях (ULTIMMA-1, ULTIMMA-2, IMMHANCE and IMMVENT). У 9,8% пациентов отмечался сопутствующий псориатический артрит в анамнезе; 42,1% — до включения в исследование получали лечение другим биологическим препаратом. В исследованиях ULTIMMA-1 и ULTIMMA-2 по всем первичным и вторичным конечным точкам (статичная общая оценка врачом «чисто» или «почти чисто» (sPGA 0/1), статичная общая оценка врачом «чисто» (sPGA 0), PASI 75, PASI 90 и PASI 100) отмечалось статистически достоверное преимущество препарата Скайризи по сравнению с плацебо и устекинумабом на неделях 16 и 52. Улучшение на фоне лечения препаратом Скайризи также наблюдалось со стороны псориаза волосистой части головы, ногтей, ладоней и стоп.
Среди пациентов, достигших sPGA 0/1 на неделе 28 в исследовании IMMHANCE, 87,4% поддерживали ответ к неделе 52 при непрерывной терапии препаратом Скайризи по сравнению с 61,3%, кто получил последнюю дозу препарата на неделе 16 (рерандомизация на неделе 28). Среди пациентов, достигших полного или почти полного очищения кожи по оценке (sPGA) на неделе 28, у которых отмечалась потеря ответа (sPGA≥3) после прекращения приема препарата Скайризи, 83,7% (128/153) восстановили ответ sPGA «чисто» или «почти чисто» после 16 нед повторной терапии препаратом Скайризи.
В исследовании IMMVENT по конечным точкам sPGA 0/1, PASI 75, PASI 90 и PASI 100 отмечалось статистически достоверное преимущество препарата Скайризи по сравнению с адалимумабом на неделе 16. У пациентов с недостаточным ответом на адалимумаб на неделе 16 (PASI 50–90) переключение на лечение препаратом Скайризи позволило достигнуть достоверно лучших результатов по параметрам sPGA 0, sPGA 0/1, PASI 90 и PASI 100 на неделе 44 по сравнению с продолжением терапии адалимумабом.
Псориатический артрит. Эффективность и безопасность препарата Скайризи изучалась у 1407 пациентов в двух рандомизированных двойных слепых плацебо-контролируемых исследованиях с участием пациентов 18 лет и старше с активным псориатическим артритом (исследования KEEPSAKE1 и KEEPSAKE2). Пациенты, участвующие в данных исследованиях, имели диагноз псориатический артрит в течение периода не менее 6 мес на основании критериев классификации псориатического артрита (CASPAR). У пациентов исходно отмечалось: средняя продолжительность заболевания псориатическим артритом составляла 4,9 года, ≥5 болезненных и ≥5 припухших суставов, а также активный бляшечный псориаз или псориаз ногтей. У 55,9% пациентов отмечалось ≥3% площади поражения кожи бляшечным псориазом. У 63,4 и 27,9% пациентов наблюдался энтезит и дактилит соответственно. В исследовании KEEPSAKE1, где дополнительно оценивался псориаз ногтей, у 67,3% пациентов наблюдался псориаз ногтей. Псориатический спондилит был зарегистрирован у 19,6 и 19,6% пациентов в исследованиях KEEPSAKE1 и KEEPSAKE2 соответственно. В KEEPSAKE1 все пациенты ранее имели неадекватный ответ или непереносимость базисных противовоспалительных препаратов (БПВП) и не получали до включения в исследование биологическую терапию. В исследовании KEEPSAKE2 46,5% пациентов ранее имели неадекватный ответ или непереносимость биологической терапии. 59,6% пациентов из обоих исследований получали сопутствующую терапию метотрексатом, 11,6% получали сопутствующую терапию другими БПВП и 28,9% получали монотерапию препаратом Скайризи.
В обоих исследованиях терапия препаратом Скайризи привела к значительному улучшению показателей активности заболевания (достижение клинических ответов ACR 20/50/70 и минимальной активности заболевания) по сравнению с плацебо на неделе 24. Эффективность препарата наступала быстро по всем критериям с более высокими ответами на терапию, наблюдаемыми уже на неделе 4 для ACR20, по сравнению с плацебо. Терапия препаратом Скайризи привела к статистически значимому улучшению показателей в лечении дактилита и энтезита у пациентов с ранее диагностированным дактилитом или энтезитом. Достижение ACR 20/50/70, минимальной активности заболевания, улучшение дактилита и энтезита сохранялось вплоть до недели 52. В обоих исследованиях наблюдались аналогичные ответы независимо от сопутствующей терапии БПВП, количества ранее применявшихся БПВП, возраста, пола, расы и ИМТ. В исследовании KEEPSAKE2 ответы на лечение наблюдались независимо от предшествующей биологической терапии.
В обоих исследованиях доля пациентов, достигших ответа PsARC (Psoriatic Arthritis Response Criteria) на неделе 24, была выше среди пациентов, получавших терапию препаратом Скайризи, по сравнению с плацебо. Кроме того, в обоих исследованиях пациенты, получавшие препарат Скайризи, достигли большего улучшения показателя активности заболевания при использовании индекса DAS28-СРБ по сравнению с плацебо на неделе 24. Улучшения сохранялись до недели 52 для PsARC и DAS28-СРБ в обоих исследованиях. В обоих исследованиях были показаны улучшения по всем компонентам оценок ACR, включая оценку боли пациентом. По данным модифицированного индекса тяжести псориаза ногтей (mNAPSI) и 5-балльной глобальной оценки тяжести поражения ногтей на пальцах рук (PGA-F) терапия препаратом Скайризи привела к статистически значимому улучшению псориаза ногтей у пациентов, имеющих соответствующие проявления исходно (67,3%) в исследовании KEEPSAKE1. Данное улучшение сохранялось вплоть до недели 52.
В исследовании KEEPSAKE1 ингибирование прогрессирования структурных повреждений оценивалось рентгенологически и выражалось как изменение модифицированной общей шкалы Шарпа (mTSS) на неделе 24 по сравнению с исходным уровнем. При применении препарата Скайризи отмечалось численно более низкое среднее прогрессирование структурных повреждений на неделе 24 по сравнению с плацебо (средний балл mTSS составлял 0,23 в группе Скайризи по сравнению с 0,32 в группе плацебо (статистически недостоверно). Доля пациентов без рентгенологического прогрессирования (определяемого как изменение по сравнению с исходным уровнем mTSS≤0) была выше в группе Скайризи (92,4%) по сравнению с плацебо (87,7%) на неделе 24 (номинальное значение р = 0,016).
У пациентов, получавших терапию препаратом Скайризи, наблюдалось статистически значимое улучшение физической функции по сравнению с исходным уровнем по оценке HAQ-DI на неделе 24 по сравнению с плацебо. Улучшения сохранялись до недели 52. На неделе 24 у пациентов, получавших терапию препаратом Скайризи, также наблюдались значительные улучшения в сводных оценках физического компонента шкалы качества жизни SF-36 V2 и в оценке утомляемости по шкале FACIT по сравнению с пациентами, получавшими плацебо. Улучшения сохранялись до недели 52. У пациентов с псориатическим спондилитом, которые получали терапию препаратом Скайризи, наблюдались улучшения по сравнению с исходным уровнем в показателях индекса активности анкилозирующего спондилита (BASDAI) и активности заболевания анкилозирующим спондилитом (ASDAS) по сравнению с плацебо на неделе 24. Улучшения сохранялись до недели 52.
Фармакокинетика
Фармакокинетика рисанкизумаба схожа у пациентов с бляшечным псориазом и пациентов с псориатическим артритом.
Всасывание. Рисанкизумаб характеризуется линейной фармакокинетикой с дозозависимым повышением экспозиции в диапазоне доз от 18 до 300 мг и от 0,25 до 1 мг/кг при п/к введении, а также от 200 до 1200 мг и от 0,01 до 5 мг/кг при в/в введении.
После п/к введения рисанкизумаба Cmax в плазме была достигнута через 3–14 дней, предполагаемая абсолютная биодоступность составила 89%. Подсчитано, что средняя Css и остаточная концентрация препарата в плазме крови составляют 12 и 2 пг/мл соответственно при следующем режиме введения пациентам с псориазом: 150 мг на неделе 0; 4 и каждые 12 нед после этого.
Распределение. У типичного пациента с псориазом и массой тела 90 кг Vss составляет 11,2 л, что указывает на то, что распределение рисанкизумаба в основном ограничивается сосудистым и интерстициальным пространством.
Метаболизм. Терапевтические моноклональные антитела IgG обычно разлагаются на мелкие пептиды и аминокислоты в результате катаболизма подобно эндогенным IgG. Рисанкизумаб не метаболизируется ферментами цитохрома Р450.
Выведение. Для типичного пациента с псориазом и массой тела 90 кг системный клиренс рисанкизумаба составляет 0,31 л/день, а терминальный T1/2 — 28 дней.
Поскольку рисанкизумаб является моноклональным антителом IgG1, не предполагается, что рисанкизумаб подвергается КФ или выделяется с мочой в виде интактной молекулы.
Исследование лекарственных взаимодействий проводилось у пациентов с бляшечным псориазом для оценки влияния многократного введения рисанкизумаба на фармакокинетику маркерных субстратов, чувствительных к CYP. Экспозиция кофеина (субстрат CYP1A2), варфарина (субстрат CYP2C9), омепразола (субстрат CYP2C19), метопролола (субстрат CYP2D6) и мидазолама (субстрат CYP3A) при введении рисанкизумаба была сопоставима с их экспозицией до введения рисанкизумаба. Это указывает на отсутствие клинически значимых лекарственных взаимодействий с помощью данных ферментов.
Результаты популяционного фармакокинетического анализа показали, что на экспозицию рисанкизумаба не влияли сопутствующие препараты (метформин, аторвастатин, лизиноприл, амлодипин, ибупрофен, ацетилсалицилат и левотироксин), которые использовали некоторые пациенты с бляшечным псориазом во время клинических исследований. Аналогичная ситуация наблюдалась при псориатическом артрите на основании результатов популяционного фармакокинетического анализа (см. «Взаимодействие»).
Особые группы пациентов
Дети. Фармакокинетика рисанкизумаба у детей не изучалась.
Пожилые пациенты. Из 2234 пациентов с бляшечным псориазом, получавших терапию препаратом Скайризи, 243 пациента были старше 65 лет, а 24 пациента — старше 75 лет. В целом не было выявлено различий в безопасности и эффективности терапии препаратом Скайризи между пациентами старшего и более молодого возраста (см. «Способ применения и дозы»).
Пациенты с нарушением функции почек или печени. Специальные исследования для определения влияния почечной или печеночной недостаточности на фармакокинетику рисанкизумаба не проводились. Согласно данным популяционного фармакокинетического анализа, уровни креатинина в сыворотке крови, Cl креатинина или маркеры функции печени (АЛТ/АСТ/билирубин) не оказывали значимого влияния на клиренс рисанкизумаба у пациентов с псориазом или с псориатическим артритом.
Поскольку рисанкизумаб является моноклональным антителом IgG1, в основном он выводится при внутриклеточном катаболизме. Ожидается, что рисанкизумаб не подвергается метаболизму с помощью CYP или элиминации почками (см. «Способ применения и дозы»).
Масса тела. Клиренс рисанкизумаба и Vd увеличиваются в зависимости от увеличения массы тела. Однако клинически значимые изменения параметров эффективности и безопасности рисанкизумаба при увеличении массы тела не наблюдались, поэтому коррекция дозы на основании массы тела не требуется.
Пол, раса. Пол, раса не оказывали клинически значимого влияния на клиренс рисанкизумаба у взрослых пациентов с бляшечным псориазом или с псориатическим артритом. Согласно данным клинического исследования по изучению фармакокинетики, у пациентов из Китая и Японии не наблюдались клинически значимые различия концентраций рисанкизумаба в плазме крови по сравнению с пациентами европеоидной расы.
Показания
бляшечный псориаз среднетяжелой и тяжелой степени у взрослых пациентов;
в качестве монотерапии или в комбинации с базисными противовоспалительными препаратами для лечения активного псориатического артрита у взрослых пациентов.
Противопоказания
тяжелые реакции гиперчувствительности к рисанкизумабу или вспомогательным веществам препарата;
активная форма туберкулеза;
возраст до 18 лет (эффективность и безопасность не изучены).
С осторожностью: пациенты с хроническими инфекциями или наличием в анамнезе рецидивирующей инфекции. Не следует проводить вакцинацию живыми вакцинами на фоне терапии препаратом Скайризи (отсутствуют данные об иммунном ответе на живые или инактивированные вакцины).
Применение при беременности и кормлении грудью
Беременность
Данные о применении препарата Скайризи у беременных женщин ограничены. Полученных данных недостаточно для информирования о рисках, связанных с применением лекарственного препарата Скайризи у беременных женщин.
Данные, полученные в ходе исследований на животных. Проводилось расширенное исследование токсического воздействия на пре- и постнатальное развитие на яванских макаках. Каждую неделю с 20-го дня беременности до момента родоразрешения яванским макакам вводили п/к инъекции рисанкизумаба в дозах 5 или 50 мг/кг. Дальнейшее наблюдение за самками и детенышами продолжалось в течение 6 мес (180 дней) после родоразрешения. Указанные дозы приводили к экспозиции, приблизительно в 70 раз превышающей клиническое воздействие при МРДЧ. Не наблюдалось связанных с применением препарата случаев смерти и/или пороков развития плода/новорожденного. Влияние на рост и развитие новорожденного отсутствовало, оценка включала внешние, висцеральные, скелетные и нейроповеденческие параметры и конечные точки токсического воздействия на иммунную систему. У детенышей отмечалось дозозависимое повышение средней концентрации препарата в сыворотке крови, которая составляла около 20–90% от средней концентрации в организме самки. После родоразрешения у большинства взрослых самок яванских макак и всех детенышей в группах применения рисанкизумаба отмечалась определяемая концентрация рисанкизумаба в сыворотке крови в течение периода до 91 дня. Через 180 дней после родоразрешения концентрация рисанкизумаба в сыворотке крови была ниже определяемого уровня.
Период грудного вскармливания
Нет данных о проникновении рисанкизумаба в грудное молоко, о воздействии препарата на ребенка в период грудного вскармливания или на выработку молока. Несмотря на то, что человеческий IgG выделяется в грудное молоко, опубликованные данные свидетельствуют о том, что антитела в грудном молоке не попадают в кровоток ребенка в значимых количествах.
Способ применения и дозы
П/к.
Пациенты могут самостоятельно вводить препарат Скайризи после соответствующего обучения технике п/к инъекций.
Пациентов следует проинформировать о том, что необходимо ввести 2 предварительно заполненных шприца для достижения дозы 150 мг и ознакомиться с инструкцией по применению перед введением препарата. Каждый предварительно заполненный шприц предназначен только для одноразового использования.
Инъекция каждой дозы должна производиться в разные анатомические участки (в область бедер или живота). Следует избегать чувствительных, поврежденных, эритематозных и уплотненных участков, а также участков, пораженных псориазом. Введение препарата Скайризи в верхнюю часть наружной поверхности плеча должно выполняться только лицом, осуществляющим уход за пациентом, или медицинским работником.
Перед проведением инъекции необходимо достать упаковку препарата Скайризи из холодильника и довести ее до комнатной температуры в течение 15–30 мин, избегая прямых солнечных лучей, не вынимая шприцы из коробки.
Неиспользованные ЛС или отходы должны быть утилизированы в соответствии с местными требованиями.
Рекомендуемый режим дозирования
Бляшечный псориаз. Рекомендуемая доза препарата Скайризи — 150 мг (в виде 2 п/к инъекций по 75 мг единовременно) на неделе 0; 4 и далее каждые 12 нед.
Следует рассмотреть возможность прекращения терапии у пациентов, не достигающих ответа на терапию в период свыше 16 нед. У некоторых пациентов с первоначальным частичным ответом впоследствии могут улучшиться результаты при продолжении терапии более 16 нед.
Псориатический артрит. Рекомендуемая доза препарата Скайризи — 150 мг (в виде двух п/к инъекций по 75 мг единовременно) на неделе 0; 4 и далее каждые 12 нед. Препарат Скайризи может применяться в качестве монотерапии или в комбинации с БПВП.
Пропуск дозы
В случае пропуска дозы препарата Скайризи необходимо ввести дозу как можно скорее. Затем следует возобновить введение доз согласно установленному графику.
Особые группы пациентов
Дети. Отсутствуют данные по безопасности и эффективности применения препарата Скайризи у детей до 18 лет.
Пациенты пожилого возраста. Коррекция дозы не требуется (см. «Фармакокинетика»).
Пациенты с нарушением функции почек или печени. Не было проведено специальных исследований для определения влияния почечной или печеночной недостаточности на фармакокинетику препарата Скайризи. Данные состояния, как правило, не должны оказывать существенного влияния на фармакокинетику моноклональных антител. Коррекция дозы не требуется (см. «Фармакокинетика»).
Инструкция по подготовке и проведению инъекции препарата Скайризи в однодозовом шприце
Перед проведением инъекции препарата Скайризи необходимо обязательно ознакомиться с указанной ниже информацией.
Прежде чем проводить инъекцию, необходимо пройти обучение по введению препарата Скайризи. Для этого необходимо обратиться к лечащему врачу.
Рекомендуется отмечать в календаре, когда нужно вводить препарат Скайризи.
До момента использования препарат Скайризи необходимо хранить в оригинальной упаковке в защищенном от света месте.
Нельзя использовать препарат в следующих случаях: если раствор мутный и содержит крупные хлопья или частицы (раствор должен быть прозрачным или слегка желтоватым и может содержать небольшие полупрозрачные частицы); истек срок годности; если препарат был заморожен (даже если впоследствии он был разморожен); при падении или повреждении шприца; если защитная пленка блистера, где находятся шприцы, повреждена или отсутствует (необходимо вернуть лекарственный препарат в аптеку).
Не следует снимать колпачок иглы до непосредственного проведения инъекции.
Перед проведением инъекции необходимо достать упаковку препарата Скайризи из холодильника и довести ее до комнатной температуры, для этого необходимо оставить шприц при комнатной температуре в течение 15–30 мин, избегая прямых солнечных лучей. Не вынимать шприцы из картонной пачки до тех пор, пока пациент не будет готов выполнить инъекцию. Не нагревать препарат Скайризи любым другим способом, например в микроволновой печи или горячей воде.
Необходимо следовать инструкциям, изложенным ниже, при каждом использовании препарата Скайризи.
Шаг 1. Поместить следующие предметы на чистую плоскую поверхность: 2 одноразовых шприца и 2 спиртовые салфетки; 2 ватных тампона или 2 марлевые салфетки; специальный контейнер для утилизации.
Вымыть и вытереть руки. Начать с одного шприца для первой инъекции.
Для введения полной дозы требуется 2 инъекции, выполненные поочередно.
Шаг 2. Выбрать 1 из 3 мест для инъекции: передняя часть левого бедра; передняя часть правого бедра; нижняя часть живота, за исключением области вокруг пупка диаметром 5 см. При выполнении второй инъекции следует отступать не менее чем на 3 см от места предыдущей инъекции. Не вводить препарат в то же место.
Перед каждой инъекцией необходимо протирать место инъекции спиртовой салфеткой круговыми движениями.
Не вводить препарат через одежду, в воспаленную, поврежденную кожу, в места с покраснениями и уплотнениями, а также в шрамы или растяжки, в места, пораженные псориазом.
Шаг 3. Следует держать шприц закрытой иглой вниз, как показано на рисунке.
Осмотреть раствор в шприце. Наличие пузырьков в шприце является нормой. Раствор должен быть прозрачным или слегка желтым и может содержать мелкие белые или прозрачные частицы.
Не вводить препарат, если раствор мутный и содержит крупные хлопья или частицы.
Шаг 4. Держа шприц в одной руке, другой рукой аккуратно снять колпачок иглы. Возможно, на конце иглы появится капля жидкости. Это нормально. Выбросить колпачок иглы.
Не прикасаться к игле пальцами и не допускать соприкосновения кончика иглы с какой-либо поверхностью.
Шаг 5. Держать корпус шприца одной рукой между большим и указательным пальцем, как карандаш. Слегка сжать подготовленное место инъекции другой рукой и крепко удерживать его. Быстрым движением полностью ввести иглу в кожу под углом примерно 45°. Удерживать положение шприца под тем же углом.
Шаг 6. Медленно нажимать на поршень, пока весь раствор не будет введен. Извлечь иглу из кожи под тем же углом, под которым проводилось введение. Медленно отвести большой палец от поршня. Игла закроется защитным устройством. Защитное устройство иглы не активируется, пока не будет введена вся жидкость. Следует обратиться к своему лечащему врачу, если есть подозрение, что не введена полная доза. Прижимать ватный тампон или марлевую салфетку к месту инъекции в течение 10 с.
Не растирать место введения после завершения инъекции. Может возникнуть небольшое кровотечение из места инъекции. Это нормально.
Шаг 7. Для введения полной дозы требуется 2 инъекции, выполненные поочередно. Повторить шаги 2–6 при введении второй инъекции. После первой инъекции необходимо сразу сделать инъекцию вторым шприцом.
Шаг 8. Поместить использованные шприцы в специальный контейнер для утилизации.
Не выбрасывать использованные шприцы вместе с бытовыми отходами.
Лечащий врач или медсестра должны проинформировать пациента, как вернуть специальный контейнер для полной утилизации.
Побочные действия
Опыт клинических исследований
Бляшечный псориаз
В клинических исследованиях принимало участие 2234 пациента с бляшечным псориазом, которым вводили препарат Скайризи (2167 пациенто-лет применения). Из всех участников 1208 пациентов с псориазом получали терапию препаратом Скайризи в течение не менее 1 года.
Данные плацебо-контролируемых исследований и исследований с активным контролем были объединены для оценки безопасности применения препарата Скайризи в течение 16 нед. Всего были оценены результаты терапии 1306 пациентов в группе применения препарата Скайризи в дозе 150 мг. Серьезные нежелательные реакции были отмечены у 2,4% в группе применения препарата Скайризи (9,9 явления на 100 пациенто-лет) по сравнению с 4,0% в группе плацебо (17,4 явления на 100 пациенто-лет), 5,0% в группе применения устекинумаба (18,4 явления на 100 пациенто-лет) и 3,0% для группы адалимумаба (14,7 явления на 100 пациенто-лет).
В таблице 1 приведены нежелательные реакции, отмеченные во время проведения клинических исследований с применением препарата Скайризи, которые были классифицированы в соответствии с классами систем органов MedDRA. Для оценки частоты использованы следующие критерии: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000).
Таблица 1
Список нежелательных реакций, отмеченных в клинических исследованиях
| Класс систем органов | Частота развития | Нежелательные реакции |
| Инфекционные и паразитарные заболевания | Очень часто | Инфекции верхних дыхательных путейa |
| Часто | Дерматомикозb | |
| Нечасто | Фолликулит | |
| Со стороны нервной системы | Часто | Головная больc |
| Общие нарушения и реакции в месте введения | Часто | Утомляемостьd, реакция в месте введенияe |
aВключает инфекцию дыхательных путей (вирусная, бактериальная или неуточненная), синусит (в т.ч. острый), ринит, назофарингит, фарингит (в т.ч. вирусный), тонзиллит.
bВключает трихофитию кистей, стоп, промежности, дерматофитию туловища, отрубевидный лишай, онихомикоз.
cВключает головную боль, головную боль напряжения, синусовую головную боль.
dВключает утомляемость, общую слабость.
eВключает синяк в месте инъекции, эритему, гематому, геморрагию, раздражение кожи, боль, зуд, кожную реакцию, отек.
Описание отдельных нежелательных реакций
Инфекции. Инфекции наблюдались у 22,1% пациентов, принимавших препарат Скайризи (90,8 случая на 100 пациенто-лет), по сравнению с 14,7% в группе плацебо (56,5 случая на 100 пациенто-лет), 20,9% в группе устекинумаба (87,0 случая на 100 пациенто-лет) и 24,3% в группе адалимумаба (104,2 случая 100 пациенто-лет). Большинство нежелательных реакций были несерьезными, легкой или средней степени тяжести и не приводили к прекращению введения препарата Скайризи.
На протяжении всей программы исследований применения препарата при псориазе, учитывая длительное воздействие препарата Скайризи, частота инфекций (75,5 случая на 100 пациенто-лет) была аналогична наблюдаемой в течение первых 16 нед терапии.
Профиль безопасности препарата Скайризи при длительном применении
На 52-й нед терапии частота развития нежелательных реакций была аналогична профилю безопасности, наблюдаемому в течение первых 16 нед терапии. В течение 52 нед скорректированная по объему применения частота развития серьезных нежелательных явлений на 100 пациенто-лет составляла 9,4 для пациентов, получавших препарат Скайризи, и 10,9 для пациентов, получавших устекинумаб. У пациентов, получавших терапию препаратом Скайризи в течение наиболее продолжительного периода времени (77 нед), не было выявлено новых нежелательных реакций по сравнению с первыми 16 нед терапии.
Псориатический артрит
В целом профиль безопасности, наблюдаемый у пациентов с псориатическим артритом, получавших препарат Скайризи, соответствовал профилю безопасности, наблюдаемому у пациентов с бляшечным псориазом.
Иммуногенность
Как и для всех терапевтических белков, введение рисанкизумаба может вызвать развитие иммуногенности. Обнаружение антител в значительной степени зависит от чувствительности и специфичности метода анализа. Кроме того, частота положительного результата на обнаружение антител (включая нейтрализующие антитела) может быть обусловлена влиянием нескольких факторов, таких как метод анализа, обработка образцов проб, время сбора проб, сопутствующая лекарственная терапия и сопутствующие заболевания. По этим причинам сравнение частоты выявления антител к рисанкизумабу с таковой в исследованиях других лекарственных препаратов может вводить в заблуждение.
Бляшечный псориаз
В рамках клинических исследований применения препарата при псориазе было выявлено, что доля пациентов, получавших терапию в рекомендуемой клинической дозе в течение 52 нед и выработавших к препарату антитела и нейтрализующие антитела, составила 24% (263/1079) и 14% (150/1079) соответственно.
Присутствие антител к рисанкизумабу, а также нейтрализующих антител не было связано с изменениями клинического ответа или безопасности применения препарата.
Псориатический артрит
В клинических исследованиях у пациентов с псориатическим артритом, получавших препарат Скайризи в рекомендованной дозе вплоть до 28 нед, были обнаружены появившиеся за время лечения антитела к лекарственному препарату и нейтрализующие антитела у 12,1% (79/652) и 0% (0/652) пациентов соответственно. Антитела к рисанкизумабу, включая нейтрализующие антитела, не были связаны с изменениями клинического ответа или безопасности.
Взаимодействие
Препарат Скайризи не подвергается почечной элиминации или метаболизму печеночными ферментами. Не выявлено лекарственного взаимодействия между препаратом Скайризи и ингибиторами/индукторами ферментов, матаболизирующих препарат.
Согласно результатам исследования лекарственных взаимодействий у пациентов с бляшечным псориазом и результатам популяционного фармакокинетического анализа у пациентов с бляшечным псориазом и псориатическим артритом, рисанкизумаб не вызывал лекарственных взаимодействий или не подвергался им (см. «Фармакокинетика»).
При одновременном введении рисанкизумаба и субстратов цитохрома P450 коррекция дозы не требуется.
Передозировка
Симптомы: в случае передозировки рекомендуется наблюдение за пациентами на предмет выявления признаков и симптомов нежелательных реакций.
Лечение: при необходимости следует незамедлительно провести симптоматическую терапию.
Особые указания
Инфекции. Применение препарата Скайризи может повышать риск развития инфекций.
Следует соблюдать осторожность при применении препарата Скайризи у пациентов с хроническими инфекциями или с наличием в анамнезе рецидивирующей инфекции. Пациенты должны быть проинформированы о необходимости обращения к врачу в случае появления признаков и симптомов, предполагающих развитие инфекции. Необходимо тщательно контролировать состояние пациента, у которого развивается инфекция или который не отвечает на стандартную терапию. Терапию препаратом Скайризи не следует проводить до тех пор, пока не исчезнут клинические симптомы инфекционного заболевания.
Туберкулез. На протяжении клинических исследований III фазы 72 пациентам с псориазом и латентной формой туберкулеза одновременно проводилась терапия препаратом Скайризи и была назначена соответствующая профилактическая терапия туберкулеза, при этом в течение среднего периода наблюдения (61 нед) ни у одного пациента не развился активный туберкулез. Пациентам с латентным туберкулезом следует провести противотуберкулезную терапию до начала терапии препаратом Скайризи.
Не следует назначать терапию препаратом Скайризи пациентам с активной формой туберкулеза.
Вакцинация. Перед началом терапии препаратом Скайризи необходимо провести соответствующую возрасту вакцинацию согласно действующим рекомендациям по иммунопрофилактике. Не следует проводить иммунизацию живыми вакцинами в ходе лечения препаратом Скайризи. Отсутствуют данные об иммунном ответе на живые или инактивированные вакцины.
Влияние на способность управлять транспортными средствами, механизмами. Препарат Скайризи не оказывает влияния или оказывает незначительное влияние на способность к вождению транспортных средств и управлению механизмами.
Форма выпуска
Раствор для п/к введения, 75 мг/0,83 мл. По 0,83 мл в однодозовых шприцах из бесцветного стекла I типа, оснащенных защитным устройством для иглы. По 1 шприцу в блистере из пластика и бумаги. По 2 бл. и 2 салфетки, пропитанные изопропиловым спиртом, вместе с инструкцией по применению в пачке картонной; или по 2 бл. вместе с инструкцией по применению в пачке картонной.
Картонная пачка может быть снабжена стикером для контроля первого вскрытия.
Производитель
Производитель готовой ЛФ, фасовщик (первичная упаковка). Берингер Ингельхайм Фарма ГмбХ и Ко.КГ / Boehringer Ingelheim Pharma Gmbh & Co.KG. Биркендорферштрассе 65, 88397 Биберах-на-Риссе, Германия/Birkendorfer Str. 65, 88397 Biberach a.d.R, Germany.
Упаковщик (вторичная упаковка), выпускающий контроль качества. ЭббВи С.Р.Л./AbbVie S.R.L. С.Р. 148 Понтина 52 км с.н.к. — 04011 Камповерде ди Априлиа (ЛТ), Италия/S.R. 148 Pontina 52 km s.n.c. — 04011 Campoverde di Aprilia (LT), Italy; или АО «ОРТАТ», Россия. 157092, Костромская обл., Сусанинский р-н, с. Северное, мкр. Харитоново.
Тел./факс: (4942) 650-806.
Владелец регистрационного удостоверения/организация, принимающая претензии от потребителей. ООО «ЭббВи», Россия. 125196, Москва, ул. Лесная, 7, БЦ «Белые Сады», здание «А».
Тел.: (495) 258-42-77; факс: (495) 258-42-87.
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре 2–8 °C, в оригинальной упаковке для защиты от света.
(не замораживать)
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Скайризи (Skyrizi)
💊 Состав препарата Скайризи
✅ Применение препарата Скайризи
Описание активных компонентов препарата
Скайризи
(Skyrizi)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2022.01.27
Владелец регистрационного удостоверения:
Код ATX:
L04AC18
(Рисанкизумаб)
Лекарственная форма
| Скайризи |
Р-р д/п/к введения 75 мг/0.83 мл: шприцы 2 шт. рег. №: ЛП-006460 |
Форма выпуска, упаковка и состав
препарата Скайризи
Раствор для п/к введения прозрачный или слегка опалесцирующий, бесцветный или слегка желтоватый; допускается наличие небольших полупрозрачных аморфных белковых включений.
Вспомогательные вещества: сорбитол, натрия сукцината гексагидрат, янтарная кислота, полисорбат 20, вода д/и.
0.83 мл — шприцы однодозовые из бесцветного стекла типа I (1) с защитным устройством для иглы — блистеры (2) — пачки картонные×.
0.83 мл — шприцы однодозовые из бесцветного стекла типа I (1) с защитным устройством для иглы — блистеры (2) в комплекте с салфетками (2 шт.), пропитанными 70% изопропиловым спиртом — пачки картонные×.
× пачка может быть снабжена стикером для контроля первого вскрытия.
Фармакологическое действие
Средство для лечения псориаза, гуманизированное моноклональное антитело иммуноглобулина G1, которое селективно и с высокой аффинностью связывается с субъединицей p19 цитокина интерлейкина-23 (ИЛ-23) человека и ингибирует его взаимодействие с рецептором ИЛ-23. ИЛ-23 — это естественный цитокин, участвующий в воспалительном и иммунном ответе. ИЛ-23 способствует образованию, поддержанию числа и активации Th17-лимфоцитов, которые вырабатывают ИЛ-17А, ИЛ-17F и ИЛ-22, а также другие провоспалительные цитокины и играют важную роль в патогенезе аутоиммунных заболеваний, в частности, псориаза. У пациентов с бляшечным псориазом уровень ИЛ-23 повышен в пораженной заболеванием коже. Предотвращая связывание ИЛ-23 с его рецептором, рисанкизумаб ингибирует сигнальный путь и высвобождение провоспалительных цитокинов.
Рисанкизумаб не связывается с человеческим ИЛ-12, который имеет общую с ИЛ-23 субъединицу p40.
Согласно данным исследования, однократное введение рисанкизумаба пациентам с псориазом приводит к снижению в коже экспрессии генов, связанных с иммунной осью ИЛ-23/ИЛ-17. В псориатических поражениях также наблюдалось уменьшение толщины эпидермиса, воспалительной инфильтрации и экспрессии маркеров псориаза.
Фармакокинетика
Рисанкизумаб характеризуется линейной фармакокинетикой с дозозависимым повышением экспозиции в диапазоне доз от 18 до 300 мг и от 0.25 до 1 мг/кг при п/к введении, а также от 200 до 1200 мг и от 0.01 до 5 мг/кг при в/в введении.
После п/к введения рисанкизумаба Cmax в плазме достигается через 3-14 дней, предполагаемая абсолютная биодоступность составляет 89%. Подсчитано, что средняя Cmax в состоянии равновесия и остаточная концентрация препарата в плазме крови составляют 12 и 2 пг/мл соответственно при следующем режиме введения пациентам с псориазом: 150 мг на неделях 0, 4 и каждые 12 недель после этого.
У типичного пациента с псориазом и массой тела 90 кг Vd в равновесном состоянии составляет 11.2 л, что указывает на то, что распределение рисанкизумаба в основном ограничивается сосудистым и интерстициальным пространством.
Терапевтические моноклональные антитела IgG обычно разлагаются на мелкие пептиды и аминокислоты в результате катаболизма подобно эндогенным IgG.
Для типичного пациента с псориазом и массой тела 90 кг, системный клиренс рисанкизумаба составляет 0.31 л/сут, а терминальный T1/2 — 28 дней.
Не предполагается, что рисанкизумаб подвергается клубочковой фильтрации или выделяется с мочой в виде неизмененного вещества.
Показания активных веществ препарата
Скайризи
Лечение бляшечного псориаза среднетяжелой и тяжелой степени у взрослых пациентов; в качестве монотерапии или в комбинации с базисными противовоспалительными препаратами (БПВП) для лечения активного псориатического артрита у взрослых пациентов.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Рекомендуемая доза рисанкизумаб — 150 мг (в виде двух п/к инъекций по 75 мг единовременно) на неделе 0, неделе 4 и далее каждые 12 недель.
Побочное действие
Инфекционные и паразитарные заболевания: очень часто — инфекции верхних дыхательных путей; часто — дерматомикоз; нечасто — фолликулит.
Со стороны нервной системы: часто — головная боль.
Общие нарушения: часто — утомляемость, реакция в месте введения.
Противопоказания к применению
Тяжелые реакции повышенной чувствительности к рисанкизумабу;
активная форма туберкулеза; детский возраст до 18 лет.
С осторожностью
Хронические инфекции или наличием в анамнезе рецидивирующей инфекции.
Не следует проводить вакцинацию живыми вакцинами на фоне терапии рисанкизумабом.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период грудного вскармливания.
Применение у детей
Противопоказано применение у детей и подростков в возрасте до 18 лет.
Применение у пожилых пациентов
Специальных указаний по ограничению применения у пациентов пожилого возраста нет.
Особые указания
Применение рисанкизумаба может повышать риск развития инфекций.
Пациенты должны быть проинформированы о необходимости обращения к врачу в случае появления признаков и симптомов, предполагающих развитие инфекции. Необходимо тщательно контролировать состояние пациента, у которого развивается инфекция или который не отвечает на стандартную терапию. Терапию рисанкизумабом не следует проводить до тех пор, пока не исчезнут клинические симптомы инфекционного заболевания.
Пациентам с латентным туберкулезом следует провести противотуберкулезную терапию до начала терапии рисанкизумабом.
Перед началом терапии рисанкизумабом необходимо провести соответствующую возрасту вакцинацию согласно действующим рекомендациям по иммунопрофилактике. Не следует проводить иммунизацию живыми вакцинами в ходе лечения рисанкизумабом.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Skyrizi
Регистрационный номер
Торговое наименование
Скайризи
Международное непатентованное наименование
Лекарственная форма
раствор для подкожного введения
Состав
Описание
Прозрачный или слегка опалесцирующий, бесцветный или жёлтого цвета раствор. Допускается наличие небольших полупрозрачных аморфных белковых включений.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Механизм действия
Рисанкизумаб — это гуманизированное моноклональное антитело иммуноглобулина G1 (IgGl), которое селективно и с высокой аффинностью связывается с субъединицей p19 цитокина интерлейкина-23 (ИЛ-23) человека и ингибирует его взаимодействие с рецептором ИЛ-23. ИЛ-23 — это естественный цитокин, участвующий в воспалительном и иммунном ответе. ИЛ-23 способствует образованию, поддержанию числа и активации Th17-лимфоцитов, которые вырабатывают ИЛ-17-А, ИЛ-17Р и ИЛ-22, а также другие провоспалительные цитокины и играют важную роль в патогенезе аутоиммунных заболеваний, в частности, псориаза. У пациентов с бляшечным псориазом уровень ИЛ-23 повышен в поражённой заболеванием коже. Предотвращая связывание ИЛ-23 с его рецептором, рисанкизумаб ингибирует сигнальный путь и высвобождение провоспалительных цитокинов.
Рисанкизумаб не связывается с человеческим ИЛ-12, который имеет общую с ИЛ-23 субъединицу p40.
Фармакодинамика
Согласно данным исследования, однократное введение рисанкизумаба пациентам с псориазом приводит к снижению в коже экспрессии генов, связанных с иммунной осью ИЛ-23/ИЛ-17. В псориатических поражениях также наблюдалось уменьшение толщины эпидермиса, воспалительной инфильтрации и экспрессии маркеров псориаза.
В исследовании с участием пациентов с псориатическим артритом на фоне терапии рнсанкизумабом в дозе 150 мг подкожно (на неделе 0, неделе 4 и затем каждые 12 недель) на 24 неделе наблюдалось статистически и клинически значимое снижение уровня биомаркёров, связанных с ИЛ-23 и ИЛ-17, включая сывороточные ИЛ-17А, ИЛ-17Е и ИЛ-22, по сравнению с исходным уровнем.
Фармакокинетика
Всасывание
Рисанкизумаб характеризуется линейной фармакокинетикой с дозозависимым повышением экспозиции в диапазоне доз от 18 до 300 мг и от 0,25 до 1 мг/кг при подкожном введении, а также от 200 до 1200 мг и от 0,01 до 5 мг/кг при внутривенном введении.
После подкожного введения рисанкизумаба максимальная концентрация в плазме была достигнута через 3–14 дней, предполагаемая абсолютная биодоступность составила 89 %.
Подсчитано, что средняя максимальная концентрация в состоянии равновесия и остаточная концентрация препарата в плазме крови составляют 12 и 2 пг/мл соответственно при следующем режиме введения пациентам с псориазом: 150 мг на неделе 0, 4 и каждые 12 недель после этого.
Распределение
У типичного пациента с псориазом и массой тела 90 кг объём распределения в равновесном состоянии (Vss) составляет 11,2 л, что указывает на то, что распределение рисанкизумаба в основном ограничивается сосудистым и интерстициальным пространством.
Метаболизм
Терапевтические моноклональные антитела IgG обычно разлагаются на мелкие пептиды и аминокислоты в результате катаболизма подобно эндогенным IgG. Рисанкизумаб не метаболизируется ферментами цитохрома P450.
Выведение
Для типичного пациента с псориазом и массой тела 90 кг, системный клиренс (CL) рисанкизумаба составляет 0,31 л/день, а терминальный период полувыведения — 28 дней.
Поскольку рисанкизумаб является моноклональным антителом иммуноглобулина IgGl, не предполагается, что рисанкизумаб подвергается клубочковой фильтрации или выделяется с мочой в виде интактной молекулы.
Взаимодействие с другими лекарственными средствами
Исследование лекарственных взаимодействий проводилось у пациентов с бляшечным псориазом для оценки влияния многократного введения рисанкизумаба на фармакокинетику маркерных субстратов, чувствительных к цитохрому P450 (CYP).
Экспозиция кофеина (субстрат CYP1A2), варфарина (субстрат CYP2C9), омепразола (субстрат CYP2C19), метопролола (субстрат CYP2D6) и мидазолама (субстрат CYP3A) при введении рисанкизумаба было сопоставимо с их экспозицией до введения рисанкизумаба.
Это указывает на отсутствие клинически значимых лекарственных взаимодействий с помощью данных ферментов.
Результаты популяционного фармакокинетического анализа показали, что на экспозицию рисанкизумаба не влияли сопутствующие препараты (метформин, аторвастатин, лизиноприл, амлодипин, ибупрофен, ацетилсалицилат и левотироксин), которые использовали некоторые пациенты с бляшечным псориазом во время клинических исследований (см. раздел «Взаимодействие с другими лекарственными средствами»).
Особые группы пациентов
Дети
Фармакокинетика рисанкизумаба у детей не изучалась.
Пожилые пациенты
Из 2234 пациентов с бляшечным псориазом, получавших терапию препаратом Скайризи, 243 пациента были старше 65 лет, а 24 пациента — старше 75 лет. В целом не было выявлено различий в экспозиции рисанкизумаба, безопасности и эффективности терапии препаратом Скайризи между пациентами более старшего и более молодого возраста. Аналогичная ситуация наблюдалась в случае применения при псориатическом артрите на основании результатов популяционного фармакокинетического анализа (см. раздел «Способ применения и дозы»).
Пациенты с нарушением функции почек или печени
Специальные исследования для определения влияния почечной или печёночной недостаточности на фармакокинетику рисанкизумаба не проводились. Согласно данным популяционного фармакокинетического анализа, уровни креатинина в сыворотке крови, клиренс креатинина или маркеры функции печени (АЛТ/АСТ/билирубин) не оказывали значимого влияния на клиренс рисанкизумаба у пациентов с псориазом или с псориатическим артритом.
Поскольку рисанкизумаб является моноклональным антителом IgGl, в основном он выводится при внутриклеточном катаболизме. Ожидается, что рисанкизумаб не подвергается метаболизму с помощью ферментов цитохрома Р450 или элиминации почками (см. раздел «Способ применения и дозы»).
Масса тела
Клиренс рисанкизумаба и объём его распределения увеличиваются с зависимости от увеличения массы тела. Однако клинически значимые изменения параметров эффективности и безопасности рисанкизумаба при увеличении массы тела не наблюдались, поэтому коррекция дозы на основании массы тела не требуется.
Пол, раса
Пол, раса не оказывали клинически значимого влияния на клиренс рисанкизумаба у взрослых пациентов с бляшечным псориазом или псориатическим артритом. Согласно данным клинического исследования по изучению фармакокинетики, у пациентов из Китая и Японии, не наблюдались клинически значимые различия концентраций рисанкизумаба в плазме крови по сравнению с пациентами европеоидной расы.
Краткая информация о клинических исследованиях
Бляшечныи псориаз
Эффективность и безопасность препарата Скайризи изучалась у 2109 пациентов со среднетяжёлым и тяжёлым бляшечным псориазом (статичная общая оценка врачом sPGA ≥ 3 и индекс тяжести и площади поражения PASI ≥ 12) в 4-х многоцентровых, рандомизированных, двойных слепых исследованиях (ULTIMMA-1, ULTIMMA-2, IMMHANCE, and IMMVENT).
У 9,8 % пациентов отмечался сопутствующий псориатический артрит в анамнезе, 42,1 % — до включения в исследование получали лечение другим биологическим препаратом. В исследованиях ULTIMMA-1 и ULTIMMA-2 по всем первичным и вторичным конечным точкам [статичная общая оценка врачом «чисто» или «почти чисто» (sPGA 0/1), статичная общая оценка врачом «чисто» (sPGA 0), PASI 75, PASI 90 и PASI 100] отмечалось статистически достоверное преимущество препарата Скайризи по сравнению с плацебо и устекинумабом на неделях 16 и 52. Улучшение на фоне лечения препаратом Скайризи также наблюдалось со стороны псориаза волосистой части головы, ногтей, ладоней и стоп.
Среди пациентов, достигших sPGA 0/1 на неделе 28 в исследовании IMMHANCE, 87,4 % поддерживали ответ к неделе 52 при непрерывной терапии препаратом Скайризи по сравнению с 61,3 %, кто получил последнюю дозу препарата на неделе 16 (ре-рандомизация на неделе 28).
В исследовании IMMVENT по конечным точкам sPGA 0/1, PASI 75, PASI 90 и PASI 100 отмечалось статистически достоверное преимущество препарата Скайризи по сравнению с адалимумабом на неделе 16. У пациентов с недостаточным ответом на адалимумаб на неделе 16 (PASI 50 — < PASI 90) переключение на лечение препаратом Скайризи позволило достигнуть достоверно лучших результатов по параметрам sPGA 0, sPGA 0/1, PASI 90 и PASI 100 на неделе 44 по сравнению с продолжением терапии адалимумабом.
Псориатический артрит
Эффективность и безопасность препарата Скайризи® изучалась у 1407 пациентов в двух рандомизированных двойных слепых плацебо-контролируемых исследованиях с участием пациентов в возрасте 18 лет и старше с активным псориатическим артритом (исследования KEEPSAKE 1 и KEEPSAKE2). Пациенты, участвующие в данных исследованиях, имели диагноз псориатический артрит в течение периода не менее 6 месяцев на основании критериев классификации псориатического артрита (CASPAR). У пациентов исходно отмечалось: средняя продолжительность заболевания псориатическим артритом 4,9 года, ≥5 болезненных и ≥5 припухших суставов, а также активный бляшечный псориаз или псориаз ногтей. У 55,9% пациентов отмечалось ≥3 % площади поражения кожи бляшечным псориазом. У 63,4% и 27,9 % пациентов наблюдался энтезит и дактилит соответственно. В исследовании KEEPSAKE 1, где дополнительно оценивался псориаз ногтей, у 67,3 % пациентов наблюдался псориаз ногтей. Псориатический спондилит был зарегистрирован у 19,6 % и 19,6 % пациентов в исследованиях KEEPSAKE 1 и KEEPSAKE 2 соответственно. В исследовании KEEPSAKE 1 все пациенты ранее имели неадекватный ответ или непереносимость базисных противовоспалительных препаратов (БПВП) и не получали до включения в исследование биологическую терапию. В исследовании KEEPSAKE2 46,5 % пациентов ранее имели неадекватный ответ или непереносимость биологической терапии. 59,6 % пациентов из обоих исследований получали сопутствующую терапию метотрексатом, 11,6 % получали сопутствующую терапию другими БПВП, отличными от метотрексата, и 28,9 % получали монотерапию препаратом Скайризи®.
В обоих исследованиях терапия препаратом Скайризи® привела к значительному улучшению показателей активности заболевания (достижение клинических ответов ACR 20/50/70 и минимальной активности заболевания) по сравнению с плацебо на неделе 24. Эффективность препарата достигалась быстро по веем критериям с более высокими ответами на терапию, наблюдаемыми уже на неделе 4 для ACR20, по сравнению с плацебо. Терапия препаратом Скайризи® привела к статистически значимому улучшению показателей в лечении дактилита и энтезита у пациентов с ранее диагностированным дактилитом или энтезитом. Достижение ACR 20/50/70, минимальной активности заболевания, улучшение дактилита и энтезита сохранялось вплоть до недели 52. В обоих исследованиях наблюдались аналогичные ответы независимо от сопутствующей терапии БПВП, количества ранее применявшихся БПВП, возраста, пола, расы и индекса массы тела. В исследовании KEEPSAKE 2 ответы на лечение наблюдались независимо от предшествующей биологической терапии.
В обоих исследованиях доля пациентов, достигших модифицированного ответа PsARC (Psoriatic Arthritis Response Criteria) на неделе 24, была выше среди пациентов, получавших терапию препаратом Скайризи®, по сравнению с плацебо. Кроме того, в обоих исследованиях пациенты, получавшие препарат Скайризи® достигли большего улучшения показателя активности заболевания (28 суставов) при использовании индекса DAS28-CPB по сравнению с плацебо на неделе 24. Улучшения сохранялись до недели 52 для PsARC и DAS28-CPB в обоих исследованиях. В обоих исследованиях были показаны улучшения по веем компонентам оценок ACR, включая оценку боли пациентом.
По данным модифицированного индекса тяжести псориаза ногтей (mNAPSI) и 5-баллыюй глобальной оценки тяжести поражения ногтей на пальцах рук (PGA-F) терапия препаратом Скайризи® привела к статистически значимому улучшению псориаза ногтей у пациентов, имеющих соответствующие проявления исходно (67,3 %) в исследовании KEEPSAKE 1. Данное улучшение сохранялось вплоть до недели 52.
В исследовании KEEPSAKE 1 ингибирование прогрессирования структурных повреждений оценивалось рентгенологически и выражалось как изменение модифицированной общей шкалы Шарпа (mTSS) на неделе 24 по сравнению с исходным уровнем. При применении препарата Скайризи® отмечалось численно более низкое среднее прогрессирование структурных повреждений на неделе 24 по сравнению с плацебо (средний балл mTSS составлял 0,23 в группе Скайризи® по сравнению с 0,32 в группе плацебо [статистически недостоверно]). Доля пациентов без рентгенологического прогрессирования (определяемого как изменение по сравнению с исходным уровнем mTSS ≤ 0) была выше в группе Скайризи® (92,4 %) по сравнению с плацебо (87,7 %) на неделе 24 (номинальное значение р = 0,016).
У пациентов, получавших терапию препаратом Скайризи®, наблюдалось статистически значимое улучшение физической функции по сравнению с исходным уровнем по оценке HAQ-DI на неделе 24 по сравнению с плацебо. Улучшения сохранялись до 52 недели.
На неделе 24 у пациентов, получавших терапию препаратом Скайризи®, также наблюдались значительные улучшения в сводных оценках физического компонента шкалы качества жизни SF-36 V2 и в оценке утомляемости по шкале FACIT по сравнению с пациентами, получавшими плацебо. Улучшения сохранялись до 52 недели.
У пациентов с псориатическим спондилитом, которые получали терапию препаратом Скайризи®, наблюдались улучшения по сравнению с исходным уровнем в показателях индекса активности анкилозирующего спондилита (BASDAI) и активности заболевания анкилозирующим спондилитом (ASDAS) по сравнению с плацебо на неделе 24. Улучшения сохранялись до недели 52.
Показания
- Препарат Скайризи показан для лечения бляшечного псориаза среднетяжёлой и тяжёлой степени у взрослых пациентов.
- Препарат Скайризи показан в качестве монотерапии или в комбинации с базисными противовоспалительными препаратами (БПВП) для лечения активного псориатического артрита у взрослых пациентов.
Противопоказания
- Тяжёлые реакции гиперчувствительности к рисанкизумабу или к другим вспомогательным веществам препарата см. Раздел «Особые указания»);
- Активная форма туберкулёза;
- Детский возраст до 18 лет (эффективность и безопасность не изучены).
С осторожностью
- Необходимо соблюдать осторожность при применении препарата Скайризи® у пациентов с хроническими инфекциями или с наличием в анамнезе рецидивирующей инфекции.
- Не следует проводить вакцинацию живыми вакцинами на фоне терапии препаратом Скайризи®. Отсутствуют данные об иммунном ответе на живые или инактивированные вакцины.
Применение при беременности и в период грудного вскармливания
Беременность
Полученных данных недостаточно для информирования о рисках, связанных с применением лекарственного препарата Скайризи® у беременных женщин.
Данные, полученные в ходе исследований на животных
Проводилось расширенное исследование токсического воздействия на пре- и постнатальное развитие на яванских макаках. Каждую неделю с 20-го дня беременности до момента родоразрешения яванским макакам вводили подкожные инъекции рисанкизумаба в дозах 5 или 50 мг/кг. Дальнейшее наблюдение за самками и детёнышами продолжалось в течение 6 месяцев (180 дней) после родоразрешения. Указанные дозы приводили к экспозиции, приблизительно в 70 раз превышающей клиническое воздействие при максимально рекомендуемой для человека дозе (МРДЧ). Не наблюдалось связанных с применением препарата случаев смерти и/или пороков развития плода/новорождённого. Влияние на рост и развитие новорождённого отсутствовало, оценка которого включала внешние, висцеральные, скелетные и нейроповеденческие параметры и конечные точки токсического воздействия на иммунную систему. У детёнышей отмечалось дозозависимое повышение средней концентрации препарата в сыворотке крови, которая составляла около 20–90 % от средней концентрации в организме самки. После родоразрешения у большинства взрослых самок яванских макак и всех детёнышей в группах применения рисанкизумаба отмечалась определяемая концентрация рисанкизумаба в сыворотке крови в течение периода до 91 дня.
Через 180 дней после родоразрешения концентрация рисанкизумаба в сыворотке крови была ниже определяемого уровня.
Период грудного вскармливания
Нет данных о проникновении рисанкизумаба в грудное молоко, о воздействии препарата на ребёнка в период грудного вскармливания или на выработку молока. Несмотря на то, что человеческий IgG выделяется в грудное молоко, опубликованные данные свидетельствуют о том, что антитела в грудном молоке не попадают в кровоток новорождённого/ребёнка в значимых количествах.
Способ применения и дозы
Для подкожного введения.
Пациенты могут самостоятельно вводить препарат Скайризи® после соответствующего обучения технике подкожных инъекций. Перед введением препарата пациенты должны ознакомиться с инструкцией по медицинскому применению.
Каждый предварительно заполненный шприц предназначен только для однократного использования.
Следует избегать введения препарата в чувствительных, повреждённых, эритематозных и уплотнённых участках кожи, а также участках, поражённых псориазом. Введение препарата Скайризи® в верхнюю часть наружной поверхности плеча должно выполняться только лицом, осуществляющим уход за пациентом, или медицинским работником.
Перед проведением инъекции необходимо достать упаковку препарата Скайризи® из холодильника и довести её до комнатной температуры в течение 15–30 минут, избегая прямых солнечных лучей, не вынимая шприц из коробки.
Неиспользованный лекарственный препарат или остатки препарата должны быть утилизированы в соответствии с требованиями, принятыми в конкретном регионе.
Рекомендуемый режим дозирования
Бляшечный псориаз
Рекомендуемая доза препарата Скайризи® — 150 мг в виде подкожной инъекции на неделе 0, неделе 4 и далее каждые 12 недель.
Следует рассмотреть возможность прекращения терапии у пациентов, не достигающих ответа на терапию в период свыше 16 недель. У некоторых пациентов с первоначальным частичным ответом впоследствии могут улучшиться результаты при продолжении терапии более 16 недель.
Псориатический артрит
Рекомендуемая доза препарата Скайризи® — 150 мг на неделе 0, неделе 4 и далее каждые 12 недель.
Препарат Скайризи® может применяться в качестве монотсрапии или в комбинации с базисными противовоспалительными препаратами (БПВП).
Пропуск дозы
В случае пропуска дозы препарата Скайризи® необходимо ввести дозу как можно скорее. Затем следует возобновить введение доз согласно установленному графику.
Особые группы пациентов
Дети
Отсутствуют данные по безопасности и эффективности применения препарата Скайризи® у детей в возрасте до 18 лет.
Пациенты пожилого возраста
Коррекция дозы не требуется (см. раздел «Фармакологические свойства»).
Пациенты с нарушением функции почек или печени
Не было проведено специальных исследований для определения влияния почечной или печёночной недостаточности на фармакокинетику препарата Скайризи®. Данные состояния, как правило, не должны оказывать существенного влияния на фармакокинетику моноклональных антител. Коррекция дозы не требуется (см. раздел «Фармакологические свойства»).
ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ
Перед введением препарата Скайризи® полностью прочитайте инструкцию по применению
Перед проведением инъекции препаратом Скайризи® необходимо обязательно ознакомиться с указанной ниже важной информацией.
- Прежде чем проводить инъекцию, необходимо пройти обучение по введению препарата Скайризи®. Для этого необходимо обратиться к лечащему врачу.
- Необходимо отмечать в своём календаре, когда Вам нужно вводить препарат Скайризи®.
- До момента использования препарат Скайризи® необходимо хранить в оригинальной упаковке (картонной пачке) в защищённом от света месте.
- Не вводить препарат, если раствор мутный и содержит крупные хлопья или частицы (раствор должен быть бесцветным или жёлтым и может содержать небольшие полупрозрачные частицы).
- Не применять препарат после истечения срока годности.
- Не применять препарат, если он был заморожен (даже если впоследствии он был разморожен).
- Не встряхивать шприц.
- Не применять препарат, если заполненный шприц падал на пол или повреждён.
- Не применять препарат, если нарушена перфорация на картонной пачке. Необходимо вернуть такой препарат в аптеку.
- Не снимайте колпачок с иглы вплоть до момента выполнения инъекции.
- Для более комфортного проведения инъекции: перед инъекцией необходимо достать упаковку препарата Скайризи® из холодильника и довести её до комнатной температуры, для этого необходимо оставить шприц при комнатной температуре в течение 15–30 минут, избегая прямых солнечных лучей.
- Не вынимайте шприц из картонной пачки до тех пор, пока не будете готовы выполнить инъекцию.
- Не нагревайте препарат Скайризи® любым другим способом, например, в микроволновой печи или в горячей воде.
Следуйте инструкциям, изложенным ниже, каждый раз, когда используете препарат Скайризи®.
ШАГ 1
Извлеките предварительно заполненный шприц из картонной пачки, держа его за упор для пальцев.
При извлечении из картонной пачки не держите шприц за упор поршня и не тяните за него.
Поместите следующие предметы на чистую плоскую поверхность:
- 1 предварительно заполненный шприц;
- 1 спиртовую салфетку;
- 1 ватный тампон или марлевую салфетку;
- контейнер для утилизации.
Вымойте и высушите руки.
ШАГ 2
место для инъекции
Выберите одно из трёх мест для инъекции:
- передняя часть левого бедра;
- передняя часть правого бедра;
- область живота (не менее 5 см от пупка).
Перед каждой инъекцией необходимо протирать место инъекции спиртовой салфеткой круговыми движениями.
- НЕ прикасайтесь и не дуйте на место инъекции после его обработки спиртовой салфеткой. Перед инъекцией дайте коже высохнуть.
- НЕ делайте инъекцию через одежду.
- НЕ делайте инъекции в местах с раздражённой кожей, синяками, покраснениями и уплотнениями, а также в кожу, имеющую шрамы или растяжки.
- НЕ делайте инъекции в местах кожи, поражённой псориазом.
ШАГ 3
Держите шприц закрытой иглой вниз, как показано на рисунке.
Осмотрите раствор в шприце.
- Наличие пузырьков в шприце является нормой.
- Раствор должен быть бесцветным или жёлтым и может содержать мелкие белые или прозрачные частицы.
- НЕ вводите препарат, если раствор мутный и содержит крупные хлопья или частицы.
ШАГ 4
Снятие колпачка иглы:
- Держите шприц в одной руке за область между упором для пальцев и колпачком иглы.
- Другой рукой аккуратно снимите колпачок иглы.
- НЕ держите шприц за упор поршня и не тяните за него при снятии колпачка иглы.
- Возможно, на конце иглы появится капля жидкости. Это нормально.
- Выбросьте колпачок иглы.
- НЕ прикасайтесь к игле пальцами и не допускайте соприкосновения иглы с какой-либо поверхностью.
ШАГ 5
Держите корпус шприца одной рукой между большим и указательным пальцем, как карандаш.
Слегка сожмите подготовленное место инъекции другой рукой и крепко удерживайте его.
Быстрым движением полностью введите иглу в кожу под углом примерно 45°. Удерживайте шприц под тем же углом.
ШАГ 6
Медленно нажимайте на поршень пока весь раствор не будет введён.
Извлеките иглу из кожи под тем же углом, под которым производилось введение.
Медленно отведите большой палец от поршня. Игла закроется защитным устройством.
- Защитное устройство иглы не активируется, пока не будет введён весь раствор препарата.
- Обратитесь к своему лечащему врачу, если считаете, что не ввели полную дозу.
Прижимайте ватный тампон или марлевую салфетку к месту инъекции в течение 10 секунд.
Не растирайте место введения после завершения инъекции.
Может возникнуть небольшое кровотечение из места инъекции. Это нормально.
ШАГ 7
Поместите использованные шприцы в контейнер для утилизации.
- НЕ выбрасывайте использованные шприцы вместе с бытовыми отходами.
- Ваш врач или медсестра расскажут Вам, как вернуть контейнер для полной утилизации.
Побочное действие
Опыт клинических исследований
Бляшечный псориаз
В клинических исследованиях принимало участие 2234 пациентов с бляшечным псориазом, которым вводили препарат Скайризи® (2167 пациенто-лет применения). Из всех участников 1208 пациентов с псориазом получали терапию препаратом Скайризи® в течение не менее одного года.
Данные плацебо-контролируемых исследований и исследований с активным контролем были объединены для оценки безопасности применения препарата Скайризи® в течение 16 недель. Всего были оценены результаты терапии 1306 пациентов в группе применения препарата Скайризи® в дозе 150 мг. Серьёзные нежелательные реакции были отмечены у 2,4 % в группе применения препарата Скайризи® (9,9 явлений на 100 пациенто-лет) по сравнению с 4,0 % в группе плацебо (17,4 явления на 100 пациенто-лет), 5,0 % в группе применения устекинумаба (18,4 явления на 100 пациенто-лет) и 3,0 % для группы адалимумаба (14,7 явления на 100 пациенто-лет).
В таблице 1 приведены нежелательные реакции, отмеченные во время проведения клинических исследований с применением препарата Скайризи, которые были классифицированы в соответствии с классами систем органов MedDRA. Для оценки частоты использованы следующие критерии: очень часто (≥1/10); часто (≥1/100 до <1/10); нечасто (≥1/1 000 до 1/100); редко (≥1/10 000 до 1/1 000); очень редко (<1/10 000).
|
Класс систем органов |
Частота развития |
Нежелательные реакции |
|
Инфекционные и паразитарные заболевания |
Очень часто |
Инфекции верхних дыхательных путейa |
|
Часто |
Дерматомикозb |
|
|
Нечасто |
Фолликулит |
|
|
Нарушения со стороны нервной системы |
Часто |
Головная больc |
|
Общие нарушения и реакции в месте введения |
Часто |
Утомляемостьd Реакция в месте введенияe |
|
a Включает: инфекцию дыхательных путей (вирусная, бактериальная или неуточнённая), синусит (в том числе острый), ринит, назофарингит, фарингит (в том числе вирусный), тонзиллит. b Включает: грибковое поражение кожи стоп, трихофитию промежности, дерматофитию туловища, отрубевидный лишай, грибковую инфекцию рук c Включает: головную боль, головную боль напряжения, синусовую головную боль d Включает: утомляемость, общую слабость. е Включает: синяк в месте инъекции, эритему, гематому, кровоизлияние, инфекцию, воспаление, раздражение, боль, зуд, кожную реакцию, отёк |
Описание отдельных нежелательных реакций
Инфекции
Инфекции наблюдались у 22,1 % пациентов, принимавших препарат Скайризи® (90,8 случаев на 100 пациенто-лет), по сравнению с 14,7 % в группе плацебо (56,5 случаев на 100 пациенто-лет), 20,9 % в группе устекинумаба (87,0 случаев на 100 пациенто-лет) и 24,3 % в группе адалимумаба (104,2 случаев на 100 пациенто-лет). Большинство нежелательных реакций были несерьёзными, лёгкой или средней степени тяжести и не приводили к прекращению введения препарата Скайризи®.
На протяжении всей программы исследований применения препарата при псориазе, учитывая длительное воздействие препарата Скайризи®, частота инфекций (75,5 случаев на 100 пациенто-лет) была аналогична наблюдаемой в течение первых 16 недель терапии.
Профиль безопасности препарата Скайризи® при длительном применении На 52-й неделе терапии частота развития нежелательных реакций была аналогична профилю безопасности, наблюдаемому в течение первых 16 недель терапии. В течение 52 недель, скорректированная по объёму применения частота развития серьёзных нежелательных явлений на 100 пациенто-лет составляла 9,4 для пациентов, получавших препарат Скайризи®, и 10,9 для пациентов, получавших устекинумаб. У пациентов, получавших терапию препаратом Скайризи® в течение наиболее продолжительного периода времени (77 недель), не было выявлено новых нежелательных реакций по сравнению с первыми 16 неделями терапии.
Псориатический артрит
В целом профиль безопасности, наблюдаемый у пациентов с псориатическим артритом, получавших препарат Скайризи®, соответствовал профилю безопасности, наблюдаемому у пациентов с бляшечным псориазом.
Опыт пострегистрационного применения
Во время пострегистрационного применения препарата Скайризи® были выявлены нижеуказанные нежелательные реакции. Поскольку сообщения о развитии данных реакций были получены на добровольной основе из группы неопределённого числа пациентов, не всегда возможно достоверно оценить их частоту или установить, связаны ли данные реакции с приёмом препарата Скайризи®.
Нарушения со стороны кожи и подкожных тканей: экзема, сыпь и крапивница.
Иммуногенность
Как и для всех терапевтических белков, введение рисанкизумаба может вызвать развитие иммуногенности. Обнаружение антител в значительной степени зависит от чувствительности и специфичности метода анализа. Кроме того, частота положительного результата на обнаружение антител (включая нейтрализующие антитела) может быть обусловлена влиянием нескольких факторов, таких как методология метода анализа, обработка образцов проб, время сбора проб, сопутствующая лекарственная терапия и сопутствующие заболевания. По этим причинам сравнение частоты выявления антител к рисанкизумабу с таковой в исследованиях других лекарственных препаратов может вводить в заблуждение.
Бляшечный псориаз
В рамках клинических исследований применения препарата при псориазе было выявлено, что доля пациентов, получавших терапию в рекомендуемой клинической дозе в течение 52 недель и выработавших к препарату антитела и нейтрализующие антитела составила 24 % (263/1079) и 14 % (150/1079) соответственно.
Присутствие антител к рисанкизумабу, а также нейтрализующих антител не было связано с изменениями клинического ответа или безопасности применения препарата.
Псориатический артрит
В клинических исследованиях у пациентов с псориатическим артритом, получавших препарат Скайризи® в рекомендованной дозе вплоть до 28 недель, были обнаружены появившиеся за время лечения антитела к лекарственному препарату и нейтрализующие антитела у 12,1 % (79/652) и 0 % (0/652) пациентов соответственно. Антитела к рисанкизумабу, включая нейтрализующие антитела, не были связаны с изменениями клинического ответа или безопасности.
Передозировка
В случае передозировки рекомендуется наблюдение за пациентами на предмет выявления признаков и симптомов нежелательных реакций. При необходимости следует незамедлительно провести симптоматическую терапию.
Взаимодействие с другими лекарственными средствами
Препарат Скайризи® не подвергается почечной элиминации или метаболизму печёночными ферментами. Взаимодействия между препаратом Скайризи® и лекарственными препаратами, являющимися ингибиторами, индукторами и/или субстратами изоферментов, не ожидается.
Согласно результатам исследования лекарственных взаимодействий у пациентов с бляшечным псориазом и результатам популяционного фармакокинетического анализа у пациентов с бляшечным псориазом и псориатическим артритом рисанкизумаб не вызывал лекарственных взаимодействий или не подвергался им (см. раздел «Фармакологические свойства»).
При одновременном введении рисанкизумаба и субстратов цитохрома Р450 коррекция дозы не требуется.
Особые указания
Реакции гиперчувствительности
В случае развития реакций гиперчувствительности необходимо прекратить введение препарата Скайризи® и незамедлительно начать соответствующую терапию.
Инфекции
Применение препарата Скайризи® может повышать риск развития инфекций.
Следует соблюдать осторожность при применении препарата Скайризи® у пациентов с хроническими инфекциями или с наличием в анамнезе рецидивирующей инфекции.
Пациенты должны быть проинформированы о необходимости обращения к врачу в случае появления признаков и симптомов, предполагающих развитие инфекции. Необходимо тщательно контролировать состояние пациента, у которого развивается инфекция или который не отвечает на стандартную терапию. Терапию препаратом Скайризи® не следует проводить до тех пор, пока не исчезнут клинические симптомы инфекционного заболевания.
На протяжении клинических исследований III фазы 72-ум пациентам с псориазом и латентной формой туберкулёза одновременно проводилась терапия препаратом Скайризи® и была назначена соответствующая профилактическая терапия туберкулёза, при этом, в течение среднего периода наблюдения (61 неделя) ни у одного пациента не развился активный туберкулёз. Пациентам с латентным туберкулёзом следует провести противотуберкулёзную терапию до начала терапии препаратом Скайризи®.
Не следует назначать терапию препаратом Скайризи® пациентам с активной формой туберкулёза.
Вакцинация
Перед началом терапии препаратом Скайризи® необходимо провести соответствующую возрасту вакцинацию согласно действующим рекомендациям по иммунопрофилактике. Не следует проводить иммунизацию живыми вакцинами в ходе лечения препаратом Скайризи®.
Отсутствуют данные об иммунном ответе на живые или инактивированные вакцины.
Влияние на способность управлять транспортными средствами, механизмами
Препарат Скайризи® не оказывает влияния или оказывает незначительное влияние на способность к вождению транспортных средств и управлению механизмами.
Форма выпуска
Раствор для подкожного введения 150 мг/мл.
По 1,0 мл в однодозовые шприцы из бесцветного стекла типа I.
Шприцы оснащены защитным устройством для иглы.
По 1 шприцу в чехле из картона и ламинированной алюминиевой фольги вместе с инструкцией по применению помещается в картонную пачку с картонным вкладышем.
Картонная пачка может быть снабжена стикером для контроля первого вскрытия.
Хранение
При температуре от 2 до 8 °C в оригинальной упаковке для защиты от света.
Не замораживать.
Срок годности
2 года.
Не применять после истечения срока годности.
Условия отпуска из аптек
Отпускают по рецепту.
Производитель
AbbVie Biotechnology Ltd.,
США
AbbVie S.r.L.,
Италия
ОРТАТ, ЗАО,
Российская Федерация
Производитель
Производитель готовой лекарственной формы, фасовщик (первичная упаковка)
ЭббВи Биотехнология Лтд. / AbbVie Biotechnology Ltd.
Роуд № 2 км 59,2 Барселонета, Пуэрто-Рико (ПР) 00617, США /
Road Number 2 Km 59.2 Barceloneta, Puerto Rico (PR) 00617, USA
Упаковщик (вторичная упаковка), выпускающий контроль качества
ЭббВи С.Р.Л./AbbVie S.R.L.
С.Р. 148 Понтина 52 км с.н.к. — 04011 Камповерде ди Априлиа (ЛТ), Италия /
S.R. 148 Pontina 52 km s.n.c. — 04011 Campoverde di Aprilia (LT), Italy
или
АО «ОРТАТ», Россия
157092, Костромская обл., Сусанинский район, с. Северное, мкр. Харитоново, тел./факс (4942) 650-806.
Владелец регистрационного удостоверения / Организация, принимающая претензии от потребителей:
ООО «ЭббВи», Россия
125196, г. Москва, ул. Лесная, д.7, этаж 4, помещение 1
БЦ «Белые Сады», здание «А»
тел. (495) 258 42 77.
Generic name: Risankizumab [ RIS-an-KIZ-ue-mab ]
Drug class: Interleukin inhibitors
Medically reviewed by Drugs.com. Last updated on Apr 18, 2023.
Uses of Skyrizi:
- It is used to treat plaque psoriasis.
What do I need to tell my doctor BEFORE I take Skyrizi?
- If you are allergic to Skyrizi (150 MG Dose) (risankizumab); any part of Skyrizi (150 MG Dose) (risankizumab); or any other drugs, foods, or substances. Tell your doctor about the allergy and
what signs you had. - If you have an infection.
- If you have active TB (tuberculosis).
- If you have recently had a live vaccine
This is not a list of all drugs or health problems that interact with Skyrizi (150 MG Dose) (risankizumab).
Tell your doctor and pharmacist about all of your drugs (prescription or OTC, natural products, vitamins) and health problems. You must check
to make sure that it is safe for you to take Skyrizi (150 MG Dose) (risankizumab) with all of your drugs and health problems. Do not start, stop, or change the dose of
any drug without checking with your doctor.
What are some things I need to know or do while I take Skyrizi?
- Tell all of your health care providers that you take Skyrizi (150 MG Dose) (risankizumab). This includes your doctors, nurses, pharmacists, and dentists.
- Make sure you are up to date with all your vaccines before treatment with Skyrizi (150 MG Dose) (risankizumab).
- You may have more chance of getting an infection. Wash hands often. Stay away from people with infections, colds, or flu.
- You will need a TB (tuberculosis) test before starting Skyrizi (150 MG Dose) (risankizumab).
- Talk with your doctor before getting any vaccines. Use of some vaccines with Skyrizi (150 MG Dose) (risankizumab) may either raise the chance of an infection or make
the vaccine not work as well. - Tell your doctor if you are pregnant, plan on getting pregnant, or are breast-feeding. You will need to talk about the benefits and risks
to you and the baby.
How is this medicine (Skyrizi) best taken?
Use Skyrizi (150 MG Dose) (risankizumab) as ordered by your doctor. Read all information given to you. Follow all instructions closely.
- It is given as a shot into the fatty part of the skin on the top of the thigh, belly area, or upper arm.
- If you will be giving yourself the shot, your doctor or nurse will teach you how to give the shot.
- Do not shake.
- If the dose is more than 1 injection, give the injections into 2 different places.
- Do not give into tender, bruised, red, or hard skin.
- Do not give into skin that is affected by psoriasis.
- To make the injection feel better, take Skyrizi (150 MG Dose) (risankizumab) out of the refrigerator and allow it to sit at room temperature for up to 30 minutes
before use. Do not remove the cap or cover. Do not heat Skyrizi (150 MG Dose) (risankizumab). - This product is clear but may contain small white or clear particles. You may also see one or more air bubbles. Do not use if the solution
is cloudy, leaking, or has large particles. - This medicine is colorless to a faint yellow. Do not use if the solution changes color.
- Each prefilled syringe is for one use only.
- Throw away needles in a needle/sharp disposal box. Do not reuse needles or other items. When the box is full, follow all local rules for
getting rid of it. Talk with a doctor or pharmacist if you have any questions.
What do I do if I miss a dose?
- Take a missed dose as soon as you think about it and go back to your normal time.
- Do not take 2 doses at the same time or extra doses.
- If you are not sure what to do if you miss a dose, call your doctor.
What are some side effects that I need to call my doctor about right away?
WARNING/CAUTION: Even though it may be rare, some people may have very bad and sometimes deadly side effects when taking a drug. Tell your
doctor or get medical help right away if you have any of the following signs or symptoms that may be related to a very bad side effect:
- Signs of an allergic reaction, like rash; hives; itching; red, swollen, blistered, or peeling skin with or without fever; wheezing;
tightness in the chest or throat; trouble breathing, swallowing, or talking; unusual hoarseness; or swelling of the mouth, face, lips, tongue,
or throat. - Signs of infection like fever, chills, very bad sore throat, ear or sinus pain, cough, more sputum or change in color of sputum, pain with
passing urine, mouth sores, or wound that will not heal. - Flu-like signs.
- Shortness of breath.
- Weight loss.
- Warm, red, or painful skin or sores on the body.
What are some other side effects of Skyrizi?
All drugs may cause side effects. However, many people have no side effects or only have minor side effects. Call your doctor or get medical
help if any of these side effects or any other side effects bother you or do not go away:
- Signs of a common cold.
- Feeling tired or weak.
- Irritation where the shot is given.
- Headache.
These are not all of the side effects that may occur. If you have questions about side effects, call your doctor. Call your doctor for medical
advice about side effects.
You may report side effects to the FDA at 1-800-332-1088. You may also report side effects at https://www.fda.gov/medwatch.
If OVERDOSE is suspected:
If you think there has been an overdose, call your poison control center or get medical care right away. Be ready to tell or show what was
taken, how much, and when it happened.
How do I store and/or throw out Skyrizi?
- Store in a refrigerator. Do not freeze.
- Do not use if it has been frozen.
- Store in the original container to protect from light.
- Keep all drugs in a safe place. Keep all drugs out of the reach of children and pets.
- Throw away unused or expired drugs. Do not flush down a toilet or pour down a drain unless you are told to do so. Check with your
pharmacist if you have questions about the best way to throw out drugs. There may be drug take-back programs in your area.
Consumer Information Use and Disclaimer
- If your symptoms or health problems do not get better or if they become worse, call your doctor.
- Do not share your drugs with others and do not take anyone else’s drugs.
- This medicine comes with an extra patient fact sheet called a Medication Guide. Read it with care. Read it again each time Skyrizi (150 MG Dose) (risankizumab) is
refilled. If you have any questions about Skyrizi (150 MG Dose) (risankizumab), please talk with the doctor, pharmacist, or other health care provider. - If you think there has been an overdose, call your poison control center or get medical care right away. Be ready to tell or show what was
taken, how much, and when it happened.
Frequently asked questions
- What are monoclonal antibodies?
- What causes Plaque Psoriasis?
- How long does it take for Skyrizi to work?
- What’s the dosing schedule for Skyrizi?
- Can you drink alcohol while taking Skyrizi?
- What is Skyrizi used for and how does it work?
- How is Skyrizi injection administered?
View more FAQ
Further information
Always consult your healthcare provider to ensure the information displayed on this page applies to your personal circumstances.
Medical Disclaimer