Стелара® (Stelara®) инструкция по применению
📜 Инструкция по применению Стелара®
💊 Состав препарата Стелара®
✅ Применение препарата Стелара®
📅 Условия хранения Стелара®
⏳ Срок годности Стелара®
Описание лекарственного препарата
Стелара®
(Stelara®)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для электронного издания справочника Видаль 2022
года, дата обновления: 2021.12.16
Владелец регистрационного удостоверения:
Код ATX:
L04AC05
(Устекинумаб)
Лекарственные формы
| Стелара® |
Р-р д/п/к введения 45 мг/0.5 мл: шприцы 1 шт. рег. №: ЛП-001104 |
|
|
Р-р д/п/к введения 90 мг/1.0 мл: шприцы 1 шт. рег. №: ЛП-001104 |
Форма выпуска, упаковка и состав
препарата Стелара®
Раствор для п/к введения прозрачный или слегка опалесцирующий, от бесцветного до светло-желтого цвета; раствор может содержать единичные прозрачные частицы белка.
Вспомогательные вещества: сахароза — 38 мг, L-гистидин (в том числе L-гистидина гидрохлорида моногидрат) — 0.5 мг, полисорбат 80 — 0.02 мг, вода д/и — до 0.5 мл.
0.5 мл — шприцы из боросиликатного стекла (тип I) (1) с устройством UltraSafe Passive® — пачки картонные.
0.5 мл — шприцы из боросиликатного стекла (тип I) (1) с устройством UltraSafe Passive® — лотки пластиковые — пачки картонные.
Раствор для п/к введения прозрачный или слегка опалесцирующий, от бесцветного до светло-желтого цвета; раствор может содержать единичные прозрачные частицы белка.
Вспомогательные вещества: сахароза — 76 мг, L-гистидин (в том числе L-гистидина гидрохлорида моногидрат) — 1.0 мг, полисорбат 80 — 0.04 мг, вода д/и — до 1.0 мл.
1.0 мл — шприцы из боросиликатного стекла (тип I) (1) с устройством UltraSafe Passive® — пачки картонные.
1.0 мл — шприцы из боросиликатного стекла (тип I) (1) с устройством UltraSafe Passive® — лотки пластиковые — пачки картонные.
Фармакологическое действие
Устекинумаб представляет собой полностью человеческое моноклональное антитело IgG1?, которое специфично связывается с общей единицей белка p40 интерлейкинов (ИЛ) ИЛ-12 и ИЛ-23 человека. Препарат Стелара® ингибирует биоактивность ИЛ-12 и ИЛ-23 человека, предотвращая связывание p40 с рецептором ИЛ-12Rβ1, экспрессируемым на поверхности иммунных клеток. Препарат Стелара® не связывается с ИЛ-12 или ИЛ-23, которые уже связаны с рецепторами ИЛ-12Rβ1 на поверхности клеток. Таким образом, маловероятно, что препарат Стелара® будет способствовать опосредованной комплементом или антителами цитотоксичности в отношении клеток, экспрессирующих рецепторы к ИЛ-12 и/или ИЛ-23.
ИЛ-12 и ИЛ-23 представляют собой гетеродимерные цитокины, секретируемые активированными антигенпредставляющими клетками, например, макрофагами и дендритными клетками. ИЛ-12 стимулирует клетки-естественные киллеры (NK) и дифференцировку CD4+ T-клеток до фенотипа Т-хелпера-1 (Th1), а также стимулирует выработку интерферона гамма (ИФНγ). ИЛ-23 индуцирует путь Т-хелперов-17 (Th17) и способствует выработке ИЛ-17A, ИЛ-21, и ИЛ-22. У пациентов с псориазом определятся повышенные уровни ИЛ-12 и ИЛ-23 в коже и крови. Концентрация ИЛ12/23p40 в сыворотке крови является фактом дифференциации пациентов с псориатическим артритом, что подтверждает участие ИЛ-12 и ИЛ-23 в патогенезе псориатических воспалительных заболеваний. Полиморфизм генов, кодирующих ИЛ-23А, ИЛ-23R и ИЛ-12B, определяет предрасположенность к таким заболеваниям. Кроме того, высокий уровень экспрессии ИЛ-12 и ИЛ-23 обнаруживается в пораженной псориазом коже, а опосредованная ИЛ-12 индукция интерферона гамма коррелирует с активностью псориатического процесса. Чувствительные к ИЛ-23 Т-клетки были обнаружены в энтезах у мышей со смоделированным воспалительным артритом, где ИЛ-23 вызывал воспаление энтезов. Кроме того, имеются доклинические данные, свидетельствующие об участии ИЛ-23 и нисходящих путей в процессах эрозии и разрушения костной ткани посредством повышения экспрессии рецепторного активатора лиганда ядерного фактора κB (RANKL), который активирует остеокласты.
У пациентов с болезнью Крона отмечено повышение уровней ИЛ-12 и ИЛ-23 в кишечнике и лимфатических узлах. Это сопровождается увеличением уровней интерферона и ИЛ-17A в сыворотке, указывая, что ИЛ-12 и ИЛ-23 способствуют активации Th1 и Th17 при болезни Крона. Кроме того, как ИЛ-12, так и ИЛ-23 могут стимулировать выработку Т-клетками ФНО-α, что приводит к хроническому воспалению кишечника и повреждению эпителиальных клеток. Была обнаружена достоверная взаимосвязь между болезнью Крона и генетическим полиморфизмом генов ИЛ23R и ИЛ12B, что указывает на потенциальную причинную роль сигнальной системы ИЛ-12/23 в развитии заболевания. Это подтверждается доклиническими данными, свидетельствующими, что активация сигнального пути ИЛ-12/23 необходима для развития повреждения кишечника у мышей со смоделированным воспалительным поражением кишечника.
Связывая общую субъединицу p40 ИЛ-12 и ИЛ-23, препарат Стелара® может влиять на клиническое течение псориаза, псориатического артрита, болезни Крона и язвенного колита посредством прерывания пути выработки цитокинов Th1 и Th17, которые играют центральную роль в патогенезе этих заболеваний.
У пациентов с псориазом и/или псориатическим артритом при терапии препаратом Стелара® не отмечалось очевидного влияния на относительное количество популяций циркулирующих иммунных клеток, в том числе субпопуляции Т-клеток памяти и неактивированных Т-клеток, или уровни циркулирующих цитокинов.
В исследованиях, проведенных у пациентов с псориазом и псориатическим артритом, клинический ответ (улучшение оценок по PASI и ACR соответственно), по-видимому, был взаимосвязан с концентрацией устекинумаба в сыворотке. У пациентов с псориазом с лучшим клиническим ответом по шкале PASI средняя концентрация устекинумаба в сыворотке крови была выше, чем у пациентов с менее выраженным клиническим ответом. Доля пациентов, у которых на 28-ой неделе терапии был достигнут ответ PASI 75, увеличивалась по мере увеличения концентрации устекинумаба в сыворотке. Доля пациентов, у которых были достигнуты оценки ACR 20 и ACR 50, увеличивалась по мере увеличения концентрации устекинумаба в сыворотке крови.
У пациентов с болезнью Крона и язвенным колитом в результате терапии препаратом Стелара® отмечалось значимое снижение уровней маркеров воспаления, в том числе С-реактивного белка (CRP) и фекального кальпротектина. У пациентов, получавших препарат Стелара® в течение 44 недель, по сравнению с группой плацебо достигалось и сохранялось снижение в сыворотке крови концентраций ИФНγ и ИЛ-17А, являющихся провоспалительными цитокинами, регулируемыми ИЛ-12 и ИЛ-23.
Иммунизация
Во время долгосрочного клинического исследования III фазы (PHOENIX 2), у пациентов с псориазом, получавших препарат Стелара® в течение, по крайней мере, 3,5 лет, наблюдался иммунный ответ на полисахаридную пневмококковую и противостолбнячную вакцину, схожий с таковым в контрольной группе пациентов, получавших несистемную терапию псориаза. У примерно одинакового относительного числа (%) пациентов, получающих лечение препаратом Стелара®, и пациентов из контрольной группы достигалась защитная концентрация противопневмококковых и противостолбнячных антител.
Фармакокинетика
Всасывание
Медиана времени до достижения Cmax устекинумаба в сыворотке крови у здоровых лиц составила 8.5 дней после его однократного п/к введения в дозе 90 мг. Медианы показателя tmax устекинумаба после его однократного подкожного введения в дозе 45 мг или 90 мг у пациентов с псориазом были сравнимы с таковыми, отмечаемыми у здоровых добровольцев.
Абсолютная биодоступность устекинумаба после его однократного подкожного введения пациентам с псориазом составляет оценивается равной 57.2%.
Распределение
Среднее значение Vd устекинумаба у пациентов с псориазом в терминальной фазе выведения после однократного в/в введения составляла от 57 до 83 мл/кг.
По результатам популяционного фармакокинетического анализа Vd устекинумаба в равновесном состоянии составил 4.62 л у пациентов с болезнью Крона и 4,44 л у пациентов с язвенным колитом.
Метаболизм
Метаболический путь устекинумаба не известен.
Выведение
Медиана системного клиренса устекинумаба у пациентов с псориазом после однократного в/в введения составляла от 1.99 до 2.34 мл/сут/кг.
В ходе клинических исследований T1/2 устекинумаба у пациентов с болезнью Крона, псориазом и/или псориатическим артритом находился в диапазоне от 15 до 32 дней, а его медиана составила около 3 недель.
По результатам популяционного фармакокинетического анализа клиренс устекинумаба составил 0.19 л/сут, а T1/2 – около 19 дней у пациентов с болезнью Крона и язвенным колитом.
Линейность дозы
Системная экспозиция устекинумаба (Cmax и AUC) после однократного внутривенного введения в дозе от 0.09 мг/кг до 4.5 мг/кг или после однократного п/к введения в дозе от приблизительно 24 мг и до 240 мг у пациентов с псориазом возрастала примерно пропорционально введенной дозе.
Фармакокинетика после однократного и многократного введения
Профили изменения концентрации устекинумаба в плазме крови с течением времени после однократного или многократного п/к введения в целом были предсказуемы. Css устекинумаба в плазме крови у пациентов с псориазом достигалась к 28-ой неделе после первого п/к введения и на 0-й и 4-й неделях при последующих введениях каждые 12 недель. Медиана наименьших значений Css находилась в диапазоне от 0.21 мкг/мл до 0.26 мкг/мл (при введении в дозе 45 мг) и от 0.47 мкг/мл до 0.49 мкг/мл (при введении в дозе 90 мг).
После в/в введения рекомендованной инициирующей дозы медиана Cmax устекинумаба составила 126.1 мкг/мл у пациентов с болезнью Крона и 127.0 мкг/мл у пациентов с язвенным колитом Начиная с 8-ой недели, п/к введение поддерживающей дозы устекинумаба, составляющей 90 мг, проводилось каждые 8 или 12 недель. Css устекинумаба достигалась к моменту введения второй поддерживающей дозы. При п/к введении устекинумаба 1 раз каждые 8 или 12 недель не наблюдалось признаков кумуляции дозы с течением времени.
При п/к введении поддерживающей дозы 90 мг устекинумаба 1 раз каждые 8 недель медиана наименьших значений Css находилась в диапазоне от 1.97 мкг/мл до 2.24 мкг/мл у пациентов с болезнью Крона и в диапазоне от 2.69 мкг/мл до 3.09 мкг/мл у пациентов с язвенным колитом. При п/к введении поддерживающей дозы 90 мг устекинумаба 1 раз каждые 12 недель медиана наименьших значений Css находилась в диапазоне от 0.61 мкг/мл до 0.76 мкг/мл у пациентов с болезнью Крона и в диапазоне от 0.92 мкг/мл до 1.19 мкг/мл у пациентов с язвенным колитом. На фоне наименьших значений Css устекинумаба, достигавшихся при его введении в дозе 90 мг с частотой 1 раз каждые 8 недель, отмечались более высокие показатели клинической ремиссии, чем при наименьших значениях Css, достигавшихся после введения устекинумаба в дозе 90 мг с частотой 1 раз каждые 12 недель.
Определение частоты п/к введения
На основании полученных данных и популяционного фармакокинетического анализа отмечено, что у пациентов с болезнью Крона и язвенным колитом с потерей ответа на терапию наблюдается понижение концентрации устекинумаба в крови с течением времени по сравнению с пациентами с сохраненным ответом на терапию. При терапии болезни Крона изменение кратности подкожного введения дозы 90 мг с 1-го раза в 12 недель до 1-го раза в 8 недель вызывало повышение наименьших значений Css устекинумаба и сопровождалось повышением эффективности. При терапии язвенного колита симуляции на основании популяционной фармакокинетической модели показали, что при изменении кратности п/к введения дозы 90 мг с 1-го раза в 12 недель до 1-го раза в 8 недель ожидается троекратное увеличение наименьших значений Css устекинумаба. Кроме того на основании данных клинических исследований у пациентов с язвенным колитом отмечается прямая зависимость между наименьшими значениями Css устекинумаба в плазме крови и клиническим ответом на терапию, клинической ремиссией и заживлением слизистой оболочки кишечника.
Влияние массы тела на фармакокинетику
У пациентов с псориазом или псориатическим артритом концентрация устекинумаба в плазме крови изменялась в зависимости от массы тела. При применении в любой из доз (45 мг или 90 мг) у пациентов с более высокой массой тела (>100 кг) отмечалась более низкая медиана концентрации устекинумаба по сравнению с пациентами с более низкой массой тела (≤100 кг). Однако при сравнении разных доз медиана наименьших концентраций устекинумаба в плазме крови у пациентов с более высокой массой тела (>100 кг) при дозе 90 мг была сравнима с таковой у пациентов с более низкой массой тела (≤100 кг) при дозе 45 мг.
Популяционный фармакокинетический анализ
В ходе популяционного фармакокинетического анализа с использованием данных, полученных у пациентов с псориазом, кажущийся клиренс и кажущийся Vd составили 0.465 л/сут и 15.7 л соответственно, а T1/2 у пациентов с псориазом составил около 3-х недель. Кажущийся клиренс устекинумаба не зависел от пола, возраста или расы. Он зависел от массы тела, при этом отмечалась тенденция к более высоким показателям кажущегося клиренса у пациентов с более высокой массой тела. Медиана кажущегося клиренса у пациентов с массой тела >100 кг была приблизительно на 55% выше, чем у пациентов с массой тела ≤100 кг. Медиана кажущегося Vd у пациентов с массой тела >100 кг была приблизительно на 37% выше, чем у пациентов с массой тела ≤100 кг. Аналогичные результаты были получены и в результате подтверждающего популяционного фармакокинетического анализа, проводившегося по данным, полученным для пациентов с псориатическим артритом.
В ходе популяционного фармакокинетического анализа у пациентов с псориазом была проведена оценка влияния сопутствующих заболеваний (сахарный диабет, артериальная гипертензия и гиперлипидемия) на фармакокинетику устекинумаба. На нее оказывало влияние наличие сахарного диабета, при этом у пациентов с сахарным диабетом отмечалась тенденция к более высоким показателям кажущегося клиренса. Средние показатели кажущегося клиренса у пациентов с сахарным диабетом были приблизительно на 29% выше, чем у пациентов без сахарного диабета.
Популяционный фармакокинетический анализ установил наличие тенденции к более высоким показателям клиренса устекинумаба у пациентов с положительным иммунным ответом.
Специальных исследований лекарственных взаимодействий у здоровых лиц или у пациентов с псориазом, псориатическим артритом, болезнью Крона или язвенным колитом не проводилось.
В ходе популяционного фармакокинетического анализа было изучено влияние лекарственных препаратов, наиболее часто применяемых у пациентов с псориазом (в т.ч. парацетамола/ацетаминофена, ибупрофена, ацетилсалициловой кислоты, метформина, аторвастатина, напроксена, левотироксина, гидрохлортиазида и противогриппозной вакцины), на фармакокинетику устекинумаба. Было установлено, что ни один из этих препаратов не оказывает значимого влияния. Фармакокинетика устекинумаба не изменялась при одновременном применении с НПВС и в случае предшествующей терапии ингибиторами ФНО-α у пациентов с псориатическим артритом. Фармакокинетика устекинумаба не изменялась при одновременном применении с метотрексатом, пероральными ГКС, 6-меркаптопурином или азатиоприном у пациентов с болезнью Крона, а также в случае предшествующей терапии биологическими препаратами (например, ингибиторами ФНО-α и/или ведолизумабом) у пациентов с язвенным колитом.
Эффекты ИЛ-12 или ИЛ-23 в отношении регуляции активности изоферментов CYP450 были изучены в ходе исследования in vitro с применением гепатоцитов человека. В результате было установлено, что ИЛ-12 и/или ИЛ-23 при концентрации 10 нг/мл не влияют на активность изоферментов CYP450 (CYP1A2, 2B6, 2C9, 2C19, 2D6 или 3A4).
Особые группы пациентов
Дети (в возрасте от 6 до 18 лет). Фармакокинетика устекинумаба у детей в возрасте от 6 до 18 лет, с псориазом, получавших рекомендованную дозу, в целом была сравнима с фармакокинетикой у взрослых пациентов с псориазом.
Фармакокинетика устекинумаба у детей в возрасте до 18 лет с болезнью Крона или язвенным колитом не изучалась.
Пожилые пациенты (в возрасте от 65 лет и старше). Исследования фармакокинетики у пациентов пожилого возраста не проводилось. Популяционный фармакокинетический анализ среди пациентов старше 65 лет не выявил влияния возраста на величины кажущегося клиренса и Vd.
Пациенты с нарушением функции почек. Данные о фармакокинетике препарата у пациентов с нарушением функции почек отсутствуют.
Пациенты с нарушением функции печени. Данные о фармакокинетике препарата у пациентов с нарушением функции печени отсутствуют.
Другие группы пациентов. Фармакокинетика устекинумаба сравнима у пациентов азиатского происхождения и пациентов неазиатского происхождения с псориазом, болезнью Крона или язвенным колитом.
Употребление алкоголя или табака не влияло на фармакокинетику устекинумаба.
Показания препарата
Стелара®
- Бляшечный псориаз
Препарат Стелара® показан для лечения бляшечного псориаза средней или тяжелой степени у взрослых пациентов при отсутствии ответа или при наличии противопоказаний, или при непереносимости других методов системной терапии, в т.ч. циклоспорина, метотрексата или ПУВА-терапии (псорален и ультрафиолет А).
- Бляшечный псориаз у детей
Препарат Стелара® показан для лечения бляшечного псориаза средней или тяжелой степени у детей и подростков в возрасте от 6 лет и старше при отсутствии адекватного ответа или непереносимости других методов системной терапии или фототерапии.
- Псориатический артрит
Лечение взрослых пациентов с активным псориатическим артритом (ПсА) в качестве монотерапии или в комбинации с метотрексатом при отсутствии адекватного ответа на предыдущую стандартную терапию при отсутствии адекватного ответа на предыдущую стандартную терапию.
- Болезнь Крона
Лечение взрослых пациентов с активной болезнью Крона средней или тяжелой степени с неадекватным ответом, утратой ответа или непереносимостью стандартной терапии или терапии ингибиторами ФНО, или имеющих медицинские противопоказания к проведению такой терапии.
- Язвенный колит
Лечение взрослых пациентов с активным язвенным колитом умеренной и тяжелой степени с неадекватным ответом, утратой ответа или непереносимостью стандартной или биологической терапии, или имеющих медицинские противопоказания к проведению такой терапии.
Режим дозирования
Препарат Стелара® в лекарственной форме раствор для п/к введения предназначен для п/к инъекций.
Взрослые пациенты
Бляшечный псориаз
Рекомендованная доза составляет 45 мг. Вторую инъекцию делают 4 недели спустя после первого применения, затем каждые 12 недель.
У пациентов с массой тела более 100 кг препарат рекомендуется использовать в дозе 90 мг.
При неэффективности терапии в течение 28 недель рекомендуется рассмотреть целесообразность применения препарата.
Коррекция дозы
Пациентам, у которых клиническая эффективность препарата при применении каждые 12 недель выражена недостаточно, следует увеличить дозу препарата до 90 мг каждые 12 недель. В случае если такой режим дозирования не эффективен, дозу препарата 90 мг следует вводить каждые 8 недель.
Возобновление лечения
Было показано, что возобновление терапии по схеме: вторая инъекция через 4 недели спустя после первого применения, а затем каждые 12 недель, является эффективным и безопасным.
Псориатический артрит
Рекомендованная доза составляет 45 мг. Вторую инъекцию делают 4 недели спустя после первого применения, затем каждые 12 недель.
У пациентов с массой тела более 100 кг препарат рекомендуется использовать в дозе 90 мг.
Болезнь Крона и язвенный колит
Пациентам с болезнью Крона или язвенным колитом рекомендовано однократное, инициирующее терапию внутривенное введение препарата Стелара® в лекарственной форме концентрат для приготовления раствора для инфузий в дозе, рассчитанной на основании массы тела, с последующим п/к введением дозы 90 мг через 8 недель (первое п/к введение) и 1 раз каждые 12 недель в дальнейшем.
Подробная информация о в/в введении препарата Стелара® указана в инструкции по медицинскому применению препарата Стелара®, концентрат для приготовления раствора для инфузий.
Пациенты, у которых через 8 недель после первого п/к введения не удалось получить достаточный ответ, в это время могут получить вторую п/к инъекцию.
У пациентов с потерей ответа при введении 1 раз в 12 недель положительный результат может получен при увеличении частоты введений до 1-го раза в 8 недель.
В дальнейшем препарат пациентам можно вводить 1 раз в 8 недель или 1 раз в 12 недель, в зависимости от клинической ситуации.
Во время терапии препаратом Стелара®можно продолжать терапию иммуномодуляторами и/или ГКС. Пациентам, у которых удалось добиться ответа на терапию препаратом Стелара®, терапию ГКС можно сократить или отменить, в соответствии со стандартами терапии.
При прерывании терапии болезни Крона возобновление ее посредством подкожных инъекций каждые 8 недель является безопасным и эффективным.
Дети (6 лет и старше)
Бляшечный псориаз
Рекомендованная доза зависит от массы тела пациента, как показано в таблице 1. Вторую инъекцию делают 4 недели спустя после первого применения, затем каждые 12 недель.
Таблица 1. Рекомендованная доза препарата Стелара® у детей с бляшечным псориазом
* для расчета необходимого объема препарата (мл) для пациентов с массой тела менее 60 кг используется следующая формула: масса тела (кг) × 0,0083 (мл/кг).Рассчитанный объем препарата округляется до сотой доли мл (0,01 мл). Инъекция осуществляется градуированным шприцем вместимостью 1 мл. Для пациентов, которым необходима доза менее 45 мг, препарат Стелара® выпускается во флаконах с дозировкой 45 мг.
Таблица 2. Объем введения препарата Стелара® у детей с бляшечным псориазом с массой тела менее 60 кг
Детям препарат применяется в условиях стационара.
При неэффективности терапии в течение 28 недель рекомендуется рассмотреть целесообразность применения препарата.
Особые группы пациентов
Дети. Исследования препарата Стелара® у детей младше 6 лет не проводились.
Пожилые пациенты. В клинических исследованиях не наблюдалось существенных возрастных различий клиренса или объема распределения препарата. Количество пациентов в возрасте от 65 лет и старше было недостаточным для окончательного вывода о влиянии возраста на клиническую эффективность препарата.
Пациенты с нарушением функции почек. У пациентов с почечной недостаточностью не проводилось отдельных исследований препарата.
Пациенты с нарушением функции печени. У пациентов с печеночной недостаточностью не проводилось отдельных исследований препарата.
Указания по введению препарата
Препарат предназначен для п/к введения.
Перед введением препарата внимательно осмотрите содержимое шприца. Раствор может быть прозрачным или слегка опалесцирующим от бесцветного до светло-желтого цвета, может содержать единичные прозрачные частицы белка. Такой внешний вид является нормальным для белковых растворов. При изменении цвета, помутнении или наличии твердых частиц раствор использовать нельзя. Устекинумаб не содержит консервантов, поэтому любой неиспользованный остаток препарата в шприце использовать нельзя.
Препарат не следует смешивать с другими жидкостями для инъекции. Если для введения дозы 90 мг используют 2 шприца по 45 мг препарата, следует сделать 2 последовательные инъекции. При этом вторая инъекция должна быть сделана сразу же после первой. Инъекции следует делать в разные области. Не встряхивайте препарат. Длительное энергичное встряхивание может повредить препарат. Не используйте препарат, если его встряхивали. В начале лечения инъекции препарата Стелара® должен делать только медицинский персонал, однако, в последующем, если врач сочтет это возможным, пациенты или лица, осуществляющие уход за ними, или лица, осуществляющие уход за ними, могут делать инъекции препарата Стелара® самостоятельно, соблюдая все необходимые предосторожности и пройдя предварительно обязательное обучение технике подкожных инъекций, с последующим контролем врача. У детей в возрасте от 6 до 18 лет все инъекции должны проводиться медицинским персоналом.
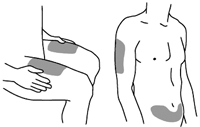
Рекомендованными местами для инъекции являются верхняя часть бедра или область живота примерно 5 см ниже пупка. Также можно использовать область плеча (см. 
Рис.1. Рекомендованные места для инъекции
Рис. 2. Шприц с препаратом Стелара®
Достаньте шприц с препаратом из картонной пачки, держа его в направлении иголкой от себя. Убедитесь, что шприц не поврежден. Тщательно вымойте руки и обработайте место инъекции ватным тампоном, смоченным антисептиком. Снимите защитный колпачок с иглы. Вы можете увидеть пузырек воздуха в шприце. Это допустимо, не пытайтесь удалить его. Вы также можете увидеть капельку жидкости на конце иглы. Это также допустимо.
Никогда не снимайте защитный колпачок, пока не определились с местом инъекции. Не допускайте контакта иголки с посторонними предметами.
Аккуратно зажмите кожу в области инъекции между большим и указательным пальцами, воткните иголку в кожу и медленно опустите поршень шприца до предела (Рис. 3).
Рис. 3.
После этого отпустите кожу и осторожно выньте иглу. Как только вы уберете палец с поршня, иголка автоматически скроется в корпусе шприца (Рис.4).
Рис. 4.
Приложите ватный тампон, смоченный антисептиком, к месту инъекции и подержите несколько секунд. Не трите место инъекции. При необходимости заклейте пластырем.
Использованный шприц необходимо утилизировать в соответствии с местными требованиями по уничтожению такого рода отходов. Повторное использование шприца и иглы запрещено.
Побочное действие
Побочные реакции — это нежелательные явления, которые были расценены как обоснованно связанные с использованием устекинумаба на основании всесторонней оценки имеющихся данных о нежелательных явлениях. В отдельных случаях не представляется возможным достоверно установить наличие причинной связи между нежелательным явлением и применением устекинумаба. Кроме того, поскольку клинические исследования проводятся в разных условиях, невозможно провести непосредственное сравнение частоты нежелательных реакций, наблюдаемых в клиническом исследовании препарата, с частотой, наблюдаемой в клинических исследованиях другого препарата, и частота нежелательного явления, наблюдаемая в клиническом исследовании, может не соответствовать частоте, наблюдаемой в клинической практике.
Опыт применения в клинических исследованиях у взрослых пациентов с псориазом, псориатическим артритом, болезнью Крона и язвенным колитом
Данные по безопасности, представленные далее, отражают применение препарата Стелара® в 14 исследованиях II фазы и III фазы, проведенных у 6709 пациентов (4135 пациентов с псориазом и/или псориатическим артритом, 1749 пациентов с болезнью Крона и 825 пациентов с язвенным колитом). Наиболее частыми (>5%) побочными действиями, наблюдавшимися в контролируемых периодах клинических исследований препаратом Стелара®, проведенных у пациентов по всем показаниям к применению, были назофарингит и головная боль. Большинство случаев были расценены как легкие и не требующие прекращения терапии. Общий профиль безопасности препарата Стелара® был схожим у пациентов по всем показаниям к применению.
В Таблице 3 представлен обзор побочных реакций, зарегистрированных в клинических исследованиях. Расчет частоты этих побочных реакций проводился на основании случаев, зарегистрированных во время начальных контролируемых периодов клинических исследований. Побочные реакции расположены в порядке уменьшения частоты, в соответствии со следующими категориями: очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (≥1/1000, <1/100), редко (≥1/10000, <1/1000).
Таблица 3. Обзор побочных реакций, зарегистрированных в клинических исследованиях
Инфекции
В плацебо-контролируемых исследованиях частота инфекций или серьезных инфекций была сравнима у пациентов, получавших препарат Стелара®, и у пациентов, получавших плацебо. В плацебо-контролируемых периодах клинических исследований частота инфекций составляла 1.36 и 1.34 на пациенто-год наблюдения в группах, получавших препарат Стелара®, и плацебо соответственно.
В ходе контролируемых и неконтролируемых периодов клинических исследований, что составляет 11581 пациенто-лет терапии у 6709 пациентов, получавших препарат Стелара®, частота инфекций составляла 0.91 на пациенто-год наблюдения. Частота серьезных инфекций у пациентов, получавших препарат Стелара®, составляла 0.02 на пациенто-год наблюдения.
В клинических исследованиях у пациентов с латентным туберкулезом, одновременно получавших изониазид, не отмечалось случаев развития туберкулеза.
Злокачественные новообразования
В ходе плацебо-контролируемых периодов клинических исследований, проведенных у пациентов с псориазом, псориатическим артритом, болезнью Крона и язвенным колитом, частота возникновения злокачественных новообразований, без учета случаев немеланомного рака кожи, у пациентов, получавших препарат Стелара®, составляла 0.11 на 100 пациенто-лет наблюдения и 0.23 на 100 пациенто-лет наблюдения у пациентов, получавших плацебо.
Частота возникновения немеланомного рака кожи у пациентов, получавших препарат Стелара®, составляла 0.43 на 100 пациенто-лет наблюдения по сравнению с 0.46 на 100 пациенто-лет наблюдения у пациентов, получавших плацебо, в ходе контролируемых и неконтролируемых периодов клинических исследований, что составляет 11561 пациенто-лет терапии у 6709 пациентов.
Злокачественные новообразования, кроме случаев немеланомного рака кожи, были зарегистрированы с частотой 0.54 на 100 пациенто-лет наблюдения у пациентов, получавших препарат Стелара®. Частота случаев возникновения немеланомного рака кожи у пациентов, получавших препарат Стелара®, составила 0.49 на 100 пациенто-лет наблюдения (56 пациентов на 11545 пациенто-лет наблюдения).
Частота возникновения злокачественных новообразований у пациентов, получавших препарат Стелара®, была аналогична частоте, ожидаемой в общей популяции (стандартизованное отношение частоты = 0.93 [95% доверительный интервал: 0.71, 1.20], с учетом поправок на возраст, пол и расовую принадлежность)1.
Соотношение пациентов с базальноклеточным и плоскоклеточным типами рака (3:1) соответствовало соотношению, ожидаемому в общей популяции.
1 — База данных программы наблюдения, эпидемиологии и отслеживания исходов (SEER) (www.seer.cancer.gov) SEER*Srart Database: Incidence — SEER 6.6.2 Regs Research Data, подача — ноябрь 2009 (1973-2007) — в связи с характеристиками страны — США в целом, 1969-2007 Округи, Национальный институт онкологии, DCCPS, исследовательская программа наблюдения, группа наблюдательных систем, выпущено в апреле 2010, на основании подачи в ноябре 2009 года.
Реакции гиперчувствительности и инфузионные реакции
Подкожное введение. Во время контролируемых периодов клинических исследований препарата Стелара®, проведенных у пациентов с псориазом и псориатическим артритом, сыпь и крапивница наблюдались менее чем у 1% пациентов каждая
Внутривенное введение. В исследованиях индуцирующей терапии при болезни Крона и язвенном колите не было зарегистрировано случаев развития анафилактических или других серьезных инфузионных реакций. В исследованиях по показанию болезнь Крона побочные действия, развивавшиеся во время инфузии или в течение часа после инфузии, были зарегистрированы у 2.4% из 466 пациентов, получавших плацебо, и у 2.6% из 470 пациентов, получавших препарат Стелара в рекомендованной дозе. В исследованиях по показанию язвенный колиту 1.9% из 319 пациентов, получавших плацебо, и у 0.9% из 320 пациентов, получавших рекомендуемую дозу препарата Стелара, побочные реакции отмечались во время инфузии или в течение часа после инфузии.
Иммуногенность
В клинических исследованиях при псориазе и псориатическом артрите образование антител к устекинумабу было выявлено у 12,4% пациентов, получавших препарат Стелара®. У пациентов с положительными результатами тестов на антитела к устекинумабу отмечалась тенденция к более низкой эффективности, тем не менее, наличие антител не препятствовало развитию клинического ответа. У большинства пациентов с положительными результатами тестов на антитела присутствовали также и нейтрализующие их антитела.
В клинических исследованиях у пациентов с болезнью Крона и язвенным колитом образование антител к устекинумабу было выявлено соответственно у 2.9% и у 4.6% пациентов, получавших препарат Стелара® в течение около одного года. Не наблюдалось очевидной взаимосвязи между образованием антител к устекинумабу и развитием реакций в месте введения препарата.
Опыт применения в клинических исследованиях у детей с псориазом
Безопасность препарата Стелара® изучалась в двух исследованиях фазы 3 у детей с бляшечным псориазом от средней до тяжелой степени. Первое исследование включало 110 пациентов в возрасте от 12 до 18 лет, которые получали лечение в течение 60 недель (CADMUS), а второе – 44 пациента в возрасте от 6 до 12 лет, которые получали лечение в течение 56 недель (CADMUS Jr). В целом, зарегистрированные побочные действия были аналогичны наблюдавшимся в предшествующих исследованиях у взрослых пациентов с бляшечным псориазом
Опыт пострегистрационного применения
Побочные реакции в Таблице 4 расположены в порядке уменьшения частоты* с использованием следующих категорий:
очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (≥1/1000, <1/100), редко (≥1/10000, <1/1000), в т.ч. отдельные сообщения.
Таблица 3. Пострегистрационные сообщения
* Расчет частоты побочных реакций, зарегистрированных при пострегистрационном периоде наблюдения, проводился на основании 11 плацебо-контролируемых клинических исследований, в случае, если такое побочное действие наблюдалось в этих исследованиях. В противном случае, считалось, что частота ниже определенного значения, учитывая объем применения в 11 клинических исследованиях, в которых это побочное действие не наблюдалось.
Противопоказания к применению
- повышенная чувствительность к устекинумабу или любому вспомогательному веществу препарата;
- детский возраст до 6 лет (по показанию «бляшечный псориаз»), до 18 лет (по показаниям «псориатический артрит», «болезнь Крона» и «язвенный колит»);
- беременность;
- период грудного вскармливания;
- серьезные инфекционные заболевания в острой фазе, в т.ч. туберкулез;
- злокачественные новообразования.
С осторожностью
- хронические или рецидивирующие паразитарные и инфекционные заболевания вирусной, грибковой или бактериальной природы;
- злокачественные опухоли в анамнезе;
- пожилой возраст (≥ 65 лет).
Применение при беременности и кормлении грудью
Способные к деторождению женщины
Женщины, способные к деторождению, должны использовать эффективные методы контрацепции во время терапии и в течение как минимум 15 недель после ее окончания.
Беременность
Данные о применении устекинумаба у беременных женщин являются недостаточными. В исследованиях у животных не обнаружено прямого или косвенного негативного влияния в отношении беременности, развития эмбриона/плода, родоразрешения и постнатального развития. В качестве меры предосторожности предпочтительно избегать применения препарата Стелара®во время беременности.
Период грудного вскармливания
Неизвестно выделяется ли устекинумаб с человеческим грудным молоком. В исследованиях у животных устекинумаб в небольшом количестве выделялся с грудным молоком. Неизвестно абсорбируется ли устекинумаб системно после введения. В связи с потенциальным риском возникновения нежелательных реакций устекинумаба у младенцев, находящихся на грудном вскармливании, решение о прекращении грудного вскармливания во время применения препарата и в течение 15 недель после завершения терапии или о прекращении применения препарата Стелара® должно быть принято на основании оценки пользы грудного вскармливания для ребенка и пользы терапии препаратом Стелара® для матери.
Фертильность
Оценка влияния препарата Стелара® на фертильность человека не проводилась
Применение при нарушениях функции печени
Данных о фармакокинетике препарата у пациентов с печеночной недостаточностью нет.
Изучение препарата у пациентов с печеночной недостаточностью не проводилось.
Применение при нарушениях функции почек
Данных о фармакокинетике препарата у пациентов с почечной недостаточностью нет.
Изучение препарата у пациентов с почечной недостаточностью не проводилось.
Применение у детей
Противопоказания: детский возраст до 6 лет — по показанию «бляшечный псориаз»; до 18 лет — по показаниям «псориатический артрит», «болезнь Крона» и «язвенный колит».
Применение у пожилых пациентов
С осторожностью следует применять у пациентов пожилого возраста.
Особые указания
Прослеживаемость
Для улучшения прослеживаемости биологических лекарственных препаратов необходимо записывать торговое наименование и номер серии введенного препарата.
Инфекции
Препарат Стелара® является селективным иммунодепрессантом, и потенциально может увеличивать риск возникновения инфекций и реактивации латентных инфекций.
В ходе клинических исследований у пациентов, получавших препарат Стелара®, наблюдались случаи возникновения серьезных бактериальных и вирусных инфекций.
Препарат Стелара® не следует применять у пациентов с клинически значимой активной инфекцией. Следует с осторожностью применять препарат Стелара® у пациентов с хронической инфекцией или рецидивирующей инфекцией в анамнезе.
Перед началом терапии препаратом Стелара® следует обследовать пациентов на наличие туберкулеза. Препарат Стелара® не следует применять у пациентов с активным туберкулезом. Перед применением препарата Стелара® следует провести терапию латентного туберкулеза. Кроме того, противотуберкулезную терапию перед началом применения препарата Стелара® следует провести пациентам с латентным или активным туберкулезом в анамнезе, для которых отсутствует подтверждение проведения эффективного курса лечения. У пациентов, получающих препарат Стелара®, во время и после терапии следует внимательно контролировать признаки или симптомы активного туберкулеза.
Пациентов следует проинструктировать о необходимости обращения за медицинской помощью в случае появления признаков или симптомов, указывающих на развитие инфекции. В случае, если у пациента развивается серьезная инфекция, необходимо проводить тщательное наблюдение пациента и не применять препарат Стелара® до разрешения инфекционного процесса.
Злокачественные новообразования
Препарат Стелара® является селективным иммунодепрессантом. Препараты-иммунодепрессанты могут способствовать увеличению риска развития злокачественных новообразований. У некоторых пациентов, получавших препарат Стелара® в рамках клинических исследований, наблюдалось развитие кожных и некожных злокачественных новообразований.
Применение препарата Стелара® не изучалось у пациентов со злокачественными новообразованиями в анамнезе. Следует проявлять осторожность при назначении препарата Стелара® пациентам со злокачественными новообразованиями в анамнезе, а также при рассмотрении возможности продолжения терапии препаратом Стелара® у пациентов с диагностированными злокачественными новообразованиями.
У всех пациентов, особенно у пациентов в возрасте старше 60 лет и у пациентов, ранее получавших длительную терапию иммунодепрессантами или ПУВА-терапию, необходимо проводить обследование на наличие немеланомного рака кожи.
Реакции гиперчувствительности
Системные реакции гиперчувствительности. В ходе пострегистрационного наблюдения были зарегистрированы серьезные реакции гиперчувствительности, в некоторых случаях через несколько дней после применения. Отмечалась анафилаксия и ангионевротический отек. В случае развития анафилактических или других серьезных реакций гиперчувствительности следует начать соответствующую терапию и прекратить применение препарата Стелара®.
Реакции гиперчувствительности со стороны органов дыхания. Случаи аллергического альвеолита, эозинофильной пневмонии и неинфекционной организующейся пневмонии отмечались в пострегистрационный период применения устекинумаба. Клинические проявления включали кашель, одышку и интерстициальные инфильтраты после применения от одной до трех доз препарата. Серьезные исходы включали дыхательную недостаточность и длительную госпитализацию. Улучшение состояния отмечалось после прекращения терапии устекинумабом, а также, в некоторых случаях, после применения глюкокортикостероидов. Если инфекция исключена и диагноз гиперчувствительности подтвержден, то необходимо прекратить применение устекинумаба и назначить соответствующую терапию.
Гиперчувствительность к латексу. Защитный колпачок для иглы содержит в своем составе натуральную резину (производное латекса) и при наличии гиперчувствительности к латексу может вызвать аллергические реакции.
Вакцинация
Не рекомендуется применять живые вирусные или живые бактериальные вакцины одновременно с препаратом Стелара®.
Данные о вторичном инфицировании при применении живых вакцин у пациентов, получающих препарат Стелара®, отсутствуют.
Следует соблюдать осторожность при применении живых вакцин для иммунизации членов семьи пациента, получающего лечение препаратом Стелара®, поскольку имеется риск вирусо- или бактериовыделения и передачи инфекции от этих лиц пациентам.
Пациентам, получающим препарат Стелара®, можно одновременно вводить инактивированные или неживые вакцины.
Длительное лечение препаратом Стелара® не подавляет гуморальный иммунный ответ на вакцины, содержащие пневмококковый полисахарид и противостолбнячную вакцину.
Сопутствующая иммуносупрессивная терапия
Безопасность и эффективность препарата Стелара® при применении в комбинации с иммунодепрессантами или фототерапией не изучалась в исследованиях у пациентов с псориазом.
В исследованиях у пациентов с псориатическим артритом одновременное применение метотрексата не влияло на безопасность и эффективность препарата Стелара®. В исследованиях у пациентов с болезнью Крона и язвенным колитом совместное применение препарата Стелара® с иммуномодуляторами (6-меркаптопурином, азатиоприном, метотрексатом) или с глюкокортикостероидами не влияло на безопасность и эффективность препарата Стелара®. Следует проявлять осторожность при рассмотрении возможности одновременного применения иммунодепрессантов и устекинумаба, а также при переходе с терапии другими биологическими препаратами на терапию устекинумабом.
Иммунотерапия
Безопасность и эффективность применения препарата Стелара® у пациентов, прошедших иммунотерапию аллергических заболеваний, не установлена. Препарат Стелара® может оказывать влияние на иммунотерапию аллергических заболеваний. Следует соблюдать осторожность при применении устекинумаба у пациентов, получающих или ранее получавших иммунотерапию аллергических заболеваний, особенно если такая терапия связана с анафилаксией.
Серьезные кожные реакции
У пациентов с псориазом отмечались случаи эксфолиативного дерматита после применения устекинумаба. У пациентов с бляшечным псориазом может развиваться эритродермический псориаз, являющий частью естественного течения заболевания, с симптомами, которые могут быть клинически неотличимы от эксфолиативного дерматита. При наблюдении пациентов с псориазом врачу необходимо проявлять настороженность в отношении симптомов эритродермического псориаза и эксфолиативного дерматита. При появлении таких симптомов необходимо назначить соответствующую терапию. Применение препарата Стелара®должно быть прекращено при подозрении на проявление данного побочного действия.
Особые группы пациентов
Пожилые пациенты (≥ 65 лет). В целом не наблюдалось различий между эффективностью и безопасностью препарата Стелара®при его применении у пациентов в возрасте от 65 и старше по сравнению с более молодыми пациентами в клинических исследованиях по одобренным показаниям. Однако количество пациентов в возрасте от 65 лет и старше было недостаточным для определения различий их ответа на терапию от более молодых пациентов. Так как в целом в популяции пожилых пациентов наблюдается более частое возникновение инфекций, то необходимо соблюдать осторожность при терапии таких пациентов.
Хранение
В случае необходимости шприцы можно однократно хранить при комнатной температуре не выше 30 °С, в оригинальной упаковке, в защищенном от света месте в течение не более 30 дней.
После хранения шприцев при комнатной температуре не выше 30 °С запрещается их хранение в холодильнике (при температуре от 2 °С до 8 °С).
Влияние на способность к управлению транспортными средствами и механизмами
Исследований не проводилось.
Передозировка
При однократных в/в введениях доз до 6 мг/кг в рамках клинических исследований не отмечалось токсичности, ограничивающей дозу.
Лечение: в случае передозировки рекомендуется наблюдать пациента на предмет любых признаков и проявлений нежелательных реакций с целью немедленного начала соответствующей симптоматической терапии.
Лекарственное взаимодействие
Исследования лекарственного взаимодействия с препаратом Стелара® у человека не проводились.
Эффекты ИЛ-12 или ИЛ-23 на регуляцию изоферментов CYP450 оценивались in vitro с использованием гепатоцитов человека. В исследовании было показано, что ИЛ-12 и/или ИЛ-23 в концентрации 10 нг/мл не влияют на активность изоферментов CYP450 человека (CYP1A2, 2В6, 2С9, 2С19, 2D6 или 3А4). Полученные результаты не предполагают необходимости коррекции дозы у пациентов, принимающих одновременно с препаратом Стелара® препараты, метаболизируемые изоферментами CYP450.
Живые вакцины не следует вводить одновременно с применением препарата Стелара®.
При совместном применении препарата Стелара® и таких препаратов, как парацетамол (ацетаминофен), ибупрофен, ацетилсалициловая кислота, метформин, аторвастатин, напроксен, левотироксин и гидрохлоротиазид взаимодействия не было выявлено.
Безопасность и эффективность совместного применения препарата Стелара® с другими иммунодепрессантами (метотрексат, циклоспорин) или биологическими препаратами для лечения псориаза не была оценена.
Условия хранения препарата Стелара®
Препарат следует хранить в недоступном для детей, защищенном от света месте, в оригинальной упаковке при температуре от 2° до 8°С. Не замораживать. Не встряхивать.
Срок годности препарата Стелара®
Срок годности — 3 года. Не использовать после истечения срока годности.
Условия реализации
Препарат отпускают по рецепту.
Контакты для обращений
ЯНССЕН, ФАРМАЦЕВТИЧЕСКОЕ ПОДРАЗДЕЛЕНИЕ ООО «ДЖОНСОН & ДЖОНСОН»

|
|
ЯНССЕН, 121614 Москва, ул. Крылатская, д. 17, корп. 2 |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Стелара — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер
ЛП-005728
Торговое наименование препарата
Стелара
Международное непатентованное наименование
Устекинумаб
Лекарственная форма
концентрат для приготовления раствора для инфузий
Состав
1 мл концентрата содержит:
действующее вещество: устекинумаб — 5,0 мг;
вспомогательные вещества: L-гистидин — 0,8 мг, L-гистидина гидрохлорида моногидрат — 1,1 мг, сахароза — 85 мг, полисорбат 80 — 0,40 мг, L-метионин — 0,40 мг, динатрия эдетата дигидрат — 0,02 мг, вода для инъекций — до 1,0 мл.
Описание
Прозрачная или почти прозрачная, бесцветная жидкость или жидкость с коричневатым или коричневато-желтоватым или желтоватым оттенком, которая может содержать незначительное количество небольших прозрачных или белых частиц белка.
Фармакотерапевтическая группа
Иммуносупрессоры, ингибиторы интерлейкина
Код АТХ
L04A
Фармакодинамика:
Механизм действия
Устекинумаб представляет собой полностью человеческое моноклональное антитело IgG1к, которое специфично связывается с общей единицей белка р40 интерлейкинов (ИЛ) ИЛ-12 и ИЛ-23 человека. Препарат Стелара ингибирует биоактивность ИЛ-12 и ИЛ-23 человека, предотвращая связывание р40 с рецептором ИЛ-12Rβ1, экспрессируемым на поверхности иммунных клеток. Препарат Стелара не связывается с ИЛ-12 или ИЛ-23, которые уже связаны с рецепторами ИЛ-12Rβ1 на поверхности клеток. Таким образом, маловероятно, что препарат Стелара будет способствовать опосредованной комплементом или антителами цитотоксичности в отношении клеток, экспрессирующих рецепторы к ИЛ-12 и/или ИЛ-23.
ИЛ-12 и ИЛ-23 представляют собой гетеродимерные цитокины, секретируемые активированными антигенпредставляющими клетками, например, макрофагами и дендритными клетками. ИЛ-12 стимулирует клетки-естественные киллеры (NK) и дифференцировку CD4+ Т-клеток до фенотипа Т-хелпера-1 (Тh1), а также стимулирует выработку интерферона гамма (ИФНγ). ИЛ-23 индуцирует путь Т-хелперов-17 (Тh17) и способствует выработке ИЛ-17А, ИЛ-21 и ИЛ-22.
У пациентов с болезнью Крона отмечено повышение уровней ИЛ-12 и ИЛ-23 в кишечнике и лимфатических узлах. Это сопровождается увеличением уровней интерферона и ИЛ-17А в сыворотке, указывая, что ИЛ-12 и ИЛ-23 способствуют активации Th1 и Тh17 при болезни Крона. Кроме того, как ИЛ-12, так и ИЛ-23 могут стимулировать выработку Т-клетками ФНО-α, что приводит к хроническому воспалению кишечника и повреждению эпителиальных клеток. Была обнаружена достоверная взаимосвязь между болезнью Крона и генетическим полиморфизмом генов ИЛ23R и ИЛ 2В, что указывает на потенциальную причинную роль сигнальной системы ИЛ-12/23 в развитии заболевания. Это подтверждается доклиническими данными, свидетельствующими, что активация сигнального пути ИЛ-12/23 необходима для развития повреждения кишечника у мышей со смоделированным воспалительным поражением кишечника. Связывая общую субъединицу р40 ИЛ-12 и ИЛ-23, препарат Стелара может влиять на клиническое течение болезни Крона посредством прерывания пути выработки цитокинов Тh1 и Тh17, которые играют центральную роль в патогенезе этих заболеваний.
У пациентов с болезнью Крона в результате терапии препаратом Стелара отмечалось значимое снижение уровней маркеров воспаления, в том числе С-реактивного белка (CRP) и фекального кальпротектина. У пациентов, получавших препарат Стелара в течение 44 недель, по сравнению с группой плацебо достигалось и сохранялось снижение в сыворотке крови концентраций ИФНγ и ИЛ-17А, являющихся провоспалительными цитокинами, регулируемыми ИЛ-12 и ИЛ-23.
Иммунизация
Во время долгосрочного клинического исследования у пациентов, получавших препарат Стелара в течение, по крайней мере, 3.5 лет, наблюдался иммунный ответ на полисахаридную пневмококковую и противостолбнячную вакцину, схожий с таковым в контрольной группе пациентов, получавших несистемную терапию. У примерно одинакового относительного числа (%) пациентов, получающих лечение препаратом Стелара, и пациентов из контрольной группы достигалась защитная концентрация противопневмококковых и противостолбнячных антител.
Фармакокинетика:
Всасывание
Медиана времени до достижения максимальной концентрации устекинумаба в сыворотке крови (tmax) у здоровых лиц составила 8,5 дней после его однократного подкожного введения в дозе 90 мг. Медианы показателя tmax устекинумаба после его однократного подкожного введения в дозе 45 мг или 90 мг у пациентов были сравнимы с таковыми, отмечаемыми у здоровых добровольцев. Абсолютная биодоступность устекинумаба после его однократного подкожного введения пациентам оценивается равной 57,2%.
Распределение
Среднее значение объема распределения устекинумаба у пациентов в терминальной фазе выведения (Vz) после однократного внутривенного введения составляла от 57 до 83 мл/кг.
Метаболизм
Метаболический путь устекинумаба не известен.
Выведение
Медиана системного клиренса (CL) устекинумаба у пациентов после однократного внутривенного введения составляла от 1,99 до 2,34 мл/сут/кг.
В ходе клинических исследований период полувыведения (Т1/2) устекинумаба у пациентов с болезнью Крона в диапазоне от 15 до 32 дней, а его медиана составила около 3-х недель.
Линейность дозы
Системная экспозиция устекинумаба (Сmах и AUC) после однократного внутривенного введения в дозе от 0,09 мг/кг до 4,5 мг/кг или после однократного подкожного введения в дозе от приблизительно 24 мг и до 240 мг у пациентов возрастала примерно пропорционально введенной дозе.
Фармакокинетика после однократного и многократного введения
У пациентов с болезнью Крона после внутривенного ведения в рекомендованной инициирующей дозе медиана максимальной концентрации устекинумаба составила 126,1 мкг/мл. Начиная с 8-ой недели, подкожное введение поддерживающей дозы устекинумаба. составляющей 90 мг, проводилось каждые 8 или 12 недель.
Равновесная концентрация устекинумаба достигалась к моменту введения второй поддерживающей дозы. Медиана наименьших равновесных концентраций устекинумаба при введении в дозе 90 мг каждые 8 или 12 недель находилась в диапазоне от 1,97 мкг/мл до 2,24 мкг/мл и от 0,61 мкг/мл до 0,76 мкг/мл соответственно. На фоне наименьших равновесных концентраций устекинумаба. достигавшихся при его введении в дозе 90 мг с частотой 1 раз каждые 8 недель, отмечались более высокие показатели клинической ремиссии, чем при наименьших равновесных концентрациях, достигавшихся после введения устекинумаба в дозе 90 мг с частотой 1 раз каждые 12 недель.
Влияние массы тела на фармакокинетику
Концентрация устекинумаба в плазме крови при подкожном введении изменялась в зависимости от массы тела. При применении в дозе 45 мг или 90 мг у пациентов с более высокой массой тела (>100 кг) отмечалась более низкая медиана концентрации устекинумаба по сравнению с пациентами с более низкой массой тела (<100 кг). Однако при сравнении разных доз медиана наименьших концентраций устекинумаба в плазме крови у пациентов с более высокой массой тела (>100 кг) при дозе 90 мг была сравнима с таковой у пациентов с более низкой массой тела (≤100 кг) при дозе 45 мг.
Популяционный фармакокинетический анализ
В ходе популяционного фармакокинетического анализа при подкожном введении кажущийся клиренс (CL/F) и кажущийся объем распределения (V/F) составили 0,465 л/сут и 15,7 л соответственно, а Т1/2 составил около 3-х недель. Кажущийся клиренс при подкожном введении устекинумаба не зависел от пола, возраста или расы. Он зависел от массы тела, при этом отмечалась тенденция к более высоким показателям кажущегося клиренса у пациентов с более высокой массой тела. Медиана кажущегося клиренса у пациентов с массой тела >100 кг была приблизительно на 55% выше, чем у пациентов с массой тела ≤100 кг. Медиана кажущегося объема распределения у пациентов с массой тела >100 кг была приблизительно на 37% выше, чем у пациентов с массой тела ≤100 кг.
В ходе популяционного фармакокинетического анализа была проведена оценка влияния сопутствующих заболеваний (сахарный диабет, артериальная гипертензия и гиперлипидемия) на фармакокинетику устекинумаба при подкожном введении. На нее оказывало влияние наличие сахарного диабета, при этом у пациентов с сахарным диабетом отмечалась тенденция к более высоким показателям кажущегося клиренса. Средние показатели кажущегося клиренса у пациентов с сахарным диабетом были приблизительно на 29% выше, чем у пациентов без сахарного диабета.
Популяционный фармакокинетический анализ установил наличие тенденции к более высоким показателям клиренса устекинумаба у пациентов с положительным иммунным ответом.
Специальных исследований лекарственных взаимодействий не проводилось.
В ходе популяционного фармакокинетического анализа было изучено влияние некоторых лекарственных препаратов (в том числе парацетамола/ ацетаминофена ибупрофена, ацетилсалициловой кислоты, метформина, аторвастатина, напроксена, левотироксина. гидрохлортиазида и противогриппозной вакцины) на фармакокинетику устекинумаба. Было установлено, что ни один их этих препаратов не оказывает значимого влияния. У пациентов с болезнью Крона фармакокинетика устекинумаба не изменялась при одновременном применении с метотрексатом, нестероидными противовоспалительными лекарственными средствами, пероральными кортикостероидами, 6-меркаптопурином, азатиоприном, или в результате предшествующего применения препаратов, блокирующих ФНО-α.
Эффекты ИЛ-12 или ИЛ-23 в отношении регуляции активности изоферментов CYP450 были изучены в ходе исследования in vitro с применением гепатоцитов человека. В результате было установлено, что ИЛ-12 и/или ИЛ-23 при концентрации 10 нг/мл не влияют на активность изоферментов CYP450 (CYP1А2, 2В6, 2С9, 2С19, 2D6 или 3А4).
Особые группы пациентов
Дети (в возрасте до 18 лет)
Фармакокинетика устекинумаба в лекарственной форме концентрат для приготовления раствора для инфузий у детей в возрасте до 18 лет не изучалась.
Пожилые пациенты (в возрасте от 65 лет и старше)
Исследования фармакокинетики у пациентов пожилого возраста не проводилось. Популяционный фармакокинетический анализ среди пациентов старше 65 лет не выявил влияния возраста на величины кажущегося клиренса (CL/F) и объема распределения (V/F).
Пациенты с нарушением функции почек
Данные о фармакокинетике препарата у пациентов с нарушением функции почек отсутствуют. Пациенты с нарушением функции печени
Данные о фармакокинетике препарата у пациентов с нарушением функции печени отсутствуют.
Другие группы пациентов
Фармакокинетика устекинумаба сравнима у пациентов азиатского происхождения и у пациентов неазиатского происхождения.
Употребление алкоголя или табака не влияло на фармакокинетику устекинумаба.
Показания:
Препарат Стелара в лекарственной форме концентрат для приготовления раствора для инфузий предназначен для терапии взрослых пациентов с болезнью Крона умеренной и тяжелой степени.
Препарат Стелара в лекарственной форме концентрат для приготовления раствора для инфузий предназначен для:
- индукции и поддержания клинического ответа
- индукции и поддержания клинической ремиссии
- достижения бесстероидной ремиссии
- индукции эндоскопической ремиссии
- улучшения связанного со здоровьем качества жизни
у взрослых пациентов с активной болезнью Крона умеренной и тяжелой степени, у которых:
- прогрессирование заболевания продолжалось на фоне терапии иммуномодуляторами или кортикостероидами, или была выявлена непереносимость этих препаратов, или
- наблюдалась зависимость от кортикостероидов, или
- прогрессирование заболевания продолжаюсь на фоне терапии одним или несколькими ингибиторами ФНO), или была выявлена непереносимость одного или нескольких ингибиторов ФHО.
Противопоказания:
— Клинически значимая повышенная чувствительность к устекинумабу или любому вспомогательному веществу препарата;
— клинически значимая активная инфекция (например, активный туберкулез);
— детский возраст до 18 лет.
Беременность и лактация:
Беременность
В исследованиях на животных не было получено доказательств тератогенности, врожденных дефектов или задержек развития при применении доз, примерно в 45 раз превышающих самую высокую эквивалентную дозу, предназначенную для применения у людей. Тем не менее, исследования влияния устекинумаба на репродуктивную функцию и на развитие потомства у животных не всегда прогнозируют реакции, развивающиеся у человека.
Неизвестно, может ли применение препарата Стелара нанести вред плоду при применении у беременных женщин или повлиять на репродуктивную функцию. Препарат Стелара следует применять у беременных женщин только в случае, если ожидаемая польза от применения у матери перевешивает потенциальный риск для плода.
Период грудного вскармливания
Выделение препарата Стелара с грудным молоком наблюдалось у обезьян. Неизвестно, абсорбируется ли препарат Стелара системно после приема внутрь. Поскольку многие препараты и иммуноглобулины выделяются с грудным молоком у человека и в связи с возможностью возникновения нежелательных явлений у детей, получающих грудное молоко, следует принять решение о прекращении грудного вскармливания в период приема препарата или об отмене терапии устекинумабом.
Фертильность
Оценка влияния препарата Стелара на фертильность человека не проводилась. В исследовании фертильности, проведенном у мышей, не было выявлено неблагоприятных эффектов в отношении фертильности самок.
Способ применения и дозы:
Болезнь Крона
Дозы
Пациентам с болезнью Крона рекомендовано однократное, инициирующее терапию внутривенное введение препарата Стелара в дозе, рассчитанной на основании массы тела (Таблица 1).
|
Таблица 1: Инициирующая доза препарата Стелара (внутривенное введение)а |
||
|
Масса тела пациента на момент введения препарата |
Доза |
Количество флаконов препарата Стелара, концентрат для приготовления раствора для инфузий, 130 мг |
|
< 55 кг |
260 мг |
2 |
|
> 55 кг-≤ 85 кг |
390 мг |
3 |
|
> 85 кг |
520 мг |
4 |
а Рекомендованная доза (около 6 мг/кг)
Через 8 недель после введения инициирующей дозы препарат Стелара вводится подкожно в дозе 90 мг (первое подкожное введение). Для подкожного введения используется препарат Стелара в лекарственной форме раствор для подкожного введения.
Информация о последующих подкожных введениях препарата указана в инструкции по медицинскому применению препарата Стелара, раствор для подкожного введения.
Особые группы пациентов
Дети
Исследования препарата Стелара в лекарственной форме концентрат для приготовления раствора для инфузий у детей младше 18 лет не проводились.
Пожилые пациенты
В клинических исследованиях не наблюдалось существенных возрастных различий клиренса или объема распределения препарата. Количество пациентов в возрасте от 65 лет и старше было недостаточным для окончательного вывода о влиянии возраста на клиническую эффективность препарата.
Пациенты с нарушением функции почек
У пациентов с почечной недостаточностью не проводилось отдельных исследований препарата.
Пациенты с нарушением функции печени
У пациентов с печеночной недостаточностью не проводилось отдельных исследований препарата.
Способ применения
Препарат Стелара, концентрат для приготовления раствора для инфузий, 130 мг, предназначен только для внутривенного инфузионного введения.
Внутривенное инфузионное введение препарата Стелара должно проводиться только квалифицированными медицинскими работниками.
Инструкции по приготовлению раствора, обращению с ним и его утилизации
Приготовление раствора препарата Стелара, концентрат для приготовления раствора для инфузий, 130 мг, должно производиться квалифицированными специалистами с соблюдением требований асептики, следующим образом:
1. Рассчитайте необходимую дозу и требуемое количество флаконов препарата Стелара на основании массы тела пациента (см. Таблицу 1). Каждый флакон препарата Стелара объемом 26 мл содержит 130 мг устекинумаба.
2. Из инфузионной емкости, содержащей 250 мл 0,9% раствора хлорида натрия, извлеките объем раствора, равный объему препарата Стелара, который необходимо ввести пациенту (на каждый флакон препарата Стелара необходимо извлечь из инфузионной емкости 26 мл раствора хлорида натрия, т.е. при необходимости введения двух флаконов требуется извлечь 52 мл, при введении трех флаконов — 78 мл, при введении четырех флаконов — 104 мл; извлеченный раствор утилизируется). При необходимости допускается использование инфузионных емкостей объемом 250 мл, содержащих 0,45% раствор хлорида натрия.
3. Из каждого флакона препарата Стелара извлеките 26 мл концентрата и введите его емкость с инфузионным раствором. Итоговый объем получившегося раствора препарата должен быть равен 250 мл. Осторожно перемешайте.
4. Перед введением внимательно осмотрите полученный раствор. При выявлении в растворе видимых непрозрачных частиц, изменении цвета или наличии инородных частиц использовать такой раствор запрещается.
5. Введите полученный раствор препарата пациенту путем внутривенной инфузии длительностью не менее одного часа. Раствор необходимо использовать в течение 8 часов после приготовления.
6. Используйте только инфузионные наборы со встроенным стерильным, апирогенным фильтром с низким связыванием белков (размер пор 0,2 микрометра).
7. Запрещается вводить препарат Стелара одновременно с другими препаратами через одну и ту же инфузионную систему.
8. Каждый флакон препарата Стелара предназначен только для одноразового использования и весь неиспользованный концентрат должен быть утилизирован в соответствии с действующими правилами.
Побочные эффекты:
В этом разделе представлены данные о побочных действиях. Побочные действия — это нежелательные явления, которые были расценены как обоснованно связанные с использованием устекинумаба на основании всесторонней оценки имеющихся данных о нежелательных явлениях.
В отдельных случаях не представляется возможным достоверно установить наличие причинной связи между нежелательным явлением и применением устекинумаба. Кроме того, поскольку клинические исследования проводятся в разных условиях, невозможно провести непосредственное сравнение частоты нежелательных реакций, наблюдаемых в клиническом исследовании препарата, с частотой, наблюдаемой в клинических исследованиях другого препарата, и частота нежелательного явления, наблюдаемая в клиническом исследовании, может не соответствовать частоте, наблюдаемой в клинической практике.
Опыт применения в клинических исследованиях у взрослых пациентов
Данные по безопасности, представленные далее, отражают применение препарата Стелара в 12 исследованиях 11 фазы и III фазы.
Наиболее частыми (>5%) побочными действиями, наблюдавшимися в контролируемых периодах клинических исследований препарата Стелара, были назофарингит и головная боль. Большинство случаев были расценены как легкие и не требующие прекращения терапии.
В Таблице 2 представлен обзор побочных действий, зарегистрированных в клинических исследованиях. Расчет частоты этих побочных действий проводился на основании случаев, зарегистрированных во время начальных контролируемых периодов клинических исследований.
Побочные действия расположены в порядке уменьшения частоты, в соответствии со следующими категориями:
Очень часто (≥1/10)
Часто (≥1/100, <1/10)
Нечасто (≥1/1000, <1/100)
Редко (≥1/10000, <1/1000)
|
Таблица 2: Обзор побочных действий, зарегистрированных в клинических исследованиях |
|
|
Инфекции и инвазии |
Часто: инфекции верхних дыхательных путей, назофарингит, синусит |
|
Нечасто: воспаление подкожной жировой клетчатки, одонтогенные инфекции, опоясывающий лишай, вирусные инфекции верхних дыхательных путей, вульвовагинальные грибковые инфекции |
|
|
Нарушения со стороны психики |
Нечасто: депрессия |
|
Нарушения со стороны нервной системы |
Часто: головокружение, головная боль |
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
Часто: орофарингеальная боль |
|
Нечасто: заложенность носа |
|
|
Нарушения со стороны желудочно-кишечного тракта |
Часто: диарея, тошнота, рвота |
|
Нарушения со стороны кожи и подкожной клетчатки |
Часто: зуд |
|
Нечасто: акне |
|
|
Нарушения со стороны опорно-двигательного аппарата и соединительной ткани |
Часто: боль в спине, миалгия, артралгия |
|
Общие нарушения и реакции в месте введения препарата |
Часто: усталость, эритема в месте введения, боль в месте введения |
|
Нечасто: реакции в месте введения (в том числе, кровотечение, гематома, уплотнение, припухлость и зуд), астения |
Инфекции
В плацебо-контролируемых исследованиях частота инфекций или серьезных инфекций была сравнима у пациентов, получавших препарат Стелара, и у пациентов, получавших плацебо. В плацебо-контролируемых периодах клинических исследований частота инфекций составляла 1,38 и 1,35 на пациенто-год наблюдения в группах, получавших препарат Стелара, и плацебо соответственно.
В ходе контролируемых и неконтролируемых периодов клинических исследований, что составляет 10953 пациенто-лет терапии у 5884 пациентов, получавших препарат Стелара, частота инфекций составляла 0,91 на пациенто-год наблюдения. Частота серьезных инфекций у пациентов, получавших препарат Стелара, составляла 0,02 на пациенто-год наблюдения.
В клинических исследованиях у пациентов с латентным туберкулезом, одновременно получавших изониазид, не отмечалось случаев развития туберкулеза.
Злокачественные новообразования
В ходе плацебо-контролируемых периодов клинических исследований частота возникновения злокачественных новообразований, без учета случаев немеланомного рака кожи, у пациентов, получавших препарат Стелара, составляла 0,12 на 100 пациенто-лет наблюдения и 0,26 на 100 пациенто-лет наблюдения у пациентов, получавших плацебо.
Частота возникновения немеланомного рака кожи у пациентов, получавших препарат Стелара. составляла 0,48 на 100 пациенто-лет наблюдения и 0,52 на 100 пациенто-лет наблюдения у пациентов, получавших плацебо, в ходе контролируемых и неконтролируемых периодов клинических исследований, что составляет 10935 пациенто-лет терапии у 5884 пациентов. Злокачественные новообразования, кроме случаев немеланомного рака кожи, были зарегистрированы с частотой 0,53 на 100 пациенто-лет наблюдения у пациентов, получавших препарат Стелара. Частота случаев возникновения немеланомного рака кожи у пациентов, получавших препарат Стелара, составила 0,49 на 100 пациенто-лет наблюдения (53 пациента на 10919 пациенто-лет наблюдения).
Частота возникновения злокачественных новообразований у пациентов, получавших препарат Стелара®, была аналогична частоте, ожидаемой в общей популяции (стандартизованное отношение частоты = 0,87 [95% доверительный интервал: 0,66, 1,14], с учетом поправок на возраст, пол и расовую принадлежность)1.
Соотношение пациентов с базальноклеточным и плоскоклеточным типами рака (4:1) соответствовало соотношению, ожидаемому в общей популяции.
1 — Ваза данных программы наблюдения, эпидемиологии и отслеживания исходов (SEER) (wwvv.seer.cancer.gov) SEER*Stat Database: Incidence — SEER 6.6.2 Regs Research Data подача — ноябрь 2009 (1973-2007) — в связи с характеристиками страны — США в целом, 1969-2007 Округи, Национальный институт онкологии, DCCPS, исследовательская программа наблюдения, группа наблюдательных систем, выпущено в апреле 2010, на основании подачи в ноябре 2009 года.
Реакции гиперчувствительности и инфузионные реакции
Подкожное введение
Во время контролируемых периодов клинических исследований препарата Стелара сыпь и крапивница наблюдались менее чем у 1% пациентов каждая.
Внутривенное введение
В исследованиях индуцирующей терапии при болезни Крона не было зарегистрировано случаев развития анафилактических или других серьезных инфузионных реакций. В этих исследованиях побочные действия, развивавшиеся во время инфузии или в течение часа после инфузии, были зарегистрированы у 2,4% из 466 пациентов, получавших плацебо, и у 2,6% из 470 пациентов, получавших препарат Стелара в рекомендованной дозе.
Иммуногенность
В клинических исследованиях у пациентов с болезнью Крона образование антител к устекинумабу было выявлено менее чем у 3% пациентов, получавших препарат Стелара. Не наблюдалось очевидной взаимосвязи между образованием антител к устекинумабу и развитием реакций в месте введения препарата. У пациентов с положительными результатами тестов на антитела к устекинумабу отмечалась тенденция к более низкой эффективности, тем не менее, наличие антител не препятствовало развитию клинического ответа. У большинства пациентов с положительными результатами тестов на антитела присутствовали также и нейтрализующие их антитела.
Опыт пострегистрационного применения
Побочные действия в Таблице 3 расположены в порядке уменьшения частоты* с использованием следующих категорий:
Очень часто: ≥1/10
Часто: ≥1/100 и <1/10
Нечасто: ≥1/1000 и <1/100
Редко: ≥1/10000 и <1/1000
Очень редко: <1/10000, в том числе отдельные
|
Таблица 3: Пострегистрационные сообщения |
|
|
Нарушения со стороны иммунной системы |
Нечасто: реакции гиперчувствительности (в том числе сыпь, крапивница) |
|
Редко: серьезные реакции гиперчувствительности (в том числе анафилаксия и ангионевротический отек) |
|
|
Инфекции и инвазии |
Нечасто: инфекции нижних отделовдыхательных путей |
|
Нарушения со стороны кожи и подкожной клетчатки |
Нечасто: пустулёзный псориаз |
|
Редко: эритродермический псориаз |
* Расчет частоты побочных действий, зарегистрированных при пострегистрационном периоде наблюдения, проводился на основании 11-ти плацебо-контролируемых клинических исследований, в случае, если такое побочное действие наблюдалось в этих исследованиях. В противном случае, считалось, что частота ниже определенного значения, учитывая объем применения в 11-ти клинических исследованиях, в которых это побочное действие не наблюдалось.
Передозировка:
При однократных внутривенных введениях доз до 6 мг/кг в рамках клинических исследований не отмечалось токсичности, ограничивающей дозу. В случае передозировки рекомендуется наблюдать пациента на предмет любых признаков и проявлений нежелательных реакций с целью немедленного начала соответствующей симптоматической терапии.
Взаимодействие:
Исследования лекарственных взаимодействий с препаратом Стеларау человека не проводились. Эффекты ИЛ-12 или ИЛ-23 на регуляцию изоферментов CYP450 оценивались in vitro с использованием гепатоцитов человека. В исследовании было показано, что ИЛ-12 и/или ИЛ-23 в концентрации 10 нг/мл не влияют на активность изоферментов CYP450 человека (CYP1А2, 2В6, 2С9, 2С19, 2D6 или 3А4). Полученные результаты не предполагают необходимости коррекции дозы у пациентов, принимающих одновременно с препаратом Стелара препараты, метаболизируемые изоферментами CYP450.
Живые вакцины не следует вводить одновременно с применением препарата Стелара.
Особые указания:
Инфекции
Препарат Стелара является селективным иммунодепрессантом, и потенциально может увеличивать риск возникновения инфекций и реактивации латентных инфекций.
В ходе клинических исследований у пациентов, получавших препарат Стелара, наблюдались случаи возникновения серьезных бактериальных и вирусных инфекций.
Препарат Стелара не следует применять у пациентов с клинически значимой активной инфекцией. Следует с осторожностью применять препарат Стелара у пациентов с хронической инфекцией или рецидивирующей инфекцией в анамнезе.
Перед началом терапии препаратом Стелара следует обследовать пациентов на наличие туберкулеза. Препарат Стелара не следует применять у пациентов с активным туберкулезом. Перед применением препарата Стелара следует провести терапию латентного туберкулеза. Кроме того, противотуберкулезную терапию перед началом применения препарата Стелара следует провести пациентам с латентным или активным туберкулезом в анамнезе, для которых отсутствует подтверждение проведения эффективного курса лечения. У пациентов, получающих препарат Стелара, во время и после терапии следует внимательно контролировать признаки или симптомы активного туберкулеза.
Пациентов следует проинструктировать о необходимости обращения за медицинской помощью в случае появления признаков или симптомов, указывающих на развитие инфекции. В случае, если у пациента развивается серьезная инфекция, необходимо проводить тщательное наблюдение пациента и не применять препарат Стелара до разрешения инфекционного процесса.
Злокачественные новообразования
Препарат Стелара является селективным иммунодепрессантом. Препараты-иммунодепрессанты могут способствовать увеличению риска развития злокачественных новообразований. У некоторых пациентов, получавших препарат Стелара в рамках клинических исследований, наблюдалось развитие кожных и некожных злокачественных новообразований.
Применение препарата Стелара не изучалось у пациентов со злокачественными новообразованиями в анамнезе. Следует проявлять осторожность при назначении препарата Стелара пациентам со злокачественными новообразованиями в анамнезе, а также при рассмотрении возможности продолжения терапии препаратом Стелара у пациентов с диагностированными злокачественными новообразованиями.
У всех пациентов, особенно у пациентов в возрасте старше 60 лет и у пациентов, ранее получавших длительную терапию иммунодепрессантами или ПУВА-терапию, необходимо проводить обследование на наличие немеланомного рака кожи.
Реакции гиперчувствительности
В ходе пострегистрационного наблюдения были зарегистрированы серьезные реакции гиперчувствительности, включая анафилаксию и ангионевротический отек. В случае развития анафилактических или других серьезных реакций гиперчувствительности следует начать соответствующую терапию и прекратить применение препарата Стелара.
Вакцинация
Не рекомендуется применять живые вирусные или живые бактериальные вакцины одновременно с препаратом Стелара.
Данные о вторичном инфицировании при применении живых вакцин у пациентов, получающих препарат Стелара, отсутствуют.
Следует соблюдать осторожность при применении живых вакцин для иммунизации членов семьи пациента, получающего лечение препаратом Стелара. поскольку имеется риск вирусо- или бактериовыделения и передачи инфекции от этих лиц пациентам.
Пациентам, получающим препарат Стелара, можно одновременно вводить инактивированные или неживые вакцины.
Длительное лечение препаратом Стелара не подавляет гуморальный иммунный ответ на вакцины, содержащие пневмококковый полисахарид и противостолбнячную вакцину.
Иммуносупрессия
В исследованиях у пациентов с болезнью Крона совместное применение препарата Стелара с иммуномодуляторами (6-меркаптопурином, азатиоприном, метотрексатом) или с кортикостероидами не влияло на безопасность и эффективность препарата Стелара. Следует проявлять осторожность при рассмотрении возможности одновременного применения иммунодепрессантов и устекинумаба, а также при переходе с терапии другими биологическими препаратами на терапию устекинумабом.
Иммунотерапия
Безопасность и эффективность применения препарата Стелара у пациентов, прошедших иммунотерапию аллергических заболеваний, не установлена. Препарат Стелара может оказывать влияние на иммунотерапию аллергических заболеваний. Следует соблюдать осторожностью при применении устекинумаба у пациентов, получающих или ранее получавших иммунотерапию аллергических заболеваний, особенно если такая терапия связана с анафилаксией.
Влияние на способность управлять транспортными средствами и механизмами:
Исследований не проводилось.
Форма выпуска/дозировка:
Концентрат для приготовления раствора для инфузий, 5 мг/мл.
Упаковка:
По 26 мл концентрата во флаконе из стекла I типа, укупоренном пробкой из бутилового каучука и алюминиевым колпачком с защитным диском из пластмассы.
По 1 флакону вместе с инструкцией по применению в пачке картонной.
Условия хранения:
При температуре от 2 до 8 °С, в защищенном от света месте.
Не замораживать. Не встряхивать. После приготовления раствор можно хранить при комнатной температуре не более 4 ч.
Хранить в недоступном для детей месте.
Срок годности:
3 года.
Не применять по истечении срока годности.
Условия отпуска
По рецепту
Производитель
Силаг АГ, Hochstrasse 201, 8200 Schaffhausen, Switzerland, Швейцария
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
ООО «Джонсон & Джонсон»
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
МНН: Устекинумаб
Производитель: Силаг АГ
Анатомо-терапевтическо-химическая классификация: Ustekinumab
Номер регистрации в РК:
РК-БП-5№023288
Информация о регистрации в РК:
03.03.2022 — 03.03.2032
Информация о реестрах и регистрах
Информация по ценам и ограничения
Предельная цена закупа в РК:
1 043 469.75 KZT
- Скачать инструкцию медикамента
Торговое наименование
Стелара®
Международное непатентованное название
Устекинумаб
Лекарственная
форма, дозировка
Раствор
для инъекций , 45 мг/0.5мл и 90 мг
Фармакотерапевтическая группа
Антинеопластические
и иммуномодулирующие препараты. Иммуносупрессанты. Ингибиторы
интерлейкина. Устекинумаб.
Код АТХ
L04AC05
Показания к применению
— для
лечения взрослых пациентов с умеренной и тяжелой степенью бляшечного
псориаза, у которых не было ответа, или были противопоказания, или
непереносимость других системных методов лечения, включая
циклоспорин, метотрексат (МТХ) или PUVA
(Псорален и Ультрафиолет А)
— для
лечения взрослых пациентов с псориатическим артритом в качестве
монотерапии или в комбинации с метотрексатом при
недостаточном ответе на предыдущую терапию небиологическими
болезнь-модифицирующими антиревматическими препаратами
— для
лечения умеренной или тяжелой степени тяжести болезни Крона у
взрослых пациентов:
— с
неадекватным ответом, отсутствием эффективности или непереносимостью
стандартной терапии и/или ингибиторов фактора некроза опухоли (ФНО-α)
— с
наличием противопоказаний к препаратам стандартной терапии или
препаратам из группы ингибиторов фактора некроза опухоли (ФНО-α)
— для
лечения умеренной или тяжелой степени тяжести язвенного колита у
взрослых пациентов:
— с
неадекватным ответом, отсутствием эффективности или непереносимостью
стандартной терапии и/или биологической терапии
— с
наличием противопоказаний к препаратам стандартной терапии или
биологической терапии.
Перечень
сведений, необходимых до начала применения
Противопоказания
-
если у
Вас аллергия на устекинумаб или любой другой компонент данного
препарата (перечислены в разделе Дополнительные
сведения);
-
если у
Вас активная инфекция, которую Ваш врач считает серьезной.
Если вы
не уверены, что вышеперечисленное касается Вас, перед применением
препарата Стелара®
проконсультируйтесь со своим врачом или фармацевтом.
Необходимые
меры предосторожности при применении
Прежде
чем начать применение препарата Стелара®,
обсудите это со своим врачом или фармацевтом. Ваш
врач должен оценить состояние вашего здоровья до начала терапии.
Обязательно сообщите своему врачу о любом заболевании до начала
терапии. Также сообщите своему врачу, если Вы были в тесном контакте
с кем-то, у кого может быть туберкулез. Ваш врач осмотрит вас и
проведет обследование на туберкулез, перед началом терапии препаратом
Стелара®.
Если врач считает, что Вы подвержены риску заболеть туберкулезом, Вам
может быть назначено лечение от туберкулеза до того, как Вы начнете
получать препарат Стелара®.
Обращайте
внимание на серьезные нежелательные реакции
Стелара®
может вызывать серьезные нежелательные реакции, включая аллергические
реакции и инфекции. Вы должны следить за определенными признаками
болезни, во время терапии препаратом Стелара®.
См. «Серьезные нежелательные реакции» в разделе Описание
нежелательных реакций для
получения информации о полном списке этих нежелательных реакций.
Перед
применением Стелара®
сообщите вашему врачу если:
• Если
у Вас когда-либо была аллергическая реакция на препарат Стелара®.
Проконсультируйтесь
со своим врачом, если вы не уверены.
• Если
у Вас когда-либо был какой-либо тип рака — поскольку
иммунодепрессанты, такие как Стелара®
могут ослабить часть иммунной системы. Это может увеличить риск
развития рака.
• Если
у Вас инфекция или вы недавно перенесли инфекцию.
• Если
у Вас есть новые или видоизменяющиеся поражения на части кожи,
пораженной псориазом или на здоровой коже.
• Если
у Вас когда-либо была аллергическая реакция на латекс или на
препарата Стелара®
— шприц этого лекарственного средства содержит латексную резину,
которая может вызывать тяжелые аллергические реакции у людей, которые
чувствительны к латексу. См. «Серьезные нежелательные реакции»
в разделе Описание нежелательных реакций для получения информации о
признаках аллергических реакций.
• Если
Вы применяете какое-либо другое лечение псориаза и/или
псориатического артрита — например, другой иммунодепрессант или
фототерапию (когда пораженные участки подвергаются воздействию
ультрафиолетового (УФ) света). Эти процедуры могут также ослабить
часть иммунной системы. Использование таких методов лечения совместно
с препаратом Стелара®
не изучалось. Однако возможно, что это может увеличить вероятность
заболеваний, связанных с ослаблением иммунной системы.
• Если
Вы получаете или когда-либо получали инъекции для лечения аллергии,
не известно, какое воздействие может оказать препарат Стелара®
• Если
Вам 65 лет или больше – риск получить инфекцию значительно
выше.
-
Если
Вы не уверены, относится ли что-либо из вышеперечисленного к вам,
проконсультируйтесь со своим врачом или фармацевтом перед
применением Стелара®.
Взаимодействия
с другими лекарственными препаратами
Сообщите
своему врачу или фармацевту если:
• Если
вы принимаете, недавно принимали или могли принять какие-либо другие
лекарства.
• Если
вы недавно прошли или собираетесь пройти вакцинацию. Некоторые виды
вакцин (живые вакцины) не следует вводить при применении препарата
Стелара®.
Специальные
предупреждения
Дети
и подростки
Применение
препарата Стелара®
не рекомендуется детям с псориазом до 12 лет, детям с псориатическим
артритом, болезнью Крона и язвенным колитом до 18 лет, так как
применение препарата в этой возрастной группе не было изучено.
Во
время беременности или лактации
Предпочтительно
избегать применения препарата Стелара®
во время беременности. Воздействие препарата Стелара®
на беременных женщин не известно. Если
вы женщина детородного возраста, вам рекомендуется избегать
беременности и Вы должны использовать эффективные методы контрацепции
во время лечения препаратом Стелара®
и в течение, по крайней мере, 15 недель после завершения лечения.
• Проконсультируйтесь
с врачом, если Вы беременны, думаете, что Вы беременны или планируете
беременность
• Проконсультируйтесь
с врачом, если вы кормите грудью или планируете кормить грудью. Вы и
ваш доктор должны принять решение, следует ли вам кормить грудью или
принимать препарат Стелара®.
Особенности
влияния препарата на способность управлять транспортным средством или
потенциально опасными механизмами
Препарат
не оказывает или оказывает незначительное влияние на способность
управлять транспортным средством или потенциально опасными
механизмами.
Рекомендации
по применению
Препарат
Стелара®
необходимо использовать под наблюдением и контролем врача, имеющего
опыт в диагностике и лечении заболеваний,
при которых показан препарат Стелара®.
Всегда
применяйте этот препарат в точности так, как сказал вам Ваш врач.
Посоветуйтесь с врачом, если Вы не уверены. Поговорите
со своим врачом о том, когда вам будут вводить очередную дозу
препарата и последующие консультации.
Режим
дозирования
Ваш
врач рассчитает дозу и определит режим лечения.
Взрослые
от 18 лет и старше
Псориаз
или псориатический артрит
• Рекомендуемая
начальная доза препарата Стелара®
составляет 45 мг. Для пациентов с массой тела более 100 кг начальная
доза может составлять 90 мг вместо 45 мг.
• После
введения начальной дозы, следующее введение препарата будет через 4
недели, а затем через каждые 12 недель. Поддерживающая доза препарата
обычно совпадает с начальной дозой.
Болезнь
Крона или язвенный колит
• Лечение
болезни Крона или язвенного колита препаратом Стелара®
следует начинать с однократной внутривенной инфузии препарата
Стелара®
130
мг. Врач
рассчитает для вас необходимую дозу для внутривенного введения в
зависимости от веса вашего тела. После начальной внутривенной дозы
вам будет назначена следующая доза препарата Стелара®
90 мг путем инъекции под кожу (подкожная инъекция) через 8 недель, а
затем каждые 12 недель.
• У
некоторых пациентов после
первой подкожной инъекции поддерживающей дозы препарата могут
назначить Стелара®
90 мг с интервалом каждые 8 недель. Только Ваш врач может принять
решение, когда Вы должны будете получить следующую дозу препарата.
Метод
и путь введения
• Стелара®
вводится в виде инъекции под кожу («подкожно»). В начале
терапии врач или медсестра сделают инъекцию препарата Стелара®
• Однако,
если врач сочтет это возможным, вы можете делать себе инъекции
препарата Стелара®
самостоятельно. В этом случае Вы будете проходить обязательное
обучение технике подкожных инъекций.
• Инструкцию
по введению препарата, см. в разделе «Указания по введению
препарата» ниже.
Указания
по введению препарата
В
начале лечения инъекции препарата Стелара®
должен
делать только медицинский персонал, однако, в последующем, если врач
сочтет это допустимым, пациент может делать себе инъекции препарата
Стелара®
самостоятельно, соблюдая все необходимые меры предосторожности и
пройдя предварительно обязательное обучение технике подкожных
инъекций. Проконсультируйесь
со своим врачом, если у вас есть какие-либо вопросы о самостоятельном
введении препарата Стелара®.
-
Препарат
Cтелара®
не следует смешивать с другими растворами для инъекций -
Не
встряхивайте препарат. Длительное энергичное встряхивание может
изменить свойства препарата. Не используйте препарат, если его
сильно встряхивали.
Рис. 1
Шприц с препаратом Стелара®
1
– наконечник поршня 5 —
корпус
2
– поршень
6 – место указания срока годности
3
– клипсы активации предохранителя иглы 7 – смотровое
окно
4
– крылья предохранителя иглы 8 –
игла
9
– защитный колпачок иглы
1.Проверьте
количество предварительно заполненных шприцев и подготовьте
необходимые материалы:
Подготовка
к использованию предварительно заполненного шприца.
-
Достаньте
препарат из холодильника. Выньте шприц с препаратом из картонной
пачки и оставьте на 30 минут при комнатной температуре. Не
снимайте защитный колпачок иглы, до тех пор, пока температура
препарата не достигнет комнатной. -
Держите
предварительно заполненный шприц за корпус шприца закрытой иглой
вверх. -
Не
держите шприц за наконечник поршня, поршень, защитные «крылья»
иглы или защитный колпачок иглы. -
Не
оттягивайте назад поршень в течение всей процедуры. -
Не
снимайте защитный колпачок иглы с предварительно заполненного шприца
до момента введения препарата. -
Не
прикасайтесь к клипсам активации предохранителя иглы (отмеченные *
на рис. 1) для предотвращения преждевременного закрытия иглы
предохранителем.
Проверьте
шприц, чтобы убедиться, что:
-
дозировка
препарата правильна
— Если
необходимая доза препарата составляет 45 мг, то используйте дозу 45
мг препарата Стелара®.
— Если
необходимая доза препарата составляет 90 мг, то используйте дозу 90
мг препарата Стелара®.
-
Вы
используете препарат Стелара® -
проверьте
срок годности -
предварительно
заполненный шприц не поврежден -
раствор
прозрачный или слегка опалесцирующий (с жемчужным блеском) от
бесцветного до светло-желтого цвета. -
раствор
не приобрел иной цвет или не стал мутным и не содержит посторонние
частицы -
раствор
не заморожен
Подготовьте
дополнительные материалы, которые Вам потребуются для выполнения
инъекции (спиртовую салфетку, шарик ваты или марли и контейнер для
острых предметов).
2.
Выбор и подготовка места для инъекции
Препарат
Стелара®
предназначен для применения в виде подкожных инъекций. Подходящими
местами для инъекции являются верхняя часть бедра или область живота
примерно на 5 см ниже пупка. Следует избегать инъекций в область,
пораженную псориазом. Также можно ввести препарат в плечо.
Рис.
2 Рекомендованные места для инъекции
Тщательно
вымойте Ваши руки теплой водой с мылом. Протрите
место для инъекции спиртовой салфеткой. До выполнения инъекции не
дотрагивайтесь до этой области.
3.
Снятие защитного колпачка иглы
Не
снимайте защитный колпачок с иглы предварительно заполненного шприца
до момента введения препарата.
Удалите
упаковку со шприца, держа за корпус шприца и стягивая упаковку без ее
перекручивания. Снимите защитный колпачок иглы и выбросьте. При
снятии защитного колпачка иглы не дотрагивайтесь до поршня.
Рис.
3 Снятие защитного колпачка иглы
Вы
можете увидеть пузырек воздуха в шприце
или
каплю жидкости в конце
иглы.
Это допустимо, не пытайтесь удалить его. Не допускайте контакта иглы
с посторонними предметами. Не используйте шприц, если вы уронили его
со снятым колпачком. В этом случае обратитесь за консультацией к
врачу или фармацевту. Препарат должен быть введен сразу после снятия
колпачка.
4.
Введение препарата
Возьмите
корпус предварительно заполненного шприца одной рукой между средним и
указательным пальцами и положите большой палец сверху наконечника
поршня. Используйте другую руку, чтобы осторожно собрать
предварительно очищенную кожу в складку
между
большим и указательным пальцами руки. Не сжимайте плотно. Не
оттягивайте назад поршень в течение всей процедуры. Одним быстрым
движением введите иглу через кожу настолько глубоко, насколько она
сможет войти (см. рис. 4).
Рис. 4
Введите
препарат полностью, надавливая на поршень до тех пор, пока наконечник
поршня не будет полностью расположен между крыльями предохранителя
иглы (см. рис.5).
Рис. 5
Когда
поршень переместится до упора, продолжайте надавливать на наконечник
поршня, удалите иглу из кожи и прекратите сжимать кожу (см. рис. 6).
Рис. 6
Медленно
отнимите большой палец от наконечника поршня, чтобы пустой шприц
поднялся вверх до полного закрытия иглы предохранителем, как показано
на рисунке 7:
Рис. 7
5.
После инъекции
Приложите
к месту инъекции спиртовую салфетку. Может появиться небольшое
количество крови или жидкости в месте инъекции. Это допустимо.
Приложите ватный тампон, смоченный антисептиком, к месту инъекции и
подержите 10 секунд. Не трите место инъекции. При необходимости
заклейте пластырем.
6.
Утилизация
Использованный
шприц поместите в контейнер для острых предметов (см. рис.8). Для
Вашей безопасности и здоровья и для безопасности окружающих, иглы и
пустые шприцы не должны использоваться повторно. Утилизируйте
контейнер для острых предметов в соответствии с местными требованиями
по уничтожению такого рода отходов. Антисептические
салфетки и другие материалы могут быть утилизированы в месте с
обычным мусором.
Рис.
8
Меры,
которые необходимо принять в случае передозировки
Если Вы
ввели или Вам ввели препарат Стелара®
больше
чем предусмотрено, немедленно обратитесь к врачу или фармацевту.
Возьмите с собой упаковку препарата, даже если она пустая.
Меры,
необходимые при пропуске одной или нескольких доз лекарственного
препарата
Если Вы
забыли или пропустили очередную дозу препарата, обратитесь к врачу
или фармацевту. Не
вводите двойную дозу, чтобы восполнить пропущенную дозу.
Указание
на наличие риска симптомов отмены
Прекращение
применения препарата Стелара®
не опасно. Однако, если вы прекратите прием, симптомы Вашего
заболевания могут возобновиться Рекомендации
по обращению за консультацией к медицинскому работнику для
разъяснения способа применения лекарственного препарата
Если
у Вас остались вопросы по применению данного препарата обратитесь к
своему врачу или фармацевту.
Описание
нежелательных реакций, которые
проявляются при стандартном применении ЛП и меры, которые следует
принять в этом случае
Как и
все лекарственные препараты, данный препарат может вызывать побочные
эффекты, хотя они возникают не у каждого.
Серьезные
нежелательные реакции
У
некоторых пациентов могут возникнуть серьезные нежелательные реакции,
которые требуют срочного лечения.
Аллергические
реакции могут потребовать срочного лечения. Сообщите своему врачу или
обратитесь в скорую помощь, если вы заметили любой из следующих
признаков:
Серьезные
аллергические реакции («анафилаксия») редко встречаются у
людей, принимающих препарат Стелара®.
Симптомы включают в себя:
—
затрудненное дыхание или глотание
—
низкое кровяное давление, которое может вызвать головокружение или
предобморочное состояние
—
отек лица, губ, рта или горла.
Частыми
симптомами аллергической реакции являются кожная сыпь и крапивница.
В
редких случаях у пациентов получавших устекинумаб были
зарегистрированы аллергические реакции легких и воспаление легких.
Немедленно сообщите своему врачу, если у вас появятся такие симптомы,
как кашель, одышка и лихорадка.
Если
у Вас возникла тяжелая аллергическая реакция, Ваш врач может принять
решение о прекращении применения препарата Стелара®.
Инфекции
могут потребовать срочного лечения. Немедленно сообщите своему врачу,
если у Вас возник любой из следующих симптомов:
• часто
-инфекции носа или горла, а также насморк
• нечасто
— инфекции органов грудной клетки
• нечасто
— воспаление подкожных тканей («целлюлит»)
• нечасто-
опоясывающий герпес (тип болезненной сыпи с волдырями)
Стелара®
может снизить способность Вашего организма бороться с инфекциями, и
некоторые инфекции могут иметь серьезные осложнения.
Вы
должны тщательно следить за возникновением симптомов инфекции, при
применении препарата Стелара®.
Симптомы включают:
•
лихорадку,
гриппоподобные симптомы, ночную потливость
•
чувство
усталости или одышки; кашель, который не проходит
• ощущение
повышения температуры, появления покраснения и болезненности кожи или
болезненная кожная сыпь с волдырями
•
жжение
при мочеиспускании
•
диарея
Немедленно
сообщите своему врачу, если вы заметили какие-либо из этих симптомов
инфекции.
Эти
симптомы могут быть симптомами инфекции, таких как инфекций органов
грудной клетки, кожные инфекции или опоясывающий герпес, которые
впоследствии могут иметь серьезные осложнения. Сообщите своему врачу,
если у вас есть какая-либо инфекция, которая не проходит или
постоянно возобновляется. Ваш врач может принять решение о
прекращении применения препарата Стелара®
до излечения от инфекции. Также сообщите врачу, есть ли у вас имеются
открытые порезы или язвы, так как туда может попасть инфекция.
Шелушение
кожи — покраснение и шелушение кожи на большом участке кожи могут
быть симптомами эритродермического псориаза или эксфолиативного
дерматита, которые являются серьезными кожными заболеваниями. Вы
должны немедленно сообщить своему врачу, если заметите какой-либо из
этих симптомов.
Другие
нежелательные реакции
Часто
(≥1/100, <1/10)
—
диарея
—
тошнота
—
рвота
—
чувство усталости
—
головокружение
—
головная боль
—
зуд (‘прурит’)
—
боль в спине, мышцах или суставах
—
воспаление горла
—
покраснение и боль в месте введения инъекции
—
синусит
Нечасто
(≥1/1000, <1/100)
—
зубные инфекции
—
вагинальная грибковая инфекция
—
депрессия
—
заложенность носа или насморк
—
кровотечение, синяки, уплотнения, отек и зуд в месте инъекции
—
чувство слабости
—
опущение верхнего века и провисание мышц на одной стороне лица
(«паралич лица» или «паралич Белла»), что
обычно является временным явлением
—
изменение псориаза с покраснением и новыми крошечными, желтыми или
белыми волдырями на коже, иногда сопровождающееся лихорадкой
(пустулезный псориаз)
—
шелушение кожи
—
угревая сыпь
Редко
(≥1/10000, <1/1000)
—
покраснение и шелушение кожи на большей части тела, которая может
сопровождаться зудом или болью (эксфолиативный дерматит). Подобные
симптомы иногда развиваются как естественное изменение типа симптомов
псориаза (эритродермический псориаз)
При
возникновении нежелательных лекарственных реакций обращаться к
медицинскому работнику, фармацевтическому работнику или напрямую в
информационную базу данных по нежелательным реакциям (действиям) на
лекарственные препараты, включая сообщения о неэффективности
лекарственных препаратов
РГП на
ПХВ «Национальный Центр экспертизы лекарственных средств и
медицинских изделий» Комитета контроля качества и безопасности
товаров и услуг Министерства здравоохранения Республики Казахстан
http://www.ndda.kz
Дополнительные
сведения
Состав
лекарственного препарата
Один
шприц содержит
активное
вещество —
устекинумаб
45.0 или 90.0,
вспомогательные
вещества:
сахароза,
L-гистидин
(в том числе L-гистидина
моногидрохлорида
моногидрат), полисорбат 80, вода для инъекций.
Описание
внешнего вида, запаха, вкуса
Опалесцирующий
раствор от бесцветного до светло-желтого цвета. Раствор может
содержать единичные прозрачные частицы белка.
Форма выпуска и упаковка
По 0.5
мл (для дозировки 45 мг/0.5 мл) или 1 мл (для дозировки 90 мг/1 мл) в
шприцы из боросиликатного стекла (тип I) с устройством UltraSafe
Passive®.
По 1 шприцу с препаратом в пластиковом поддоне вместе с инструкцией
по медицинскому применению на государственном и русском языках
помещают в картонную пачку.
Срок хранения
3 года
Не
применять по истечении срока годности!
Условия хранения
Хранить
в оригинальной упаковке, в защищенном от света месте при
температуре от 2 С
до 8 С.
Не замораживать! Не
встряхивать!
Хранить
в недоступном для детей месте.
Условия отпуска из аптек
По
рецепту
Сведения
о производителе
Силаг
АГ, Швейцария,
Хохштрассе
201, Шаффхаузен.
Тел.:
(495) 755-83-57; факс: (495) 755-83-58
е-mail:
DrugSafetyRU@ITS.JNJ.com
Держатель
регистрационного удостоверения
ООО
«Джонсон & Джонсон»
Российская
Федерация, 121614, г. Москва, ул. Крылатская, 17/2
Тел.:
8 (495) 755 83 57
Факс:
8 (495) 755 83 58
Адрес
электронной почты:
DrugSafetyRU@ITS.JNJ.com
Наименование,
адрес и контактные данные (телефон, факс, электронная почта)
организации на
территории Республики Казахстан, принимающей претензии (предложения)
по качеству лекарственных средств от потребителей и
ответственная
ответственной за пострегистрационное наблюдение за безопасностью
лекарственного средства
Республика
Казахстан
Филиал
ООО «Джонсон & Джонсон» в Республике Казахстан
050040,
г. Алматы,
ул.
Тимирязева, 42, павильон № 23 «А»
Тел.:
+7 (727) 356 88 11
Факс:
+7 (727) 356 88 13
Адрес
электронной почты: DrugSafetyKZ@its.jnj.com
| Стелара_45_мг_и_90_мг.doc | 0.61 кб |
| Стелара_раствор_каз.doc | 0.63 кб |
| Стелара_45+90_рус.docx | 0.53 кб |
| Стелара_45+90_каз.docx | 0.53 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
18.05.2023
Описание препарата Стелара (концентрат для приготовления раствора для инфузий, 5 мг/мл) основано на официальной инструкции, утверждено компанией-производителем в 2023 году
Дата согласования: 18.05.2023
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Комментарий
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Отзывы
Действующее вещество
ATX
Фармакологическая группа
Состав
| Концентрат для приготовления раствора для инфузий | 1 мл |
| действующее вещество: | |
| устекинумаб | 5,0 мг |
| вспомогательные вещества: L-гистидин — 0,8 мг; L-гистидина гидрохлорида моногидрат — 1,1 мг; сахароза — 85 мг; полисорбат 80 — 0,40 мг; L-метионин — 0,40 мг; динатрия эдетата дигидрат — 0,02 мг; вода для инъекций — до 1,0 мл |
Описание лекарственной формы
Концентрат для приготовления раствора для инфузий: прозрачная или почти прозрачная, бесцветная жидкость или жидкость с коричневатым или коричневато-желтоватым или желтоватым оттенком, которая может содержать незначительное количество небольших прозрачных или белых частиц белка.
Фармакологическое действие
Фармакологическое действие
—
иммунодепрессивное.
Фармакодинамика
Механизм действия
Устекинумаб представляет собой полностью человеческое моноклональное антитело IgG1κ, которое специфично связывается с общей единицей белка p40 ИЛ-12 и ИЛ-23 человека. Препарат Стелара ингибирует биоактивность ИЛ-12 и ИЛ-23 человека, предотвращая связывание p40 с рецептором ИЛ-12Rβ1, экспрессируемым на поверхности иммунных клеток. Препарат Стелара не связывается с ИЛ-12 или ИЛ-23, которые уже связаны с рецепторами ИЛ-12Rβ1 на поверхности клеток. Таким образом, маловероятно, что препарат Стелара будет способствовать опосредованной комплементом или антителами цитотоксичности в отношении клеток, экспрессирующих рецепторы к ИЛ-12 и/или ИЛ-23.
ИЛ-12 и ИЛ-23 представляют собой гетеродимерные цитокины, секретируемые активированными антигенпредставляющими клетками, например макрофагами и дендритными клетками. ИЛ-12 стимулирует клетки — естественные киллеры (NK) и дифференцировку CD4+ T-клеток до фенотипа Т-хелпера-1 (Th1), а также стимулирует выработку интерферона гамма (ИФН-γ). ИЛ-23 индуцирует путь Т-хелперов-17 (Th17) и способствует выработке ИЛ-17A, ИЛ-21 и ИЛ-22.
У пациентов с болезнью Крона отмечено повышение уровней ИЛ-12 и ИЛ-23 в кишечнике и лимфатических узлах. Это сопровождается увеличением уровней интерферона и ИЛ-17A в сыворотке, указывая, что ИЛ-12 и ИЛ-23 способствуют активации Th1 и Th17 при болезни Крона. Кроме того, как ИЛ-12, так и ИЛ-23 могут стимулировать выработку Т-клетками ФНО-α, что приводит к хроническому воспалению кишечника и повреждению эпителиальных клеток. Была обнаружена достоверная взаимосвязь между болезнью Крона и генетическим полиморфизмом генов ИЛ-23R и ИЛ-12B, что указывает на потенциальную причинную роль сигнальной системы ИЛ-12/23 в развитии заболевания. Это подтверждается доклиническими данными, свидетельствующими, что активация сигнального пути ИЛ-12/23 необходима для развития повреждения кишечника у мышей со смоделированным воспалительным поражением кишечника.
Связывая общую субъединицу p40 ИЛ-12 и ИЛ-23, препарат Стелара может влиять на клиническое течение болезни Крона и язвенного колита посредством прерывания пути выработки цитокинов Th1 и Th17, которые играют центральную роль в патогенезе этих заболеваний.
У пациентов с болезнью Крона в результате терапии препаратом Стелара отмечалось значимое снижение уровней маркеров воспаления, в т.ч. С-реактивного белка (C-РБ) и фекального кальпротектина. Уровень С-РБ оценивался во время долгосрочного продленного исследования, и его снижение, наблюдаемое во время фазы поддерживающей терапии, обычно сохранялось до 252-й нед терапии. У пациентов, получавших препарат Стелара в течение 44 нед, по сравнению с группой плацебо достигалось и сохранялось снижение в сыворотке крови концентраций ИФН-γ и ИЛ-17А, являющихся провоспалительными цитокинами, регулируемыми ИЛ-12 и ИЛ-23.
У пациентов с язвенным колитом терапия препаратом Стелара приводила к снижению уровней маркеров воспаления, в т.ч. С-РБ и фекального кальпротектина во время фазы индукции терапии, которые сохранялись на протяжении фазы поддерживающей терапии и во время долгосрочного продленного исследования до 92-й нед.
Иммунизация
Во время долгосрочного клинического исследования у пациентов, получавших препарат Стелара в течение по крайней мере 3,5 года, наблюдался иммунный ответ на полисахаридную пневмококковую и противостолбнячную вакцину, схожий с таковым в контрольной группе пациентов, получавших несистемную терапию. У примерно одинакового относительного числа (%) пациентов, получающих лечение препаратом Стелара, и пациентов из контрольной группы достигалась защитная концентрация противопневмококковых и противостолбнячных антител.
Фармакокинетика
Всасывание. Медиана Tmax устекинумаба в сыворотке крови у здоровых лиц составила 8,5 дня после его однократного п/к введения в дозе 90 мг. Медианы показателя Tmax устекинумаба после его однократного п/к введения в дозе 45 или 90 мг у пациентов были сравнимы с таковыми, отмечаемыми у здоровых добровольцев.
После в/в введения рекомендуемой инициирующей дозы медиана Cmax устекинумаба в плазме крови составляла 126,1 мкг/мл у пациентов с болезнью Крона и 127,0 мкг/мл у пациентов с язвенным колитом.
Распределение. Среднее значение Vd устекинумаба у пациентов в терминальной фазе выведения (Vz) после однократного в/в введения составляла от 57 до 83 мл/кг.
По результатам популяционного фармакокинетического анализа, Vd устекинумаба в равновесном состоянии составил 4,62 л у пациентов с болезнью Крона и 4,44 л у пациентов с язвенным колитом.
Метаболизм. Метаболический путь устекинумаба неизвестен.
Выведение. Медиана системного клиренса устекинумаба у пациентов после однократного в/в введения составляла от 1,99 до 2,34 мл/сут/кг.
По результатам популяционного фармакокинетического анализа, клиренс устекинумаба составил 0,19 л/сут, а T1/2 – около 19 дней у пациентов с болезнью Крона и язвенным колитом.
Линейность дозы. Системная экспозиция устекинумаба (Cmax и AUC) после однократного в/в введения в дозе от 0,09 до 4,5 мг/кг или после однократного п/к введения в дозе от приблизительно 24 и до 240 мг у пациентов возрастала примерно пропорционально введенной дозе.
Фармакокинетика после однократного и многократного введения
После в/в введения рекомендованной инициирующей дозы медиана Cmax устекинумаба составила 126,1 мкг/мл у пациентов с болезнью Крона и 127,0 мкг/мл у пациентов с язвенным колитом. Начиная с 8-й нед, п/к введение поддерживающей дозы устекинумаба, составляющей 90 мг, проводилось каждые 8 или 12 нед. Css устекинумаба достигалась к моменту введения 2-й поддерживающей дозы. При п/к введении устекинумаба 1 раз каждые 8 или 12 нед не наблюдалось признаков кумуляции дозы с течением времени.
При п/к введении поддерживающей дозы 90 мг устекинумаба 1 раз каждые 8 нед медиана наименьших Css находилась в диапазоне от 1,97 до 2,24 мкг/мл у пациентов с болезнью Крона и в диапазоне от 2,69 до 3,09 мкг/мл у пациентов с язвенным колитом. При п/к введении поддерживающей дозы 90 мг устекинумаба 1 раз каждые 12 нед медиана наименьших Css находилась в диапазоне от 0,61 до 0,76 мкг/мл у пациентов с болезнью Крона и в диапазоне от 0,92 до 1,19 мкг/мл у пациентов с язвенным колитом. На фоне наименьших Css устекинумаба, достигавшихся при его введении в дозе 90 мг с частотой 1 раз каждые 8 нед, отмечались более высокие показатели клинической ремиссии, чем при наименьших Css, достигавшихся после введения устекинумаба в дозе 90 мг с частотой 1 раз каждые 12 нед.
Влияние массы тела на фармакокинетику
Концентрация устекинумаба в плазме крови при п/к введении изменялась в зависимости от массы тела. При применении в дозе 45 или 90 мг у пациентов с более высокой массой тела (>100 кг) отмечалась более низкая медиана концентрации устекинумаба по сравнению с пациентами с более низкой массой тела (≤100 кг). Однако при сравнении разных доз медиана наименьших концентраций устекинумаба в плазме крови у пациентов с более высокой массой тела (>100 кг) при дозе 90 мг была сравнима с таковой у пациентов с более низкой массой тела (≤100 кг) при дозе 45 мг.
Популяционный фармакокинетический анализ
В ходе популяционного фармакокинетического анализа при п/к введении кажущийся клиренс (CL/F) и кажущийся Vd (V/F) составили 0,465 л/сут и 15,7 л соответственно, а T1/2 составил около 3 нед. CL/F при п/к введении устекинумаба не зависел от пола, возраста или расы. Он зависел от массы тела, при этом отмечалась тенденция к более высоким показателям CL/F у пациентов с более высокой массой тела. Медиана CL/F у пациентов с массой тела >100 кг была приблизительно на 55% выше, чем у пациентов с массой тела ≤100 кг. Медиана V/F у пациентов с массой тела >100 кг была приблизительно на 37% выше, чем у пациентов с массой тела ≤100 кг.
В ходе популяционного фармакокинетического анализа была проведена оценка влияния сопутствующих заболеваний (сахарный диабет, артериальная гипертензия и гиперлипидемия) на фармакокинетику устекинумаба при п/к введении. На нее оказывало влияние наличие сахарного диабета, при этом у пациентов с сахарным диабетом отмечалась тенденция к более высоким показателям CL/F. Средние показатели CL/F у пациентов с сахарным диабетом были приблизительно на 29% выше, чем у пациентов без сахарного диабета.
Популяционный фармакокинетический анализ установил наличие тенденции к более высоким показателям клиренса устекинумаба у пациентов с положительным иммунным ответом.
Специальных исследований лекарственных взаимодействий не проводилось.
В ходе популяционного фармакокинетического анализа было изучено влияние некоторых лекарственных препаратов (в т.ч. парацетамол/ацетаминофен, ибупрофен, ацетилсалициловая кислота, метформин, аторвастатин, напроксен, левотироксин, гидрохлортиазид и противогриппозная вакцина) на фармакокинетику устекинумаба. Было установлено, что ни один из этих препаратов не оказывает значимого влияния. Фармакокинетика устекинумаба не изменялась при одновременном применении с метотрексатом, пероральными кортикостероидами, 6-меркаптопурином или азатиоприном у пациентов с болезнью Крона, а также в случае предшествующей терапии биологическими препаратами (например, ингибиторы ФНО-α и/или ведолизумаб) у пациентов с язвенным колитом.
Эффекты ИЛ-12 или ИЛ-23 в отношении регуляции активности изоферментов CYP450 были изучены в ходе исследования in vitro с применением гепатоцитов человека. В результате было установлено, что ИЛ-12 и/или ИЛ-23 при концентрации 10 нг/мл не влияют на активность изоферментов CYР450 (CYP1A2, CYP2B6, CYP2C9, CYP2C19, CYP2D6 или CYP3A4).
Особые группы пациентов
Пациенты с нарушением функции почек. Данные о фармакокинетике препарата у пациентов с нарушением функции почек отсутствуют.
Пациенты с нарушением функции печени. Данные о фармакокинетике препарата у пациентов с нарушением функции печени отсутствуют.
Дети до 18 лет. Фармакокинетика устекинумаба в ЛФ концентрат для приготовления раствора для инфузий у детей до 18 лет не изучалась.
Пожилые пациенты (от 65 лет и старше). Исследования фармакокинетики у пациентов пожилого возраста не проводились. Популяционный фармакокинетический анализ среди пациентов старше 65 лет не выявил влияния возраста на величины CL/F и V/F.
Другие группы пациентов. Фармакокинетика устекинумаба сравнима у пациентов азиатского и неазиатского происхождения.
Употребление алкоголя или табака не влияло на фармакокинетику устекинумаба.
Показания
болезнь Крона умеренной и тяжелой степени:
— индукция клинического ответа;
— индукция клинической ремиссии;
— достижение бесстероидной ремиссии;
— индукция эндоскопической ремиссии;
— улучшение связанного со здоровьем качества жизни;
активная болезнь Крона умеренной и тяжелой степени у взрослых, у которых:
— прогрессирование заболевания продолжалось на фоне терапии иммуномодуляторами или кортикостероидами, или была выявлена непереносимость этих препаратов, или
— наблюдалась зависимость от кортикостероидов, или
— прогрессирование заболевания продолжалось на фоне терапии одним или несколькими ингибиторами ФНО, или была выявлена непереносимость одного или нескольких ингибиторов ФНО;
лечение взрослых пациентов с активным язвенным колитом умеренной и тяжелой степени с неадекватным ответом, утратой ответа или непереносимостью стандартной или биологической терапии, или имеющих медицинские противопоказания к проведению такой терапии.
Противопоказания
клинически значимая повышенная чувствительность к устекинумабу или любому вспомогательному веществу препарата;
клинически значимая активная инфекция (например, активный туберкулез);
возраст до 18 лет.
Применение при беременности и кормлении грудью
Беременность. В исследованиях на животных не было получено доказательств тератогенности, врожденных дефектов или задержек развития при концентрациях устекинумаба в крови, примерно в 150 раз превышающих Cmax, достигаемую после 4 еженедельных п/к введений в дозе 90 мг или при концентрациях устекинумаба в крови, превышающих в 21 раз концентрацию, достигаемую через 1 ч после в/в введения в дозе 6 мг/кг. Тем не менее, исследования влияния устекинумаба на репродуктивную функцию и на развитие потомства у животных не всегда прогнозируют реакции, развивающиеся у человека.
Неизвестно, может ли применение препарата Стелара нанести вред плоду при применении у беременных женщин или повлиять на репродуктивную функцию. Препарат Стелара следует применять у беременных женщин только в случае, если ожидаемая польза от применения у матери перевешивает потенциальный риск для плода.
Период грудного вскармливания. Выделение препарата Стелара с грудным молоком наблюдалось у обезьян. Неизвестно, абсорбируется ли препарат Стелара системно после приема внутрь. Поскольку многие препараты и Ig выделяются с грудным молоком у женщин и в связи с возможностью возникновения нежелательных явлений у детей, получающих грудное молоко, следует принять решение о прекращении грудного вскармливания в период приема препарата или об отмене терапии устекинумабом.
Фертильность. Оценка влияния препарата Стелара на фертильность человека не проводилась. В исследовании фертильности, проведенном у мышей, не было выявлено неблагоприятных эффектов в отношении фертильности самок.
Способ применения и дозы
В/в.
Дозы. Пациентам с болезнью Крона или язвенным колитом рекомендовано однократное, инициирующее терапию в/в введение препарата Стелара в дозе, рассчитанной на основании массы тела (таблица 1).
Таблица 1
Инициирующая доза препарата Стелара (внутривенное введение)*
| Масса тела пациента на момент введения препарата, кг | Доза, мг | Количество флаконов препарата Стелара, концентрат для приготовления раствора для инфузий, 130 мг |
| ≤55 | 260 | 2 |
| 55–85 | 390 | 3 |
| >85 | 520 | 4 |
* Рекомендованная доза (около 6 мг/кг).
Через 8 нед после введения инициирующей дозы препарат Стелара вводится п/к в дозе 90 мг (1-е п/к введение). Для п/к введения используется препарат Стелара в ЛФ раствор для п/к введения.
Информация о последующих п/к введениях препарата указана в инструкции по применению препарата Стелара, раствор для п/к введения.
Особые группы пациентов
Пациенты с нарушением функции почек. У пациентов с почечной недостаточностью не проводилось отдельных исследований препарата.
Пациенты с нарушением функции печени. У пациентов с печеночной недостаточностью не проводилось отдельных исследований препарата.
Дети. Исследования препарата Стелара в ЛФ концентрат для приготовления раствора для инфузий у детей младше 18 лет не проводились.
Пожилые пациенты. В клинических исследованиях не наблюдалось существенных возрастных различий клиренса или Vd препарата. Количество пациентов от 65 лет и старше было недостаточным для окончательного вывода о влиянии возраста на клиническую эффективность препарата.
Способ применения
Препарат Стелара, концентрат для приготовления раствора для инфузий, 130 мг, предназначен только для в/в инфузионного введения.
В/в инфузионное введение препарата Стелара должно проводиться только квалифицированными медицинскими работниками.
Инструкции по приготовлению раствора, обращению с ним и его утилизации
Приготовление раствора препарата Стелара, концентрат для приготовления раствора для инфузий, 130 мг, должно производиться квалифицированными специалистами с соблюдением требований асептики, следующим образом.
1. Рассчитать необходимую дозу и требуемое количество флаконов препарата Стелара на основании массы тела пациента (см. таблица 1). Каждый флакон препарата Стелара объемом 26 мл содержит 130 мг устекинумаба.
2. Из инфузионной емкости, содержащей 250 мл 0,9% раствора хлорида натрия, извлечь объем раствора, равный объему препарата Стелара, который необходимо ввести пациенту (на каждый флакон препарата Стелара необходимо извлечь из инфузионной емкости 26 мл раствора хлорида натрия, т.е. при необходимости введения 2 флаконов требуется извлечь 52 мл, при введении 3 флаконов — 78 мл, при введении 4 флаконов — 104 мл; извлеченный раствор утилизируется). При необходимости допускается использование инфузионных емкостей объемом 250 мл, содержащих 0,45% раствор хлорида натрия.
3. Из каждого флакона препарата Стелара извлечь 26 мл концентрата и ввести его в емкость с инфузионным раствором. Итоговый объем получившегося раствора препарата должен быть равен 250 мл. Осторожно перемешать.
4. Перед введением внимательно осмотреть полученный раствор. При выявлении в растворе видимых непрозрачных частиц, изменении цвета или наличии инородных частиц использовать такой раствор запрещается.
5. Ввести полученный раствор препарата пациенту путем в/в инфузии длительностью не менее 1 ч. Раствор необходимо использовать в течение 4 ч после приготовления.
6. Использовать только инфузионные наборы со встроенным стерильным, апирогенным фильтром с низким связыванием белков (размер пор 0,2 микрометра).
7. Запрещается вводить препарат Стелара одновременно с другими препаратами через одну и ту же инфузионную систему.
8. Каждый флакон препарата Стелара предназначен только для одноразового использования, и весь неиспользованный концентрат должен быть утилизирован в соответствии с действующими правилами.
Побочные действия
Побочные действия — это нежелательные явления, которые были расценены как обоснованно связанные с использованием устекинумаба на основании всесторонней оценки имеющихся данных о нежелательных явлениях. В отдельных случаях не представляется возможным достоверно установить наличие причинной связи между нежелательным явлением и применением устекинумаба. Кроме того, поскольку клинические исследования проводятся в разных условиях, невозможно провести непосредственное сравнение частоты нежелательных реакций, наблюдаемых в клиническом исследовании препарата, с частотой, наблюдаемой в клинических исследованиях другого препарата, и частота нежелательного явления, наблюдаемая в клиническом исследовании, может не соответствовать частоте, наблюдаемой в клинической практике.
Опыт применения в клинических исследованиях у взрослых пациентов
Данные по безопасности, представленные далее, отражают применение препарата Стелара в 12 исследованиях II и III фаз.
Наиболее частыми (>5%) побочными действиями, наблюдавшимися в контролируемых периодах клинических исследований препарата Стелара, были назофарингит и головная боль. Большинство случаев были расценены как легкие и не требующие прекращения терапии.
В таблице 2 представлен обзор побочных действий, зарегистрированных в клинических исследованиях. Расчет частоты этих побочных действий проводился на основании случаев, зарегистрированных во время начальных контролируемых периодов клинических исследований. Побочные действия расположены в порядке уменьшения частоты, в соответствии со следующими категориями: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000).
Таблица 2
Обзор побочных действий, зарегистрированных в клинических исследованиях
| Системно-органный класс | Частота |
| Инфекции и инвазии | Часто — инфекции верхних дыхательных путей, назофарингит, синусит; нечасто — воспаление подкожной жировой клетчатки, одонтогенные инфекции, опоясывающий лишай, вирусные инфекции верхних дыхательных путей, вульвовагинальные грибковые инфекции |
| Со стороны психики | Нечасто — депрессия |
| Со стороны нервной системы | Часто — головокружение, головная боль |
| Со стороны дыхательной системы, органов грудной клетки и средостения | Часто — орофарингеальная боль; нечасто — заложенность носа |
| Со стороны ЖКТ | Часто — диарея, тошнота, рвота |
| Со стороны кожи и подкожной клетчатки | Часто — зуд; нечасто — акне |
| Со стороны опорно-двигательного аппарата и соединительной ткани | Часто — боль в спине, миалгия, артралгия |
| Общие нарушения и реакции в месте введения препарата | Часто — усталость, эритема в месте введения, боль в месте введения; нечасто — реакции в месте введения (в т.ч. кровотечение, гематома, уплотнение, припухлость и зуд), астения |
Инфекции
В плацебо-контролируемых исследованиях частота инфекций или серьезных инфекций была сравнима у пациентов, получавших препарат Стелара, и пациентов, получавших плацебо. В плацебо-контролируемых периодах клинических исследований частота инфекций составляла 1,36 и 1,34 на пациенто-год наблюдения в группах, получавших препарат Стелара, и плацебо соответственно.
В ходе контролируемых и неконтролируемых периодов клинических исследований, что составляет 11581 пациенто-год терапии у 6709 пациентов, получавших препарат Стелара, частота инфекций составляла 0,91 на пациенто-год наблюдения. Частота серьезных инфекций у пациентов, получавших препарат Стелара, составляла 0,02 на пациенто-год наблюдения.
В клинических исследованиях у пациентов с латентным туберкулезом, одновременно получавших изониазид, не отмечалось случаев развития туберкулеза.
Злокачественные новообразования
В ходе плацебо-контролируемых периодов клинических исследований частота возникновения злокачественных новообразований, без учета случаев немеланомного рака кожи, у пациентов, получавших препарат Стелара, составляла 0,11 на 100 пациенто-лет наблюдения и 0,23 на 100 пациенто-лет наблюдения у пациентов, получавших плацебо.
Частота возникновения немеланомного рака кожи у пациентов, получавших препарат Стелара, составляла 0,43 на 100 пациенто-лет наблюдения и 0,46 на 100 пациенто-лет наблюдения у пациентов, получавших плацебо, в ходе контролируемых и неконтролируемых периодов клинических исследований, что составляет 11561 пациенто-год терапии у 6709 пациентов.
Злокачественные новообразования, кроме случаев немеланомного рака кожи, были зарегистрированы с частотой 0,54 на 100 пациенто-лет наблюдения у пациентов, получавших препарат Стелара. Частота случаев возникновения немеланомного рака кожи у пациентов, получавших препарат Стелара, составила 0,49 на 100 пациенто-лет наблюдения (56 пациентов на 11545 пациенто-лет наблюдения).
Частота возникновения злокачественных новообразований у пациентов, получавших препарат Стелара®, была аналогична частоте, ожидаемой в общей популяции (стандартизованное отношение частоты = 0,93 (95% ДИ: 0,71; 1,20), с учетом поправок на возраст, пол и расовую принадлежность)*.
Соотношение пациентов с базальноклеточным и плоскоклеточным типами рака (3:1) соответствовало соотношению, ожидаемому в общей популяции.
* База данных программы наблюдения, эпидемиологии и отслеживания исходов (SEER) (www.seer.cancer.gov) SEER*Stat Database: Incidence — SEER 6.6.2 Regs Research Data, подача — ноябрь 2009 (1973–2007) — в связи с характеристиками страны — США в целом, 1969–2007 Округи, Национальный институт онкологии, DCCPS, исследовательская программа наблюдения, группа наблюдательных систем, выпущено в апреле 2010 года, на основании подачи в ноябре 2009 года.
Реакции гиперчувствительности и инфузионные реакции
П/к введение. Во время контролируемых периодов клинических исследований препарата Стелара при п/к введении сыпь и крапивница наблюдались менее чем у 1% пациентов каждая.
В/в введение. В исследованиях индуцирующей терапии при болезни Крона и язвенном колите не было зарегистрировано случаев развития анафилактических или других серьезных инфузионных реакций. В исследованиях по показанию болезнь Крона побочные действия, развивавшиеся во время инфузии или в течение часа после инфузии, были зарегистрированы у 2,4% из 466 пациентов, получавших плацебо, и у 2,6% из 470 пациентов, получавших препарат Стелара в рекомендованной дозе. В исследованиях по показанию язвенный колит у 1,9% из 319 пациентов, получавших плацебо, и у 0,9% из 320 пациентов, получавших рекомендуемую дозу препарата Стелара, побочные действия отмечались во время инфузии или в течение часа после инфузии.
Иммуногенность
У пациентов с положительными результатами тестов на антитела к устекинумабу отмечалась тенденция к более низкой эффективности, тем не менее, наличие антител не препятствовало развитию клинического ответа. У большинства пациентов с положительными результатами тестов на антитела присутствовали также и нейтрализующие их антитела. В клинических исследованиях у пациентов с болезнью Крона и язвенным колитом образование антител к устекинумабу было выявлено соответственно у 2,9 и 4,6% пациентов, получавших препарат Стелара в течение около 1 года. Не наблюдалось очевидной взаимосвязи между образованием антител к устекинумабу и развитием реакций в месте введения препарата.
Опыт пострегистрационного применения
Побочные действия в таблице 3 расположены в порядке уменьшения частоты* с использованием следующих категорий: очень часто (≥1/10); часто (≥1/100 и <1/10); нечасто (≥1/1000 и <1/100); редко (≥1/10000 и <1/1000); очень редко (<1/10000, в т.ч. отдельные).
Таблица 3
Пострегистрационные сообщения
| Системно-органный класс | Частота |
| Со стороны иммунной системы | Нечасто — реакции гиперчувствительности (в т.ч. сыпь, крапивница); редко — серьезные реакции гиперчувствительности (в т.ч. анафилаксия и ангионевротический отек) |
| Инфекции и инвазии | Нечасто — инфекции нижних отделов дыхательных путей |
| Со стороны дыхательной системы, органов грудной клетки и средостения | Редко — аллергический альвеолит, эозинофильная пневмония |
| Со стороны кожи и подкожной клетчатки | Нечасто — пустулезный псориаз; редко — эритродермический псориаз, лейкоцитокластический васкулит |
* Расчет частоты побочных действий, зарегистрированных при пострегистрационном периоде наблюдения, проводился на основании 11 плацебо-контролируемых клинических исследований, в случае если такое побочное действие наблюдалось в этих исследованиях. В противном случае считалось, что частота ниже определенного значения, учитывая объем применения в 11 клинических исследованиях, в которых это побочное действие не наблюдалось.
Взаимодействие
Исследования лекарственных взаимодействий с препаратом Стелара у человека не проводились.
Эффекты ИЛ-12 или ИЛ-23 на регуляцию изоферментов CYP450 оценивались in vitro с использованием гепатоцитов человека. В исследовании было показано, что ИЛ-12 и/или ИЛ-23 в концентрации 10 нг/мл не влияют на активность изоферментов CYP450 человека (CYP1А2, CYP2В6, CYP2С9, CYP2С19, CYP2D6 или CYP3А4). Полученные результаты не предполагают необходимости коррекции дозы у пациентов, принимающих одновременно с препаратом Cтелара препараты, метаболизируемые изоферментами CYP450.
Живые вакцины не следует вводить одновременно с применением препарата Стелара.
Передозировка
При однократных в/в введениях доз до 6 мг/кг в рамках клинических исследований не отмечалось токсичности, ограничивающей дозу. В случае передозировки рекомендуется наблюдать пациента на предмет развития любых признаков и проявлений нежелательных реакций с целью немедленного начала соответствующей симптоматической терапии.
Особые указания
Инфекции
Препарат Стелара является селективным иммунодепрессантом и потенциально может увеличивать риск возникновения инфекций и реактивации латентных инфекций.
В ходе клинических исследований у пациентов, получавших препарат Стелара, наблюдались случаи возникновения серьезных бактериальных и вирусных инфекций.
Препарат Стелара не следует применять у пациентов с клинически значимой активной инфекцией. Следует с осторожностью применять препарат Стелара у пациентов с хронической инфекцией или рецидивирующей инфекцией в анамнезе.
Перед началом терапии препаратом Стелара следует обследовать пациентов на наличие туберкулеза. Препарат Стелара не следует применять у пациентов с активным туберкулезом. Перед применением препарата Стелара следует провести терапию латентного туберкулеза. Кроме того, противотуберкулезную терапию перед началом применения препарата Стелара следует провести пациентам с латентным или активным туберкулезом в анамнезе, для которых отсутствует подтверждение проведения эффективного курса лечения. У пациентов, получающих препарат Стелара, во время и после терапии следует внимательно контролировать признаки или симптомы активного туберкулеза.
Пациентов следует проинструктировать о необходимости обращения за медицинской помощью в случае появления признаков или симптомов, указывающих на развитие инфекции. В случае, если у пациента развивается серьезная инфекция, необходимо проводить тщательное наблюдение пациента и не применять препарат Стелара до разрешения инфекционного процесса.
Злокачественные новообразования
Препарат Стелара является селективным иммунодепрессантом. Препараты-иммунодепрессанты могут способствовать увеличению риска развития злокачественных новообразований. У некоторых пациентов, получавших препарат Стелара в рамках клинических исследований, наблюдалось развитие кожных и некожных злокачественных новообразований.
Применение препарата Стелара не изучалось у пациентов со злокачественными новообразованиями в анамнезе. Следует проявлять осторожность при назначении препарата Стелара пациентам со злокачественными новообразованиями в анамнезе, а также при рассмотрении возможности продолжения терапии препаратом Стелара у пациентов с диагностированными злокачественными новообразованиями.
У всех пациентов, особенно у пациентов старше 60 лет и у пациентов, ранее получавших длительную терапию иммунодепрессантами или ПУВА-терапию, необходимо проводить обследование на наличие немеланомного рака кожи.
Реакции гиперчувствительности
В ходе пострегистрационного наблюдения были зарегистрированы серьезные реакции гиперчувствительности, включая анафилаксию и ангионевротический отек. В случае развития анафилактических или других серьезных реакций гиперчувствительности следует начать соответствующую терапию и прекратить применение препарата Стелара.
Вакцинация
Не рекомендуется применять живые вирусные или живые бактериальные вакцины одновременно с препаратом Стелара.
Данные о вторичном инфицировании при применении живых вакцин у пациентов, получающих препарат Стелара, отсутствуют.
Следует соблюдать осторожность при применении живых вакцин для иммунизации членов семьи пациента, получающего лечение препаратом Стелара, поскольку имеется риск вирусо- или бактериовыделения и передачи инфекции от этих лиц пациентам.
Пациентам, получающим препарат Стелара, можно одновременно вводить инактивированные или неживые вакцины.
Длительное лечение препаратом Стелара не подавляет гуморальный иммунный ответ на вакцины, содержащие пневмококковый полисахарид и противостолбнячную вакцину.
Иммуносупрессия
В исследованиях у пациентов с болезнью Крона и язвенным колитом совместное применение препарата Стелара с иммуномодуляторами (6-меркаптопурин, азатиоприн, метотрексат) или с кортикостероидами не влияло на безопасность и эффективность препарата Стелара. Следует проявлять осторожность при рассмотрении возможности одновременного применения иммунодепрессантов и устекинумаба, а также при переходе с терапии другими биологическими препаратами на терапию устекинумабом.
Иммунотерапия
Безопасность и эффективность применения препарата Cтелара у пациентов, прошедших иммунотерапию аллергических заболеваний, не установлена. Препарат Стелара может оказывать влияние на иммунотерапию аллергических заболеваний. Следует соблюдать осторожность при применении устекинумаба у пациентов, получающих или ранее получавших иммунотерапию аллергических заболеваний, особенно если такая терапия связана с анафилаксией.
Влияние на способность управлять транспортными средствами и механизмами. Исследований не проводилось.
Форма выпуска
Концентрат для приготовления раствора для инфузий, 5 мг/мл. По 26 мл концентрата во флаконе из стекла I типа, укупоренном пробкой из бутилового каучука и алюминиевым колпачком с защитным диском из пластмассы. По 1 флакону вместе с инструкцией по применению в пачке картонной.
Производитель
Силаг АГ, Хохштрассе 201, 8200 Шаффхаузен, Швейцария.
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей. ООО «Джонсон & Джонсон». Россия, 121614, Москва, ул. Крылатская, 17, корп. 2.
Тел.: (495) 755-83-57; факс: (495) 755-83-58.
Комментарий
Материал предназначен для медицинских (фармацевтических) работников.
Номер согласования: CP-311675.
Условия отпуска из аптек
По рецепту.
Условия хранения
В защищенном от света месте, при температуре 2–8 °C (не замораживать, не встряхивать).
Хранить в недоступном для детей месте.
Срок годности
3 года.
После вскрытия – 4 ч (при комнатной температуре).
Не применять по истечении срока годности, указанного на упаковке.
Stelara
Регистрационный номер
Торговое наименование
Стелара®
Международное непатентованное наименование
Лекарственная форма
концентрат для приготовления раствора для инфузий
Состав
1 мл концентрата содержит:
действующее вещество: устекинумаб — 5,0 мг;
вспомогательные вещества: L-гистидин — 0,8 мг, L-гистидина гидрохлорида моногидрат — 1,1 мг, сахароза — 85 мг, полисорбат 80 — 0,40 мг, L-метионин — 0,40 мг, динатрия эдетата дигидрат — 0,02 мг, вода для инъекций — до 1,0 мл.
Описание
Прозрачная или почти прозрачная, бесцветная жидкость или жидкость с коричневатым или коричневато-желтоватым или желтоватым оттенком, которая может содержать незначительное количество небольших прозрачных или белых частиц белка.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Механизм действия
Устекинумаб представляет собой полностью человеческое моноклональное антитело IgG1к, которое специфично связывается с общей единицей белка р40 интерлейкинов (ИЛ) ИЛ-12 и ИЛ-23 человека. Препарат Стелара ингибирует биоактивность ИЛ-12 и ИЛ-23 человека, предотвращая связывание р40 с рецептором ИЛ-12Rβ1, экспрессируемым на поверхности иммунных клеток. Препарат Стелара не связывается с ИЛ-12 или ИЛ-23, которые уже связаны с рецепторами ИЛ-12Rβ1 на поверхности клеток. Таким образом, маловероятно, что препарат Стелара будет способствовать опосредованной комплементом или антителами цитотоксичности в отношении клеток, экспрессирующих рецепторы к ИЛ-12 и/или ИЛ-23.
ИЛ-12 и ИЛ-23 представляют собой гетеродимерные цитокины, секретируемые активированными антигенпредставляющими клетками, например, макрофагами и дендритными клетками. ИЛ-12 стимулирует клетки-естественные киллеры (NK) и дифференцировку CD4+ Т-клеток до фенотипа Т-хелпера-1 (Тh1), а также стимулирует выработку интерферона гамма (ИФНγ). ИЛ-23 индуцирует путь Т-хелперов-17 (Тh17) и способствует выработке ИЛ-17А, ИЛ-21 и ИЛ-22.
У пациентов с болезнью Крона отмечено повышение уровней ИЛ-12 и ИЛ-23 в кишечнике и лимфатических узлах. Это сопровождается увеличением уровней интерферона и ИЛ-17А в сыворотке, указывая, что ИЛ-12 и ИЛ-23 способствуют активации Th1 и Тh17 при болезни Крона. Кроме того, как ИЛ-12, так и ИЛ-23 могут стимулировать выработку Т-клетками ФНО-α, что приводит к хроническому воспалению кишечника и повреждению эпителиальных клеток. Была обнаружена достоверная взаимосвязь между болезнью Крона и генетическим полиморфизмом генов ИЛ23R и ИЛ 2В, что указывает на потенциальную причинную роль сигнальной системы ИЛ-12/23 в развитии заболевания. Это подтверждается доклиническими данными, свидетельствующими, что активация сигнального пути ИЛ-12/23 необходима для развития повреждения кишечника у мышей со смоделированным воспалительным поражением кишечника. Связывая общую субъединицу р40 ИЛ-12 и ИЛ-23, препарат Стелара может влиять на клиническое течение болезни Крона посредством прерывания пути выработки цитокинов Тh1 и Тh17, которые играют центральную роль в патогенезе этих заболеваний.
У пациентов с болезнью Крона в результате терапии препаратом Стелара отмечалось значимое снижение уровней маркеров воспаления, в том числе С-реактивного белка (CRP) и фекального кальпротектина. У пациентов, получавших препарат Стелара в течение 44 недель, по сравнению с группой плацебо достигалось и сохранялось снижение в сыворотке крови концентраций ИФНγ и ИЛ-17А, являющихся провоспалительными цитокинами, регулируемыми ИЛ-12 и ИЛ-23.
Иммунизация
Во время долгосрочного клинического исследования у пациентов, получавших препарат Стелара в течение, по крайней мере, 3.5 лет, наблюдался иммунный ответ на полисахаридную пневмококковую и противостолбнячную вакцину, схожий с таковым в контрольной группе пациентов, получавших несистемную терапию. У примерно одинакового относительного числа ( %) пациентов, получающих лечение препаратом Стелара, и пациентов из контрольной группы достигалась защитная концентрация противопневмококковых и противостолбнячных антител.
Фармакокинетика
Всасывание
Медиана времени до достижения максимальной концентрации устекинумаба в сыворотке крови (tmax) у здоровых лиц составила 8,5 дней после его однократного подкожного введения в дозе 90 мг. Медианы показателя tmax устекинумаба после его однократного подкожного введения в дозе 45 мг или 90 мг у пациентов были сравнимы с таковыми, отмечаемыми у здоровых добровольцев. Абсолютная биодоступность устекинумаба после его однократного подкожного введения пациентам оценивается равной 57,2 %.
Распределение
Среднее значение объёма распределения устекинумаба у пациентов в терминальной фазе выведения (Vz) после однократного внутривенного введения составляла от 57 до 83 мл/кг.
Метаболизм
Метаболический путь устекинумаба не известен.
Выведение
Медиана системного клиренса (CL) устекинумаба у пациентов после однократного внутривенного введения составляла от 1,99 до 2,34 мл/сут/кг.
В ходе клинических исследований период полувыведения (Т½) устекинумаба у пациентов с болезнью Крона в диапазоне от 15 до 32 дней, а его медиана составила около 3-х недель.
Линейность дозы
Системная экспозиция устекинумаба (Сmах и AUC) после однократного внутривенного введения в дозе от 0,09 мг/кг до 4,5 мг/кг или после однократного подкожного введения в дозе от приблизительно 24 мг и до 240 мг у пациентов возрастала примерно пропорционально введённой дозе.
Фармакокинетика после однократного и многократного введения
У пациентов с болезнью Крона после внутривенного ведения в рекомендованной инициирующей дозе медиана максимальной концентрации устекинумаба составила 126,1 мкг/мл. Начиная с 8-ой недели, подкожное введение поддерживающей дозы устекинумаба. составляющей 90 мг, проводилось каждые 8 или 12 недель.
Равновесная концентрация устекинумаба достигалась к моменту введения второй поддерживающей дозы. Медиана наименьших равновесных концентраций устекинумаба при введении в дозе 90 мг каждые 8 или 12 недель находилась в диапазоне от 1,97 мкг/мл до 2,24 мкг/мл и от 0,61 мкг/мл до 0,76 мкг/мл соответственно. На фоне наименьших равновесных концентраций устекинумаба. достигавшихся при его введении в дозе 90 мг с частотой 1 раз каждые 8 недель, отмечались более высокие показатели клинической ремиссии, чем при наименьших равновесных концентрациях, достигавшихся после введения устекинумаба в дозе 90 мг с частотой 1 раз каждые 12 недель.
Влияние массы тела на фармакокинетику
Концентрация устекинумаба в плазме крови при подкожном введении изменялась в зависимости от массы тела. При применении в дозе 45 мг или 90 мг у пациентов с более высокой массой тела (>100 кг) отмечалась более низкая медиана концентрации устекинумаба по сравнению с пациентами с более низкой массой тела (<100 кг). Однако при сравнении разных доз медиана наименьших концентраций устекинумаба в плазме крови у пациентов с более высокой массой тела (>100 кг) при дозе 90 мг была сравнима с таковой у пациентов с более низкой массой тела (≤100 кг) при дозе 45 мг.
Популяционный фармакокинетический анализ
В ходе популяционного фармакокинетического анализа при подкожном введении кажущийся клиренс (CL/F) и кажущийся объём распределения (V/F) составили 0,465 л/сут и 15,7 л соответственно, а Т½ составил около 3-х недель. Кажущийся клиренс при подкожном введении устекинумаба не зависел от пола, возраста или расы. Он зависел от массы тела, при этом отмечалась тенденция к более высоким показателям кажущегося клиренса у пациентов с более высокой массой тела. Медиана кажущегося клиренса у пациентов с массой тела >100 кг была приблизительно на 55 % выше, чем у пациентов с массой тела ≤100 кг. Медиана кажущегося объёма распределения у пациентов с массой тела >100 кг была приблизительно на 37 % выше, чем у пациентов с массой тела ≤100 кг.
В ходе популяционного фармакокинетического анализа была проведена оценка влияния сопутствующих заболеваний (сахарный диабет, артериальная гипертензия и гиперлипидемия) на фармакокинетику устекинумаба при подкожном введении. На неё оказывало влияние наличие сахарного диабета, при этом у пациентов с сахарным диабетом отмечалась тенденция к более высоким показателям кажущегося клиренса. Средние показатели кажущегося клиренса у пациентов с сахарным диабетом были приблизительно на 29 % выше, чем у пациентов без сахарного диабета.
Популяционный фармакокинетический анализ установил наличие тенденции к более высоким показателям клиренса устекинумаба у пациентов с положительным иммунным ответом.
Специальных исследований лекарственных взаимодействий не проводилось.
В ходе популяционного фармакокинетического анализа было изучено влияние некоторых лекарственных препаратов (в том числе парацетамола/ ацетаминофена ибупрофена, ацетилсалициловой кислоты, метформина, аторвастатина, напроксена, левотироксина. гидрохлортиазида и противогриппозной вакцины) на фармакокинетику устекинумаба. Было установлено, что ни один их этих препаратов не оказывает значимого влияния. У пациентов с болезнью Крона фармакокинетика устекинумаба не изменялась при одновременном применении с метотрексатом, нестероидными противовоспалительными лекарственными средствами, пероральными кортикостероидами, 6-меркаптопурином, азатиоприном, или в результате предшествующего применения препаратов, блокирующих ФНО-α.
Эффекты ИЛ-12 или ИЛ-23 в отношении регуляции активности изоферментов CYP450 были изучены в ходе исследования in vitro с применением гепатоцитов человека. В результате было установлено, что ИЛ-12 и/или ИЛ-23 при концентрации 10 нг/мл не влияют на активность изоферментов CYP450 (CYP1А2, 2В6, 2С9, 2С19, 2D6 или 3А4).
Особые группы пациентов
Дети (в возрасте до 18 лет)
Фармакокинетика устекинумаба в лекарственной форме концентрат для приготовления раствора для инфузий у детей в возрасте до 18 лет не изучалась.
Пожилые пациенты (в возрасте от 65 лет и старше)
Исследования фармакокинетики у пациентов пожилого возраста не проводилось. Популяционный фармакокинетический анализ среди пациентов старше 65 лет не выявил влияния возраста на величины кажущегося клиренса (CL/F) и объёма распределения (V/F).
Пациенты с нарушением функции почек
Данные о фармакокинетике препарата у пациентов с нарушением функции почек отсутствуют. Пациенты с нарушением функции печени
Данные о фармакокинетике препарата у пациентов с нарушением функции печени отсутствуют.
Другие группы пациентов
Фармакокинетика устекинумаба сравнима у пациентов азиатского происхождения и у пациентов неазиатского происхождения.
Употребление алкоголя или табака не влияло на фармакокинетику устекинумаба.
Показания
Препарат Стелара в лекарственной форме концентрат для приготовления раствора для инфузий предназначен для терапии взрослых пациентов с болезнью Крона умеренной и тяжёлой степени.
Препарат Стелара в лекарственной форме концентрат для приготовления раствора для инфузий предназначен для:
- индукции и поддержания клинического ответа
- индукции и поддержания клинической ремиссии
- достижения бесстероидной ремиссии
- индукции эндоскопической ремиссии
- улучшения связанного со здоровьем качества жизни
у взрослых пациентов с активной болезнью Крона умеренной и тяжёлой степени, у которых:
- прогрессирование заболевания продолжалось на фоне терапии иммуномодуляторами или кортикостероидами, или была выявлена непереносимость этих препаратов, или
- наблюдалась зависимость от кортикостероидов, или
- прогрессирование заболевания продолжаюсь на фоне терапии одним или несколькими ингибиторами ФНO), или была выявлена непереносимость одного или нескольких ингибиторов ФHО.
Противопоказания
— Клинически значимая повышенная чувствительность к устекинумабу или любому вспомогательному веществу препарата;
— клинически значимая активная инфекция (например, активный туберкулёз);
— детский возраст до 18 лет.
Применение при беременности и в период грудного вскармливания
Беременность
В исследованиях на животных не было получено доказательств тератогенности, врождённых дефектов или задержек развития при применении доз, примерно в 45 раз превышающих самую высокую эквивалентную дозу, предназначенную для применения у людей. Тем не менее, исследования влияния устекинумаба на репродуктивную функцию и на развитие потомства у животных не всегда прогнозируют реакции, развивающиеся у человека.
Неизвестно, может ли применение препарата Стелара нанести вред плоду при применении у беременных женщин или повлиять на репродуктивную функцию. Препарат Стелара следует применять у беременных женщин только в случае, если ожидаемая польза от применения у матери перевешивает потенциальный риск для плода.
Период грудного вскармливания
Выделение препарата Стелара с грудным молоком наблюдалось у обезьян. Неизвестно, абсорбируется ли препарат Стелара системно после приёма внутрь. Поскольку многие препараты и иммуноглобулины выделяются с грудным молоком у человека и в связи с возможностью возникновения нежелательных явлений у детей, получающих грудное молоко, следует принять решение о прекращении грудного вскармливания в период приёма препарата или об отмене терапии устекинумабом.
Фертильность
Оценка влияния препарата Стелара на фертильность человека не проводилась. В исследовании фертильности, проведенном у мышей, не было выявлено неблагоприятных эффектов в отношении фертильности самок.
Способ применения и дозы
Болезнь Крона
Дозы
Пациентам с болезнью Крона рекомендовано однократное, инициирующее терапию внутривенное введение препарата Стелара в дозе, рассчитанной на основании массы тела (Таблица 1).
|
Таблица 1: Инициирующая доза препарата Стелара (внутривенное введение)а |
||
|
Масса тела пациента на момент введения препарата |
Доза |
Количество флаконов препарата Стелара, концентрат для приготовления раствора для инфузий, 130 мг |
|
< 55 кг |
260 мг |
2 |
|
> 55 кг-≤ 85 кг |
390 мг |
3 |
|
> 85 кг |
520 мг |
4 |
а Рекомендованная доза (около 6 мг/кг)
Через 8 недель после введения инициирующей дозы препарат Стелара вводится подкожно в дозе 90 мг (первое подкожное введение). Для подкожного введения используется препарат Стелара в лекарственной форме раствор для подкожного введения.
Информация о последующих подкожных введениях препарата указана в инструкции по медицинскому применению препарата Стелара, раствор для подкожного введения.
Особые группы пациентов
Дети
Исследования препарата Стелара в лекарственной форме концентрат для приготовления раствора для инфузий у детей младше 18 лет не проводились.
Пожилые пациенты
В клинических исследованиях не наблюдалось существенных возрастных различий клиренса или объёма распределения препарата. Количество пациентов в возрасте от 65 лет и старше было недостаточным для окончательного вывода о влиянии возраста на клиническую эффективность препарата.
Пациенты с нарушением функции почек
У пациентов с почечной недостаточностью не проводилось отдельных исследований препарата.
Пациенты с нарушением функции печени
У пациентов с печёночной недостаточностью не проводилось отдельных исследований препарата.
Способ применения
Препарат Стелара, концентрат для приготовления раствора для инфузий, 130 мг, предназначен только для внутривенного инфузионного введения.
Внутривенное инфузионное введение препарата Стелара должно проводиться только квалифицированными медицинскими работниками.
Инструкции по приготовлению раствора, обращению с ним и его утилизации
Приготовление раствора препарата Стелара, концентрат для приготовления раствора для инфузий, 130 мг, должно производиться квалифицированными специалистами с соблюдением требований асептики, следующим образом:
1. Рассчитайте необходимую дозу и требуемое количество флаконов препарата Стелара на основании массы тела пациента (см. Таблицу 1). Каждый флакон препарата Стелара объёмом 26 мл содержит 130 мг устекинумаба.
2. Из инфузионной ёмкости, содержащей 250 мл 0,9 % раствора хлорида натрия, извлеките объём раствора, равный объёму препарата Стелара, который необходимо ввести пациенту (на каждый флакон препарата Стелара необходимо извлечь из инфузионной ёмкости 26 мл раствора хлорида натрия, то есть при необходимости введения двух флаконов требуется извлечь 52 мл, при введении трёх флаконов — 78 мл, при введении четырёх флаконов — 104 мл; извлечённый раствор утилизируется). При необходимости допускается использование инфузионных ёмкостей объёмом 250 мл, содержащих 0,45 % раствор хлорида натрия.
3. Из каждого флакона препарата Стелара извлеките 26 мл концентрата и введите его ёмкость с инфузионным раствором. Итоговый объём получившегося раствора препарата должен быть равен 250 мл. Осторожно перемешайте.
4. Перед введением внимательно осмотрите полученный раствор. При выявлении в растворе видимых непрозрачных частиц, изменении цвета или наличии инородных частиц использовать такой раствор запрещается.
5. Введите полученный раствор препарата пациенту путём внутривенной инфузии длительностью не менее одного часа. Раствор необходимо использовать в течение 8 часов после приготовления.
6. Используйте только инфузионные наборы со встроенным стерильным, апирогенным фильтром с низким связыванием белков (размер пор 0,2 микрометра).
7. Запрещается вводить препарат Стелара одновременно с другими препаратами через одну и ту же инфузионную систему.
8. Каждый флакон препарата Стелара предназначен только для одноразового использования и весь неиспользованный концентрат должен быть утилизирован в соответствии с действующими правилами.
Побочное действие
В этом разделе представлены данные о побочных действиях. Побочные действия — это нежелательные явления, которые были расценены как обоснованно связанные с использованием устекинумаба на основании всесторонней оценки имеющихся данных о нежелательных явлениях.
В отдельных случаях не представляется возможным достоверно установить наличие причинной связи между нежелательным явлением и применением устекинумаба. Кроме того, поскольку клинические исследования проводятся в разных условиях, невозможно провести непосредственное сравнение частоты нежелательных реакций, наблюдаемых в клиническом исследовании препарата, с частотой, наблюдаемой в клинических исследованиях другого препарата, и частота нежелательного явления, наблюдаемая в клиническом исследовании, может не соответствовать частоте, наблюдаемой в клинической практике.
Опыт применения в клинических исследованиях у взрослых пациентов
Данные по безопасности, представленные далее, отражают применение препарата Стелара в 12 исследованиях 11 фазы и III фазы.
Наиболее частыми (>5 %) побочными действиями, наблюдавшимися в контролируемых периодах клинических исследований препарата Стелара, были назофарингит и головная боль. Большинство случаев были расценены как лёгкие и не требующие прекращения терапии.
В Таблице 2 представлен обзор побочных действий, зарегистрированных в клинических исследованиях. Расчёт частоты этих побочных действий проводился на основании случаев, зарегистрированных во время начальных контролируемых периодов клинических исследований.
Побочные действия расположены в порядке уменьшения частоты, в соответствии со следующими категориями:
Очень часто (≥1/10)
Часто (≥1/100, <1/10)
Нечасто (≥1/1000, <1/100)
Редко (≥1/10000, <1/1000)
|
Таблица 2: Обзор побочных действий, зарегистрированных в клинических исследованиях |
|
|
Инфекции и инвазии |
Часто: инфекции верхних дыхательных путей, назофарингит, синусит |
|
Нечасто: воспаление подкожной жировой клетчатки, одонтогенные инфекции, опоясывающий лишай, вирусные инфекции верхних дыхательных путей, вульвовагинальные грибковые инфекции |
|
|
Нарушения со стороны психики |
Нечасто: депрессия |
|
Нарушения со стороны нервной системы |
Часто: головокружение, головная боль |
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
Часто: орофарингеальная боль |
|
Нечасто: заложенность носа |
|
|
Нарушения со стороны желудочно-кишечного тракта |
Часто: диарея, тошнота, рвота |
|
Нарушения со стороны кожи и подкожной клетчатки |
Часто: зуд |
|
Нечасто: акне |
|
|
Нарушения со стороны опорно-двигательного аппарата и соединительной ткани |
Часто: боль в спине, миалгия, артралгия |
|
Общие нарушения и реакции в месте введения препарата |
Часто: усталость, эритема в месте введения, боль в месте введения |
|
Нечасто: реакции в месте введения (в том числе, кровотечение, гематома, уплотнение, припухлость и зуд), астения |
Инфекции
В плацебо-контролируемых исследованиях частота инфекций или серьёзных инфекций была сравнима у пациентов, получавших препарат Стелара, и у пациентов, получавших плацебо. В плацебо-контролируемых периодах клинических исследований частота инфекций составляла 1,38 и 1,35 на пациенто-год наблюдения в группах, получавших препарат Стелара, и плацебо соответственно.
В ходе контролируемых и неконтролируемых периодов клинических исследований, что составляет 10953 пациенто-лет терапии у 5884 пациентов, получавших препарат Стелара, частота инфекций составляла 0,91 на пациенто-год наблюдения. Частота серьёзных инфекций у пациентов, получавших препарат Стелара, составляла 0,02 на пациенто-год наблюдения.
В клинических исследованиях у пациентов с латентным туберкулёзом, одновременно получавших изониазид, не отмечалось случаев развития туберкулёза.
Злокачественные новообразования
В ходе плацебо-контролируемых периодов клинических исследований частота возникновения злокачественных новообразований, без учёта случаев немеланомного рака кожи, у пациентов, получавших препарат Стелара, составляла 0,12 на 100 пациенто-лет наблюдения и 0,26 на 100 пациенто-лет наблюдения у пациентов, получавших плацебо.
Частота возникновения немеланомного рака кожи у пациентов, получавших препарат Стелара. составляла 0,48 на 100 пациенто-лет наблюдения и 0,52 на 100 пациенто-лет наблюдения у пациентов, получавших плацебо, в ходе контролируемых и неконтролируемых периодов клинических исследований, что составляет 10935 пациенто-лет терапии у 5884 пациентов. Злокачественные новообразования, кроме случаев немеланомного рака кожи, были зарегистрированы с частотой 0,53 на 100 пациенто-лет наблюдения у пациентов, получавших препарат Стелара. Частота случаев возникновения немеланомного рака кожи у пациентов, получавших препарат Стелара, составила 0,49 на 100 пациенто-лет наблюдения (53 пациента на 10919 пациенто-лет наблюдения).
Частота возникновения злокачественных новообразований у пациентов, получавших препарат Стелара®, была аналогична частоте, ожидаемой в общей популяции (стандартизованное отношение частоты = 0,87 [95 % доверительный интервал: 0,66, 1,14], с учётом поправок на возраст, пол и расовую принадлежность)1.
Соотношение пациентов с базальноклеточным и плоскоклеточным типами рака (4:1) соответствовало соотношению, ожидаемому в общей популяции.
1 — Ваза данных программы наблюдения, эпидемиологии и отслеживания исходов (SEER) (wwvv.seer.cancer.gov) SEER*Stat Database: Incidence — SEER 6.6.2 Regs Research Data подача — ноябрь 2009 (1973-2007) — в связи с характеристиками страны — США в целом, 1969-2007 Округи, Национальный институт онкологии, DCCPS, исследовательская программа наблюдения, группа наблюдательных систем, выпущено в апреле 2010, на основании подачи в ноябре 2009 года.
Реакции гиперчувствительности и инфузионные реакции
Подкожное введение
Во время контролируемых периодов клинических исследований препарата Стелара сыпь и крапивница наблюдались менее чем у 1 % пациентов каждая.
Внутривенное введение
В исследованиях индуцирующей терапии при болезни Крона не было зарегистрировано случаев развития анафилактических или других серьёзных инфузионных реакций. В этих исследованиях побочные действия, развивавшиеся во время инфузии или в течение часа после инфузии, были зарегистрированы у 2,4 % из 466 пациентов, получавших плацебо, и у 2,6 % из 470 пациентов, получавших препарат Стелара в рекомендованной дозе.
Иммуногенность
В клинических исследованиях у пациентов с болезнью Крона образование антител к устекинумабу было выявлено менее чем у 3 % пациентов, получавших препарат Стелара. Не наблюдалось очевидной взаимосвязи между образованием антител к устекинумабу и развитием реакций в месте введения препарата. У пациентов с положительными результатами тестов на антитела к устекинумабу отмечалась тенденция к более низкой эффективности, тем не менее, наличие антител не препятствовало развитию клинического ответа. У большинства пациентов с положительными результатами тестов на антитела присутствовали также и нейтрализующие их антитела.
Опыт пострегистрационного применения
Побочные действия в Таблице 3 расположены в порядке уменьшения частоты* с использованием следующих категорий:
Очень часто: ≥1/10
Часто: ≥1/100 и <1/10
Нечасто: ≥1/1000 и <1/100
Редко: ≥1/10000 и <1/1000
Очень редко: <1/10000, в том числе отдельные
|
Таблица 3: Пострегистрационные сообщения |
|
|
Нарушения со стороны иммунной системы |
Нечасто: реакции гиперчувствительности (в том числе сыпь, крапивница) |
|
Редко: серьёзные реакции гиперчувствительности (в том числе анафилаксия и ангионевротический отёк) |
|
|
Инфекции и инвазии |
Нечасто: инфекции нижних отделовдыхательных путей |
|
Нарушения со стороны кожи и подкожной клетчатки |
Нечасто: пустулёзный псориаз |
|
Редко: эритродермический псориаз |
* Расчёт частоты побочных действий, зарегистрированных при пострегистрационном периоде наблюдения, проводился на основании 11-ти плацебо-контролируемых клинических исследований, в случае, если такое побочное действие наблюдалось в этих исследованиях. В противном случае, считалось, что частота ниже определённого значения, учитывая объём применения в 11-ти клинических исследованиях, в которых это побочное действие не наблюдалось.
Передозировка
При однократных внутривенных введениях доз до 6 мг/кг в рамках клинических исследований не отмечалось токсичности, ограничивающей дозу. В случае передозировки рекомендуется наблюдать пациента на предмет любых признаков и проявлений нежелательных реакций с целью немедленного начала соответствующей симптоматической терапии.
Взаимодействие с другими лекарственными средствами
Исследования лекарственных взаимодействий с препаратом Стеларау человека не проводились. Эффекты ИЛ-12 или ИЛ-23 на регуляцию изоферментов CYP450 оценивались in vitro с использованием гепатоцитов человека. В исследовании было показано, что ИЛ-12 и/или ИЛ-23 в концентрации 10 нг/мл не влияют на активность изоферментов CYP450 человека (CYP1А2, 2В6, 2С9, 2С19, 2D6 или 3А4). Полученные результаты не предполагают необходимости коррекции дозы у пациентов, принимающих одновременно с препаратом Стелара препараты, метаболизируемые изоферментами CYP450.
Живые вакцины не следует вводить одновременно с применением препарата Стелара.
Особые указания
Инфекции
Препарат Стелара является селективным иммунодепрессантом, и потенциально может увеличивать риск возникновения инфекций и реактивации латентных инфекций.
В ходе клинических исследований у пациентов, получавших препарат Стелара, наблюдались случаи возникновения серьёзных бактериальных и вирусных инфекций.
Препарат Стелара не следует применять у пациентов с клинически значимой активной инфекцией. Следует с осторожностью применять препарат Стелара у пациентов с хронической инфекцией или рецидивирующей инфекцией в анамнезе.
Перед началом терапии препаратом Стелара следует обследовать пациентов на наличие туберкулёза. Препарат Стелара не следует применять у пациентов с активным туберкулёзом. Перед применением препарата Стелара следует провести терапию латентного туберкулёза. Кроме того, противотуберкулёзную терапию перед началом применения препарата Стелара следует провести пациентам с латентным или активным туберкулёзом в анамнезе, для которых отсутствует подтверждение проведения эффективного курса лечения. У пациентов, получающих препарат Стелара, во время и после терапии следует внимательно контролировать признаки или симптомы активного туберкулёза.
Пациентов следует проинструктировать о необходимости обращения за медицинской помощью в случае появления признаков или симптомов, указывающих на развитие инфекции. В случае, если у пациента развивается серьёзная инфекция, необходимо проводить тщательное наблюдение пациента и не применять препарат Стелара до разрешения инфекционного процесса.
Злокачественные новообразования
Препарат Стелара является селективным иммунодепрессантом. Препараты-иммунодепрессанты могут способствовать увеличению риска развития злокачественных новообразований. У некоторых пациентов, получавших препарат Стелара в рамках клинических исследований, наблюдалось развитие кожных и некожных злокачественных новообразований.
Применение препарата Стелара не изучалось у пациентов со злокачественными новообразованиями в анамнезе. Следует проявлять осторожность при назначении препарата Стелара пациентам со злокачественными новообразованиями в анамнезе, а также при рассмотрении возможности продолжения терапии препаратом Стелара у пациентов с диагностированными злокачественными новообразованиями.
У всех пациентов, особенно у пациентов в возрасте старше 60 лет и у пациентов, ранее получавших длительную терапию иммунодепрессантами или ПУВА-терапию, необходимо проводить обследование на наличие немеланомного рака кожи.
Реакции гиперчувствительности
В ходе пострегистрационного наблюдения были зарегистрированы серьёзные реакции гиперчувствительности, включая анафилаксию и ангионевротический отёк. В случае развития анафилактических или других серьёзных реакций гиперчувствительности следует начать соответствующую терапию и прекратить применение препарата Стелара.
Вакцинация
Не рекомендуется применять живые вирусные или живые бактериальные вакцины одновременно с препаратом Стелара.
Данные о вторичном инфицировании при применении живых вакцин у пациентов, получающих препарат Стелара, отсутствуют.
Следует соблюдать осторожность при применении живых вакцин для иммунизации членов семьи пациента, получающего лечение препаратом Стелара. поскольку имеется риск вирусо- или бактериовыделения и передачи инфекции от этих лиц пациентам.
Пациентам, получающим препарат Стелара, можно одновременно вводить инактивированные или неживые вакцины.
Длительное лечение препаратом Стелара не подавляет гуморальный иммунный ответ на вакцины, содержащие пневмококковый полисахарид и противостолбнячную вакцину.
Иммуносупрессия
В исследованиях у пациентов с болезнью Крона совместное применение препарата Стелара с иммуномодуляторами (6-меркаптопурином, азатиоприном, метотрексатом) или с кортикостероидами не влияло на безопасность и эффективность препарата Стелара. Следует проявлять осторожность при рассмотрении возможности одновременного применения иммунодепрессантов и устекинумаба, а также при переходе с терапии другими биологическими препаратами на терапию устекинумабом.
Иммунотерапия
Безопасность и эффективность применения препарата Стелара у пациентов, прошедших иммунотерапию аллергических заболеваний, не установлена. Препарат Стелара может оказывать влияние на иммунотерапию аллергических заболеваний. Следует соблюдать осторожностью при применении устекинумаба у пациентов, получающих или ранее получавших иммунотерапию аллергических заболеваний, особенно если такая терапия связана с анафилаксией.
Влияние на способность управлять транспортными средствами, механизмами
Исследований не проводилось.
Форма выпуска
Концентрат для приготовления раствора для инфузий, 5 мг/мл.
По 26 мл концентрата во флаконе из стекла I типа, укупоренном пробкой из бутилового каучука и алюминиевым колпачком с защитным диском из пластмассы.
По 1 флакону вместе с инструкцией по применению в пачке картонной.
Хранение
При температуре от 2 до 8 °С, в защищённом от света месте.
Не замораживать. Не встряхивать. После приготовления раствор можно хранить при комнатной температуре не более 4 ч.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности.
Условия отпуска из аптек
Отпускают по рецепту.