Стиварга® (Stivarga®)
💊 Состав препарата Стиварга®
✅ Применение препарата Стиварга®
Описание активных компонентов препарата
Стиварга®
(Stivarga®)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2020.03.03
Владелец регистрационного удостоверения:
Код ATX:
L01EX05
(Регорафениб)
Лекарственная форма
| Стиварга® |
Таб., покр. пленочной оболочкой, 40 мг: 84 шт. рег. №: ЛП-(000334)-(РГ-RU) Предыдущий рег. №: ЛП-003405 |
Форма выпуска, упаковка и состав
препарата Стиварга®
Таблетки, покрытые пленочной оболочкой светло-розового цвета, овальные, на одной стороне методом выдавливания нанесено «40», на другой стороне — «BAYER».
Вспомогательные вещества: целлюлоза микрокристаллическая, кроскармеллоза натрия, магния стеарат, повидон-25, кремния диоксид коллоидный.
Состав пленочной оболочки: опадрай II™ 85G35294 розовый: железа оксид красный (E172), железа оксид желтый (E172), лецитин (соевый), макрогол/PEG 3350, поливиниловый спирт (частично гидролизованный), тальк, титана диоксид (E171).
28 шт. — флаконы (3) с влагопоглотителем — пачки картонные.
Фармакологическое действие
Противоопухолевое средство. Регорафениб является ингибитором многочисленных протеинкиназ, включая киназы, участвующие в ангиогенезе опухоли (VEGFRl,-2,-3, TIE2), онкогенезе (KIT, RET, RAF-1, BRAF, BRAFv600E), метастазировании (VEGFR3, PDGFR, FGFR), а также в противоопухолевом иммунном ответе (CSF1R). В частности, регорафениб ингибирует мутантную киназу KIT, ключевой онкогенный фактор в развитии стромальных опухолей ЖКТ. Благодаря этому регорафениб блокирует пролиферацию опухолевых клеток. В доклинических исследованиях было показано, что регорафениб оказывает выраженное противоопухолевое действие на широком спектре опухолевых моделей, включая колоректальный рак, гастроинтестинальные стромальные опухоли и печеночно-клеточный рак. Эффект регорафениба возможно связан с его антиангиогенным и антипролиферативным воздействием. Кроме того, регорафениб снижает уровень макрофагов, ассоциированных с опухолью, и показывает антиметастатическое действие in vivo.Основные метаболиты препарата в организме человека (М-2 и М-5) по своей эффективности на моделях in vitro и in vivo сопоставимы с регорафенибом.
Фармакокинетика
После приема внутрь средняя относительная биодоступность регорафениба составляет 69-83%.
Среднее значение Cmax в плазме крови составляет около 2.5 мг/л приблизительно через 3-4 ч после однократной пероральной дозы регорафениба 160 мг. Наибольшая концентрация регорафениба и его основных фармакологически активных метаболитов М-2 (N-оксид) и М-5 (N-оксид и N-дезметил) достигается после приема завтрака с низким содержанием жиров по сравнению с приемом после завтрака с высоким содержанием жиров или приемом натощак. По сравнению с приемом натощак экспозиция регорафениба увеличивается на 48% при приеме после завтрака с высоким содержанием жиров и на 36% при приеме после завтрака с низким содержанием жиров. По сравнению с приемом натощак, экспозиция метаболитов М-2 и М-5 выше при приеме регорафениба после завтрака с низким содержанием жиров и ниже при приеме после завтрака с высоким содержанием жира.
Кривая зависимости «концентрация-время» демонстрирует несколько пиков как для регорафениба, так и для его основных циркулирующих метаболитов, в течение 24 ч после приема дозы, что связано с печеночно-кишечной рециркуляцией. Связывание регорафениба с белками плазмы крови in vitro высокая и составляет 99.5%.
Метаболизм регорафениба осуществляется главным образом в печени путем окисления, опосредованного изоферментом CYP3A4, а также путем глюкуронирования, опосредованного UGT1A9. В плазме выявляются 2 основных и 6 второстепенных метаболитов регорафениба. Основные циркулирующие в плазме крови метаболиты регорафениба М-2 (N-оксид) и М-5 (N-оксид и N-дезметил) обладают фармакологической активностью и в равновесном состоянии имеют концентрации, сходные с концентрацией регорафениба.
In vitro связывание М-2 и М-5 с белками крови выше, чем у регорафениба и составляет 99.8% и 99.95 соответственно. Метаболиты могут быть восстановлены и гидролизированы микрофлорой ЖКТ, при этом возможно повторное всасывание неконъюгированного активного вещества и его метаболитов (печеночно-кишечная рециркуляция).
T1/2 регорафениба и его метаболита М-2 из плазмы составляет от 20 до 30 ч после приема внутрь. Средний T1/2 метаболита М-5 составляет около 60 ч (40-100 ч).
Приблизительно 90% дозы регорафениба, меченого радиоактивным изотопом, выводится в течение 12 сут после его приема, при этом 71% выводится через кишечник (47% в виде неизмененного вещества и 24% в виде метаболитов) и около 19% — почками в виде глюкуронидов. В равновесном состоянии выведение глюкуронидов почками уменьшается и составляет меньше 10%. Исходное соединение, обнаруженное в каловых массах, может быть продуктом желудочно-кишечного расщепления глюкуронидов, или продуктом восстановления метаболита М-2 (N-оксида), или остатком неабсорбированного препарата.
Системное воздействие регорафениба при равновесной концентрации возрастает пропорционально дозе при дозе до 60 мг и менее пропорционально при дозах более 60 мг. Накопление активного вещества при равновесной концентрации приблизительно в 2 раза превышает концентрацию в плазме, которая соответствует T1/2 и частоте приема лекарственного средства.
Поскольку печень имеет большое значение в выведении регорафениба, у пациентов с тяжелыми нарушениями функции печени возможно усиление его действия.
У пациентов с легкой, средней или тяжелой степенью почечной недостаточности экспозиция регорафениба и его метаболитов М-2 и М-5 в равновесном состоянии являлась такой же, как у пациентов с нормальной функцией почек. У пациентов с тяжелой степенью почечной недостаточности экспозиция регорафениба в равновесном состоянии была такой же, как и у пациентов с нормальной функцией почек, в то время как экспозиция М-2 и М-5 уменьшалась приблизительно на 30%. У пациентов с терминальной степенью почечной недостаточности фармакокинетика регорафениба не изучена.
Показания активных веществ препарата
Стиварга®
Метастатический колоректальный рак у пациентов, которым уже проводилась или не показана химиотерапия фторпиримидиновыми препаратами, терапия, направленная против сосудистого эндотелиального фактора роста (VEGF), и терапия, направленная против рецепторов эпидермального фактора роста (EGFR).
Неоперабельные или метастатические гастроинтестинальные стромальные опухоли у пациентов при прогрессировании на терапии иматинибом и сунитинибом или при непереносимости данного вида лечения.
Печеночно-клеточный рак у пациентов, которым уже проводилась терапия сорафенибом.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Для приема внутрь.
Рекомендуемая доза составляет 160 мг 1 раз/сут в течение 3 недель. В последующую неделю (4-я неделя от начала лечения) следует перерыв. Один курс лечения — это период 4 недели от начала приема.
Лечение продолжают до тех пор, пока сохраняется клиническая эффективность или до появления неприемлемого токсического действия.
Индивидуальная переносимость и безопасность лечения может потребовать временного прекращения терапии и/или уменьшения дозы.
Побочное действие
Со стороны системы кроветворения: очень часто — тромбоцитопения, анемия; часто — лейкопения.
Со стороны иммунной системы: нечасто — реакции повышенной чувствительности.
Со стороны сердечно-сосудистой системы: очень часто — кровотечения, повышение АД; нечасто — инфаркт миокарда, ишемия миокарда, гипертонический криз.
Со стороны дыхательной системы: очень часто — дисфония.
Со стороны кожи и подкожных тканей: очень часто — ладонно-подошвенная эритродизестезия, кожная сыпь; часто — алопеция, сухость кожи, эксфолиативный дерматит; нечасто — поражение ногтей, многоформная эритема; редко — синдром Стивенса-Джонсона, токсический эпидермальный некролиз.
Со стороны пищеварительной системы: очень часто — диарея, стоматит, рвота, тошнота; часто — нарушение вкуса, сухость слизистой оболочки полости рта, гастроэзофагеальный рефлюкс, гастроэнтерит; нечасто — прободение ЖКТ, свищ ЖКТ, панкреатит.
Со стороны печени и желчевыводящих путей: очень часто — гипербилирубинемия, повышение активности трансаминаз; нечасто — тяжелое нарушение функции печени.
Со стороны нервной системы: часто — головная боль, тремор; редко — синдром задней обратимой энцефалопатии.
Со стороны костно-мышечной системы: часто — мышечные спазмы.
Со стороны мочевыделительной системы: часто — протеинурия.
Со стороны эндокринной системы: часто — гипотиреоз.
Со стороны обмена веществ: очень часто — снижение аппетита и потребления пищи, снижение массы тела; часто — гипокалиемия, гипофосфатемия, гипокальциемия, гипонатриемия, гипомагниемия, гиперурикемия, дегидратация.
Лабораторные данные: часто — увеличение активности амилазы и липазы, отклонение от нормального значения МНО.
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): редко — кератоакантома/плоскоклеточный рак кожи.
Инфекционные и паразитарные заболевания: часто — инфекции мочевыводящих путей, назофарингит, кандидоз кожи и слизистых, системный микоз, пневмония.
Общие реакции: очень часто — астения/общая слабость, боль различной локализации, повышение температуры тела, воспаление слизистых оболочек.
Противопоказания к применению
Тяжелая степень печеночной недостаточности (класс С по классификации Чайлд-Пью); терминальная степень почечной недостаточности; совместное применение с сильными ингибиторами и индукторами CYP3A4; возраст до 18 лет; беременность и период лактации (грудного вскармливания); повышенная чувствительность к регорафенибу.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период лактации (грудного вскармливания).
Применение при нарушениях функции печени
Противопоказано применение при тяжелая степени печеночной недостаточности (класс С по классификации Чайлд-Пью).
Применение при нарушениях функции почек
Противопоказано применение при терминальной степени почечной недостаточности.
Применение у детей
Препарат противопоказан для применения у детей и подростков в возрасте до 18 лет
Особые указания
С осторожностью применять при нарушениях функции печени легкой и средней степени тяжести; при наличии факторов риска кровотечения, а также при совместном применении с антикоагулянтами и другими препаратами, повышающими риск кровотечений; при ИБС.
До начала лечения регорафенибом рекомендуется определить показатели функции печени (ACT, АЛТ, билирубин). На протяжении первых двух месяцев терапии следует проводить контроль функции печени по меньшей мере каждые 2 недели, затем не реже 1 раза в месяц, а также согласно клиническим показателям.
Поскольку регорафениб является ингибитором UGT1A1, у пациентов с синдромом Жильбера возможно появление слабовыраженной непрямой (неконъюгированной) гипербилирубинемии.
Если у пациентов, получающих лечение регорафенибом, отмечается ухудшение показателей функции печени, связанное с терапией (в отсутствие явной альтернативной причины, например, механической желтухи или прогрессирования основного заболевания), врачу следует изменить дозу регорафениба и наблюдать за состоянием пациента.
При применении у пациентов с легким и умеренным нарушением функции печени следует проводить тщательный контроль за состоянием пациента. Противопоказано применение у пациентов с тяжелым нарушением функции печени (класс С по классификации Чайлд-Пью), поскольку регорафениб не изучен у данной категории пациентов (возможно увеличение экспозиции).
В случаях ухудшения состояния на фоне прогрессирования инфекции следует рассмотреть вопрос о приостановке лечения регорафенибом.
При наличии факторов риска кровотечения, а также при совместном назначении с антикоагулянтами (например, варфарин, фенпрокумон) или другими лекарственными препаратами, повышающими риск кровотечения, следует контролировать показатели коагулограммы и общего анализа крови. Перед началом лечения регорафенибом у пациентов с циррозом печени следует проводить обследование и последующее лечение варикозно расширенных вен пищевода в соответствии со стандартным подходом. При появлении тяжелого кровотечения, требующего экстренного медицинского вмешательства, следует рассмотреть вопрос о прекращении лечения регорафенибом.
В случае прободения ЖКТ или образования свища терапию регорафенибом следует прекратить.
У пациентов с ИБС необходимо отслеживать клинические признаки и симптомы ишемии миокарда. При возникновении ишемии и/или инфаркта миокарда следует прекратить терапию регорафенибом до нормализации состояния. При принятии решения о возобновлении терапии врач должен оценивать соотношение пользы от приема регорафениба с потенциальным риском у каждого отдельного пациента. Если клинические проявления ишемии сохраняются, возобновлять терапию не следует.
В случае развития обратимой задней энцефалопатии следует прекратить лечение регорафенибом, проводить контроль АД и поддерживающую терапию.
Перед началом и во время лечения регорафенибом следует регулярно контролировать АД и корректировать его повышение в соответствии с принятыми стандартами лечения. В случаях развития тяжелой или стойкой артериальной гипертензии, устойчивой к проводимой адекватной антигипертензивной терапии, врач должен временно прервать терапию и/или снизить дозу регорафениба. В случае развития гипертонического криза лечение регорафенибом следует отменить.
В случае проведения обширных хирургических вмешательств рекомендуется временное прекращение терапии регорафенибом, поскольку лекарственные препараты, обладающие антиангиогенными свойствами, могут подавлять или ухудшать заживление ран. Решение о возобновлении терапии после хирургических вмешательств должно основываться на клинической оценке адекватности заживления раны.
С целью профилактики развития ладонно-подошвенной эритродизестезии следует контролировать образование мозолей и использовать специальные вкладыши для обуви и перчатки для предотвращения давления на подошвы и ладони. Для лечения ладонно-подошвенной эритродизестезии можно использовать кератолитические кремы (например, кремы на основе мочевины, салициловой кислоты или альфа-гидроксильной кислоты, которые следует наносить только на пораженные участки кожи) и увлажняющие кремы в обильном количестве для облегчения симптомов. При необходимости временно прекращают лечение и/или снижают дозу регорафениба или в тяжелых или повторяющихся случаях кожных реакций терапию регорафенибом прекращают.
Следует контролировать биохимические и метаболических показатели. При необходимости назначают заместительную терапию в соответствии с принятыми стандартами лечения. В случаях устойчивых или рецидивирующих нарушений следует рассмотреть возможность временного прекращения лечения, снижения дозы или полного прекращения терапии регорафенибом.
Влияние на способность к управлению транспортными средствами и механизмами
При возникновении нежелательных явлений, которые могут влиять на указанные способности, рекомендуется избегать управления транспортными средствами и занятий другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций (до исчезновения данных симптомов).
Лекарственное взаимодействие
Применение кетоконазола (400 мг в течение 18 дней), сильного ингибитора изофермента CYP3A4, в сочетании с однократным приемом регорафениба (160 мг на пятый день) приводило к увеличению среднего воздействия (AUC) регорафениба приблизительно на 33% и снижению среднего воздействия его активных метаболитов, М-2 (N-оксид) и М-5 (N-оксид и N-дезметил) приблизительно на 90%. Не рекомендуется применять регорафениб совместно с сильными ингибиторами CYP3A4 (например, кларитромицин, грейпфрутовый сок, итраконазол, кетоконазол, позаконазол, телитромицин и вориконазол), поскольку их влияние на воздействие регорафениба в стабильном состоянии и его метаболитов (М-2 и М-5) не изучалось.
Применение рифампина (600 мг в течение 9 дней), сильного индуктора CYP3A4, в сочетании с однократным приемом регорафениба (160 мг на седьмой день) приводило к снижению среднего воздействия (AUC) регорафениба приблизительно на 50%, увеличению среднего воздействия активного метаболита М-5 в 3-4 раза, при этом не отмечалось изменения экспозиции активного метаболита М-2. Другие сильные ингибиторы CYP3A4 (например, фенитоин, карбамазепин, фенобарбитал и препараты, содержащие зверобой продырявленный) могут увеличивать метаболизм регорафениба. Не рекомендуется применять регорафениб совместно с сильными индукторами CYP3A4 или подбирать лекарственные средства, которые не влияют на CYP3A4 или индуцируют его в минимальной степени.
In vitro было показано, что регорафениб, также как и его активный метаболит М-2, подавляет глюкуронизацию под действием UGT1A1 и UGT1А9, в то время как метаболит М-5 подавляет UGT1A1 только в концентрациях, которые достигаются в равновесном состоянии in vivo.
Применение регорафениба с последующим 5-дневным перерывом перед назначением иринотекана приводило к увеличению среднего воздействия (AUC) SN-38 , субстрата UGT1А1 и активного метаболита иринотекана приблизительно на 44%. Также отмечалось увеличение среднего воздействия (AUC) иринотекана приблизительно на 28%. Эти данные показывают, что комбинированное применение регорафениба может увеличивать системную экспозицию субстратов UGT1A1 и UGT1A9.
Применение регорафениба (160 мг в течение 14 дней) перед однократным приемом розувастатина (5 мг), который является субстратом BCRP, приводило к увеличению среднего воздействия (AUC) розувастатина в 3.8 раз и к увеличению его средней Cmax в плазме крови в 4.6 раза. Комбинированное применение с регорафенибом может повышать концентрацию в плазме других субстратов BCRP (например, метотрексат, флувастатин, аторвастатин). Рекомендуется контролировать состояние пациентов с целью выявления признаков и симптомов увеличения экспозиции к субстратам BCRP.
Исследования in vitro показывают, что метаболиты регорафениба М-2 и М-5 являются субстратами Р-гликопротеина и BCRP. Ингибиторы и стимуляторы BCRPи Р-гликопротеина могут препятствовать экспозиции М-2 и М-5. Клиническая значимость данных результатов исследований неизвестна.
In vitro было показано, что регорафениб является конкурентным ингибитором цитохромов CYP2C8, CYP2C9, CYP2B6 в концентрациях, которые достигаются in vivo в стабильном состоянии (Cmax в плазме 8.1 мкмоль). In vitro ингибирующее действие в отношении CYP3A4 и CYP2C19 менее выражено.
Комбинированное применение регорафениба с неомицином не оказывает влияние на экспозицию регорафениба, но может нарушить его печеночно-кишечную циркуляцию. Тем не менее при сравнении фармакологической активности регорафениба in vivo и in vitro было показано уменьшение экспозиции его активных метаболитов М-2 и М-5 приблизительно на 80%. Клиническая значимость взаимодействия с неомицином не известна, но оно может являться причиной снижения эффективности регорафениба.
Комплексообразующие соединения солей желчных кислот, такие как колестирамин и холестагель, могут взаимодействовать с регорафенибом, образуя нерастворимые комплексы, которые оказывают влияние на абсорбцию (или реабсорбцию), что потенциально может привести к снижению экспозиции. Клиническое значение данных потенциальных взаимодействий неизвестно, но может привести к снижению эффективности регорафениба.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Общий профиль безопасности препарата Стиварга® оценивается на данных клинических исследований с участием более 1200 пациентов, получавших терапию в плацебо-контролируемых клинических исследованиях III фазы. Данная группа включала 500 пациентов с метастатическим колоректальным раком и 132 пациента с гастроинтестинальными стромальными опухолями.
В клинических исследованиях наиболее частыми нежелательными реакциями (≥30% пациентов) были астения/усталость, ладонно-подошвенная эритродизестезия, диарея, снижение аппетита и потребления пищи, повышение АД, дисфония, инфекции.
Наиболее серьезными нежелательными реакциями при приеме препарата Стиварга® были поражения печени, кровотечения, прободение ЖКТ.
Перечисленные ниже нежелательные явления, отмеченные при применении препарата Стиварга® в ходе клинических исследований, распределены по частоте возникновения в соответствии со следующей градацией: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000).
Для классификации и описания конкретной реакции, ее синонимов и связанных с ней состояний, используется наиболее подходящий термин из MedDRA.
В каждой частотной группе нежелательные явления представлены в порядке уменьшения их значимости.
Со стороны крови и лимфатической системы: очень часто — тромбоцитопения, анемия; часто — лейкопения.
Со стороны сердца и сосудов: очень часто — кровотечения1, повышение АД; нечасто — инфаркт миокарда, ишемия миокарда, гипертонический криз.
Со стороны дыхательной системы, органов грудной клетки и средостения: очень часто — дисфония.
Со стороны кожи и подкожных тканей: очень часто — ладонно-подошвенная эритродизестезия, кожная сыпь, алопеция; часто — сухость кожи, эксфолиативный дерматит; нечасто — поражение ногтей, мультиформная эритема; редко — синдром Стивенса-Джонсона, токсический эпидермальный некролиз.
Со стороны ЖКТ: очень часто — диарея, стоматит, рвота, тошнота; часто — нарушение вкуса, сухость слизистой оболочки полости рта, гастроэзофагеальный рефлюкс, гастроэнтерит; нечасто — прободение ЖКТ1, свищ ЖКТ.
Со стороны печени и желчевыводяших путей: очень часто — гипербилирубииемия; часто — повышение активности трансаминаз; нечасто — тяжелое нарушение функции печени1,2.
Со стороны нервной системы: очень часто — головная боль; часто — тремор; редко — синдром задней обратимой энцефалопатии.
Со стороны скелетно-мышечной и соединительной ткани: часто — мышечно-скелетная ригидность.
Со стороны почек и мочевыводящих путей: часто — протеинурия.
Со стороны эндокринной системы: часто — гипотиреоз.
Со стороны обмена веществ и питания: очень часто — снижение аппетита и потребления пищи; часто — гипокалиемия, гипофосфатемия, гипокальциемия, гипонатриемия, гипомагниемия, гиперурикемия.
Лабораторные и инструментальные данные: очень часто — снижение массы тела; часто — увеличение активности амилазы и липазы, отклонение от нормального значения MHO.
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): редко — кератоакантома/плоскоклеточный рак кожи.
Инфекционные и паразитарные заболевания: очень часто — инфекции.
Общие расстройства и нарушения в месте введения: очень часто — астения/общая слабость, боль различной локализации, повышение температуры тела, воспаление слизистых оболочек.
1 Сообщалось о летальном исходе в результате неблагоприятной реакции.
2 В соответствии с критериями Международной рабочей группы экспертов по лекарственному поражению печени.
Поражения печени. Тяжелое лекарственное поражение печени со смертельным исходом наблюдалось у трех пациентов из более чем 1200 пациентов, принимавших участие во всех клинических исследованиях и получавших терапию препаратом Стиварга® (0,25%). У двоих из данных пациентов отмечались метастазы в печени. Дисфункция печени у данных пациентов началась в течение первых двух месяцев терапии и характеризовалась повреждением гепатоцитов с повышением активности трансаминаз >20×ВГН, сопровождаемым увеличением концентрации билирубина. В результате биопсии печени у двух пациентов был обнаружен некроз клеток печени с воспалительным инфильтратом.
Кровотечения. В двух плацебо-контролируемых исследованиях III фазы общая частота кровотечений у пациентов, получавших препарат Стиварга®, составила 19,3%. Большинство случаев кровотечения имели легкую или умеренную степень тяжести (1-я и 2-я степень: 16,9%). Наиболее часто отмечалось носовое кровотечение (7,6%).
Летальные исходы у пациентов, получавших препарат Стиварга®, отмечались редко (0,6%) и чаще были связаны с поражением дыхательной, пищеварительной и мочеполовой систем.
Инфекции. В двух плацебо-контролируемых исследованиях III фазы инфекционные заболевания чаще отмечались у пациентов, получавших лечение препаратом Стиварга®, по сравнению с пациентами, получавшими плацебо (все степени: 31% по сравнению с 14,4%). Чаще инфекции у пациентов, получавших препарат Стиварга®, имели легкую или умеренную степень выраженности (1-я и 2-я степень: 22,9%) и включали инфекции мочевыводящих путей (6,8%), назофарингит (4,2%), а также кандидоз кожи и слизистых и системный микоз (2,4%). Не наблюдались различия по частоте летальных исходов в связи с развитием инфекции у пациентов, получавших препарат Стиварга® (0,6%) и у пациентов, получавших плацебо (0,6%).
Ладонно-подошвенная эритродизестезия. В плацебо-контролируемом исследовании III фазы общая частота возникновения ладонно-подошвенной эритродизестезии у пациентов с метастатическим колоректальным раком, принимавших препарат Стиварга®, составила 45,2% и у пациентов, получающих плацебо — 7,1%. В плацебо-контролируемом исследовании III фазы у пациентов с гастроинтестинальными стромальными опухолями общая частота возникновения ладонно-подошвенной эритродизестезии составила 66,7% — у пациентов, получавших терапию препаратом Стиварга®, и 15,2% — у пациентов, получавших плацебо. В обоих исследованиях большинство случаев ладонно-подошвенной эритродизестезии у пациентов, получавших препарат Стиварга® отмечалось во время первого цикла лечения и имело легкую или среднюю степень тяжести (1-я и 2-я степени: 28,6% у пациентов — с метастатическим колоректальным раком и 44,7 % — у пациентов с гастроинтестинальными стромальными опухолями). Частота возникновения ладонно-подошвенной эритродизестезии 3-й степени составила 16,6% у пациентов с метастатическим колоректальным раком и 22% у пациентов с гастроинтестинальными стромальными опухолями.
Повышение АД. В плацебо-контролируемом исследовании III фазы у пациентов с метастатическим колоректальным раком общая частота случаев повышения АД составила 30,4% у пациентов, принимавших препарат Стиварга®, и 7,9% у пациентов, принимавших плацебо. В плацебо-контролируемом исследовании Ш фазы у пациентов с гастроинтестинальными стромальными опухолями общая частота случаев повышения АД составила 59,1% — у пациентов, получавших препарат Стиварга®, и 27,3% — у пациентов, получавших плацебо. В обоих исследованиях большинство случаев повышения АД у пациентов, получавших препарат Стиварга®, было зарегистрировано в течение первого цикла лечения. При этом случаи повышения АД имели легкую и умеренную степень тяжести (1-я и 2-я степень: 22,8% — у пациентов с метастатическим колоректальным раком и 31,1% — у пациентов с гастроинтестинальными стромальными опухолями). Частота случаев повышения АД 2-й степени составила 7,6% (у пациентов с колоректальным раком) и 27,3% (у пациентов с гастроинтестинальными стромальными опухолями). Был зарегистрирован один случай повышения АД 4-й степени у пациента с гастроинтестинальной стромальной опухолью.
Протеинурия. В плацебо-контролируемом исследовании III фазы среди пациентов с метастатическим колоректальным раком частота случаев протеинурии, связанной с лечением, составила 7,4% у пациентов, получавших терапию препаратом Стиварга®, в сравнении с 2,4% у пациентов, принимавших плацебо. После развития протеинурии у 40,5% пациентов из группы препарата Стиварга® и 66,7% пациентов из группы плацебо состояние не вернулось к исходным значением. В плацебо-контролируемом исследовании III фазы среди пациентов с гастроинтестинальными стромальными опухолями общая частота случаев протеинурии составила 6,8% у пациентов, получающих терапию препаратом Стиварга®, в сравнении с 1,5% у пациентов, принимавших плацебо.
Со стороны сердца и сосудов. Во всех проводимых клинических исследованиях нежелательные явления в виде нарушений со стороны сердца (все степени) чаще регистрировались (20,5 относительно 10,4%) у пациентов, получавших терапию препаратом Стиварга®, в возрасте 75 лет или старше (N=78), чем у пациентов, получавших терапию препаратом Стиварга®, в возрасте до 75 лет (N=995).
Лабораторные и инструментальные данные. В двух плацебо-контролируемых исследованиях III фазы у 26,1% пациентов, получавших терапию препаратом Стиварга®, и у 15,1% пациентов, получавших плацебо, концентрация ТТГ была выше ВГН. Значения ТТГ в 4 раза превышающие ВГН были зарегистрированы у 6,9% пациентов, получавших терапию препаратом Стиварга®, и у 0,7% пациентов, принимавших плацебо. Концентрация свободного трийодтиронина (Т3 свободный) меньше нижней границы нормы отмечалась у 25,6% пациентов, получающих терапию Стиварга®, и у 20,9% пациентов, получающих плацебо. Концентрация свободного тироксина (Т4 свободный) меньше нижней границы нормы отмечалась у 8% пациентов в группе терапии препаратом Стиварга® и у 6,6% пациентов из группы плацебо. В целом, приблизительно у 7% пациентов, получающих терапию препаратом Стиварга®, развился гипотиреоз, требующий применения заместительной гормонотерапии.
Стиварга — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер: ЛП-003405
Торговое наименование препарата: Стиварга®/Stivarga®
Международное непатентованное наименование: Регорафениб/ Regorafenib
Лекарственная форма: таблетки, покрытые пленочной оболочкой
Состав:
Одна таблетка, покрытая пленочной оболочкой, содержит:
Действующее вещество: регорафениб — 40,00 мг.
Вспомогательные вещества: целлюлоза микрокристаллическая — 100,00 мг, кроскармеллоза натрия — 154,00 мг, магния стеарат — 3,60 мг, повидон-25 — 160,00 мг, кремния диоксид коллоидный — 2,40 мг.
Пленочная оболочка: опадрай II™ 85G35294 розовый (железа оксид красный Е172 — 0,0648 мг, железа оксид желтый Е172 — 0,0732 мг, лецитин — 0,42 мг, макрогол/PEG 3350 — 1,482 мг, поливиниловый спирт, частично гидролизованный — 5,28 мг, тальк — 2,40 мг, титана диоксид Е171- 2,28 мг) — 12,00 мг.
Описание
Овальные таблетки, покрытые пленочной оболочкой, светло-розового цвета, на одной стороне методом выдавливания нанесено «40», на другой стороне — «BAYER».
Фармакотерапевтическая группа
Противоопухолевый препарат, ингибитор протеинкиназы.
Код АТХ: L01XE21
Фармакологические свойства
Фармакодинамика
Механизм действия
Регорафениб является ингибитором многочисленных протеинкиназ, включая киназы, участвующие в ангиогенезе опухоли (VEGFR1,-2,-3, TIE2), онкогенезе (KIT, RET, RAF-1, BRAF, BRAFv600E), а также входящие в состав микроокружения опухоли (PDGFR, FGFR). В частности, регорафениб ингибирует мутантную киназу KIT, ключевой онкогенный фактор в развитии стромальных опухолей желудочно-кишечного тракта. Благодаря этому регорафениб блокирует пролиферацию опухолевых клеток. В доклинических исследованиях было показано, что регорафениб оказывает выраженное противоопухолевое действие на широком спектре опухолевых моделей, включая колоректальный рак и гастроинтестинальные стромальные опухоли. Эффект препарата связан с его антиангиогенным и антипролиферативным воздействием. Кроме того, регорафениб показывает антиметастатическое действие in vivo. Основные метаболиты препарата в организме человека (М-2 и М-5) по своей эффективности на моделях in vitro и in vivo сопоставимы с регорафенибом.
Фармакокинетика
Всасывание
После приема таблеток регорафениба его средняя относительная биодоступность по сравнению с раствором для приема внутрь составляет 69-83 %.
Среднее значение пикового уровня регорафениба в плазме крови (Cmax) составляет около 2,5 мг/л приблизительно через 3-4 часа после однократной пероральной дозы регорафениба 160 мг (4 таблетки по 40 мг).
Наибольшая концентрация регорафениба и его основных фармакологически активных метаболитов М-2 (N-оксид) и М-5 (N-оксид и N-дезметил) достигается после приема завтрака с низким содержанием жиров по сравнению с приемом после завтрака с высоким содержанием жиров или приемом натощак. По сравнению с приемом натощак экспозиция регорафениба увеличивается на 48 % при приеме после завтрака с высоким содержанием жиров и на 36 % при приеме после завтрака с низким содержанием жиров. По сравнению с приемом натощак, экспозиция метаболитов М-2 и М-5 выше при приеме регорафениба после завтрака с низким содержанием жиров и ниже при приеме после завтрака с высоким содержанием жира.
Распределение
Кривая зависимости «концентрация-время» демонстрирует несколько пиков как для регорафениба, так и для его основных циркулирующих метаболитов, в течение 24 часов после приема дозы, что связано с печеночно-кишечной рециркуляцией препарата. Связь регорафениба с белками плазмы крови in vitro высокая и составляет 99,5 %.
Метаболизм
Метаболизм регорафениба осуществляется, главным образом, в печени путем окисления, опосредованного изоферментом CYP3A4, а также путем глюкуронирования, опосредованного UGT1A9. В плазме выявляются два основных и шесть второстепенных метаболитов регорафениба. Основные циркулирующие в плазме крови метаболиты регорафениба М-2 (N-оксид) и M-5 (N-оксид и N-дезметил) обладают фармакологической активностью и в равновесном состоянии имеют концентрации, сходные с концентрацией регорафениба.
In vitro связь М-2 и М-5 с белками крови выше, чем у регорафениба и составляет 99,8 % и 99,95 % соответственно.
Метаболиты могут быть восстановлены и гидролизированы микрофлорой желудочнокишечного тракта, при этом возможно повторное всасывание неконъюгированного препарата и его метаболитов (печеночно-кишечная рециркуляция).
Выведение
Период полувыведения регорафениба и его метаболита М-2 из плазмы составляет от 20 до 30 часов после приема внутрь. Средний период полувыведения метаболита М-5 составляет около 60 часов (40 — 100 часов).
Приблизительно 90 % дозы препарата, меченого радиоактивным изотопом, выводится в течение 12 дней после его приема, при этом 71 % выводится через кишечник (47 % в виде исходного соединения и 24 % в виде метаболитов) и около 19 % — почками в виде глюкуронидов. В равновесном состоянии выведение глюкуронидов почками уменьшается и составляет меньше 10 %. Исходное соединение, обнаруженное в каловых массах, может быть продуктом желудочно-кишечного расщепления глюкуронидов, или продуктом восстановления метаболита М-2 (N-оксида), или остатком неабсорбированного препарата.
Линейность/нелинейность
Системное воздействие регорафениба при равновесной концентрации возрастает пропорционально дозе при дозе до 60 мг и менее пропорционально при дозах более 60 мг. Накопление препарата при равновесной концентрации приблизительно в два раза превышает концентрацию в плазме, которая соответствует периоду полувыведения и частоте приема лекарственного средства.
После перорального приема регорафениба в дозе 160 мг его средняя максимальная концентрация в плазме крови (Cmax) в равновесном состоянии достигает 3,9 мг/л (8,1 мкмоль). Соотношение максимальной и минимальной концентрации регорафениба в плазме крови составляет менее 2.
Для обоих метаболитов М-2 и М-5 свойственно нелинейное накопление в плазме крови. После однократного приема регорафениба концентрации метаболитов М-2 и М-5 намного ниже, чем у исходного соединения. В равновесном состоянии концентрации М-2 и М-5 сопоставимы с концентрацией регорафениба.
Фармакокинетика у различных групп пациентов
Пациенты с нарушением функции печени
У пациентов с легкой (класс А по классификации Чайлд-Пью) или умеренной (класс В по классификации Чайлд-Пью) степенью печеночной недостаточности, фармакокинетические параметры регорафениба были такими же, как у пациентов с нормальной печеночной функцией. У пациентов с тяжелой степенью печеночной недостаточности (класс С по классификации Чайлд-Пью) фармакокинетика регорафениба не изучена. Поскольку печень имеет большое значение в выведении регорафениба, у пациентов с тяжелым нарушением функции печени возможно усиление действия препарата (см. раздел «Особые указания»).
Пациенты с нарушением функции почек
У пациентов с легкой и средней степенью почечной недостаточности экспозиция регорафениба и его метаболитов М-2 и М-5 в равновесном состоянии является такой же, как у пациентов с нормальной функцией почек. У пациентов с тяжелой степенью почечной недостаточности или терминальной степенью почечной недостаточности фармакокинетика регорафениба не изучена.
Пациенты пожилого возраста
Влияние возраста на фармакокинетику регорафениба у пациентов от 29 до 85 лет не обнаружено.
Пол
Не выявлено различий в фармакокинетике регорафениба в зависимости от пола.
Этническая принадлежность
Не выявлено различий в фармакокинетических параметрах регорафениба в зависимости от принадлежности к этнической группе.
Электрофизиология сердца/удлинение QТ
У пациентов с онкологическими заболеваниями не было выявлено удлинение интервала QТ в равновесном состоянии при приеме регорафениба в дозе 160 мг.
Показания к применению
Противопоказания
С осторожностью
Необходимо соблюдать дополнительную осторожность при назначении препарата в следующих ситуациях:
Применение при беременности и в период грудного вскармливания
Фертильность
Не проводилось специальных исследований применения регорафениба для оценки его влияния на фертильность человека.
В исследованиях на животных наблюдалось снижение мужской и женской фертильности. Женщин репродуктивного возраста необходимо проинформировать об опасности препарата Стиварга® для плода. Во время лечения и в течение 8 недель после терапии препаратом Стиварга® женщины и мужчины репродуктивного возраста должны применять надежные методы контрацепции.
Беременность
Данные о применении препарата Стиварга® у беременных женщин отсутствуют.
Учитывая механизм действия регорафениба, возможно негативное влияние препарата Стиварга® на плод. Исследования на животных продемонстрировали репродуктивную токсичность регорафениба.
Период грудного вскармливания
Не установлено, выделяются ли регорафениб и его метаболиты с женским молоком.
Исследования на животных показали, что регорафениб и его метаболиты выделяются с грудным молоком.
Поскольку нельзя исключить возможность негативного влияния регорафениба на рост и развитие детей раннего возраста, следует прекратить грудное вскармливание в период лечения препаратом Стиварга®.
Способ применения и дозы
Для приема внутрь.
Препарат Стиварга® должен назначаться только врачом, имеющим опыт противоопухолевой терапии.
Рекомендуемая суточная доза препарата Стиварга® составляет 160 мг (4 таблетки по 40 мг). Препарат назначается один раз в сутки в течение 3 недель. В последующую неделю (4-я неделя от начала лечения) следует перерыв в приеме препарата. Период продолжительностью 4 недели от начала приема является одним курсом лечения препаратом Стиварга®.
Таблетки принимают каждый день (один раз в сутки) в одно и то же время после приема пищи, содержащей низкое (< 30 %) количество жира (см. раздел «Фармакокинетика»). Таблетки следует проглатывать целиком, запивая водой.
Если очередной прием препарата пропущен, пациент должен принять таблетку в тот же день, как только об этом вспомнит. Не следует принимать двойную дозу препарата в течение одного дня с целью компенсировать пропущенный прием.
В случае рвоты после приема препарата Стиварга® дополнительную таблетку принимать не следует.
Лечение продолжают до тех пор, пока сохраняется клиническая эффективность препарата или до появления его неприемлемого токсического действия (см. раздел «Особые указания»).
Коррекция дозы
Индивидуальная переносимость и безопасность лечения может потребовать временного прекращения терапии и/или уменьшения дозы препарата Стиварга®.
Коррекция дозы на каждом этапе снижения дозы составляет 40 мг (1 таблетка). Наименьшая рекомендуемая доза препарата Стиварга® составляет 80 мг в сутки. Максимальная суточная доза 160 мг.
Таблица 1.
Рекомендации по коррекции дозы препарата Стиварга® при развитии ладонно-подошвенной эритродизестезии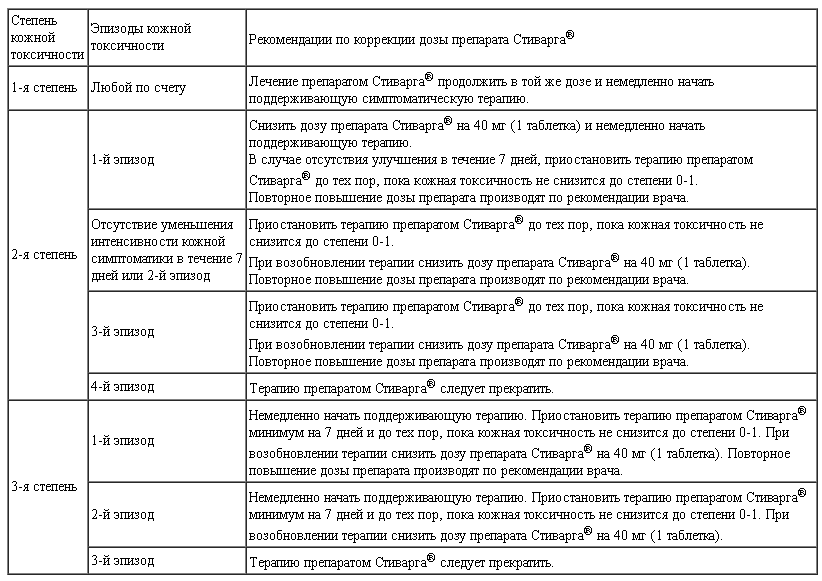
Таблица 2.
Рекомендации по коррекции дозы препарата Стиварга® при ухудшении биохимических показателей функции печени (см. раздел «Особые указания»)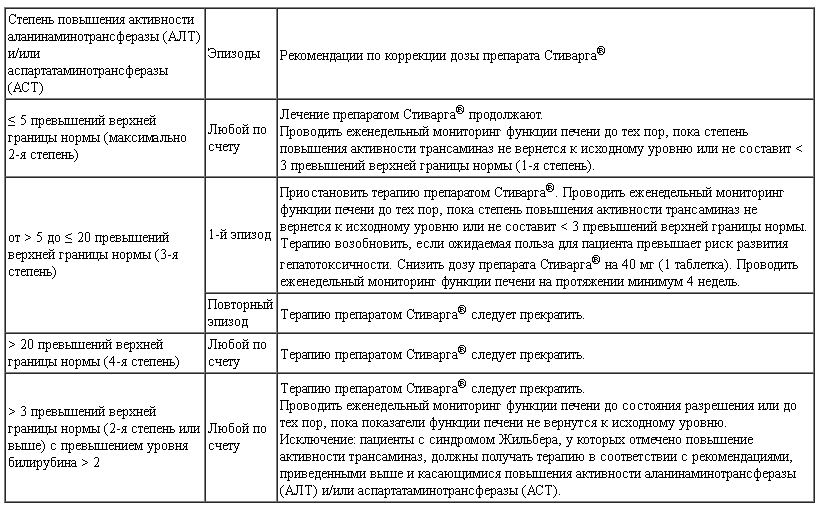
Особые группы пациентов
Пациенты с нарушением функции печени
Печень имеет большое значение в выведении регорафениба. Не было выявлено клинически значимых различий в воздействии препарата Стиварга® у пациентов со средним (класс А по классификации Чайлд-Пью) и умеренным (класс В по классификации Чайлд-Пью) нарушением функции печени в сравнении с пациентами с нормальной функцией печени. Пациентам со средним и умеренным нарушением функции печени коррекция дозы не требуется. Рекомендуется проводить мониторинг функции печени на фоне терапии препаратом Стиварга® у данной категории пациентов (см. разделы «Фармакокинетика», «Особые указания»). Не рекомендуется лечение препаратом Стиварга® пациентов с тяжелым нарушением функции печени (класс С по классификации Чайлд-Пью), поскольку применение препарата у данной категории пациентов не изучено.
Пациенты с нарушением функции почек
В клинических исследованиях не отмечалось значимых различий безопасности и эффективности препарата Стиварга® у пациентов с легкой степенью почечной недостаточности (рСКФ 60-89 мл/мин/1,73 м2) в сравнении с пациентами с нормальной функцией почек. Ограниченные данные по фармакокинетике не выявили различий в экспозиции у пациентов со средней степенью почечной недостаточности (рСКФ 30-59 мл/мин/1,73 м2). Пациентам с легкой и средней степенью почечной недостаточности снижение дозы препарата не требуется (см. раздел «Фармакокинетика»). Применение препарата Стиварга® у пациентов с тяжелой степенью почечной недостаточности (рСКФ < 30 мл/мин/1,73 м2) не изучено.
Дети
Безопасность и эффективность назначения препарата Стиварга® у детей и подростков до 18 лет не установлена.
Пациенты пожилого возраста
В клинических исследованиях не отмечалось значимых различий безопасности и эффективности препарата Стиварга® у пожилых (65 лет и старше) пациентов в сравнении с более молодыми пациентами. Пациентам пожилого возраста коррекция дозы не требуется (см. раздел «Фармакокинетика»).
Пол
В клинических исследованиях не отмечалось значимых различий безопасности и эффективности препарата Стиварга® между пациентами мужского и женского пола. Коррекция дозы препарата в зависимости от пола пациента не требуется (см. раздел «Фармакокинетика»).
Этническая принадлежность
В клинических исследованиях не отмечалось значимых различий безопасности и эффективности препарата Стиварга® у пациентов разных этнических групп. Корректировка дозы препарата в зависимости от этнической принадлежности пациента не требуется (см. раздел «Фармакокинетика»).
Побочное действие
Общий профиль безопасности препарата Стиварга® оценивается на данных клинических исследований с участием более 1200 пациентов, получавших терапию в плацебо-контролируемых клинических исследованиях III фазы. Данная группа включала 500 пациентов с метастатическим колоректальным раком и 132 пациента с гастроинтестинальными стромальными опухолями.
Данный профиль безопасности регорафениба был подтвержден и в клиническом исследовании III В фазы с участием 2872 пациентов с метастатическим колоректальным раком при прогрессировании на стандартной терапии.
В клинических исследованиях наиболее частыми нежелательными реакциями (≥ 30% пациентов) были астения/усталость, ладонно-подошвенная эритродизестезия, диарея, снижение аппетита и потребления пищи, повышение артериального давления, дисфония, инфекции.
Наиболее серьезными нежелательными реакциями при приеме препарата Стиварга® были поражения печени, кровотечения, прободение желудочно-кишечного тракта.
Перечисленные ниже нежелательные явления, отмеченные при применении препарата Стиварга® в ходе клинических исследований, распределены по частоте возникновения в соответствии со следующей градацией: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥ 1/1000 до <1/100), редко (от ≥ 1/10000 до <1/1000). Для классификации и описания конкретной реакции, ее синонимов и связанных с ней состояний, используется наиболее подходящий термин из Медицинского словаря для регуляторной деятельности (MedDRA).
В каждой частотной группе нежелательные явления представлены в порядке уменьшения их значимости.
Нарушения со стороны крови и лимфатической системы
Очень часто: тромбоцитопения, анемия.
Часто: лейкопения.
Нарушения со стороны сердца и сосудов
Очень часто: кровотечения*, повышение артериального давления.
Нечасто: инфаркт миокарда, ишемия миокарда, гипертонический криз.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Очень часто: дисфония.
Нарушения со стороны кожи и подкожных тканей
Очень часто: ладонно-подошвенная эритродизестезия, кожная сыпь, алопеция.
Часто: сухость кожи, эксфолиативный дерматит.
Нечасто: поражение ногтей, мультиформная эритема.
Редко: синдром Стивенса-Джонсона, токсический эпидермальный некролиз.
Нарушения со стороны желудочно-кишечного тракта
Очень часто: диарея, стоматит, рвота, тошнота.
Часто: нарушение вкуса, сухость слизистой оболочки полости рта, гастроэзофагеальный рефлюкс, гастроэнтерит.
Нечасто: прободение желудочно-кишечного тракта*, свищ желудочно-кишечного тракта.
Нарушения со стороны печени и желчевыводящих путей
Очень часто: гипербилирубинемия.
Часто: повышение активности трансаминаз.
Нечасто: тяжелое нарушение функции печени*#.
Нарушения со стороны нервной системы
Очень часто: головная боль.
Часто: тремор.
Редко: синдром задней обратимой энцефалопатии.
Нарушения со стороны скелетно-мышечной и соединительной ткани
Часто: мышечно-скелетная ригидность.
Нарушения со стороны почек и мочевыводящих путей
Часто: протеинурия.
Нарушения со стороны эндокринной системы
Часто: гипотиреоз.
Нарушения со стороны обмена веществ и питания
Очень часто: снижение аппетита и потребления пищи.
Часто: гипокалиемия, гипофосфатемия, гипокальциемия, гипонатриемия, гипомагниемия, гиперурикемия.
Лабораторные и инструментальные данные
Очень часто: снижение массы тела.
Часто: увеличение активности амилазы и липазы, отклонение от нормального значения международного нормализованного отношения (МНО).
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы)
Редко: кератоакантома/ плоскоклеточный рак кожи.
Инфекционные и паразитарные заболевания
Очень часто: инфекции.
Общие расстройства и нарушения в месте введения
Очень часто: астения/общая слабость, боль различной локализации, повышение температуры тела, воспаление слизистых оболочек.
* сообщалось о летальном исходе в результате неблагоприятной реакции;
# в соответствии с критериями Международной рабочей группы экспертов по лекарственному поражению печени.
Поражения печени
В большинстве случаев тяжелого поражения печени дисфункция печени начиналась в течение первых двух месяцев терапии и характеризовалась повреждением гепатоцитов с повышением активности трансаминаз > 20 х ВГН (верхняя граница нормы), сопровождаемым увеличением концентрации билирубина. В клинических исследованиях тяжелые поражения печени со смертельным исходом чаще наблюдались у пациентов японской национальности, получавших препарат Стиварга® (около 1,5 %), в сравнении с пациентами не японской национальности (<0,1 %).
Кровотечения
В двух плацебо-контролируемых исследованиях III фазы общая частота кровотечений у пациентов, получавших препарат Стиварга®, составила 19,3 %. Большинство случаев кровотечения имели легкую или умеренную степень тяжести (1-я и 2-я степень: 16,9 %). Наиболее часто отмечалось носовое кровотечение (7,6 %). Летальные исходы у пациентов, получавших препарат Стиварга®, отмечались редко (0,6 %) и чаще были связаны с поражением дыхательной, пищеварительной и мочеполовой систем.
Инфекции
В двух плацебо-контролируемых исследованиях III фазы инфекционные заболевания чаще отмечались у пациентов, получавших лечение препаратом Стиварга®, по сравнению с пациентами, получавшими плацебо (все степени: 31,0 % по сравнению с 14,4 %). Чаще инфекции у пациентов, получавших препарат Стиварга®, имели легкую или умеренную степень выраженности (1-я и 2-я степень: 22,9 %) и включали инфекции мочевыводящих путей (6,8 %), назофарингит (4,2 %), а также кандидоз кожи и слизистых и системный микоз (2,4 %). Не наблюдалось различий по частоте летальных исходов в связи с развитием инфекции у пациентов, получавших препарат Стиварга® (0,6 %) и у пациентов, получавших плацебо (0,6 %).
Ладонно-подошвенная эритродизестезия
В плацебо-контролируемом исследовании III фазы общая частота возникновения ладонноподошвенной эритродизестезии у пациентов с метастатическим колоректальным раком, принимавших препарат Стиварга®, составила 45,2 % и у пациентов, получающих плацебо — 7,1 %. В плацебо-контролируемом исследовании III фазы у пациентов с гастроинтестинальными стромальными опухолями общая частота возникновения ладонно-подошвенной эритродизестезии составила 66,7 % у пациентов, получавших терапию препаратом Стиварга®, и 15,2 % у пациентов, получавших плацебо. В обоих исследованиях большинство случаев ладонно-подошвенной эритродизестезии у пациентов, получавших препарат Стиварга®, отмечалось во время первого цикла лечения и имело легкую или среднюю степень тяжести (1-я и 2-я степени: 28,6 % у пациентов с метастатическим колоректальным раком и 44,7 % у пациентов с гастроинтестинальными стромальными опухолями). Частота возникновения ладонно-подошвенной эритродизестезии 3-й степени составила 16,6 % у пациентов с метастатическим колоректальным раком и 22,0 % у пациентов с гастроинтестинальными стромальными опухолями.
Повышение артериального давления
В плацебо-контролируемом исследовании III фазы у пациентов с метастатическим колоректальным раком общая частота случаев повышения артериального давления составила 30,4 % у пациентов, принимавших препарат Стиварга®, и 7,9 % у пациентов, принимавших плацебо. В плацебо-контролируемом исследовании III фазы у пациентов с гастроинтестинальными стромальными опухолями общая частота случаев повышения артериального давления составила 59,1 % у пациентов, получавших препарат Стиварга®, и 27,3 % у пациентов, получавших плацебо. В обоих исследованиях большинство случаев повышения артериального давления у пациентов, получавших препарат Стиварга®, было зарегистрировано в течение первого цикла лечения. При этом случаи повышения артериального давления имели легкую и умеренную степень тяжести (1-я и 2-я степень: 22,8 % у пациентов с метастатическим колоректальным раком и 31,1 % у пациентов с гастроинтестинальными стромальными опухолями). Частота случаев повышения артериального давления 2-й степени составила 7,6 % (у пациентов с колоректальным раком) и 27,3 % (у пациентов с гастроинтестинальными стромальными опухолями). Был зарегистрирован один случай повышения артериального давления 4-й степени у пациента с гастроинтестинальной стромальной опухолью.
Протеинурия
В плацебо-контролируемом исследовании III фазы среди пациентов с метастатическим колоректальным раком частота случаев протеинурии, связанной с лечением, составила 7.4 % у пациентов, получавших терапию препаратом Стиварга®, в сравнении с 2,4 % у пациентов, принимавших плацебо. После развития протеинурии у 40,5 % пациентов из группы препарата Стиварга® и 66,7 % пациентов из группы плацебо состояние не вернулось к исходным значением. В плацебо-контролируемом исследовании III фазы среди пациентов с гастроинтестинальными стромальными опухолями общая частота случаев протеинурии составила 6,8 % у пациентов, получающих терапию препаратом Стиварга®, в сравнении с 1,5% у пациентов, принимавших плацебо.
Нарушения со стороны сердца и сосудов
Во всех проводимых клинических исследованиях нежелательные явления в виде нарушений со стороны сердца (все степени) чаще регистрировались (20,5 % относительно 10.4 %) у пациентов, получавших терапию препаратом Стиварга®, в возрасте 75 лет или старше (N=78), чем у пациентов, получавших терапию препаратом Стиварга®, в возрасте до 75 лет (N=995).
Лабораторные и инструментальные данные
В двух плацебо-контролируемых исследованиях III фазы у 26,1 % пациентов, получавших терапию препаратом Стиварга®, и у 15,1 % пациентов, получавших плацебо, концентрация тиреотропного гормона (ТТГ) была выше верхней границы нормы. Значения ТТГ в 4 раза превышающие верхнюю границу нормы были зарегистрированы у 6,9 % пациентов, получавших терапию препаратом Стиварга®, и у 0,7 % пациентов, принимавших плацебо. Концентрация свободного трийодтиронина (Т3 свободный) меньше нижней границы нормы отмечалась у 25,6 % пациентов, получающих терапию Стиварга®, и у 20,9 % пациентов, получающих плацебо. Концентрация свободного тироксина (Т4 свободный) меньше нижней границы нормы отмечалась у 8,0 % пациентов в группе терапии препаратом Стиварга® и у 6,6 % пациентов из группы плацебо. В целом, приблизительно у 7 % пациентов, получающих терапию препаратом Стиварга®, развился гипотиреоз, требующий применения заместительной гормонотерапии.
Передозировка
Симптомы
В клинических исследованиях максимальная суточная доза препарата Стиварга® составляла 220 мг. Наиболее частыми нежелательными реакциями при данной дозе препарата были нежелательные реакции со стороны кожи, дисфония, диарея, воспаление слизистых оболочек, сухость слизистой оболочки полости рта, снижение аппетита, повышение артериального давления, общая слабость.
Лечение
Специфический антидот не известен.
В случае передозировки прием препарата Стиварга® следует прекратить и применять стандартную симптоматическую терапию. Пациент должен находиться под наблюдением врача до стабилизации состояния.
Взаимодействие с другими лекарственными препаратами и другие формы взаимодействия
Фармакокинетические взаимодействия
Индукторы CYP3A4/ингибиторы CYP3A4 и UGT1A9
In vitro было показано, что регорафениб метаболизируется цитохромом CYP3A4 и уридинфосфатглюкуронилтрансферазой UGT1A9.
Применение кетоконазола (400 мг в течение 18 дней), сильного ингибитора изофермента CYP3A4, в сочетании с однократным приемом регорафениба (160 мг на пятый день) приводило к увеличению среднего воздействия (AUC) регорафениба приблизительно на 33% и снижению среднего воздействия его активных метаболитов, М-2 (N-оксид) и M-5 (N-оксид и N-дезметил) приблизительно на 90 %. Не рекомендуется применять препарат Стиварга® совместно с сильными ингибиторами CYP3A4 (например, кларитромицин, грейпфрутовый сок, итраконазол, кетоконазол, позаконазол, телитромицин и вориконазол), поскольку их влияние на воздействие регорафениба в стабильном состоянии и его метаболитов (М-2 и М-5) не изучалось.
Не рекомендуется применять сильные ингибиторы UGT1A9 (например, мефенаминовая кислота, дифлунизал и нифлумовая кислота) во время терапии регорафенибом, поскольку их влияние на экспозицию регорафениба и его метаболитов в равновесном состоянии не изучалось.
Применение рифампина (600 мг в течение 9 дней), сильного индуктора CYP3A4, в сочетании с однократным приемом регорафениба (160 мг на седьмой день) приводило к снижению среднего воздействия (AUC) регорафениба приблизительно на 50 %, увеличению среднего воздействия активного метаболита М-5 в 3-4 раза, при этом не отмечалось изменения экспозиции активного метаболита М-2. Другие сильные ингибиторы CYP3A4 (например, фенитоин, карбамазепин, фенобарбитал) могут увеличивать метаболизм регорафениба. Не рекомендуется применять препарат Стиварга® совместно с сильными индукторами CYP3A4 или подбирать лекарственные средства, которые не влияют на CYP3A4 или индуцируют его в минимальной степени.
Субстраты UGT1A1 и UGT1A9
In vitro было показано, что регорафениб, также как и его активный метаболит М-2, подавляет глюкуронизацию под действием UGT1A1 и UGT1A9, в то время как метаболит M-5 подавляет UGT1A1 только в концентрациях, которые достигаются в равновесном состоянии in vivo.
Применение регорафениба с последующим 5-дневным перерывом перед назначением иринотекана приводило к увеличению среднего воздействия (AUC) SN-38, субстрата UGT1A1 и активного метаболита иринотекана приблизительно на 44%. Также отмечалось увеличение среднего воздействия (AUC) иринотекана приблизительно на 28%. Эти данные показывают, что комбинированное применение регорафениба может увеличивать системную экспозицию субстратов UGT1A1 и UGT1A9.
Субстраты белка резистентности рака молочной железы (BCRP) и P-гликопротеина
Применение регорафениба (160 мг в течение 14 дней) перед однократным приемом розувастатина (5 мг), который является субстратом BCRP, приводило к увеличению среднего воздействия (AUC) розувастатина в 3,8 раз и к увеличению его средней максимальной концентрации в плазме крови (Cmax) в 4,6 раза. Комбинированное применение с регорафенибом может повышать концентрацию в плазме других субстратов BCRP (например, метотрексат, флувастатин, аторвастатин). Рекомендуется контролировать состояние пациентов с целью выявления признаков и симптомов увеличения экспозиции к субстратам BCRP.
В клинических исследованиях было показано, что регорафениб не оказывает влияния на фармакокинетические параметры дигоксина, поэтому его можно применять совместно с субтратами Р-гликопротеина, такими как дигоксин. При этом не отмечается клинически значимого взаимодействия между лекарственными препаратами.
Ингибиторы Р-гликопротеина и BCRP/стимуляторы Р-гликопротеина и BCRP
Исследования in vitro показывают, что метаболиты регорафениба М-2 и М-5 являются субстратами Р-гликопротеина и BCRP. Ингибиторы и стимуляторы BCRP и Р-гликопротеина могут препятствовать экспозиции М-2 и М-5. Клиническая значимость данных результатов исследований неизвестна.
Селективные субстраты изоформы CYP
In vitro было показано, что регорафениб является конкурентоспособным ингибитором цитохромов CYP2C8, CYP2C9, CYP2B6 в концентрациях, которые достигаются in vivo в стабильном состоянии (максимальная концентрация в плазме 8,1 мкмоль). In vitro ингибирующее действие в отношении CYP3A4 и CYP2C19 менее выражено.
Было проведено исследование с целью оценки влияния приема регорафениба в дозе 160 мг в течение 14 дней на фармакокинетику маркерных субстратов CYP2C8 (розиглитазон), CYP2C9 (варфарин), CYP2C19 (омепразол) и CYP3A4 (мидазолам).
Фармакокинетические данные показывают, что регорафениб можно применять совместно с субстратами CYP2C8, CYP2C9, CYP3A4 и CYP2C19. При этом не отмечается клинически значимого взаимодействия между лекарственными препаратами.
Антибиотики
Профиль концентрация-время показывает, что регорафениб и его метаболиты могут подвергаться печеночно-кишечной циркуляции (см. раздел «Фармакокинетика»). Комбинированное применение регорафениба с неомицином (слабо абсорбируемый противомикробный препарат, применяемый с целью эрадикации флоры желудочнокишечного тракта) не оказывает влияние на экспозицию регорафениба, но может нарушить его печеночно-кишечную циркуляцию. Тем не менее при сравнении фармакологической активности регорафениба in vivo и in vitro было показано уменьшение экспозиции его активных метаболитов M-2 и M-5 приблизительно на 80 %. Клиническая значимость взаимодействия с неомицином не известна, но оно может являться причиной снижения эффективности регорафениба. Фармакокинетическое взаимодействие регорафениба с другими антибиотиками не изучалось.
Комплексообразующие соединения солей желчных кислот
Существует вероятность, что регорафениб и его метаболиты М-2 и М-5 могут подвергаться печеночно-кишечной циркуляции (см. раздел «Фармакокинетика). Комплексообразующие соединения солей желчных кислот, такие как холестирамин и холестагель могут взаимодействовать с регорафенибом, образуя нерастворимые комплексы, которые оказывают влияние на абсорбцию (или реабсорбцию), что потенциально может привести к снижению экспозиции. Клиническое значение данных потенциальных взаимодействий неизвестно, но может привести к снижению эффективности регорафениба.
Особые указания
Действие на печень
У пациентов, получавших лечение препаратом Стиварга®, часто регистрировались отклонения значений биохимических показателей функции печени (аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ) и билирубин). У небольшой части пациентов отмечались тяжелые нарушения показателей функции печени (3-4 степени тяжести) и клинически выраженные нарушения функции печени (в том числе с летальным исходом) (см. раздел «Побочное действие»).
До начала лечения препаратом Стиварга® рекомендуется определить показатели функции печени (АСТ, АЛТ, билирубин). На протяжении первых двух месяцев терапии следует проводить контроль функции печени по меньшей мере каждые 2 недели, затем не реже 1 раза в месяц, а также согласно клиническим показателям.
Поскольку регорафениб является ингибитором уридиндифосфатглюкуронилтрансферазы (UGT1A1), у пациентов с синдромом Жильбера возможно появление слабовыраженной непрямой (неконъюгированной) гипербилирубинемии (см. раздел «Взаимодействие с другими лекарственными препаратами и другие формы взаимодействия»).
Если у больных, получающих лечение препаратом Стиварга®, отмечается ухудшение показателей функции печени, связанное с терапией (в отсутствие явной альтернативной причины, например, механической желтухи или прогрессирования основного заболевания), врачу следует изменить дозу препарата и наблюдать за состоянием пациента (см. раздел «Способ применения и дозы», таблица 1).
Печень имеет большое значение в выведении регорафениба. При применении препарата Стиварга® у пациентов с легким и умеренным нарушением функции печени следует проводить тщательный контроль за состоянием пациента (см. раздел «Способ применения и дозы»). Не рекомендуется применение препарата Стиварга® у пациентов с тяжелым нарушением функции печени (класс С по классификации Чайлд-Пью), поскольку препарат Стиварга® не изучен у данной категории пациентов (возможно увеличение экспозиции препарата).
Кровотечения
У больных, получавших препарат Стиварга®, было зарегистрировано повышение частоты эпизодов кровотечений, в некоторых случаях с летальным исходом (см. раздел «Побочное действие”). При наличии факторов риска кровотечения, а также при совместном назначении с антикоагулянтами (например, варфарин, фенпрокумон) или другими лекарственными препаратами, повышающими риск кровотечения, следует контролировать показатели коагулограммы и общего анализа крови. При появлении тяжелого кровотечения, требующего экстренного медицинского вмешательства, следует рассмотреть вопрос о прекращении лечения препаратом Стиварга®.
Ишемия миокарда и инфаркт миокарда
При приеме препарата Стиварга® отмечалось увеличение частоты случаев ишемии миокарда и инфаркта миокарда (см. раздел «Побочное действие”).
Пациенты с нестабильной стенокардией или появлением стенокардии (в течение 3 месяцев до начала терапии препаратом Стиварга®), недавним инфарктом миокарда (в период 6 месяцев до начала терапии препаратом Стиварга®) и пациенты с сердечной недостаточностью 2 класса и выше по классификации Нью-Йоркской кардиологической ассоциации были исключены из клинических исследований.
У пациентов с ишемической болезнью сердца необходимо отслеживать клинические признаки и симптомы ишемии миокарда. При возникновении ишемии и/или инфаркта миокарда следует прекратить терапию препаратом Стиварга® до нормализации состояния. При принятии решения о возобновлении терапии врач должен оценивать соотношение пользы от приема препарата с потенциальным риском у каждого отдельного пациента. Если клинические проявления ишемии сохраняются, возобновлять терапию не следует.
Синдром обратимой задней энцефалопатии.
У пациентов, получавших препарат Стиварга®, были зарегистрированы случаи развития обратимой задней энцефалопатии (см. раздел «Побочное действие”). Обратимая задняя энцефалопатия проявлялась в виде судорог, головной боли, изменения сознания, нарушения зрения или корковой слепоты, иногда в сочетании с артериальной гипертензией. Для подтверждения диагноза пациентам следует провести томографию головного мозга. В случае развития обратимой задней энцефалопатии следует прекратить лечение препаратом Стиварга®, проводить контроль артериального давления и поддерживающую терапию.
Прободение и свищ желудочно-кишечного тракта
У пациентов, получавших препарат Стиварга®, были зарегистрированы случаи прободения желудочно-кишечного тракта и образования свища желудочно-кишечного тракта (см. раздел «Побочное действие»). Эти события были связаны с опухолями в брюшной полости. В случае прободения желудочно-кишечного тракта или образования свища терапию препаратом Стиварга® следует прекратить.
Повышение артериального давления
На фоне терапии препаратом Стиварга® было зарегистрировано увеличение частоты повышения артериального давления (см. раздел «Побочное действие»). Перед началом и во время лечения препаратом Стиварга® следует регулярно контролировать артериальное давление и корректировать его повышение в соответствии с принятыми стандартами лечения. В случаях развития тяжелой или стойкой артериальной гипертензии, устойчивой к проводимой адекватной антигипертензивной терапии, врач должен временно прервать терапию и/или снизить дозу препарата (см. раздел «Способ применения и дозы”). В случае развития гипертонического криза лечение препаратом Стиварга® следует отменить.
Нарушения заживления ран
В случае проведения обширных хирургических вмешательств рекомендуется временное прекращение терапии препаратом Стиварга®, поскольку лекарственные препараты, обладающие антиангиогенными свойствами, могут подавлять или ухудшать заживление ран. Решение о возобновлении терапии после хирургических вмешательств должно основываться на клинической оценке адекватности заживления раны.
Кожная токсичность
Наиболее частыми нежелательными реакциями при приеме препарата Стиварга® были ладонно-подошвенная эритродизестезия и сыпь (см. раздел «Побочное действие»). С целью профилактики развития ладонно-подошвенной эритродизестезии следует контролировать образование мозолей и использовать специальные вкладыши для обуви и перчатки для предотвращения давления на подошвы и ладони. Для лечения ладонноподошвенной эритродизестезии можно использовать кератолитические кремы (например, кремы на основе мочевины, салициловой кислоты или альфа-гидроксильной кислоты, которые следует наносить только на пораженные участки кожи) и увлажняющие кремы в обильном количестве для облегчения симптомов. При необходимости временно прекращают лечение и/или снижают дозу препарата Стиварга® или, в тяжелых или повторяющихся случаях кожных реакций, терапию препаратом Стиварга® прекращают (см. раздел «Способ применения и дозы»).
Отклонения значений лабораторных показателей
При применении препарата Стиварга® было зарегистрировано повышение частоты электролитных нарушений (включая гипофосфатемию, гипокальциемию, гипонатриемию и гипокалиемию) и нарушений метаболизма (включая увеличение концентрации тиреотропного гормона, увеличение активности амилазы). Отклонения от нормы обычно носили легкий или умеренный характер и не сопровождались клиническими проявлениями. В случае возникновения электролитных нарушений или нарушений метаболизма коррекция дозы или прекращение терапии не требуется. Во время терапии препаратом Стиварга® рекомендуется контролировать биохимические и метаболические показатели. При необходимости назначают заместительную терапию в соответствии с принятыми стандартами лечения. В случаях устойчивых или рецидивирующих нарушений следует рассмотреть возможность временного прекращения лечения или снижения дозы, или полного прекращения терапии препаратом Стиварга® (см. раздел «Способ применения и дозы»).
Информация о некоторых ингредиентах
Суточная доза регорафениба 160 г содержит 2,427 ммоль (или 55,8 мг) натрия. На это следует обратить внимание пациентов, соблюдающих диету, контролирующую потребление натрия. Суточная доза регорафениба 160 г содержит 1,68 мг лецитина (получен из сои).
Системная токсичность
После повторного введения дозы у мышей, крыс и собак наблюдались нежелательные реакции со стороны ряда органов, прежде всего почек, печени, пищеварительного тракта, щитовидной железы, лимфатической/кроветворной системы, эндокринной системы, репродуктивной системы и кожи. В 26-недельном исследовании токсичности при введении повторных доз у крыс наблюдалось небольшое увеличение частоты случаев утолщения атриовентрикулярных клапанов сердца. Причиной данного явления может служить ускорение возрастного физиологического процесса. Данные реакции наблюдались при системных экспозициях, находящихся в диапазоне или ниже диапазона предполагаемой экспозиции у человека (основано на сравнении AUC).
Изменения зубов и костей, а также нежелательные явления в репродуктивной системе были наиболее выражены у молодых и растущих животных, а также у молодых крыс, что указывает на потенциальный риск для детей и подростков.
Тератогенность и эмбриотоксичность
Специальные исследования влияния регорафениба на фертильность не проводились. Следует учитывать способность регорафениба оказывать неблагоприятное воздействие на репродуктивную систему мужчин и женщин. В исследовании на крысах и собаках после многократного применения регорафениба при экспозициях ниже предполагаемой экспозиции у человека (при сравнении AUС) наблюдались морфологические изменения в яичках, яичниках и матке. Наблюдаемые изменения были обратимы только частично.
В исследовании на кроликах при экспозиции ниже предполагаемой экспозиции у человека наблюдалась эмбриотоксичность (при сравнении AUС). В основном были обнаружены нарушения формирования мочевыделительной системы, сердца и крупных сосудов, костей.
Влияние на способность управлять транспортными средствами, механизмами
Специальные исследования не проводились, однако при возникновении нежелательных явлений, которые могут влиять на указанные способности, рекомендуется избегать управления транспортными средствами и занятий другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций (до исчезновения данных симптомов).
Форма выпуска
Таблетки, покрытые пленочной оболочкой, 40 мг.
По 28 таблеток с влагопоглотителем в непрозрачном флаконе белого цвета из полиэтилена высокой плотности с завинчивающейся крышкой с герметизирующей вставкой и устройством против вскрытия флакона детьми. 1 или 3 флакона с инструкцией по применению в картонной пачке.
Условия хранения
Хранить при температуре не выше 30 °С.
Хранить в оригинальной упаковке.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять после истечения срока годности, указанного на упаковке.
Условия отпуска
Отпускается по рецепту.
Производитель
Байер Фарма АГ, Кайзер-Вильгельм-Аллее, 51368 Леверкузен, Германия
Bayer Pharma AG, Kaiser-Wilhelm-Allee, 51368 Leverkusen, Germany
Наименование и адрес юридического лица, на имя которого выдано регистрационное удостоверение
Байер Фарма АГ, Мюллерштрассе 178, 13353 Берлин, Германия
Bayer Pharma AG, Mullerstrasse 178, 13353 Berlin, Germany
За дополнительной информацией и с претензиями обращаться по адресу:
107113 Москва, 3-я Рыбинская ул., д.18, стр.2
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Противоопухолевые средства. Ингибиторы протеинкиназы. Код АТХ L01XE21.
Фармакологические свойства
Фармакодинамика
Механизм действия и фармакодинамические эффекты
Регорафениб эффективно блокирует разнообразные протеинкиназы, включая киназы, участвующие в ангиогенезе (VEGFR1, -2, -3, TIE2), онкогенезе (KIT, RET, RAF-1, BRAF, BRAFV600E), образовании метастаз (VEGFR3, PDGFR, FGFR) и активности иммунитета против опухолей (CSF1R). В частности, регорафениб ингибирует мутантную киназу KIT, ключевой онкогенный фактор в развитии гастроинтестинальных стромальных опухолей. Благодаря этому регорафениб блокирует пролиферацию опухолевых клеток. В доклинических исследованиях регорафениб продемонстрировал мощную противоопухолевую активность на широком спектре опухолевых моделей, включая модели колоректальных, гастроинтестинальных стромальных и гепатоцеллюлярных опухолей. Эффект лекарственного средства связан с его антиангиогенным и антипролиферативным воздействием. Кроме того, регорафениб уменьшал уровни макрофагов, ассоциированных с опухолью и показал антиметастатическое действие in vivo. Основные метаболиты регорафениба в организме человека (М-2 и М-5) на моделях in vitro и in vivo показывают действие, аналогичное регорафенибу.
Клиническая эффективность и безопасность
Метастатический колоректальный рак
Клиническая эффективность и безопасность лекарственного средства Стиварга® была оценена в международном многоцентровом рандомизированном двойном слепом плацебо — контролируемом исследовании III фазы (CORRECT) у пациентов с метастатическим колоректальным раком, у которых наблюдалось прогрессирование заболевания после стандартной терапии.
Первичной конечной точкой оценки эффективности являлась общая выживаемость (ОВ). Вторичными критериями являлись выживаемость без прогрессирования (ВБП), уровень объективного ответа опухоли и частота контроля заболевания.
Всего было рандомизировано 760 пациентов в соотношении 2:1. Пациенты получали либо регорафениб 160 мг перорально (4 таблетки Стиварга®, содержащие 40 мг регорафениба каждая) один раз в день (N=505) плюс оптимальная поддерживающая терапия (ОПТ) (N=255), либо плацебо плюс ОПТ, в течение 3-х недель и перерывом терапии в одну неделю. Средняя суточная доза регорафениба составила 147 мг.
Лечение продолжалось до прогрессирования заболевания или возникновения клинически неприемлемых признаков токсичности. Предварительно запланированный промежуточный анализ эффективности осуществлялся после регистрации 432 летальных случаев. Исследование было выведено из слепого метода после того, как результаты данного запланированного промежуточного анализа ОВ вышли за пределы предварительно определенных границ эффективности.
Среди 760 пациентов, средний возраст которых составлял 61 год, 61% составляли мужчины, 78% пациентов принадлежали к европеоидной расе, общее состояние всех пациентов в начале исследования оценивали как 0 или 1 по шкале общего состояния (ОС) ECOG. Во время лечения лекарственным средством Стиварга® показатель общего состояния ≥ 2 был отмечен у 11,4% пациентов. Средняя продолжительность лечения и суточная доза, а также частота коррекции дозы и снижения дозы были такими же, как у пациентов ОС ≥ 2 получавших плацебо 18,6%. Большинство пациентов с ОС ≥ 2 прервали лечение в связи с прогрессированием заболевания. Первичной локализацией опухоли являлась толстая кишка (65%), прямая кишка (29%) или обе (6%). На момент включения в исследование мутации KRAS отмечались у 57% пациентов.
Большинство пациентов (52%) получили 3 или меньше предыдущих курсов противоопухолевой терапии при метастазах. Терапия включала в себя химиотерапию на основе фторпиримидинов, лечение ингибиторами фактора роста эндотелия сосудов (VEGF), и при диком типе KRAS терапию ингибиторами рецептора эпидермального фактора роста (EGFR).
Добавление лекарственного средства Стиварга® к ОПТ показало значительное увеличение выживаемости по сравнению с плацебо плюс ОПТ при значении р равном 0,005178 согласно стратифицированному тесту логарифмических рангов, соотношении рисков равном 0,774 (95% CI 0,636; 0,942) и средней ОВ равной 6,4 месяца по сравнению с 5,0 месяцами. ВБП была значительно больше среди пациентов, принимавших лекарственное средство Стиварга® плюс ОПТ (соотношение рисков HR: 0,494, р<0,000001). Частота ответа (полный ответ или частичный ответ) составила 1% и 0,4% для пациентов принимающих лекарственное средство Стиварга® и плацебо соответственно (р=0.188432). Частота контроля заболевания (полный ответ, частичный ответ или стабильное заболевание) была значительно выше для пациентов, принимающих лекарственное средство Стиварга® (41,0% против 14,9%, р<0,000001).
Анализ подгрупп в отношении общей выживаемости и выживаемости без прогрессирования показал эффективность регорафениба по сравнению с плацебо вне зависимости от возраста (< 65; ≥ 65), пола, статуса по шкале ECOG, первичного очага заболевания, времени от установления диагноза до выявления метастазов, предшествующей противоопухолевой терапии, предшествующих линий терапии метастатического рака и мутации в гене KRAS.
Анализ подгрупп в отношении статуса мутаций в гене KRAS в анамнезе пациентов свидетельствует о том, что у пациентов, имеющих опухоли, содержащие ген KRAS дикого типа, регорафениб оказывал положительное влияние на показатели ОВ в отличие от плацебо, в то время как у пациентов, имеющих опухоли с мутациями в гене KRAS, наблюдался низкий эффект в числовом эквиваленте; положительное влияние на ВБП в группе регорафениба отмечалось независимо от статуса мутаций в гене KRAS. Отношение рисков (95% ДИ) к показателям общей выживаемости составило 0,653 (от 0,476 до 0,895) у пациентов с опухолями, содержащими ген KRAS дикого типа и 0,867 (от 0,670 до 1,123) у пациентов, которые имели опухоли с мутациями в гене KRAS, без каких-либо признаков неоднородности терапевтического эффекта (тест на незначимые взаимодействия). Отношение рисков (95% ДИ) к показателям выживаемости без прогрессирования составило 0,475 (0,362-0,623) у пациентов с опухолями, содержащими ген KRAS дикого типа и 0,525 (0,425-0,649) у пациентов с опухолями, имеющими мутации в гене KRAS.
Клиническую эффективность и безопасность применения лекарственного средства Стиварга® оценивали в ходе международного, многоцентрового, рандомизированного, двойного слепого плацебо-контролируемого исследования (CONCUR) III фазы, у 204 пациентов монголоидной расы (> 90% из Восточной Азии), с метастатическим колоректальным раком, предварительно получавших лечение, у которых наблюдалось прогрессирование заболевания после химиотерапии на основе фторпиримидинов. Только 59,5% пациентов, включенных в исследование CONCUR, предварительно получали VEGF и EGFR терапию. Основной конечной точкой эффективности была общая выживаемость (ОВ). Добавление лекарственного средства Стиварга® к ОПТ привело к достоверному повышению выживаемости пациентов по сравнению с комбинацией плацебо и ОПТ, отношение рисков составило 0,550 (р = 0,000159 по стратифицированному тесту логарифмических рангов), а средняя ОВ составляла 8,8 месяца и 6,3 месяца (95 % ДИ 0,395; 0,765).
Показатель ВВП был значительно выше у пациентов, получавших лекарственное средство Стиварга® и ОПТ (отношение рисков: 0,311, р <0,000001), средняя ВВП составила 3,2 месяца с лекарственным средством Стиварга® и 1,9 месяца с плацебо. Профиль безопасности лекарственного средства Стиварга® плюс ОПТ в исследовании CONCUR был сопоставим с профилем безопасности, полученным в исследовании CORRECT.
Метастатические гастроинтестинальные стромальные опухоли (ГИСО)
Клиническая эффективность и безопасность лекарственного средства Стиварга® была оценена в международном многоцентровом рандомизированном двойном слепом плацебо — контролируемом исследовании III фазы при лечении пациентов с гастроинтестинальными стромальными опухолями (ГИСО), ранее получавших терапию двумя ингибиторами тирозинкиназы (иматинибом и сунитинибом).
Анализ основного показателя эффективности — выживаемости без прогрессирования заболевания (ВВП) — проводили после регистрации 144 случаев ВВП. Также оценивали вторичные показатели, в том числе время до возобновления заболевания (ВДВ) и общую выживаемость (ОВ).
Всего было рандомизировано 199 пациентов с ГИСО в соотношении 2:1, принимавших регорафениб в дозе 160 мг плюс ОПТ или плацебо плюс ОПТ (N=66) перорально один раз в день (N=133) в течение 3 недель, с последующим перерывом в приеме продолжительностью в 1 неделю. Средняя суточная принимаемая доза регорафениба составила 140 мг.
Лечение продолжалось до прогрессирования заболевания или появления клинически неприемлемых признаков токсичности. Пациентам, получавшим плацебо, у которых наблюдалось возобновление заболевания, было предложен открытое применение регорафениба (перекрестный вариант). Пациенты, получавшие регорафениб, у которых наблюдалось возобновление заболевания и для кого, по мнению исследователя, терапия регорафенибом приносила клиническую пользу, имели возможность продолжить прием регорафениба в открытом исследовании.
Среди 199 рандомизированных пациентов, средний возраст которых составил 58 лет, 64% составляли мужчины, 68% пациентов составляли представители европеоидной расы, все пациенты имели показатель общего состояния 0 или 1 на исходном уровне по шкале общего состояния (ОС) ECOG. Общее среднее время с момента последнего возобновления заболевания или рецидива до момента рандомизации составило 6 недель.
ВВП была значительно выше среди пациентов, принимавших регорафениб плюс ОПТ, чем плацебо плюс ОПТ с соотношением рисков 0,268 [95% CI 0,185; 0,388] и средней ВВП 4,8 месяцев по сравнению с 0,9 месяцами (р < 0,000001). Относительный риск возобновления заболевания или смерти снизился примерно на 73,2% у пациентов, принимавших регорафениб, по сравнению с пациентами, принимавшими плацебо. Увеличение ВВП носило постоянный характер независимо от возраста, пола, географического региона, ранее проводимого лечения, ОС по шкале ECOG.
ВДВ было значительно продолжительнее у пациентов, получавших регорафениб плюс ОПТ, чем у пациентов, получавших плацебо плюс ОПТ с соотношением рисков равным 0,248 [95% CI 0,170; 0,364], и среднее ВДВ составило 5,4 месяца по сравнению с 0,9 месяцами (р < 0,000001).
Соотношение рисков для ОВ составило 0,772 (95% CI 0,423; 1,408; р = 0,199); 85% пациентов, изначально рандомизированных в группу плацебо, после возобновления заболевания получали лечение регорафенибом.
Кроме того, 56 пациентов, получавших плацебо плюс ОПТ, в рамках открытого исследования, после перекреста принимали лекарственное средство Стиварга® вследствие возобновления заболевания, и всего 41 пациент, принимавший лекарственное средство Стиварга® плюс ОПТ, продолжили лечение лекарственным средством Стиварга® после возобновления заболевания. Средняя вторичная ВВП (измеренная согласно оценке исследователя) составила 5,0 и 4,5 месяца соответственно.
Печеночно-клеточный рак (ПКР)
Клиническая эффективность и безопасность лекарственного средства Стиварга® была оценена в международном многоцентровом рандомизированном двойном слепом плацебо — контролируемом исследовании III фазы (RESORCE) при лечении пациентов с ПКР, ранее получавших терапию сорафенибом. Первичной конечной точкой оценки эффективности являлась общая выживаемость (ОВ). Вторичными критериями являлись выживаемость без прогрессирования (ВВП), время до возобновления заболевания (ВДВ), уровень объективного ответа опухоли и частота контроля заболевания.
Всего было рандомизировано 573 пациента с ПКР в соотношении 2:1, принимавших регорафениб в дозе 160 мг плюс ОПТ (N=379) или плацебо плюс ОПТ (N=194) перорально один раз в день в течение 3 недель, с последующим перерывом в приеме продолжительностью в 1 неделю. Средняя суточная принимаемая доза регорафениба составила 144 мг.
В исследование включались пациенты, у которых наблюдалось прогрессирование заболевания после терапии сорафенибом, и пациенты с печеночной недостаточностью легкой степени (класс А по шкале Чайлд-Пью). Из исследования исключались пациенты, полностью прекратившие терапию вследствие развития токсичности, вызванной приемом сорафениба, или переносившие менее 400 мг сорафениба один раз в день до отмены терапии. Рандомизация проводилась в течение 10 недель после прекращения терапии сорафенибом. Пациенты продолжали прием лекарственного средства Стиварга® до радиологического или клинического прогрессирования заболевания или выявления признаков неприемлемой токсичности. Однако пациенты могли продолжить терапию лекарственным средством Стиварга® после выявления прогрессирования по усмотрению исследователя.
Для всех 573 рандомизированных пациентов демографические и базовые характеристики заболевания, представленные ниже, были сопоставимы между группами, получавшими терапию лекарственным средством Стиварга® и плацебо:
Медиана возраста: 63 года
Мужчины: 88%
Европеоидная раса:36%, монголоидная раса:41%
ОС по шкале ECOG: 0 баллов — 66%, 1 балл — 34
Печеночная недостаточность: класс А по шкале Чайлд-Пью — 98%, класс В по шкале Чайлд-Пью — 2%
Этиология включала гепатит В (38%), гепатит С (21%), неалкогольный стеатогепатит ASH (7%)
Отсутствие, как макроскопической сосудистой инвазии, так и внепеченочного распространения опухоли: 19%
Рак печени: стадия В — 13% (по BCLC — Барселонская классификация рака печени), стадия С — 87%
Локально-региональная трансартериальная эмболизация или инфузионная химиотерапия: 61%
Лучевая терапия до применения регорафениба: 15%
Медиана продолжительности лечения: 7,8 месяцев
Добавление лекарственного средства Стиварга® к ОПТ показало статистически значимое увеличение выживаемости по сравнению с плацебо плюс ОПТ с соотношением рисков 0,624 (95% CI 0,498; 0,7852), р=0,000017 по стратифицированному тесту логарифмических рангов, и медианой общей выживаемости 10,6 месяцев против 7,8 месяцев.
Фармакокинетика
Абсорбция
Среднее значение пикового уровня регорафениба в плазме крови составляет около 2,5 мг/л приблизительно через 3-4 часа после приема внутрь однократной дозы 160 мг регорафениба — 4 таблетки по 40 мг. При однократной дозе в 60 мг или 100 мг средняя относительная биодоступность таблеток по сравнению с раствором для перорального применения составляет 69% и 83% соответственно.
Наибольшая концентрация регорафениба и его основных фармакологически активных метаболитов (М-2 и М-5) достигается при приеме после завтрака с низким содержанием жиров (легкого) по сравнению с приемом после завтрака с высоким содержанием жиров или приемом натощак. По сравнению с приемом натощак экспозиция регорафениба возрастает на 48% при приеме после завтрака с высоким содержанием жиров и на 36% при приеме после завтрака с низким содержанием жиров. По сравнению с приемом натощак, экспозиция метаболитов М-2 (N — оксид) и М-5 (N — оксид и N — десметил) выше при приеме регорафениба после легкого завтрака с низким содержанием жиров и ниже при приеме после завтрака с высоким содержанием жиров.
Распределение
Кривая зависимости «концентрация — время» демонстрирует несколько пиков как для регорафениба, так и для его основных циркулирующих метаболитов, в течение 24 часов после приема дозы, что связано с печеночно — кишечной рециркуляцией лекарственного средства. In vitro связывание с белками плазмы высокое и составляет 99,5%. In vitro связывание М-2 и М-5 с белками крови выше, чем у регорафениба и составляет 99,8% и 99,95% соответственно. Метаболиты М-2 и М-5 являются слабыми субстратами Р-гликопротеина. Метаболит М-5 является слабым BCRP-субстратом.
Метаболизм
Регорафениб метаболизируется главным образом в печени посредством окислительного метаболизма, опосредованного изоферментом CYP3A4, а также путем глюкуронизации, опосредованной UGT1A9. В плазме были идентифицированы два основных и шесть второстепенных метаболитов регорафениба. Основными циркулирующими метаболитами регорафениба в плазме крови являются М-2 (N-оксид) и М-5 (N-оксид и N-десметил), которые представляют собой фармакологически активные вещества и в равновесном состоянии имеют концентрацию аналогичную регорафенибу. М-2 метаболизируется посредством окислительного метаболизма, опосредованного изоферментом CYP3A4, а также путем глюкуронизации, опосредованной UGT1А9.
Метаболиты могут быть восстановлены или гидролизованы микрофлорой желудочно-кишечного тракта, при этом возможна реабсорбция неконъюгированного активного вещества и его метаболитов (печеночно-кишечная рециркуляция).
Выведение
После перорального приема средний период полувыведения из плазмы для регорафениба и его метаболита М-2 по данным различных исследований составляет от 20 до 30 часов. Средний период полувыведения для метаболита М-5 составляет приблизительно 60 часов (варьируется от 40 до 100 часов).
Приблизительно 90% меченой изотопами дозы выводится в течение 12 дней после приема, около 71% дозы выделяется с калом (47% в виде исходного соединения, 24% в виде метаболитов) и около 19% дозы выделяется с мочой в виде глюкуронидов. В равновесном состоянии выведение глюкуронидов почками уменьшается и составляет менее 10%. Исходное соединение, обнаруженное в кале, может быть продуктом неабсорбированного лекарственного средства, желудочно-кишечного расщепления глюкуронидов либо восстановления метаболита М-2.
М-5 может расщепляться микрофлорой желудочно-кишечного тракта до М-4, обеспечивая реабсорбцию М-4 (печеночно-кишечная рециркуляция). М-5 окончательно выводится с калом как М-6 (карбоновая кислота) через М-4.
Линейность/нелинейность
Системное воздействие регорафениба при равновесной концентрации возрастает пропорционально дозе при применении до 60 мг и менее пропорционально при дозах более 60 мг. Накопление лекарственного средства при равновесной концентрации приблизительно в два раза превышает концентрацию в плазме, которая соответствует периоду полувыведения и частоте приема лекарственного средства. После перорального приема регорафениба в дозе 160 мг его средняя максимальная концентрация в плазме крови в равновесном состоянии достигает 3,9 мг/л (8,1 мкмоль). Соотношение максимальной и минимальной концентрации регорафениба в плазме крови составляет менее 2.
Оба метаболита М-2 и М-5 демонстрируют нелинейный характер накопления, что может быть обусловлено гепато-энтеральной циркуляцией или насыщением UGT1A9 пути. Несмотря на то, что после однократного приема регорафениба концентрации М-2 и М-5 в плазме крови намного ниже, чем у исходного соединения, в равновесном состоянии плазменные концентрации М-2 и М-5 аналогичны концентрациям регорафениба.
Печеночная недостаточность
Воздействие регорафениба и его метаболитов М-2 и М-5 сопоставимо у пациентов с печеночной недостаточностью легкой степени (класс А по шкале Чайлд-Пью) и у пациентов с нормальной печеночной функцией.
Ограниченные данные по пациентам с умеренной печеночной недостаточностью (класс В по шкале Чайлд-Пью) указывают на величину экспозиции, аналогичную той, что наблюдается у пациентов с нормальной печеночной функцией после однократной дозы в 100 мг регорафениба. Отсутствуют какие-либо данные для пациентов с печеночной недостаточностью класса С по шкале Чайлд-Пью (тяжелая степень). Поскольку регорафениб выводится из организма в основном печенью, у пациентов с тяжелыми нарушениями функции печени возможно повышение экспозиции.
Почечная недостаточность
Доступные клинические данные и данные фармакокинетического моделирования, основанные на физиологических показателях, указывают на схожие экспозиции регорафениба и его метаболитов М-2 и М-5 в равновесном состоянии у пациентов с легкой или умеренной степенью почечной недостаточности в сравнении с пациентами с нормальной функцией почек. Фармакокинетика регорафениба не была изучена у пациентов с острой почечной недостаточностью или терминальной стадией почечной недостаточности. Тем не менее, данные фармакокинетического моделирования, основанного на физиологических показателях, не предусматривают релевантных изменений экспозиции у таких пациентов.
Пациенты пожилого возраста
Возраст не оказывает влияния на фармакокинетику регорафениба в пределах изученного возрастного диапазона (29-85 лет).
Пол
Не выявлено различий в фармакокинетике регорафениба в зависимости от пола.
Этническая принадлежность
Не выявлено различий в фармакокинетических параметрах регорафениба в зависимости от этнической принадлежности.
Электрофизиология сердца/удлинение интервала ОТ
У пациентов женского и мужского пола с онкологическими заболеваниями не было выявлено удлинения интервала QT в равновесном состоянии при приеме регорафениба в дозе 160мг.
Доклинические данные о безопасности
Системная токсичность
После повторного введения дозы у мышей, крыс и собак наблюдались нежелательные реакции со стороны ряда органов, прежде всего почек, печени, пищеварительного тракта, щитовидной железы лимфатической/кроветворной системы, эндокринной системы, репродуктивной системы и кожи. В 26-недельном исследовании токсичности при введении повторных доз у крыс наблюдалось небольшое увеличение частоты случаев утолщения атриовентрикулярных клапанов сердца. Причиной данного явления может служить ускорение возрастного физиологического процесса. Данные реакции наблюдались при системных экспозициях, находящихся в диапазоне или ниже диапазона предполагаемой экспозиции у человека (основано на сравнении AUC). Изменения зубов и костей, а также нежелательные явления в репродуктивной системе были наиболее выражены у молодых и растущих животных, а также у молодых крыс, что указывает на потенциальный риск для детей и подростков.
Тератогенность и эмбриотоксичность
Специальные исследования влияния регорафениба на фертильность не проводились. Следует учитывать способность регорафениба оказывать неблагоприятное воздействие на репродуктивную систему мужчин и женщин. В исследовании на крысах и собаках после многократного применения регорафениба при экспозициях ниже предполагаемой экспозиции у человека (при сравнении AUC) наблюдались морфологические изменения в яичках, яичниках и матке. Наблюдаемые изменения были обратимы только частично.
В исследовании на кроликах при экспозиции ниже предполагаемой экспозиции у человека наблюдалась эмбриотоксичность (при сравнении AUC). В основном были обнаружены нарушения формирования мочевыделительной системы, сердца и крупных сосудов.
Генотоксичность и канцерогенность
Регорафениб не показал генотоксичности в исследованиях in vitro и in vivo на мышах.
Исследования канцерогенности регорафениба не проводились.
Стиварга — это противоопухолевый препарат, который применяется для лечения рака толстой кишки, карциномы печени и метастатического поражения печени другими видами рака, а также для терапии стромальных опухолей ЖКТ.
Противоопухолевый эффект данного лекарственного средства основан на подавлении действия сразу нескольких киназ, которые принимают участие в пролиферации (делении) злокачественных клеток, росте кровеносных сосудов и создании опухолевого микроокружения.
Стиварга была официально одобрена FDA в 2012 году. В странах ЕС ее начали использовать в 2014 году, а в СНГ с 2016 г. Препарат достоверно увеличивает общую продолжительность жизни на 23% у больных колоректальным раком 4 стадии при неэффективности стандартной терапии, также увеличивается время жизни без прогрессирования. В связи с этим, данное лекарственное средство рассматривают в качестве оптимального варианта терапии для пациентов, у которых стандартные методы лечения исчерпали свои ресурсы. До появления Стиварги такие больные получали только симптоматическое лечение.
Гастроинтестинальные стромальные опухоли (ГИСО) — это злокачественные новообразования, которые развиваются из мышечной оболочки органов ЖКТ, их относят к саркомам. ГИСО встречаются крайне редко, но имеют очень агрессивное течение и неблагоприятный прогноз. При обнаружении опухоли на ранней стадии показано хирургическое лечение, однако, к сожалению, у 40% больных развивается рецидив, и новоообразование начинает давать метастазы. Стандартная терапия первой линии предполагает назначение иматиниба, но у 80% больных, положительно ответивших на терапию, развивается резистентность и в итоге возникает прогрессирование процесса.
Назначение стиварги в случаях, когда другие методы лечения исчерпали свой потенциал, снижает риск прогрессирования и смерти на 73%.
- Состав
- Форма выпуска
- Фармакологическое действие
- Фармакокинетика и фармакодинамика
- Показания к применению
- Противопоказания к назначению Стиварга
- Побочные действия
- Способы применения
- Особые указания при применении препарата Cтиварга
- Совместимость Стиварга с другими препаратами
- Применение Стиварга во время беременности и кормления грудью
- Передозировка
- Управление транспортными средствами
Состав
Основным действующим веществом лекарственного препарата является регорафениб в дозировке 40 мг в одной таблетке.
Форма выпуска
Стиварга имеет таблетированную форму. Каждая таблетка выполнена в виде продолговатого овала и покрыта оболочкой бледно-розового цвета. Она растворяется в кишечнике, что обеспечивает защиту от неблагоприятного действия желудочного сока. На одной стороне таблетки выгравирована цифра 40, на другой — BAYER.
Таблетки упакованы в пластиковые непрозрачные флаконы белого цвета с закручивающейся крышкой. В одном флаконе находится 28 таблеток. Каждый флакон помещен в бело-голубую картонную коробку и снабжен бумажным вкладышем, содержащим инструкцию по применению стиварги.
Фармакологическое действие
Стиварга подавляет действие различных протеинкиназ, в том числе тех, которые принимают активное участие в развитии и метастазировании злокачественного новообразования:
- Участвующие в процессах ангиогенеза — VERGFRI, TIE.
- В процессе канцерогенеза — KIT, RET, BRAF, RAF.
- В процессе метастазирования — PDGFR, FGFR.
- Участвующие в обеспечении противоопухолевого иммунитета — CSF1R.
Фармакокинетика и фармакодинамика
Биодоступность
Биодоступность Стиварги при рекомендованном способе применения составляет 69-83%, при этом средняя концентрация в плазме крови достигается через 3-4 часа после однократного приема в стандартной дозировке 160 мг (это 4 таблетки). Наилучшая усвояемость отмечается при применении Стиварги после нежирного завтрака. При этом, увеличивается экспозиция, как основного действующего вещества, так и его метаболитов.
Следует отметить, что максимальная концентрация основного действующего вещества и его метаболитов имеет суточные колебания при применении в рекомендованном режиме, что связано с печеночно-кишечной рециркуляцией.
Распределение в организме
После всасывания, как основное действующее вещество, так и его метаболиты прочно связываются с белками плазмы. Связывание регорафениба и М-5 по результатам лабораторных исследований составляет 99,5%, М-2 — 99,8%.
Метаболизм
Метаболизм осуществляется печенью посредством изоферментов CYP3A4 и UGT1A19. В плазме определяют несколько метаболитов, из которых выделяют 2 основных (М-2 и М-5) и 6 второстепенных. Они обладают фармакологической активностью и при равновесном состоянии имеют сходные концентрации с регорафенибом. Концентрация метаболитов может снижаться за счет восстановления кишечной микрофлорой, после чего возможно их повторное всасывание (печеночно-кишечная рециркуляция).
Выведение
Период полувыведения основного вещества и его главного метаболита М-2 составляет 20-30 часов. Период полувыведения второстепенных метаболитов и метаболита М-5 более длительный, он занимает около 60 часов, но может варьировать от 40 до 100 часов.
В целом 90% основного действующего вещества выводится в течение 12 суток. Основной путь выведения — через кишечник. Таким способом выводится до 70-71% регорафениба. Оставшаяся часть выводится почками.
Фармакокинетика при печеночной дисфункции
Наличие печеночной недостаточности легкой и средней степени тяжести не давало каких-либо значимых отклонений в фармакокинетике препарата. У пациентов с тяжелой недостаточностью (класс С) исследование фармакокинетики Стиварга не проводилось, поэтому им не рекомендовано данное лечение. Учитывая то, что препарат в основном метаболизируется печенью, ожидается усиление его действия у таких больных.
Применение у пожилых людей
При клинических испытаниях, фармакокинетических изменений обнаружено не было. Изучение проводилось на пациентах от 29 до 85 лет.
Пол
Половых различий в фармакокинетике Стиварги не обнаружено.
Этнические особенности
Не было выявлено различий фармакокинетики у пациентов с различной расовой принадлежностью.
Показания к применению
- Метастатическая форма рака толстой кишки у пациентов на фоне неэффективности или прогрессирования опухоли после терапии фторпиримидинами и таргетными препаратами. Также Стиварга может назначаться при наличии противопоказаний к вышеперечисленным препаратам.
- Установленный диагноз ГИСО, в том числе в неоперабельном состоянии, или при наличии отдаленных метастазов при неэффективности терапии иматинибом или сунитинибом, а также при наличии противопоказаний и непереносимости данных препаратов.
- Карцинома печени у пациентов при неэффективности лечения сорафенибом.
Противопоказания к назначению Стиварга
- Тяжелое поражение печени с развитием печеночной недостаточности класса С по Чайлд-Пью. Хотя клинических испытаний у данной категории больных не проводилось, ожидается, что у них препарат будет усиливать свое токсическое действие.
- Терминальная почечная недостаточность. При клинических испытаниях на пациентах со всеми формами почечной недостаточности (кроме терминальной), не было обнаружено фармакокинетических изменений регорафениба. У больных с тяжелой почечной недостаточностью было отмечено увеличение концентрации основных метаболитов на 30%. Исследования у пациентов с терминальной почечной недостаточностью не проводились.
- Необходимость одновременного приема несовместимых препаратов, например, сильных ингибиторов CYP3A4. В этом случае лечение Стиваргой рекомендуется приостановить.
- Возраст младше 18 лет. Не проводилось клинических испытаний эффективности препаратов на детях, поэтому им данный препарат не назначают.
- Индивидуальная непереносимость действующего вещества регорафениба.
С осторожностью Стиварга назначается в следующих случаях:
- Легкая и средняя печеночная недостаточность. В этом случае требуется более частый контроль лабораторных показателей функции печени.
- Наличие мутации KRAS.
- Высокая вероятность развития кровотечения. Например, пациенты с диагностироанными коагулопатиями или пациенты, вынужденные принимать антикоагулянты и антиагреганты.
- Наличие ишемической болезни сердца.
Побочные действия
Безопасность лекарственного средства оценивалась на более чем 1200 пациентах в рандомизированных плацебо-контролируемых исследованиях. Группа исследования включала 500 пациентов с 4 стадией колоректального рака и 132 пациента с ГИСО.
В зависимости от частоты встречаемости, регистрировались следующие побочные действия:
Очень частые побочные действия (>1/10)
- Угнетение функции кроветворения, что приводит к тромбоцитопениям (кровоточивости), анемиям.
- Артериальная гипертензия.
- Дисфония — нарушение голоса.
- Ладонно-подошвенный синдром, который характеризуется одним из следующих симптомов: покалывание или жжение в пальцах рук и ног, сухость, шелушение, растрескивание кожи, образование чешуек и омозоленности, гиперемия (слабое или ярко выраженное покраснение), отечность кожи, образование волдырей.
- Кожная сыпь.
- Диарея.
- Тошнота и рвота.
- Явления стоматита.
- Головная боль.
- Снижение аппетита, вплоть до отказа от еды, сильное похудение.
- Изменение лабораторных показателей — повышение уровня билирубина и печеночных трансаминаз.
- Астенические явления (слабость, упадок сил).
- Боль различной локализации.
- Повышение температуры тела, не связанное с инфекционными осложнениями.
Частые осложнения (>1/100-<1/10)
- Выпадение волос.
- Сухость кожных и слизистых покровов.
- Эксфолиативные дерматиты.
- Изменение вкусового восприятия.
- Явления гастроэнтерита.
- Изжога, гастроэзофагеальный рефлюкс.
- Судороги, мышечные спазмы.
- Головная боль.
- Тремор конечностей.
- Изменение лабораторных показателей — появление белка в моче, снижение уровня тиреоидных гормонов (гипотиреоз). Снижение уровня электролитов (K, Na, CL), Р, магния, увеличение МНО, активности липазы и амилазы.
- Инфекционные осложнения со стороны мочевыделительной системы, местные и общие грибковые инфекции — кандидозы кожи и слизистых оболочек.
- Со стороны иммунной системы — лейкопения со снижением иммунной защиты организма.
Нечастые осложнения (>1/1000-<1/100)
- Реакции гиперчувствительности, вплоть до анафилаксии.
- Ишемические поражения сердечной мышцы.
- Гипертонический криз.
- Поражение ногтей.
- Многоформная эритема.
- Язвы и прободения желудка и кишечника, образование свищей.
- Панкреатит.
- Развитие тяжелой дисфункции печени.
Редкие осложнения (1/10000-1/1000)
- Синдром Стивена-Джонса — тяжелое состояние, обусловленное токсическим и аллергическим действием препарата. Проявляется общим недомоганием, лихорадкой, покраснением кожи, которое переходит в отмирание клеток кожи и слизистых с образованием пузырей, корок и трещин.
- Синдром задней обратимой энцефалопатии. Он проявляется головной болью, спутанностью сознания, нарушением зрения и судорогами на фоне объективных изменений белого вещества задней доли головного мозга. Данные изменения носят обратимый характер при вовремя начатом лечении и отмене действия провоцирующего фактора.
- Возникновение вторичных новообразований, которые могут носить как доброкачественный, так и злокачественный характер. Это могут быть кисты, полипы, кератоакантомы и плоскоклеточный рак кожи.
Поражение печени
Было зарегистрировано 3 случая с летальным исходом у пациентов, проходивших терапию препаратом Стиварга. У двоих из них было метастатическое поражение печени. У всех троих поражение печени начало проявляться в течение первых двух месяцев от начала приема препарата и сопровождалось повышением печеночных трансаминаз более чем в 20 раз от верхней границы нормы. Также наблюдалось увеличение показателей билирубина. В результате проведения биопсии, у двоих пациентов был выявлен некроз печеночных клеток с воспалительным инфильтратом.
Кровотечения
Данное осложнение наблюдалось в 19,3% случаев. Как правило, это были носовые кровотечения легкой и средней степени тяжести.
Инфекционные осложнения
Инфекционные осложнения отмечались у 31% пациентов. Чаще отмечались легкие или умеренные проявления. В основном поражались органы мочевыделительной системы, назофарингиты, грибковые поражения слизистых оболочек и кожи, а также системные микозы. Инфекционные осложнения не влияли на летальность больных.
Ладонно-подошвенный синдром
Ладонно-подошвенный синдром наблюдался у 45,2% больных раком толстой кишки и у 66,7% больных ГИСО. В большинстве случаев данное осложнение развивалось при первом цикле терапии и носило умеренную или легкую степень выраженности. Тяжелая эритродизестезия отмечалась у 16,6% больных КРР и у 22% больных ГИСО.
Артериальная гипертензия
Общее количество случаев артериальной гипертензии во время клинических испытаний составило 30,4%. Осложнение чаще развивалось в первом цикле терапии, причем больше страдали пациенты с ГИСО. В основном это была нетяжелая гипертензия, но был зарегистрирован один случай тяжелой артериальной гипертензии.
Протеинурия
Наличие белка в моче отмечалась у 7,4% пациентов с КРР и у 6,8% у больных с ГИСО, при этом у 40,5% таких больных после снижения дозы или отмены препарата белок в моче не исчез.
Осложнения со стороны сердечно-сосудистой системы
Осложнения со стороны сердечно-сосудистой системы при применении Стиварга чаще наблюдались у пациентов старше 75 лет.
Гипотиреоз
У 26,1% пациентов было обнаружено превышение концентрации ТТГ, из них у 6,9% пациентов превышение было в 4 раза. Снижение Т3 наблюдалось у 25,6% пациентов, Т4 — у 8%. В 7% случаев больным, принимавшим Стиварга, требовалась медикаментозная коррекция гипотиреоза.
Смертельные исходы при использовании Стиварга во время клинических испытаний отмечались редко (0.6%) и были связаны с поражением органов ЖКТ (в том числе печени), легких и почек.
Способы применения
Рекомендуемый режим приема препарата Стиварга составляет 160 мг один раз в сутки в течение 3-х недель. На четвертой неделе от момента начала лечения необходимо сделать перерыв. Таким образом, один курс терапии Стиваргой составляет 4 недели.
Лечение продолжают курсами до тех пор, пока оно вызывает клинический эффект, или не развились неприемлемые осложнения. При индивидуальной непереносимости или развитии тяжелых осложнений, препарат на время отменяют или снижают его дозировку.
Если прием препарата был пропущен, рекомендуемую дозу необходимо употребить, как только пациент вспомнил о нем, дальнейшее лечение должно осуществляться по обычной схеме. Нельзя принимать двойную дозу лекарства в один и тот же день для компенсации пропущенного приема.
Особые указания при применении препарата Cтиварга
До начала противоопухолевого лечения необходимо определить уровень печеночных ферментов и билирубина. В первые 2 месяца контроль этих показателей проводят минимум раз в 2 недели, затем не менее одного раза в месяц. При наличии клинических показаний, анализы контролируют чаще.
Если у пациентов из-за терапии Стиваргой ухудшаются показатели печеночных проб, дозу препарата уменьшают и организуют активное наблюдение за пациентом. При этом следует исключать альтернативные причины печеночной патологии, например, механическую желтуху из-за обтурации желчных протоков опухолью или конкрементами, или прогрессирование злокачественного процесса (печеночной карциномы, возникновение множественных метастазов и др).
Если лечение проводится на фоне легкой или умеренной печеночной недостаточности, пациент подлежит активному наблюдению с лабораторным контролем печеночных проб. На фоне тяжелой печеночной недостаточности лечение противопоказано, поскольку у данной когорты пациентов действие препарата не изучалось. Предполагается, что у них может возникнуть увеличение времени экспозиции действующего вещества.
Если имеются факторы риска развития кровотечения (тромбоцитопении, коагулопатии, необходимость приема антикоагулянтов или антиагрегантов), необходимо контролировать показатели коагулограммы и уровень тромбоцитов. Если терапия проводится пациентам с циррозом, им необходимо предварительное лечение расширенных вен пищевода. При развитии тяжелой кровопотери, необходима отмена препарата. Также препарат отменяют при прободении органов ЖКТ.
При лечении препаратом Стиварга на фоне ИБС, необходимо контролировать состояние сердца, в частности отслеживать наличие признаков ишемии и инфаркта. При их развитии, препарат немедленно отменяют, и лечение продолжают после нормализации состояния пациента. При возобновлении лечения, необходимо тщательно взвесить соотношение польза/риск в конкретном случае. Если признаки ишемии сохраняются, возобновление противоопухолевого лечения данным препаратом не рекомендуется.
Перед началом и в процессе лечения с помощью препарата Стиварга необходимо регулярно контролировать артериальное давление и, при необходимости, корректировать гипертензию согласно принятым стандартам. Если гипертензия носит тяжелый и упорный характер, устойчива к рекомендованному лечению, необходимо временное прекращение приема Стиварга или снижение его дозировки. Если развился гипертонический криз, препарат полностью отменяют.
При развитии симптомов задней энцефалопатии, лечение препаратом Стиварга отменяют и проводят нормализацию и контроль артериального давления, противоопухолевое лечение продолжают с помощью поддерживающей терапии.
При планировании обширных операций, необходима отмена Стиварга, поскольку препарат обладает антиангиогенным действием, что ухудшает процесс заживления раны. Кроме того, он увеличивает риск развития кровотечений во время операции и в послеоперационном периоде. Возобновление противоопухолевого лечения производится после ранозаживления.
При развитии ладонно-подошвенного синдрома, рекомендуется применение кремов и препаратов, обладающих кератолитическим действием. Их наносят только на пораженную кожу. Также рекомендуется использовать увлажняющие средства в неограниченном количестве. Они частично облегчают симптомы. При необходимости, противоопухолевое лечение временно приостанавливают. При тяжелой форме синдрома и развитии рецидивов, необходима отмена Стиварга.
В целом, рекомендуется проводить регулярный контроль биохимических и метаболических показателей и, при необходимости, назначать коррекционную терапию согласно принятым стандартам. Если нарушения носят рецидивирующий и устойчивый характер, прием препарата Стиварга временно прекращают или полностью отменяют.
Совместимость Стиварга с другими препаратами
Индукторы CYP3A4/ингибиторы CYP3A4 и UGT1A9
В лабораторных исследованиях было установлено, что метаболизм Стиварга производится с помощью ферментов цитохрома CYP3A4 и UGT1A9. Дальнейшее изучение показало, что при одновременном однократном использовании Стиварга в рекомендуемой дозе кетоконазолом обнаруживалось повышение AUC регорафениба. В то же время на 90% снижалось AUC его активных метаболитов. В этой связи противопоказано назначение Стиварга одновременно с сильными ингибиторами CYP3A4: кларитромицином, итраконазолом, кетоконазолом и др. Также противопоказано его одновременное применение совместно с сильными ингибиторами UGN1A9 (мефенаминовая кислота, нифлумовая кислота и др.).
Изменение фармакокинетики наблюдалось и при совместном однократном применении Стиварга в рекомендуемой дозировке с рифампином (сильным индуктором CYP3A4). Такое сочетание вызывало снижение AUC регорафениба наполовину и увеличение AUC его активных метаболитов в 4 раза. Изучение взаимодействия с другими аналогичными препаратами не проводилось, но ожидается аналогичное изменение фармакокинетики, поэтому их совместное применение не рекомендуется (фенитоин, карбамазепин, фенобарбитал и др).
Субстраты UGP1A1 и UGT1A9
Регорафениб и М-2 подавляет процесс глюкуронизации, который проходит под действием UGP1A1 и UGT1A9, а М-5 подавляет действие UGT1A1 в равновесных концентрациях.
Во время испытаний, применение Стиварга совместно со стандартной терапией ГИСО приводило к увеличению AUC метаболитов иринотекана на 44%, рост AUC основного действующего вещества иринотекана увеличивался на 28%.
Субстраты BCR и Р-гликопротеина
Совместное применение Стиварга и Розувастина приводило к росту AUC Розувастина в 3,8 раза. При необходимости одновременного лечения данными препаратами, нужно обязательно контролировать состояние таких пациентов, чтобы своевременно выявить симптомы повышения экспозиции субстратов BCR.
Клинически значимого изменения фармакокинетики Стиварга и субстратов Р-гликопротеина не обнаружено, поэтому допускается их совместное применение.
Селективные субстраты CYP
Клинически значимого изменения метаболизма Стиварга и субстратов CYP не обнаружено, поэтому допускается их совместное применение с варфарином, омепразолом и другими препаратами.
Антибиотики
Проводились клинические исследования взаимодействия Стиварга с неомицином. Было выявлено, что экспозиция регорафениба не изменялась, но было обнаружено снижение его активных метаболитов, что может приводить к нарушению печеночно-кишечной циркуляции и снижению действия противоопухолевого эффекта. Взаимодействие с другими антибиотиками не изучалось.
Применение Стиварга во время беременности и кормления грудью
Беременность
Исследования Стиварги показали токсическое и мутагенное действие на плод при тестировании на лабораторных животных, поэтому на всех сроках беременности его применение запрещено. Мужчины и женщины, находящиеся в репродуктивном периоде, которым показано противоопухолевое лечение препаратом Стиварга, должны пользоваться надежными надежной контрацепцией на время прохождения терапии и в течение 8 недель после ее окончания.
Грудное вскармливание
Также исследования на лабораторных животных показали, что с молоком выделяется как основное действующее вещество препарата Стиварга, так и его метаболиты. Учитывая то, что невозможно полностью исключить их токсическое действие на ребенка, от грудного вскармливания следует отказаться.
Фертильность
Специальных исследований, которые бы оценивали влияние на репродуктивные возможности человека Стиварга, не проводилось. Однако тесты на животных показали снижение репродуктивных свойств, как у особей женского пола, так и у мужского.
Передозировка
При передозировке препарата Стиварга были отмечены следующие эффекты:
- Дерматологические реакции.
- Нарушение голоса.
- Диарея.
- Воспалительные реакции и сухость слизистых.
- Повышение артериального давления.
- Утомляемость.
Антидота к Стиварга не существует. Если подозревается передозировка препарата, его применение немедленно прекращают и назначают симптоматическое лечение. За пациентом устанавливается активное наблюдение до стабилизации его состояния.
Управление транспортными средствами
Исследований, направленных на влияние Стиварга на способность к вождению и управлению механизмами, не проводилось. Однако во время клинических испытаний фиксировались побочные реакции, которые свидетельствовали о снижении внимания и скорости психомоторных реакций. Поэтому пациентам, проходящим противоопухолевую терапию препаратом Стиварга, рекомендуется воздержаться от управления транспортными средствами.