Повышенная чувствительность к любому из компонентов препарата. Детский возраст (до 12 лет).
Применение при беременности и в период лактации
Ограниченные данные, полученные от беременных женщин (в пределах 300-1000 беременностей, завершившихся рождением ребенка), указывают на отсутствие пороков развития или токсического воздействия на плод/новорожденного, которые были бы связаны с тенофовира дизопроксил фумаратом. Исследования на животных не указывали на токсическое воздействие на репродуктивную функцию. При необходимости можно рассмотреть целесообразность применения тенофовира дизопроксил фумарата во время беременности. Препарат следует применять во время беременности только в том случае, если ожидаемая польза от лечения для матери превышает потенциальный риск для плода.
Исследования показали, что тенофовир выделяется в грудное молоко. Данные о влиянии тенофовира на новорожденных/младенцев недостаточны. Поэтому препарат не следует применять в период кормления грудью.
Не рекомендуется кормить грудью матерям, инфицированным ВИЧ и вирусом гепатита В, получавшим терапию препаратом с целью предупреждения риска постнатальной передачи ВИЧ и вируса гепатита В ребенку.
Способ применения и дозы
Лечение должен начинать врач, имеющий опыт в лечении ВИЧ-инфекции и/или хронического гепатита В.
Взрослые
Для лечения ВИЧ-инфицированных пациентов, уже имеющих опыт антиретровирусной терапии, выбор препарата должен базироваться на проверке индивидуальной вирусной резистентности и/или истории лечения пациентов.
Рекомендованная доза для лечения ВИЧ или хронического гепатита В составляет 1 таблетка 1 раз в сутки внутрь, во время приема пищи.
Пациенты с хроническим гепатитом В
Оптимальная продолжительность лечения неизвестна.
Лечение пациентов с положительной реакцией на антиген вируса гепатита В (HBeAg) без цирроза должно продолжаться не менее 6-12 месяцев после подтверждения сероконверсии НВе (исчезновение антигенов вируса гепатита В и ДНК-вируса гепатита В с выявлением анти- НВе) или до сероконверсии HBs, либо исчезновения эффективности (см. раздел «Особые указания»). После прекращения лечения необходимо регулярно проверять уровни АЛТ и ДНК-вируса гепатита В в сыворотке крови с целью установления каких-либо поздних рецидивов виремии.
Лечение пациентов с отрицательной реакцией на антиген вируса гепатита В без цирроза должно продолжаться, как минимум, до сероконверсии HBs или появления признаков исчезновения эффективности лечения. В случае пролонгированного лечения, продолжающегося более 2 лет, рекомендуется регулярно проводить повторный пересмотр лечения, чтобы подтвердить приемлемость для пациента продолжения выбранной терапии.
Подростки
ВИЧ-1: для подростков в возрасте от 12 до 18 лет и с массой тела более 35 кг рекомендованная доза составляет 1 таблетка 1 раз в сутки внутрь, во время приема пищи.
Хронический гепатит В: для подростков в возрасте от 12 до 18 лет и с массой тела более 35 кг рекомендованная доза составляет 1 таблетка 1 раз в сутки внутрь, во время приема пищи. Оптимальная продолжительность лечения на настоящее время не установлена.
Таблетку необходимо проглотить. Если пациентам тяжело глотать, то таблетку можно принять сразу же после ее растворения: 1 таблетку растворяют приблизительно в 100 мл воды, апельсинового или виноградного сока.
Если прием дозы был пропущен, и прошло менее 12 часов от обычного времени приема дозы, то пациенту следует как можно скорее принять препарат вместе с едой и вернуться к обычному режиму приема препарата. Если в случае пропущенного приема дозы прошло более 12 часов и приближается время приема следующей дозы препарата, то пациенту не следует принимать пропущенную дозу, но необходимо вернуться к обычному режиму приема препарата.
Если в течение 1 часа после приема препарата у пациента возникла рвота, следует принять еще 1 таблетку. Если рвота у пациента возникла более чем через 1 час после приема препарата, то еще одну таблетку принимать не следует.
Пациенты пожилого возраста
На сегодняшний день нет данных, на основании которых можно дать рекомендации относительно дозирования для пациентов в возрасте от 65 лет (см. раздел «Особые указания»).
Пациенты с нарушением функции почек
Тенофовир выводится из организма вместе с мочой, поэтому пациенты с почечной дисфункцией испытывают повышенное воздействие тенофовира. Данные о безопасности и эффективности применения тенофовира дизопроксил фумарата у пациентов с умеренными и тяжелыми нарушениями функции почек (клиренс креатинина менее 50 мл/мин) ограничены. Оценка показателей безопасности относительно незначительных нарушений функции почек (клиренс креатинина 50-80 мл/мин) в долгосрочной перспективе не проводилась. По этой причине пациентам с нарушениями функции почек тенофовира дизопроксил фумарат необходимо применять, если потенциальная польза лечения считается превышающей потенциальный риск. Коррекция интервала дозирования рекомендуется для пациентов с клиренсом креатинина менее 50 мл/мин.
Незначительные нарушения функции почек (клиренс креатинина 50-80 мл/мин)
Ограниченные данные, полученные в результате клинических исследований, свидетельствуют в пользу сохранения для пациентов с незначительными нарушениями функции почек дозирования тенофовира дизопроксил фумарата один раз в сутки.
Умеренные нарушения функции почек (клиренс креатинина 30-49 мл/мин) Прием 1 таблетки препарата каждые 48 часов рекомендуется на основе моделирования фармакокинетических данных разовой дозы у ВИЧ-отрицательных субъектов и субъектов, не инфицированных вирусом гепатита В, с разными степенями почечных нарушений, в том числе с терминальной стадией почечной недостаточности, требующей гемодиализа. Однако такое дозирование не было подтверждено в рамках клинических исследований. Поэтому клиническую реакцию на лечение и функцию почек у таких пациентов необходимо внимательно контролировать (см. раздел «Особые указания» и «Фармакокинетика»).
Тяжелые нарушения функции почек (клиренс креатинина менее 30 мл/мин) и пациенты, находящиеся на гемодиализе
Соответствующая коррекция дозы не может быть применена из-за отсутствия таблетки с другим содержанием действующего вещества, поэтому применение препарата для пациентов этой группы не рекомендуется. Если альтернативное лечение отсутствует, можно применить продленные интервалы введения следующим образом:
тяжелые нарушения функции почек: принимать по 1 таблетке каждые 72-96 часов (дважды в неделю);
пациенты, находящиеся на гемодиализе: принимать по 1 таблетке каждые 7 суток после завершения сессии гемодиализа*.
Указанные коррекции доз не были подтверждены в рамках клинических исследований. Моделирование дает основания предположить, что длительный интервал дозирования не является оптимальным и может привести к повышенной токсичности и, возможно, к неадекватной реакции. По этой причине клиническую реакцию на лечение и функцию почек необходимо внимательно контролировать (см. раздел «Особые указания» и » Фармакокинетика»).
* Как правило, введение 1 раз в неделю, допуская 3 сессии гемодиализа в неделю, продолжительностью приблизительно 4 часа каждый, или после 12 часов кумулятивного гемодиализа.
Нельзя дать рекомендации относительно дозирования для пациентов без гемодиализа с клиренсом менее 10 мл/мин.
Не рекомендуется применять тенофовира дизопроксил фумарат у педиатрических пациентов с нарушением функции почек (см. раздел «Особые указания»).
Пациенты с нарушением функции печени
Для пациентов с нарушениями функции печени нет необходимости в коррекции дозы (см. раздел «Особые указания” и «Фармакокинетика»).
При прекращении приема препарата пациентов с хроническим гепатитом В, с сопутствующим инфицированием ВИЧ или без сопутствующего инфицирования, необходимо внимательно наблюдать с целью выявления признаков обострения гепатита (см. раздел см. раздел «Особые указания»).
Побочное действие
Краткие данные о профиле безопасности ВИЧ-1 и гепатит В
Редко сообщалось о случаях нарушений функции почек, почечной недостаточности и проксимальной почечной тубулопатии (в том числе синдром Фанкони), которые иногда приводили к костным аномалиям (редко – к переломам).
Для пациентов, принимающих препарат, рекомендуется наблюдение за почечной функцией (см. раздел «Особые указания»).
ВИЧ-1. Побочные реакции на лечение тенофовира дизопроксил фумаратом в сочетании с другими антиретровирусными препаратами могут ожидаться у примерно одной трети пациентов. Такие реакции, как правило, представляют собой явления в желудочно-кишечном тракте от незначительной до средней степени тяжести. Приблизительно 1% пациентов, получавших лечение тенофовира дизопроксил фумаратом, прекратили лечение из-за реакций со стороны желудочно-кишечного тракта.
С тенофовира дизопроксил фумаратом связаны такие явления, как лактат- ацидоз, тяжелая гепатомегалия с жировой дегенерацией печени и липодистрофия (см. раздел тенофовира дизопроксил фумаратом «Особые указания» и «Описание отдельных побочных реакций»).
Не рекомендуется одновременное применение тенофовира дизопроксил фумарата и диданозина, поскольку это может привести к повышению риска побочных реакций (см. раздел «Взаимодействие с другими лекарственными средствами»). Редко сообщалось о случаях заболевания панкреатитом и лактат-ацидозом, иногда с летальным исходом (см. раздел «Особые указания»).
Гепатит В. Побочные реакции на лечение тенофовира дизопроксил фумаратом (в основном незначительные) могут ожидаться, примерно, у одной четверти пациентов. Во время клинических исследований по изучению пациентов, инфицированных вирусом гепатита В, наиболее частой побочной реакцией на тенофовира дизопроксил фумарат была тошнота (5,4%).
Сообщалось о случаях сильного обострения гепатита у пациентов, получавших терапию, а также у пациентов, прекративших лечение гепатита В (см. раздел «Особые указания»).
Краткие сведения о побочных реакциях
Оценка побочных реакций на тенофовира дизопроксил фумарат основывается на данных по безопасности, полученных в ходе клинических исследований и постмаркетингового анализа. Все побочные реакции указаны в таблице 1.
Клинические исследования ВИЧ-1
Оценка побочных реакций по данным клинического исследования ВИЧ-1 основывается на результатах двух исследований, в рамках которых 653 пациента, ранее получавшие лечение, принимали тенофовира дизопроксил фумарат (n=443) или плацебо (n=210) в сочетании с другими антиретровирусными препаратами в течение 24 недель, а также на данных двойного слепого сравнительного контролированного исследования, в рамках которого 600 пациентов, ранее не получавших лечение, принимали 245 мг тенофовира дизопроксила (в форме фумарата) (n=299) или ставудин (n=301) в сочетании с ламивудином и эфавиренцем на протяжении 144 недель.
Клинические исследования гепатита В
Оценка побочных реакций по данным клинического исследования гепатита В главным образом основывается на результатах двух двойных-слепых сравнительных контролированных исследований, в рамках которых 641 пациент с хроническим гепатитом Вис компенсированным заболеванием печени получал 245 мг тенофовира дизопроксила (в форме фумарата) ежедневно (n=426) или адефовира дипивоксила 10 мг ежедневно (n=215) в течение 48 недель. Побочные реакции, которые наблюдались в течение 240-недельного беспрерывного лечения, соответствовали профилю безопасности тенофовира дизопроксил фумарата.
Пациенты с декомпенсированным заболеванием печени
Профиль безопасности тенофовира дизопроксил фумарата для пациентов с декомпенсированным заболеванием печени оценивался во время двойного-слепого активного контролированного исследования (GS-US-174-0108), в рамках которого пациенты получали лечение тенофовира дизопроксил фумаратом (n=45) или эмтрицитабином плюс тенофовира дизопроксила фумарат (n=45), либо энтекавиром (n=22) в течение 48 недель.
В группе приема тенофовира дизопроксила фумарата 7% пациентов прекратили лечение из-за побочных реакций, а у 9% пациентов отмечалось подтвержденное повышение креатинина в сыворотке — более > 0,5 мг/дл или подтвержденный уровень фосфата в сыворотке — менее 2 мг/дл до 48 недели. Статистически значимой разницы между группой комбинированного приема тенофовира и группой приема энтекавира не было. После 168 недели 16% (7/45) в группе приема тенофовира дизопроксил фумарата, 4% (2/45) в группе приема эмтрицитабина с тенофовира дизопроксил фумаратом и 14% (3/22) в группе приема энтекавира показали нарушение недостаточности. Тринадцать процентов (6/45) в группе приема тенофовира дизопроксил фумарата, 13% (6/45) в группе приема эмтрицитабина с тенофовира дизопроксил фумаратом и 9% (2/22) в группе приема энтекавира подтвердили повышение креатинина в сыворотке более 0,5 мг/дл или подтвержденный уровень фосфата в сыворотке менее 2 мг/дл.
На 168 неделе уровень смертности был 13% (6/45) в группе приема тенофовира дизопроксил фумарата, 11%(5/45) в группе приема эмтрицитабина с тенофовира дизопроксил фумаратом и 14% (3/22) в группе приема энтекавира среди численности пациентов с декомпенсированным заболеванием печени. Уровень гепатоцеллюлярной карциномы был 18% (8/45) в группе приема тенофовира дизопроксил фумарата, 7% (3/45) в группе приема эмтрицитабина с тенофовира дизопроксил фумаратом и 9% (2/22) в группе приема энтекавира. Субъекты с высоким исходным показателем СРТ имели более высокий риск развития серьезных побочных реакций (см. раздел «Особые указания»).
Пациенты с ламивудин-резистентным хроническим гепатитом В:
Не было обнаружено новых побочных реакций тенофовира дизопроксил фумарата во время двойного-слепого рандомизированного исследования (GS-US-174-0121), в рамках которого пациенты 280 ламивудин-резистентных пациентов получали лечение тенофовира дизопроксил фумаратом (n=141) или эмтрицитабином плюс тенофовира дизопроксила фумарат (n=139) в течение 96 недель.
Побочные реакции с потенциальным (или, как минимум, возможным) отношением к лечению приводятся ниже по классам систем органов и частоте. В рамках каждой группы по частоте нежелательные явления приведены в порядке уменьшения серьезности. Побочные реакции по частоте определяются как: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100) и редко (от ≥1/10 000 до <1/1000).
Таблица 1. Краткие данные о побочных реакциях, связанных с приемом тенофовира дизопроксил фумаратом, на основании клинического исследования и постмаркетингового анализа
| Классы систем органов и частота | Побочные реакции |
| Нарушения со стороны обмена веществ и питания | |
| Очень часто | Г ипофосфатемия1 |
| Нечасто | Гипокалиемия1 |
| Редко | Лактатацидоз3 |
| Нарушения со стороны нервной системы | |
| Очень часто | Головокружение |
| Часто | Головная боль |
| Нарушения со стороны желудочно-кишечного тракта | |
| Очень часто | Диарея, рвота, тошнота |
| Часто | Боль в животе, вздутие живота, метеоризм |
| Нечасто | Панкреатит3 |
| Нарушения со стороны печени и желчевыводящих путей | |
| Часто | Повышенный уровень трансаминазы |
| Редко | Жировая дегенерация печени, гепатит |
| Нарушения со стороны кожи и подкожных тканей | |
| Очень часто | Высыпания |
| Редко | Ангионевротический отек |
| Нарушения со стороны скелетно-мышечной и соединительной ткани | |
| Нечасто | Рабдомиолиз1, мышечная слабость |
| Редко | Остеомаляция (проявляется как боль в костях и нечасто является одной из причин переломов)1,2, миопатия1 |
| Нарушения со стороны почек и мочевыводящих путей | |
| Нечасто | Повышенный креатинин |
| Редко | Острая почечная недостаточность, почечная недостаточность, острый тубулярный некроз, проксимальная почечная тубулопатия (в том числе синдром Фанкони), нефрит (в том числе острый интерстициальный нефрит)2, нефрогенный несахарный диабет |
| Общие расстройства и нарушения в месте введения | |
| Очень часто | Астения |
| Часто | Усталость |
Побочная реакция может возникнуть как следствие проксимальной почечной тубулопатии. Не считается, что она причинно связана с тенофовира дизопроксила фумаратом при отсутствии этого заболевания.
Побочная реакция была установлена во время постмаркетингового исследования, но не наблюдалась во время рандомизированных контролируемых исследований или программы расширенного доступа к тенофовира дизопроксила фумарату. Категория частоты была установлена по статистическим расчетам на основе общего количества пациентов, принимавших тенофовира дизопроксила фумарат в рамках рандомизированных контролируемых исследований и программы расширенного доступа (n=7319).
Для получения дополнительной информации, обратитесь к представленному ниже разделу.
Описание отдельных побочных реакций
ВИЧ-1 и гепатит В Нарушение функции почек
Поскольку препарат может привести к нарушению работы почек, рекомендуется наблюдать за функцией почек (см. разделы «Особые указания» и «Краткие данные о профиле безопасности»).
ВИЧ-1
Взаимодействие с диданозином
Одновременное применение тенофовира дизопроксила фумарата и диданозина не рекомендуется, так как это приводит к повышению системного воздействия диданозина на 40-60%, что может увеличить риск возникновения побочных реакций, связанных с диданозином (см. раздел «Взаимодействие с другими лекарственными средствами»). Редко сообщалось о случаях заболевания панкреатитом и лактат-ацидозом, иногда с летальным исходом.
Липиды, липодистрофия и метаболические отклонения
Комбинированная антиретровирусная терапия была связана с метаболическими отклонениями от нормы, такими как гипертриглицеридемия, гиперхолестеринемия, инсулиновая резистентность, гипергликемия и гиперлактатемия (см. раздел «Особые указания»).
Комбинированная антиретровирусная терапия была связана с перераспределением жиров в организме у ВИЧ-пациентов (липодистрофия), включая потерю периферического и лицевого подкожного жира, повышенное количество внутрибрюшного и висцерального жира, гипертрофию грудей и накопление жира в спинно-шейном участке (бычий горб) (см. раздел «Особые указания»).
В рамках 144-недельного контролированного клинического исследования среди пациентов, ранее не лечившихся антиретровирусными средствами, которое проводилось для сравнения тенофовира дизопроксила фумарата со ставудином в сочетании с ламивудином и эфавиренцем, было замечено, что риск липодистрофии в случае приема тенофовира дизопроксил фумарата был значительно меньше, чем при приеме ставудина. Группа приема тенофовира дизопроксил фумарата также имела значительно меньший средний показатель увеличения триглицеридов и общего уровня холестерина натощак, чем группа сравнения.
Синдром иммунной реактивации
У ВИЧ-инфицированных пациентов с тяжелой иммунной недостаточностью на момент начала комбинированной антиретровирусной терапии (combination antiretroviral therapy — CART) может возникнуть воспалительная реакция на асимптоматические или остаточные оппортунистические патогенны. Также сообщалось об аутоиммунных нарушениях (таких как болезнь Грейвса). Однако описанное время проявления более варьируемое, и эти явления могут наступить через много месяцев после начала лечения (см. раздел «Особые указания»).
Остеонекроз
Сообщалось о случаях остеонекроза, особенно относительно пациентов с общепризнанными факторами риска, развитым ВИЧ-заболеванием или продолжительным влиянием комбинированной антиретровирусной терапии (CART). Частота возникновения указанного явления неизвестна (см. раздел «Особые указания»).
Лактат-ацидоз и гепатомегалия тяжелой формы с жировой дегенерацией При применении аналогов нуклеозидов сообщалось о лактат-ацидозе, который обычно связан с жировой дегенерацией печени. Лечение аналогами нуклеозида необходимо прекратить при условии симптоматической гиперлактатемии и метаболического или молочного ацидоза, постепенно увеличивающейся гепатомегалии или быстрого повышения уровней аминотрансферазы (см. раздел «Особые указания»).
Гепатит В
Обострение гепатита во время лечения
В рамках исследований среди пациентов, которые ранее не принимали нуклеозиды, повышение уровня АЛТ во время лечения с превышением верхнего предела нормы более чем в 10 раз, и превышением начального уровня более чем в 2 раза, наблюдалось у 2,6% пациентов, получавших лечение тенофовира дизопроксил фумаратом. Повышение уровня АЛТ со средним временем до проявления, составляющим 8 недель, корректировалось при продолжительном лечении. В большинстве случаев такие повышения АЛТ были связаны с уменьшением вирусной нагрузки > 2 log10 копий/мл, которое предшествовало или совпадало с повышением АЛТ. Во время лечения рекомендуется регулярно наблюдать за функцией печени (см. раздел «Особые указания»).
Обострение гепатита после прекращения лечения
После прекращения терапии гепатита В у пациентов, инфицированных вирусом гепатита В, возникали клинические и лабораторные признаки обострения гепатита (см. раздел «Особые указания»).
Педиатрические пациенты
ВИЧ-1
Оценка побочных реакций основана на двух рандомизированных исследованиях (исследования GS-US-104-0321 и GS-US-104-0352) на 184 педиатрических пациентах, инфицированных ВИЧ-1 (возраст от 2 до 18 лет), которые получали лечение тенофовира дизопроксил фумаратом (n=93) или плацебо/активный препарат сравнения (n=91) в сочетании с другими антиретровирусными препаратами в течение 48 недель. Побочные реакции, которые наблюдались у педиатрических пациентов, лечившихся тенофовира дизопроксил фумаратом, соответствовали тем, что наблюдались в клинических исследованиях тенофовира дизопроксил фумарата у взрослых (см. разделы «Краткие данные о побочных реакциях» и «Фармакодинамика»).
Хронический гепатит В
Оценка побочных реакций основывается на одном рандомизированном исследовании (исследование GS-US-174-0115) на 106 подростках (возраст от 12 до 18 лет) с хроническим гепатитом В, которых лечили тенофовира дизопроксилом 245 мг (в форме фумарата) (n=52) или плацебо (n=54) в течение 72 недель. Побочные реакции, которые наблюдались у подростков, лечившихся тенофовира дизопроксил фумаратом, соответствовали тем, что наблюдались в клинических исследованиях тенофовира дизопроксил фумарата у взрослых (см. разделы «Краткие данные о побочных реакциях» и «Фармакодинамика»).
Уменьшение минеральной плотности костей наблюдалось у подростков, инфицированных вирусом гепатита В. Z-критерии минеральной плотности костей, наблюдаемые у субъектов, которые получали тенофовира дизопроксила фумарат, были ниже, чем эти же критерии, наблюдаемые у субъектов, которые получали плацебо (см. разделы «Особые указания» и «Фармакодинамика»).
Другие особые категории пациентов
Пациенты пожилого возраста
Исследование тенофовира дизопроксил фумарата среди пациентов в возрасте старше 65 лет не проводилось. Пациенты пожилого возраста в большей степени склонны иметь пониженную почечную функцию, поэтому во время лечения тенофовира дизопроксил фумаратом этой популяции необходимо
соблюдать осторожность (см. раздел «Особые указания»).
Пациенты с нарушением функции почек
Поскольку тенофовира дизопроксил фумарат может привести к нефротоксичности, рекомендуется внимательно контролировать функцию почек у взрослых пациентов с нарушением почечной функции, принимающих препарат (см. разделы «Способ применения и дозы», «Особые указания» и «Фармакокинетика»/ Не рекомендуется применять тенофовира дизопроксил фумарат педиатрическим пациентам с нарушением функции почек (см. разделы «Способ применения и дозы» и «Особые указания»).
Передозировка
В случае передозировки пациент должен находиться под наблюдением врача для выявления признаков токсичности. При необходимости — проводить стандартную поддерживающую терапию. Гемодиализом выводится приблизительно 10% дозы тенофовира дизопроксил фумарата. Медианное значение клиренса тенофовира составляет 134 мл/мин. Неизвестно, выводится ли тенофовир с помощью перитонеального диализа.
Взаимодействие с другими лекарственными препаратами
Исследования взаимодействия проводились только на взрослых.
На основании результатов экспериментов in vitro и известного пути выведения тенофовира возможность взаимодействий, опосредованных CYP450, при участии тенофовира и других лекарственных средств низкая.
Одновременное применение не рекомендовано
Не следует применять одновременно с другими лекарственными средствами, содержащими тенофовира дизопроксил фумарат.
Не следует применять одновременно с адефовира дипивоксилом.
Диданозин
Одновременное применение тенофовира дизопроксил фумарата и диданозина не рекомендуется (см. раздел «Особые указания» и таблицу 2).
Лекарственные средства, которые выводятся почками
Поскольку тенофовир выводится преимущественно почками, одновременное применение тенофовира дизопроксил фумарата с лекарственными препаратами, снижающими почечную функцию или конкурирующими за активную канальцевую секрецию путем транспортных белков hOAT 1, hOAT 3 или MRP 4 (например, с цидофовиром), может повышать концентрацию тенофовира в сыворотке крови и (или) лекарственных препаратов, вводимых одновременно.
Необходимо избегать применения тенофовира дизопроксил фумарата с одновременным или недавним применением нефротоксических лекарственных средств (например, аминогликозидов, амфотерицина В, фоскарнета, ганцикловира, пентамидина, ванкомицина, цидофовира и интерлейкина-2) (см. раздел «Особые указания»).
Учитывая, что такролим может влиять на функцию почек, рекомендуется тщательное наблюдение при его одновременном применении с тенофовира дизопроксил фумаратом.
Другие взаимодействия
Взаимодействия между тенофовира дизопроксил фумаратом, ингибиторами протеазы и антиретровирусными средствами, не являющимися ингибиторами протеазы, представлены ниже в Таблице 2 (увеличение обозначено <↑>, уменьшение — <↓>, отсутствие изменений — «↔», два раза в сутки — «b.i.d.» и один раз в сутки — «q.d.»).
Таблица 2. Взаимодействия между тенофовира дизопроксил фумаратом и другими лекарственными средствами
| Лекарственное средство по направлениям лечения (доза в мг) | Влияние на уровни препарата, среднее процентное изменение AUC, Сmах, Сmin | Рекомендация относительно одновременного применения с 245 мг тенофовира дизопроксила (в форме фумарата) |
| Противоинфекционные | ||
| Антиретровирусные | ||
| Ингибиторы протеазы | ||
| Атазанавир/Ритонавир (300 q.d./100 q.d./ЗОО q. d.) | Атазанавир: AUC: ↓ 25% Сmах: ↓ 28% Cmin: ↓ 26% Тенофовир: AUC: ↑ 37% Cmax: ↑ 34% Cmin: ↑ 29% | Коррекция дозы не рекомендуется. Увеличенная экспозиция к тенофовиру может усиливать связанные с тенофовиром нежелательные явления, включая почечные нарушения. Необходимо тщательно наблюдать за функцией почек (см. раздел «Особые указания»). |
| Лопинавир/ ритонавир(400 b.i.d./l 00 b.i.d./ЗОО q.d.) | Лопинавир/ритонавир.Нет существенного воздействия на фармакокинетические параметры лопинавира/ритонавира.Тенофовир:AUC: ↑ 32%Сmax: ↔Cmin: ↑ 51% | Коррекция дозы не рекомендуется. Увеличенная экспозиция к тенофовиру может усиливать связанные с тенофовиром нежелательные явления, включая почечные нарушения. Необходимо тщательно наблюдать за функцией почек (см. раздел «Особые указания»). |
| Дарунавир/ ритонавир (300/100 b.i.d./300 q.d.) | Дарунавир.Нет существенного воздействия на фармакокинетические параметры дарунавира/ритонавира.Тенофовир:AUC: ↑ 22%Cmin: ↑ 37% | Коррекция дозы не рекомендуется. Увеличенная экспозиция к тенофовиру может усиливать связанные с тенофовиром нежелательные явления, включая почечные нарушения.Необходимо тщательно наблюдать за функцией почек (см. раздел «Особые указания»). |
| Нуклеозидные ингибиторы обратной транскриптазы | ||
| Диданозин | Одновременное применение тенофовира дизопроксила фумарата и диданозина приводит к 40-60% повышению системной экспозиции к диданозину, что может увеличивать риск связанных с диданозином нежелательных явлений. Сообщалось о нечастых, иногда летальных, случаях панкреатита и лактат-ацидоза. Одновременное применение тенофовира дизопроксила фумарата и диданозина в дозе 400 мг в сутки было связано со значительным уменьшением количества клеток CD4, возможно, в связи с межклеточным взаимодействием, что повышает фосфорилированный (то’есть активный) диданозин. Уменьшенное дозирование 250 мг диданозина, который применяется одновременно с терапией тенофовира дизопроксила фумаратом, было связано с сообщениями о высокой частоте вирусологического неудачного лечения при нескольких исследованных комбинациях для лечения ВИЧ-1 инфекции. | Одновременное применение тенофовира дизопроксила фумарата и диданозина не рекомендуется (см. раздел «Особые указания»). |
| Адефовира Дипивоксил | AUC: ↔Cmax: ↔ | Тенофовира дизопроксил фумарат не следует применять одновременно с адефовира дипивоксилом (см. раздел «Особые указания»). |
| Энтекавир | AUC: ↔Cmax: ↔ | Не было клинически значимых фармакокинетических взаимодействий при одновременном применении тенофовира дизопроксил фумарата с энтекавиром. |
Исследования, проведенные с другими лекарственными средствами
Не наблюдалось клинически значимых фармакокинетических взаимодействий при одновременном применении тенофовира дизопроксил фумарата с эмтрицитабином, ламивудином, индинавиром, эфавиренцем, нелфинавиром, саквинавиром (усиленным ритонавиром), метадоном, рибавирином, рифампицином, такролимом и гормональным контрацептивом норгестиматом/этинилэстрадиолом.
Тенофовира дизопроксил фумарат следует принимать вместе с едой, поскольку пища повышает биодоступность тенофовира (см. раздел «Фармакокинетика»).
Особые указания
Перед тем, как начать терапию тенофовира дизопроксил фумаратом, следует предложить анализ на антитело к ВИЧ всем пациентам, инфицированным вирусом гепатита В (см. раздел «Одновременное инфицирование ВИЧ-1 и гепатитом В»/
Действие тенофовира дизопроксил фумарата не было исследовано у пациентов старше 65 лет. Пациенты старшего возраста имеют большую вероятность ухудшения функции почек, поэтому необходимо быть осторожным при лечении тенофовира дизопроксил фумаратом пациентов пожилого возраста.
Пациенты должны быть проинформированы об отсутствии доказательств того, что тенофовира дизопроксил фумарат предотвращает риск передачи ВИЧ другим лицам путем полового контакта или попадания в кровь. Необходимо продолжать принимать соответствующие меры предосторожности.
Препарат содержит лактозу моногидрат. Поэтому пациенты с такими редкими наследственными проблемами, как непереносимость галактозы, лактазная недостаточность Лаппа или нарушение глюкозо-галактозного всасывания, не должны принимать это лекарственное средство.
Одновременное применение с другими лекарственными средствами
— не следует применять одновременно с другими лекарственными средствами, содержащими тенофовира дизопроксил фумарат;
— не следует применять одновременно с адефовира дипивоксилом;
— не рекомендуется одновременное применение тенофовира дизопроксил фумарата и диданозина.
Одновременное применение тенофовира дизопроксил фумарата и диданозина приводит к 40-60% повышению системной экспозиции к диданозину, что может увеличивать риск связанных с диданозином нежелательных явлений (см. раздел «Взаимодействие с другими лекарственными средствами»). Сообщалось о нечастых, иногда летальных, случаях панкреатита и лактацидоза. Одновременное применение тенофовира дизопроксил фумарата и диданозина в дозе 400 мг в сутки было связано со значительным уменьшением количества клеток CD4, возможно из-за межклеточного взаимодействия, что повышает фосфорилированный (то есть активный) диданозин. Уменьшенное дозирование 250 мг диданозина, применяемого вместе с терапией тенофовира дизопроксил фумаратом, было связано с сообщениями о высокой частоте вирусологически неудачного лечения при нескольких исследованных комбинациях для лечения ВИЧ-1 инфекции.
Тройная терапия с нуклеозидами/нуклеотидами
Поступали сообщения о высокой частоте вирусологически неудачного лечения и о появлении резистентности на ранней стадии у ВИЧ-пациентов, если тенофовира дизопроксил фумарат сочетался с ламивудином и абакавиром, а также с ламивудином и диданозином по схеме введения 1 раз в сутки.
Нарушения функции почек
Тенофовир, главным образом, выводится почками. Поступали сообщения о почечной недостаточности, нарушениях функции почек, повышенном уровне креатинина, гипофосфатемии и проксимальной тубулопатии (включая синдром Фанкони) при применении тенофовира дизопроксил фумарата в клинической практике (см. раздел «Побочное действие»).
Рекомендуется проведение расчета клиренса креатинина у всех пациентов до начала лечения тенофовира дизопроксил фумаратом и наблюдение за функцией почек (клиренс креатинина и уровень фосфата в сыворотке) каждые 4 недели в течение первого года, а затем – каждые 3 месяца. Для пациентов с повышенным риском нарушения почечной функции, включая пациентов, имевших ранее почечные явления во время приема адефовира дипивоксила, следует рассмотреть необходимость проведения более частого наблюдения за функцией почек.
Если уровень фосфата в сыворотке крови <1,5 мг/дл (0,48 ммоль/л) или клиренс креатинина снижен до <50 мл/мин, для любого пациента, получающего тенофовира дизопроксил фумарат, необходимо провести повторную оценку функции почек в течение 1 недели, включая определение уровня глюкозы в крови, калия в крови и концентрации глюкозы в моче (см. раздел «Побочное действие», проксимальная тубулопатия). Следует также рассмотреть необходимость отмены лечения тенофовира дизопроксил фумаратом у пациентов со снижением клиренса креатинина до <50 мл/мин или снижением уровня фосфата в сыворотке крови до <1,0 мг/дл (0,32 ммоль/л).
Необходимо избегать применения тенофовира дизопроксил фумарата с одновременным или недавним применением нефротоксических лекарственных средств (например, аминогликозидов, амфотерицина В, фоскарнета, ганцикловира, пентамидина, ванкомицина, цидофовира и интерлейкина-2). Если одновременного применения тенофовира дизопроксил фумарата и нефротоксических средств избежать невозможно, необходимо еженедельно наблюдать за функцией почек.
Не было проведено клинических оценок тенофовира дизопроксил фумарата у пациентов, получающих лекарственные средства, которые выводятся тем же путем — почками, включая транспортные белки транспортеров органических анионов человека (human organic anion transporter — hOAT) 1 и 3 или MRP 4 (например, цидофовир — известное нефротоксическое лекарственное средство). Эти почечные транспортные белки могут быть причиной тубулярной секреции и частично почечного выведения тенофовира и цидофовира. Поэтому фармакокинетика лекарственных средств, которые выводятся тем же почечным путем, включая транспортные белки hOAT 1 и 3 или MRP 4, может изменяться в случае одновременного применения. При отсутствии крайней необходимости, одновременное применение лекарственных средств, которые выводятся одинаково почечным путем, не рекомендуется. Если такого применения избежать невозможно, следует еженедельно наблюдать за функцией почек (см. раздел «Взаимодействие с другими лекарственными средствами»).
Безопасность тенофовира для почек у пациентов с нарушением почечной функции (клиренс креатинина <80 мл/мин) исследовалась только в очень ограниченной степени.
Пациенты с клиренсом креатинина <50 мл/мин, в том числе пациенты, которым необходим гемодиализ
Данные о безопасности и эффективности действия тенофовира дизопроксил фумарата для пациентов с нарушенной функцией почек ограничены. По этой причине тенофовира дизопроксил фумарат необходимо применять, только если потенциальная польза лечения считается превышающей потенциальный риск. Применение тенофовира дизопроксил фумарата пациентам с тяжелым нарушением функции почек (клиренс креатинина <30 мл/мин) и пациентам, которым необходим гемодиализ, не рекомендуется. Если ни одно альтернативное лечение недоступно, необходимо корректировать интервал дозирования и внимательно следить за функцией почек (см. разделы «Способ применения и дозы» и «Фармакокинетика»).
Воздействие на кости
У ВИЧ-инфицированных пациентов во время 144-недельного контролированного клинического исследования, в котором сравнивали тенофовира дизопроксил фумарат со ставудином в комбинации с ламивудином и эфавиренцем у пациентов, ранее не принимавших антиретровирусные препараты, в обеих экспериментальных группах наблюдали небольшое уменьшение минеральной плотности бедренных и позвоночных костей. За 144 недели уменьшение минеральной плотности позвоночных костей и изменения биомаркеров кости по сравнению с исходными данными были значительно больше в группе, получавшей тенофовира дизопроксил фумарат. Уменьшение минеральной плотности бедренных костей было значительно больше в этой группе до 96 недель. Однако после 144 недель не наблюдалось повышенного риска переломов или признаков клинически существенных отклонений состояния костей от нормы.
Костные аномалии (которые нечасто были одной из причин переломов) могут быть связаны с проксимальной почечной тубулопатией (см. раздел «Побочное действие»). При подозрении или выявлении костных аномалий, необходимо получить соответствующие консультации.
Влияние на функцию почек и кости у детей
Наблюдение за функцией почек
Перед началом лечения необходимо провести оценку функции почек (клиренс креатинина и уровень фосфата в сыворотке), а также необходимо осуществлять наблюдение в ходе лечения, как и для взрослых (см. выше).
Управление функцией почек
Если у любого пациента детского возраста, получающего тенофовира дизопроксил фумарат, уровень фосфата в сыворотке крови определяется как <3,0 мг/дл (0,96 ммоль/л), необходимо провести повторную оценку функции почек в течение 1 недели, включая определение уровня глюкозы в крови, калия в крови и концентрации глюкозы в моче (см. раздел «Побочное действие», проксимальная тубулопатия). При подозрении аномалии со стороны почек или обнаружения таких аномалий необходимо проконсультироваться с нефрологом с целью рассмотрения необходимости отмены лечения тенофовира дизопроксил фумаратом.
Совместное применение и риск почечной токсичности
Необходимо следовать тем же рекомендациям, которые применимы для взрослых (см.выше).
Нарушение функции почек
Не рекомендуется применять тенофовира дизопроксила фумарат у детей с нарушением функции почек (см. раздел «Способ применения и дозы»).
Не следует начинать терапию тенофовира дизопроксил фумаратом у детей с нарушением функции почек, а также необходимо отменить лечение у тех пациентов детского возраста, у которых нарушение функции почек развилось в течение терапии тенофовира дизопроксил фумаратом.
Воздействие на кости
Тенофовир может стать причиной уменьшения минеральной плотности костей. Влияние изменения минеральной плотности костей, связанного с тенофовира дизопроксил фумаратом на здоровье костей в отдаленной перспективе и на риск переломов в будущем в настоящее время неизвестно (см. раздел «Фармакодинамика»).
При выявлении костных аномалий у детей или при подозрении на таковые необходимо проконсультироваться с эндокринологом и/или нефрологом.
Заболевания печени
Данные относительно безопасности и эффективности для пациентов, перенесших трансплантацию печени, очень ограничены.
Данные относительно безопасности и эффективности приема тенофовира дизопроксила фумарата для пациентов, инфицированных гепатитом В, с декомпенсированным заболеванием печени и степенью >9 по классификации Child-Pugh-Turcotte (СРТ), ограничены. Такие пациенты могут иметь более высокий риск серьезных побочных реакций со стороны печени и почек. Вследствие этого необходимо тщательно контролировать гепатобилиарные и почечные параметры у данной популяции пациентов.
Обострение гепатита
Обострение во время лечения
Спонтанные обострения хронического гепатита типа В являются относительно частыми и характеризуются временным повышением уровня аланинаминотрансферазы (АЛТ) в сыворотке крови. После начала антивирусного лечения у некоторых пациентов может повышаться уровень АЛТ в сыворотке крови (см. раздел «Побочное действие»). У пациентов с компенсированным заболеванием печени эти повышения уровня АЛТ в сыворотке крови обычно не сопровождаются повышением концентрации билирубина в сыворотке крови или печеночной декомпенсацией.
Пациенты с циррозом печени могут иметь повышенный риск печеночной декомпенсации после обострения гепатита, а потому за ними необходимо тщательно наблюдать во время лечения.
Обострение после прекращения лечения
Также сообщалось об остром приступе гепатита у пациентов, прекративших лечение гепатита В. Обострения после лечения обычно связаны с повышением ДНК вируса гепатита В, и большинство из них оказываются самоограниченными. Однако сообщалось о тяжелых обострениях, включая летальные случаи. В течение 6 месяцев после прекращения лечения гепатита В необходимо регулярно контролировать функциональное состояние печени по клиническим и лабораторным показателям. В случае необходимости может быть целесообразным возобновление лечения гепатита В. Для пациентов с развитым заболеванием печени или циррозом прекращение лечения не рекомендуется, поскольку обострение гепатита после лечения может привести к печеночной декомпенсации.
У пациентов с некомпенсированным заболеванием печени обострения гепатита особенно серьезные, а иногда летальные.
Сопутствующее инфицирование гепатитом С или D
Данные относительно эффективности тенофовира у пациентов с сопутствующим инфицированием вирусом гепатита С или D отсутствуют.
Сопутствующее инфицирование ВИЧ-1 и гепатитом В
В связи с риском развития ВИЧ-резистентности у пациентов с сопутствующим инфицированием ВИЧ/вирусом гепатита В тенофовира дизопроксила фумарат необходимо применять только как часть соответствующей антиретровирусной комбинированной схемы. Пациенты, у которых ранее были нарушения функции печени, включая хронический активный гепатит, имеют повышенную частоту нарушений функции печени во время комбинированной антиретровирусной терапии, и за ними необходимо наблюдать в соответствии со стандартной практикой. При наличии признаков ухудшения течения заболевания печени у таких пациентов следует рассмотреть вопрос о необходимости перерыва в лечении или отмене лечения. Однако необходимо отметить, что повышение уровня АЛТ может быть частью клиренса у больных вирусным гепатитом В во время лечения тенофовиром (см. выше «Обострение гепатита»).
Лактат-ацидоз
При применении аналогов нуклеозидов сообщалось о лактат-ацидозе, обычно связанном с жировой дегенерацией печени. Доклинические и клинические данные указывают на то, что риск возникновения лактат-ацидоза, эффекта влияния класса аналогов нуклеозида, для тенофовира дизопроксил фумарата является низким. Но, поскольку тенофовир структурно близок к аналогам нуклеозида, этот риск не может быть исключен. Ранние симптомы (симптоматическая гиперлактатемия) включают доброкачественные симптомы со стороны системы пищеварения (тошноту, рвоту и боль в животе), неспецифическое недомогание, потерю аппетита, потерю массы тела, респираторные симптомы (частое и (или) глубокое дыхание) или неврологические симптомы (включая двигательную слабость). Лактат-ацидоз имеет высокую летальность и может быть связан с панкреатитом, печеночной недостаточностью или почечной недостаточностью. В целом, лактат-ацидоз наблюдается после нескольких месяцев лечения.
Лечение аналогами нуклеозида должно быть прекращено при условии симптоматической гиперлактатемии и метаболического или молочного ацидоза, постепенно нарастающей гепатомегалии или быстрого повышения уровней аминотрансферазы.
Необходимо соблюдать осторожность при введении аналогов нуклеозида любому пациенту (особенно женщинам с ожирением) с гепатомегалией, гепатитом или другими известными факторами риска заболевания печени и жировой дегенерации печени (включая определенные лекарственные средства и алкоголь). Лечение альфа-интерфероном и рибавирином пациентов, имеющих сопутствующее инфицирование гепатитом С, может представлять особый риск.
Необходимо тщательное наблюдение за пациентами с повышенным риском.
Липодистрофия
У пациентов с ВИЧ-инфекцией комбинированная антиретровирусная терапия была связана с перераспределением жира в организме (липодистрофия). Отдаленные последствия этих явлений на сегодняшний день неизвестны. Данные о механизме неполные. Существует гипотеза о связи между висцеральным липоматозом и ингибиторами протеазы и липоатрофией и нуклеозидными ингибиторами обратной транскриптазы. Повышенный риск липодистрофии был обусловлен индивидуальными факторами, такими как пожилой возраст пациентов, и факторами, связанными с лекарственным средством, такими как большая продолжительность антиретровирусного лечения и вызванные этим нарушения метаболизма. Клиническое обследование должно включать оценку физических признаков перераспределения жира в организме. Следует обращать внимание на показатели липидов сыворотки крови натощак и на уровень глюкозы в крови. В случае клинической необходимости необходимо контролировать нарушение метаболизма липидов (см. раздел «Побочное действие»).
Тенофовир структурно относится к аналогам нуклеозида, поэтому нельзя исключать риск липодистрофии. Однако 144-недельные клинические данные, полученные у ВИЧ-инфицированных пациентов, которые ранее не лечились антиретровирусными средствами, указывают на то, что риск липодистрофии в случае тенофовира дизопроксил фумарата был меньше, чем при применении ставудина, если он вводился вместе с ламивудином и эфавиренцем.
Нарушения митохондриальной функции
Было показано in vitro и in vivo, что нуклеозидные и нуклеотидные аналоги приводят к поражению митохондрий различной степени. Поступали сообщения о митохондриальной дисфункции у ВИЧ-отрицательных детей раннего возраста, подвергшихся воздействию нуклеозидных аналогов in utero и (или) в постнатальный период. Основными нежелательными явлениями, о которых сообщалось, были гематологические нарушения (анемия, нейтропения) и метаболические нарушения (гиперлактатемия, гиперлипаземия). Эти явления часто носят кратковременный характер. Поступали сообщения о некоторых неврологических нарушениях, которые начинались позднее (гипертония, конвульсии, аномальное поведение). На сегодняшний день неизвестно, являются ли неврологические нарушения временными или постоянными. Любой ребенок, подвергшийся воздействию аналогов нуклеозида и нуклеотида in utero, даже ВИЧ-отрицательные дети, должен пройти клиническое и лабораторное наблюдение и полное обследование относительно возможности нарушения митохондриальной функции в случае соответствующих признаков или симптомов. Эти результаты не влияют на текущие национальные рекомендации о применении антиретровирусного лечения беременным женщинам для профилактики вертикальной передачи ВИЧ.
Синдром иммунной реактивации
У ВИЧ-инфицированных пациентов с тяжелой иммунной недостаточностью на момент введения комбинированной антиретровирусной терапии (combination antiretroviral therapy — CART) может возникнуть воспалительная реакция на асимптоматические или остаточные оппортунистические патогены, что может быть причиной серьезных клинических состояний или усиления симптомов. Как правило, такие реакции наблюдались в течение первых нескольких недель или месяцев после начала CART. Соответствующими примерами являются цитомегаловирусный ретинит, генерализованные и (или) очаговые микобактериальные инфекции и пневмония Pneumocystis jirovecii. Любые воспалительные симптомы необходимо оценивать и при необходимости назначать лечение.
Остеонекроз
Хотя этиология считается многофакторной (включая применение кортикостероидов, употребление алкоголя, тяжелое угнетение иммунитета, высокое значение индекса массы тела), о случаях остеонекроза сообщалось, в частности, относительно пациентов с развитым ВИЧ-заболеванием и (или) длительным влиянием комбинированной антиретровирусной терапии (CART). Пациентам следует порекомендовать обратиться за советом к врачу, если они испытывают боли в суставах, негибкость суставов или затруднения во время движений.
Влияние на способность к управлению автомобилем и работе с механизмами
Не проводились исследования по изучению воздействия препарата на способность к управлению автотранспортом или другими механизмами. Пациентов следует проинформировать о возможном головокружении при лечении данным препаратом.
Условия хранения
При температуре не выше 25°C.
Хранить в недоступном для детей месте.
Срок годности
года.
Не применять препарат после истечения срока годности, указанного на упаковке.
Условия отпуска
Отпуск из аптек — по рецепту врача.
Многие важные для здорового функционирования соединения присутствуют в человеческом организме или поступают в него с пищей и напитками, поэтому не требуют искусственного восполнения.
Но при различных нарушениях метаболизма тело может потребовать компенсации того или иного вещества. Одним из них является альфа-липоевая кислота, ответственная за защиту клеток от свободнорадикальной активности, нормальную утилизацию глюкозы, стабильную трофику нейронов и ряд других функций. В некоторых случаях врач может назначить дополнительный прием препаратов на основе этого соединения. Одним из них является «Тиоктацид».
Для чего назначают «Тиоктацид»?
Основным действующим веществом препарата «Тиоктацид» служит альфа-липоевая (тиоктовая) кислота. Этот витаминоподобный компонент постоянно присутствует в человеческом организме и имеет эндогенное происхождение.
Механизм ее действия схож с витаминами группы В, однако она также обладает дополнительной антиоксидантной активностью.
«Тиоктацид» регулирует углеводный и жировой обмен в организме. Препарат также оказывает защитное действие в отношении:
- сосудов;
- печени;
- нейронов.
Средство обеспечивает гипогликемическое, гипохолестеринемическое, гиполипидемическое действие, что важно для людей с сахарным диабетом, ожирением и гиперхолестеринемией. В частности, прием «Тиоктацида» обеспечивает профилактику атеросклеротических поражений сосудов, спровоцированных отложением холестериновых бляшек.
Альфа-липоевая кислота, вступая в синергию с инсулином, нормализует утилизацию глюкозы, что также полезно для пациентов с сахарным диабетом.
Вам может быть интересно: Холестерин: норма у женщин
Диабетическая гипергликемия деструктивно влияет на эндоневральный кровоток и повреждает периферические нервы. Вмешиваясь в эти процессы, «Тиоктацид» сокращает количество продуктов глюкозиляции в тканях, оптимизирует системное кровообращение и повышает антиоксидантную активность. Это способствует терапевтическому эффекту при диабетической полинейропатии.
Основными показаниями к применению «Тиоктацида» служат:
- диабетическая полинейропатия;
- алкогольная полинейропатия;
«Тиоктацид» не способен воздействовать на причину указанных проблем, особенно если они отличаются длительным и хроническим течением. Однако ее прием может стать отличным подспорьем для ускоренного выздоровления при условии прохождения традиционного лечения.
Хотите разбираться в аналогах лекарств, чтобы умело подбирать препараты на свой бюджет? Наша методичка от экспертов-провизоров «Аналоги популярных лекарств» поможет вам в этом! Получить методичку просто: подпишитесь на наши соцсети и напишите в сообщения «аналоги».
Мегаптека в соцсетях: ВКонтакте, Telegram, OK, Viber
Для чего назначают «Тиоктацид» женщинам?
Помимо указанных выше патологий и состояний, «Тиоктацид» полезно применять с целью омоложения и поддержания организма в период возрастных изменений. Также женщинам рекомендуют альфа-липоевую кислоту для восстановления фертильности при проблемах с зачатием (но сначала необходимо исключить органические заболевания репродуктивной системы). Оптимальным вариантом будет прием препарата обоими партнерами, поскольку он также способен повышать качество эякулята у мужчин.
Применение «Тиоктацида» для похудения
«Тиоктацид» широко применяют как биологически активную добавку с целью ускорения снижения веса.
Прием препарата способствует:
- снижению повышенного аппетита;
- оптимизации углеводного и липидного метаболизма;
- ускоренному выведению токсинов;
- улучшению работы эндокринной системы;
- замедлению формирования жировых отложений.
Особенно полезно принимать «Тиоктацид» при физических нагрузках, направленных на коррекцию массы тела. Выступая в качестве антикатаболитика, альфа-липоевая кислота препятствует разрушению белковых волокон – а значит, способствует росту и поддержанию мышечной ткани. Прием препарата благоприятно сказывается на восстановлении после тренировок, повышает выносливость, смягчает боли в мышцах, вызванные выделением молочной кислоты.
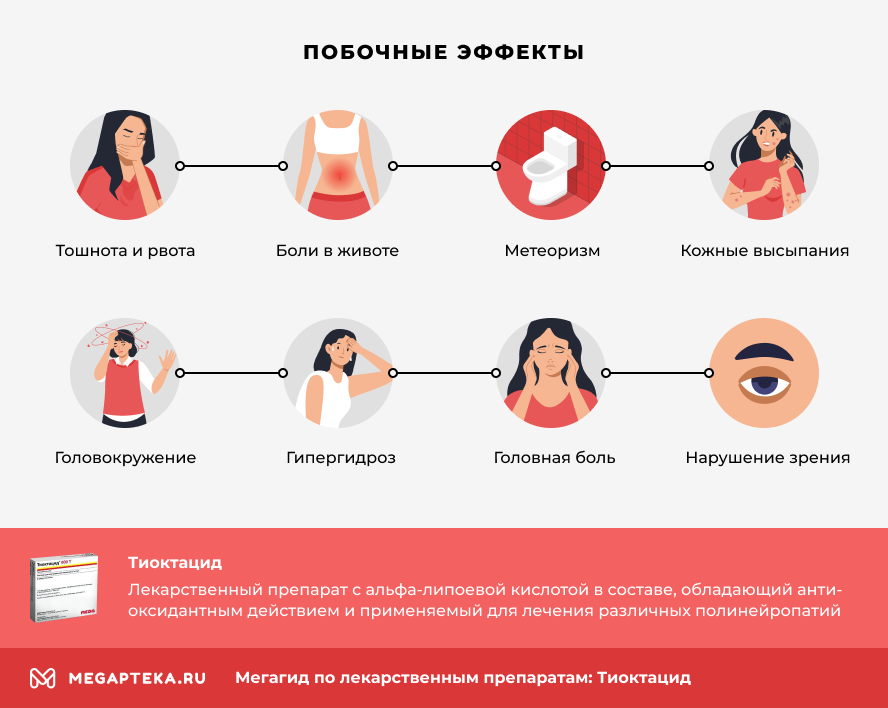
Побочные действия «Тиоктацида»
Следует отметить, что прием «Тиоктацида» противопоказан при беременности, лактации (в связи с недостаточным опытом применения), в детском и подростковом возрасте (в связи с отсутствием полных клинических данных) и при повышенной чувствительности к любому из компонентов препарата.
Побочными эффектами приема «Тиоктацида» являются:
- тошнота;
- рвота;
- боли в эпигастрии;
- метеоризм и боли в кишечнике;
- кожные высыпания и зуд;
- крапивница;
- головокружения;
- гипергидроз (избыточное потоотделение);
- головные боли;
- нарушения зрения.
Осложнения встречаются редко и связаны в основном со злоупотреблением дозировками и продолжительностью приема.
Что лучше – «Тиоктацид» или «Берлитион»?
Активное вещество и механизм действия препаратов практически не различается. Однако между препаратами существует значительное ценовое отличие: средняя стоимость «Тиоктацида» составляет 1200 рублей, а «Берлитиона» – 500 рублей.
«Тиоктацид» содержит другую соль тиоктовой кислоты – трометамоловую. «Берлитион» изготавливается на основе этилендиаминовой соли
Что лучше – «Тиоктацид» или «Октолипен»?
Как и «Берлитион», «Октолипен» представлен в виде этилендиаминовой соли альфа-липоевой кислоты. В отличие от «Тиоктацида» и «Берлитиона», он изготавливается российским производителем, поэтому его стоимость существенно ниже представленных аналогов. «Октолипен» оказывает действие, идентичное действию «Тиоктацида». Первый препарат имеет больше побочных эффектов, чем второй.
Что лучше – «Тиоктацид» или «Тиогамма»?
«Тиогамма» – препарат немецкого производства, однако, в отличие от родственного «Тиоктацида», отличается более низкой стоимостью. «Тиогамма» производится на основе меглюминовой соли тиоктовой кислоты. В плане воздействия на организм средства не имеют принципиальной разницы.
«Тиоктацид» – качественное вспомогательное средство для лечения диабетической и алкогольной полинейропатии, которое оказывает дополнительные оздоровительные и общеукрепляющие действия на организм. Альфа-липоевая кислота защищает печень, сосуды и структуры нервной системы, подавляет свободнорадикальную активность, нормализует обмен веществ. С ее помощью добиваются омоложения и похудения. Но помните, что безрецептурность и видимая безопасность препарата не отменяет побочных эффектов при самовольном приеме. К тому же, на «Тиоктацид» нельзя рассчитывать как на полноценную замену этиотропной терапии. Обсудите целесообразность приема препаратов альфа-липоевой кислоты с доктором.
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же Вы можете поделиться своим опытом с другими читателями Мегасоветов.
Тиогамма® (Thiogamma) инструкция по применению
📜 Инструкция по применению Тиогамма®
💊 Состав препарата Тиогамма®
✅ Применение препарата Тиогамма®
📅 Условия хранения Тиогамма®
⏳ Срок годности Тиогамма®
Описание лекарственного препарата
Тиогамма®
(Thiogamma)
Основано на листке-вкладыше препарата, утверждено компанией-производителем
и подготовлено для электронного издания справочника Видаль 2023 года.
Дата обновления: 2023.01.10
Владелец регистрационного удостоверения:
Контакты для обращений:
ВЕРВАГ ФАРМА ООО
(Россия)
Код ATX:
A16AX01
(Тиоктовая кислота)
Лекарственная форма
| Тиогамма® |
Таб., покр. пленочной оболочкой, 600 мг: 30, 60 или 100 шт. рег. №: ЛП-(000229)-(РГ-RU) Предыдущий рег. №: П N011140/01 |
Форма выпуска, упаковка и состав
препарата Тиогамма®
Таблетки, покрытые пленочной оболочкой, продолговатые, двояковыпуклые, с гладкой и слегка блестящей поверхностью, с одной разделительной риской на обеих сторонах, желтого цвета с возможными вкраплениями белого и темно-желтого цвета.
Вспомогательные вещества: гипромеллоза, кремния диоксид коллоидный, целлюлоза микрокристаллическая (тип PH112), лактозы моногидрат, кроскармеллоза натрия, тальк, диметикон, магния стеарат.
Состав пленочной оболочки: макрогол 6000, гипромеллоза, тальк, натрия лаурилсульфат.
10 шт. — блистеры (3) — пачки картонные.
10 шт. — блистеры (6) — пачки картонные.
10 шт. — блистеры (10) — пачки картонные.
Фармакологическое действие
Фармакодинамика
Тиоктовая кислота — эндогенный антиоксидант (связывает свободные радикалы).
В организме образуется при окислительном декарбоксилировании альфа-кетокислот.
В качестве коэнзима митохондриальных мультиферментных комплексов тиоктовая кислота участвует в окислительном декарбоксилировании пировиноградной кислоты и альфа-кетокислот. Тиоктовая кислота способствует снижению концентрации глюкозы в крови и увеличению гликогена в печени, а также снижению инсулинорезистентности.
Тиоктовая кислота участвует в регулировании липидного и углеводного обмена, влияет на обмен холестерина, улучшает функцию печени, оказывает дезинтоксикационное действие при отравлении солями тяжелых металлов и при других интоксикациях. Оказывает гепатопротекторное, гиполипидемическое, гипохолестеринемическое, гипогликемическое действие. Улучшает трофику нейронов.
При сахарном диабете тиоктовая кислота уменьшает образование конечных продуктов гликирования, улучшает эндоневральный кровоток, повышает содержание глутатиона до физиологического значения, что в результате приводит к улучшению функционального состояния периферических нервных волокон при диабетической полинейропатии.
Фармакокинетика
Всасывание и распределение
При приеме внутрь быстро и полностью всасывается в ЖКТ, одновременный прием с пищей снижает абсорбцию. Биодоступность — 30-60% вследствие эффекта «первого прохождения» через печень. Время достижения Cmax (4 мкг/мл) — около 30 мин.
Vd — 450 мл/кг.
Метаболизм и выведение
Метаболизируется в печени путем окисления боковой цепи и конъюгирования.
80-90% тиоктовой кислоты выводятся почками в виде метаболитов, в небольшом количестве тиоктовая кислота выводится в неизмененном виде. Т1/2 — 25 мин. Общий плазменный клиренс — 10-15 мл/мин.
Показания препарата
Тиогамма®
- диабетическая полинейропатия;
- алкогольная полинейропатия.
Режим дозирования
Препарат принимают внутрь, натощак, за 30 мин до завтрака, не разжевывая и запивая достаточным количеством воды.
Взрослым — по 600 мг (1 таблетка) 1 раз/сут.
В тяжелых случаях лечение начинают с назначения препаратов тиоктовой кислоты в лекарственных формах для парентерального введения в течение 2-4 недель, затем пациента переводят на лечение пероральными формами препаратов тиоктовой кислоты.
Продолжительность курса и необходимость его повторения определяются врачом.
Для пациентов пожилого возраста рекомендуется обычный режим дозирования.
Для пациентов с нарушением функции почек рекомендуется обычный режим дозирования.
Для пациентов с умеренным нарушением функций печени рекомендуется обычный режим дозирования. Данные клинических исследований и клинический опыт применения у пациентов с тяжелым нарушением функций печени недоступны. Безопасность и эффективность у пациентов с тяжелым нарушением функций печени не была установлена.
Безопасность и эффективность препарата Тиогамма® у детей и подростков в возрасте от 0 до 18 лет на данный момент не установлены. Данные отсутствуют.
Побочное действие
Частота нежелательных реакций, перечисленных ниже, определялась следующим образом: очень часто (≥1/10), часто (≥1/100 и <1/10), нечасто (≥1/1000 и <1/100), редко (≥1/10000 и <1/1000), очень редко (<1/10000, включая отдельные случаи), частота неизвестна (невозможно оценить по имеющимся данным).
Со стороны пищеварительной системы: очень редко — тошнота, рвота, абдоминальная боль, диарея.
Со стороны иммунной системы: очень редко — аллергические реакции (вплоть до развития анафилактического шока), кожная сыпь, крапивница, зуд; аутоиммунный инсулиновый синдром (АИС), клиническими проявлениями АИС могут быть: головокружение, потливость, мышечная дрожь, учащение сердцебиения, тошнота, головная боль, спутанность сознания, нарушение зрительного восприятия, потеря сознания, кома.
Со стороны нервной системы: очень редко — изменение или нарушение вкусовых ощущений.
Со стороны обмена веществ и питания: очень редко — в связи с улучшением усвоения глюкозы возможно снижение концентрации глюкозы в крови. При этом могут возникнуть симптомы гипогликемии — головокружение, повышенное потоотделение, головная боль, расстройства зрения.
Со стороны кожи и подкожной клетчатки: частота неизвестна — экзема.
Если любые из указанных выше побочных эффектов усугубляются или отмечаются любые другие побочные эффекты, пациенту необходимо сообщить об этом врачу.
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза-риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств-членов Евразийского экономического союза.
Противопоказания к применению
- повышенная чувствительность к тиоктовой кислоте или к любому из вспомогательных веществ;
- возраст до 18 лет;
- непереносимость лактозы, дефицит лактазы или глюкозо-галактозная мальабсорбция;
- беременность;
- период грудного вскармливания.
Применение при беременности и кормлении грудью
Беременность
Клинические исследования у беременных женщин не проводились. Применение препарата Тиогамма® в период беременности противопоказано.
Период лактации
Клинические исследования у кормящих женщин не проводились. Применение препарата Тиогамма® в период лактации противопоказано.
Фертильность
В доклинических исследованиях у крыс тиоктовая кислота при пероральном применении не оказывала никакого влияния на фертильность. Клинические данные о влиянии тиоктовой кислоты на фертильность отсутствуют. Сообщалось о положительном влиянии на спермограмму у бесплодных мужчин с астенотератоспермией. Каких-либо негативных эффектов в отношении фертильности для препарата Тиогамма® не ожидается.
Применение при нарушениях функции печени
Для пациентов с умеренным нарушением функций печени рекомендуется обычный режим дозирования.
Безопасность и эффективность у пациентов с тяжелым нарушением функций печени не была установлена.
Применение при нарушениях функции почек
Для пациентов с нарушением функции почек рекомендуется обычный режим дозирования.
Применение у детей
Противопоказано применение препарата в возрасте до 18 лет.
Применение у пожилых пациентов
Для пациентов пожилого возраста рекомендуется обычный режим дозирования.
Особые указания
Препарат Тиогамма® содержит лактозу (в виде моногидрата). Пациентам с непереносимостью лактозы, дефицитом лактазы, глюкозо-галактозной мальабсорбцией не следует принимать этот препарат.
У пациентов с сахарным диабетом необходим постоянный контроль концентрации глюкозы крови, особенно на начальной стадии терапии. В некоторых случаях необходимо уменьшить дозу инсулина или перорального гипогликемического препарата, чтобы избежать развития гипогликемии. При развитии гипогликемии необходимо немедленно прекратить прием препарата Тиогамма®.
При появлении симптомов повышенной чувствительности необходимо немедленно прекратить прием препарата Тиогамма®.
Пациентам, принимающим препарат Тиогамма®, следует воздержаться от употребления алкоголя, поскольку употребление алкоголя во время терапии препаратом Тиогамма® снижает лечебный эффект и является фактором риска, способствующим развитию и прогрессированию невропатии.
1 таблетка, покрытая пленочной оболочкой, препарата Тиогамма® 600 мг содержит менее 0.0041 хлебных единиц.
Описаны случаи развития аутоиммунного инсулинового синдрома (АИС) во время лечения тиоктовой кислотой. Возможность появления АИС определяется наличием у пациентов аллелей HLA-DRB1*04:06 и HLA-DRB1*04:03.
При приеме препарата не рекомендуется употребление молочных продуктов (из-за содержания в них кальция). Интервал между приемом тиоктовой кислоты и употреблением молочных продуктов должен составлять не менее 2 ч.
Одновременный прием пищи может препятствовать всасыванию тиоктовой кислоты.
Влияние на способность к управлению транспортными средствами и механизмами
Влияние приема тиоктовой кислоты на способность управлять транспортными средствами и механизмами не изучалось. Учитывая возможные нежелательные реакции (головокружение и развитие симптомов гипогликемии), необходимо соблюдать осторожность при управлении транспортными средствами и механизмами, а также при занятии потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Передозировка
Симптомы: тошнота, рвота, головная боль.
В случае приема тиоктовой кислоты в дозах от 10 до 40 г в сочетании с алкоголем наблюдались случаи интоксикации, вплоть до летального исхода.
Симптомы острой передозировки: психомоторное возбуждение или помрачение сознания, как правило, с последующим развитием генерализованных судорог и формированием лактоацидоза. Также описаны случаи гипогликемии, шока, рабдомиолиза, гемолиза, диссеминированного внутрисосудистого свертывания крови, депрессии костного мозга и мультиорганной недостаточности.
Лечение: симптоматическое. Специфического антидота нет.
Лекарственное взаимодействие
Тиоктовая кислота усиливает противовоспалительное действие ГКС.
При одновременном назначении тиоктовой кислоты и цисплатина отмечается снижение эффективности цисплатина.
Тиоктовая кислота связывает металлы, поэтому ее не следует назначать одновременно с препаратами, содержащими металлы (например, препаратами железа, магния, кальция) — интервал между приемами должен составлять не менее 2 ч.
При одновременном применении тиоктовой кислоты и инсулина или пероральных гипогликемических препаратов их действие может усиливаться.
Этанол и его метаболиты ослабляют действие тиоктовой кислоты.
Условия хранения препарата Тиогамма®
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°С.
Срок годности препарата Тиогамма®
Срок годности — 3 года. Не использовать по истечении срока, указанного на упаковке.
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
ВЕРВАГ ФАРМА ООО
(Россия)

|
|
Организация, принимающая претензии потребителей 121170 Москва, |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Аналоги препарата
Берлитион® 300
(БЕРЛИН-ФАРМА, Россия)
Липоевая кислота
(МАРБИОФАРМ, Россия)
Липоевая кислота
(УРАЛБИОФАРМ, Россия)
Октолипен®
(ФАРМСТАНДАРТ-ЛЕКСРЕДСТВА, Россия)
Октолипен®
(ФАРМСТАНДАРТ-ТОМСКХИМФАРМ, Россия)
Тиоктавексим
(АВЕКСИМА, Россия)
Тиоктацид® БВ
(MEDA PHARMA, Германия)
Тиоктовая кислота
(АТОЛЛ, Россия)
Тиоктовая кислота
(ПРОМОМЕД РУС, Россия)
Тиоктовая кислота-Ве…
(ВЕРТЕКС, Россия)
Все аналоги
Тофизопам (таблетки, 50 мг), инструкция по медицинскому применению РУ № ЛП-006234
Дата последнего изменения: 24.05.2022
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Нозологическая классификация (МКБ-10)
- Фармакологическая группа
- Лекарственная форма
- Состав
- Описание лекарственной формы
- Фармакокинетика
- Фармакодинамика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
- Отзывы
Действующее вещество
ATX
Нозологическая классификация (МКБ-10)
Список кодов МКБ-10
- F10.3 Абстинентное состояние
- F10.4 Абстинентное состояние с делирием
- F32 Депрессивный эпизод
- F33 Рекуррентное депрессивное расстройство
- F41.9 Тревожное расстройство неуточненное
- F42.0 Преимущественно навязчивые мысли или размышления
- F43.1 Посттравматическое стрессовое расстройство
- F48 Другие невротические расстройства
- G70 Myasthenia gravis и другие нарушения нервно-мышечного синапса
- G71.0 Мышечная дистрофия
- G72 Другие миопатии
- G90 Расстройства вегетативной [автономной] нервной системы
- M62.5 Истощение и атрофия мышц, не классифицированные в других рубриках
- N94.3 Синдром предменструального напряжения
- N95.1 Менопаузное и климактерическое состояние у женщин
- R07.2 Боль в области сердца
- R45.3 Деморализация и апатия
- R53 Недомогание и утомляемость
Фармакологическая группа
Лекарственная форма
Состав
1
таблетка содержит:
Действующее вещество
Тофизопам
— 50,00 мг;
Вспомогательные вещества
Лактозы
моногидрат — 91,80 мг, крахмал картофельный — 20,00 мг, целлюлоза
микрокристаллическая 101 — 9,50 мг, желатин — 3,30 мг,
кросповидон — 3,50 мг, стеариновая кислота — 1,00 мг, натрия
стеарилфумарат — 0,90 мг.
Описание лекарственной формы
Таблетки
от белого до серовато-белого цвета, круглые, плоскоцилиндрические, с фаской и
риской с одной стороны. Допускаются вкрапления серого цвета, мраморность.
Фармакокинетика
Абсорбция
При
приеме внутрь быстро и почти полностью всасывается из желудочно-кишечного
тракта (ЖКТ). Максимальная концентрация в крови (Cmax) достигается в
течение 1–1,5 часов.
Распределение
Около
50% тофизопама связывается с белками крови.
Биотрансформация
После
всасывания тофизопам подвергается значительному пресистемному метаболизму в
печени. Основным метаболическим путем является деметилирование.
Элиминация
Выводится
главным образом почками (около 60%) и в форме метаболитов через кишечник.
Период полувыведения (T1/2)
составляет 6–8 часов.
Фармакодинамика
Тофизопам
является мягким анксиолитиком с кратковременным действием и широким
терапевтическим индексом. Точный механизм действия неизвестен. Как по
химической структуре, так и по клинико-фармакологическому эффекту тофизопам
отличается от других 1,4‑бензодиазепинов.
Препарат
эффективен при лечении тревожных расстройств, в том числе сопровождающихся
вегетативными проявлениями, усталостью, апатией. В отличие от других
бензодиазепинов, тофизопам не обладает седативным, снотворным,
миорелаксирующим и противосудорожным действием. Препарат не оказывает
неблагоприятного действия на память, психомоторную и когнитивную функцию, но
обладает умеренной стимулирующей активностью.
Вследствие
отсутствия миорелаксирующего эффекта препарат может применяться и у пациентов с
миопатией, миастенией и нейрогенными атрофиями мышц, при которых применение
миорелаксантов противопоказано или нежелательно. При длительном применении
тофизопам не вызывает развитие физической или психической зависимости.
Показания
Лечение
психических (невротических) и психосоматических расстройств, сопровождающихся
эмоциональным напряжением, беспокойством, вегетативными расстройствами,
апатией, усталостью и подавленным настроением.
Алкогольный
абстинентный синдром.
Противопоказания
—
Гиперчувствительность
к тофизопаму, другим производным группы бензодиазепина, а также другим
компонентам препарата.
—
Детский возраст
до 18 лет.
—
Беременность.
—
Период грудного
вскармливания.
—
Состояния,
сопровождающиеся выраженным психомоторным возбуждением, агрессией или
выраженной депрессией.
—
Декомпенсированная
дыхательная недостаточность.
—
Синдром
обструктивного апноэ.
—
Кома.
—
Одновременное
применение с такролимусом, сиролимусом, циклоспорином.
—
Дефицит лактазы,
непереносимость лактозы, глюкозо-галактозная мальабсорбция (препарат содержит
лактозы моногидрат).
С осторожностью
Не
декомпенсированная хроническая дыхательная недостаточность, острая дыхательная
недостаточность в анамнезе, закрытоугольная глаукома, эпилепсия, органические
поражения головного мозга (например, атеросклероз).
Пожилые
пациенты и пациенты с нарушением функции печени или почек. Совместное
применение с опиоидами.
Применение при беременности и кормлении грудью
Применение
препарата во время беременности и в период грудного вскармливания
противопоказано.
Способ применения и дозы
Обычно
рекомендуемая доза: 1–2 таблетки от 1 до 3 раз в день (общая суточная доза от
50 до 300 мг).
При
нерегулярном применении можно принять 1–2 таблетки.
Максимальная
доза составляет 300 мг.
Постепенное
повышение дозы обычно не требуется — лечение можно начинать с необходимой дозы,
т.к. препарат хорошо переносим и во время его приема обычно не наблюдается
уменьшение активности и психического бодрствования.
Особые группы пациентов
Информация
об особых группах пациентов отсутствует. Клинических исследований, изучающих
эффективность и безопасность тофизопама у пожилых, у пациентов с почечной и
печеночной недостаточностью не проводилось.
Дети
Применение
у детей и подростков до 18 лет противопоказано. Отсутствует опыт применения
препарата у детей и подростков до 18 лет.
Способ применения
Для
приема внутрь.
Побочные действия
Нарушения со стороны желудочно-кишечного тракта
Снижение
аппетита, запор, повышенное отделение газов, тошнота, сухость во рту. В
отдельных случаях возможна застойная желтуха.
Нарушения со стороны центральной нервной системы
Могут
наблюдаться головная боль, бессонница, повышенная раздражимость, возбуждение,
психомоторное возбуждение, спутанность сознания, могут возникать судорожные
припадки у больных эпилепсией.
Нарушения со стороны иммунной системы
Экзантема,
скарлатиноподобная экзантема, зуд.
Нарушения со стороны опорно-двигательного аппарата
Напряжение
мышц, боль в мышцах.
Нарушения со стороны дыхательной системы, органов грудной
клетки и средостения
Угнетение
дыхания.
Взаимодействие
Концентрация
в плазме крови препаратов, которые метаболизируются изоферментом CYP3A4, может
увеличиться при одновременном приеме с тофизопамом, поэтому одновременное
применение такролимуса, сиролимуса, циклоспорина и тофизопама противопоказано.
Применение
тофизопама с препаратами, оказывающими угнетающее действие на ЦНС (анальгетики,
средства общей анестезии, антидепрессанты, седативные, снотворные), H1‑гистаминовых
рецепторов блокаторами, антипсихотическими, усиливает их эффекты (например,
седативный эффект или угнетение дыхания).
Опиоиды.
Совместное применение лекарственных средств с седативным действием, таких как
бензодиазепины или подобные им препараты, такие как тофизопам, с опиоидами
повышает риск седации, угнетения дыхания, комы и смертельного исхода в связи с
аддитивным угнетающим эффектом этих препаратов на ЦНС. Дозы и продолжительность
совместного применения таких препаратов должны быть ограничены.
Индукторы
печеночных ферментов (алкоголь, никотин, барбитураты, противоэпилептические
средства) могут усилить метаболизм тофизопама, что может привести к снижению
его концентрации в плазме крови и ослаблению терапевтического эффекта.
Некоторые
противогрибковые препараты (кетоконазол, итраконазол) могут замедлить
печеночный метаболизм тофизопама, что приводит к увеличению его концентрации в
плазме крови.
Некоторые
гипотензивные препараты (клонидин, блокаторы «медленных» кальциевых каналов)
могут усилить эффекты тофизопама. β‑адреноблокаторы могут замедлить
метаболизм препарата, однако этот эффект не имеет
клинического значения.
Дигоксин:
тофизопам может повысить концентрацию дигоксина в плазме крови.
Варфарин:
бензодиазепины могут повлиять на антикоагулянтный эффект варфарина.
Дисульфирам:
длительное применение дисульфирама может угнетать метаболизм тофизопама.
Антацидные
средства по-разному влияют на всасывание тофизопама. Циметидин и омепразол
угнетают метаболизм тофизопама.
Пероральные
контрацептивные средства могут снижать интенсивность метаболизма тофизопама.
Алкоголь:
тофизопам ослабляет угнетающее действие алкоголя на перцепцию.
Передозировка
Симптомы
Эффекты
подавления функции центральной нервной системы (ЦНС) проявляются только после
приема высоких доз (50–120 мг/кг веса тела). Такие дозы могут вызвать
рвоту, спутанное сознание, кому, угнетение дыхания и/или эпилептические
припадки.
Лечение
При
выраженном подавлении функций ЦНС не рекомендуется вызывать рвоту. Промыть
желудок. Введение активированного угля помогает уменьшить всасывание препарата.
Следует постоянно следить за основными физиологическими параметрами и применять
соответствующую симптоматическую терапию. При угнетении дыхания можно проводить
искусственную вентиляцию легких. Введение стимуляторов ЦНС не рекомендуется.
Гипотензию лучше всего устранять в/в введением жидкостей и переводом
пациента в положение Тренделенбурга. Если эти меры не восстанавливают
нормальное артериальное давление (АД), можно ввести дофамин или
норадреналин. Диализ и вызванный диурез не эффективны.
В
качестве антагониста можно ввести Флумазенил, однако его применение при
передозировке тофизопамом клинически не протестировано.
Особые указания
Необходима
особая осторожность при лечении пациентов с компенсированной хронической
дыхательной недостаточностью или ранее перенесших острую дыхательную
недостаточность.
Осторожность
необходима при лечении пожилых пациентов и лиц с психической деградацией, а
также имеющих нарушения функции почек и/или печени, т.к. у них чаще, чем у
других пациентов, наблюдаются нежелательные реакции препарата.
При
сочетании препарата тофизопама с препаратами, подавляющими функцию ЦНС
(антидепрессанты, седативные, снотворные, опиоидные анальгетики, средства общей
анестезии), антигистаминными препаратами, антипсихотическими, алкоголем
возможно усиление взаимных эффектов.
Не
рекомендуется применять препарат при хроническом психозе, фобии или навязчивых
состояниях. При уменьшении торможения возрастает риск суицидальных попыток и
агрессивного поведения. Поэтому тофизопам не рекомендуется
в качестве монотерапии депрессии или депрессии, сопровождающейся с тревогой.
Необходима
осторожность при лечении пациентов с расстройствами личности (психопатии).
Препарат
следует применять с повышенной осторожностью при органических поражениях
головного мозга (например, при атеросклерозе).
У
пациентов с эпилепсией препарат тофизопама может провоцировать судорожные
припадки.
Не
рекомендуется применять этот препарат пациентам с закрытоугольной глаукомой.
Риск при совместном применении с опиоидами
Совместное
применение препарата тофизопама с опиоидами повышает риск седации, угнетения
дыхания, комы и смертельного исхода. В связи с повышенным риском совместное
применение седативных препаратов возможно лишь у пациентов, для которых
невозможно применение альтернативных методов лечения. Если принято решение об
одновременном назначении препарата тофизопама с другими седативными
лекарственными средствами, следует использовать самые низкие эффективные дозы,
а продолжительность лечения должна быть как можно короче. Таким пациентам
необходим тщательный контроль симптомов угнетения дыхания и седации. В связи с
этим настоятельно рекомендуется ознакомить пациентов и ухаживающих за ними лиц
(при наличии таковых) о симптомах угнетения дыхания и седации.
Влияние на способность управлять
транспортными средствами, механизмами
В
период применения препарата запрещено вождение транспортных средств и/или
работа со сложными механизмами, требующими повышенной концентрации внимания.
Форма выпуска
Таблетки
50 мг.
По
10 таблеток в блистер из пленки ПВХ/ПВДХ или ПВХ/ПВДХ/ПВХ и фольги алюминиевой.
По
2 или 6 блистеров вместе с инструкцией по применению в пачку картонную.
Условия отпуска из аптек
Условия хранения
Хранить
в оригинальной упаковке (в пачке) при температуре не выше 25 °C.
Хранить
в недоступном для детей месте.
Срок годности
5
лет.
Не
использовать по истечения срока годности.
Дата обновления: 26.06.2023
Заказ в аптеках
Выбор региона:
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Отзывы
Прочитайте все отзывы и оставьте свой
ТОЛОФИТИН — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер
ЛСР-004880/09
Торговое наименование препарата
Толокнянки экстракт
Международное непатентованное наименование
Толокнянки обыкновенной листья
Лекарственная форма
таблетки покрытые оболочкой
Состав
|
Состав на одну таблетку. |
|
|
Активного компонента |
|
|
Толокнянки экстракта сухого |
-0,050 г |
|
с содержанием суммы феноло- |
|
|
гликозидов в пересчете на |
|
|
арбутин и абсолютно сухое |
|
|
вещество не менее 25 % |
|
|
Вспомогательных веществ ядра |
— до по- |
|
[сахар молочный (лактоза), |
лучения |
|
крахмал картофельный, |
таблетки |
|
поливинилпирролидон |
без обо- |
|
низкомолекулярный медицинский |
лочки |
|
(повидон), магния стеарат] |
массой |
|
0,2 г |
|
|
Вспомогательных веществ |
— до по- |
|
оболочки |
лучения |
|
[оксипропилметилцеллюлоза |
таблетки, |
|
(гипромеллоза), макрогол 6000 |
покры- |
|
(полиэтиленгликоль 6000), |
той обо- |
|
краситель азорубин |
лочкой, |
|
(кислотный красный 2С), титана |
массой |
|
двуокись пигментная (титана |
0,222 г |
|
диоксид)] |
Описание
Таблетки двояковыпуклой формы, покрытые оболочкой, темно-красного цвета с фиолетовым оттенком.
Фармакотерапевтическая группа
Диуретическое средство растительного происхождения
Код АТХ
G04BX
Фармакодинамика:
Оказывает антисептическое, противовоспалительное и диуретическое действие, стимулирует процессы регенерации, обладает мембраностабилизирующими и антиоксидантными свойствами.
Показания:
Воспалительные заболевания мочевого пузыря и мочевыводящих путей (пиелонефриты, циститы, уретриты).
Противопоказания:
Повышенная чувствительность к компонентам препарата, острая почечная и печеночная недостаточность, острый гломерулонефрит, беременность, период лактации, возраст до 18 лет.
С осторожностью:
С осторожностью — при гломерулонефритах (возможно раздражение почечной паренхимы).
Способ применения и дозы:
Внутрь, по 1-2 таблетке 3 раза в день после еды. Продолжительность курса 7-14 дней. Повторный курс — через 3 месяца по рекомендации врача. ;
Побочные эффекты:
При приеме больших доз препарата или при его длительном применении может наблюдаться обострение воспалительных заболеваний почек в результате длительного раздражения почечных канальцев.
Возможны аллергические реакции, тошнота, рвота, диарея; окрашивание мочи в темно-зеленый цвет.
Взаимодействие:
Не описано.
Форма выпуска/дозировка:
Таблетки, покрытые оболочкой.
Упаковка:
По 10 таблеток в контурную ячейковую упаковку; 1 или 3 контурных ячейковых упаковки вместе с инструкцией по применению помещают в пачку из картона.
Условия хранения:
В сухом, защищенном от света месте, при температуре не выше 25 °С.
Хранить в недоступном для детей месте.
Срок годности:
3 года.
Не применять препарат по истечении срока годности, указанного на упаковке.
Условия отпуска
Без рецепта
Производитель
Закрытое акционерное общество «ВИФИТЕХ» (ЗАО «ВИФИТЕХ»), Московская обл., Серпуховский муниципальный район, городске поселение Оболенск, район рабочего поселка Оболенск, шоссе Оболенское, стр. 20, Россия
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
ЗАО «ВИФИТЕХ»
Купить ТОЛОФИТИН в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)