Приорикс® (Priorix®) инструкция по применению
📜 Инструкция по применению Приорикс®
💊 Состав препарата Приорикс®
✅ Применение препарата Приорикс®
📅 Условия хранения Приорикс®
⏳ Срок годности Приорикс®
Описание лекарственного препарата
Приорикс®
(Priorix®)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для электронного издания справочника Видаль 2011
года, дата обновления: 2022.04.04
Код ATX:
J07BD52
(Вирус кори в комбинации с вирусами паротита и краснухи, живые ослабленные)
Лекарственная форма
| Приорикс® |
Лиофилизат д/пригот. р-ра д/п/к и в/м введения 1 доза: фл. 1 шт. в компл. с растворителем и иглами д/и рег. №: П N015888/01 |
Форма выпуска, упаковка и состав
препарата Приорикс®
Лиофилизат для приготовления раствора для п/к и в/м введения в виде однородной пористой массы от белого с оттенком до бледно-розового цвета; приложенный растворитель — прозрачная бесцветная жидкость без видимых механических включений; восстановленный препарат — прозрачный или слабо опалесцирующий раствор от чистого розово-оранжевого до розового цвета.
Вспомогательные вещества: лактоза — 32 мг, сорбитол — 9 мг, маннитол — 8 мг, аминокислоты — 9 мг.
Растворитель: вода д/и — 0.5 мл.
1 доза — флаконы из прозрачного стекла (1) в комплекте с 1 шприцем (с растворителем), 1 иглой д/и (в отдельном пластиковом контейнере с канюлей, закрытой пластиковым колпачком) — блистеры (1) — пачки картонные.
1 доза — флаконы из прозрачного стекла (1) в комплекте с 1 шприцем (с растворителем), 2 иглами д/и (в отдельных пластиковых контейнерах с канюлями, закрытыми пластиковыми колпачками) — блистеры (1) — пачки картонные.
Примечания.
1. Вакцина содержит следовые количества неомицина сульфата.
2. Номинальный титр вируса соответствует минимальному титру, гарантируемому производителем на дату окончания срока годности. Содержание вируса в одной прививочной дозе на момент выпуска препарата может отличаться и превышать минимальный титр, указанный в составе.
3. ТЦД50 — доза, инфицирующая 50% клеток монослоя.
Фармакологическое действие
Живая комбинированная аттенуированная вакцина против кори, эпидемического паротита и краснухи. Аттенуированные вакцинные штаммы вируса кори (Schwarz), эпидемического паротита (RIT 4385, производный Jeryl Lynn) и краснухи (Wistar RA 27/3) культивируются раздельно в культуре клеток куриного эмбриона (вирусы кори и паротита) и диплоидных клетках человека (вирус краснухи).
Клинические исследования показали высокую эффективность вакцины Приорикс®. Антитела к вирусу кори были обнаружены у 98% привитых, к вирусу эпидемического паротита у 96.1% и к вирусу краснухи у 99.3%. Через год после прививки у всех серопозитивных лиц сохранялся защитный титр антител к вирусу кори и вирусу краснухи и у 88.4% — к вирусу паротита.
Определенная степень защиты от заболевания корью может быть достигнута при введении вакцины неиммунизированным лицам в течение 72 ч после их контакта с больным корью.
Фармакокинетика
Данные о фармакокинетике препарата Приорикс® не предоставлены.
Показания препарата
Приорикс®
- профилактика кори, эпидемического паротита и краснухи с возраста 12 месяцев.
Режим дозирования
Вакцину вводят п/к в дозе 0.5 мл; допускается в/м введение вакцины. Не допускается в/в введение вакцины!
В соответствии с Календарем профилактических прививок России Приорикс® вводят детям в возрасте 12 месяцев с последующей ревакцинацией в возрасте 6 лет. Кроме того, Приорикс® можно вводить девочкам в 13 лет, ранее не привитым или получившим только 1 прививку моновалентными или комбинированными вакцинами против кори, краснухи и эпидемического паротита.
Правила приготовления раствора
Непосредственно перед применением во флакон с препаратом вносят содержимое прилагаемого шприца или ампулы с растворителем из расчета 0.5 мл на 1 дозу. Флакон тщательно встряхивают до полного растворения. Время растворения препарата не должно превышать 1 мин. Растворенный препарат представляет собой прозрачную жидкость от светло-оранжевого до светло-красного цвета. Если раствор выглядит иначе или имеются посторонние частицы, вакцину не используют.
Для введения препарата следует использовать новую стерильную иглу. При использовании вакцины в многодозовой упаковке для забора препарата каждый раз следует использовать новый шприц и иглу.
Растворенный препарат в многодозовой упаковке следует использовать в течение рабочего дня (в течение не более 8 ч) при условии хранения его в холодильнике (при температуре от 2° до 8°С). Препарат следует извлекать из флакона при строгом соблюдении правил асептики.
Ни при каких обстоятельствах вакцину Приорикс® не вводят в/в.
Побочное действие
Определение частоты побочных реакций: очень часто (≥10%), часто (≥1%, <10%), иногда (≥0.1%, <1%), редко (≥0.01%, <0.1%), очень редко (<0.01%).
Профиль безопасности вакцины основан на данных, полученных для 12 000 человек, получавших вакцину в рамках клинических исследований. События активно регистрировались в течение 42 дней после вакцинации.
Инфекции: часто — инфекций верхних дыхательных путей; иногда — средний отит.
Со стороны системы кроветворения: иногда — лимфаденопатия.
Со стороны пищеварительной системы: иногда — увеличение околоушных желез, диарея, рвота, анорексия.
Со стороны ЦНС: иногда — необычный плач, нервозность, бессонница; редко — фебрильные судороги.
Со стороны дыхательной системы: иногда — кашель, бронхит.
Дерматологические реакции: часто — сыпь.
Со стороны иммунной системы: редко — аллергические реакции.
Со стороны органа зрения: иногда — конъюнктивит.
Местные реакции: очень часто — покраснение в месте инъекции; часто — болезненность и отек в месте инъекции.
Общие реакции: очень часто — повышение температуры (ректальная ≥38°С; подмышечная впадина/ротовая полость: ≥37.5°С); часто — повышение температуры повышение температуры (ректальная ≥39.5°С; подмышечная впадина/ротовая полость >39°С).
В целом, профиль нежелательных реакций был сходным после введения первой дозы вакцины и ревакцинации. Однако болезненность в месте инъекции наблюдалась в 1-10% случаев после первой, вакцинации, а после ревакцинации — более чем в 10% случаев.
В условиях массовой вакцинации были зарегистрированы следующие нежелательные реакции, находящиеся во временной связи в связи с введением вакцины.
Инфекции: менингит.
Со стороны системы кроветворения: тромбоцитопения, тромбоцитопеническая пурпура.
Со стороны ЦНС: поперечный миелит, острый первичный идиопатический полиневрит (синдром Гийена-Барре), периферический неврит, энцефалит.
Дерматологические реакции: многоформная эритема.
Со стороны иммунной системы: анафилактические реакции.
Со стороны костно-мышечной системы: артралгия, артрит.
Со стороны организма в целом: синдром Кавасаки.
Об энцефалитах сообщалось с частотой менее 1 случая на 10 млн. доз, что значительно ниже, чем при естественных, заболеваниях (корь: 1/1000-1/2000; краснуха: 1/6000).
В редких случаях не исключены состояния, напоминающие паротит с укороченным инкубационным периодом. В отдельных случаях отмечался преходящий болезненный кратковременный отек яичек.
В отдельных случаях у привитых отмечалось развитие кореподобного синдрома.
Случайное в/в введение может вызвать тяжелые реакции, даже шок. В таких случаях требуется соответствующая неотложная медицинская помощь.
Противопоказания к применению
- первичный и вторичный иммунодефициты (однако препарат можно применять у лиц с бессимптомной ВИЧ-инфекцией, а также у больных СПИД);
- острые заболевания и обострения хронических заболеваний (при нетяжелых ОРВИ, острых кишечных заболеваниях допускается вакцинация сразу же после нормализации температуры);
- беременность;
- аллергические реакции на предшествующее введение препарата;
- повышенная чувствительность к неомицину, любому другому ингредиенту вакцины и куриным яйцам (однако наличие в анамнезе контактного дерматита, вызванного неомицином, и аллергической реакции на куриные яйца неанафилактического характера не является противопоказанием к прививке).
Применение при беременности и кормлении грудью
Вакцина Приорикс® противопоказана к применению при беременности.
Возможно применение вакцины в период грудного вскармливания после оценки предполагаемой пользы и потенциального риска.
Вакцинацию женщин детородного возраста проводят при отсутствии беременности и только в том случае, если женщина согласна предохраняться от зачатия в течение 3 мес после вакцинации.
Особые указания
Необходимо соблюдать осторожность при введении вакцины лицам с аллергическими заболеваниями и судорогами в личном и семейном анамнезе. Следует учитывать, что после введения вакцины в связи с возможным риском развития аллергических реакций немедленного типа пациент должен находиться под наблюдением врача в течение 30 мин. Места проведения вакцинации должны быть обеспечены средствами противошоковой терапии, в т.ч. раствором эпинефрина (адреналина) 1:1000.
Перед введением вакцины следует убедиться, что спирт или другой дезинфицирующий агент испарился с поверхности кожи и пробки флакона, т.к. эти вещества могут инактивировать аттенуированные вирусы в составе вакцины.
Передозировка
В настоящее время о случаях передозировки препарата Приорикс® не сообщалось.
Лекарственное взаимодействие
Вакцину Приорикс® можно вводить одновременно (в один день) с АКДС и АДС вакцинами, живой и инактивированной полиомиелитной вакциной, вакциной против Haemophilus influenzae тип b, вакциной против гепатита В при условии инъекции препаратов разными шприцами в разные участки тела. Другие живые вирусные вакцины назначают с интервалом не менее 1 мес.
Приорикс® не следует смешивать с другими вакцинами в одном шприце.
Приорикс® можно применять для проведения повторной прививки у лиц, ранее вакцинированных другой комбинированной вакциной против кори, паротита и краснухи или соответствующими монопрепаратами.
При необходимости постановки туберкулиновой пробы она должна быть проведена или одновременно с вакцинацией или через 6 недель после нее, поскольку коревой (а возможно и паротитный) вакцинальный процесс может вызвать временное снижение чувствительности кожи к туберкулину, что послужит причиной ложного отрицательного результата.
Условия хранения препарата Приорикс®
Вакцину в комплекте с растворителем следует хранить и транспортировать при температуре от 2° до 8°С.
Вакцину, упакованную отдельно от растворителя, следует хранить и транспортировать при температуре от 2° до 8°С.
Растворитель, упакованный отдельно от вакцины, следует хранить и транспортировать при температуре от 2° до 25°С; замораживание растворителя не допускается.
Вакцину и растворитель следует хранить в недоступном для детей месте.
Срок годности препарата Приорикс®
Срок годности вакцины — 2 года, срок годности растворителя — 5 лет.
Условия реализации
Вакцина отпускается по рецепту.
ГЛАКСОСМИТКЛЯЙН ТРЕЙДИНГ АО
(Россия)

|
|
125167 Москва |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Приорикс — инструкция по применению
Синонимы, аналоги
Статьи
Вакцина против кори, паротита и краснухи живая культуральная
Регистрационный номер:
П N015888/01.
Торговое наименование препарата:
Приорикс® / Priorix® (Вакцина против кори, паротита и краснухи живая культуральная).
Группировочное наименование:
вакцина для профилактики кори, краснухи и паротита.
Лекарственная форма:
лиофилизат для приготовления раствора для подкожного и внутримышечного введения.
Состав
1 прививочная доза (0,5 мл) содержит:
| Наименование компонентов | Количество1 |
| Действующие вещества | |
| Живой аттенуированный вирус кори (штамм Schwarz), выращенный в культуре клеток куриных эмбрионов | не менее 3,0 lg ТЦД502 |
| Живой аттенуированный вирус паротита (штамм RIT 4385), выращенный в культуре клеток куриных эмбрионов | не менее 3,7 lg ТЦД50 |
| Живой аттенуированный вирус краснухи (штамм Wistar RA 27/3), выращенный в диплоидной культуре клеток человека MRC-5 | не менее 3,0 lg ТЦД50 |
| Вспомогательные вещества | |
| Лактоза | 32 мг |
| Сорбитол | 9 мг |
| Маннитол | 8 мг |
| Аминокислоты | 9 мг |
| Неомицина сульфат | не более 25 мкг |
| Растворитель | |
| Вода для инъекций | 0,5 мл |
Примечание:
- Номинальный титр вируса. Соответствует минимальному титру, гарантируемому производителем на дату окончания срока годности. С целью компенсации снижения титра вируса в течение срока годности препарата в состав введен избыток: на момент выпуска препарата 1 прививочная доза содержит не менее 3,5 lg ТЦД50 живого аттенуированного вируса кори (штамм Schwarz), не менее 4,3 lg ТЦД50 живого аттенуированного вируса паротита (штамм RIT 4385), не менее 3,5 lg ТЦД50 живого аттенуированного вируса краснухи (штамм Wistar RA 27/3).
- ТЦД50 – тканевая цитопатогенная доза, вызывающая гибель 50 % клеток монослоя.
Описание
Лиофилизат: однородная пористая масса от белого до слегка розового цвета.
Растворитель: прозрачная бесцветная жидкость, без запаха, свободная от видимых примесей.
Восстановленный раствор препарата: прозрачная жидкость от розово-оранжевого до розового цвета; видимые механические включения должны отсутствовать.
Характеристика препарата
Приорикс® – лиофилизированный комбинированный препарат аттенуированных вакцинных штаммов вируса кори (Schwarz), эпидемического паротита (RIT 4385, производный Jeryl Lynn) и краснухи (Wistar RA 27/3), культивируемых раздельно в культуре клеток куриных эмбрионов (вирусы кори и паротита) и диплоидных клетках человека (вирус краснухи). Приорикс® соответствует требованиям Всемирной организации здравоохранения по производству биологических препаратов, требованиям к вакцинам против кори, эпидемического паротита, краснухи и живым комбинированным вакцинам.
Иммунологические свойства
Клинические испытания вакцины Приорикс® показали высокую эффективность препарата. Антитела к вирусу кори были обнаружены у 98 %, к вирусу эпидемического паротита у 96,1 % и к вирусу краснухи у 99,3 % вакцинированных. Через год после прививки у всех серопозитивных лиц сохранялся защитный титр антител к вирусу кори и вирусу краснухи и 88,4 % к вирусу паротита.
Определенная степень защиты от заболевания корью может быть достигнута при введении вакцины неиммунным лицам в течение 72 час после их контакта с больным корью.
Показания к применению
Профилактика кори, эпидемического паротита и краснухи с 12-месячного возраста.
Противопоказания
- Симптомы аллергической реакции после введения вакцин для профилактики кори, паротита и/или краснухи в анамнезе;
- повышенная чувствительность к неомицину, любому другому ингредиенту вакцины и куриным яйцам; вместе с тем наличие в анамнезе контактного дерматита, вызванного неомицином, и аллергической реакции на куриные яйца неанафилактического характера не являются противопоказанием к прививке;
- первичный и вторичный иммунодефициты. Примечание: препарат может быть введен лицам с бессимптомной ВИЧ-инфекцией, а также больным СПИД;
- беременность;
- вакцинация откладывается до окончания острых проявлений заболевания и обострения хронических заболеваний. При нетяжелых ОРВИ, острых кишечных заболеваниях и др. прививки допускается проводить сразу же после нормализации температуры.
Применение при беременности и в период грудного вскармливания
Беременность
Беременных женщин нельзя вакцинировать препаратом Приорикс®.
В то же время при применении вакцин для профилактики кори, паротита или краснухи у беременных женщин не задокументировано случаев повреждения плода.
Даже в случаях, когда невозможно исключить теоретический риск, не было зарегистрировано ни одного случая синдрома врожденной краснухи среди 3 500 женщин, которые во время вакцинации препаратами, содержащими краснушный компонент, находились на ранних сроках беременности, при этом они не знали о наступившей беременности. Непреднамеренная вакцинация женщин, неосведомленных о наступившей беременности, препаратами, содержащими коревой, паротитный и краснушный компоненты, не является показанием для прерывания беременности.
Не следует допускать наступления беременности в течение 1 месяца после вакцинации. Женщинам, планирующим беременность, следует рекомендовать отложить наступление беременности.
Период грудного вскармливания
Данные о применении у женщин, кормящих грудью, отсутствуют. Кормящие женщины могут быть привиты, если польза от вакцинации преобладает над возможным риском.
Способ применения и дозы
Способ введения
Приорикс® вводят подкожно, допускается внутримышечное применение препарата.
Приорикс® нельзя вводить внутрисосудисто.
Растворитель и восстановленный препарат перед использованием необходимо визуально проверить на отсутствие механических включений и/или изменение внешнего вида. В случае их обнаружения следует отказаться от применения растворителя или восстановленного препарата.
Восстановленный препарат представляет собой прозрачную жидкость от розово-оранжевого до розового цвета, видимые включения должны отсутствовать.
Вакцину Приорикс® нельзя смешивать в одном шприце с другими вакцинами.
Непосредственно перед применением во флакон с препаратом вносят содержимое прилагаемого шприца или ампулы с растворителем из расчета 0,5 мл на 1 дозу. Для введения препарата должна быть использована новая стерильная игла.
Приготовление вакцины перед введением с использованием растворителя в ампуле
Вакцину Приорикс® необходимо восстановить путем добавления полного объема растворителя из ампулы во флакон, содержащий лиофилизат. После добавления растворителя к лиофилизату хорошо встряхнуть образовавшуюся смесь до полного растворения лиофилизата в растворителе (не более 1 минуты). После восстановления вакцину необходимо незамедлительно ввести. Для введения вакцины следует использовать новую иглу. Для введения извлекают из флакона с восстановленной вакциной все его содержимое.
Приготовление вакцины перед введением с использованием растворителя в шприце
Вакцину Приорикс® необходимо восстановить путем добавления полного объема растворителя из предварительно наполненного шприца во флакон, содержащий лиофилизат.
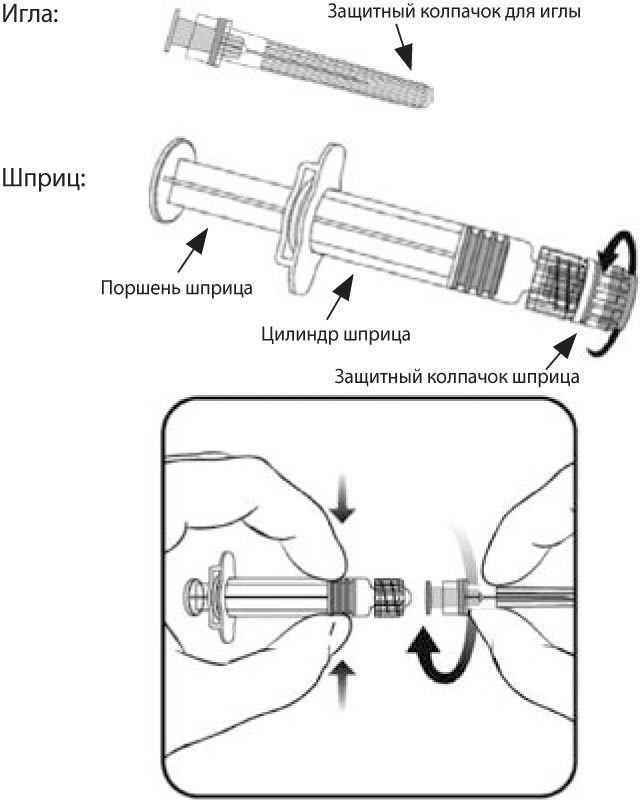
Внимание! Упаковка вакцины Приорикс® может быть представлена двумя типами шприцев, различающихся по способу соединения иглы с носиком шприца.
Для правильного выбора способа соединения иглы и шприца, следуйте представленным ниже инструкциям:
Шприц 1 типа
Рисунок 1.
Инструкция по подготовке шприца 1 типа (рисунок 1) к использованию:
- Открутите защитный колпачок шприца, поворачивая его против часовой стрелки (при этом следует удерживать шприц за цилиндр, избегая контакта с поршнем шприца).
- Крутящим движением по часовой стрелке соедините иглу со шприцем до момента, когда вы ощутите их защелкивание друг на друге (см. рисунок 1).
- Удалите защитный колпачок с иглы (в отдельных случаях он может быть туго закреплен на игле).
Шприц 2 типа
В случае, если упаковка содержит шприц, отличный от представленного на рисунке 1, то после удаления защитного колпачка с носика шприца наденьте иглу на шприц до упора без дополнительного накручивания.
Добавить растворитель к лиофилизату. После добавления растворителя к лиофилизату следует хорошо встряхнуть образовавшуюся смесь до полного растворения лиофилизата в растворителе (не более 1 минуты). После восстановления вакцину необходимо незамедлительно ввести. Для введения вакцины следует использовать новую иглу. Для введения извлекают из флакона с восстановленной вакциной все его содержимое.
Восстановленная вакцина используется немедленно и хранению не подлежит.
Неиспользованный препарат и отходы от его использования должны быть уничтожены в соответствии с требованиями, принятыми в РФ.
Схемы вакцинации
Прививочная доза вакцины составляет 0,5 мл.
В соответствии с Календарем профилактических прививок России Приорикс® вводят детям в возрасте 12 месяцев с последующей ревакцинацией в возрасте 6 лет.
Приорикс® можно вводить девочкам в 13 лет, ранее не привитым или получавшим только одну прививку моновалентными или комбинированными вакцинами против кори, краснухи и эпидемического паротита.
Побочное действие
Данные клинических исследований
Нежелательные реакции, представленные ниже, перечислены в соответствии с поражением органов и систем органов и частотой встречаемости. Частота встречаемости определяется следующим образом: очень часто (≥1/10), часто (≥1/100 и <1/10), нечасто (≥1/1000 и <1/100), редко (≥1/10000 и <1000), очень редко (<1/10000, включая отдельные случаи).
В контролируемых клинических исследованиях признаки и симптомы активно отслеживались в течение 42-дневного периода наблюдения. Вакцинированных также просили сообщать обо всех клинических проявлениях в течение времени исследования. Профиль безопасности вакцины основан на данных, полученных для 12 000 субъектов, получавших вакцину в рамках клинических исследований.
Частота встречаемости нежелательных реакций
Инфекционные и паразитарные заболевания
Часто: инфекции верхних дыхательных путей.
Нечасто: средний отит.
Нарушения со стороны крови и лимфатической системы
Нечасто: лимфаденопатия.
Нарушения со стороны иммунной системы
Редко: аллергические реакции.
Нарушения со стороны обмена веществ и питания
Нечасто: анорексия.
Нарушения психики
Нечасто: патологический плач, нервозность, бессонница.
Нарушения со стороны нервной системы
Редко: фебрильные судороги.
Нарушения со стороны органа зрения
Нечасто: конъюнктивит.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Нечасто: бронхит, кашель.
Нарушения со стороны желудочно-кишечного тракта
Нечасто: увеличение околоушных желез, диарея, рвота.
Нарушения со стороны кожи и подкожных тканей
Часто: сыпь.
Общие расстройства и нарушения в месте введения
Очень часто: покраснение в месте инъекции, повышение температуры (ректальная ≥38°C; подмышечная впадина/ротовая полость ≥37,5°C).
Часто: болезненность и отек в месте инъекции, повышение температуры (ректальная ≥39,5°C; подмышечная впадина/ротовая полость >39°C).
В целом, категории частоты встречаемости нежелательных реакций были сходными после введения первой дозы вакцины и ревакцинации. Однако, болезненность в месте инъекции в соответствии с категориями частоты встречаемости наблюдалась «Часто» после первой вакцинации и «Очень часто» после ревакцинации.
Данные пострегистрационного наблюдения
В условиях массовой вакцинации были дополнительно зарегистрированы следующие нежелательные реакции, находящиеся во временной связи с введением вакцины.
Инфекционные и паразитарные заболевания
Редко: менингит, кореподобный синдром, паротитоподобный синдром (включая орхит, эпидимит и воспаление околоушных желез).
Нарушения со стороны крови и лимфатической системы
Редко: тромбоцитопения, тромбоцитопеническая пурпура.
Нарушения со стороны иммунной системы
Редко: анафилактические реакции.
Нарушения со стороны нервной системы
Редко: энцефалит, церебеллит, симптомы, напоминающие церебеллит (включая преходящее нарушение походки и преходящую атаксию), синдром Гийена-Барре, поперечный миелит, периферический неврит.
Нарушения со стороны сосудов
Редко: васкулит (включая пурпуру Геноха-Шонлейна и синдром Кавасаки).
Нарушения со стороны кожи и подкожных тканей
Редко: мультиформная эритема.
Нарушения со стороны скелетно-мышечной системы и соединительной ткани
Редко: артралгия, артрит.
Случайное внутривенное введение может вызвать тяжелые реакции или даже шок. Незамедлительные принимаемые меры зависят от степени тяжести реакции.
Передозировка
В ходе пострегистрационного наблюдения поступали сообщения о случаях передозировки (превышение рекомендованной дозы не более чем в 2 раза). Нежелательные реакции в связи с передозировкой отсутствовали.
Взаимодействие с другими препаратами
Приорикс® можно вводить одновременно (в один день) с АКДС и АДС вакцинами, живой и инактивированной полиомиелитной вакциной, вакциной против Н. ifluenzae типа b, вакциной против гепатита В при условии инъекции препаратов отдельными шприцами в разные участки тела. Другие живые вирусные вакцины вводят с интервалом не менее 1 месяца.
Приорикс® не допускается смешивать с другими вакцинами в одном шприце.
Вакцина Приорикс® может быть использована для проведения повторной прививки лицам, ранее вакцинированным другой комбинированной вакциной против кори, паротита и краснухи или соответствующими монопрепаратами.
При необходимости постановки туберкулиновой пробы она должна быть проведена до или одновременно с вакцинацией, поскольку по имеющимся данным живые вакцины против кори (и возможно паротита) могут вызывать временное снижение чувствительности кожи к туберкулину. В связи с тем, что подобное снижение чувствительности может сохраняться от 4 до 6 недель, не следует осуществлять туберкулинодиагностику в течение указанного периода времени после вакцинации во избежание получения ложноотрицательных результатов.
Пациентам, ранее получавшим препараты крови человека (иммуноглобулины, плазму и другие), вакцинацию следует отложить, по крайней мере, на три месяца из-за вероятности недостаточного формирования антител к вирусу паротита, кори и краснухи.
Особые указания
Необходимо соблюдать осторожность при введении вакцины лицам с аллергическими заболеваниями и судорогами в личном и семейном анамнезе.
Как и при применении других биологических препаратов, в связи с возможностью развития аллергических реакций немедленного типа вакцинированный должен находиться под наблюдением не менее 30 мин. Прививочные кабинеты должны быть обеспечены средствами противошоковой терапии, в том числе раствором адреналина 1:1000.
После вакцинации или иногда перед ней возможны обмороки или выраженная слабость как психологическая реакция на инъекцию. Перед вакцинацией важно удостовериться, что пациент не получит повреждений в случае обморока.
Вакцинацию женщин в детородном возрасте проводят при отсутствии беременности и только в том случае, если женщина согласна предохраняться от зачатия в течение 1 месяца после прививки.
Как при любой другой вакцинации, не у всех вакцинированных может выявляться защитная иммунная реакция.
У детей в возрасте до 12 месяцев защитная иммунная реакция на коревой компонент вакцины может быть недостаточной в связи с возможным сохранением у них материнских антител к вирусу кори. Вместе с тем, это не должно быть основанием для исключения применения вакцины Приорикс® у детей грудного возраста (< 12 месяцев), поскольку в некоторых ситуациях, таких как группы высокого риска, вакцинация показана. В подобных случаях ревакцинацию следует проводить после достижения возраста 12 месяцев.
После первичной вакцинации у лиц с тромбоцитопенией были зафиксированы случаи обострения и повторного проявления заболевания, в связи с чем решение о назначении вакцины Приорикс® таким пациентам должно быть принято на индивидуальной основе с учетом оценки риска и пользы и только после консультации профильного врача.
Данные о применении препарата Приорикс® у лиц с иммунодефицитными состояниями ограничены, поэтому вакцинацию следует проводить с осторожностью и только в том случае, когда, по мнению врача, польза превышает риск (например, лица с бессимптомным течением ВИЧ-инфекции).
У лиц с иммунодефицитными состояниями, которым не противопоказана вакцинация (раздел «Противопоказания»), как и у иммунокомпетентных пациентов, может не развиться должный иммунный ответ, соответственно некоторая часть вакцинированных может заразиться корью, паротитом или краснухой, несмотря на правильно проведенную вакцинацию. Лица с иммунодефицитными состояниями должны находиться под тщательным наблюдением для выявления признаков кори, паротита и краснухи.
Передача вирусов кори и эпидемического паротита от вакцинированных лиц непривитым контактным лицам не зарегистрирована. Известны случаи фарингеального выделения вируса краснухи через 7-28 дней после вакцинации с пиком выделения приблизительно на 11-й день. Тем не менее, данные, подтверждающие передачу выделившегося вакцинного вируса непривитым контактным лицам, отсутствуют.
Перед введением вакцины следует убедиться, что спирт или другой дезинфицирующий агент испарился с поверхности кожи и пробки флакона, так как эти вещества могут инактивировать аттенуированные вирусы в составе вакцины.
Форма выпуска
Лиофилизат для приготовления раствора для подкожного и внутримышечного введения, 1 доза (0,5 мл).
Лиофилизат
По 1 дозе вакцины во флаконе из прозрачного стекла типа I (Евр. Ф.), укупоренном пробкой из резины и алюминиевым колпачком под обкатку, снабженным защитной пластиковой крышечкой.
Растворитель
По 0,5 мл в ампуле из прозрачного стекла типа I (Евр.Ф.).
По 0,5 мл в шприце из прозрачного стекла типа I (Евр.Ф.). Носик шприца герметично укупорен защитным резиновым колпачком или укупорен герметичной резиновой пробкой с защитным завинчивающимся пластиковым колпачком.
Комплектность
По 1 флакону с лиофилизатом, 1 ампуле с растворителем в блистере, закрытом пленкой. По 1 блистеру с инструкцией по применению в картонной пачке.
По 1 флакону с лиофилизатом, 1 шприцу с растворителем в комплекте с 1 иглой в отдельном пластиковом контейнере с канюлей, закрытой пластиковым колпачком, в блистере, закрытом пленкой. По 1 блистеру с инструкцией по применению в картонной пачке.
По 1 флакону с лиофилизатом, 1 шприцу с растворителем в комплекте с 2 иглами в отдельных пластиковых контейнерах с канюлями, закрытыми пластиковыми колпачками, в блистере, закрытом пленкой. По 1 блистеру с инструкцией по применению в картонной пачке.
По 100 флаконов с лиофилизатом с инструкцией по применению в картонной коробке. Растворитель отдельно: по 100 ампул в картонной коробке.
Срок годности
Лиофилизат: 2 года.
Растворитель: 5 лет.
Срок годности комплекта указывается по наименьшему сроку годности одного из компонентов.
Не применять после истечения срока годности, указанного на упаковке.
Датой окончания срока годности является последний день месяца, указанного на упаковке.
Условия хранения
Лиофилизат
Хранить при температуре от 2 до 8°С. Не замораживать.
Хранить в защищенном от света месте.
Растворитель
Хранить при температуре от 2 до 25°С. Не замораживать.
Комплект (лиофилизат, растворитель, с иглами или без игл)
Хранить при температуре от 2 до 8°С. Не замораживать.
Хранить в защищенном от света месте.
Хранить в недоступном для детей месте.
Условия транспортирования
Лиофилизат
Транспортировать при температуре от 2 до 8°С. Не замораживать.
Растворитель
Транспортировать при температуре от 2 до 25°С. Не замораживать.
Комплект (лиофилизат, растворитель, с иглами или без игл)
Транспортировать при температуре от 2 до 8°С. Не замораживать.
Условия отпуска
Упаковка, содержащая 1 флакон с лиофилизатом и 1 ампулу или шприц с растворителем – по рецепту.
Упаковка, содержащая 100 флаконов с лиофилизатом, упаковка, содержащая 100 ампул с растворителем – для лечебно-профилактических учреждений.
Производитель
Производитель готовой лекарственной формы
«ГлаксоСмитКляйн Байолоджикалз с.а.», Бельгия
«Фидия Фармацеутици С.п.а», Италия
Фасовщик (первичная упаковка)
«ГлаксоСмитКляйн Байолоджикалз с.а.», Бельгия
«Фидия Фармацеутици С.п.а», Италия
Упаковщик (вторичная (потребительская) упаковка)
«ГлаксоСмитКляйн Байолоджикалз с.а.», Бельгия
ООО «СмитКляйн Бичем-Биомед», Россия
Выпускающий контроль качества
ГлаксоСмитКляйн Байолоджикалз с.а. / GlaxoSmithKline Biologicals s.a.
Рю де л’Энститю, 89, 1330 Риксенсарт, Бельгия / Rue de l’Institut, 89, 1330 Rixensart, Belgium
ООО «СмитКляйн Бичем-Биомед»
143422, Россия, Московская обл., Красногорский р-н, с. Петрово¬Дальнее, «Биомед» им. Мечникова
Наименование и адрес юридического лица, на имя которого выдано регистрационное удостоверение
ЗАО «ГлаксоСмитКляйн Трейдинг»
119180, г. Москва, Якиманская наб., д. 2
Рекламации на качество препарата, сведения о случаях повышенной реактогенности или развития поствакцинальных осложнений направлять в адрес Федеральной службы по надзору в сфере здравоохранения (Росздравнадзор):
109074, Москва, Славянская пл., 4, стр.1
и в адрес ЗАО «ГлаксоСмитКляйн Трейдинг»
121614, г. Москва, ул. Крылатская, д. 17, корп. 3, эт. 5
Бизнес-Парк «Крылатские холмы»
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Прививочная доза вакцины содержит не менее 103,0ТЦД50 живого аттенуированного вируса кори штамма Шварц, не менее 103,7ТЦД50 живого аттенуированного вируса паротита штамма RIT4385, не менее 103,0ТЦД50 живого аттенуированного вируса краснухи штамма Wistar RA 27/3.
Вакцина содержит следовые количества неомицина сульфата, лактозу, сорбитол, маннитол и аминокислоты.
Вакцина: пористая масса или порошок от белого до слегка розового цвета.
Растворитель: прозрачная бесцветная жидкость, не содержащая видимых включений. Восстановленный раствор: прозрачный розовый раствор (оттенки от розово-оранжевого до ярко-розового).
Вакцины. Вакцины для профилактики вирусных инфекций. Код АТС: J07BD52
Фармакологические свойства
Фармакодинамика
Иммунная реакция у детей в возрасте с 12 месяцев
В клинических исследованиях у детей в возрасте с 12 месяцев до 2 лет Приорикс показал высокую иммуногенность.
После введения первой дозы антитела к вирусу кори были обнаружены у 98,1%, к вирусу эпидемического паротита — у 94,4% и к вирусу краснухи — у 100% вакцинированных, ранее серонегативных лиц. Через 2 года после первичной вакцинации уровни сероконверсии составили 93,4% к вирусу кори, 94,4% — к вирусу паротита и 100% — к вирусу краснухи.
Хотя данных о защитной эффективности вакцины Приорикс не получено, данные иммуногенности принимаются в качестве показателя защитной эффективности. Некоторые исследования в клинической практике свидетельствуют о том, что эффективность в отношении вируса паротита может быть ниже, чем наблюдаемые уровни сероконверсии к вирусу паротита.
Иммунная реакция у детей в возрасте 9-10 месяцев
Было проведено клиническое исследование с участием 300 здоровых детей, которым первая доза вакцины была введена в возрасте 9-10 месяцев. 147-ми из этих детей вакцины Приорикс и Варилрикс вводились одновременно. Частота сероконверсии к вирусам кори, паротита и краснухи составила 92,6%, 91,5% и 100%, соответственно. После второй дозы вакцины, введенной через 3 месяца после первой, частота сероконверсии составила 100% к вирусу кори, 99,2% — к вирусу паротита и 100% — к вирусу краснухи. В связи с этим для достижения оптимальной иммунной реакции вторая доза вакцины Приорикс должна вводиться в течение трех месяцев после введения первой дозы.
Подростки и взрослые
Безопасность и иммуногенность вакцины Приорикс у подростков и взрослых в ходе клинических исследований не изучалась.
Внутримышечный способ введения
В ходе клинических исследований ограниченному количеству лиц вакцину Приорикс вводили внутримышечно. Уровни сероконверсии к трем компонентам вакцины были сравнимы с уровнями, наблюдаемыми после подкожного введения.
Показания
Профилактика кори, эпидемического паротита и краснухи у детей с 9-месячного возраста, подростков и взрослых.
Информацию о применении вакцины у детей в возрасте 9-12 месяцев см. в разделах «Способ применения и дозировка», «Меры предосторожности» и «Фармакодинамика».
Гиперчувствительность к действующим веществам или любым другим ингредиентам вакцины или к неомицину. Наличие в анамнезе контактного дерматита, вызванного неомицином, не является противопоказанием к вакцинации. Информация в отношении реакций гиперчувствительности к куриным яйцам представлена в разделе «Меры предосторожности».
Тяжелый гуморальный или клеточный иммунодефицит (первичный или приобретенный), например, тяжелый комбинированный иммунодефицит, агаммаглобулинемия, СПИД или ВИЧ-инфекция с клиническими проявлениями или соответствующее возрасту процентное содержание CD4+ Т-лимфоцитов у детей в возрасте до 12 месяцев: CD4+ < 25%; дети в возрасте 12-35 месяцев: CD4+ < 20%; дети в возрасте 36-59 месяцев: CD4+ < 15% (см. раздел «Меры предосторожности»).
Беременность. Женщин следует предупреждать о необходимости предохраняться от зачатия в течение одного месяца после вакцинации (см. раздел «Беременность и лактация»).
Как и при применении других вакцин, введение вакцины Приорикс должно быть отложено у лиц с проявлениями острых заболеваний, сопровождающихся лихорадкой. Наличие незначительной инфекции, например, простуды, не требует отсрочки вакцинации.
Способ применения и дозировка
Непосредственно перед применением проводят визуальный осмотр растворителя и восстановленной вакцины на наличие инородных частиц и/или отклонений от физических свойств. В случае обнаружения любого из вышеперечисленного, вакцину не используют.
Во флакон с препаратом вносят содержимое прилагаемой ампулы с растворителем. Флакон тщательно встряхивают до полного растворения.
Восстановленный препарат представляет собой прозрачный раствор от розово-оранжевого до ярко-розового цвета. Варьирование цвета восстановленной вакцины связано с чувствительностью окраски к минимальным изменениям pH без ухудшения активности вакцины.
Для введения препарата должна быть использована новая стерильная игла. При использовании вакцины в многодозовой упаковке для забора препарата каждый раз должны быть использованы новый шприц и игла.
Необходимо избегать контакта с дезинфицирующими средствами (см. раздел «Меры предосторожности»).
Неиспользованную вакцину или другие сопутствующие отходы утилизируют в соответствии с местными требованиями.
Вакцину вводят сразу после восстановления. Если это невозможно, то хранить восстановленный раствор необходимо при температуре 2-8°C и использовать в течение 8- ми часов.
Режим дозирования
Вакцина Приорикс применяется на основе Национального календаря профилактических прививок Республики Беларусь.
Дети с 12 месяцев, подростки и взрослые
Рекомендуемая доза составляет 0,5 мл. Вторая доза вводится в соответствии с официальными рекомендациями.
Приорикс можно вводить лицам, ранее привитым другой моновалентной или комбинированной вакциной против кори, краснухи и эпидемического паротита.
Дети в возрасте 9-12 месяцев
У детей на первом году жизни может наблюдаться недостаточная реакция на компоненты вакцины. В случае, если эпидемическая ситуация требует вакцинации детей на первом году жизни (например, вспышка эпидемии или поездка в эндемичные регионы), вторая доза вакцины Приорикс должна вводиться на втором году жизни, желательно, в течение 3 месяцев после первой дозы. Ни при каких обстоятельствах интервал между введением 1-ой и 2-ой дозы не должен быть менее 4 недель (см. разделы «Меры предосторожности» и «Фармакодинамика»).
Дети младше 9 месяцев
Безопасность и эффективность вакцины Приорикс у детей в возрасте до 9 месяцев не установлена.
Способ введения
Приорикс вводят подкожно, однако также допускается введение путем внутримышечной инъекции в область дельтовидной мышцы или в переднелатеральную область бедра (см. разделы «Меры предосторожности» и «Фармакодинамика»),
Лицам с тромбоцитопенией или нарушениями свертываемости крови вакцину рекомендуется вводить подкожно (см. раздел «Меры предосторожности»).
Ни при каких обстоятельствах вакцина Приорикс не должна вводиться внутрисосудисто.
Профиль безопасности вакцины основан на данных, полученных для 12000 лиц, получавших вакцину в рамках контролируемых клинических исследований. Побочные реакции, которые могут возникать при использовании комбинированной вакцины против кори, паротита и краснухи подобны тем, что возникают при использовании моновалетных вакцин по отдельности или в комбинации.
В контролируемых клинических исследованиях симптомы активно мониторировали в течение 42 дней после вакцинации. Вакцинированных лиц также просили сообщать обо всех клинических явлениях на протяжении периода исследования.
Наиболее частыми побочными реакциями, возникающими после вакцинации Приорикс, были покраснение в месте инъекции и повышение температуры тела ≥38°C (ректальной) или ≥37,5°C (подмышечная впадина/ротовая полость).
Частота нежелательных реакций определялась следующим образом:
Очень часто:(≥1/10)
Часто:(≥ 1/100, < 1/10)
Нечасто:(≥1/1000, < 1/100)
Редко:(≥ 1/10000, < 1/1000)
Данные, полученные в клинических исследованиях
| Система органов | Частота | Нежелательные реакции |
| Инфекционные и паразитарные заболевания | часто | инфекция верхних дыхательных путей |
| нечасто | средний отит | |
| Нарушения со стороны крови и лимфатической системы | нечасто | лимфаденопатия |
| Нарушения со стороны иммунной системы | редко | аллергические реакции |
| Нарушения со стороны обмена веществ и питания | нечасто | анорексия |
| Нарушения психики | нечасто | нервозность, патологический плач, бессонница |
| Нарушения со стороны нервной системы | редко | фебрильные судороги |
| Нарушения со стороны органов зрения | нечасто | конъюнктивит |
| Нарушения со стороны дыхательной системы,органов грудной клетки и средостения | нечасто | бронхит, кашель |
| Нарушения со стороны желудочно-кишечного тракта | нечасто | увеличение в размере околоушных слюнных желез, диарея, рвота |
| Нарушения со стороны кожи и подкожных тканей | часто | сыпь |
| Общие расстройства инарушения в месте введения | очень часто | покраснение в месте введения, повышение температуры тела ≥38°C (ректальная температура) или ≥37,5°C (температура в подмышечной впадине/полости рта) |
| часто | боль и припухлость в месте введения, повышение температуры тела >39,5°C (ректальная температура) или >39°C (температура в подмышечнойвпадине/полости рта) |
В целом, профиль нежелательных реакций был сходным после введения первой и второй дозы вакцины. Исключение составляет боль в месте инъекции, которая была «частой» побочной реакцией после введения первой дозы вакцины и «очень частой» после введения второй дозы.
Данные пост-маркетингового опыта применения
В ходе пост-маркетингового применения поступали редкие сообщения о нижеперечисленных побочных реакциях. В связи с тем, что сообщения о данных реакциях поступали на добровольной основе от популяции неизвестного размера, реальная оценка частоты возникновения данных реакций не возможна.
| Система органов | Нежелательные реакции |
| Инфекционные и паразитарные заболевания | менингит, кореподобный синдром, паротитоподобный синдром (включающий орхит, эпидидимит и паротит) |
| Нарушения со стороны крови и лимфатической системы | тромбоцитопения, тромбоцитопеническая пурпура |
| Нарушения со стороны иммунной системы | анафилактические реакции |
| Нарушения со стороны нервной системы | энцефалит*, церебеллит, церебеллитоподобные симптомы (включая транзиторное нарушение походки и транзиторную атаксию), синдром Гийена-Барре, поперечный миелит, периферический неврит |
| Нарушения со стороны сосудов | васкулит |
| Нарушения со стороны кожи и подкожных тканей | мультиформная эритема |
| Нарушения со стороны скелетно-мышечной и соединительной ткани | артралгия, артрит |
*Об энцефалитах сообщалось с частотой менее 1 случая на 10 миллионов доз, что значительно ниже, чем при естественных заболеваниях (корь: 1:1000-1:2000; паротит: 2-4:1000; краснуха: 1:6000).
Случайное внутривенное введение может вызвать тяжелые реакции, даже шок. Немедленные мероприятия зависят от степени тяжести реакции (см. раздел «Меры предосторожности»).
В ходе постмаркетингового наблюдения были зафиксированы случаи передозировки (дозы, в 2 раза превышающие рекомендуемые). Побочных реакций зафиксировано не было.
В клинических исследованиях было продемонстрировано, что Приорикс можно вводить одновременно (в один день) с любой из перечисленных моновалентных или комбинированных вакцин (включая шестивалентную вакцину КДСа-ГепВ-Полио/Хиб) в соответствии с локальными рекомендациями: ацеллюлярная коклюшно-дифтерийно-столбнячная вакцина (аКДС), вакцина для профилактики дифтерии, столбняка, коклюша (ацеллюлярная) и с пониженным содержанием антигена (аКДС-M), вакцина против Haemophilus influenzae типа b (Hib), инактивированная полиомиелитная вакцина (IPV), вакцина против гепатита В (HBV), вакцина против гепатита A (HAV), менингококковая вакцина, серотип В (МепВ), менингококковая конъюгированная вакцина, серотип С (МепС), конъюгированная вакцина для профилактики менингококковой инфекции серогрупп А, С, W-135 и Y (MeнACWY), вакцина против вируса ветряной оспы (VZV), пероральная полиомиелитная вакцина (OPV) и десятивалентная пневмококковая конъюгированная вакцина
В связи с повышенным риском развития лихорадки, болезненности в месте введения, изменения пищевого поведения и раздражительности при одновременном применении вакцины Бексеро и комбинированной вакцины для профилактики кори-паротита- краснухи-ветряной оспы (MMR-V) по возможности можно рассмотреть раздельную вакцинацию вакциной Приорикс.
Данные в поддержку применения вакцины Приорикс с какими-либо другими вакцинами отсутствуют.
Если вакцина Приорикс применяется одновременно с другой вакциной в инъекционной форме, вакцины должны всегда вводиться в разные участки тела.
Если вакцины не вводятся одновременно, рекомендованный интервал между введением вакцины Приорикс и другими живыми аттенуированными вакцинами составляет не менее одного месяца.
При необходимости постановки туберкулиновой пробы она должна быть проведена либо до, либо одновременно с вакцинацией, или через 6 недель после нее, поскольку комбинированная вакцина против вируса кори, паротита и краснухи может вызвать временное снижение чувствительности кожи к туберкулину, что может послужить причиной ложного отрицательного результата.
Лицам, получившим гамма-глобулин человека или перенесшим переливание крови, вакцинацию следует отложить не менее чем на три месяца или дольше (до 11 месяцев) в зависимости от введенной дозы гамма-глобулина по причине возможной неэффективности вакцинации вследствие пассивно приобретенных антител против кори, эпидемического паротита и краснухи.
Как и при использовании всех инъекционных вакцин, необходимо убедиться, что в случае возникновения редкой анафилактической реакции после ведения вакцины будет оказана необходимая медицинская помощь и наблюдение.
Перед введением вакцины следует убедиться, что спирт или другой дезинфицирующий агент испарился с поверхности кожи и пробки флакона, так как эти вещества могут инактивировать аттенуированные вирусы в составе вакцины.
У детей на первом году жизни может наблюдаться недостаточная реакция на компоненты вакцины в связи с возможным влиянием материнских антител (см. разделы «Способ применения и дозировка», «Фармакодинамика»).
Следует соблюдать осторожность при введении вакцины Приорикс лицам с заболеваниями центральной нервной системы (ЦНС), склонным к фебрильным судорогам или лицам с наличием судорог в семейном анамнезе. Вакцинируемых лиц с судорогами в анамнезе следует тщательно наблюдать.
Вирусы кори и паротита выращиваются в культурах клеток куриного эмбриона, поэтому готовая вакцина может содержать следовые количества яичного белка. Пациенты с анафилактическими, анафилактоидными или другими реакциями немедленного типа на яичный белок в анамнезе (например, генерализованная крапивница, отек ротоглотки, отёк гортани, затруднение дыхания, гипотония или шок) могут иметь повышенный риск возникновения реакций гиперчувствительности немедленного типа после введения вакцины, хотя эти реакции наблюдались очень редко. Такие пациенты должны находиться под тщательным медицинским наблюдением во время и после проведения вакцинации, при этом препараты для купирования анафилактического шока должны быть в непосредственной близости.
Определенная степень защиты от заболевания корью может быть достигнута при введении вакцины неиммунным лицам в течение 72 часов после их контакта с больным корью.
После вакцинации или иногда перед ней возможны обмороки или выраженная слабость, особенно у подростков, как психологическая реакция на инъекцию. Они могут сопровождаться некоторыми неврологическими проявлениями, такими как временное зрительное расстройство, парестезия и тонико-кпонические движения конечностей. Перед вакцинацией важно удостовериться, что пациент не получит повреждений в случае обморока.
Как и при любой вакцинации, защитный иммунный ответ может развиться не у всех лиц, получивших вакцинацию.
Ни при каких обстоятельствах вакцина Приорикс не должна вводиться внутрисосудисто.
Тромбоцитопения
Имеются сообщения об обострении течения тромбоцитопении и повторного проявления заболевания у лиц с тромбоцитопенией после введения первой дозы живых вакцин против кори, паротита и краснухи. Тромбоцитопения, связанная с введением таких вакцин, наблюдается редко и, как правило, проходит без лечения. При вакцинации лиц с тромбоцитопенией или наличием в анамнезе тромбоцитопении после введения вакцины против кори, паротита и краснухи следует тщательно взвесить соотношение риска и пользы. В таких случаях следует проявлять осторожность и предпочтительно вводить вакцину подкожно.
Лица с ослабленным иммунитетом
Вакцинация может быть показана пациентам с определенным типом иммунодефицитов, в случае если польза превышает риск (например, пациенты с ВИЧ без проявления клинических симптомов, дефицит подклассов иммуноглобулина G, наследственная нейтропения, хроническая гранулематозная болезнь, болезни дефицита компонентов системы комплемента).
Реакция на вакцинацию у лиц с ослабленным иммунитетом, которым вакцинация не противопоказана (см. раздел «Противопоказания»), может быть слабее, чем у лиц с сохраненным иммунитетом, поэтому несмотря на вакцинацию некоторые из этих пациентов могут заразиться корью, паротитом или краснухой в случае контакта с больным. Следует проводить тщательный мониторинг таких пациентов на предмет наличия признаков заболевания корью, паротитом или краснухой.
Передача вируса
Не было зарегистрировано случаев передачи вакцинных вирусов кори, краснухи и паротита от вакцинированных лиц восприимчивым людям, хотя выделение вирусов краснухи и кори из глотки возможно в течение 7-28 дней после вакцинации с пиком выделения приблизительно на 11-й день. Тем не менее, отсутствуют доказательства передачи данных выделяемых вирусов, содержащихся в вакцине, восприимчивым контактным лицам. Были зафиксированы случаи передачи вакцинного вируса краснухи младенцам через грудное молоко, а также случаи передачи вируса через плаценту в отсутствии клинических признаков заболевания.
Беременность и лактация
Репродуктивная функция
Исследования влияния на репродуктивную функцию не проводились.
Беременность
Вакцина Приорикс противопоказана беременным женщинам.
Однако случаев повреждения эмбриона при введении вакцин против кори, паротита и краснухи во время беременности зафиксировано не было.
Хотя теоретический риск все еще не может быть исключен, у более чем 3500 восприимчивых женщин, которые не знали о наступившей беременности и были иммунизированы вакцинами, содержащими компонент для профилактики краснухи, на ранних стадиях беременности, не было зарегистрировано случаев синдрома врожденной краснухи. Поэтому факт непреднамеренной вакцинации беременной женщины вакциной против кори, паротита и краснухи не должен быть причиной к прерыванию беременности. Женщин следует предупреждать о необходимости предохраняться от зачатия в течение одного месяца после вакцинации. Женщинам, планирующим беременность, следует рекомендовать отложить планы по наступлению беременности.
Грудное вскармливание
Получены ограниченные данные о введении вакцины Приорикс в период грудного вскармливания. Исследования показали, что кормящие женщины, привитые живой аттенуированной вакциной против краснухи, могут передать вирус младенцам вместе с грудным молоком при отсутствии симптомов заболевания. Только в случае, если было подтверждено или есть причины полагать, что ребенок обладает ослабленным иммунитетом, следует оценить пользу и риск вакцинации матери (см. раздел «Противопоказания»).
Влияние на способность управлять автомобилем или другими механизмами
Приорикс не оказывает влияния или оказывает крайне незначительное влияние на способность управлять автомобилем или другими механизмами.
Форма выпуска
По 2 дозы во флаконе бесцветного прозрачного стекла, укупоренном серой резиновой пробкой и алюминиевым колпачком под обкатку, снабженным защитной крышечкой.
По 100 флаконов вместе с инструкцией по применению в картонной коробке. Растворитель отдельно: по 1 мл в стеклянной ампуле с синей точкой разлома и двумя желтыми кольцами. По 100 ампул в отдельной картонной коробке.
Срок годности, условия хранения и транспортирования
Срок годности вакцины Приорикс — 2 года, растворитель — 5 лет.
Дата окончания срока годности указана на этикетке флакона и упаковке. Препарат с истекшим сроком годности применению не подлежит.
Вакцину в комплекте с растворителем хранят и транспортируют при температуре от 2 до 8 °C.
Вакцину, упакованную отдельно от растворителя, хранят и транспортируют при температуре от 2 до 8 °C. Не замораживать.
Растворитель, упакованный отдельно от вакцины, хранят и транспортируют при температуре от 2 до 25 °C; замораживание растворителя не допускается. Хранить вакцину и растворитель в недоступном для детей месте.
Условия отпуска из аптек
По рецепту врача.
Производитель
ГлаксоСмитКляйн Байолоджикалз СА, Бельгия
GlaxoSmithKline Biologicals SA, Belgium
89, Рю де л’Энститю, 1330 Риксенсарт, Бельгия/
89, Rue de I’lnstitut, 1330 Rixensart, Belgium
За дополнительной информацией обращаться по адресу
Представительство ООО «GlaxoSmithKline Export Limited» (Великобритания) в Республике Беларусь
Минск, ул. Воронянского 7А, офис 400
Тел.: + 375 17 213 20 16; факс + 375 17 213 18 66
| Вакцина | Цена |
|---|---|
|
|
нет в наличии |
Вакцина «Приорикс» защищает от инфекций:
Похожие вакцины (аналоги Приорикс):
Приорикс® (GlaxoSmithKline Biologicals, Бельгия) – это комбинированная живая аттенуированная (ослабленная) вакцина, предназначенная для профилактики кори, краснухи и эпидемического паротита.
Корь — это опасная, высококонтагиозная вирусная инфекция, передающаяся воздушно-капельным путем. В основном вирус кори поражает верхние дыхательные пути и легкие, что проявляется некротическими ларингитами, длительными бронхитами, тяжелыми пневмониями. В течение полугода-года после перенесенной кори организм находится в состоянии анергии (выраженном ослаблении иммунитета), проявляющейся в очень частых и тяжелых респираторных заболеваниях.
Краснуха — это опасная, высококонтагиозная вирусная инфекция, передающаяся воздушно-капельным путем. Краснуха бывает врожденной и приобретенной.
Приобретенная краснуха характеризуется мелкопятнистой сыпью, поражением лимфатической системы и интоксикацией.
Врожденная краснуха – это хроническая инфекция плода с трансплацентарным путем передачи (через кровь больной матери на ранних сроках беременности), приводящая к гибели плода, раннему выкидышу или тяжелым порокам развития и уродствам, таким как глухота, катаракта, различные пороки сердца и мозга.
Эпидемический паротит (свинка) – это опасная, высоконтагиозная вирусная инфекция, передающаяся воздушно-капельным путем, проявляющаяся тяжелой интоксикацией, поражением слюнных желез, центральной нервной системы (воспаление головного мозга и его оболочек), панкреатитом, орхитом (воспаление яичек), который может привести к бесплодию.
В своем составе вакцина Приорикс® содержит аттенуированные (ослабленные) вакцинные штаммы вируса кори (Schwarz), эпидемического паротита (RIT 4385, производный Jeryl Lynn) и краснухи (Wistar RA 27/3), которые культивируются раздельно в культуре клеток куриного эмбриона (вирусы кори и паротита) и диплоидных клетках человека (вирус краснухи). Это позволяет одним уколом иммунизировать ребенка или взрослого против кори, эпидемического паротита и краснухи.
Вакцина Приорикс® применяется для профилактики не только трех инфекций одновременно, но и для профилактики одного или двух из трех заболеваний.
Например, если ребенок или взрослый привит или переболел корью (паротитом, краснухой или их комбинациями), но не имеет иммунитета по краснухе (паротиту, кори или их комбинациям), то применение вакцины Приорикс® также возможно.
На новый для организма вирус будет выработан иммунитет. Уже знакомые организму вирусы будут инактивированы иммунной системой, тем самым будет простимулирована их дополнительная выработка.
Показания к применению.
- — профилактика кори, эпидемического паротита и краснухи для детей с 12 месячного возраста и взрослых.
Вакцина может применяться для экстренной профилактики кори у не привитых и не болевших лиц в первые 72 часа от момента контакта с больным корью.
Режим дозирования.
Разовая доза составляет 0,5 мл. Вакцина поставляется в двух компонентах: флакон с лиофилизированной вакциной (специально высушенной) и ампула с растворителем (вода для инъекций). Вводится стерильным шприцем. Вскрытие ампул и процедуру вакцинации осуществляют при строгом соблюдении правил асептики и антисептики. Препарат во вскрытой ампуле хранению не подлежит.
Вакцина соответствует требованиям ВОЗ по производству биологических препаратов, требованиям к вакцинам против кори, эпидемического паротита, краснухи и живым комбинированным вакцинам.
Способ применения.
Вакцина поставляется в картонных коробках по 50 доз в комплекте с растворителем. Непосредственно перед введением растворитель из ампулы забирается в стерильный шприц (из расчета 0.5 мл на одну дозу), сухая вакцина во флаконе растворяется жидким растворителем из шприца и вводится ребенку из того же шприца.
Вакцина Приорикс® вводится подкожно, в область дельтовидной мышцы (плечо). Допустимо внутримышечное введение.
Внутривенное введение категорически противопоказано.
Схема вакцинации
Курс первичной вакцинации состоит из 1 дозы вакцины и ревакцинации. Схема иммунизации: первое введение и ревакцинация через 6 лет. Применение вакцины не имеет четкой привязки к возрасту. Важно соблюдать сроки вакцинации. Вакцину Приорикс® можно вводить девочкам в 13 лет, ранее не привитым или получившим только 1 прививку моновалентными или комбинированными вакцинами против кори, краснухи и эпидемического паротита.
Клинические исследования показали высокую эффективность вакцины Приорикс®. Антитела к вирусу кори были обнаружены у 98% привитых, к вирусу эпидемического паротита у 96.1% и к вирусу краснухи у 99.3%. Через год после прививки у всех серопозитивных лиц сохранялся защитный титр антител к вирусу кори и вирусу краснухи и у 88.4% — к вирусу паротита.
Плановые прививки
Согласно Национальному календарю профилактических прививок России иммунизация против кори краснухи и эпидемического паротита состоит из 1 дозы вакцины вводимой в 12 месяцев жизни и ревакцинации, которая проводится в возрасте 6 лет.
Так проводится профилактика кори и краснухи взрослым не болевшим и не привитым в возрасте до 55 лет.
Применение препарата Приорикс® совместно с другими вакцинами.
Вакцину Приорикс® можно вводить одновременно со всеми препаратами из национального календаря профилактических прививок в один день, в разные участки тела, за исключением вакцины БЦЖ.
Применение вакцины Приорикс® совместно с другими прививками не влияет на их иммуногенность (способность выработки иммунитета). Переносимость вакцин не ухудшается, количество побочных реакций не возрастает.
Введение нескольких вакцин в один день не является избыточной нагрузкой на иммунитет.
Все вакцины национального календаря прививок России взаимозаменяемы.
При необходимости постановки туберкулиновой пробы она должна быть проведена или одновременно с вакцинацией или через 6 недель после нее, поскольку коревой (а возможно и паротитный), вакцинальный процесс может вызвать временное снижение чувствительности кожи к туберкулину, что послужит причиной ложного отрицательного результата.
Другие живые вакцины, не входящие в Национальный календарь прививок, должны быть разнесены с вакциной Приорикс® не менее, чем на месяц.
Побочные реакции.
Реакции на вакцину Приорикс® редки и чаше всего переносятся легко. Делятся на местные и общие.
Местные реакции: в первые 48 ч после введения вакцины возможны: незначительная гиперемия места инъекции; слабая отечность и болезненность в месте введения.
Системные реакции: Могут развиваться с 5-го по 15-ий день и являются проявлениями инфекционного процесса вызываемого вакцинальными штаммами вирусов.
Для кори:
- повышение температуры (с 5 по 15 день)
- катаральные явления (с 5 по 15 день)
- необильная кореподобная сыпь (с 7 по 12 день)
Для краснухи:
- увеличение затылочных, шейных и заушных лимфоузлов (с 5 по 12 день)
- кратковременная сыпь (с 5 по 12 день)
- артралгии (с 5 по 12 день)
Для паротита:
- повышение температуры (с 4 по 12 день)
- катаральные явления (с 4 по 12 день)
- увеличение околоушных желез (до 42 дней)
Подобные побочные реакции специальной терапии не требуют. При необходимости проводится симптоматическое лечение.
Противопоказания к применению.
- — первичный и вторичный иммунодефициты
- — острые заболевания и обострения хронических заболеваний (при нетяжелых ОРВИ, острых кишечных заболеваниях допускается вакцинация сразу же после нормализации температуры);
- — беременность;
- — аллергические реакции на предшествующее введение препарата;
- — повышенная чувствительность к неомицину, любому другому ингредиенту вакцины и куриным яйцам (однако наличие в анамнезе контактного дерматита, вызванного неомицином, и аллергической реакции на куриные яйца неанафилактического характера не является противопоказанием к прививке).
Применение препарата Приорикс® при беременности и кормлении грудью
Вакцина Приорикс® противопоказана к применению при беременности.
Возможно применение вакцины в период грудного вскармливания после оценки предполагаемой пользы и потенциального риска.
Вакцинацию женщин детородного возраста проводят при отсутствии беременности и только в том случае, если женщина согласна предохраняться от зачатия в течение 3 месяцев после вакцинации.
Дополнительные сведения.
Применение вакцины Приорикс® возможно только у здоровых детей, сдавших общий анализ крови и мочи перед вакцинацией, и не имеющих отклонений в них. Перед вакцинацией ребенка осматривает педиатр на предмет инфекционных заболеваний. Проведение иммунизации вакциной Приорикс® возможно у тех детей, которые не имеют противопоказаний со стороны нервной системы, это устанавливает невролог.
Вакцина Приорикс® защищает только от кори, краснухи и эпидемического паротита и не защищает от других заболеваний, сопровождающихся поражением слюнных желез, а также от других эритемных инфекционных заболеваний.
Узнать наличие вакцины Приорикс и записаться на прививку можно по телефонам центра:
«Диавакс» на Таганке
+7 (495) 988-47-76
+7 (916) 550-53-03
«Диавакс» на ВДНХ
+7 (495) 616-29-59
+7 (915) 351-92-53
Если хотите пригласить определённого специалиста, оставьте заявку и мы вам перезвоним!
Возможен выезд врача на дом и на предприятия для вакцинации сотрудников. Стоимость выезда врача – договорная. Услуги по проведению вакцинации оплачиваются отдельно в соответствии с действующим прейскурантом.
25 апреля 2021 года
Составить индивидуальный график вакцинации или получить грамотную консультацию специалиста теперь можно не выходя из дома, потому что мы заботимся о Вас, снижая количество контактов и экономя Ваше время!
Онлайн-консультация по вопросам вакцинопрофилактики
Специалистом центра «Диавакс» будет составлен Индивидуальный график вакцинации, прописаны последовательность и сроки вакцинации с перечнем всех необходимых вакцин, исходя из Вашей конкретной ситуации.
Дистанционная консультация аллерголога-иммунолога
Получить исчерпывающую консультацию аллерголога-иммунолога теперь можно в онлайне! Врач поставит предварительный диагноз, определит план обследования, ответит на любые вопросы по уже назначенному лечению, в том числе по лечебному питанию при пищевой аллергии.
А еще мы отвечаем на интересующие вас вопросы в специальном разделе! Чаще всего это вопросы индивидуального характера в отношении вакцинации, иммунитета и тому подобного.
На вопросы отвечают:
- Специалисты в области иммунопрофилактики
- Сотрудники Кафедры инфекционных болезней у детей РНИМУ им. Н.И. Пирогова
Лиофилизат для приготовления раствора для инъекций в комплекте с растворителем, 0.5 мл/доза
1 доза (0,5 мл) содержит
Лиофилизат
активные вещества: живой аттенуированный вирус кори (штамм Schwarz) — не менее103.0 ЦПД501;
живой аттенуированный вирус паротита (штамм RIT 4385) — не менее103.7 ЦПД501;
живой аттенуированный вирус краснухи (штамм Wistar RA 27/3) – не менее103.0 ЦПД501
1 ЦПД — цитопатогенное действие
вспомогательные вещества: лактоза, сорбитол, маннитол, аминокислоты.
Содержит остаточное вещество неомицина сульфат (не более 25 мкг).
Растворитель
Вода для инъекций 0.5 мл
Лиофилизат: однородная пористая масса от беловатого до слегка розового цвета.
Растворитель: прозрачная бесцветная жидкость, без запаха, свободная от видимых примесей.
После разведения растворителем: раствор от светло-персикового до красновато-розового цвета.
Противокоревые вакцины. Вирус кори в комбинации с вирусами паротита и краснухи – живой ослабленный.
Код АТХ J07BD52
Фармакокинетика
Для вакцин не требуется оценка фармакокинетических свойств.
Фармакодинамика
Живая комбинированная аттенуированная вакцина против кори, паротита и краснухи. Аттенуированные вакцинные штаммы вируса кори (Schwarz), эпидемического паротита (RIT4385, производные Jeryl Lynn) и краснухи (Wistar RA 27/3) культивируются раздельно в культуре клеток куриного эмбриона (вирусы паротита и кори) и диплоидных клетках человека MRC-5 (вирус краснухи).
Приорикс соответствует требованиям Всемирной организации здравоохранения по производству биологических препаратов, требованиям к вакцинам против кори, эпидемического паротита, краснухи и живым комбинированным вакцинам.
Иммуногенность
Иммунный ответ у детей в возрасте 12 месяцев и старше
В клинических исследованиях была показана высокая иммуногенность вакцины Приорикс у детей в возрасте от 12 месяцев до 2 лет.
Вакцинация однократной дозой вакцины Приорикс вызывала образование антител к возбудителю кори у 98,1 %, к возбудителю эпидемического паротита – у 94,4 % и к возбудителю краснухи – у 100% ранее серонегативных вакцинированных лиц.
Через два года после первичной вакцинации частота сероконверсии составляла 93,4% в отношении кори, 94,4% в отношении эпидемического паротита и 100% в отношении краснухи.
Несмотря на отсутствие доступных данных, касающихся профилактической эффективности вакцины Приорикс, иммуногенность признана показателем профилактической эффективности. Тем не менее, в некоторых исследованиях в реальных условиях сообщалось, что эффективность в отношении эпидемического паротита может быть ниже, чем наблюдаемая частота сероконверсии в отношении эпидемического паротита.
Иммунный ответ у детей в возрасте от 9 до 10 месяцев
В клиническом исследовании участвовали 300 здоровых детей в возрасте от 9 до 10 месяцев на момент введения первой дозы вакцины. Из них 147 участникам вакцины Приорикс и Варилрикс® были введены одновременно. Частота сероконверсии в отношении кори, эпидемического паротита и краснухи составляла 92,6%, 91,5% и 100% соответственно. Частота сероконверсии, сообщенная после введения второй дозы через 3 месяца после первой дозы, составляла 100% в отношении кори, 99,2% в отношении эпидемического паротита и 100% в отношении краснухи. Следовательно, для обеспечения оптимального иммунного ответа вторую дозу вакцины Приорикс следует вводить в течение трех месяцев после первой.
Подростки и взрослые
Безопасность и иммуногенность вакцины Приорикс непосредственно у подростков и взрослых в клинических исследованиях не изучались.
Внутримышечный способ введения
В клинических исследованиях ограниченному числу участников вакцину Приорикс вводили внутримышечно. Значения частоты сероконверсии в отношении трех компонентов были сопоставимы с таковыми, наблюдаемыми после подкожного введения.
Вакцина Приорикс показана для активной иммунизации детей в возрасте 9 месяцев и старше, подростков и взрослых для профилактики кори, паротита и краснухи.
Приорикс вводится подкожно в дозе 0.5 мл, но также может применяться в виде внутримышечных инъекций.
Пациентам с тромбоцитопенией или каким-либо другим нарушением свертывания крови вакцину предпочтительно вводить подкожно.
Необходимо соблюдать официальные рекомендации во время иммунизации препаратом Приорикс. График вакцинации утверждается в соответствии с Национальным календарем прививок Республики Казахстан, согласно которому детей вакцинируют следующим образом: первичная вакцинация — в возрасте 12-15 месяцев и ревакцинация – в 6 лет.
Дети в возрасте от 9 до 12 месяцев
Иммунный ответ на активные вещества вакцин у детей первого года жизни может оказаться недостаточным. В случае, если эпидемиологическая ситуация требует вакцинации детей первого года жизни, таких как, например, эпидемия или путешествие в эндемичные регионы, вторую дозу вакцины Приорикс следует вводить на втором году жизни, предпочтительно в течение трех месяцев после введения первой дозы. Ни при каких обстоятельствах интервал между дозами не должен составлять менее четырех недель.
Дети младше 9 месяцев
Безопасность и эффективность вакцины Приорикс у детей в возрасте младше 9 месяцев не установлены.
Перед применением растворитель и растворенный лиофилизат необходимо визуально оценить на наличие инородных частиц, в случае обнаружения которых вакцина не подлежит использованию.
Лиофилизированный порошок необходимо растворить растворителем, который прилагается в комплекте, путем введения растворителя во флакон с лиофилизатом.
Полученную смесь взбалтывают до полного растворения лиофилизированного порошка.
В связи с незначительным изменениями рН цвет восстановленной вакцины может варьировать от светло-персикового до красновато-розового, что не влияет на качество вакцины.
Для введения вакцины следует использовать новую иглу.
Полученный раствор следует ввести полностью.
Приорикс ни при каких условиях не вводится внутривенно!
Необходимо дождаться полного испарения спирта или других дезинфицирующих веществ с поверхности кожи перед инъекцией, поскольку они могут инактивировать вирусы данной вакцины.
Приготовленную вакцину следует использовать по возможности сразу после разведения, максимальный срок хранения восстановленной вакцины составляет 8 часов при условии её хранения в холодильнике (при температуре от +2 ºС до +8 ºС).
Любая неиспользуемая вакцина или отходы должны утилизироваться в соответствии с местными требованиями к биоопасным материалам.
Краткий обзор профиля безопасности
Профиль безопасности, представленный ниже, основан в целом на данных, полученных приблизительно от 12000 лиц, которым вакцину Приорикс вводили в клинических исследованиях.
Нежелательные реакции, которые могут развиться после применения комбинированной вакцины для профилактики кори, эпидемического паротита и краснухи, соответствуют таковым, наблюдаемым после введения одновалентных вакцин по отдельности или в комбинации.
В контролируемых клинических исследованиях признаки и симптомы активно отслеживали на протяжении 42‑дневного периода последующего наблюдения. Вакцинированных лиц также просили сообщать обо всех клинических явлениях на протяжении периода исследования.
Наиболее часто встречаемыми нежелательными реакциями после введения вакцины Приорикс были покраснение в месте инъекции и повышение температуры тела ³ 38 ºC (ректальная температура) или ³ 37,5 ºC (температура в подмышечной впадине/полости рта).
Перечень нежелательных реакций
Зарегистрированные нежелательные реакции перечислены в соответствии со следующей частотой встречаемости:
Очень часто (³ 1/10)
Часто (³ 1/100 и < 1/10)
Нечасто (³ 1/1000 до < 1/100)
Редко (³ 1/10000 до < 1/1000)
Данные, полученные в клинических исследованиях
Инфекционные и паразитарные заболевания:
Часто: инфекция верхних дыхательных путей
Нечасто: средний отит
Нарушения со стороны крови и лимфатической системы:
Нечасто: лимфаденопатия
Нарушения со стороны иммунной системы:
Редко: аллергические реакции
Нарушения со стороны обмена веществ и питания:
Нечасто: анорексия
Нарушения психики:
Нечасто: нервозность, патологический плач, бессонница
Нарушения со стороны нервной системы:
Редко: фебрильные судороги
Нарушения со стороны органа зрения:
Нечасто: конъюнктивит
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения:
Нечасто: бронхит, кашель
Нарушения со стороны желудочно-кишечного тракта:
Нечасто: увеличение в размере околоушных слюнных желез, диарея, рвота
Нарушения со стороны кожи и подкожных тканей:
Часто: сыпь
Общие расстройства и нарушения в месте введения:
Очень часто: покраснение в месте введения, повышение температуры тела ³ 38 ºC (ректальная температура) или ³ 37,5 ºC (температура в подмышечной впадине/полости рта)
Часто: боль и припухлость в месте введения, повышение температуры тела > 39,5 ºC (ректальная температура) или > 39 ºC (температура в подмышечной впадине/полости рта)
В целом категории частоты встречаемости для нежелательных реакций были сходными после введения первой и второй дозы вакцины. Исключением из данного правила была боль в месте инъекции, которая встречалась «часто» после введения первой дозы вакцины и «очень часто» после введения второй дозы вакцины.
Данные, полученные при пострегистрационном применении
Во время пострегистрационного наблюдения в редких случаях были выявлены следующие нежелательные реакции. Поскольку данные о них были получены из добровольных сообщений из популяции неизвестного размера, достоверная оценка частоты не может быть предоставлена.
Инфекционные и паразитарные заболевания:
Менингит, кореподобный синдром, паротитоподобный синдром (включающий орхит, эпидидимит и паротит)
Нарушения со стороны крови и лимфатической системы:Тромбоцитопения, тромбоцитопеническая пурпура
Анафилактические реакции
Нарушения со стороны нервной системы:
Энцефалит*, церебеллит, церебеллитоподобные симптомы (включая транзиторное нарушение походки и транзиторную атаксию), синдром Гийена-Барре, поперечный миелит, периферический неврит
Нарушения со стороны сосудов
Васкулит
Нарушения со стороны кожи и подкожных тканей:
Мультиформная эритема
Нарушения со стороны скелетно-мышечной и соединительной ткани:
Артралгия, артрит
* Энцефалит был зарегистрирован с частотой менее 1 случая на 10 миллионов доз. Риск развития энцефалита после введения вакцины намного ниже риска развития энцефалита, вызываемого естественными заболеваниями (корь: 1 случай энцефалита на 1000–2000 случаев; эпидемический паротит: 2–4 случая на 1000; краснуха: приблизительно 1 случай на 6000).
При случайном введении внутрь сосудов могут развиться тяжелые реакции или даже шок. Немедленные мероприятия зависят от степени тяжести реакции.
— повышенная чувствительность к неомицину или к любому другому компоненту вакцины и куриному белку. Контактный дерматит на неомицин не является противопоказанием
— реакции гиперчувствительности на предыдущее введение вакцин, содержащих компоненты кори, эпидемического паротита и/или краснухи
— гуморальный или клеточный иммунодефицит тяжелой степени (первичный или вторичный), в т.ч. манифестная ВИЧ-инфекция
— беременность; женщины должны предохраняться от беременности в течение 1 месяца после вакцинации
— острые инфекционные заболевания, обострение хронических заболеваний
— повышение температуры тела выше 37 ºС.
При необходимости проведения туберкулиновой пробы ее следует проводить либо до вакцинации, либо одновременно с введением вакцины, поскольку сообщалось, что комбинированная вакцина для профилактики кори, краснухи, паротита может вызвать временное снижение чувствительности кожи к туберкулину. Поскольку продолжительность снижения чувствительности может составлять максимум до 6 недель, в течение этого периода времени после вакцинации не следует проводить туберкулиновую пробу во избежание получения ложноотрицательного результата.
Вакцину Приорикс можно вводить одновременно, при условии введения разными шприцами в разные участки тела, с любой из следующих одновалентных или комбинированных вакцин [включая шестивалентные вакцины (АбКДС-ВГВ-ИПВ/Хиб)]: вакцина для профилактики дифтерии-столбняка-коклюша (АбКДС и АцКДС), вакцина для профилактики Haemophilus influenzae типа b (Хиб), инактивированная полиомиелитная вакцина (ИПВ), оральная полиомиелитная вакцина (ОПВ), вакцина для профилактики гепатита В (ВГВ), вакцина для профилактики гепатита А (ВГА), менингококковая конъюгированная вакцина против серотипа С (МенС), вакцина для профилактики ветряной оспы (ВВО) и 10‑валентная пневмококковая конъюгированная вакцина, в соответствии с национальными рекомендациями.
Если Приорикс не вводится одновременно с другими живыми ослабленными вакцинами, то интервал между вакцинациями должен составлять не менее одного месяца.
У лиц, получавших человеческий гамма-иммуноглобулин или переливание крови, вакцинация должна быть отложена на срок не менее трех месяцев и не более 11 месяцев, ввиду возможной неэффективности в результате воздействия пассивно введенных антител на вакцинные вирусы кори, эпидемического паротита и краснухи.
Приорикс может применяться в качестве бустерной дозы у пациентов, вакцинированных ранее другой комбинированной вакциной от кори, эпидемического паротита и краснухи.
Приорикс нельзя смешивать с другими вакцинами в одном шприце.
Вакцинация Приорикс должна быть отложена у лиц, страдающих острыми лихорадочными состояниями. Легкая инфекция не является противопоказанием для вакцинации.
После или даже перед любой вакцинацией, особенно у подростков, возможно развитие обморочного состояния как психологической реакции на инъекционный путь введения препарата. Оно может сопровождаться некоторыми неврологическими признаками, такими как транзиторное нарушение зрения, парестезии и тонико-клонические движения конечностей во время восстановления сознания. Важно, чтобы место проведения процедуры позволяло избежать возможных повреждений при падении в обморок.
Необходимо дождаться полного испарения спирта или других дезинфицирующих веществ с поверхности кожи перед инъекцией, поскольку они могут инактивировать вирусы данной вакцины.
Ограниченная защита от кори может быть достигнута путем вакцинации в течение до 72 часов после контакта с больными корью.
Вакцинация детей в возрасте до 12 месяцев может оказаться недостаточно эффективной по коревому компоненту в связи с возможным сохранением у них материнских антител.
Как и с другими инъекционными вакцинами, должен быть налажен соответствующий медицинский уход и наблюдение на случай возникновения редких анафилактических реакций после применения вакцины. Места проведения прививок должны быть обеспечены средствами противошоковой терапии.
Коревые и паротитные компоненты вакцины, выделенные на тканях культур куриных эмбрионов, содержат яичный белок. У пациентов, имеющих в анамнезе анафилактические, анафилактоидные и другие реакции (например, генерализованная крапивница, отек гортани и ротовой области, затрудненное дыхание, гипотония, шок) на прием куриного белка, существует риск проявления реакции гиперчувствительности немедленного типа после прививки. В связи с этим у пациентов с известной гиперчувствительностью к куриному белку вакцинация должна проводиться с крайней осторожностью, при наличии полного комплекта противошоковой терапии на случай возникновения аллергической реакции.
Приорикс должен применяться с осторожностью у лиц, имеющих в анамнезе у себя или членов семьи аллергические и судорожные реакции.
Приорикс ни при каких обстоятельствах нельзя назначать внутривенно.
Как и в случае с другими вакцинами, адекватный ответ на вакцинацию может быть достигнут не у всех вакцинируемых.
Пациентов с наследственной непереносимостью фруктозы не следует вакцинировать вакциной Приорикс, поскольку она содержит сорбитол.
Тромбоцитопения
При проведении вакцинации живыми вакцинами для профилактики кори, краснухи и паротита у пациентов с тромбоцитопенией после введения первой дозы наблюдались случаи ухудшения течения тромбоцитопении и случаи рецидива тромбоцитопении. Тромбоцитопения, связанная с введением вакцины для профилактики кори, краснухи и паротита, встречается редко и обычно носит самоограничивающийся характер. У пациентов с наличием тромбоцитопении или с тромбоцитопенией в анамнезе после вакцинации для профилактики кори, краснухи и паротита необходимо тщательно оценивать соотношение польза/риск применения вакцины Приорикс. Таких пациентов следует вакцинировать с осторожностью, и вакцину предпочтительно вводить подкожно.
Пациенты с ослабленным иммунитетом
Можно рассмотреть возможность вакцинации у пациентов с отдельными иммунодефицитами, если польза превышает риски (например, пациенты с бессимптомной ВИЧ‑инфекцией, дефицитом подкласса IgG, врожденной нейтропенией, хроническим гранулематозом и заболеваниями, связанными с недостаточностью комплемента).
У пациентов с иммунодефицитом, не имеющих противопоказаний к данной вакцинации, ответ на введение вакцины может быть менее выраженным, чем у лиц с нормальным иммунитетом, поэтому у некоторых из них могут развиться корь, эпидемический паротит или краснуха в случае контакта, несмотря на введение вакцины. Необходимо тщательное наблюдение таких пациентов в отношении появления признаков кори, эпидемического паротита и краснухи.
Передача возбудителей инфекционных заболеваний
Не было документировано случаев передачи вирусов кори и эпидемического паротита от вакцинированных лиц к восприимчивым контактным лицам. Известно, что вирусы краснухи и кори выделяются из глотки в течение 7–28 дней после вакцинации; при этом максимальное выделение наблюдается приблизительно на 11‑й день. Тем не менее, отсутствуют доказательства передачи данных выделяемых вирусов, содержащихся в вакцине, восприимчивым контактным лицам. Были документированы случаи передачи вируса краснухи детям через грудное молоко, а также через плаценту без каких-либо клинических признаков заболевания.
Фертильность
Нет данных.
Беременность
Противопоказано применение вакцины Приорикс беременным женщинам.
Однако не зафиксировано сообщений о повреждении плода в случаях, когда вакцинация от кори, краснухи и паротита проводилась во время беременности.
Даже если теоретический риск не может быть исключен, не было зарегистрировано ни одного случая синдрома врожденной краснухи у более чем 3500 привитых женщин, которые были на ранних сроках беременности и не знали об этом в момент вакцинации против краснухи. Таким образом, случайная вакцинация против кори, эпидемического паротита и краснухи женщин, которые на момент вакцинации не знали о своей беременности, не должно быть причиной для прерывания беременности.
Необходимо использовать контрацептивные методы во избежание развития беременности в течение 1 месяца после вакцинации.
Лактация
Опыт применения вакцины Приорикс у кормящих женщин ограничен. В исследованиях было показано, что кормящие женщины в послеродовом периоде, вакцинированные живыми аттенуированными вакцинами для профилактики краснухи, могут выделять вирус в грудное молоко и передавать его детям, находящимся на грудном вскармливании, без развития каких-либо симптомов заболевания у последних. Только в случае, если у ребенка подтвержден иммунодефицит или предполагается его наличие, необходимо оценить риски и пользу вакцинации матери
Особенности влияния лекарственного средства на способность управлять транспортными средствами и другими механизмами и другими потенциально опасными механизмами
Влияние вакцины на способность управлять автомобилем и работать с механизмами маловероятно.
Не отмечалось побочных эффектов, связанных с передозировкой (введение 2-х доз).
Лиофилизат для приготовления раствора для инъекций в комплекте с растворителем, 0.5 мл/доза.
Лиофилизат: флакон из прозрачного стекла типа I, герметически укупоренный резиновой бутиловой пробкой.
Растворитель: запечатанная ампула из бесцветного стекла с белым кольцом для вскрытия на горлышке ампулы.
100 флаконов с лиофилизатом в картонную коробку вместе с инструкцией по медицинскому применению на государственном и русском языках.
100 ампул с растворителем в отдельную картонную коробку.
Лиофилизат: хранить при температуре от 2 ºС до 8 ºС в оригинальной упаковке для защиты от света. Не замораживать.
Растворитель: хранить при температуре от 2 ºС до 25 ºС. Не замораживать.
Восстановленная вакцина: можно хранить в течение 8 часов при температуре от 2 ºС до 8 ºС.
Хранить в недоступном для детей месте!
Условия транспортировки
При температуре от 2 ºС до 8 ºС. Не замораживать.
Лиофилизат: 2 года
Растворитель: 5 лет
Не применять по истечении срока годности
По рецепту (только для специализированных учреждений)
GlaxoSmithKline Biologicals s.a., Бельгия
(Rue de l’Institut 89, 1330 Rixensart, Belgium)