Капрелса — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-002238
Торговое наименование:
Капрелса® (Caprelsa®)
Международное непатентованное наименование:
вандетаниб
Лекарственная форма
таблетки, покрытые плёночной оболочкой
Состав
Одна таблетка 100 мг содержит:
Активное вещество: вандетаниб 100,0 мг
Вспомогательные вещества: кальция гидрофосфата дигидрат 105,0 мг, целлюлоза микрокристаллическая 25,0 мг, кросповидон 12,5 мг, повидон-К29-32 5,0 мг, магния стеарат 2,5 мг; оболочка таблетки: гипромеллоза 2910 4,9 мг, макрогол 300 1,0 мг, титана диоксид 1,6 мг.
Одна таблетка 300 мг содержит:
Активное вещество: вандетаниб 300,0 мг
Вспомогательные вещества: кальция гидрофосфата дигидрат 315,0 мг, целлюлоза микрокристаллическая 75,0 мг, кросповидон 37,5 мг, повидон-К29-32 15,0 мг, магния стеарат 7,5 мг; оболочка таблетки: гипромеллоза 2910 14,7 мг, макрогол 300 3,0 мг, титана диоксид 4,8 мг.
Описание
Таблетки 100 мг: Круглые, двояковыпуклые таблетки, покрытые плёночной оболочкой белого цвета, с гравировкой Z100 на одной стороне.
Таблетки 300 мг: Овальные, двояковыпуклые таблетки, покрытые плёночной оболочкой белого цвета, с гравировкой Z300 на одной стороне.
Фармакотерапевтическая группа:
противоопухолевое средство, ингибитор протеинтирозинкиназы
Код АТХ:
L01XE12
Фармакологические свойства
Фармакодинамика
Вандетаниб, являясь селективным ингибитором тирозинкиназы, подавляет активность тирозинкиназы рецептора-2 фактора роста сосудистого эндотелия (VEGF), стимулированного фактором роста сосудистого эндотелия (VEGF) в эндотелиальных клетках. Вандетаниб ингибирует миграцию, пролиферацию, выживаемость эндотелиальных клеток и формирование новых кровеносных сосудов, стимулированных VEGF на in vitro моделях ангиогенеза. In vivo вандетаниб уменьшал ангиогенез, индуцированный опухолевыми клетками, проницаемость сосудов опухоли и плотность микрососудистой сети опухоли, подавлял рост опухоли и метастазов на моделях гетеротрансплантата рака легкого человека у бестимусных мышей.
Кроме того, в клетках опухоли и эндотелиальных клетках вандетаниб ингибирует тирозинкиназу рецептора эпидермального фактора роста (EGF), стимулированного EGF. Вандетаниб подавляет EGFR-зависимую пролиферацию и выживаемость клеток in vitro.
In vitro исследования показали, что вандетаниб также ингибирует активность других тирозинкиназ, включая реаранжированных во время трансфекции (RET) и тирозинкиназ рецептора-3 VEGF (Flt-4).
В ходе клинического исследования с участием 331 пациента с нерезектабельным местнораспространенным или метастатическим медуллярным раком щитовидной железы показано статистически значимое улучшение выживаемости без прогрессирования, а также преимущество в частоте ответа, контроле над заболеванием, биохимическом ответе и времени до ухудшения болевого синдрома у пациентов при приеме вандетаниба по сравнению с плацебо.
Зависимость эффективности терапии вандетанибом от статуса мутации RET не доказана.
Фармакокинетика
Фармакокинетика вандетаниба в дозе 300 мг у пациентов с медуллярным раком щитовидной железы характеризуется клиренсом приблизительно 13,2 л/час, объемом распределения приблизительно 7450 л и периодом полувыведения из плазмы приблизительно 19 дней.
Всасывание
После приема внутрь всасывание вандетаниба происходит медленно, максимальная концентрация в плазме обычно достигается в среднем через 6 часов (диапазон 4-10 часов) после приема. При многократном применении наблюдалась 8-кратная кумуляция вандетаниба, с достижением равновесного состояния примерно через 2 месяца.
Распределение
Вандетаниб связывается с альбумином и альфа-1-кислым гликопротеином сыворотки человека, при этом in vitro связывание с белками составляет примерно 90%. В ex vivo образцах плазмы пациентов с колоректальным раком при равновесной экспозиции после приема препарата в дозе 300 мг/сутки связывание препарата с белками в среднем составляло 93,7% (диапазон 92,2% — 95,7%).
Метаболизм
После приема внутрь 14С-вандетаниба неизмененный вандетаниб и метаболиты вандетаниб-N-оксид и N-десметил-вандетаниб обнаружены в плазме, моче и фекалиях. Конъюгат глюкуроновой кислоты был незначительным метаболитом только в экскрете. N-десметил-вандетаниб, в основном, образуется под действием изофермента CYP3A4, а вандетаниб-N-оксид — под действием флавинсодержащих монооксигеназ FMO1 и FMO3. N-десметил-вандетаниб и вандетаниб-N-оксид циркулируют в крови в концентрациях приблизительно 11% и 1,4%, соответственно, от концентрации вандетаниба.
Выведение
В течение 21 дня после однократного приема 14С-вандетаниба примерно 69% препарата выводилось: 44% с фекалиями и 25% с мочой. Выведение препарата происходило медленно, и, следует ожидать, что дальнейшее выведение после 21 дня основывается на периоде полувыведения из плазмы крови.
Вандетаниб не являлся субстратом hOCT2, экспрессированного в НЕК293 клетках. Вандетаниб ингибирует поглощение селективного субстрата ОСТ2 маркера 14С-креатинина НЕК-ОСТ2 клетками, при этом среднее значение IC50 составляет приблизительно 2,1 мкг/мл. Это выше, чем плазменные концентрации вандетаниба (примерно 0,81 и 0,32 мкг/мл), достигаемые после многократного приема препарата в дозах 300 мг и 100 мг, соответственно. Вандетаниб ингибирует почечную экскрецию креатинина, в результате чего концентрация креатинина в плазме крови пациентов, принимающих вандетаниб, повышается.
Показания
Нерезектабельный местнораспространенный или метастатический медуллярный рак щитовидной железы.
Противопоказания
Повышенная чувствительность к вандетанибу или любому вспомогательному веществу.
Врожденный синдром удлинения интервала QT.
Беременность и период грудного вскармливания.
Пациенты с интервалом QTc более 480 мс.
Одновременное применение с другими лекарственными средствами, способными удлинять интервал QTc и/или вызывающие трепетание/мерцание: мышьяк, цизаприд, эритромицин (внутривенно), торемифен, мизоластин, моксифлоксацин, антиаритмические средства IА и III класса.
Детский возраст до 18 лет.
Почечная недостаточность тяжелой степени тяжести (клиренс креатинина < 30 мл/мин).
Печеночная недостаточность.
С осторожностью:
почечная недостаточность средней степени тяжести (клиренс креатинина ≥ 30 и < 50 мл/мин).
Беременность и период грудного вскармливания
Беременность
Не проводились адекватные и хорошо-контролируемые исследования препарата Капрелса® с участием беременных женщин. Согласно данным доклинических исследований прием препарата Капрелса® может нанести вред плоду, поскольку высок риск развития патологий эмбриона/плода. В соответствии с фармакологическим действием вандетаниб оказывал значимое воздействие на все стадии репродуктивной функции у самок крыс.
Применение препарата в период беременности противопоказано.
Период грудного вскармливания
Отсутствуют данные о применении препарата Капрелса® у женщин в период грудного вскармливания. Вандетаниб выделялся в молоко крыс, и обнаруживался в плазме крови детёнышей после введения препарата лактирующим крысам. Грудное вскармливание противопоказано в период лечения препаратом Капрелса®.
Способ применения и дозы
Внутрь по 300 мг 1 раз в сутки (1 таблетка 300 мг или 3 таблетки 100 мг), вне зависимости от приема пищи.
Таблетка также может быть диспергирована в 60 мл негазированной питьевой воды.
Другие жидкости использовать нельзя. Таблетку следует опустить в воду, не измельчая, помешивать в течение около 10 минут (таблетка полностью не растворится) и сразу же выпить полученную суспензию. Остатки смешать с дополнительными 120 мл воды и выпить полученную суспензию. Суспензию препарата Капрелса® можно также вводить через назогастральный зонд или гастростому.
Терапию препаратом Капрелса® следует продолжать до тех пор, пока пациенты с медуллярным раком щитовидной железы не перестанут получать пользу от проводимого лечения.
В случае, если пациент пропустил прием очередной дозы препарата, следующую суточную дозу следует принять согласно назначенной схеме лечения.
Коррекция дозы
Необходим контроль состояния пациента.
В связи с 19-дневным периодом полувыведения, неблагоприятные реакции, связанные с токсичностью, включая удлинение интервала QT, могут не разрешиться быстро.
При развитии токсичности 3 степени СТСАЕ (Общие терминологические критерии оценки нежелательных явлений) или выше, или удлинении интервала QТ на электрокардиограмме (ЭКГ), необходимо временно приостановить терапию до разрешения токсичности или уменьшения её тяжести до СТСАЕ степени 1 (см. раздел «Особые указания»), затем возобновив лечение с более низкой дозы. Суточную дозу 300 мг можно уменьшить до 200 мг (две таблетки по 100 мг), и затем при необходимости до 100 мг.
Особые популяции пациентов
Дети или подростки
Препарат Капрелса® не предназначен для применения у детей, поскольку безопасность и эффективность не установлены.
Пожилые пациенты (старше 65 лет)
Не требуется корректировать начальную дозу у пожилых пациентов. Клинические данные о применении препарата у пациентов в возрасте старше 75 лет ограничены.
Пациенты с почечной недостаточностью
Данные о применении препарата у пациентов с почечной недостаточностью средней степени тяжести ограничены. Согласно имеющимся данным профиль безопасности у пациентов с почечной недостаточностью легкой степени тяжести схож с профилем безопасности у пациентов с нормальной функцией почек. Коррекции начальной дозы у пациентов с почечной недостаточностью легкой степени тяжести не требуется. У пациентов с почечной недостаточностью средней степени тяжести (клиренс креатинина ≥ 30 и < 50 мл/мин) начальную дозу следует уменьшить до 200 мг. Вандетаниб противопоказан пациентам с почечной недостаточностью тяжелой степени тяжести (клиренс креатинина < 30 мл/мин), поскольку опыт применения препарата в данной популяции ограничен, безопасность и эффективность не установлены.
Исследование фармакокинетики вандетаниба у добровольцев с почечной недостаточностью тяжелой степени тяжести показало, что экспозиция вандетаниба может увеличиваться до 2-х раз.
Пациенты с печеночной недостаточностью
Согласно результатам исследований фармакокинетики у добровольцев не требуется изменять начальную дозу препарата у пациентов с легкой, умеренной или тяжелой печеночной недостаточностью. Опыт применения препарата Капрелса® у пациентов с печеночной недостаточностью (концентрация билирубина сыворотки выше верхней границы нормы более чем в 1,5 раза) ограничен. Применение препарата Капрелса® у пациентов с печеночной недостаточностью противопоказано в связи с недостаточностью данных по безопасности и эффективности препарата у данной группы пациентов.
Побочное действие
Наиболее частыми нежелательными побочными реакциями при применении препарата Капрелса® были диарея, сыпь, тошнота, повышение артериального давления и головная боль. Ниже описаны нежелательные реакции, наблюдавшиеся в завершенных клинических исследованиях с участием пациентов, получавших препарат Капрелса® для лечения медуллярного рака щитовидной железы, если не указано иначе.3
Частота нежелательных реакций представлена в виде следующей градации: очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (≥1/1000, <1/100), редко (≥1/10000, <1/1000), очень редко (< 1/10000), включая отдельные сообщения.
Со стороны сердца и сосудов:
Очень часто: удлинение интервала QТс на ЭКГ1,2, повышение артериального давления
Часто: ишемические цереброваскулярные явления, гипертонический криз
Нечасто: сердечная недостаточность, острая сердечная недостаточность, нарушения ритма, нарушение сердечной проводимости, желудочковая аритмия и остановка сердца
Со стороны желудочно-кишечного тракта:
Очень часто: диарея, тошнота, рвота, боли в животе, диспепсия
Часто: стоматит, сухость во рту, колит, дисфагия, запор, гастрит, желудочно-кишечное кровотечение
Нечасто: панкреатит, перитонит, непроходимость кишечника, перфорации кишечника, недержание кала
Общие расстройства:
Очень часто: утомляемость, астения, боль, отек
Часто: лихорадка
Нечасто: нарушение заживления ран
Лабораторные и инструментальные данные:
Очень часто: удлинение интервала QTc на ЭКГ
Часто: снижение массы тела, повышение активности аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ), повышение концентрации креатинина в крови
Нечасто: повышение концентрации гемоглобина, повышение активности амилазы в сыворотке
Со стороны обмена веществ и питания:
Очень часто: снижение аппетита, гипокальциемия
Часто: гипокалиемия, гиперкальциемия, гипергликемия, обезвоживание, гипонатриемия
Нечасто: нарушение питания (истощение)
Со стороны эндокринной системы:
Часто: гипотиреоз
Нарушения психики:
Очень часто: бессонница
Часто: депрессия, тревожность
Со стороны почек и мочевыводящих путей:
Часто: протеинурия, почечнокаменная болезнь, гематурия, дизурия, почечная недостаточность, учащенное мочеиспускание, императивные позывы к мочеиспусканию
Нечасто: хроматурия, анурия
Со стороны дыхательной системы:
Часто: носовое кровотечение, кровохарканье, пневмонит
Нечасто: дыхательная недостаточность, аспирационная пневмония
Со стороны кожи и подкожных тканей:
Очень часто: сыпь и другие кожные реакции (включая акне, сухость кожи, дерматит, зуд), реакции фоточувствительности, поражение ногтей
Часто: ладонно-подошвенная эритродизестезия, алопеция
Нечасто: буллезный дерматит, синдром Стивенса-Джонсона3, токсический эпидермальный некролиз
Со стороны органа зрения:
Очень часто: структурные изменения роговицы (включая роговичный преципитат и помутнение роговицы)
Часто: нечеткость зрения, конъюнктивит, сухость глаз, нарушения зрения, фотопсия, радужные круги вокруг источника света, глаукома, кератопатия
Нечасто: катаракта, нарушение аккомодации
Со стороны нервной системы:
Очень часто: головная боль, парестезия, дизестезия, головокружение
Часто: тремор, летаргия, потеря сознания, нарушение равновесия, нарушения вкуса
Нечасто: судороги, клонус, отек мозга
Инфекционные и паразитарные заболевания:
Очень часто: назофарингит, бронхит, инфекции верхних дыхательных путей, инфекции мочевыводящих путей
Часто: пневмония, сепсис, грипп, цистит, синусит, ларингит, фолликулит, фурункул, грибковые инфекции, пиелонефрит
Нечасто: аппендицит, стафилококковые инфекции, дивертикулит, целлюлит, абсцесс брюшной стенки
Нарушения со стороны печени и желчевыводящих путей:
Часто: желчнокаменная болезнь
1 У 13,4 % пациентов в группе вандетаниба интервал QTc (по Базетту) составил ≥ 500 мс по сравнению с 1,0% в группе плацебо. Удлинение интервала QTcF на >20 мс отмечено у более чем 91% пациентов, >60 мс — у 35% пациентов, >100 мс — у 1,7% пациентов. В связи с удлинением интервала QTc у 8% пациентов была снижена доза препарата.
2 Включая 2 случая со смертельным исходом (один в связи с сепсисом и один в связи с сердечной недостаточностью) у пациентов с интервалом QTc более 550 мс.
3 Частота основана на суммарном количестве пациентов (4684), принимавших препарат Капрелса® в клинических исследованиях.
На фоне монотерапии вандетанибом отмечали случаи развития аритмии желудочковой тахисистолической типа «пируэт», мультиформной эритемы, интерстициального заболевания легких (в некоторых случаях с летальным исходом) и синдрома обратимой задней лейкоэнцефалопатии. Ожидается, что у пациентов с медуллярным раком щитовидной железы, получающих вандетаниб, эти нежелательные явления будут отмечаться нечасто.
Нарушения зрения, например, нечеткость зрения, часто наблюдали у пациентов с медуллярным раком щитовидной железы, получавших препарат Капрелса®. Плановое исследование с помощью щелевой лампы выявило помутнение роговицы (вортикозные кератопатии) у пациентов, однако регулярное офтальмологическое обследование с помощью щелевой лампы не требуется.
В рандомизированном исследовании у пациентов с медуллярным раком щитовидной железы очень часто отмечали следующие изменения лабораторных показателей: белок и кровь в моче (экспресс-анализ с помощью тест-полосок), повышение концентрации тиреотропного гормона, гемоглобина и креатинина в сыворотке крови, повышение активности амилазы, повышение активности липазы. Отмечали повышение концентрации креатинина 1-2 степени СТСАЕ, что может быть связано с ингибированием ОСТ2 (см. раздел «Фармакокинетика»).
У пациентов, принимавших вандетаниб, отмечали повышение концентрации гемоглобина в среднем на 0,5 — 1,5 г/дл по сравнению с исходным значением.
Передозировка
Специфического лечения при передозировке препаратом Капрелса® не существует, возможные симптомы передозировки не установлены. Увеличение частоты развития и тяжести некоторых нежелательных реакций, таких как сыпь, диарея и артериальная гипертензия, отмечено при приеме препарата многократно в дозах 300 мг и выше. Следует учитывать возможное удлинение интервала QT и развитие аритмии желудочковой тахисистолической типа «пируэт».
В случае развития нежелательных реакций, связанных с передозировкой, следует проводить симптоматическое лечение, в частности, назначить соответствующее лечение тяжелой диареи. При передозировке следует прекратить дальнейший прием препарата, и предпринять соответствующие меры для предотвращения развития нежелательных явлений, например, выполнять ЭКГ в течение 24 часов для определения удлинения интервала QTc.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействия
Влияние вандетаниба на фармакокинетику других лекарственных препаратов
Данные in vitro указывают, что вандетаниб является умеренным индуктором изофермента CYP3A4. В связи с чем следует соблюдать осторожность при применении вандетаниба с субстратами изофермента CYP3A4, особенно эстроген/прогестерон комбинированными препаратами, иммунодепрессантами, такими как циклоспорин или такролимус, или противоопухолевыми препаратами подобно доцетакселу и бортезомибу. При совместном применении мидазолама (субстрат изофермента CYP3A4) и вандетаниба здоровыми добровольцами концентрация мидазолама не изменялась.
Применение вандетаниба с препаратами, выведение которых происходит при участии транспортера Р-гликопротеина (Р-gp) (например, дабигатран или дигоксин), может приводить к повышению концентрации этих препаратов в плазме и потребовать пристального клинического и лабораторного наблюдения за состоянием пациента и даже снижения дозы этих препаратов (наблюдение за пациентами, получающими вандетаниб, описано в разделах «Способ применения и дозы» и «Особые указания»). При совместном применении дигоксина и вандетаниба здоровыми добровольцами отмечено повышение AUC(o-t) (площадь под кривой зависимости концентрации от времени) и Cmax(максимальная концентрация) дигоксина на 23 % и 29 %, соответственно. Следует учитывать возможность удлинения интервала QT, развития желудочковой тахиаритмии типа «пируэт» при совместном применении вандетаниба и дигоксина; может потребоваться коррекция дозы. Вандетаниб, являясь ингибитором транспортера органических катионов (ОСТ2), может замедлять выведение метформина и других субстратов ОСТ2, тем самым повышая их концентрацию. При совместном применении метформина (субстрат ОСТ2) и вандетаниба здоровыми добровольцами (дикий тип ОСТ2) отмечено повышение AUC(o-t) и Cmax метформина на 74% и 50%, соответственно, а также снижение почечного клиренса метформина на 52%. Может потребоваться более тщательное наблюдение за пациентом и снижение дозы метформина (наблюдение за пациентами, получающими вандетаниб, описано в разделах «Способ применения и дозы» и «Особые указания»).
Влияние других лекарственных препаратов на фармакокинетику вандетаниба
При совместном применении омепразола и вандетаниба здоровыми добровольцами отмечено снижение Cmax вандетаниба на 15%, при этом значение AUC(o-t) не изменилось. При совместном применении ранитидина и вандетаниба значения Cmax и AUC(o-t) вандетаниба не изменялись. При совместном применении вандетаниба и ранитидина или омепразола коррекция дозы не требуется.
Не наблюдалось клинически значимого взаимодействия вандетаниба и мощного ингибитора изофермента CYP3A4, итраконазола. Однако при совместном применении вандетаниба и итраконазола, и других мощных ингибиторов изофермента CYP3A4 (например, кетоконазола, ритонавира и кларитромицина) следует соблюдать осторожность.
При совместном применении вандетаниба и рифампицина, мощного индуктора изофермента CYP3A4 у мужчин, концентрация вандетаниба снижалась на 40%, поэтому следует избегать совместного применения вандетаниба и мощных индукторов изофермента CYP3A4 (например, рифампицина, карбамазепина, фенобарбитала и препаратов зверобоя продырявленного) (см. раздел «Особые указания»).
Лекарственные препараты, способные удлинять интервал QTc
Вандетаниб может вызывать удлинение интервала QTc, поэтому его не следует принимать одновременно с другими лекарственными средствами, способными удлинять интервал QTc и/или вызывающими трепетание/мерцание:
- Противопоказано применение с мышьяком, цизапридом, эритромицином (внутривенно), торемифеном, мизоластином, моксифлоксацином, антиаритмическими средствами IA и III класса (см. раздел «Противопоказания»).
- Не рекомендовано применение с метадоном, галоперидолом, амисульпридом, хлорпромазином, сульпиридом, зуклопентиксолом, галофантрином, пентамидином и лумефантрином.
При отсутствии подходящей альтернативной терапии применение нерекомендуемой комбинации препаратов возможно, если обеспечен мониторинг интервала QTc на ЭКГ, контроль концентрации электролитов, и дополнительный контроль в случае возникновения или усиления диареи.
При совместном применении вандетаниба и ондансетрона наблюдали незначительный аддитивный эффект на удлинение интервала QTc (приблизительно на 10 мс), поэтому совместное применение этих препаратов не рекомендуется. В случае применения ондансетрона совместно с вандетанибом требуется тщательный контроль концентрации электролитов в сыворотке и ЭКГ, а также интенсивная терапия любых нарушений.
Прием пищи не влияет на концентрацию вандетаниба.
Ввиду возможного взаимодействия антагонистов витамина К и химиотерапевтических препаратов, рекомендуется более частый мониторинг международного нормализованного отношения (МНО).
Особые указания
Принимая во внимание возможные риски, очень важно назначать терапию вандетанибом только пациентам, которым она объективно показана, а именно пациентам с симптоматически-агрессивным течением заболевания. Только наличие симптомов или только прогрессирование заболевания не является достаточным основанием для назначения вандетаниба.
Показатель изменения концентрации биомаркеров, таких как кальцитонин и/или раковоэмбриональный антиген (СЕА), а также темп роста опухоли во время динамического наблюдения помогут определить пациентов, нуждающихся в данной терапии, а также оптимальное время ее начала.
Удлинение интервала QTc
У пациентов, получавших препарат Капрелса®, наблюдали удлинение интервала QTc на ЭКГ (см. раздел «Побочное действие»). У 8% пациентов с медуллярным раком щитовидной железы, получавших препарат в дозе 300 мг/сутки, в исследовании фазы III наблюдалось подтвержденное удлинение интервала QTc на ЭКГ. Удлинение QTc интервала на ЭКГ зависит от дозы, и поддается лечению путем соответствующего мониторинга, приостановки терапии и снижения дозы, если потребуется.
Нечасто сообщалось о случаях развития аритмии желудочковой тахисистолической типа «пируэт» (Torsades de Pointes) и желудочковой тахикардии при применении препарата Капрелса® в дозе 300 мг.
Не следует начинать терапию препаратом Капрелса® у пациентов со скорректированным значением интервала QT на ЭКГ более 480 мс. Не следует назначать препарат Капрелса® пациентам с аритмией желудочковой тахисистолической типа «пируэт» в анамнезе, кроме случаев, когда все факторы риска, способствующие ее развитию, скорректированы. Исследования применения препарата Капрелса® у пациентов с желудочковыми аритмиями или недавно перенесенным инфарктом миокарда не проводились.
ЭКГ и результаты измерений сывороточных концентраций калия, кальция, магния и ТТГ (тиреотропного гормона) необходимо получить до начала, через 2-4 недели и 8-12 недель после начала применения препарата Капрелса®, и затем каждые 3 месяца на протяжении года. ЭКГ и анализы крови необходимо также выполнять по клиническим показаниям во время этого периода и впоследствии. Концентрация калия в сыворотке крови должна поддерживаться на значении 4 мэкв/л или выше, а концентрации магния и кальция должны быть в пределах нормы для снижения риска удлинения интервала QT (на ЭКГ).
При отсутствии альтернативной терапии препарат Капрелса® можно применять с некоторыми препаратами, удлиняющими интервал QT на ЭКГ (см. раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействия»). Если такие препараты назначены пациенту, уже принимающему препарат Капрелса®, то необходимо выполнять ЭКГ мониторинг интервала QT в соответствии с фармакокинетикой добавленного препарата.
При значении интервала QTc на ЭКГ более 500 мс при однократном измерении необходимо приостановить терапию препаратом Капрелса®. После возврата интервала QTc к исходному значению или менее 450 мс можно возобновить прием препарата в более низкой дозе.
Кожные реакции
Во время терапии препаратом Капрелса® у пациентов наблюдали развитие сыпи и других кожных реакций (включая реакции фоточувствительности и синдрома ладонноподошвенной эритродизестезии).
Слабо и умеренно выраженные кожные реакции обычно разрешаются при проведении симптоматической терапии или снижении дозы препарата Капрелса®. При развитии более тяжелых кожных реакций (таких как синдром Стивенса-Джонсона, токсический эпидермальный некролиз) пациенту рекомендуется обратиться за неотложной медицинской помощью. В этих случаях может потребоваться системная терапия, например, стероидными препаратами и рекомендуется отмена препарата Капрелса®.
Во время терапии препаратом Капрелса® необходимо носить одежду, защищающую от воздействия солнечных лучей, и/или использовать солнцезащитные средства.
Диарея
У пациентов, принимавших препарат Капрелса®, наблюдалось развитие диареи. Для лечения диареи рекомендуется применение обычных противодиарейных средств. Необходимо внимательно контролировать сывороточные концентрации электролитов. При развитии тяжелой диареи (3-4 степени СТСАЕ) прием препарата необходимо приостановить до улучшения состояния, возобновляя терапию с меньшей дозы (см. разделы «Способ применения и дозы», «Побочное действие»).
Кровотечение
Сообщалось о случаях внутричерепного кровоизлияния, в связи с чем следует соблюдать осторожность при применении препарата Капрелса®у пациентов с метастазами в головной мозг.
Артериальная гипертензия
На фоне приема препарата Капрелса® было отмечено развитие артериальной гипертензии, включая гипертонический криз. В связи с чем рекомендуется наблюдение пациентов и назначение соответствующего лечения артериальной гипертензии. Если высокое артериальное давление не поддается контролю лекарственными средствами, прием препарата Капрелса® не следует возобновлять до нормализации артериального давления (см. раздел «Побочное действие»). Может потребоваться снижение дозы препарата.
Сердечная недостаточность
У пациентов, принимавших препарат Капрелса®, отмечали развитие сердечной недостаточности, в некоторых случаях необратимой и с летальным исходом. При развитии сердечной недостаточности может потребоваться временная или полная отмена терапии препаратом Капрелса®.
Повышение активности АЛТ
На фоне приема препарата Капрелса® часто отмечали повышение активности АЛТ. Большинство случаев разрешалось по мере продолжения терапии, другие — после приостановки лечения на 1-2 недели. При применении препарата Капрелса® рекомендуется периодически проводить оценку активности АЛТ.
Интерстициальное заболевание легких
При применении препарата Капрелса® наблюдалось развитие интерстициального заболевания легких, в некоторых случаях с летальным исходом. При возникновении таких респираторных симптомов как одышка, кашель и лихорадка, применение препарата Капрелса® должно быть приостановлено и проведено незамедлительное обследование. В случае подтверждения интерстициального заболевания легких, прием препарата Капрелса® следует прекратить и назначить соответствующее лечение.
Синдром обратимой задней лейкоэнцефалопатии (СОЗЛ)
У пациентов, принимавших препарат Капрелса® в комбинации с химиотерапией, или у детей с опухолью мозга, получавших монотерапию препаратом Капрелса®, отмечали развитие синдрома обратимой задней лейкоэнцефалопатии, синдрома подкоркового вазогенного отека, выявляемого на МРТ головного мозга. СОЗЛ отмечали у пациентов, принимавших вандетаниб. Данный синдром должен быть заподозрен при появлении у пациентов судорог, головной боли, нарушения зрения, спутанности сознания или нарушения умственной функции.
Почечная недостаточность
У пациентов с почечной недостаточностью средней степени тяжести (клиренс креатинина ≥ 30 и < 50 мл/мин) начальную дозу препарата следует уменьшить до 200 мг (см. раздел «Способ применения и дозы»).
Печеночная недостаточность
Опыт применения препарата Капрелса® у пациентов с печеночной недостаточностью (уровень билирубина сыворотки выше верхней границы нормы более чем в 1,5 раза) ограничен, безопасность и эффективность препарата в этой популяции больных не установлены. Препарат Капрелса® противопоказан пациентам с печеночной недостаточностью (см. раздел «Противопоказания»).
Индукторы изофермента CYP3A4
Следует избегать одновременного применения препарата Капрелса® с мощными индукторами изофермента CYP3A4, такими как рифампицин, препараты зверобоя продырявленного, карбамазепин, фенобарбитал (см. раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействия»).
Другое
Женщины детородного возраста должны использовать надежные методы контрацепции во время лечения препаратом Капрелса® и, как минимум, в течении 3-х месяцев после последнего приема препарата.
Зависимость эффективности терапии вандетанибом от статуса мутации RET не доказана. Преимущество терапии вандетанибом у пациентов с концентрацией кальцитонина менее 500 пг/мл не было изучено в клинических исследованиях, в связи с чем у таких пациентов может потребоваться тщательный контроль за концентрацией кальцитонина для снижения риска терапии вандетанибом.
Влияние на способность управлять автомобилем и иными механизмами
Не проводились исследования по изучению влияния препарата Капрелса® на способность к вождению автотранспорта и управлению механизмами. Однако, во время терапии может отмечаться повышенная утомляемость и нечеткость зрения. В случае возникновения данных явлений пациентам следует соблюдать осторожность при управлении автотранспортом и другими механизмами.
Форма выпуска
Таблетки, покрытые плёночной оболочкой, 100 мг и 300 мг.
По 10 таблеток в блистере, сформированном из непластифицированной поливинилхлоридной (ПВХ) пленки с поливинилиденхлоридом (ПВДХ), запечатанном алюминиевой фольгой высокой твердости, покрытой термолаком; по 3 блистера с инструкцией по применению в картонной пачке с контролем первого вскрытия.
Условия хранения
Хранить при температуре не выше 30 °С. Хранить в местах, недоступных для детей.
Срок годности
3 года. Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска
По рецепту.
Наименование и адрес юридического лица, на имя которого выдано регистрационное удостоверение
Джензайм Европа Б.В., Нидерланды
Гуимиир 10, 1411 ДД Наарден, Нидерланды
Genzyme Europe B.V., the Netherlands
Gooimeer 10, 14 DD Naarden, the Netherlands
Производитель
АйПиЭр Фармасьютикалс Инк, Пуэрто-Рико
КАРР 188 Лот 17, Сан Исидро Индастриал Парк, Канованас, Пуэрто-Рико
IPR Pharmaceuticals Inc, Puerto Rico, Carr 188 Lote 17, San Isidro Industrial Park, Canovanas, Puerto Rico
Выпускающий контроль качества
АстраЗенека ЮК Лимитед, Великобритания
Силк Роуд Бизнес Парк, Макклсфилд, Чешир SK 10 2NA, Великобритания
AstraZeneca UK Limited, United Kingdom
Silk Road Business Park Macclesfield Cheshire SK 10 2NA, United Kingdom
Претензии потребителей направлять по адресу:
АО «Санофи Россия», Россия 125009, г. Москва, ул. Тверская, д. 22.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Капрелса® (Caprelsa®) инструкция по применению
📜 Инструкция по применению Капрелса®
💊 Состав препарата Капрелса®
✅ Применение препарата Капрелса®
📅 Условия хранения Капрелса®
⏳ Срок годности Капрелса®
Описание лекарственного препарата
Капрелса®
(Caprelsa®)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2019 года.
Дата обновления: 2023.06.02
Владелец регистрационного удостоверения:
Контакты для обращений:
САНОФИ
Код ATX:
L01EX04
(Вандетаниб)
Лекарственные формы
| Капрелса® |
Таб., покр. пленочной оболочкой, 100 мг: 30 шт. рег. №: ЛП-002238 |
|
|
Таб., покр. пленочной оболочкой, 300 мг: 30 шт. рег. №: ЛП-002238 |
Форма выпуска, упаковка и состав
препарата Капрелса®
Таблетки, покрытые пленочной оболочкой белого цвета, круглые, двояковыпуклые, с гравировкой «Z100» на одной стороне.
Вспомогательные вещества: кальция гидрофосфата дигидрат — 105 мг, целлюлоза микрокристаллическая PH-101 — 25 мг, кросповидон — 12.5 мг, повидон К29-32 — 5 мг, магния стеарат — 2.5 мг.
Состав оболочки: гипромеллоза 2910* — 4.9 мг, макрогол 300* — 1 мг, титана диоксид — 1.6 мг.
* может использоваться готовое пленочное покрытие Опадрай белый 03В28460 идентичного состава.
10 шт. — блистеры (3) — пачки картонные.
Таблетки, покрытые пленочной оболочкой белого цвета, овальные, двояковыпуклые, с гравировкой «Z300» на одной стороне.
Вспомогательные вещества: кальция гидрофосфата дигидрат — 315 мг, целлюлоза микрокристаллическая PH-101 — 75 мг, кросповидон — 37.5 мг, повидон К29-32 — 15 мг, магния стеарат — 7.5 мг.
Состав оболочки: гипромеллоза 2910* — 14.7 мг, макрогол 300* — 3 мг, титана диоксид — 4.8 мг.
* может использоваться готовое пленочное покрытие Опадрай белый 03В28460 идентичного состава.
10 шт. — блистеры (3) — пачки картонные.
Фармакологическое действие
Вандетаниб, являясь селективным ингибитором тирозинкиназы, подавляет активность тирозинкиназы рецептора-2 фактора роста сосудистого эндотелия (VEGF), стимулированного фактором роста сосудистого эндотелия (VEGF) в эндотелиальных клетках. Вандетаниб ингибирует миграцию, пролиферацию, выживаемость эндотелиальных клеток и формирование новых кровеносных сосудов, стимулированных VEGF на in vitro моделях ангиогенеза. In vivo вандетаниб уменьшал ангиогенез, индуцированный опухолевыми клетками, проницаемость сосудов опухоли и плотность микрососудистой сети опухоли, подавлял рост опухоли и метастазов на моделях гетеротрансплантата рака легкого человека у бестимусных мышей.
Кроме того, в клетках опухоли и эндотелиальных клетках вандетаниб ингибирует тирозинкиназу рецептора эпидермального фактора роста (EGF), стимулированного EGF. Вандетаниб подавляет EGFR-зависимую пролиферацию и выживаемость клеток in vitro. In vitro исследования показали, что вандетаниб также ингибирует активность других тирозинкиназ, включая реаранжированных во время трансфекции (RET) и тирозинкиназ рецептора-3 VEGF (Flt-4).
В ходе клинического исследования с участием 331 пациента с нерезектабельным местно-распространенным или метастатическим медуллярным раком щитовидной железы показано статистически значимое улучшение выживаемости без прогрессирования, а также преимущество в частоте ответа, контроле заболевания, биохимическом ответе и времени до ухудшения болевого синдрома у пациентов при приеме вандетаниба по сравнению с плацебо.
Зависимость эффективности терапии вандетанибом от статуса мутации RET не доказана.
Фармакокинетика
Фармакокинетика вандетаниба в дозе 300 мг у пациентов с медуллярным раком щитовидной железы характеризуется клиренсом приблизительно 13.2 л/ч, Vd приблизительно 7450 л и Т1/2 из плазмы приблизительно 19 дней.
Всасывание
После приема внутрь всасывание вандетаниба происходит медленно, Cmax в плазме обычно достигается в среднем через 6 ч (диапазон 4-10 ч) после приема. При многократном применении наблюдалась 8-кратная кумуляция вандетаниба, с достижением равновесного состояния примерно через 2 месяца.
Распределение
Вандетаниб связывается с альбумином и альфа-1-кислым гликопротеином сыворотки человека, при этом in vitro связывание с белками составляет примерно 90%. В ex vivo образцах плазмы пациентов с колоректальным раком при равновесной экспозиции после приема препарата в дозе 300 мг/сут связывание вандетаниба с белками в среднем составляло 93.7% (диапазон 92.2-95.7%).
Метаболизм
После приема внутрь 14C-вандетаниба неизмененный вандетаниб и метаболиты вандетаниб-N-оксид и N-десметил-вандетаниб обнаружены в плазме, моче и кале. Конъюгат глюкуроновой кислоты был незначительным метаболитом только в экскрете. N-десметил-вандетаниб, в основном, образуется под действием изофермента CYP3A4, а вандетаниб-N-оксид — под действием флавинсодержащих монооксигеназ FMО1 и FMО3. N-десметил-вандетаниб и вандетаниб-N-оксид циркулируют в крови в концентрациях приблизительно 11% и 1.4% соответственно от концентрации вандетаниба.
Выведение
В течение 21 дня после однократного приема 14C-вандетаниба примерно 69% препарата выводилось: через кишечник (44%) и с мочой (25%). Выведение препарата происходило медленно, следует ожидать, что дальнейшее выведение после 21 дня основывается на Т1/2 из плазмы крови.
Вандетаниб не являлся субстратом hOCT2, экспрессированного в НЕК293 клетках. Вандетаниб ингибирует поглощение селективного субстрата ОСТ2 маркера 14С-креатинина НЕК-ОСТ2 клетками, при этом среднее значение IC50 составляет приблизительно 2.1 мкг/мл. Это выше, чем плазменные концентрации вандетаниба (примерно 0.81 и 0.32 мкг/мл), достигаемые после многократного приема препарата в дозах 300 мг и 100 мг соответственно. Вандетаниб ингибирует почечную экскрецию креатинина, в результате чего концентрация креатинина в плазме крови пациентов, принимающих вандетаниб, повышается.
Показания препарата
Капрелса®
- нерезектабельный местно-распространенный или метастатический медуллярный рак щитовидной железы.
Режим дозирования
Препарат принимают внутрь по 300 мг 1 раз/сут (1 таб. 300 мг или 3 таб. 100 мг), вне зависимости от приема пищи.
Таблетка также может быть диспергирована в половине стакана (50 мл) негазированной питьевой воды. Другие жидкости использовать нельзя. Таблетку следует опустить в воду, не измельчая, помешивать в течение около 10 мин (пока таблетка полностью не растворится) и сразу же выпить полученную суспензию. Остатки смешать с дополнительной половиной стакана воды и выпить. Суспензию препарата Капрелса® можно также вводить через назогастральный зонд или гастростому.
Терапию препаратом Капрелса® следует продолжать до тех пор, пока пациенты с медуллярным раком щитовидной железы не перестанут получать пользу от проводимого лечения.
Если пациент пропустил прием очередной дозы препарата, следующую суточную дозу следует принять согласно назначенной схеме лечения.
Коррекция дозы
Необходим постоянный контроль состояния пациента.
В связи с 19-дневным Т1/2 неблагоприятные реакции, связанные с токсичностью, включая удлинение интервала QT, могут не разрешиться быстро.
При развитии токсичности 3 степени СТСАЕ (Общие терминологические критерии оценки нежелательных явлений) и выше или удлинении интервала QT на ЭКГ необходимо временно приостановить терапию до разрешения токсичности или уменьшения ее тяжести до 1 степени СТСАЕ, затем возобновив лечение с более низкой дозы. Суточную дозу 300 мг можно уменьшить до 200 мг (2 таб. по 100 мг) и затем при необходимости до 100 мг.
Препарат Капрелса® не предназначен для применения у детей, поскольку безопасность и эффективность не установлены.
Не требуется корректировать начальную дозу у пациентов пожилого возраста (старше 65 лет). Клинические данные о применении препарата у пациентов в возрасте старше 75 лет ограничены.
Согласно имеющимся данным профиль безопасности у пациентов с почечной недостаточностью легкой степени схож с профилем безопасности у пациентов с нормальной функцией почек. Коррекции начальной дозы у пациентов с легкой почечной недостаточностью не требуется. Данные о применении препарата у пациентов с почечной недостаточностью средней степени тяжести ограничены. У пациентов с почечной недостаточностью средней степени тяжести (КК ≥30 и <50 мл/мин) начальную дозу следует уменьшить до 200 мг. Вандетаниб противопоказан пациентам с почечной недостаточностью тяжелой степени (КК <30 мл/мин), поскольку опыт применения препарата в данной популяции ограничен, безопасность и эффективность не установлены. Исследование фармакокинетики вандетаниба у добровольцев с тяжелой почечной недостаточностью показало, что экспозиция вандетаниба может увеличиваться до 2 раз.
Согласно результатам исследований фармакокинетики у добровольцев не требуется изменять начальную дозу препарата у пациентов с легкой, умеренной или тяжелой печеночной недостаточностью. Опыт применения препарата Капрелса® у пациентов с печеночной недостаточностью (концентрация билирубина сыворотки выше ВГН более чем в 1.5 раза) ограничен. Применение препарата Капрелса® у пациентов с печеночной недостаточностью противопоказано в связи с недостаточностью данных по безопасности и эффективности препарата у данной группы пациентов.
Побочное действие
Наиболее частыми нежелательными побочными реакциями при применении препарата Капрелса® были диарея, сыпь, тошнота, артериальная гипертензия и головная боль. Ниже описаны нежелательные реакции, наблюдавшиеся в завершенных клинических исследованиях с участием пациентов с медуллярным раком щитовидной железы, получавших препарат Капрелса®.
Частота нежелательных реакций представлена в виде следующей градации: очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (≥1/1000, <1/100), редко (≥1/10 000, <1/1000), очень редко (<1/10 000), включая отдельные сообщения.
Инфекционные и паразитарные заболевания: очень часто — назофарингит, бронхит, инфекции верхних дыхательных путей, инфекции мочевыводящих путей; часто — пневмония, сепсис, грипп, цистит, синусит, ларингит, фолликулит, фурункул, грибковые инфекции, пиелонефрит; нечасто — аппендицит, стафилококковые инфекции, дивертикулит, целлюлит, абсцесс брюшной стенки.
Со стороны обмена веществ: очень часто — гипокальциемия; часто — гипокалиемия, гиперкальциемия, гипергликемия, обезвоживание, гипонатриемия; нечасто — нарушение питания (истощение).
Со стороны эндокринной системы: часто — гипотиреоз.
Нарушения психики: очень часто — бессонница; часто — депрессия, тревожность.
Со стороны нервной системы: очень часто — головная боль, парестезия, дизестезия, головокружение; часто — тремор, летаргия, потеря сознания, нарушение равновесия, нарушения вкуса; нечасто — судороги, клонус, отек мозга.
Со стороны органа зрения: часто — нечеткость зрения, помутнение роговицы, конъюнктивит, сухость глаз, нарушения зрения, фотопсия, радужные круги вокруг источника света, глаукома, кератопатия; нечасто — катаракта, нарушение аккомодации.
Со стороны сердечно-сосудистой системы: очень часто — повышение АД; часто — удлинение интервала QTс на ЭКГ1,2, ишемические цереброваскулярные состояния, гипертонический криз; нечасто — сердечная недостаточность, острая сердечная недостаточность, нарушения ритма, нарушения сердечной проводимости, желудочковая аритмия и остановка сердца.
Со стороны дыхательной системы: часто — носовое кровотечение, кровохарканье, пневмонит; нечасто — дыхательная недостаточность, аспирационная пневмония.
Со стороны пищеварительной системы: очень часто — снижение аппетита, диарея, тошнота, рвота, боли в животе, диспепсия; часто — стоматит, сухость во рту, колит, дисфагия. запор, гастрит, желудочно-кишечное кровотечение; нечасто — панкреатит, перитонит, непроходимость кишечника, перфорации кишечника, недержание кала.
Со стороны печени и желчевыводящих путей: часто — желчнокаменная болезнь.
Со стороны мочевыделительной системы: часто — протеинурия, почечнокаменная болезнь, гематурия, дизурия, почечная недостаточность, учащенное мочеиспускание, императивные позывы к мочеиспусканию; нечасто — хроматурия, анурия.
Со стороны кожи и подкожно-жировой клетчатки: очень часто — сыпь и другие кожные реакции (включая акне, сухость кожи, дерматит, зуд), реакции фоточувствительности; часто — ладонно-подошвенная эритродизестезия, алопеция, поражение ногтей; нечасто — буллезный дерматит, синдром Стивенса-Джонсона3, токсический эпидермальный некролиз3.
Прочие: очень часто — утомляемость, астения, боль, отек; часто — лихорадка; нечасто — нарушение заживления ран.
Лабораторные и инструментальные данные: часто — снижение массы тела, повышение активности АЛТ и АСT, повышение концентрации креатинина в крови; нечасто — повышение концентрации гемоглобина, повышение активности амилазы в плазме крови.
1 У 13.4% пациентов в группе вандетаниба интервал QTc (по Базетту) составил ≥500 мс по сравнению с 1% в группе плацебо. Удлинение интервала QTcF на >20 мс отмечено у более чем 91% пациентов, >60 мс — у 35% пациентов, >100 мс — у 1/7% пациентов. В связи с удлинением интервала QTc у 8% пациентов была снижена доза препарата.
2 Включая 2 случая со смертельным исходом (1 в связи с сепсисом и 1 в связи с сердечной недостаточностью) у пациентов с интервалом QTc более 550 мс.
3 Частота основана на суммарном количестве пациентов (4684), принимавших препарат Капрелса® в клинических исследованиях.
На фоне монотерапии вандетанибом отмечали случаи развития желудочковой тахисистолической аритмии типа «пируэт», многоформной эритемы, интерстициального заболевания легких (в некоторых случаях с летальным исходом) и синдрома обратимой задней лейкоэнцефалопатии. Ожидается, что у пациентов с медуллярным раком щитовидной железы, получающих вандетаниб, эти нежелательные явления будут отмечаться нечасто.
Нарушения зрения, например, нечеткость зрения, часто наблюдали у пациентов с медуллярным раком щитовидной железы, получавших препарат Капрелса®. Плановое исследование с помощью щелевой лампы выявило помутнение роговицы (вортикозные кератопатии) у пациентов, однако регулярное офтальмологическое обследование с помощью щелевой лампы не требуется.
В рандомизированном исследовании у пациентов с медуллярным раком щитовидной железы очень часто отмечали следующие изменения лабораторных показателей: белок и кровь в моче (экспресс-анализ с помощью тест-полосок), повышение концентрации тиреотропного гормона, гемоглобина и креатинина в сыворотке крови, повышение активности амилазы, повышение активности липазы. Отмечали повышение концентрации креатинина 1-2 степени СТСАЕ, что может быть связано с ингибированием ОСТ2.
У пациентов, принимавших вандетаниб, отмечали повышение концентрации гемоглобина в среднем на 0.5-1.5 г/дл по сравнению с исходным значением.
Вандетаниб показал отсутствие канцерогенного эффекта в 6-месячном исследовании канцерогенности у rasH2 трансгенных мышей и в 2-летнем биологическом исследовании у крыс.
Противопоказания к применению
- почечная недостаточность тяжелой степени (КК <30 мл/мин);
- печеночная недостаточность;
- врожденный синдром удлинения интервала QT;
- пациенты с интервалом QTc более 480 мс;
- одновременное применение с другими лекарственными средствами, способными удлинять интервал QTc и/или вызывать трепетание/мерцание (мышьяк, цизаприд, эритромицин (в/в), торемифен, мизоластин, моксифлоксацин, антиаритмические средства IA и III класса);
- беременность;
- период лактации (грудного вскармливания);
- возраст до 18 лет;
- повышенная чувствительность к вандетанибу или любому вспомогательному веществу.
С осторожностью: почечная недостаточность средней степени тяжести (КК ≥30 и <50 мл/мин).
Применение при беременности и кормлении грудью
Не проводились адекватные и хорошо контролируемые исследования препарата Капрелса® с участием беременных женщин. Согласно данным доклинических исследований прием препарата Капрелса® может нанести вред плоду, поскольку высок риск развития патологий эмбриона/плода. В соответствии с фармакологическим действием вандетаниб оказывал значимое воздействие на все стадии репродуктивной функции у самок крыс.
Применение препарата в период беременности противопоказано.
Женщины с детородным потенциалом должны использовать эффективные методы контрацепции во время терапии и в течение, как минимум, 3 месяцев после приема последней дозы препарата Капрелса®.
Отсутствуют данные о применении препарата Капрелса® у женщин в период грудного вскармливания. Вандетаниб выделялся с молоком у крыс и обнаруживался в плазме крови детенышей после введения препарата лактирующим крысам.
Грудное вскармливание противопоказано в период лечения препаратом Капрелса®.
Применение при нарушениях функции печени
Применение препарата противопоказано при печеночной недостаточности.
Применение при нарушениях функции почек
Применение препарата противопоказано при почечной недостаточности тяжелой степени (КК <30 мл/мин).
С осторожностью следует назначать препарат при почечной недостаточности средней степени тяжести (КК ≥30 и <50 мл/мин).
Применение у детей
Препарат не предназначен для применения у детей, поскольку безопасность и эффективность не установлены.
Применение у пожилых пациентов
Не требуется корректировать начальную дозу у пожилых пациентов. Клинические данные о применении препарата у пациентов в возрасте старше 75 лет ограничены.
Особые указания
Принимая во внимание возможные риски, очень важно назначать терапию вандетанибом только пациентам, которым она объективно показана, а именно пациентам с симптоматически-агрессивным течением заболевания. Только наличие симптомов или только прогрессирование заболевания не является достаточным основанием для назначения вандетаниба.
Показатель изменения концентрации биомаркеров, таких как кальцитонин и/или раково-эмбриональный антиген (СЕА), а также темп роста опухоли во время динамического наблюдения помогут определить пациентов, нуждающихся в данной терапии, а также оптимальное время ее начала.
Удлинение интервала QTc
У пациентов, получавших препарат Капрелса®, наблюдали удлинение интервала QTc на ЭКГ. У 8% пациентов с медуллярным раком щитовидной железы, получавших препарат в дозе 300 мг/сут, в исследовании фазы III наблюдалось подтвержденное удлинение интервала QTc на ЭКГ. Удлинение интервала QTc на ЭКГ зависит от дозы и поддается лечению путем соответствующего мониторинга, приостановки терапии и снижения дозы, если потребуется.
Нечасто сообщалось о случаях развития желудочковой тахисистолической аритмии типа «пируэт» (Torsade de pointes) и желудочковой тахикардии при применении препарата Капрелса® в дозе 300 мг.
Не следует начинать терапию препаратом Капрелса® у пациентов со скорректированным значением интервала QT на ЭКГ более 480 мс. Не следует назначать препарат Капрелса® пациентам с желудочковой тахисистолической аритмией типа «пируэт» в анамнезе, кроме случаев, когда все факторы риска, способствующие ее развитию, скорректированы.
Исследования применения препарата Капрелса® у пациентов с желудочковыми аритмиями или недавно перенесенным инфарктом миокарда не проводились.
ЭКГ и результаты измерений сывороточных концентраций калия, кальция, магния и ТТГ (тиреотропного гормона) необходимо получить до начала, через 2-4 недели и 8-12 недель после начала применения препарата Капрелса®, и затем каждые 3 месяца на протяжении года. ЭКГ и анализы крови необходимо также выполнять по клиническим показаниям во время этого периода и впоследствии. Концентрация калия в сыворотке крови должна поддерживаться на значении 4 мэкв/л или выше, а концентрации магния и кальция должны быть в пределах нормы для снижения риска удлинения интервала QT (на ЭКГ).
При отсутствии альтернативной терапии препарат Капрелса® можно применять с некоторыми препаратами, удлиняющими интервал QT на ЭКГ. Если такие препараты назначены пациенту, уже принимающему препарат Капрелса®, необходимо выполнять ЭКГ мониторинг интервала QT в соответствии с фармакокинетикой добавленного препарата.
При значении интервала QTc на ЭКГ более 500 мс при однократном измерении необходимо приостановить терапию препаратом Капрелса®. После возврата интервала QTc к исходному значению или менее 450 мс можно возобновить прием препарата в более низкой дозе.
Кожные реакции
Во время терапии препаратом Капрелса® у пациентов наблюдали развитие сыпи и других кожных реакций (включая реакции фоточувствительности и синдрома ладонно-подошвенной эритродизестезии).
Слабо и умеренно выраженные кожные реакции обычно разрешаются при проведении симптоматической терапии или снижении дозы препарата Капрелса®. При развитии более тяжелых кожных реакций (таких как синдром Стивенса-Джонсона, токсический эпидермальный некролиз) пациенту рекомендуется обратиться за неотложной медицинской помощью. В этих случаях может потребоваться назначение системных ГКС и прекращение терапии препаратом Капрелса®.
Во время терапии препаратом Капрелса® необходимо носить одежду, защищающую от воздействия солнечных лучей, и/или использовать солнцезащитные средства.
Диарея
У пациентов, принимавших препарат Капрелса®, наблюдалось развитие диареи. Для лечения диареи рекомендуется применение обычных противодиарейных средств. Необходимо внимательно контролировать сывороточные концентрации электролитов. При развитии тяжелой диареи (3-4 степени СТСАЕ) прием препарата необходимо приостановить до улучшения состояния, возобновляя терапию с меньшей дозы.
Кровотечение
Сообщалось о случаях внутричерепного кровоизлияния, в связи с чем следует соблюдать осторожность при применении препарата Капрелса® у пациентов с метастазами в головной мозг.
Артериальная гипертензия
На фоне приема препарата Капрелса® было отмечено развитие артериальной гипертензии, включая гипертонический криз. В связи с этим рекомендуется наблюдение пациентов и назначение соответствующего лечения артериальной гипертензии. Если высокое АД не поддается контролю лекарственными средствами, прием препарата Капрелса® не следует возобновлять до нормализации АД. Может потребоваться снижение дозы препарата.
Сердечная недостаточность
У пациентов, принимавших препарат Капрелса®, отмечали развитие сердечной недостаточности, в некоторых случаях необратимой и с летальным исходом. При развитии сердечной недостаточности может потребоваться временная или полная отмена терапии препаратом Капрелса®.
Повышение активности АЛТ
На фоне приема препарата Капрелса® часто отмечали повышение активности АЛТ. Большинство случаев разрешалось по мере продолжения терапии, другие — после приостановки лечения на 1-2 недели. При применении препарата Капрелса® рекомендуется периодически проводить оценку активности АЛТ.
Интерстициальное заболевание легких
При применении препарата Капрелса® наблюдалось развитие интерстициального заболевания легких, в некоторых случаях с летальным исходом. При возникновении таких респираторных симптомов как одышка, кашель и лихорадка, применение препарата Капрелса® следует приостановить и провести незамедлительное обследование. В случае подтверждения интерстициального заболевания легких, прием препарата Капрелса® следует прекратить и назначить соответствующее лечение.
Синдром обратимой задней лейкоэнцефалопатии (СОЗЛ)
У пациентов, принимавших препарат Капрелса® в комбинации с химиотерапией, или у детей с опухолью мозга, получавших монотерапию препаратом Капрелса®, отмечали развитие синдрома обратимой задней лейкоэнцефалопатии, синдрома подкоркового вазогенного отека, выявляемого на МРТ головного мозга. СОЗЛ отмечали у пациентов, принимавших вандетаниб. Данный синдром должен быть заподозрен при появлении у пациентов судорог, головной боли, нарушения зрения, спутанности сознания или нарушения умственной функции.
Почечная недостаточность
У пациентов с умеренной почечной недостаточностью (КК ≥30 и <50 мл/мин) начальную дозу препарата следует уменьшить до 200 мг.
Печеночная недостаточность
Опыт применения препарата Капрелса® у пациентов с печеночной недостаточностью (уровень билирубина сыворотки выше ВГН более чем в 1.5 раза) ограничен, безопасность и эффективность препарата в этой популяции больных не установлены. Препарат Капрелса® противопоказан пациентам с печеночной недостаточностью.
Индукторы изофермента CYP3A4
Следует избегать одновременного применения препарата Капрелса® с мощными индукторами изофермента CYP3A4, такими как рифампицин, препараты зверобоя продырявленного, карбамазепин, фенобарбитал.
Другое
Преимущество терапии вандетанибом у пациентов с концентрацией кальцитонина менее 500 пг/мл не было изучено в клинических исследованиях, в связи с чем у таких пациентов может потребоваться тщательный контроль концентрации кальцитонина для снижения риска терапии вандетанибом.
Влияние на способность к управлению транспортными средствами и механизмами
Не проводились исследования по изучению влияния препарата Капрелса® на способность к вождению автотранспорта и управлению механизмами. Однако во время терапии может отмечаться повышенная утомляемость и нечеткость зрения. В случае возникновения данных явлений пациентам следует соблюдать осторожность при управлении автотранспортом и другими механизмами.
Передозировка
Возможные симптомы передозировки не установлены. Увеличение частоты развития и тяжести некоторых нежелательных реакций, таких как сыпь, диарея и артериальная гипертензия, отмечено при приеме препарата многократно в дозах 300 мг и выше. Следует учитывать возможное удлинение интервала QT и развитие желудочковой тахисистолической аритмии типа «пируэт».
Лечение: специфического лечения при передозировке препаратом Капрелса® не существует. В случае развития нежелательных реакций, связанных с передозировкой следует проводить симптоматическое лечение, в частности, назначить соответствующее лечение тяжелой диареи. При передозировке следует прекратить дальнейший прием препарата, и предпринять соответствующие меры для предотвращения развития нежелательных явлений, например, выполнять ЭКГ в течение 24 ч для определения удлинения интервала QTc.
Лекарственное взаимодействие
Влияние вандетаниба на фармакокинетику других лекарственных препаратов
Данные in vitro указывают, что вандетаниб является умеренным индуктором изофермента CYP3A4. В связи с этим следует соблюдать осторожность при применении вандетаниба с субстратами изофермента CYP3A4, особенно комбинированными препаратами, содержащими эстроген/прогестерон, иммунодепрессантами, такими как циклоспорин или такролимус, или противоопухолевыми препаратами, такими как доцетаксел и бортезомиб. При совместном применении мидазолама (субстрат изофермента CYP3A4) и вандетаниба здоровыми добровольцами концентрация мидазолама не изменялась.
Применение вандетаниба с препаратами, выведение которых происходит при участии транспортера Р-гликопротеина (P-gp) (например, дабигатран или дигоксин), может приводить к повышению концентрации этих препаратов в плазме и потребовать пристального клинического и лабораторного наблюдения за состоянием пациента и даже снижения дозы этих препаратов. При совместном применении дигоксина и вандетаниба здоровыми добровольцами отмечено повышение AUC(0-t) и Сmax дигоксина на 23% и 29% соответственно. Следует учитывать возможность удлинения интервала QT, развития желудочковой тахиаритмии типа «пируэт» при совместном применении вандетаниба и дигоксина; может потребоваться коррекция дозы.
Вандетаниб, являясь ингибитором транспортера органических катионов (ОСТ2), может замедлять выведение метформина и других субстратов ОСТ2, тем самым повышая их концентрацию. При совместном применении метформина (субстрат ОСТ2) и вандетаниба здоровыми добровольцами (дикий тип ОСТ2) отмечено повышение AUC(0-t) и Сmax метформина на 74% и 50% соответственно, а также снижение почечного клиренса метформина на 52%. Может потребоваться более тщательное наблюдение за пациентом и снижение дозы метформина.
Влияние других лекарственных препаратов на фармакокинетику вандетаниба
При совместном применении омепразола и вандетаниба здоровыми добровольцами отмечено снижение Сmax вандетаниба на 15%, при этом значение AUC(0-t) не изменилось. При совместном применении ранитидина и вандетаниба значения Сmax и AUC(0-t) вандетаниба не изменялись. При совместном применении вандетаниба и ранитидина или омепразола коррекция дозы не требуется.
Не наблюдалось клинически значимого взаимодействия вандетаниба и мощного ингибитора изофермента CYP3A4, итраконазола. Однако при совместном применении вандетаниба и итраконазола, и других мощных ингибиторов изофермента CYP3A4 (например, кетоконазола, ритонавира и кларитромицина) следует соблюдать осторожность.
При совместном применении вандетаниба и рифампицина, мощного индуктора изофермента CYP3A4 у мужчин, концентрация вандетаниба снижалась на 40%, поэтому следует избегать совместного применения вандетаниба и мощных индукторов изофермента CYP3A4 (например, рифампицина, карбамазепина, фенобарбитала и препаратов зверобоя продырявленного).
Лекарственные препараты, способные удлинять интервал QTc
Вандетаниб может вызывать удлинение интервала QTc, поэтому его не следует принимать одновременно с другими лекарственными средствами, способными удлинять интервал QTc и/или вызывающими трепетание/мерцание:
- противопоказано применение с мышьяком, цизапридом, эритромицином (в/в), торемифеном, мизоластином, моксифлоксацином, антиаритмическими средствами IA и III класса;
- не рекомендовано применение с метадоном, галоперидолом, амисульпридом, хлорпромазином, сульпиридом, зуклопентиксолом, галофантрином, пентамидином и лумефантрином.
При отсутствии подходящей альтернативной терапии применение нерекомендуемой комбинации препаратов возможно, если обеспечен мониторинг интервала QTc на ЭКГ, контроль концентрации электролитов и дополнительный контроль в случае возникновения или усиления диареи.
При применении вандетаниба совместно с ондансетроном наблюдали незначительный аддитивный эффект на удлинение интервала QTc (приблизительно на 10 мс), поэтому сопутствующее применение этих препаратов не рекомендуется. В случае назначения ондансетрона совместно с вандетанибом требуется тщательный контроль концентрации электролитов в сыворотке и ЭКГ, а также интенсивная терапия любых нарушений.
Прием пищи не влияет на концентрацию вандетаниба.
Ввиду возможного взаимодействия антагонистов витамина К и химиотерапевтических препаратов, рекомендуется более частый мониторинг МНО.
Условия хранения препарата Капрелса®
Препарат следует хранить в недоступном для детей месте при температуре не выше 30°С.
Срок годности препарата Капрелса®
Срок годности — 3 года. Не применять по истечении срока годности, указанного на упаковке.
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
САНОФИ

|
|
Представительство |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
В статье рассмотрен клинический случай, иллюстрирующий эффективность вандетаниба в качестве первой линии терапии метастатического медуллярного рака щитовидной железы (МРЩЖ), характеризующегося агрессивным клиническим течением. В половине случаев заболевание диагностируется на поздних стадиях (III–IV), когда требуется системная противоопухолевая терапия. Из-за низкой эффективности и высокой токсичности химиотерапии, нечувствительности опухоли к лучевой терапии большие надежды возлагаются на системную таргетную терапию мультикиназными ингибиторами. Первым из этой группы препаратов противоопухолевую эффективность у больных прогрессирующим МРЩЖ продемонстрировал вандетаниб. Сегодня назначение вандетаниба 300 мг/сут считается приоритетным направлением в лечении нерезектабельного и прогрессирующего МРЩЖ.
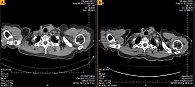
Рис. 1. Результаты КТ, подтверждающие эффективность терапии вандетанибом, – динамика по надключичным лимфоузлам (А – июль 2014 г., Б – март 2016 г.)
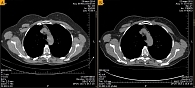
Рис. 2. Результаты КТ – динамика по медиастинальным лимфоузлам (А – июль 2014 г., Б – март 2016 г.)
Введение
На долю медуллярного рака щитовидной железы (МРЩЖ) приходится менее 5% всех случаев рака щитовидной железы и 13,4% всех случаев смерти от рака щитовидной железы. МРЩЖ диагностируется на III и IV стадиях заболевания более чем в 50% случаев [1]. Пятилетняя выживаемость пациентов с выявленными метастазами МРЩЖ составляет около 25%, десятилетняя – около 10% [1, 2]. В 20–25% случаев МРЩЖ представлен в рамках наследственных синдромов множественной эндокринной неоплазии (МЭН) 2-го типа (синдром Сиппла – МЭН IIa, семейный МРЩЖ и МЭН IIb). В остальных случаях МРЩЖ выявляется как спорадическое заболевание.
В основе наследственных синдромов лежит мутация гена RET, кодирующего трансмембранно расположенный рецептор тирозинкиназы. Активация данного рецептора приводит к бесконтрольной пролиферации С-клеток.
Спорадический МРЩЖ может возникнуть в любом возрасте, однако пик заболеваемости приходится на 30–60 лет [1]. Агрессивность течения данной формы МРЩЖ варьируется. Соматические мутации гена RET при нем описаны в 25–71% случаев [3]. При единичных отдаленных метастазах в пределах одного органа, медленном прогрессировании процесса эффективным может быть хирургическое лечение либо применение других методов местного воздействия (радиоабляция, фотодинамическая терапия, лучевая терапия, химиоэмболизация). Указанные процедуры не приводят к излечению, но могут отсрочить проведение системной терапии, снизить вероятность болевого синдрома, сдавления окружающих структур.
Среди цитотоксических препаратов наиболее востребованным при МРЩЖ считается доксорубицин. Он применяется самостоятельно или в комбинации с цисплатином. Чувствительность к данному лечению составляет 0–22% [3]. К сожалению, ответ всегда нерадикальный и продолжается несколько месяцев. Иммунотерапия с использованием дендритных клеток может быть эффективной, но пока это объект для изучения. Имеется опыт использования радиотаргетной терапии – описано несколько ответов на лечение [Иттрий-90 DOTA]-TOC у пациентов с МРЩЖ с высоким уровнем кальцитонина, накапливающим изотоп на Октреаскане с Индием-111 [4]. В неоперабельных случаях, при значительном распространении заболевания, а также при доказанном по критерию RECIST (Response Evaluation Criteriain Solid Tumor) прогрессировании МРЩЖ методом выбора в настоящее время является системная терапия мультикиназными ингибиторами. В большинстве стран одобрены два препарата данной группы – вандетаниб (Капрелса) и кабозантиниб (Кометрик). В России пока одобрен к применению только вандетаниб (ингибитор киназ генов RET, MET, VEGFR2) [3]. В исследованиях данный препарат показал частичный ответ у 45% пациентов. Безрецидивный период составил 19,5 месяца в группе плацебо и 30,5 месяца в группе вандетаниба. Из-за развития побочных эффектов препарат был отменен у 12% пациентов. 35% больных потребовалось снижение дозы.
Достичь полной ремиссии при использовании названных препаратов невозможно. Тем не менее в ряде клинических исследований прием препаратов позволил улучшить качество жизни пациентов за счет снижения диареи и других гормональных проявлений МРЩЖ и стабилизировать процесс [5].
Клинический случай
Пациентка, 60 лет, в 2002 г. перенесла тиреоидэктомию по поводу МРЩЖ Т3N0M0, стадия III. Получала заместительную гормонотерапию L-тироксином 125 мкг/сут постоянно. Регулярно проходила контрольное обследование: ультразвуковое исследование (УЗИ) шеи и брюшной полости, компьютерная томография (КТ) шеи и грудной клетки, анализ крови на гормоны (кальцитонин, тиреотропный гормон (ТТГ), периферические тиреоидные гормоны Т3, Т4), раковый эмбриональный антиген (СЕА). В январе 2008 г. при очередном обследовании выявлено повышение уровня кальцитонина в крови до 1700 пг/мл, увеличение размеров шейного лимфоузла справа, по данным УЗИ и КТ, до 0,9 × 0,5 мм. При тонкоигольной пункции увеличенного лимфоузла обнаружена цитологическая картина медуллярного рака. По поводу метастаза в шейном лимфоузле справа выполнена операция – лимфаденэктомия шеи справа. Послеоперационное гистологическое исследование подтвердило метастатическое поражение лимфоузла МРЩЖ. После операции уровень кальцитонина снизился до 412 пг/мл. Впоследствии осуществлялось динамическое наблюдение с прежним объемом обследования.
В марте 2013 г. уровень кальцитонина увеличился до 1250 пг/мл. Диагностированы рецидив в ложе удаленной опухоли щитовидной железы и повторный метастаз в шейный лимфоузел справа.
7 апреля 2013 г. выполнена операция – удаление рецидива опухоли, лимфаденэктомия шеи справа. Иммуногистохимический анализ послеоперационного материала показал метастазы медуллярного рака в шейном лимфоузле и мягких тканях шеи. После операции уровень кальцитонина составил 775 пг/мл, CEA – 154.
В июле 2014 г. зафиксировано прогрессирование заболевания. Появились жалобы на болезненность в правой надключичной области. При обследовании уровень кальцитонина – 1055 пг/мл. Результаты КТ шеи, грудной клетки и брюшной полости показали метастаз в надключичном лимфоузле справа, подключичном лимфоузле справа, медиастинальных лимфоузлах, 11-м и 12-м грудных позвонках. Общее состояние пациентки удовлетворительное.
С 12 августа 2014 г. была начата таргетная терапия препаратом вандетаниб (Капрелса) в дозе 300 мг/сут. В качестве сопутствующей терапии назначен Панангин – одна таблетка три раза в день. На третий день приема вандетаниба отмечались боли за грудиной в течение пяти минут, прошли самостоятельно. На 12-й день приема на подбородке появились единичные высыпания, не требовавшие лечения.
Каждые две недели таргетной терапии проводились контроль клинического и биохимического анализов крови, электролитов крови (кальций, магний, калий), забор крови на гормоны (ТТГ, Т3, Т4), электрокардиограмма (ЭКГ). Каждые два месяца приема вандетаниба выполнялось контрольное обследование: УЗИ шеи, КТ шеи, грудной клетки и брюшной полости, анализ крови на гормоны (кальцитонин, ТТГ, Т3, Т4), СЕА. Дополнительной терапии не требовалось.
На 34-й день лечения из-за повышения артериального давления (АД) до 220 мм рт. ст. препарат временно отменили и назначили эналаприл 5 мг два раза в сутки.
На 37-й день терапии, согласно результатам ЭКГ, зафиксирована отрицательная динамика в виде усиления потенциалов левого желудочка, нарушения процессов реполяризации переднебоковой стенки левого желудочка. Перерыв в приеме вандетаниба составил 12 дней. Общее самочувствие улучшилось, ЭКГ – с положительной динамикой, АД стабильное. Продолжен прием вандетаниба 150 мг/сут на фоне эналаприла и Панангина.
Через два месяца терапии на контрольном обследовании при оценке опухоли по критериям RECIST констатирована стабилизация процесса.
В течение 7,5 месяца пациентка принимала вандетаниб 150 мг. Общее самочувствие удовлетворительное, ЭКГ – QT 0,38 мм/с, АД стабильное, нежелательных явлений на фоне применения сниженной дозы препарата не зарегистрировано.
В апреле 2015 г. уровень кальцитонина увеличился до 3732 пг/мл, хотя, согласно данным КТ шеи, грудной клетки и брюшной полости, стабилизация процесса сохранялась. Дозу вандетаниба увеличили до 200 мг/сут. Через две недели на фоне приема препарата в указанной дозе отмечалось снижение уровня кальцитонина до 1291 пг/мл. Общее самочувствие – без ухудшения, повышение АД до 140 мм рт. ст. Пациентка принимала эналаприл 10 мг два раза в сутки.
После 19-месячной терапии вандетанибом в марте 2016 г. зафиксирована положительная динамика – уменьшение размеров шейных лимфоузлов, снижение уровня кальцитонина до 1176 пг/мл, стабилизация очагов в костях. Согласно данным КТ, при оценке опухоли по критериям RECIST зарегистрирована частичная регрессия опухоли (рис. 1 и 2).
В апреле 2016 г. появились жалобы на жидкий стул до семи раз в день, повышение АД до 200 мм рт. ст. ЭКГ показала увеличение интервала QT до 0,43 мм/с. Вандетаниб временно отменили, перерыв в лечении составил 14 дней. После стабилизации состояния прием вандетаниба с коррекцией дозы 150 мг/сут был продолжен.
В декабре 2016 г. отмечалось незначительное увеличение уровня кальцитонина до 1910 пг/мл. КТ – без динамики по сравнению с исследованием в марте 2016 г.: частичная регрессия опухоли сохранялась. Дозу вандетаниба увеличили до 200 мг/сут. Через две недели уровень кальцитонина снизился до 1100 пг/мл.
В феврале 2017 г. после 30 месяцев таргетной терапии вандетанибом рентгенологически подтверждена частичная регрессия опухоли, масса тела пациентки стабильная, сохранялись жалобы на периодический жидкий стул и периодическое повышение АД до 140 мм рт. ст. Состояние по шкале ECOG – 1. Пациентка ведет активный образ жизни, продолжает работать. За два с половиной года терапии вандетанибом гематологической токсичности не зафиксировано, с негематологическими нежелательными явлениями удалось быстро справиться. Планируется продолжить терапию вандетанибом до прогрессирования по критериям RECIST с оценкой эффективности каждые два месяца.
Обсуждение
Рассмотренный клинический случай иллюстрирует потенциальный благоприятный эффект в отношении отдаленных результатов лечения при назначении вандетаниба в первой линии терапии метастатического МРЩЖ. Пациентка продолжает получать вандетаниб в течение двух с половиной лет. Отмечается частичная ремиссия. Данное лечение позволяет не только увеличить медиану общей выживаемости, но также значительно продлить время до прогрессирования, сохранить качество жизни и социальный статус больной.
Всем пациентам с установленным диагнозом МРЩЖ независимо от этиологии (спорадический, наследственный) в отсутствие данных об отдаленных метастазах показано хирургическое вмешательство с выполнением как минимум тиреоидэктомии с центральной лимфодиссекцией, при подозрении или доказанных метастазах в боковые лимфатические узлы шеи, верхнее средостение – радикальная лимфодиссекция в объеме пораженных уровней лимфоузлов [6]. Кроме хирургического лечения, возможности которого ограничены местной распространенностью и нерадикальностью вмешательства, до недавнего времени не существовало ни одного эффективного метода лечения с учетом слабой чувствительности медуллярной карциномы как представителя нейроэндокринных карцином к химиотерапии и дистанционной лучевой терапии [7]. При наличии отдаленных метастазов МРЩЖ, неоперабельных случаев местнораспространенного опухолевого процесса или высокого риска для жизни от хирургического вмешательства закономерно возникает вопрос о системной противоопухолевой терапии. Большие ожидания клиницисты возлагают на современные таргетные противоопухолевые препараты, позволяющие ингибировать ключевые киназные триггеры опухолевой активации [8]. Первым из них, подтвердившим эффективность и приемлемую безопасность в лечении больных МРЩЖ, согласно результатам клинических исследований фаз I–III, стал препарат вандетаниб (ZD6474) – низкомолекулярный ингибитор рецепторов тирозинкиназы: VEGFR2, EGRF и активности RET тирозинкиназы, в том числе RET-мутировавших онкопротеинов [9].
В рандомизированном плацебоконтролируемом клиническом исследовании фазы III (ZETA) у взрослых больных МРЩЖ на фоне приема 300 мг вандетаниба отмечалось увеличение периода без прогрессирования опухоли до 30 месяцев по сравнению с пациентами, получавшими плацебо, – 19 месяцев (относительный риск 0,46; 95%-ный доверительный интервал 0,31–0,69; p < 0,001). При этом 45% пациентов имели объективный ответ опухоли (регрессия) [5].
В работе S.A. Wells и соавт. показано, что подгруппа пациентов со спорадическим МРЩЖ и онкомутацией M918T RET лучше отвечала на лечение вандетанибом, чем те, у кого этой мутации не было [5].
Во время терапии вандетанибом необходимо следить за уровнем ТТГ, который иногда повышается. Увеличение дозы левотироксина с 91 ± 24 до 116 ± 24 мкг/м2/кг, как правило, позволяет нормализовать уровень ТТГ. Повышение уровня тиреотропина обычно не сопровождается уменьшением фракций периферических тиреоидных гормонов (Т3, Т4) ниже диапазона референсных значений нормы. Наиболее частыми побочными эффектами были диарея, кожная сыпь, тошнота и слабость. Токсичность также проявилась артериальной гипертензией, удлинением интервала QT на ЭКГ и повышением уровня ТТГ. Наиболее частыми побочными эффектами, в основном 1–2-й степени, требовавшими снижения дозы вандетаниба, были диарея (69%) и удлинение интервала QT на ЭКГ (68%). Необходимо отметить, что эти осложнения были выражены во время первого и второго цикла приема препарата, встречались в 3–6 раз реже и были менее выражены в третьем и последующих циклах [8].
Терапия вандетанибом удовлетворительно переносится и приводит к значительному увеличению выживаемости без прогрессирования и общей выживаемости по сравнению с другими методами лечения. В рассмотренном клиническом случае удалось сохранить качество жизни и социальный статус пациентки на протяжении всего периода лечения [5].
Заключение
На современном этапе вандетаниб является препаратом выбора при неоперабельном и прогрессирующем МРЩЖ. Лечение может осуществляться препаратом в дозе 300 мг/сут с непрерывным контролем возможных нежелательных побочных эффектов, регулярной оценкой объективного ответа опухоли на основании критериев RECIST и уровня специфических опухолевых маркеров в сыворотке крови (кальцитонин, СЕА) [8].
Caprelsa®
Регистрационный номер
Торговое наименование
Капрелса®
Международное непатентованное наименование
Лекарственная форма
таблетки, покрытые плёночной оболочкой
Состав
Одна таблетка 100 мг содержит:
активное вещество: вандетаниб 100,0 мг;
вспомогательные вещества: кальция гидрофосфата дигидрат 105,0 мг, целлюлоза микрокристаллическая 25,0 мг, кросповидон 12,5 мг, повидон-К29-32 5,0 мг, магния стеарат 2,5 мг;
оболочка таблетки: гипромеллоза 2910 4,9 мг, макрогол 300 1,0 мг, титана диоксид 1,6 мг.
Одна таблетка 300 мг содержит:
активное вещество: вандетаниб 300,0 мг;
вспомогательные вещества: кальция гидрофосфата дигидрат 315,0 мг, целлюлоза микрокристаллическая 75,0 мг, кросповидон 37,5 мг, повидон-К29-32 15,0 мг, магния стеарат 7,5 мг;
оболочка таблетки: гипромеллоза 2910 14,7 мг, макрогол 300 3,0 мг, титана диоксид 4,8 мг.
Описание
Таблетки 100 мг: Круглые, двояковыпуклые таблетки, покрытые плёночной оболочкой белого цвета, с гравировкой Z100 на одной стороне.
Таблетки 300 мг: Овальные, двояковыпуклые таблетки, покрытые плёночной оболочкой белого цвета, с гравировкой Z300 на одной стороне.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Вандетаниб, являясь селективным ингибитором тирозинкиназы, подавляет активность тирозинкиназы рецептора-2 фактора роста сосудистого эндотелия (VEGF), стимулированного фактором роста сосудистого эндотелия (VEGF) в эндотелиальных клетках. Вандетаниб ингибирует миграцию, пролиферацию, выживаемость эндотелиальных клеток и формирование новых кровеносных сосудов, стимулированных VEGF на in vitro моделях ангиогенеза. In vivo вандетаниб уменьшал ангиогенез, индуцированный опухолевыми клетками, проницаемость сосудов опухоли и плотность микрососудистой сети опухоли, подавлял рост опухоли и метастазов на моделях гетеротрансплантата рака лёгкого человека у бестимусных мышей.
Кроме того, в клетках опухоли и эндотелиальных клетках вандетаниб ингибирует тирозинкиназу рецептора эпидермального фактора роста (EGF), стимулированного EGF. Вандетаниб подавляет EGFR-зависимую пролиферацию и выживаемость клеток in vitro.
In vitro исследования показали, что вандетаниб также ингибирует активность других тирозинкиназ, включая реаранжированных во время трансфекции (RET) и тирозинкиназ рецептора-3 VEGF (Flt-4).
В ходе клинического исследования с участием 331 пациента с нерезектабельным местнораспространённым или метастатическим медуллярным раком щитовидной железы показано статистически значимое улучшение выживаемости без прогрессирования, а также преимущество в частоте ответа, контроле над заболеванием, биохимическом ответе и времени до ухудшения болевого синдрома у пациентов при приёме вандетаниба по сравнению с плацебо.
Зависимость эффективности терапии вандетанибом от статуса мутации RET не доказана.
Фармакокинетика
Фармакокинетика вандетаниба в дозе 300 мг у пациентов с медуллярным раком щитовидной железы характеризуется клиренсом приблизительно 13,2 л/час, объёмом распределения приблизительно 7450 л и периодом полувыведения из плазмы приблизительно 19 дней.
Всасывание
После приёма внутрь всасывание вандетаниба происходит медленно, максимальная концентрация в плазме обычно достигается в среднем через 6 часов (диапазон 4–10 часов) после приёма. При многократном применении наблюдалась 8-кратная кумуляция вандетаниба, с достижением равновесного состояния примерно через 2 месяца.
Распределение
Вандетаниб связывается с альбумином и альфа-1-кислым гликопротеином сыворотки человека, при этом in vitro связывание с белками составляет примерно 90 %. В ex vivo образцах плазмы пациентов с колоректальным раком при равновесной экспозиции после приёма препарата в дозе 300 мг/сутки связывание препарата с белками в среднем составляло 93,7 % (диапазон 92,2 %–95,7 %).
Метаболизм
После приёма внутрь 14С-вандетаниба неизменённый вандетаниб и метаболиты вандетаниб-N-оксид и N-десметил-вандетаниб обнаружены в плазме, моче и фекалиях. Конъюгат глюкуроновой кислоты был незначительным метаболитом только в экскрете. N-десметил-вандетаниб, в основном, образуется под действием изофермента CYP3A4, а вандетаниб-N-оксид — под действием флавинсодержащих монооксигеназ FMО1 и FMО3. N-десметил-вандетаниб и вандетаниб-N-оксид циркулируют в крови в концентрациях приблизительно 11 % и 1,4 % соответственно от концентрации вандетаниба.
Выведение
В течение 21 дня после однократного приёма 14С-вандетаниба примерно 69 % препарата выводилось: 44 % с фекалиями и 25 % с мочой. Выведение препарата происходило медленно, и, следует ожидать, что дальнейшее выведение после 21 дня основывается на периоде полувыведения из плазмы крови.
Вандетаниб не являлся субстратом ЮСТ2, экспрессированного в НЕК293 клетках. Вандетаниб ингибирует поглощение селективного субстрата OCT2 маркера 14С- креатинина НЕК-OCT2 клетками, при этом среднее значение IC50 составляет приблизительно 2,1 мкг/мл. Это выше, чем плазменные концентрации вандетаниба (примерно 0,81 и 0,32 мкг/мл), достигаемые после многократного приёма препарата в дозах 300 мг и 100 мг, соответственно. Вандетаниб ингибирует почечную экскрецию креатинина, в результате чего концентрация креатинина в плазме крови пациентов, принимающих вандетаниб, повышается.
Показания
Нерезектабельный местнораспространённый или метастатический медуллярный рак щитовидной железы.
Противопоказания
- Повышенная чувствительность к вандетанибу или любому вспомогательному веществу;
- врождённый синдром удлинения интервала QT;
- беременность и период грудного вскармливания;
- пациенты с интервалом QTc более 480 мс;
- одновременное применение с другими лекарственными средствами, способными удлинять интервал QTc и/или вызывающие трепетание/мерцание: мышьяк, цизаприд, эритромицин (внутривенно), торемифен, мизоластин, моксифлоксацин, антиаритмические средства IA и III класса;
- детский возраст до 18 лет.
- почечная недостаточность тяжёлой степени тяжести (клиренс креатинина <30 мл/мин);
- печёночная недостаточность.
С осторожностью
Почечная недостаточность средней степени тяжести (клиренс креатинина ≥30 и <50 мл/мин).
Применение при беременности и в период грудного вскармливания
Беременность
Не проводились адекватные и хорошо-контролируемые исследования препарата Капрелса® с участием беременных женщин. Согласно данным доклинических исследований приём препарата Капрелса® может нанести вред плоду, поскольку высок риск развития патологий эмбриона/плода. В соответствии с фармакологическим действием вандетаниб оказывал значимое воздействие на все стадии репродуктивной функции у самок крыс.
Применение препарата в период беременности противопоказано.
Период грудного вскармливания
Отсутствуют данные о применении препарата Капрелса® у женщин в период грудного вскармливания. Вандетаниб выделялся в молоко крыс, и обнаруживался в плазме крови детёнышей после введения препарата лактирующим крысам. Грудное вскармливание противопоказано в период лечения препаратом Капрелса®.
Способ применения и дозы
Внутрь по 300 мг 1 раз в сутки (1 таблетка 300 мг или 3 таблетки 100 мг), вне зависимости от приёма пищи.
Таблетка также может быть диспергирована в 60 мл негазированной питьевой воды. Другие жидкости использовать нельзя. Таблетку следует опустить в воду, не измельчая, помешивать в течение около 10 минут (таблетка полностью не растворится) и сразу же выпить полученную суспензию. Остатки смешать с дополнительными 120 мл воды и выпить полученную суспензию. Суспензию препарата Капрелса® можно также вводить через назогастральный зонд или гастростому.
Терапию препаратом Капрелса® следует продолжать до тех пор, пока пациенты с медуллярным раком щитовидной железы не перестанут получать пользу от проводимого лечения.
В случае, если пациент пропустил приём очередной дозы препарата, следующую суточную дозу следует принять согласно назначенной схеме лечения.
Коррекция дозы
Необходим контроль состояния пациента.
В связи с 19-дневным периодом полувыведения, неблагоприятные реакции, связанные с токсичностью, включая удлинение интервала QT, могут не разрешиться быстро.
При развитии токсичности 3 степени СТСАЕ (Общие терминологические критерии оценки нежелательных явлений) или выше, или удлинении интервала QT на электрокардиограмме (ЭКГ), необходимо временно приостановить терапию до разрешения токсичности или уменьшения её тяжести до СТСАЕ степени 1 (см. раздел «Особые указания»), затем возобновив лечение с более низкой дозы. Суточную дозу 300 мг можно уменьшить до 200 мг (две таблетки по 100 мг), и затем при необходимости до 100 мг.
Особые популяции пациентов
Дети или подростки
Препарат Капрелса® не предназначен для применения у детей, поскольку безопасность и эффективность не установлены.
Пожилые пациенты (старше 65 лет)
Не требуется корректировать начальную дозу у пожилых пациентов. Клинические данные о применении препарата у пациентов в возрасте старше 75 лет ограничены.
Пациенты с почечной недостаточностью
Данные о применении препарата у пациентов с почечной недостаточностью средней степени тяжести ограничены.
Согласно имеющимся данным профиль безопасности у пациентов с почечной недостаточностью лёгкой степени тяжести схож с профилем безопасности у пациентов с нормальной функцией почек. Коррекции начальной дозы у пациентов с почечной недостаточностью лёгкой степени тяжести не требуется.
У пациентов с почечной недостаточностью средней степени тяжести (клиренс креатинина ≥30 и <50 мл/мин) начальную дозу следует уменьшить до 200 мг.
Вандетаниб противопоказан пациентам с почечной недостаточностью тяжёлой степени тяжести (клиренс креатинина <30 мл/мин), поскольку опыт применения препарата в данной популяции ограничен, безопасность и эффективность не установлены. Исследование фармакокинетики вандетаниба у добровольцев с почечной недостаточностью тяжёлой степени тяжести показало, что экспозиция вандетаниба может увеличиваться до 2-х раз.
Пациенты с печёночной недостаточностью
Согласно результатам исследований фармакокинетики у добровольцев не требуется изменять начальную дозу препарата у пациентов с лёгкой, умеренной или тяжёлой печёночной недостаточностью. Опыт применения препарата Капрелса® у пациентов с печёночной недостаточностью (концентрация билирубина сыворотки выше верхней границы нормы более чем в 1,5 раза) ограничен. Применение препарата Капрелса® у пациентов с печёночной недостаточностью противопоказано в связи с недостаточностью данных по безопасности и эффективности препарата у данной группы пациентов.
Побочное действие
Наиболее частыми нежелательными побочными реакциями при применении препарата Капрелса® были диарея, сыпь, тошнота, повышение артериального давления и головная боль. Ниже описаны нежелательные реакции, наблюдавшиеся в завершенных клинических исследованиях с участием пациентов с медуллярным раком щитовидной железы, получавших препарат Капрелса®.
Частота нежелательных реакций представлена в виде следующей градации: очень часто (>1/10), часто (>1/100, <1/10), нечасто (>1/1000, <1/100), редко (>1/10000, <1/1000), очень редко (<1/10000), включая отдельные сообщения.
Со стороны сердца и сосудов:
- Очень часто: удлинение интервала QTc на ЭКГ1,2, повышение артериального давления.
- Часто: ишемические цереброваскулярные явления, гипертонический криз.
- Нечасто: сердечная недостаточность, острая сердечная недостаточность, нарушения ритма, нарушение сердечной проводимости, желудочковая аритмия и остановка сердца.
Со стороны желудочно-кишечного тракта:
- Часто: стоматит, сухость во рту, колит, дисфагия, запор, гастрит, желудочно-кишечное кровотечение.
- Нечасто: панкреатит, перитонит, непроходимость кишечника, перфорации кишечника, недержание кала.
Общие расстройства:
- Очень часто: утомляемость, астения, боль, отёк.
- Часто: лихорадка.
- Нечасто: нарушение заживления ран.
Лабораторные и инструментальные данные:
- Очень часто: удлинение интервала QTc на ЭКГ.
- Часто: снижение массы тела, повышение активности аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (ACT), повышение концентрации креатинина в крови.
- Нечасто: повышение концентрации гемоглобина, повышение активности амилазы в сыворотке.
Со стороны обмена веществ и питания:
- Часто: гипокалиемия, гиперкальциемия, гипергликемия, обезвоживание, гипонатриемия.
- Нечасто: нарушение питания (истощение).
Со стороны эндокринной системы:
- Часто: гипотиреоз.
Нарушения психики:
- Очень часто: бессонница.
- Часто: депрессия, тревожность.
Со стороны почек и мочевыводящих путей:
- Часто: протеинурия, почечнокаменная болезнь, гематурия, дизурия, почечная недостаточность, учащённое мочеиспускание, императивные позывы к мочеиспусканию.
- Нечасто: хроматурия, анурия.
Со стороны дыхательной системы:
- Часто: носовое кровотечение, кровохарканье, пневмонит.
- Нечасто: дыхательная недостаточность, аспирационная пневмония.
Со стороны кожи и подкожных тканей:
- Очень часто: сыпь и другие кожные реакции (включая акне, сухость кожи, дерматит, зуд), реакции фоточувствительности, поражение ногтей.
Часто: ладонно-подошвенная эритродизестезия, алопеция.
- Нечасто: буллезный дерматит.
Со стороны органа зрения:
- Очень часто: структурные изменения роговицы (включая роговичный преципитат и помутнение роговицы).
- Часто: нечёткость зрения, конъюнктивит, сухость глаз, нарушения зрения, фотопсия, радужные круги вокруг источника света, глаукома, кератопатия.
- Нечасто: катаракта, нарушение аккомодации.
Со стороны нервной системы:
- Очень часто: головная боль, парестезия, дизестезия, головокружение.
- Часто: тремор, летаргия, потеря сознания, нарушение равновесия, нарушения вкуса.
- Нечасто: судороги, клонус, отёк мозга.
Инфекционные и паразитарные заболевания:
- Очень часто: назофарингит, бронхит, инфекции верхних дыхательных путей, инфекции мочевыводящих путей.
- Часто: пневмония, сепсис, грипп, цистит, синусит, ларингит, фолликулит, фурункул, грибковые инфекции, пиелонефрит.
- Нечасто: аппендицит, стафилококковые инфекции, дивертикулит, целлюлит, абсцесс брюшной стенки.
Нарушения со стороны печени и желчевыводящих путей:
- Часто: желчнокаменная болезнь.
1 У 13,4 % пациентов в группе вандетаниба интервал QTc (по Базетту) составил > 500 мс по сравнению с 1,0 % в группе плацебо. Удлинение интервала QTcF на >20 мс отмечено у более чем 91 % пациентов, >60 мс — у 35 % пациентов, >100 мс — у 1,7 % пациентов. В связи с удлинением интервала QTc у 8 % пациентов была снижена доза препарата.
2 Включая 2 случая со смертельным исходом (один в связи с сепсисом и один в связи с сердечной недостаточностью) у пациентов с интервалом QTc более 550 мс.
На фоне монотерапии вандетанибом отмечали случаи развития аритмии желудочковой тахисистолической типа «пируэт», синдрома Стивенса-Джонсона, мультиформной эритемы, интерстициального заболевания лёгких (в некоторых случаях с летальным исходом) и синдрома обратимой задней лейкоэнцефалопатии. Ожидается, что у пациентов с медуллярным раком щитовидной железы, получающих вандетаниб, эти нежелательные явления будут отмечаться нечасто.
Нарушения зрения, например, нечёткость зрения, часто наблюдали у пациентов с медуллярным раком щитовидной железы, получавших препарат Капрелса®.
Плановое исследование с помощью щелевой лампы выявило помутнение роговицы (вортикозные кератопатии) у пациентов, однако регулярное офтальмологическое обследование с помощью щелевой лампы не требуется.
В рандомизированном исследовании у пациентов с медуллярным раком щитовидной железы очень часто отмечали следующие изменения лабораторных показателей: белок и кровь в моче (экспресс-анализ с помощью тест-полосок), повышение концентрации тиреотропного гормона, гемоглобина и креатинина в сыворотке крови, повышение активности амилазы, повышение активности липазы. Отмечали повышение концентрации креатинина 1–2 степени СТСАЕ, что может быть связано с ингибированием OCT2 (см. раздел «Фармакокинетика»).
У пациентов, принимавших вандетаниб, отмечали повышение концентрации гемоглобина в среднем на 0,5–1,5 г/дл по сравнению с исходным значением.
Передозировка
Специфического лечения при передозировке препаратом Капрелса® не существует, возможные симптомы передозировки не установлены. Увеличение частоты развития и тяжести некоторых нежелательных реакций, таких как сыпь, диарея и артериальная гипертензия, отмечено при приёме препарата многократно в дозах 300 мг и выше. Следует учитывать возможное удлинение интервала QT и развитие аритмии желудочковой тахисистолической типа «пируэт».
В случае развития нежелательных реакций, связанных с передозировкой следует проводить симптоматическое лечение, в частности назначить соответствующее лечение тяжёлой диареи.
При передозировке следует прекратить дальнейший приём препарата и предпринять соответствующие меры для предотвращения развития нежелательных явлений, например, выполнять ЭКГ в течение 24 часов для определения удлинения интервала QTc.
Взаимодействие с другими лекарственными средствами
Влияние вандетаниба на фармакокинетику других лекарственных препаратов
Данные in vitro указывают, что вандетаниб является умеренным индуктором изофермента CYP3A4. В связи с чем следует соблюдать осторожность при применении вандетаниба с субстратами изофермента CYP3A4, особенно эстроген/прогестерон комбинированными препаратами, иммунодепрессантами, такими как циклоспорин или такролимус, или противоопухолевыми препаратами подобно доцетакселу и бортезомибу.
При совместном применении мидазолама (субстрат изофермента CYP3A4) и вандетаниба здоровыми добровольцами концентрация мидазолама не изменялась. Применение вандетаниба с препаратами, выведение которых происходит при участии транспортёра Р-гликопротеина (Р-gp) (например, дабигатран или дигоксин), может приводить к повышению концентрации этих препаратов в плазме и потребовать пристального клинического и лабораторного наблюдения за состоянием пациента и даже снижения дозы этих препаратов (наблюдение за пациентами, получающими вандетаниб, описано в разделах «Способ применения и дозы» и «Особые указания»). При совместном применении дигоксина и вандетаниба здоровыми добровольцами отмечено повышение AUC(0-t) (площадь под кривой зависимости концентрации от времени) и Сmах (максимальная концентрация) дигоксина на 23 % и 29 % соответственно.
Следует учитывать возможность удлинения интервала QT, развития желудочковой тахиаритмии типа «пируэт» при совместном применении вандетаниба и дигоксина; может потребоваться коррекция дозы. Вандетаниб, являясь ингибитором транспортёра органических катионов (OCT2), может замедлять выведение метформина и других субстратов OCT2, тем самым повышая их концентрацию. При совместном применении метформина (субстрат OCT2) и вандетаниба здоровыми добровольцами (дикий тип OCT2) отмечено повышение AUC(0-t) и Cmax метформина на 74 % и 50 %, соответственно, а также снижение почечного клиренса метформина на 52 %. Может потребоваться более тщательное наблюдение за пациентом и снижение дозы метформина (наблюдение за пациентами, получающими вандетаниб, описано в разделах «Способ применения и дозы» и «Особые указания»).
Влияние других лекарственных препаратов на фармакокинетику вандетаниба
При совместном применении омепразола и вандетаниба здоровыми добровольцами отмечено снижение Сmах вандетаниба на 15 %, при этом значение AUC(0-t) не изменилось. При совместном применении ранитидина и вандетаниба значения Сmах и AUC(0-t) вандетаниба не изменялись. При совместном применении вандетаниба и ранитидина или омепразола коррекция дозы не требуется.
Не наблюдалось клинически значимого взаимодействия вандетаниба и мощного ингибитора изофермента CYP3A4, итраконазола. Однако при совместном применении вандетаниба и итраконазола, и других мощных ингибиторов изофермента CYP3A4 (например, кетоконазола, ритонавира и кларитромицина) следует соблюдать осторожность.
При совместном применении вандетаниба и рифампицина, мощного индуктора изофермента CYP3A4 у мужчин, концентрация вандетаниба снижалась на 40 %, поэтому следует избегать совместного применения вандетаниба и мощных индукторов изофермента CYP3A4 (например, рифампицина, карбамазепина, фенобарбитала и препаратов зверобоя продырявленного) (см. раздел «Особые указания»).
Лекарственные препараты, способные удлинять интервал QTc
Вандетаниб может вызывать удлинение интервала QTc, поэтому его не следует принимать одновременно с другими лекарственными средствами, способными удлинять интервал QTc и/или вызывающими трепетание/мерцание:
- противопоказано применение с мышьяком, цизапридом, эритромицином (внутривенно), торемифеном, мизоластином, моксифлоксацином, антиаритмическими средствами IA и III класса (см. раздел «Противопоказания»);
- не рекомендовано применение с метадоном, галоперидолом, амисульпридом, хлорпромазином, сульпиридом, зуклопентиксолом, галофантрином, пентамидином и лумефантрином.
При отсутствии подходящей альтернативной терапии применение нерекомендуемой комбинации препаратов возможно, если обеспечен мониторинг интервала QTc на ЭКГ, контроль концентрации электролитов, и дополнительный контроль в случае возникновения или усиления диареи.
При совместном применении вандетаниба и ондансетрона наблюдали незначительный аддитивный эффект на удлинение интервала QTc (приблизительно на 10 мс), поэтому совместное применение этих препаратов не рекомендуется. В случае применения ондансетрона совместно с вандетанибом требуется тщательный контроль концентрации электролитов в сыворотке и ЭКГ, а также интенсивная терапия любых нарушений.
Приём пищи не влияет на концентрацию вандетаниба.
Ввиду возможного взаимодействия антагонистов витамина K и химиотерапевтических препаратов, рекомендуется более частый мониторинг международного нормализованного отношения (МНО).
Особые указания
Принимая во внимание возможные риски, очень важно назначать терапию вандетанибом только пациентам, которым она объективно показана, а именно пациентам с симптоматически- агрессивным течением заболевания.
Только наличие симптомов или только прогрессирование заболевания не является достаточным основанием для назначения вандетаниба.
Показатель изменения концентрации биомаркеров, таких как кальцитонин и/или раковоэмбриональный антиген (СЕА), а также темп роста опухоли во время динамического наблюдения помогут определить пациентов, нуждающихся в данной терапии, а также оптимальное время её начала.
Удлинение интервала QTc
У пациентов, получавших препарат Капрелса®, наблюдали удлинение интервала QTc на ЭКГ (см. раздел «Побочное действие»). У 8 % пациентов с медуллярным раком щитовидной железы, получавших препарат в дозе 300 мг/сутки, в исследовании фазы III наблюдалось подтверждённое удлинение интервала QTc на ЭКГ. Удлинение QTc интервала на ЭКГ зависит от дозы, и поддаётся лечению путём соответствующего мониторинга, приостановки терапии и снижения дозы, если потребуется.
Нечасто сообщалось о случаях развития аритмии желудочковой тахисистолической типа «пируэт» (Torsades de Pointes) и желудочковой тахикардии при применении препарата Капрелса® в дозе 300 мг.
Не следует начинать терапию препаратом Капрелса® у пациентов со скорректированным значением интервала QT на ЭКГ более 480 мс. Не следует назначать препарат Капрелса® пациентам с аритмией желудочковой тахисистолической типа «пируэт» в анамнезе, кроме случаев, когда все факторы риска, способствующие её развитию, скорректированы.
Исследования применения препарата Капрелса® у пациентов с желудочковыми аритмиями или недавно перенесённым инфарктом миокарда не проводились.
ЭКГ и результаты измерений сывороточных концентраций калия, кальция, магния и ТТГ (тиреотропного гормона) необходимо получить до начала, через 2–4 недели и 8–12 недель после начала применения препарата Капрелса®, и затем каждые 3 месяца на протяжении года. ЭКГ и анализы крови необходимо также выполнять по клиническим показаниям во время этого периода и впоследствии. Концентрация калия в сыворотке крови должна поддерживаться на значении 4 мэкв/л или выше, а концентрации магния и кальция должны быть в пределах нормы для снижения риска удлинения интервала QT (на ЭКГ). При отсутствии альтернативной терапии препарат Капрелса® можно применять с некоторыми препаратами, удлиняющими интервал QT на ЭКГ (см. раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействия»). Если такие препараты назначены пациенту, уже принимающему препарат Капрелса®, то необходимо выполнять ЭКГ мониторинг интервала QT в соответствии с фармакокинетикой добавленного препарата.
При значении интервала QTc на ЭКГ более 500 мс при однократном измерении необходимо приостановить терапию препаратом Капрелса®. После возврата интервала QTc к исходному значению или менее 450 мс можно возобновить приём препарата в более низкой дозе.
Кожные реакции
Во время терапии препаратом Капрелса® у пациентов наблюдали развитие сыпи и других кожных реакций (включая реакции фоточувствительности и синдрома ладонно-подошвенной эритродизестезии). Слабо и умеренно выраженные кожные реакции обычно разрешаются при проведении симптоматической терапии или снижении дозы препарата Капрелса®. В случае развития более тяжёлых кожных реакций (таких как синдром Стивенса-Джонсона) может потребоваться назначение системных глюкокортикостероидов и прекращение терапии препаратом Капрелса®.
Во время терапии препаратом Капрелса® необходимо носить одежду, защищающую от воздействия солнечных лучей, и/или использовать солнцезащитные средства.
Диарея
У пациентов, принимавших препарат Капрелса®, наблюдалось развитие диареи. Для лечения диареи рекомендуется применение обычных противодиарейных средств. Необходимо внимательно контролировать сывороточные концентрации электролитов. При развитии тяжёлой диареи (3–4 степени СТСАЕ) приём препарата необходимо приостановить до улучшения состояния, возобновляя терапию с меньшей дозы (см. разделы «Способ применения и дозы», «Побочное действие»).
Кровотечение
Сообщалось о случаях внутричерепного кровоизлияния, в связи с чем следует соблюдать осторожность при применении препарата Капрелса® у пациентов с метастазами в головной мозг.
Артериальная гипертензия
На фоне приёма препарата Капрелса® было отмечено развитие артериальной гипертензии, включая гипертонический криз. В связи с чем рекомендуется наблюдение пациентов и назначение соответствующего лечения артериальной гипертензии. Если высокое артериальное давление не поддаётся контролю лекарственными средствами, приём препарата Капрелса® не следует возобновлять до нормализации артериального давления (см. раздел «Побочное действие»). Может потребоваться снижение дозы препарата.
Сердечная недостаточность
У пациентов, принимавших препарат Капрелса®, отмечали развитие сердечной недостаточности, в некоторых случаях необратимой и с летальным исходом. При развитии сердечной недостаточности может потребоваться временная или полная отмена терапии препаратом Капрелса®.
Повышение активности АЛТ
На фоне приёма препарата Капрелса® часто отмечали повышение активности АЛТ. Большинство случаев разрешалось по мере продолжения терапии, другие — после приостановки лечения на 1–2 недели. При применении препарата Капрелса® рекомендуется периодически проводить оценку активности АЛТ.
Интерстициальное заболевание лёгких
При применении препарата Капрелса® наблюдалось развитие интерстициального заболевания лёгких, в некоторых случаях с летальным исходом. При возникновении таких респираторных симптомов как одышка, кашель и лихорадка, применение препарата Капрелса® должно быть приостановлено и проведено незамедлительное обследование. В случае подтверждения интерстициального заболевания лёгких, приём препарата Капрелса® следует прекратить и назначить соответствующее лечение.
Синдром обратимой задней лейкоэнцефалопатии (СОЗЛ)
У пациентов, принимавших препарат Капрелса® в комбинации с химиотерапией, или у детей с опухолью мозга, получавших монотерапию препаратом Капрелса®, отмечали развитие синдрома обратимой задней лейкоэнцефалопатии, синдрома подкоркового вазогенного отёка, выявляемого на МРТ головного мозга.
СОЗЛ отмечали у пациентов, принимавших вандетаниб. Данный синдром должен быть заподозрен при появлении у пациентов судорог, головной боли, нарушения зрения, спутанности сознания или нарушения умственной функции.
Почечная недостаточность
У пациентов с почечной недостаточностью средней степени тяжести (клиренс креатинина ≥30 и <50 мл/мин) начальную дозу препарата следует уменьшить до 200 мг (см. раздел «Способ применения и дозы»).
Печёночная недостаточность
Опыт применения препарата Капрелса® у пациентов с печёночной недостаточностью (уровень билирубина сыворотки выше верхней границы нормы более чем в 1,5 раза) ограничен, безопасность и эффективность препарата в этой популяции больных не установлены. Препарат Капрелса® противопоказан пациентам с печёночной недостаточностью (см. раздел «Противопоказания»).
Индукторы изофермента CYP3A4
Следует избегать одновременного применения препарата Капрелса® с мощными индукторами изофермента CYP3A4, такими как рифампицин, препараты зверобоя продырявленного, карбамазепин, фенобарбитал (см. раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействия»).
Другое
Женщины детородного возраста должны использовать надёжные методы контрацепции во время лечения препаратом Капрелса® и как минимум в течение 3-х месяцев после последнего приёма препарата.
Зависимость эффективности терапии вандетанибом от статуса мутации RET не доказана.
Преимущество терапии вандетанибом у пациентов с концентрацией кальцитонина менее 500 пг/мл не было изучено в клинических исследованиях, в связи с чем у таких пациентов может потребоваться тщательный контроль за концентрацией кальцитонина для снижения риска терапии вандетанибом.
Влияние на способность управлять транспортными средствами, механизмами
Не проводились исследования по изучению влияния препарата Капрелса® на способность к вождению автотранспорта и управлению механизмами. Однако во время терапии может отмечаться повышенная утомляемость и нечёткость зрения. В случае возникновения данных явлений пациентам следует соблюдать осторожность при управлении автотранспортом и другими механизмами.
Форма выпуска
Таблетки, покрытые плёночной оболочкой, 100 мг и 300 мг.
По 10 таблеток в блистере, сформированном из непластифицированной поливинилхлоридной (ПВХ) плёнки с поливинилиденхлоридом (ПВДХ), запечатанном алюминиевой фольгой высокой твердости, покрытой термолаком; по 3 блистера с инструкцией по применению в картонной пачке с контролем первого вскрытия.
Хранение
Хранить при температуре не выше 30 °C.
Хранить в местах, недоступных для детей.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
Отпускают по рецепту.
Производитель
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Капрелса:
- Отзывы
- Вопросы
Товары из категории — Препараты для лечения онкологических заболеваний
Инструкция по применению
Цена в интернет-аптеке WER.RU: от 233 000
Фармакологические свойства
Вандетаниб, являясь действующим веществом лекарственного средства Капрелса, оказывает подавляющее воздействие на тирозин-специфичную протеинкиназу, что способствует замедлению роста плоских клеток внутренней поверхности сосудов. В результате проведенных клинических испытаний в пробирке, было выявлено, что вандетаниб подавляет клеточные перемещения и новообразования, вызванные фактором роста сосудистого эндотелия. Опыты, проведенные на бестимусных мышах, показали, что активный компонент Капрелсы существенно понижает процесс возникновения кровеносных сосудов в тканях и органах, происходящий на фоне активности опухолевых клеток. Также он способствует снижению проницаемости раковых клеток, роста метастазов и опухоли.
Помимо этого активный компонент медикамента Капрелса подавляет белки раковых клеток, активизирующих рост эпителиальных клеток, а также деактивизирует протеинкиназы, перестроенные в процессе наполнения клеток эукариот нуклеиновой кислотой.
Согласно проведенным клиническим испытаниям с участием более трехсот пациентов, имеющих рак щитовидной железы, было выявлено отсутствие прогрессирования заболевания после приема лекарственного средства.
Активное вещество всасывается небыстро. Своего максимального содержания в организме пациента оно достигает спустя шесть часов после приема. При неоднократном употреблении увеличивается накопление компонента, выравнивание которого происходит через шестьдесят дней.
В результате процессов метаболизма в неизмененном виде действующий компонент был обнаружен в кале, моче и крови. Полураспад препарата занимает достаточно продолжительный промежуток времени, в связи чем его элиминация может занимать до двадцати одного дня. При этом порядка пятидесяти процентов выходит через кишечник и примерно двадцать пять процентов через мочевой пузырь.
Состав и форма выпуска
Состав лекарственного средства представляет собой набор следующих компонентов:
• активное вещество вандетаниб;
• дополнительные компоненты в виде микрокристаллической целлюлозы, стеарата магния, повидона, Calcium hydrophosphate dihydrate, Polyvinylpyrrolidone;
• пленочная оболочка, состоящая из полимера hypromellose 2910, macrogol 300, Titanium dioxide.
Производство лекарства осуществляется в виде таблеток круглой формы белого цвета, имеющих выпуклости с обеих сторон. На одной из сторон нанесена отметка Z100. Первичной упаковкой медикаментозного средства Капрелса являются блистерные поливинилхлоридные упаковки, в которых размещается десять таблеток. Реализация в аптечных пунктах осуществляется в картонных коробках преимущественно белого цвета, где вместе с инструкцией по применению располагаются три блистерных упаковки.
Показания к применению
Назначение Капрелсы осуществляется при наличии медуллярного рака щитовидной железы.
Побочные эффекты
Побочные эффекты могут проявляться со стороны различных органов и систем организма. Ниже они представлены в зависимости от частоты возникновения.
Очень часто могут возникать следующие реакции:
• повышение кровеносного давления;
• удлинение интервала QT на кардиограмме;
• жидкий стул, сопровождающийся спазмами;
• чувство подташнивания, переходящее в рвоту;
• расстройство пищеварительных процессов;
• повышенная утомляемость;
• слабость, упадок сил;
• отеки частей тела;
• понижение уровня кальция в крови;
• потеря аппетита;
• бессонница;
• аллергические кожные реакции в виде высыпаний, сухости, зуда, покраснений;
• аллергическая реакция на ультрафиолет;
• заболевания ногтей;
• поражения роговицы;
• головные боли, головокружения,
• ощущение покалывания в конечностях;
• воспаление носоглотки;
• воспаление легких;
• воспаление респираторного тракта;
Часто выявляются следующие побочные эффекты:
• нарушения в работе головного мозга;
• повышение кровеносного давления;
• поражения полости рта;
• нарушение процесса проглатывания;
• воспаление толстой кишки;
• нарушение дефекации;
• желудочные воспаления;
• кровотечение в желудке;
• жар, озноб;
• потеря веса;
• увеличение в крови содержания креатинина;
• увеличение в крови содержания кальция;
• увеличение в крови содержания сахара;
• понижение в крови содержания натрия;
• недостаток калия в организме;
• нарушение водно-электролитного обмена;
• понижение выработки в организме аминокислот тирозина;
• ухудшение психоэмоционального состояния;
• возникающее периодически чувство тревоги;
• повышение уровня белка в моче;
• повышение крови в моче;
• отложение камней в почках;
• нарушения мочеиспускания;
• нарушения в работе почек;
• частые позывы к мочеиспусканию;
• кровотечение из носа;
• воспаление альвеол легких;
• кашель с выделением крови;
• выпадение волос;
• нарушения зрения;
• воспаление глазной оболочки;
• повышение давления внутри глаз;
• самопроизвольное дрожание конечностей;
• летаргия;
• нарушение концентрации внимания, дезориентация в пространстве;
• внезапная потеря сознания;
• изменение вкусовых ощущений;
• инфекционные заболевания дыхательных путей, эпидермиса, почек
Редко проявляются следующие побочные эффекты:
• нарушение работы сердечно-сосудистой системы в острой форме;
• изменение количества сердечных сокращений;
• остановка сердца;
• воспаление поджелудочной железы;
• воспаление брюшины;
• кишечная непроходимость;
• прободение кишечника;
• расстройство процесса раневого заживления;
• повышение уровня гемоглобина в крови;
• паратрафия;
• кислородное голодание;
• аспирационная пневмония;
• возникновение водяных пузырей на коже;
• помутнение хрусталика глаза;
• спазм аккомодации;
• судороги конечностей;
• дивертикулез толстой кишки;
• отложение жира в подкожной клетчатке.
Противопоказания
Согласно инструкции употреблять препарат Капрелса не следует при наличии одного из нижеперечисленных противопоказаний:
• гиперчувствительность к отдельным компонентам медикамента;
• синдром удлиненного интервала QT;
• использование совместно с медикаментами, влияющими на удлинение интервала QT;
• нарушения в работе почек и печени тяжелой формы;
• период беременности и грудного вскармливания;
• детский возраст до восемнадцати лет ввиду отсутствия достоверных клинических сведений.
Беременность и лактация
В связи с отсутствием полной клинической картины, применение Капрелсы в период беременности запрещено в связи с возможным влиянием на развитие эмбриона, что было выявлено на доклиническом испытании с участием крыс.
Использование лекарственного средства во время грудного вскармливания запрещено в связи с возможным выделением активного компонента в молоко и, как следствие, оказанием негативного влияния на ребенка.
Применение: способ и особенности
Капрелса принимается перорально один раз в течение двадцати четырех часов. Прием пищи не влияет на биодоступность лекарства, поэтому его можно употреблять, как до, так и после еды. Разовой дозой является триста миллиграммов медикаментозного средства.
Таблетки Капрелса допускается принимать в виде суспензии, получаемой посредством разведения таблетки в воде. Не прибегая к измельчению, таблетку следует опустить в воду и помешивать ее до полного растворения, после чего незамедлительно выпить.
Как правило, лечение продолжается до наступления положительного эффекта от принимаемого лекарственного средства.
Совместимость с алкоголем
Достоверные данные об употреблении спиртосодержащих напитков во время терапевтического курса таблетками Капрелса отсутствуют.
Взаимодействие с другими лекарственными средствами
Рекомендуется с осторожностью принимать Капрелсу с ираконазолом, комбинированными эстроген-гестогенными препаратами, лекарствами, обеспечивающими искусственную иммуносупрессию, а также направленными на нарушение развития опухолей и метастаз, в связи с возможным повышением концентрации активных компонентов указанных средств в плазме крови.
При совместном употреблении с метформином возможно снижение темпов элиминации последнего, в связи с чем необходимо пристальное наблюдение со стороны лечащего врача.
Препарат Капрелса не рекомендуется принимать во время лечения лекарственными средствами, влияющими на удлинение интервала QT.
Передозировка
Точные признаки передозировки клинически не установлены, однако при многократном превышении установленной производителем дозы таблеток, возможны проявления побочного характера, при возникновении которых необходимо незамедлительно обратиться к компетентному специалисту для осуществления симптоматической терапии.
Особые указания
Ввиду наличия длинного перечня побочных действий и потенциальных последствий, связанных с ними, рекомендуется осуществлять назначение лекарственного средства Капрелса только при наличии серьезных оснований, среди которых агрессивное развитие заболевания.
Следует обратить внимание на тот факт, что препарат Капрелса не назначается детям до восемнадцати лет, в связи с отсутствием уверенности в его безопасном воздействии на детский организм.
Пожилой возраст не является основанием для изменения дозировки либо возникновения еще каких-либо ограничений.
Пациентам, имеющим заболевания почек легкой формы, не требуется изменять дозировку. Пациентам, имеющим заболевания почек тяжелой формы, принимать таблетки запрещено.
Также не рекомендуется принимать лекарство больным, страдающим от заболеваний печени в острой форме, в связи с отсутствием полной клинической картины.
Аналоги
Прямого аналога по составу Капрелса не имеет. В то же время к аналоговым средствам, схожим по показаниям, можно отнести Иматиб, Вотриент, Тарцева, Джакави, Иресса.
Международная классификация болезней (МКБ-10)
Согласно международной классификации болезней (МКБ-10) диагноз, при котором применяется данное медикаментозное средство, имеют кодировку: злокачественное новообразование щитовидной железы (C73).
Условия продажи
В аптечных пунктах лекарство реализуется строго по предписаниям лечащего врача.
Правила хранения, срок годности
Медикамент следует хранить в закрытом от солнечных лучей месте при температуре менее 25 градусов по Цельсию не более трех лет.
Отзывы о лекарственном средстве
Многие пациенты положительно отзываются о Капрелсе. В частности отмечается эффективное воздействие на опухоль щитовидной железы на любой ее стадии развития. Это происходит благодаря действующему компоненту вандетаниб, имеющему высокую активность в организме человека.
В то же время стоимость препарата, а также внушительный список побочных эффектов настораживают больных. Однако за неимением качественной альтернативы в борьбе с этим редким заболеванием, именно это лекарственное средство становится для многих единственной возможностью справиться со своим недугом.
Цены на Капрелса в Москве
Заберите заказ в в аптеке
WER (г. Москва)
Цена: от 233 000 руб.