Описание препарата Вектибикс (концентрат для приготовления раствора для инфузий, 20 мг/мл) основано на официальной инструкции, утверждено компанией-производителем в 2010 году
Дата согласования: 10.09.2010
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав и форма выпускa
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Отзывы
Действующее вещество
ATX
Фармакологическая группа
Состав и форма выпускa
| Концентрат для приготовления раствора для инфузий | 1 мл |
| панитумумаб | 20 мг |
| вспомогательные вещества: натрия ацетата тригидрат; натрия хлорид; уксусная кислота ледяная; вода для инъекций |
по 5 (100 мг), 10 (200 мг) или 20 (400 мг) мл во флаконах из прозрачного стекла с эластомерной пробкой, алюминиевым колпачком и отламывающимся полипропиленовым колпачком ; в контурной ячейковой упаковке 1 флакон; в пачке картонной. На каждую пачку наклеивают две прозрачные защитные этикетки — контроль первого вскрытия, — имеющие продольную цветную полосу.
Описание лекарственной формы
Прозрачная, бесцветная жидкость; может содержать полупрозрачные или белые аморфные белковые частицы.
Фармакологическое действие
Фармакологическое действие
—
противоопухолевое.
Фармакодинамика
Панитумумаб представляет собой человеческое моноклональное антитело IgG2, полученное из клеточной линии млекопитающих (яичники китайского хомячка) путем рекомбинантной ДНК-технологии.
Панитумумаб обладает высоким сродством и специфичностью к рецепторам ЭФР человека. Рецептор ЭФР — это трансмембранный гликопротеин из семейства рецепторов тирозинкиназ I типа, которое включает также HERl/c-ErbB-1, HER2, HER3 и HER4. Рецептор ЭФР стимулирует рост нормальных эпителиальных клеток, включая клетки кожи и волосяных фолликулов, и экспрессируется на различных типах опухолевых клеток.
Панитумумаб связывается с лиганд-связывающим доменом рецептора ЭФР и ингибирует процесс аутофосфорилирования, который индуцируется всеми известными лигандами рецептора ЭФР. Связывание панитумумаба с рецептором ЭФР приводит к интернализации рецептора, ингибированию процессов клеточного роста, индукции апоптоза и уменьшению продукции интерлейкина-8 и фактора роста эндотелия сосудов.
Ген KRAS (гомолог вирусного онкогена крысиной саркомы Кирстена 2) кодирует небольшой гуанозинтрифосфатсвязывающий белок, который участвует в трансдукции сигнала. KRAS активируется различными сигналами, в т.ч. и от рецептора ЭФР, и в свою очередь, стимулирует синтез других внутриклеточных белков, вовлеченных в процессы клеточной пролиферации, выживаемости и ангиогенеза.
Активирующие мутации гена KRAS часто происходят в различных опухолевых клетках человека и играют определенную роль как в процессе онкогенеза, так и в прогрессии опухоли.
Иммуногенность
Продукцию нейтрализующих антител к панитумумабу оценивали с помощью 2 различных методов иммуноанализа (ИФА — иммуноферментный анализ, который позволяет определить высокоаффинные антитела, и Биосенсор — позволяющий определить высоко- и низкоаффинные антитела). Результаты анализа показали, что в целом возникновение последозового ответа, оценивавшегося по наличию антител к панитумумабу, было низким. Антитела к панитумумабу до введения препарата были обнаружены у 5 из 636 пациентов (<1%) и 16 из 635 пациентов (2,5%), по данным ИФА и Биосенсор, соответственно. Нейтрализующие антитела к панитумумабу после введения препарата были обнаружены у 1 из 447 пациентов (0,2%) и у 7 из 447 пациентов (1,6%), по данным ИФА и Биосенсор, соответственно. При сравнении с пациентами, у которых антитела не вырабатывались, взаимосвязь между наличием нейтрализующих антител к панитумумабу и изменениями фармакокинетических параметров, эффективности и безопасности препарата не отмечена.
Определение антител зависит от чувствительности и специфичности используемого метода. На положительный результат по определению антител могут оказать влияние различные факторы, включая методику отбора образцов, прием сопутствующих препаратов и характер основного заболевания, поэтому сравнение частоты возникновения антител к панитумумабу с данным показателем для других препаратов может быть недостоверным.
Клиническая эффективность
Применение Вектибикса в клинических исследованиях у пациентов с метастатическим колоректальным раком (мКРР), у которых наблюдалась прогрессия заболевания на фоне или после предшествующего курса химиотерапии, приводит к увеличению выживаемости без прогрессии (ВБП), при этом абсолютное значение ВБП было больше у пациентов с KRAS дикого типа в опухолевых клетках по сравнению с группой пациентов с опухолями с мутациями KRAS.
Фармакокинетика
При назначении препарата Вектибикс в качестве монотерапии или в комбинации с химиотерапией фармакокинетика препарата носит нелинейный характер. После однократного введения панитумумаба в виде 1-часовой инфузии AUC возрастала в большей степени, чем это характерно при дозопропорциональной зависимости, а Cl препарата снижался с 30,6 до 4,6 мл/сут/кг при увеличении дозы от 0,75 до 9 мг/кг. Однако при введении панитумумаба в дозах свыше 2 мг/кг характер увеличения AUC был близок к дозопропорциональной зависимости.
При соблюдении рекомендованного режима дозирования (6 мг/кг 1 раз в 2 нед в виде 1-часовой инфузии) равновесная концентрация панитумумаба достигается к третьей инфузии при средних значениях Cmax (± стандартное отклонение) и Cmin (213±59) и (39±14) мкг/мл соответственно. Среднее значение (± стандартное отклонение) AUC0-t и Cl были равны (1306±374) мкг/мл·сут и (4,9±1,4) мл/кг/сут соответственно. Т1/2 препарата составил приблизительно 7,5 сут (разброс — от 3,6 до 10,9 сут).
По результатам анализа фармакокинетики в отдельных группах пациентов (преимущественно в возрасте 21–88 лет) возраст, пол пациента, раса, функция печени и почек, применение сопутствующих химиотерапевтических препаратов и экспрессия рецепторов эпителиального роста (ЭФР) клетками опухоли не оказывают явного влияния на фармакокинетику панитумумаба.
Фармакокинетика у отдельных групп пациентов
Исследований фармакокинетики панитумумаба у пациентов с нарушением функций почек или печени не проводилось.
Показания
Монотерапия метастатического колоректального рака с экспрессией рецепторов ЭФР и немутантным (диким) типом KRAS, при прогрессии заболевания на фоне или после предшествующего курса химиотерапии фторпиримидин-, оксалиплатин- и иринотекансодержащими режимами.
Противопоказания
угрожающие жизни реакции гиперчувствительности к любому из компонентов препарата в анамнезе;
интерстициальный пневмонит или фиброз легких;
детский возраст (эффективность и безопасность у детей до 18 лет не установлена);
беременность;
период кормления грудью.
Применение при беременности и кормлении грудью
Рецептор ЭФР участвует в контроле пренатального развития плода и играет определенную роль в процессах нормального органогенеза, пролиферации и дифференцировки клеток развивающегося эмбриона. Таким образом, препарат Вектибикс может оказывать потенциальный вред для плода при назначении беременным женщинам.
Известно, что человеческие антитела IgG способны проникать через плацентарный барьер, поэтому панитумумаб может проникать из организма матери в развивающийся организм плода. Поэтому женщины с сохранной репродуктивной функцией во время лечения препаратом Вектибикс и в течение 6 мес после его окончания должны использовать надежные средства контрацепции. Если беременность развилась на фоне терапии, необходимо разъяснить пациентке потенциальный риск прерывания беременности и потенциальный риск для плода.
Неизвестно, проникает ли панитумумаб в грудное молоко. Так как человеческие антитела IgG проникают в грудное молоко, можно предположить, что панитумумаб может также проникать в грудное молоко. Возможность всасывания препарата и его потенциальный вред для ребенка не установлены. В период лечения препаратом Вектибикс и в течение 3 мес после его окончания кормление грудью не рекомендуется.
В экспериментах было показано обратимое действие препарата на менструальный цикл и снижение плодовитости самок обезьян. В связи с этим панитумумаб может оказывать влияние на возможность развития беременности у женщин.
Способ применения и дозы
В/в, рекомендованная доза — 6 мг/кг массы тела 1 раз в 2 нед.
Особые группы пациентов
Безопасность и эффективность препарата Вектибикс не оценивали у пациентов с нарушениями функций почек или печени.
В случае назначения препарата людям пожилого возраста коррекции дозы не требуется.
Опыт по применению препарата Вектибикс у детей отсутствует, поэтому препарат не следует назначать пациентам младше 18 лет.
Рекомендации по коррекции доз и режима введения
При появлении слабых или умеренных признаков инфузионной реакции (степень 1–2) следует уменьшить скорость введения препарата на 50%. При появлении выраженных симптомов инфузионной реакции (степень 3–4) введение препарата Вектибикс следует немедленно прекратить.
При развитии дерматологической реакции 3-й и выше степени тяжести (по классификации NCI-CTC/CTCAE) или расцениваемой пациентом как непереносимая дерматологическая реакция следует временно приостановить применение препарата Вектибикс до уменьшения выраженности данной реакции (≤2-й степени тяжести). После уменьшения выраженности наблюдавшейся дерматологической реакции до ≤2-й степени введение препарата возобновляют в дозе, равной 50% от исходной. При отсутствии повторного развития реакции дозу препарата Вектибикс необходимо постепенно увеличивать на 25% до достижения рекомендованной дозы. В случае, если выраженность реакции не уменьшается до ≤2-й степени тяжести после пропуска 1 или 2 доз, или в случае рецидива, или возникновения непереносимой реакции при дозе препарата, равной 50% от исходной, прием препарата необходимо полностью отменить.
Инструкции по приготовлению и введению раствора для инфузии
Перед проведением инфузии препарат следует развести в 0,9% растворе натрия хлорида для инъекций с использованием асептической техники разведения. Не рекомендуется встряхивать или сильно взбалтывать флакон. Не следует вводить препарат, если наблюдается изменение цвета содержимого флакона. Из флакона с препаратом следует забирать необходимое количество препарата Вектибикс для получения дозы 6 мг/кг, которое затем растворяют в общем объеме 100 мл. Конечная концентрация не должна превышать 10 мг/мл. Дозы выше чем 1000 мг следует растворить в 150 мл 0,9% раствора натрия хлорида для инъекций. Полученный раствор перемешивают осторожным переворачиванием флакона, не встряхивая.
Препарат должен вводиться в/в с помощью инфузионного насоса в периферический зонд или постоянный катетер через встроенный фильтр 0,2 или 0,22 мкм с низкой степенью связывания белков. Рекомендованная длительность инфузии составляет приблизительно 60 мин. Длительность введения препарата в дозах свыше 1000 мг должна составлять приблизительно 90 мин.
До и после введения препарата Вектибикс инфузионную систему необходимо промыть физиологическим раствором, чтобы избежать смешивания препарата с другими лекарственными препаратами или растворами для в/в введения. Не рекомендуется струйное или болюсное введение препарата Вектибикс.
Побочные действия
Наиболее частыми нежелательными реакциями при применении препарата Вектибикс в режиме монотерапии были дерматологические реакции, наблюдавшиеся приблизительно в 93% случаев. Эти реакции обусловлены фармакологическими свойствами препарата и обычно имеют легкую или среднюю степень тяжести; только в 12% случаев дерматологические реакции носят тяжелый характер (степень тяжести 3 и выше по классификации NCI-CTC). Частыми побочными реакциями, возникавшими у >20% пациентов, были расстройства ЖКТ (тошнота — 30%, диарея — 27% и рвота — 22%); общие реакции (повышенная утомляемость — 35%, инфекции и инвазии, в т.ч. паронихия — 21%) и патология кожи и подкожной ткани (зуд — 53%, эритема — 52%, акнеформный дерматит — 51% и сыпь — 38%).
Ниже приведены данные по нежелательным реакциям, наблюдавшимся у пациентов с мКРР, получавших панитумумаб в качестве монотерапии. Профиль безопасности панитумумаба у пациентов с экспрессией KRAS дикого типа в клетках опухоли в целом был сходен с таковым для группы монотерапии мКРР. Единственным отличием было то, что патология ногтей и гипомагниемия в группе пациентов с повышенной экспрессией KRAS дикого типа была выше (≥1/10), чем у пациентов в общей популяции монотерапии мКРР (≥1/100–< 1/10), а также стоматит и угревая сыпь классифицировались как частые явления в группе с диким типом KRAS и как очень частые в общей популяции монотерапии мКРР. Кроме того, бронхоспазм, гипотензия и гипертензия классифицировались как нечастые (≥1/1000–< 1/100) в общей популяции монотерапии мКРР и как частые (≥1/100–< 1/10) в группе с диким типом KRAS.
Нежелательные реакции представлены в соответствии со следующей градацией частоты их возникновения: очень часто (≥1/10) и часто (≥1/100–<1/10), редко (≥1/1000–<1/100) и очень редко (≥1/10000–<1/1000).
Инфекции и инвазии: очень часто — паронихия; часто — пустулезная сыпь, целлюлит, глазная инфекция, инфекция век.
Со стороны кожи и подкожно-жировой клетчатки: очень часто — угревидная сыпь, угревая сыпь, эритема, шелушение кожи, эксфолиативная сыпь, кожный зуд, сухость кожи, кожные трещины, акнеформный дерматит; часто — папулезная сыпь, эритематозная сыпь, макулезная сыпь, макулопапулезная сыпь, зудящая сыпь, кожные язвы, заболевания ногтей (онихоклазия, онихолизис), гипертрихоз, алопеция, чесотка, синдром ладонно-подошвенной эритродизестезии; очень редко — ангионевротический отек.
Кожная сыпь, развивавшаяся на фоне лечения Вектибиксом, наиболее часто локализовалась на лице, верхней части грудной клетки и спине, однако в некоторых случаях распространялась и на конечности. Как следствие тяжелых дерматологических реакций отмечали также развитие инфекционных осложнений, таких как сепсис, в редких случаях с летальным исходом, целлюлит и местные абсцессы, требующие хирургического вмешательства и дренирования. Медиана времени до развития первых проявлений дерматологических реакций составила 10 дней, а медиана времени до их разрешения с момента последнего введения Вектибикса — 28 дней.
Паронихиальное воспаление сопровождалось припухлостью латеральных ногтевых валиков пальцев рук и ног.
Дерматологические реакции (включая воздействие на ногти), наблюдавшиеся у пациентов, получавших Вектибикс или другие ингибиторы ЭФР, являются известными фармакологическими эффектами данных препаратов. По данным общей популяции монотерапии мКРР к тяжелым (степени 3–4) реакциям относились: акнеформный дерматит (5%), эритема (4%), сыпь (3%), зуд (2%), эксфолиативная сыпь (1%), угревая сыпь (1%), трещины кожи (1%), шелушение кожи (<1%), сухость кожи (<1%), кожные язвы (<1%), чесотка (<1%), эритематозная сыпь (<1%), папулезная сыпь (<1%) и макулопапулезная сыпь (<1%). Паронихия отмечалась у 1 % пациентов, получавших Вектибикс.
Со стороны пищеварительной системы: очень часто — диарея, тошнота, рвота, боль в животе, запор, стоматит; часто — сухость слизистой ротовой области.
В большинстве случаев диарея имела легкую или умеренную степень тяжести, и только у 2% пациентов с экспрессией KRAS дикого типа диарея имела тяжелую степень. Сообщалось о развитии острой почечной недостаточности на фоне диареи тяжелой степени и обезвоживания.
Со стороны органов дыхания: очень часто — одышка, кашель; часто — сухость слизистой оболочки носа, носовые кровотечения, эмболия легочной артерии; редко — бронхоспазм.
Со стороны органа зрения: часто — конъюнктивит, повышенное слезотечение, гиперемия глазного яблока, сухость и раздражение глаз, раздражение век, зуд глаз, усиление роста ресниц.
Со стороны нервной системы: часто — головная боль, головокружение.
Метаболические нарушения: часто — гипомагниемия, гипокальциемия, гипокалиемия, дегидратация.
Инфузионные реакции. В ходе клинических исследований и в постмаркетинговый период отмечались следующие побочные реакции, возникающие в течение 24 ч после инфузии: боль в животе, анафилактические реакции, ангионевротический отек, боль в спине, бронхоспазм, остановка сердца, боль в грудной клетке, озноб, цианоз, одышка, приливы крови, гипертензия, гипотензия, пирексия, тахикардия, рвота.
Реакции на инфузию (развивающиеся в течение 24 ч с момента первого введения препарата) наблюдались у 3% пациентов, получавших Вектибикс в клинических исследованиях. Частота тяжелых реакций (степени 3 и 4) составила <1%.
В постмаркетинговых исследованиях сообщалось о серьезных инфузионных реакциях, включая сообщения о редких летальных исходах.
Сообщалось о развитии случая летального ангионевротического отека у пациента с рецидивирующим метастатическим плоскоклеточным раком головы, получавшего Вектибикс. Фатальное осложнение развилось при возобновлении терапии после предшествующего эпизода развития ангионевротического отека. Обе реакции зафиксированы спустя более 24 ч после введения препарата. О реакциях гиперчувствительности, развившихся более чем через 24 ч после инфузии, также сообщалось и в постмаркетинговый период.
Прочие: очень часто — повышенная утомляемость, пирексия; часто — инфузионные реакции, воспаление слизистой ротовой полости, озноб, ощущение дискомфорта в груди, гиперчувствительность, тахикардия, боли в спине; редко — анафилактические реакции, приливы крови к лицу, гипотензия, гипертензия, цианоз.
Вектибикс в комбинации с другими противораковыми препаратами и/или в виде монотерапии
Во всех клинических исследованиях в комбинации с другими противораковыми препаратами и/или в виде монотерапии наиболее серьезными побочными явлениями, связанными с препаратом Вектибикс, были: эмболия легочной артерии, тяжелая дерматологическая токсичность, осложненная инфекцией, и смерть в результате сепсиса, инфузионные реакции и гипомагниемия. Побочные реакции, требующие отмены препарата Вектибикс, включали инфузионные реакции, тяжелую кожную токсичность и паронихию.
Взаимодействие
Исследований взаимодействий препарата не проводилось.
Не рекомендуется сочетанное назначение препарата Вектибикс с режимами химиотерапии на основе режима ИФЛ (иринотекана, фторпиримидинов и кальция фолината (лейковорина) или режимами химиотерапии, включающими бевацизумаб. При назначении панитумумаба в сочетании с режимом химиотерапии, включавшей бевацизумаб, отмечалось повышение смертности.
Вектибикс не следует назначать в комбинации с химиотерапией, содержащей оксалиплатин, пациентам с мКРР, опухолями, характеризующимися мутантным KRAS, или в случае неуточненного статуса KRAS опухоли. В ходе клинического исследования у пациентов с опухолями с мутировавшим KRAS, получавших панитумумаб и 5-фторурацил и лейковорин (FOLFOX), отмечалось сокращение выживаемости без прогрессии общего времени выживаемости.
Передозировка
Симптомы: при превышении рекомендованной терапевтической дозы приблизительно в 2 раза наблюдались токсические реакции со стороны кожи, диарея, дегидратация и повышенная утомляемость, что соответствовало профилю безопасности препарата в рекомендованной дозе.
Лечение: симптоматическое.
Особые указания
Общие указания
Лечение препаратом Вектибикс должно производиться под контролем лечащего врача, имеющего опыт назначения противоопухолевых препаратов.
Определение экспрессии немутантного KRAS должно проводиться опытными врачами-лаборантами с использованием валидированной методики.
Дерматологические реакции
Дерматологические реакции — эффект ингибиторов рецептора ЭФР, обусловленный фармакологическими свойствами, — наблюдались практически у всех пациентов (приблизительно 90%), получавших препарат Вектибикс. Пациенты, у которых на фоне лечения развивались тяжелые дерматологические реакции или ухудшалось течение остальных дерматологических реакций, должны наблюдаться на предмет развития воспалительных или инфекционных осложнений (включая целлюлит); при необходимости таким пациентам следует назначить соответствующее лечение. Во время лечения препаратом Вектибикс и при развитии дерматологических реакций/кожной сыпи рекомендуется использовать солнцезащитный крем и головной убор, т.к. солнечный свет может усилить выраженность дерматологических реакций, возникающих на фоне применения препарата.
Осложнения со стороны легких
Интерстициальные заболевания легких возникали на фоне терапии другими ингибиторами рецептора ЭФР, поэтому при возникновении или ухудшении легочных симптомов лечение препаратом Вектибикс должно быть приостановлено и наблюдающиеся симптомы незамедлительно и тщательно изучены. При обнаружении пневмонита или инфильтратов в легочной ткани препарат следует отменить и назначить соответствующее лечение.
Нарушения электролитного баланса
У некоторых пациентов отмечалось прогрессивное снижение сывороточных концентраций магния, приводившее к тяжелой (степень 4) гипомагниемии. Необходим периодический мониторинг состояния пациентов с целью выявления развития гипомагниемии и сопутствующей гипокальциемии каждые 2 нед в период лечения препаратом Вектибикс и в течение 8 нед после его окончания. Также отмечались нарушения баланса других электролитов, включая гипокалиемию. Рекомендуется адекватно поддерживать сывороточные концентрации других электролитов.
Препарат содержит 0,15 ммоль натрия (что соответствует 3,45 мг натрия) на 1 мл концентрата. В связи с этим пациентам, придерживающимся диеты со сниженным содержанием натрия в период лечения, необходимо контролировать количество натрия в своем рационе.
Инфузионные реакции
В ходе клинического исследования у 4% пациентов отмечались инфузионные реакции, при этом у 1% пациентов данные реакции классифицировались как тяжелые (степени 3 и 4 по NCI-CTC).
Во всех клинических исследованиях инфузионные реакции (возникавшие в течение 24 ч после любой инфузии) отмечались у 3% пациентов, получавших Вектибикс, из которых <1% были тяжелыми (степени 3 и 4 по NCI-CTC). В постмаркетинговых исследованиях сообщалось о серьезных инфузионных реакциях, включая редкие постмаркетинговые отчеты с летальным исходом. Следует прекратить инфузию в случае возникновения тяжелой или угрожающей жизни реакции (например при возникновении бронхоспазма, ангионевротического отека, гипотензии или анафилаксии). В зависимости от тяжести и/или продолжительности реакции следует решить вопрос о постоянной отмене препарата Вектибикс.
У пациентов с легкими или умеренными (степени 1 и 2 по NCI-CTC) инфузионными реакциями следует уменьшить скорость инфузии в течение всей инфузии. Рекомендуется сохранять сниженную скорость инфузии в ходе всех последующих инфузий.
Сообщалось о реакциях гиперчувствительности, возникавших более чем через 24 ч после инфузии, включая ангионевротический отек со смертельным исходом, развившийся более чем через 24 ч после инфузии. Следует предупредить пациентов о возможности позднего развития реакции и проинструктировать обращаться к своему лечащему врачу в случае возникновения симптомов реакции гиперчувствительности.
Вектибикс в комбинации с режимами химиотерапии
При применении Вектибикса в комбинации с бевацизумабом и режимом ИФЛ отмечено значительное повышение частоты развития легочной эмболии, инфекционных осложнений (преимущественно дерматологического происхождения), диареи, нарушения электролитного баланса и дегидратации.
Дополнительный анализ данных по эффективности в зависимости от статуса KRAS не выявил преимуществ добавления Вектибикса к схемам химиотерапии на базе оксалиплатина или иринотекана и бевацизумаба. Отмечена тенденция к уменьшению выживаемости в группах на режимах, содержащих оксалиплатин или иринотекан, вне зависимости от статуса мутации KRAS.
В связи с этим, необходимо избегать сочетания Вектибикса с режимами химиотерапии, содержащими бевацизумаб.
Вектибикс в комбинации с химиотерапией на основе оксалиплатина при лечении пациентов с мКРР
Вектибикс не следует назначать в комбинации с химиотерапией, содержащей оксалиплатин, пациентам с мКРР, опухолями, характеризующимися мутантным KRAS, или в случае неуточненного статуса KRAS опухоли. В ходе исследования фазы III (n=1183, 656 пациентов с диким типом KRAS и 440 пациентов с мутировавшим типом KRAS в опухолях) по оценке панитумумаба в комбинации с инфузионным 5-фторурацилом, лейковорином (FOLFOX), по сравнению только с FOLFOX в качестве терапии первой линии при мКРР у пациентов с опухолями с мутировавшим KRAS, получавших панитумумаб и FOLFOX (n=221) по сравнению только с FOLFOX (n=219), отмечалось сокращение выживаемости без прогрессии общего времени выживаемости.
Острая почечная недостаточность
Острая почечная недостаточность отмечена у пациентов с тяжелыми диареей и дегидратацией.
Влияние на способность управлять автомобилем или работать со сложными механизмами
Специальных исследований влияния препарата на возможность управлять транспортными средствами и использовать сложное оборудование не проводилось. В случае развития нежелательных реакций со стороны органов зрения и/или снижения способности к концентрации внимания и быстроты реакции пациентам рекомендуется воздержаться от управления транспортными средствами или работы со сложным оборудованием до разрешения указанных нежелательных реакций препарата.
Особые указания по сроку годности
Вектибикс не содержит антимикробных консервантов или бактериостатических агентов. С микробиологической точки зрения препарат должен быть использован непосредственно после разведения. Если препарат не был использован сразу после разведения, пользователь несет ответственность за время и условия его хранения до следующего введения (не более 24 ч при температуре от 2 до 8 °C, если только разведение не проводилось в контролируемых и валидированных асептических условиях). Не замораживать разведенный раствор.
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре 2–8 °C (не замораживать).
Не замораживать. Хранить в оригинальной упаковке для защиты от света.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Вектибикс — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛСР-007740/09
Торговое наименование препарата:
Вектибикс
Международное непатентованное наименование:
панитумумаб
Лекарственная форма:
концентрат для приготовления раствора для инфузий
Состав
1 мл концентрата содержит:
активное вещество: панитумумаб — 20 мг;
вспомогательные вещества: натрия ацетата тригидрат — 6,8 мг, натрия хлорид — 5,8 мг, уксусная кислота ледяная — до рН 5,8, вода для инъекций — достаточное количество.
Описание
Прозрачная или слегка опалесцирующая бесцветная жидкость; может содержать полупрозрачные или белые аморфные белковые частицы.
Фармакотерапевтическая группа
Противоопухолевое средство, моноклональные антитела.
Код АТХ:
L01XC08
Фармакологические свойства
Фармакодинамика
Механизм действия
Панитумумаб представляет собой рекомбинантное человеческое моноклональное антитело (IgG2), обладающее высокой аффинностью и специфичностью к рецепторам эпителиального фактора роста человека (EGFR). Рецептор EGF — это трансмембранный гликопротеин из семейства рецепторов тирозинкиназ I типа, которое включает также EGFR (HER1/c-ErbB-1), HER2, HER3 и HER4. Рецептор EGF стимулирует рост нормальных эпителиальных клеток, включая клетки кожи и волосяных фолликулов, и экспрессируется на различных типах опухолевых клеток.
Панитумумаб связывается с лиганд-связывающим доменом рецептора EGF и ингибирует процесс аутофосфорилирования, который индуцируется всеми известными лигандами рецептора EGF. Связывание панитумумаба с рецептором EGF приводит к интернализации рецептора, ингибированию процессов клеточного роста, индукции апоптоза и уменьшению продукции интерлейкина-8 и фактора роста эндотелия сосудов.
Гены KRAS (гомолог вирусного онкогена крысиной саркомы Кирстена 2) и NRAS (гомолог нейробластомы вирусного онкогена RAS) относятся к семейству онкогенов RAS. Гены KRAS и NRAS кодируют небольшой гуанозинтрифосфат-связывающий белок, который участвует в трансдукции сигнала. KRAS и NRAS активируется различными сигналами, в том числе и от рецептора EGF, и в свою очередь, стимулирует синтез других внутриклеточных белков, вовлеченных в процессы клеточной пролиферации, выживаемости и ангиогенеза.
Активирующие мутации генов RAS часто происходят в различных опухолевых клетках человека и играют определенную роль, как в процессе онкогенеза, так и в прогрессии опухоли.
Фармакодинамические эффекты
Исследования in vitro и in vivo на животных показали, что панитумумаб ингибирует рост и выживаемость опухолевых клеток, экспрессировавших EGFR. Не наблюдалось противоопухолевой активности панитумумаба в экспериментах с ксенотрансплантатами опухолей человека, не экспрессировавшими EGFR. Добавление панитумумаба к лучевой, химио- или другой таргетной терапии в исследованиях на животных приводило к усилению противоопухолевого эффекта по сравнению с только лучевой, химио- или таргетной терапией.
Кожные реакции (в том числе проявления на ногтях) отмечались у пациентов, получавших препарат Вектибикс или другие ингибиторы EGFR, и, как известно, ассоциированы с фармакологическими эффектами терапии (см. разделы «Способ применения и дозы» и «Побочное действие»).
Иммуногенность
Как и все терапевтические протеины, панитумумаб обладает потенциальной иммуногенностью. Продукцию анти-панитумумаб антител оценивали с помощью двух различных скрининговых систем иммуноанализа для определения связывающих анти-панитумумаб антител (ИФА -иммуноферментный анализ, который позволяет определить высокоаффинные антитела, и биосенсорный иммуноанализ, позволяющий определить высоко- и низкоаффинные антитела). Пациентам, чья сыворотка оказывалась положительной в любом из двух тестов скринингового иммуноанализа, проводился также биологический тест in vitro для обнаружения нейтрализующих антител.
В качестве монотерапии:
- Выявляемость связывающих антител (за исключением случаев выявления антител до введения препарата и временно положительных) составляла < 1%, как было установлено с помощью анализа ИФА методом кислотной диссоциации, и 3,8%, как было установлено с помощью иммунологического анализа Biacore;
- Выявляемость нейтрализующих антител (за исключением случаев выявления антител до введения препарата и временно положительных) составляла < 1%;
- При сравнении с пациентами, у которых антитела не вырабатывались, взаимосвязь между наличием анти-панитумумаб антител и изменениями фармакокинетических параметров, эффективности и безопасности препарата не отмечена.
В комбинации с режимами химиотерапии на основе иринотекана или оксалиплатина:
- Выявляемость связывающих антител (за исключением случаев выявления антител до введения препарата) составляла 1%, как было установлено с помощью анализа ИФА методом кислотной диссоциации, и < 1%, как было установлено с помощью иммунологического анализа Biacore;
- Выявляемость нейтрализующих антител (за исключением случаев выявления антител до введения препарата) составляла < 1%;
- Не было обнаружено никаких доказательств изменения профиля безопасности у пациентов с положительным результатом теста на антитела к препарату Вектибикс.
Определение образования антител зависит от чувствительности и специфичности используемого метода. На положительный результат по определению антител могут оказать влияние различные факторы, включая метод проведения анализа, методику отбора и подготовку образцов, время забора проб, прием сопутствующих лекарственных препаратов и характер основного заболевания, поэтому сравнение частоты возникновения антител к другим препаратам может приводить к недостоверным результатам.
Фармакокинетика
При применении препарата Вектибикс в качестве монотерапии или в комбинации с химиотерапией фармакокинетика препарата носит нелинейный характер.
После однократного введения панитумумаба в виде 1-часовой инфузии площадь под кривой «концентрация-время» (AUC) возрастала в большей степени, чем это характерно при дозопропорциональной зависимости, а клиренс (CL) панитумумаба снижался с 30,6 до 4,6 мл/сут/кг при увеличении дозы от 0,75 до 9 мг/кг. Однако при введении панитумумаба в дозах свыше 2 мг/кг характер увеличения AUC был близок к дозопропорциональной зависимости.
При соблюдении рекомендованного режима дозирования (6 мг/кг 1 раз в 2 недели в виде 1-часовой инфузии) равновесная концентрация панитумумаба достигается к третьей инфузии при средних значениях максимальной (± стандартное отклонение [SD]) и минимальной концентраций 213 ± 59 и 39 ± 14 мкг/мл, соответственно. Среднее значение (± SD) AUC0-T и клиренса были равны 1306 ± 374 мкг x сут/мл и 4,9 ± 1,4 мл/кг/сут, соответственно. Период полувыведения препарата составил приблизительно 7,5 суток (разброс: от 3,6 до 10,9 суток).
Был выполнен популяционный анализ фармакокинетики с целью оценки потенциального влияния отдельных ковариат на параметры фармакокинетики панитумумаба. Результаты его показали, что возраст (в диапазоне 21-88 лет), пол, раса, функция печени и почек, применение сопутствующих химиотерапевтических препаратов и интенсивность окрашивания мембран EGFR (1+, 2+, 3+) в опухолевых клетках не оказывают явного влияния на фармакокинетику панитумумаба.
Исследований фармакокинетики панитумумаба у пациентов с нарушением функций почек или печени не проводилось.
Показания к применению
Лечение метастатического колоректального рака (мКРР) у взрослых пациентов с генами RAS дикого типа в опухоли:
- в качестве первой линии терапии в комбинации с режимами, содержащими фторурацил, кальция фолинат и оксалиплатин (FOLFOX) или фторурацил, кальция фолинат и иринотекан (FOLFIRI);
- в качестве второй линии терапии в комбинации с режимом, содержащим фторурацил, кальция фолинат и иринотекан (FOLFIRI) у пациентов, получавших ранее химиотерапию первой линии на основе фторпиримидина (исключая иринотекан);
- в качестве монотерапии при неэффективности режимов химиотерапии на основе фторпиримидина, оксалиплатина и иринотекана.
Противопоказания
- Пациенты с анамнезом тяжелых или угрожающих жизни реакций гиперчувствительности к действующему веществу или любому из вспомогательных веществ препарата, перечисленных в разделе «Состав» (см. раздел «Особые указания»);
- Пациенты с интерстициальным пневмонитом или фиброзом легких (см. раздел «»);
- Комбинация препарата Вектибикс с оксалиплатин-содержащим режимом химиотерапии противопоказана пациентам с мКРР и мутациями в генах RAS или пациентам с мКРР с неуточненным статусом мутаций в генах RAS (см. раздел «Особые указания»);
- Пациенты с почечной и печеночной недостаточностью (эффективность и безопасность применения не установлены);
- Детский возраст до 18 лет (эффективность и безопасность применения не установлены; см. раздел «Способ применения и дозы»);
- Беременность и период грудного вскармливания (эффективность и безопасность применения не установлены; см. раздел «Применение при беременности и в период грудного вскармливания»).
С осторожностью
- У пациентов с кератитом, язвенным кератитом или выраженной сухостью глаз (см. раздел «Особые указания»).
Применение при беременности и в период грудного вскармливания
Беременность
Достоверные данные о применении препарата Вектибикс у беременных отсутствуют. В исследованиях на животных была продемонстрирована репродуктивная токсичность препарата. Потенциальный риск ее у человека не известен. Рецептор EGF участвует в контроле пренатального развития плода и играет определенную роль в процессах нормального органогенеза, пролиферации и дифференцировки клеток развивающегося эмбриона. Таким образом, препарат Вектибикс может оказывать потенциальный вред для плода при применении у беременных женщин.
Известно, что человеческие антитела IgG способны проникать через плацентарный барьер, поэтому панитумумаб может проникать из организма матери в развивающийся организм плода. Поэтому женщины с сохранной репродуктивной функцией во время лечения препаратом Вектибикс и в течение 2 месяцев после его окончания должны использовать адекватные меры контрацепции. Если препарат Вектибикс используется в процессе беременности, или беременность развилась на фоне терапии, необходимо разъяснить пациентке потенциальный риск прерывания беременности и потенциальный вред для плода.
Грудное вскармливание
Неизвестно, проникает ли панитумумаб в грудное молоко. Так как человеческие антитела IgG проникают в грудное молоко, можно предположить, что панитумумаб может также проникать в грудное молоко. Возможность всасывания препарата и его потенциальный вред для ребенка не установлены. В период лечения препаратом Вектибикс и в течение 2 месяцев после его окончания кормление грудью не рекомендуется.
Влияние на фертильность
В экспериментах было показано обратимое действие препарата на менструальный цикл и снижение плодовитости самок обезьян. В связи с этим панитумумаб может оказывать влияние на возможность развития беременности у женщин.
Способ применения и дозы
Терапию препаратом Вектибикс необходимо проводить под контролем врача, имеющего опыт проведения противоопухолевого лечения. Перед началом терапии препаратом Вектибикс необходимо подтверждение гена RAS дикого типа (KRAS и NRAS). Мутационный статус гена должен быть определен лабораторией, имеющей опыт соответствующих исследований, с использованием валидированных методик обнаружения мутаций KRAS (в экзонах 2, 3 и 4) и NRAS (в экзонах 2, 3 и 4).
Режим дозирования
Рекомендуемая доза препарата Вектибикс составляет 6 мг/кг массы тела и вводится 1 раз в 2 недели.
При развитии тяжелых (≥ 3 степени) дерматологических реакций может потребоваться следующий режим модификации дозы препарата Вектибикс: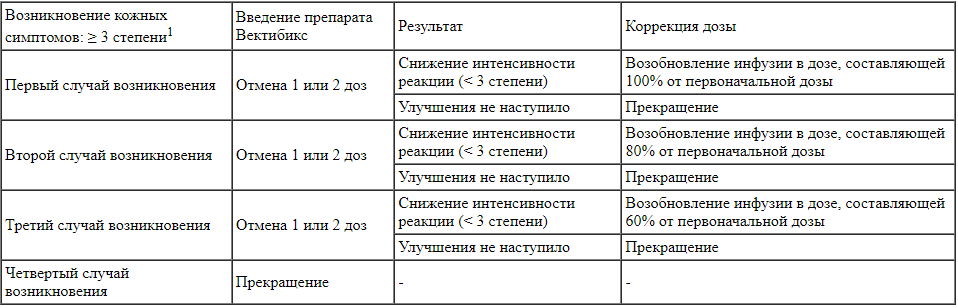
Применение у отдельных популяций пациентов
Безопасность и эффективность препарата Вектибикс не оценивались у пациентов с почечной или печеночной недостаточностью.
Отсутствуют клинические данные, позволяющие обосновать необходимость коррекции дозы препарата в пожилом возрасте.
Дети
Опыт применения препарата Вектибикс у детей отсутствует.
Способ введения
Вектибикс необходимо вводить в виде внутривенной инфузии с помощью инфузионного насоса.
Перед проведением инфузии препарат Вектибикс должен быть разведен специалистом здравоохранения в 9 мг/мл (0,9%) растворе натрия хлорида для инъекций в асептических условиях до получения конечной концентрации не более 10 мг/мл. Не встряхивать или не взбалтывать сильно флакон. Флакон с препаратом Вектибикс следует визуально оценить перед применением. Раствор должен быть бесцветным и может содержать полупрозрачные или белые аморфные белковые частицы (которые удаляются фильтром инфузионной системы). Не следует вводить препарат Вектибикс, описание которого отличается от приведенного выше. При помощи гиподермальной иглы размера 21G или меньше из флакона с препаратом забирается необходимое количество препарата Вектибикс для получения дозы 6 мг/кг, которое затем растворяют в общем объеме 100 мл. Не использовать безыгольные приспособления (например, переходники для флаконов) для извлечения препарата из флакона. Конечная концентрация не должна превышать 10 мг/мл. Дозы выше, чем 1000 мг следует растворить в 150 мл 9 мг/мл (0,9%) раствора натрия хлорида для инъекций. Полученный разведенный раствор необходимо перемешать осторожным переворачиванием, не встряхивать.
Не наблюдалось несовместимости между препаратом Вектибикс и 9 мг/мл (0,9%) раствором натрия хлорида для инъекций в инфузионных пакетах из поливинилхлорида или полиолефина.
Препарат Вектибикс следует вводить в периферический зонд или постоянный катетер через встроенный фильтр с размером пор 0,2 или 0,22 мкм с низкой степенью связывания белков. Рекомендованная длительность инфузии составляет приблизительно 60 минут. Если первая инфузия переносится хорошо, последующие инфузии могут производиться в течение 30-60 минут. Длительность введения препарата в дозах свыше 1000 мг должна составлять приблизительно 90 минут (инструкции по обращению приведены в подразделе «Особые меры предосторожности при применении и утилизации»).
До и после введения препарата Вектибикс, инфузионную систему необходимо промыть раствором натрия хлорида, чтобы избежать смешивания препарата Вектибикс с другими лекарственными препаратами или растворами для внутривенного введения.
В случае возникновения инфузионных реакций может потребоваться снижение скорости инфузии препарата Вектибикс (см. раздел «Особые указания»).
Препарат Вектибикс не должен вводиться струйно или болюсно.
Побочное действие
Обзор профиля безопасности препарата
Согласно результатам анализа данных всех пациентов с мКРР, принимавших участие в клинических исследованиях и получавших препарат Вектибикс в режиме монотерапии и в комбинации с химиотерапией (n = 2224) наиболее частыми нежелательными реакциями были кожные реакции, наблюдавшиеся приблизительно в 94% случаев. Эти реакции обусловлены фармакологическими свойствами препарата Вектибикс и обычно имеют легкую или среднюю степень тяжести; только в 23% случаев дерматологические реакции носят тяжелый характер (степень тяжести 3, по классификации NCI-CTC) и < 1% жизнеугрожающие (степень 4 по NCI-CTC). Медицинские меры в случае кожных реакций, включая рекомендации по коррекции дозы, приведены в разделе «Особые указания».
Наиболее частыми нежелательными реакциями, возникавшими у ≥ 20% пациентов, были расстройства желудочно-кишечного тракта [диарея (46%), тошнота (39%), рвота (26%), запор (23%) и боль в животе (23%)]; общие реакции [повышенная утомляемость (35%), пирексия (21%)]; нарушения обмена веществ и питания [снижение аппетита (30%)]; инфекции и инвазии [паронихия (20%)]; и патология кожи и подкожной ткани [сыпь (47%), акнеформный дерматит (39%), зуд (36%), эритема (33%) и сухость кожи (21%)].
Табличный перечень нежелательных реакций
Нежелательные реакции, наблюдавшиеся у пациентов с мКРР, получавших панитумумаб в качестве монотерапии или в комбинации с химиотерапией в клинических исследованиях (n = 2224), а также в спонтанных сообщениях, приведены ниже. Нежелательные эффекты представлены по степени убывания серьезности.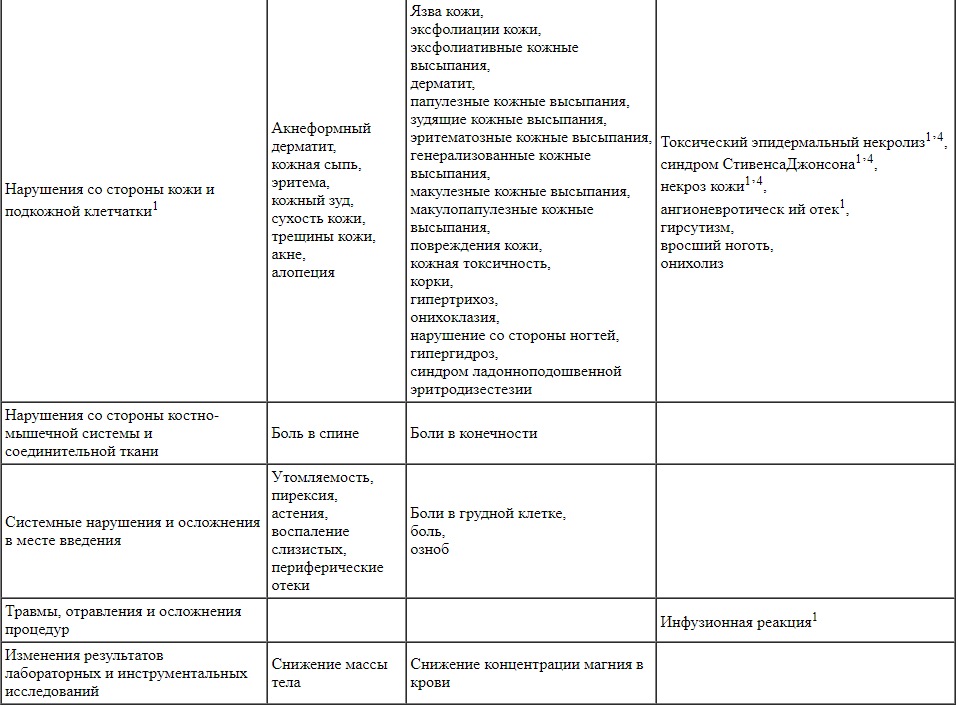
2 См. раздел «Особые указания» (инфузионные реакции).
3 См. раздел «Особые указания» (осложнения со стороны легких).
4 Некроз кожи, синдром Стивенса-Джонсона, токсический эпидермальный некролиз и язвенный кератит являются нежелательными реакциями панитумумаба, отмечавшимися в процессе его применения после регистрации. Максимальная частота этих нежелательных реакций оценивалась на основе верхней границы 95% доверительного интервала для точечной оценки с учетом рекомендаций регуляторных органов для оценки частоты нежелательных реакций в спонтанных сообщениях. Максимальное значение частоты, рассчитанное на основе верхней границы 95% доверительного интервала для точечной оценки, составило 3/2224 (или 0,13%).
Профиль безопасности препарата Вектибикс в комбинации с химиотерапией согласуется с зарегистрированными нежелательными реакциями препарата Вектибикс (используемого в монотерапии) и проявлениями фоновой токсичности химиотерапии. Новых проявлений токсичности или усугубления ранее известных проявлений токсичности помимо ожидаемых аддитивных эффектов не наблюдалось. Кожные реакции соответствовали наиболее часто отмечавшимся нежелательным реакциям у пациентов, получавших панитумумаб, в комбинации с химиотерапией. Другими проявлениями токсичности, отмечавшимися с большей частотой по сравнению с использованием препарата в монотерапии, являлись гипомагниемия, диарея и стоматит. Эти проявления токсичности нечасто приводили к досрочному завершению терапии препаратом Вектибикс или химиотерапии.
Описание отдельных нежелательных реакций
Нарушения со стороны пищеварительной системы
В большинстве случаев диарея имела легкую или умеренную степень тяжести. Сообщалось о тяжелых случаях диареи (степень 3 и 4 по NCI-CTC) у 2% пациентов, принимавших препарат Вектибикс в качестве монотерапии, и у 16% пациентов, принимавших препарат Вектибикс в комбинации с химиотерапией.
Сообщалось о развитии острой почечной недостаточности на фоне диареи тяжелой степени и обезвоживания (см. раздел «Особые указания»).
Инфузионные реакции
Во всех клинических исследованиях моно- и комбинированной терапии мКРР (n = 2224) реакции на инфузию (развивающиеся в течение 24 часов с момента первого введения препарата), симптомами/признаками которых могли являться озноб, повышение температуры тела или диспноэ, отмечались приблизительно у 5% пациентов, получавших препарат Вектибикс, из которых 1% были тяжелыми (3 и 4 степени NCI-CTC).
Сообщалось о случае развития летального ангионевротического отека у пациента с рецидивирующим метастатическим плоскоклеточным раком головы и шеи, леченого препаратом Вектибикс. Фатальное осложнение развилось при возобновлении терапии после предшествующего эпизода развития ангионевротического отека. Обе реакции зафиксированы спустя более 24 часов после введения препарата (см. разделы «Противопоказания» и «Особые указания»). О реакциях гиперчувствительности, развившихся более чем через 24 часа после инфузии, также сообщалось и в пострегистрационный период.
Данные клинического ведения реакций на инфузию приведены в разделе «Особые указания».
Нарушения со стороны кожи и подкожно-жировой клетчатки
Кожная сыпь, наиболее часто локализованная на лице, верхней части грудной клетки и спине, однако в некоторых случаях распространялась и на конечности. Как следствие тяжелых дерматологических реакций отмечали также развитие инфекционных осложнений, таких как сепсис, в редких случаях с летальным исходом, воспаление подкожной клетчатки и местные абсцессы, требующие хирургического вмешательства и дренирования. Медиана времени до развития первых проявлений дерматологических реакций составила 10 дней, а медиана времени до их разрешения с момента последнего введения препарата Вектибикс — 31 день.
Паронихиальное воспаление сопровождалось припухлостью латеральных ногтевых валиков пальцев рук и ног.
Дерматологические реакции (включая воздействие на ногти), наблюдавшиеся у пациентов, получавших препарат Вектибикс или другие ингибиторы EGFR, являются известными фармакологическими эффектами данных препаратов.
Во всех клинических исследованиях кожные реакции наблюдались приблизительно у 94% пациентов, получавших препарат Вектибикс в качестве монотерапии или в комбинации с химиотерапией (n = 2224). В основном это были сыпь и угревидный дерматит почти всегда легкого или умеренного характера. О тяжелых кожных реакциях (степень 3 по NCI-CTC) сообщалось у 23% пациентов, а о жизнеугрожающих кожных реакциях (степень 4 по NCI-CTC) -у < 1% пациентов. У пациентов, получавших препарат Вектибикс, регистрировались жизнеугрожающие и летальные инфекционные осложнения, включавшие некротизирующий фасциит и сепсис (см. раздел «Особые указания»).
Данные клинического ведения дерматологических реакций, включая рекомендации по изменению дозы, приведены в разделе «Особые указания».
В пострегистрационный период применения сообщалось о редких случаях развития некрозов кожи, синдрома Стивенса-Джонсона и токсического эпидермального некролиза (см. раздел «Особые указания»).
Офтальмологическая токсичность
Сообщалось о серьезных случаях кератитов и язвенных кератитов, которые могут приводить к перфорации роговицы (см. раздел «Особые указания»).
Другие особые популяции
Не наблюдалось различий в безопасности и эффективности у пациентов пожилого возраста (≥ 65 лет), получавших монотерапию препаратом Вектибикс. Однако было зарегистрировано увеличение числа серьезных нежелательных реакций у пожилых пациентов, получавших терапию препаратом Вектибикс в комбинации с режимами химиотерапии FOLFIRI (45% по сравнению с 32%) или FOLFOX (52% по сравнению с 37%), по сравнению с получавшими только химиотерапию (см. раздел «Особые указания»). Наиболее частыми серьезными нежелательными явлениями были диарея у пациентов, получавших препарат Вектибикс в комбинации с режимами FOLFOX или FOLFIRI, дегидратация и тромбоэмболия легочной артерии — у пациентов, получавших препарат Вектибикс в комбинации с режимом FOLFIRI.
Нет данных, касающихся безопасности применения препарата Вектибикс пациентами с почечной и печеночной недостаточностью.
Передозировка
В клинических исследованиях препарат использовался в дозах до 9 мг/кг. Были зарегистрированы случаи превышения рекомендованной терапевтической дозы (12 мг/кг) приблизительно в 2 раза. Наблюдались нежелательные эффекты, такие как токсические реакции со стороны кожи, диарея, дегидратация и повышенная утомляемость, что соответствовало профилю безопасности препарата в рекомендованной дозе.
Взаимодействие с другими лекарственными препаратами
Данные исследования о взаимодействии препарата Вектибикс и иринотекана у пациентов с мКРР показали, что фармакокинетические свойства иринотекана и его активного метаболита, SN-38, не меняются при одновременном введении препаратов. Результаты перекрестного сравнительного исследования показали, что схемы, включающие в себя иринотекан (IFL или FOLFIRI), не влияют на фармакокинетические свойства панитумумаба.
Вектибикс не должен назначаться в комбинации с режимом химиотерапии IFL или режимами химиотерапии, включающими бевацизумаб. При назначении панитумумаба в комбинации с IFL, наблюдалась высокая частота возникновения диареи тяжелой степени (см. раздел «Особые указания») и увеличивалась частота токсичности и летальных исходов при назначении панитумумаба в комбинации с режимом химиотерапии, включавшей бевацизумаб (см. раздел «Особые указания»).
Комбинация препарата Вектибикс с химиотерапией на основе оксалиплатина противопоказана пациентам с мКРР и мутациями RAS, а также пациентам с мКРР с неизвестным статусом RAS. В клиническом исследовании у пациентов с мутациями RAS в опухоли, которые получали панитумумаб и химиотерапию FOLFOX, отмечалось укорочение выживаемости без прогрессирования заболевания и общей выживаемости (см. раздел «Особые указания»).
Фармацевтическая несовместимость
Данный препарат не следует применять с другими лекарственными средствами, кроме указанных в подразделе «Особые меры предосторожности при применении и утилизации».
Особые указания
Отслеживаемость
С целью улучшения отслеживаемости биологических лекарственных препаратов следует точно записывать название и номер серии вводимого препарата.
Нежелательные реакции со стороны мягких тканей и кожи
Дерматологические реакции — фармакологический эффект, характерный для ингибиторов EGFR, регистрируются практически у всех пациентов (приблизительно 94%), получающих препарат Вектибикс. Тяжелые кожные реакции (3 степени согласно классификации NCI-CTC) отмечались у 23% пациентов, жизнеугрожающие кожные реакции (4 степени NCI-CTC) — у < 1% пациентов, принимавших препарат Вектибикс в качестве монотерапии и в комбинации с химиотерапией (n = 2224) (см. раздел «Побочное действие»). При развитии у пациента кожных реакций степени 3 (Общие терминологические критерии оценки нежелательных явлений CTCAE, версия 4.0) или более выраженной степени, либо расцененных как непереносимые, см. рекомендации по модификации дозы в разделе «Способ применения и дозы».
В клинических исследованиях после развития тяжелых кожных реакций (в том числе стоматита) имели место инфекционные осложнения, в том числе сепсис и некротизирующий фасциит, которые в редких случаях приводили к смерти, а также к образованию абсцессов, требовавших вскрытия и дренирования. Пациенты, у которых отмечались тяжелые кожные реакции или проявления токсичности со стороны мягких тканей, либо демонстрировавшие усугубление данных реакций на фоне терапии препаратом Вектибикс, должны наблюдаться на предмет развития воспалительных или инфекционных последствий (в том числе воспаление подкожной клетчатки и некротизирующего фасциита), а при наличии соответствующих клинических показаний должна быть начата соответствующая терапия. Жизнеугрожающими и летальными инфекционными осложнениями являлись некротизирующий фасциит и сепсис, которые отмечались у пациентов, получавших препарат Вектибикс. Редкие случаи синдрома Стивенса-Джонсона и токсического эпидермального некролиза отмечались у пациентов в пострегистрационном периоде, принимавших препарат Вектибикс. Временная отмена или прекращение применения препарата Вектибикс необходимы при развитии кожной токсичности или токсичности мягких тканей, ассоциированных с развитием тяжелых или жизнеугрожающих воспалительных или инфекционных осложнений.
Лечение и ведение дерматологических реакций должно быть основано на тяжести проявлений и может включать в себя увлажняющие, солнцезащитные средства (солнцезащитный фильтр ≥ 15 UVA и UVB), а также кремы с глюкокортикостероидами (не выше 1% гидрокортизона) для применения на пораженных участках и/или пероральные антибиотики (например, доксициклин). Также пациентам с признаками сыпи/дерматологической токсичности рекомендуется использовать солнцезащитные средства и головные уборы, ограничить пребывание на солнце, поскольку солнечный свет может усилить любые возможные кожные реакции.
Пациентам может быть рекомендовано наносить увлажняющие, солнцезащитные средства на лицо, руки, ноги, шею, спину и грудь каждое утро, а на ночь наносить крем, содержащий глюкокортикостероид, на лицо, руки, ноги, шею, спину и грудь во время проведения лечения.
Осложнения со стороны легких
Пациенты с наличием в анамнезе или имеющие признаки интерстициального пневмонита или фиброза легких исключались из клинических исследований. Случаи интерстициальных заболеваний легких с летальными исходами и без, возникали, преимущественно, в японской популяции. Поэтому при остром возникновении или ухудшении легочных симптомов лечение препаратом Вектибикс должно быть приостановлено и незамедлительно начато изучение возникших симптомов. При обнаружении интерстициальных заболеваний легких препарат Вектибикс следует временно отменить и назначить соответствующее лечение. У пациентов с интерстициальным пневмонитом или легочным фиброзом в анамнезе необходимо оценить отношение вероятной пользы применения препарата к риску осложнений со стороны легких.
Нарушения водно-электролитного баланса
У некоторых пациентов отмечалось прогрессивное снижение сывороточных концентраций магния, приводившее к тяжелой (степень 4) гипомагниемии. Необходим периодический мониторинг состояния пациентов на предмет развития гипомагниемии и сопутствующей гипокальциемии перед началом лечения препаратом Вектибикс, и после лечения до 8 недель после его окончания (см. раздел «Побочное действие»). При необходимости рекомендован прием препаратов магния.
Также отмечались нарушения баланса других электролитов, включая гипокалиемию. Рекомендуется мониторинг и соответствующий адекватный прием данных электролитов.
Инфузионные реакции
В клинических исследованиях монотерапии и комбинированной терапии мКРР (n = 2224), инфузионные реакции, в том числе тяжелые инфузионные реакции (возникавшие в течение 24 часов после инфузии), отмечались у пациентов, получавших препарат Вектибикс (степень 3 и 4 по NCI-CTC).
В пострегистрационных исследованиях сообщалось о серьезных инфузионных реакциях, включая редкие пострегистрационные сообщения о летальных исходах. В случае возникновения тяжелой или жизнеугрожающей реакции в процессе инфузии или в любое время после ее завершения [например, при возникновении бронхоспазма, ангионевротического отека, гипотензии, потребности в парентеральной терапии или анафилаксии], необходимо полностью отменить препарат Вектибикс (см. разделы «Противопоказания» и «Побочное действие»).
У пациентов с легкими или умеренными (степень 1 и 2 по CTCAE версии 4.0) инфузионными реакциями следует уменьшить скорость инфузии на протяжении всей инфузии. Рекомендуется сохранять сниженную скорость инфузии в ходе всех последующих инфузий.
Сообщалось о реакциях гиперчувствительности, возникавших более чем через 24 часа после инфузии, включая ангионевротический отек со смертельным исходом, развившийся более чем через 24 часа после инфузии. Следует предупредить пациентов о возможности позднего развития реакции и проинструктировать обращаться к своему лечащему врачу в случае возникновения симптомов реакции гиперчувствительности.
Острая почечная недостаточность
Острая почечная недостаточность отмечена у пациентов с тяжелой диареей и дегидратацией. Пациенты должны быть проинструктированы о необходимости немедленно обратиться за медицинской помощью при развитии тяжелой диареи.
Препарат Вектибикс в комбинации с химиотерапией на основе иринотекана, фторурацила болюсно и кальция фолината (режим IFL)
У пациентов, получавших препарат Вектибикс в комбинации с режимом IFL [болюсное введение фторурацила (500 мг/м2), кальция фолината (20 мг/м2) и иринотекана (125 мг/м2)], отмечалась высокая частота тяжелой диареи (см. раздел «Побочное действие»). Поэтому следует избегать использования препарата Вектибикс в комбинации с режимом IFL (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Препарат Вектибикс в комбинации с бевацизумабом и режимами химиотерапии
У пациентов, получавших препарат Вектибикс в комбинации с бевацизумабом и химиотерапией, отмечалось укорочение выживаемости без прогрессирования заболевания и повышение частоты летальных исходов. Кроме того, в группах терапии препаратом Вектибикс в комбинации с бевацизумабом и химиотерапией отмечалось повышение частоты тромбоэмболии легочной артерии, инфекций (преимущественно кожных), диареи, электролитных нарушений, тошноты, рвоты и дегидратации. Препарат Вектибикс не должен применяться в комбинации с химиотерапией, включающей бевацизумаб (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Препарат Вектибикс в комбинации с химиотерапией на основе оксалиплатина у пациентов с мКРР и мутациями RAS, а также с неуточненным статусом RAS
Комбинация препарата Вектибикс с химиотерапией на основе оксалиплатина противопоказана пациентам с мКРР и мутациями RAS, а также пациентам с мКРР с неуточненным статусом мутаций генов RAS (см. раздел «Противопоказания»).
Отмечалось сокращение выживаемости без прогрессирования заболевания (ВБП) и общей выживаемости (ОВ) у пациентов с мутациями KRAS (в экзоне 2) в опухоли и дополнительными мутациями RAS (KRAS [в экзонах 3 и 4] или NRAS [в экзонах 2, 3, 4]), получавших панитумумаб в комбинации с инфузионным режимом, содержащим фторурацил, кальция фолинат и оксалиплатин (FOLFOX) по сравнению с пациентами, получавшими только FOLFOX.
Оценка мутационного статуса RAS должна определяться с использованием валидированного метода в лаборатории, имеющей опыт выполнения подобных исследований (см. раздел «Способ применения и дозы»). Если препарат Вектибикс должен использоваться в комбинации с режимом FOLFOX, рекомендуется определение мутационного статуса в лаборатории, принимающей участие в программе внешнего обеспечения качества оценки статуса RAS, либо дикий тип должен быть подтвержден результатами двукратного анализа.
Офтальмологическая токсичность
Отмечались серьезные случаи кератита и язвенного кератита, которые могут приводить к перфорации роговицы. Пациенты, у которых отмечаются признаки и симптомы, свидетельствующие о наличии кератита, в том числе острые или усугубляющиеся: воспалительные изменения глаза, слезотечение, светобоязнь, снижение четкости зрения, боли в глазу и/или покраснения глаза, должны быть немедленно направлены к офтальмологу.
При подтверждении диагноза язвенного кератита терапию препаратом Вектибикс необходимо временно или полностью прекратить. При постановке диагноза кератита необходимо тщательно соотнести пользу и риски продолжения терапии.
Препарат Вектибикс должен использоваться с осторожностью у пациентов, имевших в анамнезе кератит, язвенный кератит или выраженную сухость глаза. Использование контактных линз также является фактором риска развития кератита и изъязвлений.
Пациенты с показателем общего состояния 2 по шкале ECOG, получавших препарат Вектибикс в комбинации с химиотерапией
Для пациентов с мКРР, имеющих показатель 2 по шкале ECOG, рекомендуется проведение оценки соотношения польза-риск до начала применения препарата Вектибикс в комбинации с химиотерапией. У пациентов со статусом ECOG 2 не выявлено положительное соотношение польза-риск.
Пожилые пациенты
Различий безопасности или эффективности препарата Вектибикс в монотерапии у пациентов пожилого возраста (≥ 65 лет) не наблюдалось. Однако отмечалось увеличение количества серьезных нежелательных реакций у пожилых пациентов, получавших препарат Вектибикс в комбинации с химиотерапией FOLFIRI или FOLFOX, по сравнению с применением только режимов химиотерапии (см. раздел «Побочное действие»).
Предупреждение о вспомогательных веществах
Данный препарат содержит 3,45 мг натрия в 1 мл, что соответствует 0,17% от рекомендованного ВОЗ максимального суточного потребления натрия для взрослого человека, составляющего 2 г.
Особые меры предосторожности при применении и утилизации
Препарат Вектибикс следует вводить в периферический зонд или постоянный катетер через встроенный фильтр с размером пор 0,2 или 0,22 мкм с низкой степенью связывания белков.
Разведенный раствор
Вектибикс не содержит антимикробных консервантов или бактериостатических агентов. Препарат должен быть использован непосредственно после разведения. Если препарат не был использован сразу после разведения, пользователь несет ответственность за время и условия его хранения до следующего введения (не более 24 часов при температуре 2 °C — 8 °C). Не замораживать разведенный раствор.
Препарат Вектибикс предназначен только для однократного использования.
Флакон и оставшийся в нем раствор лекарственного препарата необходимо утилизировать после однократного применения.
Весь неиспользованный остаток препарата и расходные материалы должны утилизироваться в соответствии с надлежащими требованиями.
Влияние на способность управлять транспортными средствами, механизмами
Вектибикс может оказывать влияние на способность управлять транспортными средствами и на работу с механизмами. В случае развития нежелательных реакций со стороны органов зрения и/или снижения способности к концентрации внимания и быстроты реакции, пациентам рекомендуется воздержаться от управления транспортными средствами или работы со сложным оборудованием до разрешения указанных нежелательных реакций препарата.
Форма выпуска
Концентрат для приготовления раствора для инфузий 20 мг/мл.
Флакон содержит 5 мл (100 мг/5 мл) или 20 мл (400 мг/20 мл) концентрата для приготовления раствора для инфузий.
Маркированный флакон из прозрачного стекла гидролитического класса I с эластомерной пробкой, алюминиевым колпачком и отламывающимся полипропиленовым колпачком.
По 1 флакону помещают в контурную ячейковую упаковку и затем в пачку картонную вместе с инструкцией по применению. Для контроля первого вскрытия на каждую пачку наклеивают две прозрачные защитные этикетки, имеющие продольную цветную полосу.
Условия хранения
Хранить при температуре от 2°C до 8°C.
Не замораживать.
Хранить в оригинальной упаковке для защиты от света.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не использовать по истечении срока годности, указанного на упаковке.
Условия отпуска
Отпускают по рецепту.
Производитель
Производитель готовой лекарственной формы / Фасовщик (первичная упаковка)
Амджен Мэньюфэкчуринг Лимитед,
Роуд 31, Км 24.6, Джанкос, Пуэрто-Рико, 00777, Соединенные Штаты Америки.
Упаковщик (вторичная (потребительская) упаковка) /Выпускающий контроль качества
Амджен Европа Б.В.,
Минервум 7061, NL-4817 ZK Бреда, Нидерланды или
Амджен Технолоджи (Айрлэнд) Анлимитед Компани,
Поттери Роуд, Дан Лэйри, Графство Дублин, Ирландия или
ООО «Добролек», Россия,
115446, г. Москва, Коломенский проезд, д. 13А.
Организация, принимающая претензии от потребителей
ООО «Амджен»
123112, Москва, Пресненская набережная, д.8, строение 1, 7 этаж
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Форма выпуска, упаковка и состав
препарата Вектибикс
Концентрат для приготовления раствора для инфузий в виде прозрачной, бесцветной жидкости; может содержать полупрозрачные или белые, аморфные белковые частицы.
Вспомогательные вещества: натрия ацетата тригидрат, натрия хлорид, уксусная кислота ледяная, вода д/и.
20 мл — флаконы (1) — упаковки ячейковые контурные (1) — пачки картонные.
Фармакологическое действие
Противоопухолевое средство. Панитумумаб — рекомбинантное человеческое моноклональное антитело (Ig G2), обладающее высокой аффинностью и специфичностью к рецепторам фактора эпидермального роста (EGFR).
Рецептор EGF стимулирует рост нормальных эпителиальных клеток, включая клетки кожи и волосяных фолликулов, и экспрессируется на различных типах опухолевых клеток. Панитумумаб связывается с лиганд-связывающим доменом рецептора EGF и ингибирует процесс аутофосфорилирования, который индуцируется всеми известными лигандами рецептора EGF.
Связывание панитумумаба с рецептором EGF приводит к интернализации рецептора, ингибированию процессов клеточного роста, индукции апоптоза и уменьшению продукции интерлейкина-8 и фактора роста эндотелия сосудов.
Гены KRAS (гомолог вирусного онкогена крысиной саркомы Кирстена 2) и NRAS (гомолог нейробластомы вирусного онкогена RAS) относятся к семейству онкогенов RAS. Гены KRAS и NRAS кодируют небольшой гуанозинтрифосфат-связывающий белок, который участвует в трансдукции сигнала. KRAS и NRAS активируется различными сигналами, в т.ч. и от рецептора EGF, и в свою очередь, стимулирует синтез других внутриклеточных белков, вовлеченных в процессы клеточной пролиферации, выживаемости и ангиогенеза.
Активирующие мутации генов RAS часто происходят в различных опухолевых клетках человека и играют определенную роль, как в процессе онкогенеза, так и в прогрессии опухоли.
Исследования in vitro и in vivo у животных показали, что панитумумаб ингибирует рост и выживаемость опухолевых клеток, экспрессировавших EGFR. Не наблюдалось противоопухолевой активности панитумумаба в экспериментах с ксенотрансплантатами опухолей человека, не экспрессировавшими EGFR. Добавление панитумумаба к лучевой, химио- или другой таргетной терапии в исследованиях на животных приводило к усилению противоопухолевого эффекта по сравнению с только лучевой, химио- или таргетной терапией.
Как и все терапевтические протеины, панитумумаб обладает потенциальной иммуногенностью. Продукцию нейтрализующих антител к панитумумабу оценивали с помощью двух различных скрининговых систем иммуноанализа для определения связанных антител к панитумумабу.
Фармакокинетика
Фармакокинетика панитумумаба носит нелинейный характер при применении панитумумаба в качестве монотерапии или в комбинации с химиотерапией.
После однократного введения панитумумаба в виде 1-часовой инфузии AUC возрастала в большей степени, чем это характерно для прямо пропорциональной дозозависимости, а клиренс панитумумаба снижался с 30.6 до 4.6 мл/сут/кг при увеличении дозы от 0.75 до 9 мг/кг. Однако при введении панитумумаба в дозах свыше 2 мг/кг характер увеличения AUC был близок к пропорциональной дозозависимости.
При дозе 6 мг/кг 1 раз в 2 недели в виде 1-часовой инфузии Css панитумумаба достигается к третьей инфузии при средних значениях максимальной (± стандартное отклонение [SD]) и минимальной концентраций 213 ± 59 и 39 ± 14 мкг/мл соответственно. Среднее значение (± SD) AUC0-t и клиренса были равны 1306 ± 374 мкг×сут/мл и 4.9 ± 1.4 мл/кг/сут соответственно. T1/2 панитумумаба составил приблизительно 7.5 сут (разброс: от 3.6 до 10.9 сут).
Показания активных веществ препарата
Вектибикс
Лечение метастатического колоректального рака (мКРР) у взрослых пациентов с генами RAS дикого типа в опухоли: в качестве 1-й линии терапии в комбинации с режимами, содержащими фторурацил, кальция фолинат и оксалиплатин (FOLFOX) или фторурацил, кальция фолинат и иринотекан (FOLFIRI); в качестве 2-й линии терапии в комбинации с режимом, содержащим фторурацил, кальция фолинат и иринотекан (FOLFIRI) у пациентов, получавших ранее химиотерапию 1-й линии на основе фторпиримидина (исключая иринотекан); в качестве монотерапии при неэффективности режимов химиотерапии на основе фторпиримидина, оксалиплатина и иринотекана.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Вводят в/в в виде инфузии с помощью инфузионного насоса. Доза составляет 6 мг/кг 1 раз в 2 недели. При развитии дерматологических реакций требуется коррекция дозы или отмена панитумумаба (в зависимости от степени токсичности и переносимости).
Лечение рекомендуется продолжать до прогрессирования заболевания.
Побочное действие
Инфекции и инвазии: очень часто — конъюнктивит, паронихия; часто — кожные высыпания пустулезные, воспаление подкожной клетчатки, инфекция мочевыводящих путей, фолликулит, локализованная инфекция; нечасто — инфекция глаза, инфекция века.
Со стороны крови и лимфатической системы: очень часто — анемия; часто — лейкопения.
Со стороны иммунной системы: часто — гиперчувствительность; нечасто — анафилактическая реакция.
Со стороны обмена веществ: очень часто — гипокалиемия, гипомагниемия, снижение аппетита, уменьшение массы тела; часто — гипокальциемия, дегидратация, гипергликемия, гипофосфатемия.
Психические нарушения: очень часто — бессонница; часто — тревожность.
Со стороны нервной системы: часто — головная боль, головокружение.
Со стороны органа зрения: часто — блефарит, рост ресниц, усиление слезотечения, гиперемия глаза, сухость глаз, зуд глаз,
раздражение глаза; нечасто — язвенный кератит, кератит, раздражение века.
Со стороны сердечно-сосудистой системы: часто — тахикардия, тромбоз глубоких вен, гипотензия, гипертензия, гиперемия; нечасто — цианоз.
Со стороны дыхательной системы: очень часто — диспноэ, кашель; часто — тромбоэмболия легочной артерии,
носовое кровотечение; нечасто — интерстициальная болезнь легких, бронхоспазм, сухость слизистой оболочки полости носа.
Со стороны пищеварительной системы: очень часто — диарея, тошнота, рвота, боли в животе, стоматит, запор; часто — Ректальное кровотечение, сухость во рту, диспепсия, афтозные язвы, хейлит, ГЭРБ; нечасто — обветренность губ;
сухость губ.
Со стороны кожи и подкожной клетчатки: очень часто — акнеформный дерматит, кожная сыпь, эритема, кожный зуд, сухость кожи, трещины кожи, акне, алопеция; часто — язвенные поражения кожи, эксфолиативные поражения кожи, эксфолиативные кожные высыпания, дерматит, папулезные кожные высыпания, зудящие кожные высыпания, эритематозные кожные высыпания, генерализованные кожные высыпания, макулезные кожные высыпания, макуло-папулезные кожные высыпания, повреждения кожи, кожная токсичность, корки, гипертрихоз, онихоклазия, нарушение со стороны ногтей, гипергидроз, синдром ладонно-подошвенной эритродизестезии; нечасто — токсический эпидермальный некролиз, синдром Стивенса-Джонсона, некроз кожи, ангионевротический отек, гирсутизм, вросший ноготь, онихолиз.
Со стороны костно-мышечной системы: очень часто — боль в спине; часто — боли в конечности.
Общие реакции: очень часто — утомляемость, пирексия, астения, мукозиты, периферические отеки.
Противопоказания к применению
Повышенная чувствительность к панитумумабу в анамнезе; интерстициальный пневмонит или фиброз легких; почечная недостаточность; печеночная недостаточность; комбинация с оксалиплатин-содержащим режимом химиотерапии у пациентов с мКРР и мутациями в генах RAS или пациентам с мКРР с неуточненным статусом мутаций в генах RAS; детский и подростковый возраст до 18 лет; беременность, период грудного вскармливания.
С осторожностью
Кератит, язвенный кератит, выраженная сухость глаз.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период грудного вскармливания.
Применение при нарушениях функции печени
Исследований фармакокинетики у пациентов с нарушением функции печени не проводилось.
Применение при нарушениях функции почек
Исследований фармакокинетики у пациентов с нарушением функции почек не проводилось.
Применение у детей
Противопоказано применение у детей и подростков в возрасте до 18 лет.
Применение у пожилых пациентов
Различий безопасности или эффективности панитумумаба у пациентов пожилого возраста (> 65 лет) не наблюдалось. Однако отмечалось увеличение количества серьезных нежелательных явлений у пожилых пациентов, получавших панитумумаб в комбинации с химиотерапией.
Особые указания
В период лечения следует контролировать возникновение дерматологических реакций и проводить соответствующую симптоматическую терапию. Для уменьшения выраженности данных реакций пациентам рекомендуется ограничить инсоляцию и использовать солнцезащитную одежду.
Во время инфузии возможны анафилактические реакции, бронхоспазм, артериальная гипотензия. В таких случаях инфузию следует немедленно прекратить. Сообщается о развитии реакций гиперчувствительности, включая ангионевротический отек, более чем через 24 после инфузии.
При применении ингибиторов EGFR наблюдались интерстициальные заболевания легких, развитие острых или ухудшение имеющихся легочных симптомов. При возникновении таких симптомов лечение панитумумабом следует прервать и провести соответствующее обследование. Если наличие пневмонита или легочных инфильтратов подтвердится, то панитумумаб следует отменить, а пациент должен получить соответствующую терапию.
У пациентов с тяжелой диареей и дегидратацией наблюдались нарушения функции почек.
В период лечения следует контролировать состояние зрения.
В период лечения следует контролировать электролитный баланс, особенно содержание магния в крови.
Безопасность применения в педиатрии не изучена.
Влияние на способность к управлению транспортными средствами и механизмами
В случае развития нежелательных реакций со стороны органов зрения и/или снижения способности к концентрации внимания и быстроты реакции, пациентам рекомендуется воздержаться от управления транспортными средствами или работы со сложным оборудованием до разрешения указанных нежелательных реакций.
Лекарственное взаимодействие
Не рекомендуется сочетанное применение панитумумаба с режимом химиотерапии, включающим бевацизумаб, т.к. возможно увеличение частоты токсичности и случаев летального исхода.
Каждый 1 мл концентрата содержит 20 мг панитумумаба.
Каждый флакон для однократного применения содержит:
Активное вещество: 100 мг панитумумаба в 5 мл.
Вспомогательные вещества: натрия хлорид, натрия ацетата тригидрат, уксусная кислота ледяная (для регулирования рН), вода для инъекций.
При подготовке препарата в соответствие с инструкцией, приведенной в разделе «Меры предосторожности при утилизации и прочих манипуляциях», конечная концентрация панитумумаба не должна превышать 10 мг/мл.
Панитумумаб представляет собой полностью человеческое моноклональное антитело IgG2, полученное из клеточной линии млекопитающих (яичники китайского хомячка) путем рекомбинантной ДНК-технологии.
Вспомогательные вещества обладают известным эффектом.
Каждый мл концентрата содержит 0,150 ммоль натрия, что составляет 3,45 мг натрия.
Концентрат для приготовления раствора для инфузий (стерильный концентрат).
Бесцветный раствор, может содержать полупрозрачные или белые видимые аморфные белковые частицы панитумумаба.
Противоопухолевое средство, моноклональные антитела.
Код ATX: L01XC08.
Фармакологические свойства
Фармакодинамика
Механизм действия
Панитумумаб представляет собой рекомбинантное, полностью человеческое IgG2 моноклональное антитело, которое обладает высоким сродством и специфичностью к рецепторам эпидермального фактора роста человека (ЭФР). ЭФР – трансмембранный гликопротеин из семейства рецепторов тирозинкиназ типа I, включая ЭФР (HERl/c-ErbB-1), HER2, HER3 и HER4. Рецептор ЭФР стимулирует рост нормальных эпителиальных клеток, включая клетки кожи и волосяных фолликулов, и экспрессируется на различных типах опухолевых клеток.
Панитумумаб связывается с лиганд-связывающим доменом рецептора ЭФР и ингибирует рецептор аутофосфорилирования, индуцированный всеми известными лигандами рецептора ЭФР. Связывание панитумумаба с рецептором ЭФР приводит к интернализации рецептора, ингибированию роста клеток, индукции апоптоза и снижению продукции интерлейкина-8 и фактора роста эндотелия сосудов.
KRAS (гомолог вирусного онкогена крысиной саркомы Кирстена 2) и NRAS (гомолог нейробластомы вирусного онкогена RAS) относятся к семейству онкогенов RAS. Гены KRAS и NRAS кодируют небольшой гуанозинтрифосфат-связывающий белок, участвующий в трансдукции сигнала. Различные сигналы, в том числе из рецептора ЭФР, активируют KRAS и NRAS, которые, в свою очередь, стимулируют синтез других внутриклеточных белков для стимулирования клеточной пролиферации, выживаемости клеток и ангиогенеза.
Активирующие мутации генов RAS часто происходят в различных опухолевых клетках человека и играют определенную роль как в процессе онкогенеза, так и в прогрессии опухоли.
Фармакодинамические эффекты
Исследования in vitro и in vivo на животных показали, что панитумумаб ингибирует рост и выживаемость опухолевых клеток, экспрессирующих рецептор ЭФР. Не наблюдалось каких-либо противоопухолевых эффектов панитумумаба в ксенотрансплантатах опухоли человека, лишенных экспрессии рецептора ЭФР. Добавление панитумумаба к лучевой терапии, химиотерапии или другим таргетным терапевтическим агентам в исследованиях на животных увеличивало противоопухолевые эффекты по сравнению с лучевой терапией, химиотерапией или только таргетными препаратами.
Дерматологические реакции (включая воздействие на ногти), наблюдаемые у пациентов, получавших Вектибикс или другие ингибиторы рецепторов ЭФР, как известно, связаны с фармакологическими эффектами терапии (смотрите разделы «Способ применения и дозы» и «Побочные реакции»).
Иммуногенность
Как и для всех терапевтических протеинов, существует потенциал для иммуногенности. Данные по разработке антител против панитумумаба оценивались с использованием двух различных скрининговых систем иммуноанализа для определения связанных антител к панитумумабу (иммуноферментный анализ, который позволяет определить высокоаффинные антитела и иммуноанализ Биосенсор, который позволяет определить антитела с высокой и низкой аффинностью).
Для пациентов, у которых сыворотка показала положительный результат при скрининговом иммуноанализе, проводился также биологический тест in vitro для обнаружения нейтрализующих антител.
В качестве монотерапии:
выявляемость связанных антител (за исключением выявления антител у пациентов до введения препарата и временно положительных) составляла < 1 %, как было установлено с помощью ИФА и 3,8 %, как было установлено с помощью иммунологического анализа Биокор;
выявляемость нейтрализующих антител (за исключением выявления антител у пациентов до введения препарата и временно положительных) составляла < 1 %;
при сравнении с пациентами, у которых антитела не вырабатывались, не наблюдалась взаимосвязь между наличием нейтрализующих антител к панитумумабу и изменениями фармакокинетических параметров, эффективностью и безопасностью.
В комбинации с химиотерапией на основе иринотекана или оксалиплатина:
выявляемость связанных антител (за исключением положительных пациентов до введения препарата) составляла 1 %, как было установлено с помощью ИФА и < 1 %, как было установлено с помощью анализа Биокор;
частота нейтрализующих антител (исключая пациентов с положительной реакцией) составила < 1 %;
не было обнаружено никаких доказательств изменения профиля безопасности у пациентов, у которых был положительный результат теста на антитела к Вектибиксу.
Обнаружение образования антител зависит от чувствительности и специфичности анализа. На положительный результат по определению антител может оказать влияние ряд факторов, включая метод анализа, метод отбора проб, время забора проб, прием сопутствующих препаратов и характер основного заболевания, поэтому сравнение частоты возникновения антител к панитумумабу может быть недостоверным.
Клиническая эффективность в монотерапии
Эффективность Вектибикса в монотерапии у пациентов с метастазирующим колоректальным раком (мКРР), у которых наблюдается прогрессия заболевания на фоне или после предшествующих курсов химиотерапии, была изучена в открытом несравнительном исследовании (585 пациентов) и в двух рандомизированных контролируемых исследованиях по сравнению с наилучшей поддерживающей терапией (463 пациента) и по сравнению с цетуксимабом (1010 пациентов).
Многоцентровое, рандомизированное, контролируемое исследование было проведено у 463 пациентов с метастатической карциномой ободочной или прямой кишки, экспрессирующей рецепторы ЭФР, после подтверждения прогрессирования на оксалиплатин или иринотекан-содержащей химиотерапии. Пациенты были рандомизированы в соотношении 1:1, для получения Вектибикса в дозе 6 мг/кг один раз в две недели вместе с наилучшей поддерживающей терапии (не включая химиотерапию) или только наилучшей поддерживающей терапии. Пациенты получали лечение до прогрессирования заболевания или до развития непереносимой токсичности. При прогрессировании заболевания пациенты, которые получали только наилучшую поддерживающую терапию, имели право на переход в сопутствующее исследование для получения терапии Вектибиксом в дозе 6 мг/кг один раз в две недели.
Первичной конечной точкой была выживаемость без прогрессирования (ВБП). Ретроспективно исследование было проанализировано на статус мутаций в генах KRAS во 2 экзоне (дикий тип KRAS по сравнению с мутированным типом KRAS). Образцы опухоли, полученные при первичной резекции колоректального рака, были проанализированы на наличие семи наиболее распространенных активирующих мутаций в кодоне 12 и 13 гена KRAS. 427 пациентов (92 %) были оценены для определения KRAS статуса, 184 из которых имели мутацию. Результаты эффективности, полученные из независимого анализа, представлены в таблице ниже. Не наблюдалась разница в общей выживаемости (ОВ) между двумя группами.
| Популяция KRAS дикого типа (экзон 2) | Популяция мутантного KRAS (экзон 2) | |||
| Вектибикс + наилучшая поддерживающая терапия (n = 124) | Наилучшая поддерживающая терапия (n = 119) | Вектибикс + наилучшая поддерживающая терапия (n = 84) | Наилучшая поддерживающая терапия (n = 100) | |
| Частота объективного ответа n (%) | 17 % | 0 % | 0 % | 0 % |
| Частота ответа | 22 % | 0 % | ||
| (оценивалась исследователем)а (95 % CI) | (14, 32) | (0,4) | ||
| Стабилизация заболевания | 34 % | 12 % | 12 % | 8 % |
| ВБП | ||||
| Относительный риск (95 % ДИ) | 0,49 (0,37, 0,65), р < 0,0001 | 1,07 (0,77, 1,48), р = 0,6880 | ||
| Медиана (недели) | 16,0 | 8,0 | 8,0 | 8,0 |
ДИ – доверительный интервал
а У пациентов из группы наилучшей поддерживающей терапии, которые перешли в группу панитумумаба после прогрессирования заболевания (95 % ДИ)
В эксплоративном анализе дополнительных мутаций образцов опухоли, полученных в данном исследовании, у 11 из 72 пациентов (15 %) с диким типом RAS в опухоли, которые получали панитумумаб, наблюдался объективный ответ по сравнению с 1 из 95 пациентов (1 %) с мутантным RAS статусом опухоли.
Кроме того, терапия панитумумабом ассоциировалась с улучшением ВБП по сравнению с поддерживающей терапией у пациентов с диким типом RAS в опухоли (относительный риск (ОР) = 0,38 [95 % ДИ: 0,27, 0,56]), но не у пациентов с мутантным типом RAS (ОР = 0,98 [95 % ДИ: 0,73, 1,31]). Эффективность Вектибикса также оценивалась в открытом исследовании у пациентов с мКРР с диким типом KRAS (экзон 2). В общей сложности 1010 пациентов, рефрактерных к химиотерапии, были рандомизированы в соотношении 1:1 для получения Вектибикса или цетуксимаба, чтобы протестировать, что Вектибикс не уступает цетуксимабу. Первичной конечной точкой была общая выживаемость (ОВ). Вторичными конечными точками являлись – ВБП и частота объективного ответа (ЧОО).
Результаты данного исследования представлены в таблице ниже.
| Популяция KRAS дикого типа (экзон 2) | Вектибикс(n = 499) | Цетуксимаб(n = 500) |
| ОВ | ||
| Медиана (месяцы) (95 % ДИ) | 10,4 (9,4, 11,6) | 10,0 (9,3, 11,0) |
| Относительный риск (95 % ДИ) | 0,97 (0,84, 1,11) | |
| ВБП | ||
| Медиана (месяцы) (95 % ДИ) | 4,1 (3,2, 4,8) | 4,4 (3,2, 4,8) |
| Относительный риск (95 % ДИ) | 1,00 (0,88, 1,14) | |
| ЧОО | ||
| n (%) (95 % ДИ) | 22 % (18 %, 26 %) | 20 % (16 %, 24 %) |
| Относительный риск (95 % ДИ) | 1,15 (0,83, 1,58) |
В целом, профиль безопасности панитумумаба был сходен с цетуксимабом, в частности, в отношении кожной токсичности. Однако инфузионные реакции чаще наблюдались при применении цетуксимаба (13 % по сравнению с 3 %), а нарушения электролитного баланса было более частым при применении панитумумаба, особенно гипомагниемия (29 % против 19 %).
Клиническая эффективность в комбинации с химиотерапией
Среди пациентов с мКРР и диким типом RAS показатели ВБП, ОВ и ЧОО были лучше для пациентов, которые получали панитумумаб в комбинации с химиотерапией (FOLFOX или FOLFIRI) по сравнению с только лишь с химиотерапией. Пациенты с дополнительными мутациями RAS помимо KRAS (экзон 2) не получали каких-либо преимуществ при добавлении панитумумаба к FOLFIRI, кроме того, у этих пациентов наблюдался неблагоприятный эффект при добавлении панитумумаба к FOLFOX. BRAF мутации в экзоне 15 являются прогностическим маркером неблагоприятного исхода. Мутации BRAF не являются предиктивным маркером эффективности панитумумаба в комбинации с FOLFOX или FOLFIRI.
Первая линия терапии в комбинации с FOLFOX
Эффективность Вектибикса в комбинации с оксалиплатином, 5-фторурацилом (5-ФУ) и лейковорином (FOLFOX) оценивали в рандомизированном контролируемом исследовании у 1183 пациентов с мКРР, первичной конечной точкой была ВБП. Вторичными конечными точками являлись ОВ, ЧОО, время до ответа, время до прогрессирования и продолжительность ответа. Исследование было проспективно проанализировано по статусу мутаций в генах KRAS (экзон 2), который был оценен у 93 % пациентов.
Предварительно запланированный ретроспективный анализ осуществлен у 641 пациента из 656 пациентов с диким типом KRAS (экзон 2) для мКРР. Образцы опухолей пациентов с KRAS (экзон 2) дикого типа (кодоны 12/13) были исследованы на наличие дополнительных мутаций RAS в экзоне 3 KRAS (кодон 61) и экзоне 4 (кодоны 117/146), а также экзоне 2 NRAS (кодоны 12/13), экзоне 3 (кодон 61) и экзоне 4 (кодоны 117/146), экзоне 15 BRAF (кодон 600). Выявляемость этих дополнительных RAS мутаций в популяции KRAS дикого типа экзон 2 составила примерно 16 %.
Результаты эффективности в зависимости от статуса мутаций RAS представлены в таблице ниже.
| Вектибикс + FOLFOX (месяцы) Медиана (95 % ДИ) | FOLFOX (месяцы) Медиана (95 % ДИ) | Разница (месяцы) | Отношение рисков (95 % ДИ) | |
| Популяция с диким типом RAS | ||||
| ВБП | 10,1 (9,3, 12,0) | 7,9 (7,2, 9,3) | 2,2 | 0,72 (0,58, 0,90) |
| ОВ | 26,0 (21,7, 30,4) | 20,2 (17,7, 23,1) | 5,8 | 0,78 (0,62, 0,99) |
| Популяция с мутантным типом RAS | ||||
| ВБП | 7,3 (6,3, 7,9) | 8,7 (7,6, 9,4) | -1,4 | 1,31 (1,07, 1,60) |
| ОВ | 15,6 (13,4, 17,9) | 19,2 (16,7, 21,8) | -3,6 | 1,25 (1,02, 1,55) |
Затем были идентифицированы дополнительные мутации в KRAS и NRAS экзоне 3 (кодон 59) (n = 7). Диагностический анализ показал аналогичные результаты по сравнению с результатами предыдущей таблицы.
Комбинация с FOLFIRI
Эффективность Вектибикса во второй линии терапии в комбинации с иринотеканом, 5-фторурацилом (5-ФУ) и лейковорином (FOLFIRI) оценивали в рандомизированном контролируемом исследовании у 1186 пациентов с мКРР. В качестве первичных конечных точек были выбраны ОВ и ВБП. Вторичные конечные точки включали ЧОО, время до ответа, время до прогрессирования и продолжительность ответа. Исследование было проспективно проанализировано по статусу мутаций KRAS (экзон 2), который был оценен у 91 % пациентов.
Предварительно запланированный ретроспективный анализ осуществлен у 586 пациентов из 597 пациентов с мКРР и диким типом KRAS (экзон 2), образцы опухолей у данных пациентов были исследованы на выявление дополнительных RAS и BRAF мутаций, как было описано ранее. Выявляемость RAS/BRAF мутаций составила 85 % (1014 из 1186 рандомизированных пациентов). Количество дополнительных RAS мутаций (экзоны KRAS 3, 4 и экзоны 2, 3, 4 NRAS) в популяции KRAS дикого типа (экзон 2) составило примерно 19 %. Частота мутации BRAF в экзоне 15 для популяции KRAS дикого типа (экзон 2) составила примерно 8 %.
Результаты эффективности в зависимости от статуса мутаций RAS представлены в таблице ниже.
| Вектибикс + FOLFIRI(месяцы)Медиана (95 % ДИ) | FOLFIRI (месяцы)Медиана (95 % ДИ) | Отношение рисков (95 % ДИ) | |
| Популяция с диким типом RAS | |||
| ВБП | 6,4(5,5, 7,4) | 4,6(3,7, 5,6) | 0,70(0,54, 0,91) |
| ОВ | 16,2(14,5, 19,7) | 13,9(11,9, 16,0) | 0,81(0,63, 1,02) |
| Популяция с мутантным типом RAS | |||
| ВБП | 4,8(3,7, 5,5) | 4,0(3,6, 5,5) | 0,86(0,70, 1,05) |
| ОВ | 11,8(10,4, 13,1) | 11,1(10,2, 12,4) | 0,91(0,76, 1,10) |
Эффективность препарата Вектибикс в первой линии в комбинации с FOLFIRI оценивалась в несравнительном исследовании у 154 пациентов, первичной конечной точкой являлась частота объективного ответа (ЧОО). Вторичные конечные точки включали ВБП, время до ответа, время до прогрессирования и продолжительность ответа.
Предварительно запланированный ретроспективный анализ дополнительных RAS мутаций осуществлен у 143 пациентов из 154 пациентов с мКРР и диким типом KRAS (экзон 2), частота дополнительных RAS мутаций (KRAS экзоны 3, 4 и NRAS экзоны 2, 3, 4) в популяции KRAS дикого типа (экзон 2) составила приблизительно 10 %.
Результаты эффективности в зависимости от статуса мутаций RAS по данным первичного анализа представлены в таблице ниже.
| Панитумумаб + FOLFIRI | ||
| RAS дикого типа (n = 69) | RAS мутантного типа (n = 74) | |
| ЧОО (%) (95 % ДИ) | 59(46, 71) | 41(30, 53) |
| Медиана ВБП (месяцы) (95 % ДИ) | 11,2(7,6, 14,8) | 7,3(5,8, 7,5) |
| Медиана продолжительности ответа (месяцы) (95 % ДИ) | 13,0(9,3, 15,7) | 5,8(3,9, 7,8) |
| Медиана времени до прогрессирования (месяцы) (95 % ДИ) | 13,2(7,8, 17,0) | 7,3(6,1, 7,6) |
Первая линия терапии в комбинации с бевацизумабом и химиотерапией на основе оксалиплатина или иринотекана
В рандомизированном открытом контролируемом клиническом исследовании пациенты с метастатическим колоректальным раком получали химиотерапию оксалиплатином или иринотеканом и бевацизумаб с добавлением или без панитумумаба в первой линии терапии (n = 1053 (n = 823 – оксалиплатин, n = 230 – иринотекан)). Терапия панитумумабом была прекращена после получения статистически достоверного ухудшения ВБП по результатам промежуточного анализа.
Основной целью исследования было сравнение ВБП в группе оксалиплатина. По результатам финального анализа относительный риск для ВБП составил 1,27 (95 % ДИ: 1,06, 1,52). Медиана ВБП составила 10,0 (95 % ДИ: 8,9, 11,0) в группе с панитумумабом и 11,4 (95 % ДИ: 10,5, 11,9) месяцев в группе без панитумумаба, соответственно. Наблюдалось увеличение смертности в группе панитумумаба. Относительный риск для общей выживаемости составил 1,43 (95 % ДИ: 1,11, 1,83). Медиана общей выживаемости составила 19,4 (95 % ДИ: 18,4, 20,8) в группе, получающей панитумумаб и 24,5 (95 % ДИ: 20,4, 24,5) и в группе без панитумумаба, соответственно.
Дополнительный анализ данных в зависимости от статуса мутаций в гене KRAS (экзон 2) не выявил пациентов, которые бы получали пользу от добавления панитумумаба к комбинации с оксалиплатином или иринотеканом и бевацизумабом. Для подгруппы KRAS дикого типа в группе оксалиплатина относительный риск для ВБП составил 1,36 с 95 % ДИ: 1,04–1,77. Для мутантного подтипа KRAS относительный риск для ВБП составил 1,25 с 95 % ДИ: 0,91–1,71. Тенденция к улучшению ОВ в группе контроля наблюдалась у пациентов с KRAS дикого типа на фоне оксалиплатина (относительный риск = 1,89; 95 % ДИ: 1,30, 2,75). Наблюдалась тенденция к ухудшению показателя выживаемости при применении панитумумаба и иринотекана, независимо от мутационного статуса KRAS. В целом, лечение панитумумабом в сочетании с химиотерапией и бевацизумабом ассоциируется с неблагоприятным профилем польза/риск, независимо от статуса мутаций генов KRAS в опухоли.
Детская популяция пациентов
Европейское агентство по лекарственным средствам временно отложило представление результатов исследования Вектибикса во всех подгруппах педиатрической популяции при колоректальном раке (смотрите раздел «Способ применения и дозы» для информации применения в детской популяции).
Фармакокинетика
Вектибикс применяется в качестве монотерапии или в комбинации с химиотерапией, фармакокинетика носит нелинейный характер.
После однократного введения панитумумаба в виде 1-часовой инфузии площадь под кривой «концентрация-время» (AUC) возрастала в большей степени, чем при дозопропорциональной зависимости, клиренс препарата снижался с 30,6 до 4,6 мл/день/кг при увеличении дозы с 0,75 до 9 мг/кг. Однако при введении панитумумаба в дозах свыше 2 мг/кг характер увеличения AUC был близок к дозопропорциональной зависимости.
При соблюдении рекомендуемого режима дозирования (6 мг/кг 1 раз в 2 недели в виде 1-часовой инфузии) равновесная концентрация панитумумаба достигалась к третьей инфузии при средних значениях максимальной (± стандартное отклонение) и минимальной концентраций 213 ± 59 и 39 ± 14 мкг/мл соответственно. Среднее значение (± стандартное отклонение) AUC0-tau и клиренса были равны 1306 ± 374 мкг∙день/мл и 4,9 ± 1,4 мл/кг/день соответственно. Период полувыведения препарата составил примерно 7,5 дня (диапазон: 3,6–10,9 дня).
Фармакокинетический анализ для популяций проводился с целью изучения потенциальных эффектов выбранных независимых переменных на фармакокинетику панитумумаба. Результаты показывают, что возраст (21–88), пол, раса, функции печени и почек, применение сопутствующих химиотерапевтических препаратов и интенсивное ЭФР окрашивания мембраны (1+, 2+, 3+) в опухолевых клетках не оказывала явного влияния на фармакокинетику панитумумаба.
Не проводились какие-либо клинические исследования для изучения фармакокинетики панитумумаба у пациентов с печеночной или почечной недостаточностью.
Вектибикс показан для лечения взрослых пациентов с метастатическим колоректальным раком (мКРР) и диким типом RAS в опухоли:
в первой линии терапии в комбинации с режимами FOLFOX или FOLFIRI;
во второй линии терапии в комбинации с режимом FOLFIRI у пациентов, которые получили химиотерапию на основе фторпиримидина (за исключением иринотекана);
в качестве монотерапии после отсутствия эффекта от химиотерапии на основе фторпиримидина, оксалиплатина и иринотекана.
Пациенты с тяжелой или угрожающей жизни гиперчувствительностью к активной субстанции или компонентам препарата (смотрите раздел «Меры предосторожности»).
Пациенты с интерстициальным пневмонитом или фиброзом легких (смотрите раздел «Меры предосторожности»).
Комбинация Вектибикса с химиотерапией, на основе оксалиплатина, противопоказана пациентам с мКРР и мутациями в генах RAS или пациентам, у которых статус мутаций в генах RAS неизвестен (смотрите раздел «Меры предосторожности»).
Применение во время беременности и кормления грудью
Беременность
Данные о применении Вектибикса у беременных отсутствуют. Исследования на животных показали репродуктивную токсичность. Рецептор ЭФР участвует в контроле пренатального развития и играет роль в процессах нормального органогенеза, пролиферации и дифференциации в развивающемся эмбрионе. Следовательно, Вектибикс может оказать потенциальное вредное воздействие на плод при введении его беременным женщинам.
Известно, что человеческий IgG проникает через плацентарный барьер, поэтому панитумумаб может проникать из организма матери в развивающийся организм плода. Женщины детородного возраста должны применять соответствующие средства контрацепции во время лечения с применением Вектибикса и в течение 2-х месяцев после введения последней дозы. Если Вектибикс применяется во время беременности или если пациентка забеременела при получении данного лекарственного средства, она должна быть проконсультирована о возможном риске потери беременности и о потенциальном риске для плода.
Кормление грудью
Неизвестно, проникает ли панитумумаб в грудное молоко человека. Поскольку человеческий IgG проникает в материнское молоко, можно предположить, что панитумумаб также может проникать в грудное молоко. Возможность всасывания препарата и его потенциальный вред для ребенка не установлены. В период лечения Вектибиксом и в течение 2 месяцев после введения последней дозы не рекомендуется кормление грудью.
Фертильность
Исследования на животных показали обратимое влияние на менструальный цикл и снижение женской плодовитости у обезьян. Панитумумаб может оказывать влияние на способность женщины забеременеть.
Применение Вектибикса должно находиться под контролем врача, имеющего опыт применения противоопухолевых средств. Перед началом лечения Вектибиксом, необходимо подтвердить отсутствие мутаций генов RAS (KRAS и NRAS) в опухоли. Мутационный статус должен определяться опытной лабораторией с использованием валидированных методов тестирования для обнаружения мутаций в генах KRAS (экзоны 2, 3 и 4) и NRAS (экзоны 2, 3 и 4).
Вектибикс следует вводить в виде внутривенной инфузии с помощью инфузионного насоса в периферический зонд или постоянный катетер через встроенный фильтр 0,2 или 0,22 мкм с низкой степенью связывания белков. Рекомендуемое время инфузии составляет приблизительно 60 минут. Если первая инфузия переносится хорошо, то последующие инфузии могут быть введены в течение 30–60 минут. Дозы выше чем 1000 мг следует вводить в течение примерно 90 минут (смотрите раздел «Меры предосторожности при утилизации и прочих манипуляциях»).
Линию для инфузии следует промывать раствором хлорида натрия до и после введения Вектибикса, чтобы избежать смешивания с другими лекарственными средствами или внутривенными растворами.
Снижение скорости инфузии для Вектибикса может быть необходимо в случае развития инфузионных реакций (смотрите раздел «Меры предосторожности»).
Вектибикс нельзя вводить внутривенно струйно или болюсно.
Инструкцию по разведению лекарственного средства перед введением смотрите в разделе «Меры предосторожности при утилизации и прочих манипуляциях».
Дозирование
Рекомендуемая доза Вектибикс составляет 6 мг/кг массы тела один раз в день каждые две недели. Перед инфузией Вектибикс необходимо развести в растворе хлорида натрия 9 мг/мл (0,9 %) до конечной концентрации, которая не должна превышать 10 мг/мл (смотрите раздел «Меры предосторожности при утилизации и прочих манипуляциях»).
Корректировка дозы Вектибикса может быть необходима в случае серьезных (≥ 3 степени) дерматологических реакций (смотрите раздел «Меры предосторожности»).
Применение в специальных популяциях пациентов
Педиатрическая популяция
Вектибикс не предназначен для лечения колоректального рака у детей.
Пожилые пациенты (≥ 65 лет)
Нет соответствующих клинических данных по режиму дозирования у пожилых пациентов.
Пациенты с поражением почек
Безопасность и эффективность Вектибикса не изучалась у пациентов с почечной недостаточностью.
Пациенты с поражением печени
Безопасность и эффективность Вектибикса не изучалась у пациентов с печеночной недостаточностью.
Способы введения
Меры предосторожности при утилизации и прочих манипуляциях
Вектибикс предназначен только для однократного применения. Вектибикс должен быть разведен медицинским работником в 9 мг/мл (0,9 %) растворе хлорида натрия с использованием асептической техники. Не встряхивайте и сильно не взбалтывайте флакон. Вектибикс должен быть осмотрен визуально перед введением. Раствор должен быть бесцветным и может содержать полупрозрачные или белые видимые аморфные белковые частицы (которые могут быть удалены во время фильтрации). Не вводите Вектибикс, если его описание не соответствует указанному выше. Используйте гиподермальную иглу диаметром 21 калибр или меньше, введите необходимое количество Вектибикса в дозе 6 мг/кг. Не применяйте устройства без иглы (например, адаптер для флаконов) для извлечения содержимого флакона. Разведите в общем объеме 100 мл. Конечная концентрация не должна превышать 10 мг/мл. Доза, которая превышает 1000 мг, должна быть разведена в 150 мл раствора хлорида натрия 9 мг/мл (0,9 %) (смотрите раздел «Способ применения и дозы»). Разведенный раствор необходимо перемешать с помощью легкого покачивания, не трясите флакон. Не наблюдается несовместимости между Вектибиксом и раствором хлорида натрия 9 мг/мл (0,9 %) в мешках из поливинилхлорида или полиолефина.
Любые неиспользованные лекарственные препараты или отходы следует утилизировать в соответствие с локальными требованиями.
Несовместимость
Этот лекарственный препарат нельзя смешивать с другими лекарственными средствами, кроме указанных в разделе «Меры предосторожности при утилизации и прочих манипуляциях».
Побочные реакции
Общие данные по профилю безопасности
На основании анализа данных для всех пациентов, которые получали Вектибикс при мКРР в качестве монотерапии и в комбинации с химиотерапией в рамках клинических исследований (n = 2588), наиболее часто сообщаемыми побочными реакциями были реакции со стороны кожи, которые встречались у 93 % пациентов. Эти реакции связаны с фармакологическими эффектами Вектибикса, большинство из них были легкой или средней степени тяжести с 25 % тяжелых (класс 3 NCI-CTC) и < 1 % угрожающих жизни (4-й класс NCI-CTC) реакциями. Для клинической коррекции дерматологических реакций, включая рекомендации по коррекции дозы, смотрите раздел «Меры предосторожности». Наиболее часто сообщаемыми побочными реакции, возникающими у > 20 % пациентов, были желудочно-кишечные расстройства [диарея (50 %), тошнота (41 %), рвота (27 %), запор (23 %) и боль в животе (23 %)]; общие заболевания [усталость (37 %), гипертермия (20 %)]; нарушение обмена веществ и расстройства пищеварения [анорексия (27 %)]; инфекции и инвазии [паронихия (20 %)]; заболевания кожи и подкожной клетчатки [сыпь (45 %), угревой дерматит (39 %), зуд (35 %), эритема (30 %) и сухость кожи (22 %)].
Таблица побочных реакций
Данные в таблице ниже описывают побочные реакции, которые сообщались пациентами с мКРР, которые получали панитумумаб в качестве монотерапии или в комбинации с химиотерапией (n = 2588) в рамках клинических исследований, а также из спонтанных отчетов. В каждой группе, побочные эффекты представлены по мере уменьшения степени тяжести.
| Побочные реакции | |||||
| Система организма MedDRA | Очень часто(≥ 1/10) | Часто(≥ 1/100 – < 1/10) | Нечасто(≥ 1/1000 – < 1/100) | Редко(≥ 1/10 000 – < 1/1000) | Частота неизвестна* |
| Инфекции и инвазии | Паронихия1 | Пустулезная сыпьЦеллюлит1Инфекции мочевыводящих путейФолликулитЛокализованная инфекция | Инфекция глазИнфекция век | ||
| Заболевания крови и лимфатической системы | Анемия | Лейкопения | |||
| Заболевания иммунной системы | Гиперчувствительность1 | Анафилактические реакции | |||
| Нарушения метаболизма и обмена веществ | ГипокалиемияАнорексияГипомагниемия | ГипокальциемияДегидратацияГипергликемияГипофосфатемия | |||
| Психиатрические заболевания | Бессонница | Тревожность | |||
| Заболевания нервной системы | Головная боль Головокружение | ||||
| Заболевания глаз | Конъюнктивит | БлефаритУсиление роста ресницПовышенное слезотечениеГиперемия глазного яблокаСухость глазЗуд глазРаздражение глаз | Раздражение век Кератит1 | Язвенный кератит1 | |
| Заболевания сердца | Тахикардия | Цианоз | |||
| Заболевания сосудов | Тромбоз глубоких венГипотензияГипертензияПриливы | ||||
| Заболевания органов дыхания, грудной клетки и средостения | Одышка, кашель | Эмболия легочной артерииНосовое кровотечение | БронхоспазмСухость слизистой оболочки носа | Интерстициальные заболевания легких3 | |
| Заболевания желудочно-кишечного тракта | Диарея1ТошнотаРвотаБоль в животеСтоматитЗапор | Ректальное кровотечениеСухость слизистой ротовой полостиДиспепсияАфтозный стоматитХейлитГастроэзофагеальная рефлюкснаяболезнь | Трещины губСухость губ | ||
| Заболевания кожи и подкожной клетчатки | Акнеформный дерматитСыпь1,2ЭритемаЗудСухость кожиКожные трещиныАкнеАлопеция | Синдром ладонно-подошвенной эритродизэстезииКожные язвыШелушение кожиГипертрихозОнихоклазияЗаболевания ногтейГипергидрозДерматит | Ангионевротический отек1ГирсутизмВросший ноготьОнихолизис | Некроз кожи1Синдром Стивенса-Джонсона1Токсический эпидермальный некролиз1 | |
| Заболевания мышечно-скелетной и соединительной ткани | Боли в спине | Боли в конечностях | |||
| Общие заболевания и состояния места ввода препарата | УтомляемостьПирексияАстенияВоспаление слизистойПериферические отеки | Боль в области грудиБольОзноб | Инфузионные реакции1 | ||
| Исследования | Снижение массы тела | Снижение концентрации магния в крови |
1 Смотрите раздел «Описание отдельных побочных реакций» ниже
2 Сыпь, которая является наиболее частым симптомом кожной токсичности, может развиваться в виде эксфолиативной сыпи, папулезной сыпи, эритематозной сыпи, генерализованной сыпи, макулезной сыпи, макулопапулезной сыпи, на фоне зуда, сухости и других повреждений кожи
3 Смотрите раздел «Меры предосторожности. Осложнения со стороны легких»
* Частота не может быть определена из имеющихся данных.
Профиль безопасности Вектибикса в сочетании с химиотерапией включал побочные реакции для Вектибикса (в качестве монотерапии) и фоновую токсичность химиотерапии. Не наблюдалось новых случаев токсичности или усугубления ранее известных случаев токсичности, кроме ожидаемых аддитивных эффектов. Наиболее часто возникали кожные реакции у пациентов, получавших панитумумаб в сочетании с химиотерапией. Другие реакции, которые наиболее часто встречались у пациентов при монотерапии, включали гипомагнезиемию, диарею и стоматит. Данные побочные реакции нечасто приводили к прекращению применения Вектибикса или химиотерапии.
Описание отдельных побочных реакций
Заболевания желудочно-кишечного тракта
Диарея, если сообщалась, была в основном легкой или умеренной степени тяжести. Тяжелая диарея (класс 3 и 4 по NCI-CTC) сообщалось у 2 % пациентов, получавших Вектибикс в качестве монотерапии, у 17 % пациентов, получавших Вектибикс в сочетании с химиотерапией. Сообщалось об острой почечной недостаточности у пациентов, у которых развивалась диарея и обезвоживание (смотрите раздел «Меры предосторожности»).
Инфузионные реакции
В клинических исследованиях мКРР при монотерапии и комбинированной терапии (n = 2588) инфузионные реакции (которые развивались в течение 24 часов после любой инфузии), которые включали такие симптомы/признаки, как озноб, лихорадка, одышка, сообщались примерно у 4 % пациентов, получающих Вектибикс, 1 % из этих реакций были тяжелыми (3 и 4 степень по NCI-CTC). Сообщалось о развитии случая летального ангионевротического отека у пациента с рецидивирующим метастатическим плоскоклеточным раком головы и шеи при применении Вектибикса в рамках клинических исследований. Летальный случай произошел в результате развития ангионевротического отека при возобновлении терапии; оба случая произошли больше чем через 24 часа после введения препарата (смотрите разделы «Противопоказания» и «Меры предосторожности»). Реакции гиперчувствительности, которые развивались спустя 24 часа после инфузии, также сообщались в постмаркетинговый период. Для клинического управления реакциями, связанными с инфузией, смотрите раздел «Меры предосторожности».
Заболевания кожи и подкожной клетчатки
Кожная сыпь чаще всего локализовалась на лице, груди и спине, но в некоторых случаях распространялась и на конечности. Как следствие развития тяжелых реакций со стороны кожи и подкожной клетчатки, отмечались инфекционные осложнения, включая сепсис, в редких случаях с летальным исходом, целлюлит и локальные абсцессы, требующие хирургических вмешательств и дренажа. Среднее время до развития первых симптомов дерматологических реакций составляло 10 дней, а среднее время для их разрешения после введения последней дозы Вектибикса составляло 28 дней.
Паронхиальное воспаление сопровождалось припухлостью латеральных ногтевых валиков пальцев рук и ног.
Дерматологические реакции (включая воздействие на ногти) наблюдались у пациентов, получающих Вектибикс или другие ингибиторы рецептора ЭФР, и являлись известными фармакологическими эффектами терапии.
В клинических исследованиях кожные реакции наблюдались у 93 % пациентов, получавших Вектибикс как монотерапию или в сочетании с химиотерапией (n = 2588). Эти реакции включали преимущественно сыпь и угреподобный дерматит, в основном от легкой до средней степени тяжести.
Тяжелые (3 степень по NCI-CTC) кожные реакции были зарегистрированы у 34 % пациентов, угрожающие для жизни (4 степень по NCI-CTC) кожные реакции встречались у < 1 % пациентов, которые получали Вектибикс в сочетании с химиотерапией (n =1536). Угрожающие жизни и летальные инфекционные осложнения, включая некротизирующий фасциит и сепсис, наблюдались у пациентов, получавших Вектибикс (смотрите раздел «Меры предосторожности»).
Для клинического управления кожными реакциями, включая рекомендации по корректировке дозы, смотрите раздел «Меры предосторожности».
В постмаркетинговом периоде сообщались редкие случаи некроза кожи, синдрома Стивенса-Джонсона и токсического эпидермального некролиза (смотрите раздел «Меры предосторожности»).
Офтальмологическая токсичность
Несерьезные случаи кератита наблюдались у 0,2–0,7 % пациентов в клинических исследованиях. В постмаркетинговом периоде тяжелые случаи кератита и язвенного кератита сообщались редко (смотрите раздел «Меры предосторожности»).
Другие специальные популяции
Не наблюдалось каких-либо различий в безопасности или эффективности у пожилых пациентов (≥ 65 лет) при получении Вектибикса в качестве монотерапии. Однако было зафиксировано увеличение числа серьезных побочных реакций у пожилых пациентов, получающих Вектибикс в сочетании с FOLFIRI (45 % по сравнению с 37 %) или FOLFOX (52 % по сравнению с 37 %) по сравнению только с химиотерапией (смотрите раздел «Меры предосторожности»). Наиболее частыми серьезными побочными реакциями были диарея у пациентов, получавших Вектибикс в сочетании с FOLFOX или FOLFIRI, а также обезвоживание и легочная эмболия при применении Вектибикса в сочетании с FOLFIRI.
Безопасность Вектибикса не изучалась у пациентов с почечной или печеночной недостаточностью.
Сообщения о предполагаемых побочных реакциях
Важное значение имеют сообщения о предполагаемых побочных реакциях после регистрации лекарственного средства.
Это позволяет продолжать мониторинг баланса польза/риск для лекарственного препарата. Просим специалистов здравоохранения сообщать о любых предполагаемых побочных реакциях в Республиканское унитарное предприятие «Центр экспертиз и испытаний в здравоохранении» в отдел «Республиканская клинико-фармакологическая лаборатория».
Доза до 9 мг/кг была протестирована в клинических исследованиях. Имелись сообщения о передозировке, доза превышала рекомендуемую терапевтическую дозу примерно в два раза (12 мг/кг). Среди наблюдаемых побочных реакций были токсичность кожи, диарея, обезвоживание и усталость, что соответствовало профилю безопасности в рекомендуемых дозах.
Данные из исследований по взаимодействию Вектибикса и Иринотекана у пациентов с мКРР показали, что фармакокинетика иринотекана и его активного метаболита SN-38 не изменяется при совместном введении препаратов. Результаты сравнительного исследования показали, что схемы, содержащие иринотекан (IFL или FOLFIRI), не влияют на фармакокинетику панитумумаба.
Вектибикс нельзя вводить в комбинации с химиотерапией IFL или с химиотерапией, содержащей бевацизумаб. Наблюдался высокий уровень реакций, таких как тяжелая диарея, когда панитумумаб вводили в комбинации с IFL (смотрите раздел «Меры предосторожности»), повышенная токсичность и смертность наблюдались при сочетании панитумумаба с бевацизумабом и химиотерапией (смотрите разделы «Меры предосторожности» и «Фармакодинамика»).
Комбинация Вектибикса с химиотерапией на основе оксалиплатина противопоказана для пациентов с мКРР с мутантным типом RAS или в случае, когда статус RAS для мКРР неизвестен. В клинических исследованиях наблюдалось ухудшение выживаемости без прогрессирования и общей выживаемости у пациентов с мутантным типом RAS в опухоли, которые получали панитумумаб и FOLFOX (смотрите разделы «Меры предосторожности» и «Фармакодинамика»).
Предосторожность при применении
Дерматологические реакции и токсическое воздействие на мягкие ткани
Дерматологические реакции – фармакологический эффект, наблюдаемый для рецептора эпидермального фактора роста (ЭФР), развиваются практически у всех пациентов (приблизительно 90 %), получавших лечение с применением Вектибикса. Тяжелые (3 степень по NCI-CTC) кожные реакции отмечались у 34 %, кожные реакции, угрожающие жизни (4 степень NCI-CTC) наблюдались у < 1 % пациентов, получивших Вектибикс в сочетании с химиотерапией (n = 1536) (смотрите раздел «Побочные реакции»). Если у пациента развиваются дерматологические реакции 3 степени (СТСАЕ v 4.0) или выше, или которые считаются недопустимыми, рекомендуется следующая корректировка дозы:
| Развитие симптома(-ов) со стороны кожи: степень ≥ 31 | Введение Вектибикса | Исход | Корректировка дозы |
| Первый случай возникновения | Отмена 1 или 2 доз | Улучшение (степень < 3) | Возобновление инфузии в дозе 100 % от исходной |
| Нет улучшения | Прекращение | ||
| Второй случай возникновения | Отмена 1 или 2 доз | Улучшение (степень < 3) | Возобновление инфузии в дозе 80 % от исходной |
| Нет улучшения | Прекращение | ||
| Третий случай возникновения | Отмена 1 или 2 доз | Улучшение (степень < 3) | Возобновление инфузии в дозе 60 % от исходной |
| Нет улучшения | Прекращение | ||
| Четвертый случай возникновения | Прекращение | – | – |
1 Реакции 3 степени и выше считаются тяжелыми или жизнеугрожающими
В клинических исследованиях сообщалось о развитии тяжелых дерматологических реакций (включая стоматиты), инфекционных осложнениях, в том числе сепсисе и некротизирующем фасциите, которые в редких случаях приводили к летальному исходу, а также о локальных абсцессах, которые требовали хирургического вмешательства и дренажа. Пациенты, у которых на фоне применения Вектибикса развивались тяжелые дерматологические реакции или токсическое воздействие на мягкие ткани, а также у которых наблюдалось ухудшение течения дерматологических реакций, должны наблюдаться на предмет развития воспалительных или инфекционных осложнений (включая целлюлит и некротизирующий фасциит); при необходимости таким пациентам должно быть назначено соответствующее лечение.
У пациентов, получающих Вектибикс, наблюдались осложнения, угрожающие жизни или приводящие к летальному исходу, в том числе некротизирующий фасциит и сепсис. Редкие случаи синдрома Стивенса-Джонсона и токсического эпидермального некролиза сообщались у пациентов, получавших лечение Вектибиксом в постмаркетинговом периоде. Отмена или прекращение применения Вектибикса в случае токсического воздействия на кожу и мягкие ткани связано с тяжелыми или угрожающими жизни воспалением или инфекционными осложнениями.
Лечение дерматологических реакций должно подбираться в зависимости от тяжести симптомов и может включать увлажняющие крема, солнцезащитные крема (SPF > 15 UVA и UVB) и стероидные мази (содержащие не более 1 % гидрокортизона), которые наносятся на пораженные участки и/или перорально принимаемые антибиотики. Также рекомендуется, чтобы пациенты, у которых развивается сыпь / дерматологическая токсичность, носили солнцезащитный крем и шляпы и ограничивали пребывание на солнце, так как воздействие солнечных лучей может усугубить любые кожные реакции.
Профилактическое лечение кожных реакций, включающее применение увлажняющего крема для кожи, солнцезащитного крема (SPF > 15 UVA и UVB), местного стероидного крема (не более 1 % гидрокортизона) и перорального антибиотика (например, доксициклин) может быть полезным при лечении дерматологических реакций. Пациентам рекомендуется применять увлажняющий крем и солнцезащитный крем для лица, рук, ног, шеи, спины и грудной клетки каждое утро во время лечения, а также рекомендуется наносить крем с содержанием стероидов на лицо, руки, ноги, шею, спину и область груди каждый вечер во время лечения.
Осложнения со стороны легких
Пациенты, у которых наблюдался интерстициальный пневмонит или фиброз легких, а также отмечались данные заболевания в анамнезе, исключались из клинических исследований. Случаи интерстициальных заболеваний легких, как с летальным исходом, так и без, наблюдались, в основном, в японской популяции. В случае острого начала или в случае ухудшения легочных симптомов, следует прекратить введение Вектибикса, а также необходимо начать тщательное исследование данной симптоматики: Если диагностировано интерстициальное заболевание легких, следует прекратить применение Вектибикса, и начать соответствующее лечение. У пациентов с интерстициальным пневмонитом или фиброзом легких в анамнезе, необходимо тщательно оценить преимущества применения панитумумаба и риск возникновения легочных осложнений.
Нарушение электролитного баланса
У некоторых пациентов наблюдается постепенное снижение уровня магния в сыворотке крови, что приводит к тяжелой (4 степень) гипомагнеземии.
Пациенты должны периодически наблюдаться на наличие гипомагнеземии и сопутствующей гипокальциемии до начала применения Вектибикса и периодически после начала лечения на протяжении 8 недель после завершения лечения (смотрите раздел «Побочные реакции»). При необходимости рекомендуется использовать препараты магния.
Также наблюдались другие нарушения электролитного баланса, включая гипокалиемию. Также рекомендуется мониторинг и применение этих веществ, как рекомендуется выше.
Инфузионные реакции
В клинических исследованиях мКРР при монотерапии и комбинированной терапии (n = 2588) инфузионные реакции (которые развивались в течение 24 часов после любой инфузии), сообщались примерно у 4 % пациентов, получающих Вектибикс, < 1 % из этих реакций были тяжелыми (3 и 4 степень по NCI-CTC). В постмаркетинговом периоде сообщались серьезные реакции, связанные с инфузией, включая случаи со смертельным исходом. Если развивается серьезная или угрожающая жизни реакция во время инфузии или в любое время после инфузии (например, бронхоспазм, ангиодистрофия, гипотензия, необходимость парентеральных вмешательств или анафилаксия), применение Вектибикса необходимо прекратить (смотрите раздел «Противопоказания» и «Побочные реакции»).
У пациентов, у которых развились инфузионные реакции легкой или средней степени тяжести (СТСАЕ v 4.0, 1 и 2 степень), должна быть уменьшена скорость инфузии. При всех последующих инфузиях также рекомендуется придерживаться более низкой скорости инфузии.
Сообщалось о реакциях гиперчувствительности, которые возникали более чем через 24 часа после инфузии, включая смертельный случай ангиодистрофии, которая произошла более чем через 24 часа после инфузии. Пациенты должны быть проинформированы о возможности начала поздней реакции, а также иметь контакты своего врача, чтобы сообщить о симптомах развившейся реакции гиперчувствительности.
Острая почечная недостаточность
Острая почечная недостаточность наблюдается у пациентов, у которых развивается тяжелая диарея и обезвоживание. Пациентам, страдающим тяжелой диареей, следует проконсультироваться с врачом.
Вектибикс в сочетании с химиотерапией, содержащей иринотекан, 5-фторурацил болюсно и лейковорин (IFL)
У пациентов, получающих Вектибикс в сочетании с режимом IFL [болюсно 5-фторурацил (500 мг/м2), лейковорин (20 мг/м2) и иринотекан (125 мг/м2)] отмечалась высокая частота тяжелой диареи (смотрите раздел «Побочные реакции»), поэтому следует избегать применения Вектибикса в сочетании с IFL (смотрите раздел «Взаимодействие с другими лекарственными средствами»).
Вектибикс в комбинации с бевацизумабом и химиотерапией
В рандомизированном открытом многоцентровом исследовании, в котором приняли участие 1053 пациентов, оценивалась эффективность применения химиотерапии на основе бевацизумаба и оксалиплатина или иринотекана с применением Вектибикса или без него при использовании в первой линии терапии при мКРР. У пациентов, получающих Вектибикс в сочетании с бевацизумабом и химиотерапией. Большая частота случаев легочной эмболии, инфекций (преимущественно дерматологического происхождения), диареи, дисбаланса электролитов, тошноты, рвоты и дегидратации наблюдались также в группах лечения с использованием Вектибикса в комбинации с бевацизумабом и химиотерапией. Дополнительный анализ данных эффективности в зависимости от статуса KRAS не идентифицировал подмножество пациентов, которые применяли Вектибикс в сочетании с оксалиплатином или химиотерапией на основе иринотекана и бевацизумаба.
Наблюдалась тенденция к ухудшению показателя выживаемости при применении Вектибикса в подклассе KRAS дикого типа в подгруппе бевацизумаба и оксалиплатина, а также в группе применения Вектибикса с бевацизумабом и иринотеканом, независимо от мутационного статуса KRAS. Поэтому Вектибикс не следует вводить в сочетании с химиотерапией на основе бевацизумаба (смотрите разделы «Взаимодействие с другими лекарственными средствами» и «Фармакодинамика»).
Вектибикс в сочетании с химиотерапией на основе оксалиплатина у пациентов с мКРР с мутантным типом RAS, или для которых RAS статус опухоли неизвестен
Комбинация Вектибикс с оксалиплатин-содержащей химиотерапией противопоказана для пациентов с мКРР с мутантным типом RAS или для которых RAS статус опухоли неизвестен (смотрите раздел «Способ применения и дозы» и «Фармакодинамика»).
При первичном анализе исследования (n = 1183, 656 пациентов с KRAS дикого типа (экзон 2) и 440 пациентов с мутациями KRAS), изучавшего эффективность панитумумаба в сочетании с 5-фторурацилом, лейковорином и оксалиплатином (FOLFOX) по сравнению только лишь с FOLFOX в качестве первой линии терапии мКРР, наблюдалось уменьшение времени выживаемости без прогрессирования и общей выживаемости у пациентов с мутациями KRAS, которые получали панитумумаб и FOLFOX (n = 221) по сравнению с только лишь FOLFOX (n = 219).
Предварительно запланированный ретроспективный анализ дополнительных мутаций RAS (KRAS [экзоны 3 и 4] или NRAS [экзоны 2, 3, 4]) у 641 пациента из 656 пациентов с диким типом KRAS (экзон 2) в опухоли выявили дополнительные мутации у 16 % (n = 108) пациентов. Сокращение ВБП и ОВ наблюдается у пациентов с мутантными опухолями RAS, которые получали панитумумаб и FOLFOX (n = 51) по сравнению с одним только FOLFOX (n = 57).
Статус RAS должен определяться в лаборатории с помощью валидированного метода (смотрите раздел «Способ применения и дозы»). Если Вектибикс будет применяться в комбинации с FOLFOX, тогда рекомендуется, чтобы мутационный статус определялся в лаборатории, которая участвует в Программе обеспечения внешнего качества RAS или статус дикого типа подтверждался в повторном тесте.
Офтальмологическая токсичность
Серьезные случаи кератита и язвенного кератита редко сообщались в постмаркетинговом периоде. Пациенты, имеющие признаки и симптомы, указывающие на кератит, как острый, так и ухудшение: воспаление глаз, слезотечение, светочувствительность, помутнение зрения, боль в глазах и/или покраснение глаз, должны незамедлительно обращаться к офтальмологу. Если диагноз язвенного кератита подтвержден, лечение Вектибиксом должно быть приостановлено или прекращено. Если диагностирован кератит, должны оцениваться польза и риск от продолжения лечения. Вектибикс следует использовать с осторожностью у пациентов с кератитом, язвенным кератитом или тяжелой сухостью глаз в анамнезе. Использование контактных линз также является фактором риска для развития кератита и язв.
Пациенты с функциональным статусом 2 по шкале ECOG, получавшие Вектибикс в сочетании с химиотерапией
Для пациентов с функциональным статусом 2 по шкале ECOG рекомендуется оценить баланс польза/риск до начала применения Вектибикса в сочетании с химиотерапией для лечения мКРР. Положительный баланс польза/риск не был зарегистрирован у пациентов функциональным статусом 2 по шкале ECOG.
Пожилые пациенты
Не наблюдалось каких-либо различий в безопасности или эффективности у пожилых пациентов (≥ 65 лет) при применении Вектибикс в качестве монотерапии. Однако отмечалось увеличение количества серьезных побочных реакций у пожилых пациентов, которые получали Вектибикс в сочетании с FOLFIRI или FOLFOX по сравнению с одной только химиотерапией (смотрите раздел «Побочные реакции»).
Прочие меры предосторожности
Препарат содержит 0,150 ммоль натрия (что соответствует 3,45 мг натрия) на мл концентрата. Это необходимо принимать во внимание пациентам, которые находятся на натрий-контролируемой диете.
Влияние на управление транспортными средствами и прочими механизмами
Если у пациентов во время лечения развиваются симптомы, которые оказывают влияние на орган зрения и/или на способность концентрироваться и реагировать, рекомендуется, чтобы они не водили или не использовали механизмы до тех пор, пока симптомы не исчезнут.
Флаконы
3 года.
Разведенный раствор
Вектибикс не содержит каких-либо противомикробных консервантов или бактериостатических агентов. Препарат должен быть использован сразу же после разведения. Если препарат не был использован сразу после разведения, пользователь несет ответственность за время и условия его хранения до следующего введения (не более 24 часов при температуре 2–8 °С). Не замораживать разведенный раствор.
Хранить при температуре от 2 °C до 8 °C.
Не замораживать.
Хранить в оригинальной упаковке для защиты от света.
Условия хранения разведенного раствора препарата смотрите в разделе «Срок годности».
Хранить в недоступном для детей месте.
Форма выпуска
Флакон из прозрачного стекла гидролитического класса I с эластомерной пробкой, алюминиевым колпачком и отламывающейся пластмассовой крышечкой типа «Flip off».
Один флакон содержит 100 мг панитумумаба в 5 мл концентрата для приготовления раствора для инфузий.
1 флакон в упаковке с инструкцией по медицинскому применению.
Отпускается по рецепту врача.
Выпуск партии
Amgen Europe B.V.
Минервум 7061
НЛ-4817 ЗК Бреда
Нидерланды
Владелец регистрационного удостоверения
Amgen Europe B.V.
Минервум 7061
НЛ-4817 ЗК Бреда
Нидерланды
Официальный представитель в Республике Беларусь
Представительство ООО «AlenMed Promotion» (Латвия) в Республике Беларусь
220020, Минск, пр. Победителей, 103, 7-й этаж, помещение 4
Тел: +375 17 308-73-84
Факс: +375 17 308-73-88
Следующая информация предназначена только для специалистов системы здравоохранения
Вектибикс предназначен только для однократного применения. Вектибикс должен быть разведен медицинским работником в 9 мг/мл (0,9 %) растворе хлорида натрия с использованием асептической техники. Не встряхивайте и сильно не взбалтывайте флакон. Вектибикс должен быть осмотрен визуально перед введением. Раствор должен быть бесцветным и может содержать полупрозрачные или белые видимые аморфные белковые частицы (которые могут быть удалены во время фильтрации). Не вводите Вектибикс, если его описание не соответствует указанному выше. Используйте гиподермальную иглу диаметром 21 калибр или меньше, введите необходимое количество Вектибикса в дозе 6 мг/кг. Не применяйте устройства без иглы (например, адаптер для флаконов) для извлечения содержимого флакона. Разведите в общем объеме 100 мл. Доза, которая превышает 1000 мг, должна быть разведена в 150 мл раствора хлорида натрия 9 мг/мл (0,9 %). Конечная концентрация не должна превышать 10 мг/мл. Разведенный раствор необходимо перемешать с помощью легкого покачивания, не трясите флакон. Уничтожьте флакон и любой раствор, который остался во флаконе, после однократного применения.
Линию для инфузии следует промывать раствором хлорида натрия до и после введения Вектибикса, чтобы избежать смешивания с другими лекарственными средствами или внутривенными растворами.
Вектибикс следует вводить в виде внутривенной инфузии с помощью инфузионного насоса в периферический зонд или постоянный катетер через встроенный фильтр 0,2 или 0,22 мкм с низкой степенью связывания белков. Рекомендуемое время инфузии составляет приблизительно 60 минут. Дозы выше чем 1000 мг следует вводить в течение примерно 90 минут.
Не наблюдается несовместимости между Вектибиксом и раствором хлорида натрия 9 мг/мл (0,9 %) в мешках из поливинилхлорида или полиолефина.
Вектибикс (20 мг/мл (100 мг/5 мл))
МНН: Панитумумаб
Производитель: Амджен Мэньюфэкчуринг Лимитед
Анатомо-терапевтическо-химическая классификация: Panitumumab
Номер регистрации в РК:
№ РК-ЛС-5№020049
Информация о регистрации в РК:
22.02.2018 — 22.02.2023
- Скачать инструкцию медикамента
Торговое название
Вектибикс
Международное непатентованное название
Панитумумаб
Лекарственная форма
Концентрат для приготовления раствора для инфузий 20 мг/мл (100 мг/5 мл, 400 мг/20 мл)
Состав
Один флакон содержит
активное вещество — панитумумаб 100 мг (5 мл) или 400 мг (20 мл),
вспомогательные вещества: натрия ацетата тригидрат, натрия хлорид, кислота уксусная ледяная (для регулирования pH), вода для инъекций.
Описание
Прозрачная, бесцветная жидкость, может содержать полупрозрачные или белые аморфные белковые частицы.
Фармакотерапевтическая группа
Противоопухолевые препараты. Противоопухолевые препараты другие. Моноклональные антитела. Панитумумаб.
Код АТХ L01XC08
Фармакологические свойства
Фармакокинетика
При назначении Вектибикса в качестве монотерапии или в комбинации с химиотерапией, фармакокинетика препарата носит нелинейный характер.
После однократного введения панитумумаба в виде 1-часовой инфузии, площадь под кривой «концентрация-время» (AUC) возрастала в большей степени, чем это характерно при дозопропорциональной зависимости, а клиренс препарата снижался с 30.6 до 4.6 мл/сут/кг при увеличении дозы от 0.75 до 9 мг/кг. Однако при введении панитумумаба в дозах свыше 2 мг/кг, характер увеличения AUC был близок к дозопропорциональной зависимости.
При соблюдении рекомендуемого режима дозирования (6 мг/кг 1 раз в 2 недели в виде 1-часовой инфузии), равновесные концентрации панитумумаба достигались к третьей инфузии при средних значениях максимальной (± стандартное отклонение) и минимальной концентраций 213 ± 59 и 39 ± 14 мкг/мл, соответственно. Среднее значение (± стандартное отклонение) AUC0-τ и клиренса были равны 1306 ± 374 мкг•сут/мл и 4.9 ± 1.4 мл/кг/сут, соответственно. Период полувыведения препарата составил приблизительно 7.5 суток (разброс: от 3.6 до 10.9 суток).
Была проведена совокупность анализов фармакокинетики для изучения потенциального влияния выбранных категорий на фармакокинетику панитумумаба.
Результаты анализа фармакокинетики в отдельных группах пациентов показали, что возраст (21-88 лет), пол, раса, функция печени и почек, применение сопутствующих химиотерапевтических препаратов, интенсивность иммуногистохимических реакций с рецепторами ЭФР (интенсивность окрашивания мембран (1+, 2+, 3+)) в опухолевых клетках, не оказывают явного влияния на фармакокинетику панитумумаба.
Исследования фармакокинетики панитумумаба у пациентов с нарушением функций почек или печени не проводились.
Фармакодинамика
Механизм действия
Панитумумаб представляет собой рекомбинантное, полностью человеческое моноклональное антитело IgG2, обладающее высоким сродством и специфичностью к рецепторам эпидермального фактора роста человека (ЭФР). Рецептор ЭФР – это трансмембранный гликопротеин из семейства рецепторов тирозинкиназ I типа, которое включает также HER1/c-ErbB-1, HER2, HER3 и HER4. Рецептор ЭФР стимулирует рост нормальных эпителиальных клеток, включая клетки кожи и волосяных фолликулов, и экспрессируется на различных типах опухолевых клеток.
Панитумумаб связывается с лиганд-связывающим доменом рецептора ЭФР и ингибирует процесс аутофосфорилирования, который индуцируется всеми известными лигандами рецептора ЭФР. Связывание панитумумаба с рецептором ЭФР приводит к интернализации рецептора, ингибированию процессов клеточного роста, индукции апоптоза и уменьшению продукции интерлейкина-8 и фактора роста эндотелия сосудов.
Гены KRAS (гомолог вирусного онкогена крысиной саркомы Кирстена 2) и NRAS (гомолог нейробластомы вирусного онкогена RAS) относятся к семейству онкогенов RAS. Гены KRAS и NRAS кодируют небольшой гуанозинтрифосфат-связывающий белок, который участвует в трансдукции сигнала. KRAS и NRAS активируются различными сигналами, в том числе и от рецептора ЭФР, и, в свою очередь, стимулирует синтез других внутриклеточных белков, вовлеченных в процессы клеточной пролиферации, выживаемости и ангиогенеза.
Активирующие мутации генов RAS часто происходят в различных опухолевых клетках человека и играют определенную роль, как в процессе онкогенеза, так и в прогрессии опухоли.
Фармакодинамические эффекты
Результаты in vitro анализов и эксперименты на животных in vivo показали, что панитумумаб ингибирует рост и уменьшает выживаемость опухолевых клеток, экспрессирующих рецептор ЭФР. Противоопухолевое действие панитумумаба на ксенотрансплантант человеческой опухоли, не экспрессирующей рецептор ЭФР, описано не было. В экспериментах на животных, добавление панитумумаба к режиму облучения, химиотерапии или другой таргетной терапии, увеличивало противоопухолевый эффект по сравнению с только режимом облучения, химиотерапии или таргетной терапии.
Дерматологические реакции (включая воздействие на ногти), наблюдавшиеся у пациентов, получавших Вектибикс или другие ингибиторы рецепторов ЭФР, являются известными фармакологическими эффектами данных препаратов (см. разделы «Способ применения и дозы» и «Побочные действия»).
Иммуногенность
Как и все терапевтические протеины, панитумумаб обладает потенциальной иммуногенностью. Продукцию нейтрализующих антител к панитумумабу оценивали с помощью двух различных скрининговых систем иммуноанализа для определения связанных антител к панитумумабу (ИФА — иммуноферментный анализ, который позволяет определить высокоаффинные антитела, и Биосенсор, позволяющий определить высоко- и низкоаффинные антитела). Пациентам, чья сыворотка оказывалась положительной на наличие антител в любом скрининговом иммуноанализе, проводился также биологический тест in vitro для обнаружения нейтрализующих антител.
В качестве монотерапии:
-
Частота выявления связанных антител (за исключением случаев выявления антител до введения препарата и временно положительных) составляла < 1%, как было установлено с помощью анализа ИФА и 3.8%, как было установлено с помощью иммунологического анализа Биокор;
-
Частота выявления нейтрализующих антител (за исключением случаев выявления антител до введения препарата и временно положительных) составляла < 1%;
-
При сравнении с пациентами, у которых антитела не вырабатывались, взаимосвязь между наличием нейтрализующих антител к панитумумабу и изменениями фармакокинетических параметров, эффективности и безопасности препарата не отмечена.
В комбинации с режимами химиотерапии на основе иринотекана или оксалиплатина:
-
Частота выявления связанных антител (за исключением случаев выявления антител до введения препарата и временно положительных) составляла 1.0%, как было установлено с помощью анализа ИФА и < 1% как было установлено с помощью анализа Биокор;
-
Частота выявления нейтрализующих антител (за исключением случаев выявления антител до введения препарата и временно положительных) составляла < 1%;
-
Не было обнаружено никаких доказательств изменения профиля безопасности у пациентов с положительным результатом теста на антитела к Вектибиксу.
Определение антител зависит от чувствительности и специфичности используемого метода. На положительный результат по определению антител могут оказать влияние различные факторы, включая метод проведения анализа, методику отбора образцов, время забора проб, прием сопутствующих препаратов и характер основного заболевания, поэтому сравнение частоты возникновения антител к панитумумабу с данным показателем для других препаратов может быть недостоверным.
Клиническая эффективность в качестве монотерапии
В клиническом исследовании, применение Вектибикса у пациентов с метастатическим колоректальным раком (мКРР) с диким типом гена KRAS, у которых наблюдалась прогрессия заболевания на фоне или после предшествующих курсов химиотерапии на основе фторпиримидина, оксалиплатина или иринотекана, приводит к значительному увеличению выживаемости без прогрессирования (ВБП). У пациентов с мутантным типом гена KRAS не было отмечено положительного влияния на ВБП.
Эффективность Вектибикса также оценивалась в открытом клиническом исследовании у пациентов с мКРР с диким типом гена KRAS (экзон 2). Всего 1010 пациентов, резистентных к химиотерапии, были рандомизированы в соотношении 1:1 на получение Вектибикса и цетуксимаба для определения отсутствия превосходства цетуксимаба над Вектибиксом. Первичной конечной точкой была общая выживаемость (ОВ). Вторичные ключевые точки включали выживание без прогрессирования (ВБП) и частоту объективного ответа (ЧОО).
Первичная конечная точка показала преимущество общей выживаемости (номинальное значение ZPC -3.19, p=0.0007) в пользу Вектибикса. Ожидаемый эффект лечения цетуксимабом по ОВ, сохраняемый Вектибиксом, был 106% (95% ДИ: 82%, 130%).
Клиническая эффективность в комбинации с химиотерапией
У пациентов с мКРР с диким типом генов RAS, панитумумаб в комбинации с химиотерапией (FOLFOX или FOLFIRI) показал преимущество в ВБП, ОВ и ЧОО по сравнению с монотерапией FOLFIRI.
Для пациентов с дополнительными мутациями RAS после KRAS экзона 2, не было продемонстрировано пользы от добавления панитумумаба к FOLFIRI и продемонстрирован негативный эффект добавления панитумумаба к FOLFOX у этих пациентов. Мутации BRAF в экзоне 15 предопределяли негативный исход лечения. Мутации BRAF не предопределяли исход лечения панитумумаба в комбинации с FOLFOX или FOLFIRI.
Терапия первой линии с FOLFOX
В клиническом исследовании, применение Вектибикса в комбинации с режимом химиотерапии на основе оксалиплатина, фторурацила (5-ФУ) и кальция фолината (FOLFOX), у пациентов с метастатическим колоректальным раком (мКРР) с диким типом гена KRAS, приводит к значительному увеличению выживаемости без прогрессирования (ВБП) по сравнению с монотерапией FOLFOX. Другие ключевые конечные точки включали: общую выживаемость (ОВ), частоту объективного ответа (ЧОО), время до прогрессирования (ВДП) и продолжительность ответа.
Был проведен предопределенный ретроспективный анализ 641 из 656 пациентов с мКРР с диким типом гена KRAS (экзон 2). Первичной целью этого анализа было изучение эффекта лечения панитумумабом в комбинации с FOLFOX по сравнению с монотерапией FOLFOX у пациентов с диким типом генов RAS (KRAS и NRAS экзоны 2, 3 и 4) или диким типом генов RAS и BRAF (KRAS и NRAS экзоны 2, 3 и 4 и BRAF экзон 15). В данном анализе частота дополнительных мутаций RAS в диком типе гена KRAS (экзон 2) была примерно 16%.
Последующий предопределенный анализ определил (n = 7) дополнительные мутации KRAS и NRAS в экзоне 3 (кодон 59). Анализ с включением кодона 59, также показал прогнозируемый негативный исход лечения панитумумабом.
Комбинация с FOLFIRI
В клиническом исследовании, эффективность Вектибикса во второй линии в комбинации с иринотеканом, 5-фторурацилом (5-ФУ) и кальция фолинатом (FOLFIRI) оценивали по ключевым конечным точкам — общая выживаемость (ОВ) и выживаемость без прогрессирования (ВБП). Другие ключевые конечные точки включали: частоту объективного ответа (ЧОО), время до ответа (ВДО), время до прогрессирования (ВДП) и продолжительность ответа.
Был проведен предопределенный ретроспективный анализ 586 пациентов из 597 пациентов с мКРР с диким типом гена KRAS (экзон 2) с исследованием образцов опухолей этих пациентов на дополнительные мутации RAS и BRAF, как было описано ранее. Установление мутаций RAS/BRAF было проведено у 85% пациентов (1014 из 1186 рандомизированных пациентов). Встречаемость этих дополнительных мутаций RAS (KRAS экзоны 3, 4 и NRAS экзоны 2, 3, 4) в популяции с диким типом гена KRAS (экзон 2), была примерно 19%. Встречаемость мутаций в BRAF экзоне 15, в популяции с диким типом гена KRAS (экзон 2), была примерно 8%.
Эффективность Вектибикса в терапии первой линии в комбинации с FOLFIRI, была оценена в не сравнительном исследовании у 154 пациентов с первичной конечной точкой — частота объективного ответа (ЧОО). Другие ключевые точки включали выживание без прогрессирования (ВБП), время до ответа, время до прогрессии (ВДП) и продолжительность ответа.
Был проведен предопределенный ретроспективный анализ 143 из 154 пациентов с мКРР с диким типом гена KRAS (экзон 2) и образцы опухоли этих пациентов были протестированы на дополнительные мутации RAS. Встречаемость этих дополнительных мутаций RAS (KRAS экзоны 3, 4 и NRAS экзоны 2, 3, 4) в диком типе KRAS (экзон 2) была примерно 10%.
В данном анализе мутации BRAF предопределяли негативный исход лечения, связанный с уменьшением ВБП и ОВ у пациентов с мКРР с диким типом гена KRAS в экзоне 2, независимо от группы лечения. Данные также показывают, что мутации BRAF не предопределяют дополнительную пользу эффекта лечения панитумумабом. У пациентов с мКРР с диким типом генов RAS, было показано преимущество в ВБП, ОВ и ЧОО в группе пациентов, получающих панитумумаб в комбинации с FOLFIRI по сравнению с монотерапией FOLFIRI. Для пациентов с дополнительными мутациями RAS после KRAS экзона 2, не было продемонстрировано пользы от добавления панитумумаба к FOLFIRI.
Терапия первой линии в комбинации с химиотерапией на основе бевацизумаба и оксалиплатина или иринотекана
У пациентов с мКРР с KRAS дикого типа, было продемонстрировано статистически значимое увеличение ВБП в группе пациентов, получавших Вектибикс. Применение панитумумаба в комбинации с бевацизумабом с химиотерапией на основе оксалиплатина или иринотекана связано с неблагоприятным соотношением польза-риск независимо от статуса мутации по гену KRAS.
Показания к применению
Вектибикс показан для лечения взрослых пациентов с метастатическим колоректальным раком (мКРР) с диким типом генов RAS:
-
в первой линии терапии в комбинации с режимом FOLFOX или FOLFIRI
-
в терапии второй линии в комбинации с режимом FOLFIRI для пациентов, получавших химиотерапию первой линии на основе фторпиримидина (без иринотекана)
-
в качестве монотерапии после неудачи химиотерапии на основе фторпиримидина, оксалиплатина или иринотекана
Способ применения и дозы
Лечение препаратом Вектибикс должно проводиться врачом, имеющим опыт назначения противоопухолевых препаратов. Необходимо проводить определение статуса генов RAS (KRAS и NRAS) перед началом лечения препаратом Вектибикс. Определение статуса мутации должно проводиться опытными врачами-лаборантами с использованием валидированных методов для определения мутаций KRAS (экзоны 2, 3 и 4) и NRAS (экзоны 2, 3 и 4).
Режим дозирования
Рекомендуемая доза Вектибикса составляет 6 мг/кг массы тела 1 раз в 2 недели. Перед проведением инфузии, Вектибикс разводят в 9 мг/мл (0.9%) растворе натрия хлорида для инъекций, до получения концентрации не более 10 мг/мл.
Особые группы пациентов
Безопасность и эффективность Вектибикса не оценивали у пациентов с нарушениями функций почек или печени.
В случае назначения препарата людям пожилого возраста, коррекция дозы не требуется (клинические данные отсутствуют).
Дети
Вектибикс не показан для лечения колоректального рака у детей.
Дерматологические реакции
При развитии дерматологических реакций 3 или выше степени тяжести (CTCAE v 4.0) или непереносимой дерматологической реакции, рекомендуется ввести следующее изменение дозы:
|
Возникновение кожных симптомов: ≥ степени 31 |
Введение препарата Вектибикс |
Результат |
Регулировка дозы |
|
Первый случай возникновения |
Отмена 1 или 2 доз |
Снижение интенсивности реакции (< 3 степени) |
Возобновление инфузии в дозе, составляющей 100% от первоначальной дозы |
|
Улучшения не наступило |
Прекращение |
||
|
Второй случай возникновения |
Отмена 1 или 2 доз |
Снижение интенсивности реакции (< 3 степени) |
Возобновление инфузии в дозе, составляющей 80% от первоначальной дозы |
|
Улучшения не наступило |
Прекращение |
||
|
Третий случай возникновения |
Отмена 1 или 2 доз |
Снижение интенсивности реакции (< 3 степени) |
Возобновление инфузии в дозе, составляющей 60% от первоначальной дозы |
|
Улучшения не наступило |
Прекращение |
||
|
Четвертый случай возникновения |
Прекращение |
— |
— |
1 Реакции 3 степени и выше считаются тяжелыми или жизнеугрожающими.
Инструкции по приготовлению и введению препарата
Перед проведением инфузии Вектибикс разводят в 9 мг/мл (0.9%) растворе натрия хлорида для инъекций в асептических условиях. Не рекомендуется встряхивать или сильно взбалтывать флакон. Не следует вводить препарат, если наблюдается изменение цвета содержимого флакона. Из флакона с препаратом отбирают необходимое количество Вектибикса для получения дозы 6 мг/кг, которое затем разводят в общем объеме 100 мл. Конечная концентрация не должна превышать 10 мг/мл. Дозы выше, чем 1000 мг необходимо разводить в 150 мл 9 мг/мл (0.9%) раствора натрия хлорида для инъекций. Полученный раствор перемешивают осторожным переворачиванием флакона, не встряхивают.
Не было описано различий между использованием для разведения препарата Вектибикс 9 мг/мл (0.9%) раствора натрия хлорида для инъекций в пакетах из поливинилхлорида или полиолефиновых пакетах.
Любой неиспользованный медицинский продукт или использованные материалы, должны быть утилизированы в соответствии с локальными требованиями.
Вектибикс должен вводиться внутривенно с помощью инфузионного насоса в периферический зонд или постоянный катетер через встроенный фильтр 0.2 или 0.22 мкм с низкой степенью связывания белков. Рекомендуемая длительность инфузии составляет приблизительно 60 минут. Если первая инфузия переносится хорошо, последующие инфузии могут проводиться в течение 30-60 минут. Длительность введения препарата в дозах свыше 1000 мг должна составлять приблизительно 90 минут.
До и после введения Вектибикса, инфузионную систему необходимо промыть раствором натрия хлорида, чтобы избежать смешивания Вектибикса с другими лекарственными препаратами или растворами для внутривенно введения.
В случае возникновения инфузионных реакций может потребоваться снижение скорости инфузии препарата Вектибикс.
Не вводить Вектибикс струйно или болюсно.
Побочные действия
Наиболее частыми нежелательными реакциями при применении Вектибикса в режиме монотерапии и в комбинации с химиотерапией, были дерматологические реакции, наблюдавшиеся приблизительно в 93% случаев. Эти реакции обусловлены фармакологическими свойствами препарата Вектибикс и обычно имеют легкую или среднюю степень тяжести; только в 25% случаев дерматологические реакции носят тяжелый характер (степень тяжести 3 по классификации NCI-CTC) и < 1% — жизнеугрожающие (степень тяжести 4 по NCI-CTC). Клиническое ведение кожных реакций, включая рекомендации по коррекции дозы, приведены в разделе «Особые указания».
Очень частыми нежелательными реакциями, возникавшими у ≥ 20% пациентов, были расстройства желудочно-кишечного тракта [диарея (50%), тошнота (41%), рвота (27%), запор (23%) и боль в животе (23%)]; общие реакции [повышенная утомляемость (37%), пирексия (20%)]; нарушения обмена веществ и питания [анорексия (27%)]; инфекции и инвазии [паронихия (20%)]; и патология кожи и подкожной ткани [сыпь (45%), акнеформный дерматит (39%), зуд (35%), эритема (30%) и сухость кожи (22%)].
Ниже приведены данные по нежелательным реакциям, наблюдавшимся в клинических исследованиях у пациентов с мКРР, получавших панитумумаб в качестве монотерапии или в комбинации с химиотерапией (n=2588) и случаи, о которых сообщалось при применении препарата в рутинной клинической практике.
Профиль безопасности Вектибикса в комбинации с химиотерапией включает зарегистрированные нежелательные реакции Вектибикса (в качестве монотерапии) и токсичности базовой химиотерапии. Не наблюдалось новых случаев токсичности, а также усугубления ранее указанных случаев возникновения токсичности, кроме ожидаемых аддитивных эффектов. Дерматологические реакции были наиболее частыми нежелательными реакциями, наблюдаемыми у пациентов, принимающих панитумумаб в комбинации с химиотерапией. Другие нежелательные реакции, чаще всего наблюдаемые у пациентов, получавших препарат в качестве монотерапии, включали гипомагниемию, диарею и стоматит. Эти нежелательные реакции в отдельных случаях требовали отмены Вектибикса или химиотерапии.
Частота возникновения нежелательных реакций определена следующим образом: очень часто (≥ 1/10), часто (от ≥ 1/100 до < 1/10), редко (≥ 1/1000 до < 1/100), очень редко (≥1/10,000 до <1/1000) и частота неизвестна (не может быть оценена по имеющимся данным).
Очень часто
-
паронихия1
-
анемия
-
гипокалиемия, анорексия, гипомагниемия
-
бессонница
-
конъюнктивит
-
одышка, кашель
-
диарея1, тошнота, рвота, боль в животе, стоматит, запор
-
акнеформный дерматит, сыпь1,2, эритема, кожный зуд, сухость кожи, кожные трещины, угревая сыпь, алопеция
-
боли в спине
-
повышенная утомляемость, пирексия, астения, воспаление слизистой оболочки, периферические отеки
-
снижение веса
Часто
-
пустулезная сыпь, целлюлит1, инфекции мочевыводящих путей, фолликулит, местная инфекция
-
лейкопения
-
гиперчувствительность1
-
гипокальциемия, дегидратация, гипергликемия, гипофосфатемия
-
чувство страха, головная боль, головокружение
-
блефарит, усиление роста ресниц, повышенное слезотечение, гиперемия глазного яблока, сухость глаз, зуд глаз, раздражение глаз
-
тахикардия
-
тромбоз глубоких вен, гипотензия, гипертензия, приливы
-
эмболия легочной артерии, носовые кровотечения
-
ректальное кровотечение, сухость слизистой ротовой области, диспепсия, афтозный стоматит, хейлит, гастроэзофагеальная рефлюксная болезнь
-
синдром ладонно-подошвенной эритродизестезии, кожные язвы, шелушение кожи, гипертрихоз, онихоклазия, заболевания ногтей, гипергидроз, дерматит
-
боль в конечностях
-
боль в груди, боль, озноб
-
снижение уровня магния в крови
Редко
-
инфекции глаз, инфекции век, раздражение глазного века, кератит1
-
цианоз
-
бронхоспазм, сухость слизистой оболочки носа
-
трещины на губах, сухость губ
-
ангионевротический отек1, гирсутизм, вросший ноготь, онихолизис
-
инфузионные реакции1
Очень редко
-
анафилактические реакции1
-
язвенный кератит1
-
некроз кожи1
-
синдром Стивенса-Джонсона1
-
токсический эпидермальный некролиз1
Частота неизвестна
-
интерстициальные заболевания легких3
1 см. раздел «Описание отдельных нежелательных реакций», приведенный ниже.
2 в основном сыпь включает кожную токсичность, шелушение кожи, эксфолиативную сыпь, папулезную сыпь, зудящую сыпь, эритематозную сыпь, генерализованную сыпь, макулезную сыпь, макулопапулезную сыпь, повреждения кожи.
3 см. раздел «Особые указания»
Описание отдельных нежелательных реакций
Расстройства пищеварительной системы
В большинстве случаев сообщалось о диарее легкой или умеренной степеней тяжести. Сообщалось о тяжелых случаях диареи (степени тяжести 3 и 4 по NCI-CTC) у 2% пациентов, получавших Вектибикс в качестве монотерапии и у 17% пациентов, получавших Вектибикс в комбинации с химиотерапией.
Сообщалось о развитии острой почечной недостаточности на фоне диареи тяжелой степени и дегидратации (см. раздел «Особые указания»).
Инфузионные реакции
В клинических исследованиях монотерапии мКРР (n=2588), инфузионные реакции (развивающиеся в течение 24 ч с момента первого введения препарата) наблюдались приблизительно у 4% пациентов, получавших Вектибикс, из которых < 1% были тяжелыми (степени тяжести 3 и 4 по NCI-CTC).
Сообщалось о развитии летального ангиневротического отека у пациента с рецидивирующим метастатическим плоскоклеточным раком головы и шеи, получавшего лечение Вектибиксом во время клинического исследования. Фатальное осложнение развилось при возобновлении терапии после предшествующего эпизода развития ангионевротического отека; обе реакции развились более чем через 24 часа после введения препарата. О реакциях гиперчувствительности, развивающихся более чем через 24 часа после инфузии, также сообщалось и при применении в рутинной клинической практике.
Подробности клинического ведения инфузионных реакций указаны в разделе «Особые указания».
Нарушения со стороны кожи и подкожно жировой клетчатки
Кожная сыпь наиболее часто локализовалась на лице, верхней части грудной клетки и спине, однако в некоторых случаях распространялась и на конечности. Как следствие тяжелых дерматологических реакций, отмечали также развитие инфекционных осложнений, таких как сепсис, в редких случаях, с летальным исходом, целлюлит и местные абсцессы, требующие хирургического вмешательства и дренирования. Медиана времени до развития первых проявлений дерматологических реакций составила 10 дней, а медиана времени до их разрешения с момента последнего введения Вектибикса – 28 дней.
Паронихиальное воспаление сопровождалось припухлостью латеральных ногтевых валиков пальцев рук и ног.
Дерматологические реакции (включая воздействие на ногти), наблюдавшиеся у пациентов получавших Вектибикс или другие ингибиторы рецепторов ЭФР, являются известными фармакологическими эффектами данных препаратов.
Во всех клинических исследованиях кожные реакции наблюдались у 93% пациентов, получавших Вектибикс в качестве монотерапии или в комбинации с химиотерапией (n=2588). В основном это были сыпь и угревидный дерматит почти всегда легкого или умеренного характера. Сообщалось о тяжелых кожных реакциях (степень тяжести 3 по NCI-CTC) у 34% пациентов и жизнеугрожающих кожных реакциях (степень тяжести 4 по NCI-CTC) у < 1% пациентов, получавших Вектибикс в комбинации с химиотерапией (n=1536). У пациентов, получавших Вектибикс, наблюдались жизнеугрожающие и смертельные осложнения, включая некротизирующий фасциит и сепсис (см. раздел «Особые указания»).
Подробности клинического ведения дерматологических реакций, включая рекомендации по изменению дозы, см. разделы «Особые указания» и «Способ применения и дозы».
При применении в рутинной клинической практике сообщалось о редких случаях развития некрозов кожи, синдрома Стивенса-Джонсона и токсического эпидермального некролиза (см. раздел «Особые указания»).
Офтальмологическая токсичность
Несерьезные случаи кератитов наблюдались у 0.2 – 0.7% пациентов, участвовавших в клинических исследованиях. При применении в рутинной клинической практике сообщалось о серьезных случаях кератитов и/или язвенных кератитов (см. раздел «Особые указания»).
Дети
Нет каких-либо данных о применении препарата Вектибикс у детей, поэтому Вектибикс нельзя использовать для лечения пациентов моложе 18 лет.
Другие особые популяции
У пациентов пожилого возраста (≥ 65 лет), получавших монотерапию Вектибиксом, не наблюдалось различий в безопасности и эффективности. Однако было зарегистрировано увеличение числа серьезных нежелательных реакций у пожилых пациентов, получавших терапию Вектибиксом в комбинации с FOLFIRI (45% относительно 37%) или FOLFOX (52% относительно 37%) по сравнению с применением только химиотерапии (см. раздел «Особые указания»). Наиболее часто развивающейся серьезной нежелательной реакцией у пациентов, принимающих Вектибикс в комбинации с FOLFOX или FOLFIRI, была диарея; дегидратация и тромбоэмболия легочной артерии были отмечены у пациентов, принимающих Вектибикс в комбинации с FOLFIRI.
Нет данных, касающихся безопасности применения Вектибикса пациентами с почечной и печеночной недостаточностью.
Противопоказания
-
серьезные или жизнеугрожающие реакции гиперчувствительности к любому из компонентов препарата в анамнезе
-
интерстициальный пневмонит или фиброз легких
-
в комбинации с режимом химиотерапии на основе оксалиплатина у пациентов с мКРР с мутантным типом генов RAS или у пациентов с мКРР с неуточненным типом генов RAS (см. раздел «Особые указания»)
Лекарственные взаимодействия
Исследования о взаимодействии Вектибикса и иринотекана у пациентов с мКРР показали, что фармакокинетические свойства иринотекана и его активного метаболита SN-38, не изменяются при одновременном введении препаратов. Результаты перекрестного сравнительного исследования показали, что режимы, включающие иринотекан (ИФЛ или FOLFIRI), не влияют на фармакокинетические свойства панитумумаба.
Не рекомендуется сочетанное назначение Вектибикса с режимом химиотерапии по схеме ИФЛ и с режимами химиотерапии, включающими бевацизумаб. При назначении панитумумаба в комбинации с ИФЛ, наблюдалось высокая частота диареи тяжелой степени и увеличивалась частота токсичности и летальных исходов при назначении панитумумаба в комбинации с режимом химиотерапии, включавшей бевацизумаб (см. разделы «Особые указания» и «Фармакодинамика»).
Вектибикс не следует назначать в комбинации с химиотерапией, содержащей оксалиплатин, пациентам с мКРР с мутантными генами RAS, или в случае неуточненного статуса RAS. В ходе клинического исследования у пациентов с мутантным типом гена RAS, получавших панитумумаб и FOLFOX, отмечалось ухудшение показателей выживаемости без прогрессирования и общей выживаемости (см. разделы «Особые указания» и «Фармакодинамика»).
Особые указания
Нежелательные реакции со стороны мягких тканей и кожных покровов
Дерматологические реакции – класс-эффект ингибиторов рецептора ЭФР, обусловленный фармакологическими свойствами – легкой и умеренной степеней наблюдались практически у всех пациентов (приблизительно 90%), получавших Вектибикс. Сообщалось о тяжелых кожных реакциях (степень тяжести 3 по NCI-CTC) у 34% пациентов и жизнеугрожающих кожных реакциях (степень тяжести 4 по NCI-CTC) у < 1% пациентов, получавших Вектибикс в комбинации с химиотерапией (n=1536) (см. раздел «Побочные действия»). В случае развития тяжелой дерматологической реакции (≥ степени 3) может потребоваться коррекция дозы препарата Вектибикса (см. раздел «Способ применения и дозы»).
Сообщалось о развитии тяжелых дерматологических реакций (включая стоматиты), инфекционных осложнений, включая сепсис и некротизирующий фасциит, в редких случаях приводящих к летальному исходу, и местных абсцессах, требующих оперативного вмешательства. Пациенты, у которых на фоне лечения Вектибиксом развивались тяжелые дерматологические реакции или реакции со стороны мягких тканей, или ухудшалось течение дерматологических реакций, должны наблюдаться на предмет развития воспалительных или инфекционных осложнений (включая целлюлит и некротизирующий фасциит); при необходимости таким пациентам следует назначить соответствующее лечение. У пациентов, получавших Вектибикс, наблюдались жизнеугрожающие и смертельные осложнения, включая некротизирующий фасциит и сепсис. При применении в рутинной клинической практике у пациентов, получавших Вектибикс, наблюдались редкие случаи развития синдрома Стивенса-Джонсона и токсического эпидермального некролиза. В случае возникновения нежелательных реакций со стороны мягких тканей или кожных покровов, связанных с тяжелыми или жизнеугрожающими воспалительными или инфекционными осложнениями, необходимо отложить или отменить лечение Вектибиксом.
Лечение дерматологических реакций должно быть основано на тяжести проявлений и может включать в себя увлажняющие, солнцезащитные средства (солнцезащитный фильтр > 15 УФА и УФВ), а также крема, содержащие стероиды (процент гидрокортизона не выше 1%) для применения на пораженных участках и/или пероральные антибиотики. Также, пациентам с признаками сыпи/дерматологической токсичности, рекомендуется использовать солнцезащитные средства и головные уборы, ограничить пребывание на солнце, поскольку солнечный свет может усилить любые возможные кожные реакции.
Профилактический уход за кожей включает в себя увлажняющие, солнцезащитные средства (солнцезащитный фильтр > 15 УФА и УФВ), крема, содержащие стероиды (процент гидрокортизона не выше 1%) и пероральные антибиотики (например, доксициклин), используемые при лечении дерматологических реакций. Во время проведения лечения пациентам следует наносить увлажняющие и солнцезащитные средства на лицо, руки, ноги, шею, спину и грудь каждое утро, а на ночь наносить крем, содержащий стероид на лицо, руки, ноги, шею, спину и грудь.
Осложнения со стороны легких
Пациенты с интерстициальными заболеваниями или фиброзом легких в анамнезе, не включались в клинические исследования. Случаи интерстициальных заболеваний легких, с летальными исходами и без, возникали, в основном, у японской популяции. При возникновении или ухудшении легочных симптомов лечение Вектибиксом должно быть приостановлено и выявленные симптомы незамедлительно и тщательно изучены. При диагностировании интерстициальных заболеваний легких, Вектибикс следует временно отменить и назначить пациенту соответствующее лечение. У пациентов с интерстициальным пневмонитом или легочным фиброзом в анамнезе, или признаками интерстициального пневмонита или легочного фиброза, необходимо оценить вероятную пользу применения препарата и риск развития осложнений со стороны легких.
Нарушения электролитного баланса
У некоторых пациентов отмечалось прогрессивное снижение сывороточных концентраций магния, приводившее к тяжелой (степень тяжести 4) гипомагниемии. Необходим периодический мониторинг состояния пациентов на предмет развития гипомагниемии и сопутствующей гипокальциемии перед началом лечения Вектибиксом и, периодически, в течение 8 недель после его окончания (см. раздел «Побочные действия»). При необходимости, рекомендован прием препаратов магния.
Также отмечались нарушения баланса других электролитов, включая гипокалиемию. Рекомендуется проводить указанный выше мониторинг и соответствующее адекватное поддержание этих электролитов.
Инфузионные реакции
Во всех клинических исследованиях монотерапии и комбинированной терапии мКРР (n=2588), инфузионные реакции (возникавшие в течение 24 часов после инфузии) отмечались у 4% пациентов, получавших Вектибикс, из которых < 1% были тяжелыми (степени тяжести 3 и 4 по NCI-CTC).
При применении в рутинной клинической практике сообщалось о серьезных инфузионных реакциях, включая редкие сообщения о летальных исходах. В случае возникновения тяжелой или жизнеугрожающей реакции во время или после инфузии [например, при возникновении бронхоспазма, ангионевротического отека, гипотензии с необходимостью парентерального применения препаратов или анафилаксии] прием Вектибикса следует временно прекратить.
У пациентов с легкими или умеренными (степени тяжести 1 и 2 по CTCAE v 4.0) инфузионными реакциями, следует уменьшить скорость инфузии на протяжении всей инфузии. Рекомендуется сохранять сниженную скорость инфузии в ходе всех последующих инфузий.
Сообщалось о реакциях гиперчувствительности, возникавших более чем через 24 часа после инфузии, включая ангионевротический отек со смертельным исходом, развившийся более чем через 24 часа после инфузии. Следует предупредить пациентов о возможности позднего развития реакции и проинструктировать о необходимости обращаться к своему лечащему врачу в случае возникновения симптомов реакции гиперчувствительности.
Острая почечная недостаточность
Острая почечная недостаточность была отмечена у пациентов с тяжелыми диареей и дегидратацией. Пациенты с тяжелой диареей должны быть проинструктированы о необходимости незамедлительного обращения к врачу.
Применение Вектибикса в комбинации с режимом химиотерапии на основе иринотекана, 5-фторурацила (болюсно) и кальция фолината (ИФЛ)
У пациентов принимающих Вектибикс в комбинации с режимом химиотерапии на основе ИФЛ [болюсно 5-фторурацил (500 мг/м2), кальция фолинат (20 мг/м2) и иринотекан (125 мг/м2)] наблюдалась высокая частота возникновения диареи тяжелой степени. В связи с этим, необходимо избегать применения Вектибикса в комбинации с ИФЛ.
Применение Вектибикса в комбинации с режимом химиотерапии на основе бевацизумаба
В клиническом исследовании при применении Вектибикса в комбинации с режимом химиотерапии на основе бевацизумаба, наблюдалось сокращение выживаемости без прогрессирования и увеличение летальных исходов. Также при применении Вектибикса в комбинации с режимом химиотерапии на основе бевацизумаба, увеличивалась частота возникновения легочной эмболии, инфекционных осложнений (в основном дерматологических), диареи, нарушений электролитого баланса, тошноты, рвоты и дегидратации. При применении Вектибикса в комбинации с режимом химиотерапии на основе бевацизумаба и оксалиплатина, наблюдалась тенденция к снижению выживаемости у пациентов с диким типом гена KRAS; при применении Вектибикса в комбинации с режимом химиотерапии на основе бевацизумаба и иринотекана также наблюдалась тенденция к ухудшению выживаемости у пациентов с мКРР, независимо от статуса мутации гена KRAS. Поэтому, Вектибикс не должен применяться в комбинации с режимом химиотерапии на основе бевацизумаба (см. раздел «Лекарственные взаимодействия»).
Вектибикс в комбинации с режимом химиотерапии на основе оксалиплатина у пациентов с мКРР с мутантным типом генов RAS или неуточненным статусом RAS опухоли
Вектибикс не следует назначать в комбинации с режимом химиотерапии на основе оксалиплатина пациентам с мКРР с мутантными генами RAS или в случае неуточненного статуса RAS опухоли (см. разделы «Противопоказания» и «Фармакологические свойства»). В первичном анализе исследования отмечалось значительное сокращение выживаемости без прогрессирования (ВБП) и уменьшение общего времени выживаемости (ОВ) у пациентов с мутантным геном KRAS, получавших панитумумаб и FOLFOX (n=221) и только FOLFOX (n=219).
Предопределенный ретроспективный анализ 641 из 656 пациентов с мКРР с диким типом гена KRAS (экзон 2), установил дополнительные мутации RAS (KRAS [экзоны 3 и 4] или NRAS [экзоны 2, 3, 4]) у 16% (n=108) пациентов. Сокращение ВБП и ОВ наблюдалось у пациентов с мКРР с мутантным типом генов RAS, получающих панитумумаб в комбинации с FOLFOX (n = 51) по сравнению с монотерапией FOLFOX (n= 57).
Определение статуса мутации генов RAS должно проводиться опытными врачами-лаборантами с использованием валидированной методики (см. раздел «Способ применения и дозы»).
В случае применения Вектибикса в комбинации с FOLFOX, рекомендуется проводить определение мутантного статуса в лаборатории, участвующей в программе Надлежащего определения статуса гена RAS или дикий тип гена должен быть подтвержден проведением испытания в двух повторах.
Офтальмологическая токсичность
При применении в рутинной клинической практике очень редко сообщалось о серьезных случаях кератитов и язвенных кератитов.
Пациенты, у которых наблюдаются указанные ниже признаки и симптомы кератитов, такие как острая форма или ухудшение состояния, должны незамедлительно быть направлены на обследование врачом-офтальмологом: воспалительные заболевания глаз, слезотечение, чувствительность к свету, снижение четкости зрения, болезненность и/или покраснение глаз.
При подтверждении диагноза язвенный кератит, применение Вектибикса должно быть приостановлено или прекращено. При подтверждении диагноза кератит, необходимо принять решение о возможности продолжения лечения на основании соотношения «польза и риск».
У пациентов с кератитом, язвенным кератитом или синдромом сухости глаз тяжелой степени в анамнезе, следует применять Вектибикс с осторожностью. Использование контактных линз также является фактором риска возникновения кератитов и язвенных кератитов.
Пациенты с функциональным статусом 2 по шкале ECOG, получавшие терапию Вектибиксом в комбинации с химиотерапией
Для пациентов с мКРР и со статусом ECOG 2, рекомендуется проведение оценки соотношения «польза-риск» до начала применения Вектибикса в комбинации с химиотерапией. У пациентов со статусом ECOG 2, не выявлено положительное соотношение «польза-риск».
Пожилые пациенты
У пациентов пожилого возраста (≥ 65 лет), получавших монотерапию Вектибиксом, не наблюдалось различий в безопасности и эффективности. Однако было зарегистрировано увеличение числа серьезных нежелательных реакций у пожилых пациентов, получавших Вектибикс в комбинации с режимом химиотерапии FOLFIRI или FOLFOX, по сравнению с применением только режима химиотерапии.
Другие меры предосторожности
Препарат содержит 0.150 ммоль натрия (что соответствует 3.45 мг натрия) на 1 мл концентрата. Это следует учитывать пациентам, находящимся на строгой натриевой диете.
Беременность и период кормления грудью
Беременность
Достаточное количество данных по применению Вектибикса у беременных отсутствует. Эксперименты на животных показали наличие репродуктивной токсичности. Потенциальный риск для человека неизвестен. Не рекомендуется применение препарата во время беременности. Рецептор ЭФР участвует в контроле перинатального развития плода и играет определенную роль в процессах нормального органогенеза, пролиферации и дифференцировки клеток развивающегося эмбриона. Таким образом, Вектибикс может оказывать потенциальный вред для плода при назначении беременным женщинам.
Известно, что человеческие антитела IgG способны проникать через плацентарный барьер, поэтому панитумумаб может проникать из организма матери в развивающийся организм плода. Поэтому женщины с сохраненной репродуктивной функцией во время лечения Вектибиксом и в течение 2 месяцев после его окончания должны использовать надежные средства контрацепции. При применении Вектибикса во время беременности или если беременность развилась на фоне терапии препаратом, необходимо разъяснить пациентке потенциальный риск прерывания беременности и потенциальный риск для плода.
Пациенткам, у которых беременность наступила во время лечения препаратом Вектибикс, просьба зарегистрироваться в Программе Наблюдения Беременности компании Амджен. Для регистрации в программе наблюдения, пациентки и врачи, у которых они находятся под наблюдением, могут позвонить по телефону, указанному в конце настоящей инструкции.
Период кормления грудью
Неизвестно, проникает ли панитумумаб в грудное молоко. Так как человеческие антитела IgG проникают в грудное молоко, можно предположить, что панитумумаб может также проникать в грудное молоко. Возможность всасывания препарата и его потенциальный вред для ребенка не установлены. В период лечения Вектибиксом и в течение 2 месяцев после его окончания кормление грудью не рекомендуется.
Пациенткам, кормящим во время лечения препаратом Вектибикс, просьба зарегистрироваться в Программе Наблюдения за Кормящими женщинами компании Амджен. Для регистрации в программе наблюдения, пациентки или врачи, у которых они находятся под наблюдением, могут позвонить по телефону, указанному в конце настоящей инструкции.
Фертильность
В экспериментах на животных было показано обратимое действие препарата на менструальный цикл и снижение фертильности самок обезьян. В связи с этим, панитумумаб может оказывать влияние на возможность развития беременности у женщин.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
В случае развития нежелательных реакций со стороны органов зрения и/или снижения способности к концентрации внимания и быстроты реакции, пациентам рекомендуется воздержаться от управления транспортными средствами или работы со сложным оборудованием до разрешения указанных нежелательных реакций препарата.
Передозировка
Симптомы: в клинических исследованиях назначались дозы до 9 мг/кг. Описаны случаи превышения в 2 раза рекомендованной терапевтической дозы (12 мг/кг). Выявленные нежелательные реакции включали токсические реакции со стороны кожи, диарею, дегидратацию и повышенную утомляемость, что соответствует профилю безопасности препарата в рекомендуемой дозе.
Лечение: в случае передозировки лечение симптоматическое.
Форма выпуска и упаковка
Концентрат для приготовления раствора для инфузий 20 мг/мл.
Флакон содержит 5 мл (100 мг/5 мл) или 20 мл (400 мг/20 мл) концентрата для приготовления раствора для инфузий.
Флакон из прозрачного стекла гидролитического класса I с эластомерной пробкой 13 мм, алюминиевым колпачком и отламывающимся полипропиленовым колпачком. По 1 флакону помещают в контурную ячейковую упаковку и затем в пачку картонную вместе с инструкцией по медицинскому применению на государственном и русском языках. На каждую пачку наклеивают две прозрачные защитные этикетки – контроль первого вскрытия, имеющие продольную цветную полосу.
Условия хранения
Хранить при температуре от 2C до 8C.
Не замораживать.
Хранить в оригинальной упаковке для защиты от света.
Вектибикс не содержит антимикробных консервантов или бактериостатических агентов. Препарат должен быть использован сразу после разведения. Если препарат не был использован сразу, пользователь несет ответственность за время и условия его хранения до следующего использования, но не более чем 24 часа при температуре 2C – 8C. Не замораживать разведенный раствор.
Хранить в недоступном для детей месте!
Срок хранения
3 года
Не использовать по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
По рецепту
Производитель
Амджен Мэньюфэкчуринг Лимитед
Роуд 31, Километр 24.6
Джанкос, PR 00777‑4060
Пуэрто-Рико, США
Упаковщик
Амджен Европа Б.В.
Минервум 7061
NL- 4817 ZK Бреда
Нидерланды
Владелец регистрационного удостоверения
Амджен Европа Б.В.
Нидерланды
Адрес организации, принимающей на территории Республики Казахстан претензии по качеству лекарственных средств и сообщения о побочных действиях от потребителей
ТОО «Глобал Мед »
Астана, 010000, проспект Туран, 34, Казахстан
Тел./Факс: +7 717 290 17 21
email: info@globalmed.kz
______________________________________
ИНСТРУКЦИЯ РФ ПО МЕДИЦИНСКОМУ ПРИМЕНЕНИЮ ЛЕКАРСТВЕННОГО ПРЕПАРАТА
ВЕКТИБИКС
Регистрационный номер: ЛСР-007740/09
Торговое наименование препарата: Вектибикс
Международное непатентованное наименование: панитумумаб
Лекарственная форма: концентрат для приготовления раствора для инфузий
СОСТАВ
1 мл концентрата содержит:
активное вещество: панитумумаб — 20 мг;
вспомогательные вещества: натрия ацетата тригидрат – 6,8 мг, натрия хлорид – 5,8 мг, уксусная кислота ледяная – до рН 5,8, вода для инъекций – достаточное количество.
ОПИСАНИЕ
Прозрачная или слегка опалесцирующая бесцветная жидкость; может содержать полупрозрачные или белые аморфные белковые частицы.
ФАРМАКОТЕРАПЕВТИЧЕСКАЯ ГРУППА
Противоопухолевое средство, моноклональные антитела.
Код АТХ: L01XC08
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
Фармакодинамика
Механизм действия
Панитумумаб представляет собой рекомбинантное человеческое моноклональное антитело (IgG2), обладающее высокой аффинностью и специфичностью к рецепторам эпителиального фактора роста человека (EGFR). Рецептор EGF – это трансмембранный гликопротеин из семейства рецепторов тирозинкиназ I типа, которое включает также EGFR (HER1/c-ErbB-1), HER2, HER3 и HER4. Рецептор EGF стимулирует рост нормальных эпителиальных клеток, включая клетки кожи и волосяных фолликулов, и экспрессируется на различных типах опухолевых клеток.
Панитумумаб связывается с лиганд-связывающим доменом рецептора EGF и ингибирует процесс аутофосфорилирования, который индуцируется всеми известными лигандами рецептора EGF. Связывание панитумумаба с рецептором EGF приводит к интернализации рецептора, ингибированию процессов клеточного роста, индукции апоптоза и уменьшению продукции интерлейкина-8 и фактора роста эндотелия сосудов.
Гены KRAS (гомолог вирусного онкогена крысиной саркомы Кирстена 2) и NRAS (гомолог нейробластомы вирусного онкогена RAS) относятся к семейству онкогенов RAS. Гены KRAS и NRAS кодируют небольшой гуанозинтрифосфат-связывающий белок, который участвует в трансдукции сигнала. KRAS и NRAS активируется различными сигналами, в том числе и от рецептора EGF, и в свою очередь, стимулирует синтез других внутриклеточных белков, вовлеченных в процессы клеточной пролиферации, выживаемости и ангиогенеза.
Активирующие мутации генов RAS часто происходят в различных опухолевых клетках человека и играют определенную роль, как в процессе онкогенеза, так и в прогрессии опухоли.
Фармакодинамические эффекты
Исследования in vitro и in vivo на животных показали, что панитумумаб ингибирует рост и выживаемость опухолевых клеток, экспрессировавших EGFR. Не наблюдалось противоопухолевой активности панитумумаба в экспериментах с ксенотрансплантатами опухолей человека, не экспрессировавшими EGFR. Добавление панитумумаба к лучевой, химио- или другой таргетной терапии в исследованиях на животных приводило к усилению противоопухолевого эффекта по сравнению с только лучевой, химио- или таргетной терапией.
Кожные реакции (в том числе проявления на ногтях) отмечались у пациентов, получавших препарат Вектибикс или другие ингибиторы EGFR, и, как известно, ассоциированы с фармакологическими эффектами терапии (см. разделы «Способ применения и дозы» и «Побочное действие»).
Иммуногенность
Как и все терапевтические протеины, панитумумаб обладает потенциальной иммуногенностью. Продукцию анти-панитумумаб антител оценивали с помощью двух различных скрининговых систем иммуноанализа для определения связывающих анти-панитумумаб антител (ИФА — иммуноферментный анализ, который позволяет определить высокоаффинные антитела, и биосенсорный иммуноанализ, позволяющий определить высоко- и низкоаффинные антитела). Пациентам, чья сыворотка оказывалась положительной в любом из двух тестов скринингового иммуноанализа, проводился также биологический тест in vitro для обнаружения нейтрализующих антител.
В качестве монотерапии:
- Выявляемость связывающих антител (за исключением случаев выявления антител до введения препарата и временно положительных) составляла < 1%, как было установлено с помощью анализа ИФА методом кислотной диссоциации, и 3,8%, как было установлено с помощью иммунологического анализа Biacore;
- Выявляемость нейтрализующих антител (за исключением случаев выявления антител до введения препарата и временно положительных) составляла < 1%;
- При сравнении с пациентами, у которых антитела не вырабатывались, взаимосвязь между наличием анти-панитумумаб антител и изменениями фармакокинетических параметров, эффективности и безопасности препарата не отмечена.
В комбинации с режимами химиотерапии на основе иринотекана или оксалиплатина:
- Выявляемость связывающих антител (за исключением случаев выявления антител до введения препарата) составляла 1%, как было установлено с помощью анализа ИФА методом кислотной диссоциации, и < 1%, как было установлено с помощью иммунологического анализа Biacore;
- Выявляемость нейтрализующих антител (за исключением случаев выявления антител до введения препарата) составляла < 1%;
- Не было обнаружено никаких доказательств изменения профиля безопасности у пациентов с положительным результатом теста на антитела к препарату Вектибикс.
Определение образования антител зависит от чувствительности и специфичности используемого метода. На положительный результат по определению антител могут оказать влияние различные факторы, включая метод проведения анализа, методику отбора и подготовку образцов, время забора проб, прием сопутствующих лекарственных препаратов и характер основного заболевания, поэтому сравнение частоты возникновения антител к другим препаратам может приводить к недостоверным результатам.
Фармакокинетика
При применении препарата Вектибикс в качестве монотерапии или в комбинации с химиотерапией фармакокинетика препарата носит нелинейный характер.
После однократного введения панитумумаба в виде 1-часовой инфузии площадь под кривой «концентрация-время» (AUC) возрастала в большей степени, чем это характерно при дозопропорциональной зависимости, а клиренс (CL) панитумумаба снижался с 30,6 до 4,6 мл/сут/кг при увеличении дозы от 0,75 до 9 мг/кг. Однако при введении панитумумаба в дозах свыше 2 мг/кг характер увеличения AUC был близок к дозопропорциональной зависимости.
При соблюдении рекомендованного режима дозирования (6 мг/кг 1 раз в 2 недели в виде 1‑часовой инфузии) равновесная концентрация панитумумаба достигается к третьей инфузии при средних значениях максимальной (± стандартное отклонение [SD]) и минимальной концентраций 213 ± 59 и 39 ± 14 мкг/мл, соответственно. Среднее значение (± SD) AUC0-t и клиренса были равны 1306 ± 374 мкг•сут/мл и 4,9 ± 1,4 мл/кг/сут, соответственно. Период полувыведения препарата составил приблизительно 7,5 суток (разброс: от 3,6 до 10,9 суток).
Был выполнен популяционный анализ фармакокинетики с целью оценки потенциального влияния отдельных ковариат на параметры фармакокинетики панитумумаба. Результаты его показали, что возраст (в диапазоне 21-88 лет), пол, раса, функция печени и почек, применение сопутствующих химиотерапевтических препаратов и интенсивность окрашивания мембран EGFR (1+, 2+, 3+) в опухолевых клетках не оказывают явного влияния на фармакокинетику панитумумаба.
Исследований фармакокинетики панитумумаба у пациентов с нарушением функций почек или печени не проводилось.
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
Лечение метастатического колоректального рака (мКРР) у взрослых пациентов с генами RAS дикого типа в опухоли:
- в качестве первой линии терапии в комбинации с режимами, содержащими фторурацил, кальция фолинат и оксалиплатин (FOLFOX) или фторурацил, кальция фолинат и иринотекан (FOLFIRI);
- в качестве второй линии терапии в комбинации с режимом, содержащим фторурацил, кальция фолинат и иринотекан (FOLFIRI) у пациентов, получавших ранее химиотерапию первой линии на основе фторпиримидина (исключая иринотекан);
- в качестве монотерапии при неэффективности режимов химиотерапии на основе фторпиримидина, оксалиплатина и иринотекана.
ПРОТИВОПОКАЗАНИЯ
- Пациенты с анамнезом тяжелых или угрожающих жизни реакций гиперчувствительности к действующему веществу или любому из вспомогательных веществ препарата, перечисленных в разделе «Состав» (см. раздел «Особые указания»);
- Пациенты с интерстициальным пневмонитом или фиброзом легких (см. раздел «Особые указания»);
- Комбинация препарата Вектибикс с оксалиплатин-содержащим режимом химиотерапии противопоказана пациентам с мКРР и мутациями в генах RAS или пациентам с мКРР с неуточненным статусом мутаций в генах RAS (см. раздел «Особые указания»);
- Пациенты с почечной и печеночной недостаточностью (эффективность и безопасность применения не установлены);
- Детский возраст до 18 лет (эффективность и безопасность применения не установлены; см. раздел «Способ применения и дозы»);
- Беременность и период грудного вскармливания (эффективность и безопасность применения не установлены; см. раздел «Применение при беременности и в период грудного вскармливания»).
С ОСТОРОЖНОСТЬЮ
- У пациентов с кератитом, язвенным кератитом или выраженной сухостью глаз (см. раздел «Особые указания»).
Применение при Беременности и в период ГРУДНОГО ВСКАРМЛИВАНИЯ
Беременность
Достоверные данные о применении препарата Вектибикс у беременных отсутствуют. В исследованиях на животных была продемонстрирована репродуктивная токсичность препарата. Потенциальный риск ее у человека не известен. Рецептор EGF участвует в контроле пренатального развития плода и играет определенную роль в процессах нормального органогенеза, пролиферации и дифференцировки клеток развивающегося эмбриона. Таким образом, препарат Вектибикс может оказывать потенциальный вред для плода при применении у беременных женщин.
Известно, что человеческие антитела IgG способны проникать через плацентарный барьер, поэтому панитумумаб может проникать из организма матери в развивающийся организм плода. Поэтому женщины с сохранной репродуктивной функцией во время лечения препаратом Вектибикс и в течение 2 месяцев после его окончания должны использовать адекватные меры контрацепции. Если препарат Вектибикс используется в процессе беременности, или беременность развилась на фоне терапии, необходимо разъяснить пациентке потенциальный риск прерывания беременности и потенциальный вред для плода.
Грудное вскармливание
Неизвестно, проникает ли панитумумаб в грудное молоко. Так как человеческие антитела IgG проникают в грудное молоко, можно предположить, что панитумумаб может также проникать в грудное молоко. Возможность всасывания препарата и его потенциальный вред для ребенка не установлены. В период лечения препаратом Вектибикс и в течение 2 месяцев после его окончания кормление грудью не рекомендуется.
Влияние на фертильность
В экспериментах было показано обратимое действие препарата на менструальный цикл и снижение плодовитости самок обезьян. В связи с этим панитумумаб может оказывать влияние на возможность развития беременности у женщин.
СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ
Терапию препаратом Вектибикс необходимо проводить под контролем врача, имеющего опыт проведения противоопухолевого лечения. Перед началом терапии препаратом Вектибикс необходимо подтверждение гена RAS дикого типа (KRAS и NRAS). Мутационный статус гена должен быть определен лабораторией, имеющей опыт соответствующих исследований, с использованием валидированных методик обнаружения мутаций KRAS (в экзонах 2, 3 и 4) и NRAS (в экзонах 2, 3 и 4).
Режим дозирования
Рекомендуемая доза препарата Вектибикс составляет 6 мг/кг массы тела и вводится 1 раз в 2 недели.
При развитии тяжелых (≥ 3 степени) дерматологических реакций может потребоваться следующий режим модификации дозы препарата Вектибикс:
|
Возникновение кожных симптомов: |
Введение препарата Вектибикс |
Результат |
Коррекция дозы |
|---|---|---|---|
|
Первый случай возникновения |
Отмена 1 или 2 доз |
Снижение интенсивности реакции (< 3 степени) |
Возобновление инфузии в дозе, составляющей 100% от первоначальной дозы |
|
Улучшения не наступило |
Прекращение |
||
|
Второй случай возникновения |
Отмена 1 или 2 доз |
Снижение интенсивности реакции (< 3 степени) |
Возобновление инфузии в дозе, составляющей 80% от первоначальной дозы |
|
Улучшения не наступило |
Прекращение |
||
|
Третий случай возникновения |
Отмена 1 или 2 доз |
Снижение интенсивности реакции (< 3 степени) |
Возобновление инфузии в дозе, составляющей 60% от первоначальной дозы |
|
Улучшения не наступило |
Прекращение |
||
|
Четвертый случай возникновения |
Прекращение |
— |
— |
1 Реакции 3 степени и выше считаются тяжелыми или жизнеугрожающими
Применение у отдельных популяций пациентов
Безопасность и эффективность препарата Вектибикс не оценивались у пациентов с почечной или печеночной недостаточностью.
Отсутствуют клинические данные, позволяющие обосновать необходимость коррекции дозы препарата в пожилом возрасте.
Дети
Опыт применения препарата Вектибикс у детей отсутствует.
Способ введения
Вектибикс необходимо вводить в виде внутривенной инфузии с помощью инфузионного насоса.
Перед проведением инфузии препарат Вектибикс должен быть разведен специалистом здравоохранения в 9 мг/мл (0,9%) растворе натрия хлорида для инъекций в асептических условиях до получения конечной концентрации не более 10 мг/мл. Не встряхивать или не взбалтывать сильно флакон. Флакон с препаратом Вектибикс следует визуально оценить перед применением. Раствор должен быть бесцветным и может содержать полупрозрачные или белые аморфные белковые частицы (которые удаляются фильтром инфузионной системы). Не следует вводить препарат Вектибикс, описание которого отличается от приведенного выше. При помощи гиподермальной иглы размера 21G или меньше из флакона с препаратом забирается необходимое количество препарата Вектибикс для получения дозы 6 мг/кг, которое затем растворяют в общем объеме 100 мл. Не использовать безыгольные приспособления (например, переходники для флаконов) для извлечения препарата из флакона. Конечная концентрация не должна превышать 10 мг/мл. Дозы выше, чем 1000 мг следует растворить в 150 мл 9 мг/мл (0,9%) раствора натрия хлорида для инъекций. Полученный разведенный раствор необходимо перемешать осторожным переворачиванием, не встряхивать.
Не наблюдалось несовместимости между препаратом Вектибикс и 9 мг/мл (0,9%) раствором натрия хлорида для инъекций в инфузионных пакетах из поливинилхлорида или полиолефина.
Препарат Вектибикс следует вводить в периферический зонд или постоянный катетер через встроенный фильтр с размером пор 0,2 или 0,22 мкм с низкой степенью связывания белков. Рекомендованная длительность инфузии составляет приблизительно 60 минут. Если первая инфузия переносится хорошо, последующие инфузии могут производиться в течение 30-60 минут. Длительность введения препарата в дозах свыше 1000 мг должна составлять приблизительно 90 минут (инструкции по обращению приведены в подразделе «Особые меры предосторожности при применении и утилизации»).
До и после введения препарата Вектибикс, инфузионную систему необходимо промыть раствором натрия хлорида, чтобы избежать смешивания препарата Вектибикс с другими лекарственными препаратами или растворами для внутривенного введения.
В случае возникновения инфузионных реакций может потребоваться снижение скорости инфузии препарата Вектибикс (см. раздел «Особые указания»).
Препарат Вектибикс не должен вводиться струйно или болюсно.
ПОБОЧНОЕ ДЕЙСТВИЕ
Обзор профиля безопасности препарата
Согласно результатам анализа данных всех пациентов с мКРР, принимавших участие в клинических исследованиях и получавших препарат Вектибикс в режиме монотерапии и в комбинации с химиотерапией (n = 2224) наиболее частыми нежелательными реакциями были кожные реакции, наблюдавшиеся приблизительно в 94% случаев. Эти реакции обусловлены фармакологическими свойствами препарата Вектибикс и обычно имеют легкую или среднюю степень тяжести; только в 23% случаев дерматологические реакции носят тяжелый характер (степень тяжести 3, по классификации NCI-CTC) и < 1% жизнеугрожающие (степень 4 по NCI-CTC). Медицинские меры в случае кожных реакций, включая рекомендации по коррекции дозы, приведены в разделе «Особые указания».
Наиболее частыми нежелательными реакциями, возникавшими у ≥ 20% пациентов, были расстройства желудочно-кишечного тракта [диарея (46%), тошнота (39%), рвота (26%), запор (23%) и боль в животе (23%)]; общие реакции [повышенная утомляемость (35%), пирексия (21%)]; нарушения обмена веществ и питания [снижение аппетита (30%)]; инфекции и инвазии [паронихия (20%)]; и патология кожи и подкожной ткани [сыпь (47%), акнеформный дерматит (39%), зуд (36%), эритема (33%) и сухость кожи (21%)].
Табличный перечень нежелательных реакций
Нежелательные реакции, наблюдавшиеся у пациентов с мКРР, получавших панитумумаб в качестве монотерапии или в комбинации с химиотерапией в клинических исследованиях (n = 2224), а также в спонтанных сообщениях, приведены ниже. Нежелательные эффекты представлены по степени убывания серьезности.
|
Нежелательные реакции |
|||
|---|---|---|---|
|
Класс систем органов по классификации MedDRA |
Очень часто |
Часто |
Нечасто < 1/100) |
|
Инфекции и инвазии |
Конъюнктивит Паронихия1 |
Кожные высыпания пустулезные, воспаление подкожной клетчатки1, инфекция мочевыводящих путей, фолликулит, локализованная инфекция |
Инфекция глаза, инфекция века |
|
Нарушения со стороны крови и лимфатической системы |
Анемия |
Лейкопения |
|
|
Нарушения со стороны иммунной системы |
Гиперчувствительность1 |
Анафилактическая реакция2 |
|
|
Нарушения со стороны обмена веществ и питания |
Гипокалиемия, гипомагниемия, снижение аппетита |
Гипокальциемия, дегидратация, гипергликемия, гипофосфатемия |
|
|
Психические нарушения |
Бессонница |
Тревожность |
|
|
Нарушения со стороны нервной системы |
Головная боль, головокружение |
||
|
Нарушения со стороны органа зрения |
Блефарит, рост ресниц, усиление слезотечения, гиперемия глаза, сухость глаз, зуд глаз, раздражение глаза |
Язвенный кератит1,4, кератит1, раздражение века |
|
|
Кардиологические нарушения |
Тахикардия |
Цианоз |
|
|
Нарушения со стороны сосудистой системы |
Тромбоз глубоких вен, гипотензия, гипертензия, гиперемия |
||
|
Респираторные, торакальные и медиастинальные нарушения |
Диспноэ, кашель |
Тромбоэмболия легочной артерии, носовое кровотечение |
Интерстициальная болезнь легких3, бронхоспазм, сухость слизистой оболочки полости носа |
|
Нарушения со стороны пищеварительной системы |
Диарея1, тошнота, рвота, боли в животе, стоматит, запор |
Ректальное кровотечение, сухость во рту, диспепсия, афтозные язвы, хейлит, гастроэзофагеальная рефлюксная болезнь |
Обветренность губ, сухость губ |
|
Нарушения со стороны кожи и подкожной клетчатки1 |
Акнеформный дерматит, кожная сыпь, эритема, кожный зуд, сухость кожи, трещины кожи, акне, алопеция |
Язва кожи, эксфолиации кожи, эксфолиативные кожные высыпания, дерматит, папулезные кожные высыпания, зудящие кожные высыпания, эритематозные кожные высыпания, генерализованные кожные высыпания, макулезные кожные высыпания, макулопапулезные кожные высыпания, повреждения кожи, кожная токсичность, корки, гипертрихоз, онихоклазия, нарушение со стороны ногтей, гипергидроз, синдром ладонно-подошвенной эритродизестезии |
Токсический эпидермальный некролиз1,4, синдром Стивенса-Джонсона1,4, некроз кожи1,4, ангионевротический отек1, гирсутизм, вросший ноготь, онихолиз |
|
Нарушения со стороны костно-мышечной системы и соединительной ткани |
Боль в спине |
Боли в конечности |
|
|
Системные нарушения и осложнения в месте введения |
Утомляемость, пирексия, астения, воспаление слизистых, периферические отеки |
Боли в грудной клетке, боль, озноб |
|
|
Травмы, отравления и осложнения процедур |
Инфузионная реакция1 |
||
|
Изменения результатов лабораторных и инструментальных исследований |
Снижение массы тела |
Снижение концентрации магния в крови |
1 См. подраздел «Описание отдельных нежелательных реакций».
2 См. раздел «Особые указания» (инфузионные реакции).
3 См. раздел «Особые указания» (осложнения со стороны легких).
4 Некроз кожи, синдром Стивенса-Джонсона, токсический эпидермальный некролиз и язвенный кератит являются нежелательными реакциями панитумумаба, отмечавшимися в процессе его применения после регистрации. Максимальная частота этих нежелательных реакций оценивалась на основе верхней границы 95% доверительного интервала для точечной оценки с учетом рекомендаций регуляторных органов для оценки частоты нежелательных реакций в спонтанных сообщениях. Максимальное значение частоты, рассчитанное на основе верхней границы 95% доверительного интервала для точечной оценки, составило 3/2224 (или 0,13%).
Профиль безопасности препарата Вектибикс в комбинации с химиотерапией согласуется с зарегистрированными нежелательными реакциями препарата Вектибикс (используемого в монотерапии) и проявлениями фоновой токсичности химиотерапии. Новых проявлений токсичности или усугубления ранее известных проявлений токсичности помимо ожидаемых аддитивных эффектов не наблюдалось. Кожные реакции соответствовали наиболее часто отмечавшимся нежелательным реакциям у пациентов, получавших панитумумаб, в комбинации с химиотерапией. Другими проявлениями токсичности, отмечавшимися с большей частотой по сравнению с использованием препарата в монотерапии, являлись гипомагниемия, диарея и стоматит. Эти проявления токсичности нечасто приводили к досрочному завершению терапии препаратом Вектибикс или химиотерапии.
Описание отдельных нежелательных реакций
Нарушения со стороны пищеварительной системы
В большинстве случаев диарея имела легкую или умеренную степень тяжести. Сообщалось о тяжелых случаях диареи (степень 3 и 4 по NCI-CTC) у 2% пациентов, принимавших препарат Вектибикс в качестве монотерапии, и у 16% пациентов, принимавших препарат Вектибикс в комбинации с химиотерапией.
Сообщалось о развитии острой почечной недостаточности на фоне диареи тяжелой степени и обезвоживания (см. раздел «Особые указания»).
Инфузионные реакции
Во всех клинических исследованиях моно- и комбинированной терапии мКРР (n = 2224) реакции на инфузию (развивающиеся в течение 24 часов с момента первого введения препарата), симптомами/признаками которых могли являться озноб, повышение температуры тела или диспноэ, отмечались приблизительно у 5% пациентов, получавших препарат Вектибикс, из которых 1% были тяжелыми (3 и 4 степени NCI-CTC).
Сообщалось о случае развития летального ангионевротического отека у пациента с рецидивирующим метастатическим плоскоклеточным раком головы и шеи, леченого препаратом Вектибикс. Фатальное осложнение развилось при возобновлении терапии после предшествующего эпизода развития ангионевротического отека. Обе реакции зафиксированы спустя более 24 часов после введения препарата (см. разделы «Противопоказания» и «Особые указания»). О реакциях гиперчувствительности, развившихся более чем через 24 часа после инфузии, также сообщалось и в пострегистрационный период.
Данные клинического ведения реакций на инфузию приведены в разделе «Особые указания».
Нарушения со стороны кожи и подкожно-жировой клетчатки
Кожная сыпь, наиболее часто локализованная на лице, верхней части грудной клетки и спине, однако в некоторых случаях распространялась и на конечности. Как следствие тяжелых дерматологических реакций отмечали также развитие инфекционных осложнений, таких как сепсис, в редких случаях с летальным исходом, воспаление подкожной клетчатки и местные абсцессы, требующие хирургического вмешательства и дренирования. Медиана времени до развития первых проявлений дерматологических реакций составила 10 дней, а медиана времени до их разрешения с момента последнего введения препарата Вектибикс – 31 день.
Паронихиальное воспаление сопровождалось припухлостью латеральных ногтевых валиков пальцев рук и ног.
Дерматологические реакции (включая воздействие на ногти), наблюдавшиеся у пациентов, получавших препарат Вектибикс или другие ингибиторы EGFR, являются известными фармакологическими эффектами данных препаратов.
Во всех клинических исследованиях кожные реакции наблюдались приблизительно у 94% пациентов, получавших препарат Вектибикс в качестве монотерапии или в комбинации с химиотерапией (n = 2224). В основном это были сыпь и угревидный дерматит почти всегда легкого или умеренного характера. О тяжелых кожных реакциях (степень 3 по NCI‑CTC) сообщалось у 23% пациентов, а о жизнеугрожающих кожных реакциях (степень 4 по NCI-CTC) — у < 1% пациентов. У пациентов, получавших препарат Вектибикс, регистрировались жизнеугрожающие и летальные инфекционные осложнения, включавшие некротизирующий фасциит и сепсис (см. раздел «Особые указания»).
Данные клинического ведения дерматологических реакций, включая рекомендации по изменению дозы, приведены в разделе «Особые указания».
В пострегистрационный период применения сообщалось о редких случаях развития некрозов кожи, синдрома Стивенса-Джонсона и токсического эпидермального некролиза (см. раздел «Особые указания»).
Офтальмологическая токсичность
Сообщалось о серьезных случаях кератитов и язвенных кератитов, которые могут приводить к перфорации роговицы (см. раздел «Особые указания»).
Другие особые популяции
Не наблюдалось различий в безопасности и эффективности у пациентов пожилого возраста (≥ 65 лет), получавших монотерапию препаратом Вектибикс. Однако было зарегистрировано увеличение числа серьезных нежелательных реакций у пожилых пациентов, получавших терапию препаратом Вектибикс в комбинации с режимами химиотерапии FOLFIRI (45% по сравнению с 32%) или FOLFOX (52% по сравнению с 37%), по сравнению с получавшими только химиотерапию (см. раздел «Особые указания»). Наиболее частыми серьезными нежелательными явлениями были диарея у пациентов, получавших препарат Вектибикс в комбинации с режимами FOLFOX или FOLFIRI, дегидратация и тромбоэмболия легочной артерии — у пациентов, получавших препарат Вектибикс в комбинации с режимом FOLFIRI.
Нет данных, касающихся безопасности применения препарата Вектибикс пациентами с почечной и печеночной недостаточностью.
ПЕРЕДОЗИРОВКА
В клинических исследованиях препарат использовался в дозах до 9 мг/кг. Были зарегистрированы случаи превышения рекомендованной терапевтической дозы (12 мг/кг) приблизительно в 2 раза. Наблюдались нежелательные эффекты, такие как токсические реакции со стороны кожи, диарея, дегидратация и повышенная утомляемость, что соответствовало профилю безопасности препарата в рекомендованной дозе.
ВЗАИМОДЕЙСТВИЕ С ДРУГИМИ ЛЕКАРСТВЕННЫМИ ПРЕПАРАТАМИ
Данные исследования о взаимодействии препарата Вектибикс и иринотекана у пациентов с мКРР показали, что фармакокинетические свойства иринотекана и его активного метаболита, SN-38, не меняются при одновременном введении препаратов. Результаты перекрестного сравнительного исследования показали, что схемы, включающие в себя иринотекан (IFL или FOLFIRI), не влияют на фармакокинетические свойства панитумумаба.
Вектибикс не должен назначаться в комбинации с режимом химиотерапии IFL или режимами химиотерапии, включающими бевацизумаб. При назначении панитумумаба в комбинации с IFL, наблюдалась высокая частота возникновения диареи тяжелой степени (см. раздел «Особые указания») и увеличивалась частота токсичности и летальных исходов при назначении панитумумаба в комбинации с режимом химиотерапии, включавшей бевацизумаб (см. раздел «Особые указания»).
Комбинация препарата Вектибикс с химиотерапией на основе оксалиплатина противопоказана пациентам с мКРР и мутациями RAS, а также пациентам с мКРР с неизвестным статусом RAS. В клиническом исследовании у пациентов с мутациями RAS в опухоли, которые получали панитумумаб и химиотерапию FOLFOX, отмечалось укорочение выживаемости без прогрессирования заболевания и общей выживаемости (см. раздел «Особые указания»).
Фармацевтическая несовместимость
Данный препарат не следует применять с другими лекарственными средствами, кроме указанных в подразделе «Особые меры предосторожности при применении и утилизации».
ОСОБЫЕ УКАЗАНИЯ
Отслеживаемость
С целью улучшения отслеживаемости биологических лекарственных препаратов следует точно записывать название и номер серии вводимого препарата.
Нежелательные реакции со стороны мягких тканей и кожи
Дерматологические реакции — фармакологический эффект, характерный для ингибиторов EGFR, регистрируются практически у всех пациентов (приблизительно 94%), получающих препарат Вектибикс. Тяжелые кожные реакции (3 степени согласно классификации NCI‑CTC) отмечались у 23% пациентов, жизнеугрожающие кожные реакции (4 степени NCI-CTC) – у < 1% пациентов, принимавших препарат Вектибикс в качестве монотерапии и в комбинации с химиотерапией (n = 2224) (см. раздел «Побочное действие»). При развитии у пациента кожных реакций степени 3 (Общие терминологические критерии оценки нежелательных явлений CTCAE, версия 4.0) или более выраженной степени, либо расцененных как непереносимые, см. рекомендации по модификации дозы в разделе «Способ применения и дозы».
В клинических исследованиях после развития тяжелых кожных реакций (в том числе стоматита) имели место инфекционные осложнения, в том числе сепсис и некротизирующий фасциит, которые в редких случаях приводили к смерти, а также к образованию абсцессов, требовавших вскрытия и дренирования. Пациенты, у которых отмечались тяжелые кожные реакции или проявления токсичности со стороны мягких тканей, либо демонстрировавшие усугубление данных реакций на фоне терапии препаратом Вектибикс, должны наблюдаться на предмет развития воспалительных или инфекционных последствий (в том числе воспаление подкожной клетчатки и некротизирующего фасциита), а при наличии соответствующих клинических показаний должна быть начата соответствующая терапия. Жизнеугрожающими и летальными инфекционными осложнениями являлись некротизирующий фасциит и сепсис, которые отмечались у пациентов, получавших препарат Вектибикс. Редкие случаи синдрома Стивенса-Джонсона и токсического эпидермального некролиза отмечались у пациентов в пострегистрационном периоде, принимавших препарат Вектибикс. Временная отмена или прекращение применения препарата Вектибикс необходимы при развитии кожной токсичности или токсичности мягких тканей, ассоциированных с развитием тяжелых или жизнеугрожающих воспалительных или инфекционных осложнений.
Лечение и ведение дерматологических реакций должно быть основано на тяжести проявлений и может включать в себя увлажняющие, солнцезащитные средства (солнцезащитный фильтр > 15 UVA и UVB), а также кремы с глюкокортикостероидами (не выше 1% гидрокортизона) для применения на пораженных участках и/или пероральные антибиотики (например, доксициклин). Также пациентам с признаками сыпи/дерматологической токсичности рекомендуется использовать солнцезащитные средства и головные уборы, ограничить пребывание на солнце, поскольку солнечный свет может усилить любые возможные кожные реакции.
Пациентам может быть рекомендовано наносить увлажняющие, солнцезащитные средства на лицо, руки, ноги, шею, спину и грудь каждое утро, а на ночь наносить крем, содержащий глюкокортикостероид, на лицо, руки, ноги, шею, спину и грудь во время проведения лечения.
Осложнения со стороны легких
Пациенты с наличием в анамнезе или имеющие признаки интерстициального пневмонита или фиброза легких исключались из клинических исследований. Случаи интерстициальных заболеваний легких с летальными исходами и без, возникали, преимущественно, в японской популяции. Поэтому при остром возникновении или ухудшении легочных симптомов лечение препаратом Вектибикс должно быть приостановлено и незамедлительно начато изучение возникших симптомов. При обнаружении интерстициальных заболеваний легких препарат Вектибикс следует временно отменить и назначить соответствующее лечение. У пациентов с интерстициальным пневмонитом или легочным фиброзом в анамнезе необходимо оценить отношение вероятной пользы применения препарата к риску осложнений со стороны легких.
Нарушения водно-электролитного баланса
У некоторых пациентов отмечалось прогрессивное снижение сывороточных концентраций магния, приводившее к тяжелой (степень 4) гипомагниемии. Необходим периодический мониторинг состояния пациентов на предмет развития гипомагниемии и сопутствующей гипокальциемии перед началом лечения препаратом Вектибикс, и после лечения до 8 недель после его окончания (см. раздел «Побочное действие»). При необходимости рекомендован прием препаратов магния.
Также отмечались нарушения баланса других электролитов, включая гипокалиемию. Рекомендуется мониторинг и соответствующий адекватный прием данных электролитов.
Инфузионные реакции
В клинических исследованиях монотерапии и комбинированной терапии мКРР (n = 2224), инфузионные реакции, в том числе тяжелые инфузионные реакции (возникавшие в течение 24 часов после инфузии), отмечались у пациентов, получавших препарат Вектибикс (степень 3 и 4 по NCI-CTC).
В пострегистрационных исследованиях сообщалось о серьезных инфузионных реакциях, включая редкие пострегистрационные сообщения о летальных исходах. В случае возникновения тяжелой или жизнеугрожающей реакции в процессе инфузии или в любое время после ее завершения [например, при возникновении бронхоспазма, ангионевротического отека, гипотензии, потребности в парентеральной терапии или анафилаксии], необходимо полностью отменить препарат Вектибикс (см. разделы «Противопоказания» и «Побочное действие»).
У пациентов с легкими или умеренными (степень 1 и 2 по CTCAE версии 4.0) инфузионными реакциями следует уменьшить скорость инфузии на протяжении всей инфузии. Рекомендуется сохранять сниженную скорость инфузии в ходе всех последующих инфузий.
Сообщалось о реакциях гиперчувствительности, возникавших более чем через 24 часа после инфузии, включая ангионевротический отек со смертельным исходом, развившийся более чем через 24 часа после инфузии. Следует предупредить пациентов о возможности позднего развития реакции и проинструктировать обращаться к своему лечащему врачу в случае возникновения симптомов реакции гиперчувствительности.
Острая почечная недостаточность
Острая почечная недостаточность отмечена у пациентов с тяжелой диареей и дегидратацией. Пациенты должны быть проинструктированы о необходимости немедленно обратиться за медицинской помощью при развитии тяжелой диареи.
Препарат Вектибикс в комбинации с химиотерапией на основе иринотекана, фторурацила болюсно и кальция фолината (режим IFL)
У пациентов, получавших препарат Вектибикс в комбинации с режимом IFL [болюсное введение фторурацила (500 мг/м2), кальция фолината (20 мг/м2) и иринотекана (125 мг/м2)], отмечалась высокая частота тяжелой диареи (см. раздел «Побочное действие»). Поэтому следует избегать использования препарата Вектибикс в комбинации с режимом IFL (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Препарат Вектибикс в комбинации с бевацизумабом и режимами химиотерапии
У пациентов, получавших препарат Вектибикс в комбинации с бевацизумабом и химиотерапией, отмечалось укорочение выживаемости без прогрессирования заболевания и повышение частоты летальных исходов. Кроме того, в группах терапии препаратом Вектибикс в комбинации с бевацизумабом и химиотерапией отмечалось повышение частоты тромбоэмболии легочной артерии, инфекций (преимущественно кожных), диареи, электролитных нарушений, тошноты, рвоты и дегидратации. Препарат Вектибикс не должен применяться в комбинации с химиотерапией, включающей бевацизумаб (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Препарат Вектибикс в комбинации с химиотерапией на основе оксалиплатина у пациентов с мКРР и мутациями RAS, а также с неуточненным статусом RAS
Комбинация препарата Вектибикс с химиотерапией на основе оксалиплатина противопоказана пациентам с мКРР и мутациями RAS, а также пациентам с мКРР с неуточненным статусом мутаций генов RAS (см. раздел «Противопоказания»).
Отмечалось сокращение выживаемости без прогрессирования заболевания (ВБП) и общей выживаемости (OВ) у пациентов с мутациями KRAS (в экзоне 2) в опухоли и дополнительными мутациями RAS (KRAS [в экзонах 3 и 4] или NRAS [в экзонах 2, 3, 4]), получавших панитумумаб в комбинации с инфузионным режимом, содержащим фторурацил, кальция фолинат и оксалиплатин (FOLFOX) по сравнению с пациентами, получавшими только FOLFOX.
Оценка мутационного статуса RAS должна определяться с использованием валидированного метода в лаборатории, имеющей опыт выполнения подобных исследований (см. раздел «Способ применения и дозы»). Если препарат Вектибикс должен использоваться в комбинации с режимом FOLFOX, рекомендуется определение мутационного статуса в лаборатории, принимающей участие в программе внешнего обеспечения качества оценки статуса RAS, либо дикий тип должен быть подтвержден результатами двукратного анализа.
Офтальмологическая токсичность
Отмечались серьезные случаи кератита и язвенного кератита, которые могут приводить к перфорации роговицы. Пациенты, у которых отмечаются признаки и симптомы, свидетельствующие о наличии кератита, в том числе острые или усугубляющиеся: воспалительные изменения глаза, слезотечение, светобоязнь, снижение четкости зрения, боли в глазу и/или покраснения глаза, должны быть немедленно направлены к офтальмологу.
При подтверждении диагноза язвенного кератита терапию препаратом Вектибикс необходимо временно или полностью прекратить. При постановке диагноза кератита необходимо тщательно соотнести пользу и риски продолжения терапии.
Препарат Вектибикс должен использоваться с осторожностью у пациентов, имевших в анамнезе кератит, язвенный кератит или выраженную сухость глаза. Использование контактных линз также является фактором риска развития кератита и изъязвлений.
Пациенты с показателем общего состояния 2 по шкале ECOG, получавших препарат Вектибикс в комбинации с химиотерапией
Для пациентов с мКРР, имеющих показатель 2 по шкале ECOG, рекомендуется проведение оценки соотношения польза-риск до начала применения препарата Вектибикс в комбинации с химиотерапией. У пациентов со статусом ECOG 2 не выявлено положительное соотношение польза-риск.
Пожилые пациенты
Различий безопасности или эффективности препарата Вектибикс в монотерапии у пациентов пожилого возраста (≥ 65 лет) не наблюдалось. Однако отмечалось увеличение количества серьезных нежелательных реакций у пожилых пациентов, получавших препарат Вектибикс в комбинации с химиотерапией FOLFIRI или FOLFOX, по сравнению с применением только режимов химиотерапии (см. раздел «Побочное действие»).
Предупреждение о вспомогательных веществах
Данный препарат содержит 3,45 мг натрия в 1 мл, что соответствует 0,17% от рекомендованного ВОЗ максимального суточного потребления натрия для взрослого человека, составляющего 2 г.
Особые меры предосторожности при применении и утилизации
Препарат Вектибикс следует вводить в периферический зонд или постоянный катетер через встроенный фильтр с размером пор 0,2 или 0,22 мкм с низкой степенью связывания белков.
Разведенный раствор
Вектибикс не содержит антимикробных консервантов или бактериостатических агентов. Препарат должен быть использован непосредственно после разведения. Если препарат не был использован сразу после разведения, пользователь несет ответственность за время и условия его хранения до следующего введения (не более 24 часов при температуре 2 °C ‑ 8 °C). Не замораживать разведенный раствор.
Препарат Вектибикс предназначен только для однократного использования.
Флакон и оставшийся в нем раствор лекарственного препарата необходимо утилизировать после однократного применения.
Весь неиспользованный остаток препарата и расходные материалы должны утилизироваться в соответствии с надлежащими требованиями.
ВЛИЯНИЕ НА СПОСОБНОСТЬ УПРАВЛЯТЬ ТРАНСПОРТНЫМИ СРЕДСТВАМИ, МЕХАНИЗМАМИ
Вектибикс может оказывать влияние на способность управлять транспортными средствами и на работу с механизмами. В случае развития нежелательных реакций со стороны органов зрения и/или снижения способности к концентрации внимания и быстроты реакции, пациентам рекомендуется воздержаться от управления транспортными средствами или работы со сложным оборудованием до разрешения указанных нежелательных реакций препарата.
ФОРМА ВЫПУСКА
Концентрат для приготовления раствора для инфузий 20 мг/мл.
Флакон содержит 5 мл (100 мг/5 мл) или 20 мл (400 мг/20 мл) концентрата для приготовления раствора для инфузий.
Маркированный флакон из прозрачного стекла гидролитического класса I с эластомерной пробкой, алюминиевым колпачком и отламывающимся полипропиленовым колпачком.
По 1 флакону помещают в контурную ячейковую упаковку и затем в пачку картонную вместе с инструкцией по применению. Для контроля первого вскрытия на каждую пачку наклеивают две прозрачные защитные этикетки, имеющие продольную цветную полосу.
УСЛОВИЯ ХРАНЕНИЯ
Хранить при температуре от 2°C до 8°C.
Не замораживать.
Хранить в оригинальной упаковке для защиты от света.
Хранить в недоступном для детей месте!
СРОК ГОДНОСТИ
3 года.
Не использовать по истечении срока годности, указанного на упаковке.
УСЛОВИЯ ОТПУСКА
Отпускают по рецепту.
ПРОИЗВОДИТЕЛЬ
Производитель готовой лекарственной формы / Фасовщик (первичная упаковка)
Амджен Мэньюфэкчуринг Лимитед,
Роуд 31, Км 24.6, Джанкос, Пуэрто-Рико, 00777, Соединенные Штаты Америки.
Упаковщик (вторичная (потребительская) упаковка) / Выпускающий контроль качества
Амджен Европа Б.В.,
Минервум 7061, NL-4817 ZK Бреда, Нидерланды или
Амджен Технолоджи (Айрлэнд) Анлимитед Компани,
Поттери Роуд, Дан Лэйри, Графство Дублин, Ирландия или
ООО «Добролек», Россия,
115446, г. Москва, Коломенский проезд, д. 13А.
ОРГАНИЗАЦИЯ, ПРИНИМАЮЩАЯ ПРЕТЕНЗИИ ОТ ПОТРЕБИТЕЛЕЙ
ООО «Амджен»
123112, Москва, Пресненская набережная, д.8, строение 1, 7 этаж
Тел: +7 (495) 745 0478
Факс: +7 (499) 995 1965
| 652955561477976856_ru.doc | 225.5 кб |
| 071349631477978015_kz.doc | 235.5 кб |
| Инструкция_Вектибикс_РФ.docx | 0.06 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники


