Состав
В 1 таблетке активного компонента декскетопрофена трометамола 36,9 мг, что составляет 25 мг декскетопрофена. Дополнительные индифферентные компоненты: МКЦ, крахмал кукурузный, стеарат магния, гликолят натрия крахмала, аэросил.
В 1 ампуле 2 мл активного компонента декскетопрофена трометамола 73,8 мг, что составляет 50 мг декскетопрофена. Дополнительные индифферентные компоненты: хлорид натрия, этанол 95%, раствор гидроксида натрия, вода для инъекций.
Форма выпуска
Имеет 2 формы выпуска: в виде таблеток и раствор в ампулах для инъекций.
Таблетки по форме круглые, двояковыпуклые, с риской по центру, белые в разрезе. Пленочная оболочка белая или почти белая. Расфасованы по 10 шт. в контурную ячейковую пластину и картонную коробочку.
Раствор для инъекций прозрачный, с выраженным спиртовым запахом. Выпускается в ампулах из затемненного стекла объемом 2 мл. Количество ампул в упаковке: 5 штук.
Фармакологическое действие
Лекарственное средство с обезболивающим, противовоспалительным и жаропонижающим действием.
Фармакодинамика и фармакокинетика
Принцип работы активного вещества декскетопрофена заключается в подавлении синтеза простагландинов на уровне циклооксигеназ — ЦОГ-1 и ЦОГ-2.
Максимальный пик действующего вещества в крови после применения таблетки составляет около получаса, обезболивающее действие сохраняется от 4 до 6 часов. После в/м и в/в инъекции максимальная концентрация в сыворотке появляется через 20 минут, длительность обезболивания до 8 часов.
Для действующего вещества специфично соединение с белками плазмы на 99%. Не кумулируется в организме, в основном выводится через почки с мочой. Время полувыведения при инъекционной форме около 1-2,7 часов, при таблетированной — 1,65 часов. У пожилых людей старше 65 лет дольше почти на 50%.
Показания к применению
Применяется для устранения острой и хронической боли в мышцах, суставах, связках, сухожилиях. Снимает симптоматику в момент применения.
От чего помогают таблетки Дексонала: от зубной и головной боли, болезненных менструаций, любой внезапной боли. Снимает болевую симптоматику при ревматоидном артрите, остеохондрозе, артрозе.
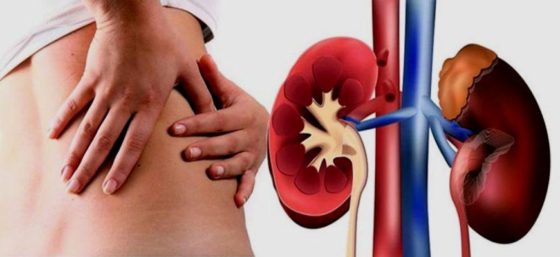
От чего помогают уколы Дексонала: от сильной боли после операций, в пояснице и суставах, при межпозвоночной грыже, почечной колике.
Противопоказания
Препарат противопоказан в следующих случаях:
- Чувствительность к декскетопрофену, веществам, входящим в состав препарата;
- Язвенные поражения ЖКТ, болезнь Крона в острой стадии, активные кровотечения;
- Людям с хронической диспепсией и сильным обезвоживанием;
- Печеночная недостаточность в тяжелой форме;
- Гиперкалиемия, прогрессирующие патологии почек;
- Сердечная недостаточность, до и после операции по шунтированию сердца;
- При склонности к кровотечениям;
- Дети и подростки до 18 лет, беременные и кормящие женщины.
Препарат можно применять, но под наблюдением врача:
- При эзофагите, гастрите;
- Людям, проходящим лечение ГКС, антикоагулянтами, антиагрегантами, диуретиками, СИОЗС.
- Больным с повышенным АД, ишемической болезнью сердца, нарушениями мозгового кровообращения, сахарным диабетом.
- При патологиях гемопоэза, системной красной волчанке.
- Людям пожилого и преклонного возраста.
Побочные действия
Наиболее часто побочные реакции наблюдаются со стороны ЖКТ. Особенно это выражено у людей старшего возраста. Самые вероятные проявления — резь в животе, изжога, поташнивание и нарушения стула. Совсем редко обострение язвенного колита, гастрита.
Остальные побочные эффекты отмечаются редко:
- Нервная система и органы чувств: головокружение, вялость, неспокойный сон, парестезии, тревожность, двоение в глазах;
- Сердечно-сосудистая система и кровь: чувство сердцебиения и жара, повышение АД, нарушение показателей крови;
- Мочеполовая система: нарушение функции почек;
- Репродуктивная система: у женщин сбой менструального цикла, у мужчин — работы простаты, в основном при длительном приеме;
- Аллергические проявления: сыпь, крапивница, бронхоспазм, фотосенсибилизация;
- Со стороны обмена веществ: редкие случаи анорексии.
Инструкция по применению Дексонала (Способ и дозировка)
Рассчитан на краткосрочный прием. Таблетки принимают не более 5 дней, в виде инъекций — не больше 2 дней.
Таблетки Дексонал, инструкция по применению
Во время приема пищи, внутрь, запивая водой.
При внезапной боли лучше принять перед едой, за 30 мин. Анальгетический эффект наступит быстрее.
При слабой боли достаточно 1/2 таблетки, минимальный промежуток между приемами 4-6 часов.
При умеренной боли — 1 таблетка с интервалом в 8 часов.
Максимально в сутки можно принять — 75 мг. Людям старшего возраста, больным с проблемами почек и печени не стоит превышать дозу 50 мг.
Уколы Дексонала, инструкция по применению
При внутримышечном введении 2 мл препарата вводят в мышцу не торопясь, в течение 15 секунд. Если было введено не все содержимое, оставшийся раствор утилизируют. Внутривенное вливание может осуществляться струйно и инфузионно.
При струйной инъекции введение в вену препарата также медленное.
Для внутривенной инфузии 2 мл препарата разводят в 30-100 мл физраствора, раствора глюкозы или Рингера. Далее вводят путем внутривенной капельницы в течение 10-30 минут.
Оптимальная дозировка — 50 мг с интервалом 8-12 ч. Максимально в сутки — 150 мг. При сильной послеоперационной боли можно сочетать Дексонал с опиоидными лекарствами. Пожилым пациентам уменьшать суточную дозировку нет необходимости.
Передозировка
Случаи передозировок практически не наблюдаются. Дексонал хорошо переносится. При сильно завышенной дозе возможны: рвота, боль в животе, бессонница, вертиго и помутнение сознания. В таком случае необходим прием адсорбентов и промывание желудка.
Взаимодействие
Усиливает действие других анальгезирующих противовоспалительных лекарств и ГСК;
Повышает эффект антикоагулянтов, типа Варфарина и гепарина, что увеличивает возможность кровотечений;
Не дружит с препаратами, содержащими Li и метотрексат, препятствуя их выведению;
Усиливает побочные эффекты фенитоина и сульфонамидов;
Ослабляет действие мочегонных и понижающих давление средств;
Прием с пентоксифеллином, тромболитиками, СИОЗС провоцирует развитие кровотечений из ЖКТ;
Усиливает действие пероральных сахароснижающих лекарств;
Прием препарата на фоне терапии зидовудином грозит развитием тяжелой анемии;
Снижает эффективность β-адреноблокаторов;
Прием с сердечными гликозидами повышает их концентрацию в крови, что может вызывать нарушение ритма сердца;
При применении с хинолонами в увеличенных дозах возможны судороги.
Условия продажи
Таблетки являются безрецептурными, ампулы с рецептурным отпуском.
Условия хранения
Хранить следует при комнатной температуре до 25°C, без доступа прямых солнечных лучей.
Срок годности
С указанной даты выпуска препарат в таблетках хранится 3 года, в ампулах — 2 года.
Особые указания
Чтобы сократить нежелательное побочное воздействие при приеме лекарства, можно уменьшить его дозировку и длительность терапии.
Пациентам, имеющим в анамнезе язву ЖКТ и аллергию, принимающим ацетилсалициловую кислоту в малых дозах, пожилым людям, следует начинать лечение с наименьшей дозировки. Рекомендовано дополнительное применение мизопростола или блокаторов протонной помпы. В случае кровотечений в ЖКТ и открытия язвы прекратить прием препарата.
У пациентов, принимающих антикоагулянты и антиагреганты, ГСК также повышается вероятность кровотечений в ЖКТ.
Препарат может повышать концентрацию креатина и азота в плазме, что неблагоприятно для мочевыводящей системы. При одновременном приеме с диуретиками есть риск нефротоксичности.
Дексонал может вызывать нарушение водного обмена, что нежелательно для пациентов с повышенным давлением, почечной и сердечной недостаточностью. В случае ухудшения состояния прием лекарства прекращают. Аналогичный подход людям с заболеваниями: сахарный диабет, ИБС, патологии мозгового кровообращения, курение.
В связи с возможностью головокружений и сонливости сразу после приема лучше избегать поездок за рулем, работы, требующей повышенной сосредоточенности.
Аналоги Дексонала
Совпадения по коду АТХ 4-го уровня:
В аптеках можно подобрать полные аналоги таблеток и уколов Дексонала на возможную замену: Велдексал, Дексалгин, Декскетопрофен-Белмед, Дексиакс, Кетодексал, Фламадекс, Риклинг, Морсадекс, Максалгин, Декскетопрофен-Эво, Декскетопрофен (Велфарм, Керн Фарма, Эллара, Биохимик, Биоком, Лекас, Органика, Северная звезда, Курская биофабрика), Дексолитин, Инфен-25.
В среднем цена аналогов Дексонала колеблется от 102 руб. за таблетки №10 российского производства до 600 руб. за раствор для в/в и в/м введ. №10 импортных фармпроизводителей.
Детям
Безопасность применения Дексонала у детей и подростков до 18 лет не установлена.
С алкоголем
При приеме Дексонала следует воздержаться от употребления алкоголя. Спиртные напитки усиливают раздражающее действие препарата на желудок, нервную систему и работу сердца. Острые реакции выражаются в виде сильной боли в животе, расстройства кишечника, рвоты, головокружения, скачков давления и учащенного сердцебиения.
При беременности и лактации
Беременным и кормящим женщинам прием Дексонала в любой форме выпуска противопоказан.
Отзывы о Дексонале
Отзывы пациентов о таблетках Дексонал с положительными рекомендациями. Отмечен быстрый обезболивающий эффект и пролонгированное действие. Чаще всего таблетки применяют от зубной боли, острой суставной и поясничной боли, при болезненных менструациях. Удобно принимать, 1 таблетки хватает до 8 часов.
Врачи-хирурги, вертебрологи и стоматологи также высоко оценивают обезболивающие таблетки и уколы Дексонал. Помогают снять выраженную боль и воспаление в краткие сроки без значительного урона ЖКТ.
Цена Дексонала, где купить
Цена на таблетки Дексонал №10 в российских аптеках составляет около 370 руб. Средняя стоимость раствора Дексонал для в/в и в/м введ. №5 -240 руб.
- Интернет-аптеки РоссииРоссия
ЗдравСити
-
Дексонал таблетки п/о плен. 25мг 10штАО Алиум
Аптека Диалог
-
Дексонал таблетки 25мг №10Оболенское фармпред.
-
Дексонал таблетки 25мг №10Оболенское фармпред.
Ригла
-
Дексонал р-р для в/в и в/м введ. 25мг/мл 2мл амп. №5Биннофарм/Алиум АО
показать еще
Випидия® (Vipidia®) инструкция по применению
📜 Инструкция по применению Випидия®
💊 Состав препарата Випидия®
✅ Применение препарата Випидия®
📅 Условия хранения Випидия®
⏳ Срок годности Випидия®
Описание лекарственного препарата
Випидия®
(Vipidia®)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2023 года.
Дата обновления: 2022.10.03
Владелец регистрационного удостоверения:
Контакты для обращений:
ШТАДА
(Россия)
Код ATX:
A10BH04
(Алоглиптин)
Лекарственные формы
| Випидия® |
Таб., покр. пленочной оболочкой, 12.5 мг: 28 шт. рег. №: ЛП-002644 |
|
|
Таб., покр. пленочной оболочкой, 25 мг: 28 шт. рег. №: ЛП-002644 |
Форма выпуска, упаковка и состав
препарата Випидия®
Таблетки, покрытые пленочной оболочкой желтого цвета, овальные, двояковыпуклые, с нанесенными чернилами надписями «TAK» и «ALG-12.5» на одной стороне.
Вспомогательные вещества:
Ядро: маннитол — 96.7 мг, целлюлоза микрокристаллическая — 22.5 мг, гипролоза — 4.5 мг, кроскармеллоза натрия — 7.5 мг, магния стеарат — 1.8 мг.
Состав пленочной оболочки: гипромеллоза 2910 — 5.34 мг, титана диоксид — 0.6 мг, краситель железа оксид желтый — 0.06 мг, макрогол 8000 — следовые количества, чернила серые F1 (шеллак — 26%, краситель железа оксид черный — 10%, этанол — 26%, бутанол — 38%) — следовые количества.
14 шт. — блистеры алюминиевые (2) — пачки картонные.
14 шт. — упаковки ячейковые контурные алюминиевые (2) — пачки картонные со склеенными боковыми клапанами.
Таблетки, покрытые пленочной оболочкой светло-красного цвета, овальные, двояковыпуклые, с нанесенными чернилами надписями «TAK» и «ALG-25» на одной стороне.
Вспомогательные вещества:
Ядро: маннитол — 79.7 мг, целлюлоза микрокристаллическая — 22.5 мг, гипролоза — 4.5 мг, кроскармеллоза натрия — 7.5 мг, магния стеарат — 1.8 мг.
Состав пленочной оболочки: гипромеллоза 2910 — 5.34 мг, титана диоксид — 0.6 мг, краситель железа оксид красный — 0.06 мг, макрогол 8000 — следовые количества, чернила серые F1 (шеллак — 26%, краситель железа оксид черный — 10%, этанол — 26%, бутанол — 38%) — следовые количества.
14 шт. — блистеры алюминиевые (2) — пачки картонные.
14 шт. — упаковки ячейковые контурные алюминиевые (2) — пачки картонные со склеенными боковыми клапанами.
Фармакологическое действие
Алоглиптин является сильнодействующим и высокоселективным ингибитором ДПП-4. Его избирательность в отношении ДПП-4 более чем в 10000 раз превосходит его действие в отношении других родственных ферментов, включая ДПП-8 и ДПП-9. ДПП-4 является основным ферментом, участвующим в быстром разрушении гормонов семейства инкретинов: глюкагоноподобного пептида-1 (ГПП-1) и глюкозо-зависимого инсулинотропного полипептида (ГИП).
Гормоны семейства инкретинов секретируются в кишечнике, их концентрация повышается в ответ на прием пищи. ГПП-1 и ГИП увеличивают синтез инсулина и его секрецию β-клетками поджелудочной железы. ГПП-1 также ингибирует секрецию глюкагона и уменьшает продукцию глюкозы печенью. Поэтому, повышая концентрацию инкретинов, алоглиптин увеличивает глюкозозависимую секрецию инсулина и уменьшает секрецию глюкагона при повышенной концентрации глюкозы в крови. У пациентов с сахарным диабетом 2 типа с гипергликемией эти изменения секреции инсулина и глюкагона приводят к снижению концентрации гликозилированного гемоглобина HbA1c и уменьшению концентрации глюкозы в плазме крови как натощак, так и постпрандиально.
Фармакокинетика
Фармакокинетика алоглиптина имеет сходный характер у здоровых лиц и у пациентов с сахарным диабетом 2 типа.
Всасывание
Абсолютная биодоступность алоглиптина составляет приблизительно 100%. Одновременный прием с пищей с высоким содержанием жиров не оказывал влияние на AUC алоглиптина, поэтому его можно принимать вне зависимости от приема пиши. У здоровых лиц после однократного перорального приема до 800 мг алоглиптина отмечается быстрая абсорбция препарата с достижением со средним значением TCmax в интервале от 1 до 2 ч с момента приема.
AUC алоглиптина пропорционально увеличивается при однократном приеме в терапевтическом диапазоне доз от 6.25 мг до 100 мг. Коэффициент вариабельности AUC алоглиптина среди пациентов небольшой (17%). AUC(0-inf) алоглиптина после однократного приема была схожа с AUC(0-24) после приема такой же дозы 1 раз/сут в течение 6 дней. Это указывает на отсутствие временной зависимости в кинетике алоглиптина после многократного приема.
Ни у здоровых добровольцев, ни у пациентов с сахарным диабетом 2 типа не наблюдалось клинически значимой кумуляции алоглиптина после многократного приема.
Распределение
Связывание с белками плазмы составляет примерно 20-30%. После однократного в/в введения алоглиптина в дозе 12.5 мг у здоровых добровольцев Vd в терминальной фазе составлял 417 л, что указывает на то, что алоглиптин хорошо распределяется в тканях.
Метаболизм
Алоглиптин не подвергается интенсивному метаболизму, от 60 до 70% алоглиптина выводится в неизмененном виде почками.
После введения 14C-меченного алоглиптина внутрь были определены два основных метаболита: N-деметилированный алоглиптин, М-I (<1% исходного вещества), и N-ацетилированный алоглиптин, М-II (<6% исходного вещества). М-I является активным метаболитом и высокоселективным ингибитором ДПП-4, схожим по действию с самим алоглиптином; М-II не проявляет ингибирующую активность по отношению к ДПП-4 или другим ДПП ферментам.
В исследованиях in vitro было выявлено, что CYP2D6 и CYP3A4 участвуют в ограниченном метаболизме алоглиптина.
Также исследования in vitro показывают, что алоглиптин не индуцирует CYP1A2, CYP2C9, CYP2B6 и не ингибирует CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 или CYP3A4 в концентрациях, достигаемых при рекомендуемой дозе алоглиптина 25 мг. В условиях in vitro алоглиптин может в небольшой степени индуцировать CYP3A4, однако в условиях in vivo алоглиптин не индуцирует CYP3A4.
Алоглиптин не ингибирует почечные транспортеры органических анионов человека первого (ОАТ1), третьего (ОАТ3) типов и почечные транспортеры органических катионов человека второго (ОСТ2) типа.
Алоглиптин существует преимущественно в виде (R)-энантиомера (>99%) и в условиях in vivo или в небольших количествах, или вообще не подвергается хиральному преобразованию в (S)-энантиомер. (S)-энантиомер не обнаруживается при приеме алоглиптина в терапевтических дозах.
Выведение
После перорального приема 14C-меченного алоглиптина 76% общей радиоактивности было выведено почками и 13% — через кишечник. Средний почечный клиренс алоглиптина (170 мл/мин) больше, чем средняя скорость клубочковой фильтрации (около 120 мл/мин), что позволяет предположить, что алоглиптин частично выводится за счет активной почечной экскреции. Средний терминальный T1/2 составляет приблизительно 21 ч.
Фармакокинетика у отдельных групп пациентов
Пациенты с почечной недостаточностью. Исследование алоглиптина в дозе 50 мг/сут было проведено у пациентов с различной степенью тяжести хронической почечной недостаточности. Включенные в исследование пациенты были разделены на 4 группы в соответствии с формулой Кокрофта-Голта: пациенты с легкой (КК от 50 до 80 мл/мин), средней степенью тяжести (КК от 30 до 50 мл/мин) и тяжелой почечной недостаточностью (КК менее 30 мл/мин), а также пациенты с терминальной стадией хронической почечной недостаточности, нуждающиеся в гемодиализе.
AUC алоглиптина у пациентов с почечной недостаточностью легкой степени тяжести увеличивалась приблизительно в 1.7 раз по сравнению с контрольной группой. Тем не менее, данное увеличение AUC находилось в пределах допустимого отклонения для контрольной группы, поэтому коррекция дозы препарата у таких пациентов не требуется.
Увеличение AUC алоглиптина приблизительно в 2 раза по сравнению с контрольной группой отмечалось у пациентов с почечной недостаточностью средней степени тяжести. Приблизительно четырехкратное увеличение AUC отмечалось у пациентов с почечной недостаточностью тяжелой степени, а также у пациентов с терминальной стадией хронической почечной недостаточности но сравнению с контрольной группой. Пациентам с терминальной стадией почечной недостаточности проводили гемодиализ сразу же после приема алоглиптина. Около 7% дозы удалялось из организма в течение 3-часового сеанса диализа.
Таким образом, для достижения терапевтической концентрации алоглиптина в плазме крови, сходной с таковой у пациентов с нормальной функцией почек, необходима коррекция дозы у пациентов с почечной недостаточностью средней степени тяжести. Алоглиптин не рекомендуется применять у пациентов с почечной недостаточностью тяжелой степени, а также с терминальной стадией почечной недостаточности, требующей проведения гемодиализа.
Пациенты с печеночной недостаточностью. У пациентов с печеночной недостаточности средней степени тяжести AUC и Cmax алоглиптина уменьшаются приблизительно на 10% и 8%, соответственно, по сравнению с пациентами с нормальной функцией печени. Данные значения клинически не значимы. Таким образом, коррекция дозы препарата при печеночной недостаточности легкой и средней степени тяжести (от 5 до 9 баллов по шкале Чайлд-Пью) не требуется. Нет клинических данных о применении алоглиптина у пациентов с тяжелой печеночной недостаточностью (более 9 баллов по шкале Чайлд-Пью).
Другие группы пациентов. Возраст (65-81 лет), пол, раса, масса тела пациентов не оказывали клинически значимого воздействия на фармакокинетические параметры алоглиптина. Коррекции дозы препарата не требуется.
Фармакокинетика у детей и подростков в возрасте до 18 лет не исследовалась.
Показания препарата
Випидия®
Сахарный диабет 2 типа у взрослых для улучшения гликемического контроля при неэффективности диетотерапии и физических нагрузок:
- в качестве монотерапии;
- в сочетании с другими пероральными гипогликемическими средствами или с инсулином.
Режим дозирования
Принимают внутрь.
Препарат Випидия® можно принимать независимо от приема пищи. Таблетки следует проглатывать целиком, не разжевывая, запивая водой.
Рекомендуемая доза препарата Випидия® составляет 25 мг 1 раз/сут в качестве монотерапии или в дополнение к метформину, тиазолидиндиону, производным сульфонилмочевины или инсулину, или в качестве трехкомпонентной комбинации с метформином, тиазолидиндионом или инсулином.
В случае если пациент пропустил прием препарата Випидия®, он должен принять пропущенную дозу как можно быстрее. Недопустим прием двойной дозы препарата Випидия® в один и тот же день.
При назначении препарата Випидия® в дополнение к метформину или тиазолидиндиону дозу последних препаратов следует оставить без изменения.
При комбинировании препарата Випидия® с производным сульфонилмочевины или инсулином дозу последних целесообразно уменьшить для снижения риска развития гипогликемии.
В связи с риском развития гипогликемии следует соблюдать осторожность при назначении трехкомпонентной комбинации препарата Випидия® с метформином и тиазолидиндионом. В случае развития гипогликемии возможно рассмотреть уменьшение дозы метформина или тиазолидиндиона.
Эффективность и безопасность алоглиптина при приеме в тройной комбинации с метформином и производным сульфонилмочевины окончательно не установлены.
Пациенты с почечной недостаточностью
Пациентам с почечной недостаточностью легкой степени (КК от >50 до ≤80 мл/мин) коррекции дозы препарата Випидия® не требуется. У пациентов с почечной недостаточностью средней степени тяжести (КК от ≥30 до ≤50 мл/мин) доза препарата Випидия® составляет 12.5 мг 1 раз/сут.
Алоглиптин не следует применять у пациентов с почечной недостаточностью тяжелой степени и у пациентов с терминальной стадией почечной недостаточности, нуждающихся в гемодиализе (КК <30 мл/мин). Алоглиптин не изучался у пациентов, проходящих перитонеальный диализ.
У пациентов с почечной недостаточностью рекомендуется проводить оценку функции почек до начала лечения препаратом Випидия® и периодически в процессе лечения.
Пациенты с печеночной недостаточностью
Не требуется коррекции дозы препарата Випидия® у пациентов с печеночной недостаточностью легкой и средней степени тяжести (от 5 до 9 баллов по шкале Чайлд-Пью). Препарат не исследовался у пациентов с тяжелой печеночной недостаточностью (более 9 баллов по шкале Чайлд-Пью), поэтому его не следует применять у данной группы пациентов.
Пациенты старше 65 лет
Не требуется коррекции дозы препарата Випидия® у пациентов старше 65 лет. Тем не менее, следует особенно тщательно подбирать дозу алоглиптина в связи с потенциальной возможностью снижения функции почек у данной группы пациентов.
Побочное действие
Определение частоты побочных эффектов препарата: очень часто (≥1/10), часто (≥1/100 и <1/10), нечасто (≥1/1000 и <1/100), редко (≥1/10000 и <1/1000), очень редко (<1/10000), частота не установлена (данные постмаркетинговых наблюдений).
Со стороны нервной системы: часто — головная боль.
Со стороны ЖКТ: часто — боль в эпигастральной области, гастроэзофагеальная рефлюксная болезнь, диарея; частота не установлена — острый панкреатит.
Со стороны печени и желчевыводящих путей: частота не установлена — нарушение функции печени, в т.ч. печеночная недостаточность.
Со стороны кожи и подкожных тканей: часто — зуд, сыпь; частота не установлена — эксфолиативные кожные заболевания, включая синдром Стивенса-Джонсона, многоформная эритема, ангионевротический отек, крапивница, буллезный пемфигоид.
Инфекционные или паразитарные заболевания: часто — инфекции верхних дыхательных путей, назофарингит.
Со стороны иммунной системы: частота не установлена — реакции гиперчувствительности, включая анафилактическую реакцию.
Со стороны обмена веществ и питания: часто — гипогликемия в случае совместного применения с производными сульфонилмочевины или препаратами инсулина.
Со стороны почек и мочевыводящих путей: частота не установлена — интерстициальный нефрит.
Противопоказания к применению
- повышенная чувствительность к алоглиптину или к любому вспомогательному веществу, или серьезные реакции гиперчувствительности к любому ДПП-4 ингибитору в анамнезе, в т.ч. анафилактические реакции, анафилактический шок и ангионевротический отек;
- сахарный диабет 1 типа;
- диабетический кетоацидоз;
- хроническая сердечная недостаточность (функциональный класс III-IV по NYHA);
- тяжелая печеночная недостаточность (более 9 баллов по шкале Чайлд-Пью) из-за отсутствия клинических данных о применении;
- тяжелая почечная недостаточность;
- беременность (в связи с отсутствием клинических данных по применению);
- период грудного вскармливания (в связи с отсутствием клинических данных по применению);
- детский и подростковый возраст до 18 лет (в связи с отсутствием клинических данных по применению).
С осторожностью:
- острый панкреатит в анамнезе;
- у пациентов с почечной недостаточностью средней степени тяжести;
- в комбинации с производным сульфонилмочевины или инсулином;
- прием трехкомпонентной комбинации препарата Випидия® с метформином и тиазолидиндионом.
Применение при беременности и кормлении грудью
Не проводилось исследований применения алоглиптина у беременных женщин. Исследования на животных не показали прямого или непрямого негативного воздействия алоглиптина на репродуктивную систему. Однако в целях предосторожности применение препарата Випидия® при беременности противопоказано.
Отсутствуют данные о проникновении алоглиптина в грудное молоко у человека. Исследования на животных показали, что алоглиптин выделяется с грудным молоком, поэтому нельзя исключить риск возникновения побочных эффектов у грудных детей. В связи с этим применение препарата в период грудного вскармливания противопоказано.
Применение при нарушениях функции печени
Противопоказано применение при тяжелой печеночной недостаточности (более 9 баллов по шкале Чайлд-Пью) из-за отсутствия клинических данных о применении.
Применение при нарушениях функции почек
Противопоказано применение при тяжелой почечной недостаточности.
С осторожностью: у пациентов с почечной недостаточностью средней степени тяжести.
Применение у детей
Противопоказано назначение препарата детям в возрасте до 18 лет.
Применение у пожилых пациентов
Не требуется коррекции дозы препарата у пациентов старше 65 лет. Тем не менее следует особенно тщательно подбирать дозу алоглиптина в связи с потенциальной возможностью снижения функции почек у данной группы пациентов.
Особые указания
Применение с другими гипогликемическими препаратами
С целью уменьшения риска развития гипогликемии рекомендуется снижение дозы производных сульфонилмочевины, инсулина или комбинации пиоглитазона (тиазолидиндиона) с метформином при одновременном применении с препаратом Випидия® (см. «Режим дозирования»).
Неизученные комбинации
Эффективность и безопасность применения препарата Випидия® в комбинации с ингибиторами натрий-зависимых ко-транспортеров глюкозы 2 или аналогами глюкагоноподобного пептида и в тройной комбинации с метформином и производными сульфонилмочевины не исследовались.
Почечная недостаточность
Т.к. пациентам с почечной недостаточностью средней степени тяжести требуется проводить коррекцию дозы препарата Випидия®, рекомендуется проводить оценку функции почек до начала и периодически в течение лечения (см. «Режим дозирования»).
Опыт применения алоглиптина у пациентов, находящихся на гемодиализе, ограничен. Препарат Випидия® не следует применять у пациентов с тяжелой почечной недостаточностью, а также у пациентов с терминальной стадией хронической почечной недостаточности, требующей гемодиализа (см. «Режим дозирования»). Алоглиптин не изучался у пациентов, проходящих перитонеальный диализ.
Острый панкреатит
Применение ингибиторов ДПП-4 связано с потенциальным риском развития острого панкреатита. В обобщенном анализе 13 клинических исследований применения алоглиптина в дозе 25 мг/сут, 12.5 мг/сут, препарата сравнения и плацебо частота развития острого панкреатита составила 2, 1, 1 или 0 случаев на 1000 пациенто-лет в каждой группе соответственно. В исследовании сердечно-сосудистых исходов частота выявления острого панкреатита у пациентов, проходивших лечение алоглиптином или плацебо, составила 3 и 2 случая на 1000 пациенто-лет соответственно. Пациенты должны быть проинформированы о характерных симптомах острого панкреатита: стойкая сильная боль в животе, которая может иррадиировать в спину. При подозрении на развитие острого панкреатита прием препарата Випидия® прекращают; при подтверждении острого панкреатита прием препарат не возобновляют. Нет данных о том, существует ли повышенный риск развития панкреатита на фоне приема препарата Випидия® у пациентов с панкреатитом в анамнезе. Поэтому при применении препарата у пациентов с панкреатитом в анамнезе следует соблюдать осторожность.
Печеночная недостаточность
Были получены постмаркетинговые сообщения о нарушениях функции печени, включая печеночную недостаточность при приеме алоглиптина. Их связь с применением препарата не была установлена. Однако пациентов необходимо тщательно обследовать на наличие возможных отклонений функции печени. Если обнаружены отклонения в функции печени и альтернативная этиология их возникновения не установлена, следует рассмотреть возможность прекращения лечения препаратом.
Буллезный пемфигоид
В пострегистрационном периоде наблюдения были получены сообщения о буллезном пемфигоиде у пациентов, принимающих ингибиторы ДПП-4, включая алоглиптин. При подозрении на буллезный пемфигоид применение препарата должно быть прекращено.
Влияние на способность к управлению транспортными средствами и механизмами
Випидия® не оказывает или оказывает незначительное влияние на способность управлять транспортными средствами и механизмами. Тем не менее, следует учитывать риск развития гипогликемии при применении препарата в сочетании с другими гипогликемическими препаратами (производные сульфонилмочевины, инсулин или комбинированная терапия с пиоглитазоном и метформином) и соблюдать осторожность при управлении транспортными средствами и механизмами.
Передозировка
Максимальная доза алоглиптина в клинических исследованиях составляла 800 мг/сут у здоровых добровольцев и 400 мг/сут у пациентов с сахарным диабетом 2 типа в течение 14 дней. Это в 32 и 16 раз, соответственно, превышает рекомендуемую суточную дозу 25 мг алоглиптина. Какие-либо серьезные нежелательные явления при приеме препарата в этих дозах отсутствовали.
Лечение: при передозировке может быть рекомендовано промывание желудка и симптоматическое лечение. Алоглиптин слабо диализируется. В клинических исследованиях только 7% дозы удалялось из организма в течение 3-часового сеанса диализа. Данных об эффективности перитонеального диализа алоглиптина нет.
Лекарственное взаимодействие
Влияние других лекарственных препаратов на алоглиптин
Алоглиптин в основном выводится из организма в неизмененном виде почками, и в незначительной степени метаболизируется ферментной системой цитохрома CYP450.
В исследованиях по взаимодействию с другими лекарственными средствами на фармакокинетику алоглиптина не оказывали клинически значимого эффекта следующие препараты: гемфиброзил (ингибитор CYP2C8/9), флуконазол (ингибитор CYP2C9), кетоконазол (ингибитор CYP3A4), циклоспорин (ингибитор Р-гликопротеина), ингибитор α-глюкозидазы, дигоксин, метформин, циметидин, пиоглитазон или аторвастатин.
Влияние алоглиптина на другие лекарственные препараты
В исследованиях in vitro показано, что алоглиптин не ингибирует и не индуцирует изоферменты CYP450 в концентрациях, достигаемых при приеме алоглиптина в рекомендуемой дозе 25 мг. Взаимодействия с изоферментами CYP450 не ожидается, и выявлено не было.
В исследованиях in vitro выявлено, что алоглиптин не является ни субстратом, ни ингибитором ОАТ1, ОАТ3 и ОСТ2. Кроме того, данные клинических исследований не указывают на взаимодействие с ингибиторами или субстратами Р-гликопротеина.
В клинических исследованиях по взаимодействию с другими лекарственными средствами алоглиптин не оказывал клинически значимого влияния на фармакокинетику следующих препаратов: кофеина, (R)- и (S)-варфарина, пиоглитазона, глибенкламида, толбутамида, декстрометорфана, аторвастатина, мидазолама, пероральных контрацептивов (норэтиндрон и этинилэстрадиол), дигоксина, фексофенадина, метформина или циметидина. Основываясь на этих данных, алоглиптин не ингибирует изоферменты системы цитохрома CYP1A2, CYP3A4, CYP2D6, CYP2C9, Р-гликопротеин и ОСТ2.
Алоглиптин не влиял на протромбиновый индекс или MHO у здоровых добровольцев при одновременном приеме с варфарином.
При одновременном приеме алоглиптина в комбинации с метформином, или пиоглитазоном (тиазолидиндион), или ингибитором α-глюкозидазы, или глибенкламидом (производное сульфонилмочевины) не наблюдалось клинически значимого фармакокинетического взаимодействия.
Условия хранения препарата Випидия®
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°С.
Срок годности препарата Випидия®
Срок годности — 3 года. Не применять по истечении срока годности.
Условия реализации
Препарат отпускают по рецепту.
Контакты для обращений
ШТАДА
(Россия)

|
|
Московский офис STADA |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. ВОЗМОЖНЫ ПОБОЧНЫЕ ЭФФЕКТЫ. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА.АллергияАртритДерматитПри аллергииРевматоидный артрит
Автор статьи
Подойницына Алёна Андреевна
,
Диплом о фармацевтическом образовании: 105924 3510722 рег. номер 31917
Все авторы
Содержание статьи
- Дипромета: состав
- Укол Дипромета: от чего помогает
- Дипромета: противопоказания
- Дипромета и алкоголь: совместимость
- Краткое содержание
- Задайте вопрос эксперту по теме статьи
Общеизвестный факт: с годами работа костно-мышечного аппарата нарушается. Наиболее частое явление в четвертой и пятой декадах жизни – остеоартроз. Считается, что к 80 годам жизни патология развивается у каждого человека. Болезнь представляет собой поражение или разрушение суставного хряща, типичные симптомы которого: боль, скованность движений и припухлость. Терапия остеоартроза включает в себя лечебную физкультуру, реабилитацию и обезболивающие препараты. Иногда приходится прибегать к введению противовоспалительных лекарств внутрь пораженных суставов.
Провизор расскажет о препарате Дипромета: ознакомит с его составом, показаниями и к применению, противопоказаниями и совместимостью с алкоголем.
Дипромета: состав
Дипломета – суспензия для инъекций. Действующее вещество препарата – бетаметазон, относящийся к стероидным гормонам с выраженной противовоспалительной, противоаллергической и иммунодепрессивной активностью.
В состав вспомогательных компонентов входят: натрия гидрофосфат, бензиловый спирт, натрия хлорид и кармеллоз, динатрия эдетат, вода для инъекций и другие ингредиенты.
Укол Дипромета: от чего помогает
Препарат Дипромета применяется в качестве дополнительного лечения при ряде заболеваний с целью снятия воспаления, боли и отека. При аутоиммунных состояниях (поражении иммунной системой собственных тканей организма) важен эффект подавления иммунитета, который оказывают уколы Дипромета. Например, иммунодепрессивная терапия – основа для лечения ревматоидного артрита и системной красной волчанки.
Как сообщает инструкция по применению, уколы Дипромета показаны при заболеваниях:
- Костно-мышечной системы и мягких тканей: ревматоидного артрита, остеоартроза, бурсита;
- Аллергического происхождения: сенной лихорадке, лекарственной аллергии, сезонном и круглогодичном рините;
- Кожи: атопическим дерматите, нейродермите, дискоидной красной волчанке, псориазе;
- Соединительной ткани: системной красной волчанке, склеродермии, дерматомиозите;
- Коры надпочечников: недостаточности функций органа;
- Иного происхождения, требующих терапии глюкокортикостероидами.
Препарат Дипромета имеет несколько путей введения: глубоко в мышцу, суставную сумку и полость сустава, мягкие ткани около сустава, внутрь кожи или в очаг поражения. Наиболее частое применение суспензии Дипромета – уколы в сустав для снятия боли и воспаления, а также увеличения его подвижности.
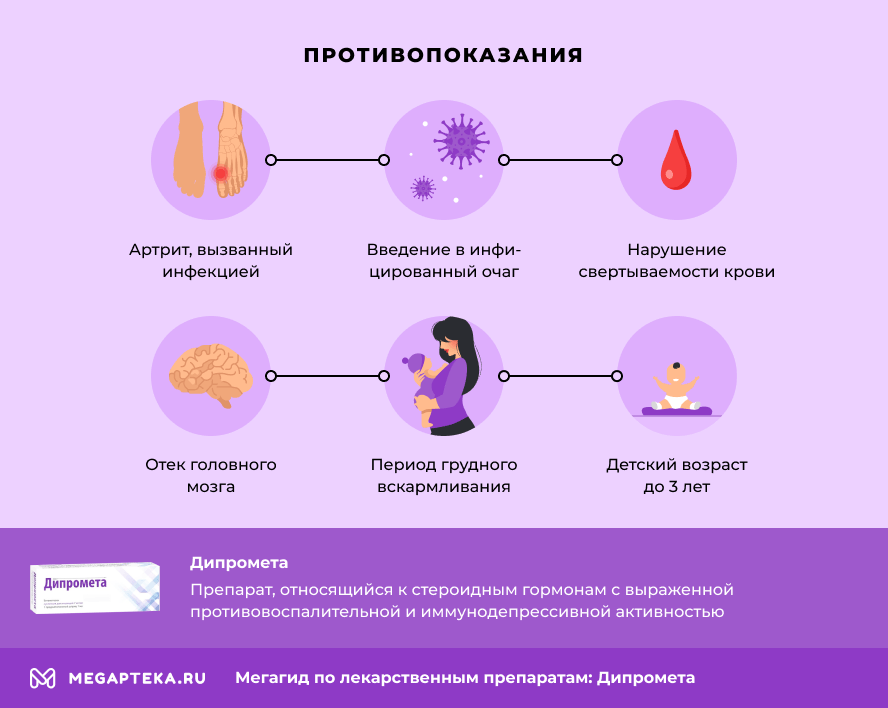
Дипромета: противопоказания
- Повышенная чувствительность к компонентам препарата;
- Системные грибковые поражения;
- Введение внутривенно, подкожно, эпидурально и интратекально;
- Введение в сухожилие и межпозвоночное пространство;
- Нестабильный сустав;
- Артрит, вызванный инфекцией;
- Введение в инфицированный очаг;
- Нарушение свертываемости крови;
- Одновременное введение с живыми или ослабленными вакцинами;
- Тромбоцитопеническая пурпура;
- Отек головного мозга;
- Период грудного вскармливания;
- Детский возраст до 3 лет.
Дипромета и алкоголь: совместимость
На время лечения рекомендуется воздержаться от употребления спиртных напитков. Алкоголь усиливает побочные действия Дипромета: повышает риск развития язвы желудка, провоцирует появление судорог, а также увеличивает внутричерепное и внутриглазное давление.
Хотите разбираться в аналогах лекарств, чтобы умело подбирать препараты на свой бюджет? Наша методичка от экспертов-провизоров «Аналоги популярных лекарств» поможет вам в этом! Получить методичку просто: подпишитесь на наши соцсети и напишите в сообщения «аналоги».
Мегаптека в соцсетях: ВКонтакте, Telegram, OK
Краткое содержание
- Действующее вещество препарата – бетаметазон, относящийся к стероидным гормонам с выраженной противовоспалительной, противоаллергической и иммунодепрессивной активностью.
- Препарат Дипромета применяется в качестве дополнительного лечения при ряде заболеваний с целью снятия воспаления, боли и отека.
- Дипромета имеет противопоказания и побочные действия.
- На время лечения рекомендуется воздержаться употребления спиртных напитков.
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же вы можете поделиться своим опытом с другими читателями Мегасоветов.
Поделиться мегасоветом
Понравилась статья? Расскажите маме, папе, бабушке и тете Гале из третьего подъезда
Описание препарата Пролиа® (раствор для подкожного введения, 60 мг/мл) основано на официальной инструкции, утверждено компанией-производителем в 2019 году
Дата согласования: 03.10.2019
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Отзывы
Действующее вещество
ATX
Фармакологическая группа
Состав
| Раствор для подкожного введения | 1 мл |
| каждый предварительно заполненный шприц (ПЗШ) содержит | |
| активное вещество: | |
| деносумаб | 60 мг |
| вспомогательные вещества: сорбитол (Е420) — 47 мг; уксусная кислота ледяная — 1 мг; полисорбат 20 — 0,1 мг; натрия гидроксид — до рН 5–5,5; вода для инъекций — до 1 мл |
Описание лекарственной формы
Прозрачная жидкость, от бесцветного до светло-желтого цвета, практически свободная от видимых включений.
Фармакологическое действие
Фармакологическое действие
—
корректирующее метаболизм костной и хрящевой ткани.
Фармакодинамика
Механизм действия. Деносумаб представляет собой полностью человеческое моноклональное антитело (IgG2), обладающее высокой аффинностью и специфичностью к RANKL (лиганд к рецептору RANK), и тем самым препятствует активации этих рецепторов RANK на поверхности остеокластов и их предшественников. Предотвращение связывания лиганда RANK с рецептором RANK ингибирует созревание, функционирование и выживаемость остеокластов, что уменьшает костную резорбцию в кортикальном и губчатом слое кости.
Фармакодинамические эффекты.Терапия препаратом Пролиа® приводила к быстрому снижению скорости ремоделирования костной ткани, достигая минимальных (снижение на 85%) показателей концентрации маркера резорбции костной ткани — сывороточных С-телопептидов (СТХ) I типа в течение 3 дней. Снижение концентрации СТХ сохранялось в интервале между введениями препарата. В конце каждого интервала дозирования степень снижения концентрации СТХ частично нивелировалась приблизительно до ≥45% по сравнению с максимальным снижением концентрации СТХ ≥87% (диапазон — 45–80%), что отражает обратимость эффектов препарата Пролиа® в отношении костного метаболизма при снижении концентрации препарата в сыворотке. Эти эффекты сохранялись на протяжении всего периода терапии. Концентрации маркеров костной резорбции обычно достигали исходных значений, наблюдавшихся до начала терапии, в течение 9 мес после введения последней дозы препарата. После возобновления терапии препаратом степень снижения концентрации СТХ была сходна со степенью снижения концентрации СТХ в начале курса лечения деносумабом.
Иммуногенность. В клинических исследованиях не наблюдалось продукции нейтрализующих антител к деносумабу. Используя метод чувствительного иммунологического анализа, было показано, что у <1% пациентов, получавших деносумаб на протяжении до 5 лет, регистрировались ненейтрализующие связывающие антитела при отсутствии признаков изменения параметров фармакокинетики, токсичности или клинического ответа.
Дети. Европейское агентство по оценке ЛС отказалось от требования предоставить результаты исследований препарата Пролиа® во всех субпопуляциях пациентов детского возраста для лечения потери костной массы, на фоне аблативной терапии половыми гормонами, а также в субпопуляции детей в возрасте младше 2 лет для лечения остеопороза. Информация о применении препарата у детей приведена в разделе «Способ применения и дозы».
Фармакокинетика
Всасывание. После п/к введения в дозе 1 мг/кг, приблизительно соответствующей зарегистрированной дозе 60 мг, значения AUC составили 78% по сравнению с в/в введением препарата в той же дозе. При п/к введении препарата в дозе 60 мг Cmax деносумаба в сыворотке крови составляла 6 мкг/мл (диапазон — 1–17 мкг/мл) и достигалась в течение 10 дней (диапазон — 2–28 дней).
Метаболизм. Деносумаб состоит только из аминокислот и углеводов в виде нативного Ig, и элиминация с помощью печеночных метаболических механизмов маловероятна. Поэтому предполагается, что выведение препарата происходит стандартными путями расщепления Ig, результатом которых является распад до малых пептидов и отдельных аминокислот.
Выведение. После достижения Cmax деносумаба в сыворотке крови концентрация препарата снижается с T1/2 26 дней (размах вариации — 6–52 дня) в течение 3 мес (диапазон — 1,5–4,5 мес). У 53% пациентов через 6 мес после введения последней дозы деносумаба его концентрация в крови не поддавалась количественному определению. Не наблюдалось кумулирования препарата или изменения параметров фармакокинетики с течением времени при п/к многократном введении деносумаба в дозе 60 мг в течение 6 мес. Продукция связывающих антител к деносумабу, аналогичная как у мужчин, так и у женщин, не оказывала влияния на параметры фармакокинетики деносумаба. Возраст (28–87 лет), раса и стадия заболевания (низкая костная масса, остеопороз, рак предстательной железы или рак молочной железы) не оказывают значительного влияния на параметры фармакокинетики деносумаба. Наблюдалась тенденция к снижению экспозиции препарата (AUC и Cmax) с повышением массы тела. Однако данная тенденция не расценивалась как клинически значимая, поскольку фармакодинамические эффекты (оценка которых осуществлялась по значениям концентраций маркеров метаболизма костной ткани и повышения МПКТ) были аналогичны в широком диапазоне значений массы тела.
Линейность фармакокинетики. В исследованиях применения деносумаба в различных дозах была продемонстрирована нелинейная дозозависимая фармакокинетика, со снижением клиренса препарата при увеличении дозы или концентрации; однако приблизительно дозопропорциональное увеличение экспозиции наблюдалось при применении доз 60 мг и выше.
Отдельные группы пациентов
Дети. Фармакокинетика препарата у детей не оценивалась.
Почечная недостаточность. В исследовании у 55 пациентов с различной степенью тяжести почечной дисфункции, включая пациентов, получавших диализную терапию, было показано, что степень выраженности почечной недостаточности не влияла на параметры фармакокинетики деносумаба.
Печеночная недостаточность. Не проводилось специальных исследований у пациентов с печеночной недостаточностью. Как правило, моноклональные антитела не выводятся при помощи печеночных метаболических механизмов. Предполагается, что печеночная недостаточность не оказывает влияния на параметры фармакокинетики деносумаба.
Показания
лечение постменопаузного остеопороза и остеопороза у мужчин при повышенном риске переломов. У женщин в постменопаузе Пролиа® значительно снижает риск вертебральных, невертебральных переломов и переломов бедра;
лечение потери костной массы у женщин, получающих терапию ингибиторами ароматазы по поводу рака молочной железы, и мужчин с раком предстательной железы, получающих гормондепривационную терапию, при повышенном риске переломов. У мужчин с раком предстательной железы, получающих гормондепривационную терапию, Пролиа® значительно снижает риск вертебральных переломов;
лечение потери костной массы, связанной с длительной терапией системными глюкокортикоидами, у взрослых пациентов при повышенном риске переломов.
Противопоказания
гиперчувствительность к любому из компонентов препарата;
гипокальциемия (см. «Особые указания»);
беременность;
период грудного вскармливания;
детский возраст до 18 лет.
Применение при беременности и кормлении грудью
Данные о применении деносумаба в период беременности ограничены. В исследованиях на животных была продемонстрирована репродуктивная токсичность препарата. Препарат Пролиа® не следует применять в период беременности и репродуктивном периоде у женщин, не использующих контрацептивы. Женщинам рекомендуется избегать наступления беременности во время терапии и минимум 5 мес после завершения терапии препаратом. Любые эффекты препарата Пролиа®, вероятно, будут более выражены в течение II и III триместров беременности, поскольку моноклональные антитела проникают через плаценту, и степень их проникновения линейно возрастает по мере увеличения срока беременности, а наибольшие значения отмечаются в течение III триместра.
Неизвестно, проникает ли деносумаб в грудное молоко. В исследованиях на генетически модифицированных мышах с выключенным геном RANKL («нокаутные мыши») было показано, что отсутствие RANKL (мишени деносумаба; см. «Фармакодинамика») в период беременности может оказывать влияние на созревание молочных желез, приводя к нарушению лактации в послеродовом периоде. Решение о необходимости прекращения грудного кормления или прекращения терапии препаратом Пролиа® следует принимать с учетом пользы грудного кормления для ребенка и пользы терапии для матери.
Влияние на фертильность. Данные о влиянии деносумаба на фертильность у человека отсутствуют. Исследования на животных не продемонстрировали прямого или косвенного негативного влияния препарата на фертильность.
Способ применения и дозы
П/к. Введение препарата должно осуществляться лицом, обученным технике выполнения инъекции. Особые меры предосторожности при применении и утилизации — см. «Особые указания».
Доза. Рекомендуемая доза препарата Пролиа® составляет 60 мг, которая вводится путем п/к инъекции 1 раз в 6 мес в бедро, живот или плечо. Во время курса лечения необходимо принимать препараты кальция и витамина D в адекватных дозах (см. «Особые указания»). Оптимальная длительность терапии остеопороза антирезорбтивными препаратами (деносумаб и бисфосфонаты) не установлена. Необходимость продолжения терапии периодически должна переоцениваться с учетом пользы и потенциальных рисков применения деносумаба у каждого конкретного пациента, и в частности через 5 лет и более после начала применения препарата (см. «Особые указания»).
Особые группы пациентов
Дети. Применение препарата Пролиа® у детей (в возрасте до 18 лет) не рекомендуется, поскольку безопасность и эффективность препарата у данной возрастной группы пациентов не установлены. Ингибирование лиганда RANK/RANK (RANKL) в исследованиях на животных ассоциировалось с ингибированием роста костей и отсутствием прорезывания зубов.
Пожилые пациенты (в возрасте ≥65 лет). Коррекции дозы препарата у пожилых пациентов не требуется.
Нарушение функции почек. Не требуется коррекции дозы препарата у пациентов с нарушением функции почек (рекомендации по мониторингу концентрации кальция — см. «Особые указания»). Отсутствуют данные о применении препарата у пациентов с тяжелым нарушением функции почек (СКФ <30 мл/мин) и получающих длительную терапию системными глюкокортикоидами.
Нарушение функции печени. Безопасность и эффективность использования деносумаба у пациентов с нарушением функции печени не установлены (см. «Фармакокинетика»).
Инструкция по использованию предварительно заполненных шприцев с препаратом Пролиа®
Необходимо прочитать данную инструкцию перед использованием препарата Пролиа® в предварительно заполненном шприце с защитным устройством для иглы:
— очень важно, чтобы перед тем, как пациент приступит к самостоятельным инъекциям, его лечащий врач или медицинская сестра подробно проинструктировали его по технике выполнения инъекции;
— Пролиа® вводится п/к (п/к инъекция);
— следует сообщить врачу, если у пациента есть аллергия на латекс (колпачок иглы предварительно заполненного шприца состоит из производного латекса);
— не снимать серый колпачок с иглы предварительно заполненного шприца, пока пациент не готов к инъекции;
— не использовать предварительно заполненный шприц, если он упал на твердую поверхность. Использовать новый предварительно заполненный шприц и сообщить об этом лечащему врачу или медицинской сестре;
— не пытаться активировать защитное устройство предварительно заполненного шприца перед инъекцией;
— не пытаться снять прозрачное защитное устройство с предварительно заполоненного шприца перед инъекцией.
В случае возникновения вопросов по применению препарата следует обращаться к лечащему врачу или медицинской сестре.
Шаг 1. Подготовка шприца
А. Извлечь контурную ячейковую упаковку с предварительно заполненным шприцем из упаковки и подготовить все необходимое для инъекции: спиртовые салфетки, ватный тампон или марлевую салфетку, пластырь и контейнер для острых отходов (не включены в упаковку).
Для более комфортной инъекции оставить предварительно заполненный шприц при комнатной температуре в течение примерно 30 мин перед инъекцией. Тщательно вымыть руки с мылом. Расположить предварительно заполненный шприц и другие необходимые расходные материалы на чистой, хорошо освещенной поверхности.
Не пытаться подогревать шприц в горячей воде или микроволновой печи.
Не оставлять предварительно заполненный шприц под прямыми солнечными лучами.
Не встряхивать предварительно заполненный шприц.
Хранить предварительно заполненный шприц в недоступном для детей месте.
B. Открыть контурную ячейковую упаковку, потянув за этикетку. Для извлечения предварительно заполненного шприца из контурной ячейковой упаковки взяться за защитное устройство.
Взять шприц, как показано на рисунке.
В целях безопасности:
— не браться за плунжер;
— не браться за серый колпачок иглы.
С. Проверить препарат и предварительно заполненный шприц.
Не использовать предварительно заполненный шприц, если:
— препарат мутный или содержит посторонние частицы. Раствор должен быть прозрачным, бесцветным или светло-желтым;
— любая из частей повреждена или сломана;
— серый колпачок иглы отсутствует или неплотно надет;
— истек последний день указанного на этикетке месяца срока годности.
Сообщить лечащему врачу или медицинской сестре обо всех перечисленных случаях.
Шаг 2. Подготовка места инъекции
А. Тщательно вымыть руки. Подготовить и обработать место инъекции.
Для инъекции можно использовать верхнюю часть бедра; живот, за исключением области вокруг пупка, примерно 5 см; наружную поверхность плеча (только если инъекцию пациенту делает кто-то другой).
Обработать место инъекции смоченным в спирте тампоном. Дать коже высохнуть.
Не дотрагиваться до места инъекции перед инъекцией.
Не использовать для инъекций области, где кожа тонкая, с гематомой, покрасневшая или жесткая. Избегать инъекций в области со шрамами или растяжками.
B. Осторожно потянуть серый колпачок с иглы без скручивания, по направлению от корпуса шприца.
С. Зажать место инъекции для получения упругой поверхности. Важно удерживать кожу зажатой при проведении инъекции.
Шаг 3. Введение
А. Зажать кожу, ввести иглу в кожу. Не дотрагиваться до обработанной области инъекции.
В. Медленно и плавно надавливать на поршень до тех пор, пока пациент не почувствует или не услышит щелчок. Важно надавливать на поршень до щелчка для введения всей дозы.
С. Отпустить большой палец, затем извлечь шприц из кожи. После того, как пациент отпустит поршень, защитное устройство предварительно заполненного шприца покроет иглу. Не надевать серый колпачок иглы обратно на предварительно заполненный шприц.
Шаг 4. Окончание
А. Выбросить использованный предварительно заполненный шприц и другие сопутствующие материалы в контейнер для острых отходов. Лекарственные препараты должны быть утилизированы в соответствии с надлежащими требованиями. Спросить у врача или провизора, как уничтожить препарат, если он больше не требуется, не нанося ущерба окружающей среде. Эти меры помогут защитить окружающую среду. Хранить шприцы и сопутствующие материалы в недоступном для детей месте.
Не использовать предварительно заполненный шприц повторно.
Не сдавать предварительно заполненный шприц на переработку и не выбрасывать его с бытовым мусором.
В. Осмотреть место инъекции. Если в месте инъекции выступит кровь, прижать к нему ватный тампон или бинт. Не растирать место инъекции. При необходимости заклеить место инъекции пластырем.
Инструкция по введению препарата Пролиа® в ПЗШ
Здесь приводится информация по правильному проведению инъекции предварительно заполненным шприцем. Очень важно, чтобы перед тем, как пациент приступит к самостоятельным инъекциям, лечащий врач, медицинская сестра подробно проинструктировали пациента по технике выполнения инъекции. Необходимо тщательно вымыть руки перед выполнением инъекции. При возникновении вопросов по технике выполнения инъекции, следует обратиться к лечащему врачу или медицинской сестре.
Перед началом инъекции: внимательно прочитать все инструкции перед использованием предварительно заполненного шприца.
Не использовать ПЗШ, если колпачок был удален.
Как использовать ПЗШ для п/к инъекций?
Пациент должен ввести все содержимое ПЗШ Пролиа® (1 мл) однократно и повторить инъекцию через 6 мес, как назначено лечащим врачом.
Оборудование
Для самостоятельной инъекции пациенту потребуется:
1. Новый предварительно заполненный шприц с препаратом Пролиа®.
2. Спиртовые салфетки или подобные материалы.
Что необходимо сделать до самостоятельного введения Пролиа® п/к?
1. Достать шприц из холодильника. Не брать предварительно заполненный шприц за поршень или защитный колпачок, это может повредить устройство.
2. Предварительно заполненный шприц оставить вне холодильника для достижения комнатной температуры. Это позволит сделать инъекцию более комфортной. Не подогревать предварительно заполненный шприц каким-либо другим способом (например, в микроволновой печи или горячей воде). Не оставлять шприц под прямыми солнечными лучами.
3. Не встряхивать предварительно заполненный шприц.
4. Не снимать колпачок с предварительно заполненного шприца до тех пор, пока пациент не готов к инъекции.
5. Проверить срок годности предварительно заполненного шприца на упаковке. Не использовать предварительно заполненный шприц, если истек последний день указанного на этикетке месяца срока годности.
6. Проверить внешний вид препарата Пролиа®. Раствор должен быть прозрачным, бесцветным или светло-желтым. Если раствор помутнел или окрашен иначе, препарат использовать нельзя.
7. Выбрать комфортное, хорошо освещенное место и чистую поверхность, где можно удобно расположить все необходимые материалы.
8. Тщательно вымыть руки.
Как правильно выбрать место для инъекции?
Лучше всего делать инъекции в верхнюю часть бедра и живот. Если инъекции делает кто-то другой, можно использовать наружную поверхность плеча.
Как правильно сделать инъекцию?
1. Продезинфицировать место инъекции с помощью спиртовой салфетки.
2. Во избежание загиба иглы, аккуратно потянуть колпачок с иглы сразу без скручивания, как показано на рисунках. Не дотрагиваться до иглы и не нажимать на поршень.
3. Если внутри предварительно заполненного шприца видны маленькие пузырьки воздуха, нет необходимости удалять их перед инъекцией. Введение раствора с пузырьками воздуха является безопасным.
4. Зажать кожу (не сдавливая) между большим и указательным пальцами. Ввести иглу в кожу полностью, как показывал доктор или медицинская сестра.
5. Медленно и плавно надавливать на поршень, одновременно придерживая кожную складку. Надавливать на поршень следует до тех пор, пока шприц не опустеет.
6. Извлечь иглу из кожи и отпустить кожную складку.
7. Если выступит кровь в месте инъекционного прокола, аккуратно стереть ее ватным тампоном или салфеткой. Не растирать место инъекции. При необходимости заклеить место инъекции пластырем.
8. Использовать 1 ПЗШ только для одной инъекции. Не использовать оставшийся в шприце препарат.
При возникновении проблем обратиться за помощью или советом к лечащему врачу или медицинской сестре.
Уничтожение использованных шприцев
Не надевать обратно колпачок на использованный шприц.
Хранить использованный шприц в недоступном для детей месте.
Использованный шприц должен быть утилизирован в соответствии с надлежащими требованиями.
Спросить у врача или провизора, как уничтожить препарат, если он больше не требуется, не нанося ущерба окружающей среде.
Побочные действия
Заключение по профилю безопасности препарата
К наиболее частым побочным действиям (отмечавшимися более чем у одного из 10 пациентов) относятся скелетно-мышечные боли и боли в конечностях. Сообщалось о нечастых случаях воспаления подкожно-жировой клетчатки и редких случаях гипокальциемии, гиперчувствительности, остеонекроза челюсти и атипичных переломах бедренной кости (см. «Особые указания» и «Описание отдельных нежелательных реакций»).
Табличный перечень нежелательных реакций
Нежелательные реакции, выявленные в клинических исследованиях II и III фазы у пациентов с остеопорозом и раком молочной железы или раком простаты, получавших гормондепривационную терапию, а также спонтанные сообщения, представлены в таблице ниже. Нежелательные реакции представлены согласно классификации (см. таблицу): очень часто — ≥1/10; часто — ≥1/100 и <1/10; нечасто —≥1/1000 и <1/100; редко — ≥1/10000 и <1/1000; очень редко — <1/10000.
Таблица
Нежелательные реакции, отмечавшиеся у пациентов с остеопорозом и раком молочной железы или раком предстательной железы, получавших гормондепривационную терапию
| Класс системы органов по классификации MedDRA | Частота | Нежелательная реакция |
| Инфекции и инвазии | Часто | Инфекции мочевыводящих путей |
| Часто | Инфекции верхних дыхательных путей | |
| Нечасто | Дивертикулит1 | |
| Нечасто | Воспаление подкожно-жировой клетчатки1 | |
| Нечасто | Инфекции уха | |
| Со стороны иммунной системы | Редко | Реакции гиперчувствительности1 |
| Редко | Анафилактическая реакция1 | |
| Со стороны обмена веществ и питания | Редко | Гипокальциемия1 |
| Со стороны нервной системы | Часто | Ишиас |
| Со стороны ЖКТ | Часто | Запор |
| Часто | Дискомфорт в животе | |
| Со стороны кожи и подкожной клетчатки | Часто | Сыпь |
| Часто | Экзема | |
| Со стороны костно-мышечной системы и соединительной ткани | Очень часто | Боль в конечностях |
| Очень часто | Скелетно-мышечная боль1 | |
| Редко | Остеонекроз челюсти (ОНЧ)1 | |
| Редко | Атипичный перелом бедренной кости1 | |
| Нечасто | Множественные переломы позвоночника (МПП) вследствие отмены лечения препаратом Пролиа®1 | |
| Неизвестно | Остеонекроз наружного слухового прохода2 |
1См. «Описание отдельных нежелательных реакций».
2См. «Особые указания».
В обобщенном анализе данных всех плацебо-контролируемых исследований II и III фазы, сообщалось о развитии гриппоподобного заболевания с частотой 1,2% в группе с деносумабом и 0,7% — в группе плацебо. Этот дисбаланс был установлен в обобщенном анализе данных и не был обнаружен при стратифицированном анализе.
Описание отдельных нежелательных реакций
Гипокальциемия. В двух плацебо-контролируемых исследованиях III фазы у женщин с постменопаузным остеопорозом, приблизительно у 0,05% пациентов (2 из 4050) снижалась концентрация кальция в сыворотке крови (<1,88 ммоль/л) после введения препарата Пролиа®. Не сообщалось о снижении концентрации кальция в сыворотке крови (ниже 1,88 ммоль/л) в двух плацебо-контролируемых клинических исследованиях III фазы у пациентов, получавших гормондепривационную терапию, или в плацебо-контролируемом клиническом исследовании III фазы у мужчин с остеопорозом. В постмаркетинговых исследованиях отмечались редкие случаи тяжелой симптоматической гипокальциемии, преимущественно у пациентов с повышенным риском развития гипокальциемии, получавших препарат Пролиа®; при этом большинство случаев отмечалось в течение первых недель после начала терапии. Примерами клинических проявлений тяжелой симптоматической гипокальциемии являются удлинение интервала QT, тетания, судорожные припадки и изменение психического статуса (см. «Особые указания»). Симптомами гипокальциемии в исследованиях деносумаба являлись парестезия или скованность мышц, мышечные подергивания, спазмы или судорожные сокращения мышц.
Инфекции кожи. Частота сообщений о развитии инфекций кожи в плацебо-контролируемых клинических исследованиях III фазы была идентична у женщин с постменопаузным остеопорозом (в группе лечения препаратом Пролиа® — 1,5%; 59 из 4050, в группе плацебо — 1,2%; 50 из 4041); у мужчин с остеопорозом (в группе плацебо — 0,8%; 1 из 120; в группе с препаратом — 0%; 0 из 120); у пациентов с раком молочной железы и раком предстательной железы, получающих гормондепривационную терапию (в группе плацебо — 1,7%; 14 из 845; в группе лечения препаратом Пролиа®— 1,4%; 12 из 860). Кожные инфекции, требующие госпитализации, были отмечены у 0,1% (3 из 4041) пациентов с постменопаузным остеопорозом в группе плацебо и у 0,4% (16 из 4050) пациентов в группе лечения препаратом Пролиа®. Преимущественно это были случаи воспаления подкожно-жировой клетчатки. О серьезных случаях инфекций кожи сообщалось со сходной частотой в группах плацебо (0,6%; 5 из 845) и группах лечения препаратом Пролиа® (0,6%; 5 из 860) в исследованиях рака молочной железы и рака предстательной железы.
ОНЧ. Отмечались редкие случаи ОНЧ: у 16 из включенных 23148 пациентов, принимавших участие в клинических исследованиях применения препарата у пациентов с остеопорозом, раком молочной железы или раком предстательной железы, получавших гормондепривационную терапию (см. «Особые указания»). 13 из этих случаев ОНЧ отмечались у женщин с постменопаузным остеопорозом, участвовавших в расширенном клиническом исследовании III фазы и продолжавших терапию препаратом Пролиа® в течение до 10 лет. Частота ОНЧ составила 0,04% — в течение 3 лет; 0,06% — в течение 5 лет и 0,44% — в течение 10 лет терапии препаратом Пролиа®. Риск развития ОНЧ возрастал по мере увеличения длительности терапии препаратом Пролиа®.
Атипичные переломы бедренной кости. В клинических исследованиях остеопороза у пациентов в группе лечения, получавшей препарат Пролиа®, были зарегистрированы редкие случаи атипичных переломов бедренной кости (см. «Особые указания»).
МПП вследствие отмены лечения препаратом Пролиа®. В клинических исследованиях остеопороза зарегистрированы случаи МПП вследствие отмены лечения препаратом Пролиа®, в особенности у пациентов с переломами позвоночника в анамнезе.
Дивертикулит. В плацебо-контролируемом клиническом исследовании III фазы у пациентов с раком предстательной железы, получавших гормондепривационную терапию, отмечен дисбаланс в сообщениях о развитии дивертикулита (1,2% — в группе лечения деносумабом, 0% — в группе плацебо). Частота развития дивертикулита была сравнима в группах исследований, включавших женщин в постменопаузе или мужчин с остеопорозом, а также у женщин, получавших терапию ингибиторами ароматазы по причине неметастатического рака молочной железы.
Реакции гиперчувствительности. В постмаркетинговых исследованиях у пациентов, получающих препарат Пролиа® в пострегистрационном периоде, редко сообщалось о реакциях гиперчувствительности, связанных с препаратом, включая сыпь, крапивницу, отек лица, эритему и анафилактические реакции.
Скелетно-мышечная боль. Скелетно-мышечные боли, в т.ч. тяжелые, отмечались у пациентов, получавших препарат Пролиа®, в постмаркетинговых исследованиях. В клинических исследованиях скелетно-мышечные боли регистрировались очень часто, как в группе лечения деносумабом, так и в группе плацебо. Скелетно-мышечная боль, приводившая к досрочному завершению участия в исследовании, отмечалась нечасто.
Использование в других особых популяциях
Почечная недостаточность. В клинических исследованиях у пациентов с тяжелой почечной недостаточностью (Cl креатинина <30 мл/мин) или пациентов, получавших диализ, отмечался более высокий риск развития гипокальциемии при отсутствии приема препаратов кальция. Пациентам с тяжелой почечной недостаточностью или пациентам, получающим диализ, важно принимать препараты кальция и витамина D (см. «Особые указания»).
Взаимодействие
В исследовании лекарственного взаимодействия препарат Пролиа® не оказывал влияния на параметры фармакокинетики мидазолама, который метаболизируется изоферментом CYP3A4. Это означает, что препарат Пролиа® не должен оказывать влияние на параметры фармакокинетики ЛС, метаболизирующихся с участием CYP3A4.
Отсутствуют клинические данные о совместном применении деносумаба и ЗГТ эстрогенами, вероятность данного фармакодинамического взаимодействия расценивается как низкая. У женщин с постменопаузным остеопорозом предшествующая терапия алендроновой кислотой не оказывала влияния на параметры фармакокинетики и фармакодинамики деносумаба согласно данным переходного исследования (с алендроновой кислоты на деносумаб).
Фармацевтическая несовместимость. В связи с отсутствием результатов исследований по совместимости данный препарат не следует применять с другими ЛС.
Передозировка
Не регистрировалось случаев передозировки в клинических исследованиях.
В клинических исследованиях деносумаб вводился в дозах до 180 мг, каждые 4 нед (суммарная доза в течение 6 мес — до 1080 мг), при этом дополнительных нежелательных реакций не наблюдалось.
Особые указания
Препараты кальция и витамина D. Всем пациентам рекомендуется прием препаратов кальция и витамина D в адекватных дозах во время терапии препаратом Пролиа®.
Меры предосторожности при использовании
Гипокальциемия. Важно выявить пациентов с риском развития гипокальциемии. Гипокальциемия должна быть скорректирована приемом препаратов кальция и витамина D в адекватных дозах до начала терапии. Рекомендуется мониторинг концентрации кальция перед введением каждой дозы препарата у пациентов, предрасположенных к развитию гипокальциемии, в течение 2 нед после введения первой дозы. При развитии симптомов гипокальциемии в течение курса терапии (см. «Побочные действия»), необходимо оценить концентрацию кальция в крови. Пациенты должны быть предупреждены о необходимости сообщать при появлении симптомов, указывающих на гипокальциемию. В постмаркетинговых исследованиях отмечались случаи тяжелой симптоматической гипокальциемии (см. «Побочные действия») которые чаще всего регистрировались в течение первых недель после начала терапии, однако их развитие возможно и в более поздние сроки. Одновременная терапия ГКС является дополнительным фактором риска развития гипокальциемии.
Почечная недостаточность. У пациентов с тяжелым нарушением функции почек (имеющие Cl креатинина <30 мл/мин) или получающих диализ существует повышенный риск развития гипокальциемии. Риск развития гипокальциемии и сопутствующего увеличения уровня паратиреоидного гормона возрастает с увеличением степени тяжести нарушения функции почек. Данным пациентам особенно важно принимать препараты кальция и витамина D в адекватных дозах, а также проводить регулярный мониторинг концентрации кальция в крови (см. выше).
Инфекции кожи и подкожно-жировой клетчатки. У пациентов, получающих препарат Пролиа®, возможно развитие кожных инфекций и воспаления подкожно-жировой клетчатки, требующих госпитализации (см. «Побочные действия»). Пациентам следует сообщить о необходимости немедленного обращения за медицинской помощью при появлении признаков или симптомов воспаления подкожно-жировой клетчатки.
ОНЧ. Были зарегистрированы редкие случаи ОНЧ у пациентов, получавших препарат Пролиа® для лечения остеопороза (см. «Побочные действия»). Необходимо отложить начало терапии/проведение нового курса терапии у пациентов с незажившими открытыми повреждениями мягких тканей полости рта. Перед началом терапии деносумабом у пациентов с наличием сопутствующих факторов риска необходимо проведение стоматологического обследования и превентивных стоматологических мероприятий, а также индивидуальная оценка соотношения пользы и рисков терапии деносумабом. При оценке индивидуального риска развития ОНЧ у пациента необходимо учитывать следующие факторы риска:
— активность лекарственного препарата, ингибирующего резорбцию костной ткани (увеличение риска для сильнодействующих препаратов);
— способ введения (увеличение риска при парентеральном введении) и суммарная доза антирезорбтивной терапии;
— злокачественные опухоли, сопутствующая патология (например, анемия, коагулопатии, инфекции), курение;
— сопутствующая терапия (кортикостероиды, химиотерапия, ингибиторы ангиогенеза, лучевая терапия области головы и шеи);
— недостаточная гигиена полости рта, болезни пародонта, плохо подобранные зубные протезы, наличие стоматологических заболеваний в анамнезе, инвазивные стоматологические процедуры (например, экстракция зубов).
Во время лечения деносумабом всем пациентам следует поддерживать надлежащую гигиену полости рта, проходить регулярные стоматологические осмотры, а также немедленно сообщать о любых нежелательных симптомах со стороны ротовой полости, таких как подвижность зубов, боль, отек, незаживающие поражения слизистой или наличие выделений. В процессе терапии инвазивные стоматологические процедуры следует проводить только после тщательной оценки; необходимо избегать выполнения данных процедур непосредственно перед введением и/или сразу после введения препарата Пролиа®.
План лечения пациентов с ОНЧ должен быть разработан совместно с лечащим врачом и стоматологом или челюстно-лицевым хирургом с опытом лечения данной патологии. Следует рассмотреть вопрос о временном прекращении терапии до разрешения данного состояния и устранения факторов риска во всех случаях, когда это возможно.
Остеонекроз наружного слухового канала. На фоне терапии деносумабом отмечались случаи остеонекроза наружного слухового прохода. Возможными факторами риска данного состояния являются применение стероидов и химиотерапия, и/или местные факторы риска, такие как инфекция или травма. Возможность развития остеонекроза наружного слухового канала следует рассматривать у пациентов, принимающих деносумаб, у которых имеются симптомы со стороны уха, включая хронические инфекции уха.
Атипичные переломы бедра. Атипичные переломы бедренной кости отмечались у пациентов, принимающих Пролиа® (см. «Побочные действия»). Атипичные переломы бедренной кости могут возникать при небольших травмах или отсутствии травм в подвертельной или диафизарной проксимальной части бедренной кости. На рентгенологических снимках эти переломы обычно имеют характерный внешний вид. Об атипичных переломах бедренной кости также сообщалось у пациентов с определенными сопутствующими заболеваниями и состояниями (например, недостаток витамина D, ревматоидный артрит, гипофосфатазия) и у пациентов, получающих некоторые виды терапии (например, бисфосфонаты, ГКС, ингибиторы протонной помпы). Эти случаи также наблюдались и в отсутствии антирезорбтивной терапии. Подобные переломы, связанные с приемом бисфосфонатов, часто имеют двусторонний характер; поэтому у пациентов, получающих терапию деносумабом, при выявлении перелома бедренной кости, необходимо обследование бедра с противоположной стороны. Следует рассмотреть вопрос о прекращении лечения препаратом Пролиа® у пациентов с подозрением на атипичный перелом бедра, с учетом индивидуальной оценки соотношения пользы и риска. Во время лечения Пролиа® пациентов следует предупредить о необходимости информирования о новых или необычных болях в области бедренной кости, тазобедренной кости или паховой области. Пациенты, у которых возникают такие симптомы, должны быть обследованы на наличие неполных переломов бедренной кости.
МПП вследствие отмены лечения препаратом Пролиа®, в особенности у пациентов с переломами позвоночника в анамнезе. Пациентов следует проинструктировать о том, что нельзя прерывать терапию препаратом Пролиа® без консультации с лечащим врачом. Перед отменой лечения препаратом Пролиа® необходимо провести индивидуальную оценку соотношения польза/риск. В случае отмены лечения препаратом Пролиа® необходимо рассмотреть перевод на альтернативную антирезорбтивную терапию.
Длительная антирезорбтивная терапия. Длительная антирезорбтивная терапия (как деносумабом, так и бисфосфонатами) может способствовать повышению риска развития таких осложнений, как остеонекроз челюсти и атипичные переломы бедра, вследствие выраженного подавления процессов ремоделирования кости (см. «Способ применения и дозы»).
Одновременное применение других ЛС, содержащих деносумаб. Пациенты, получающие терапию препаратом Пролиа®, не должны получать одновременно другие содержащие деносумаб лекарственные препараты (для профилактики осложнений со стороны костной ткани у взрослых с сóлидными опухолями, метастазирующими в кость).
Сухой натуральный каучук. Колпачок иглы предварительно заполненного шприца содержит сухой натуральный каучук (производное латекса), который может вызывать аллергические реакции.
Предупреждения в отношении вспомогательных веществ. Данный препарат содержит 47 мг сорбитола в 1 мл раствора. Следует учитывать аддитивный эффект одновременного применения препаратов, содержащих сорбитол (или фруктозу), а также поступления сорбитола (или фруктозы) с пищей. Данный препарат содержит менее 1 ммоль натрия (23 мг) в 60 мг, т.е. может расцениваться как несодержащий натрия.
Особые меры предосторожности при применении и утилизации. Перед введением следует оценить раствор на предмет наличия включений или изменения цвета. Раствор нельзя использовать при помутнении, наличии взвешенных частиц или изменении цвета. Не встряхивать. Чтобы избежать дискомфорта в месте введения, следует довести препарат до комнатной температуры (до 25 °C) перед инъекцией, а затем медленно ввести все содержимое предварительно заполненного шприца. Любое количество неиспользованного препарата или неиспользованных материалов должно быть утилизировано в соответствии с надлежащими требованиями.
Влияние на способность управлять транспортными средствами, механизмами. Исследований влияния препарата Пролиа® на способность к управлению автомобилем и работе с механизмами не проводилось.
Форма выпуска
Предварительно заполненные шприцы с раствором для п/к введения 60 мг/мл.
Раствор для п/к введения 60 мг/мл в одноразовом ПЗШ 1 мл из стекла I гидролитического класса с иглой 27G из нержавеющей стали, эластомерным колпачком и эластомерным плунжером, ламинированным фторполимером (с защитным устройством для иглы или без него). Маркированный шприц помещают в пачку картонную.
ПЗШ может быть дополнительно помещен в контурную ячейковую упаковку с термоэтикеткой. Каждую контурную ячейковую упаковку помещают в пачку картонную вместе с карточкой для пациента с описанием техники инъекции (для ПЗШ — с защитным устройством для иглы). Пачка картонная снабжена отрывной карточкой-напоминанием с двумя напоминающими наклейками. На каждую пачку наклеивают прозрачные защитные этикетки, имеющие продольную цветную полосу — контроль первого вскрытия.
Пролиа® представляет собой стерильный продукт и не содержит консервантов.
Производитель
Амджен Мэньюфэкчуринг Лимитед, Пуэрто-Рико, Роуд 31, Км 24,6, Джанкос, Пуэрто-Рико, 00777.
Выпускающий контроль качества. Амджен Европа Б.В., Нидерланды Минервум 7061,4817 ZK Бреда, Нидерланды или Амджен Технолоджи (Айрлэнд) Анлимитед Компани, Поттери Роуд, Дан Лэйри, графство Дублин, Ирландия.
Или
ООО «Добролек», 115446, Москва, Коломенский пр., 13А.
Организация, принимающая претензии от потребителей ООО «Амджен». 123112, Москва, Пресненская наб., 8, стр. 1, 7-й эт.
Тел.: (495) 745-04-78; факс: (499) 995-19-65.
Условия отпуска из аптек
По рецепту.
RU-P-MLTP-0919-078239
Условия хранения
При температуре 2–8 °C в оригинальной упаковке (не замораживать).
Хранить в оригинальной упаковке для защиты от света. Не встряхивать. После изъятия из холодильника Пролиа® может храниться при комнатной температуре не выше 25°С в оригинальной упаковке не более 30 дней.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Содержание
- Краткое описание препарата
- Фармакодинамика: механизм действия и терапевтический эффект
- Фармакокинетика Лорноксикама
- Показания к применению
- Противопоказания
- Схема лечения и режим дозирования
- Передозировка
- Побочные действия
- Взаимодействие с другими лекарственными препаратами
- Особые указания
- Условия и сроки хранения
- Условия продажи
- Стоимость препарата
- Аналоги Лорноксикама
- Отзывы о Лорноксикаме
- Источники
Краткое описание препарата
Лорноксикам – лекарство для быстрого снятия болевого приступа и воспалительных процессов в организме. Выпускается в виде таблеток, а также в форме порошка для приготовления раствора для инъекции. Перед использованием препарата нужно внимательно изучить его побочные реакции, противопоказания и точную дозировку.
Код ATX
М01АС05
Действующее вещество
Лорноксикам (lornoxicam)
Торговое наименование препарата
Лорноксикам (Lornoxicamum)
Фармакотерапевтическая группа
Нестероидный противовоспалительный препарат (НПВП)
Форма выпуска
Лиофилизат для приготовления раствора для внутривенного и внутримышечного введения, 8 мг.
Количество препарата, содержащее 8 мг действующего вещества, помещают во флаконы светозащитного стекла вместимостью 10 мл, укупоренные пробками резиновыми и обкатанные колпачками алюминиевыми.
По 5 флаконов в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой или без фольги.
1 контурную ячейковую упаковку вместе с инструкцией по применению препарата помещают в пачку из картона.
В форме таблеток лорноксикам выпускается под торговым наименованием Ксефокам. Таблетки, покрытые оболочкой 4 мг и 8 мг, продолговатые, овальной формы, от белого до желтоватого цвета, гладкие с обеих сторон (для дозировки 4 мг) Таблетки, покрытые оболочкой, продолговатые, овальной формы, от белого до желтоватого цвета с тиснением «L8» с одной стороны и гладкие с другой стороны (для дозировки 8 мг).
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. ВОЗМОЖНЫ ПОБОЧНЫЕ ЭФФЕКТЫ. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА.АллергияАртритДерматитПри аллергииРевматоидный артрит
Автор статьи
Подойницына Алёна Андреевна
,
Диплом о фармацевтическом образовании: 105924 3510722 рег. номер 31917
Все авторы
Содержание статьи
- Дипромета: состав
- Укол Дипромета: от чего помогает
- Дипромета: противопоказания
- Дипромета и алкоголь: совместимость
- Краткое содержание
- Задайте вопрос эксперту по теме статьи
Общеизвестный факт: с годами работа костно-мышечного аппарата нарушается. Наиболее частое явление в четвертой и пятой декадах жизни – остеоартроз. Считается, что к 80 годам жизни патология развивается у каждого человека. Болезнь представляет собой поражение или разрушение суставного хряща, типичные симптомы которого: боль, скованность движений и припухлость. Терапия остеоартроза включает в себя лечебную физкультуру, реабилитацию и обезболивающие препараты. Иногда приходится прибегать к введению противовоспалительных лекарств внутрь пораженных суставов.
Провизор расскажет о препарате Дипромета: ознакомит с его составом, показаниями и к применению, противопоказаниями и совместимостью с алкоголем.
Дипромета: состав
Дипломета – суспензия для инъекций. Действующее вещество препарата – бетаметазон, относящийся к стероидным гормонам с выраженной противовоспалительной, противоаллергической и иммунодепрессивной активностью.
В состав вспомогательных компонентов входят: натрия гидрофосфат, бензиловый спирт, натрия хлорид и кармеллоз, динатрия эдетат, вода для инъекций и другие ингредиенты.
Укол Дипромета: от чего помогает
Препарат Дипромета применяется в качестве дополнительного лечения при ряде заболеваний с целью снятия воспаления, боли и отека. При аутоиммунных состояниях (поражении иммунной системой собственных тканей организма) важен эффект подавления иммунитета, который оказывают уколы Дипромета. Например, иммунодепрессивная терапия – основа для лечения ревматоидного артрита и системной красной волчанки.
Как сообщает инструкция по применению, уколы Дипромета показаны при заболеваниях:
- Костно-мышечной системы и мягких тканей: ревматоидного артрита, остеоартроза, бурсита;
- Аллергического происхождения: сенной лихорадке, лекарственной аллергии, сезонном и круглогодичном рините;
- Кожи: атопическим дерматите, нейродермите, дискоидной красной волчанке, псориазе;
- Соединительной ткани: системной красной волчанке, склеродермии, дерматомиозите;
- Коры надпочечников: недостаточности функций органа;
- Иного происхождения, требующих терапии глюкокортикостероидами.
Препарат Дипромета имеет несколько путей введения: глубоко в мышцу, суставную сумку и полость сустава, мягкие ткани около сустава, внутрь кожи или в очаг поражения. Наиболее частое применение суспензии Дипромета – уколы в сустав для снятия боли и воспаления, а также увеличения его подвижности.
Дипромета: противопоказания
- Повышенная чувствительность к компонентам препарата;
- Системные грибковые поражения;
- Введение внутривенно, подкожно, эпидурально и интратекально;
- Введение в сухожилие и межпозвоночное пространство;
- Нестабильный сустав;
- Артрит, вызванный инфекцией;
- Введение в инфицированный очаг;
- Нарушение свертываемости крови;
- Одновременное введение с живыми или ослабленными вакцинами;
- Тромбоцитопеническая пурпура;
- Отек головного мозга;
- Период грудного вскармливания;
- Детский возраст до 3 лет.
Дипромета и алкоголь: совместимость
На время лечения рекомендуется воздержаться от употребления спиртных напитков. Алкоголь усиливает побочные действия Дипромета: повышает риск развития язвы желудка, провоцирует появление судорог, а также увеличивает внутричерепное и внутриглазное давление.
Хотите разбираться в аналогах лекарств, чтобы умело подбирать препараты на свой бюджет? Наша методичка от экспертов-провизоров «Аналоги популярных лекарств» поможет вам в этом! Получить методичку просто: подпишитесь на наши соцсети и напишите в сообщения «аналоги».
Мегаптека в соцсетях: ВКонтакте, Telegram, OK
Краткое содержание
- Действующее вещество препарата – бетаметазон, относящийся к стероидным гормонам с выраженной противовоспалительной, противоаллергической и иммунодепрессивной активностью.
- Препарат Дипромета применяется в качестве дополнительного лечения при ряде заболеваний с целью снятия воспаления, боли и отека.
- Дипромета имеет противопоказания и побочные действия.
- На время лечения рекомендуется воздержаться употребления спиртных напитков.
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же вы можете поделиться своим опытом с другими читателями Мегасоветов.
Поделиться мегасоветом
Понравилась статья? Расскажите маме, папе, бабушке и тете Гале из третьего подъезда
Описание препарата Пролиа® (раствор для подкожного введения, 60 мг/мл) основано на официальной инструкции, утверждено компанией-производителем в 2019 году
Дата согласования: 03.10.2019
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Отзывы
Действующее вещество
ATX
Фармакологическая группа
Состав
| Раствор для подкожного введения | 1 мл |
| каждый предварительно заполненный шприц (ПЗШ) содержит | |
| активное вещество: | |
| деносумаб | 60 мг |
| вспомогательные вещества: сорбитол (Е420) — 47 мг; уксусная кислота ледяная — 1 мг; полисорбат 20 — 0,1 мг; натрия гидроксид — до рН 5–5,5; вода для инъекций — до 1 мл |
Описание лекарственной формы
Прозрачная жидкость, от бесцветного до светло-желтого цвета, практически свободная от видимых включений.
Фармакологическое действие
Фармакологическое действие
—
корректирующее метаболизм костной и хрящевой ткани.
Фармакодинамика
Механизм действия. Деносумаб представляет собой полностью человеческое моноклональное антитело (IgG2), обладающее высокой аффинностью и специфичностью к RANKL (лиганд к рецептору RANK), и тем самым препятствует активации этих рецепторов RANK на поверхности остеокластов и их предшественников. Предотвращение связывания лиганда RANK с рецептором RANK ингибирует созревание, функционирование и выживаемость остеокластов, что уменьшает костную резорбцию в кортикальном и губчатом слое кости.
Фармакодинамические эффекты.Терапия препаратом Пролиа® приводила к быстрому снижению скорости ремоделирования костной ткани, достигая минимальных (снижение на 85%) показателей концентрации маркера резорбции костной ткани — сывороточных С-телопептидов (СТХ) I типа в течение 3 дней. Снижение концентрации СТХ сохранялось в интервале между введениями препарата. В конце каждого интервала дозирования степень снижения концентрации СТХ частично нивелировалась приблизительно до ≥45% по сравнению с максимальным снижением концентрации СТХ ≥87% (диапазон — 45–80%), что отражает обратимость эффектов препарата Пролиа® в отношении костного метаболизма при снижении концентрации препарата в сыворотке. Эти эффекты сохранялись на протяжении всего периода терапии. Концентрации маркеров костной резорбции обычно достигали исходных значений, наблюдавшихся до начала терапии, в течение 9 мес после введения последней дозы препарата. После возобновления терапии препаратом степень снижения концентрации СТХ была сходна со степенью снижения концентрации СТХ в начале курса лечения деносумабом.
Иммуногенность. В клинических исследованиях не наблюдалось продукции нейтрализующих антител к деносумабу. Используя метод чувствительного иммунологического анализа, было показано, что у <1% пациентов, получавших деносумаб на протяжении до 5 лет, регистрировались ненейтрализующие связывающие антитела при отсутствии признаков изменения параметров фармакокинетики, токсичности или клинического ответа.
Дети. Европейское агентство по оценке ЛС отказалось от требования предоставить результаты исследований препарата Пролиа® во всех субпопуляциях пациентов детского возраста для лечения потери костной массы, на фоне аблативной терапии половыми гормонами, а также в субпопуляции детей в возрасте младше 2 лет для лечения остеопороза. Информация о применении препарата у детей приведена в разделе «Способ применения и дозы».
Фармакокинетика
Всасывание. После п/к введения в дозе 1 мг/кг, приблизительно соответствующей зарегистрированной дозе 60 мг, значения AUC составили 78% по сравнению с в/в введением препарата в той же дозе. При п/к введении препарата в дозе 60 мг Cmax деносумаба в сыворотке крови составляла 6 мкг/мл (диапазон — 1–17 мкг/мл) и достигалась в течение 10 дней (диапазон — 2–28 дней).
Метаболизм. Деносумаб состоит только из аминокислот и углеводов в виде нативного Ig, и элиминация с помощью печеночных метаболических механизмов маловероятна. Поэтому предполагается, что выведение препарата происходит стандартными путями расщепления Ig, результатом которых является распад до малых пептидов и отдельных аминокислот.
Выведение. После достижения Cmax деносумаба в сыворотке крови концентрация препарата снижается с T1/2 26 дней (размах вариации — 6–52 дня) в течение 3 мес (диапазон — 1,5–4,5 мес). У 53% пациентов через 6 мес после введения последней дозы деносумаба его концентрация в крови не поддавалась количественному определению. Не наблюдалось кумулирования препарата или изменения параметров фармакокинетики с течением времени при п/к многократном введении деносумаба в дозе 60 мг в течение 6 мес. Продукция связывающих антител к деносумабу, аналогичная как у мужчин, так и у женщин, не оказывала влияния на параметры фармакокинетики деносумаба. Возраст (28–87 лет), раса и стадия заболевания (низкая костная масса, остеопороз, рак предстательной железы или рак молочной железы) не оказывают значительного влияния на параметры фармакокинетики деносумаба. Наблюдалась тенденция к снижению экспозиции препарата (AUC и Cmax) с повышением массы тела. Однако данная тенденция не расценивалась как клинически значимая, поскольку фармакодинамические эффекты (оценка которых осуществлялась по значениям концентраций маркеров метаболизма костной ткани и повышения МПКТ) были аналогичны в широком диапазоне значений массы тела.
Линейность фармакокинетики. В исследованиях применения деносумаба в различных дозах была продемонстрирована нелинейная дозозависимая фармакокинетика, со снижением клиренса препарата при увеличении дозы или концентрации; однако приблизительно дозопропорциональное увеличение экспозиции наблюдалось при применении доз 60 мг и выше.
Отдельные группы пациентов
Дети. Фармакокинетика препарата у детей не оценивалась.
Почечная недостаточность. В исследовании у 55 пациентов с различной степенью тяжести почечной дисфункции, включая пациентов, получавших диализную терапию, было показано, что степень выраженности почечной недостаточности не влияла на параметры фармакокинетики деносумаба.
Печеночная недостаточность. Не проводилось специальных исследований у пациентов с печеночной недостаточностью. Как правило, моноклональные антитела не выводятся при помощи печеночных метаболических механизмов. Предполагается, что печеночная недостаточность не оказывает влияния на параметры фармакокинетики деносумаба.
Показания
лечение постменопаузного остеопороза и остеопороза у мужчин при повышенном риске переломов. У женщин в постменопаузе Пролиа® значительно снижает риск вертебральных, невертебральных переломов и переломов бедра;
лечение потери костной массы у женщин, получающих терапию ингибиторами ароматазы по поводу рака молочной железы, и мужчин с раком предстательной железы, получающих гормондепривационную терапию, при повышенном риске переломов. У мужчин с раком предстательной железы, получающих гормондепривационную терапию, Пролиа® значительно снижает риск вертебральных переломов;
лечение потери костной массы, связанной с длительной терапией системными глюкокортикоидами, у взрослых пациентов при повышенном риске переломов.
Противопоказания
гиперчувствительность к любому из компонентов препарата;
гипокальциемия (см. «Особые указания»);
беременность;
период грудного вскармливания;
детский возраст до 18 лет.
Применение при беременности и кормлении грудью
Данные о применении деносумаба в период беременности ограничены. В исследованиях на животных была продемонстрирована репродуктивная токсичность препарата. Препарат Пролиа® не следует применять в период беременности и репродуктивном периоде у женщин, не использующих контрацептивы. Женщинам рекомендуется избегать наступления беременности во время терапии и минимум 5 мес после завершения терапии препаратом. Любые эффекты препарата Пролиа®, вероятно, будут более выражены в течение II и III триместров беременности, поскольку моноклональные антитела проникают через плаценту, и степень их проникновения линейно возрастает по мере увеличения срока беременности, а наибольшие значения отмечаются в течение III триместра.
Неизвестно, проникает ли деносумаб в грудное молоко. В исследованиях на генетически модифицированных мышах с выключенным геном RANKL («нокаутные мыши») было показано, что отсутствие RANKL (мишени деносумаба; см. «Фармакодинамика») в период беременности может оказывать влияние на созревание молочных желез, приводя к нарушению лактации в послеродовом периоде. Решение о необходимости прекращения грудного кормления или прекращения терапии препаратом Пролиа® следует принимать с учетом пользы грудного кормления для ребенка и пользы терапии для матери.
Влияние на фертильность. Данные о влиянии деносумаба на фертильность у человека отсутствуют. Исследования на животных не продемонстрировали прямого или косвенного негативного влияния препарата на фертильность.
Способ применения и дозы
П/к. Введение препарата должно осуществляться лицом, обученным технике выполнения инъекции. Особые меры предосторожности при применении и утилизации — см. «Особые указания».
Доза. Рекомендуемая доза препарата Пролиа® составляет 60 мг, которая вводится путем п/к инъекции 1 раз в 6 мес в бедро, живот или плечо. Во время курса лечения необходимо принимать препараты кальция и витамина D в адекватных дозах (см. «Особые указания»). Оптимальная длительность терапии остеопороза антирезорбтивными препаратами (деносумаб и бисфосфонаты) не установлена. Необходимость продолжения терапии периодически должна переоцениваться с учетом пользы и потенциальных рисков применения деносумаба у каждого конкретного пациента, и в частности через 5 лет и более после начала применения препарата (см. «Особые указания»).
Особые группы пациентов
Дети. Применение препарата Пролиа® у детей (в возрасте до 18 лет) не рекомендуется, поскольку безопасность и эффективность препарата у данной возрастной группы пациентов не установлены. Ингибирование лиганда RANK/RANK (RANKL) в исследованиях на животных ассоциировалось с ингибированием роста костей и отсутствием прорезывания зубов.
Пожилые пациенты (в возрасте ≥65 лет). Коррекции дозы препарата у пожилых пациентов не требуется.
Нарушение функции почек. Не требуется коррекции дозы препарата у пациентов с нарушением функции почек (рекомендации по мониторингу концентрации кальция — см. «Особые указания»). Отсутствуют данные о применении препарата у пациентов с тяжелым нарушением функции почек (СКФ <30 мл/мин) и получающих длительную терапию системными глюкокортикоидами.
Нарушение функции печени. Безопасность и эффективность использования деносумаба у пациентов с нарушением функции печени не установлены (см. «Фармакокинетика»).
Инструкция по использованию предварительно заполненных шприцев с препаратом Пролиа®
Необходимо прочитать данную инструкцию перед использованием препарата Пролиа® в предварительно заполненном шприце с защитным устройством для иглы:
— очень важно, чтобы перед тем, как пациент приступит к самостоятельным инъекциям, его лечащий врач или медицинская сестра подробно проинструктировали его по технике выполнения инъекции;
— Пролиа® вводится п/к (п/к инъекция);
— следует сообщить врачу, если у пациента есть аллергия на латекс (колпачок иглы предварительно заполненного шприца состоит из производного латекса);
— не снимать серый колпачок с иглы предварительно заполненного шприца, пока пациент не готов к инъекции;
— не использовать предварительно заполненный шприц, если он упал на твердую поверхность. Использовать новый предварительно заполненный шприц и сообщить об этом лечащему врачу или медицинской сестре;
— не пытаться активировать защитное устройство предварительно заполненного шприца перед инъекцией;
— не пытаться снять прозрачное защитное устройство с предварительно заполоненного шприца перед инъекцией.
В случае возникновения вопросов по применению препарата следует обращаться к лечащему врачу или медицинской сестре.
Шаг 1. Подготовка шприца
А. Извлечь контурную ячейковую упаковку с предварительно заполненным шприцем из упаковки и подготовить все необходимое для инъекции: спиртовые салфетки, ватный тампон или марлевую салфетку, пластырь и контейнер для острых отходов (не включены в упаковку).
Для более комфортной инъекции оставить предварительно заполненный шприц при комнатной температуре в течение примерно 30 мин перед инъекцией. Тщательно вымыть руки с мылом. Расположить предварительно заполненный шприц и другие необходимые расходные материалы на чистой, хорошо освещенной поверхности.
Не пытаться подогревать шприц в горячей воде или микроволновой печи.
Не оставлять предварительно заполненный шприц под прямыми солнечными лучами.
Не встряхивать предварительно заполненный шприц.
Хранить предварительно заполненный шприц в недоступном для детей месте.
B. Открыть контурную ячейковую упаковку, потянув за этикетку. Для извлечения предварительно заполненного шприца из контурной ячейковой упаковки взяться за защитное устройство.
Взять шприц, как показано на рисунке.
В целях безопасности:
— не браться за плунжер;
— не браться за серый колпачок иглы.
С. Проверить препарат и предварительно заполненный шприц.
Не использовать предварительно заполненный шприц, если:
— препарат мутный или содержит посторонние частицы. Раствор должен быть прозрачным, бесцветным или светло-желтым;
— любая из частей повреждена или сломана;
— серый колпачок иглы отсутствует или неплотно надет;
— истек последний день указанного на этикетке месяца срока годности.
Сообщить лечащему врачу или медицинской сестре обо всех перечисленных случаях.
Шаг 2. Подготовка места инъекции
А. Тщательно вымыть руки. Подготовить и обработать место инъекции.
Для инъекции можно использовать верхнюю часть бедра; живот, за исключением области вокруг пупка, примерно 5 см; наружную поверхность плеча (только если инъекцию пациенту делает кто-то другой).
Обработать место инъекции смоченным в спирте тампоном. Дать коже высохнуть.
Не дотрагиваться до места инъекции перед инъекцией.
Не использовать для инъекций области, где кожа тонкая, с гематомой, покрасневшая или жесткая. Избегать инъекций в области со шрамами или растяжками.
B. Осторожно потянуть серый колпачок с иглы без скручивания, по направлению от корпуса шприца.
С. Зажать место инъекции для получения упругой поверхности. Важно удерживать кожу зажатой при проведении инъекции.
Шаг 3. Введение
А. Зажать кожу, ввести иглу в кожу. Не дотрагиваться до обработанной области инъекции.
В. Медленно и плавно надавливать на поршень до тех пор, пока пациент не почувствует или не услышит щелчок. Важно надавливать на поршень до щелчка для введения всей дозы.
С. Отпустить большой палец, затем извлечь шприц из кожи. После того, как пациент отпустит поршень, защитное устройство предварительно заполненного шприца покроет иглу. Не надевать серый колпачок иглы обратно на предварительно заполненный шприц.
Шаг 4. Окончание
А. Выбросить использованный предварительно заполненный шприц и другие сопутствующие материалы в контейнер для острых отходов. Лекарственные препараты должны быть утилизированы в соответствии с надлежащими требованиями. Спросить у врача или провизора, как уничтожить препарат, если он больше не требуется, не нанося ущерба окружающей среде. Эти меры помогут защитить окружающую среду. Хранить шприцы и сопутствующие материалы в недоступном для детей месте.
Не использовать предварительно заполненный шприц повторно.
Не сдавать предварительно заполненный шприц на переработку и не выбрасывать его с бытовым мусором.
В. Осмотреть место инъекции. Если в месте инъекции выступит кровь, прижать к нему ватный тампон или бинт. Не растирать место инъекции. При необходимости заклеить место инъекции пластырем.
Инструкция по введению препарата Пролиа® в ПЗШ
Здесь приводится информация по правильному проведению инъекции предварительно заполненным шприцем. Очень важно, чтобы перед тем, как пациент приступит к самостоятельным инъекциям, лечащий врач, медицинская сестра подробно проинструктировали пациента по технике выполнения инъекции. Необходимо тщательно вымыть руки перед выполнением инъекции. При возникновении вопросов по технике выполнения инъекции, следует обратиться к лечащему врачу или медицинской сестре.
Перед началом инъекции: внимательно прочитать все инструкции перед использованием предварительно заполненного шприца.
Не использовать ПЗШ, если колпачок был удален.
Как использовать ПЗШ для п/к инъекций?
Пациент должен ввести все содержимое ПЗШ Пролиа® (1 мл) однократно и повторить инъекцию через 6 мес, как назначено лечащим врачом.
Оборудование
Для самостоятельной инъекции пациенту потребуется:
1. Новый предварительно заполненный шприц с препаратом Пролиа®.
2. Спиртовые салфетки или подобные материалы.
Что необходимо сделать до самостоятельного введения Пролиа® п/к?
1. Достать шприц из холодильника. Не брать предварительно заполненный шприц за поршень или защитный колпачок, это может повредить устройство.
2. Предварительно заполненный шприц оставить вне холодильника для достижения комнатной температуры. Это позволит сделать инъекцию более комфортной. Не подогревать предварительно заполненный шприц каким-либо другим способом (например, в микроволновой печи или горячей воде). Не оставлять шприц под прямыми солнечными лучами.
3. Не встряхивать предварительно заполненный шприц.
4. Не снимать колпачок с предварительно заполненного шприца до тех пор, пока пациент не готов к инъекции.
5. Проверить срок годности предварительно заполненного шприца на упаковке. Не использовать предварительно заполненный шприц, если истек последний день указанного на этикетке месяца срока годности.
6. Проверить внешний вид препарата Пролиа®. Раствор должен быть прозрачным, бесцветным или светло-желтым. Если раствор помутнел или окрашен иначе, препарат использовать нельзя.
7. Выбрать комфортное, хорошо освещенное место и чистую поверхность, где можно удобно расположить все необходимые материалы.
8. Тщательно вымыть руки.
Как правильно выбрать место для инъекции?
Лучше всего делать инъекции в верхнюю часть бедра и живот. Если инъекции делает кто-то другой, можно использовать наружную поверхность плеча.
Как правильно сделать инъекцию?
1. Продезинфицировать место инъекции с помощью спиртовой салфетки.
2. Во избежание загиба иглы, аккуратно потянуть колпачок с иглы сразу без скручивания, как показано на рисунках. Не дотрагиваться до иглы и не нажимать на поршень.
3. Если внутри предварительно заполненного шприца видны маленькие пузырьки воздуха, нет необходимости удалять их перед инъекцией. Введение раствора с пузырьками воздуха является безопасным.
4. Зажать кожу (не сдавливая) между большим и указательным пальцами. Ввести иглу в кожу полностью, как показывал доктор или медицинская сестра.
5. Медленно и плавно надавливать на поршень, одновременно придерживая кожную складку. Надавливать на поршень следует до тех пор, пока шприц не опустеет.
6. Извлечь иглу из кожи и отпустить кожную складку.
7. Если выступит кровь в месте инъекционного прокола, аккуратно стереть ее ватным тампоном или салфеткой. Не растирать место инъекции. При необходимости заклеить место инъекции пластырем.
8. Использовать 1 ПЗШ только для одной инъекции. Не использовать оставшийся в шприце препарат.
При возникновении проблем обратиться за помощью или советом к лечащему врачу или медицинской сестре.
Уничтожение использованных шприцев
Не надевать обратно колпачок на использованный шприц.
Хранить использованный шприц в недоступном для детей месте.
Использованный шприц должен быть утилизирован в соответствии с надлежащими требованиями.
Спросить у врача или провизора, как уничтожить препарат, если он больше не требуется, не нанося ущерба окружающей среде.
Побочные действия
Заключение по профилю безопасности препарата
К наиболее частым побочным действиям (отмечавшимися более чем у одного из 10 пациентов) относятся скелетно-мышечные боли и боли в конечностях. Сообщалось о нечастых случаях воспаления подкожно-жировой клетчатки и редких случаях гипокальциемии, гиперчувствительности, остеонекроза челюсти и атипичных переломах бедренной кости (см. «Особые указания» и «Описание отдельных нежелательных реакций»).
Табличный перечень нежелательных реакций
Нежелательные реакции, выявленные в клинических исследованиях II и III фазы у пациентов с остеопорозом и раком молочной железы или раком простаты, получавших гормондепривационную терапию, а также спонтанные сообщения, представлены в таблице ниже. Нежелательные реакции представлены согласно классификации (см. таблицу): очень часто — ≥1/10; часто — ≥1/100 и <1/10; нечасто —≥1/1000 и <1/100; редко — ≥1/10000 и <1/1000; очень редко — <1/10000.
Таблица
Нежелательные реакции, отмечавшиеся у пациентов с остеопорозом и раком молочной железы или раком предстательной железы, получавших гормондепривационную терапию
| Класс системы органов по классификации MedDRA | Частота | Нежелательная реакция |
| Инфекции и инвазии | Часто | Инфекции мочевыводящих путей |
| Часто | Инфекции верхних дыхательных путей | |
| Нечасто | Дивертикулит1 | |
| Нечасто | Воспаление подкожно-жировой клетчатки1 | |
| Нечасто | Инфекции уха | |
| Со стороны иммунной системы | Редко | Реакции гиперчувствительности1 |
| Редко | Анафилактическая реакция1 | |
| Со стороны обмена веществ и питания | Редко | Гипокальциемия1 |
| Со стороны нервной системы | Часто | Ишиас |
| Со стороны ЖКТ | Часто | Запор |
| Часто | Дискомфорт в животе | |
| Со стороны кожи и подкожной клетчатки | Часто | Сыпь |
| Часто | Экзема | |
| Со стороны костно-мышечной системы и соединительной ткани | Очень часто | Боль в конечностях |
| Очень часто | Скелетно-мышечная боль1 | |
| Редко | Остеонекроз челюсти (ОНЧ)1 | |
| Редко | Атипичный перелом бедренной кости1 | |
| Нечасто | Множественные переломы позвоночника (МПП) вследствие отмены лечения препаратом Пролиа®1 | |
| Неизвестно | Остеонекроз наружного слухового прохода2 |
1См. «Описание отдельных нежелательных реакций».
2См. «Особые указания».
В обобщенном анализе данных всех плацебо-контролируемых исследований II и III фазы, сообщалось о развитии гриппоподобного заболевания с частотой 1,2% в группе с деносумабом и 0,7% — в группе плацебо. Этот дисбаланс был установлен в обобщенном анализе данных и не был обнаружен при стратифицированном анализе.
Описание отдельных нежелательных реакций
Гипокальциемия. В двух плацебо-контролируемых исследованиях III фазы у женщин с постменопаузным остеопорозом, приблизительно у 0,05% пациентов (2 из 4050) снижалась концентрация кальция в сыворотке крови (<1,88 ммоль/л) после введения препарата Пролиа®. Не сообщалось о снижении концентрации кальция в сыворотке крови (ниже 1,88 ммоль/л) в двух плацебо-контролируемых клинических исследованиях III фазы у пациентов, получавших гормондепривационную терапию, или в плацебо-контролируемом клиническом исследовании III фазы у мужчин с остеопорозом. В постмаркетинговых исследованиях отмечались редкие случаи тяжелой симптоматической гипокальциемии, преимущественно у пациентов с повышенным риском развития гипокальциемии, получавших препарат Пролиа®; при этом большинство случаев отмечалось в течение первых недель после начала терапии. Примерами клинических проявлений тяжелой симптоматической гипокальциемии являются удлинение интервала QT, тетания, судорожные припадки и изменение психического статуса (см. «Особые указания»). Симптомами гипокальциемии в исследованиях деносумаба являлись парестезия или скованность мышц, мышечные подергивания, спазмы или судорожные сокращения мышц.
Инфекции кожи. Частота сообщений о развитии инфекций кожи в плацебо-контролируемых клинических исследованиях III фазы была идентична у женщин с постменопаузным остеопорозом (в группе лечения препаратом Пролиа® — 1,5%; 59 из 4050, в группе плацебо — 1,2%; 50 из 4041); у мужчин с остеопорозом (в группе плацебо — 0,8%; 1 из 120; в группе с препаратом — 0%; 0 из 120); у пациентов с раком молочной железы и раком предстательной железы, получающих гормондепривационную терапию (в группе плацебо — 1,7%; 14 из 845; в группе лечения препаратом Пролиа®— 1,4%; 12 из 860). Кожные инфекции, требующие госпитализации, были отмечены у 0,1% (3 из 4041) пациентов с постменопаузным остеопорозом в группе плацебо и у 0,4% (16 из 4050) пациентов в группе лечения препаратом Пролиа®. Преимущественно это были случаи воспаления подкожно-жировой клетчатки. О серьезных случаях инфекций кожи сообщалось со сходной частотой в группах плацебо (0,6%; 5 из 845) и группах лечения препаратом Пролиа® (0,6%; 5 из 860) в исследованиях рака молочной железы и рака предстательной железы.
ОНЧ. Отмечались редкие случаи ОНЧ: у 16 из включенных 23148 пациентов, принимавших участие в клинических исследованиях применения препарата у пациентов с остеопорозом, раком молочной железы или раком предстательной железы, получавших гормондепривационную терапию (см. «Особые указания»). 13 из этих случаев ОНЧ отмечались у женщин с постменопаузным остеопорозом, участвовавших в расширенном клиническом исследовании III фазы и продолжавших терапию препаратом Пролиа® в течение до 10 лет. Частота ОНЧ составила 0,04% — в течение 3 лет; 0,06% — в течение 5 лет и 0,44% — в течение 10 лет терапии препаратом Пролиа®. Риск развития ОНЧ возрастал по мере увеличения длительности терапии препаратом Пролиа®.
Атипичные переломы бедренной кости. В клинических исследованиях остеопороза у пациентов в группе лечения, получавшей препарат Пролиа®, были зарегистрированы редкие случаи атипичных переломов бедренной кости (см. «Особые указания»).
МПП вследствие отмены лечения препаратом Пролиа®. В клинических исследованиях остеопороза зарегистрированы случаи МПП вследствие отмены лечения препаратом Пролиа®, в особенности у пациентов с переломами позвоночника в анамнезе.
Дивертикулит. В плацебо-контролируемом клиническом исследовании III фазы у пациентов с раком предстательной железы, получавших гормондепривационную терапию, отмечен дисбаланс в сообщениях о развитии дивертикулита (1,2% — в группе лечения деносумабом, 0% — в группе плацебо). Частота развития дивертикулита была сравнима в группах исследований, включавших женщин в постменопаузе или мужчин с остеопорозом, а также у женщин, получавших терапию ингибиторами ароматазы по причине неметастатического рака молочной железы.
Реакции гиперчувствительности. В постмаркетинговых исследованиях у пациентов, получающих препарат Пролиа® в пострегистрационном периоде, редко сообщалось о реакциях гиперчувствительности, связанных с препаратом, включая сыпь, крапивницу, отек лица, эритему и анафилактические реакции.
Скелетно-мышечная боль. Скелетно-мышечные боли, в т.ч. тяжелые, отмечались у пациентов, получавших препарат Пролиа®, в постмаркетинговых исследованиях. В клинических исследованиях скелетно-мышечные боли регистрировались очень часто, как в группе лечения деносумабом, так и в группе плацебо. Скелетно-мышечная боль, приводившая к досрочному завершению участия в исследовании, отмечалась нечасто.
Использование в других особых популяциях
Почечная недостаточность. В клинических исследованиях у пациентов с тяжелой почечной недостаточностью (Cl креатинина <30 мл/мин) или пациентов, получавших диализ, отмечался более высокий риск развития гипокальциемии при отсутствии приема препаратов кальция. Пациентам с тяжелой почечной недостаточностью или пациентам, получающим диализ, важно принимать препараты кальция и витамина D (см. «Особые указания»).
Взаимодействие
В исследовании лекарственного взаимодействия препарат Пролиа® не оказывал влияния на параметры фармакокинетики мидазолама, который метаболизируется изоферментом CYP3A4. Это означает, что препарат Пролиа® не должен оказывать влияние на параметры фармакокинетики ЛС, метаболизирующихся с участием CYP3A4.
Отсутствуют клинические данные о совместном применении деносумаба и ЗГТ эстрогенами, вероятность данного фармакодинамического взаимодействия расценивается как низкая. У женщин с постменопаузным остеопорозом предшествующая терапия алендроновой кислотой не оказывала влияния на параметры фармакокинетики и фармакодинамики деносумаба согласно данным переходного исследования (с алендроновой кислоты на деносумаб).
Фармацевтическая несовместимость. В связи с отсутствием результатов исследований по совместимости данный препарат не следует применять с другими ЛС.
Передозировка
Не регистрировалось случаев передозировки в клинических исследованиях.
В клинических исследованиях деносумаб вводился в дозах до 180 мг, каждые 4 нед (суммарная доза в течение 6 мес — до 1080 мг), при этом дополнительных нежелательных реакций не наблюдалось.
Особые указания
Препараты кальция и витамина D. Всем пациентам рекомендуется прием препаратов кальция и витамина D в адекватных дозах во время терапии препаратом Пролиа®.
Меры предосторожности при использовании
Гипокальциемия. Важно выявить пациентов с риском развития гипокальциемии. Гипокальциемия должна быть скорректирована приемом препаратов кальция и витамина D в адекватных дозах до начала терапии. Рекомендуется мониторинг концентрации кальция перед введением каждой дозы препарата у пациентов, предрасположенных к развитию гипокальциемии, в течение 2 нед после введения первой дозы. При развитии симптомов гипокальциемии в течение курса терапии (см. «Побочные действия»), необходимо оценить концентрацию кальция в крови. Пациенты должны быть предупреждены о необходимости сообщать при появлении симптомов, указывающих на гипокальциемию. В постмаркетинговых исследованиях отмечались случаи тяжелой симптоматической гипокальциемии (см. «Побочные действия») которые чаще всего регистрировались в течение первых недель после начала терапии, однако их развитие возможно и в более поздние сроки. Одновременная терапия ГКС является дополнительным фактором риска развития гипокальциемии.
Почечная недостаточность. У пациентов с тяжелым нарушением функции почек (имеющие Cl креатинина <30 мл/мин) или получающих диализ существует повышенный риск развития гипокальциемии. Риск развития гипокальциемии и сопутствующего увеличения уровня паратиреоидного гормона возрастает с увеличением степени тяжести нарушения функции почек. Данным пациентам особенно важно принимать препараты кальция и витамина D в адекватных дозах, а также проводить регулярный мониторинг концентрации кальция в крови (см. выше).
Инфекции кожи и подкожно-жировой клетчатки. У пациентов, получающих препарат Пролиа®, возможно развитие кожных инфекций и воспаления подкожно-жировой клетчатки, требующих госпитализации (см. «Побочные действия»). Пациентам следует сообщить о необходимости немедленного обращения за медицинской помощью при появлении признаков или симптомов воспаления подкожно-жировой клетчатки.
ОНЧ. Были зарегистрированы редкие случаи ОНЧ у пациентов, получавших препарат Пролиа® для лечения остеопороза (см. «Побочные действия»). Необходимо отложить начало терапии/проведение нового курса терапии у пациентов с незажившими открытыми повреждениями мягких тканей полости рта. Перед началом терапии деносумабом у пациентов с наличием сопутствующих факторов риска необходимо проведение стоматологического обследования и превентивных стоматологических мероприятий, а также индивидуальная оценка соотношения пользы и рисков терапии деносумабом. При оценке индивидуального риска развития ОНЧ у пациента необходимо учитывать следующие факторы риска:
— активность лекарственного препарата, ингибирующего резорбцию костной ткани (увеличение риска для сильнодействующих препаратов);
— способ введения (увеличение риска при парентеральном введении) и суммарная доза антирезорбтивной терапии;
— злокачественные опухоли, сопутствующая патология (например, анемия, коагулопатии, инфекции), курение;
— сопутствующая терапия (кортикостероиды, химиотерапия, ингибиторы ангиогенеза, лучевая терапия области головы и шеи);
— недостаточная гигиена полости рта, болезни пародонта, плохо подобранные зубные протезы, наличие стоматологических заболеваний в анамнезе, инвазивные стоматологические процедуры (например, экстракция зубов).
Во время лечения деносумабом всем пациентам следует поддерживать надлежащую гигиену полости рта, проходить регулярные стоматологические осмотры, а также немедленно сообщать о любых нежелательных симптомах со стороны ротовой полости, таких как подвижность зубов, боль, отек, незаживающие поражения слизистой или наличие выделений. В процессе терапии инвазивные стоматологические процедуры следует проводить только после тщательной оценки; необходимо избегать выполнения данных процедур непосредственно перед введением и/или сразу после введения препарата Пролиа®.
План лечения пациентов с ОНЧ должен быть разработан совместно с лечащим врачом и стоматологом или челюстно-лицевым хирургом с опытом лечения данной патологии. Следует рассмотреть вопрос о временном прекращении терапии до разрешения данного состояния и устранения факторов риска во всех случаях, когда это возможно.
Остеонекроз наружного слухового канала. На фоне терапии деносумабом отмечались случаи остеонекроза наружного слухового прохода. Возможными факторами риска данного состояния являются применение стероидов и химиотерапия, и/или местные факторы риска, такие как инфекция или травма. Возможность развития остеонекроза наружного слухового канала следует рассматривать у пациентов, принимающих деносумаб, у которых имеются симптомы со стороны уха, включая хронические инфекции уха.
Атипичные переломы бедра. Атипичные переломы бедренной кости отмечались у пациентов, принимающих Пролиа® (см. «Побочные действия»). Атипичные переломы бедренной кости могут возникать при небольших травмах или отсутствии травм в подвертельной или диафизарной проксимальной части бедренной кости. На рентгенологических снимках эти переломы обычно имеют характерный внешний вид. Об атипичных переломах бедренной кости также сообщалось у пациентов с определенными сопутствующими заболеваниями и состояниями (например, недостаток витамина D, ревматоидный артрит, гипофосфатазия) и у пациентов, получающих некоторые виды терапии (например, бисфосфонаты, ГКС, ингибиторы протонной помпы). Эти случаи также наблюдались и в отсутствии антирезорбтивной терапии. Подобные переломы, связанные с приемом бисфосфонатов, часто имеют двусторонний характер; поэтому у пациентов, получающих терапию деносумабом, при выявлении перелома бедренной кости, необходимо обследование бедра с противоположной стороны. Следует рассмотреть вопрос о прекращении лечения препаратом Пролиа® у пациентов с подозрением на атипичный перелом бедра, с учетом индивидуальной оценки соотношения пользы и риска. Во время лечения Пролиа® пациентов следует предупредить о необходимости информирования о новых или необычных болях в области бедренной кости, тазобедренной кости или паховой области. Пациенты, у которых возникают такие симптомы, должны быть обследованы на наличие неполных переломов бедренной кости.
МПП вследствие отмены лечения препаратом Пролиа®, в особенности у пациентов с переломами позвоночника в анамнезе. Пациентов следует проинструктировать о том, что нельзя прерывать терапию препаратом Пролиа® без консультации с лечащим врачом. Перед отменой лечения препаратом Пролиа® необходимо провести индивидуальную оценку соотношения польза/риск. В случае отмены лечения препаратом Пролиа® необходимо рассмотреть перевод на альтернативную антирезорбтивную терапию.
Длительная антирезорбтивная терапия. Длительная антирезорбтивная терапия (как деносумабом, так и бисфосфонатами) может способствовать повышению риска развития таких осложнений, как остеонекроз челюсти и атипичные переломы бедра, вследствие выраженного подавления процессов ремоделирования кости (см. «Способ применения и дозы»).
Одновременное применение других ЛС, содержащих деносумаб. Пациенты, получающие терапию препаратом Пролиа®, не должны получать одновременно другие содержащие деносумаб лекарственные препараты (для профилактики осложнений со стороны костной ткани у взрослых с сóлидными опухолями, метастазирующими в кость).
Сухой натуральный каучук. Колпачок иглы предварительно заполненного шприца содержит сухой натуральный каучук (производное латекса), который может вызывать аллергические реакции.
Предупреждения в отношении вспомогательных веществ. Данный препарат содержит 47 мг сорбитола в 1 мл раствора. Следует учитывать аддитивный эффект одновременного применения препаратов, содержащих сорбитол (или фруктозу), а также поступления сорбитола (или фруктозы) с пищей. Данный препарат содержит менее 1 ммоль натрия (23 мг) в 60 мг, т.е. может расцениваться как несодержащий натрия.
Особые меры предосторожности при применении и утилизации. Перед введением следует оценить раствор на предмет наличия включений или изменения цвета. Раствор нельзя использовать при помутнении, наличии взвешенных частиц или изменении цвета. Не встряхивать. Чтобы избежать дискомфорта в месте введения, следует довести препарат до комнатной температуры (до 25 °C) перед инъекцией, а затем медленно ввести все содержимое предварительно заполненного шприца. Любое количество неиспользованного препарата или неиспользованных материалов должно быть утилизировано в соответствии с надлежащими требованиями.
Влияние на способность управлять транспортными средствами, механизмами. Исследований влияния препарата Пролиа® на способность к управлению автомобилем и работе с механизмами не проводилось.
Форма выпуска
Предварительно заполненные шприцы с раствором для п/к введения 60 мг/мл.
Раствор для п/к введения 60 мг/мл в одноразовом ПЗШ 1 мл из стекла I гидролитического класса с иглой 27G из нержавеющей стали, эластомерным колпачком и эластомерным плунжером, ламинированным фторполимером (с защитным устройством для иглы или без него). Маркированный шприц помещают в пачку картонную.
ПЗШ может быть дополнительно помещен в контурную ячейковую упаковку с термоэтикеткой. Каждую контурную ячейковую упаковку помещают в пачку картонную вместе с карточкой для пациента с описанием техники инъекции (для ПЗШ — с защитным устройством для иглы). Пачка картонная снабжена отрывной карточкой-напоминанием с двумя напоминающими наклейками. На каждую пачку наклеивают прозрачные защитные этикетки, имеющие продольную цветную полосу — контроль первого вскрытия.
Пролиа® представляет собой стерильный продукт и не содержит консервантов.
Производитель
Амджен Мэньюфэкчуринг Лимитед, Пуэрто-Рико, Роуд 31, Км 24,6, Джанкос, Пуэрто-Рико, 00777.
Выпускающий контроль качества. Амджен Европа Б.В., Нидерланды Минервум 7061,4817 ZK Бреда, Нидерланды или Амджен Технолоджи (Айрлэнд) Анлимитед Компани, Поттери Роуд, Дан Лэйри, графство Дублин, Ирландия.
Или
ООО «Добролек», 115446, Москва, Коломенский пр., 13А.
Организация, принимающая претензии от потребителей ООО «Амджен». 123112, Москва, Пресненская наб., 8, стр. 1, 7-й эт.
Тел.: (495) 745-04-78; факс: (499) 995-19-65.
Условия отпуска из аптек
По рецепту.
RU-P-MLTP-0919-078239
Условия хранения
При температуре 2–8 °C в оригинальной упаковке (не замораживать).
Хранить в оригинальной упаковке для защиты от света. Не встряхивать. После изъятия из холодильника Пролиа® может храниться при комнатной температуре не выше 25°С в оригинальной упаковке не более 30 дней.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Содержание
- Краткое описание препарата
- Фармакодинамика: механизм действия и терапевтический эффект
- Фармакокинетика Лорноксикама
- Показания к применению
- Противопоказания
- Схема лечения и режим дозирования
- Передозировка
- Побочные действия
- Взаимодействие с другими лекарственными препаратами
- Особые указания
- Условия и сроки хранения
- Условия продажи
- Стоимость препарата
- Аналоги Лорноксикама
- Отзывы о Лорноксикаме
- Источники
Краткое описание препарата
Лорноксикам – лекарство для быстрого снятия болевого приступа и воспалительных процессов в организме. Выпускается в виде таблеток, а также в форме порошка для приготовления раствора для инъекции. Перед использованием препарата нужно внимательно изучить его побочные реакции, противопоказания и точную дозировку.
Код ATX
М01АС05
Действующее вещество
Лорноксикам (lornoxicam)
Торговое наименование препарата
Лорноксикам (Lornoxicamum)
Фармакотерапевтическая группа
Нестероидный противовоспалительный препарат (НПВП)
Форма выпуска
Лиофилизат для приготовления раствора для внутривенного и внутримышечного введения, 8 мг.
Количество препарата, содержащее 8 мг действующего вещества, помещают во флаконы светозащитного стекла вместимостью 10 мл, укупоренные пробками резиновыми и обкатанные колпачками алюминиевыми.
По 5 флаконов в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой или без фольги.
1 контурную ячейковую упаковку вместе с инструкцией по применению препарата помещают в пачку из картона.
В форме таблеток лорноксикам выпускается под торговым наименованием Ксефокам. Таблетки, покрытые оболочкой 4 мг и 8 мг, продолговатые, овальной формы, от белого до желтоватого цвета, гладкие с обеих сторон (для дозировки 4 мг) Таблетки, покрытые оболочкой, продолговатые, овальной формы, от белого до желтоватого цвета с тиснением «L8» с одной стороны и гладкие с другой стороны (для дозировки 8 мг).
Упаковка препарата Лорноксикам
Состав
1 флакон содержит:
- лорноксикам – 8,0 мг;
- маннитол (маннит) – 100,0 мг;
- трометамол – 12,0 мг;
- динатрия эдетат (динатриевая соль этилендиаминтетрауксусной кислоты дигидрат) – 0,2 мг;
- натрия гидроксид – до pH 8,0-9,5.
Одна таблетка содержит:
- лорноксикам 4 мг или 8 мг;
- лактозы моногидрат;
- целлюлоза микрокристаллическая;
- повидон;
- натрия кроскармеллоза;
- магния стеарат;
- опадрий белый 03F58750.*
*опадрий белый 03F58750: тальк, полиэтиленгликоль, гидроксипропилметилцеллюлоза, титана диоксид (Е 171).
Производитель
Nycomed Austria (Австрия)
Фармакодинамика: механизм действия и терапевтический эффект
Лорноксикам является нестероидным противовоспалительным средством, обладает выраженным обезболивающим и противовоспалительным действием, относится к классу оксикамов.
Механизм действия связан с подавлением факторов воспаления; угнетением синтеза простагландинов, обусловленным ингибированием ЦОГ1 и ЦОГ2, что приводит к нарушению метаболизма арахидоновой кислоты и угнетению синтеза простагландинов как в очаге воспаления, так и в здоровых тканях. Подавляет экссудативную и пролиферативную фазы воспаления.
- Лорноксикам не оказывает влияния на основные показатели состояния организма: температуру тела, частоту сердечных сокращений (ЧСС), артериальное давление (АД), данные электрокардиограммы (ЭКГ), спирометрию.
Анальгетический эффект лорноксикама не связан с наркотическим действием. - Препарат Лорноксикам не оказывает опиатоподобного действия на центральную нервную систему (ЦНС) и, в отличие от наркотических анальгетиков, не угнетает дыхания, не вызывает лекарственной зависимости.
- Вследствие наличия местно-раздражающего действия в отношении желудочно-кишечного тракта (ЖКТ) и системного ульцерогенного эффекта, связанных с подавлением синтеза простагландинов, осложнения со стороны ЖКТ являются частыми нежелательными эффектами при лечении нестероидными противовоспалительными препаратами.
Лорноксикам обладает обезболивающим эффектом
Фармакокинетика Лорноксикама
- Всасывание
Максимальная концентрация (Сmax) лорноксикама в плазме крови при внутримышечном (в/м) введении достигается примерно через 0,4 часа.
Абсолютная биодоступность (рассчитанная по AUC – площадь под кривой «концентрация-время») после в/м введения составляет 97%.
- Распределение
Лорноксикам обнаруживается в плазме крови в неизменном виде и в виде гидроксилированного метаболита. Степень связывания лорноксикама с белками плазмы составляет около 99% и не зависит от концентрации.
- Биотрансформация
Лорноксикам в значительной степени метаболизируется в печени, в основном посредством гидроксилирования до неактивного 5-гидроксилорноксикама. Биотрансформация лорноксикама осуществляется посредством изофермента CYP2C9.
Вследствие полиморфизма гена, кодирующего данный фермент, существуют люди с медленным и быстрым метаболизмом препарата, что может привести к значительному повышению уровня лорноксикама в плазме у лиц с медленным метаболизмом.
Гидроксилированный метаболит не обладает фармакологической активностью. Лорноксикам полностью метаболизируется: примерно 2/3 препарата выводится печенью, а 1/3 – почками в виде неактивного метаболита.
- Выведение
Период полувыведения (Т1/2) лорноксикама в среднем составляет от 3 до 4 часов.
У лиц старческого возраста (старше 65 лет) клиренс препарата снижен на 30-40%.
У пациентов с нарушениями функции печени или почек не наблюдается значимых изменений кинетики лорноксикама, за исключением кумуляции у пациентов с хроническими заболеваниями печени после 7 дней лечения в суточной дозе 12 мг или 16 мг.
Показания к применению
- ревматоидный артрит;
- остеоартрит;
- анкилозирующий спондилит;
- суставной синдром при обострении подагры;
- бурсит;
- тендовагинит;
- умеренный и выраженный болевой синдром (в т.ч. артралгия, миалгия, невралгия, люмбаго, ишиалгия, мигрень, зубная и головная боль, альгодисменорея, боль при травмах, ожогах;
- лихорадочный синдром (при простудных и инфекционных заболеваниях).
Лорноксикам обладает обезболивающим эффектом
Фармакокинетика Лорноксикама
- Всасывание
Максимальная концентрация (Сmax) лорноксикама в плазме крови при внутримышечном (в/м) введении достигается примерно через 0,4 часа.
Абсолютная биодоступность (рассчитанная по AUC – площадь под кривой «концентрация-время») после в/м введения составляет 97%.
- Распределение
Лорноксикам обнаруживается в плазме крови в неизменном виде и в виде гидроксилированного метаболита. Степень связывания лорноксикама с белками плазмы составляет около 99% и не зависит от концентрации.
- Биотрансформация
Лорноксикам в значительной степени метаболизируется в печени, в основном посредством гидроксилирования до неактивного 5-гидроксилорноксикама. Биотрансформация лорноксикама осуществляется посредством изофермента CYP2C9.
Вследствие полиморфизма гена, кодирующего данный фермент, существуют люди с медленным и быстрым метаболизмом препарата, что может привести к значительному повышению уровня лорноксикама в плазме у лиц с медленным метаболизмом.
Гидроксилированный метаболит не обладает фармакологической активностью. Лорноксикам полностью метаболизируется: примерно 2/3 препарата выводится печенью, а 1/3 – почками в виде неактивного метаболита.
- Выведение
Период полувыведения (Т1/2) лорноксикама в среднем составляет от 3 до 4 часов.
У лиц старческого возраста (старше 65 лет) клиренс препарата снижен на 30-40%.
У пациентов с нарушениями функции печени или почек не наблюдается значимых изменений кинетики лорноксикама, за исключением кумуляции у пациентов с хроническими заболеваниями печени после 7 дней лечения в суточной дозе 12 мг или 16 мг.
Показания к применению
- ревматоидный артрит;
- остеоартрит;
- анкилозирующий спондилит;
- суставной синдром при обострении подагры;
- бурсит;
- тендовагинит;
- умеренный и выраженный болевой синдром (в т.ч. артралгия, миалгия, невралгия, люмбаго, ишиалгия, мигрень, зубная и головная боль, альгодисменорея, боль при травмах, ожогах;
- лихорадочный синдром (при простудных и инфекционных заболеваниях).
Ревматоидный артрит — одно из показаний к применению Лорноксикама
Нозологическая классификация (МКБ-10)
- M06.9 Ревматоидный артрит неуточненный
- M10 Подагра
- M13.9 Артрит неуточненный
- M15-M19 Артрозы
- M25.5 Боль в суставе
- M54.3 Ишиас
- R52.1 Постоянная некупирующаяся боль
- R52.2 Другая постоянная боль
Противопоказания
- гиперчувствительность к лорноксикаму или любому из вспомогательных веществ;
- полное или неполное сочетание бронхиальной астмы, рецидивирующего полипоза носа или околоносовых пазух, ринит, ангионевротический отек, крапивница и непереносимость ацетилсалициловой кислоты и других НПВП (в т.ч. в анамнезе);
- тромбоцитопения;
- геморрагический диатез или нарушения свертываемости крови, а также тем, кто перенес операции, сопряженные с риском кровотечения или неполного гемостаза;
- период после проведения аортокоронарного шунтирования;
- декомпенсированная сердечная недостаточность;
- эрозивно-язвенные изменения слизистой желудка или 12-перстной кишки, активное желудочно-кишечное кровотечение; цереброваскулярное или иное кровотечение;
- желудочно-кишечные кровотечения или перфорация язвы в анамнезе, связанные с приемом НПВП;
- активная пептическая язва или рецидивирующая пептическая язва в анамнезе;
- воспалительные заболевания кишечника (болезнь Крона, язвенный колит) в фазе обострения;
- тяжелая печеночная недостаточность;
- выраженная почечная недостаточность (уровень сывороточного креатинина более 700 мкмоль/л), прогрессирующие заболевания почек, подтвержденная гиперкалиемия;
- беременность и период грудного вскармливания;
- пациентам в возрасте до 18 лет (из-за недостаточного клинического опыта).
При почечной недостаточности применение Лорноксикама ограничено
Применение с осторожностью
При следующих нарушениях препарат Лорноксикам следует назначать только после тщательной оценки ожидаемой пользы терапии и возможного риска:
- Нарушение функции почек: легкой степени (креатинин сыворотки 150-300 мкмоль/л) и умеренной степени (креатинин сыворотки 300-700 мкмоль/л), так как поддержание почечного кровотока зависит от уровня почечных простагландинов. Прием препарата Лорноксикам следует прекратить в случае ухудшения функции почек в процессе лечения.
- Контроль функции почек должен осуществляться у пациентов, которым было выполнено обширное оперативное вмешательство, пациентов с сердечной недостаточностью, получающих диуретики, а также в случае применения препаратов, обладающих доказанной или предполагаемой нефротоксичностью.
- Нарушение системы свертывания крови: рекомендовано тщательное клиническое наблюдение и оценка лабораторных показателей, например активированного частичного тромбинового времени (АЧТВ).
- Нарушение функции печени (цирроз печени): следует проводить регулярное клиническое наблюдение и оценку лабораторных показателей, так как при лечении лорноксикамом в суточной дозе 12-16 мг возможна кумуляция препарата.
- Длительное лечение (более 3-х месяцев): рекомендуется регулярная оценка лабораторных показателей крови (гемоглобин), функции почек (креатинин) и ферментов печени.
- Пациенты старше 65 лет: рекомендуется контроль функции печени и почек. Применять с осторожностью у пожилых лиц в послеоперационном периоде.
- Необходимо избегать одновременного приема с другими НПВП, включая селективные ингибиторы циклооксигеназы-2.
- Нежелательные эффекты можно минимизировать, используя наименьшую эффективную дозу препарата в течение наименьшего промежутка времени, достаточного для контроля симптомов.
- Желудочно-кишечное кровотечение, язва, перфорация, которые отмечались ранее при применении всех НПВП на любом этапе лечения и могут привести к летальному исходу. Наличие Helicobacter pylori.
- Явления желудочно-кишечной токсичности в анамнезе, в частности в пожилом возрасте.
- При одновременном приеме таких лекарственных средств, как пероральные глюкокортикостероиды (например, преднизолон), антикоагулянты (например, варфарин), селективные ингибиторы обратного захвата серотонина (например, циталопрам, флуоксетин, пароксетин, сертралин) и антитромбоцитарные препараты (например, ацетилсалициловая кислота, клопидогрел).
- При одновременном применении НПВП и гепарина при проведении спинальной и эпидуральной анестезии повышается риск развития гематомы.
- Патология ЖКТ в анамнезе (язвенный колит, болезнь Крона), так как состояние пациента может ухудшиться.
- Артериальная гипертензия и/или сердечная недостаточность в анамнезе, так как при применении НПВП отмечалась задержка жидкости и развитие отеков.
- При наличии заболеваний периферических артерий или цереброваскулярных заболеваний, наличии факторов риска развития сердечно-сосудистых заболеваний, таких как артериальная гипертензия, гиперлипидемия, сахарный диабет, курение, следует назначать Лорноксикам только после тщательной оценки ожидаемой пользы терапии и возможного риска.
- Лорноксикам, как и другие НПВП, может повысить риск артериальных тромбоэмболических осложнений (например, инфаркта миокарда или инсульта).
- С осторожностью следует назначать препарат пациентам с бронхиальной астмой в активной фазе или в анамнезе, поскольку известно, что НПВП могут спровоцировать у таких пациентов бронхоспазм.
- В очень редких случаях возможны тяжелые кожные реакции, приводящие к летальному исходу, в том числе эксфолиативному дерматиту, синдрому Стивенса-Джонсона и токсическому эпидермальному некролизу.
- Применение препарата Лорноксикам, как и любого препарата, подавляющего синтез простагландинов, может нарушать способность к оплодотворению, поэтому не рекомендуется применять женщинам, желающим забеременеть.
- У пациентов с системной красной волчанкой (СКВ) и смешанными заболеваниями соединительной ткани может быть повышен риск асептического менингита.
- Лорноксикам подавляет агрегацию тромбоцитов и удлиняет время кровотечения, поэтому следует с осторожностью назначать его при повышенной склонности к кровотечениям.
- Одновременное применение НПВП и такролимуса может привести к повышению риска нефротоксичного действия вследствие угнетения синтеза простациклина в почках.
- Рекомендуется избегать применения лорноксикама при инфекциях, вызванных вирусом ветряной оспы.
Если у Вас одно из перечисленных заболеваний, перед приемом препарата обязательно проконсультируйтесь с врачом.
При почечной недостаточности применение Лорноксикама ограничено
Применение с осторожностью
При следующих нарушениях препарат Лорноксикам следует назначать только после тщательной оценки ожидаемой пользы терапии и возможного риска:
- Нарушение функции почек: легкой степени (креатинин сыворотки 150-300 мкмоль/л) и умеренной степени (креатинин сыворотки 300-700 мкмоль/л), так как поддержание почечного кровотока зависит от уровня почечных простагландинов. Прием препарата Лорноксикам следует прекратить в случае ухудшения функции почек в процессе лечения.
- Контроль функции почек должен осуществляться у пациентов, которым было выполнено обширное оперативное вмешательство, пациентов с сердечной недостаточностью, получающих диуретики, а также в случае применения препаратов, обладающих доказанной или предполагаемой нефротоксичностью.
- Нарушение системы свертывания крови: рекомендовано тщательное клиническое наблюдение и оценка лабораторных показателей, например активированного частичного тромбинового времени (АЧТВ).
- Нарушение функции печени (цирроз печени): следует проводить регулярное клиническое наблюдение и оценку лабораторных показателей, так как при лечении лорноксикамом в суточной дозе 12-16 мг возможна кумуляция препарата.
- Длительное лечение (более 3-х месяцев): рекомендуется регулярная оценка лабораторных показателей крови (гемоглобин), функции почек (креатинин) и ферментов печени.
- Пациенты старше 65 лет: рекомендуется контроль функции печени и почек. Применять с осторожностью у пожилых лиц в послеоперационном периоде.
- Необходимо избегать одновременного приема с другими НПВП, включая селективные ингибиторы циклооксигеназы-2.
- Нежелательные эффекты можно минимизировать, используя наименьшую эффективную дозу препарата в течение наименьшего промежутка времени, достаточного для контроля симптомов.
- Желудочно-кишечное кровотечение, язва, перфорация, которые отмечались ранее при применении всех НПВП на любом этапе лечения и могут привести к летальному исходу. Наличие Helicobacter pylori.
- Явления желудочно-кишечной токсичности в анамнезе, в частности в пожилом возрасте.
- При одновременном приеме таких лекарственных средств, как пероральные глюкокортикостероиды (например, преднизолон), антикоагулянты (например, варфарин), селективные ингибиторы обратного захвата серотонина (например, циталопрам, флуоксетин, пароксетин, сертралин) и антитромбоцитарные препараты (например, ацетилсалициловая кислота, клопидогрел).
- При одновременном применении НПВП и гепарина при проведении спинальной и эпидуральной анестезии повышается риск развития гематомы.
- Патология ЖКТ в анамнезе (язвенный колит, болезнь Крона), так как состояние пациента может ухудшиться.
- Артериальная гипертензия и/или сердечная недостаточность в анамнезе, так как при применении НПВП отмечалась задержка жидкости и развитие отеков.
- При наличии заболеваний периферических артерий или цереброваскулярных заболеваний, наличии факторов риска развития сердечно-сосудистых заболеваний, таких как артериальная гипертензия, гиперлипидемия, сахарный диабет, курение, следует назначать Лорноксикам только после тщательной оценки ожидаемой пользы терапии и возможного риска.
- Лорноксикам, как и другие НПВП, может повысить риск артериальных тромбоэмболических осложнений (например, инфаркта миокарда или инсульта).
- С осторожностью следует назначать препарат пациентам с бронхиальной астмой в активной фазе или в анамнезе, поскольку известно, что НПВП могут спровоцировать у таких пациентов бронхоспазм.
- В очень редких случаях возможны тяжелые кожные реакции, приводящие к летальному исходу, в том числе эксфолиативному дерматиту, синдрому Стивенса-Джонсона и токсическому эпидермальному некролизу.
- Применение препарата Лорноксикам, как и любого препарата, подавляющего синтез простагландинов, может нарушать способность к оплодотворению, поэтому не рекомендуется применять женщинам, желающим забеременеть.
- У пациентов с системной красной волчанкой (СКВ) и смешанными заболеваниями соединительной ткани может быть повышен риск асептического менингита.
- Лорноксикам подавляет агрегацию тромбоцитов и удлиняет время кровотечения, поэтому следует с осторожностью назначать его при повышенной склонности к кровотечениям.
- Одновременное применение НПВП и такролимуса может привести к повышению риска нефротоксичного действия вследствие угнетения синтеза простациклина в почках.
- Рекомендуется избегать применения лорноксикама при инфекциях, вызванных вирусом ветряной оспы.
Если у Вас одно из перечисленных заболеваний, перед приемом препарата обязательно проконсультируйтесь с врачом.
Перед применением Лорноксикама нужно посоветоваться с врачом
Схема лечения и режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Таблетки
При приеме внутрь — по 4 мг 2-3 раза/сут или по 8 мг 2 раза/сут. Максимальные суточные дозы:
- при отстствии относительных противопоказаний — 16 мг;
- при сопутствующих заболеваниях ЖКТ, нарушениях функции почек или печени, пациентам пожилого возраста (старше 65 лет), при массе тела менее 50 кг, а также после перенесенного обширного оперативного вмешательства — 12 мг в 3 приема.
Лиофилизат
В/в или в/м начальная доза — 8-16 мг. При недостаточном анальгезирующем эффекте в дозе 8 мг можно ввести повторно еще 8 мг. Суточная доза не должна превышать 16 мг.
Раствор для инъекций готовят путем растворения содержимого одного флакона (8 мг лорноксикама) водой для инъекций (2 мл). После приготовления раствора иглу заменяют.
Приготовленный таким образом раствор вводят внутривенно или внутримышечно при послеоперационных болях и внутримышечно при остром приступе люмбаго/ишиалгии. Внутримышечные инъекции делают длинной иглой.
Длительность внутривенного введения раствора должна составлять не менее 15 секунд, внутримышечного – не менее 5 секунд.
Следует использовать минимально эффективную дозу минимально возможным коротким курсом.
Передозировка
В настоящее время нет данных по передозировке лорноксикама, которые позволяли бы оценить ее последствия или предположить специфическое лечение.
Однако при превышении максимальной суточной дозы могут наблюдаться следующие симптомы: тошнота и рвота, церебральные симптомы (головокружение, расстройство зрения, атаксия, переходящая в кому, и судороги). Возможны изменения функции печени и почек и нарушения свертываемости крови.
В случае подозрения на передозировку терапию препаратом немедленно прекращают. Вследствие своего короткого периода полувыведения лорноксикам быстро удаляется из организма. Диализ неэффективен.
До настоящего времени о существовании специфического антидота не известно. Для лечения желудочно-кишечных расстройств могут применяться аналоги простагландина или ранитидин.
При передозировке Лорноксикама возможны расстройства пищеварения
Побочные действия
Нежелательные нарушения со стороны систем и органов при приеме Лорноксикама (классифицированы следующим образом: очень часто – ≥ 1/10, часто – ≥ 1/100 и < 1/10, нечасто – ≥ 1/1000 и < 1/100, редко – ≥ 1/10 000 и < 1/1000, крайне редко – < 1/10 000, включая отдельные случаи):
- инфекционные и паразитарные заболевания: редко – фарингит;
- кровь и лимфатическая система: редко – возрастание времени кровотечения, тромбоцитопения, анемия, лейкопения; крайне редко – экхимозы; имеются сообщения о том, что НПВС способны приводить к развитию потенциально тяжелых гематологических нарушений, таких как агранулоцитоз, нейтропения, апластическая анемия, гемолитическая анемия (класс-специфические эффекты);
- иммунная система: редко – реакции гиперчувствительности, анафилактические и анафилактоидные реакции;
- обмен веществ и нарушения питания: нечасто – изменение веса, анорексия;
- нервная система: часто – непродолжительные головные боли слабой интенсивности, головокружение; редко – нарушение вкуса, парестезии, тремор, сомноленция, мигрень; крайне редко – асептический менингит у больных смешанными поражениями соединительной ткани и СКВ;
- нарушения психики: нечасто – нарушение сна, депрессия; редко – тревожное возбуждение, нервозность, спутанность сознания;
- орган зрения: нечасто – конъюнктивит; редко – расстройства зрения;
- орган слуха и лабиринтные нарушения: нечасто – шум в ушах, головокружение;
- сердечно-сосудистая система: нечасто – приливы крови к лицу, сердцебиение, отеки, тахикардия, сердечная недостаточность; редко – гематома, кровотечение, артериальная гипертензия;
- дыхательная система, органы грудной клетки и средостения: нечасто – ринит; редко – кашель, диспноэ, бронхоспазм;
- пищеварительный тракт: часто – боли в животе, тошнота, диспепсические явления, рвота, диарея; нечасто – боли в эпигастральной области, сухость во рту, отрыжка, метеоризм, запор, изъязвления в полости рта, гастрит, язвенная болезнь 12-перстной кишки, язвенная болезнь желудка; редко – стоматит, глоссит, афтозный стоматит, кровавая рвота, мелена, эзофагит, дисфагия, гастроэзофагеальный рефлюкс, желудочно-кишечное кровотечение, перфоративная пептическая язва;
- печень и желчевыводящие пути: нечасто – рост показателей тестов деятельности печени, аспартатаминотрансферазы (ACT) или аланинаминотрансферазы (АЛТ); редко – нарушение функции печени; крайне редко – повреждение гепатоцитов; гепатотоксичность может вызвать печеночную недостаточность, гепатит, желтуху и холестаз;
- кожа и подкожные ткани: нечасто – потливость, зуд, сыпь, крапивница, алопеция, эритематозная сыпь, отек Квинке; редко – дерматит, пурпура, экзема; крайне редко – отеки, синдром Стивенса – Джонсона, буллезные реакции, токсический эпидермальный некролиз (иногда с летальным исходом);
- скелетно-мышечная и соединительная ткани: нечасто – артралгия; редко – спазмы мышц, боли в костях, миалгия;
- почки и мочевыводящие пути: редко – нарушения мочеиспускания, никтурия, увеличение содержания креатинина и мочевины в крови; крайне редко – при наличии нарушения функции почек, на фоне которого в целях поддержания почечного кровотока требуются почечные простагландины, лорноксикам может вызвать острую почечную недостаточность (различные формы нефротоксичности, в т. ч. нефрит и нефротический синдром, являются класс-специфическим эффектом НПВС);
- общие расстройства и нарушения в месте введения: нечасто – отек лица, недомогание; редко – астения.
Если любые из вышеуказанных нежелательных реакций усугубляются, или наблюдается появление других нарушений, следует получить консультацию врача.
При передозировке Лорноксикама возможны расстройства пищеварения
Побочные действия
Нежелательные нарушения со стороны систем и органов при приеме Лорноксикама (классифицированы следующим образом: очень часто – ≥ 1/10, часто – ≥ 1/100 и < 1/10, нечасто – ≥ 1/1000 и < 1/100, редко – ≥ 1/10 000 и < 1/1000, крайне редко – < 1/10 000, включая отдельные случаи):
- инфекционные и паразитарные заболевания: редко – фарингит;
- кровь и лимфатическая система: редко – возрастание времени кровотечения, тромбоцитопения, анемия, лейкопения; крайне редко – экхимозы; имеются сообщения о том, что НПВС способны приводить к развитию потенциально тяжелых гематологических нарушений, таких как агранулоцитоз, нейтропения, апластическая анемия, гемолитическая анемия (класс-специфические эффекты);
- иммунная система: редко – реакции гиперчувствительности, анафилактические и анафилактоидные реакции;
- обмен веществ и нарушения питания: нечасто – изменение веса, анорексия;
- нервная система: часто – непродолжительные головные боли слабой интенсивности, головокружение; редко – нарушение вкуса, парестезии, тремор, сомноленция, мигрень; крайне редко – асептический менингит у больных смешанными поражениями соединительной ткани и СКВ;
- нарушения психики: нечасто – нарушение сна, депрессия; редко – тревожное возбуждение, нервозность, спутанность сознания;
- орган зрения: нечасто – конъюнктивит; редко – расстройства зрения;
- орган слуха и лабиринтные нарушения: нечасто – шум в ушах, головокружение;
- сердечно-сосудистая система: нечасто – приливы крови к лицу, сердцебиение, отеки, тахикардия, сердечная недостаточность; редко – гематома, кровотечение, артериальная гипертензия;
- дыхательная система, органы грудной клетки и средостения: нечасто – ринит; редко – кашель, диспноэ, бронхоспазм;
- пищеварительный тракт: часто – боли в животе, тошнота, диспепсические явления, рвота, диарея; нечасто – боли в эпигастральной области, сухость во рту, отрыжка, метеоризм, запор, изъязвления в полости рта, гастрит, язвенная болезнь 12-перстной кишки, язвенная болезнь желудка; редко – стоматит, глоссит, афтозный стоматит, кровавая рвота, мелена, эзофагит, дисфагия, гастроэзофагеальный рефлюкс, желудочно-кишечное кровотечение, перфоративная пептическая язва;
- печень и желчевыводящие пути: нечасто – рост показателей тестов деятельности печени, аспартатаминотрансферазы (ACT) или аланинаминотрансферазы (АЛТ); редко – нарушение функции печени; крайне редко – повреждение гепатоцитов; гепатотоксичность может вызвать печеночную недостаточность, гепатит, желтуху и холестаз;
- кожа и подкожные ткани: нечасто – потливость, зуд, сыпь, крапивница, алопеция, эритематозная сыпь, отек Квинке; редко – дерматит, пурпура, экзема; крайне редко – отеки, синдром Стивенса – Джонсона, буллезные реакции, токсический эпидермальный некролиз (иногда с летальным исходом);
- скелетно-мышечная и соединительная ткани: нечасто – артралгия; редко – спазмы мышц, боли в костях, миалгия;
- почки и мочевыводящие пути: редко – нарушения мочеиспускания, никтурия, увеличение содержания креатинина и мочевины в крови; крайне редко – при наличии нарушения функции почек, на фоне которого в целях поддержания почечного кровотока требуются почечные простагландины, лорноксикам может вызвать острую почечную недостаточность (различные формы нефротоксичности, в т. ч. нефрит и нефротический синдром, являются класс-специфическим эффектом НПВС);
- общие расстройства и нарушения в месте введения: нечасто – отек лица, недомогание; редко – астения.
Если любые из вышеуказанных нежелательных реакций усугубляются, или наблюдается появление других нарушений, следует получить консультацию врача.
Нарушения сна могут возникать как побочные эффекты от приема Лорноксикама
Взаимодействие с другими лекарственными препаратами
Одновременное применение препарата Лорноксикам и:
- циметидина – повышает концентрацию лорноксикама в плазме крови. Взаимодействия с ранитидином и антацидными препаратами не выявлено;
- антикоагулянтов или ингибиторов агрегации тромбоцитов – возможно увеличение времени кровотечения (повышенный риск кровотечения, необходим контроль международного нормализованного отношения (МНО));
- фенпрокумона – снижает эффективность лечения фенпрокумоном;
- гепарина – НПВП повышают риск развития спинальной/эпидуральной гематомы при одновременном применении с гепарином при проведении спинальной или эпидуральной анестезии;
- бета-адреноблокаторов – снижает гипотензивную эффективность, бета-блокаторов;
- диуретиков – снижает мочегонный эффект и гипотензивное действие петлевых тиазидных и калийсберегающих диуретиков;
- дигоксина – снижает почечный клиренс дигоксина;
- хинолоновых антибиотиков – повышает риск развития судорожного синдрома;
- антиагрегантов – повышает риск желудочно-кишечного кровотечения;
- других НПВП или глюкокортикоидов – увеличивает риск изъязвления ЖКТ или кровотечений;
- метотрексата – повышает сывороточную концентрацию метотрексата. Это может привести к усилению токсичности. При необходимости одновременного назначения этих препаратов требуется пристальное наблюдение за пациентом;
- селективных ингибиторов обратного захвата серотонина (например, циталопрам, флуоксетин, пароксетин, сертралин) – повышает риск ЖКТ кровотечений;
- солей лития – НПВП подавляют почечный клиренс ионов лития, поэтому концентрация лития в сыворотке может превысить предел токсичности. Поэтому необходимо постоянное наблюдение за уровнем ионов лития в сыворотке, особенно на первоначальном этапе лечения, при изменении дозы и прекращении лечения;
- циклоспорина – увеличивает нефротоксичность циклоспорина;
- производных сульфонилмочевины – может усиливать гипогликемический эффект последних;
- цефамандол, цефоперазон, цефотетан, вальпроевая кислота – увеличивает риск кровотечения;
- веществ, являющихся индукторами и ингибиторами изофермента CYP2C9 цитохрома Р450: лорноксикам (как и другие НПВП, метаболизируемые изоферментом CYP2C9 цитохрома Р450) – взаимодействует с его индукторами и ингибиторами;
- такролимуса – повышает риск нефротоксичного эффекта вследствие угнетения синтеза простациклина в почках;
- пеметрекседа – НПВП могут снижать почечный клиренс пеметрекседа, что приводит к возрастанию нефротоксичности и желудочно-кишечной токсичности препарата, а также к угнетению кроветворения.
О совместимости Лорноксикама с другими препаратами нужно узнавать у врача
Особые указания
С осторожностью применять при эрозивно-язвенных поражениях и кровотечениях из ЖКТ (в анамнезе), умеренно выраженной почечной недостаточности, состояниях после хирургических вмешательств, у пациентов пожилого возраста (старше 65 лет), у пациентов с массой тела менее 50 кг.
Лорноксикам следует применять только после тщательной оценки ожидаемой пользы терапии и возможного риска в следующих случаях:
- небольшая степень нарушения функции почек (уровень сывороточного креатинина 150-300 мкмоль/л);
- сердечная недостаточность и другие состояния, сопровождающиеся снижением ОЦК и почечного кровотока;
- нарушения функции печени;
- артериальная гипертензия и состояния, сопровождающиеся задержкой жидкости, отеками;
- пациенты, перенесшие обширное оперативное вмешательство.
У пациентов с нарушениями функции почек в период лечения необходим регулярный контроль функции почек.
Пациентам пожилого возраста, а также больным с артериальной гипертензией при применении лорноксикама показан контроль АД.
При пептической язве желудка и язвенной болезни двенадцатиперстной кишки терапию следует проводить на фоне одновременного приема блокаторов гистаминовых H2-рецепторов или омепразола.
При длительном применении необходимо периодически контролировать картину периферической крови, а также показатели функции печени и почек.
Риск желудочно-кишечного кровотечения, изъязвления или перфорации ЖКТ возрастает с повышением дозы НПВП у пациентов с язвой желудка в анамнезе, особенно если она сопровождалась такими осложнениями, как кровотечение или перфорация у пожилых людей. Таким пациентам следует начинать лечение с наименьшей возможной дозы препарата.
Пациентам, которым необходим одновременный прием ацетилсалициловой кислоты в низких дозах или других препаратов, которые могут повысить риск нежелательных явлений со стороны ЖКТ, показано одновременное назначение препаратов, оказывающих защитное действие (например, мизопростол или ингибиторы протонного насоса).
Рекомендуется регулярное наблюдение. При появлении признаков поражения печени (кожный зуд, пожелтение кожных покровов, тошнота, рвота, боли в животе, потемнение мочи, повышение уровня «печеночных трансаминаз») следует прекратить прием препарата и обратиться к лечащему врачу.
Препарат может изменять свойства тромбоцитов, однако не заменяет профилактического действия ацетилсалициловой кислоты при сердечно-сосудистых заболеваниях.
О совместимости Лорноксикама с другими препаратами нужно узнавать у врача
Особые указания
С осторожностью применять при эрозивно-язвенных поражениях и кровотечениях из ЖКТ (в анамнезе), умеренно выраженной почечной недостаточности, состояниях после хирургических вмешательств, у пациентов пожилого возраста (старше 65 лет), у пациентов с массой тела менее 50 кг.
Лорноксикам следует применять только после тщательной оценки ожидаемой пользы терапии и возможного риска в следующих случаях:
- небольшая степень нарушения функции почек (уровень сывороточного креатинина 150-300 мкмоль/л);
- сердечная недостаточность и другие состояния, сопровождающиеся снижением ОЦК и почечного кровотока;
- нарушения функции печени;
- артериальная гипертензия и состояния, сопровождающиеся задержкой жидкости, отеками;
- пациенты, перенесшие обширное оперативное вмешательство.
У пациентов с нарушениями функции почек в период лечения необходим регулярный контроль функции почек.
Пациентам пожилого возраста, а также больным с артериальной гипертензией при применении лорноксикама показан контроль АД.
При пептической язве желудка и язвенной болезни двенадцатиперстной кишки терапию следует проводить на фоне одновременного приема блокаторов гистаминовых H2-рецепторов или омепразола.
При длительном применении необходимо периодически контролировать картину периферической крови, а также показатели функции печени и почек.
Риск желудочно-кишечного кровотечения, изъязвления или перфорации ЖКТ возрастает с повышением дозы НПВП у пациентов с язвой желудка в анамнезе, особенно если она сопровождалась такими осложнениями, как кровотечение или перфорация у пожилых людей. Таким пациентам следует начинать лечение с наименьшей возможной дозы препарата.
Пациентам, которым необходим одновременный прием ацетилсалициловой кислоты в низких дозах или других препаратов, которые могут повысить риск нежелательных явлений со стороны ЖКТ, показано одновременное назначение препаратов, оказывающих защитное действие (например, мизопростол или ингибиторы протонного насоса).
Рекомендуется регулярное наблюдение. При появлении признаков поражения печени (кожный зуд, пожелтение кожных покровов, тошнота, рвота, боли в животе, потемнение мочи, повышение уровня «печеночных трансаминаз») следует прекратить прием препарата и обратиться к лечащему врачу.
Препарат может изменять свойства тромбоцитов, однако не заменяет профилактического действия ацетилсалициловой кислоты при сердечно-сосудистых заболеваниях.
Больным с гипертонией при приеме Лорноксикама следует контролировать уровень артериального давления
Применение при беременности и в период грудного вскармливания
Из-за отсутствия данных по применению препарата Лорноксикам в период беременности и кормления грудью применять препарат не следует.
Подавление синтеза простагландинов может оказать побочное действие на беременность и/или развитие плода.
Применение ингибиторов синтеза простагландинов на раннем сроке беременности повышает риск выкидыша или развитие порока сердца. Считается, что риск пропорционален дозе и длительности лечения.
Назначение ингибиторов синтеза простагландинов в третьем триместре беременности может привести к токсичному влиянию на сердце и легкие плода (преждевременное закрытие артериального протока и развитие легочной гипертензии), а также нарушению функции почек и, следовательно, снижению амниотической жидкости.
Применение на поздних сроках может вызвать удлинение времени кровотечения у матери и плода, а также подавление сократительной активности матки, что может отсрочить или удлинить период родов.
Применение лорноксикама может отрицательно влиять на женскую фертильность и не рекомендуется женщинам, планирующим беременность.
Применение в детском возрасте
Препарат не предназначен для использования у лиц младше 18 лет, в связи с недостаточностью данных по его эффективности и безопасности у данной категории пациентов.
Применение в пожилом возрасте
Специально титровать дозу лицам в возрасте старше 65 лет при отсутствии у них нарушений функции почек и/или печени не требуется.
Пациентам данной возрастной категории в ходе терапии рекомендуется проводить контроль деятельности печени и почек и с особой осторожностью использовать препарат после хирургических операций. Следует учитывать, что у пожилых пациентов побочные эффекты со стороны ЖКТ переносятся тяжелее, чем у более молодых пациентов.
При нарушениях функции почек
Использование препарата противопоказано пациентам с тяжелой формой почечной недостаточности (при содержании сывороточного креатинина более 700 мкмоль/л), прогрессирующими болезнями почек, подтвержденной гиперкалиемией.
Больным с функциональными нарушениями почек легкой (при креатинине сыворотки 150–300 мкмоль/л) и умеренной (при креатинине сыворотки 300–700 мкмоль/л) степени следует проводить терапию препаратом с осторожностью и при необходимости выполнять корректировку дозы, поскольку для поддержания почечного кровотока особо важен уровень почечных простагландинов. Лечение Лорноксикамом следует прекратить в случае выявления ухудшения функции почек.
При нарушениях функции печени
Больным с тяжелой печеночной недостаточностью лечение препаратом противопоказано.
Пациенты с нарушениями деятельности печени легкой и умеренной степени (включая цирроз печени) в процессе терапии нуждаются в клиническом наблюдении и регулярном проведении оценки лабораторных тестов. При умеренных нарушениях функции печени может потребоваться изменение дозы. Нежелательные явления можно минимизировать путем использования наименьшей эффективной дозы на протяжении наиболее короткого периода, требуемого для контроля симптомов.
Влияние на способность управлять транспортными средствами и механизмами
Пациентам, у которых отмечается головокружение и/или сонливость во время лечения лорноксикамом, следует воздерживаться от вождения автотранспорта и управления техникой.
Если прием Лорноксикама вызывает сонливость, лучше отказаться от управления транспортным средством
Условия и сроки хранения
В защищенном от света месте при температуре не выше 25 °С.
Восстановленный раствор хранить в защищенном от света месте при температуре от 2 до 8 °С не более суток.
Хранить в местах, недоступных для детей.
Срок годности Лорноксикама в виде таблеток составляет 5 лет. Срок годности лиофилизата — 2 года. Не применять по истечении срока годности, указанного на упаковке. Готовый раствор для инъекций следует хранить не больше суток.
Условия продажи
Препарат продается в аптеках по рецепту.
Стоимость препарата
Купить Лорноксикам можно в каждой аптеке без рецепта врача. Средняя цена на препарат:
- Лорноксикам в виде таблеток (Ксефокам) – от 130 до 160 рублей за 10 штук;
- Лорноксикам в виде порошка для инъекции – от 600 до 750 рублей за упаковку.
Аналоги Лорноксикама
Если пациенту не подошел Лорноксикам для снятия боли, тогда врач может назначить прямой аналог лекарства. Вот полный список похожих препаратов:
- Ревмоксикам;
- Ксефокам;
- Мирлокс;
- Месипол;
- Мовалис;
- Мелбек;
- Лем;
- Мовасин;
- Пироксикам.
Перед использованием любого аналога обязательно прочтите его инструкцию по применению. Если знать точную дозировку и правила использования, тогда новое лекарство не нанесет вреда организму.
Отзывы о Лорноксикаме
Отзывы о Лорноксикаме от специалистов и пациентов, как правило, положительные. Они свидетельствуют об эффективности данного лекарственного средства.
Отзывы пациентов
Мне выписали уколы Лорноксикамом для снятия болевых приступов при артрите. После 3 инъекций все воспаление прошло, и мое состояние сразу улучшилось. Чтобы поддерживать действие препарата я начала принимать таблетки Лорноксикам по 2 штуки в день. Врач определил для меня курс лечения и регулярно проводил диагностические процедуры для контроля за действием лекарства. За все время лечения препарат не вызывал побочные действия или какие-либо аллергические реакции.
Алена, 54 года
У меня в аптечке всегда находятся таблетки Лорноксикама для быстрого снятия боли. Недавно, когда я пришел от стоматолога, препарат меня очень выручил. Зубная боль была просто невыносимой и сильно отдавала в голову. Через 20 минут после принятого лекарства приступ начал утихать. Я принял еще одну таблетку перед сном и полностью забыл о боли.
Иван, 42 года
Недавно мне поставили диагноз – остеохондроз в шейной зоне. В последнее время эта болезнь вызывала корешковый синдром, который сопровождался ужасной болью, воспалением и зажатостью в шее. Мне выписали ежедневные уколы Лорноксикамом. Врач делал инъекции в больнице и следил за состоянием моего здоровья. Первый укол вызвал у меня побочные действия в виде головной боли и жара в теле. Доктор снизил дозировку, и негативные реакции сразу прошли. Лорноксикам быстро снимал отеки и воспаления, помог мне справиться с приступом боли.
Алина, 56 лет
Дома в аптечке всегда лежит упаковка Лорноксикама, так как понадобиться может в любой день. Так, после посещения зубного врача, только этим лекарством и спасался. Боль была просто невыносимая с сильными прострелами. Лекарство начало действовать где-то минут через 20-25, а после приема второй таблетки вообще спал спокойно до утра. Побочек не наблюдал.
Валерий 44 года
Сильно заболело правое плечо, не могла даже нормально шевелить рукой. Ни спать, ни лежать невозможно – постоянная тянущая боль. Врач поставил диагноз после УЗИ – грыжи в шейном отделе. Пробовала разные обезболивающие, но все мимо. Ничего не убирало боль полностью. Знакомая посоветовала попробовать Лорноксикам. Взяла большую дозировку, на всякий случай. После того, как первый раз выпила, почувствовала, что боль проходит уже через полчаса. Все отлично. Из побочных – только небольшие проблемы со стулом.
Вероника 52 года
Я гимнастка и о травмах, растяжениях и прочих радостях профессионального спорта знаю не понаслышке. За свою карьеру перепробовала массу обезболивающих, от дорогих до дешевых. По рекомендации специалиста не так давно попробовала Лорноксикам. Он, конечно, не дешевый, но главное помогает снимать боль отлично. Мне подошел. Побочных действий не было никаких, пока, по крайней мере.
Лариса 25 лет
Источники
- https://health.mail.ru/drug/lornoksikam/
- https://osteoz.ru/preparaty/lornoksikam.html
- https://medi.ru/instrukciya/lornoxicam_15106/
- https://www.rlsnet.ru/mnn_index_id_2583.htm
- https://medside.ru/lornoksikam
- https://www.VIDAL.ru/drugs/lornoxicam
- https://www.neboleem.net/lornoksikam.php
- https://osteok.ru/osobennosti-ispolzovaniya-preparata-lornoksikam
- https://drugs.medelement.com/drug/%D0%BB%D0%B0%D1%80%D1%84%D0%B8%D0%BA%D1%81-8%D0%BC%D0%B3-%D0%B8%D0%BD%D1%81%D1%82%D1%80%D1%83%D0%BA%D1%86%D0%B8%D1%8F/43815141477650954?instruction_lang=RU
- https://medum.ru/lornoksikam-instrukciya