Вориконазол Сандоз лиофилизат — инструкция по применению
Синонимы, аналоги
Статьи
В настоящее время препарат не числится в Государственном реестре лекарственных средств или указанный регистрационный номер исключен из реестра.
Регистрационный номер:
ЛП-004708 — 150218
Торговое наименование:
Вориконазол Сандоз
Международное непатентованное наименование:
вориконазол
Лекарственная форма:
лиофилизат для приготовления концентрата для приготовления раствора для инфузий.
Состав
В 1 флаконе содержится:
Действующее вещество: вориконазол — 211,3 мг*;
Вспомогательное вещество: бетадекса сульфобутилат натрия — 3380,8 мг*.
* с учетом заложенного избытка 5,65 % в целях компенсации неизвлекаемого объема для гарантии заявленного количества вориконазола (200 мг) и бетадекса сульфобутилата натрия (3200 мг).
Описание
Лиофилизат: порошок от белого до почти белого цвета;
Восстановленный раствор: прозрачная бесцветная жидкость.
Фармакотерапевтическая группа:
противогрибковое средство.
Код ATX: J02AC03.
Фармакологические свойства
Фармакодинамика
Механизм действия
Вориконазол — противогрибковое средство широкого спектра действия из группы триазолов.
Механизм действия препарата связан с ингибированием грибкового цитохрома Р450, что является ключевым этапом биосинтеза эргостерола. Накопление 14?-метилстерола коррелирует с последующей потерей эргостерола в грибковых клеточных мембранах, что обуславливает противогрибковую активность вориконазола. Было установлено, что вориконазол более селективен в отношении изоферментов цитохрома Р450 грибков, чем в отношении различных ферментных систем цитохрома Р450 млекопитающих. Положительной связи между средними, максимальными и минимальными значениями концентрации вориконазола в плазме крови и эффективностью препарата в терапевтических исследованиях не выявлено, в профилактических исследованиях эта взаимосвязь не изучалась. Фармакодинамический и фармакокинетический анализ данных клинических исследований выявил положительную связь между концентрацией вориконазола в плазме крови и отклонением от нормы биохимических показателей функции печени, а также зрительными нарушениями.
In vitro вориконазол обладает широким спектром противогрибкового действия: активен в отношении Candida spp. (включая штаммы С. krusei, устойчивые к флуконазолу, и резистентные штаммы С. glabrata и С. albicans), а также проявляет фунгицидный эффект в отношении всех изученных штаммов Aspergillus spp. и патогенных грибов, ставших актуальными в последнее время, включая Scedosporium spp. или Fusarium spp., которые ограниченно чувствительны к другим существующим противогрибковым средствам. Клиническая эффективность (с частичным или полным ответом) вориконазола была продемонстрирована при инфекциях, вызванных Aspergillus spp., включая A. flavus, A. fumigatus, A. terreus, A. niger, A. nidulans, Candida spp., включая С. albicans, С. glabrata, С. krusei, С. parapsilosis и С. tropicalis, а также в отношении некоторых штаммов С. dubliniensis, С. inconspicua и С. guilliermondii, Scedosporium spp., включая S. apiospermum и S. prolificans, и Fusarium spp.
Другие грибковые инфекции, при которых применялся вориконазол (иногда с частичным или полным ответом), включали в себя отдельные случаи инфекций, вызванных Alternaria spp., Blastomyces dermatitidis, Blastoschizomyces capitatus, Cladosporium spp., Coccidioides immitis, Conidiobolus coronatus, Cryptococcus neoformans, Exserohilum rostratum, Exophiala spinifera, Fonsecaea pedrosoi, Madureila mycetomatis, Paecilomyces lilacinus, Penicillium spp., включая P. marneffei, Phialophora richardsiae, Scopulariopsis brevicaulis и Trichosporon spp., включая Т. beigelii.
Продемонстрирована активность вориконазола in vitro в отношении клинических штаммов Acremonium spp., Alternaria spp., Bipolaris spp., Cladophialophora spp., Histoplasma capsulatum. Рост большинства штаммов подавлялся при концентрациях вориконазола от 0,05 мкг/мл до 2 мкг/мл.
Выявлена также активность вориконазола in vitro в отношении Curvularia spp. и Sporothrix spp., однако клиническое значение данного эффекта неизвестно.
Фармакокинетика
Общая характеристика
Фармакокинетические параметры вориконазола характеризуются значительной межиндивидуальной вариабельностью, его фармакокинетика является нелинейной за счет насыщаемого метаболизма. При повышении дозы вориконазола наблюдается непропорциональное (более выраженное) увеличение площади под кривой «концентрация-время» (AUCt). Увеличение пероральной дозы с 200 мг 2 раза в сутки до 300 мг 2 раза в сутки приводит к увеличению AUCt в среднем в 2,5 раза. Действие вориконазола при приеме внутрь поддерживающей дозы 200 мг (или 100 мг для пациентов с массой тела менее 40 кг) соответствует действию вориконазола при применении внутривенно в дозе 3 мг/кг. При приеме внутрь поддерживающей дозы 300 мг (или 150 мг для пациентов с массой тела менее 40 кг) действие сопоставимо с внутривенным введением вориконазола в дозе 4 мг/кг. При внутривенном введении или приеме внутрь насыщающих доз вориконазола равновесная концентрация достигается в течение первых 24 ч. Если препарат назначается 2 раза в сутки в средних (но не в насыщающих) дозах, происходит кумуляция вориконазола, а равновесные концентрации достигаются к 6-му дню у большинства пациентов.
Всасывание
Вориконазол быстро и практически полностью всасывается после приема внутрь: максимальная концентрация в плазме крови (Сmах) достигается через 1-2 ч после приема. Биодоступность вориконазола при приеме внутрь составляет 96 %. При повторном приеме с пищей с большим содержанием жиров Сmах и AUCt снижаются на 34 % и 24 % соответственно. Всасывание вориконазола не зависит от рН желудочного сока.
Распределение
Средний объем распределения вориконазола в равновесном состоянии составляет около 4,6 л/кг, что указывает на активное распределение вориконазола в тканях. Связь с белками плазмы крови составляет 58 %. Вориконазол проникает через гематоэнцефалический барьер и определяется в спинномозговой жидкости.
Метаболизм
Согласно данным исследований in vitro вориконазол метаболизируется под действием изоферментов CYP2C19, CYP2C9, CYP3A4. Важную роль в метаболизме вориконазола играет изофермент CYP2C19, имеющий выраженный генетический полиморфизм, в связи с чем замедленный метаболизм вориконазола возможен у 15-20 % представителей азиатского происхождения и у 3-5 % представителей европеоидной и негроидной рас. Установлено, что у пациентов с замедленным метаболизмом вориконазола его AUCT в среднем в 4 раза больше. чем у гомозиготных пациентов с быстрым метаболизмом. У гетерозиготных пациентов с быстрым метаболизмом вориконазола его AUCT в среднем в 2 раза больше, чем у гомозиготных.
Основным метаболитом вориконазола является N-оксид, доля которого составляет около 72 % от общего количества циркулирующих в плазме крови метаболитов с радиоактивной меткой.
Этот метаболит обладает минимальной противогрибковой активностью и не влияет на клинический эффект вориконазола.
Выведение
Вориконазол выводится в виде метаболитов после биотрансформации в печени; в неизмененном виде почками выводится менее 2 % от введенной дозы препарата.
После внутривенного введения вориконазола в моче обнаруживается около 80 % введенной дозы препарата. Большая часть (>94 %) общей дозы вориконазола выводится в течение первых 96 ч после приема внутрь или внутривенного введения. Период полувыведения (T1/2) вориконазола зависит от дозы и составляет примерно 6 ч при приеме препарата внутрь в дозе 200 мг. В связи с нелинейностью фармакокинетики величина Т1/2 не позволяет предсказать кумуляцию или выведение вориконазола.
Особые группы пациентов
Пожилые пациенты
При многократном приеме вориконазола внутрь Сmах и AUCT у здоровых пожилых мужчин (>65 лет) на 61 % и 86 % соответственно выше, чем у здоровых молодых мужчин (18-45 лет).
Значимых различий Сmах и AUCt у здоровых пожилых женщин (>65 лет) и здоровых молодых женщин (18-45 лет) не выявлено.
Профиль безопасности вориконазола у молодых и пожилых пациентов не отличается. Коррекция дозы вориконазола в зависимости от возраста не требуется.
Дети
У детей отмечается большая межиндивидуальная вариабельность, чем у взрослых. Сравнение детской и взрослой популяций показало, что предполагаемая AUCT у детей после введения насыщающей дозы вориконазола 9 мг/кг была сопоставима с таковой у взрослых после введения насыщающей дозы 6 мг/кг. Предполагаемая общая концентрация у детей после введения поддерживающей дозы 4 мг/кг и 8 мг/кг два раза в сутки была также сопоставима с таковой у взрослых после введения поддерживающей дозы 3 мг/кг и 4 мг/кг два раза в сутки.
Концентрация вориконазола при внутривенном введении в дозе 8 мг/кг в два раза выше, чем при приеме внутрь в дозе 9 мг/кг. Биодоступность вориконазола при приеме внутрь у детей может ограничиваться нарушением всасывания и достаточно низкой массой тела, в этом случае может быть показано внутривенное введение.
Полученные данные свидетельствуют о более быстрой элиминации вориконазола у детей по сравнению с взрослыми в связи с большим соотношением массы печени и массы тела.
У большинства подростков концентрация вориконазола в плазме крови соответствует этому показателю у взрослых пациентов. Тем не менее, отмечались меньшие значения концентрации вориконазола в плазме крови у некоторых подростков с низкой массой тела по сравнению с взрослыми и были ближе к значениям того же показателя у детей. Основываясь на популяционном фармакокинетическом анализе, подростки в возрасте от 12 до 14 лет с массой тела менее 50 кг должны получать дозу вориконазола, рекомендованную для приема у детей.
Нарушение функции почек
Выраженность почечной недостаточности не влияет на связь препарата с белками плазмы крови. У пациентов с нарушением функции почек средней или тяжелой степени тяжести (концентрация креатинина в сыворотке крови >220 мкмоль/л или 2,5 мг/дл) наблюдается кумуляция вспомогательного вещества — бетадекса сульфобутилата натрия, входящего в состав препарата.
Нарушение функции печени
Нарушение функции печени не влияет на связь вориконазола с белками плазмы крови. Сведения о фармакокинетике вориконазола у пациентов с тяжелым циррозом печени (класс С по классификации Чайлд-Пью) отсутствуют.
Пол
При многократном приеме вориконазола внутрь Сmax и AUCT у здоровых молодых женщин были на 83 % и 113 % соответственно выше, чем у здоровых молодых мужчин (18-45 лет).
Значимых различий Сmax и AUCT у здоровых пожилых мужчин и здоровых пожилых женщин (>65 лет) выявлено не было. Равновесная концентрация вориконазола в плазме крови у женщин была на 100 % и 91 % выше, чем у мужчин после приема препарата в виде таблеток или суспензии соответственно. Коррекция дозы вориконазола в зависимости от пола не требуется. Концентрации в плазме крови у мужчин и женщин сопоставимы.
Показания к применению
Вориконазол показан для применения у взрослых и детей старше 2 лет по следующим показаниям:
- инвазивный аспергиллез;
- кандидемия у пациентов без нейтропении;
- лечение тяжелых инвазивных кандидозных инфекций (включая С. krusei);
- кандидоз пищевода;
- тяжелые грибковые инфекции, вызванные Scedosporium spp. и Fusarium spp.;
- другие тяжелые инвазивные грибковые инфекции при непереносимости или рефрактерности к другим лекарственным препаратам;
- профилактика «прорывных» грибковых инфекций у пациентов со сниженной функцией иммунной системы, лихорадкой и неитропениеи, из групп высокого риска (реципиенты трансплантации гемопоэтических стволовых клеток, пациенты с рецидивом лейкоза);
- профилактика инвазивных грибковых инфекций у пациентов (взрослые и дети старше 12 лет) из группы высокого риска, таких как реципиенты трансплантации гемопоэтических стволовых клеток.
Противопоказания
- гиперчувствительность к вориконазолу или вспомогательному веществу препарата;
- одновременное применение следующих препаратов (см. раздел «Взаимодействие с другими лекарственными средствами»):
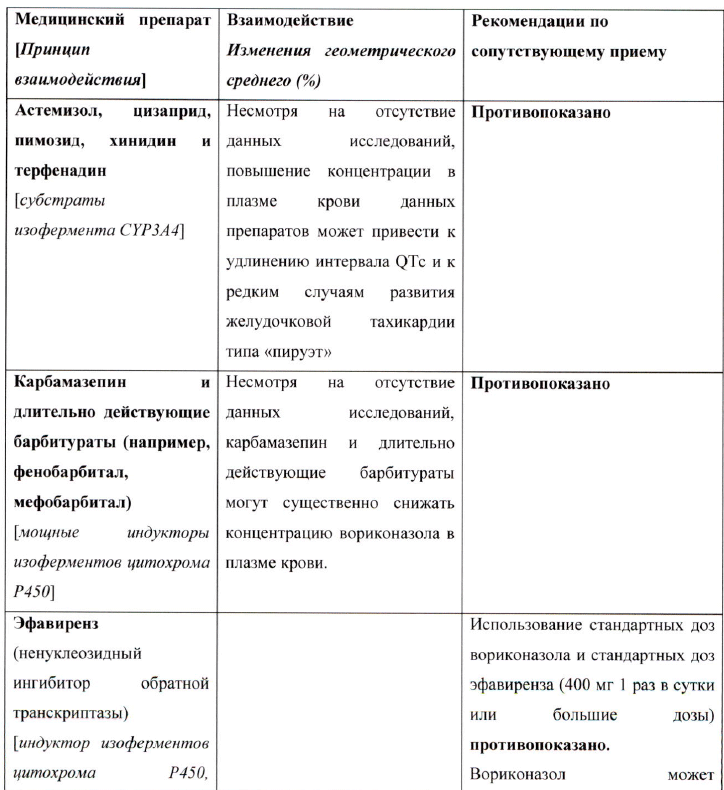
- субстраты изофермента CYP3A4, которые могут приводить к удлинению интервала QT: терфенадин, астемизол, цизаприд, пимозид или хинидин;
- сиролимус;
- рифампицин;
- карбамазепин и длительно действующие барбитураты (фенобарбитал);
- эфавиренз в дозах 400 мг и выше один раз в сутки (с вориконазолом в стандартных дозах);
- ритонавир в высоких дозах (400 мг и выше два раза в сутки);
- алкалоиды спорыньи (эрготамин, дигидроэрготамин), являющиеся субстратами изофермента CYP3A4;
- зверобой продырявленный (индуктор изоферментов цитохрома Р450 и Р- гликопротеина);
- детский возраст до 2 лет.
С осторожностью
- повышенная чувствительность к другим препаратам — производным азолов;
- печеночная и/или почечная недостаточность тяжелой степени;
- проаритмические состояния: врожденное или приобретенное удлинение интервала QT, кардиомиопатия, в особенности с сердечной недостаточностью, синусовая брадикардия, наличие аритмии с клиническими проявлениями, одновременный прием препаратов, вызывающих удлинение интервала QT (см. раздел «Особые указания»);
- применение у пациентов с электролитными нарушениями, такими как гипокалиемия, гипомагниемия и гипокальциемия.
Применение при беременности и в период грудного вскармливания
Достаточной информации о применении вориконазола у беременных женщин нет. В исследованиях на животных установлено, что препарат оказывает токсическое действие на репродуктивную функцию. Возможный риск для человека неизвестен. Вориконазол не следует применять у беременных женщин за исключением тех случаев, когда ожидаемая польза для матери превышает возможный риск для плода.
Выведение вориконазола с грудным молоком не изучалось. Следует прекратить грудное вскармливание в случае необходимости применения препарата.
Женщины репродуктивного возраста при применении вориконазола должны использовать надежные методы контрацепции.
Способ применения и дозы
Препарат Вориконазол Сандоз® следует вводить внутривенно капельно. Препарат не предназначен для болюсного введения. Рекомендуемая скорость инфузии вориконазола составляет 3 мг/кг в час в течение 1-3 часов.
Нарушения электролитного баланса, например, гипокалиемию, гипомагниемию и гипокальциемию, следует контролировать и корректировать, при необходимости, до начала и во время лечения вориконазолом.
Взрослые пациенты
Терапию вориконазолом следует начинать с внутривенного введения рекомендуемой насыщающей дозы, чтобы уже в первый день добиться адекватной концентрации препарата в плазме крови. Внутривенное введение следует продолжать в течение как минимум 7 дней, после чего возможен переход на пероральный прием препарата, при условии, что пациент способен принимать лекарственные препараты внутрь. Учитывая, что биодоступность препарата при приеме внутрь достигает 96 % (см. раздел «Фармакокинетика»), при наличии клинических показаний возможен переход с внутривенного на пероральное применение препарата без коррекции дозы.
В таблице приведена подробная информация по режиму дозирования вориконазола.
|
Внутривенно |
Внутрь |
||
|
Пациенты с массой тела 40 кг и более |
Пациенты с массой тела менее 40 кг* |
||
|
Насыщающая доза — все показания (первые 24 ч) |
6 мг/кг каждые 12 ч |
400 мг каждые 12ч |
200 мг каждые 12 ч |
|
Поддерживающая доза (после первых 24 ч) |
|||
|
Профилактика инвазивных грибковых инфекций у пациентов (взрослых и детей старше 12 лет) группы высокого риска, таких как реципиенты трансплантации гемопоэтических стволовых клеток; Профилактика «прорывных» грибковых инфекций у пациентов с лихорадкой |
3-4 мг/кг каждые 12 ч |
200 мг каждые 12 ч |
100 м г каждые 12 ч |
|
Инвазивный аспергиллез; Инфекции, вызванные Scedosporium spp. и Fusahum spp.; Другие тяжелые инвазивные грибковые инфекции |
4 мг/кг каждые 12 ч |
200 мг каждые 12 ч |
100 мг каждые 12 ч |
|
Кандидемия у пациентов без проявлений нейтропении |
3-4 мг/кг каждые 12 ч |
200 мг каждые 12 ч |
100 мг каждые 12ч |
|
Кандидоз пищевода |
Не установлено |
200 мг каждые 12ч |
100 мг каждые 12 ч |
* относится к пациентам от 15 лет и старше
Подбор дозы для внутривенного введения
При недостаточной эффективности лечения поддерживающая доза вориконазола для внутривенного введения может быть увеличена до 4 мг/кг каждые 12 ч. Если пациент не переносит препарат в дозе 4 мг/кг, ее следует снизить до 3 мг/кг каждые 12 ч.
Длительность лечения
Длительность лечения должна быть как можно короче в зависимости от клинического эффекта и результатов микологического исследования. Длительность лечения не должна превышать 180 дней.
Профилактика грибковых инфекции у взрослых и детей
Профилактическое применение препарата следует начинать в день трансплантации и можно продолжать до 100 дней. Продлить профилактику до 180 дней после трансплантации можно только в случае продолжения иммуносупрессивной терапии или развития реакции «трансплантат против хозяина» (РТПХ). Безопасность и эффективность вориконазола при применении более 180 дней в клинических исследованиях надлежащим образом не изучались.
Режим дозирования с целью профилактики такой же, как и в случае лечения в соответствующих возрастных группах.
Нарушение функции почек
У пациентов с нарушением функции почек средней или тяжелой степени тяжести (клиренс креатинина <50 мл/мин) наблюдается кумуляция вспомогательного компонента препарата бетадекса сульфобутилата натрия. Таким пациентам вориконазол следует назначать только внутрь, за исключением тех случаев, когда предполагаемая польза внутривенного введения превышает потенциальный риск. В подобных ситуациях необходимо регулярно контролировать концентрацию креатинина в плазме крови и, в случае её повышения, следует обсудить возможность перехода на прием вориконазола внутрь.
Вориконазол выводится при проведении гемодиализа с клиренсом 121 мл/мин. 4-часовой сеанс гемодиализа не приводит к удалению значительной части дозы вориконазола и не требует ее коррекции. Бетадекса сульфобутилат натрия выводится в ходе гемодиализа с клиренсом 55 мл/мин.
Нарушение функции печени
При остром повреждении печени, проявляющемся повышением активности «печеночных» трансаминаз (аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (ACT)), коррекция дозы не требуется, но рекомендуется продолжать контроль показателей функции печени. Пациентам с печеночной недостаточностью легкой или средней степени тяжести (классы А и В по классификации Чайлд-Пью) следует назначать стандартную насыщающую дозу препарата, а поддерживающую дозу снижать в 2 раза.
Отсутствуют достаточные клинические данные по безопасности применения вориконазола у пациентов с повышенными биохимическими показателями функции печени (АЛТ, ACT, щелочная фосфатаза, общий билирубин >5 верхних границ нормы).
Применение препарата у пациентов с тяжелой степенью нарушения функции печени (класс С по классификации Чайлд-Пью) не изучалось, таким пациентам вориконазол следует назначать только в тех случаях, когда ожидаемая польза превышает возможный риск, и под постоянным контролем с целью выявления признаков токсического действия препарата.
Пожшые пациенты
Коррекция дозы вориконазола у пожилых людей не требуется.
Применение у детей
Безопасность и эффективность вориконазола у детей младше 2 лет не установлены (см. раздел «.Противопоказания»). Дети в возрасте от 12 до 14 лет при массе тела >50 кг, а также дети старше 15 лет должны получать вориконазол в дозах, аналогичных применяемым у взрослых. Режим дозирования вориконазола у детей (в возрасте от 2 до 12 лет) и подростков в возрасте от 12 до 14 лет и массой тела менее 50 кг:
|
Внутривенно |
Внутрь |
|
|
Насыщающая доза (первые 24 ч) |
9 мг/кг каждые 12 ч |
Не рекомендуется |
|
Поддерживающая доза (после первых 24 ч) |
8 мг/кг 2 раза в сутки |
9 мг/кг 2 раза в сутки (максимальная доза 350 мг 2 раза в сутки) |
Терапию рекомендуется начинать с внутривенного введения препарата, а возможность перорального приема вориконазола следует рассматривать только после клинического улучшения с учетом возможности пациента принимать пероральные лекарственные препараты.
Необходимо учитывать, что воздействие препарата при внутривенном введении в дозе 8 мг/кг приблизительно в два раза выше, чем при применении внутрь в дозе 9 мг/кг.
Применение вориконазола у детей в возрасте от 2 до 12 лет с нарушениями функции печени или почек не изучалось.
Коррекция дозы у детей
При неадекватном клиническом ответе пациента доза препарата может быть увеличена с шагом 1 мг/кг (или 50 мг в случае, если изначально применялась пероральная доза 350 мг).
Если ребенок не переносит лечение, возможно снижение дозы вориконазола с шагом 1 мг/кг (или 50 мг в случае, если изначально применялась пероральная доза 350 мг).
Правила приготовления раствора
Вориконазол в лекарственной форме лиофилизат для приготовления концентрата для приготовления раствора для инфузий представляет собой стерильный порошок без консерванта, предназначенный для однократного применения. Лиофилизат восстанавливается при помощи введения во флакон 19 мл стерильной воды для инъекций или 19 мл 0,9% раствора натрия хлорида. В результате восстановления получается раствор объемом 20 мл с концентрацией вориконазола 10 мг/мл. Для восстановления рекомендуется использовать стандартный неавтоматический 20 мл шприц, чтобы удостовериться в объеме извлеченного раствора. Не следует использовать раствор, если растворитель не попадает во флакон под действием вакуума.
Флакон следует встряхнуть до полного растворения препарата. Допустимо использование только прозрачного раствора, в случае образования крупных частиц раствор следует утилизировать.
|
Масса тела (кг) |
Объем концентрата вориконазола (10 мг/мл), требуемый для: |
||||
|
Дозы 3 мг/кг (количество флаконов) |
Дозы 4 мг/кг (количество флаконов) |
Дозы 6 мг/кг (количество флаконов) |
Дозы 8 мг/кг (количество флаконов) |
Дозы 9 мг/кг (количество (флаконов) |
|
|
10 |
— |
4,0 мл (1) |
— |
8,0 мл (1) |
9,0 мл (1) |
|
15 |
— |
6,0 мл (1) |
— |
12,0 мл (1) |
13,5 мл (1) |
|
20 |
— |
8,0 мл (1) |
— |
16,0 мл (1) |
18,0 мл (1) |
|
25 |
— |
10,0 мл (1) |
— |
20,0 мл (1) |
22,5 мл (2) |
|
30 |
9,0 мл (1) |
12,0 мл (1) |
18,0 мл (1) |
24,0 мл (2) |
27.0 мл (2) |
|
35 |
10,5 мл (1) |
14,0 мл (1) |
21,0 мл (2) |
28,0 мл (2) |
31,5 мл (2) |
|
40 |
12,0 мл (1) |
16,0 мл (1) |
24,0 мл (2) |
32,0 мл (2) |
36,0 мл (2) |
|
45 |
13,5 мл (1) |
18,0 мл (1) |
27,0 мл (2) |
36.0 мл (2) |
40,5 мл (3) |
|
50 |
15,0 мл (1) |
20,0 мл (1) |
30,0 мл (2) |
40,0 мл (2) |
45,0 мл (3) |
|
55 |
16,5 мл (1) |
22,0 мл (2) |
33,0 мл (2) |
44,0 мл (3) |
49.5 мл (3) |
|
60 |
18,0 мл (1) |
24,0 мл (2) |
36,0 мл (2) |
48,0 мл (3) |
54.0 мл (3) |
|
65 |
19,5 мл (1) |
26,0 мл (2) |
39,0 мл (2) |
52,0 мл (3) |
58,5 мл (3) |
|
70 |
21,0 мл (2) |
28,0 мл (2) |
42,0 мл (3) |
— |
— |
|
75 |
22,5 мл (2) |
30,0 мл (2) |
45,0 мл (3) |
— |
— |
|
80 |
24,0 мл (2) |
32,0 мл (2) |
48,0 мл (3) |
— |
— |
|
85 |
25,5 мл (2) |
34,0 мл (2) |
51,0 мл (3) |
— |
— |
|
90 |
27,0 мл (2) |
36,0 мл (2) |
54.0 мл (3) |
— |
— |
|
95 |
28,5 мл (2) |
38,0 мл (2) |
57,0 мл (3) |
— |
— |
|
100 |
30,0 мл (2) |
40,0 мл (2) |
60,0 мл (3) |
— |
— |
Восстановленный раствор (концентрат) можно хранить в холодильнике не более 24 ч при температуре от 2 до 8 °С в том случае, если он был приготовлен в контролируемых асептических условиях. С микробиологической точки зрения препарат следует вводить немедленно.
Получившийся восстановленный раствор следует разбавить путем добавления к нему одного из нижеперечисленных растворов до конечной концентрации 0,5-5 мг/мл:
- 0.9 % раствор натрия хлорида для внутривенного введения;
- раствор Рингера лактата для внутривенного введения;
- 5 % раствор декстрозы и раствор Рингера лактата для внутривенного введения;
- 5 % раствор декстрозы и 0,45 % раствор натрия хлорида для внутривенного введения:
- 5 % раствор декстрозы для внутривенного введения;
- 5 % раствор декстрозы и 0,15 % раствор калия хлорида для внутривенного введения;
- 0,45 % раствор натрия хлорида для внутривенного введения;
- 5 % раствор декстрозы и 0,9 % раствор натрия хлорида для внутривенного введения.
Готовый к применению раствор (0,5-5 мг/мл) можно хранить не более 3 ч при температуре 20-30 °С. Совместимость вориконазола с растворами, помимо указанных выше, неизвестна.
Побочное действие
Данные о безопасности вориконазола у взрослых основаны на результатах лечения более 2000 человек (1655 принимали участие в клинических исследованиях) и применении для профилактики грибковых инфекций у 279 пациентов. Данная популяция была гетерогенной (пациенты со злокачественными новообразованиями крови, ВИЧ-инфицированные пациенты с кандидозом пищевода и рефрактерными грибковыми инфекциями, пациенты без нейтропении с кандидемией или аспергиллезом, а также здоровые добровольцы).
Ниже перечислены нежелательные реакции, которые наблюдались при применении препарата и, возможно, были связаны с лечением. Наиболее распространенными нежелательными реакциями являлись зрительные нарушения, лихорадка, сыпь, рвота, тошнота, диарея, головная боль, периферические отеки, изменение лабораторных показателей функции печени, дыхательные расстройства и боль в животе. Нежелательные реакции обычно были легко или умеренно выражены. Клинически значимой зависимости безопасности препарата от возраста, расы или пола не выявлено.
По данным Всемирной организации здравоохранения (ВОЗ) нежелательные эффекты классифицированы в соответствии с их частотой развития следующим образом: очень часто (>1/10), часто (от >1/100 до <1/10), нечасто (от >1/1000 до <1/100), редко (от >1/10000 до <1/1000), очень редко (<1/10000); частота неизвестна — по имеющимся данным установить частоту возникновения не представлялось возможным.
Инфекционные и паразитарные заболевания
часто: синусит; редко: псевдомембранозный колит.
Нарушения со стороны крови и лимфатической системы
часто: агранулоцитоз (в том числе нейтропения и фебрильная нейтропения), панцитопения, лейкопения, тромбоцитопения (включая иммунную тромбоцитопеническую пурпуру), анемия (в том числе макроцитарная, микроцитарная, нормоцитарная, мегалобластная, апластическая); нечасто: угнетение костномозгового кроветворения, лимфаденопатия, эозинофилия; редко: синдром диссеминированного внутрисосудистого свертывания.
Нарушения со стороны иммунной системы
часто: реакции гиперчувствительности; нечасто: анафилактоидные реакции.
Нарушения со стороны эндокринной системы
нечасто: недостаточность коры надпочечников, гипотиреоз; редко: гипертиреоз.
Нарушения со стороны обмена веществ и питания
очень часто: периферические отеки; часто: гипокалиемия, гипогликемия, гипонатриемия; нечасто: гиперхолестеринемия.
Психические нарушения
часто: депрессия, галлюцинации, тревожность, бессонница, ажитация.
Нарушения со стороны нервной системы
очень часто: головная боль; часто: головокружение, судороги, тремор, гипертонус (включая ригидность затылочных мышц, тетанию), парестезия, спутанность сознания, обморок, сонливость; нечасто: отек головного мозга, атаксия, дисгевзия, гипестезия, периферическая нейропатия, энцефалопатия (по гипоксически-ишемическому типу или метаболическая), экстрапирамидные симптомы (включая акатизию и паркинсонизм); редко: синдром Гийена-Барре, нистагм.
Нарушения со стороны органа зрения
очень часто: зрительные нарушения (см. подраздел «Описание отдельных нежелательных реакций»); часто: кровоизлияние в сетчатую оболочку глаза; нечасто: отек диска зрительного нерва, нарушения со стороны зрительного нерва (включая неврит зрительного нерва*), окулогирный криз, диплопия, склерит, блефарит; редко: атрофия зрительного нерва, помутнение роговицы.
Нарушения со стороны органа слуха и лабиринтные нарушения
редко: снижение остроты слуха (гипоакузия), шум в ушах.
Нарушения со стороны сердиа
часто: наджелудочковая аритмия, брадикардия, тахикардия; нечасто: фибрилляция желудочков, желудочковая экстрасистолия, наджелудочковая тахикардия, удлинение интервала QT, желудочковая тахикардия (включая желудочковую тахикардию по типу «пируэт»), полная атриовентрикулярная блокада, блокада ножки пучка Гиса, узловые аритмии.
Нарушения со стороны сосудов
часто: снижение артериального давления, флебит; редко: лимфангит, тромбофлебит.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
очень часто: нарушения дыхания (включая одышку и одышку при физической нагрузке); часто: острый респираторный дистресс-синдром, отек легких, боль в грудной клетке.
Нарушения со стороны желудочно-кишечного тракта
очень часто: тошнота, рвота, диарея, боль в животе; часто: диспепсия, запор, гингивит; нечасто: гастроэнтерит, панкреатит, перитонит, дуоденит, глоссит, отек языка.
Нарушения со стороны печени и желчевыводящих путей
очень часто: изменение лабораторных показателей функции печени (ACT, АЛТ, щелочная фосфатаза);
часто: желтуха (в т.ч. холестатическая), гепатит (включая лекарственно индуцированные поражения печени, токсический гепатит, печеночно-клеточную недостаточность и гепатотоксические реакции); нечасто: печеночная недостаточность, гепатомегалия, холецистит, холелитиаз; редко: печеночная энцефалопатия.
Нарушения со стороны колеи и подкожных тканей
очень часто: сыпь; часто: эксфолиативный дерматит, макулопапулезная сыпь, хейлит, кожный зуд, алопеция, эритема;
нечасто: макулезная сыпь, папулезная сыпь, фототоксические реакции, пурпура, синдром Стивенса-Джонсона (злокачественная экссудативная эритема), лекарственная фиксированная эритема, экзема, крапивница, аллергический дерматит;
редко: псориаз, ангионевротический отек, токсический эпидермальныи некролиз (синдром Лайелла), мультиформная эритема, псевдопорфирия, солнечный кератоз*;
частота неизвестна: веснушки*, лентиго*, кожная форма красной волчанки*, плоскоклеточный рак кожи*.
Нарушения со стороны скелетно-мышечной и соединительной ткани
часто: боль в спине; нечасто: артрит; частота неизвестна: периостит*.
Нарушения со стороны почек и мочевыводящих путей
часто: острая почечная недостаточность, гематурия, повышение концентрации креатинина в плазме крови;
нечасто: протеинурия, нефрит, некроз почечных канальцев, повышение концентрации мочевины в плазме крови.
Общие расстройства и нарушения в месте введения
очень часто: лихорадка;
часто: астения, озноб, отек лица (в том числе периорбитальный отек, отек губ);
нечасто: гриппоподобный синдром, реакция/воспаление в месте введения.
* Нежелательные реакции, отмеченные в постмаркетинговом периоде.
Описание отдельных нежелательных реакций
Нарушения зрения
В клинических исследованиях на фоне применения вориконазола очень часто отмечалось развитие нарушений зрения. На фоне долговременной или кратковременной терапии препаратом пациенты отмечали появление усиленного/измененного зрительного восприятия (гемералопия, радужные круги вокруг источника света, осциллопсия, мерцательная скотома, зрительная яркость, фотопсия), «пелену» перед глазами (помутнение стекловидного тела), изменения цветовосприятия (хлоропсия, цианопсия, ксантопсия, ахроматопсия), снижение остроты зрения, изменение полей зрения или светобоязнь. Эти нарушения были преходящими и полностью обратимыми, в большинстве случаев они разрешались самостоятельно в течение 60 минут; случаев развития клинически значимых длительных нарушений зрения зафиксировано не было. Было отмечено ослабление данного побочного эффекта на фоне повторяющихся введений вориконазола. В большинстве случаев нарушения зрения, возникавшие на фоне терапии препаратом, имели минимальную выраженность, необходимость в отмене препарата возникала редко, они не приводили к развитию стойких нарушений зрения. Развитие зрительных нарушений на фоне лечения может быть связано с повышением концентрации препарата в плазме крови или с использованием высоких доз вориконазола.
Механизм развития данного нежелательного явления неизвестен, наиболее вероятно, что источником его возникновения является сетчатка. В исследовании с участием здоровых добровольцев изучалось воздействие вориконазола на функцию сетчатки, в ходе его проведения было отмечено уменьшение амплитуды волн на электроретинограмме (ЭРГ). Изменения на ЭРГ не прогрессировали после 29 дня терапии и полностью исчезали после отмены вориконазола.
В постмаркетинговом периоде сообщалось о случаях пролонгированных нежелательных реакций со стороны органа зрения.
Кожные реакции
Среди пациентов, получавших вориконазол в рамках клинических исследований, очень часто отмечалось развитие нежелательных реакций со стороны кожи. Как правило, у таких пациентов имелись серьезные сопутствующие заболевания, по поводу которых им проводилось лечение несколькими другими препаратами. В большинстве случаев сыпь была легкой или средней степени тяжести. Развитие серьезных кожных реакций, включая синдром Стивенса-Джонсона, токсический эпидермальный некролиз и полиморфную эритему, отмечалось редко.
Если у пациентов появляется сыпь, их состояние следует тщательно контролировать, необходимо отменить вориконазол в случае, если отмечается усугубление тяжести симптомов со стороны кожных покровов. Были отмечены реакции фоточувствительности, такие как веснушки, лентиго, солнечный кератоз, особенно во время долгосрочного лечения. Были отмечены случаи плоскоклеточного рака кожи у пациентов, получавших вориконазол в течение длительного периода времени. Механизм развития неизвестен (см. раздел «Особые указания»).
Показатели функции печени
Общая частота развития повышения активности «печеночных» трансаминаз (более трех верхних границ нормы) в клинической программе изучения вориконазола составила 18,0% (319/1768) взрослых пациентов и 25,8 % (73/283) детей, проходивших лечение вориконазолом. Нарушение показателей функции печени может быть связано с более высокими концентрациями препарата в плазме крови и/или с применением более высоких доз. В большинстве случаев данные отклонения разрешались самостоятельно без необходимости в коррекции дозы во время лечения либо после корректировки дозы или отмены препарата. В некоторых случаях у пациентов с другими тяжелыми основными заболеваниями применение вориконазола было ассоциировано с развитием серьезной печеночной токсичности, включая случаи желтухи, редкие случаи гепатита и печеночной недостаточности, приводящей к летальному исходу (см. раздел «Особые указания»).
Инфузионные реакции
Во время внутривенной инфузии вориконазола здоровым пациентам возникали реакции анафилактоидного типа, включая приливы крови к коже лица, лихорадку, усиление потоотделения, тахикардию, чувство стеснения в груди, одышку, потерю сознания, тошноту, кожный зуд и сыпь. Указанные симптомы развивались непосредственно после начала инфузии (см. раздел «Особыеуказания»).
Профилактика грибковых инфекций
В открытом многоцентровом сравнительном исследовании, где вориконазол или итраконазол применяли для первичной профилактики грибковых инфекций у взрослых и подростков -реципиентов аллогенной трансплантации костного мозга без или с вероятной грибковой инфекцией, продолжительная отмена вориконазола на фоне развития нежелательных реакций отмечалась в 39,3 % по сравнению с 39,6 % пациентов, принимавших итраконазол. Связанные с лечением нежелательные реакции со стороны печени приводили к отмене препарата у 50 пациентов (21,4%), получавших лечение вориконазолом, и у 18 пациентов (7,1%), принимавших итраконазол.
Применение у детей
Безопасность вориконазола была изучена у 288 пациентов (169 в возрасте от 2 до <12 лет и 119 в возрасте от 12 до <18 лет), получавших вориконазол для лечения (105) или профилактики (183) инфекций в рамках клинических исследований и у 158 пациентов в возрасте от 2 до <12 лет в рамках программ расширенного доступа. Профиль нежелательных реакций при применении препарата у детей был схож с профилемем безопасности у взрослых. Данные пострегистрационных исследований позволяют предположить, что частота развития кожных реакций (особенно эритемы) среди пациентов детского возраста, может быть выше, чем среди взрослых. У 22 пациентов в возрасте младше 2 лет, получавших вориконазол в рамках программ расширенного доступа, было отмечено развитие следующих нежелательных реакций, для которых нельзя исключить связь с применением вориконазола: реакции фотосенсибилизации (1), аритмия (1), панкреатит (1), повышение концентрации билирубина в плазме крови (1), повышение активности «печеночных» трансаминаз (1), сыпь (1) и отек диска зрительного нерва (1). Были получены пострегистрационные данные о случаях развития панкреатита среди пациентов детского возраста.
Передозировка
В клинических исследованиях вориконазола было отмечено 3 случая развития случайной передозировки. Все случаи произошли у пациентов детского возраста, которые получили внутривенную дозу вориконазола, превышающую стандартную до 5 раз. Была отмечена единичная побочная реакция, проявившаяся в виде светобоязни, длившаяся 10 минут. Антидот для вориконазола неизвестен. В случае передозировки показана симптоматическая и поддерживающая терапия.
Вориконазол выводится при гемодиализе с клиренсом 121 мл/мин, бетадекса сульфобутилат натрия — с клиренсом 55 мл/мин. В случае передозировки гемодиализ может способствовать удалению вориконазола и бетадекса сульфобутилата натрия.
Взаимодействие с другими лекарственными препаратами
Вориконазол метаболизируется и ингибирует активность изоферментов Р450, включая CYP2C19, CYP2C9 и CYP3A4. Ингибиторы или индукторы этих изоферментов могут соответственно повышать или снижать концентрацию вориконазола в плазме крови. Также существует вероятность, что вориконазол может повышать плазменную концентрацию препаратов, метаболизирующихся при участии этих изоферментов.
Исследования по межлекарственному взаимодействию были проведены среди здоровых взрослых пациентов мужского пола, которым перорально назначался вориконазол в дозе 200 мг 2 раза в сутки до достижения равновесной концентрации препарата в плазме крови. Данные результаты подходят и для оценки вероятности взаимодействия при использовании в других популяциях и других способов введения препарата.
Таблица взаимодействия
Взаимодействие между вориконазолом и другими медицинскими препаратами представлены в таблице ниже. Направление стрелки для каждого фармакокинетического параметра основано на 90 % доверительном интервале соотношения геометрических средних, которые могут быть: в диапазоне (↔), ниже (↓) или выше (↑) диапазона, составляющего 80-125%. Звездочка (*) означает двустороннее взаимодействие. AUCT, AUC и AUC0-∞ представляют собой площадь под кривой интервала дозирования, от времени 0 до времени с определяемым показателем, а также от времени 0 до бесконечности соответственно.
Взаимодействия в таблице представлены согласно следующему порядку: противопоказания, требуется корректировка дозы и тщательный клинический и/или биологический мониторинг, а также препараты, с которыми не отмечено существенного фармакокинетического взаимодействия, но которые могут быть клинически интересны в данной терапевтической сфере.
Фармацевтическая несовместимость
Вориконазол несовместим с 4,2 % раствором натрия гидрокарбоната, поэтому его не рекомендуется использовать в качестве растворителя. Совместимость с другими концентрациями раствора натрия гидрокарбоната неизвестна.
Вориконазол нельзя вводить одновременно с препаратами крови или растворами электролитов высокой концентрации, даже если для инфузий используются разные катетеры.
Инфузию вориконазола не следует проводить через один катетер или канюлю с другими лекарственными средствами, включая препараты для парентерального питания (Аминофузин 10 % Плюс). Однако препарат может вводиться одновременно с парентеральным питанием, а также с растворами электролитов невысокой концентрации через отдельные катетеры или отдельный вход многоканального катетера.
Вориконазол не следует смешивать с другими лекарственными средствами за исключением перечисленных в разделе «Правила приготовления раствора» (см. раздел «Способ применения и дозы»).
Особые указания
Взятие материала для посева и других лабораторных исследований (серология, гистология) с целью выделения и идентификации возбудителей следует производить до начала лечения.
Лечение можно начать до получения результатов лабораторных исследований. Однако после получения этих результатов необходимо скорректировать противогрибковую терапию соответствующим образом.
К видам, наиболее часто вызывающим грибковые инфекции у человека, относятся С. Albicans, С. paraphlosis, С. tropicalis, С. glabrata и С. krusei. Для всех указанных видов минимальная подавляющая концентрация (МПК) вориконазола обычно составляет менее 1 мг/мл. Тем не менее, in vitro активность вориконазола против разных видов Candida не одинакова. В частности, МПК вориконазола для устойчивых к флуконазолу изолятов С. glabrata пропорционально выше, чем для изолятов, чувствительных к флуконазолу. В связи с этим, грибки рода Candida следует во всех возможных случаях идентифицировать до уровня вида. При возможности определения чувствительности грибов к противогрибковым препаратам полученные значения МПК следует интерпретировать с использованием пороговых критериев.
Выделены клинические штаммы микроорганизмов, обладающие пониженной чувствительностью к вориконазолу. Однако повышенные МПК не всегда позволяют предсказать клиническую неэффективность: известны случаи, когда вориконазол был эффективен у пациентов, инфицированных микроорганизмами, устойчивыми к другим азолам. Оценить корреляцию между активностью вориконазола в условиях in vitro и клиническими результатами лечения трудно, учитывая тяжелое состояние пациентов, которых включали в клинические исследования. Пограничные концентрации вориконазола, позволяющие оценивать чувствительность к этому препарату, не установлены.
Нежелательные явления со стороны сердечно-сосудистой системы
Применение вориконазола может приводить к удлинению интервала QT на электрокардиограмме, что сопровождается редкими случаями мерцания/трепетания желудочков у тяжелобольных пациентов с множественными факторами риска, такими как кардиотоксическая химиотерапия, кардиомиопатия, гипокалиемия, сопутствующая терапия, которые могли способствовать развитию данного осложнения. Следует с осторожностью вводить вориконазол пациентам с потенциально проартимогенными состояниями, такими как:
- врожденное или приобретенное удлинение интервала QT;
- кардиомиопатия, особенно в сочетании с сердечной недостаточностью;
- синусовая брадикардия:
- существующие аритмии с клиническими проявлениями;
- сопутствующая терапия препаратами, которые могут привести к удлинению интервала QT (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Нарушения электролитного баланса, например, гипокалиемию, гипомагниемию и гипокальциемию, следует контролировать и корректировать при необходимости, до начала лечения и во время лечения вориконазолом.
Было проведено исследование с участием здоровых добровольцев, в рамках которого изучалось влияние на интервал QT однократных доз вориконазола, превышавших ежедневную стандартную дозу не более, чем в 4 раза. Ни у одного из пациентов не было отмечено удлинение интервала QT на 60 мсек или более от нормы или выше клинически значимого порога в 500 мсек.
Гепатотоксичность
Частота клинически значимого повышения активности «печеночных» трансаминаз у пациентов, получающих вориконазол, составляет 13,4 %. В большинстве случаев показатели функции печени нормализуются как при продолжении лечения без изменения дозы или после ее коррекции, так и после прекращения терапии. При применении вориконазола нечасто наблюдались случаи тяжелой гепатотоксичности (желтуха, гепатит и печеночно-клеточная недостаточность, в т.ч. с летальным исходом) у пациентов с серьезными основными заболеваниями.
Нежелательные явления со стороны печени наблюдаются, в основном, у пациентов с серьезными заболеваниями, главным образом, злокачественными новообразованиями кроветворной системы. У пациентов без каких-либо факторов риска наблюдаются преходящие реакции со стороны печени, включая гепатит и желтуху. Нарушения функции печени обычно обратимы и проходят после прекращения лечения.
Мониторинг функции печени
Во время лечения вориконазолом рекомендуется постоянно контролировать функцию печени у детей и взрослых. Клиническое ведение таких пациентов должно включать лабораторную оценку функции печени (в частности, определение активности ACT и АЛТ) в начале лечения вориконазолом и не реже 1 раза в неделю в течение первого месяца терапии. В случае продолжения лечения при отсутствии изменений со стороны биохимических показателей функции печени частота мониторинга может быть уменьшена до одного раза в месяц. При выраженном повышении биохимических показателей функции печени вориконазол следует отменить, если только соотношение пользы и риска терапии согласно медицинской оценке не оправдает его дальнейшее применение.
Зрительные нарушения
При лечении вориконазолом примерно у 21 % пациентов наблюдается нарушение зрительного восприятия: затуманивание зрения, изменение цветового зрения или фотофобия. Нарушения зрения являются преходящими и полностью обратимыми; в большинстве случаев они самопроизвольно исчезают в течение 60 мин. При повторном применении вориконазола отмечается ослабление их выраженности. Зрительные нарушения обычно легко выражены, редко требуют прекращения лечения и не приводят к каким-либо отдаленным последствиям.
Механизм развития зрительных нарушений неизвестен. Установлено, что вориконазол снижает амплитуду волн на электроретинограмме (ЭРГ) у здоровых добровольцев. Данные изменения на ЭРГ не нарастали при продолжении лечения в течение 29 дней и полностью исчезали после отмены вориконазола.
Длительная терапия вориконазолом (в среднем в течение 169 дней) у пациентов с паракокцидиоидозом не оказывала клинически значимого эффекта на зрительную функцию, что подтвердили результаты тестов на остроту зрения, зрительных полей, цветовосприятия и контрастной чувствительности.
По данным постмаркетинговых исследований сообщается о развитии случаев зрительных нарушений, сохраняющихся продолжительное время, в частности, возникновение «пелены» перед глазами, неврит зрительного нерва и отек диска зрительного нерва. Следует отметить, что данными нарушения развиваются чаще всего у тяжелобольных пациентов и/или получающих сопутствующую терапию, которая может вызывать подобные нежелательные явления.
Нежелательные явления со стороны почек
У тяжелобольных пациентов, получающих лечение вориконазолом, отмечались случаи развития острой почечной недостаточности, что, вероятно, было связано с терапией нефротоксическими лекарственными препаратами основного или сопутствующих заболеваний.
Мониторинг функции почек
Состояние пациентов следует регулярно контролировать с целью выявления признаков нарушения функции почек. Для этого необходимо проводить лабораторные исследования, в частности, определять концентрацию креатинина в плазме крови (см. раздел «Способ применения и дозы»).
Мониторинг функции поджелудочной железы
Взрослые и дети, имеющие факторы риска развития острого панкреатита (например, недавно проведенная химиотерапия, трансплантация гематопоэтических стволовых клеток), должны пройти обследование (определение активности амилазы и липазы в сыворотке крови) для решения вопроса о терапии вориконазолом.
Нежелательные явления со стороны кожи
При терапии вориконазолом часто развиваются кожные реакции, в основном, у пациентов с серьезными основными заболеваниями, одновременно принимающих другие лекарственные препараты. В большинстве случаев отмечалась легко или умеренно выраженная кожная сыпь. Во время лечения вориконазолом редко отмечались случаи развития эксфолиативных кожных реакций, например, синдрома Стивенса-Джонсона. Если у пациента развиваются эксфолиативные кожные реакции, вориконазол следует отменить.
Кроме того, на фоне применения вориконазола возможно развитие фотосенсибилизации (включая веснушки, лентиго и солнечный кератоз) и псевдопорфирии. Рекомендуется всем пациентам, включая детей, избегать сильного или длительного воздействия прямых солнечных лучей во время лечения вориконазолом, а также принимать защитные меры, например, носить защищающую одежду и пользоваться солнцезащитными средствами с высоким коэффициентом защиты от ультрафиолетового излучения (SPF).
Длительное лечение
У пациентов с кожными реакциями фоточувствительности и дополнительными факторами риска сообщается о развитии плоскоклеточного рака кожи и меланомы на фоне продолжительной терапии. В случае возникновения у пациента фототоксических реакций он должен быть проконсультирован соответствующими специалистами и направлен к дерматологу. Следует рассмотреть возможность отмены вориконазола и назначения других противогрибковых препаратов. При продолжении терапии вориконазолом, несмотря на возникновение фототоксических поражений кожи, пациент должен регулярно проходить дерматологическое обследование с целью раннего выявления и лечения предраковых заболеваний кожи. Если у пациента развиваются поражения кожи, связанные с предраковыми заболеваниями кожи, плоскоклеточным раком кожи или меланомой, то следует рассмотреть вопрос о прекращении терапии вориконазолом.
Неинфекционный периостит
Имеются сообщения о случаях развития периостита у перенесших трансплантацию пациентов на фоне длительной терапии вориконазолом. Если у пациента боль в костях и имеются рентгенологические данные, указывающие на наличие периостита, следует рассмотреть возможность прекращения терапии вориконазолом после мультидисциплинарной оценки состояния пациента.
Применение у детей
Безопасность и эффективность применения препарата у детей младше 2 лет не изучалась. Вориконазол показан пациентам детского возраста от 2 лет и старше при постоянное контроле функции печени (у детей выше, чем у взрослых, частота повышения «печеночных» ферментов на фоне применения вориконазола). Биодоступность вориконазола при приеме внутрь у детей в возрасте от 2 до 12 лет может быть снижена вследствие нарушения всасываемости или низкой массы тела. В таких случаях рекомендуется внутривенное введение вориконазола. Частота развития фототоксических реакций у детей выше. В связи с тем, что фототоксические поражения могут перерождаться в плоскоклеточную карциному, у детей необходимо применять строгие меры по защите кожи от ультрафиолетового излучения. Детям с признаками фотостарения кожи, например, лентиго или веснушки, рекомендуется избегать солнца и обследоваться у дерматолога даже после прекращения лечения.
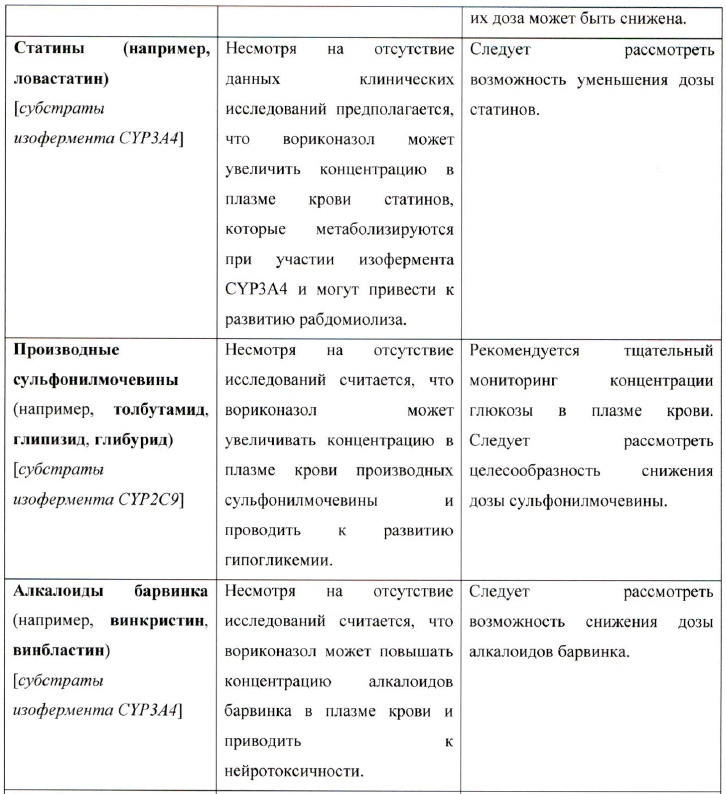
Наркотические анальгетики короткого действия (субстраты изофермента CYP3A4) Период полураспада алфентанила удлиняется в 4 раза при одновременном введении с вориконазолом, поэтому необходим тщательный мониторинг связанных с применением наркотических анальгетиков нежелательных реакций (включая более продолжительный мониторинг функции дыхания).
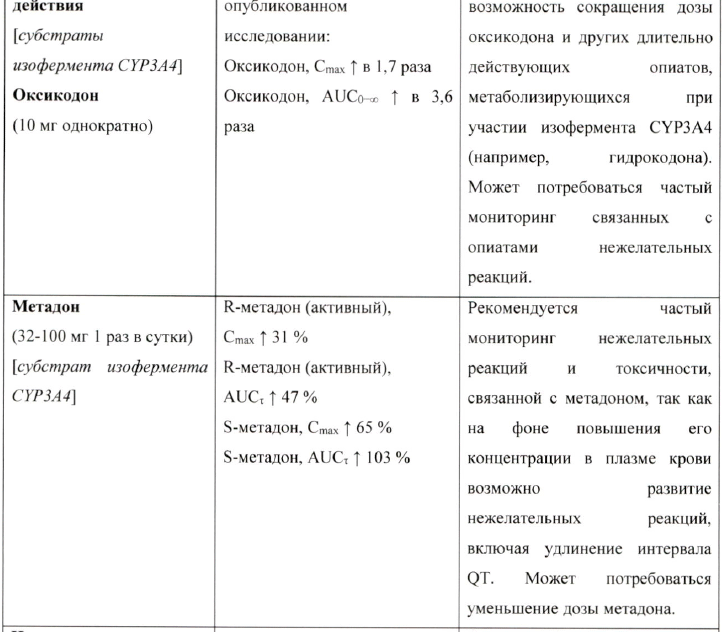
Наркотические аначъгетики длительного действия (субстраты изофермента CYP3A4) Следует рассмотреть возможность снижения дозы оксикодона и других наркотических анальгетиков длительного действия, метаболизирующихся при участии изофермента CYP3A4 (например, гидрокодон), при одновременном применении с вориконазолом. Необходимо проводить тщательный мониторинг связанных с применением наркотических анальгетиков нежелательных реакций (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Фенитоин (субстрат изофермента CYP2C9 и мощный индуктор изоферментов цитохрома Р450)
При одновременном применении фенитоина и вориконазола рекомендуется осуществлять постоянный контроль концентрации фенитоина. Следует избегать одновременной терапии вориконазолом и фенитоином, за исключением тех случаев, когда предполагаемая польза превышает потенциальный риск (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Эфавиренз (индуктор изоферментов цитохрома Р450; ингбитор и субстрат изофермента CYP3A4)
В случае одновременного применения вориконазола и эфавиренза следует увеличить дозу вориконазола до 400 мг каждые 12 часов, а дозу эфавиренза следует снизить до 300 мг каждые 24 часа (см. раздел «Взаимодействие с другими лекарственными препаратами»). Рифабутин (индуктор изоферментов цитохрома Р450)
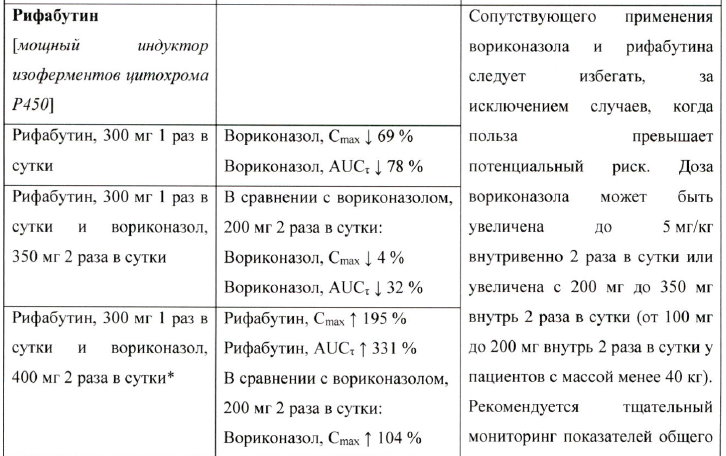
Одновременное применение вориконазола и рифабутина противопоказано, так как рифабутин значительно снижает концентрацию вориконазола в плазме крови.
Ритонавир (мощный индуктор изоферментов цитохрома Р450, ингибитор и субстрат изофермента CYP3A4J
Применять одновременно вориконазол и ритонавир в низких дозах (100 мг 2 раза в сутки) следует лишь в том случае, если ожидаемая польза от приема вориконазола значительно превышает риск от их совместного применения (см. разделы «Противопоказания» и «Взаимодействие с другими лекарственными препаратами»). Эверолимус (субстрат изофермента CYP3A4 и Р-гликопротеина)
Одновременное применение вориконазола и эверолимуса не рекомендуется, так как ожидается, что вориконазол существенно увеличит концентрацию эверолимуса в плазме крови. В настоящее время нет достаточного количества данных, которые позволили бы дать рекомендации по коррекции режима дозирования в такой ситуации.
Методом (субстрат изофермента CYP3A4J
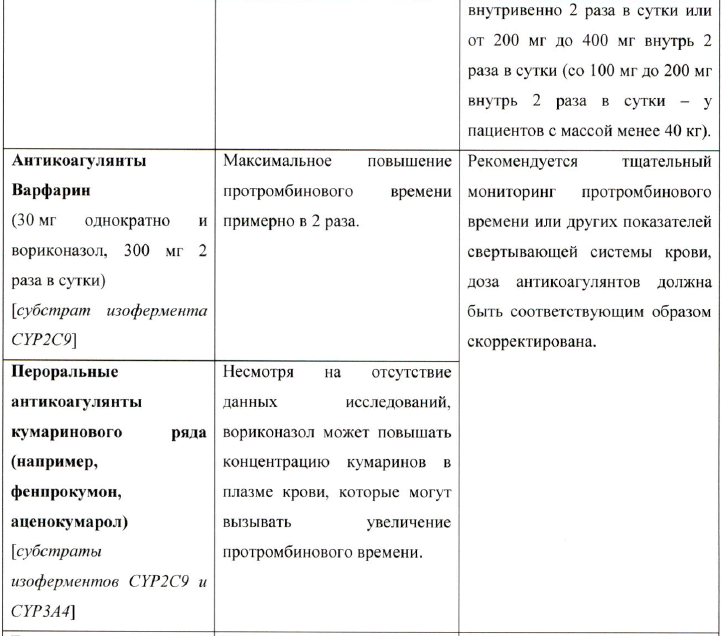
Рекомендуется постоянный мониторинг нежелательных и токсических реакций, связанных с метадоном, включая удлинение интервала QTc, при совместном применении с вориконазолом, так как возможно увеличение плазменной концентрации метадона. Может потребоваться снижение дозы метадона (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Флуконазол (ингибитор изоферментов CYP2C9, CYP2C19 и CYP3A4)
Одновременное применение вориконазола и флуконазола внутрь у здоровых добровольцев приводит к существенному увеличению Сmax и AUCt вориконазола. Подходящий режим дозирования и частоты приема вориконазола и флуконазола не установлен. Рекомендуется мониторинг связанных с вориконазолом нежелательных реакций, если вориконазол применяется сразу после флуконазола.
Содержание натрия
Извлекаемое из одного флакона препарата количество бетадекса сульфобутилата натрия(3200 мг) соответствует 222,82 мг натрия. Это необходимо принимать во внимание при назначении препарата пациентам, которым следует придерживаться диеты с ограничением содержания поваренной соли.
Инфузионные реакции
При внутривенном введении вориконазола могут наблюдаться связанные с инфузией реакции, в частности, «приливы» крови к коже лица и тошнота. Если эти симптомы выражены, то следует рассмотреть целесообразность прекращения лечения (см. раздел «Побочное действие»).
Специальные меры предосторожности при уничтожении неиспользованного лекарственного препарата
Весь неиспользованный препарат и расходные материалы должны быть утилизированы в соответствии с локальными нормативными требованиями.
Влияние на способность управлять транспортными средствами, механизмами
Вориконазол оказывает умеренное влияние на способность управлять автомобилем и работать с механизмами. Он может вызвать преходящие и обратимые изменения зрения, включая нечеткость зрения, измененное/усиленное визуальное восприятие и/или фотофобию. При наличии таких симптомов пациентам следует избегать потенциально опасных действий. например, управление автомобилем или работа с механизмами. Пациенты, получающие терапию вориконазолом, не должны управлять автомобилем в темное время суток.
Форма выпуска
Лиофилизат для приготовления концентрата для приготовления раствора для инфузий. 200 мг
Первичная упаковка
По 3592,1 мг порошка во флаконы из прозрачного стекла (тип I. Евр. Ф.) вместимостью 25 мл, укупоренные красными резиновыми хлорбутиловыми пробками (Евр. Ф.), обжатыми алюминиевыми колпачками (flip-off) с защитной пластиковой крышкой бордового цвета.
Вторичная упаковка
По 1, 5 или 10 флаконов помещают в пачку картонную вместе с инструкцией по применению.
Условия хранения
Лиофилизат — при температуре не выше 25 °С.
Восстановленный раствор (10 мг/мл) — при температуре от 2 до 8 °С в холодильнике.
Готовый к применению раствор (0,5-5 мг/мл) — при температуре от 20 до 30 °С.
Хранить в недоступном для детей месте.
Срок годности
Лиофилизат — 2 года.
Восстановленный раствор (10 мг/мл) — не более 24 ч.
Готовый к применению раствор (0.5-5 мг/мл) — не более 3 ч.
Не применять препарат после истечения срока годности, указанного на упаковке.
Условия отпуска
Отпускают по рецепту.
Производитель
Держатель РУ: Сандоз д.д.. Веровшкова 57. 1000 Любляна, Словения;
Произведено: Лек д.д., Веровшкова 57, 1526 Любляна, Словения.
Претензии потребителей направлять в ЗАО «Сандоз»:
125315, г. Москва, Ленинградский проспект, д. 72, корп. 3.
Купить Вориконазол Сандоз лиофилизат в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Вориконазол Канон (Voriconazole Canon) инструкция по применению
📜 Инструкция по применению Вориконазол Канон
💊 Состав препарата Вориконазол Канон
✅ Применение препарата Вориконазол Канон
📅 Условия хранения Вориконазол Канон
⏳ Срок годности Вориконазол Канон
Описание лекарственного препарата
Вориконазол Канон
(Voriconazole Canon)
Основано на официально утвержденной инструкции по применению препарата и подготовлено для электронного издания справочника Видаль 2014 года, дата обновления: 2021.12.20
Владелец регистрационного удостоверения:
Код ATX:
J02AC03
(Вориконазол)
Лекарственные формы
| Вориконазол Канон |
Таб., покр. пленочной оболочкой 50 мг: 2, 7, 10, 14, 28, 30, 50, 56 или 100 шт. рег. №: ЛП-002331 |
|
|
Таб., покр. пленочной оболочкой 200 мг: 2, 7, 10, 14, 28, 30, 50, 56 или 100 шт. рег. №: ЛП-002331 |
Форма выпуска, упаковка и состав
препарата Вориконазол Канон
Таблетки, покрытые пленочной оболочкой белого или почти белого цвета, круглые, двояковыпуклые; на поперечном разрезе — почти белого цвета.
Вспомогательные вещества: крахмал кукурузный прежелатинизированный 81 мг, кроскармеллоза натрия 18 мг, маннитол 83 мг, магния стеарат 3 мг, целлюлоза микрокристаллическая 65 мг.
Состав пленочной оболочки: опадрай II белый 13 мг, в т. ч.: поливиниловый спирт 6.097 мг, макрогол 3.068 мг, тальк 2.262 мг, титана диоксид 1.573 мг.
2 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (1) — пачки картонные.
7 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (1) — пачки картонные.
7 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (2) — пачки картонные.
7 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (4) — пачки картонные.
7 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (8) — пачки картонные.
10 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (1) — пачки картонные.
10 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (3) — пачки картонные.
10 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (5) — пачки картонные.
10 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (10) — пачки картонные.
14 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (1) — пачки картонные.
14 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (2) — пачки картонные.
14 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (4) — пачки картонные.
15 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (2) — пачки картонные.
Таблетки, покрытые пленочной оболочкой белого или почти белого цвета, круглые, двояковыпуклые; на поперечном разрезе — почти белого цвета.
Вспомогательные вещества: крахмал кукурузный прежелатинизированный 30 мг, кроскармеллоза натрия 5.5 мг, маннитол 30 мг, магния стеарат 1 мг, целлюлоза микрокристаллическая 23.5 мг.
Состав пленочной оболочки: опадрай II белый 4 мг, в т. ч.: поливиниловый спирт 1.876 мг, макрогол 0.944 мг, тальк 0.696 мг, титана диоксид 0.484 мг.
2 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (1) — пачки картонные.
7 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (1) — пачки картонные.
7 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (2) — пачки картонные.
7 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (4) — пачки картонные.
7 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (8) — пачки картонные.
10 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (1) — пачки картонные.
10 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (3) — пачки картонные.
10 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (5) — пачки картонные.
10 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (10) — пачки картонные.
20 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (5) — пачки картонные.
28 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (1) — пачки картонные.
28 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (2) — пачки картонные.
30 шт. — упаковки ячейковые контурные (алюминий/ПВХ) (1) — пачки картонные.
Фармакологическое действие
Вориконазол — противогрибковый препарат широкого спектра действия из группы триазолов. Механизм действия вориконазола связан с ингибированием деметилирования 14 альфа-стерола, опосредованного грибковым цитохромом Р450 — ключевого этапа биосинтеза эргостерола.
In vitro вориконазол обладает широким спектром противогрибкового действия: активен в отношении Candida spp. (включая штаммы С. krusei, С. glabrata и С. albicans), Aspergillus sp., Scedosporium spp., Fusarium spp. Клиническая эффективность вориконазола была продемонстрирована при инфекциях, вызванных Aspergillus spp., включая A. flavus, A. fumigatus, A. terreus, A. niger, A. nidulans), Candida spp., включая С. albicans, С. glabrata, С. krusei, С. parapsilosis, С. tropicalis, а так же в отношении ограниченного числа штаммов С. dubliniensis, С. inconspicua, С. guillermondii, Scedosporium spp., включая S. apiospermum, S. prolifecans и Fusarium spp. Другие грибковые инфекции, при которых применялся вориконазол включали в себя отдельные случаи инфекций, вызваны Alternaria spp., Blastomyces dermatitidis, Blastoschizomyces capitatus, Cladosporium spp., Coccidoides immitis, Conidiobolus coronatus, Cryptococcus neoformans, Exserohilum rostratum, Exophiala spinifera, Fonsecaea pedrosoi, Madurella mycetomatis, Paecilomyces lilacinus, Penicillium spp., включая P. marneffei, Philaphora richardsiae, Scopulariopsis brevicaulis и Trychosporon spp., включая Т. beigelii. Продемонстрирована активность вориконазола in vitro в отношении клинических штаммов Acremonium spp., Alternaria spp., Bipolaris spp., Cladophialophora spp., liistoplasma capsulatum. Выявлена также активность вориконазола in vitro в отношении Curvularia spp. и Sporothrix spp., однако клиническое значение данного эффекта неизвестно.
Фармакокинетика
Общая характеристика: фармакокинетические параметры вориконазола характеризуются значительной межиндивидуальной вариабельностью. Фармакокинетика вориконазола является нелинейной за счет насыщения его метаболизма. При повышении дозы наблюдается непропорциональное увеличение площади под кривой «концентрация-время» (AUCt). Увеличение пероральной дозы с 200 мг 2 раза в сутки до 300 мг 2 раза в сутки приводит к увеличению AUCt в среднем в 2,5 раза. При приеме внутрь насыщающих доз вориконазола его концентрации в плазме крови приближаются к равновесным в течение первых 24 ч. Если препарат назначают 2 раза в сутки в средних дозах, то происходит кумуляция вориконазола, а равновесные концентрации достигаются к шестому дню у большинства пациентов.
Всасывание и распределение: вориконазол быстро и практически полностью всасывается после приема внутрь; Сmax достигается через 1-2 ч после приема. Биодоступность вориконазола при приеме внутрь составляет 96%. При повторном приеме вориконазола с жирной пищей Сmax и AUCt снижаются на 34% и 24%, соответственно. Всасывание вориконазола не зависит от рН желудочного сока. Средний объем распределения вориконазола в равновесном состоянии составляет 4,6 л/кг. Связывание с белками плазмы составляет 58%. Вориконазол проникает через гематоэнцефалический барьер и определяется в спинномозговой жидкости.
Метаболизм: вориконазол метаболизируется под действием изоферментов CYP2C19, CYP2C9, CYP3A4. Важную роль в метаболизме вориконазола играет изофермент CYP2C19, проявляющий выраженный генетический полиморфизм, в связи с чем, пониженный метаболизм вориконазола возможен у 15-20% представителей азиатского происхождения и у 3-5%представителей европеоидной и негроидной рас. Установлено, что у пациентов с пониженным метаболизмом AUCt вориконазола в среднем в 4 раза выше, чем у гомозиготных пациентов с высоким метаболизмом. У гетерозиготных пациентов с высоким метаболизмом AUCt вориконазола в среднем в 2 раза выше, чем у гомозиготных.
Основным метаболитом вориконазола является N-оксид, доля которого составляет 72% от общего количества циркулирующих в плазме крови метаболитов с радиоактивной меткой. Этот метаболит обладает минимальной противогрибковой активностью и не вносит вклад в эффект вориконазола.
Выведение: вориконазол выводится в виде метаболитов; в неизмененном виде почками выводится менее 2% от введенной дозы вориконазола. После повторного приема внутрь в моче обнаруживается около 83% дозы вориконазола. Большая часть (> 94%) общей дозы выводится в течение первых 96 ч после приема внутрь. T1/2 вориконазола зависит от дозы и составляет примерно 6 ч при приеме препарата внутрь в дозе 200 мг. В связи с нелинейностью фармакокинетики величина T1/2 не позволяет предсказать кумуляцию или выведение вориконазола.
Фармакокинетика особых групп пациентов
Пол: при повторном применении препарата внутрь Сmax и AUCt у здоровых молодых женщин были на 83% и 113%, соответственно, выше, чем у молодых здоровых мужчин. Значимых различий Сmax и AUCt у здоровых пожилых мужчин и здоровых пожилых женщин (≥ 65 лет) нет. Равновесная концентрация вориконазола в плазме крови у женщин была на 100% выше, чем у мужчин после приема препарата в виде таблеток. Необходимости коррекции дозы в зависимости от пола нет. Концентрации в плазме у мужчин и женщин сходны.
Возраст: при повторном приеме вориконазола внутрь Сmax и AUCt у здоровых пожилых мужчин (≥ 65 лет) на 61% и 86%, соответственно, выше, чем у здоровых молодых мужчин (18-45 лет). Значимых различий Сmax и AUCt у здоровых пожилых женщин (≥ 65 лет) и здоровых молодых женщин (18-45 лет) нет. Необходимости коррекции дозы вориконазола в зависимости от возраста нет.
Дети: для достижения у детей концентрации вориконазола, сопоставимой с таковой при введении поддерживающей дозы вориконазола для приема внутрь взрослым 200 мг 2 раза в сутки, для детей требуется такая же доза вориконазола для приема внутрь (200 мг 2 раза в сутки, вне зависимости от массы тела). Не требуется введение насыщающей дозы, а также коррекция дозы вориконазола в зависимости от возраста для детей внутри возрастного диапазона от 2 до 12 лет. Тем не менее, биодоступность препарата при приеме внутрь у детей может ограничиваться нарушением всасывания и достаточно низкой массой тела в этом возрасте.
Нарушение функции почек: при однократном приеме вориконазола внутрь в дозе 200 мг пациентам с нормальной функцией почек и пациентам с нарушением функции почек от легкой (клиренс креатинина (КК) 41-60 мл/мин) до тяжелой (КК < 20 мл/мин) степени фармакокинетика вориконазола существенно не зависит от степени нарушения функции почек. Связывание вориконазола с белками плазмы крови примерно одинаково у пациентов с различной степенью почечной недостаточности.
Нарушение функции печени: после однократного приема внутрь в дозе 200 мг AUCt вориконазола у пациентов с легкой или средней степенью тяжести цирроза печени (классы А и В по классификации Чайлд-Пью) была на 233% выше, чем у пациентов с нормальной функцией печени. Нарушение функции печени не влияет на связь вориконазола с белками плазмы. При многократном приеме препарата внутрь AUCt вориконазола сопоставима у пациентов со средней степенью тяжести цирроза печени (класс В по классификации Чайлд-Пью), получавших препарат в поддерживающей дозе 100 мг 2 раза в сутки, и у пациентов с нормальной функцией печени, получающих вориконазол в дозе 200 мг 2 раза в сутки. Сведений о фармакокинетике вориконазола у пациентов с тяжелым циррозом печени (класс С по классификации Чайлд-Пью) нет.
Показания препарата
Вориконазол Канон
- инвазивный аспергиллез;
- тяжелые инвазивные формы кандидоза (включая С. krusei);
- кандидоз пищевода;
- кандидемия у пациентов без нейтропении;
- тяжелые грибковые инфекции, вызванные Scedosporium spp. и Fusarium spp;
- другие тяжелые инвазивные грибковые инфекции при непереносимости или рефрактерности к другим лекарственным средствам;
- профилактика «прорывных» грибковых инфекций у пациентов со сниженной функцией иммунной системы, лихорадкой и нейтропенией из группы высокого риска (реципиенты аллогенного костного мозга, пациенты с рецидивом лейкоза).
Режим дозирования
Внутрь, за 1 ч до еды или спустя 1 ч после еды.
Взрослые и дети с 12 лет: назначение препарата Вориконазол Канон следует начинать с рекомендуемой насыщающей дозы, чтобы уже в первый день добиться концентрации в плазме крови, близкой к равновесной.
Подбор дозы: при недостаточной эффективности лечения поддерживающая доза препарата Вориконазол Канон может быть увеличена до 300 мг каждые 12 ч. У пациентов с массой тела менее 40 кг доза может быть увеличена до 150 мг каждые 12 ч.
Если пациент не переносит препарат в высокой дозе (300 мг каждые 12 ч), то поддерживающую дозу постепенно снижают до 200 мг по 50 мг каждые 12 ч (для пациентов с массой тела менее 40 кг — по 100 мг каждые 12 ч).
Фенитоин можно применять одновременно с препаратом Вориконазол Канон, если поддерживающую дозу последнего увеличивают с 200 мг до 400 мг каждые 12 ч (со 100 мг до 200 мг каждые 12 ч у пациентов с массой тела менее 40 кг).
При одновременном применении вориконазола и эфавиренза (в дозе 300 мг 1 раз в сутки) поддерживающую дозу препарата Вориконазол Канон следует увеличить до 400 мг каждые 12 ч.
Нарушение функции почек: Коррекции дозы вориконазола у пациентов с легкой до тяжелой степени нарушением функции почек не требуется.
Нарушение функции печени: при остром повреждении печени, проявляющемся повышением активности АЛТ (АЛТ), АСТ (ACT), коррекция дозы не требуется, но рекомендуется продолжать контроль за показателями функции печени. Пациентам с легкими или среднетяжелыми нарушениями функции печени (классы А и В по классификации Чайлд-Пью) следует назначать стандартную насыщающую дозу препарата Вориконазол Канон, а поддерживающую дозу снижать в 2 раза. Пациентам с тяжелым нарушением функции печени препарат Вориконазол Канон следует назначать только в тех случаях, когда ожидаемая польза превышает возможный риск, и под постоянным контролем с целью выявления признаков токсического действия препарата.
Пожилые пациенты: коррекция дозы у пожилых людей не требуется.
Дети: Препарат в виде таблеток назначают детям в том случае, если ребенок может глотать таблетки.
Рекомендуемая доза для детей от 3 до 12 лет: Если ребенок может глотать таблетки, то дозу округляют до ближайшей дозы в мг/кг, кратной 50 мг, и назначают в виде целых таблеток. Режим дозирования вориконазола у детей (в возрасте от 3 до 12 лет) и подростков в возрасте от 12 до 14 лет и массой тела менее 50 кг:
Фармакокинетика и переносимость более высоких доз вориконазола у детей не изучались.
Рекомендации по применению вориконазола у детей даются на основании исследований его применения в форме порошка для приготовления суспензии для приема внутрь. Биоэквивалентность вориконазола в форме порошка для приготовления суспензии для приема внутрь и таблеток при применении у детей не изучалась. Учитывая, что у детей замедлено прохождение пищи через ЖКТ, вполне вероятно, что всасывание вориконазола при приеме внутрь будет иным, чем у взрослых. Применение вориконазола у детей в возрасте от 3 до 12 лет с нарушениями функции печени или почек не изучалось.
Коррекция дозы: При неадекватном клиническом ответе пациента, доза может быть увеличена с шагом 1 мг/кг (или 50 мг в случае, если изначально применяли максимальную дозу 350 мг).
Побочное действие
Классификация ВОЗ частоты развития побочных эффектов:
очень часто — ≥ 1/10
часто — от ≥1/100 до < 1/10
нечасто — от ≥1/1000 до <1/100
редко — от ≥ 1/10000 до <1/1000
очень редко — < 1/10000, включая отдельные сообщения.
Лабораторные показатели: часто — нарушение функции печени (включая повышение активности ACT, АЛТ, щелочной фосфатазы, ГГТ, ЛДГ, концентрации билирубина), повышение концентрации креатинина в плазме крови; нечасто — удлинение интервала QT, повышение остаточного азота мочевины, гиперхолестеринемия.
Со стороны сердечно-сосудистой системы: очень часто — периферические отеки; часто — снижение АД, тромбофлебит, флебит; нечасто — фибрилляция желудочков, желудочковая аритмия, обморок, предсердная аритмия, наджелудочковая аритмия, наджелудочковая тахикардия, брадикардия, тахикардия; редко — желудочковая тахикардия (включая трепетание желудочков), желудочковая тахисистолическая аритмия типа «пируэт», полная атриовентрикулярная блокада, блокада ножки пучка Гиса, узловые аритмии, лимфангит.
Со стороны системы кроветворения и лимфатической системы: часто — панцитопения, угнетение костномозгового кроветворения, тромбоцитопения, лейкопения, пурпура, анемия (в том числе, макроцитарная, микроцитарная, нормоцитарная, мегалобластная, апластическая); нечасто — синдром диссеминированного внутрисосудистого свертывания, лимфаденопатия, агранулоцитоз, эозинофилия.
Со стороны нервной системы: очень часто — головная боль; часто — головокружение, спутанность сознания, ажитация, тремор, парестезии; нечасто — отек головного мозга, атаксия, диплопия, вертиго, гипестезия; редко — судороги, энцефалопатия, синдром Гийена-Барре, экстрапирамидные расстройства, сонливость во время инфузии, периферическая нейропатия.
Со стороны органа зрения: очень часто — зрительные нарушения (включая нарушение/усиление зрительного восприятия, возникновение «пелены» перед глазами, изменение цветового восприятия, фотофобия); нечасто — отек соска зрительного нерва, склерит, блефарит, неврит зрительного нерва, нистагм; редко — кровоизлияние в сетчатую оболочку глаза, атрофия зрительного нерва, помутнение роговицы, окулогирный криз.
Со стороны органа слуха и вестибулярного аппарата: нечасто — гипоакузия, шум в ушах.
Со стороны дыхательной системы, грудной клетки и средостения: часто — острый респираторный дистресс-синдром, отек легких, нарушение дыхания, боль в груди.
Со стороны ЖКТ: очень часто — тошнота, рвота, диарея, боль в животе; нечасто — запор, дуоденит, диспепсия, гингивит, глоссит, панкреатит, отек языка, перитонит; редко — нарушение вкусового восприятия.
Со стороны мочеполовой системы: часто — острая почечная недостаточность, гематурия; нечасто — альбуминурия, нефрит; редко — некроз почечных канальцев.
Со стороны кожи и подкожных тканей: очень часто — сыпь; часто — отек лица, зуд, макуло-папулезная сыпь, макулезная сыпь, папулезная сыпь, фотосенсибилизация, алопеция, эксфолиативный дерматит, хейлит, эритема; нечасто — синдром Стивенса-Джонсона, ангионевротический отек, фиксированная лекарственная сыпь, экзема, псориаз, крапивница; редко —дискоидная красная волчанка, мультиформная эритема, токсический эпидермальный некролиз, псевдопорфирия; частота неизвестна — плоскоклеточный рак.
Со стороны опорно-двигательного аппарата и соединительной ткани: часто — боль в спине; нечасто — артрит; редко — гипертония; частота неизвестна — периостит.
Со стороны эндокринной системы: нечасто — недостаточность коры надпочечников; редко — гипертиреоз, гипотиреоз.
Нарушения метаболизма и питания: часто — гипокалиемия, гипогликемия.
Инфекции и инвазии: часто — гастроэнтерит, гриппоподобный синдром; редко — псевдомембранозный колит.
Общие и местные реакции: очень часто — лихорадка; часто — озноб, астения.
Со стороны иммунной системы: часто — синуситы; нечасто — аллергические реакции, анафилактоидные реакции.
Со стороны гепатобилиарной системы: часто — желтуха, холестатическая желтуха; нечасто — холецистит, холелитиаз, увеличение печени, гепатит, печеночная недостаточность; редко — печеночная кома.
Психические расстройства: часто — галлюцинации, депрессия, тревога; редко — бессонница.
Применение у детей: нежелательные эффекты препарата у детей аналогичны таковым у взрослых.
Противопоказания к применению
- гиперчувствительность к вориконазолу или любому другому компоненту препарата.
- дети в возрасте младше 3 лет (для данной лекарственной формы).
- одновременное применение препарата Вориконазол Канон и терфенадина, астемизола, цизаприда, пимозида, хинидина, сиролимуса, рифампицина, карбамазепина, длительно действующих барбитуратов (фенобарбитал), алкалоидов спорыньи (эрготамина, дигидроэрготамина), эфавиренза (400 мг и выше 1 раз в сутки), ритонавира (400 мг и выше, 2 раза в сутки), рифабутина, а также зверобоя продырявленного противопоказано (см. раздел «Взаимодействие с другими лекарственными средствами»).
С осторожностью
Повышенная чувствительность к другим препаратам — производным азолов. Тяжелая степень недостаточности функции печени, тяжелая степень недостаточности функции почек.
Препарат Вориконазол Канон следует применять с осторожностью у пациентов с проаритмическими состояниями: врожденное или приобретенное увеличение интервала QT, кардиомиопатия, в особенности с сердечной недостаточностью, синусовая брадикардия, наличие симптоматической аритмии, одновременный прием препаратов, вызывающих удлинение интервала QT. Электролитные нарушения, такие как гипокалиемия, гипомагниемия и гипокальциемия, необходимо контролировать и при необходимости, корректировать до начала терапии препаратом Вориконазол Канон или во время терапии.
Применение при беременности и кормлении грудью
Достаточной информации о применении вориконазола у беременных женщин нет. В исследованиях на животных установлено, что препарат оказывает токсическое действие на репродуктивную функцию. Возможный риск для человека неизвестен.
Вориконазол не следует применять беременным женщинам за исключением тех случаев, когда ожидаемая польза для матери явно превышает риск для плода.
Выведение вориконазола с грудным молоком не изучалось. На время применения препарата грудное вскармливание следует прекратить. Женщины репродуктивного возраста при применении препарата Вориконазол Канон должны использовать надежные методы контрацепции.
Применение при нарушениях функции печени
Пациентам с тяжелой степенью печеночной недостаточности применять с осторожностью.
Применение при нарушениях функции почек
Пациентам с тяжелой степенью почечной недостаточности применять с осторожностью.
Применение у детей
Препарат противопоказан детям в возрасте младше 3 лет (для данной лекарственной формы).
Применение у пожилых пациентов
Коррекции дозы у пациентов пожилого возраста не требуется.
Особые указания
Взятие проб для лабораторных исследований с целью выделения и идентификации возбудителей следует производить до начала лечения. Терапия может быть начата до получения результатов лабораторных исследований, однако при их наличии лечение следует соответствующим образом скорректировать.
Нежелательные явления со стороны сердечно-сосудистой системы. Применение вориконазола связано с удлинением интервала QT на ЭКГ, что сопровождается редкими случаями мерцания/трепетания желудочков у тяжелобольных пациентов с множественными факторами риска, такими как кардиотоксическая химиотерапия, кардиомиопатия, гипокалиемия и сопутствующая терапия, которые могли способствовать развитию данного осложнения.
Гепатотоксичность. При лечении вориконазолом наблюдаются нечастые (0,1 — 1%) случаи серьезных реакций со стороны печени, включая клинически проявляющийся гепатит, холестаз и печеночно-клеточную недостаточность, в том числе с летальным исходом. Нежелательные явления со стороны печени наблюдаются, в основном, у пациентов со злокачественными опухолями крови. У пациентов без каких-либо факторов риска наблюдаются преходящие реакции со стороны печени, включая гепатит и желтуху. Нарушения функции печени обычно обратимы и проходят после прекращения лечения. Во время лечения препаратом Вориконазол Канон рекомендуется постоянно контролировать функцию печени. При появлении клинических признаков нарушения функции печени, необходимо обсудить целесообразность прекращения лечения (см. раздел «Способ применения и дозы»).
Зрительные нарушения, такие как «пелена» перед глазами, неврит зрительного нерва и отек соска зрительного нерва развиваются чаще всего у тяжелобольных пациентов и/или получающих сопутствующую терапию, которая может вызывать подобные нежелательные явления. При лечении вориконазолом примерно у 21% пациентов наблюдается нарушение зрительного восприятия: затуманивание зрения, изменение цветового зрения или фотофобия. Нарушения зрения являются преходящими и полностью обратимыми; в большинстве случаев они самопроизвольно исчезают в течение 60 минут. При повторном применении вориконазола отмечается ослабление их выраженности. Зрительные нарушения обычно легко выражены, редко требуют прекращения лечения и не приводят к каким-либо отдаленным последствиям.
Нежелательные явления со стороны почек. У тяжелобольных пациентов, получающих вориконазол, отмечались случаи развития острой почечной недостаточности, что, вероятно, было связано с терапией основного или сопутствующих заболеваний, нефротоксичными лекарственными средствами. Пациентов следует наблюдать с целью выявления признаков нарушения функции почек (см. раздел «Способ применения и дозы»).
Мониторинг функции поджелудочной железы. Взрослые и дети, имеющие факторы риска развития острого панкреатита должны пройти обследование для решения вопроса о терапии вориконазолом.
Нежелательные явления со стороны кожи. Если у пациента развиваются эксфолиативные кожные реакции, то вориконазол следует отменить. Кроме того, длительное применение вориконазола сопровождается кожными реакциями фоточувствительности. Во время лечения пациентам рекомендуется избегать интенсивного или длительного воздействия прямых солнечных лучей. Если у пациента развиваются поражения кожи, связанные с плоскоклеточным раком кожи или меланомой, то следует рассмотреть вопрос о прекращении терапии вориконазолом.
Нежелательные явления со стороны костно-мышечной системы. Имеются сообщения о случаях развития периостита у пациентов после трансплантации, получающих длительную терапию вориконазолом. Терапию вориконазолом следует отменить в случае, если у пациента имеется боль в костях и на рентгенограмме отмечаются изменения, характерные для периостита.
Влияние на способность управления транспортными средствами и механизмами
Вориконазол может вызвать преходящие и обратимые нарушения зрения, включая возникновение «пелены» перед глазами, нарушение/усиление зрительного восприятия и/или фотофобию. При наличии таких симптомов пациенты должны избегать выполнения потенциально опасных действий, в частности, управления автотранспортом или использования сложной техники, требующих быстроты психомоторных реакций. При приеме вориконазола пациенты не должны водить автомобиль в ночное время.
Передозировка
В случае передозировки показана симптоматическая и поддерживающая терапия. Антидот вориконазола неизвестен. В случае передозировки гемодиализ может способствовать выведению вориконазола из организма.
Лекарственное взаимодействие
Влияние других лекарственных средств на фармакокинетику вориконазола
Одновременное применение вориконазола противопоказано со следующими лекарственными препаратами
Зверобой продырявленный оказывает короткий начальный ингибирующий эффект на метаболизм вориконазола, за которым следует его активация. Одновременное применение вориконазола и зверобоя продырявленного противопоказано (см. раздел «Противопоказания»).
Концентрация вориконазола в плазме крови значительно снижается при одновременном применении со следующими лекарственными препаратами
Рифампицин (600 мг 1 раз в сутки) снижает Сmax и AUCt вориконазола на 93% и 96%, соответственно. Одновременное применение вориконазола и рифампицина противопоказано (см. раздел «Противопоказания»).
Ритонавир. Прием ритонавира (400 мг каждые 12 ч) снижал Сmax и AUCt вориконазола при приеме внутрь в среднем на 66% и 82%, соответственно.
Прием ритонавира (100 мг каждые 12 ч) снижал Сmax и AUCt вориконазола при приеме внутрь в среднем на 24% и 39%, соответственно. Установлено, что повторный прием вориконазола внутрь не оказывает выраженного эффекта на Сmax в равновесном состоянии и AUCt ритонавира, принимаемого в дозе 400 мг каждые 12 ч. В то же время, устойчивое снижение Сmax и AUCt на 25% и 13%, соответственно, наблюдалось при приеме ритонавира в дозе 100 мг каждые 12 ч. Одновременное применение вориконазола и ритонавира (400 мг каждые 12 ч) противопоказано (см. раздел «Противопоказания»). Одновременного применения вориконазола и ритонавира в дозе 100 мг каждые 12 ч следует избегать.
Высоковероятно, что карбамазепин и длительно действующие барбитураты (фенобарбитал), значительно снижают концентрацию вориконазола в плазме крови. Одновременное применение вориконазола с карбамазепином и длительно действующими барбитуратами противопоказано (см. раздел «Противопоказания»).
Учитывая незначительное фармакокинетическое взаимодействие не требуется коррекция доз следующих лекарственных препаратов
Циметидин (400 мг 2 раза в сутки) вызывает повышение Сmax и AUCt вориконазола на 18% и 23%, соответственно. Коррекция дозы вориконазола не требуется.
Ранитидин (150 мг 2 раза в сутки) не оказывает значимого влияния на Сmax и AUCt вориконазола.
Эритромицин (1 г 2 раза в сутки) и азитромицин (500 мг 1 раз в сутки) не оказывают существенного влияния на Сmax и AUCt вориконазола. Влияние вориконазола на метаболизм эритромицина или азитромицина неизвестно. Коррекции дозы не требуется.
Действие вориконазола на фармакокинетику других лекарственных средств
Противопоказано одновременное применение вориконазола со следующими лекарственными препаратами
Терфенадин, астемизол, цизаприд, пимозид и хинидин. Одновременное применение вориконазола с данными препаратами противопоказано, так как может привести к повышению их концентрации в плазме крови. Это, в свою очередь, может вызвать удлинение интервала QT и, в редких случаях, привести к развитию мерцания/трепетания желудочков (см. раздел «Противопоказания»).
Сиролимус. Вориконазол повышает Сmax и AUCt сиролимуса (2 мг однократно) на 556% и 1014%, соответственно. Одновременное применение вориконазола и сиролимуса противопоказано (см. раздел «Противопоказания»).
Высоковероятно, что вориконазол может вызывать повышение концентраций препаратов алкалоидов спорыньи (эрготамин и дигидроэрготамин) в плазме крови и развитие эрготизма. Одновременное применение алкалоидов спорыньи с вориконазолом противопоказано (см. раздел «Противопоказания»).
Взаимодействие с вориконазолом может приводить к повышению концентрации в плазме крови следующих лекарственных препаратов
Циклоспорин. У пациентов, перенесших трансплантацию почки и находящихся в стабильном состоянии, вориконазол повышает Сmax и AUCt циклоспорина по крайней мере на 13% и 70%, соответственно. При назначении вориконазола пациентам, получающим циклоспорин, рекомендуется уменьшить дозу циклоспорина вдвое и контролировать его концентрацию в плазме крови.
Такролимус. Вориконазол повышает Сmax и AUCt такролимуса (0,1 мг/кг однократно) на 117% и 221%, соответственно. При назначении вориконазола пациентам, получающим такролимус, рекомендуется уменьшить дозу последнего до одной трети и контролировать его концентрацию в плазме крови.
Метадон. Многократное введение вориконазола внутрь повышает Сmax и AUCt фармакологически активного R-метадона на 31% и 47%, соответственно, у пациентов, получающих поддерживающую дозу метадона (30 — 100 мг в сутки). Повышение концентрации метадона в плазме крови приводит к проявлению токсических эффектов, включая удлинение интервала QT. При одновременном применении вориконазола и метадона необходимо внимательно следить за проявлением нежелательных и токсических эффектов. При необходимости доза метадона может быть снижена.
Наркотические анальгетики короткого действия. Постоянное применение вориконазола внутрь в 6 раз увеличивает AUC алфентанила в однократной дозе. При одновременном применении вориконазола и алфентанила или других наркотических анальгетиков короткого действия, его структурных аналогов (например, суфентанил) следует предусмотреть снижение дозы последних. Поскольку T1/2 алфентанила при его одновременном введении с вориконазолом увеличивается в 4 раза, необходим тщательный мониторинг нежелательных явлений, связанных с применением наркотических анальгетиков, включая более продолжительный мониторинг функции дыхания.
Фентанил. Одновременное применение вориконазола и фентанила в однократной дозе 5 мкг/кг внутривенно повышает AUC фентанила в среднем в 1,4 раза. При необходимости доза фентанила должна быть снижена.
Оксикодон. Одновременное применение вориконазола и оксикодона внутрь в однократной дозе 10 мг повышает Сmax и AUC оксикодона в 1,7 раза и в 3,6 раза. T1/2 оксикодона увеличивается в 2 раза. Необходимо проводить тщательный мониторинг нежелательных явлений. Может потребоваться снижение дозы оксикодона при совместной терапии с вориконазолом.
Варфарин. Одновременное применение вориконазола (300 мг 2 раза в сутки) с варфарином (30 мг однократно) сопровождалось увеличением максимального протромбинового времени на 93%. При одновременном применении варфарина и вориконазола рекомендуется контролировать протромбиновое время.
Другие пероральные антикоагулянты, например, фенпрокумон, аценокумарол. Вориконазол может вызывать повышение концентрации производных кумарина в плазме крови и протромбинового времени. При совместном применении необходимо с короткими интервалами контролировать протромбиновое время и соответствующим образом подбирать дозы антикоагулянтов.
Производные сульфонилмочевины. Вориконазол может повышать концентрацию производных сульфонилмочевины (толбутамида, глипизида и глибурида) в плазме крови и вызывать гипогликемию. При одновременном применении вориконазола с указанными препаратами необходимо тщательно контролировать концентрацию глюкозы в крови.
Статины. Вориконазол может вызывать повышение плазменных концентраций статинов. При одновременном применении рекомендуется оценить целесообразность коррекции дозы статинов. Повышение концентрации статинов иногда сопровождается развитием рабдомиолиза.
Бензодиазепины. Вориконазол может вызывать повышение плазменных концентраций бензодиазепинов (мидазолама, триазолама, алпразолама) и развитие пролонгированного седативного эффекта. При одновременном применении вориконазола и бензодиазепинов рекомендуется оценить целесообразность коррекции дозы бензодиазепинов.
Алкалоиды барвинка. Вориконазол может повышать содержание алкалоидов барвинка (винкристина и винбластина) в плазме крови и вызывать нейротоксичность. При одновременном применении вориконазола и алкалоидов барвинка рекомендуется оценить целесообразность коррекции дозы алкалоидов барвинка.
НПВП. Вориконазол повышает Сmax и AUCt ибупрофена (400 мг однократно) на 20% и 100%, соответственно, а Сmax и AUCt диклофенака (50 мг однократно) — на 114% и 78%, соответственно. В случае одновременного применения вориконазола и НПВП пациентов следует наблюдать с целью выявления возможных токсических эффектов и при необходимости корректировать дозу НПВП.
При одновременном применении вориконазола со следующими лекарственными препаратами значимого фармакокинетического взаимодействия не выявлено, поэтому коррекция их дозы не требуется.
Преднизолон. Вориконазол повышает Сmax и AUCt преднизолона (60 мг однократно) на 11% и 34%, соответственно. Коррекция дозы не требуется.
Дигоксин. Вориконазол не оказывает существенного влияния на Сmax и AUCt дигоксина (0,25 мг 1 раз в день).
Микофеноловая кислота. Вориконазол не оказывает влияния на Сmax и AUCt микофеноловой кислоты (1 г однократно).
Двустороннее взаимодействие.
Фенитоин. Одновременного применения вориконазола и фенитоина следует избегать, за исключением тех случаев, когда ожидаемая польза превышает возможный риск. Фенитоин (300 мг 1 раз в сутки) снижает Сmax и AUCt вориконазола на 49% и 69%, соответственно. Вориконазол (400 мг 1 раза в сутки) повышает Сmax и AUCt фенитоина (300 мг 1 раз в сутки) на 67% и 81%, соответственно. При одновременном применении фенитоина с вориконазолом рекомендуется контролировать концентрацию фенитоина в плазме крови. Фенитоин можно применять совместно с вориконазолом, если поддерживающая доза последнего увеличена с 200 до 400 мг каждые 12 ч внутрь (со 100 до 200 мг каждые 12 ч внутрь).
Омепразол (40 мг 1 раз в сутки) повышает Сmax и AUCt вориконазола на 15% и 41%, соответственно. Коррекция дозы вориконазола не рекомендуется. Вориконазол повышает Сmax и AUCt омепразола на 116% и 280%, соответственно. При назначении вориконазола пациентам, получающим омепразол, дозу последнего рекомендуется уменьшить вдвое. Вориконазол может также ингибировать метаболизм других ингибиторов протонной помпы, которые являются субстратами изофермента CYP2C19.
Пероральные контрацептивы. Одновременное применение вориконазола и пероральных контрацептивов (1 мг норэтистерона и 0,035 мг этинилэстрадиола 1 раз в сутки) приводит к увеличению Сmax и AUCt норэтистерона на 15% и 53%, соответственно, а этинилэстрадиола — на 36% и 61%, соответственно. При этом Сmax и AUCt вориконазола увеличивается на 14% и 46%, соответственно. Поскольку соотношение между норэтистероном и этинилэстрадиолом остается примерно одинаковым при взаимодействии с вориконазолом, можно предположить, что их контрацептивная активность не изменяется. В случае одновременного применения вориконазола и пероральных контрацептивов следует проводить мониторинг с целью выявления возможных нежелательных эффектов. Низкодозированные пероральные контрацептивы не исследовались.
Индинавир (800 мг 3 раза в сутки) не оказывает существенного влияния на Сmax и AUCt вориконазола. Вориконазол существенно не влияет на Сmin, Сmax и AUCt индинавира (800 мг 3 раза в сутки).
Другие ингибиторы протеазы ВИЧ. Вориконазол может ингибировать метаболизм ингибиторов протеазы ВИЧ: саквинавира, ампренавира и нелфинавира. В свою очередь, ингибиторы протеазы ВИЧ могут подавлять метаболизм вориконазола. В случае одновременного применения вориконазола с ингибиторами протеазы ВИЧ пациентов следует наблюдать с целью выявления возможных токсических эффектов.
Эфавиренз. В равновесном состоянии эфавиренз (400 мг 1 раз в сутки) снижает равновесную Сmax и AUCt вориконазола в среднем на 61% и 77%, соответственно. Вориконазол в равновесном состоянии повышает равновесную Сmax и AUCt эфавиренза в среднем на 38% и 44%, соответственно. Стандартные дозы вориконазола и эфавиренза (400 мг один раз в сутки) противопоказаны. Одновременное применение возможно, если поддерживающая доза вориконазола будет повышена до 400 мг два раза в сутки, а доза эфавиренза снижена до 300 мг один раз в сутки. При отмене терапии вориконазолом, начальная доза эфавиренза должна быть восстановлена.
Другие ненуклеозидные ингибиторы обратной транскриптазы. Делавирдин может ингибировать метаболизм вориконазола. Невирапин может индуцировать метаболизм вориконазола. Вориконазол может подавлять метаболизм ненуклеозидных ингибиторов обратной транскриптазы. При одновременном применении вориконазола с ненуклеозидными ингибиторами обратной транскриптазы пациентов следует наблюдать с целью выявления возможных токсических эффектов.
Флуконазол (200 мг один раз в сутки). Одновременное пероральное применение вориконазола и флуконазола приводит к повышению Сmax и AUCt вориконазола на 57% и 79%, соответственно. Изменения Сmax и AUCt флуконазола не установлены. Подходящий режим коррекции дозы и/или частоты приема вориконазола и флуконазола не установлен. В том случае, если вориконазол применяется после флуконазола, рекомендуется проводить тщательный контроль нежелательных реакций, связанных с приемом вориконазола.
Эверолимус. Взаимодействие не изучалось, однако, одновременное применение не рекомендуется, так как ожидается, что вориконазол значительно повышает плазменные концентрации эверолимуса. На данный момент не имеется достаточной информации для рекомендации по коррекции режима дозирования.
Одновременное применение вориконазола противопоказано со следующими лекарственными препаратами
Рифабутин (300 мг 1 раз в сутки) снижает Сmax и AUCt вориконазола (200 мг 2 раза в сутки) на 69% и 78%, соответственно. При одновременном применении рифабутина Сmax и AUCt вориконазола в дозе 350 мг 2 раза в сутки составили 96% и 68% от показателей при применении только вориконазола в дозе 200 мг 2 раза в сутки. При применении вориконазола в
дозе 400 мг 2 раза в сутки Сmax и AUCt, соответственно, на 104% и 87% выше, чем при монотерапии вориконазолом в дозе 200 мг 2 раза в сутки. Вориконазол в дозе 400 мг 2 раза в сутки повышает Сmax и AUCt рифабутина на 195% и 331%, соответственно. Одновременное применение вориконазола и рифабутина противопоказано (см. раздел «Противопоказания»).
Условия хранения препарата Вориконазол Канон
Хранить в сухом, защищенном от света месте при температуре не выше 25°С.
Хранить в недоступном для детей месте.
Срок годности препарата Вориконазол Канон
Условия реализации
Препарат отпускается по рецепту.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Таблетки, покрытые пленочной оболочкой, белого или почти белого цвета, круглые, двояковыпуклые. На поверхности таблеток допускается неровность пленочного покрытия.
Каждая таблетка содержит: активное вещество: вориконазол – 50 мг или 200 мг, вспомогательные вещества: крахмал прежелатинизированный, натрия крахмалгликолят (тип А), повидон, магния стеарат, лактозы моногидрат, опадрай II белый (85F).
Противогрибковые средства для системного применения. Производные триазола.
Код АТС: J02AC03.
Вориконазол – противогрибковый препарат из группы триазолов. Основной механизм действия данного препарата связан с ингибированием деметилирования 14α-ланостерола, опосредованного грибковым цитохромом Р450, – важнейшего этапа биосинтеза эргостерола. Накопление 14α-метилстеролов взаимосвязано с последующей потерей эргостерола в клеточной мембране грибков и обуславливает противогрибковую активность вориконазола.
Микробиология
In vitro вориконазол обладает широким спектром противогрибкового действия, включая противогрибковое действие в отношении видов Candida (включая устойчивые к флуконазолу С. krusei и резистентные штаммы С. gladrata и С. albicans) и обладает фунгицидной активностью в отношении всех изученных видов Aspergillus. Кроме того, вориконазол демонстрирует фунгицидную активность in vitro в отношении патогенной грибковой флоры, включая Scedosporium или Fusarium, которые в ограниченной степени чувствительны к существующим противогрибковым средствам.
Клиническая эффективность (с частичным и полным ответом) была продемонстрирована при инфекциях, вызванных Aspergillius spp., включая A.flavus, A. fumigarus, A. terreus, А. niger, A. nidulans, Candida spp., включая C. albicans, С. glabrata, С. krusei, С. parapsilosis и С. tropicalis и ограниченным числом С. dubliniensis, С. inconspicua и С. guilliermondii, Scedosporium spp., включая S. apiospermum, S. proliflcans и Fusarium spp.
Другие грибковые инфекции, при которых применялся препарат (часто с частичным или полным ответом) включали с себя отдельные случаи инфекций, вызванных Alternaria spp., Blastomyces dermatitidis, Blastoschizomyces capitatus, Cladosporium spp., Coccidioides im— mitis, Conidiobolus coronatus, Cryptococcus neoformans, Exserohilum rostratum, Exophiala spinifera, Fonsecaea pedrosoi, Madurella mycetomatis, Paecilomyces lilacinus, Penicillium spp., включая Р. marneffei, Phialophora richardsiae, Scopulariopsis brevicaulis и Trichosporon spp., включая инфекции, вызванные T. beigelii.
In vitro вориконазол активен в отношении клинических штаммов Acremonium spp., Alternaria spp., Bipolaris spp., Cladophialophora spp., Histoplasma capsulation. Рост большинства штаммов подавлялся при концентрациях вориконазола от 0,05 до 2 мкг/мл.
Была продемонстрирована активность in vitro в отношении следующей патогенной флоры: Curvularia spp. и Sporothrix spp, однако ее клиническая значимость неизвестна.
Пограничные значения
Забор образцов для получения грибковых культур и других соответствующих лабораторных исследований (серологических и гистопатологических) необходимо проводить до начала терапии, чтобы выделить и идентифицировать патогенные микроорганизмы. Лечение может быть начато еще до того, как станут известны результаты культурального и других лабораторных исследований, однако, как только эти результаты станут известны, противоинфекционную терапию следует соответствующим образом скорректировать.
Виды, наиболее часто вызывающие инфекции у человека, включают: С. albicans, С. раrаpsilosis, С. tropicalis, С. glabrata и С. krusei, все из которых, как правило, демонстрируют минимальную ингибирующую концентрацию (МИК) вориконазола менее 1 мг/л.
Тем не менее, вориконазол проявляет не одинаковую активность в отношении различных видов грибов рода Candida. В частности, в отношении С. glabrata МИК вориконазола для штаммов, резистентных к флуконазолу пропорционально выше, чем таковые, наблюдаемые для штаммов, чувствительных к флуконазолу. Следовательно, каждый раз необходимо пытаться установить видовую принадлежность грибов рода Candida. Если возможно проведение исследования чувствительности, то можно интерпретировать результаты МИК, используя пограничные значения.
Вориконазол является противогрибковым средством, производным триазола, широкого спектра действия и показан в следующих случаях:
– Лечение инвазивного аспергиллеза;
– Лечение кандидемии у пациентов, не имеющих нейтропении;
– Лечение тяжелых инвазивных инфекций, вызванных Candida (включая С. krusei), устойчивых к лечению флуконазолом;
– Лечение кандидоза пищевода;
– Лечение тяжелых грибковых инфекций, вызванных Scedosporium spp. и Fusarium spp;
– Лечение других тяжелых грибковых инфекций у пациентов с непереносимостью или резистентностью к другим видам лечения;
– Профилактика прорывных грибковых инфекций у лихорадящих пациентов с высоким риском (после трансплантации аллогенного костного мозга, пациенты с рецидивом лейкоза);
– Профилактика у пациентов с высоким риском развития инвазивных грибковых инфекций, например, у реципиентов трансплантатов гемопоэтических стволовых клеток (ТГСК).
Вориконазол таблетки, покрытые оболочкой, следует принимать как минимум за один час до еды или через один час после еды.
Применение у взрослых
Лечение вориконазолом следует начинать с указанной нагрузочной дозы вориконазола внутривенно, чтобы в первый же день достичь соответствующих концентраций вориконазола в плазме крови. Внутривенное введение следует продолжать минимум 7 дней до перехода на пероральный прием препарата. При улучшении клинического состояния пациента и переносимости лекарственных форм для приема внутрь возможен переход на таблетированную форму вориконазола для приема внутрь. Учитывая высокую биодоступность препарата при приеме внутрь (96%) переход с внутривенного введфшя ем препарата возможен при наличии клинических показаний.
В представленной ниже таблице содержатся подробные указания по дозировке препарата
| Лекарственная форма для приема внутрьa | ||
| Пациенты с массой тела 40 кг и более | Пациенты с массой тела менее 40 кг | |
| Нагрузочная доза по всем показаниям (первые 24 часа) | — | — |
| Поддерживающая доза (после первых 24 часов) | ||
| Профилактика инвазивных грибковых инфекций / Профилактика прорывных инфекций | 200 мг каждые 12 часов | 100 мг каждые 12 часов |
| Инвазивный аспергиллез / инфекции, вызванные Scedosporium и Fusarium / Другие тяжелые инфекции, вызванные плесневыми грибкамиb | 200 мг каждые 12 часов | 100 мг каждые 12 часов |
| Кандидемия у пациентов без нейтропении | 200 мг каждые 12 часов | 100 мг каждые 12 часов |
| Кандидоз пищевода | 200 мг каждые 12 часов | 100 мг каждые 12 часов |
а. В исследованиях на здоровых добровольцах доза 200 мг перорально каждые 12 часов обеспечивала воздействие (AUCτ), сходное с дозой 3 мг/кг в/в каждые 12 часов, доза 300 мг перорально каждые 12 часов обеспечивала воздействие (AUCτ), сходное с дозой 4 мг/кг в/в каждые 12 часов.
b. В основном клиническом исследовании инвазивного аспергиллеза медиана продолжительности в/в терапии вориконазолом составила 10 дней (в диапазоне 2-85 дней). Медиана продолжительности пероральной терапии вориконазолом составила 76 дней (в диапазоне 2-232 дней).
с. В клинических исследованиях пациенты с кандидемией получали 3 мг/кг каждые 12 часов в качестве первичной терапии, тогда как пациетпы с другими глубокими поражениями, вызванными Candida, получали 4 мг/кг в качестве неотложной терапии. Соответствующая доза должна быть обоснована тяжестью и характером инфекции.
Коррекция режима дозирования
При недостаточной эффективности проводимой терапии, поддерживающая доза препарата при приеме внутрь может быть увеличена с 200 мг каждые 12 часов (аналог дозы 3 мг/кг в/в каждые 12 часов) до 300 мг каждые 12 часов (аналог дозы 4 мг/кг в/в каждые 12 часов). У пациентов с массой тела менее 40 кг доза может быть увеличена со 100 мг до 150 мг внутрь каждые 12 часов.
При непереносимости препарата в такой высокой дозе (т.е. 300 мг внутрь каждые 12 часов) ее снижают поэтапно по 50 мг до достижения дозы 200 мг каждые 12 часов внутрь (или 100 мг каждые 12 часов для пациентов с массой тела менее 40 кг).
При одновременном применении с фенитоином поддерживающую дозу вориконазола для приема внутрь увеличивают с 200 до 400 мг каждые 12 часов (со 100 мг до 200 мг каждые 12 часов у пациентов с массой тела менее 40 кг).
При одновременном применении вориконазола с эфавиренцем поддерживающая доза вориконазола должна быть увеличена до 400 мг каждые 12 часов.
По возможности, следует избегать совместного приема вориконазола с рифабутином. Тем не менее, если комбинация необходима, поддерживающая доза вориконазола может быть увеличена от 200 мг до 350 мг внутрь каждые 12 часов (со 100 мг до 200 мг внутрь каждые 12 часов у пациентов с массой тела менее 40 кг).
Длительность терапии зависит от клинического эффекта и результатов микологического исследования.
Профилактика грибковых инфекций у взрослых и детей
Профилактическое применение вориконазола следует начинать в день трансплантации и можно продолжать в течение 100 суток. Продолжительность приема с целью развития инвазивных грибковых инфекций, что определяется нейтропенией или иммуносупрессией. Продлить профилактический прием вориконазола свыше 180 дней после трансплантации можно только в случае продолжающейся иммуносупрессивной терапии или развития реакции «трансплантат против хозяина» (ТПХ). Безопасность и эффективность при применении вориконазола более 180 дней в клинических исследованиях надлежащим образом не изучалась, необходима тщательная оценка пользы и риска.
Режим дозирования с целью профилактики такой же, как с целью лечения в соответствующих возрастных группах.
Применение у пациентов пожилого возраста
Коррекция дозы препарата у пациентов пожилого возраста не требуется.
Применение у пациентов с почечной недостаточностью
Почечная недостаточность не оказывает влияния на фармакокинетику вориконазола, принимаемого внутрь. Поэтому, у пациентов с почечной недостаточностью от легкой степени тяжести до тяжелой необходимости в коррекции дозы нет.
Применение у пациентов с печеночной недостаточностью
У пациентов с острой печеночной недостаточностью, проявляющейся в повышении маркеров функции печени (АЛТ, ACT), необходимость в коррекции дозы отсутствует. Рекомендуется продолжить контроль маркеров функции печени.
Пациентам с циррозом печени легкой или средней степени тяжести (класс тяжести А и В по Чайлд-Пью) рекомендуется применять вориконазол в стандартной нагрузочной дозе, а поддерживающую дозу препарата уменьшать в два раза.
Применение вориконазола у пациентов с тяжелым хроническим циррозом печени (класс тяжести С по Чайлд-Пью) не изучалось.
При применении вориконазола отмечались случаи повышения маркеров функции печени и появления клинических признаков повреждения печени, таких как желтуха; поэтому препарат должен назначаться пациентам с тяжелыми нарушениями функции печени только в тех случаях, когда польза от его применения превышает потенциальный риск. Необходим тщательный контроль риска токсичности препарата у пациентов с тяжелым нарушением функции печени.
Применение в детском возрасте
Применение у детей (в возрасте от 2 до 12 лет) и в раннем подростковом возрасте (от 12 до 14 лет и < 50 кг)
Рекомендуется следующий режим терапии:
| Внутривенно | Перорально | |
| Нагрузочная доза препарата (первые 24 часа) | 9 мг/кг каждые 12 часов | Не рекомендуется |
| Поддерживающая доза (после первых 24 часов) | 8 мг/кг два раза в сутки | 9 мг/кг два раза в сутки (максимальная доза 350 мг два раза в сутки) |
Примечание: Основано на результатах популяционного фармакокинетического анализа у 112 детей с иммуносупрессией в возрасте от 2 до < 12 лет и 26 подростков в возрасте от 12 до < 17 лет.
Лечение рекомендуется начинать с внутривенного введения препарата, вопрос о переходе на пероральный прием следует рассматривать только после существенного улучшения клинического состояния. Следует отметить, что при внутривенном введении доза 8 мг/кг обеспечит воздействие вориконазола, в 2 раза превышающее воздействие дозы 9 мг/кг при приеме внутрь.
Данные рекомендации по пероральному приему препарата у детей основаны на исследованиях, в которых вориконазол назначался в виде порошка для приготовления пероральной суспензии. Биоэквивалентность при использовании порошка для приготовления пероральной суспензии и таблеток у детей не изучалась. Учитывая предположительно ограниченное время прохождения через желудочно-кишечный тракт у детей, всасывание таблеток у детей может отличаться по сравнению с взрослыми пациентами. Поэтому рекомендуется у детей в возрасте от 2 до < 12 лет использовать суспензию для приема внутрь. Безопасность и эффективность применения препарата у детей до 2 лет не установлена. Поэтому вориконазол не рекомендуется детям в возрасте до 2 лет. Применение вориконазола у детей с печеночной и почечной недостаточностью в возрасте от 2 до 12 лет не изучалось.
Применение у всех других подростков (12-14 лет и ≥ 50 кг; 15-16 лет вне зависимости от массы тела)
Следует назначать дозы, рекомендуемые взрослым.
Коррекция дозировки
При недостаточной эффективности препарата доза может увеличиваться по 1 мг/кг (или по 50 мг, если первоначально использовалась максимальная доза для приема внутрь 350 мг). При непереносимости препарата дозу препарата снижают по 1 мг/кг (или по 50 мг, если первоначально использовалась максимальная доза для приема внутрь 350 мг).
В случае если пациент пропустил очередной прием препарата, следующая доза должна быть принята в соответствии с назначенным режимом. Необходимо предупредить пациента о том, что не следует принимать двойную дозу, чтобы восполнить пропущенную дозу.
Профиль безопасности вориконазола основан на сведениях, полученных из объединенной базы данных по безопасности, собранной при исследовании более 2000 человек (1655 пациентов в терапевтических исследованиях). Она включает разнородную популяцию, включающую пациентов, страдающих злокачественными заболеваниями крови, ВИЧ-инфицированных пациентов с кандидозом пищевода и рефрактерными грибковыми инфекциями, пациентов с кандидемией или аспергиллезом, не страдающих нейтропенией, а также здоровых добровольцев. У 561 пациента продолжительность терапии вориконазолом составила более 12 недель, 136 пациентов получали вориконазол более 6 месяцев.
Кроме того, безопасность вориконазола изучалась у 279 пациентов, принимавших лечение вориконазолом в исследованиях по профилактике. Профиль нежелательных явлений в данных исследованиях по профилактике был аналогичен установленному профилю безопасности, полученному по данным 2000 участников в клинических исследованиях вориконазола.
В приведенную ниже таблицу включены нежелательные реакции, отмеченные в терапевтических и/или благотворительных/расширенных исследованиях, при возможной причинной взаимосвязи. Наиболее часто наблюдавшимися нежелательными явлениями были нарушение зрения, лихорадка, сыпь, тошнота, рвота, диарея, головная боль, периферические отеки и боль в животе. В целом выраженность нежелательных проявлений была легкой или умеренной степени тяжести. Клинически значимых различий по полу, возрасту или расе при анализе данных по безопасности не обнаружено.
Нежелательные проявления, обнаруженные у участников, получавших вориконазол
| Класс системы органов по MedDRA* | Нежелательные реакции на лекарственное средство |
| Инфекционные и паразитарные заболевания | |
| Часто | Синусит |
| Нарушения со стороны крови и лимфатической системы | |
| Часто | Тромбоцитопения, анемия (включая макроцитарную, микроцитарную, нормоцитарную, мегалобластную, апластическую), лейкопения, панцитопения |
| Нечасто | Лимфаденопатия, агранулоцитоз, эозинофилия, диссеминированное внутрисосудистое свертывание крови, миелосупрессия |
| Нарушения со стороны иммунной системы | |
| Часто | Гиперчувствительность |
| Нечасто | Аллергические реакции, анафилактоидные реакции |
| Нарушения со стороны эндокринной системы | |
| Нечасто | Недостаточность коры надпочечников, гипотиреоз |
| Редко | Гипертиреоз |
| Нарушения со стороны обмена веществ и питания | |
| Очень часто | Периферические отеки |
| Часто | Гипогликемия, гипокалиемия, гипонатриемия |
| Нарушения психики | |
| Часто | Галлюцинации, спутанность сознания, депрессия, страх, тревога |
| Нарушения со стороны нервной системы | |
| Очень часто | Головная боль |
| Часто | Головокружение, тремор, парестезия |
| Нечасто | Атаксия, отек головного мозга, гипертония, гипестезия, нистагм, синкопе, нарушение восприятия вкуса |
| Редко | Синдром Гийена-Барре, глазодвигательный криз, экстрапирамидный синдром, бессонница, энцефалопатия, сонливость во время инфузии, судороги, периферическая нейропатия |
| Нарушения со стороны органа зрения | |
| Очень часто | Нарушения зрения (включая нарушение/усиление зрительного восприятия, затуманивание зрения, изменение цветовосприятия, светобоязнь) |
| Нечасто | Блефарит, неврит зрительного нерва, отек соска зрительного нерва, склерит, диплопия |
| Редко | Кровоизлияние в сетчатку, помутнение роговицы, атрофия зрительного нерва |
| Нарушения со стороны органа слуха и лабиринтные нарушения | |
| Нечасто | Головокружение |
| Редко | Гипакузия, звон в ушах |
| Нарушения со стороны сердца | |
| Часто | Суправентиркулярная аритмия, тахикардия, брадикардия |
| Нечасто | Фибрилляция желудочков, вентрикулярная экстрасистолия, суправентрикулярная тахикардия, вентрикулярная тахикардия |
| Редко | Полная желудочковая тахикардия типа «пируэт», полная атриовентрикулярная (АВ) блокада, блокада ножки пучка Гиса, узловой ритм |
| Нарушения со стороны сосудов | |
| Часто | Гипотензия, флебит |
| Нечасто | Тромбофлебит |
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | |
| Очень часто | Респираторный дистресс-синдром |
| Часто | Острый респираторный дистресс-синдром, отек легких |
| Нарушения со стороны желудочно-кишечного тракта | |
| Очень часто | Абдоминальные боли, тошнота, рвота, диарея |
| Часто | Диспепсия, запор, хейлит |
| Нечасто | Панкреатит, дуоденит, глоссит, отек языка |
| Нарушения со стороны печени и желчевыводящих путей | |
| Очень часто | Аномальные печеночные функциональные пробы (включая аспартат-трансферазу [ACT], аланин-трансферазу [АЛТ], щелочную фосфатазу, гамма-глутамил-транспептидазу [ГГТ], лактатдегидрогеназу [ЛДГ], билирубин) |
| Часто | Желтуха, холестатическая желтуха, гепатит |
| Нечасто | Печеночная недостаточность, гепатомегалия, холецистит, желчнокаменная болезнь |
| Нарушения со стороны кожи и подкожных тканей | |
| Очень часто | Сыпь |
| Часто | Отек лица, зуд, макулопапулезная сыпь, реакции фотосенсибилизации кожи, алопеция, эксфолиативный дерматит, пурпура |
| Нечасто | Фиксированный медикаментозный дерматит, экзема, псориаз, синдром Стивенса-Джонсона, крапивница |
| Редко | Ангионевротический отек, дискоидная красная волчанка, многоформнаяэритема, токсический эпидермальный некролиз, псевдопорфирия |
| Нарушения со стороны скелетно-мышечной и соединительной ткани | |
| Часто | Боль в спине |
| Нечасто | Артрит |
| Частота неизвестна | Периостит (побочный эффект, выявленный при применении после регистрации) |
| Нарушения со стороны почек и мочевых путей | |
| Часто | Повышение уровня креатинина, острая почечная недостаточность, гематурия |
| Нечасто | Повышение остаточного азота мочевины крови, альбуминурия, нефрит, тубулярный некроз почек |
| Общие расстройства и нарушения в месте введения | |
| Очень часто | Лихорадка |
| Часто | Боль в груди, отек лица, астения, озноб |
| Редко | Гриппоподобный синдром |
| Новообразования доброкачественные, злокачественные и неуточненные (включая кисты и полипы) | |
| С неизвестной частотой | Плоскоклеточная карцинома (побочный эффект, выявленный при применении после регистрации) |
* Частота определялась следующим образом: очень часто – ≥ 10%, часто – от ≥ 1% до < 10%, нечасто – от ≥ 0,1% до < 1%, редко – от 0,01% до < 0,1%.
Нарушения зрения
В клинических исследованиях нарушения зрения, связанные с приемом вориконазола, встречались довольно часто. В этих исследованиях примерно у 21% испытуемых наблюдалось нарушение/усиление зрительного восприятия, затуманивание зрения, изменение цветовосприятия и/или светобоязнь. Подобные нарушения зрения были временными и полностью обратимыми, большинство из них разрешаются спонтанно в течение 60 минут. При приеме последующих доз вориконазола данные побочные эффекты ослаблялись. Обычно нарушения зрения носили легкий характер, редко приводили к отмене препарата и не ассоциировались с долговременными последствиями. Нарушения зрения могли быть связаны с высокой концентрацией препарата в плазме крови и/или дозой.
В период пострегистрационного наблюдения регистрировались сообщения о продолжительных нежелательных явлениях со стороны зрения.
Механизм возникновения данных эффектов неизвестен, но, скорее всего, он локализован в сетчатке.
В ходе исследования воздействия вориконазола на функцию сетчатки у здоровых добровольцев, вориконазол вызвал уменьшение волновой амплитуды на электроретинограмме. Электроретинограмма измеряет электрический ток в сетчатке. Данные изменения электроретинограммы не прогрессировали в течение 29 дней применения препарата и исчезли после прекращения приема вориконазола.
Долговременный эффект вориконазола (медиана 169 дней; диапазон 5-353 дня) на зрение оценивали у лиц с паракокцидиоидомикозом. Вориконазол не оказывал клинически значимого влияния на зрение, что определялось путем исследования остроты зрения, полей зрения, цветовосприятия и контрастной чувствительности. Не было отмечено признаков токсичности для сетчатки. Нежелательные проявления со стороны зрения наблюдались у 17/35 лиц, получавших вориконазол. Эти проявления не приводили к отмене препарата, были в основном легкими, случались на протяжении первой недели лечения и разрешались в процессе продолжения терапии вориконазолом.
Кожные реакции
В ходе клинических исследований кожные реакции при лечении вориконазолом встречались довольно часто, однако они проявлялись у тяжелобольных пациентов, одновременно принимавших множество сопутствующих лекарственных препаратов. В большинстве случаев появившаяся сыпь была легкой или средней степени тяжести. Отмечены случаи развития у пациентов тяжелых кожных реакций при лечении вориконазолом, включая синдром Стивенса-Джонсона (не часто), токсический эпидермальный некролиз (редко) и полиформную эритему (редко).
В случае появления у пациента сыпи необходимо тщательно контролировать его состояние и при прогрессировании кожных реакций отменить вориконазол. Были отмечены реакции фотосенсибилизации кожи у пациентов, получавших лечение вориконазолом в течение длительного периода времени.
Маркеры функции печени
В ходе программы клинических исследований вориконазола клинически значимые отклонения уровня трансаминаз имели место у 13,4% испытуемых (200/1493). Отклонения от нормы значений маркеров функции печени могут быть связаны с высоким уровнем концентрации в плазме и/или дозами. В большинстве случаев отклонение маркеров функции печени восстанавливалось в процессе лечения или без коррекции дозы, или после коррекции дозы, включая отмену препарата.
В редких случаях применения вориконазола ассоциировалось со случаями тяжелой почечной токсичности у пациентов с тяжелыми основными заболеваниями. Имели место случаи желтухи, случаи гепатита и печеночной недостаточности с летальным исходом.
Применение у детей
Безопасность вориконазола изучалась у 285 детей в возрасте от 2 до <12 лет, которые получали лечение вориконазолом в исследованиях по изучению фармакокинетики (127 детей) и в благотворительных программах (158 детей). Профиль нежелательных проявлений у этих 285 детей был подобен таковому у взрослых. Данные пострегистрационного наблюдения свидетельствуют о том, что кожные реакции у детей могут отмечаться с большей частотой по сравнению с взрослыми.
В период пострегистрационного наблюдения регистрировались сообщения о случаях развития панкреатита у пациентов детского возраста.
• Наличие в анамнезе гиперчувствительности к вориконазолу или любому из вспомогательных веществ.
• Совместное применение вориконазола с субстратами CYP3A4 (терфенадином астемизолом, цизапридом, пимозидом или хинидином). Повышение концентрации в плазме этих лекарственных препаратов может привести к удлинению интервала QTc и, в редких случаях, к развитию трепетания/мерцания желудочков torsades de pointes.
• Совместное применение с сиролимусом. Вориконазол значительно увеличивал концентрацию сиролимуса в плазме крови здоровых лиц.
• Совместное применение с рифабутином, рифампицином, карбамазепином и длительно действующими барбитуратами (например, фенобарбиталом) противопоказано, поскольку данные лекарственные препараты могут привести к значимому снижению концентрации вориконазола в плазме крови.
• Совместное применение с эфавиренцом в высоких дозах (400 мг и более один раз в сутки). В данной дозе эфавиренц значительно снижает концентрации вориконазола в плазме крови здоровых лиц.
• Совместное применение вориконазола и высоких доз ритонавира (400 мг и более два раза в сутки) противопоказано, поскольку при использовании таких доз ритонавира значительно снижается концентрация вориконазола в плазме крови у здоровых лиц.
• Совместное применение с алколоидами спорыньи (эрготамином, дигидроэрготамином), которые являются субстратами CYP3A4, противопоказано, поскольку повышение концентрации в плазме данных лекарственных препаратов может привести к эрготизму.
• Совместное применение с St John’s Wort (препарат на основе зверобоя).
В ходе клинических исследований имели место 3 эпизода случайной передозировки препарата. Все эти случаи произошли с детьми, которые получили внутривенно дозы вориконазола в 5 раз превышающие рекомендованные. В одном случае была отмечена светобоязнь, которая длилась 10 минут.
Антидоты вориконазола не известны. В случае передозировки рекомендуется проводить симптоматическое и поддерживающее лечение.
Вориконазол подвергается гемодиализу с клиренсом 121 мл/мин. Внутривенный носитель активного вещества SBECD подвергается гемодиализу с клиренсом 55 мл/мин. При передозировке гемодиализ может помочь удалить вориконазол и SBECD из организма.
Гиперчувствительность: Следует соблюдать осторожность при назначении вориконазола пациентам с гиперчувствительностью к другим азолам.
Нежелательные явления со стороны сердца: Применение некоторых азолов, включая вориконазол, ассоциировалось с удлинением интервала QT на электрокардиограмме. В процессе клинической разработки и пострегистрационного наблюдения у пациентов, принимавших вориконазол, отмечались редкие случаи развития torsades de pointes. Эти случаи наблюдались у тяжело больных пациентов с множественными влияющими факторами риска, такими как: наличие в анамнезе приема кардиотоксических химиопрепаратов, кардиомиопатии, гипокалиемии и сопутствующего приема лекарственных средств, которые могут привести к развитию этого проявления. Вориконазол следует назначать с осторожностью пациентам с потенциально проаритмическими состояниями, такими как:
— Врожденное или приобретенное удлинение интервала QTc.
— Кардиомиопатия, в частности, сопровождающаяся сердечной недостаточностью.
— Синусовая брадикардия.
— Симптоматические аритмии.
— Совместный прием лекартсвенных средств, которые известно удлиняют интервал QTc на ЭКГ.
Электролитные нарушения, такие как гипокалиемия, гипомагниемия и гипокальциемия должны постоянно контролироваться, и, при необходимости, корректироваться перед и во время приема вориконазола. Исследование, проведенное с участием здоровых добровольцев, в котором изучали влияние на интревал QTc однократных доз вориконазола до 4 раз превышающих обычную суточную дозу. Ни у одного испытуемого ни в одной группе не отмечалось увеличения QTc > 60 мсек от исходного значения. Ни у одного испытуемого не наблюдалось удлинения интервала, превышающего потенциально клиническую значимую пороговую величину 500 мсек.
Печеночная токсичность: В клинических исследованиях в процессе лечения вориконазолом отмечались не частые (>0,1% и <1%) случаи тяжелых печеночных реакций (включая клинический гепатит, холестаз и молниеносную печеночную недостаточность, в том числе и с летальным исходом). Случаи печеночных реакций отмечались главным образом у пациентов с тяжелыми основными заболеваниями (в основном при злокачественных заболеваниях крови). Преходящие печеночные реакции, включая гепатит и желтуху, имели место у пациентов без каких-либо определяемых факторов риска. Нарушения функции печени, как правило, носили обратимый характер и проходили после прекращения лечения.
Контроль функции печени: Пациентам, получающим вориконазол, рекомендуется регулярно контролировать функцию печени, особенно маркеры функции печени и уровень билирубина. При появлении клинических симптомов поражения печени, которые могут быть вызваны приемом вориконазола, следует обсудить целесообразность прекращения терапии вориконазолом.
Нежелательные явления со стороны органа зрения: В период пострегистрационного наблюдения были зарегистрированы случаи продолжительных нежелательных проявлений со стороны зрения, в том числе случаи ретробульбарного неврита и отека диска зрительного нерва. Эти проявления отмечались в основном у тяжело больных пациентов, у которых имелись основные заболевания и/или прием сопутствующих лекарств, которые могли послужить причиной или способствовать развитию этих проявлений.
Нежелательные явления со стороны почек: У тяжелобольных пациентов, получающих лечение вориконазолом, наблюдалась острая почечная недостаточность. Пациенты, получавшие вориконазол, вероятно, получали сопутствующее лечение нефротоксическими препаратами и имели сопутствующие состояния, которые могут приводить к снижению функции почек.
Контроль функции почек: Пациенты должны тщательно наблюдаться на предмет развития нарушений функции почек. Наблюдение должно включать оценку лабораторных данных, особенно креатинина сыворотки.
Контроль функции поджелудочной железы: У взрослых и детей с факторами риска развития острого панкреатита (например, недавняя химиотерапия, трансплантация гемопоэтических стволовых клеток [ТГСК]) следует следить за развитием панкреатита при лечении вориконазолом.
Дерматологические нежелательные явления: Редко у пациентов в ходе лечения вориконазолом развивались эксфолиативные кожные реакции, такие как синдром Стивенса-Джонсона. В случае развития у пациента эксфолиативных кожных реакций необходимо отменить прием вориконазола.
Кроме того, применение вориконазола ассоциировалось с развитием фототоксичности, включая такие реакции как лентиго, старческий кератоз, псевдопорфирия, появления веснушек. Пациентам рекомендуется избегать интенсивного или продолжительного воздействия прямого солнечного света во время лечения вориконазолом. Были получены сообщения о случаях плоскоклеточного рака кожи и меланомы при продолжительной терапии вориконазолом у пациентов с реакциями фоточувствительности кожи и дополнительными факторами риска. Если у пациента развивается поражение кожи, по типу плоскоклеточного рака кожи или меланомы, то прием вориконазола следует отменить.
Нежелательные явления со стороны опорно-двигательного аппарата: При длительной терапии вориконазолом у пациентов после трансплантации были зарегистрированы случаи периостита и флюороза. При появлении у пациентов боли в костях и рентгенологической картине периостита или флюороза лечение вориконазолом следует прекратить.
Применение у детей: Безопасность и эффективность применения препарата у пациентов в возрасте до 2 лет не установлена. Вориконазол показан детям в возрасте два года и старше. Состояние функции печени следует контролировать как у детей, так и у взрослых. У детей от 2 до 12 лет при синдроме мальабсорбции и очень низкой массе тела для своего возраста пероральная биодоступность может быть ограничена. В этом случае рекомендуется внутривенное введение вориконазола.
Профилактика
В случае проявление нежелательных эффектов, связанных с лечением (гепатотоксичность, тяжелые кожные реакции, включая фотоксичность или плоскоклеточный рак кожи, тяжелые или длительные нарушения зрения, периостит) лечение вориконазолом должно быть прекращено, и должна быть рассмотрена возможность применения альтернативных противогрибковых средств.
Эверолимус (субстрат CYP3A4, субстрат P-gp): Одновременное применение вориконазола и эверолимуса не рекомендуется, поскольку предполагается, что вориконазол значительно увеличивает концентрации эверолимуса. Имеющихся в настоящее время данных для предоставления рекомендаций по дозировке в данной ситуации не достаточно.
Флуконазол (ингибитор CYP2C9, CYP2C19 и CYP3A4): Одновременное пероральное применение вориконазола и флуконазола приводило к значительному повышению Сmах и AUCτ вориконазола у здоровых лиц. Снижение дозы и/или частоты применения вориконазола и флуконазола, которое устраняло бы этот эффект, не было установлено. Рекомендован контроль нежелательных явлений, связанных с применением вориконазола, если вориконазол используется после флуконазола.
Эфавиренц (индуктор CYP450; ингибитор и субстрат CYP3A4): При одновременном назначении вориконазола и эфавиренца дозу вориконазола следует увеличить до 400 мг каждые 12 часов, а дозу эфавиренца следует снизить до 300 мг каждые 24 часа.
Рифабутин: Совместного приема вориконазола с рифабутином, по возможности, следует избегать. Тем не менее, если комбинация необходима, поддерживающая доза вориконазола может быть увеличена от 200 мг до 350 мг внутрь каждые 12 часов (со 100 мг до 200 мг внутрь каждые 12 часов у пациентов с массой тела менее 40 кг).
Фенитоин (субстрат CYP2C9 и мощный индуктор CYP450): При совместном приеме фенитоина с вориконазолом рекомендуется тщательный мониторинг уровня фенитоина. Совместного применения фенитоина и вориконазола следует избегать, если только терапевтическая польза не перевешивает риск.
Ритонавир (мощный индуктор CYP450, ингибитор и субстрат CYP3A4): Одновременного применения вориконазола и низких доз ритонавира (100 мг два раза в сутки) следует избегать, за исключением случаев, когда соотношение польза/риск оправдывает использование вориконазола.
Метадон (субстрат CYP3A4): Повышенные концентрации в плазме метадона ассоциировались с токсичностью, включая удлинение интервала QT. При одновременном применении рекомендуется частый мониторинг нежелательных явлений и токсичности, связанной с метадоном. Может потребоваться снижение дозы метадона.
Опиаты короткого действия (субстрат CYP3A4): При одновременном назначении вориконазолом может потребоваться снижение дозы алфентанила, фентанила и других опиатов короткого действия, подобных по структуре алфентанилу, и подвергающихся метаболизму с помощью CYP3A4 (например, суфентанил). Поскольку период полувыведения алфентанила при одновременном применении алфентанила с вориконазолом удлиняется в 4 раза и в независимом опубликованном исследовании при одновременном приеме вориконазола и фентанила средняя AUC0-∞ фентанила повышалась в 1,4 раза, может потребоваться частый контроль нежелательных явлений, ассоциированных с приемом опиатов (включая более длительный период контроля дыхания).
Опиаты длительного действия (субстрат CYP3A4): При одновременном применении с вориконазолом следует рассмотреть необходимость снижения дозы оксикодона и других опиатов длительного действия, метаболизирующихся с помощью CYP3A4 (например, гидрокодона). Может потребоваться частый контроль нежелательных явлений, ассоциированных с применением опиатов.
Пациентам с редкими наследственными формами непереносимости галактозы или дефицитом лактазы или мальабсорбции глюкозы-галактозы не рекомендуется принимать препарат.
Беременность
Адекватная информация по применению вориконазола у беременных женщин отсутствует. Исследования на животных выявили репродуктивную токсичность высоких доз препарата. Потенциальный риск для людей неизвестен.
Вориконазол не следует назначать беременным женщинам, если польза для матери явно не превосходит потенциальный риск для плода.
Женщины репродуктивного возраста
Во время терапии препаратом женщины репродуктивного возраста должны использовать эффективные методы контрацепции.
Грудное вскармливание
Исследования на предмет того, проникает ли вориконазол в грудное молоко, не проводились. Вориконазол не следует использовать у кормящих матерей, за исключением случаев, когда польза явно превосходит риск.
Вориконазол может вызвать временные и преходящие нарушения зрения, включая затуманивание, изменение/усиление визуального восприятия и/или светобоязнь. Пациенты должны избегать потенциально опасных видов деятельности, таких как вождение автомобиля или управление механизмами на время, пока у них имеются эти симптомы. Во время приема вориконазола пациентам не следует водить автомобиль в ночное время.
Вориконазол метаболизируется изоферментами цитохрома Р450, CYP2C19, CYP2C9 и CYP3A4 и ингибирует их активность. Ингибиторы или индукторы данных изоферментов могут соответственно повысить или понизить концентрацию вориконазола в плазме крови, и вориконазол может увеличивать концентрацию в плазме веществ, метаболизирующихся данными изоферментами CYP450.
Если не было указано иное, то исследования лекарственного взаимодействия проводились на здоровых мужчинах путем неоднократного применения вориконазола внутрь по 200 мг дважды в сутки (BID) до достижения стационарного состояния. Полученные результаты являются релевантными и для других популяций и способов применения.
Вориконазол следует с осторожностью назначать пациентам, одновременно получающим препараты, о которых известно, что они удлиняют интервал QT. В случаях, когда вориконазол может увеличить концентрацию в плазме веществ, метаболизирующихся изоферментами CYP3A4 (некоторые антигистаминные препараты, хинидин, цизаприд, пимозид), их одновременное применение противопоказано.
Таблица взаимодействия
Взаимодействия между вориконазолом и другими лекарственными средствами приведены ниже в таблице. Направление стрелок для каждого фармакокинетического параметра основано на 90% доверительном интервале отношения средних геометрических: в пределах (↔), ниже (↓) или выше (↑) диапазона 80-125%. Звездочка (*) указывает на двустороннее взаимодействие. AUCτ, AUCt, и AUC0-∞ представляют собой значения площади под кривой в период применения препарата, от нуля до момента определения и от нуля до бесконечности, соответственно. «НО» – не определено.
Взаимодействия в таблице представлены в следующем порядке: противопоказания, взаимодействия, требующие коррекции дозы и тщательного клинического и/или биологического мониторинга, и, наконец, не обладающие существенным фармакокинетическим взаимодействием, но которые могут представлять клинический интерес в данной терапевтической области.
| Лекарственное средство (механизм взаимодействия) | Взаимодействие Изменения средних геометрических (%) |
Рекомендации в отношении совместного применения |
| Астемизол, цизаприд, пимозид, квинидин и терфенадин [субстраты CYP3A4] |
Несмотря на то, что данные исследования не проводились, повышение концентрации данных лекарственных препаратов в плазме крови может привести к удлинению интервала QTc и, в редких случаях, к развитию torsades de pointes (пируэтная желудочковая тахикардия). | Противопоказано. |
| Карбамазепин и длительно действующие барбитураты (например, фенобарбитал, мефобарбитал) [сильные индукторы CYP450] |
Несмотря на то, что данные исследования не проводились, карбамазепин и длительно действующие барбитураты, по всей видимости, значительно снижают концентрацию вориконазола в плазме крови. | Противопоказано. |
| Эфавиренц (ненуклеозидный ингибитор обратной транскриптазы) [индуктор CYP450; ингибитор и субстрат CYP3A4] Высокая доза(400 мг 1 раз/сутки)* |
Эфавиренц Cmax ↑ 38% Эфавиренц AUCτ ↑ 44% Вориконазол Cmax ↓ 61% Вориконазол AUCτ ↓ 77% |
Стандартные дозы вориконазола и стандартные дозы эфавиренца (400 мг или более 1 раз/сутки противопоказано назначать одновременно. |
| Низкая доза (300 мг 1 раз/сутки, одновременно с вориконазолом в дозе 400 мг ВГО)* | По сравнению с эфавиренцем 600 мг 1 раз/сутки, Эфавиренц Сmax ↔ Эфавиренц AUCτ ↑ 17% По сравнению с вориконазолом в дозе 200 мг 2 раза/сутки, Вориконазол Cmax ↑ 23% Вориконазол AUCτ ↓ 7% |
Вориконазол может одновременно назначаться с эфавиренцем, при этом поддерживающая доза вориконазола должна быть увеличена до 400 мг 2 раза/сутки, а доза эфавиренца должна быть снижена до 300 мг 1 раз/сутки. После прекращения лечения вориконазолом следует вернуться к исходной дозе эфавиренца. |
| Алкалоиды спорыньи (например, эрготамин и дигидроэрготамин) [субстраты CYP3A4] |
Несмотря на то, что данные исследования не проводились, вориконазол может повышать уровень алкалоидов спорыньи в плазме крови и привести к развитию эрготизма. | Противопоказано. |
| Рифабутин [мощный индуктор CYP450] 300 мг 1 раз/сутки 300 мг 1 раз/сутки (одновременно с вориконазолом в дозе400 мг 2 раза/сутки)* |
Вориконазол Cmax ↓ 69% Вориконазол AUCτ ↓ 78% Рифабутин Cmax ↑ 195% Рифабутин AUCτ ↑ 331% По сравнению с вориконазолом в дозе 200 мг 2 раза/сутки, Вориконазол Cmax ↑ 104% Вориконазол AUCτ ↓ 87% |
Противопоказано. |
| Рифампицин (600 мг 1 раз/сут) [мощный индуктор CYP450] |
Вориконазол Cmax ↓ 93% Вориконазол AUCτ ↓ 96% |
Противопоказано. |
| Ритонавир (ингибитор протеазы) [мощный индуктор CYP450; ингибитор и субстрат CYP3A4] Высокая доза (400 мг 2 раза/сути) Низкая доза (100 мг 2 раза/сутки)* |
Ритонавир Cmax и AUCτ ↔ Вориконазол Cmax ↓ 66% Вориконазол AUCτ ↓ 82% Ритонавир Cmax ↓ 25% Ритонавир AUCτ ↓ 13% Вориконазол Cmax ↓ 24% Вориконазол AUCτ ↓ 39% |
Одновременное применение вориконазола и высоких доз ритонавира (400 мг и более 2 раза/сутки) противопоказано. Одновременное применение вориконазола и низких доз ритонавира (100 мг 2 раза/сутки) следует избегать, если оценка соотношения польза/риск для пациента не обосновывает использование вориконазола. |
| St John’s Wort – препарат на основе зверобоя [индуктор CYP450; индуктор P-gPl] 300 мг 3 раза/сутки (одновременное с вориконазолом в дозе 400 мг однократно) |
В независимом опубликованном исследовании Вориконазол AUC0-∞ ↓59% | Противопоказано. |
| Эверолимус [субстрат CYP3A4, субстрат P-gp] |
Несмотря на то, что данные исследования не проводились, вориконазол может значительно повышать концентрацию эверолимуса в плазме крови. | Одновременное применение вориконазола и эверолимуса не рекомендуется, поскольку предполагается, что вориконазол значительно повышает концентрацию эверолимуса. |
| Флуконазол (200 мг 1 раз/сутки) [ингибитор CYP2C9, CYP2C19 и CYP3A4J] |
Вориконазол Cmax ↑ 57% Вориконазол AUCτ ↑79% Флуконазол Cmax НО Флуконазол AUCτ НО |
Снижение дозы и/или частоты применения вориконазола и флуконазола, которое устраняло бы эффект, не было установлено. Рекомендован контроль нежелательных явлений, связанных с применением вориконазола, если вориконазол используется после флуконазола. |
| Фенитоин [субстрат CYP2C9 и мощный индуктор CYP450] 300 мг 1 раз/сутки300 мг 1 раз/сутки (одновременно с вориконазолом в дозе 400 мг 2 раза/сутки)* |
Вориконазол Cmax ↓ 49% Вориконазол AUCτ ↓ 69% Фенитоин Cmax ↑ 67% Фенитоин AUCτ ↑ 81% По сравнению с вориконазолом в 200 мг 2 раза/сут, Вориконазол Cmax ↑ 34% Вориконазол AUCτ ↑ 39% |
Следует избегать совместного применения фенитоина и вориконазола, если только терапевтическая польза не превышает риск. Рекомендуется тщательный мониторинг концентраций фенитоина в плазме крови. Фенитоин может одновременно назначаться с вориконазолом, при этом поддерживающая доза вориконазола должна быть увеличена до 5 мг/кг в/в 2 раза/сут, (с 100 мг до 200 мг перорально 2 раза/сут у пациентов с массой тела менее 40 кг). |
| Антикоагулянты Варфарин (30 мг однократно, одновременно с вориконазолом в дозе 300 мг 2 раза/сутки) [субстрат CYP2C9] Другие пероральные антикоагулянты кумаринового ряда (например, фенпрокумон, аценокумарол) [субстратыCYP2C9 и CYP3A4] |
Максимальное увеличение протромбинового времени – приблизительно в 2 раза Несмотря на то, что подобные исследования не проводились, вориконазол может повышать концентрацию антикоагулянтов кумаринового ряда в плазме крови, что может привести к увеличению протромбинового времени. |
Рекомендован тщательный мониторинг протромбинового времени или другие соответствующие исследования гемостаза. Следует провести соответствующую коррекцию дозы антикоагулянтов. |
| Бензодиазепины (например, мидазолам, триазолам, алпразолам) [субстраты CYP3A4] |
Несмотря на то, что подобные клинические исследования не проводились, вориконазол может повышать уровень в плазме крови тех бензодиазепинов, которые метаболизируются с помощью CYP3A4, и приводить к пролонгированию седативного эффекта. | Следует рассмотреть вопрос снижения дозы бензодиазепанов. |
| Иммунодепрессанты [субстраты CYP3A4] Сиролимус (2 мг однократно) Циклоспорин (У стабильных пациентов, перенесших пересадку почки, получающих длительное лечение циклоспорином) Такролимус (0,1 мг/кг однократно) |
В независимом опубликованном исследовании. Сиролимус Cmax ↑ в 6,6 раза Сиролимус AUC0-∞ ↑ в 11 раз Циклоспорин Cmax ↑ 13% Циклоспорин AUCτ ↑ 70% Такролимус Cmax ↑ 117% Такролимус AUCτ ↑ 221% |
Совместное применение вориконазола и сиролимуса противопоказано. При назначении вориконазола пациентам, уже получающим циклоспорин рекомендуется наполовину сократить дозу циклоспорина и проводить тщательный мониторинг уровня циклоспорина. Повышение уровня циклоспорина ассоциировалось с нефротоксичностью. После прекращения приема вориконазола нужно тщательно контролировать уровень циклоспорина и при необходимости увеличить дозу циклоспорина. При назначении вориконазола пациентам, уже получающим такролимус, рекомендуется сократить дозу такролимуса до одной трети рекомендуемой дозы и проводить тщательный мониторинг уровня такролимуса. Повышение уровня такролимуса связано с нефротоксичностью. После прекращения приема вориконазола следует тщательно контролировать уровень такролимуса и при необходимости увеличить дозу такролимуса. |
| Опиаты длительного действия [субстраты CYP3A4] Оксикодон (10 мг однократно) |
В независимом опубликованном исследовании, Оксикодон Cmax ↑ в 1,7раза Оксикодон AUC0-∞ ↑ в 3,6 раза |
Следует рассмотреть необходимость снижения дозы оксикодона и других опиатов длительного действия, метализирующихся с помощью CYP3A4 (например, гидрокодона). Может потребоваться частный контроль нежелательных явлений, ассоциированных с применением опиатов. |
| Метадон (32-100 мг 1 раз/сутки) [субстрат CYP3A4] |
R-метадон (активный) Cmax ↑ 31% R-метадон (активный ) AUCτ ↑ 47% S-метадон Cmax ↑ 65% S-метадон AUCτ ↑ 103% |
Рекомендован частный контроль нежелательных явлений и токсичности, связанной с метадоном, включая удлинение интервала QT. Может потребоваться снижение дозы метадона. |
| Нестероидные противовоспалительные средства (НПВС) [субстраты CYP2C9] Ибупрофен (400 мг однократно) Диклофенак (50 мг однократно) |
S-ибупрофен Cmax ↑ 20% S-ибупрофен AUC0-∞ ↑ 100% Диклофенак Cmax ↑ 14% Диклофенак AUC0-∞ ↑ 78% |
Рекомендован частный контроль нежелательных явлений и токсичности, связанной с НПВС. Может потребоваться снижение дозы НПВС. |
| Омепразол (40 мг 1 раз/сутки)* [ингибитор CYP2C19; субстрат CYP2C19 и CYP3A4] |
Омепразол Cmax ↑ 16% Омепразол AUCτ ↑ 280% Вориконазол Cmax ↑ 15% Вориконазол AUCτ ↑ 41% Вориконазол может ингибировать также метаболизм других ингибиторов протонной помпы, являющихся субстратами CYP2C19, и приводить к повышению концентраций данных лекарственных препаратов в плазме крови. |
Коррекция дозы вориконазола не рекомендуется. При назначении вориконазола пациентам, получающим омепразол, дозу омепразола рекомендуется уменьшить вполовину. |
| Пероральные контрацептивы* [субстрат CYP3A4; ингибитор CYP2C19] Норэтистерон/этинилэстрадио л (1 мг/0,035 мг 1 раз/сутки) |
Этинилэстрадиол Cmax ↑ 36% Этинилэстрадиол AUCτ ↑ 61% Норэтистерон Cmax ↑ 15% Норэтистерон AUCτ ↑ 53% Вориконазол Cmax ↑ 14% Вориконазол AUCτ ↑ 46% |
Рекомендуется контролировать развитие нежелательных явлений, связанных с использованием пероральных контрацептивов и вориконазола. |
| Опиаты короткого действия [субстраты CYP3A4] Алфентанил (20 мкг/кг однократно, с одновременным приемом налоксона) Фентанил (5 мкг/кг однократно) |
В независимом опубликованном исследовании, Алфентанил AUC0-∞ ↑ в 6 раз В независимом опубликован ном исследовании, Фентанил AUC0-∞ ↑ в 1,54 раза |
Следует рассмотреть вопрос о снижении дозы алфентанила, фентанила и других опиатов короткого действия, подобных по структуре алфентанилу и подвергающихся метаболизму с помощью CYP3A4 (например, суфентанил). Рекомендован длительный и частый контроль на предмет угнетения дыхания и других нежелательных явлений, связанных с применением опиатов. |
| Статины (например, ловастатин) [субстраты CYP3A4] |
Несмотря на то, что подобные клинические исследования не проводились, вориконазол может повышать уровень в плазме крови тех статинов, которые метаболизируются с помощью CYP3A4, и приводить к развитию рабдомиолиза. | Следует рассмотреть вопрос о снижении дозы статинов. |
| Препараты сульфонилмочевины (например, толбутамид, глипизид, глибурид) [субстраты CYP2C9] |
Несмотря на то, что данные исследования не проводились, вориконазол может повышать концентрациюпрепаратовсульфонилмочевины в плазме крови и вызывать гипогликемию. | Рекомендован тщательный контроль уровня глюкозы крови. Следует рассмотреть вопрос о снижении препаратов сульфонилмочевины. |
| Алкалоиды барвинка (например, винкристин и винбластин) [субстраты CYP3A4] |
Несмотря на то, что данные исследования не проводились, вориконазол может повышать уровень алкалоидов барвинка в плазме крови и приводить к развитию нейротоксичности. | Следует рассмотреть вопрос о снижении дозы алкалоидов барвинка. |
| Другие ингибиторы протеазы ВИЧ (например, саквинавир)* [субстраты и ингибиторы CYP3A4] |
Подобные клинические исследования не проводились. Исследования in vitro демонстрируют, что вориконазол может ингибировать метаболизм ингибиторов ВИЧ-протеазы и ингибиторы ВИЧ-протеазы могут ингибировать метаболизм вориконазола. |
Может понадобиться тщательный контроль любых проявлений лекарственной токсичности и/или отсутствия эффекта и коррекции дозы. |
| Другие ненуклеозидные ингибиторы обратной транскриптазы (NNRTI) (например, делавирдин,невирапин)* [субстраты CYP3A4, ингибиторы или индукторы CYP450] |
Подобные клинические исследования не проводились. Исследования in vitro демонстрируют, что NNRTI могут ингибировать метаболизм вориконазола и вориконазол может ингибировать метаболизм NNRTI. Данные о влиянии эфавиренца на вориконазол позволяют предположить, что NNRTI могут индуцировать метаболизм вориконазола. |
Может понадобиться тщательный контроль любых проявлений лекарственной токсичности и/или отсутствия эффекта и коррекции дозы. |
| Циметидин (400 мг 2 раза/сутки) [неспеспецифический ингибитор CYP450 и повышает уровень pH в желудке] |
Вориконазол Cmax ↑ 18% Вориконазол AUCτ ↑ 23% |
Коррекция дозы не требуется |
| Дигоксин (0,25 мг 1 раз/сутки) [субстрат P-gp] |
Дигоксин Cmax ↔ Дигоксин AUCτ ↔ |
Коррекция дозы не требуется. |
| Индинавир (800 мг 3 раза/сутки) [субстрат и ингибитор CYP3A4] |
Индинавир Cmax ↔ Индинавир AUCτ ↔ Вориконазол Cmax ↔ Вориконазол AUCτ ↔ |
Коррекция дозы не требуется. |
| Макролидные антибиотики Эритромицин (1 г 2 раза/сутки) [ингибитор CYP3A4] Азитромицин (500 мг 1 раз/сутки) |
Вориконазол Cmax и AUCτ ↔ Вориконазол Cmax и AUCτ ↔ Влияние вориконазола на эритромицин или азитромицин неизвестно. |
Коррекция дозы не требуется. |
| Микофенолиевая кислота (1 г однократно) [субстрат УДФ-глюкуронилтрансферазы] |
Микофенолиевая кислота Cmax ↔ Микофенолиевая кислота AUCτ ↔ |
Коррекция дозы не требуется. |
| Преднизолон (60 мг однократно) [ингибитор CYP3A4] |
Преднизолон Cmax ↑ 11% Преднизолон AUC0-∞ ↑ 34% |
Коррекция дозы не требуется. |
| Ранитидин(150 мг 2 раза/сутки) [повышает уровень pH в желудке] |
Вориконазол Cmax и AUCτ | Коррекция дозы не требуется. |
В защищенном от влаги и света месте при температуре не выше 25°С.
Хранить в недоступном для детей месте.
2 года.
Не использовать по истечении срока годности, указанного на упаковке.
По 10 таблеток в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой. Одну контурную упаковку вместе с инструкцией по применению помещают в пачку из картона.
По рецепту.
Производитель
РУП «Белмедпрепараты»,
Республика Беларусь, 220007, г. Минск,
ул. Фабрициуса, 30, т./ф.: (+37517) 220 3716,
e-mail: medic@belmedpreparaty.com.
Voriconazole
Регистрационный номер
Торговое наименование
Вориконазол
Международное непатентованное наименование
Лекарственная форма
таблетки, покрытые плёночной оболочкой
Состав
Состав на 1 таблетку 50 мг:
Действующее вещество: вориконазол — 50,000 мг.
Вспомогательные вещества: лактозы моногидрат (сахар молочный) — 74,200 мг; целлюлоза микрокристаллическая — 36,000 мг; повидон-К25 — 9,000 мг; кроскармеллоза натрия — 9,000 мг; магния стеарат — 1,800 мг.
Состав оболочки: опадрай II 85F48105 Белый — 5,000 мг; поливиниловый спирт — 2,345 мг; макрогол-3350 — 1,180 мг; тальк — 0,870 мг; титана диоксид — 0,605 мг.
Состав на 1 таблетку 200 мг:
Действующее вещество: вориконазол — 200,000 мг.
Вспомогательные вещества: лактозы моногидрат (сахар молочный) — 296,800 мг; целлюлоза микрокристаллическая — 144,000 мг; повидон-К25 — 36,000 мг; кроскармеллоза натрия — 36,000 мг; магния стеарат — 7,200 мг.
Состав оболочки: опадрай II 85F48105 Белый — 20,000 мг; поливиниловый спирт — 9,380 мг; макрогол-3350 — 4,720 мг; тальк — 3,480 мг; титана диоксид — 2,420 мг.
Описание
Дозировка 50 мг
Круглые, двояковыпуклые таблетки, покрытые плёночной оболочкой белого или почти белого цвета. На поперечном разрезе ядро почти белого цвета.
Дозировка 200 мг
Капсулообразные двояковыпуклые таблетки с риской с одной стороны, покрытые плёночной оболочкой белого или почти белого цвета. На поперечном разрезе ядро почти белого цвета.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Механизм действия
Вориконазол — противогрибковый препарат широкого спектра действия из группы триазолов. Механизм действия вориконазола связан с ингибированием деметилирования 14α-стерола, опосредованного через грибковый цитохром Р450, который является ключевым этапом биосинтеза эргостерола. Накопление 14α-метилстерола коррелирует с последующей потерей эргостерола в грибковых клеточных мембранах, что обусловливает противогрибковую активность вориконазола. Было установлено, что вориконазол более активен в отношении изоферментов цитохрома Р450 грибков, чем в отношении различных ферментных систем цитохрома Р450 млекопитающих.
In vitro вориконазол обладает широким спектром противогрибкового действия: активен в отношении Candida spp. (включая штаммы С. krusei, устойчивые к флуконазолу и резистентные штаммы С. glabrata и С. albicans), а также проявляет фунгицидный эффект в отношении всех изученных штаммов Aspergillus spp. и патогенных грибов, ставших актуальными в последнее время, включая Scedosporium spp. или Fusarium spp., которые ограниченно чувствительны к существующим противогрибковым средствам.
Клиническая эффективность (с частичным или полным ответом) вориконазола была продемонстрирована при инфекциях, вызванных Aspergillus spp., включая A. flavus, А. fumigatus, A. terreus, A. niger, A. nidulans, Candida spp., включая С. albicans, С. glabrata, С. krusei, С. parapsilosis и С. tropicalis, а также в отношении ограниченного числа штаммов С. dubliniensis, С. inconspicua, и С. guilliermondii, Scedosporium spp., включая S. apiospermum, S. prolificans и Fusarium spp.
Другие грибковые инфекции, при которых применялся вориконазол (с частичным или полным клиническим ответом), включали в себя отдельные случаи инфекций, вызванных Alternaria spp., Blastomyces dermatitidis, Blastoschizomyces capitatus, Cladosporium spp., Coccidioides immitis, Conidiobolus coronatus, Cryptococcus neoformans, Exserohilum rostratum, Exophiala spinifera, Fonsecaea pedrosoi, Madurella mycetomatis, Paecilomyces lilacinus, Penicillium spp., включая P. marneffei, Phialophora richardsiae, Scopulariopsis brevicaulis и Trichosporon spp., включая T. beigelii.
Продемонстрирована активность вориконазола in vitro в отношении клинических штаммов Acremonium spp., Alternaria spp., Bipolaris spp., Cladophialophora spp., Histoplasma capsulation.
Рост большинства штаммов подавлялся при концентрациях вориконазола от 0,05 мкг/мл до 2 мкг/мл.
Выявлена также активность вориконазола in vitro в отношении Curvularia spp. и Sporothrix spp., однако клиническое значение данного эффекта неизвестно.
Фармакокинетика
Общая характеристика
Фармакокинетические параметры вориконазола характеризуются значительной межиндивидуальной вариабельностью.
Фармакокинетика вориконазола является нелинейной за счёт насыщения его метаболизма. При повышении дозы наблюдается непропорциональное (более выраженное) увеличение площади под кривой «концентрация–время» (AUСτ). Увеличение пероральной дозы с 200 мг 2 раза в сутки до 300 мг 2 раза в сутки приводит к увеличению AUCτ в среднем в 2,5 раза.
Воздействие вориконазола при приёме внутрь поддерживающей дозы 200 мг (или 100 мг для пациентов с массой тела менее 40 кг) соответствует воздействию вориконазола при применении внутривенно в дозе 3 мг/кг.
При приёме внутрь поддерживающей дозы 300 мг (или 150 мг для пациентов с массой тела менее 40 кг) воздействие соответствует воздействию вориконазола при внутривенном применении в дозе 4 мг/кг.
При приёме насыщающих доз вориконазола равновесная концентрация достигается в течение первых 24 ч.
Если препарат назначают 2 раза в сутки в средних терапевтических (но не в насыщающих) дозах, то происходит кумуляция вориконазола, а равновесные концентрации достигаются к 6-му дню у большинства пациентов.
Всасывание и распределение
Вориконазол быстро и практически полностью всасывается после приёма внутрь: максимальная концентрация в плазме крови (Сmax) достигается через 1–2 ч после приёма. Биодоступность вориконазола при приёме внутрь составляет 96 %. При многократном приёме вориконазола с пищей с большим содержанием жиров Сmax и AUCτ снижаются на 34 % и 24%, соответственно. Всасывание вориконазола не зависит от pH желудочного сока.
Средний объём распределения вориконазола в равновесном состоянии составляет около 4,6 л/кг, что указывает на активное распределение вориконазола в ткани. Связывание с белками плазмы крови составляет 58 %.
Вориконазол проникает через гематоэнцефалический барьер (ГЭБ) и определяется в спинномозговой жидкости.
Метаболизм
Согласно данным исследований in vitro вориконазол метаболизируется под действием изоферментов CYP2C19, CYP2C9, CYP3A4. Важную роль в метаболизме вориконазола играет изофермент CYP2C19, проявляющий выраженный генетический полиморфизм, в связи с чем пониженный метаболизм вориконазола возможен у 15–20 % представителей азиатского происхождения и у 3–5 % представителей европеоидной и негроидной рас.
Основным метаболитом вориконазола является N-оксид, доля которого составляет около 72 % от общего количества циркулирующих в плазме крови метаболитов с радиоактивной меткой. Этот метаболит обладает минимальной противогрибковой активностью и не вносит вклада в клинический эффект вориконазола.
Выведение
Вориконазол выводится в виде метаболитов после биотрансформации в печени; в неизменённом виде почками выводится менее 2 % от введённой дозы препарата.
После многократного приёма вориконазола внутрь или внутривенного введения в моче обнаруживается около 83 % и 80 % дозы препарата, соответственно. Большая часть (>94 %) общей дозы выводится в течение первых 96 ч после приёма внутрь и внутривенного введения.
Период полувыведения (T½) вориконазола зависит от дозы и составляет примерно 6 ч при приёме препарата внутрь в дозе 200 мг. В связи с нелинейностью фармакокинетики величина T½ не позволяет предположить наличие или отсутствие кумуляции, а также судить о параметрах выведения вориконазола.
Фармакокинетика в особых клинических случаях
Пол
При многократном приёме вориконазола внутрь Сmax и AUCτ у здоровых молодых женщин были на 83 % и 113 % соответственно выше, чем у здоровых молодых мужчин (18–45 лет).
Значимых различий Сmax и AUCτ у здоровых пожилых мужчин и здоровых пожилых женщин (≥65 лет) нет. Равновесная концентрация вориконазола в плазме крови у женщин была на 100 % выше, чем у мужчин. Необходимости коррекции дозы вориконазола в зависимости от пола нет. Концентрации в плазме крови у мужчин и женщин сходны.
Возраст
При многократном приёме вориконазола в виде таблеток внутрь Сmax и AUCT у здоровых пожилых мужчин (≥65 лет) на 61 % и 86 % соответственно выше, чем у здоровых молодых мужчин (18–45 лет). Значимых различий Сmax и AUCT у здоровых пожилых женщин (≥65 лет) и здоровых молодых женщин (18–45 лет) нет.
Профиль безопасности вориконазола у молодых и пожилых пациентов не отличается. Необходимости коррекции дозы вориконазола в зависимости от возраста нет.
Дети
Предполагаемая общая концентрация вориконазола у детей при приёме внутрь поддерживающей дозы 9 мг/кг (максимально 350 мг) два раза в сутки сопоставима с таковой у взрослых при приёме вориконазола внутрь в дозе 200 мг два раза в сутки.
Концентрация вориконазола при внутривенном введении в дозе 8 мг/кг в два раза выше, чем при приёме внутрь в дозе 9 мг/кг. Биодоступность вориконазола при приёме внутрь у детей может ограничиваться нарушением всасывания и достаточно низкой массой тела в этом возрасте; в этом случае может быть показано внутривенное введение.
У большинства подростков концентрация вориконазола в плазме крови соответствует этому показателю у взрослых пациентов. Тем не менее отмечались меньшие значения концентрации вориконазола в плазме крови у некоторых подростков с низкой массой тела по сравнению со взрослыми и были ближе к значениям того же показателя у детей.
Основываясь на популяционном фармакокинетическом анализе, подростки в возрасте от 12 до 14 лет с массой тела менее 50 кг должны получать дозу вориконазола, рекомендованную для детей.
Нарушение функции почек
При однократном приёме вориконазола внутрь в дозе 200 мг пациентами с нормальной функцией почек и пациентами с нарушением функции почек от лёгкой (клиренс креатинина (КК) — 41–60 мл/мин) до тяжёлой (КК <20 мл/мин) степени фармакокинетика вориконазола существенно не зависит от степени нарушения функции почек. Связывание вориконазола с белками плазмы крови примерно одинаково у пациентов с различной степенью почечной недостаточности.
Нарушение функции печени
После однократного приёма внутрь вориконазола в дозе 200 мг AUCτ у пациентов с лёгкой или средней степенью тяжести цирроза печени (классы A и B по шкале Чайлд-Пью) была на 223 % выше, чем у пациентов с нормальной функцией печени. Нарушение функции печени не влияет на связывание вориконазола с белками плазмы крови.
При многократном приёме препарата внутрь AUCτ вориконазола сопоставима у пациентов с циррозом печени средней степени тяжести (класс B по шкале Чайлд-Пью), получавших препарат в поддерживающей дозе 100 мг 2 раза в сутки, и у пациентов с нормальной функцией печени, получающих вориконазол в дозе 200 мг 2 раза в сутки.
Сведений о фармакокинетике вориконазола у пациентов с тяжёлым циррозом печени (класс C по шкале Чайлд-Пью) нет. Рекомендации по дозированию препарата см. в разделе «Способ применения и дозы».
Показания
- Инвазивный аспергиллез.
- Кандидемия у пациентов без нейтропении.
- Тяжёлые инвазивные кандидозные инфекции (включая С. krusei).
- Кандидоз пищевода.
- Тяжёлые грибковые инфекции, вызванные Scedosporium spp. и Fusarium spp.
- Другие тяжёлые инвазивные грибковые инфекции при непереносимости или рефрактерности к другим лекарственным средствам.
- Профилактика «прорывных» грибковых инфекций у пациентов со сниженной функцией иммунной системы, лихорадкой и нейтропенией, из групп высокого риска (реципиенты трансплантации гемопоэтических стволовых клеток, пациенты с рецидивом лейкоза).
- Профилактика инвазивных грибковых инфекций у пациентов (взрослых и детей старше 12 лет) группы высокого риска, таких как реципиенты трансплантации гемопоэтических стволовых клеток.
Противопоказания
- Гиперчувствительность к вориконазолу или любому другому компоненту препарата;
- одновременное применение со следующими препаратами: субстраты изофермента CYP3A4 — терфенадин, астемизол, цизаприд, пимозид или хинидин; сиролимус; рифампицин, карбамазепин и длительно действующие барбитураты (фенобарбитал); рифабутин; эфавиренз в дозах 400 мг и выше один раз в сутки; ритонавир в высоких дозах (400 мг и выше два раза в сутки); алкалоиды спорыньи (эрготамин, дигидроэрготамин), являющиеся субстратами изофермента CYP3A4; зверобой продырявленный (индуктор цитохрома Р450 и Р-гликопротеина);
- дефицит лактазы, непереносимость лактозы, глюкозо-галактозная мальабсорбция;
- детский возраст младше 3 лет (для данной лекарственной формы).
С осторожностью
Повышенная чувствительность к другим препаратам — производным азолов.
Тяжёлая степень недостаточности функции печени, тяжёлая степень недостаточности функции почек.
У пациентов с проаритмическими состояниями: врождённое или приобретенное увеличение интервала QT, кардиомиопатия, в особенности с сердечной недостаточностью, синусовая брадикардия, наличие симптоматической аритмии, одновременный приём препаратов, вызывающих удлинение интервала QT.
У пациентов с нарушениями электролитного баланса, такими как: гипокалиемия, гипомагниемия и гипокальциемия.
Применение при беременности и в период грудного вскармливания
Достаточной информации о применении вориконазола у беременных женщин нет.
В исследованиях на животных установлено, что препарат оказывает токсическое действие на репродуктивную функцию. Возможный риск для человека неизвестен.
Вориконазол не следует применять у беременных женщин за исключением тех случаев, когда ожидаемая польза для матери явно превышает возможный риск для плода.
Выведение вориконазола с грудным молоком не изучалось. На время применения препарата грудное вскармливание следует прекратить.
Женщины репродуктивного возраста при применении препарата Вориконазол должны использовать надёжные методы контрацепции.
Способ применения и дозы
Внутрь за 1 час до или через 1 ч после приёма пищи.
Перед началом терапии необходимо откорректировать такие электролитные нарушения, как гипокалиемия, гипомагниемия и гипокальциемия.
Взрослые пациенты
Применение вориконазола следует начинать с внутривенного введения в рекомендуемой насыщающей дозе, чтобы уже в первый день добиться адекватной концентрации в плазме крови. Внутривенное введение следует продолжать как минимум 7 дней, после чего возможен переход на пероральный приём препарата при условии, что пациент способен принимать лекарственные средства для приёма внутрь.
Учитывая высокую биодоступность препарата при пероральном приёме, достигающую 96 % (см. раздел «Фармакокинетика»), при наличии клинических показаний можно переходить с внутривенного на пероральное применение вориконазола без коррекции дозы.
В таблице приведена подробная информация по дозированию препарата Вориконазол
|
Внутривенные инфузии |
Внутрь |
||
|
Пациенты с массой тела 40 кг и более |
Пациенты с массой тела менее 40 кг |
||
|
Насыщающая доза — все показания (первые 24 ч) |
6 мг/кг каждые 12 ч |
не рекомендуется |
не рекомендуется |
|
Поддерживающая доза (после первых 24 ч) |
|||
|
Профилактика инвазивных грибковых инфекций у пациентов (взрослых и детей старше 12 лет) группы высокого риска, таких как реципиенты трансплантации гемопоэтических стволовых клеток/профилактика «прорывных» грибковых инфекций у лихорадящих пациентов |
3-4 мг/кг каждые 12 ч |
200 мг каждые 12 ч |
100 мг каждые 12 ч |
|
Инвазивный аспергиллез/инфекции, вызванные Scedosporium spp. и Fusarium spp./другие тяжёлые инвазивные грибковые инфекции |
4 мг/кг каждые 12 ч |
200 мг каждые 12 ч |
100 мг каждые 12 ч |
|
Кандидемия у пациентов без проявлений нейтропении |
3-4 мг/кг каждые 12 ч |
200 мг каждые 12 ч |
100 мг каждые 12 ч |
|
Кандидоз пищевода |
не установлено |
200 мг каждые 12 ч |
100 мг каждые 12 ч |
Подбор дозы для приёма внутрь
При недостаточной эффективности лечения поддерживающая доза препарата Вориконазол для приёма внутрь может быть увеличена с 200 мг каждые 12 ч до 300 мг каждые 12 ч.
У пациентов с массой тела менее 40 кг доза может быть увеличена со 100 мг до 150 мг каждые 12 ч.
Если пациент не переносит препарат в высокой дозе (то есть 300 мг внутрь каждые 12 ч), то поддерживающую дозу для приёма внутрь постепенно снижают с шагом 50 мг до 200 мг каждые 12 ч (для пациентов с массой тела менее 40 кг — до 100 мг каждые 12 ч).
Длительность лечения зависит от клинического эффекта и результатов лабораторных исследований. Длительность лечения не должна превышать 180 дней.
Профилактика у взрослых и детей
Профилактическое применение препарата следует начинать в день трансплантации и можно продолжать до 100 дней. Продлить профилактику до 180 дней после трансплантации можно только в случае продолжения иммуносупрессивной терапии или развития реакции «трансплантат против хозяина» (ТПХ).
Безопасность и эффективность вориконазола при применении более 180 дней в клинических исследованиях надлежащим образом не изучались.
Режим дозирования с целью профилактики такой же, как и с целью лечения в соответствующих возрастных группах.
Нарушение функции почек
Коррекция дозы вориконазола для приёма внутрь у пациентов с лёгкой или тяжёлой степенью нарушения функции почек не требуется.
Нарушение функции печени
При остром нарушении функции печени, проявляющемся повышением активности «печёночных» трансаминаз: аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (ACT), коррекции дозы не требуется, но рекомендуется продолжать контроль показателей функции печени.
Пациентам с лёгкой или среднетяжёлой степенью нарушения функции печени (классы А и В по шкале Чайлд-Пью) следует назначать стандартную насыщающую дозу вориконазола, а поддерживающую дозу снизить в 2 раза. Пациентам с тяжёлой степенью нарушения функции печени (класс C по шкале Чайлд-Пью) препарат Вориконазол следует назначать только в тех случаях, когда ожидаемая польза превышает возможный риск, и под постоянным контролем с целью выявления признаков токсического действия препарата.
Пожилые пациенты
Коррекции дозы не требуется.
Дети
Препарат в виде таблеток назначают детям в том случае, если ребёнок может глотать таблетки.
Режим дозирования вориконазола у детей (в возрасте от 3 до 12 лет) и подростков в возрасте от 12 до 14 лет и массой тела менее 50 кг:
|
Внутривенные инфузии |
Внутрь |
|
|
Насыщающая доза (первые 24 ч) |
9 мг/кг каждые 12 ч |
не рекомендуется |
|
Поддерживающая доза (после первых 24 ч) |
8 мг/кг 2 раза в сутки |
9 мг/кг два раза в сутки (максимальная доза 350 мг два раза в сутки) |
Терапию рекомендуется начинать с внутривенного введения вориконазола, а возможность перорального приёма препарата Вориконазол следует рассматривать только после клинического улучшения и при наличии возможности у пациента принимать пероральные формы.
Следует принимать во внимание, что эффект вориконазола при внутривенном введении в дозе 8 мг/кг приблизительно в два раза более выражен, чем при применении внутрь в дозе 9 мг/кг.
Фармакокинетика и переносимость более высоких доз вориконазола для приёма внутрь у детей не изучались.
Если ребёнок может глотать таблетки, то дозу препарата округляют до ближайшей дозы в мг/кг, кратной 50 мг, и назначают в виде целых таблеток, то есть таблетки делить нельзя.
Рекомендации по применению вориконазола внутрь у детей даются на основании исследований его применения в форме порошка для приготовления суспензии для приёма внутрь. Биоэквивалентность вориконазола в форме порошка для приготовления суспензии для приёма внутрь и таблеток при применении у детей не изучалась. Учитывая, что у детей замедлено прохождение пищи через желудочно-кишечный тракт, вполне вероятно, что всасывание вориконазола при приёме внутрь в виде таблеток будет иным, чем у взрослых.
Применение вориконазола у детей в возрасте от 2 до 12 лет с нарушениями функции печени или почек не изучалось.
У подростков (в возрасте от 12 до 14 лет с массой тела 50 кг или более; от 15 до 18 лет вне зависимости от массы тела) дозы вориконазола такие же, как для взрослых.
Коррекция дозы
При неадекватном клиническом ответе пациента, доза может быть увеличена с шагом 1 мг/кг (или 50 мг в случае, если изначально применяли максимальную дозу 350 мг).
Если ребёнок не переносит терапию в назначенной дозе, её следует снизить с шагом 1 мг/кг (или 50 мг в случае, если изначально применяли максимальную дозу 350 мг).
Побочное действие
Наиболее распространёнными нежелательными реакциями являются нарушения со стороны органа зрения, отклонение от нормы результатов функциональных проб печени, лихорадка, сыпь, рвота, тошнота, диарея, головная боль, периферические отёки, боль в животе и угнетение дыхания. Нежелательные реакции обычно были легко или умеренно выражены. Клинически значимой зависимости безопасности препарата от возраста, расы или пола не выявлено.
Частота побочных эффектов классифицирована в соответствии с рекомендациями всемирной организации здравоохранения: очень часто — ≥10 %; часто — ≥ 1% и <10%; нечасто — ≥0,1 % и <1%; редко — ≥0,01% и <0,1 %; очень редко — <0,01%; частота неизвестна — невозможно определить частоту на основании имеющихся данных.
Инфекционные и паразитарные заболевания: часто — синусит, гастроэнтерит, гингивит; нечасто — псевдомембранозный колит, лимфангит, перитонит.
Нарушения со стороны крови и лимфатической системы: часто — агранулоцитоз (включая фебрильную нейтропению и нейтропению), панцитопения, тромбоцитопения (включая иммунную тромбоцитопеническую пурпуру), анемия; нечасто — депрессия костного мозга, лейкопения, эозинофилия, синдром диссеминированного внутрисосудистого свёртывания, лимфаденопатия.
Нарушения со стороны иммунной системы: нечасто — аллергические реакции; редко — анафилактоидные реакции.
Нарушения со стороны эндокринной системы: нечасто — недостаточность коры надпочечников, гипотиреоз; редко — гипертиреоз.
Нарушения со стороны обмена веществ и питания: очень часто — периферические отёки; часто — гипокалиемия, гипогликемия, гипонатриемия (выявлено в пострегистрационных исследованиях).
Нарушения психики: часто — депрессия, галлюцинации, тревога, бессонница, ажитация, спутанность сознания.
Нарушения со стороны нервной системы: очень часто — головная боль; часто — синкопе, тремор, парестезия, сонливость, головокружение, судороги, нистагм; нечасто — отёк головного мозга, энцефалопатия, экстрапирамидные расстройства, периферическая нейропатия, атаксия, гипестезия, дисгевзия (нарушение вкусового восприятия); редко — печёночная энцефалопатия, синдром Гийена-Барре.
Нарушения со стороны органа зрения: очень часто — нарушения зрения (в том числе нечёткость зрения, затуманенное зрение, фотофобия, хлоропсия, хроматопсия, светобоязнь, цветовая слепота, цианопсия, наличие в поле зрения радужных кругов вокруг источников света, ночная слепота, осциллопсия, фотопсия, мерцательная скотома, снижения остроты зрения, зрительная яркость, дефект полей зрения, плавающие помутнения стекловидного тела и ксантопсия); часто — кровоизлияние в сетчатую оболочку глаза; нечасто — неврит зрительного нерва, отёк соска зрительного нерва, окулогирный криз, склерит, диплопия, блефарит; редко — атрофия зрительного нерва, помутнение роговицы.
Нарушения со стороны органа слуха и лабиринтные нарушения: нечасто — вертиго, гипоакузия, шум в ушах.
Нарушения со стороны сердца: часто — наджелудочковая аритмия, тахикардия, брадикардия; нечасто — фибрилляция желудочков, желудочковая экстрасистолия, желудочковая тахикардия, наджелудочковая тахикардия; редко — аритмия по типу «пируэт»; полная атриовентрикулярная блокада, блокада ножки пучка Гиса, узловые аритмии.
Нарушения со стороны сосудов: часто — артериальная гипотензия, флебит; нечасто — тромбофлебит.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: очень часто — угнетение дыхания; часто — острый респираторный дистресс-синдром, отёк лёгких.
Нарушения со стороны желудочно-кишечного тракта: очень часто — тошнота, рвота, диарея, боль в животе; часто — хейлит, диспепсия, запор; нечасто — дуоденит, глоссит, панкреатит, отёк языка.
Нарушения со стороны печени и желчевыводящих путей: очень часто — отклонения от нормы результатов функциональных печёночных тестов (повышение активности апартатаминотрансферазы, аланинаминотранферазы, щелочной фосфатазы, гамма-глутамилтрансферазы, лактатдегидрогеназы, гипербилирубинемия); часто — желтуха, холестатическая желтуха, гепатит; нечасто — холецистит, холелитиаз, увеличение печени, печёночная недостаточность.
Нарушения со стороны кожи и подкожных тканей: очень часто — сыпь; часто — эксфолиативный дерматит, алопеция, кожный зуд, макулопапулезная сыпь, эритема; нечасто — синдром Стивенса-Джонсона, фотосенсибилизация, крапивница, экзема, токсический эпидермальный некролиз, ангионевротический отёк, мультиформная эритема, псориаз, аллергический дерматит, пурпура, папулезная сыпь, макулярная сыпь; редко — псевдопорфирия, стойкая лекарственная эритема; частота неизвестна — кожная форма системной красной волчанки.
Нарушения со стороны опорно-двигательного аппарата и соединительной ткани: часто — боль в спине; нечасто — артрит; частота неизвестна — периостит.
Нарушения со стороны почек и мочевыводящих путей: часто — острая почечная недостаточность, гематурия; нечасто — некроз почечныx канальцев, протеинурия, нефрит.
Общие расстройства и нарушения в месте введения: очень часто — лихорадка; часто — озноб, астения, боль в грудной клетке, гриппоподобное заболевание, отёк лица (включая периорбитальный отёк, отёк губ и отёк рта).
Доброкачественные, злокачественные и неуточнённые новообразования (включая кисты и полипы): частота неизвестна — плоскоклеточный рак кожи.
Лабораторные и инструментальные данные: часто — повышение концентрации креатинина в крови; нечасто — удлинение интервала QT на электрокардиограмме, повышение концентрации мочевины в крови, повышение концентрации холестерина в крови.
Побочное действие при применении у детей
Было установлено, что нежелательные эффекты препарата у детей в возрасте от 3 (для данной лекарственной формы) до 12 лет аналогичны таковым у взрослых. У детей наблюдалась более высокая частота повышения активности печёночных ферментов.
В ходе пострегистрационных исследований выявлено развитие панкреатита у детей на фоне терапии вориконазолом, а также более частое возникновение кожных реакций.
Передозировка
Известно о трёх случаях непреднамеренной передозировки. Все упомянутые случаи произошли у детей, которым внутривенно была введена доза вориконазола, в пять раз превышающая рекомендованную. При этом зарегистрирован единственный случай нежелательной реакции в виде фотофобии, продолжительностью 10 минут.
Антидот вориконазола неизвестен. В случае передозировки показана симптоматическая и поддерживающая терапия.
Вориконазол выводится в ходе гемодиализа с клиренсом 121 мл/мин. В случае передозировки гемодиализ может способствовать выведению вориконазола из организма.
Взаимодействие с другими лекарственными средствами
Ингибиторы или индукторы изоферментов цитохрома P450 (CYP2C19, CYP2C9 и CYP3A4) могут вызвать соответственно повышение или снижение концентрации вориконазола в плазме крови.
Вориконазол ингибирует активность изоферментов цитохрома P450 — CYP2C19, CYP2C9 и CYP3A4, и может повышать плазменные концентрации веществ, которые метаболизируются с участием изоферментов цитохрома P450.
Взаимодействие вориконазола с другими лекарственными средствами и рекомендации при одновременном применении представлены в таблице ниже:
|
Лекарственные средства (механизм взаимодействия) |
Взаимодействие: изменение фармакокинетических параметров (%) |
Рекомендации при одновременном применении |
|
Астемизол, терфенадин, цизаприд, пимозид и хинидин (субстраты изофермента CYP3A4) |
Взаимодействие не изучалось, однако существует высокая вероятность, что повышение концентрации в плазме данных лекарственных средств, может привести к удлинению интервала QT и в редких случаях к развитию желудочковой тахикардии по типу «пируэт». |
Противопоказано |
|
Карбамазепин и длительно действующие барбитураты (например, фенобарбитал, мефобарбитал) (мощные индукторы цитохрома P450) |
Взаимодействие не изучалось, однако карбамазепин и длительно действующие барбитураты вероятно могут значительно снижать плазменные концентрации вориконазола. |
Противопоказано. |
|
Эфавиренз (ненуклеозидный ингибитор обратной транскриптазы) (индуктор цитохрома P450; ингибитор и субстрат изофермента CYP3A4) |
||
|
Одновременное применение эфавиренза в дозе 400 мг 1 раз в сутки и вориконазола в дозе 200 мг 2 раза в сутки* |
Сmах эфавиренза ↑38 % AUCТ эфавиренза ↑44 % Cmaxвориконазола ↓61 % AUCТ вориконазола ↓77 % |
Применение стандартных доз вориконазола и эфавиренза в дозе 400 мг 1 раз в сутки противопоказано. |
|
Одновременное применение 300 мг эфавиренза 1 раз в сутки и вориконазола 400 мг 2 раза в сутки |
В сравнении с эфавирензом 600 мг 1 раз в сутки: Cmaxэфавиренза ↔ AUCТ эфавиренза ↑17 %. В сравнении с вориконазолом 200 мг 2 раза в сутки: Cmaxвориконазола ↑23 % AUCТ вориконазола ↓7 %. |
Одновременное применение возможно, если поддерживающая доза вориконазола будет повышена до 400 мг 2раза в сутки, а доза эфавиренза снижена до 300 мг вориконазолом, 1 раз в сутки. При отмене терапии начальная доза эфавиренза должна быть восстановлена. |
|
Алкалоиды спорыньи (например, эрготамин, дигидроэрготамин) (субстраты изофермента CYP3A4) |
Взаимодействие вориконазола с алкалоидами спорыньи (эрготамином и дигидроэрготамином) не изучалось, однако существует высокая вероятность, что вориконазол может вызывать повышение концентрации в плазме данных лекарственных средств и приводить к эрготизму. |
Противопоказано |
|
Рифабутин 300 мг 1 раз в сутки (мощный индуктор цитохрома P450) |
Сmах рифабутина ↑195 % AUCτ рифабутина ↑331 % Сmах вориконазола ↓69 % AUCτ вориконазола ↓78 % |
Противопоказано |
|
300 мг 1 раз в сутки (при одновременном применении с вориконазолом 400 мг 2 раза в сутки)* |
В сравнении с вориконазолом 200 мг 2 раза в сутки: Сmах вориконазола ↑104 % AUCτ вориконазола ↑87 % |
|
|
Рифампицин 600 мг 1 раз в сутки (мощный индуктор цитохрома P450) |
Сmах вориконазола ↓93 % AUCτ вориконазола ↓96 % |
Противопоказано |
|
Ритонавир (ингибитор протеаз) (мощный индуктор цитохрома P450, ингибитор и субстрат изофермента CYP3A4) |
||
|
Высокие дозы (400 мг 2 раза в сутки) |
Сmах и AUCτ ритонавир ↔ Сmах вориконазола ↓66 % AUCτ вориконазола ↓82 % |
Одновременное применение вориконазола и высоких доз ритонавира (400 мг и выше 2 раза в сутки) противопоказано. |
|
Низкие дозы (100 мг 2 раза в сутки)* |
Сmах ритонавира ↓25 % AUCτ ритонавира ↓13 % Сmах вориконазола ↓24 % AUCτ вориконазола ↓39 % |
Одновременное применение вориконазола и ритонавира в низких дозах (100 мг 2 раза сутки) допустимо лишь в том случае, если ожидаемая польза от приёма вориконазола значительно превышает риск от их совместного применения. |
|
Зверобой продырявленный (индуктор цитохрома P450 и Р-гликопротеина) 300 мг 3 раза в сутки с однократной дозой вориконазола 400 мг |
AUC0-∞ вориконазола ↓59 % |
Противопоказано |
|
Эверолимус (субстрат изофермента CYP3A4 и Р-гликопротеина) |
Взаимодействие не изучалось, однако вориконазол, вероятно, может значительно повышать плазменные концентрации эверолимуса. |
Одновременное применение не рекомендуется, так как ожидается, что вориконазол значительно повышает концентрацию эверолимуса в плазме крови. На данный момент не имеется достаточной информации для рекомендации по коррекции режима дозирования. |
|
Флуконазол (ингибитор изоферментов CYP2C9, CYP2C19 и CYP3A4) 200 мг 1 раз в сутки |
Сmах вориконазола ↑57 % AUCτ вориконазола ↑79 % Изменения Сmах и AUCτ флуконазола не установлены |
Подходящий режим коррекции дозы и/или частоты приёма вориконазола и флуконазола не установлен. В том случае, если вориконазол применяется после флуконазола, рекомендуется проводить тщательный контроль нежелательных реакций, связанных с приёмом вориконазола. |
|
Фенитоин (субстрат изофермента CYP2C9 и мощный индуктор системы цитохрома P450) |
||
|
300 мг 1 раз в сутки |
Сmах вориконазола ↓49 % AUCτ вориконазола ↓69 % |
Следует избегать одновременного приёма вориконазола и фенитоина, за исключением случаев, когда польза для пациента превышает риск. Рекомендуется контролировать концентрацию фенитоина в плазме крови. |
|
300 мг 1 раз в сутки (одновременное применение с вориконазолом в дозе 400 мг 2 раза в сутки)* |
Сmах фенитоина ↑67 % AUCτ фенитоина ↑81 % В сравнении с вориконазолом 200 мг 2 раза в сутки: Сmах вориконазола ↑34 % AUCτ вориконазола ↑39 % |
Одновременное применение возможно только в случае, если поддерживающая доза вориконазола будет увеличена до 5 мг/кг внутривенно или с 200 мг до 400 мг внутрь 2 раза в сутки (у пациентов с массой тела менее 40 кг со 100 мг до 200 мг внутрь 2 раза в сутки). |
|
Антикоагулянты Варфарин (30 мгоднократно одновременно с вориконазолом 300 мг 2 раза в сутки) (субстрат изофермента CYP2C9) |
Увеличение максимального протромбинового времени было приблизительно в 2 раза. |
Если пациентам, получающим препараты кумарина, назначают вориконазол, необходимо контролировать протромбиновое время с короткими интервалами и соответствующим образом подбирать дозы антикоагулянтов. |
|
Другие пероральные антикоагулянты, например, фенпрокумон, аценокумарол (субстраты изоферментов CYP2C9, CYP3A4) |
Предполагается, что вориконазол может увеличивать концентрации в плазме крови кумаринов, что может приводить к увеличению протромбинового времени. |
|
|
Бензодиазепины (например, мидазолам, триазолам, алпразолам) (субстраты изофермента CYP3A4) |
In vitro вориконазол может вызывать повышение плазменных концентраций бензодиазепинов, которые метаболизируются под действием изофермента CYP3A4, и вызывать развитие пролонгированного седативного эффекта. |
Рекомендуется оценить целесообразность коррекции дозы бензодиазепинов. |
|
Иммунодепрессанты (субстраты изофермента CYP3A4) Сиролимус (2 мг однократно) |
Сmах сиролимуса ↑в 6,6 раз AUC0-∞ сиролимуса ↑в 11 раз |
Одновременное применение вориконазола и сиролимуса противопоказано. |
|
Циклоспорин (у пациентов, перенёсших трансплантацию почки и находящихся в стабильном состоянии) |
Сmах циклоспорина ↑13 % AUCτ циклоспорина ↑70 % |
При применении вориконазола у пациентов, получающих циклоспорин, рекомендуется уменьшить дозу циклоспорина вдвое и контролировать его концентрацию в плазме крови. Повышение концентрации циклоспорина сопровождается нефротоксичностью. После отмены вориконазола необходимо контролировать концентрацию циклоспорина и при необходимости увеличить его дозу. |
|
Такролимус (0,1 мг/кг однократно) |
Сmах такролимуса ↑117 % AUCτ такролимуса ↑221 % |
При применении вориконазола у пациентов, получающих такролимус, рекомендуется уменьшить дозу последнего до одной трети и контролировать его концентрацию в плазме крови. Повышение концентрации такролимуса сопровождается нефротоксичностью. После отмены вориконазола необходимо контролировать концентрацию такролимуса и при необходимости увеличить его дозу. |
|
Длительно действующие опиаты (субстраты изофермента CYP3A4) |
||
|
Оксикодон (10 мг однократно) |
Сmах оксикодона ↑в 1,7 раз AUC0-∞ оксикодона ↑в 3,6 раз |
Следует оценить возможность снижения дозы оксикодона и других длительно действующих опиатов, метаболизируемых изоферментом CYP3A4 (например, гидрокодона). Может понадобиться контроль состояния пациента с короткими интервалами на предмет развития нежелательных реакций связанных с опиатами. |
|
Метадон (32-100 мг 1 раз в сутки) |
Сmах R-метадона (активного метаболита) ↑31 % AUCτ R-метадона (активного метаболита)↑47 % Сmах S-метадона ↑65 % AUCτ S-метадона ↑103 % |
Повышение концентрации метадона в плазме крови приводит к проявлению токсических эффектов, включая удлинение интервала QT. Рекомендуется частый контроль состояния пациента на предмет развития нежелательных реакций и токсичности (в том числе, удлинение интервала QT), связанных с метадоном. Возможно, понадобится снижение дозы метадона. |
|
Нестероидные противовоспалительные препараты (НПВП) (субстраты изофермента CYP2C9) Ибупрофен (400 мг однократно) Диклофенак (50 мг однократно) |
Сmах S-ибупрофена ↑20 % AUC0-∞ S-ибупрофена ↑100 % Сmах диклофенака ↑114 % AUC0-∞ диклофенака ↑78 % |
Пациентов следует наблюдать с целью выявления возможных токсических эффектов и при необходимости корректировать дозу НПВП |
|
Омепразол (40 мг 1 раз в сутки)* (ингибитор изофермента СYP2C19; субстрат изоферментов CYP2C19 и CYP3A4) |
Сmах омепразола ↑116 % AUCτ омепразола ↑280 % Сmах вориконазола ↑15 % AUCτ вориконазола ↑41 % Вориконазол также может угнетать действие других ингибиторов протонной помпы, которые являются субстратами изофермента CYP2C19, что может приводить к повышению плазменных концентраций этих лекарственных средств. |
Коррекции дозы вориконазола не требуется. При начале приёма вориконазола у пациентов, уже получающих терапию омепразолом в дозах 40 мг или выше, рекомендуется дозу омепразола уменьшить вдвое. |
|
Пероральные контрацептивы* (субстраты изофермента CYP3A4; ингибиторы изофермента CYP2C19) Норэтистерон/этинилэстра диола (1 мг/0,35 мг 1 раз в сутки) |
Сmах этинилэстрадиола ↑36 % AUCτ этинилэстрадиола ↑61 % Сmах норэтистерона ↑15 % AUCτ норэтистерона ↑53 % Сmах вориконазола ↑14 % AUCτ вориконазола ↑46 % |
Рекомендуется контроль состояния пациента на предмет развития нежелательных реакций, связанных с применением пероральных контрацептивов и вориконазола. |
|
Наркотические анальгетики короткого действия (субстраты изофермента CYP3A4) |
Следует оценить возможность снижения дозы алфентанила, фентанила и других наркотических анальгетиков короткого действия, имеющих схожую с алфентанилом химическую структуру и метаболизируемых изоферментом CYP3A4 (например, суфентанила). Пациенты должны находиться под постоянным наблюдением для предотвращения угнетения функции дыхания или других побочных эффектов, связанных с приёмом наркотических анальгетиков короткого действия, и при необходимости их доза должна быть снижена. |
|
|
Алфентанил (однократная доза 20 мкг/кг с одновременным применением налоксона) |
AUC0-∞ алфентанила ↑в 6 раз |
|
|
Фентанил (однократная доза 5 мкг/кг) |
AUC0-∞ фентанила ↑в 1,34 раза |
|
|
Статины (например, ловастатин) (субстраты изофермента CYP3A4) |
Взаимодействие не изучалось, однако, вероятно, вориконазол может увеличивать плазменные концентрации статинов, метаболизируемых изоферментом CYP3A4 и может приводить к рабдомиолизу. |
Следует оценить возможность снижения дозы статинов. |
|
Производных сульфонилмочевины (например, толбутамид, глипизид, глибенкламид) (субстраты изофермента CYP2C9) |
Взаимодействие не изучалось, однако, вероятно, вориконазол может вызывать повышение концентрации производных сульфонилмочевины и являться причиной гипогликемии. |
Необходимо тщательно контролировать концентрацию глюкозы в крови. |
|
Алкалоиды барвинка (например, винкристин, винбластин) (субстраты изофермента CYP3A4) |
Вориконазол может повышать концентрацию алкалоидов барвинка (винкристина, винбластина) в плазме крови и вызывать нейротоксичность. |
Рекомендуется оценить целесообразность коррекции дозы алкалоидов барвинка |
|
Другие ингибиторы протеазы (ИП) ВИЧ (например, саквинавир, ампренавир, нелфинавир)* (ингибиторы и субстраты изофермента CYP3A4) |
Исследования in vitro показали, что вориконазол может ингибировать метаболизм ингибиторов протеазы ВИЧ (саквинавира, ампренавира, нелфинавира). В свою очередь, ИП ВИЧ могут ингибировать метаболизм вориконазола. |
Рекомендуется тщательный контроль состояния пациента на предмет развития любых проявлений лекарственной токсичности и/или недостаточности действия. Возможно потребуется коррекция дозы препаратов. |
|
Другие ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ) (например, делавирдин, невирапин)* (субстраты изофермента CYP3A4, ингибиторы ши индукторы цитохрома P450) |
Исследования in vitro показали, что метаболизм вориконазола может угнетаться под действием ННИОТ, а вориконазол в свою очередь может угнетать метаболизм ННИОТ. На основании полученных результатов исследования эффекта эфавиренза на вориконазол можно предположить, что ННИОТ могут усиливать метаболизм вориконазола. |
Рекомендуется тщательный контроль состояния пациента на предмет развития любых проявлений лекарственной токсичности и/или недостаточности действия. Возможно, потребуется коррекция дозы препаратов. |
|
Циметидин (400 мг два раза в сутки) (неспецифически ингибирует цитохром P450 и повышает уровень pH желудочного сока) |
Сmах вориконазола ↑18 % AUCτ вориконазола ↑23 % |
Коррекции дозы не требуется. |
|
Дигоксин (0,25 мг 1 раз в сутки) (субстрат Р-гликопротеина) |
Сmах дигоксина ↔ AUCτ дигоксина ↔ |
Коррекции дозы не требуется. |
|
Индинавир (800 мг 3 раза в сутки) (ингибитор и субстрат изофермента CYP3A4) |
Сmах индинавира ↔ AUCτ индинавира ↔ Сmах вориконазола ↔ AUCτ вориконазола ↔ |
Коррекции дозы не требуется. |
|
Антибиотики группы макролидов |
Коррекции дозы не требуется. |
|
|
Эритромицин (1 г 2 раза в сутки) (ингибитор изофермента CYP3A4) |
Сmах и AUCτ вориконазола ↔ |
|
|
Азитромицин (500 мг 1 раз в сутки) |
Сmах и AUCτ вориконазола ↔ Влияние вориконазола на метаболизм эритромицина или азитромицина неизвестно. |
|
|
Микофеноловая кислота (1 г однократно) (субстрат уридин-5′-дифосфат-глюкуронилтрансферазы) |
Сmах микофеноловой кислоты ↔ AUCτ микофеноловой кислоты ↔ |
Коррекции дозы не требуется. |
|
Преднизолон (60 мг однократно) (субстрат изофермента CYP3A4) |
Сmах преднизолона ↑11 % AUC0-∞ преднизолона ↑34 % |
Коррекции дозы не требуется. |
|
Ранитидин (150 мг 2 раза в сутки) (повышает pH желудочного сока) |
Сmах и AUCτ вориконазола ↔ |
Коррекции дозы не требуется. |
Фармакокинетический параметр, основанный на 90 % доверительном интервале среднего геометрического значения находится внутри (↔), выше (↑) или ниже (↓) интервала 80- 125 %.
* Взаимное воздействие.
AUCτ, AUCТ, AUC0-∞— площадь под кривой «концентрация–время» в период дозирования, от момента введения препарата до видимой концентрации в плазме крови, от момента введения препарата до бесконечности, соответственно.
Особые указания
Взятие материала для посева и других лабораторных исследований (серология, гистопатология) с целью выделения и идентификации возбудителей следует производить до начала лечения. Лечение можно начать до получения результатов лабораторных исследований. Однако после получения этих результатов необходимо скорректировать противогрибковую терапию.
К видам, наиболее часто вызывающим инфекции у человека, относятся С. albicans, С. parapsilosis, С. tropicalis, С. glabrata и С. krusei, при этом для всех них минимальная подавляющая концентрация (МПК) вориконазола обычно составляет менее 1 мг/мл.
Однако активностью вориконазола в условиях in vitro против грибков разных видов Candida не одинакова. В частности, МПК вориконазола для устойчивых к флуконазолу изолятов С. glabrata пропорционально выше, чем МПК для изолятов, чувствительных к флуконазолу. В связи с этим грибки рода Candida следует во всех возможных случаях идентифицировать до уровня вида. При возможности определения чувствительности грибов к противогрибковым препаратам полученные значения МПК следует интерпретировать с использованием пороговых критериев.
Нежелательные явления со стороны сердечно-сосудистой системы
Применение вориконазола связано с удлинением интервала QT на электрокардиограмме, что сопровождается редкими случаями мерцания/трепетания желудочков у тяжелобольных пациентов с множественными факторами риска, такими как кардиотоксическая химиотерапия, кардиомиопатия, гипокалиемия и сопутствующая терапия, которые могли способствовать развитию данного осложнения.
Вориконазол следует с осторожностью применять у пациентов со следующими потенциально проаритмическими состояниями:
— врождённое и приобретенное удлинение интервала QT;
— кардиомиопатия, особенно в сочетании с сердечной недостаточностью;
— синусовая брадикардия;
— существующие аритмии с клиническими проявлениями;
— одновременное применение лекарственных препаратов, удлиняющих интервал QT (см. раздел «Взаимодействие с другими лекарственными средствами»).
Электролитные нарушения, например, гипокалиемию, гипомагниемию и гипокальциемию, при необходимости, следует контролировать и устранять до начала и во время терапии вориконазолом.
При исследовании на здоровых добровольцах влияния вориконазола на интервал QT на ЭКГ при применении однократных доз, превышающих обычную дневную дозу не более чем в 4 раза, было установлено, что ни у одного из испытуемых не наблюдалось удлинения интервала QT на 60 или более мсек от нормы. Также ни у одного из испытуемых не наблюдалось удлинения интервала выше клинически значимого порога в 500 мсек.
Гепатотоксичность
Частота клинически значимого повышения активности «печёночных» трансаминаз у пациентов, получающих вориконазол, составляет 13,4 %. В большинстве случаев показатели функции печени нормализуются как при продолжении лечения без изменения дозы или после её коррекции, так и после прекращения терапии. При применении вориконазола нечасто наблюдались случаи тяжёлой гепатотоксичности (желтуха, гепатит и печеночноклеточная недостаточность, приводящая к смерти) у пациентов с серьёзными основными заболеваниями.
Нежелательные явления со стороны печени наблюдаются, в основном, у пациентов с серьёзными заболеваниями, главным образом, злокачественными опухолями крови. У пациентов без каких-либо факторов риска наблюдаются преходящие реакции со стороны печени, включая гепатит и желтуху. Нарушения функции печени обычно обратимы и проходят после прекращения лечения.
Мониторинг функции печени
Во время лечения вориконазолом рекомендуется постоянно контролировать функцию печени, как у детей, так и у взрослых.
Клиническое ведение таких пациентов должно включать лабораторную оценку функции печени (в частности, определение активности ACT и АЛТ) в начале лечения вориконазолом и не реже одного раза в неделю в течение первого месяца терапии.
В случае продолжения лечения при отсутствии изменении со стороны биохимических показателей функции печени частота лабораторного обследования может быть уменьшена до одного раза в месяц.
При выраженном повышении биохимических показателей функции печени вориконазол следует отменить, если только соотношение пользы и риска терапии согласно медицинской оценке не оправдывает его дальнейшее применение (см. раздел «Способ применения и дозы»).
Нарушения зрения
При лечении вориконазолом примерно у 21 % пациентов наблюдается нарушение зрительного восприятия: затуманивание зрения, изменение цветового зрения или фотофобия. Нарушения зрения являются преходящими и полностью обратимыми; в большинстве случаев они самопроизвольно исчезают в течение 60 мин. При повторном применении вориконазола отмечается ослабление их выраженности. Зрительные нарушения обычно легко выражены, редко требуют прекращения лечения и не приводят к каким-либо отдалённым последствиям.
Механизм развития зрительных нарушений неизвестен. Установлено, что вориконазол снижает амплитуду волн на электроретинограмме (ЭРГ) у здоровых добровольцев. Данные изменения ЭРГ не нарастали при продолжении лечения в течение 29 дней и полностью исчезали после отмены вориконазола.
Длительная терапия вориконазолом (в среднем в течение 169 дней) у пациентов с паракокцидиоидозом не оказывала клинически значимого эффекта на зрительную функцию, что подтверждено результатами тестов на остроту зрения, зрительных полей, цветовосприятия и контрастной чувствительности.
По данным пострегистрационных исследований сообщается о развитии случаев зрительных нарушений, сохраняющихся продолжительное время, в частности, возникновение «пелены» перед глазами, неврит зрительного нерва и отёк диска зрительного нерва. Следует отметить, что данные нарушения развиваются чаще всего у тяжелобольных пациентов и/или получающих сопутствующую терапию, которая может вызывать подобные нежелательные явления.
Нежелательные явления со стороны почек
У тяжелобольных пациентов, получающих вориконазол, отмечались случаи развития острой почечной недостаточности, что, вероятно, было связано с терапией, основного или сопутствующих заболеваний нефротоксичными лекарственными средствами.
Мониторинг функции почек
Пациентов следует наблюдать с целью выявления признаков нарушения функции почек. Для этого необходимо проводить лабораторные исследования, в частности, определять концентрацию креатинина в сыворотке крови (см. раздел «Способ применения и дозы»).
Мониторинг функции поджелудочной железы
Взрослые и дети, имеющие факторы риска развития острого панкреатита (недавняя химиотерапия, трансплантация гемопоэтических стволовых клеток) должны пройти обследование (определение активности амилазы и липазы в сыворотке крови) для решения вопроса о терапии вориконазолом.
Нежелательные явления со стороны кожи
При терапии вориконазолом часто развиваются кожные реакции, в основном, у пациентов с серьёзными основными заболеваниями, одновременно принимающих другие лекарственные средства. В большинстве случаев отмечалась легко или умеренно выраженная кожная сыпь.
Во время лечения вориконазолом у пациентов наблюдались случаи эксфолиативных кожных реакций, таких как синдром Стивенса-Джонсона. Если у пациента развиваются эксфолиативные кожные реакции, то вориконазол следует отменить.
Так как во время терапии вориконазолом возможно развитие фотосенсибилизации, то во время лечения пациентам рекомендуется избегать воздействия прямых солнечных лучей и принимать защитные меры, такие как ношение одежды и применение солнцезащитных средств с высоким коэффициентом защиты от ультрафиолетового излучения (SPF).
Длительное лечение
У пациентов с кожными реакциями фоточувствительности и дополнительными факторами риска сообщается о развитии плоскоклеточного рака кожи и меланомы на фоне продолжительной терапии.
При возникновении у пациента фототоксических реакций он должен быть проконсультирован соответствующими специалистами и направлен к дерматологу. Следует рассмотреть возможность отмены вориконазола.
При продолжении терапии вориконазолом, несмотря на возникновение фототоксических поражений кожи, пациент должен регулярно проходить дерматологическое обследование с целью раннего выявления и лечения предраковых заболеваний кожи.
Если у пациента развиваются поражения кожи, связанные с предраковыми заболеваниями кожи, плоскоклеточным раком кожи или меланомой, то следует рассмотреть вопрос о прекращении терапии вориконазолом.
Неинфекционный периостит
Имеются сообщения о случаях развития периостита у пациентов после трансплантации, получающих длительную терапию вориконазолом. Терапию вориконазолом следует отменить в случае, если у пациента имеется боль в костях и на рентгенограмме отмечаются изменения, характерные для периостита.
Применение у детей
Вориконазол показан для применения у детей в возрасте от 3 лет (для данной лекарственной формы) и старше при постоянном контроле функции печени. У детей чаще отмечается повышение активности ферментов печени. Биодоступность вориконазола при приёме внутрь у детей в возрасте от 3 до 12 лет может быть снижена за счёт нарушения всасывания или за счёт пониженной массы тела. В таких случаях показано внутривенное введение вориконазола.
Частота фототоксических реакций у детей выше. В связи с тем, что фототоксические поражения могут перерождаться в плоскоклеточную карциному (ПКК), у детей необходимо применять строгие меры по защите кожи от ультрафиолетового излучения. Детям с признаками фотостарения кожи, например, лентиго или веснушки, рекомендуется избегать солнца и обследоваться у дерматолога даже после прекращения лечения.
Наркотические анальгетики короткого действия (субстраты изофермента CYP3A4)
Поскольку период полувыведения алфентанила при его одновременном применении с вориконазолом увеличивается в 4 раза, необходим тщательный мониторинг нежелательных явлений, связанных с применением наркотических анальгетиков, включая более продолжительный мониторинг функции дыхания.
Наркотические анальгетики длительного действия (субстраты изофермента CYP3A4)
Следует предусмотреть возможность снижения дозы оксикодона и других наркотических анальгетиков продолжительного действия, которые метаболизируются изоферментом CYP3A4 (гидрокодон) при одновременном применении с вориконазолом. Необходимо проводить тщательный мониторинг нежелательных явлений, связанных с применением наркотических анальгетиков (см. раздел «Взаимодействие с другими лекарственными средствами»).
Фенитоин (мощный индуктор цитохрома Р450 и субстрат изофермента CYP2C9)
При одновременном применении фенитоина и вориконазола рекомендуется осуществлять постоянный контроль концентрации фенитоина. По возможности следует избегать одновременного применения вориконазола и фенитоина за исключением тех случаев, когда ожидаемая польза превышает возможный риск (см. раздел «Взаимодействие с другими лекарственными средствами»).
Эфавиренз (ненуклеозидный ингибитор обратной транскриптазы, индуктор цитохрома Р450, ингибитор и субстрат изофермента CYP3A4)
В случае одновременного применения вориконазола и эфавиренза дозу вориконазола следует увеличить до 400 мг 2 раза в сутки, а доза эфавиренза должна быть снижена до 300 мг каждые 24 ч (см. раздел «Взаимодействие с другими лекарственными средствами»).
Рифабутин
Одновременное применение вориконазола и рифабутина противопоказано, так как рифабутин значительно снижает концентрацию вориконазола в плазме крови.
Ритонавир (мощный индуктор цитохрома Р450, ингибитор и субстрат изофермента CYP3A4)
Применять одновременно вориконазол и ритонавир в низких дозах (100 мг 2 раза в сутки) следует лишь в том случае, если ожидаемая польза от приёма вориконазола значительно превышает риск от их совместного применения (см. разделы «Противопоказания» и «Взаимодействие с другими лекарственными средствами»).
Эверолимус (субстрат изофермента CYP3A4 и Р-гликопротеина)
Одновременное применение вориконазола и эверолимуса не рекомендуется, так как ожидается, что вориконазол значительно повышает концентрацию эверолимуса в плазме крови. На данный момент не имеется достаточной информации для рекомендации по коррекции режима дозирования.
Метадон (субстрат изофермента CYP3A4)
Повышение концентрации метадона в плазме крови приводит к проявлению токсических эффектов, включая удлинение интервала QT. При одновременном применении вориконазола и метадона необходимо внимательно следить за проявлением нежелательных и токсических эффектов. При необходимости доза метадона может быть снижена (см. раздел «Взаимодействие с другими лекарственными средствами»).
Флуконазол (ингибитор изоферментов CYP2C9, CYP2C19, CYP3A4)
Одновременное применение вориконазола и флуконазола внутрь у здоровых добровольцев приводит к значительному повышению Сmах и AUCT вориконазола. Подходящий режим коррекции дозы и/или частоты приёма вориконазола и флуконазола не установлен. В том случае, если вориконазол применяется после флуконазола, рекомендуется проводить тщательный контроль нежелательных реакций, связанных с приёмом вориконазола.
Влияние на способность управлять транспортными средствами, механизмами
Вориконазол может вызвать преходящие и обратимые нарушения зрения включая возникновение «пелены» перед глазами, нарушение/усиление зрительного восприятия и/или фотофобию. При наличии таких симптомов пациенты должны избегать выполнения потенциально опасных действий, в частности управления автомобилем или использования сложной техники. При приёме вориконазола пациенты не должны управлять автомобилем по ночам.
Форма выпуска
Таблетки, покрытые плёночной оболочкой, 50 мг и 200 мг.
По 2, 4, 6, 7, 8, 10, 14, 16, 20, 21, 25, 28 или 30 таблеток в контурную ячейковую упаковку из плёнки поливинилхлоридной и фольги алюминиевой печатной лакированной.
По 2, 4, 6, 7, 8, 10, 14, 16, 20, 21, 28, 30, 35, 40, 42, 49, 50, 56, 70, 80, 98, 100, 112 или 140 таблеток в банки из полиэтилентерефталата для лекарственных средств или полипропиленовые для лекарственных средств, укупоренные крышками из полиэтилена высокого давления с контролем первого вскрытия или крышками полипропиленовыми с системой «нажать-повернуть» или крышками из полиэтилена низкого давления с контролем первого вскрытия.
Одну банку или 1, 2, 3, 4, 5, 6, 7 или 10 контурных ячейковых упаковок вместе с инструкцией по применению помещают в картонную упаковку (пачку).
Хранение
При температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности.
Условия отпуска из аптек
Отпускают по рецепту.
Производитель
Вифенд® (лиофилизат для приготовления раствора для инфузий, 200 мг)
МНН: Вориконазол
Производитель: Фармация и Апджон Кампани
Анатомо-терапевтическо-химическая классификация: Voriconazole
Номер регистрации в РК:
№ РК-ЛС-5№014469
Информация о регистрации в РК:
20.08.2019 — бессрочно
- Скачать инструкцию медикамента
Торговое название
Вифенд®
Международное непатентованное название
Вориконазол
Лекарственная форма
Лиофилизат для приготовления раствора для инфузий, 200 мг
Состав
Один флакон содержит
активное вещество — вориконазол 200 мг,
вспомогательные вещества: натриевая соль сульфобутилового эфира β — циклодекстрина
Описание
Лиофилизат белого цвета
Фармакотерапевтическая группа
Противогрибковые препараты для системного использования.
Триазола производные. Вориконазол.
Код АТХ J02АС03
Фармакологические свойства
Фармакокинетика
Фармакокинетика вориконазола имеет нелинейный характер за счет насыщения метаболических путей его превращений. При увеличении дозы наблюдается выраженное повышение уровня его воздействия.
При внутривенном применении рекомендуемых насыщающих доз, концентрации вориконазола в плазме крови, близкие к равновесным, достигаются в течение первых 24 часов после введения препарата. Без применения насыщающей дозы при многократном приеме два раза в сутки наблюдается накопление препарата с достижением равновесной концентрации вориконазола в плазме крови у большинства пациентов к 6 — ому дню.
Распределение
Объем распределения вориконазола в равновесном состоянии составляет 4,6 л/кг, что указывает на широкое распределение препарата в тканях. Связывание с белками плазмы составляет 58 %.
Вориконазол в концентрациях, поддающихся определению, обнаруживается в спинно — мозговой жидкости.
Биотрансформация
Исследования in vitro показали, что вориконазол метаболизируется печеночными изоферментами цитохрома P — 450 — CYP2C19, CYP2C9 и CYP3A4.
Для фармакокинетики вориконазола характерна значительная индивидуальная вариабельность.
Исследования in vivo свидетельствуют о том, что CYP2C19 играет важную роль в метаболизме вориконазола. Для этого фермента характерен генетический полиморфизм. Например, низкой активности метаболизирующих вориконазол ферментов можно ожидать у 15 — 20 % представителей азиатской расы. Среди представителей европеоидной и негроидной рас распространенность лиц с низкой метаболизирующей активностью ферментов составляет 3 — 5 %. Исследования у здоровых представителей европеоидной расы и японцев показали, что у пациентов с низкой метаболизирующей активностью ферментов экспозиции (AUCτ) препарата в среднем в 4 раза выше, чем у гомозиготных участников с высокой метаболизирующей активностью. У гетерозиготных участников с высокой метаболизирующей активностью ферментов воздействие вориконазола в среднем в 2 раза выше, чем у гомозиготных участников с высокой метаболизирующей активностью ферментов.
Основным метаболитом вориконазола является N — оксид, доля которого составляет 72 % от циркулирующих меченных радиоактивной меткой метаболитов в плазме крови. Этот метаболит обладает минимальной противогрибковой активностью и не влияет на общую эффективность вориконазола.
Выведение
Вориконазол элиминируется посредством метаболизма в печени, при этом в неизмененном виде с мочой выделяется менее 2 % дозы препарата.
После многократного внутривенного введения меченного радиоактивной меткой вориконазола в моче обнаруживают примерно 80 % радиоактивной метки. После внутривенного введения основная часть (> 94 %) радиоактивной метки выводится в течение первых 96 часов.
Продолжительность терминального периода полувыведения вориконазола зависит от дозы. В связи с нелинейностью фармакокинетики терминальный период полувыведения не позволяет прогнозировать параметры накопления или элиминации вориконазола.
Фармакокинетика у особых групп пациентов
Пол
В ходе клинических исследований коррекция дозы в зависимости от пола не осуществлялась. Профиль безопасности и концентрации препарата в плазме крови у женщин и мужчин были схожими. Таким образом, коррекция дозы препарата в зависимости от пола не требуется.
Пожилые пациенты
В терапевтических исследованиях коррекция дозы в зависимости от возраста не осуществлялась. Однако была установлена взаимосвязь между концентрациями препарата в плазме крови и возрастом пациентов. Профиль безопасность вориконазола у пациентов молодого и пожилого возраста был схож, поэтому необходимость в коррекции дозы у лиц пожилого возраста отсутствует.
Пациенты детского возраста
Дозы препарата, рекомендуемые к применению у детей и подростков, определены по результатам популяционного фармакокинетического анализа объединенных данных у детей с ослабленным иммунитетом в возрасте от 2 до 12 лет и подростков с ослабленным иммунитетом в возрасте от 12 до 17 лет.
Многократные дозы вориконазола 3, 4, 6, 7 и 8 мг/кг при внутривенном введении два раза в сутки наблюдались в исследованиях по оценке фармакокинетики вориконазола у пациентов детского возраста.
Насыщающие дозы 6 мг/кг при внутривенном введении два раза в сутки на 1 — й день с последующим введением дозы 4 мг/кг два раза в сутки наблюдались в исследованиях фармакокинетического профиля применения препарата у подростков. У детей отмечалась более выраженная индивидуальная вариабельность, чем у взрослых.
При сравнении данных по фармакокинетике препарата у детей и взрослых было установлено, что прогнозируемое общее воздействие (AUC) у детей после внутривенного введения насыщающей дозы 9 мг/кг было сопоставимо с воздействием у взрослых после внутривенного введения насыщающей дозы 6 мг/кг. Прогнозируемый суммарный уровень воздействия у детей после внутривенного введения поддерживающих доз 4 и 8 мг/кг два раза в сутки был сопоставим с таковым у взрослых после внутривенного введения препарата в дозах 3 и 4 мг/кг два раза в сутки соответственно.
Поддерживающая доза для внутривенного введения у детей выше, чем у взрослых, в связи с наличием у детей более выраженной способности к элиминации препарата, обусловленной более высоким соотношением массы печени к массе тела.
Уровни воздействия вориконазола у большинства подростков были сопоставимы с таковыми у взрослых пациентов, получавших препарат по такой же схеме лечения. Однако у некоторых пациентов раннего подросткового возраста с низкой массой тела наблюдался более низкий уровень воздействия вориконазола, чем у взрослых. Вполне вероятно, что у этих пациентов метаболизм вориконазола более схож с метаболизмом у детей, чем у подростков/взрослых. Исходя из результатов популяционного фармакокинетического анализа, подростки в возрасте от 12 до 14 лет с массой тела менее 50 кг должны получать детские дозы препарата.
Нарушение функции почек
У пациентов с умеренным или тяжелым нарушением функции почек (уровнями креатинина в сыворотке > 2,5 мг/дл) наблюдается накопление вспомогательного вещества лекарственной формы для внутривенного введения — сульфобутилового эфира бета — циклодекстрина натрия (SBECD).
Фармакодинамика
Вифенд® — противогрибковый препарат широкого спектра действия, который принадлежит к группе соединений триазольной структуры.
Механизм действия
Основной механизм действия вориконазола заключается в ингибировании опосредованной грибковым цитохромом Р — 450 реакции деметилирования 14 — альфа — ланостерола, являющейся ключевым этапом биосинтеза эргостерола в грибах. Накопление 14 — альфа — метилстеролов коррелирует с последующей потерей эргостерола, входящего в состав клеточной мембраны грибов; этот процесс, возможно, лежит в основе противогрибкового действия вориконазола. Показано, что вориконазол более селективен по отношению к ферментам семейства цитохрома Р — 450 грибов, чем по отношению к различным ферментам семейства цитохрома P — 450 млекопитающих.
Зависимость параметров фармакокинетики и фармакодинамики
В 10 терапевтических исследованиях медиана средней и максимальной концентрации препарата в плазме крови у отдельных пациентов во всех исследованиях равнялась 2425 нг/мл (межквартильный размах от 1193 до 4380 нг/мл) и 3742 нг/мл (межквартильный размах от 2027 до 6302 нг/мл) соответственно. Положительной связи между средними, максимальными и минимальными значениями концентрации вориконазола в плазме крови и эффективностью препарата в исследованиях с его применением в терапевтических целях не выявлено; в исследованиях с применением вориконазола в профилактических целях такая связь не изучалась.
В результате анализа данных по фармакокинетике и фармакодинамике, полученных в клинических исследованиях, была выявлена положительная связь между концентрациями вориконазола в плазме и отклонениями от нормы биохимических показателей функции печени и зрительными нарушениями. Коррекция дозы в исследованиях с применением вориконазола в профилактических целях не изучалась.
Клиническая эффективность и безопасность
В условиях in vitro вориконазол обладает широким спектром противогрибкового действия и активен против грибов рода Candida (включая устойчивые к флуконазолу штаммы C. krusei, а также устойчивые штаммы C. glabrata и C. albicans) и фунгицидным действием относительно всех исследованных грибов рода Aspergillus. Кроме того, в условиях in vitro вориконазол обладает фунгицидным действием против новых патогенных грибов, в том числе грибов рода Scedosporium или Fusarium, имеющих ограниченную чувствительность к существующим противогрибковым средствам.
Клиническая эффективность, определяемая как частичный или полный ответ, была показана относительно грибов рода Aspergillus, в том числе A. flavus, A. fumigatus, A. terreus, A. niger, A. nidulans; грибов рода Candida, включая C. albicans, C. glabrata, C. krusei, C. parapsilosis и C. tropicalis; а также против ограниченного количества грибов C. dubliniensis, C. inconspicua, и видов C. guilliermondii, Scedosporium, в том числе S. apiospermum, S. prolificans;
кроме того, грибов рода Fusarium.
Другие грибковые инфекции, при которых применялся вориконазол (часто с частичным или полным ответом), включали в себя отдельные случаи инфекций, вызванных грибами рода Alternaria, Blastomyces dermatitidis, Blastoschizomyces capitatus, рода Cladosporium, Coccidioides immitis, Conidiobolus coronatus, Cryptococcus neoformans, Exserohilum rostratum, Exophiala spinifera, Fonsecaea pedrosoi, Madurella mycetomatis, Paecilomyces lilacinus, рода Penicillium, включая P. marneffei, Phialophora richardsiae, Scopulariopsis brevicaulis и рода Trichosporon, включая T. beigelii.
Активность препарата в условиях in vitro по отношению к клиническим штаммам наблюдалась для грибов рода Acremonium, рода Alternaria, рода Bipolaris, рода Cladophialophora и Histoplasma capsulatum, причем рост большинства штаммов подавлялся при концентрациях вориконазола от 0,05 мкг/мл до 2 мкг/мл.
В условиях in vitro выявлена активность вориконазола в отношении грибов рода Curvularia и рода Sporothrix, но клиническая достоверность неизвестна.
Пограничные значения
К видам, которые чаще всего служат причиной грибковых инфекций у человека, относятся C. albicans, C. parapsilosis, C. tropicalis, C. glabrata и C. krusei, причем для всех этих видов минимальная ингибирующая концентрация (МИК) вориконазола составляет менее 1 мг/л.
Однако активность вориконазола in vitro в отношении различных видов грибов рода Candida неодинакова. В частности, МИК вориконазола для резистентных к флуконазолу изолятов C. glabrata пропорционально выше, чем для изолятов, чувствительных к флуконазолу. В связи с этим грибы рода Candida необходимо идентифицировать до уровня вида. При возможности выполнения исследования по определению чувствительности грибов к противогрибковым препаратам полученные значения МИК могут интерпретироваться с использованием критериев границ чувствительности Европейского комитета по определению чувствительности микроорганизмов к антибактериальным средствам (EUCAST).
Границы чувствительности согласно EUCAST
|
Виды Candida |
Пограничные значения МИК (мг/л) |
|
|
≤ Ч (чувствительные) |
> У (устойчивые) |
|
|
Candida albicans1 |
0,125 |
0,125 |
|
Candida tropicalis1 |
0,125 |
0,125 |
|
Candida parapsilosis1 |
0,125 |
0,125 |
|
Candida glabrata2 |
Данных недостаточно |
|
|
Candida krusei3 |
Данных недостаточно |
|
|
Другие виды Candida4 |
Данных недостаточно |
1 Штаммы с величинами МИК выше пограничного значения чувствительности (Ч) выявлялись редко или не выявлялись вообще. Идентификацию любого из таких изолятов и исследование его чувствительности к противогрибковым средствам необходимо выполнить повторно и в случае подтверждения полученного результата изолят следует направить в поверочную лабораторию.
2 В клинических исследованиях у пациентов с инфекциями, вызванными C. glabrata, ответ на терапию вориконазолом был на 21 % ниже, чем у пациентов с инфекциями, вызванными C. albicans, C. parapsilosis и C. tropicalis. Однако этот сниженный ответ не коррелировал с повышенными значениями МИК.
3 В клинических исследованиях у пациентов с инфекциями, вызванными C. krusei, ответ на терапию вориконазолом был сопоставим с ответом на терапию у пациентов с инфекциями, вызванными C. albicans, C. parapsilosis и C. tropicalis. Однако поскольку для анализа по критериям EUCAST было доступно лишь 9 случаев инфекции, на данный момент доказательных данных для установления клинических пограничных значений для C. krusei недостаточно.
4 EUCAST не установил не зависящих от вида возбудителя пограничных значений для вориконазола.
Опыт клинического применения
В рамках данного раздела положительный результат применения препарата определяется как полный или частичный ответ на лечение.
Инфекции, вызванные Aspergillus: эффективность у пациентов с аспергиллезом и неблагоприятным прогнозом
В условиях in vitro вориконазол проявляет противогрибковое действие против разных видов Aspergillus. Эффективность вориконазола и его положительное влияние на выживаемость в сравнении со стандартной терапией амфотерицином B при первичном лечении острого инвазивного аспергиллеза были показаны в открытом, рандомизированном, многоцентровом исследовании с участием 277 пациентов с ослабленным иммунитетом, получавших лечение в течение 12 недель. Вориконазол вводили внутривенно в виде насыщающей дозы 6 мг/кг каждые 12 часов в течение первых 24 часов, а затем в виде поддерживающей дозы 4 мг/кг каждые 12 часов в течение не менее 7 дней. Далее можно было перейти к получению препарата перорально в дозе 200 мг каждые 12 часов. Медианная продолжительность в/в терапии вориконазолом составляла 10 дней (диапазон 2 — 85 дней). Медианная продолжительность пероральной терапии вориконазолом после в/в терапии составляла 76 дней (диапазон 2 — 232 дня).
Удовлетворительный общий ответ (полное или частичное исчезновение всех ассоциированных признаков, симптомов и рентгенографических/бронхоскопических изменений, имевшихся на исходном уровне) наблюдался у 53 % пациентов, получавших вориконазол, по сравнению с 31 % пациентов, получавших препарат сравнения. Выживаемость пациентов на протяжении 84 — дневного периода на фоне применения вориконазола была статистически значимо выше, чем на фоне применения препарата сравнения, при этом были продемонстрированы клинически и статистически значимые преимущества вориконазола как в плане продолжительности периода до наступления смерти, так и в плане продолжительности периода до отмены препарата в связи с его токсичностью.
Это исследование подтвердило результаты предыдущего проспективного исследования, в котором был получен положительный результат у пациентов с факторами риска неблагоприятного прогноза, включая реакцию «трансплантат против хозяина» и, особенно, церебральные инфекции (обычно сопровождающиеся почти 100 % — ой летальностью).
Эти исследования включали случаи аспергиллеза головного мозга, придаточных пазух носа, легких и диссеминированной инфекции у пациентов после трансплантации костного мозга и органов, у пациентов с гемобластозами, другими злокачественными опухолями и СПИДом.
Кандидемия у пациентов без нейтропении
Эффективность вориконазола в сравнении с амфотерицином В с последующим применением флуконазола в качестве первичной терапии кандидемии была продемонстрирована в открытом сравнительном исследовании. В исследовании участвовали 370 пациентов без нейтропении (старше 12 лет) с подтвержденной кандидемией, из которых 248 получали вориконазол. Девять пациентов в группе вориконазола и 5 пациентов в группе амфотерицина В с последующим применением флуконазола также имели грибковую инфекцию глубоких тканей, подтвержденную микологическим исследованием. Пациенты с почечной недостаточностью в это исследование не включались. Медианная продолжительность лечения составляла 15 дней в обеих группах лечения. В соответствии с проведенной Комитетом по анализу данных (КАД) оценкой результатов, которые были маскированы в отношении исследовавшегося лекарственного препарата, при первичном анализе благоприятный ответ определялся как исчезновение или ослабление всех клинических признаков и симптомов инфекции с отсутствием грибов рода Candida в крови и в инфицированных участках глубоких тканей через 12 недель после окончания терапии (ОТ). Пациенты, не прошедшие оценку через 12 недель после ОТ, рассматривались как не ответившие на лечение. В этом анализе благоприятный ответ наблюдался у 41 % пациентов в обеих группах лечения.
При вторичном анализе, в котором использовались результаты оценки ответа КАД в самой последней временной точке (при ОТ или через 2, 6 или 12 недель после ОТ), частота благоприятного ответа на терапию вориконазолом и амфотерицином В с последующим применением флуконазола составляла 65 % и 71 % соответственно.
Результаты оценки исследователем удачного исхода лечения в каждой из названных временных точек приводятся в следующей таблице.
|
Временная точка |
Вориконазол (N = 248) |
Амфотерицин B → флуконазол (N = 122) |
|
ОТ |
178 (72 %) |
88 (72 %) |
|
2 недели после ОТ |
125 (50 %) |
62 (51 %) |
|
6 недель после ОТ |
104 (42 %) |
55 (45 %) |
|
12 недель после ОТ |
104 (42 %) |
51 (42 %) |
Серьезные рефрактерные инфекции, вызванные грибами рода Candida
В клиническом исследовании приняли участие 55 пациентов с серьезными рефрактерными системными инфекциями, вызванными грибами рода Candida (включая кандидемию, диссеминированный кандидоз и другие формы инвазивного кандидоза), у которых предыдущая противогрибковая терапия, в частности флуконазолом, была неэффективной. Благоприятный ответ на лечение вориконазолом наблюдался у 24 пациентов (у 15 пациентов полный ответ, у 9 пациентов частичный ответ). У пациентов, инфицированных резистентными к флуконазолу штаммами, не принадлежащими к виду albicans, благоприятный ответ на лечение наблюдался у 3 из 3 пациентов, инфицированных C. krusei (полный ответ), и у 6 из 8 пациентов, инфицированных C. glabrata (у 5 — полный ответ, у 1 -частичный ответ). Данные о клинической эффективности подтверждались немногочисленными результатами определения чувствительности возбудителей к препарату.
Инфекции, вызванные грибами рода Scedosporium и Fusarium
Была продемонстрирована эффективность вориконазола против следующих редких патогенных грибов.
Грибы рода Scedosporium. Благоприятный ответ на терапию вориконазолом наблюдался у 16 (у 6 пациентов полный ответ и у 10 пациентов частичный ответ) из 28 пациентов с инфекцией, вызванной S. apiospermum, и у 2 (в обоих случаях частичный ответ) из 7 пациентов с инфекцией, вызванной S. prolificans. Помимо этого, благоприятный ответ наблюдался у 1 из 3 пациентов с инфекциями, вызванными более чем одним микроорганизмом, включая грибы рода Scedosporium.
Грибы рода Fusarium. Семь (3 пациента с полным ответом и 4 пациента с частичным) из 17 пациентов были успешно пролечены вориконазолом. У 3 из этих 7 пациентов наблюдалась инфекция глаз, у 1 — инфекция придаточных пазух носа и у 3 пациентов — диссеминированная инфекция. Еще 4 пациента с фузариозом были инфицированы несколькими возбудителями; у 2 из этих пациентов исход лечения был удачным.
У большинства пациентов, получавших вориконазол для лечения вышеуказанных редких инфекций, наблюдалась непереносимость применявшейся ранее противогрибковой терапии или устойчивость к ней.
Первичная профилактика инвазивных грибковых инфекций (ИГИ) — эффективность при применении у реципиентов ТГСК (трансплантации гемопоэтических стволовых клеток), ранее не инфицированных подтвержденной или подозреваемой ИГИ
Вориконазол сравнивали с итраконазолом при применении в качестве первичной профилактики в ходе открытого, сравнительного, многоцентрового исследования с участием взрослых и подростков, реципиентов аллогенных ТГСК, ранее не инфицированных подтвержденной или подозреваемой ИГИ. Благоприятным результатом лечения считалась возможность продолжать профилактическое применение исследуемого препарата на протяжении 100 дней после трансплантации КСК (без перерыва длительностью > 14 дней) и выживаемость без подтвержденной или подозреваемой ИГИ на протяжении 180 дней после трансплантации КСК. В модифицированной в соответствии с назначенным лечением (MITT) группе насчитывалось 465 реципиентов аллогенных ТГСК, причем у 45 % пациентов был острый миелоидный лейкоз (ОМЛ). Среди всех пациентов 58 % лиц предстояло миелоаблативное кондиционирование. Профилактическое применение исследуемого препарата начинали непосредственно после трансплантации КСК: 224 пациента получали вориконазол, и 241 пациент получал итраконазол. Медиана продолжительности профилактического применения исследуемого препарата в популяции MITT составила 96 дней для вориконазола и 68 дней для итраконазола.
Показатели эффективности и другие вторичные конечные точки представлены в таблице ниже.
|
Конечные точки исследования |
Вориконазол N = 224 |
Итраконазол N = 241 |
Разность процентных долей и 95 % доверительный интервал (ДИ) |
P — значение |
|
Эффективность лечения на 180* день |
109 (48,7 %) |
80 (33,2 %) |
16,4 % (7,7 %, 25,1 %)** |
0,0002** |
|
Эффективность лечения на 100 день |
121 (54,0 %) |
96 (39,8 %) |
15,4 % (6,6 %, 24,2 %)** |
0,0006** |
|
Количество пациентов, получавших исследуемый препарат с профилактической целью в течение как минимум 100 дней |
120 (53,6 %) |
94 (39,0 %) |
14,6 % (5,6 %, 23,5 %) |
0,0015 |
|
Количество выживших пациентов к 180 дню |
184 (82,1 %) |
197 (81,7 %) |
0,4 % (-6,6 %, 7,4 %) |
0,9107 |
|
Количество пациентов с доказанной или вероятной ИГИ, развившейся к 180 дню |
3 (1,3 %) |
5 (2,1 %) |
-0,7 % (-3,1 %, 1,6 %) |
0,5390 |
|
Количество пациентов с доказанной или вероятной ИГИ, развившейся к 100 дню |
2 (0,9 %) |
4 (1,7 %) |
-0,8 % (-2,8 %, 1,3 %) |
0,4589 |
|
Количество пациентов с доказанной или вероятной ИГИ, развившейся при приеме исследуемого препарата |
3 (1,2 %) |
-1,2 % (-2,6 %, 0,2 %) |
0,0813 |
* Первичная конечная точка исследования
** Разность отношений, 95 % ДИ и p — значение, полученные после поправки на рандомизацию.
Частота случаев заражения ИГИ после лечения ко Дню 180 и первичная конечная точка исследования, определяемая как успешное лечение по данным на 180 — й день, у пациентов с ОМЛ и миелоаблативным кондиционированием соответственно представлены в таблице ниже.
ОМЛ
|
Конечные точки исследования |
Вориконазол (N = 98) |
Итраконазол (N = 109) |
Разность процентных долей и 95 % доверительный интервал (ДИ) |
|
Частота случаев заражения ИГИ после лечения — 180 день |
1 (1,0 %) |
2 (1,8 %) |
— 0,8 % (- 4,0 %; 2,4 %)** |
|
Эффективность лечения на 180* день |
55 (56,1 %) |
45 (41,3 %) |
14,7 % (1,7 %; 27,7 %)*** |
* Первичная конечная точка исследования.
** При запасе 5 % была показана не меньшая эффективность.
*** Разность отношений, 95 % ДИ, полученная после поправки на рандомизацию.
Схема миелоаблативного кондиционирования
|
Конечные точки исследования |
Вориконазол (N = 125) |
Итраконазол (N = 143) |
Разность процентных долей и 95 % доверительный интервал (ДИ) |
|
Частота случаев заражения ИГИ после лечения — 180 день |
2 (1,6 %) |
3 (2,1 %) |
— 0,5 % (- 3,7 %; 2,7 %)** |
|
Эффективность лечения на 180* день |
70 (56,0 %) |
53 (37,1 %) |
20,1 % (8,5 %; 31,7 %)*** |
* Первичная конечная точка исследования.
** При запасе 5 % была показана не меньшая эффективность.
*** Разность отношений, 95 % ДИ, полученная после поправки на рандомизацию.
Вторичная профилактика ИГИ — эффективность при применении у ТГСК реципиентов, ранее инфицированных подтвержденной или подозреваемой ИГИ
Применение вориконазола в качестве вторичной профилактики изучалось в ходе открытого, несравнительного, многоцентрового исследования с участием взрослых пациентов, реципиентов аллогенных КСК, ранее инфицированных подтвержденной или подозреваемой ИГИ. В качестве первичной конечной точки использовали частоту инфицирования подтвержденной или подозреваемой ИГИ на протяжении первого года после трансплантации КСК. Популяция MITT состояла из 40 пациентов, ранее инфицированных ИГИ, включая 31 пациента с аспергиллезом, 5 пациентов с кандидозом и 4 пациента с другими ИГИ. Медиана продолжительности профилактического применения исследуемого препарата в популяции MITT составила 95,5 дня.
Подтвержденные или подозреваемые ИГИ развились у 7,5 % (3/40) пациентов в течение первого года после трансплантации КСК, включая один случай кандидемии, один случай сцедоспориоза (обе инфекции как рецидив имевшейся ранее ИГИ) и один случай зигомикоза. Выживаемость на 180 — й день составила 80,0 % (32/40), а через 1 год — 70,0 % (28/40).
Продолжительность терапии
В клинических исследованиях 705 пациент получал вориконазол более 12 недель, причем 164 из них получали вориконазол более 6 месяцев.
Пациенты детского возраста
Вориконазол применялся для лечения 61 ребенка в возрасте от 9 месяцев до 15 лет с подтвержденными или подозреваемыми инвазивными грибковыми инфекциями. В состав этой группы входило 34 пациента в возрасте от 2 до < 12 лет и 20 пациентов в возрасте от 12 до 15 лет.
У большинства пациентов (57 из 61) предыдущая противогрибковая терапия была неэффективной. В терапевтических исследованиях участвовали пять пациентов в возрасте от 12 до 15 лет; остальные получали вориконазол в рамках программ применения незарегистрированного препарата при неэффективности других методов лечения. Основными заболеваниями у этих пациентов являлись гемобластозы (27 пациентов) и хронический гранулематоз (14 пациентов). Наиболее распространенным грибковым заболеванием, по поводу которого пациенты получали лечение, являлся аспергиллез (43 из 61; 70 %).
Клинические исследования по оценке интервала QTc
Для оценки влияния трех пероральных доз вориконазола и кетоконазола на интервал QTc было проведено плацебо — контролируемое, рандомизированное, перекрестное исследование с однократным приемом препарата здоровыми добровольцами. Скорректированное относительно плацебо среднее максимальное удлинение интервала QTc по сравнению с исходным уровнем составляло 5,1 мсек, 4,8 мсек и 8,2 мсек после применения 800 мг, 1200 мг и 1600 мг вориконазола, соответственно, и 7,0 мсек после применения кетоконазола в дозе 800 мг. Ни у одного участника исследования удлинение интервала QTc не составляло ≥ 60 мсек по сравнению с исходным уровнем. Случаи удлинения интервала выше потенциально клинически значимого порогового значения 500 мсек отсутствовали.
Показания к применению
Вифенд® следует применять, главным образом, у пациентов с прогрессирующими и потенциально жизнеугрожающими инфекциями:
— лечение инвазивного аспергиллеза — лечение кандидемии у пациентов без нейтропении — лечение устойчивых к флуконазолу серьезных инвазивных инфекций, вызванных грибами рода Candida (в том числе C. krusei) — лечение тяжелых грибковых инфекций, вызванных грибами рода Scedosporium и Fusarium
— профилактика инвазивных грибковых инфекций у пациентов, которым была выполнена аллогенная трансплантация гемопоэтических стволовых клеток (ТГСК) с высоким риском развития этих инфекций.
Способ применения и дозы
Перед началом терапии необходимо получить образцы грибковой культуры и провести другие надлежащие лабораторные исследования (серологические, гистопатологические) для выделения и идентификации патогенных микроорганизмов — возбудителей инфекции. Терапия может быть начата до получения результатов культурального и других лабораторных исследований, однако, после получения этих результатов противоинфекционное лечение должно быть скорректировано соответствующим образом.
Перед внутривенной инфузией порошок Вифенда® следует растворить и затем дополнительно развести.
Раствор для инфузий не предназначен для болюсного введения.
Вифенд® нельзя вводить одновременно с другими препаратами для внутривенного введения через одну и ту же инфузионную систему или канюлю. После окончания инфузии Вифенда® инфузионную систему можно использовать для введения других препаратов для внутривенного применения.
Вифенд® не должен вводиться одновременно с препаратами крови и концентрированными растворами электролитов, вводимыми путем быстрой инфузии, даже если две инфузии вводятся через разные внутривенные катетеры.
Электролитные нарушения, такие как гипокалиемия, гипомагниемия и гипокальциемия должны быть откорректированы до начала терапии Вифендом.®
Полное парентеральное питание (ППП)
Полное парентеральное питание (ППП) не следует прекращать при назначении Вифенда®, однако раствор питательных веществ следует вводить через отдельную инфузионную систему. Если используется многоканальный катетер, ППП и Вифенд® должны вводиться через разные входы.
Вифенд® нельзя разводить 4,2 % раствором натрия бикарбоната для внутривенных инфузий. Совместимость с раствором натрия бикарбоната в других концентрациях неизвестна.
Инструкции по приготовлению раствора для инфузий
Вифенд® растворяется либо 19 мл воды для инъекций, либо 19 мл раствора натрия хлорида 9 мг/мл (0,9 %) для внутривенных инфузий для получения прозрачного концентрата объемом 20 мл, содержащего 10 мг/мл вориконазола. Если растворитель не всасывается во флакон под силой вакуума, Вифенд® не используют. Для извлечения точного объема (19,0 мл) воды для инъекций или раствора натрия хлорида 9 мг/мл (0,9 %) для внутривенных инфузий рекомендуется использовать стандартный (неавтоматический) шприц объемом 20 мл. Приготовленный раствор Вифенда® предназначен только для однократного использования, и весь неиспользованный раствор должен быть утилизирован. Можно использовать только прозрачный раствор без видимых частиц.
Для внутривенного введения необходимый объем полученного после растворения концентрата добавляют к совместимому с препаратом рекомендованному раствору для инфузий (см. таблицу ниже) для получения готового раствора вориконазола, содержащего 0,5 — 5 мг/мл действующего вещества.
Необходимые объемы концентрата Вифенда® 10 мг/мл
|
Масса тела (кг) |
Объемы концентрата Вифенда® (10 мг/мл), необходимые для приготовления: |
||||
|
Доза 3мг/кг (количество флаконов) |
Доза 4мг/кг (количество флаконов) |
Доза 6мг/кг (количество флаконов) |
Доза 8мг/кг (количество флаконов) |
Доза 9мг/кг (количество флаконов) |
|
|
10 |
— |
4.0 мл (1) |
— |
8.0 мл (1) |
9.0 мл (1) |
|
15 |
— |
6.0 мл (1) |
— |
12.0 мл (1) |
13.5 мл (1) |
|
20 |
— |
8.0 мл (1) |
— |
16.0 мл (1) |
18.0 мл (1) |
|
25 |
— |
10.0 мл (1) |
— |
20.0 мл (1) |
22.5 мл (2) |
|
30 |
9.0 мл (1) |
12.0 мл (1) |
18.0 мл (1) |
24.0 мл (2) |
27,0 мл (2) |
|
35 |
10.5 мл (1) |
14.0 мл (1) |
21.0 мл (2) |
28.0 мл (2) |
31.5 мл (2) |
|
40 |
12.0 мл (1) |
16.0 мл (1) |
24.0 мл (2) |
32.0 мл (2) |
36.0 мл (2) |
|
45 |
13.5 мл (1) |
18.0 мл (1) |
27.0 мл (2) |
36.0 мл (2) |
40.5 мл (3) |
|
50 |
15.0 мл (1) |
20.0 мл (1) |
30.0 мл (2) |
40.0 мл (2) |
45.0 мл (3) |
|
55 |
16.5 мл (1) |
22.0 мл (2) |
33.0 мл (2) |
44.0 мл (3) |
49.5 мл (3) |
|
60 |
18.0 мл (1) |
24.0 мл (2) |
36.0 мл (2) |
48.0 мл (3) |
54.0 мл (3) |
|
65 |
19.5 мл (1) |
26.0 мл (2) |
39.0 мл (2) |
52.0 мл (3) |
58.5 мл (3) |
|
70 |
21.0 мл (2) |
28.0 мл (2) |
42.0 мл (3) |
— |
— |
|
75 |
22.5 мл (2) |
30.0 мл (2) |
45.0 мл (3) |
— |
— |
|
80 |
24.0 мл (2) |
32.0 мл (2) |
48.0 мл (3) |
— |
— |
|
85 |
25.5 мл (2) |
34.0 мл (2) |
51.0 мл (3) |
— |
— |
|
90 |
27.0 мл (2) |
36.0 мл (2) |
54.0 мл (3) |
— |
— |
|
95 |
28.5 мл (2) |
38.0 мл (2) |
57.0 мл (3) |
— |
— |
|
100 |
30.0 мл (2) |
40.0 мл (2) |
60.0 мл (3) |
— |
— |
Препарат следует вводить немедленно после приготовления раствора. Его можно хранить не более 24 ч при температуре от 2°C до 8°C в том случае, когда раствор был приготовлен в контролируемых асептических условиях.
Концентрат можно разводить следующими растворами:
— 0,9 % раствор хлорида натрия для внутривенного введения
— сложный раствор натрия лактата для внутривенного введения
— 5 % раствор глюкозы и сложный раствор натрия лактата для внутривенного введения
— 5 % раствор глюкозы и 0,45 % раствор натрия хлорида для внутривенного введения
— 5 % раствор глюкозы для внутривенного введения
— 5% раствор глюкозы в 20 мэкв раствора хлорида калия для внутривенного введения
— 0,45 % раствор хлорида натрия для внутривенного введения
— 5 % раствор глюкозы и 0,9 % раствор натрия хлорида для внутривенного введения.
Совместимость Вифенда® с другими растворами помимо указанных выше неизвестна.
Применение у взрослых
Назначение Вифенда® внутривенно следует начинать с установленной насыщающей дозы, чтобы уже в первый день добиться концентрации вориконазола в плазме крови, близкой к равновесной концентрации.
Учитывая высокую биодоступность при приеме внутрь, при наличии клинических показаний можно переходить с внутривенного на пероральное применение препарата и наоборот.
Режим дозирования у взрослых
Насыщающая доза Вифенда® при всех показаниях (первые 24 часа) составляет 6 мг/кг каждые 12 часов.
Поддерживающая доза Вифенда® (через 24 часа после начала лечения) составляет 4 мг/кг два раза в сутки.
Вифенд® рекомендуется вводить со скоростью не более 3 мг/кг/ч в течение
1 — 3 ч.
Продолжительность лечения
Длительность лечения должна быть максимально короткой в зависимости от клинического и микологического ответа пациента. Продолжительное лечение вориконазолом более 180 дней (6 месяцев) требует тщательной оценки соотношения пользы и риска применения препарата.
Коррекция дозы у взрослых
Если больные не могут переносить Вифенд® в дозе 4 мг/кг внутривенно два раза в сутки, необходимо уменьшить дозу до 3 мг/кг два раза в сутки.
В случае применения в целях профилактики
Применение у детей (от 2 до < 12 лет) и подростков младшего возраста с низкой массой тела (от 12 до 14 лет с массой тела < 50 кг)
Назначается в таких же дозах, как и у детей, поскольку у подростков младшего возраста метаболизм вориконазола более схож с метаболизмом у детей, чем у взрослых.
Рекомендуемый режим дозирования следующий:
|
Схема с насыщающей дозой (первые 24 часа) |
9 мг/кг каждые 12 часов |
|
Поддерживающая доза (через 24 часа после начала лечения) |
8 мг/кг два раза в сутки |
Примечание. По результатам популяционного фармакокинетического анализа данных детей с ослабленным иммунитетом в возрасте от 2 до < 12 лет и подростков с ослабленным иммунитетом в возрасте от 12 до < 17 лет.
Рекомендуется начинать терапию с внутривенного введения препарата; возможность перорального приема следует рассматривать только после значительного клинического улучшения. Следует отметить, что воздействие вориконазола при внутривенном введении в дозе 8 мг/кг примерно в два раза выше, чем при пероральном приеме в дозе 9 мг/кг.
Все остальные подростки (от 12 до 14 лет и с массой тела ≥ 50 кг; от 15 до 17 лет, независимо от массы тела)
Вориконазол следует применять как у взрослых.
Коррекция дозы у детей (дети (от 2 до < 12 лет) и подростков младшего возраста с низкой массой тела (от 12 до 14 лет с массой тела < 50 кг))
Если ответ пациента на терапию недостаточен, внутривенная доза может быть увеличена поэтапно на 1 мг/кг. Если пациент не переносит терапию, внутривенную дозу снижают поэтапно на 1 мг/кг.
Применение у детей в возрасте менее 2 — х лет
Безопасность и эффективность Вифенда® у детей в возрасте менее 2 — х лет не установлены. В связи с этим Вифенд® не рекомендуется назначать детям младше 2 — х лет.
Применение препарата у детей в возрасте от 2 до 12 лет с печеночной или почечной недостаточностью не изучалось.
Профилактика у взрослых и детей
Профилактику начинают в день выполнения трансплантации. Ее продолжительность может составлять до 100 дней. Профилактика должна быть как можно более короткой и подбираться в зависимости от оценки риска развития инвазивной грибковой инфекции (ИГИ), о возникновении которой сигнализирует нейтропения или иммуносупрессия. Профилактика может длиться только до 180 дней после трансплантации в случае продолжительной иммуносупрессии или возникновения болезни «трансплантат против хозяина».
Дозировка
Рекомендуемый режим дозирования препарата в целях профилактики аналогичен таковому в целях лечения у соответствующих возрастных групп. Продолжительность профилактики
Безопасность и эффективность вориконазола при применении в течение периода времени, превышающего 180 дней, не были достаточным образом изучены в клинических исследованиях.
В случае применения вориконазола в течение периода времени, превышающего 180 дней (6 месяцев), требуется тщательная оценка соотношения пользы и риска.
В случае применения лечения и профилактики
Коррекция дозы
Если препарат применяется в целях профилактики, то в случае недостаточной эффективности или развития связанных с терапией нежелательных явлений коррекция дозы не рекомендуется. При развитии связанных с терапией нежелательных явлений вориконазол отменяют и назначают альтернативные противогрибковые препараты.
Коррекция дозы в случае одновременного применения с другими лекарственными препаратами
Если поддерживающая доза вориконазола повышена до 5 мг/кг внутривенно два раза в сутки, совместно с ним могут быть назначены рифабутин или фенитоин.
Если поддерживающая доза вориконазола увеличена до 400 мг каждые 12 часов, а доза эфавиренза снижена на 50 %, то есть до 300 мг один раз в сутки, совместно с вориконазолом может быть назначен эфавиренз. После отмены терапии вориконазолом прием эфавиренза возобновляют в начальной дозе.
Применение у пожилых людей
Коррекция дозы у пожилых пациентов не требуется.
Применение у больных с нарушением функции почек
У больных с умеренным или тяжелым нарушением функции почек (клиренс креатинина < 50 мл/мин) происходит накопление вспомогательного компонента препарата — сульфобутилового эфира бета — циклодекстрина (SBECD). Таким больным Вифенд® следует назначать перорально, за исключением тех случаев, когда соотношение риска и пользы оправдывает его внутривенное введение. В подобных ситуациях необходимо регулярно контролировать уровни креатинина в сыворотке крови; в случае его повышения следует обсудить возможность перехода к пероральному приему Вифенда®.
Вориконазол выводится в ходе гемодиализа с клиренсом 121 мл/мин.
Четырехчасовой сеанс гемодиализа не приводит к выведению значительной части дозы вориконазола и не требует ее коррекции. Вспомогательное вещество Вифенда® для внутривенного введения SBECD выводится в ходе гемодиализа с клиренсом 55 мл/мин.
Применение у больных с нарушением функции печени
У больных с легким или умеренным циррозом печени (класс А и В по классификации Чайлда — Пью) рекомендуется назначать cтандартную насыщающую дозу Вифенда®, а поддерживающую дозу снижать в 2 раза.
Вифенд® не изучался у пациентов с тяжелым хроническим циррозом печени (класс С по классификации Чайлда — Пью).
Данные по безопасности Вифенда® у пациентов с отклонением от нормы биохимических показателей функции печени (уровнями аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), щелочной фосфатазы (ЩФ) или общего билирубина более чем в 5 раз превосходящими верхнюю границу нормы) представлены в ограниченном объеме.
Применение Вифенда® сопровождалось повышением биохимических показателей функции печени и клиническими признаками поражения печени, например, желтухой, и поэтому больным с выраженным нарушением функции печени Вифенд® следует назначать только в тех случаях, когда ожидаемая польза превышает возможный риск.
У больных с тяжелым нарушением функции печени лечение необходимо проводить под постоянным контролем с целью выявления признаков токсичности препарата.
Побочные действия
При применении Вифенда® зарегистрированы нежелательные эффекты, которые были классифицированы по частоте их проявления следующим образом: очень часто ( 1/10), часто (от ≥ 1/100 до < 1/10), нечасто (от ≥ 1/1000 до < 1/100), редко (от ≥ 1/10 000 до < 1/1000) и неизвестно (невозможно определить по имеющимся данным).
Очень часто
— нарушения зрения (включая нечеткость зрения, хроматопсию и светобоязнь)
— респираторный дистресс
— сыпь
— абдоминальная боль, тошнота, рвота, диарея
— головная боль
— периферический отек
— пирексия
— отклонение от нормы биохимических показателей функции печени (включая АСТ, АЛТ, щелочную фосфатазу, гамма — глутамилтранспептидазу (ГГТ), лактатдегидрогеназу (ЛДГ), билирубин)
Часто
— гастроэнтерит, синусит, гингивит
— агранулоцитоз, тромбоцитопения, анемия, панцитопения
— гиперчувствительность
— судороги, головокружение, тремор, парестезия, гипертонус, сонливость, обморок
— гипогликемия, гипокалиемия, гипонатриемия
— галлюцинации, спутанность сознания, депрессия, возбуждение, тревожность, бессоница
— артериальная гипотензия, флебит
— острый респираторный дистресс — синдром, отек легких
— зуд, макулопапулезная сыпь, алопеция, эксфолиативный дерматит, эритема
— боль в спине
— боль в груди, отек лица,общая слабость, озноб, гриппоподобное заболевание
— повышение уровня креатинина в крови
— кровоизлияние в сетчатку
— брадикардия, тахикардия, наджелудочковая аритмия
— диспепсия, запор, воспалительные процессы в области губ
— желтуха, холестатическая желтуха, гепатит
— острая почечная недостаточность, гематурия
Нечасто
— псевдомембранозный колит, лимфангит
— диссеминированное внутрисосудистое свертывание крови, недостаточность красного костного мозга, лимфаденопатия, эозинофилия, лейкопения
— анафилактоидная реакция
— недостаточность коры надпочечников, гипотиреоз
— отек головного мозга, энцефалопатия, экстрапирамидное расстройство, периферическая нейропатия, атаксия, гипоэстезия, дисгевзия, нистагм
— окулогирный криз, поражение зрительного нерва (включая неврит зрительного нерва), отек диска зрительного нерва, склерит, блефарит, диплопия
— тугоухость, вертиго, шум/звон в ушах
— фибрилляция желудочков, желудочковая экстрасистолия, наджелудочковая тахикардия, желудочковая тахикардия
— тромбофлебит
— панкреатит, дуоденит, глоссит, припухлость языка
— печеночная недостаточность, гепатомегалия, холецистит, холелитиаз
— токсический эпидермальный некролиз, синдром Стивенса — Джонсона, полиморфная эритема, ангионевротический отек, псориаз, крапивница, аллергический дерматит, фототоксичность, макулезная сыпь, папулезная сыпь, пурпура, экзема
— артрит
— некроз почечных канальцев, протеинурия, нефрит
— реакция в месте инъекции
— удлинение интервала QTс на электрокардиограмме, повышение уровня мочевины в крови, повышение уровня холестерина в крови
Редко
— гипертиреоз
— синдром Гийена — Барре, печеночная энцефалопатия
— помутнение роговицы, атрофия зрительного нерва
— полная атриовентрикулярная блокада, блокада ножки пучка Гиса,
многоформная желудочковая пароксизмальная тахикардия типа “пируэт”, узловой ритм
— псевдопорфирия, локальная лекарственная сыпь
Неизвестно
— кожная красная волчанка*
— плоскоклеточная карцинома*
— периостит*
* Нежелательные эффекты, выявленные во время пострегистрационного применения.
Сообщение о подозреваемых нежелательных эффектах
Сообщение сведений о подозреваемых нежелательных эффектах, выявленных после регистрации лекарственного средства, имеет большое значение. Это позволяет продолжать мониторинг соотношения пользы и риска лекарственного средства. Медицинских работников просят сообщать о любых предполагаемых нежелательных реакциях.
Описание отдельных нежелательных реакций
Нарушения зрения
В рамках клинических исследований очень частыми нежелательными явлениями, связанными с вориконазолом, были нарушения зрения. В рамках терапевтических исследований очень частыми нежелательными явлениями, связанными с вориконазолом, были нарушения зрения. В этих исследованиях как при кратковременном, так и при длительном лечении примерно у 21 % пациентов наблюдалось изменение/повышение зрительного восприятия, нечеткое зрение, изменение цветовосприятия или светобоязнь. Эти зрительные нарушения имели преходящий характер и были полностью обратимы, самостоятельно разрешались в большинстве случаев в течение 60 минут и не оставляли после себя каких — либо клинических значимых последствий в отдаленном периоде. При повторном применении вориконазола отмечалось ослабление их выраженности. Нарушения зрения, как правило, были легко выражены, редко требовали прекращения лечения и не приводили к каким — либо последствиям в отдаленном периоде. Нарушения зрения могут быть обусловлены более высокими концентрациями препарата в плазме крови и/или более высокими дозами.
Механизм развития зрительных нарушений неизвестен, хотя, вероятнее всего, их возникновение связано с действием препарата на сетчатку. При изучении влияния вориконазола на функцию сетчатки в исследовании с участием здоровых добровольцев было выявлено снижение амплитуды волн на электроретинограмме (ЭРГ) под действием вориконазола. С помощью ЭРГ измеряют электрический ток в сетчатке. Изменения на ЭРГ не прогрессировали при продолжении терапии в течение 29 дней и полностью исчезали после отмены вориконазола.
В период пострегистрационного применения сообщалось о случаях продолжительных нежелательных явлений со стороны органа зрения.
Кожные реакции
У пациентов, получавших вориконазол в клинических исследованиях, часто отмечались кожные реакции, однако эти пациенты имели серьезные основные заболевания и одновременно принимали другие лекарственные средства. В большинстве случаев сыпь имела легкую или умеренную выраженность. В редких случаях при лечении Вифендом® развивались серьезные кожные реакции, включая синдром Стивенса — Джонсона, токсический эпидермальный некролиз и многоформную эритему.
При появлении сыпи за пациентом следует вести тщательное наблюдение и отменить Вифенд® при прогрессировании поражения кожи. Сообщалось о реакциях светочувствительности, особенно при длительной терапии.
Сообщалось о случаях плоскоклеточного рака кожи у пациентов, получавших Вифенд® в течение длительного времени; механизм возникновения опухоли неизвестен.
Биохимические показатели функции печени
Клинически значимые отклонения от нормы уровней трансаминаз в программе клинического изучения вориконазола наблюдались в общем у 13,5% (258 из 1918) получавших препарат пациентов. Отклонения от нормы биохимических показателей функции печени могут быть связаны с более высокими концентрациями препарата в плазме крови и/или более высокими дозами. В большинстве случаев биохимические показатели функции печени нормализовывались либо при продолжении лечения без изменения дозы, либо после коррекции дозы, в том числе после прекращения терапии. При применении вориконазола имели место нечастые случаи серьезной гепатотоксичности у пациентов с другими серьезными основными заболеваниями. Гепатотоксичность проявлялась в виде желтухи, а также редко в форме гепатита и печеночной недостаточности со смертельным исходом.
Реакции на инфузию
При внутривенном введении вориконазола здоровым добровольцам во время инфузии наблюдались анафилактоидные реакции, включая приливы, лихорадку, потливость, тахикардию, чувство стеснения в груди, одышку, обморочное состояние, тошноту, кожный зуд и сыпь. Эти симптомы появлялись сразу после начала инфузии.
Профилактика побочных эффектов
В ходе открытого сравнительного многоцентрового исследования для сравнения вориконазола и итраконазола как средств первичной профилактики у взрослых и подростков, реципиентов аллогенных ТГСК, ранее не инфицированных подтвержденной или подозреваемой ИГИ, окончательная отмена препарата по причине побочных эффектов была зарегистрирована у 39,3 % пациентов в группе вориконазола по сравнению с 39,6 % пациентов в группе итраконазола. Нежелательные явления со стороны печени, возникшие после начала лечения и требовавшие окончательной отмены препарата исследования, наблюдались у 50 пациентов (21,4 %), получавших вориконазол, и у 18 пациентов (7,1 %), получавших итраконазол.
Пациенты детского возраста
Безопасность вориконазола изучалась у 285 детей в возрасте от 2 до < 12 лет, получавших вориконазол в исследованиях по изучению фармакокинетики (127 детей) и в программах применения незарегистрированного препарата при неэффективности других методов лечения (158 детей). Профиль нежелательных реакций у этих 285 пациентов детского возраста соответствовал профилю нежелательных реакций у взрослых. Данные пострегистрационного наблюдения указывают на то, что у детей кожные реакции (особенно эритема) могут встречаться чаще, чем у взрослых. У 22 пациентов младше 2 лет, получавших вориконазол в программе применения незарегистрированного препарата при неэффективности других методов лечения, наблюдались следующие нежелательные реакции (для которых не может быть исключена связь с вориконазолом): реакция светочувствительности (1), аритмия (1), панкреатит (1), повышение уровня билирубина в крови (1), повышение уровня печеночных ферментов (1), сыпь (1) и отек диска зрительного нерва (1). В пострегистрационном периоде сообщалось о случаях панкреатита у детей.
Противопоказания
— гиперчувствительность к вориконазолу или любым компонентам
препарата
— одновременное применение с субстратами CYP3A4 (терфенадин, астемизол, цизаприда, пимозид или хинидин)
— одновременное применение с сиролимусом
— одновременное применение с рифампицином, карбамазепином и фенобарбиталом
— одновременное применение с эфавирензом в дозах 400 мг или выше один раз в сутки
— одновременное применение с высокими дозами ритонавира в дозах 400 мг и выше два раза в день
— одновременное применение с алкалоидами спорыньи, являющимися субстратами CYP3A4 (эрготамин, дигидроэрготамин)
— одновременное применение с препаратами зверобоя
— детский возраст до 2 — х лет
Лекарственные взаимодействия
Вориконазол метаболизируется под действием изоферментов цитохрома Р — 450 (CYP2C19, CYP2C9 и CYP3A4) и ингибирует их активность. Ингибиторы или индукторы этих изоферментов могут вызвать, соответственно, повышение или снижение концентраций вориконазола в плазме крови, а также существует вероятность повышения вориконазолом плазменных концентраций веществ, метаболизируемых этими изоферментами цитохрома Р — 450.
Вориконазол следует с осторожностью применять с лекарственными средствами, способными удлинять интервал QTс, так как в редких случаях это может приводить к возникновению многоформной желудочковой пароксизмальной тахикардии. Также противопоказано применение вориконазола вместе с веществами, метаболизируемыми изоферментом CYP3A4 (куда относятся некоторые антигистаминные препараты, хинидин, цизаприд, пимозид), концентрации которых в плазме крови он может увеличивать.
Астемизол, цизаприд, пимозид, хинидин и терфенадин (субстраты CYP3A4)
Cоответствующие исследования не проводились. Но повышенные концентрации данных лекарственных средств в плазме крови могут привести к удлинению интервала QTс и, в редких случаях, к возникновению многоформной желудочковой пароксизмальной тахикардии типа “пируэт”. Одновременное их применение противопоказано.
Карбамазепин и барбитураты длительного действия (например, фенобарбитал, мефобарбитал) (мощные индукторы CYP450)
Cоответствующие исследования не проводились. Но карбамазепин и барбитураты длительного действия значительно снижают концентрации вориконазола в плазме крови. Одновременное их применение противопоказано.
Эфавиренз (ингибитор ненуклеозидной обратной транскриптазы (индуктор CYP450; ингибитор и субстрат CYP3A4))
Одновременное применение стандартных доз вориконазола с эфавирензом (400 мг один раз в сутки или выше) противопоказано, поскольку в этих дозах эфавиренз значительно снижает концентрации вориконазола в плазме крови у здоровых пациентов. Вориконазол также значительно повышает концентрации эфавиренза в плазме крови. У здоровых лиц эфавиренз (400 мг один раз в сутки) снижает Cmax и площадь под фармакокинетической кривой на протяжении интервала времени между введением двух доз (AUC) вориконазола (200 мг два раза в сутки*) на 61 % и 77 % соответственно. Вифенд® (200 мг два раза в сутки*) повышает Cmax и AUC эфавиренза (400 мг один раз в сутки) на 38 % и 44 %, соответственно у тех же лиц.
После одновременного назначения Вифенда® (400 мг два раза в сутки*) с эфавирензом (300 мг один раз в сутки) у здоровых лиц AUC вориконазола снижается на 7 % и Cmax повышается на 23 %, по сравнению с терапией Вифендом® 200 мг два раза в сутки. AUC эфавиренза повышается на 17 % и Cmax эквивалентна при сравнении с терапией эфавирензом 600 мг один раз в сутки.
Вифенд® может применяться совместно с эфавирензом, если поддерживающая доза вориконазола повышена до 400 мг два раза в сутки, а доза эфавиренза снижена до 300 мг один раз в сутки. После прекращения терапии вориконазолом возвращаются к применению эфавиренза в начальной дозе.
Алкалоиды спорыньи (например, эрготамин и дигидроэрготамин) (субстраты CYP3A4)
Cоответствующие исследования не проводились. Однако вориконазол может приводить к повышению концентраций алкалоидов спорыньи в плазме крови и, как следствие, к эрготизму. Одновременное их применение противопоказано.
Рифабутин (сильный индуктор CYP450)
Рифабутин (300 мг один раз в сутки) снижает Cmax и AUC вориконазола (200 мг два раза в сутки) на 69 % и 78 % соответственно. При одновременном применении рифабутина (300 мг один раз в сутки) с вориконазолом (350 мг два раза в сутки*) Cmax и AUC вориконазола снижается на 4 % и 32 % соответственно по сравнению с вориконазолом в дозе 200 мг два раза в сутки.
При применении Вифенда® в дозе 400 мг два раза в сутки* и рифабутина в дозе 300 мг один раз в сутки Cmax и AUC вориконазола, соответственно, на 104 % и 87 % выше, чем при терапии Вифендом® в дозе 200 мг два раза в сутки. Вифенд® в дозе 400 мг два раза в сутки* повышает Cmax и AUC рифабутина на 195 % и 331 % соответственно. Если ожидаемая польза от лечения перевешивает риск, рифабутин можно применять одновременно с Вифендом®. Поддерживающая доза вориконазола может быть увеличена до 5 мг/кг внутривенно два раза в сутки.
При одновременном применении рифабутина и вориконазола рекомендуется тщательный контроль показателей общего анализа крови и нежелательных реакций на рифабутин (например, увеита).
Рифампицин (мощный индуктор CYP450)
Рифампицин (600 мг один раз в сутки) снижает Cmax и AUC вориконазола на 93 % и 96 % соответственно. Одновременное применение вориконазола и рифампицина противопоказано.
Ритонавир (ингибитор протеазы) (мощный индуктор CYP450; ингибитор и субстрат CYP3A4)
Ритонавир в дозе 400 мг два раза в сутки снижает Cmax и AUC вориконазола на 66 % и 82 % соответственно, Cmax и AUC ритонавира при этом не меняется. Одновременное применение вориконазола и высоких доз ритонавира (400 мг и выше два раза в сутки) противопоказано.
Ритонавир в дозе 100 мг два раза в сутки* снижает Cmax и AUC вориконазола на 24 % и 39 % соответственно, а Cmax и AUC ритонавира снижается на 25 % и 13 %. Одновременного применения вориконазола и ритонавира в низких дозах (100 мг два раза в сутки) следует избегать, за исключением тех случаев, когда соотношение пользы и риска оправдывает применение вориконазола.
Препараты зверобоя (индукторы CYP450; индукторы P — гликопротеина)
По данным одного независимого исследования при применении препаратов зверобоя (300 мг три раза в сутки) и вориконазола (однократно 400 мг) AUC0- вориконазола снижается на 59 %. Одновременное их применение противопоказано.
Эверолимус (субстрат CYP3A4, субстрат P — гликопротеина)
Несмотря на то, что соответствующие исследования не проводились, вориконазол, вероятно, может существенно увеличивать концентрации эверолимуса в плазме крови. Одновременное применение эверолимуса и вориконазола не рекомендуется, так как вориконазол значительно повышает концентрации эверолимуса.
Флуконазол (ингибитор CYP2C9, CYP2C19 и CYP3A4)
При применении флуконазола (200 мг один раз в сутки) Cmax и AUC вориконазола повышается на 57 % и 79 %, а данные Cmax и AUC флуконазола не установлены. Неизвестно, какое снижение дозы и/или частоты применения вориконазола и флуконазола привело бы к исчезновению данного эффекта. Рекомендуется провести мониторинг нежелательных явлений, связанных с применением Вифенда®, если вориконазол используется непосредственно после флуконазола.
Фенитоин (субстрат CYP2C9 и мощный индуктор CYP450)
Одновременного применения Вифенда® и фенитоина следует избегать за исключением тех случаев, когда ожидаемая польза превышает возможный риск. Рекомендуется тщательный контроль уровня фенитоина в плазме крови.
Фенитоин (300 мг один раз в сутки) снижает Cmax и AUC вориконазола на 49 % и 69 % соответственно. При одновременном применении фенитоина (300 мг один раз в сутки) и Вифенда® (400 мг два раза в сутки*) Cmax и AUC фенитоина повышается на 67 % и 81 % соответственно, Cmax и AUC вориконазола при этом повышается на 34 % и 39 %.
Фенитоин можно применять совместно с Вифендом®, если поддерживающая доза последнего увеличена до 5 мг/кг внутривенно два раза в сутки.
Антикоагулянты
Варфарин (субстрат CYP2C9)
Одновременное применение Вифенда® (300 мг 2 раза в сутки) с варфарином (30 мг однократно) сопровождалось максимальным увеличением протромбинового времени (приблизительно в 2 раза).
Другие пероральные кумарины (например, фенпрокумон, аценокумарол) (субстраты CYP2C9 и CYP3A4)
Cоответствующие исследования не проводились. Однако Вифенд® может вызвать повышение концентраций кумаринов в плазме крови, что может привести к увеличению протромбинового времени.
Рекомендуется тщательный мониторинг протромбинового времени или других соответствующих показателей коагуляции; также необходимо соответствующим образом подбирать дозы антикоагулянтов.
Бензодиазепины (субстраты CYP3A4) (например, мидазолам, триазолам, алпразолам)
Cоответствующие исследования не проводились. Но вориконазол, вероятно, повышает плазменные концентрации бензодиазепинов, метаболизируемых CYP3A4, что, в свою очередь, может привести к длительному седативному эффекту. При одновременном применении этих препаратов рекомендуется обсудить целесообразность снижения дозы бензодиазепинов.
Иммунодепрессанты (субстраты CYP3A4)
Сиролимус
По данным одного независимого исследования при применении сиролимуса в разовой дозе 2 мг Cmax и площадь под фармакокинетической кривой с момента времени 0 до бесконечности (AUC0-) сиролимуса выше в 6,6 раз и 11 раз, соответственно. Одновременное их применение противопоказано.
Циклоспорин
Циклоспорин, у реципиентов со стабильной функцией почечного трансплантата, получающих циклоспорин на протяжении длительного времени повышает Cmax и AUC циклоспорина на 13 % и 70 % соответственно. При назначении Вифенда® пациентам, получающим циклоспорин, рекомендуется уменьшить дозу циклоспорина вдвое и контролировать его уровни в плазме крови. Повышение уровней циклоспорина сопровождается нефротоксичностью. После отмены Вифенда® необходимо контролировать уровни циклоспорина и при необходимости увеличить его дозу.
Такролимус
Вориконазол повышает Cmax и площадь под фармакокинетической кривой с момента времени 0 до первой определяемой концентрации (AUCt) такролимуса (0,1 мг/кг однократно) на 117 % и 221 % соответственно. При назначении Вифенда® больным, получающим такролимус, рекомендуется уменьшить дозу последнего на две трети и контролировать его уровни в плазме крови. Повышение уровня такролимуса сопровождается нефротоксичностью. После отмены Вифенда® необходимо контролировать уровни такролимуса и при необходимости увеличить его дозу.
Опиаты длительного действия (субстраты CYP3A4)
Оксикодон
По данным одного независимого исследования при применении оксикодона в разовой дозе 10 мг Cmax и AUC0- оксикодона выше в 1,7 раза и 3,6 раза, соответственно. Следует рассмотреть возможность снижения дозы оксикодона и других опиатов длительного действия, метаболизируемых CYP3A4 (например, гидрокодона). Может потребоваться частый контроль нежелательных явлений, возникающих при применении опиатов.
Метадон (субстрат CYP3A4)
При применении метадона (32 — 100 мг один раз в сутки) Cmax и AUC R — метадона (активного) выше на 31 % и 47 %, Cmax и AUC S — метадона выше на 65 % и 103 %. Рекомендуется частый контроль нежелательных явлений и выявление признаков токсичности метадона, включая удлинение интервала QTс. Может потребоваться снижение дозы метадона.
Нестероидные противовоспалительные средства (НПВС) (субстраты CYP2C9)
Ибупрофен
При применении ибупрофена (400 мг однократно) Cmax и AUC0- S — ибупрофена выше на 20% и 100%, соответственно.
Диклофенак
При применении диклофенака (50 мг однократно) Cmax и AUC0- диклофенака выше на 114% и 78%, соответственно.
Рекомендуется проведение частого мониторинга нежелательных явлений и признаков токсичности, вызванных НПВС. Может потребоваться снижение дозы НПВС.
Омепразол (ингибитор CYP2C19; субстрат CYP2C19 и CYP3A4)
Омепразол (40 мг один раз в сутки*) повышает Cmax и AUC вориконазола на 15 % и 41 % соответственно и повышает Cmax и AUC омепразола на 116 % и 280 %, соответственно. Коррекция дозы Вифенда® не рекомендуется. При назначении Вифенда® больным, получающим омепразол в дозах 40 мг или выше, дозу последнего рекомендуется снизить вдвое. Вифенд® может также ингибировать метаболизм других ингибиторов протонного насоса, которые являются субстратами CYP2C19, что может привести к повышению концентраций этих лекарственных средств в плазме крови.
Пероральные контрацептивы* (субстраты CYP3A4; ингибиторы CYP2C19)
Норэтистерон и этинилэстрадиол
Одновременное назначение Вифенда® и орального контрацептива (1 мг норэтистерона и 0,035 мг этинилэстрадиола один раз в сутки) у здоровых женщин приводит к повышению Cmax и AUC этинилэстрадиола (36 % и 61 % соответственно), норэтистерона (15 % и 53 % соответственно) и вориконазола (14 % и 46 % соответственно). Необходим мониторинг нежелательных явлений, связанных с применением вориконазола и оральных контрацептивов.
Опиаты короткого действия (субстраты CYP3A4)
Альфетанил
По данным одного независимого исследования одновременное применение Вифенда® и альфетанила (20 мкг/кг однократно при одновременном применении с налоксоном) повышает AUC0- альфетанила в 6 раз.
Фентанил
По данным одного независимого исследования при применении фентанила в разовой дозе 5 мкг/кг AUC0- фентанила выше в 1,34 раза.
Следует рассмотреть возможность снижения дозы альфентанила, фентанила и других опиатов короткого действия, подобных по структуре альфентанилу и метаболизируемых CYP3A4 (например, суфентанила). Рекомендуется проводить расширенный и частый контроль с целью выявления признаков угнетения дыхательной функции и других нежелательных явлений, связанных с применением опиатов.
Статины (субстраты CYP3A4)
Ловастатин
Cоответствующие клинические исследования не проводились. Вориконазол, вероятно, повышает плазменные концентрации статинов, метаболизируемых CYP3A4, что, в свою очередь, может привести к рабдомиолизу. Следует рассмотреть необходимость снижения дозы статинов.
Препараты сульфонилмочевины (субстраты CYP2C9) (например, толбутамид, глипизид и глибурид)
Cоответствующие клинические исследования не проводились. Вориконазол, вероятно, повышает концентрации препаратов сульфонилмочевины в плазме крови и вызывает гипогликемию. При одновременном их применении необходимо тщательно контролировать уровни глюкозы в крови, а также следует рассмотреть необходимость снижения дозы препаратов сульфонилмочевины.
Алкалоиды барвинка (субстраты CYP3A4) (например, винкристин и винбластин)
Cоответствующие исследования не проводились. Вориконазол, вероятно, повышает концентрации алкалоидов барвинка в плазме крови и вызывает нейротоксичность. Рекомендуется обсудить целесообразность снижения дозы алкалоидов барвинка.
Другие ингибиторы ВИЧ протеазы (субстраты и ингибиторы CYP3A4) (например, саквинавир, ампренавир и нелфинавир)*
Cоответствующие клинические исследования не проводились. Результаты исследований in vitro указывают на то, что вориконазол может ингибировать метаболизм ингибиторов ВИЧ протеазы, а ингибиторы ВИЧ протеазы, в свою очередь, могут ингибировать метаболизм вориконазола. Может потребоваться тщательное наблюдение с целью выявления признаков лекарственной токсичности и/или отсутствия эффективности препарата, а также коррекция дозы.
Другие ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ) (субстраты CYP3A4, ингибиторы или индукторы CYP450) (например, делавирдин, невирапин)*
Cоответствующие клинические исследования не проводились. Результаты исследований in vitro указывают на то, что ННИОТ могут ингибировать метаболизм вориконазола, а вориконазол может ингибировать метаболизм ННИОТ.
Данные о влиянии эфавиренза на вориконазол позволяют сделать вывод о том, что метаболизм вориконазола может усиливаться под действием ННИОТ. Может потребоваться тщательное наблюдение с целью выявления признаков лекарственной токсичности и/или отсутствия эффективности препарата, а также коррекция дозы.
Циметидин (неспецифический ингибитор CYP450, повышает pH желудочного содержимого)
Циметидин в дозе 400 мг два раза в сутки повышает Cmax и AUC вориконазола на 18 % и 23 %, соответственно. При этом коррекция дозы не требуется.
Дигоксин (субстрат P — гликопротеина)
Вифенд® не оказывает существенного влияния на Cmax и AUC дигоксина (0,25 мг один раз в сутки). Коррекция дозы не требуется.
Индинавир (ингибитор и субстрат CYP3A4)
Индинавир (800 мг три раза в сутки) не оказывает существенного влияния на Cmax и AUC вориконазола. Вифенд® существенно не влияет на Cmax и AUC индинавира (800 мг 3 раза в сутки). Коррекция дозы не требуется.
Макролидные антибиотики
Эритромицин (ингибитор CYP3A4)
Эритромицин (1 г два раза в сутки) и азитромицин (500 мг один раз в сутки) не оказывают существенного влияния на Cmax и AUC вориконазола. Воздействие вориконазола на эритромицин или азитромицин неизвестно. Коррекция дозы не требуется.
Микофеноловая кислота (субстрат УДФ — глюкуронилтрансферазы)
Вифенд® не оказывает влияния на Cmax и AUCt микофеноловой кислоты (1 г однократно). Коррекция дозы не требуется.
Преднизолон (субстрат CYP3A4)
Вифенд® повышает Cmax и AUC0- преднизолона (60 мг однократно) на 11 % и 34 % соответственно. Коррекция дозы не рекомендуется.
Ранитидин (повышает pH желудочного содержимого)
Ранитидин (150 мг два раза в сутки) не оказывает влияния на Cmax и AUC вориконазола. Коррекция дозы не рекомендуется.
* указывает на двустороннее взаимодействие
Особые указания
Гиперчувствительность
Вифенд® с осторожностью должен назначаться больным с гиперчувствительностью к другим азольным препаратам.
Продолжительность терапии
Длительность лечения Вифенда® для внутривенного введения не должна превышать 6 месяцев.
Сердечно — сосудистые нарушения
Применение Вифенда® связано с удлинением интервала QTс на электрокардиограмме, что сопровождается редкими случаями многоформной желудочковой пароксизмальной тахикардии типа “пируэт” у пациентов с факторами риска, такими как кардиотоксическая химиотерапия в анамнезе, кардиомиопатия, гипокалиемия и сопутствующая терапия препаратами, которые могли способствовать развитию данного осложнения.
Пациентам со следующими потенциально проаритмическими состояниями Вифенд® должен назначаться с осторожностью:
— врожденное или приобретенное удлинение интервала QTс
— кардиомиопатия, в особенности при наличии сердечной недостаточности
— синусовая брадикардия
— существующие аритмии с клиническими симптомами
— одновременное применение лекарственных средств с установленной способностью удлинять интервал QTс. При необходимости до начала и во время терапии вориконазолом следует выявлять и корректировать такие электролитные нарушения как гипокалиемия, гипомагниемия, гипокальциемия.
Было проведено исследование с участием здоровых добровольцев, в котором оценивали влияние на длительность интервала QTc однократных доз вориконазола вплоть до доз, в 4 раза превышающих стандартные суточные дозы. Случаев удлинения интервала выше потенциально клинически значимого порогового значения 500 мсек выявлено не было.
Реакции на инфузию
При применении Вифенда® наблюдались реакции на инфузию, главным образом приливы и тошнота. С учетом степени тяжести симптомов следует рассмотреть возможность прекращения лечения.
Гепатотоксичность
При лечении Вифендом® наблюдаются нечастые случаи серьезных реакций со стороны печени (включая клинически проявляющийся гепатит, холестаз и фульминантную печеночную недостаточность, в том числе с летальным исходом). Нежелательные явления со стороны печени в основном наблюдаются у пациентов с серьезными основными заболеваниями (главным образом, гемобластозами). У пациентов, не имеющих других выявленных факторов риска, наблюдаются преходящие реакции со стороны печени, включая гепатит и желтуху. Функция печени обычно восстанавливается после прекращения терапии.
Мониторинг функции печени
За пациентами, получающими Вифенд®, следует вести тщательное наблюдение с целью выявления признаков гепатотоксичности. Клиническое наблюдение должно включать лабораторную оценку функции печени (в частности, определение уровня АСТ и АЛТ) в начале лечения Вифендом® и по меньшей мере еженедельно в течение первого месяца терапии. Длительность лечения должна быть максимально короткой, однако, если после оценки пользы и риска терапия продолжается, при отсутствии изменений биохимических показателей функции печени частота обследования может быть уменьшена до одного раза в месяц.
При существенном повышении биохимических показателей функции печени Вифенд® следует отменить, если только по заключению врача соотношение риска и пользы лечения у пациента не оправдывает продолжение его приема.
Мониторинг функции печени следует осуществлять как у детей, так и у взрослых.
Нежелательные явления со стороны зрения
Сообщалось о случаях длительно сохранявшихся нежелательных реакций со стороны органа зрения, включая нечеткое зрение, неврит зрительного нерва и отек диска зрительного нерва.
Нежелательные явления со стороны почек
У тяжелых больных, получающих Вифенд®, наблюдали случаи развития острой почечной недостаточности. Пациенты, получающие вориконазол, могут принимать и другие нефротоксичные лекарственные средства и иметь сопутствующие заболевания, что может приводить к снижению функции почек.
Мониторинг функции почек
Пациентов следует наблюдать с целью выявления признаков нарушения функции почек. Для этого необходимо проводить лабораторные исследования, в частности, определять сывороточный уровень креатинина.
Мониторинг функции поджелудочной железы
За пациентами, особенно детского возраста, с факторами риска острого панкреатита (например, химиотерапия в недавнем прошлом, трансплантация гемопоэтических стволовых клеток (ТГСК)) при терапии Вифендом® следует вести тщательное наблюдение. В такой клинической ситуации может рассматриваться возможность контроля уровня сывороточной амилазы или липазы.
Нежелательные явления со стороны кожи
У пациентов на фоне лечения Вифендом® редко развивались эксфолиативные кожные реакции, такие как синдром Стивенса — Джонсона. При появлении сыпи за пациентом следует вести тщательное наблюдение и отменить Вифенд® при прогрессировании поражения кожи.
Кроме того, применение Вифенда® сопровождалось развитием фототоксических реакций и псевдопорфирии. При терапии Вифендом® всем пациентам, включая детей, рекомендуется избегать воздействия прямых солнечных лучей и применять защитные меры в виде ношения защитной одежды и использования солнцезащитных средств с высоким коэффициентом защиты от солнечных лучей (SPF).
Длительное лечение
При длительном применении Вифенда® (в целях терапии или профилактики) в течение более 180 дней (6 месяцев) необходимо тщательно оценивать соотношение риска и пользы. В связи с этим, врачам следует рассмотреть целесообразность ограничения продолжительности применения препарата. При длительной терапии Вифендом® сообщалось о развитии следующих тяжелых нежелательных явлений:
Плоскоклеточный рак кожи (ПРК)
Сообщалось о развитии у пациентов ПРК, при этом у некоторых из них в анамнезе наблюдались фототоксические реакции. В случае развития фототоксических реакций следует обратиться за консультацией к врачам других специальностей и направить пациента к дерматологу. Терапию Вифендом® отменяют и назначают альтернативные противогрибковые препараты. Во всех случаях продолжения терапии Вифендом®, несмотря на возникновение поражений, обусловленных фототоксическими реакциями, следует регулярно проводить дерматологическое обследование для раннего выявления и лечения предраковых заболеваний кожи. При выявлении предраковых заболеваний или плоскоклеточного рака кожи Вифенд® следует отменить.
Неинфекционный периостит с повышением уровня фтористых соединений и щелочной фосфатазы
У пациентов, перенесших трансплантацию, сообщалось о развитии неинфекционного периостита с повышением уровня фтористых соединений и щелочной фосфатазы. Если у пациента развивается боли в костях и рентгенологические признаки периостита после консультации с врачами другого профиля, терапию Вифендом® прекращают.
Пациенты детского возраста
Безопасность и эффективность препарата у детей младше 2 — х лет не установлена. Вориконазол назначают детям в возрасте от двух лет и старше. Следует контролировать функцию печени у детей также как и у взрослых. При пероральном применении биодоступность препарата у детей в возрасте от 2 до < 12 лет с мальабсорбцией и очень низкой относительно возрастной нормы массой тела может быть снижена. В таких случаях рекомендуется внутривенное введение вориконазола.
Частота развития реакций фототоксичности у детей выше. Учитывая возможность развития ПРК, в этой популяции пациентов оправдано применение строгих мер по защите от воздействия ультрафиолетового облучения. При развитии у детей явлений, связанных с фотостарением кожи, таких как лентигиноз или веснушки, даже после прекращения терапии рекомендуется избегать воздействия ультрафиолетового облучения и продолжать последующее дерматологическое наблюдение.
Профилактика побочных эффектов
При возникновении связанных с применением Вифенда® нежелательных явлений (гепатотоксичность, тяжелые кожные реакции, включая фототоксичность и ПРК, тяжелые или длительные нарушения зрения и периостит) следует рассмотреть целесообразность отмены вориконазола и применения альтернативных противогрибковых препаратов.
Содержание натрия
В каждом флаконе Вифенда® содержится 217,6 мг натрия. Это следует учитывать при назначении препарата пациентам, соблюдающим диету с ограничением употребления натрия.
Беременность и период лактации
Адекватной информации о применении Вифенда® у беременных женщин нет. Вифенд® не следует применять у беременных женщин за исключением тех случаев, когда ожидаемая польза для матери явно перевешивает возможный риск для плода. Выведение Вифенда® с грудным молоком не изучалось.
В начале лечения Вифендом® кормление грудью необходимо прекратить.
Женщины репродуктивного возраста во время лечения должны постоянно пользоваться эффективными методами контрацепции.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Вифенд® может вызвать преходящие и обратимые нарушения зрения, включая нечеткость зрения, нарушение/усиление зрительного восприятия и/или светобоязнь. При наличии таких симптомов пациенты должны избегать выполнения потенциально опасных действий как, например, управления автотранспортными средствами или работы с механизмами.
Передозировка
Симптомы: усиление побочных реакций.
Лечение: антидот Вифенда® неизвестен. В случае передозировки показана симптоматическая и поддерживающая терапия.
Вифенд® выводится при гемодиализе с клиренсом 121 мл/мин. Сульфобутиловый эфир бета — циклодекстрина натрия (SBECD) также диализируется с клиренсом 55 мл/мин. В случае передозировки гемодиализ может способствовать выведению вориконазола и SBECD из организма.
Есть сообщения о трех случаях неумышленной передозировки в ходе клинических исследований. Все случаи наблюдались у детей, получивших вориконазол внутривенно в дозе, в пять раз превышавшей рекомендованную. Единственной нежелательной реакцией была светобоязнь длительностью 10 минут.
Форма выпуска и упаковка
Препарат помещают во флаконы из прозрачного бесцветного стекла типа I по ЕФ* вместимостью 30 мл, укупоренные серыми силиконизированными полимерными хлорбутилизопреновыми пробками, обжатые алюминиевыми уплотнительными кольцами с дисками из полипропилена типа «flip — off».
По 1 флакону вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в картонную пачку.
Условия хранения
Хранить при температуре не выше 25 ºС. Приготовленный раствор хранят при температуре от 2 до 8 ºC не более 24 часов.
Хранить в недоступном для детей месте!
Срок хранения
3 года
Не использовать после истечения срока годности.
Условия отпуска из аптек
По рецепту
Производитель
Фармация и Апджон Кампани
7000 Портейдж Роуд
Каламазу, МИ 49001
США
Упаковщик
Фарева Амбуаз
Зона Индустриале, 29 роут дес Индастриес
37530 Поце Сур Циссе
Франция
Владелец регистрационного удостоверения
Пфайзер Эйч Си Пи Корпорэйшн, США
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции (товара):
Представительство компании «Пфайзер Эйч Си Пи Корпорэйшн» (США) г.Алматы, пр. Абылай хана, 141
тел. (727) 272 — 27 — 01, 250 — 09 — 16
факс (727) 272 — 04 — 06
| 013637451477976668_ru.doc | 310 кб |
| 221280661477977823_kz.doc | 342 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники