Generic name: bifidobacterium, lactobacillus, and streptococcus [ BIF-eye-doe-bak-TEER-ee-um, LAK-toe-ba-SIL-us, and-STREP-toe-KOK-us ]
Drug class: Probiotics
What is VSL#3?
VSL#3 is a medical food used as a probiotic, or «friendly bacteria» to maintain a healthy digestive tract (stomach and intestines).
VSL#3 is used in people with irritable bowel syndrome, ulcerative colitis, or an ileal pouch.
Not all uses for VSL#3 have been approved by the FDA. This product should not be used in place of medication prescribed for you by your doctor.
VSL#3 may also be used for purposes not listed in this product guide.
Warnings
Do not use this product without medical advice. Follow all directions on the product label and package. Tell each of your healthcare providers about all your medical conditions, allergies, and all medicines you use.
Before taking this medicine
Before using this product, talk to your healthcare provider. You may not be able to use VSL#3 if you have certain medical conditions.
VSL#3 is available in capsule, tablet, powder, and chewable tablet formulations. Do not use different formulations at the same time without medical advice.
Ask a doctor, pharmacist, or other healthcare provider if it is safe for you to use this product if you have:
-
milk allergy or lactose intolerance; or
-
if you are taking an antibiotic medication.
It is not known whether VSL#3 will harm an unborn baby. Do not use this product without medical advice if you are pregnant.
It is not known whether bifidobacterium, lactobacillus, and streptococcus passes into breast milk or if it could harm a nursing baby. Do not use this product without medical advice if you are breast-feeding a baby.
Do not give any herbal/health supplement to a child without medical advice.
How should I take VSL#3?
Use exactly as directed on the label, or as prescribed by your doctor. Do not use in larger or smaller amounts or for longer than recommended. Your doctor may occasionally change your dose.
Check your product label to see whether you should take this product with or without food.
Mix the oral powder with cold water or a non-carbonated drink or soft food (applesauce, yogurt, ice cream). Eat or drink this mixture right away. Do not save it for later use.
You may also open the capsule and sprinkle the probiotic into a cold drink or cold soft food, following the same directions for the oral powder.
Mix this product only with a cold liquid or soft food.
Call your doctor if your symptoms do not improve, or if they get worse while using VSL#3.
Store this product in the refrigerator, do not freeze. Heat or humidity may affect the live bacteria in this product, making it less effective.
Throw away this product if the expiration date on the label has passed.
If you need to store this product out of a refrigerator, it will keep for up to 2 weeks at room temperature without affecting the live bacteria. Protect the probiotic from heat, humidity, and direct light.
What happens if I miss a dose?
Skip the missed dose if it is almost time for your next scheduled dose. Do not take extra VSL#3 to make up the missed dose.
What happens if I overdose?
Seek emergency medical attention or call the Poison Help line at 1-800-222-1222.
What should I avoid while taking VSL#3?
Do not mix the oral powder with hot liquids or foods.
VSL#3 side effects
Get emergency medical help if you have signs of an allergic reaction: hives; difficult breathing; swelling of your face, lips, tongue, or throat.
Common side effects of VSL#3 may include:
-
stomach bloating or discomfort.
This is not a complete list of side effects and others may occur. Call your doctor for medical advice about side effects. You may report side effects to FDA at 1-800-FDA-1088.
What other drugs will affect VSL#3?
Other drugs may interact with bifidobacterium, lactobacillus, and streptococcus, including prescription and over-the-counter medicines, vitamins, and herbal products. Tell each of your health care providers about all medicines you use now and any medicine you start or stop using.
Further information
Remember, keep this and all other medicines out of the reach of children, never share your medicines with others, and use this medication only for the indication prescribed.
Always consult your healthcare provider to ensure the information displayed on this page applies to your personal circumstances.
Medical Disclaimer
Copyright 1996-2023 Cerner Multum, Inc. Version: 1.02.
Разнообразный
Сочетание различных штаммов бактерий
Саше
Просто растворите в йогурте, соке или воде
Оживленный
450 Миллиардов живых бактерий на саше
Пищевая добавка с молочной кислотой и бифидобактериями
VSL#3 ® содержит 450 миллиардов живых молочнокислых бактерий и
бифидобактерий из 8 различных штаммов.
Состав: мальтоза, 450 миллиардов живых молочнокислых и бифидобактерий*,
кукурузный крахмал, сепаратор: диоксид кремния.
* Стрептококк термофильный, бифидобактерия (B. breve, B. longum**, B. infantis**),
лактобацилли (L. acidophilus, L. plantarum, L. paracasei, L. delbrueckii subsp.
bulgaricus***)
**Недавно переклассифицирован как B. animalis subsp. lactis
***Недавно переклассифицирован как L. helveticus
VSL#3 ® — это пищевая добавка. Пищевые добавки не должны использоваться в качестве замены сбалансированной и разнообразной диеты и здорового образа жизни.
Рекомендации по потреблению
VSL#3 Рекомендации по потреблению
1-2 саше в день. Содержимое пакетика перемешать в йогурте, яблочном соке, воде или другом холодном напитке и немедленно выпить.
Рекомендуемое количество потребления в день не должно быть превышено. В отдельных случаях в первые дни употребления VSL#3 ® может возникать вздутие живота, которое соответствует вполне нормальному питательному внешнему виду.
Состав рекомендуемого количества потребления VSL#3 ® в день 1-2 саше:
1 саше 4,4 г содержит 450 x 109 колониеобразующих единиц (KBE) из 8 различных штаммов бактерий.
2 саше по 8,8 г содержат 900 x 109 колониеобразующие подразделения (КБЭ) из 8 различных штаммов бактерий.
Содержание: 10 саше в коробке.
Этот продукт НЕ содержит сои, клейковины, лактозы или молочных продуктов.
Хранение
Хранить неоткрытым и прохладным (2-8 °C) долговечным до минимального срока годности. При комнатной температуре (макс. 25 °C) VSL#3 ® можно хранить до 7 дней.
Примечание:
Рекомендуемая суточная доза не должна быть превышена,
Хранение:
Хранить в недоступном для детей месте,
Рекомендуется перевозка в термобоксе https://diskontshop,eu/RM-256152/
Роль пробиотиков в гастроэнтерологии
Статьи
Опубликовано в журнале:
«Фарматека» 2007, № 6, С. 18-25
Е.А. Ушкалова
Москва
Рассматриваются возможности применения пробиотиков в гастроэнтерологической практике. Представлен обширный обзор клинических исследований пробиотиков при остром гастроэнтерите, антибиотикоассоциированой диарее, диарее путешественников, хе-ликобактерной инфекции, воспалительных заболеваниях кишечника, синдроме раздраженной кишки и т. д. Преимущества комбинированных пробиотиков обсуждаются на примере препарата Линекс.
Желудочно-кишечный тракт (ЖКТ) человека – место обитания сообщества более 400 видов патогенных и непатогенных бактерий [1], составляющих около 95 % общего количества клеток человеческого организма и находящихся в комплексном взаимодействии [2].
В течение многих десятилетий основное внимание исследователей привлекали патогенные микроорганизмы, играющие важную роль в этиологии различных заболеваний. Интенсивные клинические исследования полезных микроорганизмов – пробиоти-ков, начались лишь в 1990-е гг., хотя самой идее использования непатогенных бактерий в терапевтических целях уже около 100 лет, а первые коммерческие препараты пробиотиков появились в России в середине прошлого века. В последние годы пробиотики вызывают не меньший, если не больший, интерес, чем патогенные бактерии. Это связано, с одной стороны, с современным состоянием антибиотикорезистентности, обусловливающим поиск альтернативных антибиотикам более физиологичных и безопасных средств для профилактики и лечения инфекций, с другой – разработкой новых биотехнологий, позволяющих создавать активные и безопасные препараты пробиотиков.
В настоящее время пробиотикам отводят важное место не только в контроле микробной резистентности [3], но и в качестве стратегических средств альтернативной медицины, направленной на поддержание и восстановление здоровья человека [4]. Наиболее хорошо действие пробиотиков изучено в гастроэнтерологии.
Гастроэнтерит и инфекционная диарея
Гастроэнтерит является основной причиной острой диареи. Его могут вызывать несколько видов вирусов, бактерий или паразитов. У детей наиболее частый возбудитель гастроэнтерита – ротавирус. Специфической терапии при вирусном гастроэнтерите не существует. Антибиотики у этих пациентов не только неэффективны, но могут способствовать ухудшению дисбиоза и затруднять дальнейшее лечение. Регидратационные растворы предупреждают или устраняют последствия обезвоживания, но не позволяют сокращать продолжительность диареи. Поэтому в экспериментальных и клинических исследованиях изучены естественные антагонисты патогенной микрофлоры – пробиотики. Наибольшее количество исследований проведено в педиатрии, а самыми хорошо изученными пробиотическими микроорганизмами являются лактобактерии (табл. 1). В четырех рандомизированных контролируемых исследованиях у взрослых и детей также продемонстрирована способность Enterococcus faecium SF 68 уменьшать длительность эпизода диареи. Эффективность пробиотиков при острой диарее у детей подтверждена и в более поздних рандомизированных плацебо-контролируемых исследованиях [5, 6], а также в мета-анализе 18 исследований, показавшем, что добавление пробиотиков к стандартной регидратационной терапии позволяет уменьшать продолжительность диареи у детей до 5 лет примерно на день [7]. Пробиотики также предотвращают ассоциированное с диареей нарушение питания у детей [8].
Таблица 1.
Исследования, подтверждающие терапевтический или профилактический эффект пробиотиков при остром гастроэнтерите [9]
| Заболевание | Пробиотик | Участники | Источник |
|
Лечение |
|||
| Ротавирусная диарея | Lactobacillus rhamnosus штамм GG | Дети (n = 71) | [10] |
| L. rhamnosus штамм GG | Дети (n = 39) | [11] | |
| L. rhamnosus штамм GG | Дети (n = 49) | [12] | |
| L. rhamnosus штамм GG | Дети (n = 42) | [13] | |
| Lactobacillus casei штамм Shirota | Дети (n = 32) | [14] | |
| Гастроэнтерит | L. rhamnosus штамм GG | Дети (n = 32) | [15] |
| L. rhamnosus штамм GG | Дети (n = 26) | [16] | |
| L. rhamnosus штамм GG | Дети (n = 100) | [17] | |
| L. rhamnosus штамм GG | Дети (n = 123) | [18] | |
| L. rhamnosus штамм GG | Дети (n = 287) | [19] | |
| E. faecium SF68 | Дети (n = 104) | [20] | |
| E. faecium SF68 | Взрослые (n = 56) | [21] | |
| E. faecium SF68 | Взрослые (n = 78) | [22] | |
| E. faecium SF68 | Взрослые (n = 211) | [23] | |
| Йогурт | Дети (n = 112) | * | |
| Saccharomyces boulardii | Дети (n = 38) | [24] | |
| Lactobacillus reuteri | Дети (n = 66) | [25] | |
|
Профилактика |
|||
| Острая диарея или ротавирусная инфекция |
Bifidobacterium bifidum + Streptococcus thermophilus |
Дети (n = 55) | [26] |
* Boudraa G., неопубликованные наблюдения, 1996
Антибиотикоассоциированная диарея и псевдомембранозный колит
Польза профилактического действия пробиотиков в отношении антибиотикоассоциированной диареи продемонстрирована в хорошо спланированных клинических исследованиях (табл. 2) и подтверждена результатами нескольких мета-анализов [27–32].
Таблица 2.
Исследования, подтверждающие способность пробиотиков предотвращать антибиотикоассоциированные кишечные симптомы (преимущественно диарею) [9]
| Антибиотик | Пробиотик | Дизайн и число участников | Частота симптомов | Источник (против плацебо) |
| Ампициллин | Lactobacillus acidophilus + Lactobacillus bulgaricus | Слепое (n = 98) | 8,3 против 21,0 % | [33] |
| Неомицин | L. acidophilus + L. bulgaricus | Открытое (n = 39) | 20 против 42 % | [34] |
| Амоксициллин/клавуланат | L. acidophilus + L. bulgaricus | Открытое (n = 27) | Положительная * | [35] |
| Противотуберкулезные средства | E. faecium SF68 | Открытое (n = 200) | 5 против 18 % | [36] |
| Разные антибиотики | E. faecium SF68 | Слепое (n = 45) | 8,7 против 27,2 % | [22] |
| Эритромицин | Bifidobacterium longum | Слепое (n = 10) | Положительная * | [37] |
| Эритромицин | L. rhamnosus GG | Открытое (n = 16) | Положительная * | [38] |
| Разные антибиотики | L. rhamnosus GG | Открытое (n = 188) | 17 против 48 % | [39] |
| Клиндамицин | B. longum + Lactobacillus | Слепое (n = 10) | Положительная * | [40] |
| Бета-лактамы или тетрациклины | S. boulardii | Слепое (n = 388) | 4,5 против 17,5 % | [41] |
| Разные антибиотики | S. boulardii | Слепое (n = 180) | 9,5 против 21,8 % | [42] |
| Бета-лактамы | S. boulardii | Слепое (n = 193) | 7,2 против 14,6 % | [43] |
* Доля пациентов с антибиотикоассоциированными побочными эффектами не указана.
В двух мета-анализах отношение шансов развития диареи при профилактическом назначении пробиотиков составило по сравнению с плацебо 0,39 и 0,37 [28, 29]. Профилактическое назначение пробиотиков детям, получающим антибиотикотерапию, согласно данным мета-анализа, позволяет предотвращать один случай диареи из семи [32]. Однако профилактический эффект в отношении антибиотикоассоциированной диареи доказан не для всех пробиотиков. В одном из последних мета-анализов показано, что достоверное снижение числа случаев диареи ассоциируется только с применением пробиотиков, содержащих L. rhamnosus GG, S. boulardii или пробиотические комбинации [31].
Среди комбинированных пробиотиков, зарегистрированных в России, в клинических исследованиях продемонстрирована эффективность у взрослых и детей препарата Линекс, содержащего L. acidophilus, Bifidobacterium infantis v. liberorum и нетоксигенный молочнокиcлый Streptococcus (Enterococcus) faecium. Так, в слепом плацебо-контролируемом исследовании с участием 60 взрослых пациентов с диарей, обусловленной длительной противомикробной терапией, или с диареей неустановленной этиологии “очень хороший” эффект (прекращение диареи в первые три дня лечения) зарегистрирован у 80 % пациентов, получавших Линекс, “хороший” эффект (прекращение диареи в течение трех–пяти дней лечения) – у 20 % [44]. Аналогичные результаты получены и в исследовании с участием детей в возрасте до 7 лет. “Отличный” и “очень хороший” эффект Линекса наблюдался у 84,4 % участников [45]. В другом исследовании у детей в возрасте от 6 месяцев до 5 лет также показано, что одновременный прием Линекса с антибиотиками пенициллинового и цефалоспоринового рядов позволяет эффективно предотвращать или уменьшать клинические проявления антибиотикоассоциированного дисбактериоза кишечника [46].
Наиболее эффективным пробиотиком для лечения рецидивирующего Clostidium difficile – ассоциированного псевдомембранозного колита, по данным мета-анализа, оказался S. boulardii [31].
Диарея путешественников
Профилактический эффект в отношении диареи путешественников показан у ряда антибиотиков, однако их широкое применение с этой целью не рекомендуется в связи с риском развития побочных эффектов и распространения антибиотикоустойчивости [47], что обусловливает необходимость поиска новых безопасных и затратно-эффективных методов профилактики и лечения этого вида диареи. Особенно привлекательно с этой точки зрения выглядят пробиотики.
Результаты клинических исследований монопробиотиков противоречивы, хотя, например, комбинация L. acidophilus, L. bulgaricus и S. thermophilus позволяла снижать частоту диареи путешественников с 71 до 43 % [48]. Эксперты рассматривают применение пробиотиков при диарее путешественников как перспективное направление, требующее дальнейшего клинического изучения [49].
Хеликобактерная инфекция
В ряде исследований продемонстрирована способность лакто- и бифидобактерий угнетать рост H. pylori, включая кларитромицин-резистентные штаммы, за счет выделения бактериоцинов или продукции органических кислот, блокировать их адгезию к эпителиальным клеткам [50]. Кроме того, при хеликобактерной инфекции пробиотики способны стимулировать иммунитет хозяина [9].
Данные клинических исследований пробиотиков у больных с хеликобактерной инфекцией противоречивы. В некоторых исследованиях не удалось продемонстрировать их влияние на степень эрадикации H. pylori [51]. В других, наоборот, показано благоприятное влияние пробиотических микроорганизмов, применяемых как в виде коммерческих препаратов, так и в составе продуктов питания (молока, йогурта) [52, 53].
Повышение эффективности эрадикационной терапии под влиянием пробиотических микроорганизмов продемонстрировано в двух недавно опубликованных рандомизированных исследованиях. В одном из них, включавшем 138 пациентов с неэффективностью тройной эрадикационной терапии, четырехнедельное применение пробиотического йогурта, содержащего лакто- и бифидобактерии, перед назначением эрадикационной квадротерапии позволило значительно повысить эффективность последней [54]. Во втором исследовании (n = 206) добавление комбинации пробиотиков и лактоферрина к стандартной тройной антихеликобактерной терапии (эзомепразол, кларитромицин, амоксициллин) способствовало повышению частоты эрадикации H. pylori и значительному улучшению переносимости стандартного лечения [55].
Снижение под влиянием пробиотиков частоты побочных эффектов стандартных режимов эрадикационной терапии продемонстрировано и в других исследованиях [56, 57]. Так, улучшение переносимости эрадикационной терапии показано при добавлении к ней пробиотиков, содержащих Lactobacillus casei rhamnosus, S. boulardii и комбинацию L. acidophilus и Bifidobacterium lactis [57]. Аналогичный эффект в исследовании с участием 334 детей с гастритом или язвенной болезнью 12-перстной кишки оказывал комбинированный пробиотик Линекс [58]. В группе, получавшей Линекс, побочные эффекты антихеликобактерной терапии наблюдались у 6 % пациентов против 14 % в группе, не получавшей пробиотик. В контрольной группе наиболее частыми побочными эффектами были диарея (61 %), метеоризм (31 %) и запоры (9 %). В группе Линекса запоры не отмечались ни у одного пациента, диарейный синдром был выражен значительно слабее, чем у контрольных пациентов, и не требовал отмены антибактериальных препаратов.
Авторы мета-анализа, опубликованного в 2006 г., поддерживают применение пробиотиков при хеликобактерной инфекции, указывая, что они уменьшают бактериальную колонизацию, позволяя поддерживать низкие уровни H. pylori в желудке, а некоторые из них усиливают эрадикацию и уменьшают побочные эффекты антибиотиков [50].
Воспалительные заболевания кишечника
В патогенезе хронического воспаления при болезни Крона и язвенном колите важную роль придают нарушению баланса между патогенными и непатогенными микроорганизмами в просвете кишечника, поэтому пробиотики привлекают пристальное внимание исследователей и при этих заболеваниях.
В исследовании с участием 40 пациентов продемонстрирован благоприятный эффект комбинированного препарата VSL-3, содержащего смесь разных штаммов бифидо- и лактобактерий и Streptococcus salivarius thermophilus в отношении предотвращения рецидива болезни Крона: эндоскопические признаки рецидива заболевания наблюдались у 10 % пациентов, получавших пробиотик, по сравнению с 40 % приема 5-аминосалициловой кислоты [59]. В исследовании Schultz M. и соавт. не удалось показать способность Lactobacillus GG и Lactobacillus johnsonii предотвращать рецидив болезни Крона у больных, перенесших хирургическое вмешательство [60], однако это исследование включало лишь 11 пациентов, 6 из которых исследование не завершили. Отрицательные результаты получены и в плацебо-контролируемом исследовании по оценке способности Lactobacillus GG предотвращать рецидив болезни Крона в послеоперационном периоде у больных, перенесших полную резекцию кишечника [61]. L. johnsonii штамм LA1 также не превосходил плацебо по способности предупреждать рецидив у этой категории пациентов [62]. Авторы Кокрановского систематического обзора, опубликованного в 2006 г., пришли к за ключению, что имеющиеся в настоящее время данные не позволяют судить о значении пробиотиков в качестве средств поддерживающей терапии при болезни Крона [63].
Пробиотики изучены и у пациентов с активной болезнью Крона, но на основании результатов этих исследований нельзя делать определенных выводов [64].
Результаты клинических исследований пробиотиков у больных с язвенным колитом более убедительны. Практически во всех из них показано клиническое или эндоскопическое улучшение, а также снижение экспрессии провоспалительных цитокинов под влиянием пробиотиков [65]. В нескольких контролируемых исследованиях отмечена эффективность пробиотиков в качестве средств поддерживающей терапии при язвенном колите [65–69].
Непатогенные Е. coli (штамм Nissle 1917) в поддержании ремиссии были сопоставимы по эффективности с месалазином. Комбинированный препарат VSL-3 при назначении в очень высоких дозах в течение 6 недель индуцировал ремиссию у 77 % пациентов с активным легким или среднетяжелым язвенным колитом [70]. В контролируемом исследовании, включавшем 187 пациентов, продемонстрирована эффективность Lactobacillus GG в поддержании ремиссии у таких больных [71]. Частота рецидива через 6 и 12 месяцев не различалась в группах, получавших Lactobacillus GG, 5-аминосалициловую кислоту или их комбинацию.
В экспериментальных и нескольких клинических исследованиях продемонстрированы благоприятные профилактические и терапевтические эффекты пробиотиков при воспалении дистальных отделов тонкой кишки у больных с воспалительными заболеваниями кишечника, перенесших проктоколэктомию [72]. Наиболее высок уровень доказательности для комбинированного препарата VSL-3. В двух клинических плацебо-контролируемых исследованиях назначение этого пробиотика через месяц после достижения полной ремиссии позволяло поддерживать ее на протяжении 9 месяцев или 1 года у 85 % больных [59, 73]. В группах плацебо ремиссия в течение периода наблюдения сохранялась достоверно реже – у 0 и 6 % пациентов соответственно. В исследовании Gionchetti P и соавт. после отмены VSL-3 рецидив осложнения развился у 100 % пациентов [73].
Механизм действия пробиотиков при воспалительных заболеваниях кишечника множественный и может включать:
- угнетение роста патогенных микроорганизмов;
- улучшение барьерной функции эпителия и слизистой оболочки;
- иммунорегулирующее действие;
- даун-регуляцию секреции провоспалительных цитокинов и др. [74].
Синдром раздраженной кишки
Пробиотики представляются перспективными средствами и для лечения синдрома раздраженной кишки (СРК), поражающего 5–20 % населения [75]. Их плацебо-контролируемые исследования суммированы в табл. 3. Действие пробиотиков при СРК связывают с их влиянием на различные патофизиологические механизмы c улучшением барьерной, моторной и пищеварительной функций кишечника, снижением газообразования, изменением нейротрансмиссии в кишечнике и др. В частности, в недавно опубликованном экспериментальном исследовании показано, что L. acidophilus оказывает сопоставимый с морфином анальгезирующий эффект при абдоминальной боли, сопровождающийся увеличением экспрессии каннабиноидных и опиоидных µ-рецепторов в эпителиальных клетках, выстилающих кишечник [76].
Таблица 3.
Плацебо-контролируемые исследования пробиотиков при СРК [77]
| Пробиотик | Дизайн и число участников | Улучшение симптомов | Источник |
| E. faecium | Рандомизированное (n = 54) | Общий счет симптомов | [78] |
| Lactobacillus plantarum | Рандомизированное (n = 60) | Метеоризм | [79] |
| Lactobacillus casei GG | Перекрестное (n = 24) | Нет улучшения | [80] |
| L. plantarum | Рандомизированное (n = 40) | Боль | [81] |
| L. plantarum | Перекрестное (n = 12) | Нет улучшения | [82] |
| VSL-3 | Рандомизированное (n = 25) | Вздутие живота | [83] |
| L. plantarum, L. acidophilus, Bifidobacterium breve |
Рандомизированное (n = 70) | Общий комбинированный счет | [84] |
| Lactobacillus salivarius, B. infantis | Рандомизированное (n = 75) | Общий счет симптомов | [85] * |
* В этом исследовании продемонстрировано нарушение баланса между системными провоспалительными и противовоспалительными цитокинами, которое может быть скорректировано пробиотиками.
Хотя в большинстве исследований продемонстрированы благоприятные эффекты пробиотиков, эксперты считают, что для разработки клинических рекомендаций по их применению при СРК необходимо проведение дальнейших исследований, прежде всего комбинаций пробиотиков, обладающих множественным механизмом действия [77].
Рак толстой кишки
Патогенные микроорганизмы, обитающие в ЖКТ, играют важную роль в процессах канцерогенеза [86]. В частности, недавно в эксперименте на животных показана роль в канцерогенезе супероксида, выделяемого энтерококками [87].
Пробиотики, влияя на эндогенную микрофлору и иммунную систему, могут модулировать канцерогенез. В нескольких исследованиях показано, что при их применении снижаются фекальные концентрации энзимов, мутагенов и вторичных желчных кислот, которые могут принимать участие в канцерогенезе [88]. Протективный эффект пробиотиков, содержащихся в продуктах питания, в отношении рака толстой кишки показан и в ряде эпидемиологических исследований [89]. Возможно, место пробиотиков в профилактике и лечении аденокарциномы толстой кишки помогут определить результаты проходящего сейчас европейского исследования.
Другие потенциальные области применения пробиотиков в гастроэнтерологии
В исследованиях пробиотиков у больных с запорами получены противоречивые результаты [90, 91]. Эта проблема требует дальнейшего изучения [66].
В открытом исследовании штамм Nissle 1917 E. coli оказался эффективным при коллагенозном колите [92]. Результаты других открытых исследований позволяют предполагать, что некоторые пробиотики способствуют эрадикации возбудителей при хроническом носительстве сальмонелл и кампилобактера [93, 94]. На основании экспериментальных исследований у животных пробиотики представляются эффективными средствами для лечения грибковой колонизации ЖКТ [95]. В частности, уменьшить продолжительность грибковой колонизации слизистой оболочки позволяют L. acidophilus.
Результаты экспериментальных и одного клинического исследования указывают на благоприятный эффект пробиотиков при остром панкреатите [96]. Существуют патогенетические предпосылки для их применения при неалкогольной жировой болезни печени [86]. Перспективным представляется использование пробиотиков при печеночной энцефалопатии, в патогенезе которой важную роль играет микрофлора кишечника [97, 98]. В двух клинических исследованиях показана эффективность комбинаций пробиотиков (L. acidophilus + B. infantis и B. infantis + S. thermophilus + B. bifidus) как средств профилактики некротического энтероколита, остающегося одной из ведущих причин смертности у недоношенных детей с очень низкой массой тела при рождении [99, 100]. Пробиотики могут быть полезны при лактазной недостаточности [101, 102].
Преимущества комбинированных пробиотиков на примере Линекса
Выбор пробиотиков при лечении заболеваний ЖКТ должен основываться на данных об их эффективности и безопасности. Группа пробиотиков неоднородна. Она состоит из большого количества микроорганизмов с различными механизмами действия, дополняющими друг друга при многих заболеваниях. Во многих клинических исследованиях продемонстрирована эффективность комбинаций пробиотиков в тех случаях, когда монокомпонентные препараты оказались неэффективными, поэтому исследованию комбинированных пробиотиков эксперты придают особое значение.
Комбинированные препараты пробиотиков получили и наиболее широкое распространение в клинической практике. На российском рынке к их числу относится Линекс, в состав которого входят L. acidophilus, B. infantis, liberorum и нетоксигенный молочнокиcлый S. (E.) faecium.
Линекс удовлетворяет основным требованиям, предъявляемым к пробиотикам. Он имеет количественно и качественно сбалансированный состав, позволяющий обеспечить нормализацию физиологических функций микрофлоры во всех отделах кишечника – начиная от тонкой кишки и кончая прямой. В состав Линекса входят штаммы микроорганизмов, которые при выращивании на средах, содержащих антибиотики и химиотерапевтические средства, сохранили способность к дальнейшему размножению, поэтому резистентны к их действию. Резистентность полученных штаммов сохраняется при повторной инокуляции в течение 30 поколений и in vivo. В исследованиях Линекса показано, что переноса резистентности к другим микроорганизмам не происходит [103]. При необходимости Линекс можно применять одновременно с антибактериальными и химиотерапевтическими средствами.
Эффективность компонентов Линекса, их комбинаций и непосредственно самого препарата доказана в клинических исследованиях при различных заболеваниях ЖКТ [44–46, 58, 104].
Достоинством Линекса является его высокая безопасность. При широком многолетнем применении препарата побочных эффектов не зарегистрировано. Линекс не обладает тератогенным действием. Его безопасность и хорошая переносимость позволяют применять препарат у пациентов группы риска – беременных и кормящих грудью женщин, детей, включая новорожденных, лиц пожилого возраста и др.
Гарантией качества Линекса является и технология его производства, соответствующая всем требованиям, предъявляемым к производству пробиотиков.
Заключение
Таким образом, пробиотики играют важную роль в профилактике и лечении ряда заболеваний ЖКТ. Продолжающиеся клинические исследования могут стать основанием для расширения показаний к применению пробиотиков в гастроэнтерологии. Пробиотики оказывают не только терапевтический, но и профилактический эффект в отношении заболеваний ЖКТ, улучшают качество жизни здоровых людей [9]. Им отводится важная роль в решении проблем антибиотикорезистности.
ЛИТЕРАТУРА
1. Tannock GW. Analysis of the intestinal microflora: A renaissance. Antonie van Leenwenhoek 1999;76:265–78.
2. Dunne C, Murphy L, Flynn S, et al. Probiotics: from myth to reality. Demonstration of functionality in animal models of disease and in human clinical trials. Antonie Van Leeuwenhoek. 1999;76(1–4):279–92.
3. Harbarth S, Samore MH. Antimicrobial Resistance Determinants and Future Control. Emerg Infect Dis 2005;11(6):794–801.
4. Шендеров Б.А. Современное состояние и перспективы развития концепции “Пробиотики, пребиотики и синбиотики”. http:// www.disbak.ru/php/content.php?id=725
5. Rosenfeldt V, Michaelsen KF, Jakobsen M, et al. Effect of probiotic Lactobacillus strains on acute diarrhea in a cohort of nonhospitalized children attending day-care centers. Pediatr Infect Dis J 2002;21:417–19.
6. Rosenfeldt V, Michaelsen KF, Jakobsen M, et al. Effect of probiotic Lactobacillus strains in young children hospitalized with acute diarrhea. Pediatr Infect Dis J 2002;21:411–16.
7. Huang JS, Bousvaros A, Lee JW, et al. Efficacy of probiotic use in acute diarrhea in children: a meta-analysis. Dig Dis Sci 2002;47:2625–34.
8. Solis B, Samartin S, Gomez S, et al. Probiotics as a help in children suffering from malnutrition and diarrhoea. Eur J Clin Nutr 2002;56(Suppl. 3):S57–S59.
9. Marteau PR, de Vrese M, Cellier CJ, et al. Protection from gastrointestinal diseases with the use of probiotics. Am J Clin Nutr 2001;73(2): 430S–36s.
10. Isolauri E, Juntunen M, Rautanen T, et al. A human Lactobacillus strain (Lactobacillus casei sp strain GG) promotes recovery from acute diarrhea in children. Pediatrics 1991;88:90–97.
11. Kaila M, Isolauri E, Soppi E, et al. Enhancement of the circulating antibody secreting cell response in human diarrhea by a human Lactobacillus strain. Pediatr Res 1992;32:141–44.
12. Majamaa H, Isolauri E, Saxelin M, et al. Lactic acid bacteria in the treatment of acute rotavirus gastroenteritis. J Pediatr Gastroenterol Nutr 1995;20:333–38.
13. Isolauri E, Kaila M, Mykkanen H, et al. Oral bacteriotherapy for viral gastroenteritis. Dig Dis Sci 1994;39:2595–600.
14. Sugita T, Togawa M. Efficacy of lactobacillus preparation biolactis powder in children with rotavirus enteritis. Jpn Pediatr 1994;47:2755–62.
15. Raza S, Graham SM, Allen SJ, et al. Lactobacillus GG promotes recovery from acute nonbloody diarrhea in Pakistan. Pediatr Infect Dis J 1995;14: 107–11.
16. Pant AR, Graham SM, Allen SJ, et al. Lactobacillus GG and acute diarrhea in young children in the tropics. J Trop Pediatr 1996;42:162–65.
17. Guarino A, Canani RB, Spagnuolo MI, et al. Oral bacterial therapy reduces the duration of symptoms and of viral excretion in children with mild diarrhea. J Pediatr Gastroenterol Nutr 1997;25:516–19.
18. Shornikova AV, Isolauri E, Burkanova L, et al. A trial in the Karelian Republic of oral rehydration and Lactobacillus GG for treatment of acute diarrhoea. Acta Paediatr 1997;86:460–65.
19. Guandalini S, Pensabene L, Zikri MA, et al. Lactobacillus GG administered in oral rehydration solution to children with acute diarrhea: a multi-center European trial. J Pediatr Gastroenterol Nutr 2000;30:54–60.
20. Bellomo G, Mangiagle A, Nicastro L, et al. A controlled double blind study of SF68 strain as a new biological preparation for the treatment of diarrhea in pediatrics. Curr Ther Res 1980; 28:927–26.
21. Camarri E, Belvisi A, Guidoni G, et al. A double blind comparison of two different treatments for acute enteritis in adults. Chemotherapy 1981;27:466–70.
22. Wunderlich PF, Braun L, Fumagalli I, et al. Doubleblind report on the efficacy of lactic acid-producing Enterococcus SF68 in the prevention of antibiotic-associated diarrhoea and in the treatment of acute diarrhoea. J Int Med Res 1989;17:333–38.
23. Buydens P, Debeuckelaere S. Efficacy of SF 68 in the treatment of acute diarrhea. A placebo-controlled trial. Scand J Gastroenterol 1996;31:887–91.
24. Chapoy P. Treatment of acute diarrhea in children: a controlled trial with S Saccharomyces boulardii. Annales de Pediatrie 1985;32:1–3.
25. Shornikova AV, Casas IA, Mykkanen H, et al. Bacteriotherapy with Lactobacillus reuteri in rotavirus gastroenteritis. Pediatr Infect Dis J 1997;16:1103–07.
26. Saavedra JM, Bauman NA, Oung I, et al. Feeding of Bifidobacterium bifidum and Streptococcus thermophilus to infants in hospital for prevention of diahrroea and shedding of rotavirus. Lancet 1994;344:1046–49.
27. Cremonini F, Di Caro S, Nista EC, еt аl. Meta-analysis: the effect of probiotic administration on antibiotic-associated diarrhoea. Aliment Pharmacol Ther 2002;16(8):1461–67.
28. D’Souza AL, Rajkumar C, Cooke J, et al. Probiotics in prevention of antibiotic associated diarrhea: meta-analysis. BMJ 2002;324(7350):1361.
29. Shiohara M, Matsumura T, et al. Prevention of antibiotic-associated diarrhea in children by Clostridium butyricum MIYAIRI. Pediatr Int 2003;45:86–90.
30. Hawrelak JA, Whitten DL, Myers SP. Is Lactobacillus rhamnosus GG effective in preventing the onset of antibiotic-associated diarrhea: a systematic review. Digestion 2005;72:51–56.
31. McFarland LV. Meta-analysis of probiotics for the prevention of antibiotic associated diarrhea and the treatment of Clostridium difficile disease. Am J Gastroenterol 2006;101(4):812–22.
32. Szajewska H, Ruszczynski M, Radzikowski A. Probiotics in the prevention of antibioticassociated diarrhea in children: a meta-analysis of randomized controlled trials. J Pediatr 2006; 149:367–72.
33. Gotz V, Romankiewicz JA, Moss J, et al. Prophylaxis against ampicillin-associated diarrhea with a lactobacillus preparation. Am J Hosp Pharm 1979;36:754–57.
34. Clements ML, Levine MM, Ristiano PA, et al. Exogenous lactobacilli fed to man. Their fate and ability to prevent diarrheal disease. Prog Food Nutr Sci 1983;7:29–37.
35. Witsell DL, Garrett CG, Yarbrough WG, et al. Effect of Lactobacillus acidophilus on antibiotic-associated gastrointestinal morbidity: a prospective randomized trial. J Otolaryngol 1995;24: 230–33.
36. Borgia M, Sepe N, Brancato V, et al. A controlled clinical study on Streptococcus faecium preparation for the prevention of side reactions during long-term antibiotic treatments. Curr Ther Res 1982;31:265–71.
37. Colombel JF, Cortot A, Neut C, et al. Yoghurt with Bifidobacterium longum reduces erythromycin-induced gastrointestinal effects. Lancet 1987;2:43.
38. Siitonen S, Vapaatalo H, Salminen S, et al. Effect of Lactobacillus GG yoghurt in prevention of antibiotic associated diarrhoea. Ann Med 1990;22:57–59.
39. Young RJ, Vanderhoof JA. Successful probiotic therapy of chronic recurrent abdominal pain in children. Gastroenterology 1997;112:A856 (abstr).
40. Orrhage K, Brismar B, Nord CE. Effects of supplements of Bifidobacterium longum and Lactobacillus acidophilus on the intestinal microbiota during administration of clindamycin. Microb Ecol Health Dis 1994;7:17–25.
41. Adam J, Banet A, Banet-Bellet C. Essais cliniques controls en double insu de l’Ultralevure lyophylise. (Double-blind controlled trials with Saccharomyces boulardii–Ultralevure.) Gazette Medicale de France 1977;84:2072–78.
42. Surawicz CM, Elmer GW, Speelman P, et al. Prevention of antibiotic associated diarrhea by Saccharomyces boulardii: a prospective study. Gastroenterology 1989;96:981–88.
43. McFarland LV, Surawicz CM, Greenberg RN, et al. Prevention of beta-lactam-associated diarrhea by Saccharomyces boulardii compared with placebo. Am J Gastroenterol 1995;90: 439–48.
44. Шенвальд С., Цар В. Результаты одинарного плацебо-контролируемого клинического испытания Линекса. ИНДОК, Лек, 1984.
45. Шостакович-Корецкая Л.Р., Кривуша Е.Л., Чергинец А.В.Тактический подход к коррекции дисбиоза кишечника у детей пробиоти-ческими препаратами. Опыт применения препарата Линекс // Украинский медицинский журнал. 1999. № 2. С. 61–64.
46. Бельмер С.В. Антибиотикассоциированный дисбактериоз кишечника // РМЖ. 2004. № 12.
47. DuPont HL. Guidelines on acute infectious diarrhea in adults. The Practice Parameters Committee of the American College of Gastroenterology. Am J Gastroenterol 1997;92:1962–75.
48. Black FT, Andersen PL, Orskov J, et al. Prophylactic efficacy of lactobacilli on traveler’s diarrhea. Travel Med 1989;7:333–35.
49. Gill HS. Probiotics to enhance anti-infective defences in the gastrointestinal tract. Best Pract Res Clin Gastroenterol 2003;17(5):755–73.
50. Gotteland M, Brunser O, Cruchet S. Systematic Review: Are Probiotics Useful in Controlling Gastric Colonization by Helicobacter pylori? Aliment Pharmacol Ther 2006;23(8):1077–86.
51. Bazzoli F, Zagari RM, Fossi S, et al. In vivo Helicobacter pylori clearance failure with Lactobacillus acidophilus. Gastroenterology 1992;102:A38.
52. Canducci F, Armuzzi A, Cremonini F, et al. A lyophilized and inactivated culture of Lactobacillus acidophilus increases Helicobacter pylori eradication rates. Aliment Pharmacol Ther 2000;14:1625–29.
53. Chicoine L, Joncas JH. Use of lactic acid bacteria during non bacterial gastroenteritis. Union Medicale du Canada 1973;102:1114–15.
54. Sheu BS, Cheng HC, Kao AW, et al. Pretreatment with Lactobacillus- and Bifidobacterium-containing yogurt can improve the efficacy of quadruple therapy in eradicating residual Helicobacter pylori infection after failed triple therapy. Am J Clin Nutr 2006;83(4):864–69.
55. de Bortoli N, Leonardi G,Ciancia E, et al. Helicobacter pylori Eradication: A Randomized Prospective Study of Triple Therapy Versus Triple Therapy Plus Lactoferrin and Probiotics. Am J Gastroenterol 2007; [Epub ahead of print].
56. Myllyluoma E, Veijola L, Ahlroos T, et al. Probiotic supplementation improves tolerance to Helicobacter pylori eradication therapy – a placebo-controlled, double-blind randomized pilot study. Aliment Pharmacol Ther 2005;21:1263–72.
57. Cremonini F, Di Caro S, Covino M, et al. Effect of different probiotic preparations on anti-Helicobacter pylori therapy-related side effects: a parallel group, triple blind, placebo-controlled study. Am J Gastroenterol 2002;97:2744–49.
58. Жихарева Н.С., Хавкин А.И. Терапия антибиотикассоциированного дисбактериоза // РМЖ. 2006. Т. 14. № 19.
59. Mimura T, Rizzello F, Helwig U, et al. Once daily high dose probiotic therapy (VSL#3) for maintaining remission in recurrent or refractory pouchitis. Gut 2004;53:108–114.
60. Schultz M, Timmer A, Herfath H, et al. Lactobacillus GG in inducing and maintaining remission of Crohn.s disease. BMC Gastroenterol 2004;4:5.
61. Prantera C, Scribano ML, Falasco G, et al. Ineffectiveness of probiotics inpreventing recurrence after curative resection for Crohn.s disease: a randomised controlled trialwith Lactobacillus GG. Gut 2002;51:405–09.
62. Gionchetti P, Rizzello F, Lammers KM, et al. Antibiotics and probiotics in treatment of inflammatory bowel disease. World J Gastroenterol 2006;12:3306–13.
63. Rolfe VE. Probiotics for maintenance of remission in Crohn’s disease Cochrane Rev Abstract 2006.
64. Chermesh I, Eliakim R. Probiotics and the gastrointestinal tract: Where are we in 2005? World J Gastroenterol 2006;12:853–57.
65. Kruis W, Schutz E, Fric P, et al. Double-blind comparison of an oral Escherichia coli preparation and mesalazine in maintaining remission of ulcerative colitis. Aliment Pharmacol Ther 1997;11:853–58.
66. Kruis W. Maintenance of remission in ulcerative colitis is equally effective with Escherichia coli Nissle 1917 and with standard mesalamine. Dig Dis Week 2001, abstr. 680.
67. Kruis W, Fric P, Pokrotnieks J, et al. Maintaining remission of ulcerative colitis with the probiotic Escherichia coli Nissle 1917 is as effective as with standard mesalazine. Gut 2004;53:1617–23.
68. Rembacken BJ, Snelling AM, Hawkey PM, et al. A double blind trial on non pathogenic E. coli vs mesalazine for the treatment of ulcerative colitis. Gut 1997;41:3911.
69. Rembacken BJ, Snelling AM, Hawkey PM, et al. Non-pathogenic Escherichia coli versus mesala-zine for the treatment of ulcerative colitis: a randomized trial. Lancet 1999;354:635–39.
70. Bibiloni R, Fedorak RN, Tannack GW, et al. VSL#3 probiotic-mixture induces remission in patients with active ulcerative colitis. Am J Ga-stroenterol 2005;100:1539–46.
71. Zocco MA, dal Verme LZ, Cremonini F, et al. Efficacy of Lactobacillus GG in maintaining remission of ulcerative colitis. Aliment Pharmacol Ther 2006;23:1567–74.
72. Penner RM, Fedorak RN. Probiotics in the Management of Inflammatory Bowel Disease. Medscape General Medicine 2005;7(3):19.
73. Gionchetti P, Rizzello F, Venturi A, et al. Oral bacteriotherapy as maintenance treatment in patients with chronic pouchitis: a double-blind, placebo-controlled trial. Gastroenterology 2000;119:305–09.
74. Mach T. Clinical usefulness of probiotics in inflammatory bowel diseases. J Physiol Pharmacol 2006;57(Suppl. 9):23–33.
75. Rodriguez LA, Ruigomez A. Increased risk of irritable bowel syndrome after bacterial gastroenteritis: cohort study. BMJ 1999;318:565–66.
76. Rousseaux C, Thuru X, Gelot A, et al. Lactobacillus acidophilus modulates intestinal pain and induces opioid and cannabinoid receptors. Nat Med 2007;13:35–37.
77. Verdu EF, Collins SM. Irritable Bowel Syndrome and Probiotics: From Rationale to Clinical Use. Curr Opin Gastroenterol 2005;21(6):697–701.
78. Gade J, Thorn P. Paraghurt for patients with irritable bowel syndrome: a controlled clinical investigation from general practice. Scand J Prim Health Care 1989;7:23–26.
79. Nobaek S, Johansson ML, Molin G, et al. Alteration of intestinal microflora is associated with reduction in abdominal bloating and pain in patients with irritable bowel syndrome. Am J Ga-stroenterol 2000;95:1231–38.
80. O’Sullivan MA, O’Morain CA. Bacterial supplementation in the irritable bowel syndrome: a randomized double-blind placebo-controlled crossover study. Dig Liver Dis 2000;32:294–301.
81. Niedzielin K, Kordecki H, Birkenfeld B. A controlled, double-blind, randomized study on the efficacy of lactobacillus plantarum 299V in patients with irritable bowel syndrome. Eur J Ga-stroenterol Hepatol 2001;13:1143–47.
82. Sen S, Mullan MM, Parker TJ, et al. Effect of lactobacillus plantarum 299v on colonic fermentation and symptoms of irritable bowel syndrome. Dig Dis Sci 2002;47:2615–20.
83. Kim HJ, Camilleri M, McKinzie S, et al. A randomized controlled trial of a probiotic, VSL#3, on gut transit and symptoms in diarrhoea-predominant irritable bowel syndrome. Aliment Pharmacol Ther 2003;17:895–904.
84. Saggioro A. Probiotics in the treatment of irritable bowel syndrome. J Clin Gastroenterol 2004;38:S104–S106.
85. O’Mahony L, McCarthy J, Kelly P, et al. Lactobacilli and bifidobacterium in irritable bowel syndrome: symptom responses and relationship to cytokine profiles. Gastroenterology 2005;128:541–51.
86. Fedorak RN, Madsen KL. Probiotics and Prebiotics in Gastrointestinal Disorders. Curr Opin Gastroenterol 2004;20(2):146–55.
87. Wang X, Huycke MM. Extracellular superoxide production by Enterococcus faecalis promotes chromosomal instability in mammalian cells. Ga-stroenterology 2007;132(2):551–61. Epub 2006 Nov 29.
88. Wollowski I, Rechkemmer G, Pool-Zobel BL. Protective role of probiotics and prebiotics in colon cancer. Am J Clin Nutr 2001;73:451S–5S.
89. Capurso G, Marignani M, Fave GD. Probiotics and the incidence of colorectal cancer: when evidence is not evident. Dig Liver Dis 2006; 38(Suppl. 2):S277–82.
90. Koebnick C, Wagner I, Leitzmann P, et al. Probiotic beverage containing Lactobacillus casei Shirota improves gastrointestinal symptoms in patients with chronic constipation. Can J Ga-stroenterol 2003;17:655–59.
91. Banaszkiewicz A, Szajewska H. Ineffectiveness of Lactobacillus GG as an adjunct to lactulose for the treatment of constipation in children: a double-blind, placebo-controlled randomized trial. J Pediatr 2005;146:364–69.
92. Tromm A, Niewerth U, Khoury M, et al. The probiotic E. coli strain Nissle 1917 for the treatment of collagenous colitis: first results of an open-label trial. Z Gastroenterol 2004;42:365–69.
93. Alm L. The effect of Lactobacillus acidophilus administration upon the survival of Salmonella in randomly selected human carriers. Prog Food Nutr Sci 1983;7:13–17.
94. Tojo M, Oikawa T, Morikawa Y, et al. The effects of Bifidobacterium breve administration on Campylobacter enteritis. Acta Paediatr Jpn 1987;29:160–67.
95. Zwolinska-Wcislo M, Brzozowski T, Mach T, et al. Are probiotics effective in the treatment of fungal colonization of the gastrointestinal tract? Experimental and clinical studies. J Physiol Pharmacol 2006;57(Suppl. 9):35–49.
96. Meier R, Steuerwald M. Place of probiotics. Curr Opin Crit Care 2005;11(4):318–25.
97. Boca M, Vyskocil M, Mikulecky M, et al. Complex therapy of chronic hepatic encephalopathy supplemented with probiotic: comparison of two studies. Cas Lek Cesk 2004;143(5):324–28.
98. Zhao HY, Wang HJ, Lu Z, Intestinal microflora in patients with liver cirrhosis. Chin J Dig Dis 2004;5(2):64–67.
99. Lin HC, Su BH, Chen AC, et аl. Oral probiotics reduce the incidence and severity of necrotizing enterocolitis in very low birth weight infants. Pediatrics 2005;115(1):1–4.
100.Bin-Nun A, Bromiker R, Wilschanski M, et al. Oral probiotics prevent necrotizing enterocolitis in very low birth weight neonates. J Pediatr 2005;147(2):192–96.
101. Kolars JC, Levitt MD, Aouji M, et al. Yogurt – an autodigesting source of lactose. N Engl J Med 1984;310:1–3.
102. Savaiano DA, AbouElAnouar A, Smith DE, et al. Lactose malabsorption from yogurt, pasteurized yogurt, sweet acidophilus milk, and cultured milk in lactase-deficient individuals. Am J Clin Nutr 1984;40:1219–23.
103. Шульпекова Ю.О. Применение пробиотиков в клинической практике // РМЖ. 2003. Т. 5. № 1.
104. Грачева Н.М., Ющук Н.Д., Чупринина Р.П. и др. Дисбактериозы кишечника, причины возникновения, диагностика, применение бактерийных биологических препаратов. Пособие для врачей и студентов. М., 1999. 44 с.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
|
|
VSL#3 (AKA «VSL3») is a high-potency probiotic medical food intended for the dietary management of ulcerative colitis (UC), IBS (irritable bowel syndrome) or an ileal pouch. Its trademark description is “The Living Shield”, which I think is very fitting for what probiotics do. One thing to note, however, is that this is NOT the same VSL#3 that was used in studies prior to 2016. You will find out the significance of that in a moment. It is produced by Alfasigma. |
What Kind of Supplement is VSL3?
VSL#3 is a medical food, which means, according to the US FDA:
- It is a specially formulated and processed product (as opposed to a naturally occurring foodstuff used in its natural state) for the partial or exclusive feeding of a patient by means of oral intake or enteral feeding by tube, meaning a tube or catheter that delivers nutrients beyond the oral cavity directly into the stomach or small intestine;2
- It is intended for the dietary management of a patient who, because of therapeutic or chronic medical needs, has limited or impaired capacity to ingest, digest, absorb, or metabolize ordinary foodstuffs or certain nutrients, or who has other special medically determined nutrient requirements, the dietary management of which cannot be achieved by the modification of the normal diet alone;
- It provides nutritional support specifically modified for the management of the unique nutrient needs that result from the specific disease or condition, as determined by medical evaluation;
- It is intended to be used under medical supervision; and
- It is intended only for a patient receiving active and ongoing medical supervision wherein the patient requires medical care on a recurring basis for, among other things, instructions on the use of the medical food.
Medical foods are NOT drugs and therefore do not have to go through the FDA drug-approval process.
What Probiotics are in VSL#3?
VSL3 is composed of 8 strains of lactic acid bacteria. (Note that the strain names are not on the VSL3 website, but were published in some of the studies referenced below):
- S. thermophilus BT01
- B. breve BB02
- B. longum BL03
(recently reclassified as B. lactis) - B. infantis BI04 (recently reclassified as B. lactis)
- L. acidophilus BA05
- L. plantarum BP06
- L. paracasei BP07
- L. delbrueckii sub.bulgaricus
BD08 (recently reclassified as L. helveticus)
What Products Contain VSL#3?
At the time of this writing, VSL3 is available in 3 different products: Please always check ingredients prior to consumption!
- Capsules containing 112.5 billion CFU per capsule, hydroxylpropylmethylcellulose, cornstarch, magnesium stearate, silicon dioxide, stearic acid, microcrystalline cellulose.
- Unflavored packets containing 450 billion CFU per packet, cornstarch, silicon dioxide.DS (double strength) sachets containing maltose, 900 billion CFU per sachet, cornstarch, silicon dioxide.
- The DS formula is available only with a prescription.
The powder should be mixed with only cool foods (applesauce, yogurt, cold soup, etc.) or cool non-carbonated liquids. The capsules may be opened and the contents mixed with cool foods or cool non-carbonated liquids.
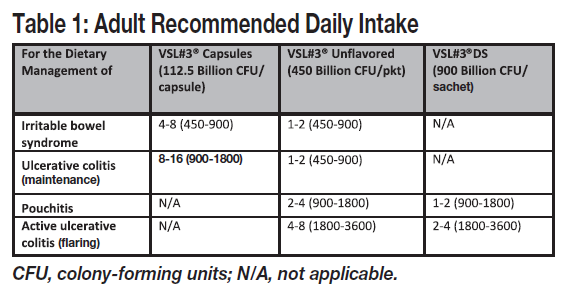
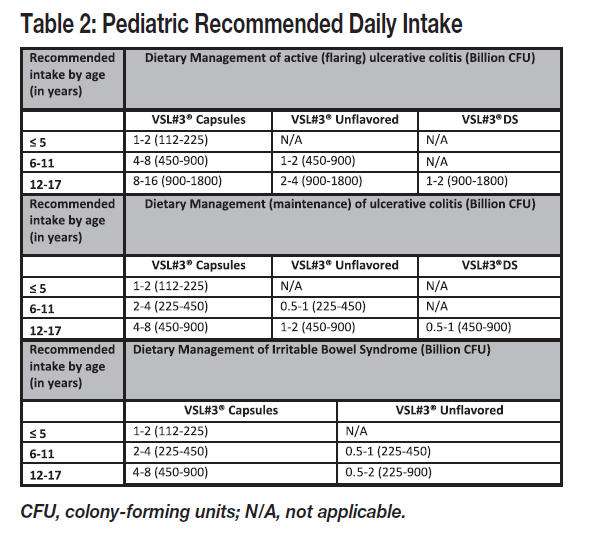
How Much is Recommended?
At the time of this writing, the product website for healthcare professionals recommends:
Please note that consumers are supposed to be working with a physician for treatment with these conditions. Follow your doctor’s recommendations as to usage.
When Can You Expect Results?
According to the website, “Adjustment of the intestinal flora can take a few days or weeks; it may take up to 1 month for the colonization of the gut to become optimally stable.”
What Does the Research Show?
To my knowledge, there are limited studies with this product as of December, 2019. As noted on the Visbiome page, scientific studies performed prior to 2016 should be credited to Visbiome and NOT to VSL3, not only because of the ratios of the different probiotic organisms, but also because of the different culturing conditions. Additionally, studies performed in 2017 may or may not have been performed with this Alfasigma product. You can read more about the lawsuit involving Visbiome and VSL#3 on the Visbiome page.
Here are some studies I found:
A research summary published in March of 2019 with VSL#3 (Alfasigma) in IBD patients investigated the presence of fecal high mobility group box 1 (HMGB1) index, an important proinflammatory mediator involved in IBD development. A mouse colitis study and in vitro study were also performed comparing #3 to a Bifidobacterium longum strain. Results showed that HMGB1 were high in both active IBD and colitis mice. After treatments with the 2 investigated probiotics there were reduced serum and fecal HMGB1 levels as well as increased expression of zonula occludins-1, occludin, and claudin-1 in colon tissues of mice. In vitro, HMGB1 reduced transepithelial electrical resistance, zonula occludins-1 protein expression, and increased paracellular permeability of FITC-dextran, showing that it plays a role in IBD. Probiotic treatments had the opposite effects.
A small, pilot crossover study published June, 2019, in which the authors declared no conflict of interest, compared this probiotic and Visbiome. Results showed that feces from 10 healthy donors obtained prior to probiotic intake and feces collected after supplementation with VSL3 did not affect Candida albicans growth. On the contrary, a 3log10 inhibition of Candida growth was observed with Visbiome intake (as the European version, Vivomixx).
An in vitro wound-healing study from 2017 to test the ability of probiotics to protect gastrointestinal mucosal surfaces was undertaken with this product and Visbiome. The results showed that Visbiome did not affect monolayer morphology (cell structure) and cell density (favorable results), but VSL#3 “caused clear morphological cell damage and strongly reduced cellularity» (unfavorable results). Visbiome was declared to have protective effects, including reactive-oxygen species protection, whereas the other product did not.
A 2017 study in mice with induced colitis showed that VSL#3 and (what now is) Visbiome purchased in the UK had different effects. Visbiome, but not VSL#3, attenuated “clinical” scores of colitis.
Another study was published in 2017. In a small cohort of patients receiving combined antiretroviral therapy for HIV-1, what is now known as Visbiome was used, and then in vitro studies were performed to compare Visbiome (the previous US-made VSL#3) to VSL#3 (Alfasigma). The ultimate conclusion was, “Our data, in conjunction with previously published findings, confirm that the new Italian-made formulation of VSL#3® is different from the previous US-made VSL#3 and therefore its efficacy and safety in HIV-infected subjects is still unproven.”
PROS of VSL#3, In My Opinion
- Multiple species, as research shows it takes a village of probiotic organisms to be healthy
- Live freeze-dried lactic acid bacteria
- Super-high potency
- If stored under refrigeration (36-46°F or 2-8°C), VSL#3 products are guaranteed through the «Best if used by» date, not the manufactured date.
- Can be stored at room temperature (77 degrees F) for up to 2 weeks without a significant effect on potency
- May be frozen, but not thawed and refrozen
- Vegetarian capsule
- All formulations are free from wheat, gluten (other cereals), soy, milk including lactose, crustacean shellfish, eggs, peanuts, nuts, fish, celery, mustard, sesame seeds, sulfur dioxide and sulfites (>10 mg/kg), lupin, mollusks (Read ingredients!)
- Kosher and Halal certified
- Non-GMO cornstarch in the unflavored powder, and nothing else is GMO in any of their products
CONS of VSL#3, In My Opinion
- Expensive (but some insurances may cover it)
- No published clinical trials with this formulation to date (Dec 2019)
- Daily consumption of high levels of VSL3 is needed to maintain adequate and balanced bacterial colonization. You can’t take it sporadically. (But then again, daily consumption of probiotics is a good idea in most cases anyway.)
- Definitely requires refrigeration long term. VSL3 can be stored at room temperature (77°F) for up to 2 weesk without having a major effect on potency, but after that or if exposed to high temperatures, the number of beneficial bacteria can become significantly reduced.
- Like any probiotic, this one can cause bloating and gas when it is first being used until the body and flora adapt to the changes. Because all the forms of the product are so highly potent, it may be best to use partial dosages when starting them. You might have to weather some discomfort until your intestines get used to the new environment.
Where to Buy VSL#3?
Your local pharmacy may carry the non-prescription products. At this time the product is not found at Amazon.com or other distributors I work with.
Obviously, the prescription «DS» product is only available with a prescription from your doctor.
Return to the main page for probiotic supplement reviews.
Return to Homepage.
I research studies and share my clinical experience to write this free site to help you find solutions to your problems. As part of that, I recommend products and services that I genuinely believe will be of help to you. If you click on a link to a product/service, I may receive a small commission to support my efforts if you buy something. The item does not cost you more.
Thanks for visiting this site! If you’ve enjoyed reading this page or have found the information to be useful to you, please «like», tweet about it, or share it so others can benefit, too. You can leave comments below via Facebook or Disqus.
Comment with Disqus (including as a guest), Twitter or Google accounts:
If you are one of my many readers without a Facebook account, you can still comment.
Disclaimer: Please note: By law, I cannot provide any personalized recommendations for your specific health concern on this site. The information contained in this site is
educational in nature and is not intended as diagnosis, treatment, prescription or
cure for any physical or mental disease, nor is it intended as a substitute for
regular medical care. Consult with your doctor regarding any health or
medical concerns you may have.
Capsules — 112.5B
The VSL#3® Difference
VSL#3® contains 8 complementary strains from 3 different genera.
Many OTC brands only have 1 strain.
VSL#3® is stored and shipped under refrigerated conditions to ensure optimal viability.
Contains 100+ billion live CFU.
5x more good bacteria than many leading OTC brands.
Recommended by Gastroenterologists
VSL#3® is held to a higher standard as a Medical Food.
Most well-known probiotic brands are food supplements.
More CFU per dollar than many other leading brands.
About The Capsules
112.5 Billion CFU
Consume as directed by your physician. (Usual adult dosage: 1-2 capsules, as needed, up to 4x a day).
Refrigerate at 36-46ºF (2-8ºC).
Can be stored at room temperature for up to 2 weeks without adversely affecting potency.
Do not use if blue ring is separated from the cap.
View Product Insert
IBS
Ulcerative colitis
*VSL#3® is a probiotic medical food intended for the dietary management of ulcerative colitis (UC), irritable bowel syndrome (IBS), or an ileal pouch.
Streptococcus thermophilus
Bifidobacterium breve
Bifidobacterium lactis *
Bifidobacterium lactis **
Lactobacillus acidophilus
Lactobacillus plantarum
Lactobacillus paracasei
Lactobacillus helveticus ***
* Previously classified as B. longum
** Previously classified as B. infantis
*** Previously classified as L. delbrueckii
Lactic acid bacteria with bifidobacteria blend, hydroxylpropylmethylcellulose, cornstarch, magnesium stearate, silicon dioxide, stearic acid, microcrystalline cellulose.
Standard Ground Shipping
Before 1:00 pm (ET)
After 1:00 pm (ET)
Before 1:00 pm (ET)
After 1:00 pm (ET)
Before 1:00 pm (ET)
After 1:00 pm (ET)
Before 1:00 pm (ET)
After 1:00 pm (ET)
Recommended by Gastroenterologists
Why doctor’s trust VSL#3®:
Dr. George Barrett MD
Founder and Chief of Gastroenterology Beth Israel Deaconess Hospital — Milton
“I recommend VSL #3® for maintenance of a healthy gut microbiome.”
Dr. William Andy Shaver MD
Gastroenterologist Lubbock, TX
“I’ve had great success in using VSL#3® post colonoscopy, and especially so in my IBS and UC patients.”
Dr. Victor Gallo
Garden City Colon and Rectal Surgery Practice